Область техники, к которой относится изобретение
Данное изобретение относится к применению ингибитора или антагониста тканевого фактора, TF, для приготовления лекарственного средства для лечения или предупреждения диабета или связанных с диабетом заболеваний. Этот ингибитор или антагонист, в основном, предназначен для лечения диабетических пациентов, страдающих от диабета типа I или типа II соответственно, а также метаболического синдрома, предшествующего диабету типа II.
В первом случае (в случае диабета типа I) этот антагонист или ингибитор используют в сочетании с трансплантацией островков Лангерганса пациентам с диабетом типа I для повышения выживаемости островков. В последнем случае этот антагонист или ингибитор используют для предупреждения артериосклероза и сердечно-сосудистого заболевания у пациентов с диабетом типа II.
Уровень техники
Гемостаз является решающим для выживания. Любое нарушение в гемостатическом балансе, такое как повреждение стенки сосуда, приводит к немедленной активации системы свертывания. Система свертывания in vivo запускается, в основном, трансмембранным гликопротеиновым тканевым фактором (TF) массой 47 кДа, который действует в качестве кофактора для расщепления фактора VII до VIIa, для протеолитической функции фактора VIIa для пути свертывания через тканевой фактор (внешний) и в качестве рецептора. TF принадлежит к суперсемейству рецепторов цитокинов, и было показано, что при образовании комплекса с фактором VIIa он запускает внутриклеточную трансдукцию сигнала, вовлеченную в ангиогенез, диапедез и воспаление. TF конститутивно экспрессируется клетками в адвентициальной оболочке кровеносных сосудов, а также в обильно васкуляризованных тканях, таких как плацента, головной мозг и легкие. Обычно клетки, экспонированные крови, такие как эндотелиальные клетки и моноциты, не экспрессируют TF, но некоторые воспалительные стимулы, такие как липополисахариды (LPS), иммунные комплексы и цитокины могут индуцировать экспрессию TF в этих клетках. TF строго регулируется ингибитором пути тканевого фактора (TFPI) в крови. Несколько недавних публикаций представили доказательство незначительных количеств критического TF в крови, которые могут активироваться неидентифицированными стимулами. Считается, что переносимый кровью TF делает возможной немедленную активацию каскада свертывания, но, вероятно, вносит также вклад в артериосклеротические бляшки. Происхождение переносимого кровью TF до сих пор является неизвестным.
Существует потенциальная связь между гиперинсулинемией/гипергликемией и активацией этого каскада свертывания. Ceriello et al. сообщили, что активация коагуляции увеличивается после еды. Кроме того, это подтверждается исследованиями, показывающими, что инфузия глюкозы индуцировала временное увеличение в образовании FVIIa, что отражало активацию пути TF, и в образовании тромбина в здоровых субъектах. Этот эффект был еще более ярко выраженным у пациентов с сахарным диабетом типа II, которые имели пролонгированные периоды гипергликемии/гиперинсулинемии. Примечательно, что тот же самый уровень гипергликемии, комбинированный с одновременной инфузией инсулина, которая уменьшает внутреннюю секрецию инсулина, нейтрализовал активность пути TF. Не только индивидуумы с сахарным диабетом типа II, но также индивидуумы с высоким BMI, т.е. индивидуумы с инсулинорезистентностью и, следовательно, увеличенными образованием и уровнями циркулирующего в кровотоке инсулина, имели увеличенную активность пути TF. Это состояние гиперсвертываемости у пациентов с сахарным диабетом типа II является приемлемым объяснением увеличенного риска диабетических сосудистых осложнений в этой группе пациентов.
Другой потенциальной связью между TF и островками Лангерганса является реакция свертывания, запускаемая островками, экспонированными АВО-совместимой крови, как в клинической трансплантации островков, так и в экспериментальных исследованиях. Эта реакция, называемая мгновенной опосредованной кровью воспалительной реакцией (IBMIR), отличается начальной активацией систем свертывания и комплемента, быстрым связыванием и активацией тромбоцитов, связыванием лейкоцитов, что вместе приводит к разрушению целостности островков и приводит к тромбозу вокруг островков.
В течение многих лет клиническая трансплантации островков имела коэффициент успеха, оцениваемый как инсулин-независимость после 1 года, приблизительно 10%. В последний год Shapiro et al. совершили прорыв, заключающийся в том, что они показали, что инсулин-независимость могла быть получена, если пациента повторно обрабатывали трансплантатами из более чем одного донора. При изучении отдаленных результатов та же самая группа показала, что перенесшие трансплантацию пациенты имели функцию β-клеток, соответствующую только 20% таковой у здоровых индивидуумов, несмотря на то, что эти пациенты получали островки из более чем одного донора. Взятые вместе эти находки недооценивают, что здесь, по-видимому, вовлечен неблагоприятный процесс, наиболее вероятно, потеря трансплантированной ткани.
Раскрытие изобретения
Авторы данного изобретения неожиданно обнаружили, что тканевой фактор экспрессируется в островках Лангерганса человека. Тканевой фактор был обнаружен в большинстве эндокринных клеток в островках, но не в клетках экзокринной ткани. Неожиданное открытие, что TF экспрессируется и продуцируется эндокринными клетками в островках Лангерганса ("продуцируемый островками TF"), указывает на то, что TF высвобождается вместе с высвобождением инсулина. Этот TF является, наиболее вероятно, ответственным за увеличенный риск артериосклероза и сердечно-сосудистого заболевания у пациентов с диабетом типа II или его предшествующими стадиями и субъектов с нарушенной толерантностью к глюкозе. Таким образом, ингибитор или антагонист образования TF в островках Лангерганса или высвобождения тканевого фактора или, по меньшей мере, его активной формы из этих островков может быть использован для предупреждения артериосклероза и сердечно-сосудистого заболевания у этих пациентов.
Резонно считать, что реакция IBMIR объясняет начальную потерю ткани, которая имеет место при клинической трансплантации островков. Механизм запуска IBMIR неизвестен, но данное изобретение показало, что IBMIR может нейтрализоваться in vitro мелагатраном, ингибитором тромбина, что свидетельствует о том, что IBMIR критическим образом зависит от активации тромбина. Тромбин может образовываться двумя путями: посредством пути тканевого фактора (внешнего пути) и посредством амплификационного каскада, в который вовлечен внутренний путь. Следовательно, локальное образование TF в островках Лангерганса человека является, наиболее вероятно, инициатором реакции IBMIR. Таким образом, ингибитор или антагонист против TF может подавлять или элиминировать IBMIR, и эта стратегия может быть использована для лечения пациентов с диабетом типа I в связи с трансплантацией островков для повышения выживания и во избежание отторжения трансплантируемых островков.
Таким образом, в первом аспекте данное изобретение относится к применению или способу применения ингибитора или антагониста тканевого фактора, TF, в получении лекарственного средства для лечения или предупреждения диабета или связанных с диабетом заболеваний. Выражение "диабет или связанные с диабетом заболевания" включает в себя нарушенную толерантность к глюкозе или инсулинорезистентность с ненормальным образованием инсулина (например, гиперсекрецией инсулина) и заболевания, происходящие из таких метаболических состояний, как артериосклероз, сердечно-сосудистые заболевания (например, острый инфаркт миокарда) и цереброваскулярные заболевания (например, кровотечение и инфаркт).
Ингибитор/антагонист может быть любым агентом, который влияет на TF на уровне ДНК, РНК или белка, и, следовательно, может быть выбран из группы известных ингибиторов TF, хотя этот агент не ограничивается ими.
В контексте данного изобретения выражение "ингибирование TF" означает полное или частичное ингибирование образования TF, а также высвобождения TF, в частности, его активной формы, из островков. Данное изобретение относится также к ингибированию высвобождаемого продуцируемого островками TF. Под термином "ингибитор" авторы изобретения имеют в виду вещества, способные к такому ингибированию TF.
В первом варианте данное изобретение обеспечивает применение, такое как описанное выше, в приготовлении лекарственного средства для введения в связи с трансплантацией продуцирующих инсулин клеток пациентам с инсулинзависимым сахарным диабетом (IDDM).
Во втором воплощении данное изобретение обеспечивает применение ингибитора/антагониста TF для получения лекарственного средства для лечения сердечно-сосудистых заболеваний и/или артериосклероза. Свободный TF связывается с артериосклеротическими бляшками и способствует увеличенному риску тромбоза, например, в случае инфаркта миокарда. Ожидается, что это применение является особенно важным для лечения пациентов с диабетом типа II или предшествующими ему стадиями.
Ингибитор или антагонист TF может быть анти-TF антителом, имеющим биологический эффект связывания TF, в частности, продуцируемого островками TF.
Ингибитор или антагонист TF может быть также агентом, способным блокировать синтез TF, таким как антисмысловая конструкция, блокирующая ген TF.
В альтернативном воплощении ингибитор или антагонист TF используют в комбинации с антикоагулянтом, таким как гепарин, или его фракции, или производные. Другие возможные комбинации включают ингибитор тромбина и/или ингибитор тромбоцитов.
Во втором аспекте данное изобретение относится к способу лечения или предупреждения диабета или связанных с диабетом заболеваний, предусматривающему введение ингибитора или антагониста тканевого фактора, TF, субъекту, нуждающемуся в этом лечении или предупреждении. Этот способ, например, предназначен для лечения диабетических пациентов и пациентов с нарушенной толерантностью к глюкозе. Этот способ предусматривает введение анти-TF-агента, который полностью или частично ингибирует образование TF в островках Лангерганса или высвобождение его из островков Лангерганса.
В третьем аспекте данное изобретение относится к ингибиторам/антагонистам как таковым, которые имеют способность ингибировать полностью или частично образование TF в островках Лангерганса или высвобождение его из островков Лангерганса.
Краткое описание чертежей
Фиг.1: Панель а. Срез поджелудочной железы человека, окрашенный mAb №4509, отчетливо показывает окрашивание панкреатических островков.
Панель b. Срез изолированного островка человека, окрашенный анти-TF mAb №4509. TF обнаруживается в большинстве клеток этого островка.
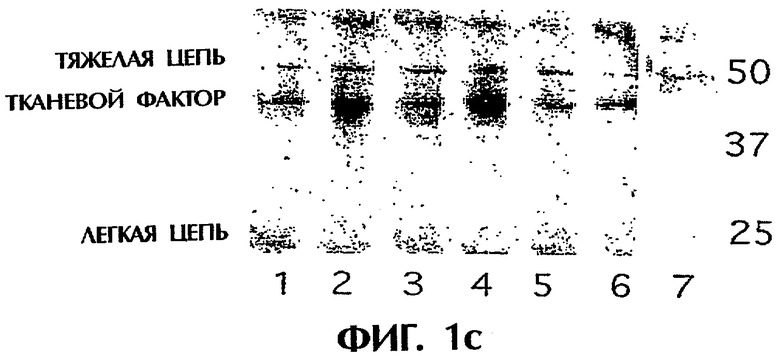
Панель с. Чистые островки человека из трех индивидуумов иммунопреципитировали анти-TF mAb №4503 или №4509 и подвергали электрофорезу в ДСН-ПААГ и Вестерн-блоттингу с использованием кроличьих поликлональных анти-TF-антител №4502. Дорожки 1-6 представляют три пары TF, преципитированные mAb №4503 (дорожки 1, 3, 5), и mAb №4509 (дорожки 2, 4, 6); дорожка 7, только преципитирующее антитело.
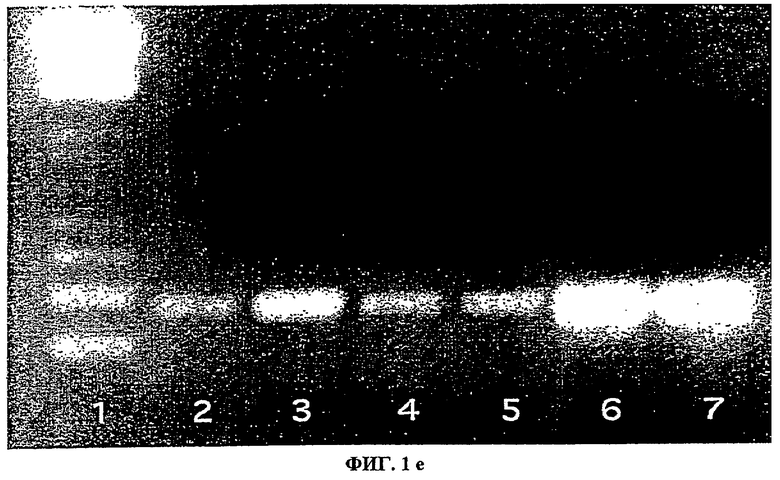
Панель d. ОТ-ПЦР изолированных островков человека из 6 индивидуумов (дорожки 2-7), дающая продукт размером 0,3 т.п.н. Дорожка 7 содержит стандарт молекулярных масс.
Панель е. Количественное определение TF в островках человека, культивированных в течение 0,2 и 7 дней (n=3).
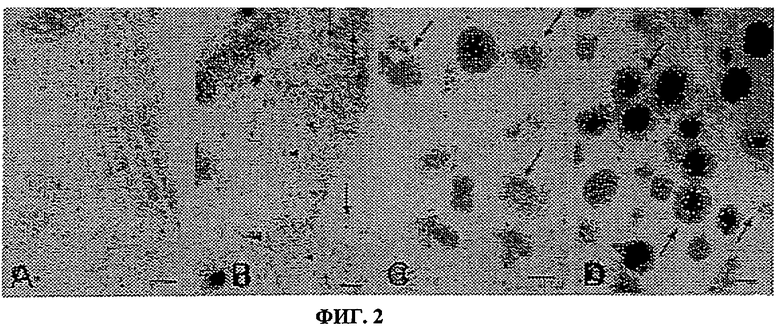
Фиг.2. Электронная микрофотография, показывающая репрезентативные результаты по иммуномечению золотом с анти-TF mAb №4509 на срезах изолированных островков. Все частицы золота имеют диаметр 15 нм. Черточками показан размер 100 нм.
a) молекулы TF (стрелки), показанные в гладкой эндоплазматической сети β-клеток (×54000);
b) аппарат Гольджи в α-клетке, причем частицы золота демонстрируют молекулы TF в стопках Гольджи (острия стрелок), в транзиторных везикулах, которые отпочковываются от транс-района аппарата Гольджи (большие стрелки) и в секреторной грануле (малая стрелка) (×36000);
c) отложение TF (стрелки) в центральной части гранул β-клеток (×36000);
d) отложения TF (стрелки), случайным образом распределенные в гранулах α-клеток (×54000).
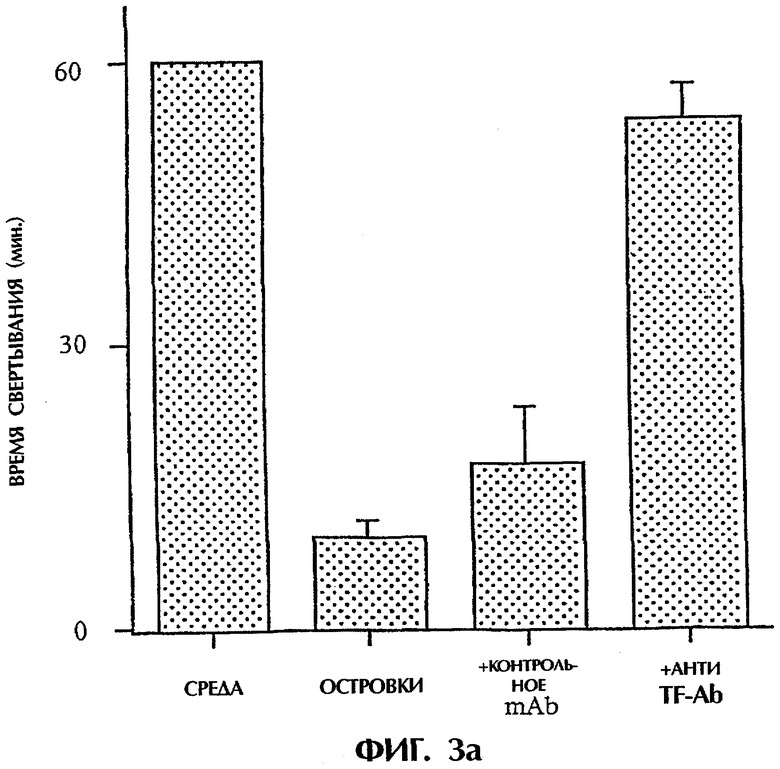
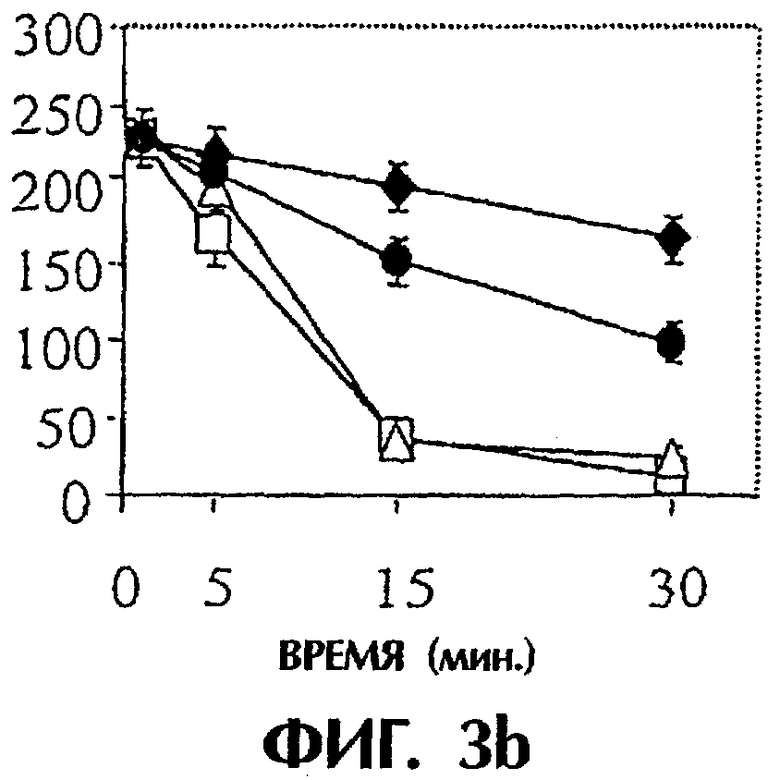
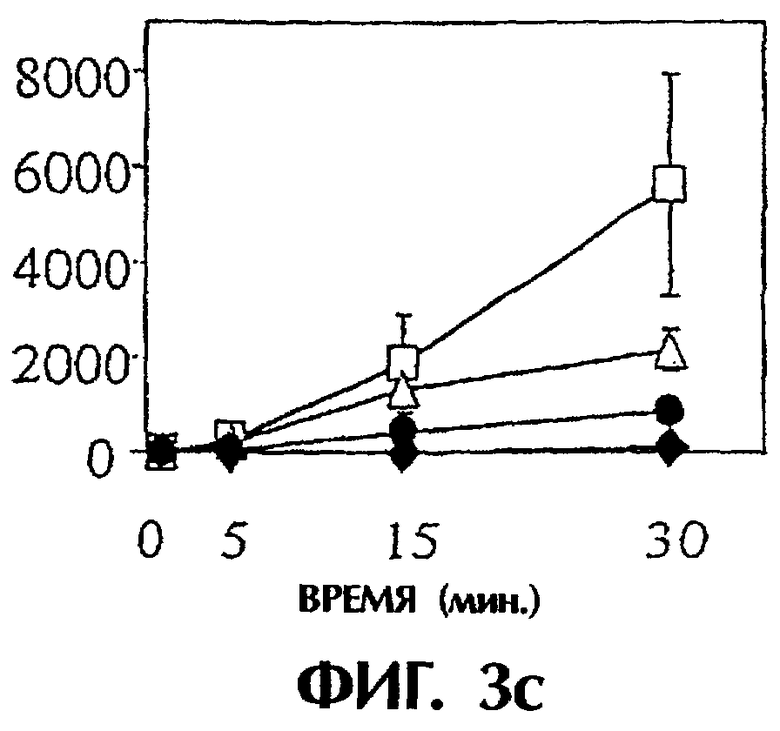
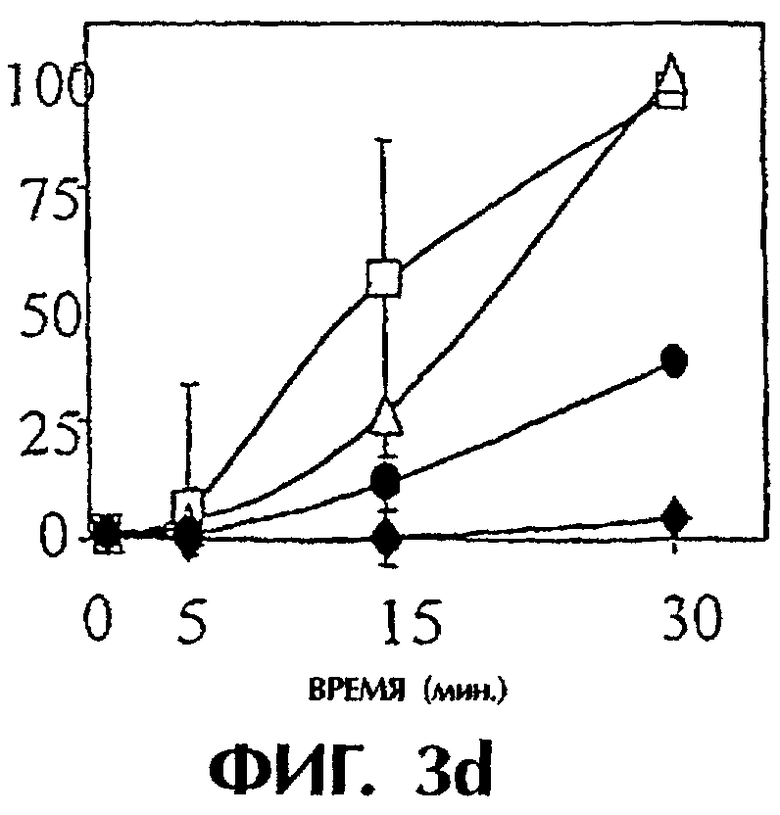
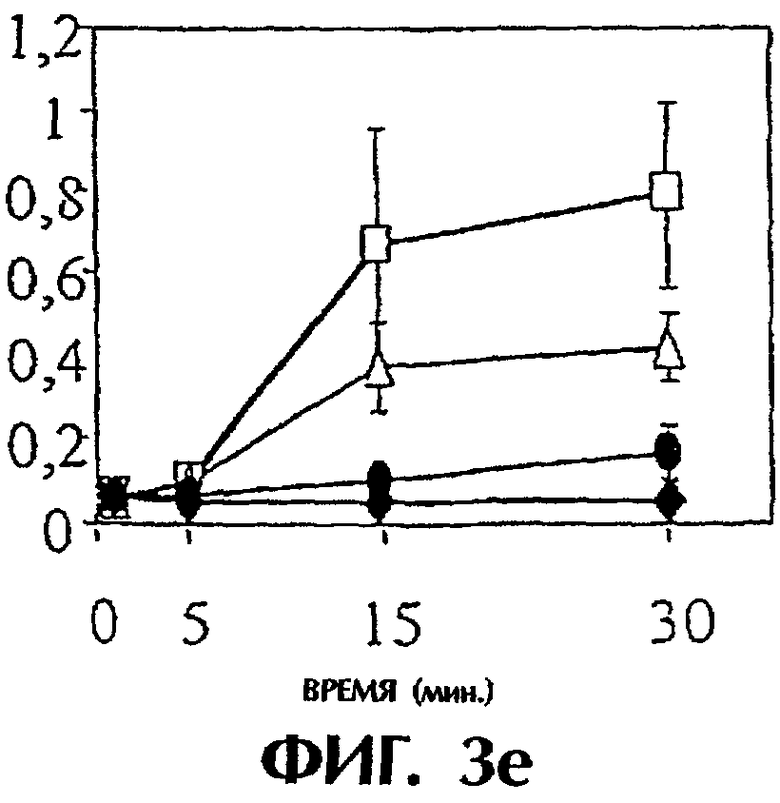
Фиг.3: Панель а. Действие анти-TF на время свертывания, запускаемого островками человека. Четыре мкл островков человека предобрабатывали средой, неингибиторным анти-TF mAb №4503 (контрольным mAb) и ингибиторным анти-TF №4509 в течение 10 минут при комнатной температуре. После этого островки инкубировали с 250 мкл плазмы человека, не обработанной антикоагулянтом, и регистрировали время свертывания в приборе ReoRox™ (n=7). IBMIR индуцировалась островками в модели трубчатой петли. Островки предобрабатывали средой (белые квадраты), неингибиторным анти-TF mAb №4503 (контрольным mAb) (белые треугольники) и ингибиторным анти-TF №4509 (черные кружки) в течение 10 минут при комнатной температуре. Среда без островков представлена черными ромбами. После этого 4 мкл островков человека инкубировали с 5 мл не обработанной антикоагулянтом АВО-совместимой крови человека в гепаринизированных трубчатых петлях. IBMIR регистрировали посредством b) подсчета тромбоцитов и ИФА на с) TAT, d) F 1+2 и е) FXIa-AT.
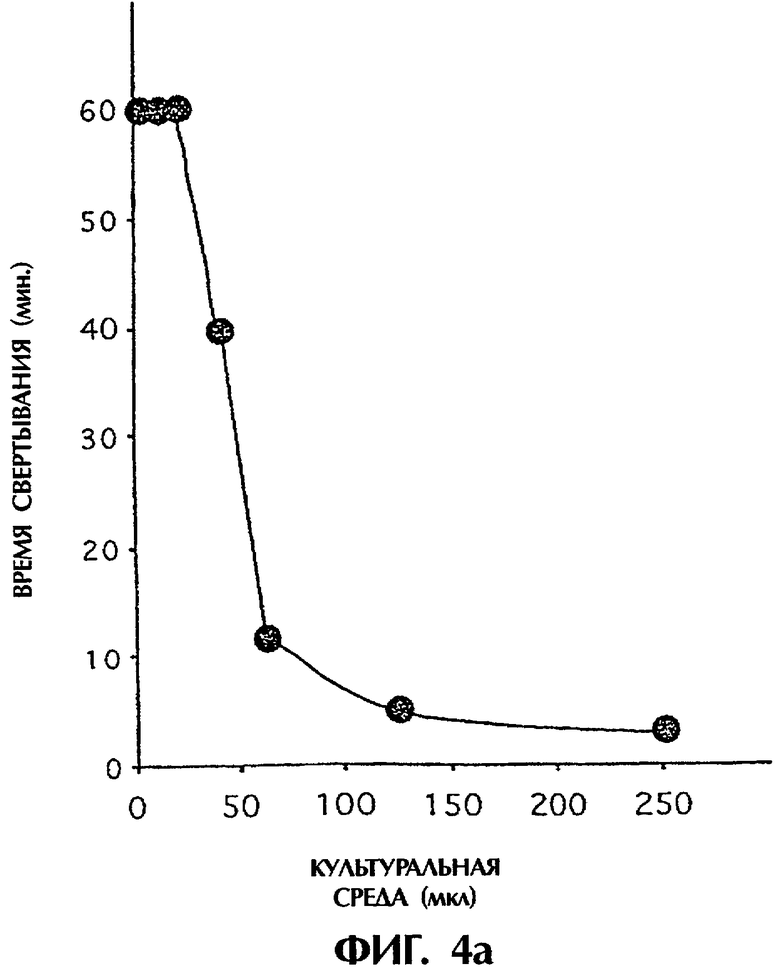
Фиг.4: 250 мкл обработанной цитратом плазмы человека смешивали с варьирующими объемами среды из культур островков Лангерганса человека. Время свертывания оценивали после рекальцификации плазмы в приборе ReoRox™. Панель а является репрезентативным серийным разведением среды из одной партии островков, тогда как панель b является 60 мкл культуральной среды из островков трех различных индивидуумов, которые были обработаны ЗФР, mAb №4503 или mAb №4509 (среднее ± SEM (стандартная ошибка среднего)).
Фиг.5: IBMIR, запускаемая островками человека, блокируется анти-TF и iFVIIa.
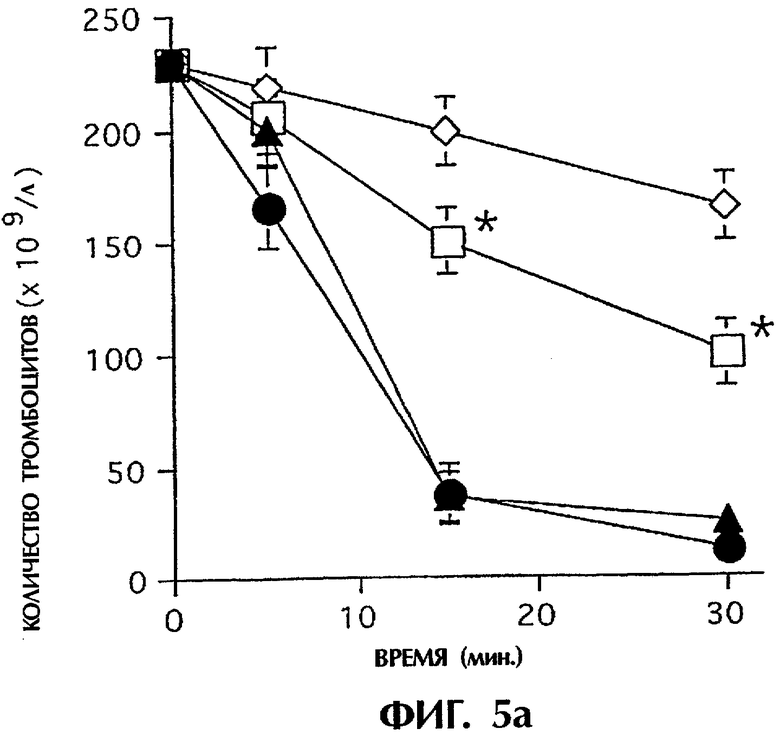
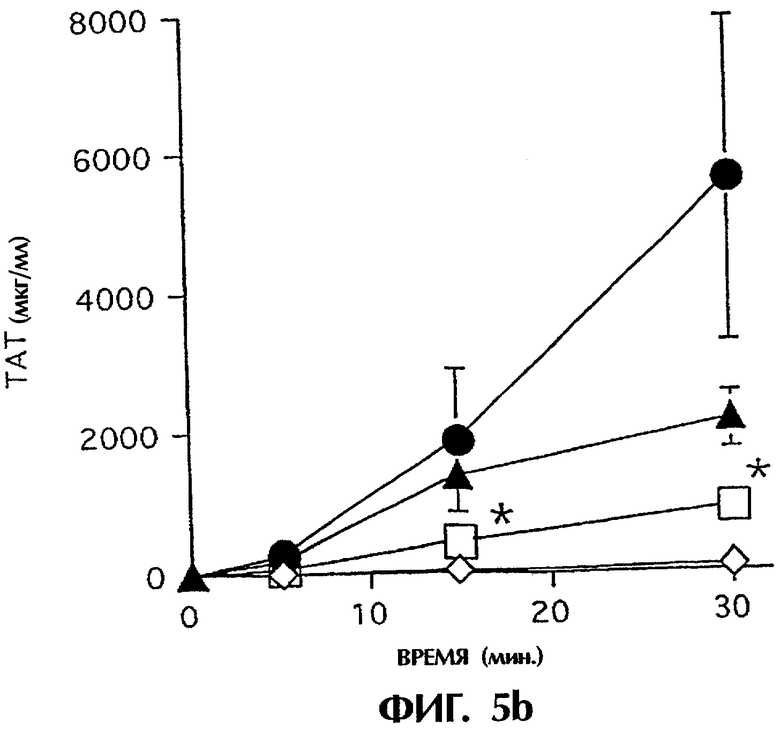
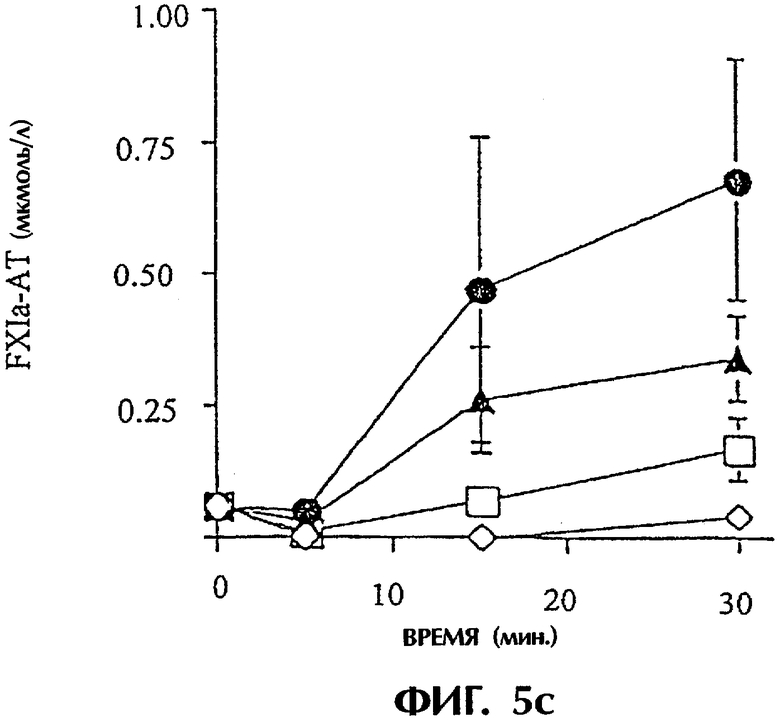
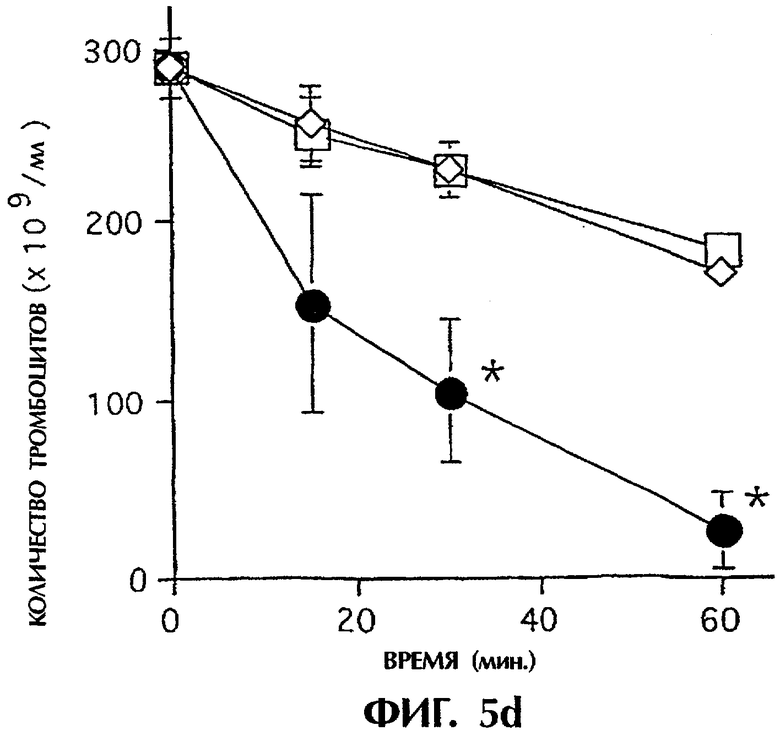
IBMIR, индуцированная островками в модели трубчатой петли. Островки предобрабатывали ЗФР (•), неингибиторным анти-TF mAb №4503 (контрольным mAb; ▴) или ингибиторным анти-TF №4509  . ⋄ показывает среду без островков. Островки инкубировали с не обработанной антикоагулянтом АВО-совместимой кровью человека в гепаринизированных трубчатых петлях. IBMIR регистрировали посредством а) подсчета количества тромбоцитов и ИФА на b) ТАТ и с) FXIa-AT (*р<0,05 при сравнении с петлей, содержащей только островки). Альтернативно инкубирование островков проводили в присутствии
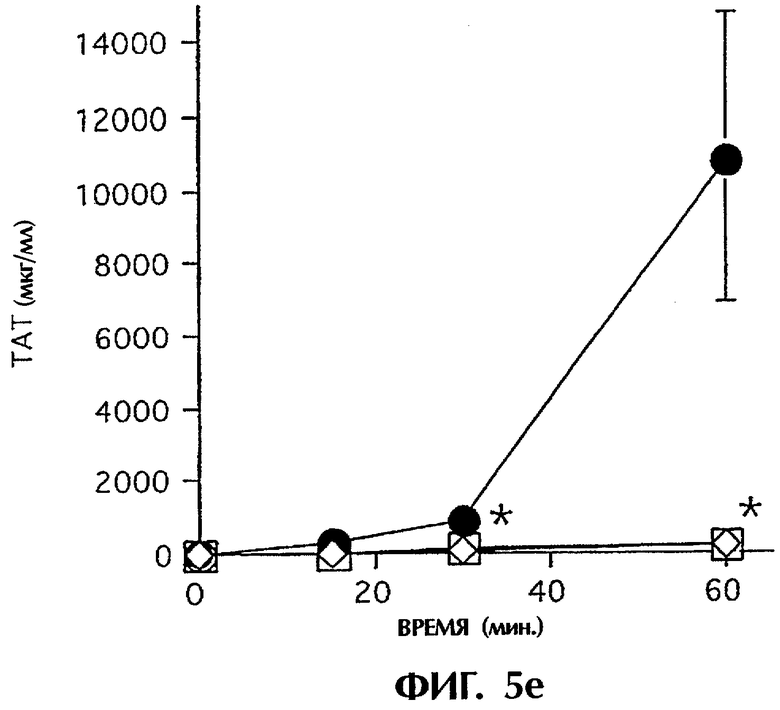
. ⋄ показывает среду без островков. Островки инкубировали с не обработанной антикоагулянтом АВО-совместимой кровью человека в гепаринизированных трубчатых петлях. IBMIR регистрировали посредством а) подсчета количества тромбоцитов и ИФА на b) ТАТ и с) FXIa-AT (*р<0,05 при сравнении с петлей, содержащей только островки). Альтернативно инкубирование островков проводили в присутствии  или в отсутствие (•) 40 пмоль/л iFVIIa. ⋄ показывает среду без островков. IBMIR регистрировали посредством d) подсчета количества тромбоцитов и ИФА на е) ТАТ и f) FXIa-AT (*p<0,05 при сравнении с петлей, содержащей только iFVIIa).
или в отсутствие (•) 40 пмоль/л iFVIIa. ⋄ показывает среду без островков. IBMIR регистрировали посредством d) подсчета количества тромбоцитов и ИФА на е) ТАТ и f) FXIa-AT (*p<0,05 при сравнении с петлей, содержащей только iFVIIa).
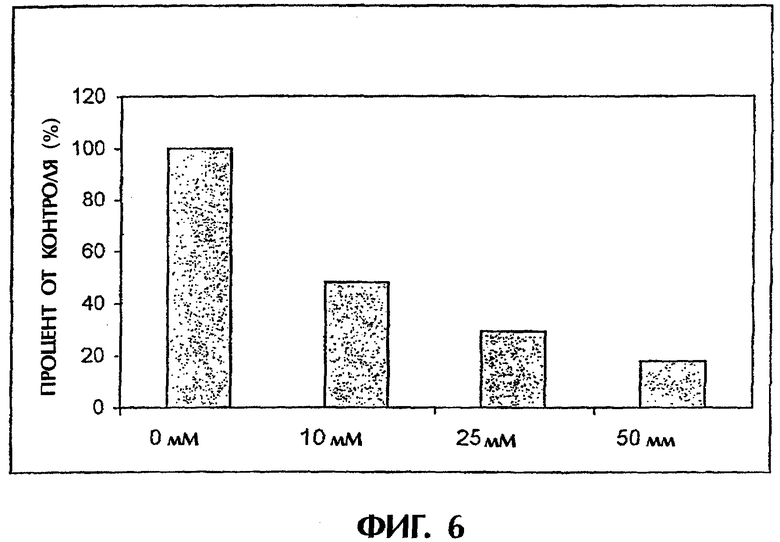
Фиг.6: Внутриклеточная концентрация TF после культивирования в среде, содержащей никотинамид, и оцениваемая в сравнении с контролем.
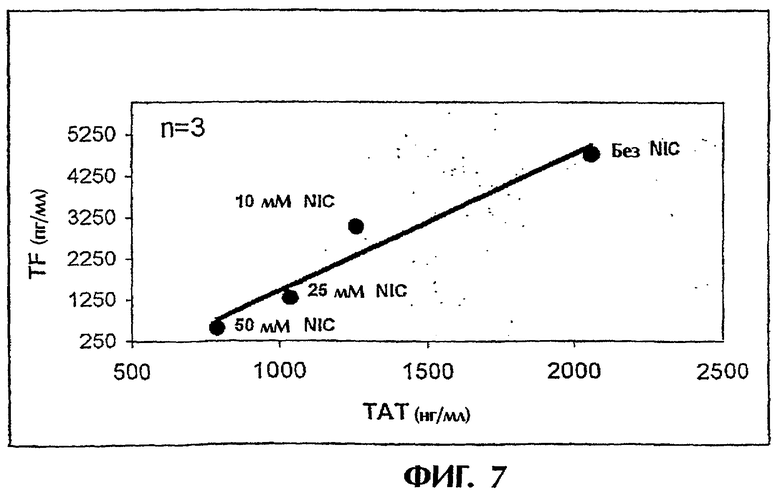
Фиг.7: Образование ТАТ, отражающее активацию коагуляции.
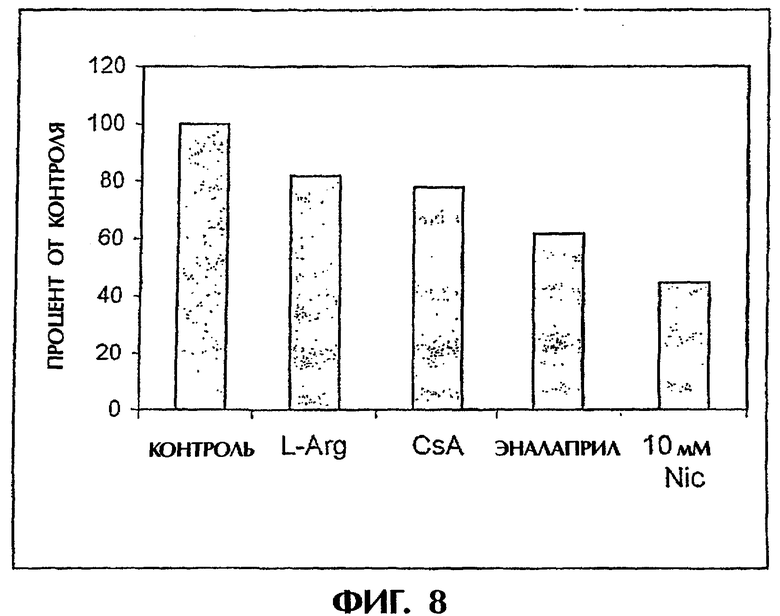
Фиг.8: Внутриклеточная концентрация TF после культивирования в среде, содержащей эналаприл (40 мкг/мл), циклоспорин А (10 мкмоль/л), L-аргинин (1 нмоль/л), никотинамид (10 ммоль/л) соответственно, и оцениваемая в сравнении с контролем.
Осуществление изобретения
Экспрессия и продуцирование TF в островках Лангерганса человека
Срезы поджелудочной железы окрашивали на присутствие TF с использованием mAb №4509 (фиг.1а). Было обнаружено, что TF был распределен в большинстве, но не во всех эндокринных клетках островков Лангерганса. Распределение окрашивания предполагало, что TF локализован в гранулах большинства островковых клеток. Изолированные островки из поджелудочной железы человека также показали сходное распределение TF, что указывает на то, что на экспрессию TF не влияла процедура выделения (фиг.1b). TF был также обнаружен в адвентициальной оболочке крупных кровеносных сосудов. Эндотелиальные клетки не окрашивались, что указывало на то, что TF не экспрессировался в ответ на какой-либо из сигналов воспаления. TF не был обнаружен в ацинорных клетках экзокринной поджелудочной железы.
Для подтверждения, что TF присутствовал в островках человека, белок извлекали из лизатов чистых островков двумя различными анти-TF-антителами mAb (№4503 и 4509). Связанный антителами белок подвергали электрофорезу в ДСН-ПААГ с последующим Вестерн-блоттингом. Преципитированный белок идентифицировали с использованием поликлонального анти-TF-антитела. В сходных экспериментах TF извлекали поликлональным анти-TF-антителом и идентифицировали любым из этих двух mAb (не показано). Этот полипептид имел молекулярную массу 47 кДа, идентичную молекулярной массе TF (фиг.1с). Количество TF на один культивируемый островок рассчитывали после количественного определения TF в лизатах при помощи ELISA (фиг.1d). Сразу же после выделения островков это содержание было 13 пг/островок. Оно временно увеличивалось в культуре в три раза в день 2 (42 пг/островок), но было значительно более низким в день 7 (21 пг/островок). ОТ-ПЦР, выполненная на чистых изолированных вручную островках, подтвердила экспрессию TF также и на уровне мРНК (фиг.1е).
Электронно-микроскопическое детектирование TF в островках человека
Электронно-микроскопическую детекцию TF выполняли на in situ островках из двух здоровых поджелудочных желез и двух партиях изолированных островков иммунологическим способом с использованием частиц золота на обработанных при низкой температуре заключенных в Lowicryl образцах (фиг.2). Эндокринные клетки во всех исследованных островках хорошо сохранялись на уровне ультраструктуры, хотя контрастирование внутриклеточных структур не было оптимальным, так как эти ткани не были обработаны осмием. Как в in situ панкреатических островках, так и в изолированных островках частицы золота демонстрировали присутствие TF как в α-, так и в β-клетках. В обоих типах клеток TF был локализован в гладком эндоплазматическом ретикулюме (фиг.2а), в стопках Гольджи и в транзиторных везикулах, отпочковывающихся из транс-Гольджи-стопок (фиг.2b), а также в гормональных гранулах α- и β-клеток (фиг.2с и d). Молекулы TF были обнаружены в умеренных концентрациях в гранулах β-клеток, предпочтительно в электронно-плотной центральной части, но в более высокой концентрации и случайным образом распределенными по всему матриксу гранул α-клеток. Не была обнаружена TF-иммунореактивность в δ- или РР-клетках. Все эксперименты по мечению негативного контроля были отрицательными.
Блокирование IBMIR анти-TF-антителами
Островки Лангерганса человека в контакте с не обработанной антикоагулянтом плазмой крови человека индуцировали гелеобразование после приблизительно 9,5 минут, как было зарегистрировано с использованием вискозиметрии в сравнении с контролем, содержавшим только буфер, который не индуцировал свертывания в пределах 60 минут, что свидетельствовало о том, что островки были способны индуцировать активацию свертывания (фиг.3а). Для того чтобы связать экспрессию TF в островках с прокоагулянтной активностью, были предприняты попытки блокировать эту активность анти-TF-антателами. В присутствии ингибиторного анти-TF (mAb №4509) гелеобразование задерживалось в 5,6 раза до 53 минут в сравнении с 1,8-кратным задерживанием в случае контрольного mAb против нефункционального эпитопа TF (mAb №4503).
Для исследования, запускает ли TF IBMIR, островки человека перфузировали свежей АВО-совместимой кровью человека в модели трубчатой петли в течение 30 минут (фиг.3). Островки инкубировали с анти-TF-антителами в течение 10 минут и затем промывали три раза перед их добавлением в трубчатые петли. В контроле со средой и с неингибиторным анти-TF-антителом (№4503) свертывание происходило в пределах 15 минут, но с ингибиторным анти-TF-антителом (№4509) свертывание было ингибированным на протяжении всего периода наблюдения. Это отражалось в потреблении тромбоцитов (количестве тромбоцитов), в высвобождении содержимого α-гранул тромбоцитов (β-тромбоглобулина) и в образовании тромбина-антитромбина, протромбиновых фрагментов 1+2 и комплексов фактор XIa-антитромбин, которые все подавлялись mAb №4509, но не mAb №4503 (фиг.3; таблица I). Эти открытия демонстрируют, что TF является пусковым механизмом для IBMIR.
Свертывание плазмы крови человека TF, высвобождаемым из культивируемых панкреатических островков
Прокоагулянтная активность была обнаружена в культуральной среде культивируемых островков, когда эту среду смешивали с плазмой человека (фиг.4). В присутствии культуральной среды плазма свертывалась в пределах 5 минут. Свертывающая активность блокировалась mAb №4509, тогда как mAb №4503 не оказывал действия. Если супернатанты ультрацентрифугировали при ×100000 g, не наблюдали свертывания с этими супернатантами, хотя осадок имел двойную активность в сравнении с несепарированной культуральной средой. Это показало, что активность TF была ассоциирована с высокомолекулярной фракцией, и, поскольку TF является мембраносвязанным белком с трансмембранной частью, этот белок, наиболее вероятно, является связанным с микрочастицами.
Блокирование IBMIR анти-TF-антителами и iFVIIa
Инкубирование островков Лангерганса человека со свежей плазмой человека без добавок индуцировало гелеобразование (наблюдаемое при помощи вискозиметрии) после приблизительно 9,5 минут, тогда как один буфер не индуцировал свертывание даже после 60 минут, что свидетельствовало о том, что эти островки были способны индуцировать активацию свертывания (n=7; не показано). Для того чтобы связать экспрессию TF в островках с прокоагулянтной активностью, авторы попытались блокировать гелеобразование анти-TF-антителами. В присутствии ингибиторного анти-TF (mAb №4509) гелеобразование происходило в 5,6 раза медленнее (после 53 минут) в сравнении с замедлением в 1,8 раза в случае островков, подвергнутых действию контрольного mAb против нефункционального эпитопа TF (mAb №4503).
Для исследования, запускает ли наблюдаемый TF IBMIR, авторы перфузировали островки человека свежей АВО-совместимой кровью человека в модели трубчатой петли в течение 30 минут (фиг.5). Островки инкубировали с ингибиторным или неингибиторным анти-TF-mAb в течение 10 минут и затем промывали три раза перед добавлением в трубчатые петли. В контрольных пробах (кровь только с островками или с неингибиторным анти-TF-антителом (mAb №4503) свертывание происходило в пределах 15 минут, но с ингибиторным анти-TF-антителом (mAb №4509) свертывание было ингибированным на протяжении всего периода наблюдения. Это различие отражалось в потреблении тромбоцитов (количестве тромбоцитов), в высвобождении содержимого α-гранул тромбоцитов (β-тромбоглобулина) и в образовании тромбина-антитромбина (ТАТ), протромбиновых фрагментов F1+2 и комплексов FXIa-AT, которые все подавлялись ингибиторным mAb №4509, но не неингибиторным mAb №4503 (фиг.5а-с; таблица I). Даже еще более ясно выраженное ингибирование IBMIR получали с iFVIIa, эффективным ингибитором активности TF. Кровь, содержащая 40 пмоль/л iFVIIa, полностью ингибировала снижение количества тромбоцитов и увеличение TAT, FXIa-AT и С3а (фиг.5d-h). Это действие этих двух ингибиторов в сильной степени указывает на то, что TF запускает IBMIR.
Анти-TF-антитела и сайт-инактивированный FVIIa
Антитела против тканевого фактора человека (mAb №4509 и 4503 и поликлональное антитело №4502) покупали у American Diagnostica Inc. (Greenwich, Connecticut). MAb №4509 ингибирует активность TF, a mAb №4503 узнает нефункциональный эпитоп TF. Поликлональное козье антимышиное антитело, меченное 10-и 15-нм частицами Au (GAM-G10/15) и поликлональное козье антикроличье антитело, меченное 10- и 15-нм частицами Au (GAR-G 10/15) покупали у Amersham International (Amersham, Bucks, England). Сайт-инактивированный фактор Vila (iFVIIa) получали инактивацией FVIIa (NovoSeven, Novo Nordic, Denmark) дансил-Glu-Gly-Arg-хлорметилкетоном в соответствии с Wildgoose et al. Обсуждение
Результаты данного исследования однозначно указывают на то, что TF продуцируется и секретируется α- и β-клетками островков Лангерганса. Иммунопреципитация, ОТ-ПЦР и электронно-микроскопические исследования указывают на экспрессию TF как α-, так и β-клетками, но не δ- или РР-клетками. TF-активность, обнаруженная в культуральных супернатантах, указывает на то, что TF высвобождается из островков. Локализация TF в гранулах α- и β-клеток указывает на то, что TF высвобождается вместе с инсулином и глюкагоном. Однако регуляция синтеза TF неизвестна.
Тот факт, что IBVIR ингибируется анти-TF, вместе с недавним открытием, что большая часть процесса IBMIR запускается и усиливается тромбином, позволяет авторам изобретения предложить гипотезу запуска этой реакции, хотя авторы ни в коем случае не считают себя связанными этой гипотезой, и эта гипотеза не должна рассматриваться как сужающая объем данного изобретения, определенный в формуле изобретения. После первоначального образования тромбина экспрессируемым островками TF активированные тромбином тромбоциты начинают связываться с поверхностью островков. Лиганд/лиганды, с которыми тромбоциты связываются на поверхности островков, все еще не идентифицированы, но сообщалось, что коллагены типов I, III, IV и V окружают островки человека. Коллаген является известным медиатором связывания и активации тромбоцитов. Это сопровождается быстрой потерей тромбоцитов из крови. Через амплификационный каскад, включающий в себя фактор XI и активированные тромбоциты, образуется больше тромбина, который образует фибриновую капсулу, окружающую островки.
Ингибирование связанной с островками активности TF перед трансплантацией, вероятно, будет предотвращать IBMIR при клинической трансплантации островков. Авторы предвидят, что протоколы предобработки, включающие как агенты, способные блокировать экспрессию TF (анти-TF-антител), так и агенты, способные блокировать синтез TF, например, антисмысловые агенты, будут разработаны в ближайшем будущем. Предобработка островков перед трансплантацией могла бы давать явные клинические преимущества, так как она не оказывала бы вредного действия на гемостаз реципиента.
Потенциальным источником переносимого кровью TF являются лейкоциты, которые, как известно, вырабатывают связанный с микрочастицами TF. Обнаружение у здоровых индивидуумов увеличенной активности TF-пути в ответ на инфузию глюкозы в сильной степени указывает на то, что TF-активность инициируется альтернативным чувствительным к глюкозе механизмом. Высвобождение TF вместе с инсулином давало бы такую тесную взаимосвязь у индивидуумов без явного активного воспалительного процесса. Разрушенные артериосклеротические бляшки содержат TF, и количество TF коррелирует с тромбогенностью бляшки. Поскольку концентрация TF увеличивается вблизи поверхности бляшки, обращенной в просвет сосуда, было сделано предположение, что ассоциированный с бляшкой TF происходит из крови. В поддержку этого открытия переносимый кровью TF связывается с артериосклеротическими бляшками, которые впоследствии способны инициировать развитие локального артериального тромбоза. Данное изобретение предполагает, что, по меньшей мере, часть переносимого кровью TF происходит из клеток панкреатических островков. Принимая во внимание увеличенное образование тромбина в ответ на гипергликемию у пациентов с диабетом типа II и, возможно, у других индивидуумов с инсулинорезистентностью и гиперинсулинемией, можно думать, что, вероятно, в этих случаях присутствует TF, более активный и способный связываться с артериосклеротическими бляшками. Это могло бы увеличивать риск тромбоза у пациентов с указанными состояниями.
Согласно следующему аспекту данного изобретения выработка и/или высвобождение TF может ингибироваться введением инсулина или других веществ, которые будут уменьшать образование инсулина.
Было обнаружено, что пациенты, которым давали инсулин, обнаруживают значительно сниженную частоту сердечно-сосудистого заболевания. Предполагаемым объяснением является то, что поскольку TF тесно связан с инсулином в островках Лангерганса, где вырабатывается инсулин, скорость высвобождения TF из островков будет уменьшаться вместе с уменьшением высвобождения инсулина.
Предполагаемым участвующим в этом механизмом является то, что инсулин будет снижать уровень глюкозы в крови, и чувствительная к глюкозе система будет отслеживать этот пониженный уровень глюкозы и, следовательно, не будет запускать дальнейшее высвобождение инсулина из островков, уменьшая посредством этого высвобождение TF.
В настоящее время пациентов, страдающих от диабета II типа, не лечат инсулином. Вместо этого им дают лекарственные средства, запускающие высвобождение инсулина из островков с сопутствующим высвобождением TF, увеличивающим риск появления ишемической (коронарной) болезни сердца (CHD).
Это означает, что инсулин может быть использован для предупреждения CHD у пациентов с риском внезапного появления CHD, например, пациента, имеющего диабет типа 2 и его продромальное состояние, инсулинорезистентность. Таким образом, данное изобретение обеспечивает новый способ лечения этих пациентов, предусматривающий введение вещества, которое может характеризоваться уменьшением выработки и/или высвобождения инсулина, но действующего через ингибирование TF.
Еще одним важным открытием в рамках данного изобретения является то, что существует связь между гиперинсулинемией и сердечно-сосудистым заболеванием у пациентов, страдающих от диабета типа II. Таким образом, обнаружение связи между экспрессией TF в островках Лангерганса и хорошо известным риском коронарной болезни сердца (CHD) у пациентов с диабетом типа II может быть использовано в рамках данного изобретения для обеспечения лекарственных средств и способов лечения.
Гиперинсулинемия является признаком, который является общим как для диабета типа II, так и для его продромального состояния, инсулинорезистентности. В обоих состояниях β-клетки панкреатических островков вырабатывают увеличивающиеся количества инсулина для регуляции относительной гипергликемии, являющейся результатом прогрессивно увеличивающейся инсулинорезистентности. Оба эти состояния связаны с повышенным риском CHD. В результате этого риск инфаркта миокарда у пациентов с диабетом типа II, в остальном здоровых, является таким же высоким, как риск у пациентов, которые уже перенесли инфаркт миокарда.
В некоторых публикациях сообщалось, что активация свертывания происходит после еды. Эти открытия дополнительно подтверждались сообщениями, что инфузия глюкозы индуцирует временное увеличение образования FVIIa, отражающее активацию пути TF, и образования тромбина у здоровых пациентов. Этот эффект является еще более выраженным у пациентов с сахарным диабетом типа II, которые испытывают длительные периоды гиперинсулинемии/гипергликемии. Особый интерес представляет наблюдение, что один и тот же уровень гипергликемии при объединении с одновременной инфузией инсулина для снижения эндогенной секреции инсулина способен нейтрализовать активность пути TF, что указывает на то, что эндогенная выработка инсулина является необходимым условием для активации свертывания.
Считается, что связывание связанного с микрочастицами TF с тромбоцитами является важным для прогрессирования тромбообразования. В частности, переносимый кровью TF значительно повышен у пациентов с острым инфарктом миокарда и нестабильной стенокардией.
Локальная выработка TF в островках человека и экскреция в ответ на длительные периоды гипергликемии обеспечивают возможное объяснение активации системного пути TF во время гиперинсулинемии.
Артериосклеротические бляшки содержат TF, и это количество TF коррелирует с тромбогенностью бляшки. Происхождение TF в этих бляшках полностью не выяснено, но известно, что как клетки гладких мышц, так и пенистые клетки в липидной центральной части бляшки вырабатывают TF. Артериосклеротическая бляшка может запускать образование тромба двумя путями: либо бляшка разрывается и обнажает свою TF-содержащую липидную центральную часть, либо обнажается эндотелиальная поверхность бляшки и подлежащая ткань индуцирует образование тромба. В последнем случае переносимый кровью TF может прикрепляться к субэндотелиальной поверхности и запускать тромбоз.
Таким образом, в соответствии с одним аспектом данного изобретения перечень ингибиторов TF включает в себя вещества, которые способны уменьшать секрецию инсулина и, вследствие этого, снижать высвобождение TF из островков Лангерганса. Примеры таких веществ включают в себя тиазолиндионы, которые уменьшают инсулинорезистентность, и/или экзогенный инсулин или аналоги инсулина, природные или рекомбинантные.
Материалы и способы
Выделение островков
Авторы изолировали островки, как описано повсеместно, из трупов людей-доноров (одобренных комитетом по этике) с использованием перфузии либеразой с последующей очисткой на непрерывном градиенте плотности фиколла в охлаждаемой центрифуге СОВЕ 2991 (СОВЕ Blood Component Technology, Lakewood, CO, USA). Эти препараты островков поддерживали в культуральной среде (CMRL 1066; ICN Biomedicals, Costa Mesa, CA) при 37°С (5% CO2) в течение 1-7 дней. Объем и чистоту определяли микроскопическим определением размеров после окрашивания дифенилтиокарбазоном. Жизнеспособность оценивали по секреции инсулина в ответ на введение глюкозы в динамической перфузионной системе (1,67,16,7 и опять 1,67 мкмоль/л глюкозы).
Анти-TF-антитела
Антитела против тканевого фактора человека (mAb №4509, 4503 и polyAB №4502) покупали у American Diagnostica Inc. (Greenwich, CT, USA).
Иммуногистохимическов окрашивание
Кусочки целых поджелудочных желез и изолированные островки собирали в среде для заливки (Tissue-Tek; Miles, Eckhart, IN) и быстро замораживали в жидком азоте. Из этих проб делали срезы и окрашивали их mAb №4509 с последующим добавлением конъюгированных с HRP (пероксидазой хрена) свиных антител против мышиного Ig (DAKO A/S, Glostrup, Denmark).
Иммунопреципитация TF из очищенных островков Лангерганса человека
Две тысячи островков промывали пять раз центрифугированием при 9×g при комнатной температуре (RT) с использованием ЗФР, содержащего 5 мМ ЭДТА, 10 мМ бензамидин, 0,1 мг/мл ингибитора трипсина сои и 1 мМ ФМСФ. Осадок инкубировали в 0,5 мл того же самого буфера с добавлением 1% тритона Х-100 (Sigma) при 37°С в течение 30 минут. После этого дебрис клеток удаляли центрифугированием при 10000×g в течение 5 минут. Три мкг mAb №4509 или №4503 инкубировали с 250 мкл клеточного лизата в течение 30 минут при 37°С и преципитировали белок G-сефарозой (Pharmacia, Upjohn, Stockholm, Sweden). Пробы подвергали электрофорезу в ДСН-ПААГ и Вестерн-блот-анализу с использованием кроличьих polyAb №4502 и HRP-конъюгированных антител против кроличьих иммуноглобулинов (Dako A/S).
Электронная микроскопия
Для анализа ультраструктуры брали образцы панкреатической ткани из двух пациентов-мужчин и выделяли островки из двух доноров поджелудочной железы. Ни один из этих пациентов или доноров не страдал от какого-либо метаболического заболевания, все поджелудочные железы были макро- и микроскопически нормальными и не обнаруживали какого-либо отложения амилоида. Для сохранения антигенности эти образцы обрабатывали с использованием низкотемпературного способа. Ультратонкие срезы, помещенные на никелевые сетки, подвергали иммуномечению иммунологическим способом с использованием частиц золота. Антитела против TF (mAb №4509, 4503 и pAb №4502, разведение 1:25) (см. также таблицу 1) и частицы из коллоидного золота 10 или 15 нм использовали в качестве электроноплотных маркеров. Срезы контрастировали уранилацетатом и цитратом свинца перед исследованием на электронном микроскопе Philips 201.
Время свертывания
Время свертывания плазмы измеряли в четырехканальном свободно осциллирующем реометре, ReoRox 4, от GHI (Global Haemostasis Institute AB, Linkoping, Sweden).
Трубчатые петли в качестве модели
Авторы изобретения используют модификацию модели, описанной ранее. Петли, изготовленные из ПВХ-трубки (диаметр = 6,3, длина 390 мм), покрывали внутри гепарином Corline (Colline, Uppsala, Sweden) в соответствии с рекомендацией изготовителя.
Четыре мкл (˜4000 IEQ) промытых островков (дважды в CMRL 1066) либо предынкубировали с 15 мкл mAb №4509, контрольного mAb №4503, либо с ЗФР в течение десяти минут при комнатной температуре. После трех стадий промывки эти островки ресуспендировали в 150 мкл CMRL 1066 и помещали в эти петли, после чего добавляли свежую АВО-совместимую кровь человека (5 мл). Для создания кровотока со скоростью приблизительно 100 мл/мин авторы помещали их на качалку, помещенную в термостат на 37°С на 30 минут. Авторы также использовали контрольную петлю, содержащую кровь с добавлением 150 мкл CMRL 1066, но не содержащую островков. Перед перфузией и спустя 5, 15 и 30 минут авторы отбирали пробы крови в ЭДТА (4,1 мМ, конечная концентрация) для последующего анализа.
Анализ крови и плазмы
Тромбоциты и дифференциально лейкоциты (лейкоцитарную формулу) в крови подсчитывали с использованием анализатора Coulter AcT Diff Analyser (Beckman Coulter, FL, USA).
Уровни в плазме протромбиновых фрагментов 1+2 и комплекса тромбин-антитромбин (ТАТ) определяли количественно с использованием коммерчески доступных ИФА-наборов (Enzygnost® F1+2 и TAT, Dade Behring, Marburg, Germany). Комплекс FXIa-AT в плазме определяли количественно согласно Sanches et al. β-тромбоглобулин (P-TG) анализировали с использованием Asserachom (Diagnostica Stago, Asnieres-sur-Seine, France). Продукты активации комплемента С3а и sC5b-9 определяли, как описано ранее.
ОТ-ПЦР-анализ
Цитоплазматическую РНК из островков выделяли, как описано. Одноцепочечные кДНК получали с использованием олиго(dT)-затравки (Amersham Pharmacia). ПЦР-праймеры комбинировали так, чтобы получить ПЦР-продукты, простирающиеся на два или более экзонов транскрипта TF, для амплификации только кДНК, но не следовых количеств геномной ДНК. ОТ-ПЦР проводили в течение 35 циклов с использованием компонентов для высокоточной ПЦР (Expand, Boehringer-Mannheim, Germany), после чего продукты анализировали на 3% агарозных гелях с 0,5 мкг/мл бромида этидия.
Статистический анализ
Все результаты выражали в виде среднего ± SEM. Средние значения сравнивали с использованием ANOVA с критерием Фридмана. Значимость определяли при α=0,05.
Greenwich, CT, USA 5 и 6: Amersham
International, Amersham, Bucks, England.
Ингибирование синтеза и секреции TF
Островки культивировали в течение 24 часов в среде CMRL, содержащей 10 мМ никотинамид, которая является стандартной средой, используемой для культуры панкреатических островков. После этого эту среду заменяли средой CMRL без никотинамида. После периода базовой линии (фона) в течение еще 24 часов островки отбирали вручную для анализа содержания TF. Культивирование продолжали в течение 48 часов в среде, содержащей агенты, о которых известно, что они влияют на экспрессию TF в моноцитах и эндотелиальных клетках. Ими были L-аргинин, циклоспорин А, эналаприл, ацетилцистеин и никотинамид. Островки собирали и анализировали содержание TF с использованием коммерческого ИФА-набора, и эти островки испытывали в модели петли in vitro.
Культура островков вместе с витамином группы В никотинамидом уменьшала синтез и секрецию тканевого фактора. При культивировании островков вместе с никотинамидом при концентрациях в диапазоне от 0 до 50 мМ выработка в островках тканевого фактора ингибировалось зависимым от дозы образом (фиг.1А). Подобным образом при испытании в системе петли in vitro в контакте с кровью человека внутриклеточное содержание TF коррелировало с активацией свертывания, что отражалось в образовании ТАТ (фиг.1В). Это показало, что содержание TF в клетках островков и секреция TF ингибировались никотинамидом зависимым от дозы образом. Сходные эффекты получали с иммуносупрессорным лекарственным средством циклоспорином А (фиг.2), аминокислотой L-Arg (фиг.2), ингибитором превращающего ангиотензин фермента эналаприлом (фиг.2) и антиоксидантом ацетилцистеином (не показано).
Фиг.6-8 иллюстрируют действие никотинамида.
Островки культивировали в течение 48 часов в среде, содержащей 0, 10, 25 и 50 мМ никотинамид, и оценивали внутриклеточные концентрации TF, см. фиг.6. Островки подвергали также действию свежей АВО-совместимой крови человека в модели петли in vitro. Пробы отбирали спустя 5, 15, 30 и 60 минут и анализировали на ТАТ, см. фиг.7.
Островки культивировали в течение 48 часов в среде, содержащей эналаприл (40 мкг/мл), циклоспорин А (10 мкмоль/л), L-аргинин (1 ммоль/л), никотинамид (10 ммоль/л) и оценивали внутриклеточную концентрацию TF. Концентрация TF выражена в процентах относительно необработанного контроля, см. фиг.8.
Следует также отметить, что никотинамид имеет антиоксидантные свойства, что, как считают, является важным фактором в механизме, ответственном за его активность. Таким образом, ожидается, что другие соединения в этой группе веществ являются применимыми в соответствии с данным изобретением. Дополнительными примерами таких соединений, перечисление которых не является исчерпывающим, являются витамин Е, глутатион, ацетицистеин, дитиокарбамат пирролидина, пиритион, пентоксифиллин, гемоксигеназа-1/СО-билирубин, простагландин А1.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕДОТВРАЩЕНИЕ ОБРАЗОВАНИЯ И/ИЛИ СТАБИЛИЗАЦИИ ТРОМБОВ | 2005 |
|
RU2514878C2 |
| СПОСОБ МОДУЛИРОВАНИЯ ВАСКУЛЯРИЗАЦИИ | 2005 |
|
RU2378006C2 |
| СТАНДАРТНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ И СПОСОБЫ ЛЕЧЕНИЯ ТРОМБОЗА ПЕРОРАЛЬНЫМ ВВЕДЕНИЕМ ИНГИБИТОРА ФАКТОРА ХА | 2007 |
|
RU2452484C2 |
| НОВЫЕ АНТИТЕЛА К ТКАНЕВОМУ ФАКТОРУ В КАЧЕСТВЕ АНТИКОАГУЛЯНТОВ | 2003 |
|
RU2345789C2 |
| МОДИФИЦИРОВАННЫЙ ФАКТОР VII | 1995 |
|
RU2214833C2 |
| АНТИТЕЛА ПРОТИВ ИНГИБИТОРА МЕТАБОЛИЧЕСКОГО ПУТИ ТКАНЕВОГО ФАКТОРА | 2009 |
|
RU2562114C2 |
| GLA ДОМЕНЫ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2014 |
|
RU2705786C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПОЛИПЕПТИДЫ ФАКТОРА VII И ПОЛИПЕПТИДЫ PAI-1 | 2002 |
|
RU2304980C2 |
| Способ определения ингибиторного потенциала крови для прогнозирования неконтролируемой активации системы комплемента при Ковид-19 | 2023 |
|
RU2814496C1 |
| ПРИМЕНЕНИЕ FVIIa ИЛИ АНТАГОНИСТА ТКАНЕВОГО ФАКТОРА ДЛЯ РЕГУЛЯЦИИ ГЕННОЙ ЭКСПРЕССИИ И КЛЕТОЧНОЙ МИГРАЦИИ ИЛИ ХЕМОТАКСИСА | 2000 |
|
RU2268744C2 |





Предложено применение ингибитора тканевого фактора, TF, в приготовлении лекарственного средства для лечения или предупреждения отторжения трансплантата инсулинпродуцирующих клеток, для лечения или предупреждения немедленной опосредованной кровью воспалительной реакции (IBMIR), а также соответствующие способы лечения. Показано, что ингибиторы TF никотинамид, эналаприл, аргинин снижали синтез и секрецию TF, что TF является пусковым механизмом для IBMIR и что анти-TF и iFVIIa блокирует IBMIR, запускаемой островками Лангерганса человека. Ингибирование данной реакции перед клинической трансплантацией островков Лангерганса может обеспечить снижение потерь трансплантированной ткани при отсутствии вредного действия на гемостаз пациента. 4 н. и 9 з.п. ф-лы, 8 ил., 1 табл.
Приоритет по пунктам:
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Способ лечения сахарного диабета | 1976 |
|
SU1084011A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| реферат Entrez PubMed: Bennet W | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2008-01-27—Публикация
2003-02-21—Подача