Изобретение относится к экспериментальной онкологии и представляет собой новый способ лечения животных со злокачественными метастазирующими опухолями.
Общеизвестно, что клетки злокачественных опухолей отличаются от нормальных очень слабо выраженной дифференцировкой при наличии неограниченной способности к делению. В результате малигнизации в нормальных клетках нарушаются механизмы, регулирующие дифференцировку и клеточный цикл, что приводит к их неконтролируемой пролиферации и отмене апоптоза.
Несмотря на значительные успехи в клинической онкологии поиск новых подходов к терапии злокачественных новообразований остается очень актуальной медико-биологической проблемой.
Обнаружение в 50-е годы токсичности экзогенных рибонуклеаз (РНКаз) по отношению к раковым клеткам послужило толчком к изучению этих ферментов в качестве противоопухолевых препаратов.
Известен способ ингибирования роста опухолевых клеток in vitro с использованием фермента онконазы, получаемого из Rana japonica и Rana pipiens, имеющего очень высокий процент гомологии с РНКазой А и обладающего рибонуклеазной активностью. Онконаза в концентрации 10-100 мкг/мл культуральной среды ингибирует рост опухолевых клеток (Matousek J., Ribonucleases and their antitumor activity. Comp Biochem Physiol С Toxicol PharmacoL, 2001, Vol.129, n.3, p.175-91).
Известен способ ингибирования роста лимфомы Беркета и В-клеточной неходжкинской лимфомы у мышей с помощью внутримышечных инъекций конъюгатов онконазы с моноклональными антителами LL2 в дозе 5 мг на кг веса животного или с моноклональными антителами CD22 в дозе 25 мг/кг соответственно, позволяющий удлинить продолжительность жизни животных в два раза (Newton D.L. et al., Potent and specific antitumor effects of an anti-CD22-targeted cytotoxic ribonuclease: potential for the treatment of non-Hodgkin lymphoma. Blood, 2001, Vol.97, n.2, p.528-535).
Недостатками известного способа являются высокие терапевтические дозы фермента и побочные эффекты при лечении онконазой, такие как протеинурия и отек почек.
Известен способ ингибирования спонтанного роста лимфолейкоза у мышей линии АКР путем использования ДНКазы в концентрации 250 мг/кг каждые 48 часов в течение 4-13 недель. (Salganik R.I. et al., Effect of deoxyribonuclease on the course of lymphatic leukaemia in AKR mice. Nature, 1967, Vol.214, p.100-102.) Способ обеспечивает существенное уменьшение и нормализацию размеров лимфатических узлов и увеличение продолжительности жизни животных, однако характеризуется использованием высоких терапевтических доз фермента и побочными осложнениями.
Ближайшим к заявляемому способу - прототипом - является способ лечения злокачественных опухолей у животных с использованием фермента BS-РНКазы (Soucek J. et al., Antitumor action of bovine seminal ribonuclease. Neoplasma. 1996, Vol.43, n.5, p.335-40.). Противоопухолевый эффект BS-РНКазы т vivo исследовали с использованием карциномы простаты человека, трансплантированной мышам линии nude. Осуществляли ежедневные подкожные инъекции раствора BS-РНКазы в концентрации 12,5 мг/кг в течение трех недель (15 доз). Подкожное введение препарата приводило к существенному уменьшению размера опухолей у животных, однако было показано, что BS-РНКаза оказывает сильный токсический эффект: приводит к деградации тестикулярной ткани у самцов и влияет на эмбриогенные ткани и созревание ооцитов у самок, обладает иммуносупрессивным действием. Поэтому очевидным недостатком способа лечения злокачественных опухолей с использованием BS-РНКазы является высокая токсичность фермента.
Технической задачей предлагаемого изобретения является разработка способа лечения злокачественных опухолей у животных с использованием природного фермента панкреатической рибонуклеазы (РНКазы А) в тысячекратно сниженных дозах, который при высокой эффективности позволяет также исключить возникновение побочных действий лечебного препарата.
Дополнительной технической задачей является расширение ассортимента противоопухолевых средств природного происхождения.
Поставленная техническая задача достигается предлагаемым способом, заключающимся в том, что больному животному внутримышечно вводят раствор РНКазы А в концентрации (3,5-7,0)·10-4 мг/кг веса животного ежедневно, курсом 8-10 дней. В качестве растворителя (наполнителя) РНКазы А используют изотонический раствор хлорида натрия.
РНКазы являются важнейшими природными ферментами метаболизма рибонуклеиновых кислот. РНКазы представляют собой ферменты класса гидролаз, которые катализируют расщепление фосфодиэфирных связей в РНК. Источником РНКазы А является поджелудочная железа крупного рогатого скота. РНКаза А имеет мол. вес 13680, полипептидная цепь этого фермента состоит из 124 аминокислотных остатков и содержит 4 дисульфидных мостика, стабилизирующих ее пространственную конфигурацию. РНКаза А специфически расщепляет РНК по сайтам 5'-Pyr↓А-3'. В каталитический центр фермента РНКазы А входят следующие остатки аминокислот - His12, His119, Lys41, Gin11, в субстрат-связывающий - Thr45, Phe120, Ser123.
РНКазу А получают одним из известных способов, например способом, описанным в патенте РФ № 2180918, опубл. 27.03.2002.
Определяющим отличием предлагаемого способа от прототипа является использование в качестве противоопухолевого препарата природного фермента животного происхождения - панкреатической рибонуклеазы (РНКазы А) в экспериментально подобранном оптимальном режиме, что позволяет повысить эффективность лечения, существенно снизить дозу препарата и исключить побочные осложнения. Ежедневное внутримышечное введение низких доз РНКазы А повышает эффективность лечения в результате постепенного всасывания фермента и поддержания его концентрации на относительно постоянном уровне.
Основные биологические функции РНКаз заключаются в расщеплении мРНК, превращении предшественников РНК в зрелые формы, продукции малых регуляторных РНК, деградации определенных типов РНК. В последние годы пристальное внимание уделяется функциям РНКаз, связанным с регуляцией экспрессии генов, роста и дифференцировки клеток, защитой от патогенов, индукцией апоптоза.
Проведенные исследования показали, что противоопухолевый эффект РНКазы А связан с прямым повреждением структуры и выключением функций нуклеиновых кислот опухолевых клеток. РНКаза А вызывает угнетение роста опухоли, а также деструкцию опухолевых клеток в очагах метастазирования при одновременном отсутствии побочного токсического воздействия на организм животного.
Механизм клеточной гибели, опосредованный РНКазой, состоит из двух основных этапов: проникновение внутрь клетки и разрушение клеточной РНК. Взаимодействие положительно заряженных молекул РНКазы с опухолевыми клетками обеспечивается усиленным отрицательным зарядом опухолей за счет анионного фосфатидилсерина, экспонирующегося на поверхности кровеносных сосудов в опухолях (Ran S., et al., Increased exposure of anionic phospholipids on the surface of tumor blood vessels. Cancer Res., 2002, Vol.62, p.6132-6140). Вслед за связыванием с клеточной мембраной происходит проникновение молекул РНКазы в раковую клетку посредством эндоцитоза (Haigis M.С., Raines R.Т., Secretory ribonucleases are internalized by a dynamin-independent endocytic pathway. J Cell Sci., 2003, Vol.116, n.2, p.313-24). Затем РНКаза высвобождается в цитозоль и вызывает деградацию клеточной РНК. Однако существуют данные, что на этапе выхода в цитозоль природная РНКаза А инактивируется рибонуклеазным ингибитором.
Результаты исследований показали, что природная РНКаза А, будучи в немодифицированном состоянии, способна проявлять противоопухолевый эффект даже при низких дозах. Возможно, проникновение высоких доз РНКазы А в цитозоль может запустить синтез рибонуклеазного ингибитора через активацию механизма обратной связи. Можно предположить, что существует критическая концентрация РНКазы А, при которой активации синтеза рибонуклеазного ингибитора еще не происходит и некоторое количество молекул РНКазы А остаются свободными и активными.
В последние годы появились данные, которые утверждают, что в крови людей, больных раковыми заболеваниями, резко возрастает концентрация свободных внеклеточных нуклеиновых кислот, которые предположительно регулируют процессы опухолевого роста и метастазирования (Laktionov P.P. et al., Cell-surface-bound nucleic acids: Free and cell-surface-bound nucleic acids in blood of healthy donors and breast cancer patients. Ann N Y Acad Sci., 2004, Vol.1022, p.221-7). Таким образом, вероятным альтернативным механизмом действия РНКазы может быть разрушение внеклеточных нуклеиновых кислот и, следовательно, разрыв пути передачи сигнала.
Нижеследующие примеры иллюстрируют влияние ингибирующего эффекта РНКазы А на рост и процессы метастазирования карциномы легких Льюиса и гепатомы А-1 у мышей
Пример 1
Карцинома Льюиса была трансплантирована подкожно в левую лапу мышам линии С57В1 возрастом 10-11 недель. Начиная с 10-ого дня после прививания мышам карциномы легких Льюиса больным животным проводили ежедневные внутримышечные инъекции физиологического раствора РНКазы A (Sigma) в концентрации 3,5·10-4 мг/кг веса животного, курсом 8 дней.
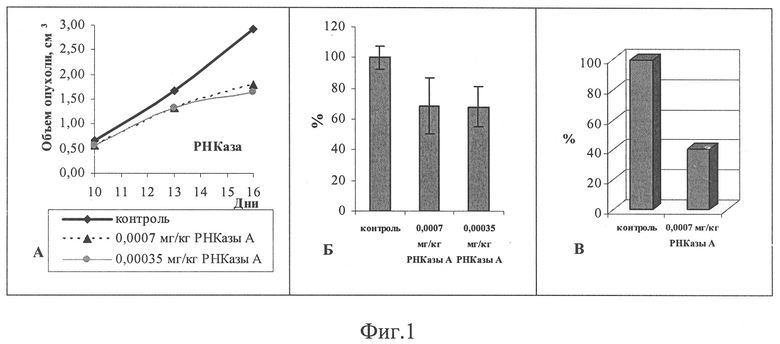
На фиг.1 (А) представлены результаты измерений объемов опухолей в контрольной группе и в группе животных, получавших инъекции раствора РНКазы А. Как видно из фиг.1А, в начальный период лечения скорость роста опухолей между группами различалась слабо. Однако к 16-му дню после трансплантации карциномы Льюиса наблюдали существенную (до 44%) регрессию объема опухолей в опытной группе, Р<0,05.
На 20-ый день после трансплантации опухоли мыши были препарированы, опухоли изъяты и взвешены. Степень регрессии опухолей приведены на фиг.1(Б). Из фиг.1(Б) видно, что лечение РНКазой А при концентрации 3,5·10-4 мг/кг веса животного приводит к существенному (31%) снижению веса опухолей.
Пример 2
Карцинома Льюиса была трансплантирована подкожно в левую лапу мышам линии С57В1 возрастом 10-11 недель. Начиная с 8-го дня после прививания мышам карциномы легких Льюиса больным животным проводили ежедневные внутримышечные инъекции физиологического раствора РНКазы А (Sigma) в концентрации 7·10-4 мг/кг веса животного длительностью 10 дней.
Как видно из фиг.1 (А, Б) РНКаза А в концентрации 7·10-4 мг/кг веса животного способствует достоверному снижению темпа роста опухолей у мышей.
После окончания эксперимента легкие были изъяты, зафиксированы в 4% растворе формалина на среде DMEM. Для оценки воздействия РНКазы А на процессы метастазирования в легких экспериментальных животных было также проведено патоморфологическое исследование с помощью гематоксилин/эозинового окрашивания парафиновых срезов респираторных органов в контрольной и опытной группе.
При сравнении группы контрольных животных и группы животных, получавших лечение РНКазы А, в последней были выявлены признаки индуцированного (лекарственного) патоморфоза метастазов, проявляющееся в выраженных дистрофических изменениях онкоцитов (изменение тинкториальных свойств цитоплазмы, кариорексис) и усилении мононуклеарной инфильтрации, включающей нейтрофилы, лимфоциты и макрофаги. В исследуемых группах было проведено измерение площади среза доли легкого и площади метастазов на данной срезе, высчитывался процент площади метастазов по отношению к площади измеряемой доли легкого. Площадь, занимаемая метастазами в доле легкого, представлена на фиг.1 (В). В группе животных, получавших инъекции РНКазы А в концентрации 7·10-4 мг/кг веса животного, процент торможения роста метастазов составил 59%.
Пример 3
Гепатома А-1 была трансплантирована подкожно (внутримышечно) в левую лапу мышам линии A/Sn возрастом 14-16 недель. Начиная с 5-ого дня после прививания мышам гепатомы А-1 больным животным проводили ежедневные внутримышечные инъекции раствора РНКазы А (Sigma) в концентрации 3.5·10-4 мг/кг веса животного, курсом 10 дней.
На 20-й день после трансплантации опухоли мыши были препарированы, опухоли изъяты и взвешены. Степень регрессии опухолей приведены на фиг.2 (А). Из фиг.2 (А) видно, что лечение РНКазой А при концентрации 3,5·10-4 мг/кг веса животного приводит к 27% снижению веса опухолей.
После окончания эксперимента печень была изъята, взвешена и зафиксирована в 4% растворе формалина на среде DMEM. Печеночный индекс определяли: вес печени/вес животного · 100%. В группе животных, получавших лечение, наблюдали снижение повышенного в результате болезни печеночного индекса на 38,5% относительно контрольной группы.
Для оценки воздействия РНКазы А на процессы метастазирования в печени экспериментальных животных было также проведено патоморфологическое исследование с помощью гематоксилин/эозинового окрашивания парафиновых срезов печеночной доли в контрольной и опытной группе. В опытной группе отмечено уменьшение количества метастазов, в их структуре наблюдали вторичные изменения, выраженные в появлении периферических или чаще всего центральных очагов некрозов. В исследуемых группах было проведено измерение площади среза печеночной доли и площади метастазов на данном срезе и определен процент площади метастазов по отношению к площади измеряемой печеночной доли. В группе, получавшей лечение, отмечено сокращение площади метастазов в печени, отсутствие метастазов в миокарде и почке, наличие которых наблюдали в контрольной группе. Площадь, занимаемая метастазами в печеночной доле, представлена на фиг.2 (Б). Процент торможения роста метастазов у животных, получавших лечение, составил 91.6%.
В целом выявленные структурные изменения метастазов в группе животных, получавших лечение, свидетельствуют о воздействии РНКазы А непосредственно на опухолевые клетки. При этом не выявлено выраженного воздействия на прилегающие участки тканей.
Таким образом, предлагаемый способ обеспечивает эффективное лечение злокачественных опухолей у животных с использованием низких, абсолютно безопасных для организма концентраций природного фермента РНКазы А.
Использование предлагаемого способа позволит, по сравнению с прототипом:
- снизить дозу используемого препарата в (1,5-18,0)·103 раз;
- исключить побочные осложнения;
- расширить функциональные возможности способа, т.к. способ обеспечивает не только ингибирование роста злокачественных опухолей, но и препятствует их метастазированию;
- расширить ассортимент противоопухолевых лекарственных средств природного происхождения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО НА ОСНОВЕ ПОЛИСАХАРИДОВ АИРА БОЛОТНОГО, ПОВЫШАЮЩЕЕ ПРОТИВООПУХОЛЕВУЮ И ПРОТИВОМЕТАСТАТИЧЕСКУЮ АКТИВНОСТЬ ЦИТОСТАТИЧЕСКИХ ПРЕПАРАТОВ | 2005 |
|
RU2308285C2 |
| СПОСОБ ПОВЫШЕНИЯ ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТИ ЦИКЛОФОСФАНА В ЭКСПЕРИМЕНТЕ | 2004 |
|
RU2270682C2 |
| СРЕДСТВА, ПОВЫШАЮЩИЕ ПРОТИВООПУХОЛЕВУЮ И АНТИМЕТАСТАТИЧЕСКУЮ АКТИВНОСТЬ ЦИТОСТАТИЧЕСКИХ ПРЕПАРАТОВ | 2011 |
|
RU2471496C1 |
| СРЕДСТВО, ПОВЫШАЮЩЕЕ ПРОТИВООПУХОЛЕВУЮ И АНТИМЕТАСТАТИЧЕСКУЮ АКТИВНОСТЬ ЦИКЛОФОСФАНА | 2002 |
|
RU2225720C1 |
| ИНГИБИТОР АНГИОГЕНЕЗА, АНТИАНГИОГЕННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2005 |
|
RU2287341C1 |
| КОРРЕКТОР ПАРАНЕОПЛАСТИЧЕСКИХ ПОВРЕЖДЕНИЙ И ТОКСИЧЕСКИХ ЭФФЕКТОВ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2008 |
|
RU2385324C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2006 |
|
RU2320364C1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ЦИТОТОКСИЧЕСКИХ ЭФФЕКТОВ ПАРАНЕОПЛАСТИЧЕСКИХ ПРОЦЕССОВ И ХИМИОТЕРАПИИ, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2447888C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТЬЮ, ПОВЫШАЮЩЕЕ ПРОТИВОМЕТАСТАТИЧЕСКОЕ ДЕЙСТВИЕ ЦИКЛОФОСФАНА | 2015 |
|
RU2578457C1 |
| N-[3-ОКСО-ЛУПАНО-28-ИЛ]-ПИПЕРИДИН-СРЕДСТВО С ПРОТИВООПУХОЛЕВОЙ, АНТИМЕТАСТАТИЧЕСКОЙ, ПРОТИВОВОСПАЛИТЕЛЬНОЙ И ЦИТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2466136C1 |

Изобретение относится к экспериментальной онкологии. Способ включает введение рибонуклеазы. При этом в качестве рибонуклеазы используют панкреатическую РНКазу А в концентрации (3,5-7,0)·10-4 мг/кг массы животного. Панкреатическую РНКазу А вводят внутримышечно ежедневно, курсом 8-10 инъекций. Способ позволяет повысить эффективность лечения, существенно снизить дозу рибонуклеазы и исключить побочные осложнения. 2 ил.
Способ лечения злокачественных опухолей у животных путем введения рибонуклеазы, отличающийся тем, что в качестве рибонуклеазы используют панкреатическую РНКазу А в концентрации (3,5-7,0)10-4 мг/кг массы животного, при этом введение последней осуществляют внутримышечно, ежедневно, курсом 8-10 инъекций.
| SOUSEK J | |||
| et al | |||
| Antitumor action of bovine seminal ribonuclease | |||
| Neoplasma | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПАНКРЕАТИЧЕСКОЙ РИБОНУКЛЕАЗЫ | 2000 |
|
RU2180918C1 |
| MATOUSEK J | |||
| Ribonucleases and their antitumor activity | |||
| Comp | |||
| Biochem | |||
| Physiol | |||
| & Toxicol | |||
| Pharmacol | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Newton D.L | |||
| et al | |||
| Potent | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
Авторы
Даты
2008-02-27—Публикация
2006-07-13—Подача