Изобретение относится к способам определения различных термодинамических констант неорганических и органических веществ, в частности определения констант равновесия химических реакций (Кравн) (произведений растворимости малорастворимых веществ (ПР) и констант устойчивости растворимых комплексных соединений (β)), которые применяются в теоретической и практической областях химии.
Известными способами являются:
Метод линеаризации кривой титрования (аналог) [Б.М.Марьянов Математические вопросы исследования химических равновесий./Под ред. Э.С.Щербакова и др. - Томск: Изд-во ТГУ. 1978. С.131-229] [1].
Экспериментально-расчетный метод, позволяющий использовать в инструментальной титриметрии реакции, выход которых не достигает 100%. Наряду с точкой стехиометричности (т.с.), метод позволяет оценивать константу равновесия аналитической реакции, т.е. ПР, ионное произведение (ИП), константу устойчивости, константу ионизации продуктов реакции. Кривые титрования приводят к линейному виду с помощью специальных переменных, функциональный вид которых зависит от способа индикации т.е.
Линеаризация кривой титрования возможна при условии, что ионная сила раствора в процессе титрования сохраняется неизменной.
Помимо ионной силы при комплексонометрическом титровании необходимо поддерживать на постоянном уровне рН раствора.
Способ определения произведений растворимости и ионных произведений малорастворимых солей и комплексных соединений (аналог) [Чеботарев В.К., Щербакова Л.В., Краев Ю.К., Мосунова А.Е. Способ определения произведений растворимости и ионных произведений малорастворимых солей и комплексных соединений. Патент РФ №2240555//20.11.2004. Бюл. №32] [2] - экспериментально-расчетный способ с использованием предельной степени протекания реакции, которая достигается путем синхронного уменьшения концентрации титранта и определяемого компонента. При исчезновении скачка потенциала рассчитывают молярную концентрацию компонента, образующего малорастворимое соединение в точке стехиометричности, далее равновесную концентрацию определяемого вещества и растворимость малорастворимого соединения, а затем произведение растворимости или ионное произведение.
К недостаткам аналога относится длительная стадия проведения эксперимента и невозможность определения констант равновесия (Кравн) для растворимых соединений и малорастворимых соединений при рПР>8,00 (при такой величине рПР степень протекания реакции меньше предельной).
Прямая потенциометрия и потенциометрическое титрование в присутствии "посредника" (прототип) [В.В.Величко, В.И.Супрунович, Ю.И.Усатенко. О прочности тиооксиналятов некоторых металлов.//Ж. неорганической химии. 1974. Т.19. №4. С.1004-1008] [3]. В данном случае при титровании смеси "посредник" - Men+ (посредником служит ион одноименный с материалом индикаторного электрода) на потенциометрических кривых фиксируются два скачка. Первый из них соответствует полному связыванию "посредника", второй - Men+. Участок кривой между первым и вторым скачками, характеризующий частичное связывание иона металла в виде малорастворимого осадка или растворимого комплексного соединения, использовали для расчета его ИП или β. Для различных точек этого участка по уравнению Нернста находят равновесную концентрацию ионов "посредника", далее из выражения - ионное произведение = ["посредник"]·[лиганд] рассчитывают равновесную концентрацию лиганда, определяют концентрацию не связанного (свободного) металла при заданной концентрации лиганда и вычисляют ИП или β определяемого компонента. Основным недостатком данного способа является невозможность титрования с двумя скачками иона - «посредника» в смеси с определяемым компонентом.
Общими признаками прототипа и заявляемого способа определения констант равновесия является использование потенциометрического титрования.
Сущность изобретения заключается в том, что способ определения констант равновесия реакций малорастворимых солей и растворимых комплексных соединений, включающий индивидуальное потенциометрическое титрование, отличающийся тем, что в процессе титрования добавляют воду и достигают предельной степени протекания реакции путем изменения коэффициента разбавления при постоянной концентрации титранта до исчезновения скачка потенциала, рассчитывают коэффициент разбавления (f), предельную степень протекания реакции (СПпред), далее молярную растворимость малорастворимого соединения (S) (или молярную концентрацию определяемого компонента (Ст.с) в точке стехиометричности), а затем константу равновесия образующегося соединения (Кравн) учитывая стехиометрические коэффициенты.
Осуществляется предлагаемый способ определения констант равновесия реакций малорастворимых солей и комплексных соединений путем применения индивидуальных потенциометрических титрований с использованием предельной степени протекания реакции (СПпред) [3] и коэффициента разбавления (f).
Коэффициент разбавления (f) показывает во сколько раз объем титруемого раствора в т.с. больше начального объема определяемого вещества, и рассчитывается по уравнению 1:
где
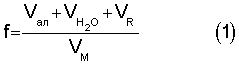
 - соответственно, объемы раствора соли металла, добавленной воды и титранта, a VM - начальный объем определяемого вещества. Степень протекания индивидуальной реакции напрямую зависит от коэффициента разбавления (f), который в свою очередь оказывает влияние на величину скачка потенциала и погрешность определения Кравн.
- соответственно, объемы раствора соли металла, добавленной воды и титранта, a VM - начальный объем определяемого вещества. Степень протекания индивидуальной реакции напрямую зависит от коэффициента разбавления (f), который в свою очередь оказывает влияние на величину скачка потенциала и погрешность определения Кравн.
Взаимосвязь коэффициента разбавления и предельной степени протекания реакции выражается следующими уравнениями [Chebotarev V.K., Kraev Y.K., Voronkina I.V. and others Prognostication criterion of potential and practical use of analytical reagents in titrimetria of individual substances // Talanta. 1998. №47. P.1043-1051] [4]:
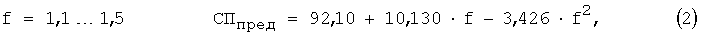
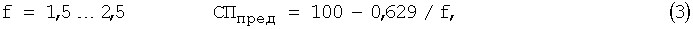
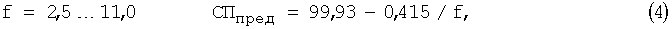
где СПпред - предельная степень протекания реакции; f - коэффициент разбавления.
С увеличением коэффициента разбавления повышается и предельная степень протекания реакции. Экспериментально доказано, что при коэффициенте разбавления (f от 2,5 до 11,0) предельная степень протекания реакции (СПпред) изменяется от 99,72 до 99,90%. Реализация предлагаемого способа расчета констант равновесия (Кравн) (произведение растворимости (ПР), константа ионизации (ИП), константа устойчивости (β), константа нестойкости (К')) может быть представлена в виде определенной модели:
1. Принимают концентрацию растворов реагента и иона металла 0,1000 моль/л, Vx=VR=10,00 мл, градиент приливания вблизи т.с. 0,10 мл. Условия титрования стандартные: р=1 атм; t=(25±0,1)°С.
2. Проводят расчет кривых потенциометрического титрования соединений с известными величинами констант равновесия по уравнению Нернста, на примере реакций осаждения:
Br-+Ag+→AgBr↓ (ПР=5,3·10-13)
SCN-+Ag+→AgSCN↓ (ПР=1,1·10-12).
В зависимости от величины скачка потенциала симбатно уменьшают концентрации реагента и иона металла до концентрации, при которой скачок еще фиксируется.
3. Концентрация реагента остается постоянной, а концентрация иона металла изменяется за счет разбавления его раствора до исчезновения скачка потенциала, что соответствует предельной степени протекания реакции.
Коэффициент разбавления (f) вычисляют по уравнению 1:
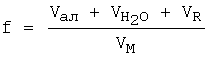
4. Проводят расчет константы равновесия по схеме:
а) находят концентрацию иона металла с учетом f по уравнению:

б) рассчитывают СПпред по одному из уравнений 2, 3, 4;
в) рассчитывают молярную растворимость (или равновесную концентрацию (моль/л)) в т.с. по уравнению:
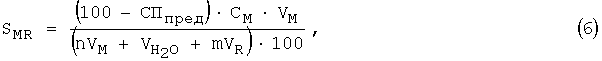
учитывая стехиометрические коэффициенты m и n;
г) проводят расчет константы равновесия:
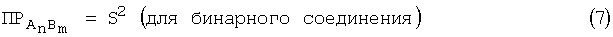
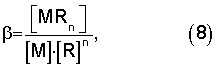
где ПР - произведение растворимости;
S - растворимость малорастворимого соединения, моль/л;
β - константа устойчивости комплексного соединения;
[MRn] - молярная концентрация не диссоцировавших комплексных ионов, моль/л;
[М] - молярная концентрация иона комплексообразователя, моль/л;
[R] - молярная концентрация иона лиганда, моль/л;
m и n- стехиометрические коэффициенты.
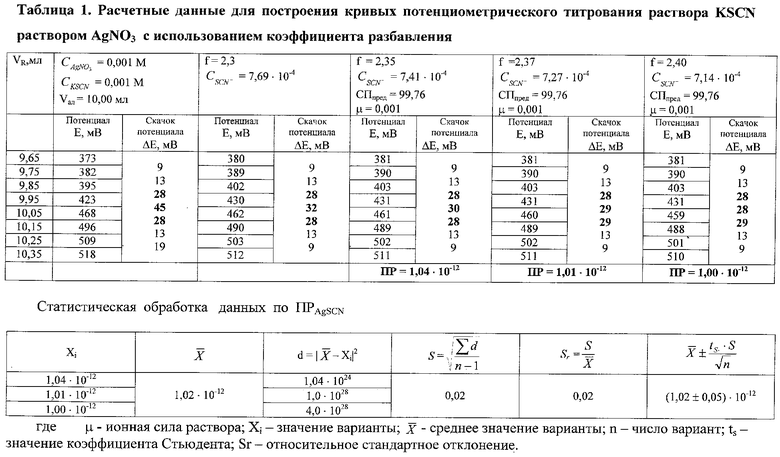
Для реакций осаждения на примере тиоционата серебра AgSCN (п.2 теоретической схемы расчета) по рассчитанным кривым титрования, степеням протекания реакции, представленным в таблице 1, проведен расчет f, Sт.с и ПР (1,02±0,05)·10-12). Данные таблицы свидетельствуют о том, что рассчитанное значение ПРAgSCN близко к справочным величинам 1,1·10-12 [Лурье Ю.Ю. Справочник по аналитической химии. 5-е изд., перераб. и доп. - М.: Химия. 1979. - С.96-97] [5]; (1,16÷1,57)·10-12 [Справочник химика./Под редакцией Никольского. 2-е изд. Т. III. М.: Химия, 1964. 10008 с.] [6]; 1,0·10-12 [Лазарев А.И., Харламов И.П., Яковлев Г.Я., Яковлева Е.Ф. Справочник химика аналитика. - М.: Металлургия, 1976. - 138 с.] [7].
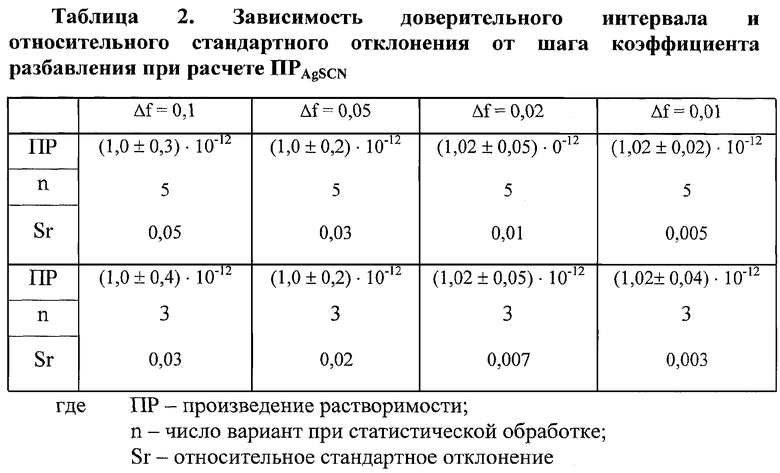
Манипулируя шагом коэффициента разбавления добиваются того, что рассчитанные значения ПР отличаются между собой в десятых и даже сотых долях коэффициента перед степенным сомножителем в значении Кравн (табл.2).
Показано, что, если шаг коэффициента разбавления (Δf) равен 0,1-0,05 определение ведется с изменением доверительного интервала во второй значащей цифре (например, ПРAgSCN=(1,0±0,n)·10-12). При Δf c шагом <0,05 - в третьей значащей цифре (например, ПРAgSCN=(1,02±0,0, n)·10-12). Это позволяет определить значение Кравн с меньшей погрешностью. Анализ результатов таблиц 1 и 2 позволяет сделать вывод, что статистическую обработку проводят по трем или по пяти значениям Кравн.
Согласно теоретической схеме расчета Кравн устанавливают шаг коэффициента разбавления (f) и возможную погрешность определения Кравн, рассчитаны пороговые молярные концентрации иона металла и реагента, а также оценивают правильность предлагаемого способа определения констант равновесия реакций малорастворимых солей и растворимых комплексных соединений путем сравнения рассчитанных Кравн с табличными данными [5], [6], [7]. Предлагаемый способ определения констант равновесия реакций малорастворимых солей и комплексных соединений апробируют на примере потенциометрического титрования указанных выше систем: бромид - и тиоцианат-ионов азотнокислым серебром, а также на примере взаимодействия некоторых сульфидобразующий ионов металлов и дитиопирилметана, образующих растворимые комплексы. Для фиксации т.с. используют метод потенциометрического титрования как наиболее удобный по техническому исполнению. При этом применяют установку для титрования рН-метрмилливольтметр. Индикаторным электродом служит электрод из серебра в паре с насыщенным хлорсеребряным электродом сравнения. Перемешивание анализируемого раствора осуществляют электромагнитной мешалкой из комплекта прибора.
Титрование проводят при постоянной концентрации реагента. Концентрация же определяемого вещества изменяется за счет разбавления его раствора (изменяя коэффициент разбавления) до исчезновения скачка потенциала, что соответствует предельной степени протекания реакции. Далее выполняют расчет коэффициента разбавления (f) до предельной степени протекания реакции (Спред) до молярной растворимости малорастворимого соединения (S) (или молярной концентрации определяемого компонента в точке стехиометричности (Ст.с) для растворимых соединений) до константы равновесия образующегося соединения (Кравн). Титрование проводят в стандартных условиях: р=1 атм; t=(25,0±0,1)°С. Постоянную ионную силу раствора поддерживают 0,1 М KNO3 в случае титрования бромид- и тиоцианат-ионов азотнокислым серебром и 10М раствором серной кислоты в случае титрования сульфидобразующих ионов металлов дитиопирилметаном.
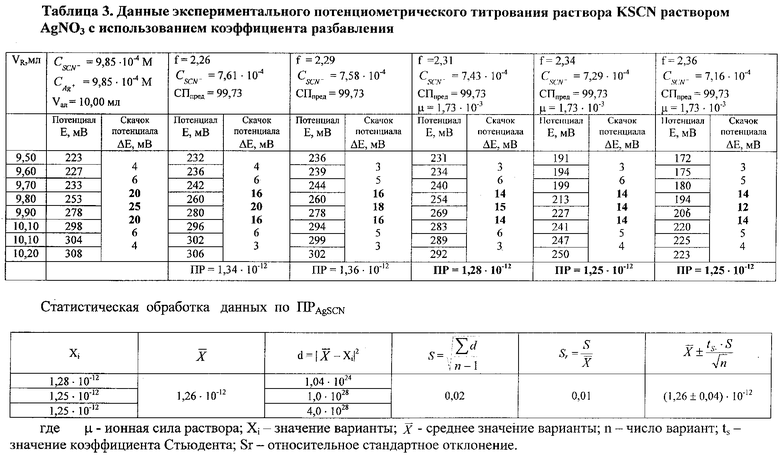
Рассмотрим пример расчета ПР тиоционата серебра по данным экспериментального потенциометрического титрования (табл.3).
1. Рассчитывают f по уравнению 1:
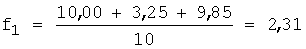
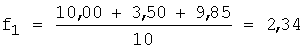
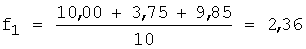
2. Вычисляют концентрацию определяемого компонента с учетом разбавления по уравнению 5:
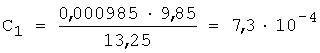
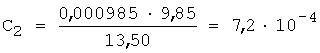
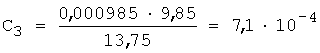
3. Рассчитывают СПпред по уравнению 3, так f=1,5...2,5
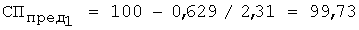
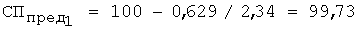
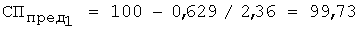
4. По предельной степени протекания реакции выполняют расчет растворимости роданида серебра по уравнению 6:

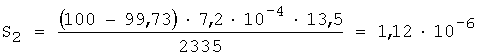
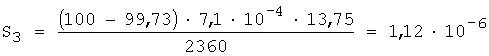
5.Вычисляют ПР:
ПРAgSCN=S2
ПР1=(1,13·10-6)2=1,28·10-12
ПР2=(1,12·10-6)2=1,25·10-12
ПР3=(1,12·10-6)2=1,25·10-12.
После статистической обработки получают следующий результат: ПРAgSCN=(1,26±0,04)·10-12 (табл.3).
Данные таблицы свидетельствуют о том, что рассчитанные на основе экспериментальных данных значения ПРAgSCN в области исчезновения скачка потенциала близки и сравнимы со справочной величиной - экспериментально найденная величина ПРAgSCN=(1,26±0,04)·10-12; справочные величины ПРAgSCN=1,1·10-12 [5]; (1,16÷1,57)·10-12 [6]; 1,0·10-12 [7].
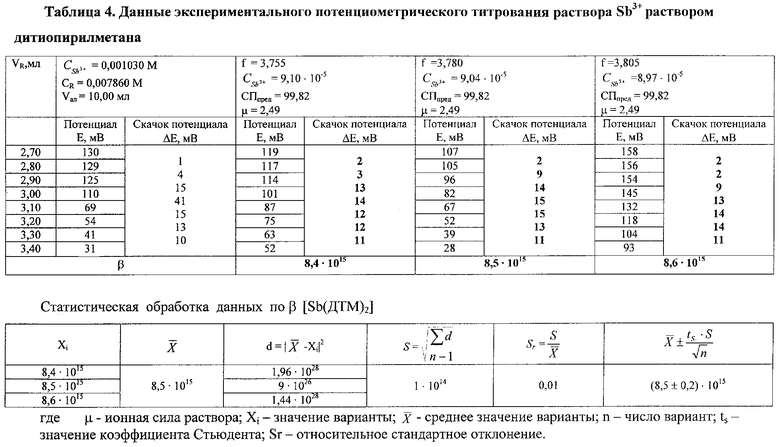
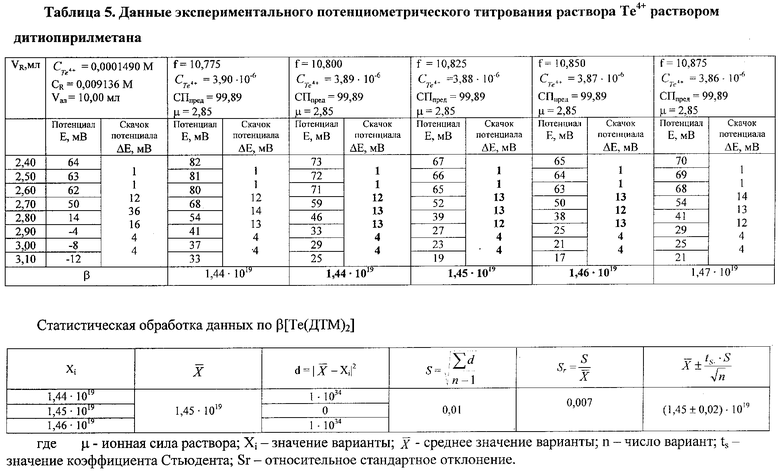
Аналогичным образом проводят расчет константы устойчивости комплексных соединений. В качестве примера представлены рассчитанные по экспериментальным данным, β растворимых комплексов дитиопирилметаната сурьмы и теллура, которые приведены в табл.4 и 5.
Данные таблиц свидетельствуют, что при концентрации раствора дитиопирилметана, равной 7,86·10-3 моль/л, концентрации раствора соли сурьмы и теллура равны соответственно 9,10·10-5 моль/л и 3,89·10-6 моль/л скачок потенциала размазывается, т.е. его невозможно зафиксировать.
Расчет константы устойчивости рассматривают на примере комплекса Sb(ДТМ)2:
1) рассчитывают коэффициент разбавления по уравнению 1:
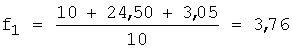
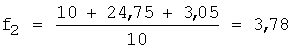
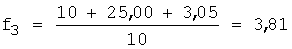
2) вычисляют концентрации (моль/л) иона металла с учетом разбавления по уравнению 5:
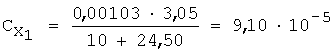
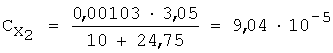
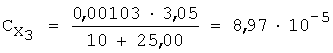
3) рассчитывают СПпред (%) с учетом коэффициента разбавления по уравнению 4:
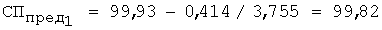
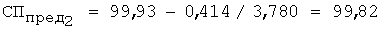
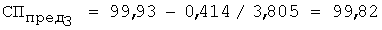
4) равновесную концентрацию (моль/л) устанавливают по уравнению
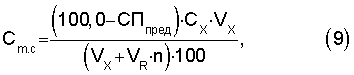
где СПпред - предельная степень протекания реакции, %;
СХ - молярная концентрация определяемого компонента с учетом разбавления, моль/л;
VХ - объем определяемого компонента, мл;
VR - объем титранта, пошедший на титрование, мл;
n - стехиометрический коэффициент.
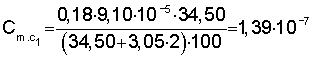
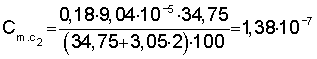
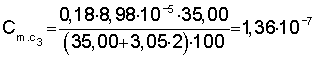
5) константу устойчивости комплекса рассчитывают по уравнению:




После статистической обработки получают следующие результаты: β[Sb(ДТМ)2]=(8,5±0,2)·1015; β[Те(ДТМ)2]=(1,45±0,02)·1019.
Таким образом, предлагаемый новый способ определения констант равновесия реакций малорастворимых солей и растворимых комплексных соединений, отличается сокращением оперативного времени при определении произведений растворимости и констант устойчивости; возможностью регулирования погрешности определения констант равновесия, за счет варьирования шага коэффициента разбавления; возможность определения констант равновесия растворимых комплексных соединений; простотой и экспрессностью.
Изобретение относится к способам определения различных термодинамических констант неорганических и органических веществ в теоретической и практической областях химии. Способ включает индивидуальное потенциометрическое титрование, в процессе которого добавляют воду и достигают предельной степени протекания реакции путем изменения коэффициента разбавления при постоянной концентрации титранта до исчезновения скачка потенциала, рассчитывают коэффициент разбавления по формуле 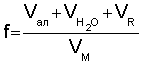 , где Vал,
, где Vал, 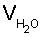 и VR - соответственно, объемы раствора соли металла, добавленной воды и титранта, a VM - начальный объем определяемого вещества, вычисляют концентрацию определяемого компонента с учетом разбавления, определяют предельную степень протекания реакции с учетом коэффициента разбавления, на основании которой рассчитывают молярную растворимость малорастворимой соли или равновесную концентрацию растворимого комплексного соединения в точке стехеометричности, после чего определяют константу равновесия с учетом стехеометрических коэффициентов. Достигается ускорение и повышение информативности определения. 5 табл.
и VR - соответственно, объемы раствора соли металла, добавленной воды и титранта, a VM - начальный объем определяемого вещества, вычисляют концентрацию определяемого компонента с учетом разбавления, определяют предельную степень протекания реакции с учетом коэффициента разбавления, на основании которой рассчитывают молярную растворимость малорастворимой соли или равновесную концентрацию растворимого комплексного соединения в точке стехеометричности, после чего определяют константу равновесия с учетом стехеометрических коэффициентов. Достигается ускорение и повышение информативности определения. 5 табл.
Способ определения констант равновесия реакций малорастворимых солей и растворимых комплексных соединений, включающий индивидуальное потенциометрическое титрование, отличающийся тем, что в процессе титрования добавляют воду и достигают предельной степени протекания реакции путем изменения коэффициента разбавления при постоянной концентрации титранта до исчезновения скачка потенциала, рассчитывают коэффициент разбавления по формуле
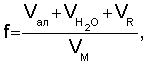
где Vал, 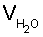 и VR - соответственно, объемы раствора соли металла, добавленной воды и титранта, а VM - начальный объем определяемого вещества, вычисляют концентрацию определяемого компонента с учетом разбавления, определяют предельную степень протекания реакции с учетом коэффициента разбавления, на основании которой рассчитывают молярную растворимость малорастворимой соли или равновесную концентрацию растворимого комплексного соединения в точке стехеометричности, после чего определяют константу равновесия с учетом стехеометрических коэффициентов.
и VR - соответственно, объемы раствора соли металла, добавленной воды и титранта, а VM - начальный объем определяемого вещества, вычисляют концентрацию определяемого компонента с учетом разбавления, определяют предельную степень протекания реакции с учетом коэффициента разбавления, на основании которой рассчитывают молярную растворимость малорастворимой соли или равновесную концентрацию растворимого комплексного соединения в точке стехеометричности, после чего определяют константу равновесия с учетом стехеометрических коэффициентов.
| ВЕЛИЧКО В.В, СУПРУНОВИЧ В.И., УСАТЕНКО Ю.И | |||
| - Журнал неорганической химии | |||
| ПРИБОР ДЛЯ ЗАПИСИ И ВОСПРОИЗВЕДЕНИЯ ЗВУКОВ | 1923 |
|
SU1974A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОИЗВЕДЕНИЙ РАСТВОРИМОСТИ И ИОННЫХ ПРОИЗВЕДЕНИЙ МАЛОРАСТВОРИМЫХ СОЛЕЙ И КОМПЛЕКСНЫХ СОЕДИНЕНИЙ | 2002 |
|
RU2240555C2 |
| Инверсионно-вольтамперометрический способ определения произведения растворимости | 1987 |
|
SU1553892A1 |
| Инверсионно-вольтамперометрический способ определения произведения растворимости соединений металлов | 1985 |
|
SU1471116A1 |
| US 4582572 A1, 15.04.1986 | |||
| ЛОПАТИН Б.А | |||
| Теоретические основы электрохимических методов анализа | |||
| - М.: ВШ, 1975, с.45-46 | |||
| БУДАНОВ В.В., ВОРОБЬЕВ Н.К | |||
| Практикум по физической химии | |||
| - М.: Химия, 1986, с.280-281. | |||
Авторы
Даты
2008-04-27—Публикация
2006-11-13—Подача