Изобретение относится к области получения индивидуальных трет.пентенов и получения изопрена (2-метил-бутадиена-1,3). Более конкретно изобретение относится к области получения 2-метил-2-бутена и изопрена из изопентана.
Известен способ [П.А.Кирпичников и др. «Альбом технологических схем основных производств промышленности синтетического каучука». Л., Химия, 1986, с.53-70] получения смеси преимущественно трет.пентенов, включающий высокотемпературное газофазное каталитическое дегидрирование изопентана, извлечение из контактного газа дегидрирования смеси углеводородов С5, содержащей преимущественно изопентан и изопентены, и последующее разделение указанной смеси экстрактивной ректификацией в присутствии полярного экстрагента с выделением потока, содержащего преимущественно изопентан, возвращаемого на дегидрирование, и потока, содержащего преимущественно смесь трет.пентенов (2-метил-1-бутена и 2-метил-2-бутена).
Известен также способ [П.А.Кирпичников и др. там же] получения изопрена путем высокотемпературного газофазного каталитического дегидрирования смеси трет.пентенов, получаемый вышеуказанным способом, при котором из контактного газа дегидрирования извлекают смесь углеводородов C5, содержащую преимущественно трет.пентены, изопрен и пиперилены (пентадиены-1,3), из нее экстрактивной ректификацией в присутствии полярного агента извлекают смесь пентадиенов и затем ректификацией отделяют изопрен от пипериленов.
Процесс получения изопрена из изопентана, в котором последовательно используются указанные выше способы, обычно именуемый процессом двухстадийного дегидрирования изопентана, весьма сложен и дорог.
Известен способ [патент Ru - 2102370 от 20.01.1998 г.] получения изопрена из изопентана, согласно которому изопентан подвергают жидкофазному окислению преимущественно в гидроперекись трет.пентина, которой эпоксидируют 2-метил-2-бутен с образованием окиси 2-метил-2-бутена и трет.пентанола. Окись 2-метил-2-бутена и трет.пентанол разделяют ректификацией и затем окись 2-метил-2-бутена превращают в изопрен. Трет.пентанол подвергают дегидратации с получением смеси 2-метил-2-бутена и 2-метил-1-бутена. Из указанной смеси ректификацией выделяют 2-метил-2-бутен, направляемый на эпоксидирование, а 2-метил-1-бутен подвергают изомеризации в 2-метил-2-бутен на сульфокатионитном катализаторе в присутствии большого количества спирта с последующим разложением образующего(их)ся эфира(ов) и затем из реакционной смеси выделяют дополнительное количество 2-метил-2-бутена.
Указанный процесс весьма сложен. Одним из его существенных недостатков является низкая конверсия (˜7%) изопентана в гидроперекись трет.пентила. Попытка повысить конверсию приводит к образованию большого количества побочных продуктов из-за окисления в молекулах изопентана вторичного углеродного атома, соседствующего с третичным углеродным атомом. Предложенный в Ru - 2102370 прием изомеризации 2-метил-1-бутена в 2-метил-2-бутен в присутствии спирта приводит к образованию большого количества побочных продуктов (в частности, эфиров) и требует дальнейшего отделения 2-метил-2-бутена от спирта и побочных продуктов.
Известен способ [патент Ru - 2170225 от 04.08.1998 г.] совместного получения изопрена и мономера с алкенильной группой (изобутена или алкенилбензола). При этом изопентан подвергают каталитическому дегидрированию, из контактного газа дегидрирования извлекают смесь углеводородов С5 и затем из нее получают 2-метил-2-бутен, используя ректификацию и изомеризацию 2-метил-1-бутена в 2-метил-2-бутен, а поток, содержащий преимущественно изопентан и частично ненасыщенные углеводороды C5, возвращают в зону дегидрирования. Выделяемый 2-метил-2-бутен затем эпоксидируют алкилгидроперекисью в окись 2-метил-2-бутен, превращаемую далее в изопрен.
Необходимую для эпоксидирования алкилгидроперекись получают путем жидкофазного окисления соответствующего углеводорода (изобутана или алкилбензола). Из алкилгидроперекиси в процессе эпоксидирования 2-метил-2-бутена образуется соответствующий спирт, дегидратацией которого получают мономер с одной алкенильной группой: изобутен, стирол, α-метилстирол.
Существенным недостатком способа является то, что он рассчитан на переработку С5-фракции дегидрирования, практически не содержащей пентадиенов (см. поток 3 в табл.1-3). В действительности, такие фракции содержат 2,5-3% изопрена и 0,2-0,4% пипериленов. При отгонке С5-фракции потока, содержащего преимущественно изопентан, он включает также до 4,5% изопрена, который при рециркуляции указанного потока в зону дегидрирования вызывает закоксовывание катализатора. Пиперилены, особенно транс-, практически неотделимы от 2-метил-2-бутена обычной ректификацией из почти тангенциальной зеотропии (в потоке 2-метил-2-бутена его относительная летучесть по отношению к транс-пиперилену составляет всего 1,07-1,08).
Другим недостатком способа по патенту RU 2170225 является то, что в нем не решена проблема эффективного вывода н.пентана, имеющего с 2-метил-2-бутеном почти тангенциальную зеотропию, что ведет к чрезмерному накапливанию н.пентана в системе эпоксидирования или гидроксилирования.
Способ ограничивается применением для эпоксидирования 2-метил-2-бутена гидроперекисей углеводородов и не предусматривает возможности применения перекиси водорода.
Мы заявляем:
Способ получения 2-метил-2-бутена из изопентана, включающий газофазное дегидрирование изопентана в зоне дегидрирования, извлечение из контактного газа С5-фракции, содержащей преимущественно изопентан, трет.пентены, примеси изопрена и других углеводородов, и получение из нее потока, содержащего преимущественно 2-метил-2-бутен, с использованием жидкофазной каталитической изомеризации в С5-фракции 2-метил-1-бутена в 2-метил-2-бутен и ректификации, отличающийся тем, что указанную С5-фракцию, возможно дополнительно содержащую пиперилены и 2-пентены, непосредственно или после отгонки от большей части 2-метил-2-бутена подвергают жидкофазной гидроизомеризации в присутствии твердого катализатора, содержащего металл(ы) VIII группы периодической системы Д.И.Менделеева, способный(е) одновременно катализировать гидрирование пентадиенов, изопрена и возможно пипериленов, и позиционной изомеризации трет.пентенов, предпочтительно с последующей дополнительной изомеризацией 2-метил-1-бутена в 2-метил-2-бутен на сульфокатионитном катализаторе, и ректификации с выводом в качестве дистиллята потока преимущественно изопентана, содержащего не более 1,0 мас.%, предпочтительно не более 0,2 мас.% пентадиена(ов), который в основном рециркулируют в зону дегидрирования, и выводом из нижней части ректификации потока преимущественно 2-метил-2-бутена с примесью н.пентана и возможно 2-пентенов.
В качестве способов, способствующих эффективному получению 2-метил-2-бутена из изопентана согласно п.1, мы также заявляем способы, при которых:
- проводят совместное гидрирование пентадиенов и изомеризацию 2-метил-1-бутена в присутствии сульфокатионитного катализатора, содержащего указанный(е) металл(ы),
- в указанные зоны изомеризации и/или гидроизомеризации вводят дополнительное количество насыщенного(ых) углеводорода(ов), возможно потока преимущественно изопентана, в количестве, обеспечивающем концентрацию алканов в смеси от 50 до 90 мас.%,
- выводимый при ректификации поток, содержащий преимущественно изопентан, подвергают ректификации, при которой выводят дистиллят, содержащий преимущественно 3-метил-1-бутен, и кубовый остаток предпочтительно рециркулируют в зону дегидрирования,
- выводимый из нижней части указанной ректификации поток преимущественно 2-метил-2-бутена дополнительно подвергают отгонке от димеров, возможно олигомеров и смол.
Мы заявляем (независимо от способа по п.1):
Способ получения изопрена из изопентана, включающий газофазное дегидрирование изопентана, извлечение из контактного газа С5-фракции, содержащей преимущественно изопентан, трет-пентены, примеси изопрена и других углеводородов, получение из нее потока преимущественно 2-метил-2-бутена с использованием жидкофазной изомеризации 2-метил-1-бутена в 2-метил-2-бутен и ректификации, катализируемое взаимодействие 2-метил-2-бутена с гидроперекисью и последующее превращение образующего(их)ся кислород-содержащего(их) соединения(ий) C5 в изопрен, отличающийся тем, что указанную С5-фракцию, возможно дополнительно содержащую пиперилены и 2-пентены, непосредственно или после отгонки от большей части 2-метил-2-бутена подвергают жидкофазной гидроизомеризации в присутствии твердого катализатора, содержащего металл(ы) VIII группы периодической системы Д.И.Менделеева, способный(е) одновременно катализировать гидрирование пентадиенов, изопрена и возможно пипериленов, и позиционной изомеризации трет.пентенов, предпочтительно с последующей дополнительной изомеризацией 2-метил-1-бутена в 2-метил-2-бутен на сульфокатионитном катализаторе, и ректификации, отгоняют поток преимущественно изопентана, предпочтительно рециркулируемого в зону дегидрирования, и выводят из нижней части ректификации поток преимущественно 2-метил-2-бутена с содержанием не более 10%, предпочтительно не более 2%, н.пентана и возможно примесью 2-пентенов, в указанном потоке 2-метил-2-бутен подвергают взаимодействию с гидроперекисью углеводорода и/или гидроперекисью водорода в присутствии катализатора, содержащего активный при указанном взаимодействии металл переменной валентности IV, V или VI группы периодической системы Д.И.Менделеева, предпочтительно молибден, вольфрам или титан, с рециркуляцией потока, содержащего преимущественно 2-метил-2-бутен, с выводом потока с повышенным содержанием н.пентана, и образующуюся окись 2-метил-2-бутена и/или продукты его гидроксилирования превращают в изопрен, удаляемый из смеси и образующийся из гидроперекиси углеводорода спирт возможно дегидратируют в соответствующий моновиниловый мономер.
В качестве способов, способствующих эффективному получению изопрена из изопентана согласно п.8, мы также заявляем способы, при которых:
- поток преимущественно 2-метил-2-бутена, содержащий частично н.пентан, подвергают катализируемому взаимодействию с гидроперекисью как минимум в двух зонах, в одной из которых поддерживают молярное преобладание 2-метил-2-бутена над гидроперекисью, и, как минимум, часть непрореагировавших углеводородов подают в реакционную зону с молярным преобладанием гидроперекиси над 2-метил-2-бутеном, выводят поток с повышенным содержанием н.пентана и выводят поток, содержащий гидроперекись, продукты взаимодействия и возможно катализатор, который возвращают в первую из указанных зон,
- в первой зоне взаимодействия 2-метил-2-бутена с гидроперекисью поддерживают молярное отношение поступающих 2-метил-2-бутена и гидроперекиси от 1,4:1 до 10:1, а во второй зоне от 0,1:1 до 0,85:1,
- для взаимодействия с 2-метил-2-бутеном используют гидроперекись(и), получаемую(ые) окислением углеводорода(ов) из группы, включающей изобутан, этилбензол, изопропилбензол, и образующий(е)ся при ее взаимодействии с 2-метил-2-бутеном спирт(ы) предпочтительно дегидратируют и получают соответственно изобутен, стирол или а -метилстирол, либо спирт(ы) извлекают из реакционной смеси и используют для иных целей,
- в качестве указанной гидроперекиси углеводорода используют гидроперекись трет-бутила и из образующегося при взаимодействии с 2-метил-2-бутеном трет-бутанола получают дополнительное количество изопрена путем его взаимодействия с формальдегидом и разложения образующихся полупродуктов,
- из реакционной смеси извлекают трет.бутанол и получают из него и возможно изобутена дополнительно изопрен с использованием его(их) взаимодействия с формальдегидом и разложения полупродуктов,
- продукты гидроксилирования 2-метил-2-бутена получают путем его контактирования с водным и/или спиртовым раствором перекиси водорода в присутствии водорастворимого и/или твердого катализатора, содержащего металл(ы) переменной валентности, выбранный(е) из группы, включающей молибден, вольфрам, титан,
- продукты гидроксилирования и/или дигидроксилирования подвергают каталитической дегидратации непосредственно в получаемом водном и/или водно-спиртовом растворе.
В предлагаемом способе могут быть использованы различные варианты (процессы) термокаталитического дегидрирования изопентана, в частности известные процессы дегидрирования со взвешенным алюмохромовым катализатором, со стационарным слоем алюмохромового или платинусодержащего катализатора и возможно другие процессы дегидрирования изопентана, в которых изопентан превращается преимущественно в трет.пентены.
Для одновременного гидрирования алкадиенов в С5-фракции дегидрирования и гидроизомеризации 2-метил-1-бутена в 2-метил-2-бутен могут быть использованы любые катализаторы, пригодные для селективного гидрирования алкадиенов без существенного гидрирования трет.алкенов.
Для изомеризации 2-метил-1-бутена в 2-метил-2-бутен также могут быть использованы любые катализаторы, способные осуществлять перемещение двойной связи в молекулах трет.пентенов без разрушения углеродного скелета, в частности катионитные (обычно сульфокатионитные) катализаторы или катализаторы, содержащие металлы переменной валентности, из которых наиболее известны и используются в промышленности катализаторы, содержащие никель, палладий, медь или платину на твердом носителе.
Процесс преимущественного гидрирования алкадиенов (с сопутствующей изомеризацией 2-метил-1-бутена) может предшествовать процессу изомеризации 2-метил-1-бутена в 2-метил-2-бутен на катионите(ах) или осуществляться после указанной изомеризации, либо эти процессы могут быть совмещены в одной реакционной зоне.
В качестве реакторов для изомеризации могут быть использованы различные аппараты с вертикальным (сверху вниз или снизу вверх), горизонтальным или иным способом движения жидкости и ее контактирования с катализатором. Для гидрирования и гидроизомеризации могут быть использованы вертикальные аппараты с барботажем водородсодержащего потока через жидкость (и катализатор) или аппараты оросительного типа с системой поддержания заданного давления водорода. Одна из ректификационных зон может предшествовать гидроизомеризации и снизу нее поток, содержащий преимущественно 2-метил-2-бутен.
В качестве катализаторов для эпоксидирования и/или гидроксилирования 2-метил-2-бутена могут использоваться различные известные катализаторы, содержащие молибден, вольфрам и др. металлы, эффективные в указанных процессах.
Получение изопрена из окиси 2-метил-2-бутена или спирта(ов), получаемого(ых) гидроксилированием и/или дигидроксилированием 2-метил-2-бутена, может осуществляться путем разложения с известными селективными катализаторами, например, в присутствии борофосфатных катализаторов или катализаторов, содержащих соединения стронция или иных кислых катализаторов. Возможно получение изопрена из С5-гликолей путем жидкофазной или паро-жидкостной дегидратации, катализируемой сильной кислотой (H2SO4, Н3PO4 и др.) или сильнокислотным катионитом. Окись 2-метил-2-бутена для превращения в изопрен может быть первоначально или в совместном процессе превращена в спирт(ы) С5 и/или С5-ненасыщенный спирт с последующей его дегидратацией.
Использование предлагаемых способов иллюстрируется фиг.1-3 и примерами. Указанные фигуры и примеры не исчерпывают всех возможных вариантов и могут быть использованы иные технические решения при условии выполнения соответственно п.1 и/или п.8 формулы изобретения.
На фигурах используются условные обозначения: ИП - Изопентан, НП - н-пентан, 2М2Б - 2-метил-2-бутен, C4 - углеводороды С4, С5 - углеводороды C5, С6+ - углеводороды С6 и более высококипящие углеводороды, КМ - компрессор, СО - сепаратор-отстойник.
Согласно фиг.1 поток, содержащий преимущественно изопентан, подают по линии 1. Указанный поток вместе с рециркулируемым потоком 15 (поток ИП+) нагревают, испаряют и подают по линии 2 в узел дегидрирования (УД). Из УД выводят газообразный поток 3, который компремируют в компрессоре КМ и по линии 4 подают в узел выделения С5-смеси (узел УВС). Из УВС выводят по линиям 5, 6 и 7 соответственно потоки абгаза, преимущественно углеводородов С4 и углеводородов С6+. По линии 8 выводят поток, содержащий преимущественно углеводороды С5, который подают непосредственно (по линии 8а) в реакционную зону Р или предварительно подают в ректификационную колонну К-1 (по линии 8б), где отгоняют от большей части содержащегося 2-метил-2-бутена (поток 10), отстаивают от воды в СО и по линии 9 (далее 11) подают в зону Р.
Зона Р содержит катализатор(ы), обладающий(е) активностью в реакциях гидрирования алкадиенов и гидроизомеризации алкенов с изменением положения двойной связи. Углеводороды C5 в зоне Р поддерживают предпочтительно в жидком состоянии. Снизу в зону Р через распределительное устройство по линии 12 подают водород или водородсодержащую газовую смесь. Из зоны Р сверху выводят по линии 13 газовый поток, включающий непрореагировавший водород. Часть потока 13 может быть рециркулирована на вход в зону Р по линии 13б.
Из верхней части зоны Р выводят углеводородный поток 14, который подают в ректификационную зону К-2. В качестве дистиллята из зоны К-2 выводят поток 15, содержащий преимущественно изопентан, который рециркулируют по линии 15 в узел УД.
Снизу зоны К-2 по линии 16 выводят поток, содержащий преимущественно 2-метил-2-бутен, который далее выводят по линии 16а или по линии 16б подают в аппарат И, где отгоняют от димеров и других тяжелых примесей (линия 18) и выводят по линии 17 (далее по линии 10а), возможно соединяя с потоком 10.
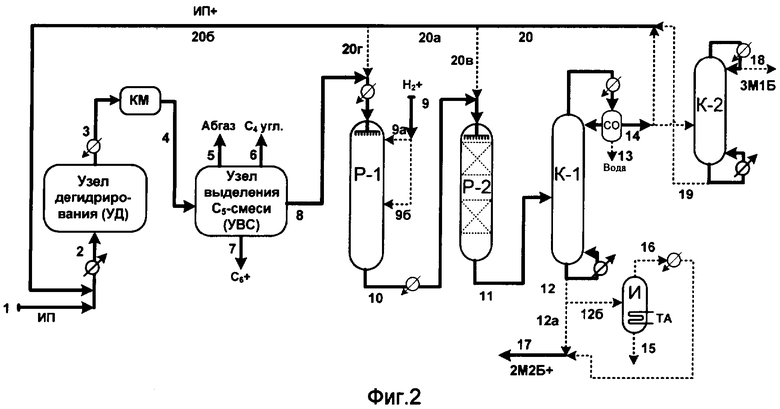
Согласно фиг.2 дегидрирование изопентана в узле УД и выделение С5-смеси углеводородов в узле УВС проводят аналогично показанному на фиг.1.
В отличие от фиг.1 гидроизомеризацию 2-метил-1-бутена и гидрирование пентадиенов проводят в реакторе Р-1 оросительного типа, содержащем катализатор с металлом(ами), активным(и) для указанных реакций.
Жидкую углеводородную смесь (пот.8 и возможно пот.20г) подают в Р-1 сверху через распределительное устройство. Водород подают в небольшом количестве по линии 9 (далее 9а, 9б), регулируют его давление в Р-1.
Из Р-1 снизу по линии 10 реакционную смесь подают сверху в реактор Р-2 (возможно с потоком 20в) через распределительное устройство. Р-1 содержит сульфокатионитный катализатор. Снизу Р-2 выводят жидкий поток 11, который подают в ректификационную колонну К-1.
Из К-1 снизу выводят поток 12, содержащий преимущественно 2-метил-2-бутен. Его далее выводят по линии 12а или по линии 12б подают в аппарат И для отгонки от тяжелых примесей. Указанные примеси выводят по линии 15, а отогнанный поток, содержащий преимущественно 2-метил-2-бутен, выводят по линии 16. Возможно потоки 12а и 16 соединяют и выводят по линии 17.
Сверху К-1 газовый поток конденсируют и расслаивают в сепараторе-отстойнике СО. Снизу выводят водный слой. Углеводородный поток 14 в основном рециркулируют в УД по линии 14а (далее 20, 20а, 20б) и/или по линии 14б подают в колонну К-2, из которой сверху по линии 18 выводят дистиллят, содержащий преимущественно 3-метил-1-бутен, а снизу по линии 19 выводят поток, содержащий преимущественно изопентан, который рециркулируют в основном в УД (по линии 20, 20а, 20б).
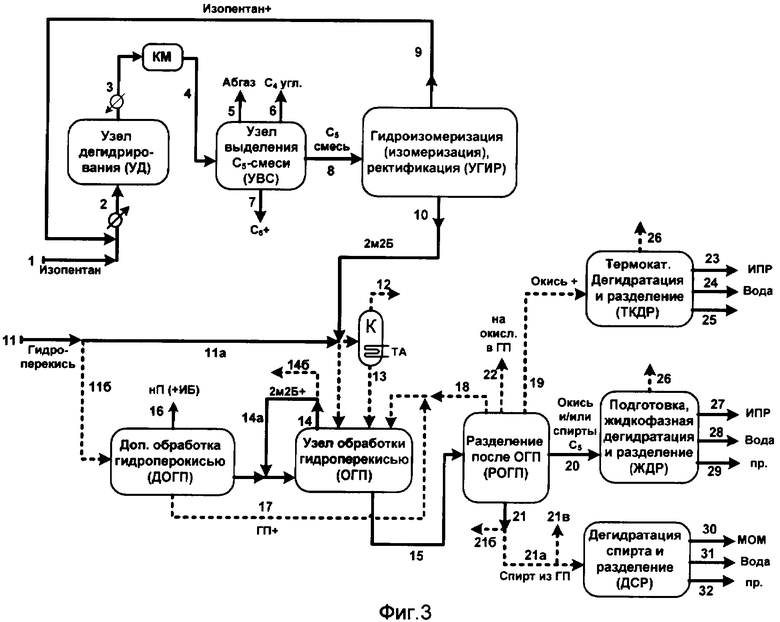
Согласно фиг.3 переработку осуществляют путем дегидрирования изопентана (ИП) в узле УД с последующим выделением С5-смеси из контактного газа дегидрирования в узле УВС. Далее С5-смесь перерабатывают в узле гидроизомеризации (и возможно дополнительной изомеризации) и ректификации (узел УГИР) аналогично показанному на фиг.1 или фиг.2.
Выделяют поток 10, содержащий преимущественно 2-метил-2-бутен (2М2Б), который направляют на взаимодействие с гидроперекисью, и поток 9, содержащий преимущественно изопентан, который рециркулируют в узел УД.
Поток 10 на фиг.3 соответствует потоку 10а на фиг.1 или потоку 17 на фиг.2; поток 9 на фиг.3 соответствует потоку 15 на фиг.1 или потоку 20 на фиг.2.
Поток 10 направляют в узел обработки гидроперекисью (ОГП). Возможно предварительно поток 10 смешивают с потоком гидроперекиси (поток 11а), смесь подают в колонну К и по линии 12 отгоняют легкие углеводороды (например, изобутен при использовании гидроперекиси трет.бутила). По линии 13 отогнанную от легких примесей смесь подают в ОГП.
В ОГП рециркулируют также потоки непрореагировавшего 2-метил-2-бутена 14а и 18 и поток 17 из узла ДОГП (если он используется).
Из узла ОГП выводят поток непрореагировавшего 2М2Б по линии 14 и поток 15, содержащий преимущественно продукты, образующиеся при взаимодействии 2М2Б с гидроперекисью. Поток 14 частично (преимущественно большей части возвращают в ОГП по линии 14а, а частично подают в узел дополнительной обработки гидроперекисью по линии 14б).
Исходный поток, содержащий гидроперекись, поступает в процесс по линии 11. Часть его по линии 11б подают в узел ДОГП.
Из ДОГП по линии 16 выводят поток, содержащий н.пентан (НП) и возможно легкие компоненты, например изобутан (ИБ). По линии 17 выводят поток, содержащий преимущественно гидроперекись и продукты ее взаимодействия с 2М2Б, который подают в узел ОГП.
В потоках, подаваемых в ОГП, суммарно поддерживают молярное преобладание 2М2Б над гидроперекисью. В потоках, подаваемых в ДОГП, суммарно поддерживают молярное преобладание гидроперекиси над 2М2Б.
Поток 15 из ОГП подают в зону разделения РОГП.
Из РОГП выводят по линии 19 окись 2М2Б и возможно трет.бутанол, или по линии 20 выводят окись 2М2Б и/или спирты С5. По линии 21 (далее 21а) выводят поток, содержащий спирт, образовавшийся из гидроперекиси углеводорода (например, метилфенилкарбинол, диметилфенилкарбинол или трет-бутанол), или воду, далее выводимую по линии 21б.
Поток 19 подают в узел термокаталитической дегидратации и разделения (ТКДР), откуда выводят как минимум поток изопрена, ИПР (линия 23), поток воды (поток 24), побочные продукты (суммарно поток 25) и возможно поток изобутена (поток 26).
Поток 20 подают в узел подготовки, жидкофазной дегидратации и разделения (узел ЖДР), откуда выводят как минимум поток изопрена (поток 27), поток воды (поток 28) и побочные продукты (суммарно поток 29).
Поток 21а, содержащий спирт, образовавшийся из гидроперекиси углеводорода, возможно подают в узел дегидратации спирта и разделения (ДСР), из которого выводят как минимум моноолефиновый углеводород (мономер) MOM по линии 30, воду по линии 31 и суммарно (условно) побочные продукты по линии 32.
Если поток 21а содержит трет-бутанол, его возможно подают по линии 21в на получение дополнительного количества изопрена путем взаимодействия с формальдегидом и последующего разложения полупродуктов в изопрен.
ПРИМЕРЫ
Пример 1
Получение 2-метил-2-бутена из изопентана осуществляют согласно фиг.1
Дегидрирование изопентана в УД проводят в системе с кипящим слоем алюмохромового катализатора при 530-540°С. Подают 1100 кг «свежего» изопентана (с<0,5%) н.пентана и рецикловый поток. Выделение С5-смеси из контактного газа (в УВС) осуществляют путем абсорбции углеводородов высококипящим углеводородным растворителем с последующей ректификацией для отгонки потока, содержащего преимущественно углеводороды С4, а затем отгоняют С5-смесь от С6- и более высококипящих углеводородов.
С5-смесь (пот.8) подвергают ректификации в колонне К-1 от 2-метил-2-бутена (с примесью н.пентана и возможно 2-пентенов), который выводят по линии 10. Дистиллят (пот.9) после отстаивания воды подают в реактор гидроизомеризации Р, содержащий катализатор «Ni на кизельгуре» (˜30% мас Ni). Снизу в «Р» через распределительное устройство подают поток, содержащий водород, часть которого после выхода из «Р» рециркулируют на вход.
Гидроизомеризат из «Р» по линии 14 подают в ректификационную колонну 2. В качестве дистиллята выводят поток 15, содержащий преимущественно изопентан, который рециркулируют в УД. Снизу выводят поток 16, содержащий преимущественно 2-метил-2-бутен, который соединяют с потоком 10 и выводят по линии 10а. В реакторе Р поддерживают температуру 25°С, нагрузку 1,1 кг жидкости/кг катализатора в час. Общая конверсия 2-метил-1-бутена в 2-метил-2-бутен составляет 89,5%. Основные углеводородные потоки даны в табл.1.
В результате получают 839 кг/ч потока (10а), содержащего преимущественно 2-метил-2-бутен (97,3%) с примесью н.пентана (1,7%), 2-пентенов (0,6%), 2-метил-1-бутена (<0,1%) и пипериленов (0,3%). На дегидрирование возвращают 2145 кг/ч потока, содержащего преимущественно изопентан (95,6%) с примесью 0,3% н.пентана и 4% пентенов, менее 0,1% изопрена.
В колонне К-1 75 теор. тарелок, флегмовое число 5, в колонне К-2 70 теор. тарелок, флегмовое число 4,5.
к примеру 1
Пример 2
Получение 2-метил-2-бутена осуществляют подобно указанному в примере 1. В отличие от примера 1 в качестве катализатора гидроизомеризации используют сульфокатионитный катализатор, содержащий 0,7 мас.% палладия. В реакторе поддерживают температуру 30°С, нагрузку на катализатор 0,7 кг жидкости/кг катализатора в час. В отличие от примера 1 прирост изопентана в 2 раза выше, но имеет место образование димеров С10 в количестве 0,2% от общего количества жидкости. От них продукт переиспаряют в аппарате «И».
В результате получают 862 кг/ч потока, содержащего преимущественно 2-метил-2-бутен (97,1%) с примесью н.пентана (2,1%), 2-пентенов (0,5%), 2-метил-1-бутена (0,1%) и пипериленов (0,3%).
На дегидрирование возвращают 2121 кг/ч потока, содержащего преимущественно изопентан (95,3%) с примесью н.пентана (0,35%), пентенов (4,3%), менее 0,05% изопрена.
Пример 3
Получение 2-метил-2-бутена из 1100 кг/ч изопентана (с 0,5% н.пентана) осуществляют согласно фиг.2. Дегидрирование изопентана и выделение С5-смеси проводят аналогично указанному в примере 1. В качестве катализатора гидроизомеризации в реакторе Р-1 используют палладий (1,2 мас.%) на окиси алюминия, в реакторе Р-2 (для изомеризации) - мелкозернистый сульфокатионит Амберлист-35. В Р-1 температура 35-40°С, давление водорода 3,5-4,0 ата, в Р-2 -25°С. Нагрузка на катализатор в Р-1 - 2,0 кг/кг кат.час, в Р-2 - 6,5 кг/кг кат.час.
В колонне К-1 80 теор. тарелок, флегмовое число 5. Характеристика основных углеводородных потоков дана в табл.2
В результате получают 793 кг/ч потока (пот.17), содержащего 98,2% 2-метил-2-бутена, 1,3% н.пентана, 0,5% н.пентенов, ≤0,05% пипериленов (изопрен отсутствует) и получают поток для рециркуляции на дегидрирование (пот.14), содержащий 94,1% изопентана, 0,7% н.пентана, 1,9% 3-метил-1-бутена, 0,8% н.пентенов, 2,6% трет.пентенов, ≤0,1% изопрена.
Пример 4
Получение 2-метил-2-бутена из 1100 кг/ч изопентана (с 0,5% н.пентана) осуществляют подобно примеру 3. В отличие от примера 3 в реакторе Р-1 используют катализатор «никель на кизельгуре» (30% никеля), в реакторе Р-2 формованный в виде колец (диаметр 3-5 мм, длина 4-6 мм) катализатор типа КИФ. В Р-1 температура 20-25°С, давление водорода 3,3-3,5 ата, в Р-2 температура 35-40°С. Нагрузка на катализатор в Р-1 1,5 кг жидкости/кг катализатора, в Р-2 - 2 кг жидкости/кг катализатора.
Составы потоков близки к указанным в табл.2.
Пример 5
Получение 2-метил-2-бутена из 1100 кг/ч изопентана (с 0,5% н.пентана) проводят аналогично указанному в примере 3 (по фиг.2). В отличие от примера 3 отгоняемый поток 14 до рециркуляции на дегидрирование подвергают ректификации в колонне К-2, имеющей эффективность 80 теор. тарелок при удельном флегмовом числе (отношение флегмового потока к потоку питания) 3,9.
В качестве дистиллята из К-2 выводят ˜42 кг/час потока, содержащего 98% 3-метил-1-бутена и ˜2% изопентана (других пентенов менее 0,03%). Из куба выводят и рециркулируют на дегидрирование 2146 кг/ч потока, содержащего 95,8% изопентана, 0,7% н.пентана, ˜3,4% пентенов и ≤0,1% изопрена (см. табл.2).
к примерам 3-5
Пример 6
Получение изопрена из изопентана и одновременно изобутена из изобутана осуществляют согласно фиг.3. При этом дегидрирование изопентана и получение С5-смеси проводят аналогично указанному в примере 1, а получение 2-метил-2-бутена из С5-смеси - аналогично указанному в примере 3.
796 кг/ч потока, содержащего 98,2% 2-метил-2-бутена, 1,3% н.пентана, 0,5% других пентенов (в основном н.пентенов), ≤0,05% пипериленов, подают на взаимодействие с гидроперекисью трет.бутила.
Поток гидроперекиси трет.бутила, ГПТБ, содержащий 70% ГПТБ (1001,6 кг/ч), 10% трет.бутанола (143,1 кг/ч) и 20% изобутана, подают по линии 11. Большую часть его (линия 11а) соединяют с потоком 2М2Б (линия 10), отгоняют из потока в колонне К изобутан, а кубовый остаток (пот.13) подают в узел ОГП. В ОГП подают также поток 18 (2М2Б) из узла разделения РОГП и поток 17 из узла ДОГП. Суммарно в подаваемых в ОГП потоках поддерживают молярное отношение 2М2Б и ГПТБ=2,5:1 и температуру 90-110°С. В ОГП происходит практически полная конверсия ГПТБ.
Непрореагировавший 2М2Б отгоняют и частично рециркулируют в ОГП по линии 14а, частично направляют в узел ДОГП по линии 14б. В ДОГП по линии 11б подают часть потока 11. В ДОГП поддерживают молярное отношение 2М2Б:ГПТБ=0,4:1 и температуру 85-100°С.
В качестве катализатора в ОГП и ДОГП используют нафтенат молибдена в концентрации 0,05%.
Из ДОГП отгоняют поток 16, содержащий н.пентан и изобутан, и выводят поток 17, подаваемый в ОГП.
Из ОГП выводят поток 15, содержащий преимущественно окись 2М2Б и трет.бутанол, который подают в узел разделения РОГП. Из РОГП смесь окиси 2М2Б и трет.бутанола подают в узел термокаталитической дегидратации и разделения ТКДР, содержащий катализатор дегидратации.
Из ТКДР выводят 658 кг/ч изопрена (поток 22) и 730 кг/ч изобутена (поток 21), воду (поток 22) и побочные продукты (условно поток 23), в т.ч. 70 кг/ч метилизопропилкетона.
Пример 7
Получение изопрена из изопентана и одновременно стирола из этилбензола осуществляют согласно фиг.3. Дегидрирование изопентана и получение С5-смеси проводят аналогично указанному в примере 1, а получение 2-метил-2-бутена (2М2Б) из С5-смеси - аналогично указанному в примере 3. 796 кг/ч потока, содержащего 98,2% 2-метил-2-бутена, 4,3% н.пентана, 0,5% других пентенов, ≤0,05% пипериленов, подают на взаимодействие с гидроперекисью этилбензола (ГПЭБ).
Поток, содержащий 35% ГПЭБ (1525 кг/ч), 60-63% этилбензола (ЭБ) и 2-5% метилфенолкарбинола (с примесью ацетофенона) подают по линии 11. Часть потока (˜50-60%) по линии 11a подают в узел ОГП, и другую часть по линии 11б подают в узел ДОГП.
Из ОГП часть непрореагировавшего 2М2Б с примесями отгоняют по линии 14. Большую часть потока 14 по линии 14а рециркулируют в узел ОГП, а меньшую часть с содержанием ˜25 кг/ч н.пентана подают по линии 14б в узел ДОГП.
Из ДОГП отгоняют поток 16 с высоким содержанием н.пентана и выводят жидкий поток 17, который подают в ОГП. В ОГП и ДОГП в качестве катализатора используют комплекс, получаемый взаимодействием молибдена с ГПЭБ и этанолом. На подаче(ах) ОГП поддерживают суммарное молярное отношение 2М2Б и ГПЭБ 4:1; на подаче(ах) в ДОГП - их отношение 0,3:1. Температура в ОГП 100-110°С, в ДОГП - 90-100°С.
Жидкий поток 15 из ОГП подвергают разделению в узле РОГП. Из РОГП выводят поток 18 (в основном 2М2Б), рециркулируемый в ОГП, поток 20, содержащий преимущественно окись 2М2Б, поток 21, содержащий преимущественно метилфенилкарбинол, ДМФК, и поток 22 (в основном этилбензол), предпочтительно направленный на окисление для получения гидроперекиси.
Окись 2М2Б подвергают жидкофазной изомеризации в ненасыщенный спирт С5 и дегидратации с получением изопрена (пот.27) в узле ЖДР при 160-180°С.
В потоке 21 ДМФК подвергают дегидратации в присутствии кислого твердого катализатора и по линии 30 выводят стирол (селективность превращения 97-98%).
В результате получают ˜660 кг/ч изопрена и ˜1115 кг/ч стирола.
Пример 8
Получение изопрена из изопентана осуществляют согласно фиг.3. Дегидрирование изопентана и получение С5-смеси проводят аналогично примеру 1, получение 2-метил-2-бутана (2М2Б) из С5-смеси - аналогично примеру 3.
В качестве гидроперекиси для взаимодействия с 2М2Б используют перекись водорода, которую подают в процесс (линия 11) в виде водного раствора при молярном количестве перекиси водорода по отношению в 2М2Б от 1:1 до 1,2. Поток 2М2Б (пот.10) и часть раствора перекиси водорода (пот.11а) подают в узел ОГП (остальную часть раствора перекиси водорода подают по линии 11б в узел ДОГП), причем раствор перекиси водорода при введении в ОГП и возможно в ДОГП тщательно диспергируют.
В качестве катализатора используют в основном титан на твердом пористом носителе, содержащем кремний. Суммарное молярное отношение 2М2Б и Н2О2 во вводимых потоках составляет в ОГП 5:1, в ДОГП - 0,3:1. Температура в ОГП 80-95°С, в ДОГП - 75-90°С.
Образующиеся продукты гидро- и дигидроксилирования после отгонки 2М2Б в узле РОГП подают в водном растворе по линии 20 в узел ЖДР, где в присутствии твердого сильнокислотного катализатора (сульфокатионита) дегидрируют с отгонкой изопрена.
По линии 27 выводят 670 кг/ч потока, содержащего преимущественно изопрен.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РАЗДЕЛЕНИЯ АЛКАН-АЛКЕНОВЫХ ФРАКЦИЙ | 2008 |
|
RU2379277C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕТ-ПЕНТЕНА(ОВ) И АЛКИЛ C-C-ТРЕТ-ПЕНТИЛОВОГО ЭФИРА | 2010 |
|
RU2434835C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЧИСТОГО 1-БУТЕНА ИЗ C-ФРАКЦИЙ | 2010 |
|
RU2436758C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЧИСТОГО 1-БУТЕНА | 2006 |
|
RU2304134C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООКТАНОВЫХ СМЕСЕЙ, СОДЕРЖАЩИХ АЛКИЛ-ТРЕТ-АЛКИЛОВЫЕ ЭФИРЫ | 2010 |
|
RU2434933C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-БУТЕНА И ИЗОБУТЕНА ИЛИ/И ЕГО ПРОИЗВОДНЫХ | 2011 |
|
RU2470905C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕНОЛА И КЕТОНА ИЗ ГИДРОПЕРОКСИДА АЛКИЛАРОМАТИЧЕСКОГО УГЛЕВОДОРОДА (ВАРИАНТЫ) | 2006 |
|
RU2341510C2 |
| СПОСОБ ПЕРЕРАБОТКИ УГЛЕВОДОРОДНОГО СЫРЬЯ С ПОЛУЧЕНИЕМ ВЫСОКООКТАНОВЫХ ПРОДУКТОВ | 2004 |
|
RU2283297C2 |
| СПОСОБ ПЕРЕРАБОТКИ УГЛЕВОДОРОДНОЙ СМЕСИ | 2003 |
|
RU2252931C2 |
| СПОСОБ ИЗВЛЕЧЕНИЯ И ОЧИСТКИ 1,3-БУТАДИЕНА | 2006 |
|
RU2304133C1 |
Изобретение относится к способу получения 2-метил-2-бутена из изопентана, включающему газофазное дегидрирование изопентана в зоне дегидрирования, извлечение из контактного газа С5-фракции, содержащей преимущественно изопентан, трет.пентены, примеси изопрена и других углеводородов, и получение из нее потока, содержащего преимущественно 2-метил-2-бутен, с использованием жидкофазной каталитической изомеризации в С5-фракции 2-метил-1-бутена в 2-метил-2-бутен и ректификации, характеризующемуся тем, что указанную С5-фракцию, возможно дополнительно содержащую пиперилены и 2-пентены, непосредственно или после отгонки от большей части 2-метил-2-бутена подвергают жидкофазной гидроизомеризации в присутствии твердого катализатора, содержащего металл(ы) VIII группы периодической системы Д.И.Менделеева, способный(е) одновременно катализировать гидрирование пентадиенов, изопрена и возможно пипериленов, и позиционной изомеризации трет.пентенов, предпочтительно с последующей дополнительной изомеризацией 2-метил-1-бутена в 2-метил-2-бутен на сульфокатионитном катализаторе, и ректификации с выводом в качестве дистиллята потока преимущественно изопентана, содержащего не более 1,0 мас.%, предпочтительно не более 0,2 мас.% пентадиена(ов), который в основном рециркулируют в зону дегидрирования, и выводом из нижней части ректификации потока преимущественно 2-метил-2-бутена с примесью н.пентана и возможно 2-пентенов. Также изобретение относится к способу получения изопрена из изопентана, заключающемуся во взаимодействии 2-метил-2-бутена, полученного на основе газофазного дегидрирования изопентана, с гидроперекисью с дальнейшим превращением оксида или продуктов гидроксилирования в изопрен. 2 н. и 11 з.п. ф-лы, 2 табл., 3 ил.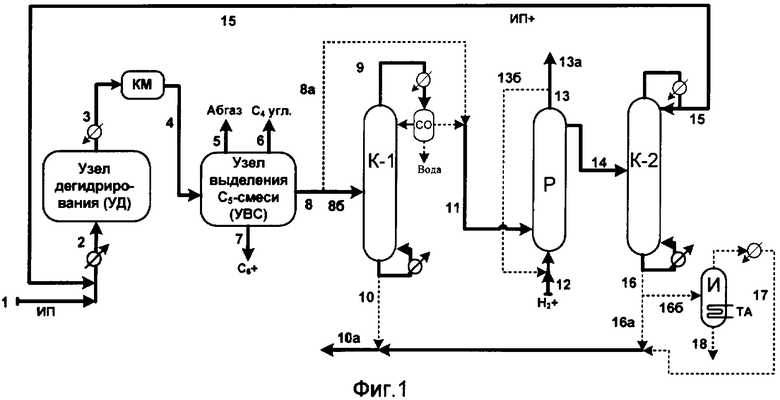
| Кирпичников П.А | |||
| и др | |||
| Альбом технологических схем основных производств промышленности синтетического каучука, Л., Химия, 1986, С.53-70 | |||
| СПОСОБ ПОЛУЧЕНИЯ ИЗОПРЕНА | 1996 |
|
RU2102370C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ ИЗОПРЕНА И ИЗОБУТЕНА ИЛИ АЛКЕНИЛБЕНЗОЛА | 1998 |
|
RU2170225C2 |
| US 4176141 A, 27.11.1979. | |||
Авторы
Даты
2008-07-20—Публикация
2006-12-25—Подача