Настоящее изобретение испрашивает приоритет согласно патентной заявке AR Р 02-0105123, зарегистрированной 27 декабря 2003 г.
Изобретение относится к аналогам 1-дезамино-8-D-аргинилвазопрессина, в частности к аналогам 1-дезамино-8-D-аргинилвазопрессина, содержащим замещения в позициях 4 и 5.
1-Дезамино-8-D-аргинилвазопрессин (десмопрессин) является олигопептидом восьми аминокислот (см. патент США 3,497, 491 (Zaoral et al.); Huguenin et al., Helv.Chi.Acta, 49:695 (1966); Zaoral et al., Coll. Czech. Chem. Commun., 32: 1250 (1967)). Антидиуретическая активность этого пептида известна специалистам (см. Vavra et al., Lancet, 1: 948 (1968)). Десмопрессин используют для лечения неадекватной секреции антидиуретического гормона (diabetis insipidus) и детского энуреза.
Специалистам известны также гемостатические и профибринолитические свойства этого олигопептида. Введение десмеопрессина связывают с повышением плазматических уровней коагуляционного фактора VIII, фактора Фон Виллебранда и тканевого активатора плазминогена (см. Manucci et al., Br.J.Haemotol., 30:81-93 (1975)). Эти свойства десмопрессина позволяют применять его при некоторых нарушениях коагуляции, в частности при хирургическом лечении пациентов в случае опасности кровоизлияния. Позднее открыли также противоопухолевое действие десмопрессина. Применение этого олигопептида связывали со снижением метастатической колонизации в органах, удаленных от циркулирующих раковых клеток, и ингибированием развития метастаз в регионарных лимфатических узлах после хирургических процедур (см. AR P990100736; ЕР 1,031,352; US 200220013262 (Alonso et al.); Alonso et al., Breast Cancer Res. Treat., 57:271-275 (1999); Giron et al., J.Surg.Oncol., 81; 38-44 (2002)).
Специалистам известно также о существовании аналогов десмопрессина, обладающих биологической активностью, равной или более высокой, чем у десмопрессина. Такие аналоги получают, например, в результате метилирования или замещения одной или нескольких аминокислот из пептидной цепи десмопрессина или его предшественника - вазопрессина (см. Loukoti, J.Pept, Sci 6 (3): 123-9 (2000); Kihlberg et al., J.Med.Chem., 38 (1): 161-9 (1995); Barth et al., Eur J.Pharmacol., 232(2-3):223-6 (1993); Barth, J.Recept.Res., 13(1-4):305-11 (1993); Lammek et al., J.Med.Chem., 32 (1): 244-7 (1989); US 4,876,243 (Marshall et al)). Однако до настоящего времени не описано одновременное замещение аминокислот в позициях 4 и 5 пептидной цепи десмопрессина в сочетании с удалением дисульфидной связи в позициях 1 и 6.
Задачей настоящего изобретения являются аналоги 1-дезамино-8-D-аргинилвазопрессина, не известные ранее. Некоторые из описанных здесь олигопептидов проявляют высокую способность ингибирования миграции метастазов и канцерогенных клеток. Дополнительными достоинствами описанных здесь олигопептидов являются простота их синтеза и относительно низкая стоимость получения.
Олигопептиды согласно настоящему изобретению синтезировали способом Хогтена (способ чайных пакетиков) (см. Houghten, Proc. Natl. Acad. Sci. USA, 82: 5131-35 (1985); Houghten et al., Int. J.Peptide Protein Res., 27: 673-678 (1985); US 5, 486,596 (Prochazka et al)). При использовании способа Хогтена синтез пептидов выполняют с помощью миниатюрных пористых пакетиков, изготовленных из полипропилена (чайные пакетики) и содержащих аминокислоты, связанные со смолой. Пакетики погружают в растворы, содержащие активированные аминокислоты, чтобы вызвать соединение аминокислот, присутствующих в растворе, с аминокислотами, связанными со смолой. На этой стадии процесса аминокислоты, связанные со смолой, вымываются и освобождаются от защиты, что способствует их соединению с активированными аминокислотами, присутствующими в растворе. Полипропиленовый пакетик извлекают из первого реакционного раствора и погружают во второй раствор, содержащий другие активированные аминокислоты, чтобы таким образом ввести в пептидную цепь дополнительные аминокислоты. Процесс повторяют несколько раз, чтобы получить требуемый пептид. Этот способ, а также его видоизменения известны специалистам (см. Grant, G., Ed., "Synthetic Peptides" (W.H.Freeman&Co., New York, 1992, стр.78-142)). В одном из вариантов реализации настоящего изобретения аналоги 1-дезамино-8-D-аргинилвазопрессина имеют следующую общую формулу:
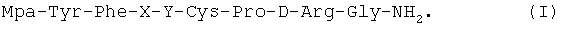
В других вариантах реализации настоящего изобретения аналоги 1-дезамино-8-D-аргинилвазопрессина содержат дисульфидную связь между группой Мра в позиции 1 и цистеином в позиции 6. В этих случаях аналоги 1-дезамино-8-D-аргинилвазопрессина имеют следующую общую формулу:
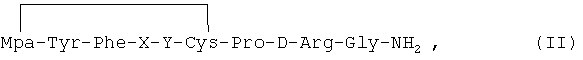
где X представляет собой предпочтительно слабую полярную или неполярную аминокислоту. Наиболее предпочтительно аминокислота является аспарагином или глутамином, если используют слабую полярную аминокислоту, или аланином, валином, лейцином или изолейцином, если используют неполярную аминокислоту;
Y представляет собой предпочтительно слабую полярную или неполярную аминокислоту. Наиболее предпочтительно аминокислота является аспарагином или глутамином, если используют слабую полярную аминокислоту, или аланином, валином, лейцином или изолейцином, если используют неполярную аминокислоту.
Используемое в настоящем описании обозначение "Мра" представляет собой радикал 3-меркаптопропионовой кислоты с формулой SH-CH2-CH2-COOH.
Общие процедуры
Пептиды согласно настоящему изобретению синтезировали в соответствии с описанными ниже процедурами.
1. Синтез
Пептиды синтезировали с помощью смолы метилбензилгидриламина с использованием методики Boc/Bencil согласно следующему протоколу:
1. Пористые пакетики из полипропилена заполнили метилбензилгидриламиновой смолой. Затем пакетики поместили в колбу Nalgen™ и добавили дихлорметан до их полного покрытия. Затем колбу Nalgen™ встряхивали в течение 5 минут, чтобы обеспечить насыщение смолы. Экстрагировали раствор дихлорметана.
2. Полипропиленовые пакетики с предыдущей операции три раза промыли дихлорметаном, содержащим 5% диизопропиламина. Каждая промывка продолжалась 2 минуты. Затем полипропиленовые пакетики три раза промыли дихлорметаном, каждый раз - в течение 1 минуты, чтобы удалить избыток диизопропиламина.
3. Полипропиленовые пакетики с предыдущей операции поместили в колбу Nalgen™, содержащую раствор соответствующей аминокислоты в дихлорметане. Затем добавили равное количество диизопропилкарбодимида, растворенного в дихлорметане, чтобы активировать соединение аминокислоты, растворенной в метилбензилгидриламиновой смоле. Колбу Nalgen™ встряхивали в течение 1 часа до окончания реакции.
4. Реакционный раствор с предыдущей операции удалили. Полипропиленовые пакетики с предыдущей операции дважды промыли N,N-диметилформамидом, каждый раз - в течение 1 минуты, чтобы удалить избыток аминокислот и других вторичных продуктов.
5. Полипропиленовые пакетики с предыдущей операции дважды промыли дихлорметаном, каждый раз - в течение 1 минуты, чтобы удалить избыток N,N-диметилформамида. Защитную группу N-α-тер-бутилоксикарбонила (N-a-t-Boc) удалили кислотным лизисом с помощью 55% раствора трифторуксусной кислоты в дихлорметане. Полипропиленовые пакетики выдержали в растворе трифторуксусной кислоты в течение 30 минут. В результате реакции получили соль α-аминогруппы.
6. Полипропиленовые пакетики с предыдущей операции последовательно промыли: а) дихлорметаном, однократно - в течение 1 минуты, б) изопропанолом - дважды, каждый раз в течение 1 минуты, в) дихлорметаном, однократно - в течение 1 минуты.
Вышеописанный протокол повторили для каждой аминокислоты таким образом, чтобы получить аналоги десмопрессина согласно настоящему изобретению.
2. Экстракция
Пептиды, синтезированные согласно предыдущей процедуре, отделили от смолы метилбензилгидриламина согласно следующему протоколу:
1. Пептидную связь со смолой из предыдущей процедуры подвергли действию фтористоводородной кислоты в присутствии анизола при 0°С в течение 1 часа, чтобы отделить указанный пептид от смолы.
2. Фтористоводородную кислоту удалили из реакционной смеси потоком азота при 0°С в течение 1 часа.
3. Смолу и пептид с предыдущей операции дважды промыли диэтиловым эфиром.
4. Пептид экстрагировали из реакционной смеси с предыдущей операции 10% раствором уксусной кислоты. Процесс повторили дважды.
5. Экстрагирующие растворы с предыдущей операции, содержащие пептид, лиофилизировали.
6. Пептид хранили в атмосфере азота.
Вышеописанный протокол повторили для каждого пептида согласно настоящему изобретению.
3. Очистка
Пептиды, полученные согласно предыдущей процедуре, очистили с помощью обращенно-фазной высокоэффективной жидкостной хроматографии, используя колонку C18. В качестве растворителей использовали: а) водный раствор, содержащий 0,1% трифторуксусной кислоты и б) раствор ацетонитрила, содержащий 0,1% трифторуксусной кислоты. После очистки согласно данной процедуре пептиды лиофилизировали.
Вышеописанный протокол повторили для каждого пептида согласно настоящему изобретению.
4. Образование дисульфидной связи
Линеаризованные пептиды, полученные согласно предыдущей процедуре, растворили в воде до получения начального реакционного раствора с концентрацией 5 мг/мл. В реакционный раствор медленно добавили 1М раствор NH4НСО3 до получения слабо щелочной концентрации с рН 7,5. Затем в реакционный раствор при легком перемешивании добавили 1,5% раствор Н2O2. Полученный реакционный раствор периодически анализировали с помощью масс-спектроскопии, чтобы определить степень образования дисульфидных связей. После образования дисульфидных связей кислотность реакционного раствора изменили до рН 4 с помощью СН3СООН. Пептиды с дисульфидными связями, полученные в результате этой процедуры, очистили способом обращенно-фазной высокоэффективной жидкостной хроматографии.
Вышеописанный протокол повторили для каждого пептида согласно настоящему изобретению.
Пример 1
Аналоги 1-дезамино-8-D-аргинилвазопрессина без дисульфидных связей между позициями 1 и 6
В соответствии с общими процедурами 1, 2 и 3 синтезировали следующие аналоги десмопрессина:
1) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аланил-L-аспарагил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ala-Asn-Cys-Pro-D-Arg-Gly-NH2
2) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аланил-L-глутамил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ala-Gln-Cys-Pro-D-Arg-Gly-NH2
3) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аланил-L-изолейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ala-Ile-Cys-Pro-D-Arg-Gly-NH2
4) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аланил-L-лейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ala-Leu-Cys-Pro-D-Arg-Gly-NH2
5) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аланил-L-валил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ala-Val-Cys-Pro-D-Arg-Gly-NH2
6) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аспарагил-L-аспарагил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Asn-Asn-Cys-Pro-D-Arg-Gly-NH2
7) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аспарагил-L-глутаминил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Asn-Gln-Cys-Pro-D-Arg-Gly-NH2
8) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аспарагил-L-изолейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Asn-Ile-Cys-Pro-D-Arg-Gly-NH2
9) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аспарагил-L-лейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Asn-Leu-Cys-Pro-D-Arg-Gly-NH2
10) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-аспарагил-L-валил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Asn-Val-Cys-Pro-D-Arg-Gly-NH2
11) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-глутаминил-L-аспарагил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Gln-Asp-Cys-Pro-D-Arg-Gly-NH2
12) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-глутаминил-L-глутаминил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Gln-Gln-Cys-Pro-D-Arg-Gly-NH2
13) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-глутаминил-L-изолейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Gln-Ile-Cys-Pro-D-Arg-Gly-NH2
14) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-глутаминил-L-лейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Gln-Leu-Cys-Pro-D-Arg-Gly-NH2
15) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-глутаминил-L-валил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Gln-Val-Cys-Pro-D-Arg-Gly-NH2
16) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-изолейцил-L-аспарагил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ile-Asn-Cys-Pro-D-Arg-Gly-NH2
17) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-изолейцил-L-глутаминил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ile-Gln-Cys-Pro-D-Arg-Gly-NH2
18) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-изолейцил-L-изолейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ile-Ile-Cys-Pro-D-Arg-Gly-NH2
19) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-изолейцил-L-лейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ile-Leu-Cys-Pro-D-Arg-Gly-NH2
20) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-изолейцил-L-валил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Ile-Val-Cys-Pro-D-Arg-Gly-NH2
21) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-лейцил-L-аспарагил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Leu-Asn-Cys-Pro-D-Arg-Gly-NH2
22) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-лейцил-L-глутаминил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Leu-Gln-Cys-Pro-D-Arg-Gly-NH2
23) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-лейцил-L-изолейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Leu-Ile-Cys-Pro-D-Arg-Gly-NH2
24) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-лейцил-L-лейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Leu-Leu-Cys-Pro-D-Arg-Gly-NH2
25) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-лейцил-L-валил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Leu-Val-Cys-Pro-D-Arg-Gly-NH2
26) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-валил-L-аспарагил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Val-Asn-Cys-Pro-D-Arg-Gly-NH2
27) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-валил-L-глутаминил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Val-Gln-Cys-Pro-D-Arg-Gly-NH2
28) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-валил-L-изолейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Val-Ile-Cys-Pro-D-Arg-Gly-NH2
29) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-валил-L-лейцил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Val-Leu-Cys-Pro-D-Arg-Gly-NH2
30) 3-меркаптопропионил-L-тирозил-L-фенилаланил-L-валил-L-валил-L-цистеил-L-пропил-D-аргил-L-глицинамид:
Mpa-Tyr-Phe-Val-Val-Cys-Pro-D-Arg-Gly-NH2
Пример 2
Аналоги 1-дезамин-8-D-аргинилвазопрессина с дисульфидными связями между позициями 1 и 6
В соответствии с общими процедурами 1, 2, 3 и 4 синтезировали следующие аналоги десмопрессина:
1) 1-(3-меркаптопропионовая кислота)-4-L-аланил-5-L-аспарагил-8-D-аргинилвазопрессин:
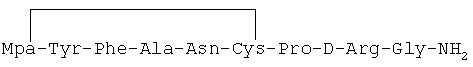
2) 1-(3-меркаптопропионовая кислота)-4-L-аланил-5-L-глутаминил-8-D-аргинилвазопрессин:
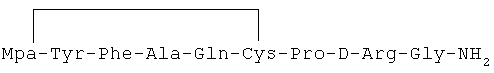
3) 1-(3-меркаптопропионовая кислота)-4-L-аланил-5-L-изолейцил-8-D-аргинилвазопрессин:
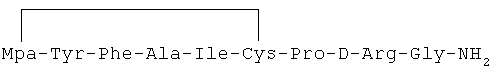
4) 1-(3-меркаптопропионовая кислота)-4-L-аланил-5-L-лейцил-8-D-аргинилвазопрессин:
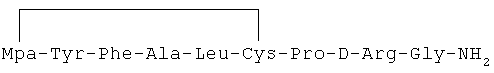
5) 1-(3-меркаптопропионовая кислота)-4-L-аланил-5-L-валил-8-D-аргинилвазопрессин:
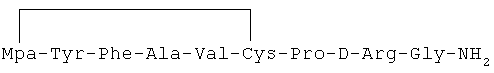
6) 1-(3-меркаптопропионовая кислота)-4-L-аспарагил-5-L-аспарагил-8-D-аргинилвазопрессин:
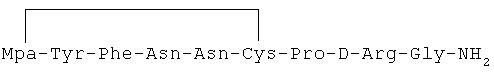
7) 1-(3-меркаптопропионовая кислота)-4-L-аспарагил-5-L-глутаминил-8-D-аргинилвазопрессин:
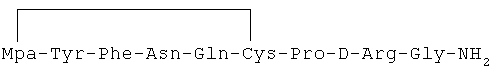
8) 1-(3-меркаптопропионовая кислота)-4-L-аспарагил-5-L-изолейцил-8-D-аргинилвазопрессин:
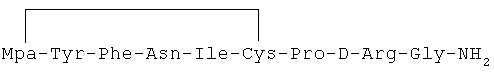
9) 1-(3-меркаптопропионовая кислота)-4-L-аспарагил-5-L-лейцил-8-D-аргинилвазопрессин:
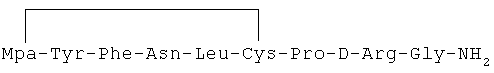
10) 1-(3-меркаптопропионовая кислота)-4-L-аспарагил-5-L-валил-8-D-аргинилвазопрессин:
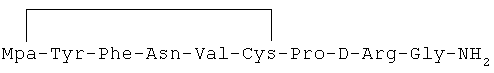
11) 1-(3-меркаптопропионовая кислота)-4-L-глутаминил-5-L-глутаминил-8-D-аргинилвазопрессин:
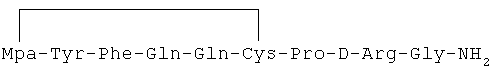
12) 1-(3-меркаптопропионовая кислота)-4-L-глутаминил-5-L-изолейцил-8-D-аргинилвазопрессин:
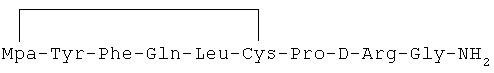
13) 1-(3-меркаптопропионовая кислота)-4-L-глутаминил-5-L-лейцил-8-D-аргинилвазопрессин:
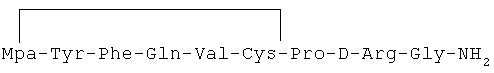
14) 1-(3-меркаптопропионовая кислота)-4-L-глутаминил-5-L-валил-8-D-аргинилвазопрессин:
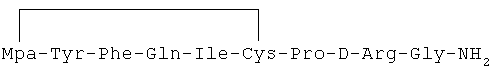
15) 1-(3-меркаптопропионовая кислота)-4-L-изолейцил-5-L-аспарагил-8-D-аргинилвазопрессин:
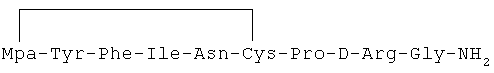
16) 1-(3-меркаптопропионовая кислота)-4-L-изолейцил-5-L-глутаминил-8-D-аргинилвазопрессин:
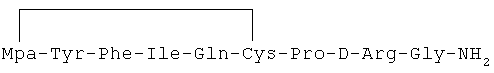
17) 1-(3-меркаптопропионовая кислота)-4-L-изолейцил-5-L-изолейцил-8-D-аргинилвазопрессин:
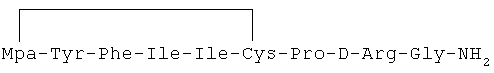
18) 1-(3-меркаптопропионовая кислота)-4-L-изолейцил-5-L-лейцил-8-D-аргинилвазопрессин:
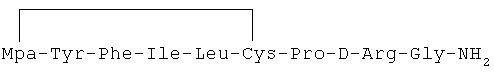
19) 1-(3-меркаптопропионовая кислота)-4-L-изолейцил-5-L-валил-8-D-аргинилвазопрессин:
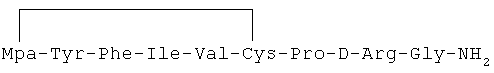
20) 1-(3-меркаптопропионовая кислота)-4-L-лейцил-5-L-аспарагил-8-D-аргинилвазопрессин:
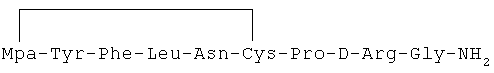
21) 1-(3-меркаптопропионовая кислота)-4-L-лейцил-5-L-глутаминил-8-D-аргинилвазопрессин:
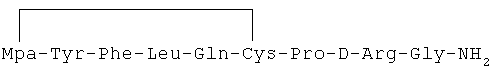
22) 1-(3-меркаптопропионовая кислота)-4-L-лейцил-5-L-изолейцил-8-D-аргинилвазопрессин:
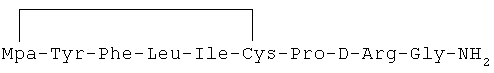
23) 1-(3-меркаптопропионовая кислота)-4-L-лейцил-5-L-лейцил-8-D-аргинилвазопрессин:
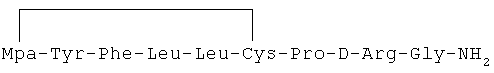
24) 1-(3-меркаптопропионовая кислота)-4-L-лейцил-5-L-валил-8-D-аргинилвазопрессин:
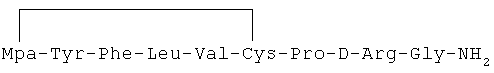
25) 1-(3-меркаптопропионовая кислота)-4-L-валил-5-L-аспарагил-8-D-аргинилвазопрессин:
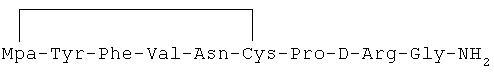
26) 1-(3-меркаптопропионовая кислота)-4-L-валил-5-L-глутаминил-8-D-аргинилвазопрессин:
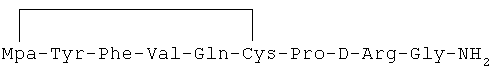
27) 1-(3-меркаптопропионовая кислота)-4-L-валил-5-L-изолейцил-8-D-аргинилвазопрессин:
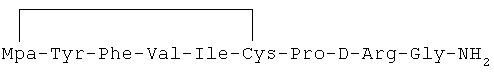
28) 1-(3-меркаптопропионовая кислота)-4-L-валил-5-L-лейцил-8-D-аргинилвазопрессин:
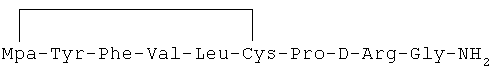
29) 1-(3-меркаптопропионовая кислота)-4-L-валил-5-L-валил-8-D-аргинилвазопрессин:
Настоящее изобретение описано с некоторыми подробностями и приведенными примерами, способствующими его пониманию и воспроизводимости. Специалисты могут внести определенные изменения в форму и детали без отклонения от истинной задачи и области распространения изобретения согласно формуле настоящего изобретения. Все цитируемые публикации полностью включаются в данное описание изобретения в качестве ссылки.
Пример 1
Антиметастатическое действие линейного аналога 1-дезамино-8-D-аргинилвазопрессина, описанного в примере 1-(2) описания изобретения и имеющего формулу Mpa-Tyr-Phe-Ala-Gln-Cys-Pro-D-Arg-Gly-NH2
Для проведения данного исследования использовали клеточную линию F3II (инвазивная метастатическая карцинома), изогенная мышам линии Balb/c. Клетки культивировали в монослое на питательной среде МЕМ в присутствии 15% эмбриональной бычьей сыворотки. Перед инокуляцией in vivo клетки снимали трипсином. Группу из 10 мышей в возрасте 10-16 недель инокулировали жизнеспособными опухолевыми клеткам в количестве 1-2×105 в объеме 0.3 мл MEM на мышь путем введения в боковую вену хвоста. Мышам вводили линейный пептидный аналог формулы Mpa-Tyr-Phe-Ala-Gln-Cys-Pro-D-Arg-Gly-NH2.
Две дозы линейного пептида в количестве 2 мкг/кг тела в физиологическом растворе вводили внутривенно. Первую дозу вводили совместно с опухолевыми клетками, в то время как вторую дозу вводили спустя 24 часа. Контрольная группа получила внутривенно только физиологический раствор. Спустя три недели после инокуляции животных умерщвляли путем сворачивания шеи и проводили полную аутопсию. Легкие фиксировали в растворе Буэна и число метастатических узелков определяли под препаровальной лупой. Результаты показаны в таблице I. Введение указанного линейного пептида уменьшило образование метастатических узелков в легких использованных животных приблизительно на 70%.
Пример 2
In vitro антиангиогенное действие циклического аналога 1-дезамино-8-D-аргинилвазопрессина, описанного в примере 2-(26) описания изобретения и имеющего формулу
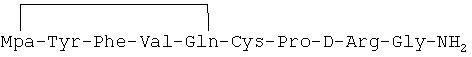
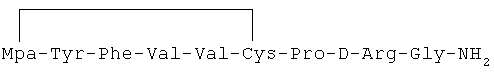
Культуру клеток эндотелия капилляров человека (HMVEC) выращивали на искусственной базальной мембране, на среде M191 в присутствии специфичного фактора роста и 2% эмбриональной бычьей сыворотки и подвергали воздействию пептидного циклического аналога формулы
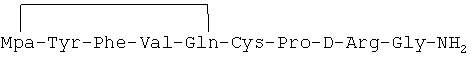
Через 20 часов эндотелиальные трубочки, выращенные как в присутствии, так и в отсутствии 1 мкМ указанного циклического пептида, фотографировали при 100-кратном увеличении с помощью инвертированного фазово-контрастного микроскопа и подсчитывали бифуркации сосудов.
Как показано в Таблице II, воздействие циклического пептида способно уменьшить образование сосудистых каналов на 43%.
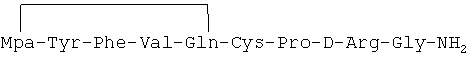
Пример 3
In vitro противораковое действие циклического аналога 1-дезамино-8-D-аргинилвазопрессина, описанного в примере 2-(2) описания изобретения и имеющего формулу
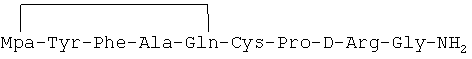
Культуру клеток карциномы молочной железы человека линии MCF-7 выращивали на питательной среде D-MEM в присутствии 10% эмбриональной бычьей сыворотки, и подвергали воздействию пептидного циклического аналога с формулой
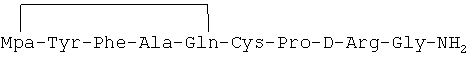
Через 20 часов клетки, выращенные как в присутствии, так и в отсутствии 1 мкМ циклического пептида, фиксировали в формалине, окрашивали толуидиновым синим, тщательно промывали фосфатным буфером и лизировали 1% ДСН (додецилсульфат натрия). Массу клеток определяли спектрофотометрически при длине волны 595 нм.
Как показано в Таблице III, воздействие циклического пептида способно уменьшить рост клеток карциномы молочной железы человека на 24%.
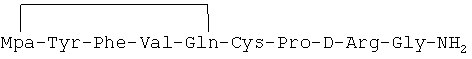
Пример синтеза 1
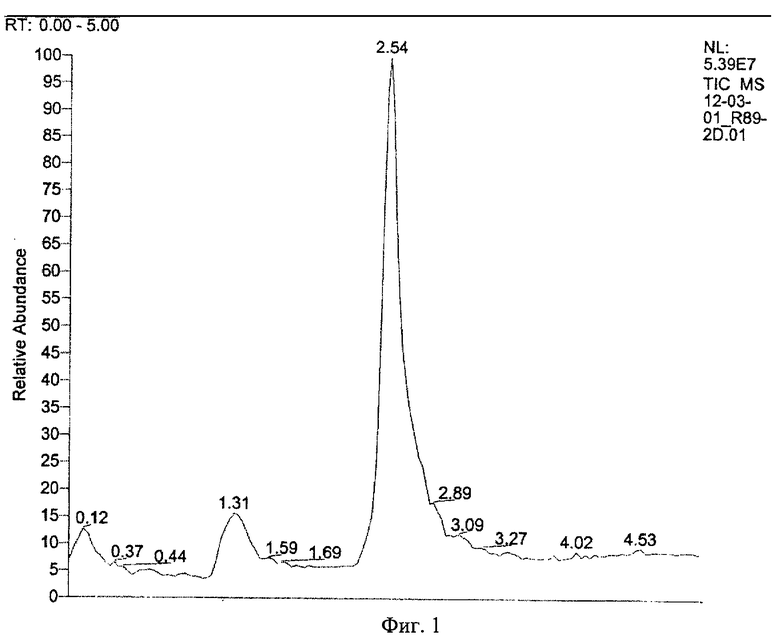
Пептид, синтезированный согласно примеру 1-(2) описания изобретения, очистили и определили его количество с помощью метода обращенно-фазной высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) при помощи хроматографа Shimadzu Prominence (Shimadzu Scientific Instruments Inc), градиента вода/ацетонитрил в соотношении 20/80 в 0.1% растворе трифторуксусной кислоты и колонки С18 Ultrasphere (Beckman) (4.6 мм×25 см). Оценку количества готового пептида проводили с использованием 1 мг/мл коммерчески доступного стандарта Десмопрессина. Пептид идентифицировали с помощью методов масс-спектрометрии с электронной ионизацией аэрозоля (ESI-MS) при помощи спектрометра Thermo Finnigan LCQ Duo (Thermo Electron Corp).
Линейный пептидный аналог, описанный в примере 1-(2), был идентифицирован как имеющий формулу:
Mpa-Tyr-Phe-Ala-Gln-Cys-Pro-D-Arg-Gly-NH2
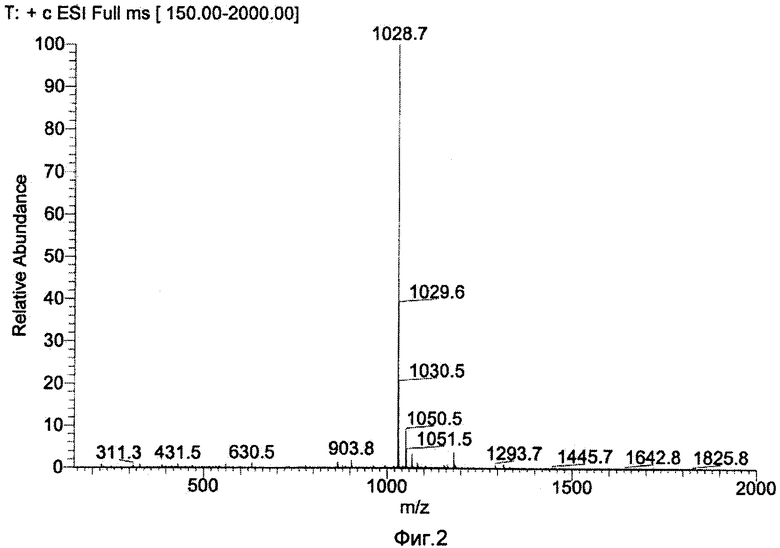
Масс-анализ (М+Н): 1028.7
Синтезированное количество: 1 мг
Результаты показаны на Фиг.1 и 2.
Пример синтеза 2
Пептид, синтезированный согласно примеру 2-(26) описания изобретения, очистили и определили его количество с помощью метода обращенно-фазной высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) при помощи хроматографа Shimadzu Prominence (Shimadzu Scientific Instruments Inc), градиента вода/ацетонитрил в соотношении 20/80 в 0.1% растворе трифторуксусной кислоты и колонки С18 Ultrasphere (Beckman) (4.6 мм×25 см). Оценка количества готового пептида было проведена с использованием 1 мг/мл коммерчески доступного стандарта Десмопрессина. Пептид идентифицировали с помощью методов масс-спектрометрии с электронной ионизацией аэрозоля (ESI-MS) при помощи спектрометра Thermo Finnigan LCQ Duo (Thermo Electron Corp).
Циклический пептидный аналог, описанный в примере 2-(26), был идентифицирован как имеющий формулу:
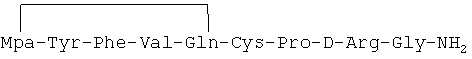
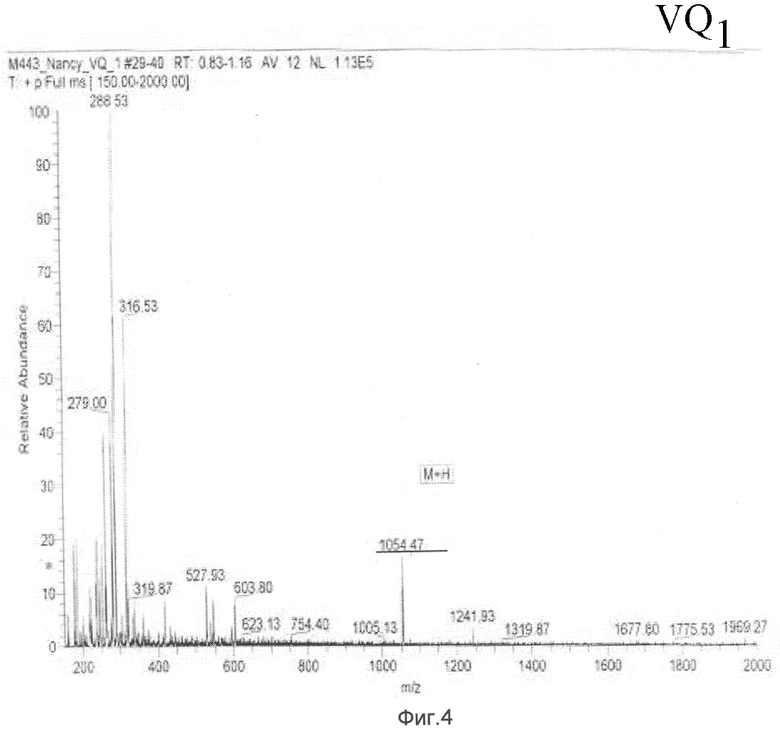
Масс-анализ (М+Н): 1054.5
Синтезированное количество: 25 мг
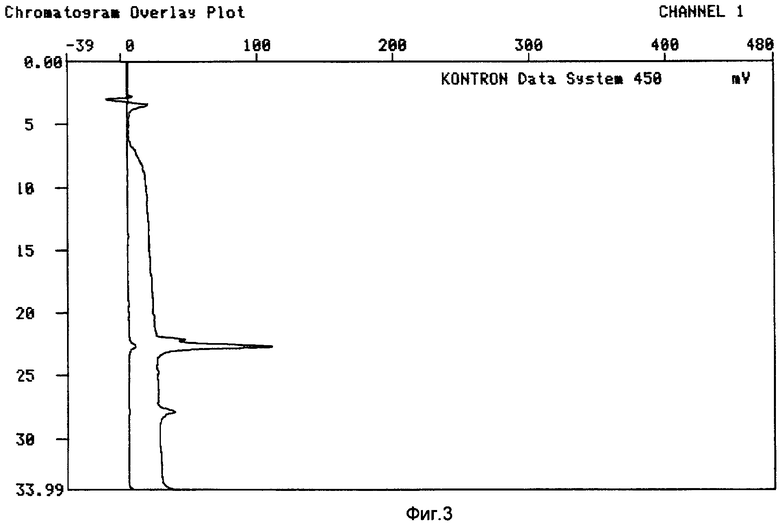
Результаты показаны на Фиг.3 и 4.
Пример синтеза 3
Пептид, синтезированный согласно примеру 2-(2) описания изобретения, очистили и определили его количество с помощью метода обращенно-фазной высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) при помощи: хроматографа Shimadzu Prominence (Shimadzu Scientific Instruments Inc), градиента вода/ацетонитрил в соотношении 20/80 в 0.1% растворе трифторуксусной кислоты и колонки С18 Ultrasphere (Beckman) (4.6 мм×25 см). Оценка количества готового пептида было проведена с использованием 1 мг/мл коммерчески доступного стандарта Десмопрессина. Пептид идентифицировали с помощью методов масс-спектрометрии с электронной ионизацией аэрозоля (ESI-MS) при помощи спектрометра Thermo Finnigan LCQ Duo (Thermo Electron Corp).
Циклический пептидный аналог, описанный в примере 2-(2), был идентифицирован как имеющий формулу:
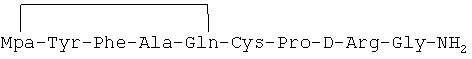
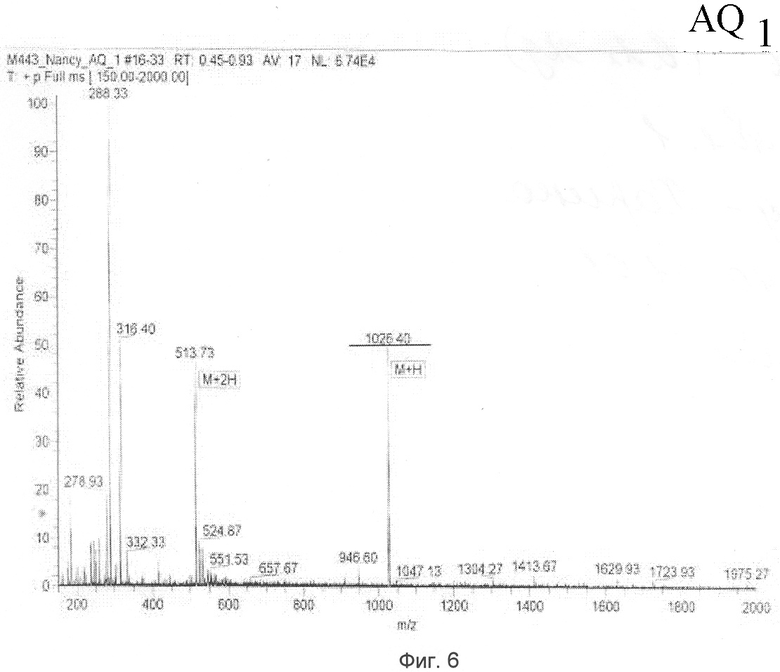
Масс-анализ (М+Н): 1026.4
Синтезированное количество: 42 мг
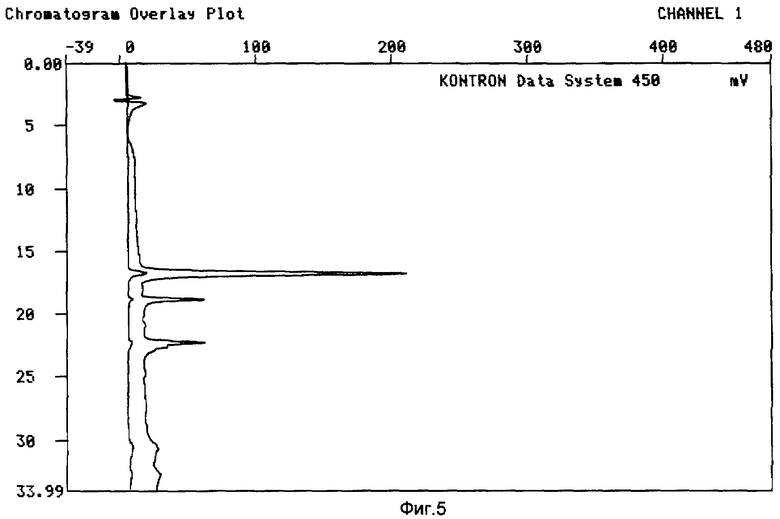
Результаты показаны на Фиг.5 и 6.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАЩИЩЕННЫЕ ПРОИЗВОДНЫЕ ВАЗОПРЕССИНА | 1997 |
|
RU2123498C1 |
| Новые производные оксинтомодулина и содержащая их фармацевтическая композиция для лечения ожирения | 2012 |
|
RU2739209C2 |
| Фармацевтическая композиция, содержащая инсулин и глюкагон | 2019 |
|
RU2823246C2 |
| ЗАЩИЩЕННЫЕ ПРОИЗВОДНЫЕ ОКСИТОЦИНА | 1997 |
|
RU2125062C1 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ КОНЪЮГАТА ТРОЙНОГО АГОНИСТА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ, ОБЛАДАЮЩЕГО АКТИВНОСТЯМИ В ОТНОШЕНИИ ВСЕХ ИЗ РЕЦЕПТОРОВ ГЛЮКАГОНА /GLP-1/GIP, ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ЛЕГКОГО | 2020 |
|
RU2829342C1 |
| ВАРИАНТЫ FC-ОБЛАСТИ С ИЗМЕНЕННЫМ СВЯЗЫВАНИЕМ С НЕОНАТАЛЬНЫМ FC-РЕЦЕПТОРОМ (FCRN) ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2830231C2 |
| СПОСОБ ВВЕДЕНИЯ МОЛЕКУЛ GLP-1 | 2003 |
|
RU2332229C2 |
| Терапевтическое применение глюкагона и включающей его комбинации | 2019 |
|
RU2838895C2 |
| МУТАНТЫ ГЕМАГГЛЮТИНИНА ВИРУСА ГРИППА | 2019 |
|
RU2809237C2 |
| АНАЛОГИ ИНСУЛИНА, ХАРАКТЕРИЗУЮЩИЕСЯ СНИЖЕННОЙ АФФИННОСТЬЮ СВЯЗЫВАНИЯ С РЕЦЕПТОРАМИ ИНСУЛИНА | 2019 |
|
RU2816595C2 |
Предложены новые аналоги 1-дезамино-8-D-аргинилвазопрессина, имеющие следующую общую формулу: Mpa-Tyr-Phe-X-Y-Cys-Pro-D-Arg-Gly-NH2, где Мра представляет собой радикал 3-меркаптопропионовой кислоты с формулой SH-CH2-CH2-COOH; X представляет собой аминокислоту из группы, включающей аланин, аспарагин, глутамин, изолейцин, лейцин и валин, a Y представляет собой аминокислоту из группы, включающей глутамин, изолейцин, лейцин и валин. Аналоги 1-дезамино-8-D-аргинилвазопрессина, имеющие следующую общую формулу:
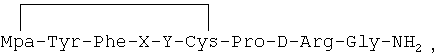 где Мра представляет собой радикал 3-меркаптопропионовой кислоты с формулой SH-CH2-CH2-СООН; X представляет собой аминокислоту из группы, включающей аланин, аспарагин, глутамин, изолейцин, лейцин и валин, a Y представляет собой аминокислоту из группы, включающей глутамин, изолейцин, лейцин и валин. 2 н. и 12 з.п. ф-лы, 6 ил., 3 табл.
где Мра представляет собой радикал 3-меркаптопропионовой кислоты с формулой SH-CH2-CH2-СООН; X представляет собой аминокислоту из группы, включающей аланин, аспарагин, глутамин, изолейцин, лейцин и валин, a Y представляет собой аминокислоту из группы, включающей глутамин, изолейцин, лейцин и валин. 2 н. и 12 з.п. ф-лы, 6 ил., 3 табл.
Mpa-Tyr-Phe-X-Y-Cys-Pro-D-Arg-Gly-NH2,
где Мра представляет собой радикал 3-меркаптопропионовой кислоты с формулой SH-CH2-CH2-COOH;
X представляет собой аминокислоту из группы, включающей аланин, аспарагин, глутамин, изолейцин, лейцин и валин, а
Y представляет собой аминокислоту из группы, включающей глутамин, изолейцин, лейцин и валин,
при условии, что:
если X представляет собой аспарагин или глутамин, то Y не является глутамином.
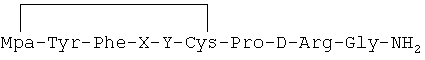
где Мра представляет собой радикал 3-меркаптопропионовой кислоты с формулой SH-CH2-CH2-COOH;
X представляет собой аминокислоту из группы, включающей аланин, аспарагин, глутамин, изолейцин, лейцин и валин, а
Y представляет собой аминокислоту из группы, включающей глутамин, изолейцин, лейцин и валин,
при условии, что:
если X представляет собой аспарагин или глутамин, то Y не является
глутамином.
Авторы
Даты
2008-07-27—Публикация
2003-12-29—Подача