Изобретение относится к синтетическим, химическим биологически активным веществам пиридинового ряда формулы I-II
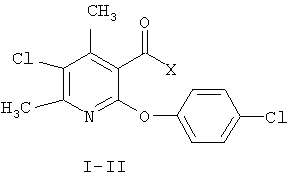
I Х-ОН;
II Х=4-хлорбензиламиноамино;
способным снижать фитотоксическое действие гербицида 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) на растениях подсолнечника (антидотам). Заявляемые соединения известны ранее (база STN №447432-63-5. 06.09.2002 и 442870-78-2, 07.08.2002 - соединения 1-2 соответственно), однако их антидотные свойства выявлены впервые.
Как известно, подсолнечник является чрезвычайно чувствительной культурой к гербицидам группы 2,4-Д, и, в случаях непреднамеренного попадания гербицида на его посевы, потери могут составлять, в зависимости от дозы, до 100% [Чкаников Д.И., Соколов М.С. Гербицидное действие 2,4-Д и других галоидфеноксикислот. - М.: Наука, 1973].
До сих пор защита вегетирующих растений подсолнечника от повреждающего действия 2,4-Д остается актуальной и нерешенной.
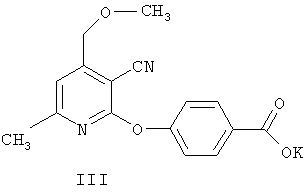
Наиболее близким аналогом по химической структуре заявляемых соединений является 4-(6-метил-4-метоксиметил-3-циано-2-пиридилокси)-бензоат калия, известный в качестве стимулятора прорастания семян пшеницы [«4-(6-Метил-4-метоксиметил-3-циано-2-пиридилокси)-бензоат калия, проявляющий рострегулирующую активность». Патент РФ №2220958 от 10.01.2004, заявка №2002120606 от 29.07.2002], формулы III
В качестве аналогов по свойствам известны N-замещенные 3-циано-4,6-диметил-5-хлорпиридил-2-сульфониламиды, наиболее активным из которых является соединение IV (прототип) [«N-Замещенные 3-циано-4,6-диметил-5-хлорпиридил-2-сульфониламиды в качестве антидотов гербицида 4-дихлорфеноксиуксусной кислоты на подсолнечнике» Патент РФ №2287273 от 20.11.2006, заявка №2005119555 от 23.06.2005]:
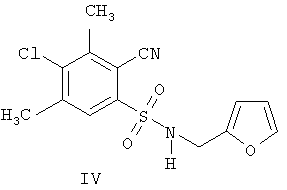
Недостатком N-замещенных 3-циано-4,6-диметил-5-хлорпиридил-2-сульфониламидов, в том числе и соединения IV, является то, что синтез полупродукта для их получения - 3-циано-4,6-диметил-5-хлорпиридил-2-сульфонилхлорида проводится с использованием сжиженного хлора, а следовательно, является опасным производством и требует специального аппаратурного оформления, что приводит к увеличению его стоимости.
Задачей настоящего изобретения является расширение арсенала биологически активных веществ, полученных синтетическим путем, для использования их в сельском хозяйстве в качестве средств, защищающих вегетирующие растения подсолнечника от повреждающего действия 2,4-Д (антидота). Это достигается обработкой поврежденных растений подсолнечника 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислотой I и ее N-4-хлор-бензиламидом II.
Синтез заявляемых соединений I-II осуществлялся по следующей схеме:
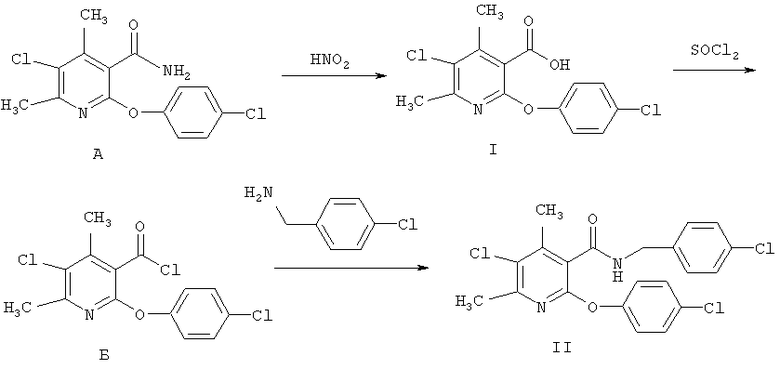
Исходный 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотинамид А диазотировали азотистой кислотой по известному методу Буво с образованием целевой 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты I [Вацуро К.В., Мищенко Г.Л. Именные реакции в органической химии. - М: Химия, 1976. - С.84]. Далее кислоту I переводили в соответствующий хлорангидрид Б кипячением с избытком тионилхлорида аналогично [Вейганд-Хильгетад. Методы эксперимента в органической химии: Пер. с англ. - М.: Химия, 1968. - С 232]. Взаимодействием хлорангидрида Б с бензиламином в присутствие триэтиламина в качестве акцептора хлороводорода синтезировали заявляемый N-4-хлорбензиламид 4,6-диметил-5-хлор-2-(4-хлорфенокси)-никотиновой кислоты II аналогично [Вейганд-Хильгетад. Методы эксперимента в органической химии: Пер. с англ. - М.: Химия, 1968. - С.431].
Изобретение иллюстрируется следующими примерами.
Пример 1. 4,6-Диметил-5-хлор-2-(4-хлорфенокси)никотиновая кислота (соединение I)
Нагревают 6,7 г (24,4 ммоль) амида 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты А с 28,0 мл серной кислоты (d=1,84) до полного растворения, затем охлаждают до 0°С и прибавляют по каплям раствор 3,9 г (56,5 ммоль) нитрита натрия в 20 мл H2O, поддерживая температуру реакционной массы не выше 0°С. Затем температуру повышают до комнатной и выдерживают реакционную массу при перемешивании 30-60 мин. Содержимое колбы выливают в 60 г измельченного льда, выделившийся осадок отфильтровывают, переосаждают из 10% раствора NaOH, сушат, получают 5,6 г (84%) целевого продукта I в виде бесцветного кристаллического вещества с т.пл.=133-134°С.
Найдено, %: С 53.52; Н 3.36; N 4.30; C14H11Cl2NO3;
Вычислено, %: С 53.87; Н 3.55; N 4.49.
Масс-спектр, m/z (относит. интенсивность): М+ 311 (43), 293 [М-Н2О]+ (88), 267 [М-CO2]+ (100), 232 [М-CI]+ (43), 156 [М-ОС6Н4-CI-4, -СО]+ (34), 127 [ОС6Н4-CI-4]+ (34), 111 [C6H4-CI]+ (32).
Пример 2. Хлорангидрид 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты (соединение Б)
Смесь из 3,0 г (10,8 ммоль) 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты I и 12,85 г (0,108 моль) тионилхлорида нагревают при температуре кипения до полного растворения осадка. Избыток тионилхлорида отгоняют под вакуумом. В остатке получают 3,2 г (97%) целевого продукта Б в виде густого масла.
Найдено, %: С 51.09; Н 3,54; N 2.98; N 4.51; С14Н10Cl3NO3;
Вычислено, %: С 50.86; Н 3.05; N 4.34.
Пример 3. Н-(4-хлорбензил)-4,6-диметил-5-хлор-2-(4-хлорфенокси)никотинамид (соединение II)
К раствору 0,47 г (1,47 ммоль) хлорангидрида 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты Б в 10 мл безводного бензола приливают раствор 0,22 г (1,56 ммоль) 4-хлорбензиламина и 0,14 г (1,42 ммоль) триэтиламина в 5 мл бензола и кипятят реакционную массу 1,5 ч. Отделенный от осадка гидрохлорида триэтиламина реакционный раствор упаривают досуха, остаток перекристаллизовывают из этилацетата, получают 0,57 г (82%) целевого продукта II в виде бесцветного порошка с т.пл=152-154°С.
Найдено, %: С 61.35; Н 3,44; N 9.96; С21Н15Cl2N3O2;
Вычислено, %: С 61.18; Н 3.67; N 10.19.
Масс-спектр, m/z (относит. интенсивность): M+ 434 (41), 294 [М-NHCH2C6H4CI-4]+ (100), 266 [294-СО]+ (33), 231 [266-CI]+ (12), 140 [NHCH2C6H4CI-4]+ (93), 125 [СН2С6Н4CI-4]+ (45).
Пример 4. Оценка соединений I-II на антидотную активность на проростках подсолнечника.
Проросшие семена подсолнечника с длиной зародышевого корешка 2-4 мм помещали на 1 ч в раствор 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) в концентрации 10-3% в расчете получения 40-60% ингибирования роста гипокотиле. После гербицидного воздействия проростки промывали водой и помещали в растворы испытываемых на антидотную активность веществ в концентрациях 10-2, 10-3, 10-4, 10-5% (вариант гербицид + антидот). Спустя 1 ч семена промывали водой и раскладывали на полосы фильтровальной бумаги (размер 10×75 см) по 20 шт., которые сворачивали в рулоны и помещали в стаканы с 50 мл воды. Дальнейшее проращивание семян проводили в термостате в течение 3 суток при температуре 28°С. Температура растворов и промывной воды 28°С.
Семена варианта «гербицид» (эталон сравнения) выдерживали 1 ч в растворе 2,4-Д в концентрации 10-3% и 1 ч в воде.
Семена контрольного варианта 2 часа выдерживали в воде.
Повторность опыта трехкратная. В каждой повторности использовали по 20 шт. семян.
Защитный (антидотный) эффект определяли по увеличению длины гипокотиля и корня в варианте гербицид + антидот относительно названных величин в варианте «гербицид» (эталон).
Статистическая обработка экспериментальных данных проведена с использованием t-критерия Стъюдента при Р=0,95.
Результаты исследований приведены в таблице.
Как видно из данных таблицы, применение на фоне воздействия гербицида предлагаемых в качестве антидотов 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты I ее N-4-хлорбензиламида II резко снижает токсическое действие гербицида.
Соединения I-II нивелировали отрицательное действие 2,4-Д на гипокотиле проростков подсолнечника на 29-54% при использовании в трех и более концентрациях, в то время как величина антидотного эффекта прототипа IV составляла 15-30%.
Соединения I-II снижали ингибирующее действие 2,4-Д на корни проростков на 41-50% также при использовании в четырех концентрациях, а прототип IV проявлял антидотный эффект на уровне 17-31%.
Соединение III, являющееся структурным аналогом продуктов I-II, проявляет низкую антидотную активность (8-11% по гипокотилю и 15-18% по корням).
Таким образом, применение заявляемых в качестве антидотов 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты I ее N-4-хлорбензиламида II позволяет эффективно защитить подсолнечник от отрицательного воздействия 2,4-Д, а также расширить ассортимент известных антидотов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ N-ЗАМЕЩЕННЫХ 3-ЦИАНО-4,6-ДИМЕТИЛ-5-ХЛОРПИРИДИЛ-2-СУЛЬФОНИЛАМИДОВ В КАЧЕСТВЕ АНТИДОТОВ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ НА ПОДСОЛНЕЧНИКЕ | 2005 |
|
RU2287273C1 |
| 4,6-ДИМЕТИЛ-2-ХЛОР-3-(5-Х-1,2,4-ОКСАДИАЗОЛИЛ-3)-ПИРИДИНЫ В КАЧЕСТВЕ АНТИДОТОВ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2008 |
|
RU2356900C1 |
| N-ЭТИЛ-(3`-ЦИАНО-4`-МЕТИЛ-6-ХЛОРПИРИДИЛ-2`)ЭТОКСИГИДРАЗОН В КАЧЕСТВЕ АНТИДОТА | 2005 |
|
RU2276664C1 |
| АНТИДОТЫ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2009 |
|
RU2430915C2 |
| 2-ТИОАЛКИЛПИРИДИНЫ И ТИЕНО[2,3-B]ПИРИДИНЫ-АНТИДОТЫ ГЕРБИЦИДА ГОРМОНАЛЬНОГО ДЕЙСТВИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2003 |
|
RU2232762C1 |
| АНТИДОТ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ НА ПОДСОЛНЕЧНИКЕ | 2013 |
|
RU2551166C2 |
| 3-Амино-4,6-диметил-N-(4-циано-3-(цианометил)-1H-пиразол-5-ил)тиено[2,3-b]пиридин-2-карбоксамиды в качестве антидотов 2,4-Д на подсолнечнике | 2024 |
|
RU2831200C1 |
| 2,3-ДИХЛОР-4-[(6-ХЛОР-5-ЦИАНО-4-МЕТИЛПИРИДИЛ-2)-МЕТИЛГИДРАЗОНО]-БУТЕН-2-ОВАЯ КИСЛОТА В КАЧЕСТВЕ АНТИДОТА 2,4-Д НА ПОДСОЛНЕЧНИКЕ | 2009 |
|
RU2426719C2 |
| Применение 2-хлор-N-(4-циано-3-цианометил-1Н-пиразол-5-ил)ацетамида в качестве антидота 2,4-Д на подсолнечнике | 2023 |
|
RU2810585C1 |
| АНТИДОТЫ ГЕРБИЦИДА 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ | 2009 |
|
RU2421992C1 |
Изобретение относится к применению 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты и ее N-4-хлорбензиламида I-II
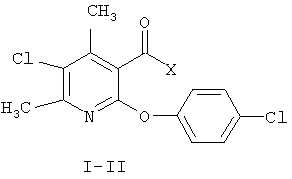 , где I Х=ОН; II Х=4-хлорбензиламиноамино;
, где I Х=ОН; II Х=4-хлорбензиламиноамино;
в качестве антидотов гербицида 2,4-дихлорфеноксиуксусной кислоты на подсолнечнике. 1 табл.
Применение 4,6-диметил-5-хлор-2-(4-хлорфенокси)никотиновой кислоты и ее N-4-хлорбензиламида I-II
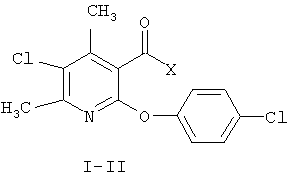
I Х - ОН;
II Х - 4-хлорбензиламиноамино;
в качестве антидотов гербицида 2,4-дихлорфеноксиуксусной кислоты на подсолнечнике.
| Устройство для правки цилиндрических изделий | 1973 |
|
SU442870A1 |
| Загрузочное устройство доменной печи | 1970 |
|
SU447432A1 |
Авторы
Даты
2008-08-27—Публикация
2006-12-18—Подача