Изобретение относится к медицине, а именно к офтальмологии и предназначено для имитации грибкового кератита у кроликов в экспериментальных условиях для последующего изучения патологического процесса и разработки способов его лечения.
Одной из причин роговичной слепоты во всем мире являются грибковые кератиты и язвы роговицы. Всего же, по примерным оценкам, ежегодно регистрируется около 1 миллиона случаев грибковых поражений роговицы. От 1% до 40% из которых приведут к слепоте [Бельская К.И., Обрубов А.С. Патогенез и клинические особенности течения грибковых кератитов (обзор литературы). Офтальмология. 2021; 18(1): 12-19; Mills B, Radhakrishnan N, Karthikeyan Rajapandian SG, Rameshkumar G, Lalitha P, Prajna NV. The role of fungi in fungal keratitis. Exp Eye Res. 2021 Jan; 202: 108372].
Клинически значимыми и чаще всего вызывающими грибковые поражения роговицы являются дрожжевые грибы рода Candida. Из группы плесневых грибов наиболее важны представители рода Fusarium, Aspergillus, Curvularia и Bipolaris [Mahendra Rai, Avinash P. Ingle, Indarchand Gupta, Pramod Ingle, Priti Paralikar, Marcelo Luís Occhiutto. Mycotic Keratitis: An Old Disease with Modern Nanotechnological Solutions. In: Rai, Mahendra. Mycotic keratitis. Boca Raton, FL: CRC Press, Taylor & Francis Group; 2018. 1-18].
На сегодняшний день грибковые кератиты изучены недостаточно и тяжело контролируются, поэтому для анализа механизмов заражения, патогенеза и выбора оптимального метода лечения, основанных на изучении клинической картины заболевания, требуется легко воспроизводимая экспериментальная модель кератомикоза, что в дальнейшем может способствовать более детальному изучению механизмов заражения, течения патологического процесса и разработке новых методик лечения.
Одна из основных проблем экспериментальной медицины - выбор вида животных, на которых будут проводиться исследования. Для изучения инфекционного процесса на глазах выбраны кролики породы Советская шиншилла.
В литературе описано немало аналогов, содержащих разнообразные способы моделирования грибкового кератита у экспериментальных животных.
Известен «Способ создания экспериментальной модели грибкового кератита у кроликов» (Патент RU №2746647 С1, МПК G09B 23/28 - 19.04.2021, Бюл. №1), который заключается в том, что под местной анестезией на роговицу накладывают смоченный в 5% спиртовом растворе Формалина стерильный диск из гемостатической губки, надевают мягкую контактную линзу на 24 часа, на следующий день снимают мягкую контактную линзу и диск гемостатической губки, на поверхность роговицы в течение 3 дней инстиллируют 0,1% раствор Дексаметазона 4 раза в сутки, на 3-й день под местной инфильтрационной анестезией производят скарификацию эпителия роговицы размером 10×10 мм, инстиллируют на роговицу 99% концентрат Димексида, далее производится обильное орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензией грибковых изолятов Fusarium spp., включающей фрагменты мицелия, на внутреннюю поверхность мягкой контактной линзы наносят 0,2-0,3 мл этой же суспензии, надевают мягкую контактную линзу на роговицу, в последующие дни через 1 день за 3-4 подхода производят дополнительное орошение роговицы, отодвинув мягкую контактную линзу, 99% концентратом Димексида, свежей клинической суспензией грибковых изолятов Fusarium spp. 106 КОЕ/мл. Данная методика позволяет произвести грибковый кератит у кроликов с минимализацией травмы у экспериментальных животных.
Недостаток данного метода - сложность при фиксации гемостатической губки под мягкую контактную линзу, кролики терли лапами глаза и постоянно скидывали линзу с глазной поверхности.
Известен «Способ моделирования грибкового кератита у кроликов» (Патент RU №2346338 С2, МПК G09B 23/28, A61F 9/00 - 10.02.2009, Бюл. №4). Производится скарификация эпителия всей поверхности роговицы, далее надевают на глаз предварительно инфицированную дрожжевыми грибами мягкую контактную линзу и сшивают веки на 3-8 суток. Заявленный метод позволял достичь клинической картины грибкового кератита с контролируемыми стадиями процесса.
Недостатком данного способа является его травматичность, так же такие задачи, как наличие хирургического навыка экспериментатора, необходимость специально оборудованного кабинета для оперативных вмешательств, проведение наркоза, усложняют создание модели грибкового кератита. Также нам не удалось достичь выраженной картины грибкового кератита по вышеописанной методике.
Аналогом метода является способ того же назначения, включающий моделирование грибкового кератита на кроликах посредством интракорнеального введения 0,1 мл клеточной взвеси грибков (2,5 × клеток/мл) [Schreiber, W., Olbrisch, A., Vorwerk, C., Koenig, W., Behrens-Baumann, W. Combined topical fluconazole and corticosteroid treatment for experimental Candida albicans keratomycosis. Investigative ophthalmology & visual science, 44(6): 2634-2643].
Методика индуцированного кератомикоза от группы исследователей из Китая обладает рядом преимуществ: обнаружена оптимальная концентрация грибковой суспензии в сравнительных исследованиях, путь заражения близок к естественному, однако требует применения недоступных контактных линз из парафильма [Zhu, Jiang-li et al. Experimental model of Fusarium solani keratitis in rats. International journal of ophthalmology. 2011; 4(4): 371-376.].
Модель лабораторного грибкового кератита, опубликованная в 2004 году, предусматривает внутрибрюшинное введение экспериментальным мышам Циклофосфамида в дозе 180 мг/кг массы тела за 5, 3 и 1 день до инстиляции инокулятов. Создавали поверхностную рану роговицы в виде сетки путем скарификации роговицы с помощью иглы для подкожных инъекций. Инстилировали 5 мкл инокулята Fusarium solani (10х3, 10х4, 10х5 КОЕ), далее массировали закрытые веки для распределния грибков. Через 3 дня получали клиническую картину кератомикоза [Tzu G. Wu, Victor V. Keasler, Bradley M. Mitchell, Kirk R. Wilhelmus, Immunosuppression Affects the Severity of Experimental Fusarium solani Keratitis. The Journal of Infectious Diseases, 2004; 190(1): 192-198].
Объединяющее преимущество всех методов заключается в заявленной авторами надежности воспроизведения методов. Однако не все способы легко применимы в осуществлении: для ряда исследовательских моделей необходимо оснащение экспериментальной операционной дорогостоящим микроскопом, в некоторых случаях применяются травматичные методики, как интрастромальные инъекции и тарзорафия. Мы, так же как и большинство исследователей, производили скарификацию эпителия роговицы и применяли контактные линзы. Как показала практика, для развития грибкового кератита у экспериментального животного обязательна предварительная подготовка микробиома, а именно локальное воссоздание искусственной имуносупрессии. По этой причине наша методика отличается однократным применением 5% спиртового раствора Формалина и инстиляций Дексаметазона на этапе подготовки к заражению, а также применением 99% концентрата Димексида в момент орошения роговицы кролика клинической суспензией Candida spp. Для приготовления инокулюма использованы чистые, 5 суточные культуры грибов Candida Albicans, выросшие на плотной питательной среде Сабуро. Инокулят предварительно растерт в ступке. В стерильном изотоническом растворе хлорида натрия приготовлена взвесь микроорганизмов с конечной плотностью 1,0×106 клеток/мл, что соответствует 0,5 MF (измерение денситометром согласно данным изготовителя стандартов мутности bioMerieux).
Задачей заявляемого изобретения является разработка малотравматичной достоверно воспроизводимой экспериментальной модели грибкового кератита у кроликов, позволяющий расширить возможности для исследования патологического процесса и разработки местного этиотропного лечения.
Техническим результатом заявленного изобретения является достоверно производимый грибковый кератит, вызванный клинической суспензией Candida spp., являющимся основным эндемичным этиологическим фактором кератомикозов.
Технический результат заявленного изобретения достигается за счет того, что в течение первых суток в конъюнктивальную полость и поверхность роговицы производится 5-ти разовая инстилляция 5% спиртового раствора Формалина, на следующий день в течение 3 дней инстиллируют 0,1% раствор Дексаметазона 5 раза в сутки, далее на 4-й день инстиллируют 2- 3 капли 99% концентрата Димексида, промывают роговицу и конъюнктивальную полость 0,1% раствором Дексаметазона, после чего под местной анестезией 0,4% Оксибупрокаина производят скарификацию эпителия роговицы размером 10×10 мм стерильным микрохирургическим лезвием, предварительно смоченным в 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., включающей фрагменты мицелия, затем производится обильное орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., на внутреннюю поверхность мягкой контактной линзы наносят 0,2-0,3 мл этой же суспензии, надевают мягкую контактную линзу на роговицу, в последующие дни через 1 день за 5-6 подходов производят дополнительное орошение роговицы, отодвинув мягкую контактную линзу, 99% концентратом Димексида, свежей клинической суспензией грибковых изолятов Candida spp. 106 КОЕ/мл, таким образом на 10-11-ый день получают грибковый кератит.
Преимуществом, обеспечиваемым приведенной совокупностью признаков, является достоверность воспроизведения, не инвазивные методы локальной подготовки, усиление результативности при помощи инстиляций медицинских растворов.
Детали, признаки, а также преимущества настоящего изобретения следует из нижеследующего описания реализации заявленного технического решения с использованием фигур, на которых показано:
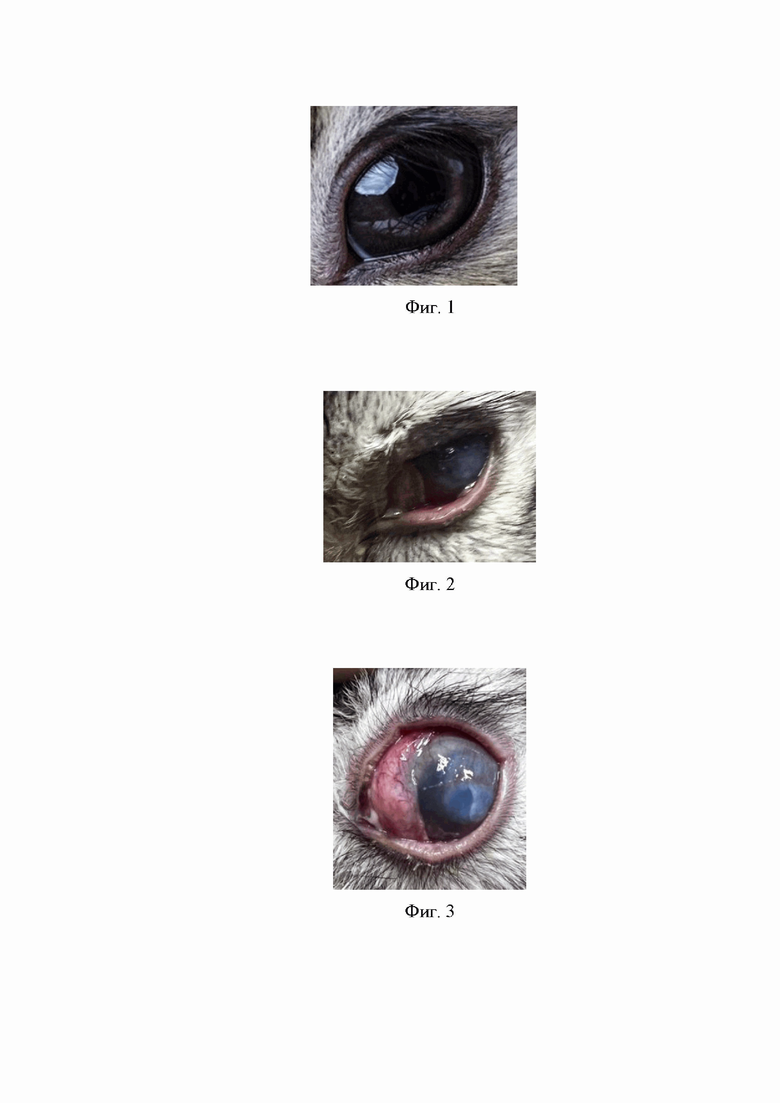
Фиг.1 - здоровая роговица испытуемого кролика перед началом экспериментального заражения;
Фиг.2 - результат после 5- разового закапывания 5% спиртового раствора Формалина в течение суток: смешанная инъекция сосудов конъюнктивы, обильное слизистое отделяемое, эпителиопатия, выраженный роговичный синдром;
Фиг.3 - стромальный кератит у кролика в результате экспериментального заражения роговицы кролика клинической суспензией грибковых изолятов Candida spp. по описанной методике.
Способ осуществляется следующим образом:
В 1-ые сутки в конъюнктивальную полость и на поверхность роговицы инстиллируют 5% спиртовый раствор Формалина, на 2-ые сутки в течение 3 дней инстиллируют 0,1% раствор Дексаметазона 5 раз в сутки. Далее на 4-й день инстиллируют 2-3 капли 99% концентрата Димексида, промывают роговицу и конъюнктивальную полость 0,1% раствором Дексаметазона, после чего под местной анестезией 0,4% Оксибупрокаина производят скарификацию эпителия роговицы размером 10×10 мм стерильным микрохирургическим лезвием, предварительно смоченным в 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., включающей фрагменты мицелия. После чего осуществляют орошение конъюнктивальной поверхности и роговицы 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., включающей фрагменты мицелия. Далее на внутреннюю поверхность мягкой контактной линзы наносят 0,2-0,3 мл этой же суспензии, надевают мягкую контактную линзу на роговицу. В последующие дни через 1 день за 5-6 подходов проводят дополнительные процедуры заражения роговицы, сняв мягкую контактную линзу, выполняют орошение 99% концентратом димексида, свежей клинической суспензией грибковых изолятов Candida spp. 106 КОЕ/мл.
В результате вышеописанных мероприятий на 10-11-ый день получают грибковый кератит.
Изобретение направлено на устранение вышеописанных недостатков и достоверное воспроизведение грибкового кератита с причинением меньших страданий экспериментальному животному.
Всего провели эксперимент на 15 кроликах.
Способ поясняется следующим экспериментальным примером.
Пример 1.
Кролик (Фиг.1), при стартовом культуральном исследовании мазков конъюнктивы и роговицы правого глаза выявлен Aspergillus flavus 101 КОЕ/мл, Penicillium expansum 102 КОЕ/мл, S. aureus 101 КОЕ/мл, Enterobacteriaceae 101 КОЕ/мл. Роговица инфицирована по описанной методике.
На 1-ый день в течение суток производится 5-ти разовая инстилляции 5% спиртового раствора формалина в конъюнктивальную полость и поверхность роговицы.
После обработки роговицы 5% спиртовым раствором формалина развилась клиническая картина химического ожога конъюнктивы и роговицы: смешанная инъекция сосудов конъюнктивы, обильное слизистое отделяемое, эпителиопатия, выраженный роговичный синдром (Фиг.2). Бактериологический и микологический посев мазка отделяемого конъюнктивальной полости, забранного в этот день, роста микрофлоры не выявил.
В течение последующих 3 дней производятся инстиляции 0,1% Дексаметазона 5 раз в сутки в исследуемый глаз. Далее на 4-й день инстилируется 2-3 капли 99% концентрата Димексида. Выжидается 20-30 минут для испарения лишнего объема лекарственных средств. Промывание роговицы и конъюнктивальной полости 0,1% раствором Дексаметазона, после чего под местной анестезией 0,4% Оксибупрокаина производят скарификацию эпителия роговицы размером 10×10 мм стерильным микрохирургическим лезвием, предварительно смоченным в 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., включающей фрагменты мицелия. После чего производится обильное орошение конъюнктивальной полости 106 КОЕ/мл клинической суспензии грибковых изолятов Candida spp., включающей фрагменты мицелия. На внутреннюю поверхность мягкой контактной линзы наносится 0,2-0,3 мл этой же суспензии. Мягкая контактная линза надевается на роговицу. Дополнительное орошение суспензией проводилось через 1 день в 5 подходов.
Результатом вышеописанного алгоритма явился кератит (Фиг.3).
Применение спиртового раствора Формалина позволяет полностью санировать конъюнктивальную полость экспериментальных животных, что подтверждено культуральными данными, получить химический ожог легкой степени и инициировать асептическое воспаление. Инстиляции Дексаметазона позволяют достичь местный иммунодефицит и предотвратить самостоятельную санацию условно-патогенного Candida spp. Применение Димексида при электронной микроскопии соскобов с роговицы показало повышение адгезии грибковой культуры к боуменовой оболочке и эпителию, что в результате повысило результативность контаминации. Отсутствие мягкой контактной линзы приводит к самопроизвольной санации даже при выполнении вышеописанных условий.
Таким образом, заявленная методика позволяет произвести грибковый кератит у кроликов с минимализацией травмы у экспериментальных животных, Формалин обеспечивает предварительное обеззараживание конъюнктивальной полости, дополнительное применение Дексаметазона подавляет защитные механизмы местного иммунитета, а Димексид способствует повышению адгезии мицелии грибов в клинической суспензии.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ создания экспериментальной модели грибкового кератоувеита у кроликов | 2021 |
|
RU2768476C1 |
| Способ создания экспериментальной модели грибкового кератита у кроликов | 2020 |
|
RU2746647C1 |
| Способ лечения грибковой язвы роговицы | 2021 |
|
RU2802388C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГРИБКОВОГО КЕРАТИТА У КРОЛИКОВ | 2007 |
|
RU2346338C1 |
| Лекарственное средство для лечения резистентного грибкового кератита и способ его применения | 2022 |
|
RU2790703C1 |
| Способ лечения грибкового кератита после сквозной кератопластики | 2022 |
|
RU2820070C2 |
| НОВАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 2010 |
|
RU2481100C2 |
| Лечение резистентного бактериального кератита с помощью мягкой контактной линзы на квантовых точках | 2023 |
|
RU2811935C1 |
| СПОСОБ ЛЕЧЕНИЯ ЯЗВ РОГОВИЦЫ СИНЕГНОЙНОЙ И ГОНОКОККОВОЙ ЭТИОЛОГИИ | 2006 |
|
RU2330633C1 |
| Способ раннего консервативного лечения ожогов роговицы легкой и средней степени | 2023 |
|
RU2811887C1 |
Изобретение относится к медицине, а именно к экспериментальной офтальмологии. В течение первых суток в конъюнктивальную полость и поверхность роговицы производят 5-разовую инстилляцию 5% спиртового раствора Формалинана. На следующий день в течение 3 дней инстиллируют 0,1% раствор Дексаметазона 5 раз в сутки. На 4-й день инстиллируют 2-3 капли 99% концентрата Димексида и промывают роговицу и конъюнктивальную полость 0,1% раствором Дексаметазона. После промывания под местной анестезией 0,4% Оксибупрокаина производят скарификацию эпителия роговицы размером 10×10 мм стерильным микрохирургическим лезвием, предварительно смоченным в 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., включающей фрагменты мицелия. Закончив скарификацию, производят орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., и на внутреннюю поверхность мягкой контактной линзы наносят 0,2-0,3 мл этой же суспензии. Мягкую контактную линзу надевают на роговицу и в последующие дни через 1 день за 5-6 подходов производят дополнительное орошение роговицы, отодвинув мягкую контактную линзу, 99% концентратом Димексида, клинической суспензией грибковых изолятов Candida spp. 106 КОЕ/мл. На 10-11-й день получают грибковый кератит. Способ позволяет малотравматично, достоверно и легко воспроизвести экспериментальную модель грибкового кератита, вызванного клинической суспензией Candida spp., у кроликов, что, в свою очередь, позволяет расширить возможности для исследования патологического процесса и разработки местного этиотропного лечения. 3 ил., 1 пр.
Способ моделирования грибкового кератита у кроликов, включающий скарификацию эпителия и применение мягкой контактной линзы, отличающийся тем, что в течение первых суток в конъюнктивальную полость и поверхность роговицы производят 5-разовую инстилляцию 5% спиртового раствора Формалина, на следующий день в течение 3 дней инстиллируют 0,1% раствор Дексаметазона 5 раз в сутки, далее на 4-й день инстиллируют 2-3 капли 99% концентрата Димексида, промывают роговицу и конъюнктивальную полость 0,1% раствором Дексаметазона, после чего под местной анестезией 0,4% Оксибупрокаина производят скарификацию эпителия роговицы размером 10×10 мм стерильным микрохирургическим лезвием, предварительно смоченным в 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., включающей фрагменты мицелия, затем производят орошение конъюнктивальной поверхности 106 КОЕ/мл клинической суспензией грибковых изолятов Candida spp., на внутреннюю поверхность мягкой контактной линзы наносят 0,2-0,3 мл этой же суспензии, надевают мягкую контактную линзу на роговицу, в последующие дни через 1 день за 5-6 подходов производят дополнительное орошение роговицы, отодвинув мягкую контактную линзу, 99% концентратом Димексида, клинической суспензией грибковых изолятов Candida spp. 106 КОЕ/мл, таким образом, на 10-11-й день получают грибковый кератит.
| Способ создания экспериментальной модели грибкового кератита у кроликов | 2020 |
|
RU2746647C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ГРИБКОВОГО КЕРАТИТА У КРОЛИКОВ | 2007 |
|
RU2346338C1 |
| СПОСОБ ЭКСПЕРИМЕНТАЛЬНОГО МОДЕЛИРОВАНИЯ БАКТЕРИАЛЬНОГО КЕРАТИТА | 2021 |
|
RU2764121C1 |
| KR 102193023 B1, 18.12.2020 | |||
| БОРОВКОВА К.Е | |||
| и др | |||
| Модели грибковых инфекций на животных / Лабораторные животные для научных исследований | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| - стр | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| КОЛЕСНИКОВА В.К., и др., Эффективность применения активаторов регенерации глазной поверхности при | |||
Авторы
Даты
2024-07-31—Публикация
2023-12-18—Подача