ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к 2-пиридил-замещенным имидазолам, которые являются ингибиторами рецептора I типа трансформирующего фактора роста-β (TGF-β) (ALK5) и/или рецептора I типа активина (ALK4), способам их получения, и к их применению в медицине, особенно при лечении и профилактике заболевания, опосредованного этими рецепторами.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
TGF-β обозначает семейство белков, TGF-β1, TGF-β2 и TGF-β3, которые являются плейотропными модуляторами клеточной пролиферации и дифференциации, процесса заживления раны, продукции внеклеточного матрикса и подавления иммунного ответа. Другими представителями этого надсемейства являются активины, ингибины, морфогенетические белки костей, факторы роста и дифференциации и ингибирующее вещество Мюллера.
TGF-β1 передает сигналы через две высоко гомологичные одиночные трансмембранные серин/треонин киназы, т.е. через рецепторы типа I (ALK5) и типа II TGF-β. После олигомеризации, индуцированной лигандом, рецептор II типа гиперфосфорилирует сериновые/треониновые остатки в области GS в ALK5, что приводит к активации ALK5 путем создания связывающего сайта для белков Smad. Активированный ALK5, в свою очередь, фосфорилирует белки Smad2 и Smad3 на C-концевом SSXS-мотиве, таким образом вызывая их диссоциацию из рецептора и образование гетеромерного комплекса со Smad4. Комплексы Smad транслоцируются в ядро, ассоциируются со специфическими ДНК-связывающими кофакторами и комодуляторами, в конечном счете активируя транскрипцию компонентов внеклеточного матрикса и ингибиторов матрикс-разрушающих протеаз.
Активины передают сигналы способом, аналогичным способу TGF-β. Активины присоединяются к серин/троенин киназе, рецептору II типа активина (ActRIIB), и активированный рецептор II типа гиперфосфорилирует сериновые/треониновые остатки в области GS в ALK4. Активированный ALK4, в свою очередь, фосфорилирует Smad2 и Smad3. Последующее образование гетерокомплекса Smad со Smad4 приводит к активин-индуцируемому контролю транскрипции генов.
Многочисленные экспериментальные исследования на животных показали взаимосвязь между гломерулярной экспрессией TGF-β и фиброзом, включая Thy-1 модельпролиферирующего гломерулонефрита на крысах, анти-GBM гломерулонефрита на кроликах, и 5/6 модель нефректомии очагового сегментарного гломерулосклероза на крысах, как это недавно было описано в обзоре (например, Bitzer, M. et al., Kidney Blood Press. Res. 21:1-12 (1998)). Нейтрализация антител к TGF-β улучшает гломерулярную гистологию на Thy-1 модели нефрита (например, Border, W. A. et al., Nature 346: 371-374 (1990)).
Гипергликемические условия повышают количества м-РНК TGF-β и усиливают синтез белка как в мышиных проксимальных трубочковидных клетках, так и человеческих мезангиальных клетках (например, Wahab, N. A. et al., Biochem. J. 316:985-992 (1996); Rocco, M. V. et al., Kidney Int. 41: 107-114 (1992)). У больных диабетом с начальным расстройством почек обнаруживается повышенное накопление м-РНК TGF-β и белка в клубочках (например, Yoshioka, K. et al., Lab. Invest. 68: 154-163 (1993)). В почках с хроническим почечным интерстициальным фиброзом характерными признаками являются утолщение базальной мембраны трубочек и увеличение итерстициальной составляющей, с интерстициальным фиброзом, характеризующимся повышением концентрации коллагенов I, III, V, VII и фибронектина (например, Eddy, A. A, J. Am. Soc. Nephrol. 7: 2495-2508 (1996)).
Экспрессия гена TGF-β и продукция белка увеличиваются в случае различных животных моделей пневмофиброза, включая блеомициновую, силикагелевую, асбестовую и радиационную (например, Phan, S. H. и Kunkel, S. L, Exp. Lung Res. 18: 29-43 (1992); Williams, A. O. et al., Am. J. Pathol. 142: 1831-1840 (1993); Rube, C. E. et al., Int. J. Radial Oncol. Biol. Phys. 47: 1033-1042 (2000)). При человеческих легочных фиброзных заболеваниях наблюдалось сопутствующее увеличение белка TGF-β1 и повышение экспрессии гена коллагена в ткани, прилегающей к идиопатическому пневмофиброзу (например, Broekelmann, T. J. et al., Proc. Natl. Acad. Sci. USA 88:6642-6646 (1991)). Повышенная продукция TGF-β была описана у пациентов с саркоидозом, пневмокониозом, асбестовым пневмокониозом и радиационно-индуцированным фиброзом (например, Khalil, N. et al., Am. J. Respir. Cell. Mol. Biol. 14: 131-138 (1996); Jagirdar, J. et al., Environ. Health Perspect. 105: 1197-1203 (1997)). Антитела к TGF-β и растворимым рецепторам TGF-β могли частично ингибировать фиброз в блеомицин-индуцированном легочном фиброзена моделях грызунов (например, Giri, S. N. et al., Thorax 48: 959-966 (1993); Wang, Q. et al., Thorax 54: 805-812 (1999)). Полагают, что табачный дым является одним из наиболее важных факторов, которые могут вызывать небольшое заболевание дыхательных путей, с последующим развитием хронического обструктивного заболевания легких (COPD) (например, Wright, J. M. et al., Am. Rev. Respir. Dis. 146: 240-262 (1992)). COPD является медленно прогрессирующим и необратимым заболеванием, характеризующимся функциональной аномальностью обструкции дыхательных путей. По одной из гипотез, TGF-β участвует в перестройке дыхательных путей, обнаруживаемой при хронических воспалительных расстройствах дыхательных путей, таких как COPD (например, Takizawa, H. Int. J. Mol. Med. 1: 367-378 (1998); Ning, W. et al., Proc. Natl. Acad. Sci. USA 101:14895-14900 (2004)).
Звездчатые клетки печени (HSC) являются основным источником белков внеклеточного матрикса при печеночном фиброзе. Продукция внеклеточного матрикса активированными печеночными звездчатыми клетками значительно увеличивается при действии TGF-βl (например, Friedman, S. L, Prog. Liver Dis. 14: 101-130 (1996); Pietrangelo, A, Semin. Liver Dis. 16:13-30 (1996)). У трансгенных мышей, которые сверхэкспрессируют TGF-βl в печени, печеночный фиброз развивается так же, как и внепеченочные патологии, такие как почечный фиброз (например, Sanderson, N. et al., Proc. Natl. Acad. Sci. USA 92:2572-2576 (1995)).
TGF-βl и его рецепторы сверхэкспрессированы в травмированных кровяных сосудах и в фибропролиферирующих сосудистых повреждениях, что приводит к сверхпродукции внеклеточного матрикса (например, Saltis, J. et al., Clin. Exp. Pharmacol. Physiol. 23: 193-200 (1996); McCaffrey, T. A. et al., J. Clin. Invest. 96: 2667-2675 (1995)).
Антитела к TGF-β уменьшают образование шрамов и улучшают клеточную архитектуру новых слоев кожи у крыс (например, Shah, M, J. Cell. Sci. 108: 985-1002(1995)), улучшают заживление роговичных ран у кроликов (например, Moller-Pedersen, T, Curr. Eye Res. 17:736-747 (1998)) и ускоряют процесс заживления раны желудочных язв у крыс (например, Ernst, H, Gut 39: 172-175 (1996)).
Радиационный фиброз является частым следствием терапевтического или случайного радиационного переоблучения в нормальных человеческих тканях. TGF-βl играет центральную роль в инициации, развитии и устойчивости радиационного фиброза, как это недавно было описано в обзоре (например, Martin, M. et al., Int. J. Radiat Oncol. Biol. Phys. 47:277-290 (2000)).
Трансплантация органов осложняется во многих случаях хроническим отторжением и для некоторых органов, таких как почка, это является основной формой потери пересаженного органа. В случае больных людей хроническое отторжение трансплантантов легкого и почки связано с увеличенной экспрессией TGF-β в ткани (например, El-Gamel, A. et al., Eur. J. Cardiothorac. Surg. 13: 424-430 (1998); Shihab, F. S. et al., J. Am. Soc. Nephrol. 6:286-294 (1995)).
TGF-β участвует в образовании перитонеальных спайек (например, Saed, G. M. et al., Wound Repair Regeneration 7: 504-510 (1999)). Перитонеальные и подкожные фибротические спайки могут быть предотвращены ингибиторами ALK5 и/или ALK4.
Опухолевые клетки и стромальные клетки в опухолях на последних стадиях различных видов рака обычно сверхэкспрессируют TGF-β. Это ведет к стимуляции ангиогенеза и клеточной подвижности, подавлению имунной системы и к повышенному взаимодействию опухолевых клеток с внеклеточным матриксом (например, Hojo, M. et al., Nature 397: 530-534 (1999)). Следовательно, опухолевые клетки становятся более инвазивными и метастазируют в отдаленные органы (например, Maehara, Y. et al., J. Clin. Oncol. 17: 607-614 (1999); Picon, A. et al., Cancer Epidemiol. Biomarkers Prev. 7:497-504 (1998)).
Профибринолизин-активирующий ингибитор-1 (PAI-1) является основным физиологическим ингибитором как профибринолизин-активатора тканевого типа, так и профибринолизин-активатора урокиназного типа. Повышенные уровни PAI-1 связаны с тромбообразованием и сосудистыми расстройствами, предполагающими, что высокий уровень PAI-1 в плазме может вызывать состояние гиперкоагуляции путем нарушения естественного баланса между фибринолизом и коагуляцией (например, Vaughan, D. E., J. Invest. Med. 46: 370-376 (1998)). Известно, что TGF-β стимулирует экспрессию PAI-1 (например, Dennler, S. et al., EMBO J. 17: 3091-3100 (1998)). Соответственно, ингибирование продукции PAI-1 с помощью ингибитора пути передачи сигнала TGF-β может привести к новой фибринолитической терапии.
Передача сигнала активина и сверхэкспрессия активина связана с патологическими расстройствами, которые включают в себя аккумуляцию внеклеточного матрикса и фиброз (например, Matsuse, T. et al., Am. J. Respir. Cell Mol. Biol. 13:17-24 (1995); Inoue, S. et al., Biochem. Biophys. Res. Comm. 205:441-448 (1994); Matsuse, T. et al., Am. J. Pathol. 148:707-713 (1996); De Bleser et al., Hepatology 26:905-912 (1997); Pawlowski, J. E, et al., J. Clin. Invest. 100:639-648 (1997); Sugiyama, M. et al., Gastroenterology 114:550-558 (1998); Munz, B. et al., EMBO J. 18:5205-5215 (1999)), воспалительный отклик (например, Rosendahl, A. et al., Am. J. Respir. Cell Mol. Biol. 25:60-68 (2001), кахексию или истощение (Matzuk, M. M. et al., Proc. Natl. Acd. Sci. USA 91:8817-8821 (1994); Coerver, K. A. et al., Mol. Endocrinol. 10:534-543 (1996); Cipriano, S. C. et al., Endocrinology 141:2319-2327 (2000)), заболевания или патологические ответы центральной нервной системы (например, Logan, A. et al., Eur. J. Neurosci. 11:2367-2374 (1999); Logan, A. et al., Exp. Neurol. 159:504-510 (1999); Masliah, E. et al., Neurochem. Int. 39:393-400 (2001); De Groot, C. J. A. et al., J. Neuropathol. Exp. Neurol. 58:174-187 (1999); John, G. R. et al., Nat. Med. 8:1115-1121 (2002)) и гипертензию (например, Dahly, A. J. et al., Am. J. Physiol. Regul. Integr. Comp. Physiol. 283: R757-767 (2002)). Исследования показали, что TGF-β и активин могут действовать синергично, усиливая продукцию внеклеточного матрикса (например, Sugiyama, M. et al., Gastroenterology 114; 550-558 (1998)).
Следовательно, становится очевидно, что ингибирование ALK5 и/или ALK4-зависимого фосфорилирования Smad2 и Smad3 предпочтительными соединениями настоящего изобретения может использоваться для лечения и профилактики расстройства, включающего эти пути передачи сигнала.
В заявках WO 00/61576 и US 2003/0149277Al описаны производные триарилимидазолов и их применение в качестве ингибиторов ALK5. В WO 01/62756Al описаны производные пиридинилимидазола и их применение в качестве ингибиторов ALK5. В WO 02/055077Al описано применение производных имидазолил-циклических ацеталей в качестве ингибиторов ALK5. И также в WO 03/087304A2 описаны тризамещенные гетероарилы и их применение в качестве ингибиторов ALK5 и/или ALK4.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Сейчас неожиданно обнаружено, что класс 2-пиридил-замещенных имидазолов действует как мощные и селективные ингибиторы ALK5 и/или ALK4 и, следовательно, они могут использоваться при лечении и профилактике различных заболеваний, опосредованных ALK5 и/или ALK4, таких как гломерулонефрит, диабетическая нефропатия, нефрит при волчанке, нефропатия, индуцированная гипертензией, почечный интерстициальный фиброз, почечный фиброз, возникающий в результате осложнений при применении лекарств, ВИЧ-обусловленная нефропатия, трансплантантная некропатия, печеночный фиброз всех этиологий, печеночная дисфункция, связанная с различными инфекциями, гепатит, вызванный алкоголем, расстройства желчных протоков, пневмофиброз, острая легочная недостаточность, респираторный дистресс-синдром у взрослых, идиопатический пневмофиброз, хронический обструктивный легочный синдром, легочное заболевание, вызванное инфекционными или токсическими агентами, пост-инфарктный сердечный фиброз, застойная сердечная недостаточность, кардиомиопатия при дилатации, миокардит, сосудистый стеноз, рестеноз, атеросклероз, рубцевание хрусталика, рубцевание роговицы, пролиферирующая витреоретинопатия, образование избыточных или гипертрофических шрамов или келоидов на коже в процессе заживления раны, полученной при травматических или хирургических повреждениях, перитониальные и подкожные спайки, склеродермия, фибросклероз, прогрессирующий системный склероз, дерматомиозит, полимиозит, артрит, остеопороз, язвы, неврологическая дисфункция, эректильная дисфункция у мужчин, болезнь Альцгеймера, болезнь Рейно, фибротические разновидности рака, рост опухолевых метастазов, радиационно-индуцированный фиброз и тромбоз.
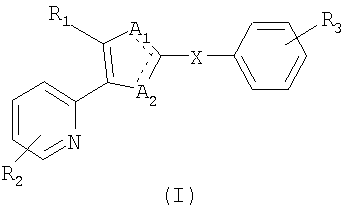
В варианте осуществления настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль:
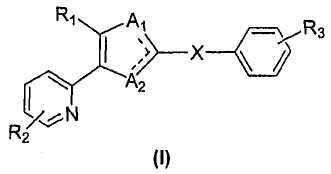
где R1 является нафтильной, антраценильной или фенильной группой, необязательно замещенной заместителями, выбранными из атома галогена, OH-группы, -O-C1-6-алкила, -S-C1-6-алкила, C1-6-алкила, C1-6-галогеналкила, -O-(CH2)n-Ph, -S-(CH2)n-Ph, циано-группы, фенила и CO2R, где R является водородом или C1-6-алкилом, а n равно 0, 1, 2 или 3; или R1 является фенилом или пиридилом, конденсированным с ароматическим или неароматическим 5-7-членным кольцом, где упомянутое кольцо может необязательно содержать до трех гетероатомов, независимо выбранных из N, O и S, и конденсированный фенил или пиридил может далее быть необязательно замещен атомом галогена, OH-группой, -O-C1-6-алкилом, -S-C1-6-алкилом, C1-6-алкилом, C1-6-галогеналкилом, циано-группой, фенилом или =О;
R2 является водородом, OH-группой, -O-C1-6-алкилом, -S-C1-6-алкилом, C1-6-алкилом, фенилом, C1-6-галогеналкилом, NH2-группой, NH(CH2)n-Ph, NH-C1-6-алкилом, атомом галогена, CN-группой, NO2-группой, CONHR или SO2NHR, где R является водородом или C1-6-алкилом, и n равно 0, 1, 2 или 3;
R3 является водородом, C1-6-алкилом, C3-7-циклоалкилом, -(CH2)P-NO2, -(CH2)P-NR4R5, -(CH2)P-CHO, -(CH2)P-CONHOH, -(CH2)P-CN, -(CH2)P-CO2H, -(CH2)P-CO2R4, -(CH2)P-CONR4R5, -(CH2)P-тетразолом, -(CH2)P-COR4, -(CH2)q(OR6)2, -(CH2)P-OR4, -(CH2)P-CH=CH-CN, -(CH2)P-CH=CH-CO2H, -(CH2)P-CH=CH-CO2R4, -(CH2)P-CH=CH-CONR4R5, -(CH2)P-NHCOR4, -(CH2)pNHCO2R4, -(CH2)P-CONHSO2R4, -(CH2)P-NHSO2R4 или -(CH2)P-CH=CH-тетразолом;
R4 и R5 являются, независимо, водородом или C1-6-алкилом; R6 является C1-4-алкилом; p равно 0, 1, 2, 3 или 4; q равно 1, 2, 3 или 4; X является C1-10-алкиленовой группой, C2-10-алкениленовой группой или C2-10-алкиниленовой группой; один из A1 и A2 является атомом азота, а другой является NR7; и R7 является атомом водорода, OH-группой, C1-6-алкилом или C3-7-циклоалкилом.
Применяемая здесь двойная связь, обозначенная пунктирной линией в формуле (I), представляет возможные таутомерные формы цикла для соединений, попадающих в объем этого изобретения, двойная связь находится у незамещенного атома азота.
Предпочтительно R1 является необязательно замещенным нафтилом или фенилом. Более предпочтительно R1 является фенилом, необязательно замещенным заместителями, выбранными из атома галогена, OH-гуппы, -O-C1-6-алкила, -S-C1-6-алкила и фенила; или R1 является фенилом, конденсированным с ароматическим или неароматическим 5-7-членным кольцом, где упомянутое кольцо может необязательно содержать до двух гетероатомов, независимо выбранных из N, O и S, и конденсированный фенил или пиридил может далее быть необязательно замещен атомом галогена, OH-группой, -O-C1-6-алкилом, -S-C1-6-алкилом, C1-6-алкилом, C1-6-галогеналкилом или =О. Например, R1 представляет собой бензо[1,3]диоксолил, 2,3-дигидробензо[1,4]диоксинил, бензоксазолил, бензотиазолил, бензо[1,2,5]оксадиазолил, бензо[1,2,5]тиадиазолил, хиноксалинил, дигидробензофуранил, бензимидазолил, C1-6-бензимидазолил, [1,2,4]триазоло[1,5-α]пиридил, бензо[1,4]оксазинил-3-он, бензоксазолил-2-он или бензо[1,4]оксазинил.
Предпочтительно R2 является отличным от водорода заместителем. Если R2 является отличным от водорода заместителем, он предпочтительно находится в орто-положении к атому азота пиридильного цикла. R2 предпочтительно является C1-4-алкилом.
Предпочтительно R3 является -(CH2)P-CONHOH, -(CH2)P-CN, -(CH2)P-CO2H, -(CH2)P-CONR4R5 или -(CH2)P-тетразолом.
Предпочтительно R4 и R5 являются, независимо, водородом или C1-3-алкилом. Предпочтительно p равно 0, 1 или 2. Предпочтительно X представляет собой C1-6-алкиленовую группу. Предпочтительно один из A1 и A2 является атомом азота, а другой является NR7, где R7 является атомом водорода.
Характерные соединения данного изобретения, которые могут быть упомянуты, включают в себя следующие соединения и их фармацевтически приемлемые соли:
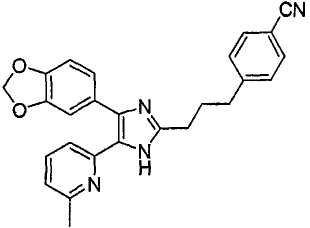
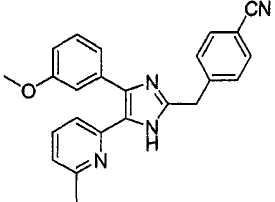
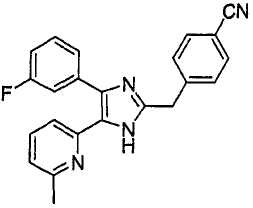
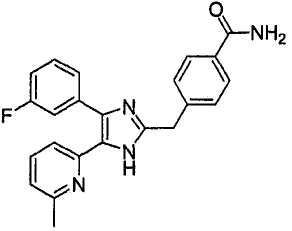
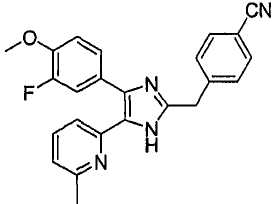
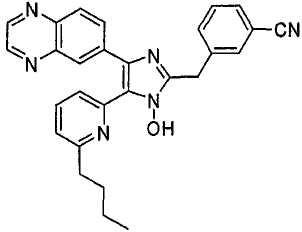
4-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензонитрил;
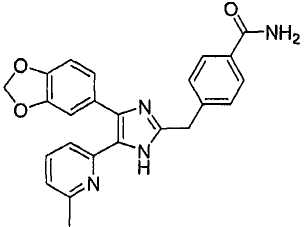
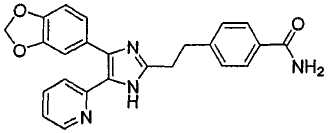
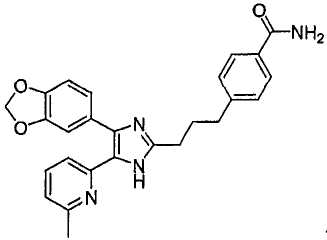
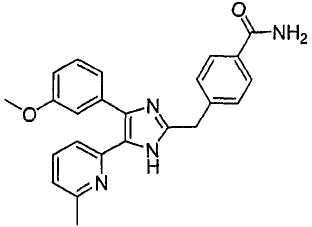
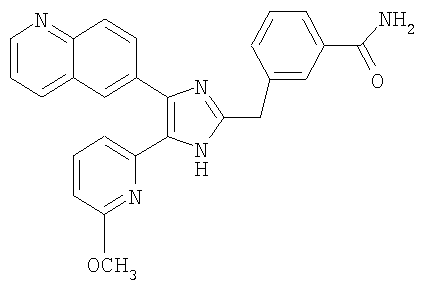
4-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
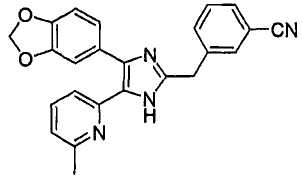
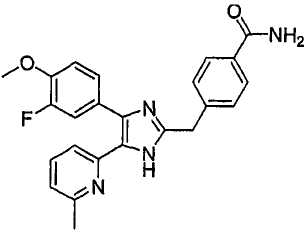
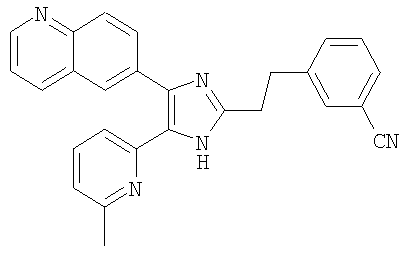
3-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензонитрил;
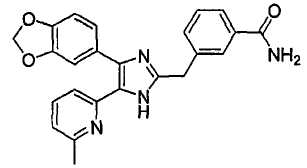
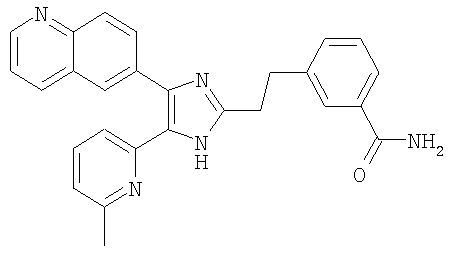
3-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
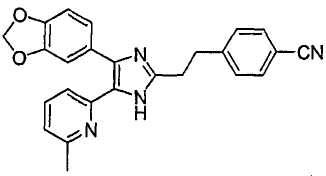
4-(2-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)этил)бензонитрил;
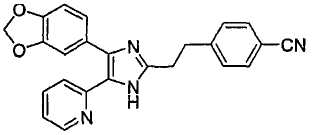
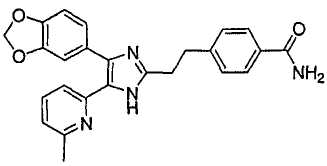
4-(2-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
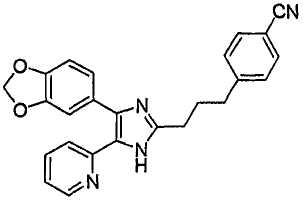
4-(3-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)пропил)бензонитрил;
4-(3-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)пропил)бензамид;
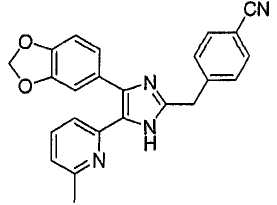
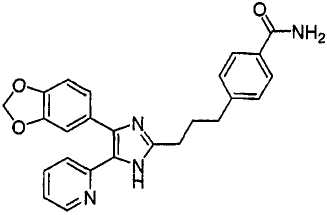
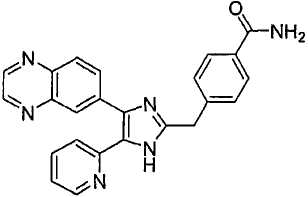
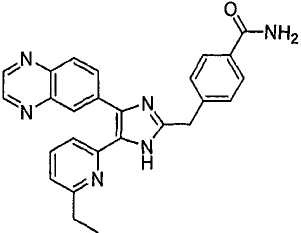
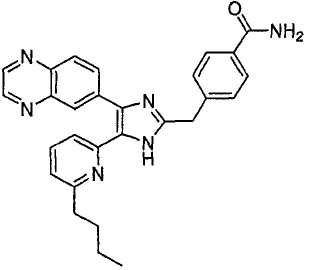
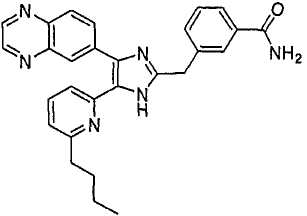
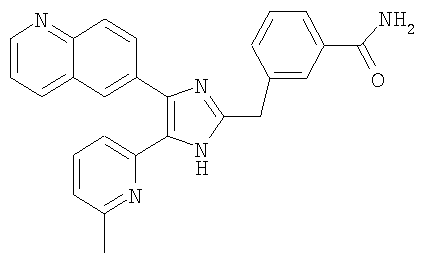
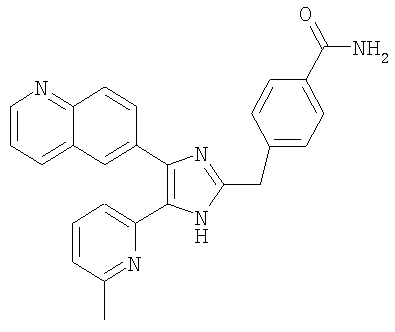
4-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
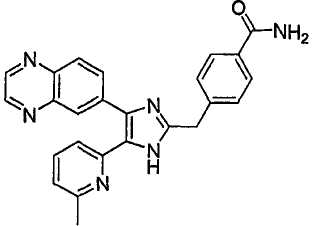
4-((5-(6-этилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
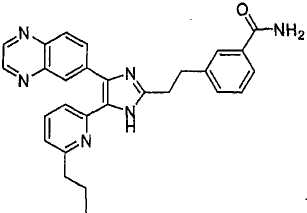
4-((5-(6-н-пропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
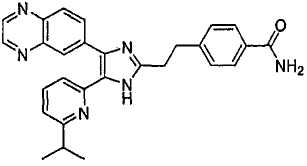
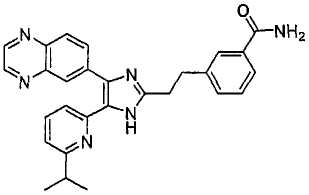
4-((5-(6-изопропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
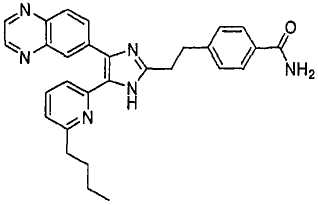
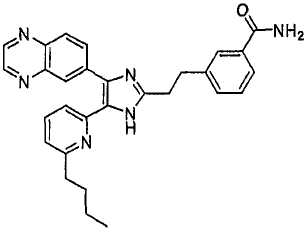
4-((5-(6-n-бутилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
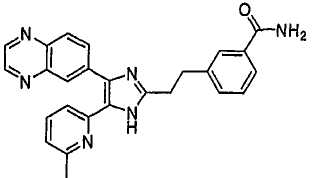
3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензонитрил;
3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
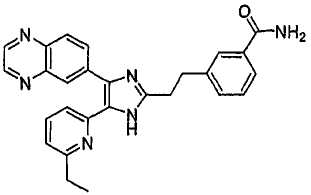
3-((5-(6-этилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
3-((5-(6-н-пропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
3-((5-(6-изопропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
3-((5-(6-н-бутилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид;
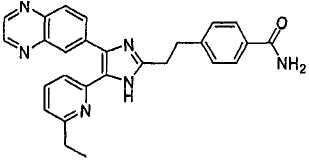
4-(2-(5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
4-(2-(5-(6-этилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
4-(2-(5-(6-н-пропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
4-(2-(5-(6-изопропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
4-(2-(5-(6-н-бутилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
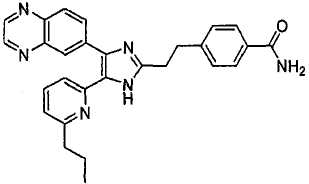
3-(2-(5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
3-(2-(5-(6-этилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
3-(2-(5-(6-н-пропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
3-(2-(5-(6-изопропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид;
3-(2-(5-(6-н-бутилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамид.
Соединения настоящего изобретения обычно являются небольшими органическими молекулами (небольшие непептидные молекулы), обычно менее приблизительно 1000 Дальтон по массе. Предпочтительные непептидные небольшие молекулы имеют молекулярные веса менее приблизительно 750 Дальтон, более предпочтительно менее приблизительно 500 Дальтон и еще более предпочтительно менее приблизительно 300 Дальтон.
Соединения формулы (I) могут также поставляться в форме "пролекарства", которое предназначается для высвобождения соединения формулы (I) при введении субъекту. Методы создания пролекарств хорошо известны специалистам и зависят от заместителей, содержащихся в соединении формулы (I). Например, заместитель, содержащий гидроксил, мог бы присоединяться к носителю, который делает соединение биологически неактивным до тех пор, пока он не отщепляется эндогенными ферментами или, например, ферментами, ориентированными на специальный рецептор или участок в организме больного.
Соединение формулы (I), которое является кислотным по природе (например, имеющее карбоксильную или фенольную гидроксильную группу), может образовывать фармацевтически приемлемую соль, такую как натриевую, калиевую, кальциевую соль или соль с золотом. Также в объем данного изобретения входят соли, образованные с фармацевтически приемлемыми аминами, такими как аммиак, алкиламины, гидроксиалкиламины, и N-метилглюкозамин. Соединение формулы (I) может быть обработано кислотой с образованием соли присоединения кислоты. Примеры таких кислот включают в себя хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, метансульфоновую кислоту, фосфорную кислоту, пара-бромфенилсульфоновую кислоту, угольную кислоту, янтарную кислоту, лимонную кислоту, бензойную кислоту, щавелевую кислоту, малоновую кислота, салициловую кислоту, яблочную кислоту, фумаровую кислоту, аскорбиновую кислоту, малеиновую кислоту, уксусную кислоту и другие минеральные и органические кислоты, хорошо известные для специалистов в данной области. Соли присоединения кислоты могут быть получены путем обработки соединения формулы (I) в виде его свободного основания достаточным количеством кислоты (например, хлористоводородной кислоты) с образованием соли присоединения кислоты (например, гидрохлоридной соли). Соль присоединения кислоты может быть конвертирована обратно в форму свободного основания обработкой соли соответствующим разбавленным водным основаным раствором (например, гидроксида натрия, бикарбоната натрия, карбоната калия или аммиака).
Некоторые из соединений этого изобретения могут быть кристаллизованы или перекристаллизованы из растворителей, таких как водные и органические растворители. В таком случае могут образовываться сольваты. Это изобретение включает в свой объем стехиометрические сольваты, включая гидраты, также как соединения, содержащие различные количества воды, которые могут образовываться в процессах, таких как лиофильная сушка.
Соединения формулы (I) могут содержать один или несколько асимметрических центров и, таким образом, могут существовать как энантиомеры или диастереомеры. Понятно, что данное изобретение включает как смеси, так и отдельные индивидуальные соединения формулы (I). Далее определенные соединения формулы (I), которые содержат алкенильные группы, могут существовать как цис- или транс-изомеры. В каждом случае данное изобретение включает как смеси, так и отдельные индивидуальные изомеры.
Соединения формулы (I) могут также существовать в таутомерных формах, и данное изобретение включает в себя как смеси, так и отдельные индивидуальные таутомеры.
Также включены в данное изобретение радиоктивно-меченые производные соединений формулы (I), которые применимы для биологических исследований.
Применяемый здесь термин "алкильная" группа относится к насыщенной алифатической углеводородной группе, содержащей 1-10 (например, 1-6 или 1-4) атомов углерода. Алкильная группа может быть линейной или разветвленной. Примерами алкильной группы являются, но не ограничены ими, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гептил и 2-этилгексил. Алкильная группа может быть необязательно замещена одним или несколькими заместителями, такими как атом галогена, алкокси-, циклоалкокси-, амино-, нитро-, карбокси-, циано-, гидрокси-, сульфо- или меркапто-группа.
Применяемый здесь термин "алкиленовая" группа относится к насыщенной алифатической углеводородной группе, содержащей 1-10 (например, 1-6 или 1-4) атомов углерода. Алкиленовая группа может быть линейной или разветвленной. Примерами алкиленовой группы являются, но не ограничены ими, метилен, этилен, пропилен, изопропилен, бутилен, изобутилен, втор-бутилен, трет-бутилен, н-пентилен, н-гептилен и 2-этилгексилен. Алкиленовая группа может быть необязательно замещена одним или несколькими заместителями, такими как атом галогена, алкокси-, циклоалкокси-, амино-, нитро-, карбокси-, циано-, гидрокси-, сульфо- или меркапто-группа.
Применяемый здесь термин "алкениленовая" группа относится к алифатической углеводородной группе, которая содержит 2-10 (например, 2-6 или 2-4) атомов углерода и по меньшей мере одну двойную связь. Подобно алкиленовой группе алкениленовая группа может быть линейной или разветвленной. Примерами алкениленовой группы являются, но не ограничены ими, аллилен, изопренилен, 2-бутенилен и 2-гексенилен. Алкениленовая группа может быть необязательно замещена одним или несколькими заместителями, такими как атом галогена, алкокси-, циклоалкокси-, гетероциклоалкилокси-, арилокси-, гетероарилокси-, аралкилокси-, гетероарилалкокси-, амино-, нитро-, карбокси-, циано-, гидрокси-, сульфо-, меркапто-, алкилсульфанильная, алкилсульфинильная, алкилсульфонильная, аминокарбонильная, алкилкарбониламино-, циклоалкилкарбониламино-, циклоалкилалкилкарбониламино-, арилкарбониламино-, аралкилкарбониламино-, гетероциклоалкилкарбониламино-, гетероциклоалкилалкилкарбониламино-, гетероарилкарбониламино-, гетероаралкилкарбониламино-, уреидная, тиоуреидная, сульфамоильная, сульфамидная, алкоксикарбонильная или алкилкарбонилокси-группа.
Применяемый здесь термин "алкиниленовая" группа относится к алифатической углеводородной группе, которая содержит 2-10 (например, 2-6 или 2-4) атомов углерода и имеет по меньшей мере одну тройную связь. Алкиниленовая группа может быть линейной или разветвленной. Примерами алкиниленовой группы являются, но не ограничены ими, пропаргилен и бутинилен. Алкиниленовая группа может быть необязательно замещена одним или несколькими заместителями, такими как атомом галогена, алкокси-, циклоалкилокси-, гетероциклоалкилокси-, арилокси-, гетероарилокси-, аралкилокси-, гетероарилалкокси-, амино-, нитро-, карбокси-, циано-, гидрокси-, сульфо-, меркапто-, алкилсульфанильная, алкилсульфинильная, алкилсульфонильная, аминокарбонильная, алкилкарбониламино-, циклоалкилкарбониламино-, циклоалкилалкилкарбониламино-, арилкарбониламино-, аралкилкарбониламино-, гетероциклоалкилкарбониламино-, гетероциклоалкилалкилкарбониламино-, гетероарилкарбониламино-, гетероаралкилкарбониламино-, уреидная, тиоуреидная, сульфамоильная, сульфамидная, алкоксикарбонильная или алкилкарбонилокси-группа.
Применяемый здесь термин "циклоалкильная" группа относится к алифатической карбоциклический группе, включающей 3-10 (например, 4-8) атомов углерода. Примерами циклоалкильных групп являются циклопропил, циклопентил, циклогексил, циклогептил, адамантил, норборнил, кубил, октагидроинденил, декагидронафтил, бицикло[3.2.1]октил, бицикло[2.2.2]октил, бицикло[3.3.1]нонил и бицикло[3.2.3]нонил.
Применяемый здесь термин "алкокси"-группа относится к алкил-O-группе, где "алкил" был определен выше как "алкильная" группа.
Применяемый здесь термин "галогеналкильная" группа относится к алкильной группе, содержащей один или несколько атомов галогена. Примеры галогеналкильных групп включают в себя фторметильную, хлорметильную, бромметильную и трифторметильную группу.
Применяемый здесь термин "галоген" или "галоидная группа" относится к фтору, хлору, брому или йоду.
Применяемый здесь термин "ингибитор ALK5 и/или ALK4" относится к соединению, иному, чем ингибитор различных видов Smad, например Smad6 и Smad7, которое селективно ингибирует рецепторы ALK5 и/или ALK4, предпочтительно по отношению к рецепторам p38 или рецепторам типа II.
Применяемый здесь термин "ALK5- и/или ALK4-зависимые заболевания" относится к любому заболеванию, которое опосредуется (или модулируется) посредством ALK5 и/или ALK4, например заболевание, которое модулируется ингибированием фосфорилирования Smad2 и Smad3 в путях передачи сигнала TGF-β и/или активина.
Применяемый здесь термин "язвы" применяется для обозначения заболеваний, включая без ограничения, диабетические язвы, хронические язвы, желудочные язвы и язвы двенадцатиперстной кишки.
Соединения формулы (I) могут быть получены с помощью ряда известных способов из коммерчески доступных или известных исходных материалов. Если исходные материалы не доступны из коммерческих источников, они могут быть получены процедурами, известными в уровне технике.
Схема 1
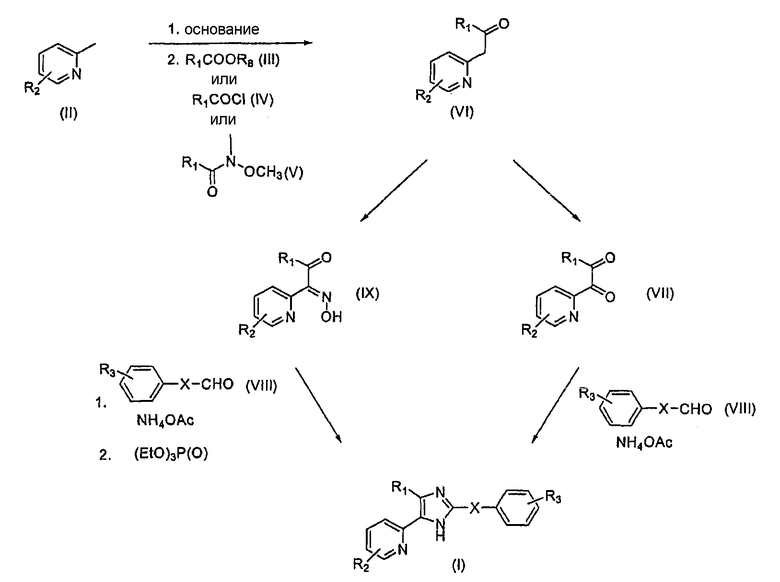
В одном способе соединения формулы (I), где A1 является атомом азота, а A2 является NH, или A1 является NH, а A2 является атомом азота, получают согласно схеме 1. В особенности, необязательно замещенный 2-метилпиридин (II) депротонируется под действием основания, такого как LDA или LiHMDS, перед взаимодействием с R1COOR8 (III), где R8 является C1-6-алкильной группой, R1COCl (IV) или метоксиметиламидом R1-замещенной карбоновой кислоты (V), с образованием кетона (VI). Метоксиметиламид (V) может быть получен взаимодействием соответствующего хлорангидрида кислоты (IV) с N,O-диметилгидроксиламингидрохлоридом. Кетон (VI) может быть окислен в дикетон (VII) дейтвием HBr в DMSO. Этот дикетон (VII) может затем быть конденсирован с соответствующим образом замещенным альдегидом (VIII) или замещенным производным альдегида в присутствии ацетата аммония, что приводит к соединению формулы (I). R1, R2, R3 и X определены выше. Альдегид (VIII) может быть получен согласно способам, описаным в WO 02/096875Al и Liquid Crystals 10:273-287 (1991). Альтернативно кетон (VI) может быть обработан натрий нитритом в HCl или уксусной кислоте с образованием α-кетооксима (IX), который далее может быть конденсирован с соответствующим образом замещенным альдегидом (VIII) или замещенным производным альдегида в присутствии ацетата аммония с образованием N-гидроксиимидазолов. Обработка этих соединений триэтилфосфитом приводит к соединению формулы (I).
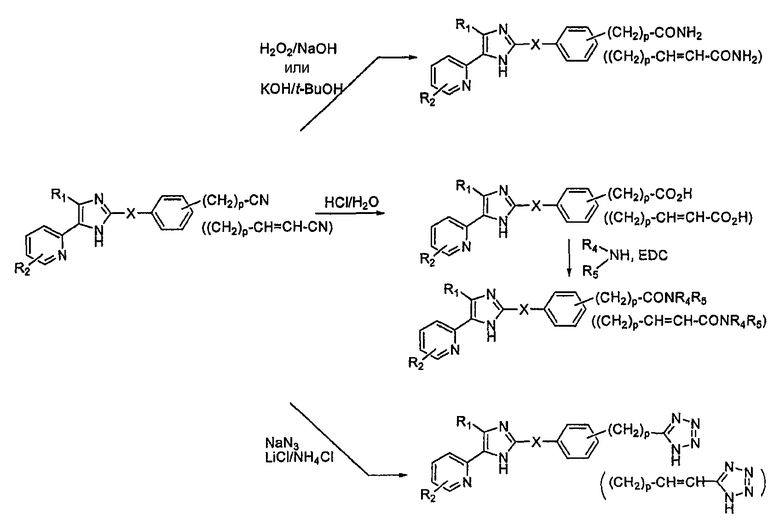
В другом способе, когда R3 в соединениях формулы (I) является -(CH2)P-CN- или -(CH2)P-CH=CH-CN-группой, соединение может быть далее функционализировано с образованием соединения формулы (I), как это обозначено на схеме 2. R1, R2, X и P определены выше, а R4 и R5 являются, независимо, водородом или C1-6-алкильной группой.
Схема 2
Полученные соединения этого изобретения, представленные формулами (I)-(IX), могут быть разделены и очищены соответствующими традиционными способами, такими как колоночная хроматография и перекристаллизация.
Соединения данного изобретения могут вводиться любым подходящим путем, например пероральным, буккальным, подъязычным, ректальным, вагинальным, назальным, местным или парентеральным введением (включая внутривенное, внутримышечное, подкожное и внутрисердечное).
Композиции для местного применения настоящего изобретения могут быть представлены как, например, мази, кремы или лосьоны, глазные мази и глазные или ушные капли, пропитанные перевязочные материалы и аэрозоли, и могут содержать соответствующие традиционные добавки, такие как консерванты, растворители, облегчающие проникновение лекарства, и смягчители в маслах и кремах.
Композиции также могут содержать совместимые традиционные носители, такие как основы для крема или мази и этанол или олеиловый спирт для лосьона. Такие носители могут составлять от приблизительно 1% до приблизительно 98% композиции. Обычно они будут составлять до приблизительно 80% композиции.
Для введения человеку при лечении или профилактике заболеваний, определенных ранее, пероральные, буккальные или подъязычные дозировки соединения формулы (I), будут обычно находиться в диапазоне от 50-5000 мг в день для среднего взрослого пациента (70 кг). Таким образом, для типичного взрослого пациента индивидуальные таблетки или капсулы содержат от 25-500 мг активного соединения в соответствующем фармацевтически приемлемом наполнителе или носителе, для введения в единичных или многократных дозировках, один или несколько раз в день. Дозировки для парентерального введения будут обычно находиться в диапазоне от 25-250 мг для единичной дозы, как это необходимо. На практике врач будет определять действительный режим приема, который будет более соответствовать индивидуальному больному и будет изменяться в зависимости от возраста, веса и реакции отдельного больного. Вышеупомянутые дозировки являются образцовыми для среднего случая, но могут существовать индивидуальные случаи, в которых могут применяться большие или меньшие диапазоны дозировок, и это находится в объеме данного изобретения.
Для применения у людей соединение формулы (I) может вводиться одно, но будет обычно вводиться в смеси с фармацевтическим носителем, выбранным с учетом намеченного способа введения и обычной врачебной практики. Например, соединение может вводиться перорально, буккально или подъязычно в форме таблеток, содержащих эксципиенты, такие как крахмал или лактоза, или в капсулах, или в овулах, или одно или в смеси с эксципиентами, или в форме эликсиров или суспензий, содержащих отдушки или окрашивающие агенты. Такие жидкие препараты могут быть получены с применением фармацевтически приемлемых добавок, таких как суспендирующий агент (например, метилцеллюлоза, полусинтетический глицерид, такой как витепсол, или смеси глицеридов, таких как смесь масла косточек абрикосов и эфиров PEG-6 или смеси PEG-8 и каприловых/каприновых глицеридов). Соединение может также вводиться парентерально, например внутривенно, внутримышечно, подкожно или внутрисердечно. Для парентерального введения соединение лучше всего применять в форме стерильного водного раствора, который может содержать другие вещества, например соли или моносахариды, такие как маннит или глюкоза, для того, чтобы раствор являлся изотоничным с кровью.
Таким образом, в следующем аспекте данное изобретение представляет фармацевтическую композицию, содержащую соединение формулы (I), или его фармацевтически приемлемую соль или сольват, совместно с фармацевтически приемлемым разбавителем или носителем.
Данное изобретение также представляет соединение формулы (I) или его фармацевтически приемлемую соль или сольват, или фармацевтическую композицию, содержащую любое из этих соединений, для применения при лечении.
Далее данное изобретение представляет применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции, содержащей любое из этих соединений, для производства лекарственного средства для лечения заболевания, опосредованного ALK5 и/или ALK4 рецепторами у млекопитающих.
ALK5- и/или ALK4-опосредованные заболевания включают в себя, без ограничения, такие заболевания, как гломерулонефрит, диабетическая нефропатия, нефрит при волчанке, нефропатия, индуцированная гипертензией, почечный интерстициальный фиброз, почечный фиброз, возникающий в результате осложнений при применении лекарств, ВИЧ-обусловленная нефропатия, трансплантантная некропатия, печеночный фиброз всех этиологий, печеночная дисфункция, связанная с различными инфекциями, гепатит, вызванный алкоголем, расстройства желчных протоков, пневмофиброз, острая легочная недостаточность, респираторный дистресс-синдром у взрослых, идиопатический пневмофиброз, хронический обструктивный легочный синдром, легочное заболевание, вызванное инфекционными или токсическими агентами, пост-инфарктный сердечный фиброз, застойная сердечная недостаточность, кардиомиопатия при дилатации, миокардит, сосудистый стеноз, рестеноз, атеросклероз, рубцевание хрусталика, рубцевание роговицы, пролиферирующая витреоретинопатия, образование избыточных или гипертрофических шрамов или келоидов на коже в процессе заживления раны, полученной при травматических или хирургических повреждениях, перитониальные и подкожные спайки, склеродермия, фибросклероз, прогрессирующий системный склероз, дерматомиозит, полимиозит, артрит, остеопороз, язвы, неврологическая дисфункция, эректильная дисфункция у мужчин, болезнь Альцгеймера, болезнь Рейно, фибротические разновидности рака, рост опухолевых метастазов, радиационно-индуцированный фиброз и тромбоз.
Данное изобретение далее представляет способ ингибирования пути передачи сигналов TGF-β и/или активина у млекопитающих, например ингибирования фосфорилирования Smad2 или Smad3 посредством ALK5 и/или ALK4.
Далее данное изобретение представляет способ уменьшения аккумуляции избыточного внеклеточного матрикса у млекопитающих путем ингибирования путей передачи сигнала TGF-β и/или активина, например ингибирования фосфорилирования Smad2 или Smad3 посредством ALK5 и/или ALK4.
Далее данное изобретение представляет способ ингибирования метастазов опухолевых клеток у млекопитающих путем ингибирования пути передачи сигнала TGF-β.
Далее данное изобретение представляет способ лечения раковых новообразований, опосредованных сверхэкспрессией TGF-β у млекопитающих путем ингибирования пути передачи сигнала TGF-β.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Вышеупомянутые аспекты и другие особенности настоящего изобретения будут объяснены в следующем описании, рассматриваемом в связи с сопроводительными чертежами, где:
на фигуре 1 показано действие соединений примеров 6, 9, 10, 13 и 31 на TGF-β1-индуцированную активность репортера SBE-Luc в клетках HepG2,
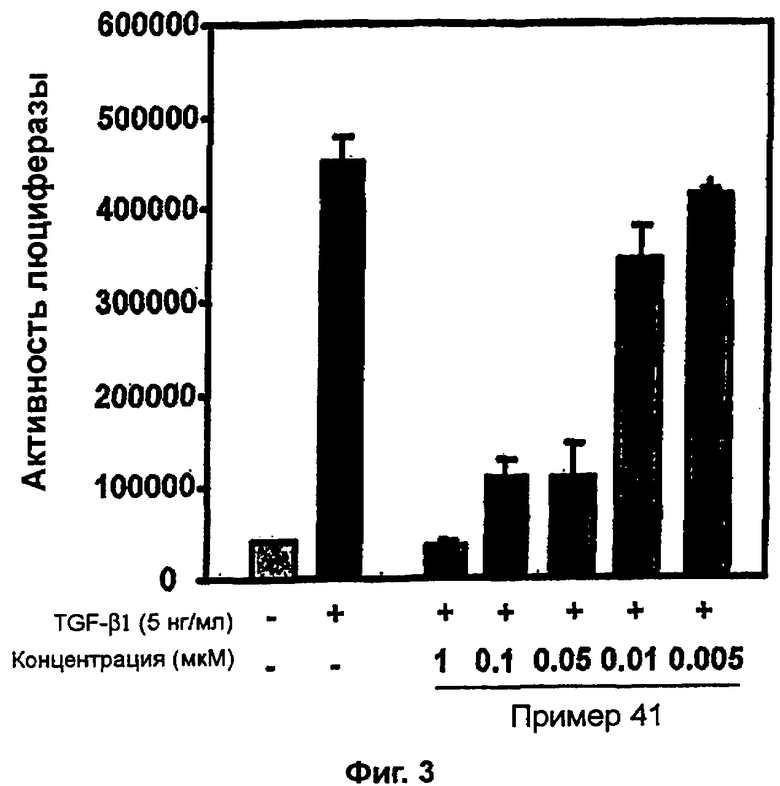
на фигуре 2 показано действие соединения примера 41 на TGF-β1-индуцированную активность репортера SBE-Luc в клетках HepG2,
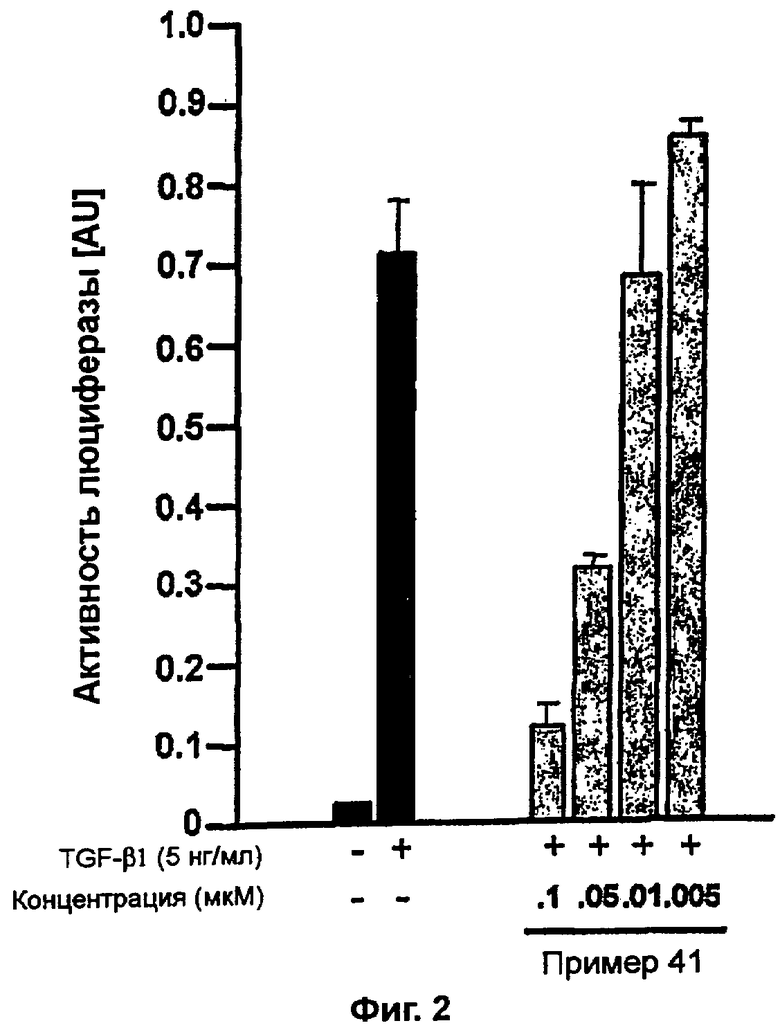
на фигуре 3 показано действие соединения примера 41 на TGF-β1-индуцированную активность репортера 3TP-Lux в клетках HepG2,
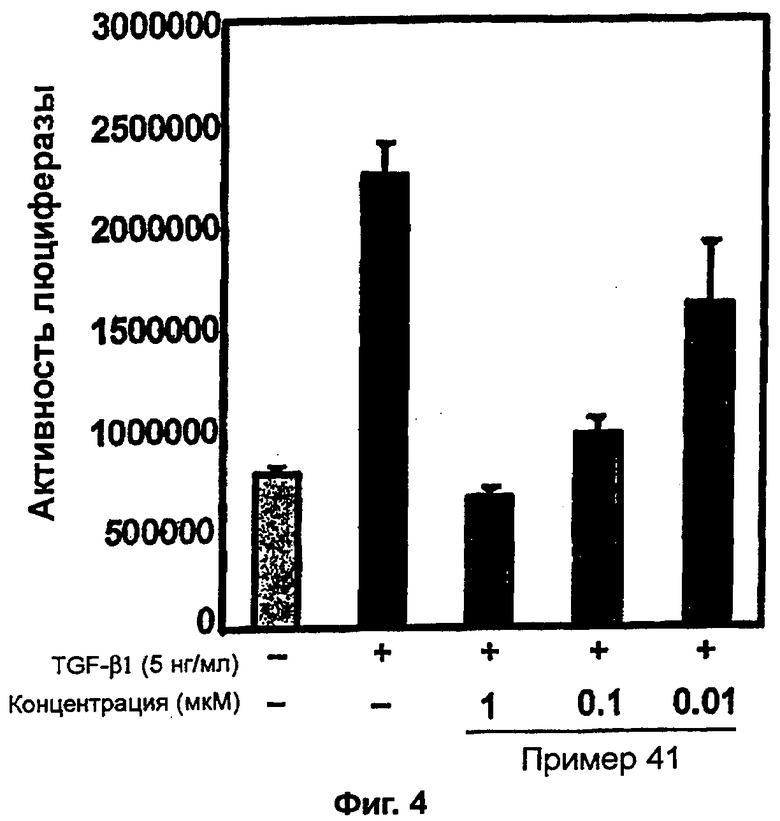
на фигуре 4 показано действие соединения примера 41 на TGF-β1-индуцированную активность репортера PAI-1 промотера-Luc в клетках HepG2,
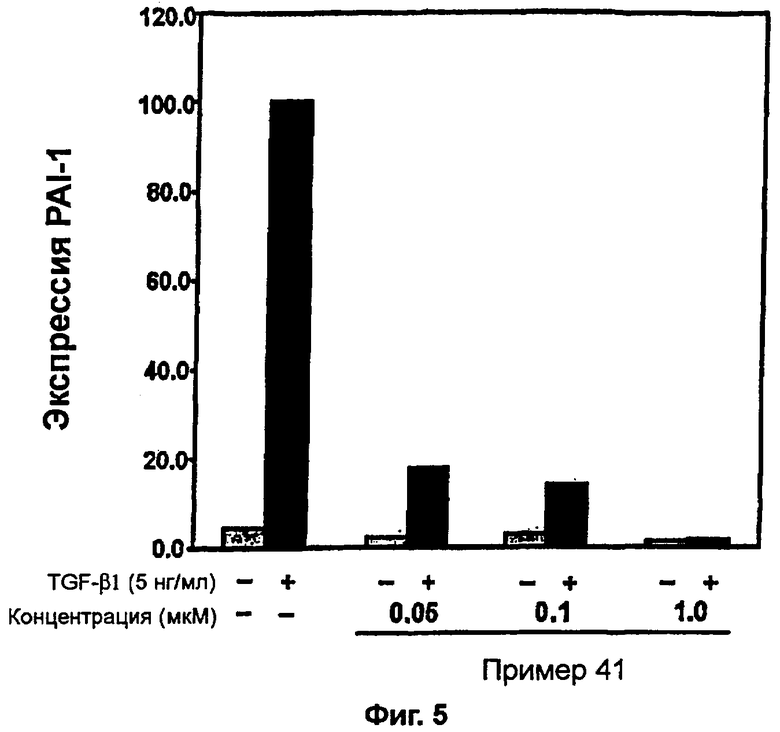
на фигуре 5 показано действие соединения примера 41 на TGF-β1-индуцированную экспрессию PAI-1 в человеческих кератиноцитах HaCaT,
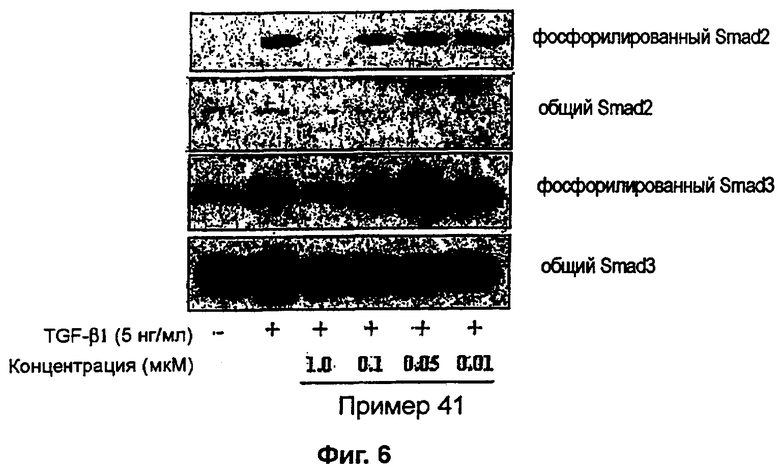
на фигуре 6 показано действие соединения примера 41 на TGF-β1-индуцированное фосфорилирование Smad2 и Smad3 в человеческих кожных фибробластах,
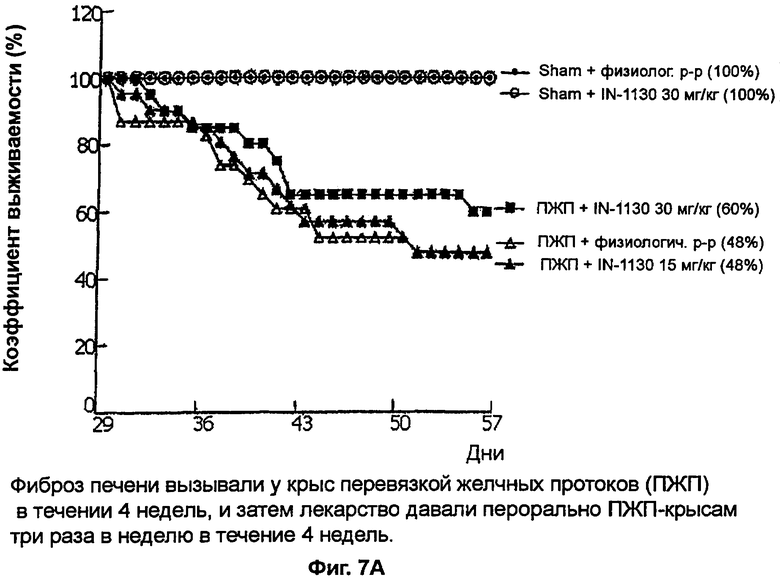
на фигурах 7А и 7B показано действие соединения примера 41 на фиброз печени у крыс с перевязкой желчных протоков,
в таблице 1 представлены структуры и данные 1H-ЯМР спектров и масс-спектров для соединений примеров 1-61, и
на фигуре 8 показано действие соединения примера 41 на активности протеинкиназ in vitro.
ПРИМЕРЫ
Настоящее изобретение далее иллюстрируется в нижеследующих примерах, которые не должны использоваться для ограничения объема данного изобретения, описанного в формуле изобретения. В примерах масс-спектры с ионизацией электрораспылением (ESI-MS) получали на масс-спектрометре Q-Tof2 (Micromass, Manchester, UK).
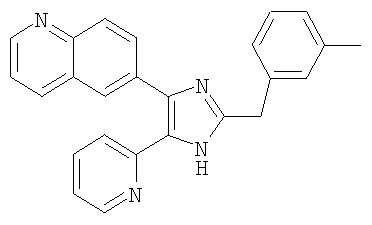
Пример получения 1: Получение 3-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила (пример 5).
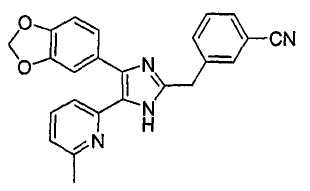
К перемешиваемому раствору 1-(бензо[1,3]диоксол-5-ил)-2-(6-метилпиридин-2-ил)этан-1,2-диона (50 мг, 0,19 ммоль) (полученного согласно способу, описанному в WO 01/62756A1) в AcOH (3 мл) добавляли 3-(формилметил)бензонитрил (28 мг, 0,19 ммоль) (получен согласно способу, описанному в WO 02/096875 Al) и NH4OAc (86 мг, 1,11 ммоль), и смесь нагревали при 120°C в течении 3 часов. pH охлажденной реакционной смеси доводили до pH 7-8 при 0°C с помощью 28% NH4OH, и реакционную смесь экстрагировали CH2Cl2 (10 мл). Раствор CH2Cl2 промывали водой (5 мл) и насыщенным соляным раствором (5 мл), высушивали (над безводным Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали жидкостной хроматографией среднего давления (MPLC) на силикагеле с применением смеси MeOH и CH2Cl2 (1:19 (по объему)) в качестве элюента, что дало 26 мг (36%) 3-((4-бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила в виде твердого вещества. MS (ESI) m/z: 395,13 (MH+). 1H-ЯМР спектр (400 МГц, CDCl3): δ 7,52 (с, 1H), 7,46 (м, 1H), 7,40 (т, 1H), 7,33 (д, 1H), 7,32-7,26 (м, 2H), 7,09-7,04 (м, 2H), 6,90 (д, 1H), 6,82 (д, 1H), 5,96 (с, 2H), 4,10 (с, 2H), 2,38 (с, 3H).
Пример получения 2: Получение 3-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензамида (Пример 6)
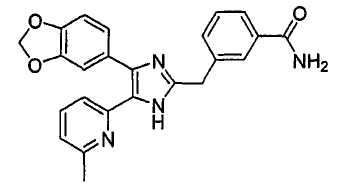
К перемешиваемому раствору 3-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила (70 мг, 0,17 ммоль) в EtOH (4 мл) при комнатной температуре добавляли 30% H2O2 (0,59 ммоль) и 6 н. раствор NaOH (0,04 ммоль). Смесь нагревали до 50-60°C и перемешивали в течение 3 часов, и к полученному раствору добавляли 1 н. раствор HCl, доводя pH до 7-8 при 0°C. Этанол упаривали при пониженном давлении, и остаток растворяли в CH2Cl2 (30 мл). Раствор CH2Cl2 промывали водой (15 мл) и насыщенным соляным раствором (15 мл), высушивали (над безводным Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали жидкостной хроматографией (MPLC) на силикагеле с применением смеси MeOH и CH2Cl2 (1:9 (по объему)) в качестве элюента, что дало 23 мг (33%) 3-((4-бензо[1,3]диоксол-5-ил)-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)метил)бензамида в виде твердого вещества. MS (ESI) m/z: 413,11 (MH+). 1H-ЯМР спектр (400 МГц, CDCl3): δ 7,59 (с, 1H), 7,52 (д, 1H), 7,37 (дд, 1H), 7,24 (м, 2H), 7,15 (т, 1H), 7,01 (перекрывается с соседним сигналом, 1H), 7,00 (с, 1H), 6,88 (д, 1H), 6,75 (д, 1H), 6,70 (уш. с, 1H), 6,02 (уш. с, 1H), 5,92 (с, 2H), 4,00 (с, 2H), 2,34 (с, 3H).
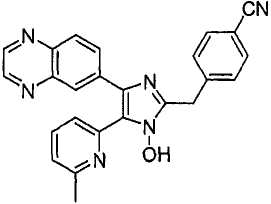
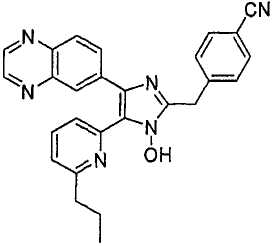
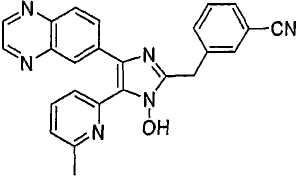
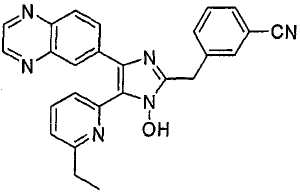
Пример получения 3: Получение 4-((1(3)-гидрокси-5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила (Пример 30)
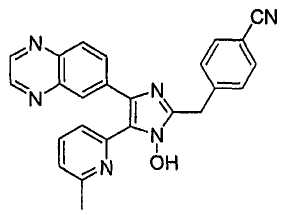
К перемешиваемому раствору 1-(6-метилпиридин-2-ил)-2-(хиноксалин-6-ил)этан-1,2-диона-1-оксима (67 мг, 0,23 ммоль) (получен согласно способу, описанному в WO 01/62756 A1) в трет-бутилметиловом эфире (2,5 мл) добавляли 4-(формилметил)бензонитрил (101 мг, 0,69 ммоль) (получен согласно способу, описанному в WO 02/096875 Al) и NH4OAc (89 мг, 1,15 ммоль), растворенные в MeOH (1,2 мл), и смесь перемешивали при комнатной температуре в течение ночи. pH реакционной смеси доводили до pH 7-8 при 0°C действием насыщенного раствора NaHCO3. Реакционная смесь распределялась между CH2Cl2 (40 мл) и водой (40 мл). Водный слой повторно экстрагировали CH2Cl2 (3 × 15 мл). Обьединенный раствор CH2Cl2 высушивали (над безводным Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали MPLC на силикагеле с применением смеси MeOH и CH2Cl2 (1:30, затем 1:19 (по объему)) в качестве элюента, что дало 38 мг (40%) 4-((1(3)-гидрокси-5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила в виде твердого вещества. MS (ESI) m/z: 419,23 (MH+). 1H-ЯМР спектр (400 МГц, CDCl3): δ 8,86 (м, 2H), 8,35 (д, 1H), 8,17 (д, 1H), 8,06 (дд, 1H), 7,62 (м, 2H), 7,56 (м, 2H), 7,52 (т, 1H), 7,36 (д, 1H), 7,06 (д, 1H), 4,31 (с, 2H), 2,61 (с, 3H).
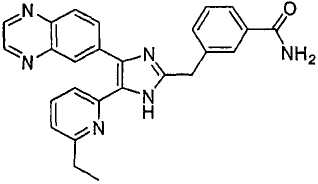
Пример получения 4: Получение 4-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида (Пример 31)
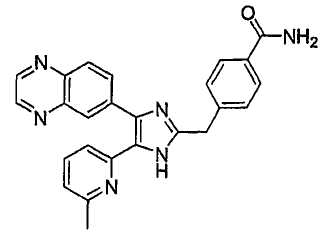
К перемешиваемому раствору 4-((1(3)-гидрокси-5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила (264 мг, 0,631 ммоль) в смеси этанола (16 мл) и DMSO (4 мл) при комнатной температуре добавляли 30% H2O2 (6,62 ммоль) и 6 н. раствор NaOH (0,47 ммоль). Смесь нагревали до 50-60°C и перемешивали в течение ночи, и к полученному раствору добавляли 1 н. раствор HCl, доводя pH до 7-8 при 0°C. Этанол упаривали при пониженном давлении, и остаток распределяли между CH2Cl2 (30 мл) и H2O (50 мл). Водный слой насыщали NaCl и экстрагировали CH2Cl2 (3 × 30 мл). Обьединенные растворы CH2Cl2 промывали насыщенным соляным раствором (30 мл), высушивали (над безводным Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток растворяли в безводном ДМФА (20 мл) и обрабатывали триэтилфосфитом (2,39 ммоль). Смесь нагревали при 110°C в течение 3 дней, охлаждали до комнатной температуры и упаривали досуха при пониженном давлении. Реакционную смесь распределяли между CH2Cl2 (30 мл) и водой (50 мл), и водный слой экстрагировали CH2Cl2 (2 × 30 мл). Обьединенный раствор CH2Cl2 промывали насыщенным раствором NaHCO3 (40 мл) и насыщенным соляным раствором (50 мл), высушивали (над безводным Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали MPLC на силикагеле с применением смеси MeOH и CH2Cl2 (1:9, затем 1:5 (по объему)) в качестве элюента, что дало 96 мг (36%) 4-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида в виде твердого вещества. MS (ESI) m/z: 421,14 (MH+). 1H-ЯМР спектр (400 МГц, CDCl3): δ 12,01 (уш. с, 1H), 8,83 (м, 2H), 8,38 (с, 1H), 8,15 (дд, 2H), 7,55 (д, 2H), 7,42 (дд, 1H), 7,33 (д, 1H), 7,21 (д, 2H), 6,95 (д, 1H), 6,62 (уш. с, 1H), 5,83 (уш. с, 1H), 4,13 (с, 2H), 2,29 (с, 3H).
Пример получения 5: Получение 4-(2-(5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этил)бензамида (Пример 48)
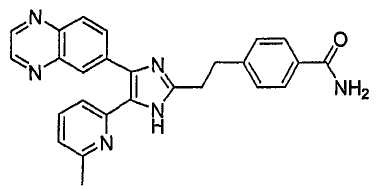
К перемешиваемому раствору 4-(2-(1,3-диоксолан-2-ил)этил)бензонитрила (1,50 г, 7,34 ммоль) (получен согласно способу, описанному у Kelly, S. M, Liquid Crystals 10: 273-287 (1991)) в MeOH (50 мл) при комнатной температуре добавляли 30% H2O2 (25,70 ммоль) и 6 н. раствор NaOH (7,34 ммоль). Смесь нагревали до 50-60°C и перемешивали в течение 2 часов, и к полученному раствору добавляли 1 н. раствор HCl, доводя pH до 7-8 при 0°C. Метанол упаривали при пониженном давлении, и остаток экстрагировали CH2Cl2 (3 × 30 мл). Раствор CH2Cl2 промывали насыщенным соляным раствором (30 мл), высушивали (над безводным Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали MPLC на силикагеле с применением смеси MeOH и CH2Cl2 (1:19, затем 1:9 (по объему)) в качестве элюента, что дало 1,58 г (97%) 4-(2-(1,3-диоксолан-2-ил)этил)бензамида в виде твердого вещества. 1H-ЯМР спектр (400 МГц, CDCl3): δ 7,74 (дд, 2H), 7,29 (д, 2H), 6,01 (уш. с, 1H), 5,71 (уш. с, 1H), 4,89 (т, 1H), 3,99 (м, 2H), 3,88 (м, 2H), 2,80 (м, 2H), 1,99 (м, 2H).
К перемешиваемому раствору 4-(2-(1,3-диоксолан-2-ил)этил)бензамида (0,50 г, 2,26 ммоль) в ТГФ (22 мл) добавляли 1 н. раствор HCl (20 мл) при комнатной температуре. Смесь нагревали до 80-90°C в течение 1 часа и охлаждали до комнатной температуры. После насыщения NaCl реакционную смесь экстрагировали повторно CHCl3 (5 × 20 мл). Обьединенный раствор CHCl3 высушивали (над безводным Na2SO4), фильтровали и упаривали при пониженном давлении, что давало 0,40 г (98%) 4-(2-формилэтил)бензамида в виде твердого вещества, которое применяли на следующей стадии без дальнейшей очистки. 1H-ЯМР спектр (400 МГц, CDCl3): δ 9,82 (т, 1H), 7,74 (м, 2H), 7,27 (м, 2H), 6,14 (уш. с, 1H), 6,03 (уш. с, 1H), 3,01 (м, 2H), 2,81 (м, 2H).
К перемешиваемому раствору 1-(6-метилпиридин-2-ил)-2-(хиноксалин-6-ил)этан-1,2-диона (1,05 г, 3,79 ммоль) (получен согласно способу, описанному в WO 02/055077 A1) в смеси трет-бутилметилового эфира (35 мл) и MeOH (25 мл) добавляли 4-(2-формилэтил)бензамид (1,00 г, 5,69 ммоль) и NH4OAc (1,46 г, 18,95 ммоль), и смесь перемешивали при комнатной температуре в течение ночи. pH реакционной смеси доводили до pH 7-8 при 0°C насыщенным раствором NaHCO3. После удаления растворителя реакционную смесь экстрагировали CH2Cl2 (3 × 25 мл), раствор CH2Cl2 высушивали (над безводным Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали MPLC на силикагеле с применением смеси MeOH и CH2Cl2 (1:19, затем 1:9 (по объему)) в качестве элюента, что дало 1,08 г (66%) 4-(2-(5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)этилбензамида в виде твердого вещества. MS (ESI) m/z: 435,19. 1H-ЯМР спектр (400 МГц, CDCl3): δ 8,82 (м, 2H), 8,36 (с, 1H), 8,09 (д, 2H), 7,64 (д, 2H), 7,43 (т, 1H), 7,32 (д, 1H), 7,17 (д, 2H), 6,99 (д, 1H), 6,58 (уш. с, 1H), 6,09 (уш. с, 1H), 3,06 (с, 4 H), 2,45 (с, 3H).
Пример получения 6: Получение 4-(3-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)пропил)бензонитрила (Пример 13)
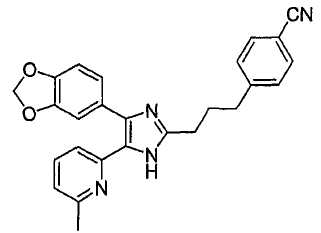
К перемешиваемому раствору 1-(бензо[1,3]диоксол-5-ил)-2-(6-метилпиридин-2-ил)этан-1,2-диона (230 мг, 0,86 ммоль) в AcOH (8 мл) добавляли 4-(3-формилпропил)бензонитрил (156 мг, 0,90 ммоль) (получен согласно способу, описанному у Kelly, S. M, Liquid Crystals 10: 273-287 (1991)) и NH4OAc (396 мг, 5,14 ммоль), и смесь нагревали при 120°C в течение 3 часов. pH охлажденной реакционной смеси доводили до pH 7-8 при 0°C действием 28% NH4OH, и реакционную смесь экстрагировали CH2Cl2 (3 × 30 мл). Обьединенный раствор CH2Cl2 высушивали (над безводным Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали MPLC на силикагеле с применением смеси MeOH и CH2Cl2 (1:30, затем 1:19 (по объему)) в качестве элюента, что дало 130 мг (36%) 4-(3-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)H-имидазол-2-ил)пропил)бензонитрила в виде твердого вещества. MS (ESI) m/z: 423,14. 1H-ЯМР спектр (400 МГц, CDCl3): δ 10,63 (уш. с, 1H), 7,51 (д, 2H), 7,42 (дд, 1H), 7,30 (д, 1H), 7,24 (д, 2H), 7,10-7,04 (м, 2H), 6,93 (д, 1H), 6,82 (д, 1H), 5,98 (с, 2H), 2,74 (м, 4 H), 2,47 (с, 3H), 2,07 (м, 2H).
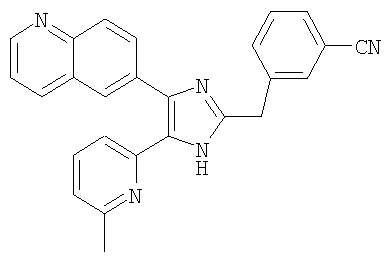
Пример получения 7: Получение 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила (Пример 40)
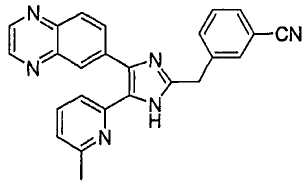
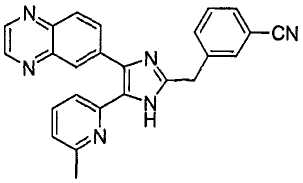
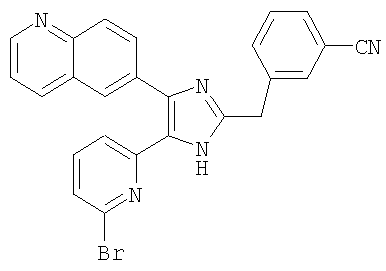
К раствору 1-(6-метилпиридин-2-ил)-2-(хиноксалин-6-ил)этан-1,2-дион (40,0 г, 144,26 ммоль) (получен согласно способу, описанному в WO 02/055077 A1) в смеси трет-бутилметилового эфира (350 мл) и MeOH (350 мл) добавляли 3-(формилметил)бензонитрил (23,03 г, 158,69 ммоль) (получен согласно способу, описанному в WO 02/096875 A1 ) в трет-бутилметиловом эфире (350 мл) и NH4OAc (111,00 г, 1,44 моль) в MeOH (350 мл), смесь перемешивали при 45°C в течение ночи. pH реакционной смеси доводили до pH 7-8 при 0°C насыщенным раствором NaHCO3. После удаления растворителя реакционную смесь экстрагировали CH2Cl2 (3 × 800 мл), раствор CH2Cl2 высушивали (над безводным MgSO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали MPLC на силикагеле с применением смеси MeOH и CH2Cl2 (1:19, затем 1:9 (по объему)) в качестве элюента, что дало 28,98 г (50%, неочищенное соединение) 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила в виде твердого вещества. MS (ESI) m/z: 403,14 (MH+). 1H-ЯМР спектр (400 МГц, CDCl3): δ 8,84 (м, 2H), 8,39 (с, 1H), 8,15 (с, 2H), 7,56 (с, 1H), 7,46 (м, 3H), 7,37 (д, 1H), 7,32 (т, 1H), 6,99 (д, 1H), 4,17 (с, 2H), 2,37 (с, 3H).
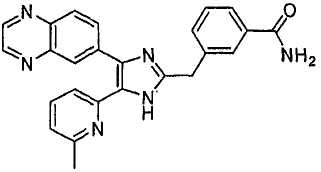
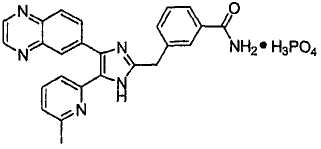
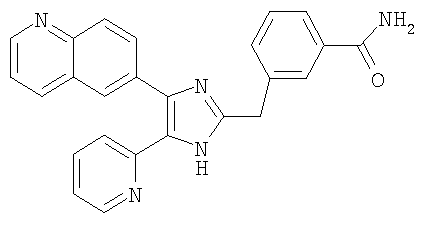
Пример получения 8: Получение 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида (Пример 41)
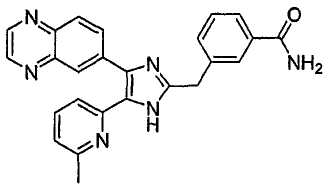
К перемешиваемому раствору 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензонитрила (28,98 г, 72,58 ммоль) в EtOH (250 мл) добавляли 30% H2O2 (4,85 мл, 39,92 ммоль) и 1 н. раствор NaOH (250 мл). Смесь нагревали до 40°C в течение 30 минут, и затем к полученному раствору добавляли 30% H2O2 (4,85 мл, 39,92 ммоль). Через 30 минут к реакционной смеси добавляли 1 н. HCl при 0°C, доводя pH до 7-8. После удаления растворителя остаток экстрагировали повторно CH2Cl2 (3 × 450 мл). Объединенный раствор CH2Cl2 высушивали (над безводным MgSO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали MPLC на силикагеле с применением смеси MeOH и CH2Cl2 (1:9, затем 1:5 (по объему)) в качестве элюента, что дало 18,49 г (61%) 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида в виде твердого вещества. MS (ESI) m/z: 421,23 (MH+). 1H-ЯМР спектр (400 МГц, CDCl3): δ 8,79 (с, 2H), 8,34 (с, 1H), 8,06 (с, 2H), 7,71 (с, 1H), 7,55 (д, 1H), 7,41 (т, 1H), 7,34 (д, 1H), 7,29 (д, 1H), 7,19 (т, 1H), 6,96 (д, 1H), 6,83 (уш. с, 1H), 6,30 (уш. с, 1H), 4,13 (с, 2H), 2,36 (с, 3H).
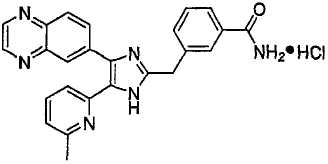
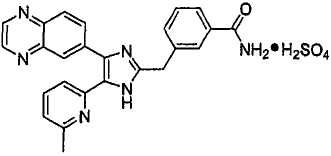
Пример получения 9: Получение гидрохлорида 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида (Пример 58)
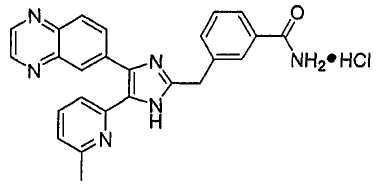
3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамид (5,0 г, 11,89 ммоль) растворяли в сухом CH2Cl2 (40 мл), фильтровали через стеклянный фильтр и промывали сухим CH2Cl2 (20 мл). Раствор CH2Cl2 охлаждали до 0°C и к нему добавляли 1,0 M HCl в Et2O (18 мл, 18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 минут, упаривали досуха при пониженном давлении и высушивали в течение ночи над P2O5, что дало 5,25 г (97%) гидрохлорида 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида в виде слабо-желтого порошка. 1H-ЯМР спектр (400 МГц, DMSO-d6): δ 9,03 (с, 2H), 8,48 (д, 1H), 8,19 (д, 1H), 8,11 (м, 1H), 8,06 (д, 1H), 8,04 (д, 1H), 7,83 (м, 1H), 7,80 (т, 1H), 7,74 (м, 1H), 7,48 (м, 2H), 7,45 (уш. с, 1H), 7,38 (д, 1H), 4,54 (с, 2H), 2,54 (с, 3H).
Пример получения 10: Получение сульфата 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида (Пример 59)
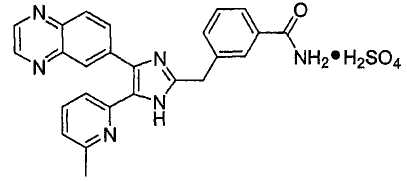
К перемешиваемому раствору 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида (50 мг, 0,12 ммоль) в сухом CH2Cl2 (2 мл) добавляли 10% H2SO4 в EtOH (80 мкл, 0,14 ммоль), и смесь перемешивали при комнатной температуре в течении 15 минут. Реакционную смесь добавляли к MeOH (1 мл) и затем быстро выливали в безводный Et2O (15 мл). Выпавший твердый осадок собирали фильтрованием и высушивали в течение ночи над P2O5, что дало 54 мг (88%) сульфата 3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)H-имидазол-2-ил)метил)бензамида в виде слабо-желтого порошка. 1H-ЯМР спектр (400 МГц, DMSO-d6): δ 9,03 (с, 2H), 8,41 (д, 1H), 8,22 (д, 1H), 8,01-7,88 (м, 3H), 7,83 (м, 1H), 7,79 (т, 1H), 7,62 (д, 1H), 7,49 (т, 1H), 7,44 (уш. с, 1H), 7,39 (д, 1H), 7,35 (д, 1H), 4,45 (с, 2H), 2,58 (с, 3H).
Соединения, перечисленные в нижеследующей Таблице 1, были получены способами, аналогичными тем, что описаны в примерах получения 1-10 ранее. Данные масс-спектрометрии этих соединений включены в Таблицу 1.
m/z (MH+)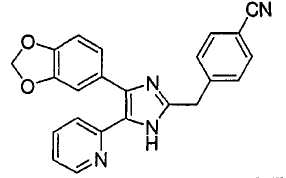

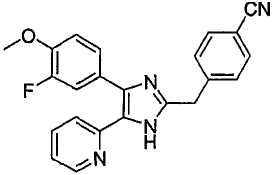
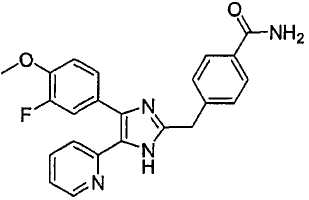


ДАННЫЕ БИОЛОГИЧЕСКИХ ИСПЫТАНИЙ
Биологическая активность соединений данного изобретения может быть исследована с применением следующих тестов:
Бесклеточный тест для оценки ингибирования ALK5-киназного фосфорилирования Smad3
Конститутивно активный, His-меченый ALK5 (T204D) и полноразмерный белок Smad3 экпрессировался в клетках насекомых с применением экспрессионной системы бакуловируса Invitrogen BacNBlue. Экспрессированные белки очищали на колонке с полимером Qiagen Ni-NTA. Очищенный белок Smad3, 200 нг, смешивали с 100 мкл 0,1 M натрий бикарбонатного покрывающего буфера и наносили в флэш-плашки с помощью пипетки. Плашки закрывали и инкубировали при 4°C в течение 16 часов. Затем плашки промывали 3 раза 200 мкл покрывающего буфера и оставляли блокироваться с 1% BSA в PBS при комнатной температуре в течение 1 часа. Очищенный белок ALK5, 100 нг, смешивали с 100 мкл реакционного буфера, содержащего 20 мМ Tris-HCl (pH 7,4), 5 мМ MgCl2, 1 мМ CaCl2, 1 мМ DTT, 1 мкМ ATP и 2 мкКи γ-32P-ATP, и 1 мкл каждого тестируемого соединения формулы (I), в виде раствора в 100% DMSO при различных концентрациях. Затем тест начинали добавлением реакционной смеси ALK5 в флэш-плашки, покрытые Smad3, после чего инкубировали при 30°C в течение 3 часов. После инкубирования аналитический буфер удаляли и промывали 3 раза 200 мкл 10 мМ раствора пирофосфата натрия. Затем флэш-плашки высушивали на воздухе и проводили подсчет на счетчике Packard TopCount.
Соединения формулы (I) обычно показывали величину IC50 менее 10 мкМ; некоторые показывали величину IC50 менее 1 мкМ; и некоторые даже показывали величину IC50 менее 50 нМ.
Бесклеточный тест для оценки ингибирования ALK4-киназного фосфорилирования Smad3
Ингибирование ALK4-киназного фосфорилирования Smad3 тестовыми соединениями формулы (I) может быть определено способом, подобным тому, что описан выше для ингибирования ALK5, за исключением того, что аналогичным образом His-меченый ALK4 применяли вместо конститутивно активного, His-меченого ALK5.
Соединения формулы (I) обычно показывали величину IC50 менее 10 мкМ; некоторые показывали величину IC50 менее 1 мкМ.
Исследование для оценки клеточного ингибирования передачи сигналов TGF-β
Биологическую активность соединений формулы (I) определяли путем измерения их способности ингибировать TGF-β1-индуцированную активность репортера Smad-связывающего элемента люциферазы (SBE-Luc) и активность репортера PAI-1-люциферазы (p3TP-Lux) в клетках HepG2. Клетки HepG2 кратковременно трансфицировали или репортерной конструкцией SBE-Luc, или репортерной конструкцией p3TP-Lux, выращенными в среде DMEM, содержащей 10% FBS, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ L-глутамина, 1 мМ пирувата натрия, и заменимых аминокислот. Трансфицированные клетки затем добавляли при концентрации 2,5 × 104 клеток/лунка в 96-луночные планшеты и истощали в течение 3-6 часов в среде с 0,5% FBS при 37°C в инкубаторе с 5% CO2. Затем клетки стимулировали 5 нг/мл лиганда TGF-β1 в минимальной среде, содержащей 1% DMSO или в присутствии, или отсутствии тестируемого соединения формулы (I), и инкубировали при 37°C в термостате с 5% CO2 в течение 24 часов. Среду промывали, и активность люциферазы в клеточных лизатах определяли с применением люциферазной системы для анализа (Promega).
Соединения формулы (I) обычно показывали величину IC50 менее 10 мкМ; некоторые показывали величину IC50 менее 1 мкМ; и некоторые даже показывали величину IC50 менее 50 нМ.
Приложение
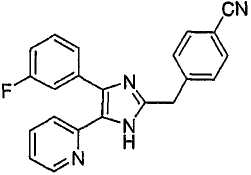
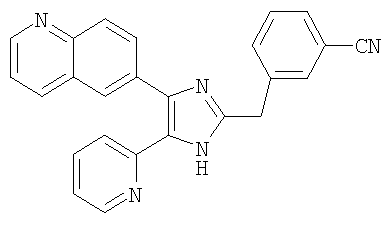
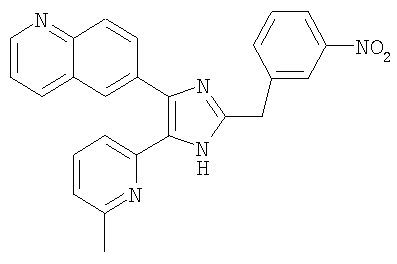
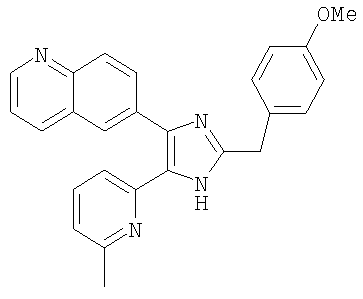
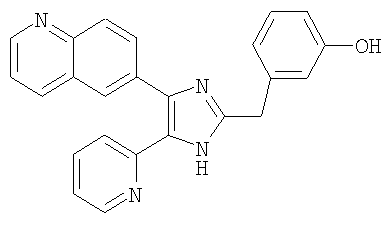
Пример получения 11: Получение 3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил-1H-имидазол-2-ил)метил)бензонитрила (Пример 5)
К перемешиваемому раствору 1-(хинолин-6-ил)-2-(6-метилпиридин-2-ил)этан-1,2-диона (80,1 г, 0,29 мол.) (полученному согласно способу, описанному в WO 01/62756 А1) в МеОН (700 мл) добавляли NH4OAc (446,3 г, 5,79 мол.1) и 4-(формилметил)бензонитрил (84,2 г, 0,58 мол.) (полученный согласно способу, описанному в WO 02/096875 А1) в трет-бутил-метиловом эфире (700 мл) и смесь перемешивают при 40-50°С в течение 18 часов. Реакционную смесь упаривали при пониженном давлении и рН доводили до рН 8 насыщенным раствором NaHCO3. Полученную смесь экстрагировали CH2Cl2 (1000 мл × 2) и органический слой промывали водой (200 мл) и солевым раствором (200 мл), сушили (MgSO4), фильтровали и упаривали при пониженном давлении. Остаток очищали на силикагеле с применением смеси МеОН и CH2Cl2 (1:10 (по объему)) в качестве элюента, что дало указанное в заголовке соединение (46,5 г, 40%).
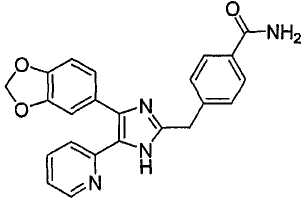
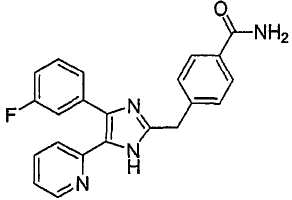
Пример получения 12: Получение 3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)бензамида (Пример 6)
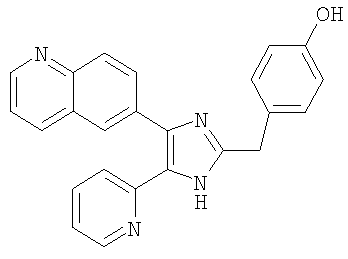
К раствору 3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил-1H-имидазол-2-ил)метил)бензонитрила (Пример 5) (510 мг, 1,25 ммоль) в этаноле (5 мл) добавляли 1 н. NaOH (8,3 мл, 8,3 ммоль) и 30% H2O2 (282 мкл, 2,49 ммоль), и смесь перемешивали при 60°С. После перемешивания в течение 6 часов смесь охлаждали до 0°С, разбавляли Н2О (5 мл), нейтрализовали водным 2 н. раствором HCl до рН 7-8, и перемешивали в течение 24 часов. Осадок твердого вещества собирали на фильтре, промывали водой и Et2O, и сушили под вакуумом. Твердое вещество очищали MPLC на силикагеле, используя смесь МеОН и CH2Cl2 (1:19, затем 1:9(по объему)) в качестве элюента, что дало указанное в заголовке соединение (337 мг, 50%).
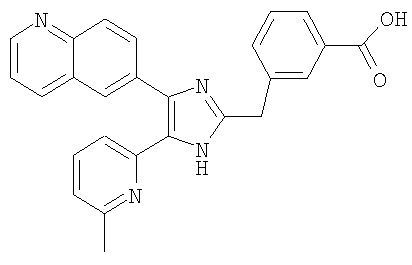
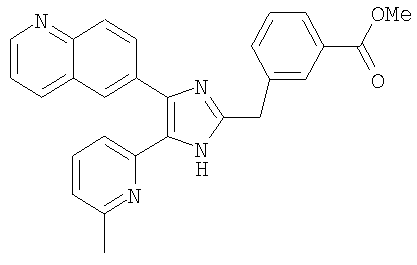
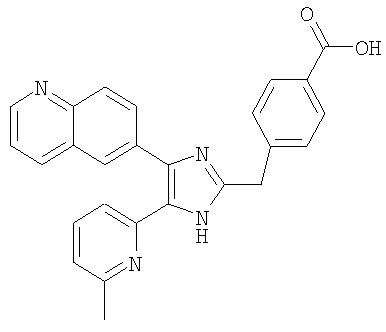
Пример получения 13: Получение 3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)бензойной кислоты (Пример 7)
3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1Н-имидазол-2-ил)метил)бензамид (Пример 6) (200 мг, 0,50 ммоль) растворяли в конц. HCl (2 мл) и нагревали при кипении с обратным холодильником. После перемешивания в течение 15 часов реакционную смесь охлаждали до комнатной температуры и рН доводили до рН 9 с помощью 6 М водного раствора NaOH. Полученную смесь промывали СН2Cl2 и подкисляли до рН 4-5 1 н. водным раствором HCl. Осадок твердого вещества собирали фильтрованием, промывали водой и сушили при пониженном давлении. Твердое вещество очищали перекристаллизацией из смеси МеОН и CH3CN с получением указанного в заголовке соединения (146 мг, 69%).
Пример получения 14: Получение метил 3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)бензоата (Пример 21)
К раствору 3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)бензойной кислоты (Пример 7) (50 мг, 0,119 ммоль) в МеОН (2 мл) добавляли H2SO4 (0,2 мл) и нагревали при температуре кипения с обратным холодильником. После перемешивания в течение 3 часов реакционную смесь охлаждали до комнатной температуры и упаривали досуха при пониженном давлении.
Остаток растворяли в насыщенном растворе NaHCO3, и смесь экстрагировали СН2Cl2. Органический слой сушили (Na2SO4), фильтровали и упаривали досуха при пониженном давлении, что дало указанное в заголовке соединение (50 мг, 97%).
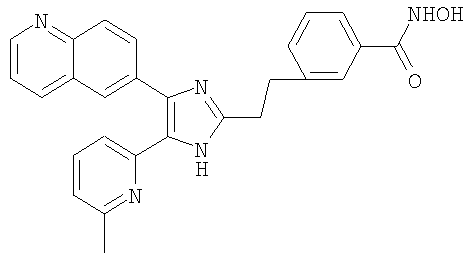
Пример получения 15: Получение N-гидрокси-3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)бензамида (Пример 13)
Метил 3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)бензоат (Пример 21) (50 мг, 0,115 ммоль) растворяли в растворе 2,3 М NH2OH в МеОН (2 мл) и перемешивали при комнатной температуре. Через 15 часов рН реакционной смеси доводили до рН 6 с помощью 1 н. водного раствора HCl. Полученную смесь экстрагировали смесью МеОН и СН2Cl2 (1:10(по объему)). Органический слой сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали MPLC на NH-силикагеле, применяя смесь МеОН и СН2Cl2 (1:10(по объему)) в качестве элюента, что дало указанное в заголовке соединение (19 мг, 38%).
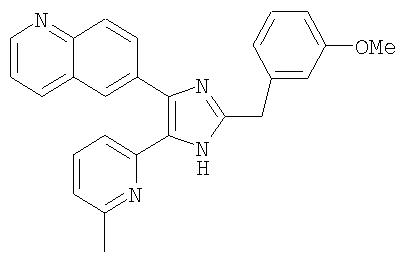
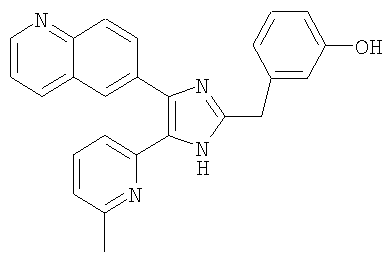
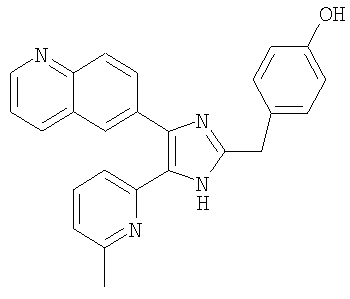
Пример получения 16: Получение 3-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)фенол (Пример 16)
К раствору 6-(2-(3-метоксибензил)-5-(6-метилпиридин-2-ил)-1H-имидазол-4-ил)хинолина (Пример 15) (300 мг, 0,74 ммоль) в уксусной кислоте (5 мл) добавляли 48% водный раствор HBr (5 мл) и перемешивали при 105°С в течение 15 часов. Реакционную смесь охлаждали до комнатной температуры и упаривали досуха при пониженном давлении. Остаток растворяли в насыщенном растворе NaHCO3 и экстрагировали смесью МеОН и СН2Cl2 (1:9(по объему)). Органический слой сушили (Na2SO4), фильтровали и упаривали досуха при пониженном давлении. Остаток очищали MPLC на силикагеле, применяя смесь МеОН и СН2Cl2 (1:9(по объему)) в качестве элюента, что дало указанное в заголовке соединение (260 мг, 90%).
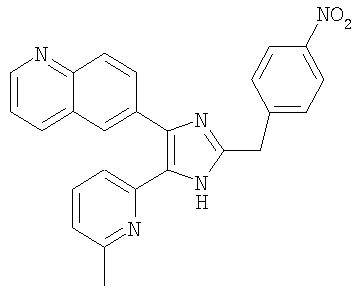
Пример получения 17: Получение 4-((5-(6-метилпиридин-2-ил)-4-(дхинолин-6-ил)-1H-имидазол-2-ил)метил)бензамина (Пример 23)
6-(2-(4-Нитробензил)-5-(6-метилпиридин-2-ил)-1Н-имидазол-4-ил)хинолин (Пример 20) (93,6 мг, 0,22 ммоль) и SnCl2 (210,5 мл, 1,11 ммоль) суспендировали в МеОН (3 мл), и смесь перемешивали при 50°С. После перемешивания в течение 5 часов реакционную смесь упаривали досуха при пониженном давлении, разбавляли H2O, нейтрализовали 2 М водным раствором NaOH до рН 8. Осадок твердого вещества собирали фильтрованием, промывали водой и Et2O, и сушили под вакуумом (74 мг, 85%).
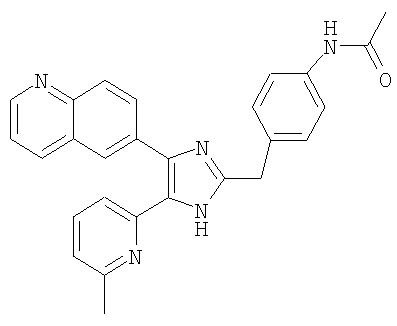
Пример получения 18: Получение N-(4-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)фенил)ацетамида (Пример 31)
К раствору 4-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил) метил)бензамина (Пример 23) (40 мг, 0,102 ммоль в пиридине (1,5 мл) добавляли ацетилхлорид (8, 0 мкл, 0,112 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь упаривали досуха при пониженном давлении, разбавляли водой Н2O, подкисляли 4 н. водным раствором HCl до рН 2, и рН полученного раствора доводили до рН 9. Осадок твердого вещества собирали фильтрованием, промывали водой и Et2O, и сушили под вакуумом (42,3 мг, 96%).
Пример получения 19: Получение N-(4-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)фенил)метансульфонамид (Пример 36)
К раствору 4-((5-(6-метилпиридин-2-ил)-4-(хинолин-6-ил)-1H-имидазол-2-ил)метил)бензамина (Пример 23) (40 мг, 0,102 ммоль) в пиридине (1,5 мл) добавляли метансульфонилхлорид (8,7 мкл, 0,112 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь упаривали досуха при пониженном давлении, разбавляли Н2O, подкисляли 4 н. водным раствором HCl до рН 2, и рН полученного раствора доводили до рН 9. Осадок твердого вещества собирали фильтрованием, промывали водой и Et2O, и сушили под вакуумом (45,3 мг, 95%).
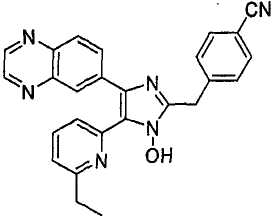
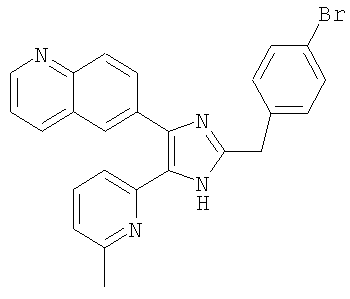
Соединения, перечисленные в нижеследующей Таблице 2, были получены способами, аналогичными тем, которые описаны в примерах получения 11-19 выше. Данные 1H ЯМР-спектров и масс-спектрометрии этих соединений включены в Таблицу 2.
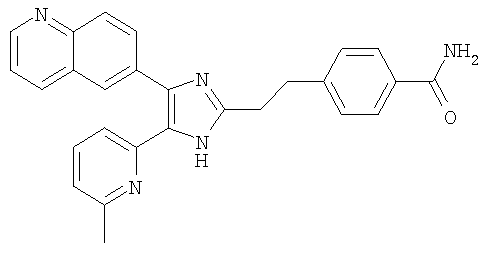
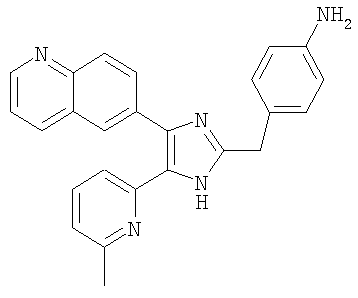
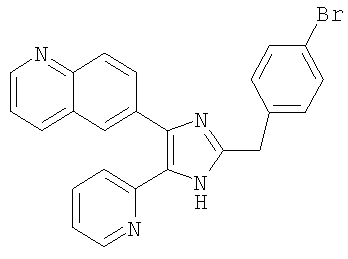
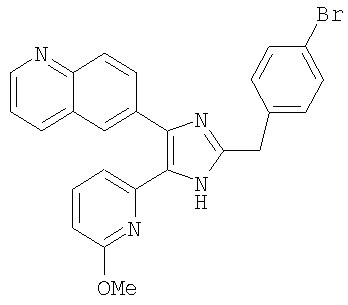

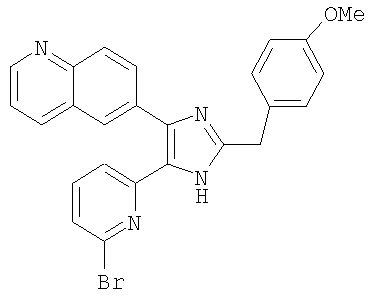
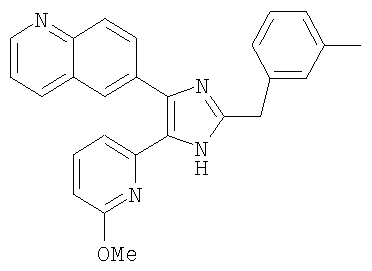
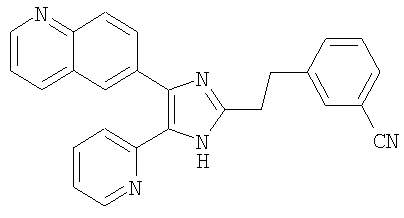
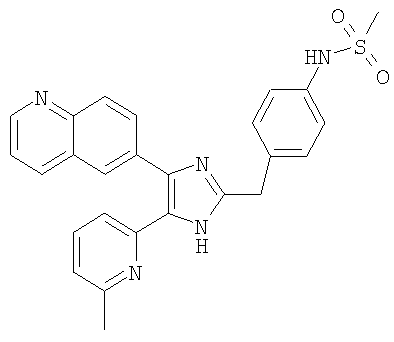
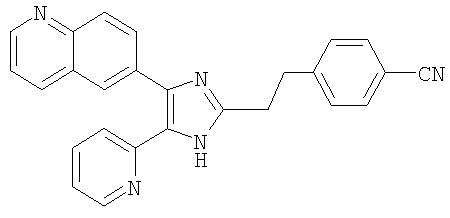
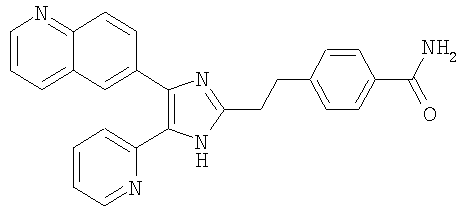
| название | год | авторы | номер документа |
|---|---|---|---|
| 2-ПИРИДИЛЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ALK5 И/ИЛИ ALK4 | 2012 |
|
RU2612958C2 |
| 2-ПИРИДИЛЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ В КАЧЕСИВЕ ТЕРАПЕВТИЧЕСКИХ ИНГИБИТОРОВ ALK5 И/ИЛИ ALK4 | 2011 |
|
RU2518069C1 |
| ПРОИЗВОДНЫЕ ТИЕНО[3,2-d]ПИРИМИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПРОТЕИНКИНАЗЫ | 2011 |
|
RU2524210C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА ДЛЯ ТОРМОЖЕНИЯ РОСТА РАКОВЫХ КЛЕТОК И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2362773C2 |
| 2-ЦИАНОПИРИМИДИН-4-ИЛКАРБАМАТ, ИЛИ ПРОИЗВОДНОЕ МОЧЕВИНЫ, ИЛИ ЕГО СОЛЬ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2019 |
|
RU2788740C2 |
| ПРОИЗВОДНЫЕ 1-(4-ИЗОКСАЗОЛ-5-ИЛ)-1Н-ПИРАЗОЛ-1-ИЛ)-2-МЕТИЛПРОПАН-2-ОЛА И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИРОРОВ ИЛ-17 И ИФН-ГАММА ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ И ХРОНИЧЕСКОГО ВОСПАЛЕНИЯ | 2018 |
|
RU2785342C2 |
| ПРОИЗВОДНЫЕ ДИАМИНОПИРИМИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2587981C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ СОСТОЯНИЙ, ОПОСРЕДОВАННЫХ СХСR4 И CCR5 | 2001 |
|
RU2277092C2 |
| ИНГИБИТОРЫ СЕТР | 2006 |
|
RU2513107C2 |
| ПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ (ВАРИАНТЫ), СПОСОБ ИХ ПОЛУЧЕНИЯ, КОМПОЗИЦИЯ ИХ СОДЕРЖАЩАЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С КИНАЗОЙ mTOR ИЛИ КИНАЗОЙ PI3K | 2010 |
|
RU2538200C2 |
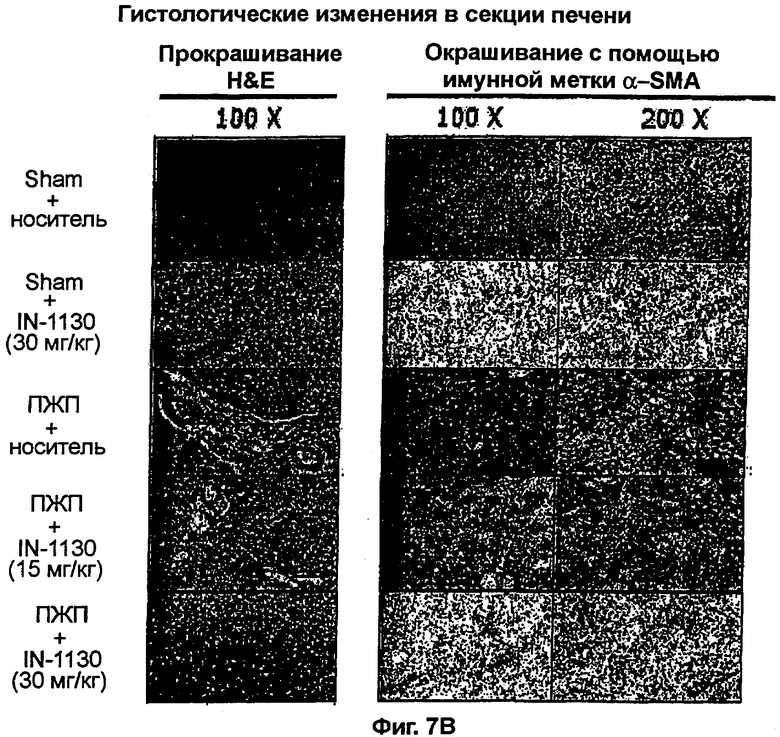
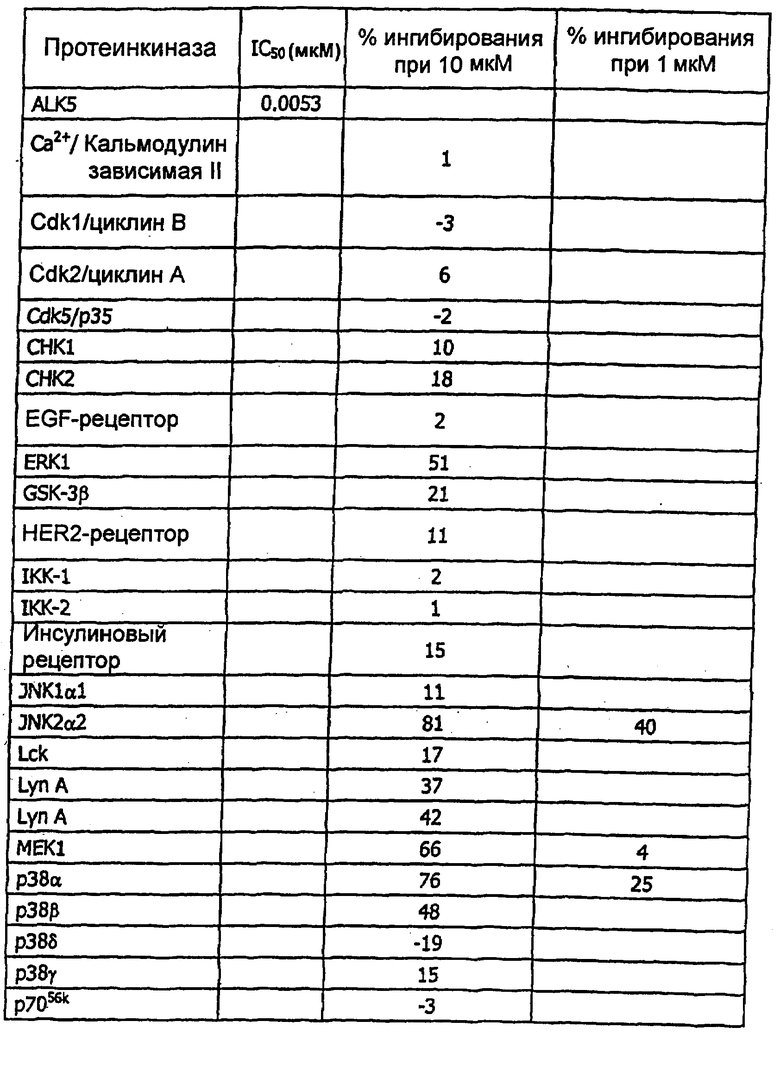
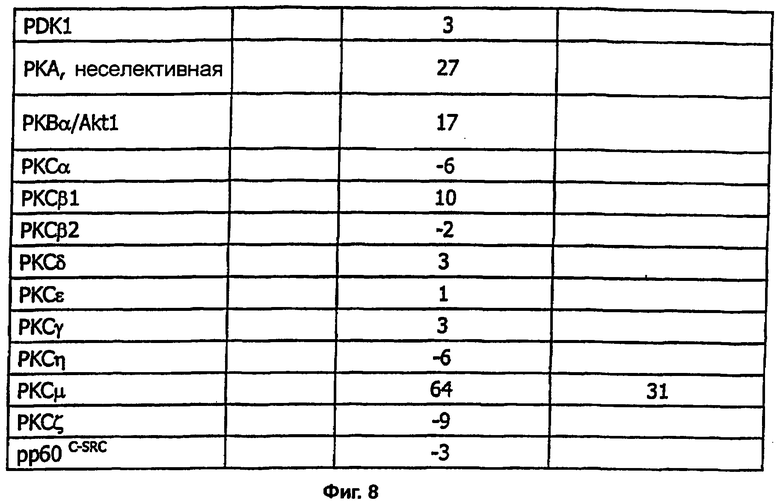
Изобретение относится к новым соединениям формулы (I) или к его фармацевтически приемлемым солям:
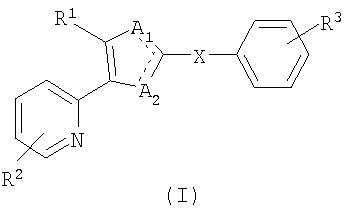
где R1 является фенильной группой, необязательно замещенной заместителями, выбранными из атома галогена, -O-C1-6-алкила; или R1 является фенилом, конденсированным с ароматическим или неароматическим 5-7-членным кольцом, где упомянутое кольцо может необязательно содержать до трех гетероатомов, независимо выбранных из N, О и S; R2 является водородом, -O-C1-6-алкилом, -C1-6-алкилом или атомом галогена; R3 является C1-6-алкилом, -(СН2)P-NO2, -(CH2)P-NR4R5, -(СН2)P-CONHOH, -(CH2)P-CN, -(CH2)P-СО2Н, -(CH2)P-СО2R4, -(CH2)P-CONR4R5, -(CH2)P-OR4, -(CH2)P-NHCOR4 или -(CH2)P-NHSO2R4; R4 и R5 являются независимо водородом или C1-6-алкилом; р равно 0, 1, 2, 3 или 4; X является C1-10-алкиленовой группой; один из A1 и A2 является атомом азота, а другой является NR7; и R7 является атомом водорода или ОН-группой. Изобретение также относится к фармацевтической композиции, к способу ингибирования путей передачи сигналов TGF-β и/или активина, к способу уменьшения накопления избыточного внеклеточного матрикса у млекопитающих, к способу ингибирования метастазов опухолевых клеток у млекопитающих, к способу лечения раковых новообразований, обусловленных сверхэкспрессией TGF-β, путем ингибирования пути передачи сигнала TGF-β у млекопитающих, к способу лечения заболевания, а также к способу ингибирования тромбоза у млекопитающих. Технический результат - получение новых биологически активных соединений, обладающих способностью к ингибированию активности рецепторов ALK5 и/или ALK4. 8 н. и 8 з.п. ф-лы, 2 табл., 8 ил.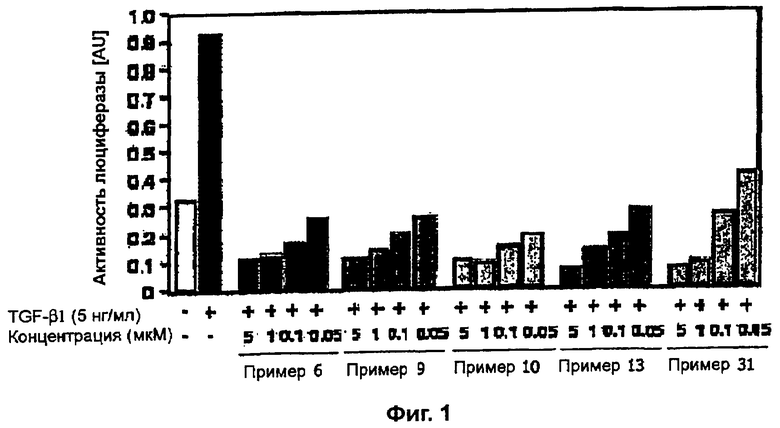
где R1 является фенильной группой, необязательно замещенной заместителями, выбранными из атома галогена, -O-C1-6-алкила или R1 является фенилом, конденсированным с ароматическим или неароматическим 5-7-членным кольцом, где упомянутое кольцо может необязательно содержать до трех гетероатомов, независимо выбранных из N, О и S;
R2 является водородом, -O-C1-6-алкилом, -C1-6-алкилом или атомом галогена;
R3 является С1-6-алкилом, -(CH2)P-NO2, -(СН2)P-NR4R5, -(CH2)P-CONHOH, -(CH2)P-CN, -(СН2)P-CO2Н, -(CH2)P-CO2R4, -(CH2)P-CONR4R5, -(CH2)P-OR4, -(CH2)P-NHCOR4 или -(CH2)P-NHSO2R4;
R4 и R5 являются независимо водородом или С1-6-алкилом;
р равно 0, 1, 2, 3 или 4;
X является C1-10-алкиленовой группой;
один из A1 и А2 является атомом азота, а другой является NR7; и
R7 является атомом водорода или ОН-группой.
R2 является отличным от водорода заместителем и находится в ортоположении по отношению к атому азота пиридильного цикла;
R3 является -(CH2)P-CONHOH, -(CH2)P-CN, -(СН2)P-CO2Н или -(CH2)P-CONR4R5;
R4 и R5 являются независимо водородом или С1-3-алкилом,
р равно 0, 1 или 2;
Х представляет собой C1-6-алкиленовую группу; и
один из A1 и А2 является атомом азота, а другой является NR7, где R7 является атомом водорода.
4-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)Н-имидазол-2-ил)метил)бензонитрила;
4-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
3-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)Н-имидазол-2-ил)метил)бензонитрила;
3-((4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
4-(2-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)Н-имидазол-2-ил)этил)бензонитрила;
4-(2-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
4-(3-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)Н-имидазол-2-ил)пропил)бензонитрила;
4-(3-(4-(бензо[1,3]диоксол-5-ил)-5-(6-метилпиридин-2-ил)-1(3)Н-имидазол-2-ил)пропил)бензамида;
4-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
4-((5-(6-этилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
4-((5-(6-н-пропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
4-((5-(6-изопропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
4-((5-(6-н-бутилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензонитрила;
3-((5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
3-((5-(6-этилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
3-((5-(6-н-пропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
3-((5-(6-изопропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
3-((5-(6-н-бутилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)метил)бензамида;
4-(2-(5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
4-(2-(5-(6-этилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
4-(2-(5-(6-н-пропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
4-(2-(5-(6-изопропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
4-(2-(5-(6-н-бутилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
3-(2-(5-(6-метилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
3-(2-(5-(6-этилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
3-(2-(5-(6-н-пропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
3-(2-(5-(6-изопропилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида;
3-(2-(5-(6-н-бутилпиридин-2-ил)-4-(хиноксалин-6-ил)-1(3)Н-имидазол-2-ил)этил)бензамида,
и их фармацевтически приемлемых солей.
| US 5656644 А, 12.08.1997 | |||
| WO 00/61576 A1, 19.10.2000 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| ЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБЫ ЛЕЧЕНИЯ ЦИТОКИН-ОПОСРЕДОВАННЫХ ЗАБОЛЕВАНИЙ | 1998 |
|
RU2222534C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2157368C2 |
Авторы
Даты
2009-03-10—Публикация
2004-11-09—Подача