На основании Раздела 35, Параграф 119 Кодекса США по данной заявке испрашивается приоритет в соответствии с канадской патентной заявкой № 2427722, поданной 29 апреля 2003 года, под названием «Способ изготовления катализатора и способ его применения для высокоэффективной конверсии матана в этилен», изобретатель Ибрагим Багхерзаде, заявка уступлена компании ХРД КОРП. (Хьюстон, штат Техас), Национальной Нефтехимической Компании, а также Компании по Нефтехимическим исследованиям и технологиям Тегерана (Иран).
Изобретение относится к синтезу высших углеводородов из метана. В частности, изобретение относится к способу изготовления катализатора на основе перовскита, для целей высокоэффективной конверсии метана в этилен.
Одна из наименее разрешенных проблем в гетерогенном катализе касается его использования в частичном окислении метана для образования более реактивных химических веществ, таких как этан, этилен и других алифатических углеводородов. Окислительная дегидроконденсация метана для образования этана и этилена являлась предметом обширных исследований, последовавших за работами первооткрывателей в данной области - Келлера и Басина в 1982 году. В частности, была широко изучена конверсия метана в этилен. Большинство исследователей стремились к повышению эффективности конверсии.
Было проведено множество исследований, и получено большое количество патентов на использование элементов в группах III, IV, V Периодической таблицы химических элементов, известных как переходные металлы. Оксиды щелочных металлов, оксиды щелочноземельных металлов и даже комплексы оксидов металлов использовали в качестве катализаторов для конверсии метана в этилен. В недавнем времени был опубликован ряд статей касательно конверсии метана в этилен, включая и статью авторов настоящего изобретения, озаглавленную "Реакционная способность катализаторов типа ATiOs (A=Ba, Sr, Ca) на основе перовскита и их воздействие на реакцию окислительной дегидроконденсации метана", Научно-Исследовательский Институт Нефтяных Отраслей Промышленности (RIPI) NIOC, том 3, №10, 1993, в которой обсуждаются хорошо определенные структуры данного катализатора, изготовленного по золь-гелевой технологии. Снятие характеристик этих структур производилось с помощью дифракции рентгеновских лучей (XRD), растрового электронного микроскопа (S.Е.М), по методике Брунауэра, Эммета и Теллера (В.Е.Т) и посредством подтверждения присутствия на поверхности карбоната, как определено с помощью ИК-спектроскопии преобразования Фурье (FTIR).
Были изучены кинетика и механизм окислительной дегидроконденсации метана с использованием катализатора на основе оксида натрия-марганца. Этот механизм подтвердился и для других катализаторов сходной структуры. Результаты этого исследования были представлены в статье, озаглавленной "Кинетика и механизм окислительной дегидроконденсации метана посредством катализатора на основе натрия - оксида марганца "Rahmatolah et al., Chem Eng Technol 16 (1993) 62-67. Реакция с использованием катализатора на основе натрия - оксида марганца происходит по механизму Ридиал-Редокса, который включает в себя как гомогенный, так и гетерогенный этапы реакции. Образование газовой фазы промежуточного продукта СН является результатом гетерогенного процесса (поверхностная реакция), а образование углеводородов С2+ соединением метиловых групп (СН3) является результатом гомогенного процесса газовой фазы.
Каталитическая активность конверсии метана в этилен зависит от константы скорости поверхностного окисления (Кох) и константы скорости восстановления (Red) между поверхностью кислорода (О2) и метана (СН4). Было показано, что кинетические результаты катализа Mn могут быть выражены скоростным уравнением, основанным на механизме Ридиал-Редокса. Кроме того, как сообщалось в статье "Окислительная дегидроконденсация метана в этилен посредством усиленного натрием оксида марганца", Golpasha et al., Journal of Engineering, Islamic Republic of Iran, vol.3, No. s 3&4, Nov 1990, было обнаружено, что катализатор на основе оксида марганца, усиленный натрием и поддерживаемый на кварце, обнаруживает удовлетворительную активность и селективность в отношении синтеза этилена из метана при оптимальных рабочих условиях с температурой 830°С при атмосферном давлении с соотношением метана к кислороду 2/1 (СН4/O2=2).
Кроме того, возможность коммерческого использования конверсии природного газа в этилен посредством прямых конверсионных реакций изучалась в докладе, озаглавленном "Возможность коммерциализации конверсии природного газа в этилен, осуществляемой посредством прямой конверсии", представленном автором данного изобретения на XVI Всемирном Нефтяном Конгрессе IIES-NIOC в июне 2000 года в Калгари (штат Альберта, Канада). В докладе сравнивались различные технологии конверсии природного газа с различных точек зрения, включая потребности в капиталовложениях, экономию на масштабах производства, эффективность катализатора, и демонстрировалась возможность коммерциализации процесса окислительной дегидроконденсации метана (ОСМ) посредством катализатора на основе пирохлоров, приготовленных по золь-гелевой технологии. Экспериментальный выход углеводородного продукта (НС) из представленной в докладе реакции с участием катализатора составляет 18-20% при 750-830°С при атмосферном давлении с помощью катализатора Sm2Sn2O7 (4).
Один из изобретателей в докладе "Прямая окислительная конверсия метана в этилен посредством катализатора на основе перовскита" на XIV Всемирном Нефтяном Конгрессе в 1994 году в Ставенгере (Норвегия), сообщал о каталитической окислительной дегидроконденсации метана с помощью катализаторов на основе перовскита, CaTiO3, приготовленных с помощью модифицированной керамической технологии, дающей выход углеводородов более 18-20% при 830°С. Катализатор усиливался с помощью Na4Р2O7, который незначительно улучшил эффективность катализатора.
Среди других разработок предшествующего уровня техники следует отметить: патент США № 4939310, раскрывающий способ конверсии метана в высшие углеводородные продукты с использованием оксида марганца при 500-1000°С в контакте со смесью из метана и кислорода. Патент США № 4443649 раскрывает способ конверсии метана в углерод с использованием того же катализатора, что и в патенте США № 4939310, но включает также сравнения с композициями, включающими Ni, Rh, Pd, Ag, Os, lr, Pt и Au вместо марганца. Патенты США №№ 4443649 и 4544787 демонстрируют использование марганца в различных типах катализаторов.
Патент США № 5695618 описывает окислительную дегидроконденсацию метана с использованием октаэдрального молекулярного сита в качестве катализатора.
Патент США № 6096934 описывает конверсию метана в этан и этилен с использованием того же катализатора, что и в патенте США №5.695. 618, использующем отгонку с паром в рамках того же способа.
Патент США № 5877387 описывает использование катализатора на основе Pb-замещенного гидроксиапатита для окислительной дегидроконденсации метана, которая происходит при 600°С.
Патент США № 4523050 описывает конверсию метана в высшие углеводороды. Согласно этому патенту обеспечивают контактирование смеси метана и кислорода с поверхностью твердого катализатора, содержащего Si, Mn или силикат марганца.
Подобным же образом, по патенту США 4,523,049 конверсию метана с помощью катализатора на основе марганца усиливают с помощью щелочного или щелочноземельного металла.
Патент США 4544784 описывает конверсию метана в углеводород с использованием катализаторов на основе оксидов металла марганца, которые включают в себя галогенные соединения. Этот усиленный катализатор способствует более эффективной конверсии и большему контакту газовой смеси с твердой поверхностью катализатора.
Патент США 5051390 описывает приготовление когель-катализатора в водном растворе. Растворимые соли щелочных металлов и щелочноземельных металлов смешивают с растворимыми металлами, которые могут быть термически разложимы для образования оксида металла и гидролизуемого силана при условии, что гомогенный когель получается без образования осадков и частиц. Полученный катализатор затем используют для конверсии метана в более тяжелые углеводороды, такие как этилен и этан.
До настоящего времени катализаторы, получаемые с использованием известных способов и разнообразных традиционных компонентов, способны были лишь конвертировать метан в высшие углеводороды, такие как этилен, с выходом примерно 20%. В наиболее предпочтительной ситуации катализаторы для прямой конверсии метана в высшие углеводороды могли бы способствовать получению упомянутых высших углеводородов с выходом более 20% для обеспечения коммерчески жизнеспособного способа производства этилена.
Авторы настоящего изобретения также разработали способ поддержания активности катализатора с течением времени посредством периодического добавления в реактор окислительной дегидроконденсации метана (ОСМ) галогенного источника в ходе конверсии ОСМ.
Как продемонстрировано в настоящем описании, был получен катализатор, способный конвертировать метан в этилен с выходом углеводородов (НС) более 30%. В одном варианте изобретения катализатор BaTiO3 специально используют в процессе окислительной дегидроконденсации метана (ОСМ), где обеспечивают достижение выхода этилена примерно 26%. Согласно другому варианту воплощения изобретения способ приготовления катализатора основан на керамической технологии (золь-золевой технологии) посредством смешивания оксида титана с карбонатом бария и хлоридом олова в водном растворе (деионизированной воде). Результирующую суспензию сушат, нагревают и прокаливают, получая в итоге катализатор на основе перовскита с улучшенными характеристиками для конверсии.
В широком аспекте изобретения, способ производства катализатора на основе перовскита предусматривает образование водной суспензии соли щелочноземельного металла, порошкообразной соли металла и порошкообразного оксида переходного металла, например, посредством смеси Ва (1-0.05х) + TiO2 + SnCl2 (0.05х), где х выражен в молях.
Определение этого состава производили в диапазоне Ва((1-2 моль - х) + TiO2 ((1 моль)) + SnCl2 (х), где х колеблется между 0.09 и 0.1 моль, или 0.95 моль бария на моль TiO2 до 0.05 моль SnCl2. К суспензии добавляют полимерное связующее вещество для образования пасты. Затем пасту высушивают и измельчают. Для того чтобы конвертировать металлы и оксиды металлов в кристаллическую структуру перовскита, получающийся порошок нагревают с использованием температурного профиля, соответствующего полимерному связующему веществу, и затем выдерживают при температуре, достаточной для прокаливания измельченной пасты, - вплоть до получения катализатора на основе перовскита. Полимерное связующее вещество выбирают из группы, включающей винилацетатдибутилакрилат и метилгидроксилэтилцеллюлозу. Посредством температурного профиля, соответствующего таким связующим веществам, увеличивают температуру с шагом 1/4 часа следующим образом: выдерживают при температуре примерно до 200°С, выдерживают при температуре примерно до 400°С, выдерживают при температуре примерно до 600°С, выдерживают и увеличивают температуру до температуры прокаливания - примерно до 700-1000°С, в предпочтительном варианте до 800°С.
Прокаленный порошок просеивают в соответствии с условиями применимости к ОСМ. Порошок сортируют по размеру, согласно требованиям пригодности для использования в каталитическом реакторе.
Катализатор настоящего изобретения применяют, в частности, для процесса ОСМ, предусматривающего контакт потока питающего газа, содержащего метан, и кислорода в реакторе окислительной дегидроконденсации в условиях окислительной дегидроконденсации в присутствии катализатора на основе перовскита.
Посредством периодического добавления галогенного источника в реактор ОСМ в ходе реакции окислительной дегидроконденсации активность катализатора поддерживают в течение длительного времени.
На Фиг.1а и 1б представлены сравнения кристаллических структур, полученных с помощью растровой электронной микроскопии (SEM), до и после применения температурного профиля согласно Фиг.2.
На Фиг.2 схематически показан возрастающий температурный профиль во время прокаливания катализатора в одном из вариантов реализации изобретения.
На Фиг.3 представлена дифракция - распечатка дифрактометра рентгеновских лучей, подтверждающая кристаллическую структуру до прокаливания (а), (с) и после (b), (d) прокаливания при 700°С и 1000°С, соответственно.
На Фиг.4 схематически представлен проточный реактор с неподвижным слоем кварца, использованный для осуществления окислительной дегидроконденсации метана с помощью катализаторов настоящего изобретения для получения этилена.
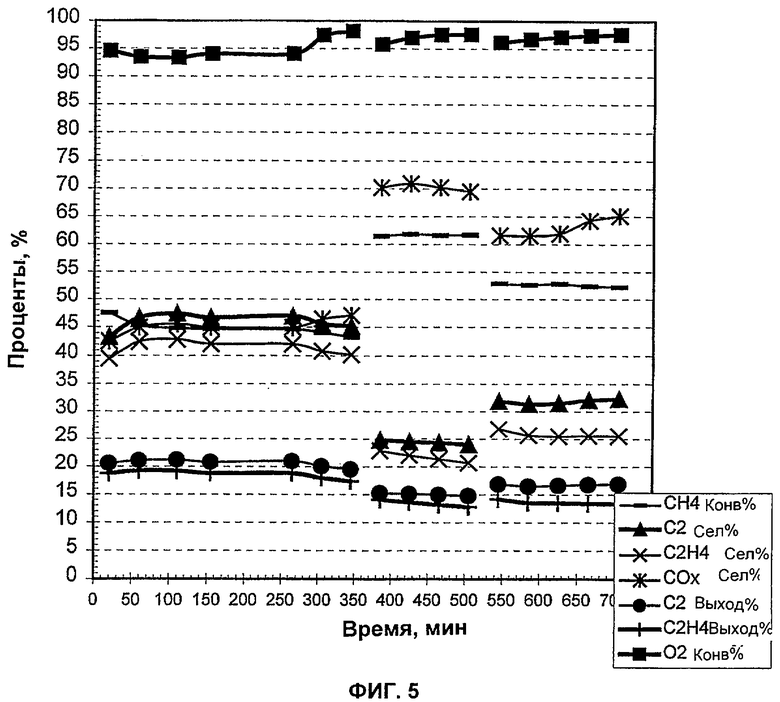
На Фиг.5 показаны результаты добавления тетрахлорида углерода (ССЦ) в конце окислительной дегидроконденсации метана в этилен в виде функции времени.
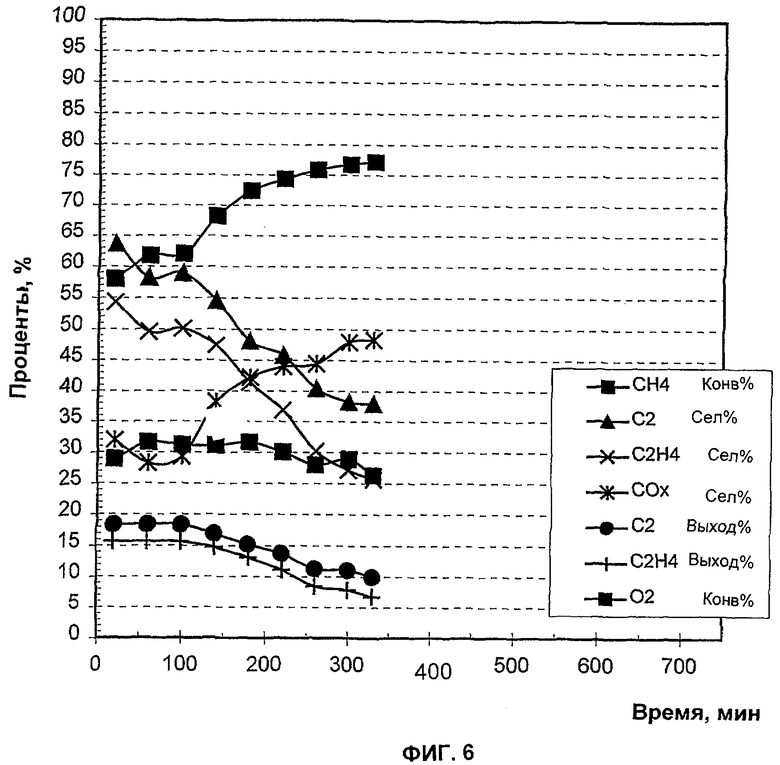
На Фиг.6 в виде функции времени показана окислительная дегидроконденсация метана в этилен при отсутствии тетрахлорида углерода (CCl4).
На Фиг.7 схематически представлен опытный реактор, использованный для осуществления окислительной дегидроконденсации метана с использованием катализатора по одному из вариантов реализации настоящего изобретения.
На Фиг.8 в виде функции времени показаны результаты добавления диоксида углерода (СО2) к питающему газа в конце окислительной дегидроконденсации метана в этилен.
Кристаллический катализатор в соответствии с настоящим изобретением на основе перовскита получают с использованием керамической (золь-золевой) технологии. Катализатор обладает улучшенными характеристиками по сравнению с катализаторами, полученными в результате известных золь-золевых технологий.
В целом, в соответствии с одним вариантом изобретения катализатор изготавливают с использованием золь-золевой технологии, первоначально заключающейся в смешивании солей щелочноземельного металла с оксидом переходного металла в водном растворителе (деионизированная вода) для получения суспензии. К суспензии добавляют полимерное связующее вещество, что способствует смешиванию компонентов и образованию пасты. Результирующую пасту высушивают и измельчают в ступке. Измельченные компоненты просеивают для получения размеров, совместимых с реактором с неподвижным слоем катализатора. Просеянные компоненты прокаливают, удаляя все нежелательные летучие вещества и комбинированные компоненты. Прокаливание производят с помощью ступенчатого многоэтапного повышения температуры с течением времени для образования кристаллической структуры перовскита.
Следствием применения способа является получение катализатора на основе перовскита общей формулы ABTiO3, имеющего кристаллическую структуру, которая хорошо подходит для частичного окисления метана и для производства этилена. В предпочтительном варианте А является Sn, a В является Ва.
В более специфическом варианте суспензию из солей щелочноземельного металла и оксида переходного металла приготавливают в водном растворителе, включающем в себя дистиллированную или деионизированную воду. Щелочноземельные компоненты выбирают из группы, включающей Ва, Са и Sr и их комбинаций. Соли металлов выбирают из группы, включающей Sn, Mg, Na, Li и Ва.
В одном из вариантов барий в виде карбоната (ВаСО3) смешивают в воде с солью металла, такой как хлорид олова (SnCl2), используемый в качестве промотора катализатора, и с оксидом переходного металла, таким как оксид титана (TiO3).
Компоненты энергично перемешивают, получая суспензию. К суспензии добавляют полимерное связующее вещество, такое как метилгидроксилэтилцеллюлозу или винилацетатбутилакрилат. Посредством связующего вещества обеспечивают адекватное смешивание компонентов, способствуют образованию пасты и улучшают конечный вид катализатора.
В лабораторном примере изготавливали 50 г образца компонентов. В цилиндрический лабораторный химический стакан диаметром 8.7 см и высотой 14.2 см наливали 50 см3 дистиллированной воды. Для перемешивания воды использовали смеситель, состоящий из турбины с плоской лопастью (3 см в диаметре) с частотой вращения 2000 об/мин. Компоненты добавляли к перемешиваемой воде до образования пасты. Пропорции готовили согласно формуле Ва (1-0.05х) + TiO2 + SnCl2 (0.05x), где х=1 моль (т.е. Ва((0.95 моль)) + TiO2 ((1 моль)) + SnCl2 (0.05 моль)).
Результирующую пасту сушили в термостате примерно при 110°С в течение времени, достаточного для просушивания пасты. В описанном выше примере это время составило 8 часов. В альтернативном варианте суспензию также высушивали на воздухе в течение времени, необходимого для испарения воды. Сушка на воздухе может занять больше времени, порядка 48 часов, в зависимости от многих окружающих условий и условий приготовления суспензии.
После сушки пасту измельчали. Для вышеописанного (лабораторного масштабированного примера), высушенную пасту измельчали в ступке или прессе для образования или получения первого калибра порошка, примерно отсортированного для каталитического реактора. Затем измельченный порошок прокаливали для удаления любых нежелательных летучих химически объединенных компонентов.
Измельченный материал содержал полимерные цепи, термолабильные при температуре прокаливания. Таким образом, измельченный материал подвергали возрастающему увеличению температуры в течение периода времени в эмпирически определенном температурном профиле с тем, чтобы активизировать образование кристалла, пока не будет достигнуто время соответствующей температуры прокаливания. Температурный профиль соответствовал полимерному связующему веществу, где усиливали образование кристаллической формы.
Как проиллюстрировано на Фиг.2, материал обычно подвергают ступенчатому этапному повышению температуры, которое предусматривает как само повышение температуры, так и выдерживание при этой температуре. Повышение температуры используют для достижения температурного профиля, который дополняет полимерное связующее вещество. Как известно специалистам в данной области, обычные температурные показатели для сгорания могут повышаться по мере увеличения времени и температуры. Например, при раннем повышении от окружающей температуры температурный показатель может быть около 200°С примерно за 1/4 часа с последующим периодом выдержки в течение 1/4 часа. Усредненные по периодам возрастания и выдерживания скорости находятся в диапазоне примерно от 75°С до примерно 200°С в течение примерно 1/2 часа, или примерно 200°С (180-220°С) - примерно 400°С в час. При конечных температурах прокаливания, где температуры выше и деструкция снижается, используют также более высокие температурные показатели. Подобным же образом, удовлетворительные режимы включают в себя также, большей частью, постоянные температурные режимы примерно 400°С в час.
Как показано на Фиг.2 (не в масштабе), рост повышений температуры примерно в 200°С происходит в течение 1/4-1/2 часа, за которым следует отрезок выдерживания, также равный 1/4-1/2 часа, пока не будет достигнута конечная температура в диапазоне примерно 700-1000°С, предпочтительно 800°С. Порошкообразный материал подвергают воздействию конечной температуре прокаливания в течение примерно дополнительных 8 часов или более. В течение этого времени осуществляют прокаливание. Таким образом, в одном варианте настоящего изобретения, начиная от комнатной температуры (окружающей температуры) примерно в 25°С, за 7 стадий по 1/4 часа обеспечивают конечную температуру прокаливания примерно в 800°С через 1 и 3/4 часа.
После прокаливания материал прессуют и затем измельчают под давлением (2-7 т/см3), просеивают, выбирая частицы порошка, имеющие размер, пригодный для использования в реакторе с неподвижным слоем катализатора, использованного для частичного окисления метана для получения этилена. Материал пригодного размера должен проходить через сито № 30.
Ссылаясь на Фиг.1а и 1б, для подтверждения образования необходимых псевдокубических трехмерных кристаллов перовскита получившегося катализатора, SnBaTiO3, показанных до и после прокаливания, используют растровую электронную микроскопию и дифракцию рентгеновских лучей.
Кристалл перовскита (SnBaTiO3) содержит титан в форме октаэдра и обнаруживает реакционную способность к окислительной дегидроконденсации метана в результате приобретения поверхности, допускающей контакт с газом метаном, и, в частности, обнаруживает большую пригодность для производства этилена, чем другие известные катализаторы. Хотя каждый атом водорода, присутствующий в газе, способен контактировать более чем с одним атомом кислорода на поверхности кристалла, контакт только с одним атомом кислорода, очевидно, требуется для образования гидроксила (ОН), необходимого для конверсии метана (СН4) в метил (СН3) и затем в этилен (C2H4).
Авторы обнаружили, что в одном из вариантов получающийся катализатор - катализатор SnBaTiO2 - обнаруживает селективность для производства этилена примерно 44%, давая выход этилена и более тяжелых соединений примерно 29.5% и конверсию метана примерно 67% при температуре реакции в диапазоне примерно от 600 до примерно 800°С. Использование золь-золевой технологии получения катализатора SnBaTiO2 воспроизводимо как в отношении структуры катализатора, так и в отношении ее способности получать воспроизводимый высокий выход этилена по сравнению с традиционными катализаторами при использовании для окислительной дегидроконденсации метана (ОСМ).
Реакция ОСМ завершается дегидрогенизацией метана в этан, в которой связь между одним из водородов и остатком молекулы метана ослабляется. ОСМ проводят в реакторе окислительной дегидроконденсации в условиях окислительной дегидроконденсации в присутствии катализатора на основе перовскита. Ослабление связи обеспечивает возможность частичного окисления молекулы метана, в результате давая этан. Затем этан конвертируют в этилен.
Катализатор отвечает за обеспечение узлов кислорода, которые соединяются с водородом, выделенным во время дегидрогенизации, вызывая конверсию метана (СН4) в метальную группу, СН3. Метильные группы могут затем свободно воссоединяться как этан, С2Н6.
Этан окисляется и становится этиленом C2H4. Свободный водород соединяется с кислородом, образуя воду.
На практике изобретатели обнаружили, что добавление небольших количеств галогенидов, таких как хлорид, в поток питающего газа в реакции ОСМ с использованием катализатора настоящего изобретения, обеспечивает большую стабильность и увеличивает срок службы катализатора. Предполагается, что хлор в газовой фазе в качестве R-Cl, такой как источники хлорида метана или хлорида этана, распространяет реакцию с выделением свободных радикалов посредством изменения свойств поверхности катализатора на основе перовскита. Также предполагается, что при условиях реакции добавленный галоген, такой как хлорид, образует свободные радикалы или ионы хлорида, которые способны распространять радикальную реакцию, формировать и влиять на селективность в отношении высших углеводородов (С2+).
Другие источники галогена (хлорида) включают в себя газообразный хлор, хлороформ, тетрахлорид углерода (CCl4), хлорид двухвалентного олова (SnCl2) и соляную кислоту (HCl). Источник галогена добавляют в реактор без остановки потока приточных газов.
Другие потенциальные источники хлорида, которые могут использоваться, включают в себя метиленхлорид, этилендихлорид и большинство остальных источников хлорида при условии, что эти источники не вводят других компонентов, например концентрации других катионов, таких как, только для примера, но не ограничиваясь указанным, натрий, Li, Sn, Ca, Ba, Pb, Ir, La, Rb, Rh, актиниды, другие лантаниды, различные олефины или другие компоненты, присутствие которых было бы вредным для процесса ОСМ, которые являлись бы ядом для катализатора, мешающим приточным газам, или неблагоприятно воздействовали на конечный продукт процесса.
Этилен признан важным для промышленности соединением ввиду того, что он является предшественником для синтеза большого количества соединений от мономеров, таких как стирол, до полимеров, сополимеров и сополимеров этилена с другими олефинами. Иные продукты, получающиеся в результате реакции этилена с другими субстратами, включают в себя такие различные продукты, как полиэтилены, этиленгликоли, этилендибромид, этилендихлорид, этилбензол, оксид этилена, и такие пластики, как полистирол и т.п.
Потенциальные субстраты, с которыми этилен и другие углеводороды, полученные в реакторе ОСМ, могли бы реагировать для получения таких продуктов, включают в себя одно или более соединений, например алифатические углеводороды, такие как этилен, пропилен, бутилен и т.п., алканы, такие как этан, пропан, бутан, пентан и т.п., алкины, ароматические соединения, такие как бензол или толуол и их производные, дополнительные газообразные кислород или хлор, другие галогены, такие как бром, фтор и йод.
Хотя многие способы предусматривают использование этилена в концентрациях более чем 90% чистого объема, некоторые из способов предусматривают применение этилена в концентрациях, полученных в результате описанных здесь реакций ОСМ.
Пример 1.
Окислительная дегидроконденсация метана. В соответствии с настоящим изобретениям с использованием золь-золевой технологии изготавливали различные катализаторы Применяли различные щелочноземельные металлы для использования в реакции прямой конверсии с целью получения этилена из метана. Катализаторы приготовляли с использованием основной формулы кристалла перовскита, ABTiO3, с тем, чтобы определить оптимальный катализатор на основе перовскита, способный неоднократно обеспечивать наибольший выход этилена. Исследовали комбинации, включающие А = олово (Sn), а В выбирали из группы, включающей В = Са, Sr, Ba или их комбинации. Формулу рассматривали в диапазоне Ва((1-2 молей - х) + TiO2 ((1 моль)) + SnCl2 (x), где х находился в диапазоне между 0.09 и 0.1 моль, или 0.95 моль бария на моль TiO2 к 0.05 моль SnCl2
Как проиллюстрировано на Фиг.4, эксперименты проводили в проточном реакторе с неподвижным слоем кварца, имеющим диаметр 10 мм при температуре примерно от 500°С до примерно 1000°С, в предпочтительном варианте диапазон задавали примерно от 700°С до примерно 800°С. Реактор работал при атмосферном давлении.
Общий расход питающего газа метан/кислород в соотношении 2:1 составлял 10-12 л/ч/г катализатора, и объемная скорость газа (GHSV) находилась в диапазоне 200-20000 в час. Способ осуществляли непрерывно и, анализировали продукты в оперативном режиме с помощью газового хроматографа (GC-HP6890 с HP-PLOT-Q) и колонки молекулярного сита 5А.
В Таблице 1 представлены различные приготовленные и испытанные катализаторы, процент конвертированного метана, процентное соотношение выхода этилена и процентное соотношение выхода углеводородов на моль, для каждого опыта.
Обнаружили, что способы с использованием щелочноземельных элементов имели различную активность, в частности: Са<Sr<Ва. Количество и выход конвертированного метана были наибольшими, когда использовали хлор, и катализатор, который обеспечивал оптимальные результаты, был таким, в котором щелочноземельным металлом являлся барий, а олово (Sn) использовали в качестве промотора. В частности, катализатор, использованный в тесте 7 (Табл.1), образовывали соединением 187,5 г ВаСО3 с 11,1 г SnCl2·2H2O и 80,0 г TiO2, обрабатывали, прокаливали и подвергали воздействию давления (7 т на квадратный дюйм) ранее описанным способом.
Метан, который вводили в питающий газ и использовали в реакции, был полностью чистым или смешанным с углеводородными газами, такими как этан, вплоть до С2+, имевший соотношение метана к кислороду на молярной основе 2:1 с расходом в диапазоне 10-12 л в час-1 на г-1 катализатора. Кроме того, в альтернативных вариантах использовали газы Не или N2, которые применяли в качестве разбавителей, а реакцию проводили при атмосферном давлении. Продуктами прямой конверсии метана являются этан, этилен, оксид углерода, диоксид углерода и вода.
Разложение катализатора сдерживали присутствием в питающем потоке галогенизированных компонентов.
Полученный катализатор имел псевдокубическую форму кристалла перовскита, которая была стабильной до и после прокаливания.
Пример 2.
Опыт окислительной дегидроконденсации метана: эффект от добавления галогена. В Примерах 2-3 ОСМ проводили с использованием опытного реактора примерно с 30,5 г катализатора, приготовленного из смеси карбоната бария, хлорида олова и оксида титана в соотношении 39,3 г; 11,4 г; 19,2 г. Затем получившийся катализатор гранулировали при давлении 5,5 т/см3 и измельчали на частицы диаметром 1,96-3,96 мм.
Применяли камеру реактора модели SS316 с размерами внешнего диаметра 25 мм, внутреннего диаметра 21 мм, длиной 490 мм. Камеру оснащали кварцевой футеровкой и кварцевой набивкой, катализатор набивали ближе к середине камеры реактора и не разбавляли, как показано на Фиг.7 (показана верхняя подача газа). Оценивали эффект верхней и нижней подачи газа; лучшие результаты (Табл.2) получали при нижней подаче газа. Верхнюю и нижнюю части реактора набивали частицами кварца диаметром 1,98-3,96 мм.
В этом примере галоген в виде тетрахлорида углерода (CCl4) впрыскивали во впускное отверстие реактора в различное время, в различное время отбирали пробы образца (TOS), и определялся процент конверсии (конв.), селективность (сел.) или выход данных продуктов, показанные на Фиг.5.
Для этого примера параметры были следующими:
размер частиц катализатора: 2-4 мм (1,96-3,96 мм);
количество использованного катализатора: 20 см3/30,5 г.
Метан/кислород/азот: молярное соотношение входного газа:
CH4:O2:N2=2:1:4,
или
1:1:2,
или
2:1.5:4,
WHSVCl=0.16; GHSV=1175 или 1331, или 1265; 18 мм.
Реактор QTL, - во впускное отверстие реактора каждые два часа впрыскивали CCl4 (0,2 микролитра ((μI)).
Объемную скорость газа (GHSV) регулировали в диапазоне от 1175 до 1331 или 1265 в заданные периоды времени, а паузы, показанные в графических данных, показывают, где происходили изменения расхода GHSV.
Полученные данные указывают, что присутствие галогена в реакторе поддерживает конверсию метана в этилен в течение длительного времени (Фиг.5) по сравнению с отсутствием галогена (Фиг.6). Селективность этилена находится в диапазоне 40-45% в течение ранних фаз эксперимента, примерно 20-30% в течение его последних стадий (Фиг.5). Выход этилена составлял около 20% в течение ранних фаз.
Пример 3.
Для этого примера использовали тот же катализатор, что и для Примера 2, но неразбавленный галоген в реактор не добавляли.
Для этого примера параметры были следующими:
метан/кислород/азот: молярное соотношение входного газа: СН4:O2:N2 был 2:1:8. GHSV=5123; WHSVCl=0,44.
Применяли футерованный кварцем реактор, CCl4 не добавляли.
Пример 4.
Влияние диоксида углерода. Газ диоксид углерода (CO2) добавляли к смеси приточных газов так, чтобы смесь приточных газов содержала СН4:O2:N2:CO2 в соотношении 2:1:1:2, при GHSV 3300 и затем 1550; WHSV с 1 0.45/0.21, и пузырь тетрахлорида углерода (CCl4) инжектировали с азотом в течение 3 минут через каждый час, катализатор из опыта №7 (из Табл.1) - 13 см3/22,6 г, неразбавленный.
Результаты (Фиг.8) показывают, что происходила конверсия метана более 90% с выходом этилена более 30% и поддерживалась в течение реакции ОСМ.
Пример 5.
Влияние добавления воды. В этом примере реактор нагревали в верхней, средней и нижней частях тремя независимыми печами (печь 1, печь 2 и печь 3), как показано на Фиг.7. Сначала реактор нагревали до 450°С с помощью азота с расходом примерно 100 мл/мин. При температуре 450°С и выше реактор подогревали смесью реагентов, которая включала воду. При этом воду накачивали с помощью насоса, показанного на Фиг.7. В качестве питающих газов применяли азот, (N2) кислород (O2) и метан (CH4) (Фиг.7).
Азот: 150 мл/мин (расход газа дан при 0°С и 1 атм.).
Кислород: 201 мл/мин.
Метан: 407 мл/мин.
Вода: 76,5 г/ч = 1587 мл/мин (пар, вычисленный при 0°С и 1 атм.).
Смесь реагентов (в молях) представляет собой N2:O2:CH4:H2O=1.5:2:4:15.9 (6.40, 8.57, 17.36, и 67.67 моль %, соответственно).
Температуру реактора регулировали в температурном диапазоне между 700 и 800°С.
Пробы анализировали с использованием газового хроматографа (GC), как было описано ранее.
Результаты (Табл.2) предполагают, что хлорид десорбировал из катализатора в ходе реакции.
Существуют альтернативные варианты, предусматривающие добавление в реактор галогена, такие как непрерывное или "порционное" (периодическое добавление определенного количества агента) нагнетание. Во время реакции в этом примере тетрахлорид углерода CCl4 впрыскивали микрошприцем со скоростью 0,2 микролитра каждые два часа для поддержания высокой активности катализатора.
| название | год | авторы | номер документа |
|---|---|---|---|
| МНОГОСЛОЙНЫЙ СМЕШАННЫЙ ОКСИДНЫЙ КАТАЛИЗАТОР, НАНЕСЕННЫЙ НА НОСИТЕЛЬ, ДЛЯ ОКИСЛИТЕЛЬНОЙ КОНДЕНСАЦИИ МЕТАНА | 2020 |
|
RU2783516C1 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2010 |
|
RU2433950C1 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2014 |
|
RU2573005C1 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА | 2024 |
|
RU2834479C1 |
| СПОСОБ СЕЛЕКТИВНОГО ПОЛУЧЕНИЯ УКСУСНОЙ КИСЛОТЫ И КАТАЛИЗАТОР ДЛЯ СЕЛЕКТИВНОГО ОКИСЛЕНИЯ ЭТАНА И/ИЛИ ЭТИЛЕНА В УКСУСНУЮ КИСЛОТУ | 1997 |
|
RU2189969C2 |
| ГАЗОГЕНЕРАТОР ДЛЯ КОНВЕРСИИ ТОПЛИВА В ОБЕДНЕННЫЙ КИСЛОРОДОМ ГАЗ И/ИЛИ ОБОГАЩЕННЫЙ ВОДОРОДОМ ГАЗ, ЕГО ПРИМЕНЕНИЕ И СПОСОБ КОНВЕРСИИ ТОПЛИВА В ОБЕДНЕННЫЙ КИСЛОРОДОМ ГАЗ И/ИЛИ ОБОГАЩЕННЫЙ ВОДОРОДОМ ГАЗ (ЕГО ВАРИАНТЫ) | 2010 |
|
RU2539561C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ ОКИСИ ЭТИЛЕНА | 1992 |
|
RU2014114C1 |
| СПОСОБ ХИМИЧЕСКОЙ ПЕРЕРАБОТКИ СМЕСЕЙ ГАЗООБРАЗНЫХ УГЛЕВОДОРОДОВ (АЛКАНОВ) C-C В ОЛЕФИНЫ C-C (ЭТИЛЕН И ПРОПИЛЕН) | 2010 |
|
RU2435830C1 |
| СПОСОБ ПОЛУЧЕНИЯ УГЛЕВОДОРОДОВ C-C | 2007 |
|
RU2341507C1 |
| КАТАЛИЗАТОР ДЛЯ ОКИСЛИТЕЛЬНОЙ КОНДЕНСАЦИИ МЕТАНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2647844C1 |






Изобретение относится к способу получения катализатора на основе перовскита для окислительной дегидроконденсации метана. Описан способ изготовления катализатора, предусматривающзий следующие этапы: формируют водную суспензию, содержащую соль щелочноземельного металла, порошкообразный хлорид металла и порошкообразный оксид переходного металла; причем водную суспензию формируют посредством дисперсии в воде порошкообразной соли щелочноземельного металла, выбранного из группы, включающей барий и/или кальций и, возможно, стронций или их комбинацию, добавляют в воду порошкообразный хлорид металла, где порошкообразный хлорид металла выбран из группы, включающей Sn, Mg, Na, Li, Ba, далее добавляют порошкообразный оксид переходного металла, являющийся оксидом титана, в воду; затем добавляют к суспензии полимерное связующее вещество вплоть до образования пасты; высушивают пасту до образования порошка; нагревают порошок при повышающейся температуре по заранее определенному температурному профилю, прокаливают нагретый порошок и получают катализатор на основе перовскита, причем суспензия включает смесь, содержащую Ba и/или Са и/или Sr (0.95 моль) + TiO2 + хлорид металла, который выбран из группы, состоящей из Sn, Mg, Na, Li, Ba в количестве 0,05 моль. Изобретение также описывает катализатор, полученный таким способом, и способ его использования в окислительной дегидроконденсации метана. 3 н. и 16 з.п. ф-лы, 2 табл., 8 ил.
| IRANIAN J | |||
| POLIMER SCIENCE AND TECHNOLOG, vol.2, no2, 1993, pag.106-112 | |||
| КАТАЛИЗАТОР ОКИСЛЕНИЯ АММИАКА | 1996 |
|
RU2100068C1 |
| JP 07291607 A, 07.11.1995 | |||
| Многоканальное устройство приоритета | 1983 |
|
SU1148030A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2009-03-27—Публикация
2004-04-28—Подача