Изобретение относится к микробиологии и прикладной биотехнологии и может быть использовано для лабораторной селекции бактерий-продуцентов L-аспарагиназ.
Заявляемый способ представляет собой новый специфический, быстрый, простой и удобный метод выявления наиболее активных продуцентов аспарагиназы в чашках Петри и может найти применение при разработке новых лекарственных противоопухолевых ферментных препаратов.
Бактериальная L-аспарагиназа из природных штаммов Escherichia coli, Erwinia carotovora или Erwinia chrysanthemi (L-аспарагинамидогидролаза, ЕС 3.5.1.1.) применяется при острых лимфобластных лейкозах, лимфо- и ретикулосаркомах человека [1, 2] и производится в США («Enzon/Rhone Poulenc Rorer»), Германии («Medac Gmbh», «Merck & Co.Inc.»), Англии («Ipsen Limited»), Латвии («Grindex») и ряде других стран. Эффективность производства бактериального препарата прямо зависит от количества вырабатываемого фермента. При получении рекомбинантных суперпродуцентов или возникновении мутаций возможно появление смешанных культур, что определяет необходимость выделения чистой наиболее активной культуры [3, 4, 5].
В настоящее время активность аспарагиназы определяют, в основном, фотометрическим методом, основанным на качественной и количественной оценке выделяющегося при гидролизе аспарагина аммиака реактивом Несслера [6, 7]. Менее широкое распространение получило спектрофотометрическое определение, возможно, из-за необходимости использования очищенного фермента [8].
Оба метода позволяют определять активность только в жидкой среде, что затрудняет отбор отдельных клонов. При этом для выделения чистых культур микробиологи пользуются почти исключительно методом поверхностных рассевов на пластинчатом агаре в чашках Петри, т.е. на твердой среде.
Наиболее близким к заявляемому способу из известных методов выявления штаммов-продуцентов L-аспарагиназы является метод R.Gulati et al, в котором используется твердая синтетическая среда с феноловым красным [9]. Недостатками метода являются плохая воспроизводимость и низкая специфичность. Кроме того, синтетическая среда может оказаться неполноценной для роста ауксотрофных микроорганизмов и привести к потере активного продуцента.
Техническим результатом заявляемого способа является создание простого и быстрого комплексонометрического метода выявления штаммов бактерий с высокой L-аспарагиназной активностью, позволяющего повысить эффективность отбора наиболее активных штаммов.
Указанный технический результат достигается путем подбора состава дифференциальной среды для выявления штаммов с высокой L-аспарагиназной активностью на основе стандартных сред LB (Luria-Bertani) или М9 с добавлением 1,5% агара, [10, 11, 12], содержащих дополнительно: 0,3 М L-аспарагин и диагностические компоненты - 0,0057 М или 0,0083 М сульфат меди (CuSO4×5Н2О) и 0,0024 М или 0,0032 М гексацианоферрат калия (K3Fe(CN)6, соответственно. Исследуемые бактерии высевают на поверхность приготовленной диагностической среды, выдерживают посевы в термостате при оптимальной температуре роста в течение 12-20 или 24-48 часов, соответственно, после чего учитывают результаты по окраске выросших колоний. Красный цвет колоний и красный ореол вокруг них указывают на способность исследуемого штамма разрушать аспарагиновые комплексы.
Установлено, что комплексонометрическое определение наиболее активных продуцентов L-аспарагиназы основано на образовании прочных красных комплексов меди с анионом гексацианоферрата при ферментативном разрушении синих комплексов с L-аспарагином и L-аспарагиновой кислотой. В результате реакции активные колонии окрашиваются в красный цвет, в то время как неактивные свой естественный цвет не изменяют. Суть предложенного способа выявления штаммов бактерий с L-аспарагиназной активностью состоит в следующем.
В результате реакции с восстанавливающими ингредиентами агара, входящего в состав твердой среды LB и среды М9 из добавленного гексацианоферрата (III) образуется гексацианоферрат (II). При ферментативном гидролизе аспарагина и разрушении прочного хелатного комплекса этой аминокислоты с Cu (II) ионы меди связываются с анионом гексацианоферрата (II), что сопровождается выпадением красно-коричневого осадка.
Cu2++[Fe(CN)6]2-→Cu2[Fe(CN)6]↓
рН≤7
Среду, содержащую комплексные соединения с медью, готовят непосредственно перед употреблением. Автоклавирование питательной среды и растворов проводят в стандартных условиях. Ниже приведены примеры приготовления сред.
Пример 1. Модифицированная среда LB.
Сначала готовится стандартная среда LB. На 1 л: бакто-триптон 10 г [«Fluka» (Швейцария)]; бакто-дрожжевой экстракт 5 г [«Fluka» (Швейцария)]; NaCl 10 г [«Sigma-Aldrich» (США)]; pH 7,6 [10, 11, 12, 13]. К 100 мл расплавленной стерильной среды LB, содержащей 1,5% бакто-агара [«Ferak» (Германия)], последовательно добавляют 4,0 г L-аспарагина [«Reanal» (Венгрия)]; 3,0 мл 0,2 М CuSO4×5H2O [«Sigma-Aldrich (США)], и 2,5 мл 0,1 М K3Fe(CN)6 [«Sigma-Aldrich»(США)]. Таким образом, конечная концентрация дополнительных компонентов составляет 0,3 М L-аспарагина, 0,0057 М CuSO4×5H2O и 0,0024 М K3Fe(CN)6. После добавления каждого компонента смесь тщательно перемешивают.
Пример 2. Модифицированная среда М9.
Сначала готовится стандартная среда М9. На 1 л: Na2HPO4 6 г [«Serva»(Германия)]; KH2PO4 3 г [«Serva»(Германия)]; NaCl 0,5 г [«Sigma-Aldrich» (США)]; NH4Cl 1 г [«Sigma-Aldrich» (США)]; pH 7,6. После автоклавирования и охлаждения в среду добавляют следующие компоненты: 1 М MgSO4x7H2O 2 мл [«Sigma-Aldrich» (США)]; 20% глюкоза 10 мл [«Panreac» (Испания)]; 1 М CaCl2 1 мл [«Sigma-Aldrich» (США)]. Три последних раствора стерилизуются фильтрованием [10, 11]. К 100 мл расплавленной стерильной среды М9, содержащей 1,5% агара [«Ferak» (Германия)], последовательно добавляют 4,0 г L-аспарагина [«Reanal» (Венгрия)]; 4,5 мл 0,2 М CuSO4×H2O [«Sigma-Aldrich» (США)] и 3,5 мл 0,1 М K3Fe(CN)6 [«Sigma-Aldrich» (США)]. Таким образом, конечная концентрация дополнительных компонентов составляет 0,3 М L-аспарагина, 0,0083 М CuSO4×5H2O и 0,0032 М K3Fe(CN)6. После добавления каждого компонента смесь тщательно перемешивают.
При необходимости в среду вносят антибиотики и индукторы {например, при выращивании штаммов BL-21(DE3)/pBAD/ECARLANS (E.coli/pBAD) и BL-21(DE3)/pACYC177-LANS (E.coli/pACYC) вносят L-арабинозу [«Sigma-Aldrich» (США)] до 0,0015 М или IPTG (isopropyl-beta-D-thiogalactopyranoside) [«Sigma-Aldrich» (США)] до 0,001 M} соответствено. Среду разливают в чашки Петри и подсушивают в ламинаре в течение 20 мин. Горячая готовая среда зеленого цвета, холодная - зеленоватая с голубым оттенком, что обусловлено сочетанием синего цвета медного комплекса и желтого гексацианоферрата.
Герметично закрытые готовые чашки могут храниться при комнатной температуре в течение месяца. Покрасневшая или побуревшая среда вследствие выпадения осадка Cu2[Fe(CN)6] к употреблению непригодна.
Для тестирования сред из коллекции лаборатории медицинской биотехнологии ИБМХ РАМН отобраны рекомбинантные штаммы Е.coli с высокой L-аспарагиназной активностью от 12 до 34 МЕ/мг белка: BL-21(DE3)/pBAD/ECARLANS (E.coli/pBAD) и BL-21(DE3)/pACYC177-LANS (E.coli/pACYC); стандартные генетически модифицированные штаммы E.coli, используемые в биотехнологии с низкой L-аспарагиназной активностью (до 10 МЕ/мл белка): JM 109, DH-52, МС 1061, BL-21(DE3); а также природные штаммы: Lactobacillus plantarum, Lactobacillus casei varrhamnosus, Bacillus megaterium, Bacillus subtilis и Erwinia carotovora N1 (коллекция микроорганизмов БГУ, Минск, Беларусь) с активностью 0,003-0,007 и 0,1-0,3 МЕ/мг белка соответственно.
Бактериальную культуру шпателем или петлей рассевают по поверхности диагностической среды, приготовленной по примеру 1 или 2. Чашки помещают в термостат при температуре 37°С на 12-20 часов (среда на основе LB) и 24-48 часов (среда на основе М9). Покраснение колоний и диаметр окрашенной зоны вокруг них зависят от клеточной массы и способности изучаемых штаммов разрушать аспарагиновые комплексы. Более длительная инкубация не рекомендуется вследствие образования и диффузии побочных продуктов реакции и метаболитов клеток.
Результаты, полученные при применении заявляемого способа, были сопоставлены с данными стандартного метода с использованием реактива Несслера. Активность L-аспарагиназы выражали в Международных единицах (ME). За 1 ME активности принимали количество фермента, катализирующего высвобождение 1 мкмоль аммиака за 1 мин при 37°С.
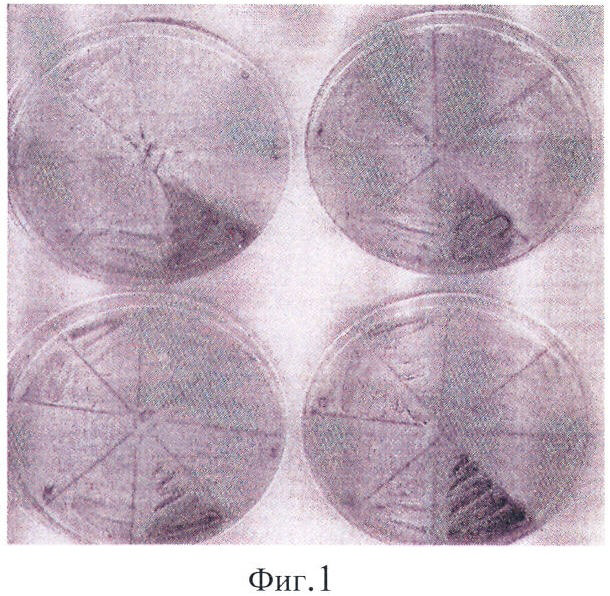
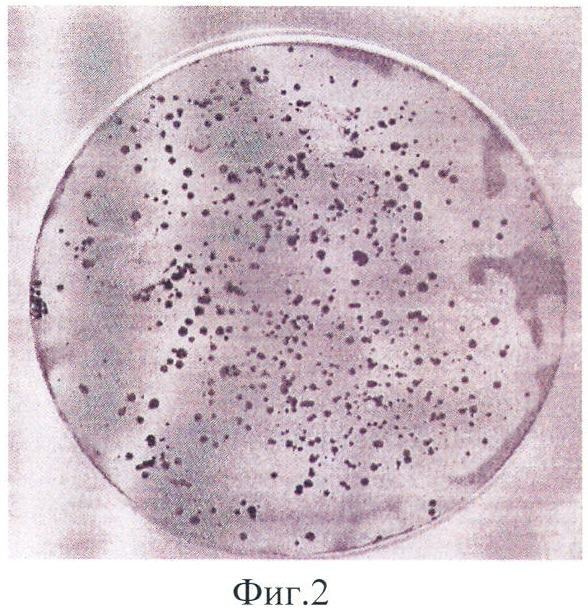
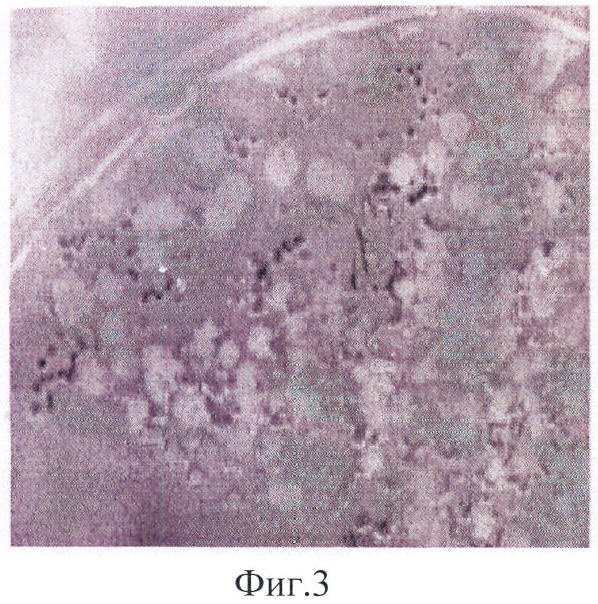
Результаты представлены в табл.1 и на фиг.1-3.
На фиг.1 видна хорошая воспроизводимость результатов при правильно подобранных условиях. В семи бесцветных секторах находятся штаммы E.coli XL-blue, Lactobacillus plantarium, Erwinia carotovora, Bacillus subtilis, Bacillus megaterium, E.coli BL-21 (DE3), E.coli DH-52. В окрашенном секторе - E.coli BL-21 (DE3)/pACYC177-LANS. На фиг.2 видны отдельные окрашенные колонии в однородной культуре. На фиг.3 видна смесь активных и неактивных клонов.
Показано, что только колонии Lactobacillus plantarium, Lactobacillus casei varrhamnosus и Bacillus subtilis, Bacillus megaterium с активностью 0,007 МЕ/мг белка оставались неокрашенными при любых сроках инкубации и любой окраске среды.
Приведенная в примерах 1 и 2 концентрация CuS04x5H2O эквивалентна содержанию связующих компонентов среды; увеличение концентрации и появление свободных ионов меди приводит к неспецифическому красному окрашиванию и невозможности роста клеток в этих условиях. Гексацианоферрат калия является не только необходимым компонентом основной реакции, но и индикатором, свидетельствующим о наличии или отсутствии токсических количеств ионов меди.
Незначительное изменение концентраций хлоридов или нитратов заметно не влияет на результат. Изменение ионного состава осложняет анализ, поэтому для приготовления среды желательно использовать бакто-триптон и дрожжевой экстракт с контролируемым содержанием примесей. В случае выраженных биохимических нарушений в клетках продукты неполного окисления и метаболиты, особенно альдегиды и кетоны, выделяемые в среду, также влияют на рН и окислительно-восстановительный потенциал системы, а следовательно, и на процесс тестирования, что может привести к неспецифическому покраснению колоний.
Несмотря на колебания химического состава некоторых ингредиентов сред (бакто-триптон и дрожжевой экстракт), применение реагентов (с учетом производителя) в соответствующих концентрациях позволяет получать хорошо воспроизводимые результаты не только на синтетических средах, таких как М9, но даже в среде LB.
Таким образом, предложенный комплексонометрический способ позволяет:
1) выявлять бактериальные штаммы с L-аспарагиназной активностью не менее 0,01-0,1 МЕ/мг белка, в т.ч. проводить первичный отбор единичных активных колоний прямо с чашки;
2) оценивать чистоту культуры по биохимической активности в отношении L-аспарагина;
3) сохранять испытуемые колонии живыми и использовать их в дальнейшей работе, т.к. клетки растут на привычной среде, ионы гексацианоферрата по мере дезамидирования аспарагина удаляются из раствора в виде осадка с медью, а ионы меди постоянно находятся в связанном состоянии и на рост культуры практически не влияют;
4) использовать не только синтетические среды, но и традиционную среду LB, на которой растет большинство микроорганизмов, и, наиболее вероятно, сможет расти любой модифицированный штамм.
5) использовать доступные и недорогие реактивы.
Литература
1. Wriston J.C. Asparaginase // Methods in Enzymology. - 1985, - Vol.113. - P.608-618.
2. Соколов Н.Н., Занин А.А., Александрова С.С.Бактериальные L-аспарагиназы и глутамин (аспарагин)азы: некоторые свойства, строение и противоопухолевая активность // Вопросы медицинской химии - 2000. - Том. 46(6). - С.531-548.
3. Harms E., Wehner A., Jennings M. et al. Construction of expression system for Escherichia coli asparaginase 11 and two-step purification of the recombinant enzyme from periplasmic extracts // Protein Expr. Purif. - 1991. - Vol.2. - P.144-150.
4. Gilbert H.J., Blazek R., Bullman H.M. et al. Cloning and expression of the Erwinia chrysanthemi asparaginase gene in Escherichia coli and Erwinia carotovora // J.Gen. Microbiol. - 1986. - Vol.132. - P.151-160.
5. Эльдаров М.А., Жгун А.А., Гервазиев Ю.В. и др. Ген L-аспарагиназы Erwinia carotovora и штамм Escherichia coli ВКПМ №В-8174 - продуцент L-аспарагиназа Erwinia carotovora // Патент РФ 2221868. 20.01.2004 Бюл.№2.
6. Wade H.E., Phillips P.B.Automated determination of bacterial asparaginase and glutaminase // Anal.Biochem. - 1971. - Vol.44. - P.89.
7. Wriston J.C. Asparaginase // Methods Enzymol. - 1970. - Vol.17A. - P. 732-742.
8. Howard J.B., Carpenter, F.H. L-asparaginase from Erwinia carotovora. Substrate specificity and enzymatic properties // J. Biol. Chem. - 1972. - Vol.247. - P.1020-1030.
9. Gulati R. et al. A rapid plate assay for screening L-asparaginase producing micro-organisms // Letters in Applied Microbiology. - 1997. - Vol.24. - P.23-26.
10. Мазин А.В., Кузнеделов К.Д., Краев А.С. и др. Методы молекулярной генетики и генной инженерии. - Новосибирск: «Наука». - 1990. - 248 с.
11. Maniatis G. Molecular Cloning, A Laboratory manual. 1 st edition. - 1987. - P.68.
12. Bertani G. Studies on Lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli // L Bacteriology. - 1952. - Vol.62. - P.293-300.
13. Guennadi S., Joseleau-Petit D., D'Ari R. Escherichia coli Physiology in Luria-Bertani Broth // J. Bacteriology. - 2007. - Vol.189. - P.8746-8749.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СУБСТАНЦИИ РЕКОМБИНАНТНОЙ L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA | 2010 |
|
RU2441914C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pACYC-LANS(KM), ШТАММ Escherichia coli BL21(DE3), ТРАНСФОРМИРОВАННЫЙ РЕКОМБИНАНТНОЙ ДНК pACYC-LANS(KM), И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ L-АСПАРАГИНАЗЫ Erwinia carotovora | 2010 |
|
RU2441916C1 |
| МУТАНТНАЯ РЕКОМБИНАНТНАЯ L-АСПАРАГИНАЗА Wolinella succinogenes (ВАРИАНТЫ) | 2014 |
|
RU2545722C1 |
| ГЕН L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA И ШТАММ ESCHERICHIA COLI ВКПМ № В-8174 - ПРОДУЦЕНТ L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA | 2001 |
|
RU2221868C2 |
| СПОСОБ УЛУЧШЕНИЯ КАТАЛИТИЧЕСКИХ СВОЙСТВ ГИПЕРТЕРМОФИЛЬНЫХ L-АСПАРАГИНАЗ I ТИПА, L-АСПАРАГИНАЗА I ТИПА ИЗ ГИПЕРТЕРМОФИЛЬНОЙ АРХЕИ THERMOCOCCUS SIBIRICUS, ПОЛУЧЕННАЯ ТАКИМ СПОСОБОМ | 2023 |
|
RU2836049C1 |
| МОДИФИЦИРОВАННЫЙ ГЕН tsA, КОДИРУЮЩИЙ ТЕРМОСТАБИЛЬНУЮ L-АСПАРАГИНАЗУ ИЗ АРХЕИ THERMOCOCCUS SIBIRICUS, РЕКОМБИНАНТНЫЙ ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ ТЕРМОСТАБИЛЬНОЙ L-АСПАРАГИНАЗЫ И СПОСОБ ОЧИСТКИ ЭТОГО ФЕРМЕНТА | 2022 |
|
RU2794225C1 |
| ГИБРИДНЫЙ БЕЛОК НА ОСНОВЕ L-АСПАРАГИНАЗЫ Wolinella succinogenes, ШТАММ Escherichia coli - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО БЕЛКА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2562166C1 |
| ПРОДУЦЕНТ L-АСПАРАГИНАЗЫ E. COLI И ЭКСПРЕССИОННАЯ ПЛАЗМИДА PET28A-ASNSYN, КОДИРУЮЩАЯ L-АСПАРАГИНАЗУ | 2023 |
|
RU2817891C1 |
| Модифицированный ген рас бактерий Escherichia coli, кодирующий предшественник фермента с активностью пенициллин G ацилазы, рекомбинантный штамм Escherichia coli - продуцент пенициллин G ацилазы и способ микробиологического синтеза этого фермента | 2015 |
|
RU2624022C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pL-ASP-08 И ШТАММ БАКТЕРИЙ Escherichia coli XL1-blue/pL-ASP-08 - ПРОДУЦЕНТ L-АСПАРАГИНАЗЫ | 2009 |
|
RU2397248C1 |
Изобретение относится к биотехнологии и может быть использовано для повышения эффективности лабораторной селекции микроорганизмов-продуцентов L-аспарагиназ и найти применение при разработке новых лекарственных противоопухолевых ферментных препаратов. Способ предусматривает приготовление дифференциальной среды на основе стандартной среды LB или М9 с содержанием 1,5% агара и дополнительно содержащих L-аспарагин и диагностические компоненты - 0,0057 М или 0,0083 М сульфата меди CuSO4×5H2O и 0,0024 М или 0,0032 М гексацианоферрата калия K3Fe(CN)6 соответственно. Высев исследуемых микроорганизмов на соответствующую дифференциальную среду. Инкубацию посевов в термостате при оптимальной температуре роста микроорганизма в течение 12-20 или 24-48 часов соответственно. Учет результатов по окраске выросших колоний. Красный цвет колоний и окрашенная зона вокруг них указывают на способность исследуемого микроорганизма разрушать аспарагиновые комплексы. Изобретение позволяет сократить сроки выявления микроорганизмов, упростить и ускорить первичный отбор активных колоний, сохранить испытуемые колонии живыми. 3 ил., 1 табл.
Способ выявления штаммов бактерий-продуцентов L-аспарагиназы, предусматривающий высев исследуемых штаммов на поверхность дифференциальной среды, приготовленной на основе стандартных сред LB или М9 с добавлением 1,5% агара, дополнительно содержащих 0,3 М L-аспарагина и диагностические компоненты - 0,0057 М или 0,0083 М сульфата меди CuSO4·5H2O и 0,0024 М или 0,0032 М гексацианоферрата калия K3Fe(CN)6, соответственно, инкубацию при оптимальной температуре роста штамма в течение 12-20 или 24-48 ч на соответствующей дифференциальной среде, и последующий учет результатов по окраске выросших колоний, при этом красный цвет колоний и красный ореол вокруг них указывают на наличие L-аспарагиназной активности исследуемого штамма.
| GULARI R | |||
| et al | |||
| A rapid plate assay for screening L-asparaginase producing micro-organisms, Lett | |||
| Appl | |||
| Microbiol., 1997, Jan., 24 (1), p.23-26 | |||
| WADE H.E | |||
| et al | |||
| Automated determination of bacterial asparaginase and glutaminase, Anal | |||
| Biochem | |||
| Устройство станционной централизации и блокировочной сигнализации | 1915 |
|
SU1971A1 |
| Способ получения L-аспарагиназы | 1989 |
|
SU1713929A1 |
| Штамм на-165продуцент -аспарагиназы | 1975 |
|
SU576338A1 |
Авторы
Даты
2010-09-10—Публикация
2008-06-03—Подача