Настоящее изобретение относится к области медицины и фармацевтики, а именно к фармацевтической композиции на основе экстрактов растительного происхождения, предназначенной для лечения и/или профилактики сифилиса и вирусных заболеваний, выбранных из гриппа, ВИЧ-инфекции, нейроинфекции, цитомегаловирусной инфекции, вирусных гепатитов А, В, С, вторичных иммунодефицитных состояний на фоне хронических бактериальных инфекций и герпесвирусной инфекции, а также к способу лечения данных заболеваний.
Проблема лечения и профилактики вирусных инфекций, в том числе передаваемых половым путем, включая ВИЧ и гепатиты В и С, приобретает с каждым годом все большую значимость. С ростом числа заболеваний вирусной этиологии увеличивается и актуальность создания эффективных средств не только их лечения, но и профилактики (на сегодняшний день в мире от СПИДа и вирусных гепатитов В и С умирают ежегодно несколько миллионов человек).
Актуальность создания нового средства для лечения и профилактики сифилиса обусловлена сложностью и неудобством для пациента существующих схем лечения, необходимостью длительных курсов терапии.
Кроме того, в связи с существующей опасностью пандемии отдельных форм гриппа (грипп А птиц, вызываемый вирусом H5N1), важной оказывается разработка средств профилактики и лечения данного вирусного заболевания.
Известны лекарственные средства на основе экстрактов растительного происхождения, разрешенные для медицинского применения, обладающие противовирусным действием, такие как флакозид, гипорамин или глицирризиновая кислота, содержащаяся в экстракте корней солодки; глицирризиновую кислоту также используют в виде глицирризината натрия.
Гипорамин, представляющий собой сумму полифенольных соединений из листьев облепихи крушиновидной, содержащую не менее 60% галлоэллаготаннинов, разрешен для медицинского применения у взрослых и детей в качестве противовирусного средства. Обладает широким спектром антивирусной активности в отношении вирусов простого герпеса, цитомегаловируса, Varicella Zoster, вирусов иммунодефицита человека (ВИЧ-инфекция) и др. Биологически активными компонентами являются гидролизуемые таннины. (Новые отечественные лекарственные средства Сводный выпуск, М., 2000 г. Гос. Реестр, т.1, 2001 г.). На основе гипорамина созданы препараты против вируса иммунодефицита человека (патент СССР №1805967), для лечения и профилактики вирусных заболеваний (патент РФ №2118163).
Флакозид разрешен для медицинского применения у взрослых и детей как противовирусное средство при острых вирусных гепатитах А и В, первичных и рецидивирующих формах простого герпеса экстрагенитальной и генитальной локализации, опоясывающем лишае и других инфекций. Представляет собой производное флавонов, получают из листьев бархата амурского (Машковский М.Д. Лекарственные средства, т.2, 2000 г., Гос. Реестр лекарственных средств, 2001 г., т.1). Применение флакозида для лечения герпеса раскрыто в авторском свидетельстве СССР №491387.
Наиболее близким к заявляемому изобретению техническим решением, по нашему мнению, является патент РФ №2200571, в котором раскрыт состав (комплекс) природных соединений растительного происхождения, активный в отношении вирусных инфекций и других инфекций, передаваемых половым путем, включающий гипорамин, отличающийся тем, что комплекс дополнительно содержит флакозид и хелепин или хелепин Д (экстракты травы десмодиума канадского), в соотношении 1:(2,0-4,0):(2,0-2,5) соответственно. Показано, что комплекс гипорамина, флакозида и хелепина эффективен в отношении наиболее актуальных на сегодняшний день вирусных инфекций - ВИЧ, герпесвирусной инфекции и вирусного гепатита.
В то же время одним из наиболее важных направлений в терапии вирусных инфекций различной этиологии (ВИЧ-инфекции, герпесвирусной инфекции, вирусного гепатита и др.) является применение индукторов синтеза эндогенного интерферона.
Индукторы эндогенного интерферона представляют собой новый класс противовирусных, противоопухолевых и иммуномодулирующих препаратов. Наиболее перспективными в данном классе являются низкомолекулярные интерфероногены - производные 10-карбоксиметилен-9-акриданона (акридоноуксусной кислоты), обладающие целым рядом фармакологических свойств (низкой токсичностью, отсутствием аллергенного, мутагенного и эмбриотоксического действия на организм), необходимых для создания "идеального" индуктора эндогенного интерферона. Важным фармакологическим свойством акридоноуксусной кислоты является отсутствие метаболического расщепления в печени и кумулирования в организме.
Акридоноуксусная кислота впервые получена немецкими исследователями в 1923 г. термической циклизацией аминокислоты замещенного N-фенилглицина.
По своему химическому строению акридоноуксусная кислота представляет собой плоскую трициклическую гетероароматическую систему с N-карбоксиметильным заместителем; в ее строении легко обнаруживается фрагмент N,N-дизамещенной фармакологически активной аминоуксусной кислоты - глицина.
В данном соединении одновременно сочетаются высокая липофильность, обусловленная плоским гетероароматическим кольцом и гидрофильность за счет кольцевой кетогруппы и бокового остатка уксусной кислоты у атома азота. Такое уникальное химическое строение акридоноуксусной кислоты позволяет предположить наличие у нее высокой биологической активности, обусловленной как легким проникновением в органы и ткани организма, так и возможным влиянием на рецепторный аппарат клетки и влиянием на метаболические реакции в организме.
Противовирусная активность акридоноуксусной кислоты и ее производных была показана американскими исследователями в 1972 г. - натриевая соль акридоноуксусной кислоты показала высокий уровень защиты против вирусов леса Семлики, западного и восточного энцефалита, гриппа и герпеса. В более поздних исследованиях различных авторов установлено, что противовирусная активность акридоноуксусной кислоты, равно как и ее фармацевтически приемлемых солей, в отношении широкого спектра вирусов обусловлена индукцией в организме высоких титров эндогенного интерферона.
Несмотря на то, что способностью индуцировать эндогенный интерферон под действием различных "биологических" (вирусы, бактерии, токсины и др.) и "химических" (соли тяжелых металлов, полимеры, гетероароматические соединения) индукторов обладают почти все виды клеток организма, было установлено, что индуцировать интерферон под действием соли АУК способны исключительно иммунокомпетентные клетки организма: моноциты, макрофаги, лимфоциты и купферовские клетки печени. Оптимальная интерфероноиндуцирующая концентрация АУК в культурах иммунокомпетентных клеток составляет 6 мкг/мл.
Акридоноуксусная кислота хорошо проникает через плацентарный барьер и индуцирует высокие титры интерферона в тканях плода, не влияя на его жизнеспособность, что установлено при исследовании индукции интерферона у беременных самок мышей. Данный биологический эффект с отсутствием тератогенных свойств у акридоноуксусной кислоты дает возможность проведения лечения ряда заболеваний в акушерской и педиатрической практике.
Высокий уровень индуцируемого α/β интерферона, продуцируемый натриевой солью акридоноуксусной кислоты, оказывает тормозящее действие на развитие различных опухолей; антипролиферативный эффект индуктора интерферона значительно выражен на модели слабометастазирующей опухоли, а не на модели быстрометастазирующей опухоли лимфосаркомы.
При предварительном введении животным коринебактерий (Corynebacterium parvum), с последующей индукцией солью акридоноуксусной кислоты противоопухолевый эффект препарата значительно увеличивался. Характерно, что введение в параллельном опыте природного индуктора интерферона - вируса Ньюкасла вместо соли акридоноуксусной кислоты не привело к усилению противоопухолевого эффекта на модели лимфомы мышей, что свидетельствует о различных биологических эффектах интерферонов, синтезирующихся в ответ на воздействие "химического" и "биологического" индуктора.
Учитывая, что фармакологические эффекты акридоноуксусной кислоты выходят за рамки, которые можно объяснить только индукцией интерферона, очевидно, что противовирусное, противоопухолевое и антипролиферативное действие препарата может быть связано не только с эффектами индуцируемого интерферона, но с дозозависимым специфическим ингибированием ключевого внутриклеточного фермента цикло-АМФ-фосфодиэстеразы, что приводит к снижению содержания в клетке универсального месенжера цикло-АМФ и соответственно повышает чувствительность клеток к антигенному и митогенному воздействию.
Помимо эффектов, связанных с индукцией интерферона, возможно "непосредственное" противовирусное и противоопухолевое действие акридоноуксусной кислоты, опосредование через ингибирование функций ключевых ферментов дыхательной цепи митохондрий клетки - убихинонов, либо ингибирование связывания АТФ с митохондриальным АДФ/АТФ-зависимым транспортным белком путем специфического ковалентного присоединения акридоноуксусной кислоты по пептидной связи лизин - цистеин.
На основе акридоноуксусной кислоты и ее производных получен ряд препаратов, в частности компанией НТФФ «Полисан» (Россия, Санкт-Петербург) разработан препарат Циклоферон (соль акридоноуксусной кислоты с N-метилглюкамином, 12,5%-ный раствор для инъекций), успешно используемый в клинике при ВИЧ-инфекции (СПИД, стадия IIA-IIIB), нейроинфекции (энцефалит, болезнь Лайма, нейроСПИД), вирусном гепатите, герпетической, цитомегаловирусной и хламидийной инфекции, вторичных иммунодефицитных состояниях на фоне хронических бактериальных инфекций, ревматических и системных заболеваниях соединительной ткани (ревматоидном артрите, системной красной волчанке), дегенеративно-дистрофических заболеваниях суставов, в т.ч. деформирующем остеоартрозе; у детей старше 4 лет (в составе комплексной терапии) при вирусном гепатите (А, В, С), герпетической и ВИЧ-инфекции.
НТФФ «Полисан» получены патенты на Циклоферон в РФ, в Японии, США и ЕС.
Более подробная информация о свойствах и противовирусной активности акридоноуксусной кислоты и ее производных, включая Циклоферон, доступна (на 18.03.2009) в сети Интернет по адресу (WWW): http://www.ama.dp.ua/Info/library/CycloClin/AUK.asp
Также, ранее в уровне техники была показана возможность применения для лечения и профилактики вирусных гепатитов как экстракта корней солодки (либо его активного начала - глицирризиновой кислоты либо фармацевтически приемлемой соли глицирризиновой килсоты, в частности глицирризината натрия), так и экстракта бересты, либо его активного начала - бетулина.
Бетулин представляет собой кристаллическое органическое вещество, нерастворимое в воде, наполняющее в виде мелкого порошка пробковые клетки березовой коры и сообщающее белый цвет бересте. Молекулярная формула С36Н60О3. Бетулин - одно из первых выделенных из растительного сырья веществ (1778 г.).
Основным источником природного бетулина является береза. Белая часть березовой коры у отдельных видов березы (Betula verrueosa, Betula papyfera) содержит до 30% и более бетулина (Hayek, E.W. et al. (1989) A Bicentennial of Betulin, Phytochemistry, 28(9) p.2229-2242).
Бетулин является пентациклическим тритерпеном с углеродным скелетом ряда лупана, который также называют бетулинолом, трохотоном, березовой камфарой и (корили-) резигюлом. Характерной особенностью ряда лупана является кольцо с пятью атомами углерода в составе пентациклической системы, которое в положении С-19 имеет изопентениловую группу. Бетулин отличается высокой термостабильностью, его температура плавления находится между 250 и 261°С, причем после сублимации рекристаллизованного продукта достигаются еще более высокие значения. Его молекулярный вес составляет 442,7, он растворим в пиридине и тетрагидрофуране, но малорастворим в дихлорметане, хлороформе и холодных органических растворителях, причем с повышением температуры его растворимость значительно возрастает. В воде и холодном петролейном эфире бетулин практически не растворим. Кроме того, кинетические исследования показали очень низкую реакционную способность гидроксильных групп бетулина.
В 1899 г.были показаны антисептические свойства бетулина и поэтому он использовался для стерилизации перевязочных бинтов и пластырей (Wheeler J., (1899), Pharm. J., Die Darstellung des Betulin durch Sublimation, 494, Ref. Chem. Centr. 1900 I, стр.353). В натуропатии и народной медицине получали и получают до сих пор отвары березовой коры, которые применяют для лечения малярии, водянки, подагры и при кожных заболеваниях, а также в виде настойки для компрессов при лечении абсцессов.
Большое число исследований посвящено гепатопротекторной активности бетулина. Было обнаружено, что бетулин снижает активность аланинамигютрансферазы, щелочной фосфатазы, содержание малеинового диальдегида, предупреждает воспалительный процесс в печени (Ю.К.Василенко и др. "Фармакологические свойства тритерпеноидов коры березы" Экспериментальная и клиническая фармакология, 1993, т.54 №4 стр.53-55).
В публикации Sun IC, Shen JK, Wang HK, Cosentino LM, Lee KH. Synthesis and anti - HIV activity of betulin derivaties, Bioorg Med Chem Lett. 1998 May 19, 8(10), p.1267-1272 указывается, что 3-замещенные глютариловые производные бетулина in vitro проявляли цитотоксичность в отношении лимфоцитов, трансформированных HIV; антиВИЧ-активность показана также для ряда производных бетулина (см.: Hashimoto F, Kashiwada Y, Cosentino LM, Chen CH, Garrett PE, Lee KH. Anti-AIDS agents-XXVII. Synthesis and anti-HIV activity of betulinic acid and dihydrobetulinic acid derivatives. Bioorg Med Chem. 1997 Dec; 5(12): pp.2133-43).
Позже было показано, что экстракт бересты или бетулин может успешно использоваться как в лечении (патент РФ №2244554), так и в профилактике вирусного гепатита С (патент РФ №2264820), однако для получения комбинированных составов для лечения вирусных гепатитов и других вирусных инфекций бетулин ранее не применялся.
Неожиданно в рамках настоящего изобретения было установлено, что композиция, содержащая гипорамин и флакозид в терапевтически эффективных количествах, содержащая дополнительно терапевтически эффективное количество акридоиоуксусной кислоты (предпочтительно в виде фармацевтически приемлемой соли, более предпочтительно в виде соли с N-метилглюкамином), а также терапевтически эффективное количество экстракта корней солодки, или глицирризиновой кислоты, или фармацевтически приемлемой соли глицирризиновой кислоты (предпочтительно глицирризината натрия) и терапевтически эффективное количество экстракта бересты или бетулина, обладает значительно более выраженной противовирусной активностью в отношении перечисленных выше вирусных инфекций как в сравнении с противовирусной активностью прототипа, так и в сравнении с противовирусной активностью каждого из компонентов в отдельности; также была неожиданно показана эффективность заявляемой в рамках данного изобретения фармацевтической композиции в терапии гриппа А птиц, вызванного вирусом H5N1.
Таким образом, в рамках настоящего изобретения заявляется следующая группа изобретений:
- Фармацевтическая композиция для лечения сифилиса и вирусных заболеваний, выбранных из гриппа, ВИЧ-инфекции, нейроинфекции, цитомегаловирусной инфекции, вирусного гепатита, вторичных иммунодефицитных состояний на фоне хронических бактериальных инфекций и герпесвирусной инфекции, выполненная на основе экстрактов растительного происхождения и содержащая терапевтически эффективные количества суммы полифенольных соединений из листьев облепихи крушиновидной, включая не менее 60% галлоэллаготаннинов, флакозид и фармацевтически приемлемый носитель, отличающаяся тем, что дополнительно содержит терапевтически эффективное количество акридоноуксусной кислоты или ее фармацевтически приемлемой соли, терапевтически эффективное количество экстракта корней солодки или глицирризиновой кислоты, или фармацевтически приемлемой соли глицирризиновой кислоты, и терапевтически эффективное количество экстракта бересты или бетулина.
- Способ лечения сифилиса и вирусных заболеваний, выбранных из гриппа, ВИЧ-инфекции, цитомегаловирусной инфекции, вирусного гепатита, вторичных иммунодефицитных состояний на фоне хронических бактериальных инфекций и герпесвирусной инфекции, включающий введение фармацевтической композиции по изобретению нуждающемуся в этом пациенту по 2-3 дозы 3 раза в сутки.
В рамках настоящего изобретения термин «ВИЧ-инфекция» включает в себя также СПИД, стадии IIA-IIIB; термин «нейроинфекция» включает в себя нейро-СПИД, вирусный энцефалит, болезнь Лайма.
В рамках настоящего изобретения композиция может быть выполнена в виде любой удобной для применения формы, такой, как твердые или мягкие желатиновые капсулы, пеллеты, таблетки, в т.ч. таблетки с модифицированным высвобождением, саше, при помощи традиционных для данных лекарственных форм приемов изготовления и вспомогательных веществ.
Было установлено опытным путем, что оптимальными, хотя и не ограничивающими объем притязаний в соответствии с настоящей заявкой являются следующие терапевтически эффективные количества активных ингредиентов заявляемой композиции: от 10 до 100 мг гипорамина, от 100 до 200 мг флакозида, от 250 до 1000 мг акридоноуксусной кислоты или ее фармацевтически приемлемой соли (предпочтительно соли с N-метилглюкамином), от 30 до 300 мг глицирризиновой кислоты, и от 100 до 350 мг бетулина.
Неожиданный технический результат заключается в качественном расширении спектра и в количественном усилении (в сравении с прототипом) антисифилитической (анитрепонематозной) и противовирусной активности заявляемой фармацевтической композиции в отношении гриппа, ВИЧ-инфекций, нейроинфекций, цитомегаловирусной инфекции, вирусного гепатита, герпесвирусной инфекции, вторичных иммунодефицитных состояний на фоне хронических бактериальных инфекций.
Следует понимать, что представленные ниже в примерах данные приводятся лишь для иллюстрации заявленного изобретения, а не для ограничения объема притязаний, и подтверждают наличие неожиданно более выраженной антисифилитической (анитрепонематозной) и противовирусной активности заявляемой композиции как в сравнении с композицией по прототипу, так и в сравнении с отдельными компонентами.
Пример 1. Активность заявляемой композиции в отношении Treponema pallidum
Проведены исследования влияния композиции по изобретению, растительного комплекса в соответствии с прототипом (гипорамин, флакозид и хелепин, взятые в соотношении 1:2,0-4,0:2,0-2,5), гипорамина и флакозида, на бледную трепонему - возбудитель сифилиса. Количественный состав композиции по изобретению был подобран таким образом, что она содержала эквивалентное композиции по прототипу количество гипорамина и флакозида. Взвесь бледных трепонем получали из орхитов кролика на 7-й день после заражения их сифилисом. Трепонемы наблюдали в темнопольном микроскопе - окуляр х40, объектив х7. Взвесь бледных трепонем сохранялась в стерильном физиологическом растворе. Для опытов использовали взвесь с содержанием около 100 бледных трепонем в поле зрения. Растворы активных соединений готовили из расчета 20 мг вещества в 1 мл жидкости: для водорастворимых соединений (например гипорамин) - в 1 мл дистиллированной воды, для водонерастворимых (флакозид) - 5%-ный раствор этилового спирта + 0,9 мл дистиллированной воды.
Трепонемоцидный эффект наблюдали методом прямого контакта в капле. Одну каплю (0,05 мл) каждого раствора помещали на предметное стекло, смешивали с равным объемом взвеси терпонем в изотоническом растворе NaCl, накрывали покровным стеклом и просматривали под микроскопом.
Результаты представлены в таблице 1.
Аналогичные данные были получены для нескольких составов в рамках данного изобретения, различающихся количественным соотношением компонентов, результаты сведены в таблицу 2.
Пример 2. Противовирусная активность заявляемой композиции в отношении вирусного гепатита С
Было обследовано 74 пациента (54-мужчины, 20-женщины) в возрасте от 16 до 60 лет, с диагностированным хроническим гепатитом С, без признаков циррозирования. Все пациенты были разделены на 3 группы: I группа (27 человек, из них 17 мужчин, 10 женщин) получала 2 раза в сутки перорально композицию в соответствии с прототипом (гипорамин + флакозид + хелепин), II группа (27 человек, из них 15 мужчин, 12 женщин) получала 2 раза в сутки перорально композицию по изобретению, в расчете на эквивалентное количество гипорамина и флакозида, III группа (контрольная, 20 человек, 15 мужчин, 5 женщин) получала 2 раза в сутки базисную терапию (ферментативные и симптоматические препараты, витамины групп А и Е и рибавирин).
Ежедневно производился общий осмотр всех больных, включавший опрос больного, измерение температуры тела, пульса, артериального давления, определение увеличения печени и селезенки. Кроме того, осуществлялся ежедневный лабораторный контроль эффективности лечения, включавший в себя:
- обнаружение специфических маркеров вирусных гепатитов A (anti-HAV IgM), В (HbsAg, anti-Bc IgM), С (anti-HCV, РНК HCV) и D (anti-HD);
- биохимический анализ крови с определением уровня билирубина, сывороточных АлАТ (аланинаминотрансферазы) и АсАТ (аспартатаминотрансферазы), ГГТП (гамма-глутамилтранспептидазы), сулемовой и тимоловой проб, протромбинового индекса, общего белка и альбумина, исследование аутоантител (циркулирующих иммунных комплексов, LE-клеток);
- исследование вирусной нагрузки и генотипирование HCV;
- изучение показателей интерферонового статуса пациентов.
Исследование проводилось до назначения препаратов и через 10, 20, 30 дней от начала терапии, по окончании лечения, а затем - через 3 и 6 месяцев от начала лечения и в дальнейшем (у ряда пациентов) - в течение 1 года от начала приема препарата.
В качестве критериев оценки терапевтической эффективности заявляемой композиции использовали:
А. По данным общего осмотра больных - симптомы печеночной недостаточности, такие как: головная боль, слабость, снижение аппетита, подташнивание, боли в правом подреберье.
Сравнительные результаты для групп I-III представлены в таблице 3 (см. ниже). Из них можно видеть, что у больных, получавших терапию в соответствии с прототипом (гипорамин + флакозид + хелетшн), но сравнению с контрольной группой наблюдалось некоторое нивелирование симптомов печеночной недостаточности, однако у пациентов группы II, получавших терапию в соответствии с настоящим изобретением, наблюдалось значительно более выраженное улучшение состояния; кроме того, у больных контрольной группы симптомы заболевания зачастую возникали вновь через некоторое время после отмены проводимой терапии. Кроме того, к 30-му дню лечения у пациентов, получавших композицию в соответствии с изобретением, наблюдалась значительно более отчетливая нормализация размеров печени по сравнению с пациентами, получавшими препарат по прототипу, и тем более по сравнению с пациентами контрольной группы.
Б. По данным лабораторных анализов - сроки нормализации уровня АлАТ и АсАТ, а также динамика показателей вирусологического исследования (снижение вирусной нагрузки, элиминация HCV из крови больных) и интерферон-индуцирующие свойства композиции. При проведении исследования учитывалась возможность появления побочных реакций.
Статистическую обработку материала проводили с использованием вариационного анализа и определением среднего арифметического (М), средней ошибки среднего арифметического (m), с последующим установлением достоверности различий между средними показателями групп (р). Сравнительные результаты для групп I-III представлены в таблице 4 (см. ниже). Из представленных данных можно видеть, что динамика изменений уровня билирубина, гамма-ГТП, общего белка и альбумина во всех трех группах была примерно одинаковой.
В то же время, как в группе I, так и в группе II наблюдалось значительное снижение уровня АлАТ и АсАТ (в контрольной группе уровень этих ферментов изменялся незначительно), при этом в группе II, получавшей композицию в соответствии с изобретением, данное снижение было значительно более выражено (различия были статистически достоверны при р<0,05), причем данные показатели АлАТ и АсАТ в группе больных, получавших композицию по изобретению, оставались стабильными даже через 6 месяцев от начала лечения. Для значений АлАТ и АсАТ на 60-й день (сразу после окончания курса терапии) различия между группами I и II были статистически достоверны при р<0,01.
У больных, получавших композицию в соответствии с изобретением, в сравнении с больными, получавшими композицию по прототипу, наблюдалось явное улучшение показателей интерферонового статуса (повышение уровней сывоторочного интерферона, альфа-интерферона) через 10 и 20 дней от начала курса терапии.
В группах I и II в ходе лечения выявлено достоверное снижение РНК HCV (к моменту окончания курса частота выявления РНК HCV в группах I и II составила соответственно 22,5% и 13,0%) по сравнению с контрольной группой, где частота выявления РНК HCV к моменту окончания курса составила 90%, однако уже через 1 мес. после окончания курса лечения РНК HCV обнаруживалось у 25,0% пациентов группы I и лишь у 5,0% пациентов группы II (в контрольной группе частота выявления РНК HCV выросла до 97%); через 6 мес.от начала терапии РНК HCV была выявлена у 30% пациентов, получавших композицию по прототипу, и лишь у 13,0% пациентов, получавших композицию в соответствии с изобретением.
Кроме того, в рамках настоящего изобретения было показано, что композиция в соответствии с изобретением не оказывала побочных отрицательных эффектов при лечении хронического вирусного гепатита С. Композиция по изобретению хорошо переносилась больными, нормализовала их эмоциональное состояние; ни у одного больного не было отмечено аллергических реакций.
Композиция по изобретению в сравнении с прототипом проявила неожиданно высокую противовирусную активность, что выразилось в статистически достоверном снижении симптомов печеночной недостаточности и в сокращении сроков их исчезновения, а также в значительно более быстром темпе (в сравнении с прототипом) снижения уровней АлАТ, АсАТ и ЩФ, и в статистически достоверном уменьшении (в ряде случаев - исчезновении) РНК HCV и в улучшении показателей иитерферонового статуса и выработки эндогенного альфа-интерферона.
Пример 3. Противовирусная активность заявляемой композиции в отношении вирусного гепатита В.
В исследовании эффекивности заявляемой композиции в терапии вирусного гепатита В участвовали 60 человек (38 мужчин, 22 женщины), в возрасте от 22 до 58 лет, страдающие острым вирусным гепатитом В.
Треть пациентов (20 человек) получала трижды в сутки перорально (в виде капсул) композицию в соответствии с прототипом (гипорамин + флакозид + хелепин) и симптоматическую терапию (группа сравнения), другая треть пациентов (20 человек) получала трижды в сутки перорально (в виде капсул) композицию в соотвествии с изобретением, содержавшую эквивалентное количество гипорамина и флакозида (опытная группа); треть пациентов (20 человек) получала трижды в сутки препарат плацебо (в виде капсул, по виду не отличимых от исследуемых композиций) (контрольная группа), при этом распределение больных на группы производили случайным образом; достоверных различий между группами по возрасту, весу, полу, срокам и степени тяжести заболевания не было выявлено.
Все пациенты переносили острую фазу болезни, при этом ни один больной в течение 2-3 месяцев до исследования и в течение него не принимали препаратов интерферона, иммуностимуляторов, стероидов.
Эффективность заявляемой композиции и композиции в соответствии с прототипом оценивалась как по продолжительности сохранения клинических симптомов заболевания (слабость, диспепсический синдром, боли в правом подреберье, желтуха, кожный зуд), так и по изменению биохимических показателей сыворотки крови (общий билирубин, аланинаминотрансфераза (АлАТ), аспартатаминотрансфераза (АсАТ)), а также по наблюдавшимся в ходе лечения изменениям в системе интерферона у больных «опытной» группы, контрольной группы и группы сравнения (получавшей композицию в соответствии с прототипом) и по наличию у больных к моменту окончания лечения маркеров репликации HBV, а именно по исчезновению ДНК HBV, по сероконверсии HBeAg в НВеАВ (как считается, сероконверсия HBeAg в НвеАВ при вирусном гепатите В означает прекращение репликации вируса и благоприятный исход заболевания), по наличию HBsAg, а также по наличию у пациентов антител (IgM) к «коровьему» антигену (анти-НВс IgM).
Результаты представлены в таблицах 5-7. Так, в таблице 5 указана продолжительность сохранения клинических симптомов заболевания в опытной группе, контрольной группе и группе сравнения; в таблице 6 приводятся данные биохимического анализа сыворотки крови у больных острым вирусным гепатитом В в опытной группе, контрольной группе и группе сравнения; в таблице 7 приводятся данные о наличии у больных в опытной группе, группе сравнения и в контрольной группе маркеров репликации HBV и анти-НВс IgM в опытной группе, контрольной группе и группе сравнения по окончании курса лечения).
2 Группа сравнения (n=20) (пациенты, получавшие композицию в соответствии с прототипом)
3 Контрольная группа (n=20) (пациенты, получавшие плацебо)
4 В норме - 3,4-17,1 мкмоль/л
5 В норме - до 666 нмоль/(с·л)
6 В норме - до 666 нмоль/(с·л)
Пример 4. Противовирусная активность заявляемой композиции в отношении ВИЧ-инфекции
Изучение противовирусной активности заявляемой фармацевтической композиции (в сравнении с прототипом) проводили в условиях in vitro в перевиваемой смешанной культуре Т-лимфоцитов человека Н9/IIIB и Н9, инфицированных ВИЧ-1 (штамм HTLV-III). Смесь культуры клеток (в соотношении 1:1) готовили непосредственно перед экспериментом и разливали по 2 мл в каждую лунку планшета «Coster». Одновременно в 1/3 лунок вносили исследуемую композицию в соответствии с настоящим изобретением (с получением конечной концентрации (по гипорамину) 30, 10, 5 и 1 мкг/мл (опытный препарат, «О»); в 1/3 лунок вносили композицию в соответствии с прототипом (с получением аналогичной конечной концентрации по гипорамину) (препарат сравнения, «С»); еще 1/3 лунок использовали в качестве контроля (контроль, «К»).
Планшет инкубировали при температуре 37°С при 5% СО2 в течение 7 суток. Жизнеспособность клеточных культур оценивали ежедневно с помощью инвертированного микроскопа. Результаты опыта учитывали на 4-е сутки методом непрямой иммунофлуоресценции с использованием сыворотки ВИЧ-инфицированного человека в разведении 1:40, определяя количество ВИЧ+ клеток в опытной группе, в группе сравнения и в контрольной группе (клеточная культура, не обработанная противовирусными составами). Каждый опыт (исследование каждой концентрации опытного препарата и препарата сравнения) повторяли трижды.
В контрольной группе количество ВИЧ+ клеток составило к 4-м суткам 24,9±2,4%, это значение в дальнейшем было принято за 100%.
Результаты исследования были сведены в таблицу 8 (указан % по отношению к числу ВИЧ+ клеток в контроле).
Пример 5. Противовирусная активность заявляемой композиции в отношении вируса гриппа А птиц H5N1
Сравнительное исследование вируснейтрализующей активности заявляемой композиции и комплекса веществ в соответствии с прототипом (RU 2200571) проводили в системе куриного эмбриона, с использованием вируса гриппа А птиц H5N1. Вирусиейтрализующее действие заявляемой композиции и комплекса веществ в соответствии с прототипом изучали в контактных опытах in vitro, а также индикацией на куриных эмбрионах. Композицию в соответствии с изобретением (опытный препарат, «О») либо комплекс веществ в соотвествии с прототипом (препарат сравнения, «С») растворяли в буферном растворе с рН 7,2-7,4 и смешивали с 1, 10, 100 и 1000 ЭИД100 (эмбриональных инфекционных доз, вызывающих инфицирование куриных эмбрионов в 100% случаев), с получением конечных концентраций растворов (по гипорамину) 100 или 50, или 25, или 10, или 5, или 2,5, или 1, или 0,5, или 0,25, или 0,1 или 0,05 мкг/мл. Смеси препаратов с вирусом гриппа А птиц H5N1 выдерживали в течение 1 ч при температуре +4°С, затем вводили в объеме 0,2 мл в аллантоисную полость 9-10 интактных куриных эмбрионов. Через 48 ч после введения куриные эмбрионы вскрывали и определяли в аллантоисной жидкости определяли наличие вируса гриппа (методом гемагллютинации). Активность выражали количеством нейтрализованных эмбриональных инфекционных доз вируса гриппа.
Каждое измерение повторяли трижды, по результатам трех измерений вычисляли среднее арифметическое и стандартное отклонение.
Результаты исследования противовирусной активности заявляемой композиции в сравнении с препаратом по прототипу представлены в таблице 9.
Пример 6. Противовирусная активность заявляемой композиции в отношении герпесвирусной инфекции (вирус HSV1) в эксперименте in vivo
Эксперимент 1. Было проведено доклиническое исследование сравнительной противовирусной активности заявляемой фармацевтической композиции в отношении вируса простого герпеса 1-го типа (вирус HSV-1, штамм SC16) в сравнении с фармацевтической композицией-прототипом.
Исследование проводилось на лабораторных мышах (самки BALB/c и DBA/2, Bantin and Kingman, Великобритания). Животных, входящих в контрольную группу (25 животных), опытную группу (25 животных) или группу сравнения (25 животных), заражали путем внутрибрюшинного введения суспензии вируса HSV-1 SC16 в дозе 5·105 БОЕ (бляшкообразующих единиц) в 0,1 мл фосфатного буфера.
Противовирусное лечение (пероральное введение заявляемой композиции (в опытной группе) или препарата сравнения, известного из RU 2200571 комплекса веществ (в группе сравнения), содержащего эквивалентное количество гипорамина и флакозида), начинали через 24 ч от момента инфицирования и продолжали в течение 120 ч от момента инфицирования. Опытный препарат и препарат сравнения давались таким образом, чтобы обеспечить дозу (по гипорамину) около 100 мг/кг массы тела в сутки.
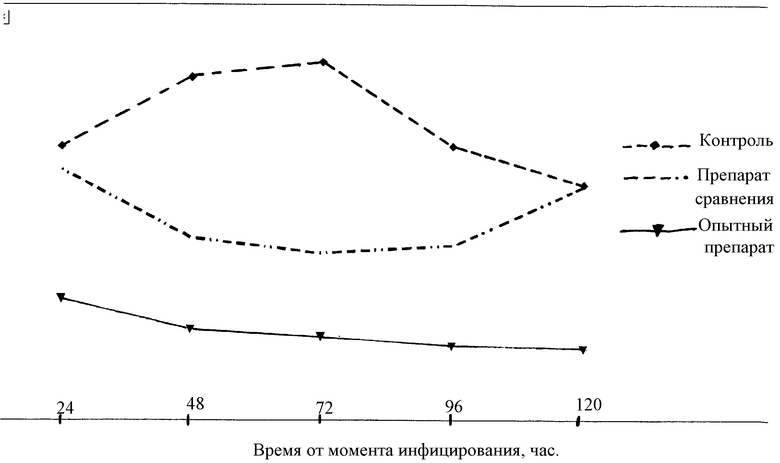
Поскольку из литературы известно, что селезенка и перитонеальный экссудат являются основными резервуарами вируса герпеса в организме и что титр вируса герпеса (БОЕ/0,1 мл) в перитонеальных смывах хорошо коррелирует с содержанием вируса в тканях селезенки, то в рамках настоящего эксперимента определяли титр вируса в перитонеальных смывах, полученных у животных опытной группы, группы сравнения и контрольной группы через 24, 48, 72, 96 и 120 ч от момента инфицирования.
Перитонеальные смывы получали, вводя в брюшную полость животных 2 мл ледяной минимальной питательной среды Eagle, содержащей 10% сыворотки новорожденных телят, аккуратно массировали мышам живот и затем отбирали пробы для исследования перитонеальной жидкости. Полученные пробы трижды подвергали замораживанию/размораживанию, затем определяли содержание вируса (HSV-1 SC-16) в каждом из образцов методом бляшкообразования в культуре клеток Vero (клетки почечного эпителия).
Результаты представлены в таблице 10 и на чертеже (в виде десятичных логарифмов значений БОЕ/0,1 мл).
Из представленных данных можно видеть, что хотя в группе, получавшей комплекс веществ растительного происхождения в соответствии с прототипом (гипорамин, флакозид и хелепин или хелепин Д, взятые в определенном количественном соотношении), через 48 ч от момента заражения наблюдалось некоторое снижение титра вируса (в сравнении с контролем, где титр вируса практически не изменялся в первые 3-е суток от момента инфицирования), однако, напротив, в группе животных, получавшей композицию в соответствии с заявляемым изобретением, содержащую эквивалентное количество гипорамина, титр вируса уже к 48 ч от момента заражения был близок к уровню чувствительности метода, а к концу эксперимента (120 ч от момента заражения) вирус в перитонеальных смывах животных опытной группы вообще не обнаруживался.
Эксперимент 2. Эффективность заявляемой композиции в отношении HSV-2 инфекции
Мышей (60 самок Balb/c, включая 20 животных опытной группы, 20 животных группы сравнения и 20 животных контрольной группы) заражали вирусом герпеса HSV-2 (Bry) (путем инокуляции суспензии вируса в мочку уха) и исследовали действие заявляемой фармацевтической композиции и препарата сравенения (комплекс веществ согласно RU 2200571) на латентную герпесвирусную инфекцию. Лечение начинали на 1-е сутки после заражения.
В таблице 11 показано число животных с выявленной латентной HSV-1 инфекцией в тройничном (ТГ) и цервикальном дорзальном корневом (ЦДК) ганглии в каждой из групп (опыт, контроль, препарат сравнения) спустя 7 дней после начала лечения.
(RU 2200571)
Представленные данные, по нашему мнению, убедительно свидетельствуют о том, что заявляемая композиция в сравнении с прототипом (комплекс веществ согласно патенту RU 2200571) обладает неожиданно более высокой в количественном отношении антитрепонематозной и противовирусной активностью и характеризуется широким спектром противовирусной активности, что и составляет неожиданный технический результат настоящего изобретения.
Изобретение относится к фармацевтической промышленности, в частности к фармацевтической композиции для лечения сифилиса и вирусных заболеваний. Фармацевтическая композиция для лечения сифилиса и вирусных заболеваний, выбранных из гриппа, вирусного иммунодефицита человека, цитомегаловирусной инфекции, вирусного гепатита А, В, С и герпесвирусной инфекции, содержащая сумму полифенольных соединений из листьев облепихи крушиновидной, включая не менее 60% галлоэллаготаннинов, флакозид, фармакологически приемлемый носитель и вещество из экстракта корней солодки, или глицирризиновой кислоты, или ее фармацевтически приемлемой соли, акридоноуксусную кислоту или ее фармацевтически приемлемую соль, экстракт бересты или бетулин, взятые в терапевтически эффективных количествах. Способ лечения сифилиса и вирусных заболеваний, включающий введение заявленной фармацевтической композиции, по 2-3 дозы 3 раза в день. Вышеуказанная композиция обладает выраженным противовирусным действием в отношении вышеуказанных инфекций. 2 н. и 20 з.п. ф-лы, 1 ил., 11 табл.
1. Фармацевтическая композиция для лечения сифилиса и вирусных заболеваний, выбранных из гриппа, ВИЧ-инфекции, нейроинфекции, цитомегаловирусной инфекции, вирусного гепатита, вторичных иммунодефицитных состояний на фоне хронических бактериальных инфекций и герпесвирусной инфекции, выполненная на основе экстрактов растительного происхождения и содержащая в терапевтически эффективных количествах сумму полифенольных соединений из листьев облепихи крушиновидной, включая не менее 60% галлоэллаготаннинов, флакозид и фармацевтически приемлемый носитель, отличающаяся тем, что дополнительно содержит терапевтически эффективное количество акридоноуксусной кислоты или ее фармацевтически приемлемой соли, терапевтически эффективное количество экстракта корней солодки, или глицирризиновой кислоты, или фармацевтически приемлемой соли глицирризиновой кислоты, и терапевтически эффективное количество экстракта бересты или бетулина.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что терапевтически эффективное количество суммы полифенольных соединений из листьев облепихи крушиновидной составляет от 10 до 100 мг.
3. Фармацевтическая композиция по п.1, отличающаяся тем, что терапевтически эффективное количество флакозида составляет от 100 до 200 мг.
4. Фармацевтическая композиция по п.1, отличающаяся тем, что фармацевтически приемлемая соль акридоноуксусной кислоты представляет собой соль акридоноуксусной кислоты с N-метилглюкамином.
5. Фармацевтическая композиция по п.1, отличающаяся тем, что терапевтически эффективное количество акридоноуксусной кислоты или ее фармацевтически приемлемой соли составляет от 250 до 1000 мг.
6. Фармацевтическая композиция по п.1, отличающаяся тем, что фармацевтически приемлемая соль глицирризиновой кислоты представляет собой глицирризинат натрия.
7. Фармацевтическая композиция по п.1, отличающаяся тем, что терапевтически эффективное количество глицирризиновой кислоты или ее фармацевтически приемлемой соли составляет от 30 до 300 мг.
8. Фармацевтическая композиция по п.1, отличающаяся тем, что терапевтически эффективное количество экстракта бересты или бетулина составляет от 100 до 350 мг.
9. Фармацевтическая композиция по п.1, отличающаяся тем, что вирусный гепатит представляет собой вирусный гепатит А, или вирусный гепатит В, или вирусный гепатит С.
10. Фармацевтическая композиция по п.1, отличающаяся тем, что ВИЧ-инфекция представляет собой СПИД (стадии IIА-IIIВ).
11. Фармацевтическая композиция по п.1, отличающаяся тем, что нейроинфекция представляет собой нейро-СПИД, или вирусный энцефалит, или болезнь Лайма.
12. Фармацевтическая композиция по п.1, отличающаяся тем, что грипп представляет собой грипп А птиц, вызванный вирусом H5N1.
13. Фармацевтическая композиция по любому из пп.1-12, отличающаяся тем, что выполнена в форме твердых или мягких желатиновых капсул.
14. Фармацевтическая композиция по любому из пп.1-12, отличающаяся тем, что выполнена в форме пеллет(ов).
15. Фармацевтическая композиция по любому из пп.1-12, отличающаяся тем, что выполнена в форме таблеток.
16. Фармацевтическая композиция по п.15, отличающаяся тем, что выполнена в форме таблеток с модифицированным высвобождением.
17. Фармацевтическая композиция по любому из пп.1-12, отличающаяся тем, что выполнена в форме саше.
18. Способ лечения сифилиса и вирусных заболеваний, выбранных из гриппа, ВИЧ-инфекции (включая СПИД, стадии IIА-IIIВ), нейроинфекции, цитомегаловирусной инфекции, вирусного гепатита, вторичных иммунодефицитных состояний на фоне хронических бактериальных инфекций и герпесвирусной инфекции, включающий введение фармацевтической композиции по любому из пп.1-17, нуждающемуся в этом пациенту по 2-3 дозы 3 раза в сутки.
19. Способ по п.18, отличающийся тем, что грипп представляет собой грипп А птиц, вызванный вирусом H5N1.
20. Способ по п.18, отличающийся тем, что вирусный гепатит представляет собой вирусный гепатит А, или вирусный гепатит В, или вирусный гепатит С.
21. Способ по п.18, отличающийся тем, что нейроинфекция представляет собой нейро-СПИД, или вирусный энцефалит, или болезнь Лайма.
22. Способ по п.18, отличающийся тем, что ВИЧ-инфекция представляет собой СПИД (стадии IIА-IIIВ).
Авторы
Даты
2010-10-10—Публикация
2009-05-29—Подача