Область техники, к которой относится изобретение
Настоящее изобретение относится к новому способу фагового дисплея, фаговым или фагмидным векторам, используемым в настоящем способе, и полученным таким способом фаговым частицам.
Уровень техники
Проявление полипептидов на бактериофаге (фаговый дисплей) является способом отбора, позволяющим выделять полипептиды с желаемыми свойствами из большого набора вариантов (Russel M., Lowman H.B., Clackson Т., в кн.: «Phage Display», 2004, под ред. Clackson Т. и Lowman H.B., изд-во Oxford University Press, cc.1-26). Способ фагового дисплея интенсивно изучается для отбора из комбинаторных антител или пептидных библиотек. Самыми применимыми бактериофагами в способе фагового дисплея являются нитчатые фаги. Нитчатые фаги составляют большое семейство вирусов бактерий, инфицирующих многие виды грамотрицательных бактерий. Наиболее известными нитчатыми фагами являются нитчатые фаги Escherichia соli, а именно фаги f1/M13/fd и IKe. Для фагового дисплея в большинстве случаев используют нитчатые фаги f1, M13 и fd. Геномы этих фагов идентичны более чем на 98%, а их генные продукты взаимозаменяемы.
Специфика сборки нитчатого фага, в отличие от сборки многих других бактериофагов, заключается в том, что это секреторный процесс. Включение полипептидов в растущий фаг происходит в цитоплазматической мембране, и формирующиеся фаги по мере сборки выталкиваются из клетки (Russel и др., см. ссылку выше). В этом процессе клетки Е.coli не лизируются. Пять белков оболочки вируса (pIII, pVI, pVII, pVIII и pIX) включены в цитоплазматическую мембрану до их включения в фаговые частицы (фиг.1). Например, большая часть р1П переносится через мембрану в периплазматическое пространство, хотя С-концевой гидрофобный хвост закрепляет белок в мембране.
Одной из предпосылок фагового дисплея с применением нитчатых вирусов является транслокация исследуемого пептида через цитоплазматическую мембрану. Обычно в основе этого лежит генетическая гибридизация исследуемого пептида с белком оболочки фага и транслокация соответствующего слитого полипептида. В другом варианте исследуемый пептид и белок оболочки фага транслоцируются независимо. В этой ситуации исследуемый пептид стабильно связан с фаговой частицей в периплазме, например, за счет формирования дисульфидной связи (Cys-дисплей) или лейцин-зиппера (pJuFo система) с соответствующим белком оболочки фага. При обычном способе индикации с применением нитчатых вирусов и гибридизацией с рIII метаболический путь Sec используют для транслокации слитого полипептида, представляющего исследующий белок. В этом метаболическом пути полипептид сначала синтезируется на рибосоме, а затем в результате посттрансляционного процесса в состоянии, предшествующем формированию пространственной конфигурации, транслоцируется Sec транслоконом (фиг.2, (3)-(4)-(5)). То есть траслокационный перенос через цитоплазматическую мембрану начинается только после синтеза существенного количества полипептидной цепи. Однако вклад механизма транслокации в успех фагового дисплея полностью не установлен и возможность использовать путь котрансляционой транслокации не была установлена в предшествующем уровне техники.
Было произведено функциональное проявление внутриклеточных и внеклеточных белков различного размера и структуры на нитчатых фагах (Russel и др., см. ссылку выше). Тем не менее, некоторые полипептиды не поддаются проявлению из-за присущих им специфических свойств, причины которых в большинстве случаев неизвестны. Таким образом, успех проявления определенных белков непредсказуем. В связи с этим обычно рекомендуется сначала установить эффективность проявления с применением нитчатых вирусов для каждого используемого белка. Кроме того, если комбинаторная библиотека создана для фагового дисплея, не все клоны могут быть подвержены проявлению равно эффективно, что особенно справедливо для библиотек, созданных с молекул кДНК. Проблемы, связанные с проявлением полипептидов, могут быть результатом их воздействия на выработку фага, его агрегацию в периплазме, его протеолиз, токсичность в отношении Е.coli или несовместимость с используемым путем транслокации. Главным образом, предшествующая транслокации стадия является важным фактором, влияющим на инкорпорацию слитых полипептидов в фаговые частицы. Если пространственная сборка полипептидов происходит преждевременно, они могут быть невосприимчивы к транслокации или даже проявляют цитоплазматическую токсичность. Таким образом, важно, происходит ли транслокация белка посттрансляционно (потенциально допуская преждевременную укладку) или котрансляционно (не допуская цитоплазматической укладки). Современные способы проявления с применением нитчатых фагов используют посттрансляционные метаболические пути для транслокации слитого полипептида через цитоплазматическую мембрану (Russel и др., см. ссылку выше, Paschke M., Höhne W., Gene 2005, 350, 79-88), Таким образом, полипептиды, несовместимые с такими метаболическими путями, могут быть невосприимчивы к проявлению, поэтому отбор фаговым дисплеем крайне неэффективен или даже невозможен. Например, посттрансляционный метаболический путь Sec, который почти исключительно используется для фагового дисплея, по своему существу неспособен к транслокации белков, которые не могут сохраняться в неуложенном состоянии в цитоплазме, поскольку транслокон Sec сам может транспортировать только неуложенные полипептиды (Huber D. и др., J. Bacteriol. 2005, 187, 2983-2991, Paschke и др., см. ссылку выше).
Таким образом, технические задачи, решаемые в настоящем изобретении, заключаются в идентификации новых подходов к транслокации для эффективного проявления тех полипептидов на нитчатых фагах, проявление которых неэффективно при использовании посттрансляционной транслокации. Решение этой технической задачи достигается осуществлением решений, описанных в формуле настоящего изобретения.
Краткое описание изобретения
Настоящее изобретение относится к способу проявления с применением нитчатых фагов, в котором исследуемые полипептиды (ИП), проявление которых произведен на фаговых частицах, котрансляционно транслоцируются через цитоплазматическую мембрану грамотрицательных бактерий, особенно основанному на метаболическом пути сигнал-распознающей частицы.
Таким образом, настоящее изобретение позволяет осуществлять фаговый дисплей путем контрансляционной транслокации слитых полипептидов, в том числе исследуемых полипептидов. Этот способ особенно применим для полипептидов, о которых известно, что сложно осуществить их проявление на фагах, а также для белков кДНК библиотек и других комбинаторных библиотек, особенно если укладка белка происходит очень быстро.
Настоящее изобретение также относится к фаговым или фагмидным векторам, включающим генетическую конструкцию, кодирующую слитый полипептид, включая подвергаемый проявлению ИП на фаговой частице и N-концевую сигнальную последовательность, активирующую котрансляционную транслокацию, основанную на метаболическом пути частицы распознавания сигнала, и к фагам, полученным по способу настоящего изобретения.
Краткое описание фигур
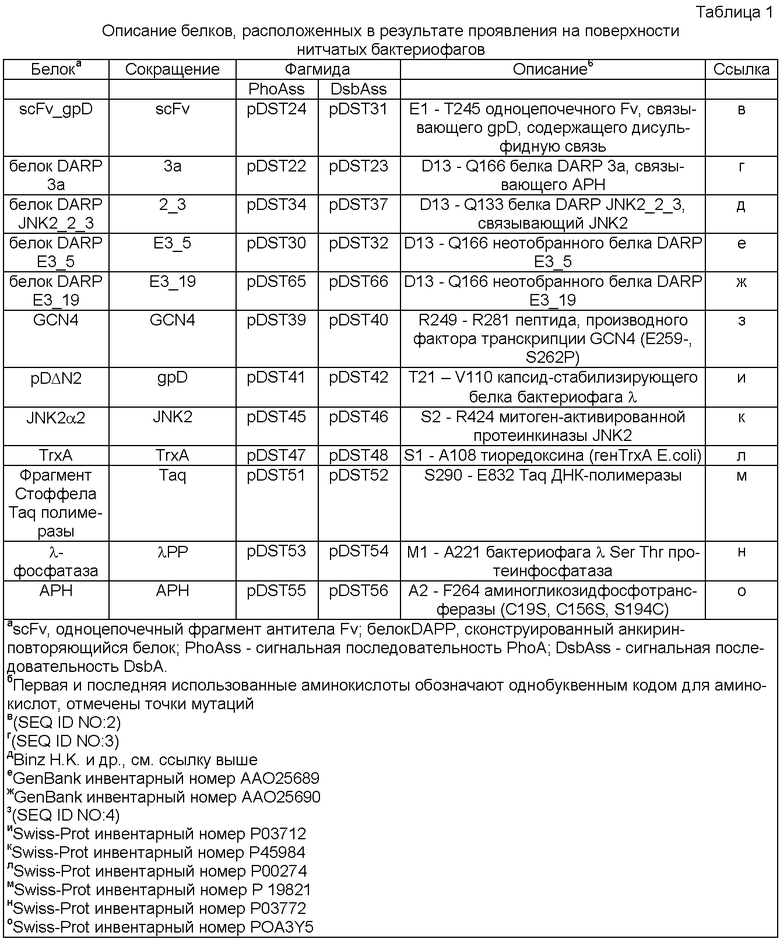
Фиг.1. Инсерция в мембрану и проявление исследуемых полипептидов.
N-концевые (N), С-концевые (С) исследуемые полипептиды (ИП), N-концевые домены рIII (N1, N2), С-концевой домен pIII (СТ).
А) Проявление исследуемого полипептида (ИП) на частицах нитчатого фага всегда включает транслокацию ИП через цитоплазматическую мембрану в периплазму. Обычно ИП транслоцируют в качестве слитого полипептида, включающего белок оболочки III (pIII) или его фрагмент. рIII включает два N-концевых домена (N1, N2) и С-концевой домен (СТ). В этом конкретном примере слитый полипептид содержит N-концевой ИП и С-концевой домен СТ.
Слитый полипептид и рIII закрепляются в цитоплазматической мембране через С-концевой гидрофобный фрагмент по СТ домену после транслокации и перед его инкорпорацией в фаговую частицу.
Б) Упрощенное изображение частицы нитчатого фага с проявлением рIII слитым полипептидом А). N-концевые домены рIII (N1, N2) и исследуемые белки, включенные в фаговую частицу через СТ часть молекулы.
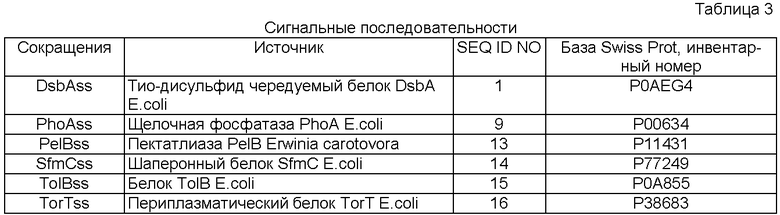
Фиг.2. Транслокация полипептидов через цитоплазматическую мембрану грамотрицательных бактерий.
Упрощенное изображение трех крупных метаболических путей, известных для транслокации полипептидов через цитоплазматическую мембрану в периплазму грамотрицательных бактерий. Этими путями являются метаболические пути SRP, Sec и Tat. И Sec, и SRP метаболические пути основываются на транслоконе Sec (SecTR), а метаболический путь Tat основан на транслоконе Tat (TatTR). И Sec, и Tat метаболические пути транслоцируют полипептиды посттрансляционно, а метаболический путь SRP котрансляционно транслоцирует полипептиды. Метаболические пути Sec и SRP сходятся на Sec транслоказе, которая транспортирует белки в неуложенном состоянии (нс) через мембрану. Напротив, транслокон Tat транслоцирует только уложенные (у) белки. Аминокислотная композиция сигнальной последовательности (ss) четко определяет предшественника белка по одному из этих метаболических путей. После транслокации сигнальная последовательность отщепляется от предшественника белка пептидазой. Метаболический путь SRP опосредуется сигнальной распознающей частицей (signal recognition particle - SRP), рибонуклеопротеин, состоящий из гомолога белка размером 54 кДа и 4.5S РНК. На этом метаболическом пути имеется SRP, который нацеливает пробелок к транслокону Sec. SRP распознает и связывает соответствующие сигнальные последовательности, являющиеся производными рибосомы (R), принимает комплекс вновь образуемой на рибосоме цепи на SRP-рецептор (SR) и затем пробелок котрансляционно транслоцируется через транслокон Sec. Полипептиды, которые несовместимы с метаболическим путем Sec из-за их преждевременной укладки в цитоплазме, могут быть эффективно транслоцированы по метаболическому пути SRP в ходе трансляции. (1) SRP связывается с частично гидрофобными сигнальными последовательностями формирующихся белков, являющихся производными рибосомы. (2) SRP направляет комплекс формируемой в рибосоме цепи через SRP-рецептор к транслокону Sec, где происходит котрансляционная транслокация. Большинство предшественников белков обладает менее гидрофобными сигнальными последовательностями и подвергается SecB - зависимому экспорту. (3) Триггерный фактор - цитозольный шаперон, который обладает неспецифическим сродством к формируемым полипептидам, связывается со зрелой областью формируемого пробелка и эффективно сохраняет связь до полного завершения трансляции. (4) После диссоциации триггерного фактора цитозольные факторы, например, SecB, помогают сохранять пробелки в протяженной не подвергшейся укладке конформации. (5) Предшественники белков, которые сохраняют протяженную конформацию, эффективно транспортируются через Sec транслокон. (6) Однако, если укладка предшественника белка происходит в цитоплазме, белок обычно разрушается (10) или может даже закупорить транслокон Sec. Пробелки с сигнальными последовательностями, содержащими мотив двойного аргинина, предназначенные для транслокона Tat. (7) Ассоциация с шапероном (ТС), например, DnaK или другим Tat-специфическим фактором, предположительно защищает сигнальную последовательность до тех пор, пока не происходит укладка (8). Тот же фактор или дополнительный фактор также может активировать правильную укладку белка. Tat транслокация происходит только в том случае, если предшественник белка претерпел правильную укладку, в противном случае предшественник белка разрушается по протеолитическому механизму (9, 10), имеющемуся в клетке.
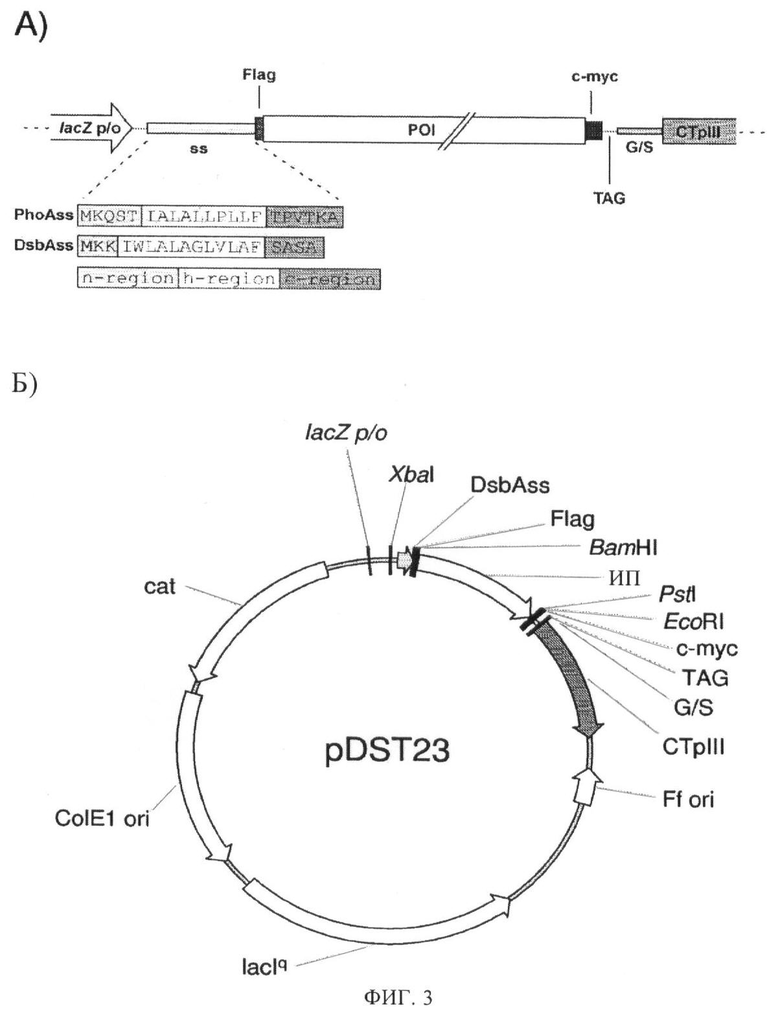
Фиг.3. Схематическое представление серий фагмидного вектора pDST.
А) Схематическое изображение экспрессирующей кассеты серий фагмидного вектора pDST. Экспрессирующая кассета включает элемент промотора/оператора гена lacZ E.coli (lacZ р/о), сайт связывания рибосомы (не показан), кодирующие последовательности сигнальных последовательностей (signal sequence - ss) и исследуемого полипептида (ИП), подвергаемого проявлению, супрессорный стоп-кодон (TAG), кодирующие последовательности для гибкого глицин/серинового линкера (G/S) и для С-концевого домена (аминокислоты 250-406) белка III нитчатого фага (CTpIII), опосредующего включение слитого полипептида в фаговую частицу, два стоп-кодона (TGATAA, не показаны) и элемент терминации транскрипции (не показан). Кодирующая последовательность ИП фланкирована последовательностями ДНК, кодирующими Flag-tag (Flag) и c-myc-tag (c-myc). Показаны обозначаемые однобуквенным кодом аминокислотные последовательности сигнальной последовательности DsbA (DsbAss) в качестве примера сигнальных последовательностей, нацеленных на метаболический путь SRP, и сигнальной последовательности PhoA (PhoAss) в качестве примера сигнальных последовательностей, нацеленных на метаболический путь Sec. Эти сигнальные последовательности содержат положительно заряженную N-концевую область (n-область), неполярную гидрофобную середину (h-область) и более полярную С-концевую область (с-область).
Б) Схематическое представление фагмиды pDST23. Помимо элементов, показанных в А), показано начало репликации нитчатого фага (filamentous phage replication origin - Ff ori), ген репрессора lac E.coli (lacl), который образует penpeccop lac, необходимый для строгого контроля lacZ р/о, начало репликации ColE1 (origin of replication - ColE1 ori) для бактериальной репликации вектора, ген устойчивости к антибиотику (cat), кодирующий устойчивость к хлорамфениколу, опосредованную хлорамфениколацетилтрансферазой, и сайты рестрикции XbaI, BamHI, PstI и EcoRI. В плазмиде pDST23 кодируемый полипептид является сконструированным анкирин-повторяющимся белком (DARP) 3а.
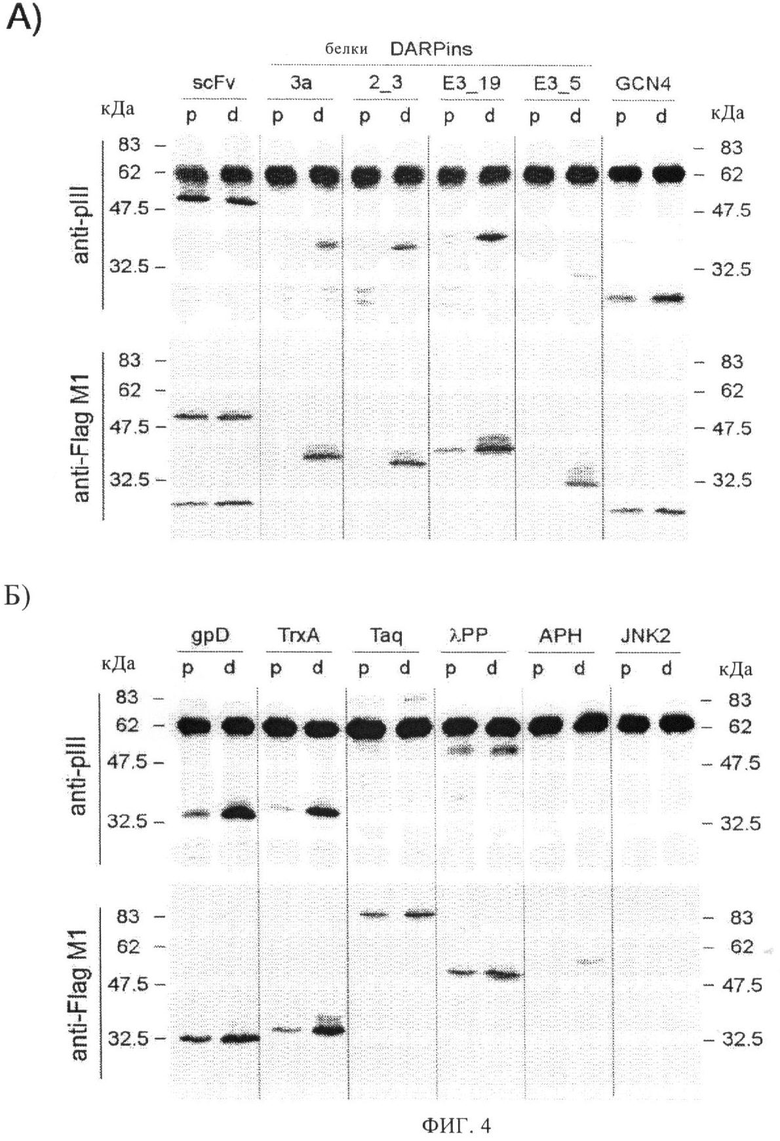
Фиг.4. Оценка продуктивности проявления методом вестерн-блоттинга.
А) и Б) Очищенные в градиенте CsC1 фаговые частицы, полученные с помощью соответствующих фагмид, разделяют с помощью SDS-PAGE, наносят на мембраны поливинилиденфторида (ПВДФ) и выявляют с применением антител, специфичных для С-концевого домена белка III (анти-рIII) или Flag-tag (анти-FlagM1). Аликвоты, нанесенные на стартовую линию, скорректированы до величины 5×1011 фаговых частиц. Анализируют продуктивность проявления фаговых частиц для различных полипептидов. Сокращенные названия полипептидов приводят над дорожками, причем они соответствуют полипептидам, перечисленным в табл.1. Кроме того, табл.1 показывает соответствующие фагмиды, используемые для получения фаговых частиц, а экспрессирующая кассета обведена в рамку на фиг.3А. Продуктивности проявления сравнивают для каждого полипептида, в котором использованы либо сигнальные последовательности PhoA (дорожки, обозначенные «р»), либо сигнальная последовательность DsbA (дорожки, обозначенные «d»), для транслокации соответствующего слитого полипептида по метаболическому пути Sec или SRP соответственно. Более жирные полосы соответствуют более высокой продуктивности проявления. Молекулярные массы маркерных белков в кДа указаны с обеих сторон блоттинга. Полоса 62 кДа в пятне анти-рIII соответствует белку дикого типа.
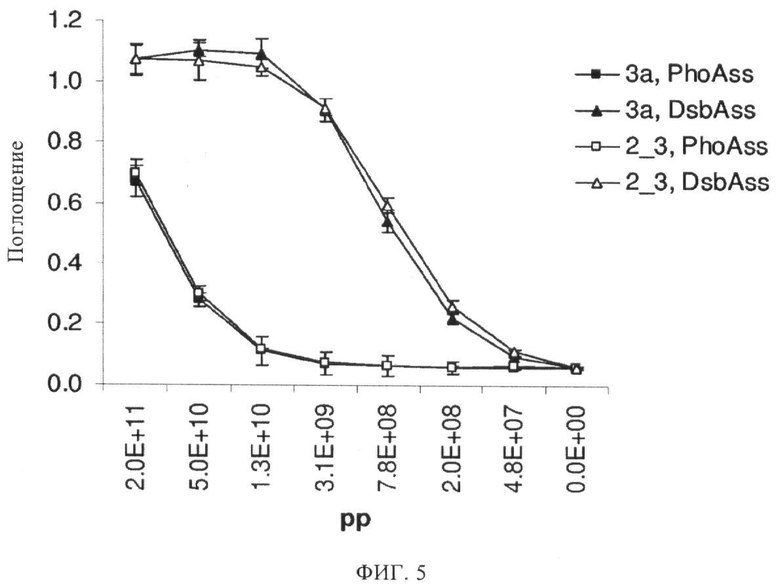
Фиг.5. Оценка продуктивности проявления методом ELISA.
Фаговые частицы с проявлением либо the cJun N-концевая киназа 2 (JNK2)-связывающим белком DARP, называемым 2_3 (незаштрихованные значки), либо аминогликозидкиназа АРН(3')-IIIа (АРН)-связывающим белком DARP, называемым 3а (заштрихованные значки), инкубируют в лунках, покрытых нейтравидином и блокированных БСА, которые содержат иммобилизованные биотинилированные белки JNK2 или АРН соответственно. После промывки связанные фаговые частицы обнаруживают с помощью антитела анти-М13, связанного с пероксидазой хрена, и визуализируют с помощью растворимого субстрата ВМ Blue POD. Представленные на графике данные показывают поглощение по оси у, измеренное при 360 нм после вычитания фона, измеренного при 392 нм, относительно числа фаговых частиц в лунке, указанных по оси х. Фаговые частицы, полученные от вариантов фагмид, кодирующих сигнальную последовательность DsbA (значки в виде треугольников), показывают половину от максимального сигнала уже примерно при нагрузке примерно 8×108 фагов на лунку, а фаговые частицы, полученные от вариантов, кодирующих сигнальную последовательность PhoA (значки в виде квадратов), показывают половину от максимального сигнала уже примерно при нагрузке примерно 2×1011 фагов на лунку, свидетельствуя о более чем в 100 раз меньшей продуктивности проявления. Таким образом, применение сигнального пути SRP, опосредованного сигнальной последовательностью DsbA, для транслокации слитых полипептидов резко повышает продуктивность проявления по сравнению с применением сигнального пути Sec, опосредованного сигнальной последовательностью PhoA.
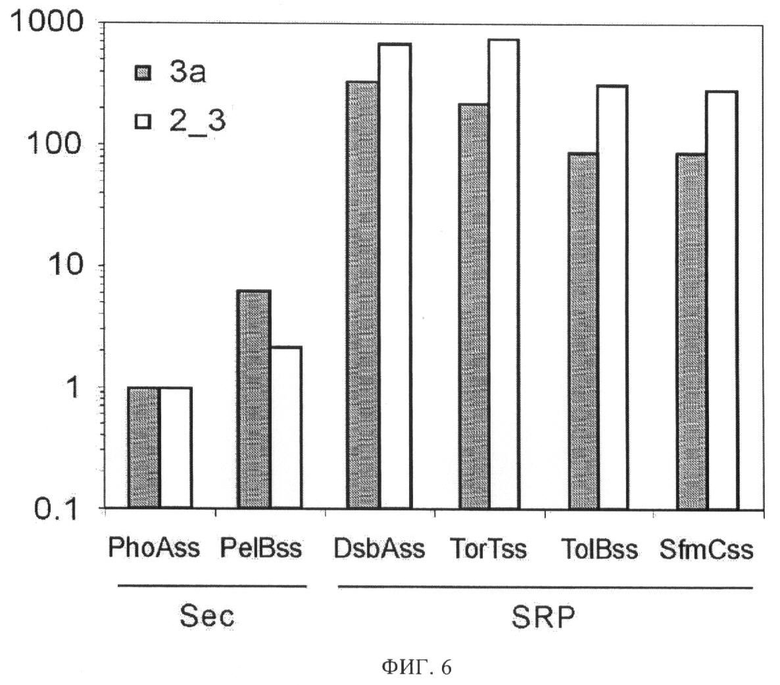
Фиг.6. Количественная оценка продуктивности проявления методом ELISA.
Фаговые частицы с проявлением белков DARP 2_3 или 3а анализируют согласно описанию к фиг.5. Результаты представлены в виде диаграммы (по логарифмической шкале), причем допущено, что продуктивность проявления PhoAss равна 1. Уровень проявления для каждой сигнальной последовательности соответствует числу фаговых частиц, дающих величину OD450=0,5 относительно числа фаговых частиц, содержащих PhoAss, дающих величину OD450=0,5. PelBss: сигнальная последовательность белка PelB Erwinia carotovora (предполагаемая Sec-зависимая сигнальная последовательность). SRP-зависимые сигнальные последовательности белков Е.coli TorT (TorTss), TolB (TolBss) и SfmC (SfmCss) тестируют дополнительно к DsbAss. Наблюдают повышенную продуктивность проявления, вплоть до 700 раз, для SRP-зависимой сигнальной последовательности TorTss по сравнению с Sec-зависимой сигнальной последовательностью PhoAss. SRP-зависимые TolBss и SfmCss показали повышенную продуктивность проявления вплоть до 300 раз. Предположительно Sec-зависимая сигнальная последовательность PelBss показывает повышение продуктивности проявления только от двух до шести раз.
Подробное описание изобретения
В контексте настоящего изобретения понятие «фаговый дисплей с применением нитчатых вирусов» относится к фаговому дисплею, основанному на нитчатых фагах. Нитчатые фаги составляют большое семейство вирусов бактерий, которые инфицируют многие грамположительные бактерии. Предпочтительно нитчатые фаги инфицируют Е.coli, в частности, фаги f1/M13/fd и IKе. Способы использования фагового дисплея с применением нитчатых вирусов хорошо известны специалистам в данной области (например, Russel и др., см. ссылку выше).
В контексте настоящего изобретения понятие «сигнальная последовательность» относится к N-концевому участку аминокислот полипептида, который приводит к нацеливанию полипептида на транслоказу. У Е.coli N-концевая сигнальная последовательность обычно содержит 15-52 аминокислот. Большинство сигнальных последовательностей содержит положительно заряженную N-концевую область (n-область), неполярную гидрофобную сердцевину (h-область) и более полярную С-концевую область (с-область). С-область содержит сайт расщепления для сигнальной пептидазы. Сигнальная пептидаза является мембранно-связанной протеазой, которая удаляет сигнальную последовательность с полипептида во время реакции транслокации. Такие сигнальные последовательности, содержащие 18-30 аминокислот, являются предпочтительными. Определение сигнальных последовательностей хорошо известно специалистам в данной области. Например, они могут быть получены из баз данных Swiss-Prot или GenBank или аннотированных обширных баз геномов.
В контексте настоящего изобретения понятие «пробелок» относится к полипептиду, включающему N-концевую сигнальную последовательность. Сигнальная последовательность отщепляется от пробелка во время реакции транслокации, в результате чего формируется зрелый белок.
В контексте настоящего изобретении понятие «слитый полипептид» относится к полипептиду, включающему N-концевую сигнальную последовательность, исследуемый полипептид (ИП) и дополнительную аминокислотную последовательность, позволяющую осуществлять проявление на нитчатом фаге. Предпочтительно такая дополнительная последовательность включает полипептид оболочки нитчатого фага или его фрагмент. В другом варианте последовательность присоединяет ИП к частице фага в периплазме за счет формирования устойчивой связи, например, формирования дисульфидной связи (Cys-дисплей) или формирования лейцин-зиппера (pJuFo системы) с соответствующим белком оболочки фага. В этой иной стратегии ИП и соответствующий белок оболочки фага транслоцируются независимо через цитоплазматическую мембрану.
В контексте настоящего изобретения понятие «транслокация» относится к транслокации полипептида через биологическую мембрану, опосредованной транслоконом (Holland I.B. и др., Biochim. Biophys. Acta 1694, 2004, cc.5-16). Транслокация происходит посттрансляционно или котрансляционно. Следовательно, транслоказа является ферментом или ферментным комплексом, который специфически транспортирует полипептид через транслокон (Holland и др., см. ссылку выше).
В контексте настоящего изобретения понятие «метаболический путь Sec» относится к механизму транспорта белка для посттрансляционной транслокации пробелков через цитоплазматическую мембрану грамотрицательных бактерий через транслокон Sec (Holland и др., см. ссылку выше). Метаболический путь Sec опосредован молекулярными шаперонами, наиболее часто SecB, которые сохраняют пробелки в неуложенном состоянии перед транслокацией. Метаболический путь Sec является основным путем транслокации белков у грамотрицательных бактерий.
В контексте настоящего изобретения понятие «метаболический путь SRP» обозначает механизм транспорта белка для котрансляционной транслокации пробелков через цитоплазматическую мембрану грамотрицательных бактерий через транслокон Sec (Schierle C.F. и др., J. Bacteriol. 185, 2003, cc.5706-5713, Huber и др., см. ссылку выше). Метаболический путь SRP опосредован сигнал-распознающей частицей (signal recognition particle - SRP) -рибонуклеопротеиновым комплексом, содержащим гомолог белка массой 54 кДа (Fifty-four homolog - Ffh) и 4,5S РНК. В метаболическом пути SRP сигнальная последовательность взаимодействует с SRP сразу после ее отделения от рибосомы. Комплекс, включающий SRP, создающийся полипептид и рибосому, затем трансферируется через SRP-рецептор на транслокон Sec, где полипептид подвергается котрансляционной транслокации через транслокон Sec.
Метаболические пути Sec и SRP сходятся на транслоказе Sec, которая транспортирует белки в неуложенном состоянии через мембрану. Это аминокислотная композиция сигнальной последовательности, которая строго предпочтительно нацеливает пробелок на метаболический путь SRP, а не метаболический путь Sec, для его транслокации (Huber и др., см. ссылку выше).
В контексте настоящего изобретения понятие «DsbA» относится к периплазматическому тиолу Е.coli: дисульфид-заменяемому белку DsbA (база Swiss-Prot, номер в каталоге Р24991). DsbA является субстратом метаболического пути SRP (Huber и др., см. ссылку выше). DsbA экспортируется котрансляционно, чтобы избежать его укладки в цитоплазме, которая может ингибировать его экспорт.
В контексте настоящего изобретения понятие «ТrхА» относится к белку Е.coli тиоредоксину 1 (база Swiss-Prot, номер в каталоге Р00274). ТrхА может применяться в качестве репортерного белка для различения сигнальных последовательностей, нацеливающих пробелок на метаболический путь SRP или Sec (Schierle и др., см. ссылку выше, Huber и др., см. ссылку выше).
В контексте настоящего изобретения понятие «метаболический путь Tat» относится к метаболическому пути транслокации двойного аргининового белка (Tat) (Paschke и др., см. ссылку выше). Метаболический путь Tat принципиально отличается от метаболических путей Sec и SRP. В отличие от транслокона Sec транслокон Tat транспортирует только полностью уложенные белки. В отличие от метаболического пути SRP транслокон Tat пропускает белки через мембрану посттрансляционно.
В одном из предпочтительных вариантов осуществления настоящего изобретения сигнальная последовательность слитого полипептида, включающего ИП, проявление которого должен быть произведен на фаговых частицах, является сигнальной последовательностью, индуцирующей котрансляционную транслокацию.
Способы определения, индуцирует ли исследуемая сигнальная последовательность котрансляционную транслокацию через цитоплазматическую мембрану грамотрицательных бактерий, хорошо известны специалистам в данной области. Например, исследуемая сигнальная последовательность генетически гибридизирована со зрелой МаlЕ (база Swiss-Prot, номер в каталоге Р02928, остатки с 27 по 396). Искусственный пробелок затем экспрессируется в Е.coli и выход котрансляционного протеолитического процессинга его формирующейся цепочки анализируют двухмерным гель-электрофорезом согласно описанному (Josefsson L.-G., Randall, L.L., Methods Enzymol. 97, 1983, cc.77-85, Schierle и др., см. ссылку выше). Удаление исследуемой N-концевой сигнальной последовательности при продолжающемся формировании цепочек пробелка показывает, что транслокация инициируется до полного синтеза полипептида и, следовательно, транслокация происходит котрансляционно. Предпочтительными сигнальными последовательностями являются те, которые индуцируют котрансляционную транслокацию более чем на 80%, более предпочтительно более чем на 90%, при гибридизации со зрелым MalE. Наиболее предпочтительными сигнальными последовательностями являются те, которые индуцируют только котрансляционную транслокацию и не индуцируют посттрансляционную транслокацию при гибридизации со зрелым МаlЕ. В другом варианте могут применяться сигнальные последовательности, о которых уже известно, что они индуцируют котрансляционную транслокацию, например, сигнальная последовательность белка DsbA.
В другом варианте осуществления настоящего изобретения сигнальной последовательностью слитого полипептида, включающего ИП для проявления на фаговых частицах, является сигнальная последовательность, нацеливающая на метаболический путь распознавании сигнала.
Метаболический путь распознавании сигнала грамотрицательных бактерий и способы определения, нацеливает ли исследуемая сигнальная последовательность пробелок на метаболический путь SRP, хорошо известны специалистам в данной области. Например, транслокация ТrхА, гибридизированного с сигнальной последовательностью, нацеливающей на метаболический путь SRP, строго подавляется в Е.coli, несущей мутацию гена ffh (например, мутантный штамм ffh77 или ffh87), который кодирует компонент SRP (Schierle и др., см. ссылку выше, Huber и др., см. ссылку выше). Следовательно, сигнальные последовательности, нацеливающие на метаболический путь SRP, индуцируют транслокацию ТrхА через цитоплазматическую мембрану у Е.coli дикого типа, но крайне неэффективны в мутантном штамме ffh. Таким образом, сигнальные последовательности могут быть поделены на два противоположных класса: нацеливающие на метаболический путь SRP и не нацеливающие на метаболический путь SRP. Сигнальные последовательности, нацеливающие на метаболический путь Sec, могут быть перенаправлены на метаболический путь SRP за счет повышения общей гидрофобности сигнальной последовательности, в частности за счет повышения гидрофобности ее h-области. Например, умеренные изменения сигнальной последовательности Ма1Е, которые просто повышают гидрофобность за счет замены полярных или низкомолекулярных (Gly или Ala) аминокислот в h-области на крупные гидрофобные остатки, меняет направление белка с метаболического пути Sec на метаболический путь SRP. В другом варианте могут применяться сигнальные последовательности, о которых уже известно, что они нацеливают на метаболический путь SRP, например, сигнальная последовательность белка DsbA. Другими сигнальными последовательностями метаболического пути SRP являются последовательности подгруппы аутотранспортеров, например, сигнальные последовательности гемоглобинпротеазы (Hbp, UniProtKB, номер в каталоге 088093). Необычно, что сигнальная последовательность Hbp относительно длинная (52 аминокислоты) и содержит N-концевой отрезок, который предшествует классической сигнальной последовательности. Кроме того, h-область сигнальной последовательности Hbp не является в высокой степени гидрофобной. Сигнальная последовательность белка SecM (база Swiss-Prot, номер в каталоге Р62395) является другим примером длинноцепочечной последовательности, которая включает N-концевой отрезок и умеренно гидрофобную h-область, о которой известно, что направляет по метаболическому пути SRP.
В еще одном варианте осуществления настоящего изобретения сигнальной последовательностью слитого полипептида, включающего ИП для проявления на фаговых частицах, является сигнальная последовательность, индуцирующая транслокацию ТrхА через цитоплазматическую мембрану грамотрицательных бактерий.
Многие широко применяемые сигнальные последовательности, например, в белках PhoA (база Swiss-Prot, номер в каталоге Р00634) и МаlЕ (база Swiss-Prot, номер в каталоге Р02928), неэффективно активируют транслокацию ТrхА через цитоплазматическую мембрану (Schierle и др., см. ссылку выше). Напротив, сигнальная последовательность DsbA индуцирует эффективную транслокацию ТrхА. Субклеточное фракционирование клеток хозяина, экспрессирующих ТrхА, гибридизированный с исследуемой сигнальной последовательностью, позволяет различить те сигнальные последовательности, которые могут индуцировать транслокацию ТrхА через цитоплазматическую мембрану в периплазму, от сигнальных последовательностей, не обладающих такими свойствами (Huber и др., см. ссылку выше). Количество ТrхА во фракциях периплазмы свидетельствует об эффективности сигнальной последовательности, направленной на индукцию транслокации ТrхА. В другом варианте могут применяться сигнальные последовательности, о которых уже известно, что они индуцируют транслокацию ТrхА, например, сигнальную последовательность DsbA.
В предпочтительном варианте осуществления настоящего изобретения сигнальной последовательностью слитого полипептида, включающего ИП, предназначенный для проявления на фаговых частицах, является сигнальная последовательность, выбранная из группы, состоящей из TorT, SfmC, FocC, CcmH, YraI, TolB, NikA, FlgI и DsbA, а также их гомологов.
В особенно предпочтительном варианте осуществления настоящего изобретения сигнальной последовательностью слитого полипептида, включающего ИП, предназначенный для проявления на фаговых частицах, является сигнальная последовательность, выбранная из группы, состоящей из TorT, SfmC, TolB и DsbA.
В контексте настоящего изобретения понятие «гомолог» сигнальной последовательности означает аминокислотную последовательность с 70%, предпочтительно 80%, особенно 90% или более идентичностью с какой-либо из сигнальных последовательностей, указанных выше, которая сохраняет общий заряд, гидрофобность и способность расщеплять n-области, h-области и с-области сигнальной последовательности соответственно. Примерами таких гомологов являются аминокислотные последовательности, в которых одна, две, три или четыре, особенно одна или две, аминокислоты замещены на другие аминокислоты, в которых одна, две, три или четыре аминокислоты делегированы, или одна или две аминокислоты добавлены, или имеются комбинации замен, делений и добавлений, указанных выше. В заменах аминокислот неполярные аминокислоты предпочтительно замещены другими неполярными аминокислотами, например, Ile замещен на Leu, Val, Ala, Trp, Phe или Met, или, наоборот, полярные аминокислоты замещены на другие полярные аминокислоты, например, Thr замещен на Ser, Asn или Gln, или, наоборот, отрицательно заряженные аминокислоты на другие отрицательно заряженные аминокислоты, например, Asp замещен на Glu, или наоборот, или положительно заряженные аминокислоты замещены на другие положительно заряженные аминокислоты, например, Lys замещен на Arg или His или наоборот.
Например, в предпочтительной сигнальной последовательности DsbA с аминокислотами MKKIWLALAG LVLAFSASA (SEQ ID NO:1) возможна замена аминокислот Lys2 на Arg, Ala9 на Leu, Ala14 на Val и Ser16 на Thr.
Известно, что сигнальные последовательности TorT, SfmC, FocC, CcmH, YraI, TolB, NikA, FigI и DsbA индуцируют котрансляционную транслокацию белка ТrхА нацеливанием на метаболический путь SRP и в большинстве случаев обладает повышенной общей гидрофобностью по сравнению с сигнальными последовательностями, нацеленными на метаболический путь Sec (Huber и др., см. ссылку выше). Белки имеют следующие номера в каталоге базы Swiss-Prot: TorT Р38683, SfmC P77249, FocC P62609, CcmH P33925, YraI P42914, TolB Р0А855, NikA P33590, F1gI P0A6S3 и DsbA P24991.
Определение только одной гидрофобности не позволяет выявлять SRP-зависимые и не SRP-зависимые сигнальные последовательности в диапазоне высокой гидрофобности (Huber и др., см. ссылку выше). Таким образом, помимо гидрофобности другие свойства (например, структура сигнального пептида) влияют на предпочтительность одного из путей транслокации.
В особенно предпочтительном варианте осуществления настоящего изобретения сигнальной последовательностью является сигнальная последовательность DsbA или какая-либо аминокислотная последовательность, обладающая 90% идентичность с сигнальной последовательностью DsbA.
В настоящем способе применим какой-либо из методов проявления с применением нитчатых фагов, например, фагов f1, M13, fd и Ike, особенно f1, М13 и fd.
В частности, способ настоящего изобретения включает стадии:
(а) конструирования вектора в виде нитчатого фага или фагмиды, содержащего экспрессирующую кассету для слитого полипептида, имеющего N-концевую сигнальную последовательность, индуцирующую котрансляционную транслокацию слитого полипептида через цитоплазматическую мембрану грамотрицательных бактерий;
(б) конструирования комбинаторной библиотеки фаговых или фагмидных векторов путем клонирования библиотеки ДНК, кодирующей исследуемые полипептиды в экспрессирующей кассете вектора стадии (а);
(в) трансформации соответствующих грамотрицательных бактерий библиотекой векторов стадии (б) и
(г) осуществления циклов отбора методом фагового дисплея для разделения фаговых частиц на основании свойств проявленных исследуемых белков.
На стадии (а) векторы в виде нитчатых фагов или фагмид конструируют, используя обычные методы генной технологии. Например, сигнальная последовательность, кодирующая часть экспрессируемой кассеты для слитого полипептида установленного фагового или фагмидного вектора, замещается кодирующей последовательностью указанной сигнальной последовательности, при использовании стандартных методов работы с ДНК. В другом варианте новый фаговый или фагмидный вектор, содержащий экспрессирующую кассету для слитого полипептида, содержащего указанную сигнальную последовательность, конструируют заново, используя общие знания о композиции таких векторов (например, Russel и др., см. ссылку выше) и стандартные методы синтеза и сборки ДНК. Фаговыми или фагмидными векторами для этой цели, например, являются pAK100, рСоmb3, pEXmide3, pHEN1, pJuFo или pSEX. Пример такого фагмидного вектора (pDST23) описан на фиг.3 и в прилагаемом примере в качестве иллюстрации настоящего изобретения, но не ограничивать настоящее изобретение этим конкретным примером его осуществления.
Предпочтительно сигнальная последовательность слитого полипептида на стадии (а) индуцирует транслокацию слитого полипептида по метаболическому пути SRP.
Более предпочтительно сигнальная последовательность слитого полипептида на стадии (а) индуцирует котрансляционную транслокацию ТrхА.
На стадии (б) применяют стандартные методы получения комбинаторных библиотек векторов. Например, библиотеки комбинаторных ДНК, кодирующих исследуемые белки, получают ненаправленным или направленным мутагенезом, тасованием ДНК, получением кДНК путем амплификации клеточных иРНК или обычным конструированием и затем лигированием в состав экспрессирующей кассеты указанного вектора стандартными методами ДНК.
На стадии (в) применяют стандартные методы трансформации грамотрицательных бактерий. Например, бактерии трансформируют библиотекой комбинаторных векторов стадии (б) методом электропортации или химическими средствами. Такие методы хорошо известны специалистам в данной области.
На стадии (г) проводят стандартные циклы отбора методом фагового дисплея. Такие циклы отбора методом фагового дисплея хорошо известны специалистам в данной области (например, Russel и др., см. ссылку выше).
Предпочтительно свойством проявленного дисплеем исследуемого полипептида на стадии (г) является специфическое связывание с целевой исследуемой молекулой. В этом случае фаговые частицы, проявляющие связывание ИП с целевой молекулой, отделяют от фаговых частиц, на которых выявлены посторонние полипептиды, путем применения амплифицированных фаговых частиц на каждом цикле отбора по целевой молекуле, функционально иммобилизированной на поверхности, отмывая несвязанные фаговые частицы, элюируя связанные фаговые частицы и используя элюированные фаговые частицы в качестве ввода для амплификации фаговых частиц следующего цикла отбора.
Очевидно, что каждый раз в контексте настоящего изобретения понятия «сигнальная последовательность» или «конкретная сигнальная последовательность» означают одну или несколько, например, одну, две, три или четыре сигнальные последовательности другой композиции. Использование более одной сигнальной последовательности может обладать преимуществом для конкретных применений, что также входит в рамки настоящего изобретения.
Настоящее изобретение также относится к фагу или фагмидному вектору, включающему генную конструкцию, кодирующую слитый полипептид, который содержит ИП, гибридизированный с N-концом сигнальной последовательности, индуцирующей котрансляционную транслокацию ТrхА, в частности, сигнальную последовательность, выбранную из группы, состоящей из сигнальных последовательностей белков TorT, SfmC, FocC, CcmH, YraI, TolB, NikA FlgI, DsbA и их гомологов, предпочтительно выбранных из TorT, SfmC, TolB и DsbA. Наиболее предпочтительным является фаговый или фагмидный вектор, включающий сигнальную последовательность DsbA или ее гомолог.
Предпочтительный слитый полипептид включает ИП, гибридизированный с белком оболочки фага рIII или pVIII или фрагментом белка оболочки pIII. Таким фрагментом является, например, фрагмент, включающий аминокислоты с 250 по 406 белка pIII.
Сигнальная последовательность периплазматического фермента DsbA направляет слитые репортерные белки по метаболическому пути SRP и, таким образом, повышает их котрансляционный экспорт. Это свидетельствует о том, что относительно гидрофобный сигнальный пептид DsbA взаимодействует с SRP и индуцирует котрансляционную транслокацию DsbA. Таким образом, сигнальная последовательность фермента DsbA может использоваться в качестве генерической сигнальной последовательности для других белков, что описано ниже в примере. Кроме того, могут быть применены гомологи сигнальной последовательности фермента DsbA и сигнальные последовательности ТоrТ, SfmC, FocC, CcmH, YraI, TolB, NikA, FlgI и их гомологов.
Способ настоящего изобретения наиболее пригоден для применения с библиотеками соединений, например, библиотек ДНК, особенно библиотек кДНК. В отличие от способов, применимых до настоящего времени для фагового дисплея, способ настоящего изобретения позволяет надежно осуществлять презентацию полипептидов, получаемых в результате экспрессии таких библиотек.
В предпочтительном варианте осуществления настоящего изобретения описан способ проявления на основе нитчатых фагов, в котором исследуемые полипептиды (ИП), кодируемые библиотекой ДНК, проявляются на фаговых частицах. Предпочтительно котрансляционная транслокация ИП, кодируемых библиотекой ДНК, проводится на основе метаболического пути частиц распознавания сигнала, например, сигнальной последовательности, индуцирующей котрансляционную транслокацию ТrхА. Наиболее предпочтительным является способ, описанный в настоящем изобретении для фагового дисплея повторяющихся белков.
Подобно каким-либо другим технологиям отбора, успех отбора фаговым дисплеем строго зависит от разнообразия представителей библиотек, подвергнутых проявлению. Крупная комбинаторная библиотека ДНК сама по себе не является гарантией того, что большое разнообразие представителей библиотек может быть презентировано методом проявления. При фаговом дисплее подвергаемые проявлению полипептиды должны быть транслоцированы через цитоплазматическую мембрану до их включения в фаговые частицы. Все современные способы проявления с применением нитчатых фагов используют посттрансляционный метаболический путь для транслокации гибридных полипептидов через цитоплазматическую мембрану (Russel и др., см. ссылку выше, Paschke и др., см. ссылку выше). Таким образом, представители библиотеки, несовместимые с этими метаболическими путями, будут отклонены, что приводит к очевидному снижению разнообразия библиотеки, поддающегося проявлению.
Рассматриваемые библиотеки ДНК являются разнообразными библиотеками комбинаторных ДНК, в том числе библиотеки, полученные случайным или сайт-направленным мутагенезом, перетасовкой ДНК или продуманным конструированием. Такие способы могут привести к возникновению библиотек с новыми свойствами, например связывающими свойствами, причем некоторые из них могут быть несовместимы с транслокацией, используя метаболический путь Sec. Такие библиотеки включают библиотеки ДНК, которые кодируют пептидные библиотеки, библиотеки антител или библиотеки, основанные на иной основе (Russel и др., см. ссылку выше, Nygren P.А. и Skerra A., J. Immunol. Methods, 290, 2004, 3-28).
Другие рассмотренные библиотеки ДНК являются библиотеками кДНК, особенно эукариотического происхождения. Библиотеки кДНК кодируют огромное разнообразие природных клеточных белков, в том числе цитоплазматических белков, мембранных белков и внеклеточных белков. Некоторые из этих представителей естественно существующих библиотек могут быть несовместимы с транслокацией по метаболическому пути Sec.
Другими рассмотренными библиотеками ДНК являются библиотеки, кодирующие одноцепочечные Fv-антитела (single-chain Fv - scFv), которые применяют для отбора фрагментов scFv, действующих внутри клетки (интрател). Необходимое условие для интрател заключается в том, что они хорошо уложены и стабильны в цитоплазме Е.coli. Таким образом, стабильные в цитоплазме и хорошо уложенные интратела являются неэффективно транслонированными по посттрансляционному механизму метаболического пути Sec.
Другими рассмотренными библиотеками ДНК являются те библиотеки, которые кодируют библиотеки на другой основе, а именно на повторяющихся белках, включая анкирин-повторяющие белки, белки, обогащенные лейцином, тетратрикопептид-повторяющие белки, пентатрикопептид-повторяющие белки или армадилло/белок теплового шока - повторяющие белки.
Предпочтительной библиотекой является библиотека ДНК, кодирующая созданные анкирин-повторяющие белки (белки DARP) (Binz И.К. и др., Nat. Biotechnol., 22, 2004, cc.575-582). В примере приведены белки DARP, представленные в результате проявления на фаговых частицах.
Настоящее изобретение также относится к фагам, полученным способом настоящего изобретения.
Настоящее изобретение также относится к периплазматической экспрессии очень быстро укладывающихся и стабильных в цитоплазме белков, в частности, к периплазматической экспрессии белков DARP. Белки DsbAss и белки DARP, кодируемые фагмидами из примеров, могут непосредственно применяться для эффективной периплазматической экспрессии белков DARP в несупрессированных клетках Е.coli. В другом варианте векторы стандартной периплазматической экспрессии могут быть адаптированы путем замены ДНК, кодирующей сигнальную последовательность, применяемую для периплазматической экспрессии, на ДНК, кодирующую сигнальную последовательность настоящего изобретения, особенно на ДНК, кодирующую DsbAss. Например, эффективная периплазматическая экспрессия белков DARP является инструментом для экспрессии белков DARP, гибридизированных с эффекторными белками, в частности, токсинами или цитокинами, которые очень трудно экспрессировать в цитоплазме.
Новый способ фагового дисплея, описанный в настоящем изобретении ниже, позволяет эффективно включать очень широкий диапазон исследуемых полипептидов (ИП), подвергаемых проявлению, в фаговые частицы и, таким образом, позволяет эффективно осуществлять фаговый дисплей. Принципиальное отличие данного нового способа от традиционных методов фагового дисплея заключается в применении сигнальных последовательностей, направляющих слитый полипептид, содержащий ИП для проявления, по котрансляционному метаболическому пути SRP (фиг.2, (1)-(2)). Таким образом, ИП, подвергаемые проявлению, эффективно транслоцируются через цитоплазматическую мембрану в периплазму, в результате чего происходит эффективное включение ИП в фаговые частицы. К предпочтительным слитым белкам также относится один из белков оболочки нитчатого фага или усеченные варианты белков оболочки. В этом случае исследуемый белок закреплен на цитоплазматической мембране за счет гидрофобного удлинения белка оболочки фага после транслокации (фиг.1) и перед включением в фаговую частицу.
Примером сигнальной последовательности, нацеленной на метаболический путь SRP, является сигнальная последовательность белка DsbA E.coli (signal sequence DsbA - DsbAss). Все другие элементы приведенных в качестве примеров фагмид pDST являются производными классических фагмид, например, серий рАК.100, которые несут сигнальные последовательности белка PelB (PelBss) или PhoA (PhoAss), направляющие исследуемые полипептиды, подвергаемые проявлению, по посттрансляционному метаболическому пути Sec (фиг.2, (3)-(4)-(5)).
В одной из серий экспериментов продуктивность применения способа проявления сравнивали в зависимости от того, использовали ли фаговые частицы, полученные от фагмид pDST, кодирующих PhoAss, или от фагмид pDST, кодирующих DsbAss. Фаговые частицы получали по стандартным протоколам, описанным ниже, и очищали центрифугированием в градиенте CsCl. Вестерн блоттинг показал, что для проявления одноцепочечного антитела Fv фаговые частицы, полученные от фагмиды pDST, имеют примерно одинаковые по продуктивности результаты от применения проявления ИП, вне зависимости от того, какая сигнальная последовательность была применена (фиг.4А, scFv).
Наблюдают четкое различие, выражающееся в том, что для всех четырех исследованных белков DARP проявление может быть эффективным только в том случае, если используют фагмиды pDST, содержащие DsbAss, и проявление белков практически не фиксируют при использовании фагмид pDST, содержащих PhoAss (фиг.4А, белки DARP). Сходным образом применение фагмид pDST, содержащих DsbAss, приводит к значительно более высокой продуктивности проявление для полипептидов GCN4 (фиг.4А), белка D головки фага лямбда, ТrхА и АРН (фиг.4Б). Продуктивность фагового дисплея лишь ненамного выше для полимеразы Taq, фосфатазы фага лямбды (λРР), а в случае c-jun N-концевой киназы 2 (JNK2, фиг.4Б) проявления белка не обнаружено. Это показывает, что продуктивность проявления на фаговых частицах при использовании фагмид pDST, содержащих DsbAss, по меньшей мере, сопоставима с продуктивностью проявления с использованием классических фагмид с PhoAss, но продуктивность проявления резко повышается при осуществлении проявления белков DARP и других быстро укладывающихся и термодинамически стабильных белков.
Для количественной оценки этого различия фаговые частицы использовали в экспериментах ELISA. Фаговые частицы для проявления DARPins, специфически связывающие белки АРН и JNK2, сопоставляли после получения либо с фагмид pDST, содержащих DsbAss, либо с фагмид pDST, содержащих PhoAss. С помощью выявления связанных фаговых частиц путем подсчета с анти-М13 антителом показано, что продуктивность фагового дисплея возрастает более чем в 100 раз (фиг.5).
Для того чтобы показать, что повышенная продуктивность проявления, полученная с применением белков DARP, также способствует отбору, две исследуемые смеси, содержащие три разных типа фаговых частиц, полученных из фагмид, кодирующих либо DsbAss, либо PhoAss, были смешаны в различных разведениях. Для обеих исследуемых смесей фаговые частицы с проявлением белков DARP, специфически связывающих белки АРН и JNK2, закапывают в разведении 1:107 в фаговые частицы, на которых в результате проявления представлены неотобранные белки DARP Е3_5 и Е3_19. Эти две исследуемые смеси используют в качестве вводных библиотек для стандартных процедур отбора методом фагового дисплея на белки-мишени АРН и JNK2 (табл.2). Несмотря на то, что АРН и JNK2 специфические фаговые частицы могут быть обогащены в исследуемых смесях, полученных от DsbAss-кодирующих фагмид, примерно 1000-кратно на цикл отбора (уже более 10% тестированных клонов было специфично по отношению к своей мишени после всего лишь двух циклов отбора), обогащения из исследуемой библиотеки, полученной от PhoAss-содержащих фагмид, не наблюдают даже после пяти циклов отбора (не наблюдают специфических клонов).
В других сериях экспериментов продуктивность проявления оценивали методом ELISA между фаговыми частицами, полученными от фагмид pDST, кодирующих сигнальные последовательности PhoAss, PelBss, DsbAss, TorTss, TolBss или SfmCss. Фаговые частицы с проявлением белков DARP, специфически связывающие белки АРН и JNK2, сравнивали после получения от отдельных фагмид pDST. Основываясь на выявлении связанных фаговых частиц, подсчитанных с анти-М13 антителом, повышенную продуктивность вплоть до 700-кратной величины, наблюдали с SRP-зависимыми сигнальными последовательностями (DsbAss, TorTss, TolBss или SfmCss) по сравнению с Sec-зависимой сигнальной последовательностью PhoAss (фиг.6).

Пример
Материалы
Химические реактивы получают от фирмы Fluka (Швейцария). Олигонуклеотиды получают от фирмы Microsynth (Швейцария). Vent ДНК-полимераза, ферменты рестрикции и буферы получают от фирмы New England Biolabs (США) или фирмы Fermentas (Литва). Фаг-помощник VCS M13 получают от фирмы Stratagene (США). Клонирование и амплифицирование фага проводят в Е.coli XL1-Blue фирмы Stratagene (США).
Молекулярная биология
Если не указано иначе, все методы молекулярной биологии осуществляют по известным протоколам (в кн.: «Current Protocols in Molecular Biology», 1999, под ред. Ausubel F.M. и др., Нью-Йорк, изд-во John Wiley and Sons). Краткое содержание протоколов приводят ниже.
Методы, связанные с фаговым дисплеем
Если не указано иначе, все методы, связанные с фаговым дисплеем, осуществляют по известным протоколам (в кн.: «Phage Display A Practical Approach», 2004, под ред. Clackson Т., Lowman H.B, Нью-Йорк, изд-во Oxford University Press, в кн.: «Phage Display: A Laboratory Manual», 2001, под ред. Barbas III, C.F., Burton, D.R., Scott, J.K., изд-во Cold Spring Harbor Laboratory Press). Краткое описание протоколов приводят ниже.
Клонирование
Производное фагмиды рАK100 (Krebber А. и др., J. Immunol. Methods 201, 1997, cc.35-55), кодирующей DARPin 3а, является стартовой точкой для клонирования первой фагмиды настоящего исследования, называемой pDST23.
Для замены сигнальной последовательности производного рАК100 конструируют олигонуклеотиды oDST4 (SEQ ID NO:5), oDST5 (SEQ ID NO:6), oDST6 (SEQ ID NO:7) и oDST8 (SEQ ID NO:8). Эти четыре олигонуклеотида кодируют сигнальную последовательность Е.coli DsbA. Белок Е.coli DsbA присутствует в базе данных Swiss-Prot (инвентарный номер Р24991). Его сигнальной последовательностью является MKKIWLALAG LVLAFSASA (SEQ ID NO:1). Проводят отжиг и амплификацию олигонуклеотидов oDST4, oDST5, oDST6 и oDST8 с олигонуклеотидами oDST6 и oDST8 методом ПЦР. Образуемый фрагмент ДНК кодирует сигнальную последовательность DsbA и фланкирован сайтами эндонуклеаз рестрикции ХbаI и ВаmHI. Этот фрагмент ДНК разрушают рестриктазами XbaI и ВаmHI, затем лигируют в сходным образом обработанное и дефосфорилированное производное рАK100. Получаемую фагмиду pDST23 (фиг.3) выделяют и точную последовательность выверяют секвинированием ДНК.
Для прямого экспериментального сравнения фагмид, кодирующих сигнальную последовательность PhoA (SEQ ID NO:9), получают вторую фагмиду, называемую pDST22. Четыре нуклеотида - называемые oDST4p (SEQ ID NO:10), oDST5p (SEQ ID NO:11), oDST6 (SEQ ID NO:7) и oDST8p (SEQ ID NO:12), отжигают и амплифицируют с oDST6 и oDST8p методом ПЦР. Получаемый фрагмент ДНК кодирует сигнальную последовательность PhoA и фланкирован сайтами эндонуклеаз рестрикции ХbаI и ВаmHI. Этот фрагмент разрушают рестриктазами ХbаI и ВаmHI и лигируют в сходным образом обработанную и дефосфорилированную фагмиду pDST23. Получаемую фагмиду pDST22 выделяют и точную последовательность выверяют секвинированием ДНК.
Другие фагмиды, применяемые в настоящем изобретении и перечисленные в табл.1, были получены следующим образом. Кодирующие последовательности исследуемых белков амплифицируют с применением ПЦР, используя соответствующие сконструированные ПЦР-праймеры и матрицу ДНК, например, приготовленные кДНК или доступные плазмидные ДНК. В результате либо в ВаmHI, либо в BglII сайты рестрикции интродуцируют 5-затравку к каждой из кодирующих последовательностей и в два сайта рестрикции (EcoRI и PstI) интродуцируют 3-затравку каждой из кодирующих последовательностей. Эти ПЦР-фрагменты были расщеплены рестриктазами либо BamHI или BglII, либо EcoRI или PstI и затем лигированы в сходным образом обработанные и дефосфорилированные фагмиды pDST23 или pDST22. Открытую рамку считывания экспрессирующей кассеты для слитого полипептида, включающего продукт клонирования ПЦР, поддерживают для всех конструкций, особенно поддерживают правильную рамку считывания для С-концевого гибрида С-концевого домена фагового белка III (СТр3). Первая и последняя аминокислоты клонированных исследуемых белков приведены в табл.1 вместе с номером ссылки или номером в каталоге баз данных GenBank или Swiss-Prot. Точная последовательность всех фагмид выверяется сиквенсом ДНК.
Для разработанных анкириновых белков (designed ankyrin proteins - DARP) 3а и 2_3, фагмиды, кодирующие PelBss (pDST80 и pDST81 соответственно), SfmCss (pDST86 и pDST87 соответственно), TolBss (pDST84 и pDST85 соответственно) и TorTss (pDST88 и pDST89 соответственно) были получены с применением той же стратегии клонирования, которая описана выше для DsbAss и PhoAss.
Получение и очистка фага
5 мл 2xYT среды, содержащей 1% глюкозы, 34 мкг/мл хлорамфеникола (cam) и 15 мкг/мл тетрациклина (tet), инокулируют единичной колонией штамма Е.coli XL-1 Blue, несущего исследуемую фагмиду, и клетки выращивают ночь при 30°С при перемешивании. 5 мл свежей среды 2xYT, содержащей 1% глюкозы, 34 мкг/мл хлорамфеникола (cam) и 15 мкг/мл тетрациклина (tet), инокулируют выращенной в течение ночи культурой в соотношении 1:100 (ОП600≈0,04) и выращивают при 37°С до ОП600 0,5 при встряхивании. Культуры инфицируют хелперным фагом VCS M13 в количестве 4×1010 БОЕ (бляшки образующие единицы) в мл (кратность инфицирования ~20) и клетки инкубируют 30 мин при 37°С без перемешивания и затем 30 мин при 37°С в условиях перемешивания. Среду заменяют путем сбора клеток центрифугированием (3500 g, 24°C, 10 мин) и ресуспендированием пеллет в 50 мл 2xYT среды, содержащей 34 мкг/мл cam, 50 мкг/мл канамицина и 0,1 мМ изопропил-β-D-тиогалактозида (ИПТГ). После роста в течение 14-16 ч при 30°С при встряхивании клетки удаляют центрифугированием (5600 g, 4°С, 10 мин).
Супернатант инкубируют на льду в течение 1 ч в 1/4 объема ледяного раствора PEG/NaCl (20% полиэтиленгликоля 6000, 2,5 М NaCl). Осажденные фаговые частицы собирают центрифугированием (5600 g, 4°С, 15 мин) и переносят в 1 мл TBS150 (25 мМ Tris/HCl, 150 мМ NaCl, pH 7,5). Дальнейшую очистку фаговых частиц проводят центрифугированием в градиенте CsCl следующим образом. После внесения 1,6 г CsCl объем доводят TBS150 до 4 мл. Раствор CsCl переносят в пробирку из полиалломера размером 1/2×11/2 дюйма (фирма Beckmann, США, No 358980) и центрифугируют при 100000 об/мин в течение 4 ч в роторе TLN-100 (фирма Beckman Instruments) при 4°С. После центрифугирования полосу фага выделяют. Фаги переносят в пробирки из поликарбоната размером 1/2×2 дюйма (фирма Beckmann, США, No 349622), которые наполняют TBS150 до объема 3 мл. После центрифугирования при 50000 об/мин в течение 1 ч в роторе TLA-100.3 при 4°С, осадок фага суспендируют в 3 мл TBS. После дополнительного центрифугирования при 50000 об/мин в течение 1 ч в роторе TLA-100.3 при 4°С фаги суспендируют в 1 мл TBS. Общую концентрацию фаговых частиц подсчитывают спектрофотометрически. Титр инфицирования образцов фага определяют титрованием в клетках Е.coli XL-1 Blue, используя агаровую среду 2xYT, содержащую 1% глюкозы и 34 мкг/мл хлорамфеникола. Колонии подсчитывают после инкубирования в течение ночи при 37°С.
Блоттинг фага
5×1011 фаговых частиц, очищенных в градиенте CsCl, применяют для натрий додецилсульфат полиакриламидного гель-электрофореза (SDS-PAGE) в условиях восстановления и переносят на мембрану поливинилиденфторида (ПВДФ) Immobilon-P Transfer Membrane (фирма Millipore, США) электроблоттингом. Мембрану блокируют MTTBS150 (TBS150, 0,1% Tween 20, 5% снятое молоко) в течение 1 ч при комнатной температуре (КТ) и инкубируют с мышиным анти-рIII антителом (фирма MoBiTec, Германия, No. PSKAN3) (1:1000 в MTTBS150, 20 мин при КТ) в качестве первичного антитела, которое распознает С-концевой домен рIII. Конъюгат F(ab')2 фрагмента козьего антитела IgG мыши и пероксидазы хрена (фирма Pierce, США, No. 31438) (1:10000 в MTTBS150, 1 ч при КТ) используют в качестве вторичного антитела. Белки определяют с помощью субстрата ChemiGlow West (фирма Alpha Innotech, США).
Во втором эксперименте блокированную мембрану инкубируют с мышиным анти -FLAG M1 антителом (фирма Sigma, США, No. F3040) (1:5000 в MTTBS150, 1 ч при КТ) в качестве первичного антитела. Конъюгат козьего антимышиного IgG и щелочной фосфатазы (фирма Sigma, США No. A3562) (1:10000 в MTTBS150, 1 ч при КТ) используют в качестве вторичного антитела. Белки выявляют с помощью субстратов 5-бром-4-хлор-3-индолилфосфата (BCIP) и нитросинего тетразолия (nitro blue tetrazolium - NBT) (фирма Fluka, Швейцария).
Исследование фага методом фермент-связанного иммуносорбентного анализа (ELISA)
Метод ELISA для исследования фага проводят для оценки количества функционально представленных методом проявления белков DARP на частицах фага М13. Биотинилированные белки АРН и JNK2 (Binz и др., см. ссылку выше) иммобилизуют следующим образом: нейтравидин (66 нмолей, 100 мкл/лунку, фирма Socochim, Швейцария) в TBS150 иммобилизуют в планшетках MaxiSorp (фирма Nunc, Дания, No. 442404), инкубируя в течение ночи при 4°С. Лунки блокируют в 300 мкл буфера BTTBS150 (TBS150, 0,1% Tween 20, 1% БСА) в течение 1 ч при комнатной температуре. Связывание биотинилированных белков АРН и JNK2 (100 мкл, 1 мкмоль) в BTTBS150 проводят в течение 1 при 4°С.
Серии разведений фаговых частиц в буфере BTTBS150 вносят в лунки и инкубируют при комнатной температуре в течение 2 ч. После промывки лунок, выполненной пять раз 300 мкл буфера TTBS150 (TBS150, 0,1% Tween 20) в течение 5 мин, связанные фаговые частицы выявляют с помощью конъюгата анти-М13 пероксидазы хрена (фирма Amersham Pharmacia Biotech, Великобритания, No. 27-9421-01) и растворимого субстрата ВМ Blue POD (фирма Roche Diagnostics, Германия, No. 1484281).
Пэннинг фага
Подвергшиеся проявлению фаговые частицы Е3_5, Е3_19, 3а и 2_3 получают либо с применением фагмид, кодирующих сигнальную последовательность PhoA (pDST30, pDST65, pDST22, pDST34), либо фагмид, кодирующих сигнальную последовательность DsbA (pDST32, pDST66, pDST23, pDST37), соответственно. Такие фаговые частицы применяют для получения смесей фаговых частиц, полученных от фагмид, кодирующих либо PhoAss, либо DsbAss. К смеси в пропорции 1:1 фаговых частиц, на которых в результате проявления расположены несвязывающие белки DARP Е3_5 и Е3_19, вносят в разведении 1:107 фаговые частицы, на которых в результате проявления расположены мишень-специфичные белки DARP 3а или 2_3.
Биотинилированные белки АРН и JNK2 наносят согласно описанному методу ELISA для фагов. В каждую лунку с 0,1 мл смесей фаговых частиц (1013 КОЕ/мл) вносят по 0,1 мл буфера BTTBS150 и инкубируют в течение 2 ч. После промывания буфером TTBS150 (3 раза для первого цикла отбора, 4 раза для второго цикла и 5 раз для дополнительных циклов) и буфером TBS150 (3 раза для первого цикла отбора, 4 раза для второго цикла и 5 раз для дополнительных циклов) фаговые частицы элюируют путем инкубирования в течение 15 мин с 0,2 мл элюирующего буфера (0,2 М глицин/HCl, рН 2,2) примерно при 22°C с последующей элюцией в течение 30 мин 0,2 мл трипсина (10 мг/мл в TBS150) при 37°С. Объединенные элюаты (нейтрализованные 10 мкл 2М Tris-основания) используют для инфекции 4 мл экспоненциально растущей культуры Е.coli XL1-Blue. Через 30 мин при 37°C без перемешивания и 30 мин при 37°C с перемешиванием клетки высевают на чашки с агаровой средой 2xYT, содержащей 1% глюкозы, 34 мкг/мл хлорамфеникола и 15 мкг/мл тетрациклина и культивируют в течение ночи при 37°С. Клетки смывают с чашек средой 2xYT, содержащей 1% глюкозы, 15% глицерина, 34 мкг/мл хлорамфеникола и 15 мкг/мл тетрациклина и используют для получения фага для следующего цикла пэннинга. После каждого цикла пэннинга определяют идентичность 9-16 элюированных фаговых частиц. Для этого инфицируют этими фаговыми частицами Е.coli и проводят скрининг колоний методом ПЦР с клон-специфическими праймерами.






Изобретение касается способа проявления с применением нитчатого фага, а также к фаговым или фагмидным векторам и библиотекам таких векторов, применяемым в способе. Способ заключается в конструировании вектора в виде нитчатого фага или фагмиды, содержащего экспрессирующую кассету для слитого полипептида, имеющего концевую сигнальную последовательность, выбранную из группы сигнальных последовательностей TorT, SfmC, TolB и DsbA. Далее конструируют комбинаторную библиотеку фаговых или фагмидных векторов путем клонирования библиотеки ДНК, кодирующей исследуемые полипептиды в экспрессирующей кассете полученного на предыдущей стадии вектора, трансформируют такой библиотекой соответствующие грамотрицательные бактерии и осуществляют цикл отбора способом фагового дисплея. Этот способ позволяет проявлять полипептиды, о которых известно, что они плохо поддаются проявлению на фагах, а также для белков библиотек кДНК и других комбинаторных библиотек, особенно тех, которые образуются в результате очень быстрой укладки, стабильной поддержки белка. 3 н. и 2 з.п. ф-лы, 6 ил., 3 табл.
1. Способ проявления полипептидов с применением нитчатого фага, в котором исследуемые полипептиды, кодируемые библиотекой ДНК, проявляют на фаговых частицах, включающий стадии:
(а) конструирования вектора в виде нитчатого фага или фагмиды, содержащего экспрессирующую кассету для слитого полипептида, имеющего N-концевую сигнальную последовательность, выбранную из группы сигнальных последовательностей ТоrТ, SfmC, TolB и DsbA,
(б) констуирования комбинаторной библиотеки фаговых или фагмидных векторов путем клонирования библиотеки ДНК, кодирующей исследуемые полипептиды в экспрессирующей кассете вектора стадии (а); где указанная библиотека ДНК является библиотекой кДНК или библиотекой комбинаторных ДНК, которые кодируют пептидные библиотеки, библиотеки антител или библиотеки, основанные на иной основе,
(в) трансформации соответствующих грамотрицательных бактерий библиотекой векторов стадии (б) и
(г) осуществления циклов отбора способом фагового дисплея для разделения фаговых частиц на основании свойств проявленных исследуемых белков.
2. Способ по п.1, в котором исследуемые полипептиды, подвергаемые проявлению на фаговых частицах, являются повторяющимися белками.
3. Фаговый или фагмидный вектор для применения в способе по п.1, включающий генную конструкцию, кодирующую слитый белок, включающий исследуемый полипептид, подвергаемый проявлению на фаговых частицах, и сигнальную последовательность, выбранную из группы, включающей сигнальные последовательности TorT, SfmC, TolB и DsbA.
4. Библиотека фаговых или фагмидных векторов для применения в способе по п.1, включающих генные конструкции, кодирующие слитые белки, причем каждый из белков включает сигнальную последовательность, выбранную из группы, включающей сигнальные последовательности TorT, SfmC, TolB и DsbA и исследуемый полипептид, подвергаемый проявлению на фаговых частицах, причем каждый исследуемый полипептид кодируется представителем библиотеки ДНК, причем указанная библиотека ДНК является библиотекой кДНК или библиотекой комбинаторных ДНК, которые кодируют пептидные библиотеки, библиотеки антител или библиотеки, основанные на иной основе.
5. Библиотека векторов по п.4, в которой библиотека ДНК, кодирующая исследуемые полипептиды, является библиотекой ДНК, кодирующей повторяющиеся белки.
| ROSANDER A et al | |||
| Identification of extracytoplasmic proteins in Bradyrhizobiumjaponicum using phage display, Mol Plant Microbe Interact, 2003 Aug., Vol.16, No 8, p.727-737 | |||
| WALL Т et al | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
| RU 2008104610 A, 20.08.2009. | |||
Авторы
Даты
2011-02-20—Публикация
2006-06-30—Подача