ДАННЫЕ О ПРИОРИТЕТЕ
Настоящая заявка испрашивает преимущество в соответствии с §119 35 U.S.C. на основании индийской предварительной заявки, поданной 24 Марта 2006 и имеющей название «ПО СУЩЕСТВУ ЧИСТЫЙ ГИДРОХЛОРИД ЛЕРКАНИДИПИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ», и на основании индийской предварительной заявки No. 75/MUM/2006, поданной 17 января 2006 и имеющей название «ПОЛИМОРФНАЯ ФОРМА V ГИДРОХЛОРИДА ЛЕРКАНИДИПИНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ», и на основании американской предварительной заявки No. 60/751834, поданной 20 декабря 2005 и имеющей название «ПОЛИМОРФНАЯ ФОРМА V ГИДРОХЛОРИДА ЛЕРКАНИДИПИНА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ», и на основании индийской предварительной заявки No. 1125/MUM/2005, поданной 16 сентября 2005 и имеющей название «НОВЫЕ ПОЛИМОРФНЫЕ ФОРМЫ ГИДРОХЛОРИДА ЛЕРКАНИДИПИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ», содержание каждой из которых включено в описание настоящей заявки посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
1. Область техники, к которой относится изобретение
Настоящее изобретение в целом относится к новому полиморфу гидрохлорида лерканидипина и способам его получения. Настоящее изобретение также в целом относится к способу получения гидрохлорида аморфной формы лерканидипина и способу очистки гидрохлорида лерканидипина.
2. Описание предшествующего уровня техники
Гидрохлорид лерканидипина, также известный, как гидрохлорид 2-[(3,3-дифенилпропил)метиламино]-1,1-диметилэтилметилового эфира 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридинкарбоновой кислоты, представлен структурой Формулы I.
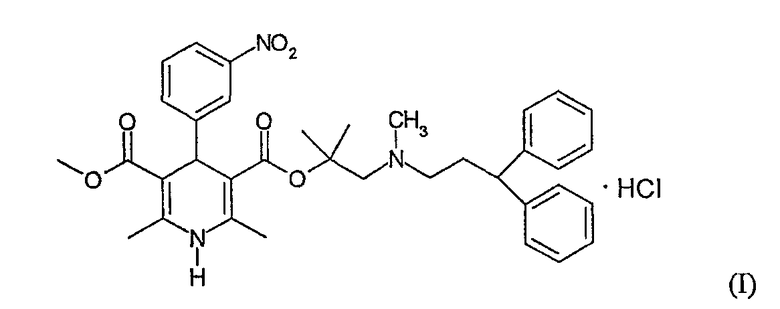
Гидрохлорид лерканидипина представляет собой синтетический антигипертензивный блокатор кальциевых каналов, продаваемый под торговыми марками Леркадип, Лердип, Лерзам, Занедип и Занидип®. Гидрохлорид лерканидипина представляет собой дигидропиридиновый блокатор кальциевых каналов, используемый для лечения гипертензии. Он может уменьшать системное артериальное кровяное давление в течение длительного периода действия и, как полагают, уменьшает развитие атеросклероза. См., например, The Merck Index, Thirteenth Edition, 2001, p. 973, monograph 5465.
Европейский патент № 0153016 ("патент '016") и патент США № 4968832 ("патент '832"), введенные здесь посредством ссылки, раскрывают гидрохлорид лерканидипина. Патенты '016 и '832 далее раскрывают способы получения гидрохлорида лерканидипина и гидрохлорида аморфной формы лерканидипина. Недостатки, связанные с этими способами, включают, например, получение примесей. Следовательно, предпочтительно уменьшить уровень примесей при получении гидрохлорида лерканидипина.
Патент США № 5912351 раскрывает простой способ получения гидрохлорида лерканидипина. Он включает реакцию 1,4-дигидро-2,6-диметил-5-метоксикарбонил-4-(3-нитрофенил)пиридин-3-карбоновой кислоты с тионилхлоридом в дихлорметане и диметилформамиде при температуре между -4 и +1°C и последующую этерификацию полученного хлорида кислоты 2, N-диметил-N-(3,3-дифенилпропил)-1-амино-2-пропиловым спиртом при температуре между -10 и 0°C. Способ дает выход гидрохлорида лерканидипина в безводной негигроскопичной кристаллической форме и позволяет избежать образования нежелательных побочных продуктов и последующую очистку на хроматографических колонках.
Одна примесь, как полагают, присутствует при получении гидрохлорида лерканидипина и представляет собой 2-[N-(3,3-дифенилпропил)-N-метиламино]-1,1-диметилэтилпропиловый диэфир 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)пиридин-3,5-дикарбоновой кислоты, как определено при помощи ВЭЖХ анализа различных партий гидрохлорида лерканидипина, полученного реакцией бутановой кислоты, гидрохлорида 2-[(3-нитрофенил)метилен]-3-оксо-2-[(3,3-дифенилпропил)метиламино]-1,1-диметилэтилового эфира и метил-3-аминокротоната в присутствии триэтиламина и н-пропанола, применяя набор методов далее в Примере 16 EP 0153016. Структура 2-[N-(3,3-дифенилпропил)-N-метиламино]-1,1-диметилэтилпропилового диэфира 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)пиридин-3,5-дикарбоновой кислоты представлена структурой Формулы II.
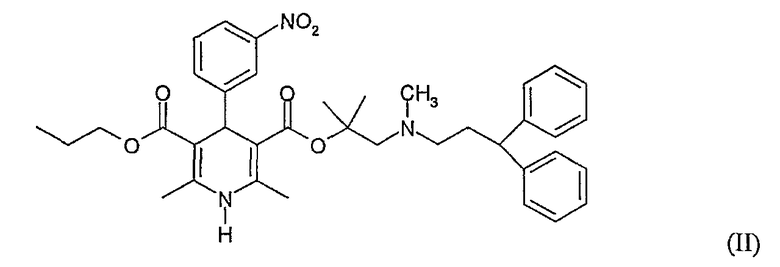
Примесь, образованная из-за переэтерификации гидрохлорида лерканидипина в положении 5 н-пропанолом в присутствии HCl в н-пропаноле. Кроме того, эту примесь очень трудно удалить из неочищенного гидрохлорида лерканидипина.
Патент США № 6852737 ("патент '737") раскрывает кристаллические Формы I и II и неочищенные Формы A и B гидрохлорида лерканидипина и способ их получения. Неочищенная Форма А гидрохлорида лерканидипина описана в Примере 2 как имеющая пик в дифференциальной сканирующей калориметрии (ДСК) при 150-152°C. Неочищенная Форма В гидрохлорида лерканидипина описана в Примере 3 как имеющая пик в дифференциальной сканирующей калориметрии (ДСК) при 131-135°C. Патент '737, кроме того, раскрывает, что патент США № 5912351 ("патент '351 ") получает третью неочищенную форму гидрохлорида лерканидипина, называемую неочищенной Формой C. Неочищенная Форма C, как сообщается, имеет ДСК пик при 186-192°C. Кроме того, патент '737 раскрывает, что термогравиметрические изучения показывают, что неочищенная Форма А содержит 3-4% остаточного этилацетата, неочищенная Форма В содержит 0,3-0,7% остаточного этилацетата и неочищенная Форма C содержит 0-0,1% остаточных растворителей. Кристаллические Формы I и II гидрохлорида лерканидипина являются хорошо охарактеризованными при помощи дифракционного рентгеновского анализа в патенте '737. Пример 12 патента '737 раскрывает, что кристаллическая Форма I имеет температуру плавления (T пик) 198,7°C и начальную температуру 179,8°C и кристаллическая Форма II имеет температуру плавления (T пик) 209,3°C и начальную температуру 169,0°C.
WO 2006/089787 раскрывает гидрохлорид аморфного лерканидипина, имеющий чистоту, по меньшей мере, 95%, и способ его получения. Способ включает растворение кристаллического гидрохлорида лерканидипина в органическом растворителе, чтобы обеспечить раствор и выделение гидрохлорида аморфного лерканидипина при помощи или (a) добавления воды к раствору, чтобы образовать осадок и собрать осадок, или (b) выпаривания органического растворителя.
Полиморфизм представляет собой явление различных кристаллических форм взятого отдельно соединения и представляет собой свойство некоторых соединений и комплексов. Таким образом, полиморфы представляют собой определенные твердые фазы, совместно использующие одинаковую молекулярную формулу, еще каждый полиморф может иметь определенные физические свойства. Следовательно, отдельно взятое соединение может давать разнообразие полиморфных форм, где каждая форма имеет различные и определенные физические свойства, такие как различные кривые растворимости, различные точки температур плавления и/или различные пики дифракции рентгеновских лучей. Так как растворимость каждого полиморфа может варьироваться, идентификация существования фармацевтических полиморфов является существенной для обеспечения фармацевтических препаратов с приписываемыми кривыми растворимости. Желательно исследовать все формы твердых состояний лекарственного средства, включая все полиморфные формы и определить стабильность, растворение и свойства текучести каждой полиморфной формы. Полиморфные формы соединения могут различаться в лаборатории при помощи рентгеновской спектроскопии и при помощи других методов таких, как ИК-спектрометрия. Кроме того, полиморфные формы одинакового лекарственного вещества или активного фармацевтического ингредиента могут быть введены сами по себе или в составе готовой лекарственной формы (также известной, как окончательная или готовая лекарственная форма) и являются хорошо известными специалисту в области фармацевтики, чтобы воздействовать, например растворимость, стабильность, текучесть, податливость и сжимаемость лекарственных веществ и эффективность готовых лекарственных форм.
Открытие новых полиморфных форм фармацевтически пригодного соединения обеспечивает новую возможность улучшить характеристики применения фармацевтического препарата. Также добавляется к материалу, что технолог имеет возможность для разработки, например, формы фармацевтического препарата лекарственного средства с целевым профилем высвобождения или другими желаемыми характеристиками. Новую полиморфную форму гидрохлорида лерканидипина сейчас раскрывают.
Попытки также были сделаны, чтобы приготовить фармацевтические препараты с высокой степенью чистоты и минимальным количеством присутствия примесей. Контроль примесей требует изучения различных средств, чтобы остановиться на условиях реакции и протоколах испытаний, необходимых для гарантии, что лекарственные средства, которые вводятся пациентам, по существу чистые. Следовательно, остается необходимость в улучшенном способе получения гидрохлорида лерканидипина, в котором устраняются или уменьшаются примеси удобным и экономичным методом, чтобы обеспечить по существу чистые формы гидрохлорида лерканидипина.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с одним вариантом осуществления настоящего изобретения способ получения по существу чистого гидрохлорида лерканидипина обеспечивается, включая (a) растворение гидрохлорида лерканидипина в спиртосодержащем растворителе для образования раствора,
(b) добавление алифатического эфирсодержащего растворителя к раствору и (c) выделение гидрохлорида лерканидипина из раствора.
В соответствии со вторым вариантом осуществления настоящего изобретения гидрохлорид лерканидипина обеспечивается по существу в полиморфной форме V.
В соответствии с третьим вариантом осуществления настоящего изобретения по существу чистый гидрохлорид лерканидипина обеспечивается в полиморфной форме V.
В соответствии с четвертым вариантом осуществления настоящего изобретения обеспечивается гидрохлорид лерканидипина по существу в полиморфной форме V и имеющий, по меньшей мере, одну из следующих характеристик (a) модель дифракции рентгеновских лучей (XRD) по существу в соответствии с Фиг.1 и/или термограмма дифференциальной сканирующей калориметрии (ДСК) по существу в соответствии с Фиг.2.
В соответствии с пятым вариантом осуществления настоящего изобретения гидрохлорид лерканидипина обеспечивается по существу в полиморфной форме V и показывающий характерные пики (выраженные в градусах 2θ±0,2°θ) приблизительно при одном или большем количестве положений около 17,2752 и около 19,8836.
В соответствии с шестым вариантом осуществления настоящего изобретения способ получения гидрохлорида лерканидипина обеспечивается по существу в полиморфной форме V, способ, включающий:
(a) растворение гидрохлорида лерканидипина в спиртосодержащем растворителе для получения раствора;
(b) добавление алифатического эфирсодержащего растворителя к раствору и
(c) выделение гидрохлорида лерканидипина по существу в полиморфной форме V из раствора.
Преимущества способа вышеупомянутых вариантов осуществления включают, по меньшей мере, следующие:
1. Способ представляет собой простой способ, который целесообразен и эффективен в промышленном масштабе и приводит по существу к чистому гидрохлориду лерканидипина.
2. Способ обеспечивает улучшенную эффективность, поскольку он использует экономичные реагенты и производит меньше отходов и меньше примесей.
В соответствии с другим вариантом осуществления настоящего изобретения способ получения гидрохлорида аморфной формы лерканидипина обеспечивается способом, включающим (a) растворение гидрохлорида лерканидипина по существу в полиморфной форме V в органическом растворителе; и (b) выделение гидрохлорида аморфной формы лерканидипина.
В соответствии с еще другим вариантом осуществления настоящего изобретения способ получения гидрохлорида аморфной формы лерканидипина обеспечивается, способ, включающий (a) растворение по существу чистого гидрохлорида лерканидипина в органическом растворителе; (b) обработка раствора осветляющим веществом для образования осветленного раствора и (c) выделение гидрохлорида аморфной формы лерканидипина.
Преимущества способа этого варианта осуществления включают, по меньшей мере, следующие:
1. Способ представляет собой простой способ, который целесообразен и эффективен в промышленном масштабе и приводит по существу к чистому гидрохлориду лерканидипина.
2. Способ обеспечивает улучшенную эффективность, поскольку он использует экономичные реагенты и производит меньше отходов и меньше примесей.
ОПРЕДЕЛЕНИЯ
Термины «обработка» или «лечение» состояния, нарушения или заболевания, используемые в описании, обозначают: (1) предотвращение или задержку возникновения клинических симптомов состояния, нарушения или заболевания, возникающих у млекопитающих, которые могут страдать от или быть предрасположенными к состоянию, нарушению или заболеванию, но все еще не иметь опыта или показывать клинические или субклинические симптомы состояния, нарушения или заболевания, (2) ингибирование состояния, нарушения или заболевания, т.е. прекращение или уменьшение развития заболевания или, по меньшей мере, одного их клинического или субклинического симптома или (3) смягчение заболевания, т.е. вызывая ослабление симптомов состояния, нарушения или заболевания или, по меньшей мере, одного из их клинических или субклинических симптомов. Преимущество для объекта, который проходит лечение, представляет собой или статистически значимое, или, по меньшей мере, ощущаемое для пациента или для врача.
Термин «терапевтически эффективное количество», используемый в описании, обозначает количество соединения, которое при введении млекопитающему для лечения состояния, нарушения или заболевания, является достаточным для проведения такого лечения. «Терапевтически эффективное количество» может варьироваться в зависимости от соединения, заболевания и его тяжести и возраста, веса, физического состояния и восприимчивости млекопитающего, который подвергается лечению.
Термин «доставка», используемый в описании, обозначает терапевтически эффективное количество активного ингредиента к определенному месту в пределах организма «хозяина», обозначает, вызывая терапевтически эффективную концентрацию активного ингредиента в крови в определенном месте. Это может быть выполнено, например, топическим, очаговым или систематическим введением активного ингредиента в организм «хозяина».
Термин «буферное вещество», используемый в описании, как предполагается, обозначает соединение, используемое для устойчивости изменений pH при разбавлении или добавлении кислот или щелочей. Такие соединения включают путем примера и без ограничений метафосфат калия, фосфат калия, одноосновный ацетат натрия и безводный и дегидратированный цитрат натрия и другие такие вещества, известные специалисту в данной области.
Термин «подслащивающее вещество», используемый в описании, как предполагается, обозначает соединение, используемое для придания сладкого вкуса при получении. Такие соединения включают путем примера и без ограничений аспартам, декстрозу, глицерин, маннитол, сахариновый натрий, сорбит, сахарозу, фруктозу и другие такие вещества, известные специалисту в данной области.
Термин «связывающее вещество» используемый в описании, как предполагается, обозначает вещества, используемые, чтобы вызвать адгезию частиц порошка в гранулах таблеток. Такие соединения включают путем примера и без ограничений акациевую альгиновую кислоту, трагант, карбоксиметилцеллюлозу натрия, поливинилпирролидон, сжимающийся сахар (например, NuTab), этилцеллюлозу, желатин, жидкую глюкозу, метилцеллюлозу, повидон и пептизированный крахмал, их комбинации и другие вещества, известные специалисту в данной области.
При необходимости другие связывающие вещества можно включить в настоящее изобретение. Типовые связывающие вещества включают крахмал, поли(этиленгликоль), гуаровую камедь, полисахарид, бентониты, сахара, инвертированные сахара, полоксамеры (PLURONICTM F68, PLURONICTM F127), коллаген, альбумин, целлюлозы в безводных растворителях, их комбинации и т.п. Другие связывающие вещества включают, например, поли(пропиленгликоль), полиоксиэтилен-полипропилен сополимер, полиэтиленовый эфир, полиэтиленовый сорбитановый эфир, поли(этиленоксид), микрокристаллическую целлюлозу, поли(винилпирролидон), их комбинации и другие такие вещества, известные специалисту в данной области.
Термин «разбавитель» или «наполнитель», используемые в описании, как предполагается, обозначают инертные вещества, используемые в качестве наполнителей для создания желаемого объема, скользящих свойств и характеристик компрессии при получении таблеток и капсул. Такие соединения включают путем примера и без ограничений двухосновный фосфат кальция, каолин, сахарозу, маннит, микрокристаллическую целлюлозу, порошковую целлюлозу, осажденный карбонат кальция, сорбит, крахмал, их комбинации и другие такие вещества, известные специалисту в данной области.
Термин «вещество, способствующее скольжению», используемый в описании, как предполагается, обозначает вещества, используемые в рецептуре таблеток и капсул для улучшения скользящих свойств в течение сжатия таблетки и получения эффекта, предотвращающего слипание. Такие соединения включают путем примера и без ограничений коллоидную окись кремния, силикат кальция, силикат магния, кремниевый гидрогель, кукурузный крахмал, тальк, их комбинации и другие такие вещества, известные специалисту в данной области.
Термин «смазывающее вещество», используемый в описании, как предполагается, обозначает вещества, используемые в рецептуре таблеток, для уменьшения трения в течение сжатия таблеток. Такие соединения включают путем примера и без ограничений стеарат кальция, стеарат магния, минеральное масло, стеариновую кислоту, стеарат цинка, их комбинации и другие такие вещества, известные специалисту в данной области.
Термин «вещество, вызывающее дезинтеграцию», используемый в описании, как предполагается, обозначает соединение, используемое в твердых лекарственных формах для поддержания разрушения твердой массы на маленькие частицы, которые являются более легко диспергированными или растворенными. Типовые вещества, вызывающие дезинтеграцию, включают путем примера и без ограничений крахмалы, такие как кукурузный крахмал, картофельный крахмал, пептизированный и модифицированный крахмал, подслащивающие вещества, глины, такие как бентонит, микрокристаллическая целлюлоза (например, AvicelTM), карзиум (например, AmberliteTM), альгинаты, натриевый гликолят крахмала, камедь, такую как агар, гуар, плод рожкового дерева, карайя, пектин, трагант, их комбинации и другие такие вещества, известные специалисту в данной области.
Термин «смачивающее вещество», используемый в описании, как предполагается, обозначает соединение, используемое для поддержания достигнутого внутреннего контакта между твердыми частицами и жидкостями. Типовые смачивающие вещества включают путем примера и без ограничений желатин, казеин, лецитин (фосфатиды), аравийскую камедь, холестерин, трагант, стеариновую кислоту, бензалконий хлорид, стеарат кальция, глицерин моностеарат, цетостеариловый спирт, цетомакрогольный эмульгирующий парафин, сорбитановые эфиры, полиоксиэтиленалкиловые эфиры (например, макрогольные эфиры такие, как цетомакрогол 1000), производные полиоксиэтиленового касторового масла, полиоксиэтиленовые сорбитановые эфиры жирных кислот (например, TWEENTMs), полиэтиленгликоли, полиоксиэтиленовый стеариновый коллоидальный диоксид кремния, фосфаты, додецилсульфат натрия, карбоксиметилцеллюлозу кальция, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозы фталат, некристаллическую целлюлозу, магнийалюмосиликат, триэтаноламин, поливиниловый спирт, поливинилпирролидон (ПВП), тилоксапол (неионный жидкий полимер алкиларилполиэфирного спиртового типа, также известный как суперинон или тритон), их комбинации и другие такие вещества, известные специалисту в данной области.
Большинство из этих вспомогательных веществ описаны детально, например, в Howard C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, (7th Ed. 1999); Alfonso R. Gennaro et al., Remington: The Science and Practice of Pharmacy, (20th Ed. 2000); и A. Kibbe, Handbook of Pharmaceutical Excipients, (3rd Ed. 2000), которые включены в настоящее описание посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
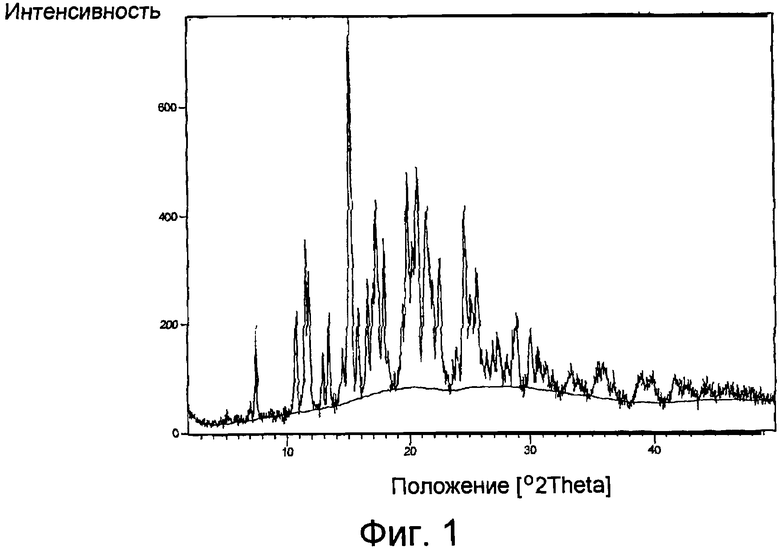
Фиг.1 представляет собой характерный дифракционный рентгеновский анализ образца порошка полиморфной формы V гидрохлорида лерканидипина.
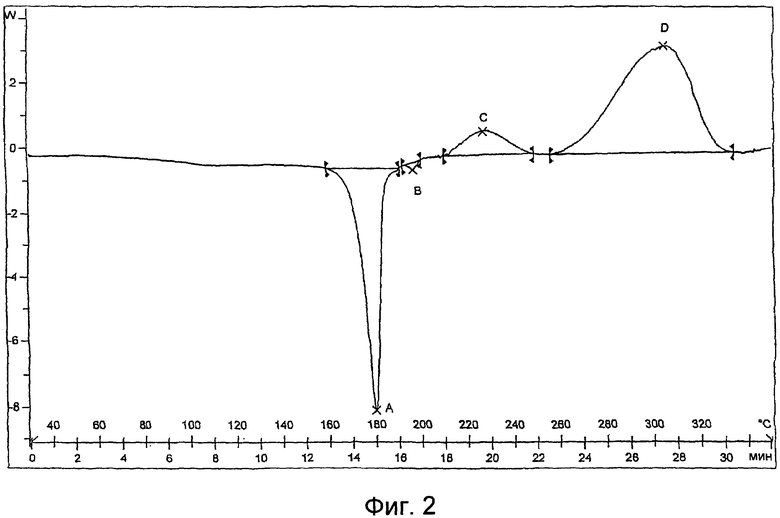
Фиг.2 представляет собой характерную термограмму дифференциальной сканирующей калориметрии полиморфной формы V гидрохлорида лерканидипина.
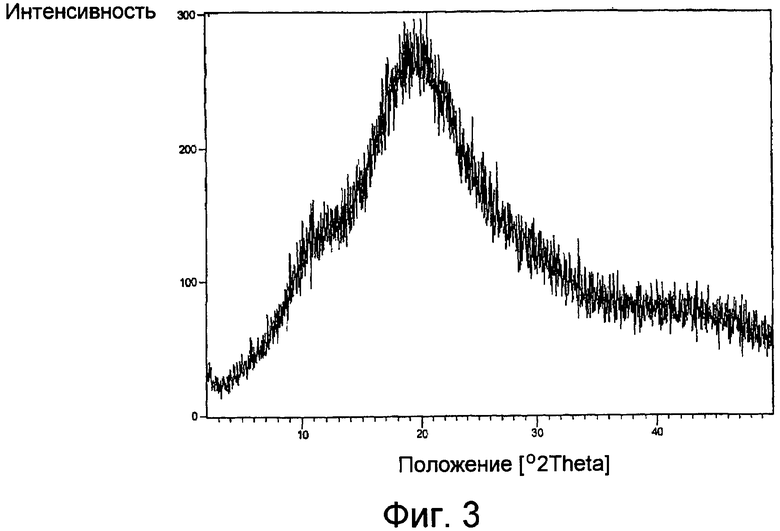
Фиг.3 представляет собой характерный дифракционный рентгеновский анализ образца порошка гидрохлорида лерканидипина в аморфной форме.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ОСУЩЕСТВЛЕНИЯ
Один вариант осуществления настоящего изобретения направлен на новую полиморфную форму гидрохлорида лерканидипина, обозначаемую полиморфная форма V. Новая полиморфная форма V гидрохлорида лерканидипина может быть охарактеризована, например, дифракционным рентгеновским анализом образца порошка и/или точкой плавления. Спектр XRD порошка полиморфной формы V представлен на Фиг.1 и изложен в табличной форме в Таблице 1 ниже. Рентгеновская дифракция порошка была измерена порошковым рентгеновским дифрактометром, оборудованным Cu-анодом (λ =1,54 Ангстрема), источник рентгеновских лучей работает при 45 кВ, 40 мА и Ni фильтр используют, чтобы отделить K-бета радиацию. Калибровка 2 тета выполняется, используя NIST SRM 640c Si стандарт. Образец был проанализирован, используя следующие измеряемые параметры: диапазон измерения=2-50° 2θ.; ширина шага=0,017 °; и время измерения за шаг=5 сек.
Как показано на Фиг.2, полиморфная форма V гидрохлорида лерканидипина показывает преобладающий эндотермальный пик при около 179,5°C, как измерено дифференциальным сканирующим калориметром (DSC 822, Mettler Toledo) при скорости сканирования 10°C в минуту со стандартом индия. В этом отношении, должно пониматься, что эндотерм, измеренный определенным дифференциальным сканирующим калориметром, зависит от множества факторов, включая скорость нагрева (т.е. скорость сканирования), используемый калибровочный стандарт, градуировку средства измерений, относительную влажность и химическую чистоту тестируемого образца.
Таким образом, эндотерм, как измерено ДСК на приборе, идентифицированном выше, может измениться до ±1°C или даже ±11/2°C. Следовательно, термин «около 179,5°C», как предполагается, охватывает такие колебания прибора.
В одном варианте осуществления полиморфная форма V гидрохлорида лерканидипина может быть получена, по меньшей мере:
(a) растворением гидрохлорида лерканидипина в спиртосодержащем растворителе для получения раствора;
(b) добавлением алифатического, эфирсодержащего растворителя к раствору стадии (a); и
(c) выделением гидрохлорида лерканидипина по существу в полиморфной форме V из раствора.
На стадии (a) способа настоящего изобретения гидрохлорид лерканидипина растворяют в спиртосодержащем растворителе. Гидрохлорид лерканидипина может быть получен, используя методы, хорошо известные в данной области техники или из коммерческих источников и не составляют часть настоящего изобретения.
Пригодные спиртосодержащие растворители включают ароматические и алифатические C1-C12 спирты и т.п. и их смеси. Пригодные алифатические спирты включают C1-C8 спирты, такие как, например, метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол и т.п., и их смеси. Пригодные ароматические спирты включают C3-C12 спирты, такие как, например, бензиловый спирт, бензилоксиэтанол, феноксиэтанол и т.п., и их смеси. Обычно спиртосодержащий растворитель может присутствовать в отношении около 1:1 объем/вес по отношению к гидрохлориду лерканидипина. Гидрохлорид лерканидипина и спиртосодержащий растворитель(и) может быть нагрет до температуры в пределах от около 40°C до около 60°C, предпочтительно от около 45°C до около 55°C и наиболее предпочтительно от около 50°C до около 55°C в течение периода времени в пределах от около 30 минут до около 40 минут. Раствор предпочтительно охлаждают до комнатной температуры, температура в пределах от около 25°C до около 30°C.
На стадии (b) способа настоящего изобретения алифатический эфирсодержащий растворитель добавляют к раствору. Пригодные алифатические эфирсодержащие растворители включают эфирные группы, имеющие от около 2 до около 12 углеродных атомов, например, этилацетат, изопропилацетат и т.п., и их смеси. Алифатический эфирсодержащий растворитель может присутствовать в отношении около 10:1 объем/вес по отношению к гидрохлориду лерканидипина.
Алифатический эфирсодержащий растворитель предпочтительно добавляют при комнатной температуре, температура в диапазоне от около 25°C до около 30°C.
На стадии (c) способа настоящего изобретения гидрохлорид лерканидипина по существу в полиморфной форме V выделяют из раствора. Полиморфная форма V гидрохлорида лерканидипина может быть выделена, например, кристаллизацией раствора стадии (b)для получения по существу чистых кристаллов гидрохлорида лерканидипина; и выделением кристаллов методами, известными в данной области техники, например фильтрацией для получения полиморфной формы V гидрохлорида лерканидипина. Выделенные кристаллы могут тогда быть далее высушены. Кристаллизация может быть выполнена перемешиванием раствора при от около 60 до около 100 оборотов в минуту (об/мин) в течение периода времени в пределах от около 1 часа до около 16 часов. Температура в течение перемешивания может располагаться от около 25°C до около 30°C. Полученное твердое вещество может тогда быть отфильтровано и промыто эфирсодержащим растворителем, например, изопропилацетатом (около 1:1 объем/вес, растворитель:гидрохлорид лерканидипина), чтобы обеспечить кристаллы гидрохлорида лерканидипина. Кристаллы могут затем быть высушены. Кристаллы могут быть высушены при температуре в пределах от около 50°C до около 55°C, пока потеря в массе при высушивании ("LOD") меньше чем около 10% не достигнута. Период времени для высушивания может располагаться от около 6 часов до около 12 часов и предпочтительно около 8 часов.
Определенные эксплуатационные стадии хорошо известны в данной области техники и, если не обозначено иначе, любой известный метод для того, чтобы выполнять эти функции, может использоваться в способах этого изобретения. Например, растворители могут быть удалены дистилляцией при атмосферном давлении или под вакуумом. Высушивание может быть достигнуто выпариванием, сушкой распылением, сушкой под вакуумом и сушкой сублимацией. Перемешивание обозначает любой метод для смешивания или перемешивания реакционной смеси.
В другом варианте осуществления высокоочищенный гидрохлорид лерканидипина может быть получен
(a) реагированием раствора, включающего бутановую кислоту, 2-[(3-нитрофенил) метилен]-3-оксо-2-[(3,3-дифенилпропил)метиламино]-1,1-диметилэтиловый эфира гидрохлорид и метилен дихлорид, с метил 3 аминокротонатом и н-пропанолом и устанавливая pH раствора около 8 до около 9 основанием;
(b) охлаждением реакционной массы до температуры от около 50°C до около 55°C, отгоняя н-пропанол для получения остатка, растворяя осадок в н-пропаноле, устанавливая pH реакционной массы, используя н-пропанол/HCl и отгоняя н-пропанол для получения осадка;
(c) растворением осадка в изопропилацетате, промывая водой, обрабатывая раствор углем и отгоняя изопропилацетат для получения осадка;
(d) растворением осадка в метаноле и изопропилацетате, отбирая раствор с полиморфной формой V гидрохлорида лерканидипина и фильтрованием и промыванием твердого вещества; и
(e) высушиванием твердого вещества, полученного на стадии (d)для получения по существу чистого гидрохлорида лерканидипина.
На стадии (a) способа настоящего изобретения бутановая кислота, 2-[(3-нитрофенил) метилен]-3-оксо-2-[(3, 3-дифенилпропил)метиламино]-1,1-деметилэтилового эфира гидрохлорида раствор (около 77% вес/объем) в галогенизированном углеводородном растворителе, например метилендихлориде, реагирует с метил 3-аминокротонатом и н-пропанолом. Раствор гидрохлорида реагирует с метил 3-аминокротонатом при молярном отношении около 1:1. Реакция может иметь место при температуре в пределах от около 70°C до около 90°C и предпочтительно от около 75°C до около 80°C. Период времени для реакции может располагаться от около 8 часов до около 12 часов и предпочтительно в течение около 10 часов. После реакции pH реакционной массы может быть установлен от около 8 до около 9, используя подходящее основание, например триалкиламин, такое как триэтиламин.
На стадии (b) способа настоящего изобретения реакционную массу охлаждают до подходящей температуры, и затем н-пропанол удаляют, например, дистилляцией. Подходящая температура будет обычно располагаться от около 40°C до около 70°C и предпочтительно от около 50°C до около 55°C. Осадок, таким образом полученный, может тогда быть перерастворен в н-пропаноле. Это растворение может иметь место при комнатной температуре, температура в пределах от около 25°C до около 30°C. рH реакционной массы может тогда быть установлен от около 3 до около 4, используя раствор н-пропанол/HCl (20%) и н-пропанол отгоняют. Эта дистилляция может иметь место при температуре ниже около 35°C.
На стадии (c) способа настоящего изобретения осадок растворяют в изопропилацетате и промывают водой. Раствор затем обрабатывают с углем с подходящим угольным веществом, таким как активированный уголь. Изопропилацетат затем отгоняют.
Эта дистилляция может иметь место при температуре ниже около 35°C и может располагаться от около 25 до около 35°C.
На стадии (d) способа настоящего изобретения, осадок растворяют в растворе метанола и изопропилацетата. Это разбавление может иметь место при комнатной температуре. При желании раствор может быть отобран с полиморфной формой V гидрохлорида лерканидипина. Полиморфная форма V гидрохлорида лерканидипина может быть получена способом, обсужденным выше. В течение отбора раствор может перемешиваться при около 15 до около 18 оборотов в минуту (об/мин). Кристаллизация может иметь место при комнатной температуре в течение от около 20 часов до около 28 часов и предпочтительно в течение около 24 часов. Твердые частицы тогда отфильтровывают и необязательно промывают изопропилацетатом.
На стадии (e) способа настоящего изобретения твердые частицы высушивают для получения по существу чистого гидрохлорида лерканидипина. Твердые частицы могут быть высушены при температуре в пределах от около 50°C до около 55°C.
Другой вариант осуществления настоящего изобретения обеспечивает способ для очистки гидрохлорида лерканидипина. Было обнаружено, что использование спиртосодержащего растворителя, например, метанола и эфирсодержащего растворителя, например изопропилацетата может быть очень эффективным по существу в удалении примесей, обнаруженных в гидрохлориде лерканидипина, особенно примеси 2-[N-(3,3-дифенилпропил)-N-метиламино]-1,1-диметилэтилпропилового диэфира l,4-дигидро-2,6-диметил-4-(3-нитрофенил)пиридин-3,5-дикарбоновой кислоты, обсужденной выше. Способ включает, по меньшей мере, растворение неочищенного гидрохлорида лерканидипина в спиртосодержащем растворителе, таком как метанол, добавление алифатического эфирсодержащего растворителя, такого как изопропилацетата и затем выделение по существу чистого гидрохлорида лерканидипина, например, кристаллизацией, как обсуждено выше.
В еще другом варианте осуществления настоящего изобретения способ очистки гидрохлорида лерканидипина включает, по меньшей мере, стадии (a) первое растворение, (b) второе растворение, (c) кристаллизация и (d) высушивание. На стадии (a) способа очистки этого варианта осуществления настоящего изобретения гидрохлорид лерканидипина по существу растворяют в спиртосодержащем растворителе, таком как C1-C8 спирт, например метанол, этанол, изопропанол, бутанол и т.п., и их смеси. Обычно спиртосодержащий растворитель присутствует в отношении около 1:1 объем/вес по отношению к гидрохлориду лерканидипина. Гидрохлорид лерканидипина и спиртосодержащий растворитель может быть нагрет до температуры в пределах от около 40°C до около 65°C в течение периода времени в пределах от около 20 минут до около 1 часа. Раствор может затем быть охлажден до комнатной температуры, температура в пределах от около 25°C до около 30°C.
На стадии (b) способа очистки этого варианта осуществления настоящего изобретения разбавление далее включает добавление к раствору алифатического эфирсодержащего растворителя такого, как эфирная группа, имеющая от около 2 до около 12 углеродных атомов, например изопропилацетата. Алифатический эфирсодержащий растворитель может присутствовать в отношении около 10:1 объем/вес по отношению к гидрохлориду лерканидипина. Алифатический эфир может быть добавлен при комнатной температуре, температура в диапазоне от около 25°C до около 30°C.
На стадии (с) способа очистки этого варианта осуществления настоящего изобретения раствор может перемешиваться при температуре в пределах от около 25°C до около 30°C. Раствор может перемешиваться от около 60 оборотов в минуту до около 100 оборотов в минуту в течение периода времени в пределах от около 12 часов до около 20 часов. Полученное твердое вещество может тогда быть выделено стандартными методами, например фильтрацией, и необязательно промыто подходящим растворителем, таким как изопропилацетат (около 1:1 объем/вес, изопропилацетат: гидрохлорид лерканидипина) для получения кристаллов гидрохлорида лерканидипина.
На стадии (d) способа очистки этого варианта осуществления настоящего изобретения кристаллы могут быть высушены при температуре в пределах от около 50°C до около 55°C, до тех пор пока LOD будет не меньше, чем около 10% за период времени от около 6 до около 12 часов и предпочтительно через около 8 часов.
Выполняя способы очистки настоящего изобретения, по существу чистый гидрохлорид лерканидипина может быть получен со степенью чистоты, большей чем или равной около 98,5%, предпочтительно больше чем или равной около 99,5% и более предпочтительно больше чем или равной около 99,7%. Чистота гидрохлорида лерканидипина настоящего изобретения может быть определена любым методом, известным в данной области техники, например анализ с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
Другой вариант осуществления настоящего изобретения обеспечивает способ получения гидрохлорида аморфной формы лерканидипина. Было обнаружено, что очищенный гидрохлорид лерканидипина в подходящем органическом растворителе, таком как спиртосодержащий растворитель, например, метанол, который объединен с осветляющим веществом, таким как активированный уголь и затем смешан с водой, является предпочтительно эффективным при получении гидрохлорида аморфного лерканидипина с никаким значительным изменением в профиле распределения примесей. Обычно способ включает, по меньшей мере, (a) растворение очищенного гидрохлорида лерканидипина, как получено выше, в органическом растворителе, (b) обработка раствора осветляющим веществом для получения осветленного раствора и (c) выделение гидрохлорида аморфной формы лерканидипина. В одном варианте осуществления очищенный гидрохлорид лерканидипина для использования в получении очищенного гидрохлорида аморфного лерканидипина настоящего изобретения представляет собой гидрохлорид лерканидипина по существу в полиморфной форме V, как обсуждено выше.
В другом варианте осуществления настоящего аспекта способ получения гидрохлорида аморфного лерканидипина включает стадии (a) растворение, (b) обработка осветляющим веществом, (c) концентрирование, (d) перерастворение, (e) добавление и (f) выделение.
На стадии (a) способа настоящего изобретения по существу чистый гидрохлорид лерканидипина или гидрохлорид лерканидипина по существу в полиморфной форме V растворяют в органическом растворителе, таком как спиртосодержащий растворитель, как обсуждено выше. Органический растворитель может присутствовать в отношении около 10:1 объем/вес по отношению к гидрохлориду лерканидипина. Осветленный раствор гидрохлорида лерканидипина и органического растворителя может быть получен при комнатной температуре, температура в пределах от около 25°C до около 30°C.
На стадии (b) способа настоящего изобретения, подходящее осветляющее вещество может быть добавлено к осветленному раствору. Любой из многих таких агентов, которые, как известно, являются пригодными для того, чтобы адсорбировать примеси при синтетических режимах очистки, может применяться. В одном предпочтительном варианте осуществления осветляющее вещество представляет собой активированный уголь. Осветляющее вещество может присутствовать в отношении около 0,05:1 мас/мас по отношению к гидрохлориду лерканидипина. Раствор может перемешиваться при температуре в пределах от около 25°C до около 30°C в течение периода времени в пределах от около 2 минут до около 10 минут и предпочтительно от около 3 минут до около 5 минут. Раствор может затем быть отфильтрован, например, через подложку с высокой пропускной способностью при температуре в пределах от около 25°C до около 30°C. Подложка с высокой пропускной способностью может быть промыта спиртом (например, около 2:1 объем/вес по отношению к гидрохлориду лерканидипина).
На стадии (c) способа настоящего изобретения, концентрирование может быть выполнено любыми удобными средствами, используемыми, чтобы сконцентрировать раствор, например дистилляция при атмосферном давлении. В одном варианте осуществления концентрирование может быть выполнено дистиллированием осветленного отфильтрованного раствора при температуре в пределах от около 25°C до около 30°C под вакуумом (не меньше, чем около 700 мм) до тех пор пока по существу никакой дистиллят не наблюдается.
На стадии (d) способа настоящего изобретения перерастворение включает растворение осадка, полученного после концентрирования, в том же самом или отличном органическом растворителе, таком как спиртосодержащий растворитель, как обсуждено выше. Органический растворитель может присутствовать в отношении около 1:1 объем/вес по отношению к гидрохлориду лерканидипина. Осветленный раствор гидрохлорида лерканидипина и спиртосодержащий растворитель может быть получен при комнатной температуре, температура в пределах от около 25°C до около 30°C.
На стадии (e) способа настоящего изобретения вода добавляется к осветленному раствору. Вода может присутствовать в отношении около 50:1 объем/вес по отношению к гидрохлориду лерканидипина. Добавление может быть сделано в течение периода времени в пределах от около 45 минут до около 60 минут. Добавление осветленного раствора гидрохлорида лерканидипина и спиртосодержащего растворителя к воде может сопровождаться перемешиванием при температуре в диапазоне от около 30°C до около 35°C в течение периода времени обычно в пределах от около 25 до около 35 минут после добавления осветленного раствора к воде.
На стадии (f) способа настоящего изобретения гидрохлорид аморфного лерканидипина может быть выделен, например, собирая осадок гидрохлорида аморфного лерканидипина. Это может быть достигнуто методами, известными в данной области техники, например фильтрацией. Альтернативно, гидрохлорид аморфного лерканидипина может быть выделен кристаллизацией. Кристаллизация может быть выполнена, например, охлаждая водный раствор до температуры в пределах от около 0°C до около 5°C. Реакционная смесь может быть далее поддержана при температуре в пределах от около 0°C до около 5°C в течение периода времени обычно в пределах от около 1 до около 4 часов и предпочтительно около 3 часов. Полученные твердые частицы могут затем быть отфильтрованы и промыты водой (например, около 2:1 объем/вес по отношению к гидрохлориду лерканидипина). Полученные кристаллы могут быть высушены, например, под вакуумом (не меньше, чем около 700 мм) при температуре в пределах от около 60°C до около 65°C, пока влагосодержание не меньше, чем около 2%, за период времени от около 6 до около12 часов и предпочтительно около 8 часов.
Выполняя этот способ настоящего изобретения, по существу чистый гидрохлорид аморфного лерканидипина может быть получен со степенью чистоты больше, чем около 95%, предпочтительно больше, чем около 97% и наиболее предпочтительно больше, чем около 99,75%. Аморфная форма продукта может быть определена рентгенодифрактометрией порошка, как обсуждено выше.
Другой вариант осуществления настоящего изобретения обеспечивает гидрохлорид лерканидипина по существу свободный от 2-[N-(3,3-дифенилпропил)-N-метиламино]-1,1-диметилэтилпропилового диэфира 1,4-дигидро-2,6-диметил-4-(3-нитрофенил) пиридин-3,5-дикарбоновой кислоты. Термин «гидрохлорид лерканидипина по существу свободный от 2-[N-(3,3-дифенилпропил)-N-метиламино]-1,1-диметилэтилпропилового диэфира 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)пиридин-3,5-дикарбоновой кислоты», используемый в описании, следует понимать, означает гидрохлорид лерканидипина, образованный с небольшим или никаким содержанием 2-[N-(3,3-дифенилпропил)-N-метиламино]-1,1-диметилэтилпропилового диэфира 1,4-дигидро-2,6-диметил-4-(3-нитрофенил) пиридин-3,5-дикарбоновой кислоты. Таким образом, количество 2-[N-(3,3-дифенилпропил)-N-метиламино]-1,1-деметилэтилпропилового диэфира 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)пиридин-3,5-дикарбоновой кислоты, если присутствует, полученного в результате способа, при получении гидрохлорида лерканидипина будет присутствовать в относительно незначительных количествах, например меньше, чем около 0,15 весовых процентов, предпочтительно меньше, чем около 0,1 весовых процентов и наиболее предпочтительно 0 весовых процентов по отношению к гидрохлориду лерканидипина.
Еще один вариант осуществления настоящего изобретения направлен на фармацевтические составы, содержащие, по меньшей мере, терапевтически эффективное количество гидрохлорида лерканидипина настоящего изобретения. Такие фармацевтические составы можно вводить млекопитающему пациенту в любой лекарственной форме, например жидкость, порошок, эликсир, впрыскиваемый раствор и т.д. Лекарственные формы могут быть применены к введению пациенту оральным, буккальным, парентеральным, офтальмическим, ректальным и трансдермальным путем или любым другим приемлемым путем введения. Оральные лекарственные формы включают, но не ограничиваются, таблетки, пилюли, капсулы, пастилки, пакеты-саше, суспензии, порошки, таблетки для рассасывания, эликсиры и т.п. Гидрохлорид лерканидипина настоящего изобретения можно также вводить как суппозитории, глазные мази и суспензии, и парентеральные суспензии, которые вводятся другими путями. Лекарственные формы могут содержать гидрохлорид лерканидипина настоящего изобретения, как является или, альтернативно, могут содержать гидрохлорид лерканидипина настоящего изобретения как часть состава. Фармацевтические составы могут далее содержать один или более фармацевтически приемлемых наполнителей. Пригодные наполнители и количества для использования могут быть легко определены технологом, основываясь на опыте и рассмотрении стандартных процедур и справочников в этой области, например буферные вещества, подслащивающие вещества, связывающие вещества, разбавители, наполнители, смазки, смачивающие вещества и вещества, вызывающие дезинтеграцию, описанные выше.
Капсульные дозировки будут содержать гидрохлорид лерканидипина настоящего изобретения в пределах капсулы, которая может быть покрыта желатином. Таблетки и порошки могут также быть покрыты энтеросолюбильным покрытием. Покрытые энтеросолюбильной оболочкой порошковые формы могут иметь покрытия, содержащие, по меньшей мере, ацетфталат целлюлозы, гидроксипропилметилфталат целлюлозы, поливинилфталат спирта, карбоксиметилэтилцеллюлозу, сополимер стирола и малеиновой кислоты, сополимер метакриловой кислоты и метилметакрилата, и как материалы, и при желании, они могут быть применяться с пригодными пластификаторами и/или пролонгирующими агентами. Покрытая капсула или таблетка могут иметь покрытие на их поверхности или могут быть капсулой или таблеткой, включающей порошок или гранулы, покрытые энтеросолюбильной оболочкой.
Таблетированные композиции могут иметь мало или много компонентов в зависимости от используемого метода изготовления таблеток, желательных скоростей высвобождения и других факторов. Например, композиции настоящего изобретения могут содержать разбавители, такие как материалы на основе производных целлюлозы, как соли порошкообразной целлюлозы, микрокристаллической целлюлозы, сверхчистой целлюлозы, метилцеллюлозы, этилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы и другие замещенные и незамещенные целлюлозы; крахмал; пептизированный крахмал; неорганические разбавители, такие как карбонат кальция и дифосфат кальция, и другие разбавители, известные специалисту в данной области. Еще другие пригодные разбавители включают воски, сахара (например, лактозу) и сахарные спирты, как маннит и сорбитол, полимеры акрилата и сополимеры так же, как пектин, декстрин и желатин.
Другие наполнители, рассмотренные в соответствии с настоящим изобретением, включают связывающие вещества, такие как аравийская камедь, пептизированный крахмал, альгинат натрия, глюкоза и другие связывающие вещества, используемые в способах при влажном и сухом гранулировании и прямом прессовании при изготовлении таблеток; вещества, вызывающие дезинтеграцию, такие как натриевый гликолята крахмала, кросповидон, низкозамещенная гидроксипропилцеллюлоза и другие; смазки как стеарат магния и кальция и стеарилфумарат натрия; ароматизаторы; подслащивающие вещества; консерванты; фармацевтически приемлемые красители и вещества, способствующие скольжению, такие как диоксид кремния.
В одном варианте осуществления гидрохлорид лерканидипина, раскрытый здесь для использования в фармацевтических композициях настоящего изобретения, может иметь D50 и D90 размер частицы меньше, чем около 400 микрон, предпочтительно меньше, чем около 200 микрон, более предпочтительно меньше, чем около 150 микрон, все еще более предпочтительно меньше, чем около 50 микрон и наиболее предпочтительно меньше, чем около 15 микрон. Отмечено, что индекс Dх означает, что X% частиц имеют диаметр меньше, чем указанный диаметр D. Таким образом, D50 около 400 микрон означает, что 50% микронизированных частиц в составе имеют диаметр меньше чем около 400 микрон. Термин «микронизация», используемый в описании, означает любой способ или методы, с помощью которых уменьшают размер частиц. Например, размеры частиц гидрохлорида лерканидипина настоящего изобретения могут быть получены любым размалыванием, дроблением, микронизацией или другим методом сокращения размера частицы, известным в данной области техники, чтобы превратить форму твердого вещества гидрохлорида лерканидипина настоящего изобретения в любой вышеупомянутый желательный диапазон размера частицы. Как также используется здесь, частицы гидрохлорида лерканидипина с уменьшенным размером называются как «микронизированные частицы гидрохлорида лерканидипина» или «микронизированный гидрохлорид лерканидипина».
Фактические уровни дозировки гидрохлорида лерканидипина настоящего изобретения могут быть различны для получения количества гидрохлорида лерканидипина настоящего изобретения, которое является эффективным для получения желательного терапевтического ответа для определенной композиции и метода введения. Выбранный уровень дозировки поэтому зависит от таких факторов как, например, желательный терапевтический эффект, путь введения, желательная продолжительность лечения и другие факторы. Полная суточная доза соединений этого изобретения, которую вводят организму «хозяина» в одиночной или разделенной дозе и может широко изменяться в зависимости от разнообразия факторов, включая, например, массу тела, общее состояние здоровья, пол, диету, время и путь введения, скорость всасывания и экскреции, взаимодействие с другими лекарственными средствами, тяжесть определенных состояний, которые лечат и т.д. Фармацевтические композиции здесь могут быть получены в любой форме высвобождения, например немедленное высвобождение, замедленное высвобождение, регулируемое высвобождение и т.д.
Следующие примеры обеспечивают возможность специалисту в данной области применять изобретение и просто иллюстрируют изобретение. Примеры не должны быть рассмотрены, как ограничение возможностей изобретения, как определено в особенностях и преимуществах.
Экспериментальная часть
Чистоту измеряли при помощи ВЭЖХ при следующих условиях:
Колонка: C8 водная симметрия, 250×4,6 мм, 5 мкм
Температура: 25°C
Подвижная фаза: Буфер: Ацетонитрил (48:52, об/об)
Буфер: 0,15 M перхлорат натрия в воде. Установление pH до 4,0 с 1% перхлорной кислотой
Детектор: UV, 220 нм
Объемная скорость потока: 1,5 мл/мин
Вводимый объем: 20 мкл
Время непрерывной работы: 60 минут
Время удерживания: 15,5 минут
ПРИМЕР 1
Получение гидрохлорида лерканидипина
В 2-литровую 4-горлую круглодонную колбу загружали бутановую кислоту, 2-[(3-нитрофенил)метилен]-3-оксо-2-[(3,3-дифенилпропил)метиламино]-1,1-диметилэтилового эфира гидрохлорид (30 г) в метилендихлориде (39 мл) и н-пропаноле (300 мл) при температуре в пределах от около 25°C до около 30°C. Триэтиламин (15 г) добавляли для установления pH от около 8 до около 9, как проверено при помощи индикаторной бумаги. Добавляли метил 3-аминокротонат (6,28 г). Реакционную смесь нагревали при температуре в пределах от около 75°C до около 80°C и перемешивали в течение около 10 часов. Реакционную смесь охлаждали и н-пропанол отгоняли под вакуумом полностью при температуре в пределах от около 50°C до около 55°C. Осадок растворяли в н-пропаноле (150 мл) при температуре в пределах от около 30°C до около 35°C и затем охлаждали при температуре в пределах от около 25°C до около 30°C. н-Пропанол/HCl (10 мл, 20% HCl) медленно добавляли, поддерживая реакционную смесь при комнатной температуре, чтобы установить pH от около 3 до около 4, как проверено при помощи индикаторной бумаги. Реакционную смесь поддерживали в течение около 30 минут при комнатной температуре, н-пропанол перемешивали с изопропилацетатом (60 мл) при температуре в пределах от около 30°C до около 35°C. Осадок растворяли в изопропилацетате (180 мл) и промывали водой (2×180 мл).
Активированный уголь (3 г) добавляли к органическому слою и перемешивали в течение около 15 минут при температуре в пределах от около 25°C до около 30°C. Органический слой пропускали через подложку с высокой пропускной способностью и промывали изопропилацетатом (30 мл). Изопропилацетат отгоняли полностью под вакуумом при температуре ниже около 35°C и дегазировали в течение около 2 часов при температуре ниже около 35°C. Осадок растворяли в метаноле (15 мл) и изопропилацетате (300 мл) при комнатной температуре. Раствор отбирали с чистым гидрохлоридом лерканидипина в полиморфной форме V (30 г) и перемешивали от около 15 оборотов в минуту до около 18 оборотов в минуту в течение около 24 часов. Твердые частицы отфильтровывали и промывали изопропилацетатом (30 мл). Отфильтрованный осадок весил около 25 граммов. Продукт высушивали в духовом шкафу при температуре в пределах от около 50°C до около 55°C в течение около 8 часов, при котором потеря при высушивании (LOD) была меньше, чем около 10,0%. Высушенный продукт был гидрохлорид лерканидипина, весящий около 15 граммов, с выходом около 42% и чистотой около 98,5%, как определено при помощи ВЭЖХ.
ПРИМЕР 2
Получение полиморфной формы V гидрохлорида лерканидипина
В 2-литровую 4-горлую круглодонную колбу гидрохлорид лерканидипина (110 г; чистота около 98,5%) Примера 1 и метанол (110 мл) добавляли при комнатной температуре, температура в пределах от около 25°C до около 30°C при перемешивании. Реакционную смесь затем нагревали при температуре в пределах от около 50°C до около 55°C и поддерживали в течение около 30 минут. Реакционную смесь затем охлаждали до комнатной температуры. Изопропилацетат (1100 мл) добавляли к охлажденному раствору при комнатной температуре и поддерживали в течение около 16 часов при комнатной температуре со скоростью мешалки от около 60 оборотов в минуту до около 100 оборотов в минуту. Осажденное вещество отфильтровывали и промывали изопропилацетатом (110 мл). Отфильтрованный осадок весил около 132 г.
Продукт высушивали в духовом шкафу при температуре в пределах от около 50°C до около 55°C в течение около 8 часов, при котором LOD был меньше, чем около 10,0%. Высушенный продукт весил около 86,9 граммов с выходом около 79% и чистотой больше, чем около 99,7% как определено при помощи ВЭЖХ. Все индивидуальные примеси были ниже около 0,07% веса.
XRD и ДСК конечного продукта показаны на Фиг.1 и 2, и были зарегистрированы и идентифицированы как полиморфная форма V гидрохлорида лерканидипина.
ПРИМЕР 3
Очистка полиморфной формы V гидрохлорида лерканидипина
В 2-литровую 4-горлую круглодонную колбу гидрохлорид лерканидипина (110 г; чистота около 98,5%) Примера 1 и метанол (110 мл) добавляли при температуре в пределах от около 25°C до около 30°C при перемешивании. Реакционная смесь затем нагревали до температуры в пределах от около 50°C до около 55°C и поддерживали в течение около 30 минут. Холодная вода циркулировала в конденсаторе. Затем осветленную реакционную массу перенесли к комнатной температуре. Это сопровождалось добавлением изопропилацетата (1100 мл) при комнатной температуре и поддерживали в течение около 16 часов от около 60 до около 100 оборотов в минуту. Осажденное вещество отфильтровывали и промывали изопропилацетатом (110 мл). Отфильтрованный осадок весил около 132,0 г.
Продукт высушивали в духовом шкафу при температуре в пределах от около 50°C до около 55°C в течение около 8 часов, при котором LOD был меньше, чем около 10,0%. Высушенный продукт был полиморфной формой V гидрохлорида лерканидипина, весящей около 86,9 г, с выходом около 79% и чистотой больше, чем около 99,7%, как определено при помощи ВЭЖХ. Все индивидуальные примеси были ниже около 0,07% веса.
ПРИМЕР 4
Получение гидрохлорида аморфной формы лерканидипина
В чистую и сухую 2-литровую 4-горлую круглодонную колбу, очищенный гидрохлорид лерканидипина (100,0 г, чистота около 99,7%), полученный в Примере 3 и метанол (1,0 л) загружали при комнатной температуре. Реакционную массу перемешивали при комнатной температуре, пока осветленный раствор не был получен. Активированный уголь (5,0 г) добавляли и перемешивали в течение около 5 минут при комнатной температуре. Реакционную смесь отфильтровывали через подложку с высокой промывной способностью и промывали метанолом (200,0 мл). Осветленный фильтрат собирали в очищенную и высушенную 2-литровую круглодонную колбу. Метанол отгоняли под вакуумом (не меньше, чем 700 мм) полностью при комнатной температуре. Осадок перерастворяли в метаноле (100,0 мл) при комнатной температуре.
В чистую 10-литровую 4-горлую круглодонную колбу диминерализованную (DM) воду (5,0 л), добавляли. Раствор метанола, содержащий осадок, добавляли к воде DM медленно с перемешиванием в течение периода от около 45 минут до около 60 минут при температуре в пределах от около 30°C до около 35°C. Реакционную массу перемешивали в течение около 30 минут при температуре в пределах от около 30°C до около 35°C. Реакционную массу охлаждали до температуры в пределах от около 0°C до около 5°C. Реакционную массу перемешивали при температуре в пределах от около 0°C до около 5°C в течение около 3 часов. Твердые частицы отфильтровывали и промывали с DM водой (200,0 мл). Отфильтрованный осадок весил около 175,0 г.
Затем продукт высушивали в вакуумной печи (вакуум не меньше, чем 700 мм) при температуре в пределах от около 60°C до около 65°C в течение около 8 часов, при котором влагосодержание было ниже 2%. Фиг.3 представляет собой характерный образец рентгеновской порошковой дифрактометрии, показывая, что высушенный продукт был очищенным гидрохлоридом аморфного лерканидипина. Очищенный гидрохлорид аморфного лерканидипина весил около 70,0 грамм с выходом около 70% и чистотой около 99,7% как определено помощи ВЭЖХ.
Понятно, что могут быть сделаны различные модификации вариантов осуществления, раскрытых в настоящем описании. Поэтому вышеупомянутое описание не должно рассматриваться как ограничивающее, а просто как пояснение примерами предпочтительных вариантов осуществления. Например, функции, описанные выше и осуществленные в качестве лучшего способа выполнения настоящего изобретения, приведены только в целях иллюстрации. Другие меры и методы могут быть осуществлены специалистом в данной области техники, не отступая от объема и сущности этого изобретения. Кроме того, специалисты в данной области техники предположат другие модификации в пределах объема и сущности особенностей и преимуществ, предложенных здесь.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛЬ ОМЕКАМТИВА МЕКАРБИЛА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2663663C2 |
| ФОРМА IV ИВАБРАДИНА ГИДРОХЛОРИДА | 2012 |
|
RU2619121C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМОРФНОЙ ФОРМЫ ГИДРОХЛОРИДА СЕРТРАЛИНА | 2003 |
|
RU2310647C2 |
| КРИСТАЛЛИЧЕСКИЕ СОЛЬВАТЫ ГИДРОХЛОРИДА 6-(ПИПЕРИДИН-4-ИЛОКСИ)-2Н-ИЗОХИНОЛИН-1-OHA | 2012 |
|
RU2619129C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-[(3R)-3-МЕТИЛМОРФОЛИН-4-ИЛ]-4-(1-МЕТИЛ-1H-ПИРАЗОЛ-5-ИЛ)-8-(1H-ПИРАЗОЛ-5-ИЛ)-1,7-НАФТИРИДИНА | 2019 |
|
RU2802512C2 |
| КРИСТАЛЛИЧЕСКАЯ ФУМАРАТНАЯ СОЛЬ (S)-[3,4-ДИФТОР-2-(2-ФТОР-4-ЙОДФЕНИЛАМИНО)ФЕНИЛ][3-ГИДРОКСИ-3-(ПИПЕРИДИН-2-ИЛ)АЗЕТИДИН-1-ИЛ]МЕТАНОНА | 2016 |
|
RU2762181C2 |
| Способ получения аморфных форм соединений, обладающих противоопухолевой активностью | 2023 |
|
RU2841137C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА СОЕДИНЕНИЯ ПИРИМИДО [6, 1-а]ИЗОХИНОЛИН-4-ОНА | 2011 |
|
RU2577541C2 |
| БЕЗВОДНАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА КАБАЗИТАКСЕЛА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2014 |
|
RU2672110C2 |
| НОВЫЕ СОЛИ ПРОИЗВОДНЫХ, ОБЛАДАЮЩИХ ПРОТИВОСУДОРОЖНЫМ ДЕЙСТВИЕМ | 2002 |
|
RU2320665C2 |
Изобретение описывает способы очистки гидрохлорида лерканидипина, которые используют бинарные системы спиртосодержащего растворителя такого, как метанол и алифатического эфирсодержащего растворителя, такого как изопропилацетат. А кроме того, описывается гидрохлорид лерканидипина в полиморфной форме V, способы ее получения, а также фармацевтическая композиция для лечения гипертензии, содержащая гидрохлорид лерканидипина в полиморфной форме V. Технический результат: изобретение обеспечивает улучшенную эффективность, поскольку использует экономичные реагенты, уменьшает количество отходов, а также приводит к чистому гидрохлориду лерканидипина. 11 н. и 9 з.п.ф-лы, 1 табл., 3 ил.
1. Способ получения, по существу, чистого гидрохлорида лерканидипина, включающий: (а) растворение гидрохлорида лерканидипина в спиртосодержащем растворителе с получением раствора; (b) добавление алифатического сложного эфирсодержащего растворителя к раствору; и (с) выделение, по существу, чистого гидрохлорида лерканидипина из раствора.
2. Способ по п.1, в котором, по существу, чистый гидрохлорид лерканидипина является свободным от 2-[N-(3,3-дифенилпропил)-N-метиламино]-1,1-диметилэтилпропилового диэфира 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)пиридин-3,5-дикарбоновой кислоты.
3. Продукт, полученный способом по п.1, для получения фармацевтической композиции по п.9, причем продукт содержит гидрохлорид лерканидипина, имеющий чистоту, равную или больше, чем около 98,5%, и один или более фармацевтически приемлемых наполнителей, выбранных из группы, состоящей из буферных веществ, подслащивающих веществ, связывающих веществ, разбавителей, наполнителей, смазок, смачивающих веществ и веществ, вызывающих дезинтеграцию.
4. Гидрохлорид лерканидипина, по существу, в полиморфной форме V и имеющий, по меньшей мере, одну из следующих характеристик: (а) модель дифракции рентгеновских лучей (XRD), по существу, в соответствии с Фигурой 1; и/или (b) термограмма дифференциальной сканирующей калориметрии (ДСК) в соответствии с Фигурой 2.
5. Гидрохлорид лерканидипина, по существу, в полиморфной форме V и показывающий характерные пики (выраженные в градусах 2θ±0,2°θ) приблизительно при одном или большем количестве положений: около 17,2752 и около 19,8836.
6. Гидрохлорид лерканидипина, по существу, в полиморфной форме V и показывающий преобладающий пик эндотермы при около 179,5°С.
7. Гидрохлорид лерканидипина, по существу, в полиморфной форме V по п.4, далее охарактеризованный, показывая характерные пики (выраженные в градусах 2θ±0,2°θ) приблизительно при одном или большем количестве положений: около 11,5702, около 15,1595, около 20,7967, около 21,4870 и около 24,6309.
8. Гидрохлорид лерканидипина, по существу, в полиморфной форме V по п.4, имеющий чистоту, равную или больше, чем около 98,5%.
9. Фармацевтическая композиция для лечения гипертензии, включающая терапевтически эффективное количество гидрохлорида лерканидипина, по существу, в полиморфной форме V по п.4.
10. Фармацевтическая композиция по п.9, в которой гидрохлорид лерканидипина представляет собой микронизированный гидрохлорид лерканидипина, имеющий размер частиц меньше чем около 400 мкм.
11. Способ получения гидрохлорида лерканидипина, по существу, в полиморфной форме V, способ, включающий: (а) растворение гидрохлорида лерканидипина в спиртосодержащем растворителе с получением раствора; (b) добавление алифатического эфирсодержащего растворителя к раствору; и (с) выделение гидрохлорида лерканидипина, по существу, в полиморфной форме V.
12. Способ по п.11, в котором спиртосодержащий растворитель представляет собой ароматический или алифатический C1-C12 спирт, и алифатический сложный эфирсодержащий растворитель имеет от около 2 до около 12 углеродных атомов.
13. Способ по п.12, в котором стадия выделения включает кристаллизацию раствора с получением кристаллов гидрохлорида лерканидипина; и высушивание кристаллов гидрохлорида лерканидипина с получением гидрохлорида лерканидипина, по существу, в полиморфной форме V.
14. Способ по п.13, в котором гидрохлорид лерканидипина, по существу, в полиморфной форме V в дальнейшем преобразуют в гидрохлорид лерканидипина в аморфной форме.
15. Гидрохлорид лерканидипина, по существу, в полиморфной форме V получен способом по п.11.
16. Способ получения, по существу, чистого гидрохлорида лерканидипина, способ, включающий:
(a) реагирование раствора, включающего бутановую кислоту, 2-[(3-нитрофенил)метилен]-3-оксо-2-[(3,3-дифенилпропил)метиламине]-1,1-диметилэтилового эфира гидрохлорид и метилендихлорид, с метил 3-аминокротонатом и н-пропанолом и установление рН раствора от около 8 до около 9 с помощью основания;
(b) отгонка н-пропанола с получением осадка;
(c) растворение осадка в изопропилацетате;
(d) обработка раствора, содержащего изопропилацетат осветляющим веществом с получением осветленного раствора;
(e) концентрирование осветленного раствора с получением концентрированного осветленного раствора;
(f) растворение концентрированного осветленного раствора в метаноле и изопропилацетате;
(g) отбор раствора с гидрохлоридом лерканидипина по существу в полиморфной форме V, и
(h) выделение гидрохлорида лерканидипина по существу в полиморфной форме V.
17. Способ по п.16, далее включающий:
охлаждение реакционной массы до температуры от около 50°С до около 55°С;
отгонка н-пропанола с получением первого осадка;
растворение первого осадка в н-пропаноле,
установление рН реакционной массы, используя н-пропанол/НСl и отгоняя н-пропанол, с получением второго осадка;
растворение второго осадка в изопропилацетате и промывание водой с получением раствора;
очистка раствора активированным углем и отгонка изопропилацетата с получением третьего осадка;
растворение третьего осадка в метаноле и изопропилацетате,
отбор раствора с гидрохлоридом лерканидипина в полиморфной форме V и отфильтровывание твердых частиц; и
высушивание твердых частиц с получением гидрохлорида лерканидипина по существу в полиморфной форме V,
18. Способ получения гидрохлорида аморфного лерканидипина, включающий (а) растворение гидрохлорида лерканидипина, по существу, в полиморфной форме V в органическом растворителе; и (b) выделение гидрохлорида аморфной формы лерканидипина.
19. Способ получения гидрохлорида аморфного лерканидипина, включающий (а) растворение, по существу, чистого гидрохлорида лерканидипина в органическом растворителе; (b) обработка раствора осветляющим веществом с получением осветленного раствора и (с) выделение аморфной формы гидрохлорида лерканидипина.
20. Способ по п.19, далее включающий:
растворение, по существу, чистого гидрохлорида лерканидипина в первом спиртосодержащем растворителе с получением раствора;
обработка раствора активированным углем;
концентрирование раствора;
повторное растворение концентрированного раствора во втором спиртосодержащем растворителе;
добавление воды к раствору;
кристаллизация раствора; и
высушивание продукта стадии (f) с получением аморфной формы гидрохлорида лерканидипина.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| US 5912351 А, 15.06.1999 | |||
| Сбалансированный манипулятор | 1987 |
|
SU1423367A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Устройство для пропитки непрерывно движущегося материала | 1978 |
|
SU685737A1 |
| 0 |
|
SU153016A1 | |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2011-07-27—Публикация
2006-09-18—Подача