Изобретение относится к области медицины, а именно к аллергологии, иммунологии и клинической лабораторной диагностике.
В России аллергическими заболеваниями страдает от 10 до 30% населения [1]. Инфекционно-зависимые формы в структуре аллергических болезней составляют до 75% всех аллергопатологий, в числе которых следует отметить тяжело протекающие болезни: бронхиальную астму, хронические бронхиты, риниты, аллергодерматозы, осложненные инфекцией, нередко приводящие больных к инвалидности [2]. Экономический ущерб от аллергических заболеваний, осложненных инфекцией, чрезвычайно высок из-за многократных ежегодных обострений хронических инфекций у больных.
В основе инфекционно-зависимых форм аллергии лежит гиперреактивность сенсибилизированного организма больного к аллергенам микробов, обитающих на коже и слизистых оболочках носа, зева, бронхов больных [3, 4, 5, 6, 7]. Аллергенные свойства микроба зависят от природы его метаболитов, путей их трансформации внутри организма человека, от специфики взаимосвязей живой микробной клетки с организмом хозяина.
Многообразие способов воздействия микроба на макроорганизм обусловливает сложность решения проблемы аллергенности бактерий и их метаболитов [8]. Ранее исследованиями многочисленных авторов [9, 10], в частности сотрудниками ГНЦ-Института иммунологии ФМБА А.Д.Адо, В.Н.Федосеевой и соавт. 1997-2003 гг., было показано, что стафилококки играют важную роль в патогенезе инфекционно-зависимых форм аллергии. Была доказана возможность формирования гиперчувствительности немедленного типа у больных респираторно-аллергическими заболеваниями, атопическими дерматитами на аллергены стафилококка. Последнее является важным критерием назначения больным аллерген-специфической иммунотерапии аллерговакцинами из стафилококка [11] и последующей тактики ведения больных с немедленным типом аллергии к стафилококку.
Предлагаемая тест-система ИФА позволяет в условиях «ин витро» выявлять специфическое связывание IgE-антител в сыворотках крови пациентов, сенсибилизированных аллергенами стафилококка, и является необходимым дополнением как при клинико-лабораторной диагностике стафилококковой аллергии, так и при разработке стратегии ее аллерген-специфической иммунотерапии.
Существующие коммерческие тест-системы ИФА стафилококковой специфичности позволяют лишь определить наличие в организме человека стафилококковой инфекции, не выявляя специфического IgE-ответа на стафилококковые аллергены. В связи с этим в настоящее время в современной «ин витро»-диагностике стафилококковой аллергии указанный тест ИФА отсутствует. Возможно это объясняется тем, что длительный период времени основное внимание исследователей уделялось изучению механизмов иммунотоксических эффектов при действии на организм стафилококковых энтеротоксинов, а стафилококк - в качестве источника аллергенов, стимулирующих специфический IgE-ответ, рассматривался в качестве теоретических разработок лишь в единичных работах [9, 4, 12].
В последние годы появилась серия работ, подтверждающих участие стафилококковых суперантигенов в патогенезе аллергических заболеваний, в частности в стимуляции синтеза IgE-антител. При этом доказана связь аллергии к стафилококку с I (немедленным) типом аллергических реакций [13]. Это, в свою очередь, свидетельствует о необходимости применения рассматриваемой тест-системы ИФА при “ин витро”-диагностике аллергии немедленного типа к стафилококку [14, 4, 6, 15, 16].
Авторы не обнаружили в уровне техники аналог-прототип, наиболее близкий к заявленному изобретению, поскольку нами впервые была поставлена задача разработки технологии получения тест-системы ИФА для определения специфических IgE-антител к стафилококку в сыворотках крови больных аллергическими заболеваниями, имеющих гиперчувствительность к аллергенам стафилококка, и диагностики аллергии к стафилококку с использованием указанной тест-системы.
Использование настоящего изобретения позволяет определить специфические IgE-антитела к стафилококку в сыворотке крови больного аллергическими заболеваниями с помощью заявляемой тест-системы, обладающей высокой чувствительностью, и повысить эффективность диагностики аллергии к стафилококку.
В соответствии с настоящим изобретением тест-система ИФА для определения специфических IgE-антител к стафилококку в сыворотке крови больного аллергическими заболеваниями, имеющего гиперчувствительность к аллергенам стафилококка, включает планшеты одноразового применения с иммобилизованной активной аллергенной субстанцией (AAC), выделенной из стафилококка, на стрипах; AAC St. aureus; положительный и отрицательный контроли (сыворотки); конъюгат анти-IgE-антител; твин-20; буфер с добавлением Твина (pH 7,0-7,2) для приготовления раствора для отмывок; цитратный буфер (pH 4,7) для приготовления рабочего раствора; ортофенилендиамин (ОФД) в виде таблеток 0,0002 г и пергидроль H2O2 - 37% - для приготовления красящего раствора; H2SO4 в качестве стоп-раствора; и инструкцию по использованию набора. При этом AAC состоит из трех активных фракций с молекулярными массами 50, 130 и 170 кДа.
Вторым объектом изобретения является способ определения специфических IgE-антител к стафилококку в сыворотке крови больного аллергическими заболеваниями, имеющего гиперчувствительность к аллергенам стафилококка. Указанный способ включает следующие стадии: подготовку твердой фазы (планшет) для сорбции AAC с использованием КББ - карбонатно-бикарбонатного буфера (pH 9,5); нанесение раствора AAC в лунки планшета; инкубацию AAC на твердой фазе в холоде при 2-4°C в течение 2 суток; отмывание буфером (pH 7,0-7,2) трижды, подсушивание; нанесение контрольных и испытуемых сывороток в лунки соответствующих стрипов с 50 мкл буфера (pH 7,0-7,2); инкубацию в термостате при 37°C в течение 2,5 часов; отмывание буфером (pH 7,0-7,2) трижды, подсушивание стрипов; нанесение раствора конъюгата во все лунки стрипов; инкубацию в холоде при 2-4°C в течение 18-20 часов; нанесение красителя ОФД в цитратном буфере (pH 4,7) во все лунки стрипов; нанесение во все лунки стоп-раствора; контроль реакции ИФА по оптической плотности во всех образцах при длине волны 492 нм на Мультискане.
Следующим объектом изобретения является способ диагностики стафилококковой аллергии, включающий определение специфических IgE-антител к стафилококку в сыворотке крови больного с использованием вышеуказанного способа, причем позитивная реакция оценивается 2-4 классом.
1. МАТЕРИАЛЫ И МЕТОДЫ
1. Подбор и паспортизация опытных штаммов стафилококка для получения аллергенной субстанции осуществлялась на основе идентификации видовых признаков штаммов стафилококка, выделенных от больных бронхиальной астмой и атопическим дерматитом стафилококкового генеза, на базе бактериологической лаборатории ГФБУ Институт иммунологии ФМБА, Отдела живых культур ГИСКа им Л.А.Тарасевича Роспотребнадзора с учетом морфологических, культуральных и биохимических характеристик.
1.2 Создание банка специфических сывороток с высокой IgE-связывающей активностью с аллергенами стафилококка осуществлялось на основе клинико-лабораторного обследования больных респираторно-аллергическими заболеваниями и атопическим дерматитом (АД), осложненными стафилококковой инфекцией отделения НКО (зав. проф. Л.В.Лусс) и отд. аллергологии и иммунопатологии кожи (зав. проф. Феденко Е.С.). Обследовано 47 больных с бронхиальной астмой и 12 чел. с АД, осложненными стафилококковой инфекцией (всего 59 чел.). Банк специфических сывороток составил 15 образцов с интенсивностью ИФА в специфическом IgE-связывании со стафилококковым аллергеном 2-4 класса.
1.3 Получение аллергенной фракции производили по методу выращивания культур на питательных средах, покрытых целлофановыми дисками [9] с последующей обработкой суспензии клеток стафилококка в ультразвуковом дезинтеграторе. Дробление стафилококковых клеток проводили с помощью ультразвукового дезинтегратора UD-20 фирмы Techpan (Польша) при рабочей частоте 22±1,65 кГц и выходной мощности 180 Вт. Дезинтегрирование проходило в течение 45 мин. Неразрушенные фрагменты микробных клеток осаждали центрифугированием, осадок удаляли. Определяли чистоту и однородность декантата, содержание белка по Кьельдалю, которое составило 0,5 мг/мл. Разделение белковых фракций в надосадочной жидкости проводили методом электрофореза в полиамилакридном геле с использованием камеры для электрофореза SE 300 mini VE фирмы Hoefer (США). Фракции с молекулярной массой 170, 130 и 50 кДа показали наивысшую степень специфического IgE-связывания в иммуноблоте. Выделение указанных фракций осуществляли методом гель-фильтрации с использованием Сефадекса G-100 фирмы Pharmacia (Швеция) на колонке фирмы LKB (Швеция) размером 3><48 см (V=340 мл). Элюцию вели 0,04 М Na-фосфатным буфером, объем препарата 1,5 мл [19]. Фракции Мм - 50, 130 и 170 рассматривались в качестве основных при создании AAC для тест-системы.
1.4 Оценка активных аллергенных фракций (AAC) проводилась на основе специфического IgE-связывания с тест-образцами «банка» сывороток методами ИФА и ингибиции ИФА.
1.5 Сорбция AAC на твердой фазе (планшеты разборные, одноразового применения, высокой сорбции, для иммунологического и биохимического исследований, модифицированные, производства ГУП ГОС НИИ «Биомедикал») осуществлялась в соответствии с методом В.Н.Федосеевой и соавт., 1993 [20].
1.6 Контроль интенсивности специфического IgE-связывания с экспериментальными образцами аллергенов осуществлялся в сравнительном анализе интенсивности реакций ИФА с коммерческим препаратом РУЗАМ, и энтеротоксином В в ИФА на анализаторе ImmunoCAP, Phadia и Multiscan МС.
1.7 Апробацию разработанной тест-системы ИФА осуществляли в клинико-лабораторных исследованиях при обследовании больных аллергическими заболеваниями и здоровых лиц, обращавшихся в Клинику ФГБУ «ГНЦ Институт иммунологии» ФМБА России.
В рамках настоящего изобретения разработана система «ин витро»-диагностики аллергии к стафилококку, на основе оригинальной аллергенной субстанции стафилококка (AAC), получение которой и применение в тест-системе требовало выполнения самостоятельного раздела работы, связанного с выделением активных штаммов стафилококка, их паспортизацией, получения AAC, с оценкой специфичности AAC, подбором условий фиксации аллергенной субстанции на твердой фазе и др.
2. РЕЗУЛЬТАТЫ
2.1 Подбор и паспортизация опытных штаммов стафилококка для получения AAC
Идентификацию чистой культуры стафилококка производили на основании изучения морфологии колоний, продукции коагулазы, гемолизина, способности окислять углеводы в аэробных условиях, изучения их чувствительности к антибиотикам [5]. Задача подбора активных экспериментальных штаммов стафилококка выполнялась сотрудниками лаборатории №87 и КДЛ (ФГБУ ГНЦ Институт иммунологии ФМБА России) [21]. Выбор видовой специфичности стафилококка определялся результатами наших предшествующих работ, в которых показана значимость St. aureus в процессах сенсибилизации больных аллергическими заболеваниями [1, 3]. Были выделены от больных штаммы стафилококка и отправлены для идентификации в Отдел живых культур ГИСКа им Л.А.Тарасевича. Указанные штаммы Staphylococcus aureus на желточно-молочно-солевом агаре образуют однородную популяцию мелкозернистых, гладких, круглых, блестящих колоний с ровными краями, ярко выраженным золотистым пигментом и характерными зонами накопления лецитоветилазы. На кровяном агаре мелкозернистые колонии серого цвета с гамма-гемолизом. При исследовании мазков культуры под микроскопом обнаружены типичные грамположительные кокки, расположенные поодиночке, парами, неправильными скоплениями в виде гроздей винограда.
Стафилококки выделяют ряд экзотоксинов: гемолизины, разрушающие эритроциты человека, эксфолиатины A и B, вызывающие синдром «ошпаренной кожи», токсин синдрома TSST-1 (синдром токсического шока), лейкоцидин, оказывающий цитотоксическое действие на полиморфноядерные лейкоциты, а также энтеротоксины A-F, вызывающие пищевую интоксикацию.
Среди компонентов клеточной стенки следует выделить тейхоевые кислоты, стимулирующие воспалительную реакцию организма и усиливающие адгезию бактерий к эпителиальной поверхности, а также белок A (агглютиноген), активирующий систему комплемента, что приводит к проявлению местных и системных симптомов анафилаксии, угнетению активности фагоцитоза.
Идентифицированы по свойствам (морфологическим и культуральным) образцы аллергоактивных экспериментальных штаммов стафилококка, выделенных из патологического материала, произведена их лиофилизация.
- штамм №1 Staphylococcus aureus (больной из отделения бронхиальной астмы Института иммунологии) - «Ивашкин» (штамм выделен из бронхов),
- штамм №2 Staphylococcus aureus (больной из отделения бронхиальной астмы Института иммунологии) - «Петров М.М.»,
- штамм №3 Staphylococcus hyic.
Образец паспорта штамма «Ивашкин»
1. Номер штамма ГКПМ - 201204.
2. Название штамма - Staphylococcus aureus.
3. Особенности штамма - “Ивашкин”.
4.Получен ФГБУ “ГНЦИнститут иммунологии” ФМБА России.
5. Дата получения 2009 г.
6. Условия культивирования штамма (среда, температура и т.д.) - МПА, МПБ, агар Хоттингера, бульон Хоттингера; t=37°C; 18-24 ч.
7. Характеристика - морфологические и биохимические свойства типичные.
Выделение аллергенной субстанции (AAC) из стафилококка
Иммунологически активные белки бактериальных клеток Staphylococcus aureus и их экзогенных метаболитов выделяли на основе селекции высокоаллергенных штаммов и специальной технологии получения безбалластных бактериальных суспензий, с последующей их модификацией. Выделение и модификация бактериальных белков Staphylococcus aureus осуществлялись физико-химическими методами с применением дезинтеграции бактериальных клеток. Разделение белковых фракций в надосадочной жидкости проводили методом электрофореза в полиакриламидном геле с использованием камеры для электрофореза SE 300 mini VE фирмы Hoefer (США). Фракции с молекулярной массой 170, 130 и 50 показали наивысшую степень специфического IgE-связывания в иммуноблоте. Дальнейшее выделение указанных фракций осуществляли методом гель-фильтрации с использованием Сефадекса G-100 фирмы Pharmacia (Швеция) на колонке фирмы LKB (Швеция) размером 3×48 см (V=340 мл). Элюцию вели 0,04 М Na-фосфатным буфером, объем препарата 1,5 мл [19]. Фракции Ф-50, Ф-130 и Ф-170 рассматривались в качестве основных при создании тест-системы.
Получены три активные фракции 50, 130 и 170 кДа, которые объединены в одну активную аллергенную субстанцию - AAC.
2.2 Создание “банка” IgE-специфических сывороток к стафилококку
Исследования проводили с образцами «банка» сывороток крови с повышенным содержанием в них специфических IgE-антитетел к аллергену Staphylococcus aureus. Отбор позитивных образцов осуществлялся при обследовании сывороток больных с гиперчувствительностью к стафилококку методом ИФА (в соответствии с лицензией, выданной МЗ РФ ГНЦ «Институт иммунологии» ФМБА России на клинические исследования лекарственных средств сер. ФС-1, №99-01-002274 от 2 августа 2005 г., госуд. регистр. №1037739310113) [8].
Для выполнения задач 1-го этапа исследований 2009 года был сформирован «банк» сывороток крови больных аллергическими заболеваниями с сенсибилизацией к Staphylococcus aureus. Гиперчувствительность к аллергенам стафилококка устанавливалась на основе клинической картины заболевания и результатов кожно-аллергических тестов к стандартной стафилококковой вакцине ВПТ-4.
2.3 Стандартизация AAC осуществлялась согласно 1-му этапу Программы EAACI по оценке гетерогенных экстрактов аллергенного источника (ЭАИ) [22]. В соответствии с требованиями Программы EAACI охарактеризованы:
- источник аллергенной субстанции, ее подлинность, специфичность,
- содержание белка в мл AAC,
- степень специфического IgE-связывания AAC. Характеристика фракций AAC:
- штаммы St. (паспортизованы, см. выше),
- содержание белка в AAC составило 0,5 мг/мл,
- специфическое IgE-связывание с образцами «банка» сывороток - 2-4 класс реакции ИФА.
2.4 Сравнительный анализ специфической активности AAC с препаратом Рузам
Сравнительная оценка специфического IgE-связывания с AAC и Рузам осуществлялась в ИФА с образцами банка сывороток. С этой целью на полистироловые планшеты наносили соответственно:
- AAC Staphylococcus aureus, полученный в Институте иммунологии ФМБА России;
- аллерген Рузам производства Брынцалов-А (Россия), НИИ пульмонологии МЗИМП РФ (Россия), Рузам-М (Россия);
Контроль - нулевая сыворотка, не содержащая специфических IgE-антител к стафилококку.
Класс реакции (M±m)
Из таблицы 1 видно, что образец AAC St. aureus, полученный в Институте иммунологии, обладает специфической активностью.
Уровни связывания специфических IgE-антител в сыворотках крови больных с гиперчувствительностью к Staphylococcus aureus с испытуемой AAC из Staphylococcus aureus составили 3,2±0,2 (класс ИФА), что подтверждает специфическую активность AAC. Препарат Рузам - менее активен.
2.5 Разработка экспериментального технологического процесса изготовления на основе ЛАС тест-системы ИФА для определения IgE-антител в сыворотках крови больных с гиперчувствительностью к аллергенам стафилококка
Для определения аллерген-специфических IgE-антител был отработан оптимизированный метод твердофазного ИФА на основе конъюгатов, меченных пероксидазой хрена (ООО “Полигност”, Санкт-Петербург) с тестированием планшет сборных, одноразового применения, различной сорбции для иммунологических исследований. Тест-система модифицирована для определения IgE-антител на стрипах с иммобилизованными аллергенами (1 стрип - 8 ячеек) ЗАО «БиоХимМак».
Были выявлены оптимальные условия связывания AAC Staphylococcus aureus на планшетах разной степени сорбции аллергенов. Найдены критерии оптимальной фиксации препарата и максимальной интенсивности специфического IgE-связывания, что использовано на разных этапах выполнения работ.
Проведена оценка специфической активности разработанной тест-системы ИФА.
Сформулированы требования к тест-системе ИФА на основе AAC:
- AAC должна обладать способностью взаимодействовать со специфическими к St. aureus IgE -антителами контрольной положительной сыворотки (положительный контроль). Образуемый комплекс выявляется пероксидазным конъюгатом моноклональных анти-IgE-антител, образующих цветное окрашивание с субстратной смесью. Определение проводят твердофазным иммуноферментным анализом (ИФА) [23].
Определение считают удовлетворительным, если положительная контрольная сыворотка при взаимодействии с испытуемыми образцами Staphylococcus aureus дает цветное окрашивание, оптическая плотность которого выше оптической плотности контрольной отрицательной сыворотки
Пример технологического процесса (ТП)
ТП-1 - подготовка твердой фазы (планшет) для сорбции AAC с использованием КББ (pH - 9,25);
ТП-2 - нанесение раствора AAC в лунки планшета;
ТП-3 - инкубация AAC на твердой фазе в холоде при 2-4°C в течение 2 суток;
ТП-4 - отмывание буфером (pH 7,0-7,2), подсушивание;
ТП-5 - нанесение контрольных и испытуемых сывороток в лунки соответствующих стрипов с 50 мкл буфера (pH 7,0-7,2);
ТП-6 - инкубация в термостате при 37°C в течение 2,5 часов;
ТП-7 - отмывание буфером (pH 7,0-7,2), подсушивание стрипов;
ТП-8 - нанесение раствора конъюгата во все лунки стрипов;
ТП-9 - инкубация в холоде при 2-4°C в течение 18-20 часов;
ТП-10 - отмывание буфером (pH 7,0-7,2), подсушивание стрипов;
ТП-11 - нанесение красителя ОФД в цитратном буфере (pH 4,7) во все лунки стрипов;
ТП-12 - нанесение во все лунки стоп-раствора;
ТП-13 - контроль реакции ИФА по оптической плотности во всех образцах при длине волны 492 в Мультискане.
2.6 Апробация разработанной тест-системы ИФА в клинико-лабораторных исследованиях
Было собрано 26 сывороток крови больных с респираторно-аллергическими заболеваниями и атопическим дерматитом, осложненными стафилококковой инфекцией. Показано, что сыворотки 81% пациентов с гиперчувствительностью к St.aureus показали положительную реакцию с AAC в тест-системе ИФА (2-4 класс реакции) при сравнении с позитивным и негативным контролями.
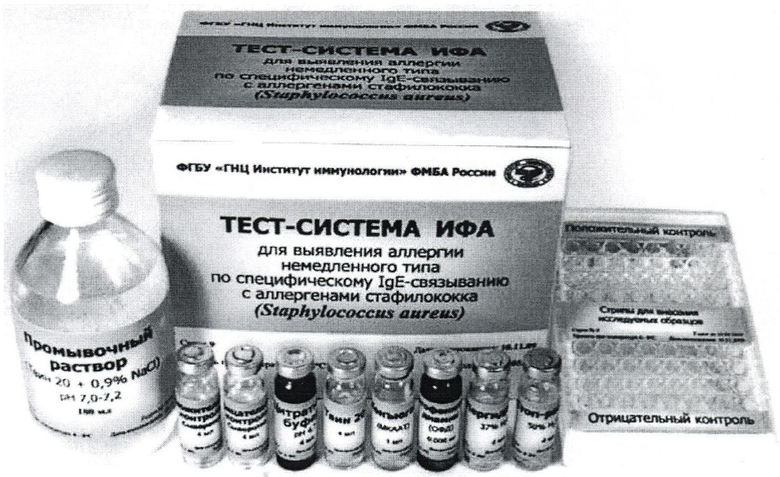
На основании проведенной работы разработана Инструкция по применению тест-системы ИФА для диагностики аллергии к стафилококку и макет тест-системы (см. иллюстрации).
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ТЕСТ-СИСТЕМЫ ИФА ДЛЯ ДИАГНОСТИКИ АЛЛЕРГИИ К СТАФИЛОКОККУ
Назначение: тест-система ИФА на основе AAC St.aureus предназначена для выявления специфических к стафилококку IgE-антител в сыворотках крови больных аллергическими заболеваниями, осложненными стафилококковой инфекцией.
Область применения: данная диагностическая система может быть использована для выявления аллергии к стафилококку.
Принцип определения: на основе активной аллергенной субстанции стафилококка (AAC) проводится скрининговый ИФА для выявления специфических IgE-антител к стафилококку у больных аллергическими заболеваниями, осложненными стафилококковой инфекцией.
Комплект тест-системы включает:
- планшеты одноразового применения (тест-система модифицирована для определения IgE-антител на стрипах с иммобилизованной AAC (1 стрип - 8 ячеек) ЗАО «БиоХимМак»),
- AAC St. aureus,
- положительный контроль (сыворотка),
- отрицательный контроль (сыворотка),
- конъюгат анти-IgE-антител,
- твин - 20,
- буфер с добавлением Твина (pH 7,2) (для отмывания, рабочий раствор),
- цитратный буфер (pH 4,7) - рабочий раствор,
- ортофенилендиамин (ОФД), таблетки 0,002 г,
- пергидроль H2O2 - 37%,
- H2SO4 - 50% (стоп-раствор),
- Инструкция по использованию набора.
Оборудование:
1. Набор автоматических дозаторов переменного объема «Biohit».
2. Холодильник с морозильной камерой на -20°C.
3. Стерильные наконечники.
4. Пробирки типа «Эппендорф» на 1,5 мл.
5. Центрифуга ЦЛ1/3.
6. Мультискан (Multiskan EX, Thermo Labsystems).
7. Термостат TC-80M-2.
8. Мешалка Titertek.
9. Иономер универсальный ЭВ-74.
10. Планшеты разборные, одноразовые, модифицированные, высокой сорбции (производства ГУП ГОС НИИ «Биомедикал»).
Проведение анализа
- В лунки планшета вносят по 100 мкл карбонатного буфера.
- В каждую лунку добавляют 20 мкл AAC.
- Планшет помещают на 2 суток в холодильник.
- Отмывание несвязавшегося AAC проводят 3 раза буфером (pH 7,2).
- Во все лунки стрипов вносят по 50 мкл буфера pH 7,2, а затем:
- в стрип №1 - 50 мкл положительного контроля - позитивная сыворотка, содержащая IgE-антитела к стафилококку, с реакцией в ИФА - 2-4 класса.
- В стрип №2 - 50 мкл исследуемых сывороток крови, содержащих IgE-антитела к стафилококку.
- В стрип №3 - 50 мкл сывороток крови, не содержащих IgE-антитела к стафилококку,
- отрицательный контроль, на 2-3 часа все стрипы, прикрыв крышкой, помещают в термостат при t=37°C.
- Планшет вынимают, отмывают буфером (pH=7,2) 3 раза.
- Заливают во все лунки каждого стрипа по 100 мкл рабочего раствора конъюгата и выдерживают в холодильнике 18-20 часов.
- Вынимают из холодильника и отмывают 3-4 раза буфером (pH 7,2), просушивают.
- Добавляют во все лунки стрипов по 100 мкл краски ОФД (рабочий субстрат), выдерживают в темноте 10-15 минут.
- Реакцию останавливают добавлением во все лунки стрипов по 100 мкл 50% р-ра H2SO4.
- Результаты считывают на Мультискане (при длине волны 492 нм).
Результаты измерений сравнивают с показателями в позитивном и негативном контролях, позитивная реакция оценивается 2-4 классом.
Примеры осуществления способа диагностики
1. Пациентка Максимова И.В., 33 г. На протяжении 4 лет принимает противоаллергическую терапию без эффекта. Пациентке провели определение специфических IgE-антител к стафилококку в сыворотке крови заявленным способом. Определился 4 класс реакции, что явилось показанием к назначению специфической иммунотерапии стафилококковой иммуновакциной.
2. Пациентка Худуева Е.Ю., 47 л. Практически всю жизнь страдает от аллергии. Принимает лечение, часто без эффекта. Заявленным способом определили 4 класс реакции, что явилось показанием к назначению специфической иммунотерапии стафилококковой иммуновакциной.
3. Пациент Кларк М., 13 лет. Определили 3 класс реакции, что явилось показанием к назначению специфической иммунотерапии стафилококковой иммуновакциной.
4. Пациент Киреев C., 2 года. Определили 2 класс реакции, что явилось показанием к назначению специфической иммунотерапии стафилококковой иммуновакциной.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ.
1. Адо А.Д. “Общая аллергология”, М., 1978, 464 с.
2. Фрадкин В.В. «Диагностические и лечебные аллергены», М., Мед., 1990, 256 с.
3. Беклемишев Н.Д., Суходоева Г.С.«Аллергия к микробам в клинике и эксперименте», М., Мед., 1990, 262 с.
4. Елисютина О.Г., Феденко Е.С.Staphylococcus aureus в патогенезе атопического дерматита. Рос., аллергологический ж., 2004, №1, с.17-21.
5. Мокроносова М.А. «Влияние золотистого стафилококка и дрожжеподобных грибов на течение атопического дерматита». Дисс. докт. мед. наук. М., 1999 г.
6. Федосеева В.Н., Молотилов Б.А., Ларина О.Н., Федоскова Т.Г. «Бактериальная аллергия», Пенза, ЧТ Тугушева, 2004, 214 с.
7. Хутуева С.Х. Бронхиальная астма. Нальчик, 1988, с.127.
8. Государственная Фармакопея СССР, XI, 1, 2, М., 1998.
9. Федосеева В.Н., Камышева В.А., Ларина О.Н. «Способ получения бактериальных аллергенов», Рос. Гос. Регистрация №2183970 от 27.06.2002 г.
10. A.Oehling, “Бактериальная инфекция в этиологии бронхиальной астмы”, Патофиз. и эксп. терапия, 1999, №1, стр.6-11.
11. Reha CM, Ebru А “Specific immunotherapy is effective in the prevention of new sensitivities.” Allergol Immunopathol (Madr) 2007; v35; N 2, p.44-51.
12. Gould H J et al. “The allergic march from St. aureus superantigens to IgE”, Allergy, 2007, 93, 106-136.
13. Gisch K, Gehrke N. “Formalin-fixed Staphylococcus aureus et al particles preven allergic sensitization of type I allergy”. Int Arch allergy Immunol, 2007, v 144 (3) p.183-196.
14. Taskapan M.J., Kumar P. «Role о staphylococcal superantigens in atopic dermatitis, Ann Allergy Asthma Immunol, 2000, V. 84(1) p 3-10; p.11-2.
15. Cardona I.D., et al. “Role of bacterial superantigens in atopic dermatis. Am J. Clin Dermatol. 2006, 7(5), p.273-79.
16 Lin YT, Wang C.T. et al «Role bacterial pathogens in atopic Dermatitis»/ Clin Rev Allergy Immunol., 2007 v 33 (3) p.167-177.
17. Guerin В Purification ana standatdization of allergens. “Rev. Med Suisse Romande, 1994, v 114, N 3, p.251-254.
18. Правила доклинической оценки безопасности фармакологических средств (GLP), Москва, 1992 г.
19. Siegel LM., Monty K J. Determination of molecular weights and frictional ration of proteins in impure systems by use of gel filtration and dtnsity gradient centrifugation. Application to crude preparations of sulfite and hidroxylamine reductases. Biochim. et biophis. acta, 1966, 112, p.346-362.
20. В.Н.Федосеева, Г.В.Порядин и др. “Руководство по иммунологическим и аллергологическим методам в гигиенических исследованиях”, М., «Промедек», 1993, 319 с.
21. «Методические рекомендации по контролю иммунобиологических препаратов. Фармакопейная статья» - ФС-42., М., МЗ РФ, 2005 г.
22. «Программа EAACI по стандартизации аллергенов», ALLERGI, 2004, 59, 571-574.
23. Федосеева В.Н., Кудрина Г.П.(ред). Методические рекомендации по оценке аллергенных свойств фармакологических средств. М.: МЗ, 1988, 22 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЛЛЕРГОТРОПИН ДЛЯ ЛЕЧЕНИЯ ПОЛИНОЗОВ И СПОСОБ ЛЕЧЕНИЯ ПОЛИНОЗОВ | 2001 |
|
RU2205661C2 |
| АЛЛЕРГОИД ИЗ ЯДА ПЧЕЛ ДЛЯ АЛЛЕРГЕН-СПЕЦИФИЧЕСКОЙ ИММУНОТЕРАПИИ БОЛЬНЫХ С АЛЛЕРГИЧЕСКИМИ РЕАКЦИЯМИ НА УЖАЛЕНИЕ ПЧЕЛАМИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2279888C1 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИАЛЬНЫХ АЛЛЕРГЕНОВ | 2001 |
|
RU2183970C1 |
| АЛЛЕРГОТРОПИНЫ ДЛЯ ЛЕЧЕНИЯ АЛЛЕРГИИ, ВЫЗЫВАЕМОЙ КЛЕЩАМИ ДОМАШНЕЙ ПЫЛИ | 2013 |
|
RU2548727C2 |
| СПОСОБ ДИАГНОСТИКИ IN VITRO СПЕЦИФИЧЕСКОЙ СЕНСИБИЛИЗАЦИИ ОРГАНИЗМА К БАКТЕРИАЛЬНЫМ АЛЛЕРГЕНАМ | 2014 |
|
RU2587327C2 |
| Способ получения аллергоида на основе пчелиного яда для проведения аллерген-специфической иммунотерапии | 2019 |
|
RU2731509C1 |
| Штамм "SAU-21Л" бактерий Staphylococcus aureus для изготовления биопрепаратов для специфической профилактики мастита коров | 2023 |
|
RU2820305C1 |
| КОМПЛЕКСНЫЙ ПРЕПАРАТ НА ОСНОВЕ АЛЛЕРГЕНОВ ПЫЛЬЦЫ БЕРЕЗЫ И МУРАМИЛПЕПТИДОВ | 2012 |
|
RU2537225C2 |
| СПОСОБ ДИАГНОСТИКИ АЛЛЕРГИИ К КОНКРЕТНОМУ АЛЛЕРГЕНУ | 2002 |
|
RU2222814C1 |
| СПОСОБ ДИАГНОСТИКИ СТАФИЛОКОККОВОЙ АЛЛЕРГИИ ПРИ АЛЛЕРГИЧЕСКОМ РИНИТЕ | 2013 |
|
RU2555352C1 |
Изобретение относится к области медицины, а именно к иммунологии и аллергологии. Изобретение обеспечивает тест-систему ИФА для определения специфических IgE-антител к стафилококку в сыворотке крови больного аллергическими заболеваниями, имеющего гиперчувствительность к аллергенам стафилококка; способ определения специфических IgE-антител к стафилококку в сыворотке крови больного аллергическими заболеваниями, имеющего гиперчувствительность к аллергенам стафилококка, с применением указанной тест-системы; и способ диагностики стафилококковой аллергии. Применение заявленного изобретения позволяет выявить аллергию на стафилококк. 4 н. и 8 з.п. ф-лы, 1 ил., 2 табл.
1. Тест-система ИФА для определения специфических IgE-антител к стафилококку в сыворотке крови больного аллергическими заболеваниями, имеющего гиперчувствительность к аллергенам стафилококка, включающая планшеты одноразового применения с иммобилизованной активной аллергенной субстанцией (ААС), выделенной из стафилококка, на стрипах; ААС St. aureus; положительный и отрицательный контроли (сыворотки); конъюгат анти-IgE-антител; твин-20; буфер с добавлением Твина (рН 7,0-7,2) для приготовления раствора для отмывок; цтратный бефер (рН 4,7) для приготовления рабочего раствора; ортофенилендиамин (ОФД) в виде таблеток 0,0002 г и пергидроль H2O2 - 37% - для приготовления красящего раствора; H2SO4 в качестве стоп-раствора; и инструкцию по использованию набора.
2. Активная аллергенная субстанция (ААС), выделенная из стафилококка, которая состоит из трех активных фракций с молекулярными массами 50, 130 и 170 кДа.
3. Способ определения специфических IgE-антител к стафилококку в сыворотке крови больного аллергическими заболеваниями, имеющего гиперчувствительность к аллергенам стафилококка, с применением тест-системы по п.1, включающий подготовку твердой фазы (планшет) для сорбции ААС с использованием КББ (рН 9,5); нанесение раствора ААС в лунки планшета; инкубацию ААС на твердой фазе в холоде при 2-4°С в течение 2 суток; отмывание буфером (рН 7,0-7,2) трижды, подсушивание; нанесение контрольных и испытуемых сывороток в лунки соответствующих стрипов с 50 мкл буфера (рН 7,0-7,2); инкубацию в термостате при 37°С в течение 2,5 ч; отмывание буфером (рН 7,0-7,2) трижды, подсушивание стрипов; нанесение раствора конъюгата во все лунки стрипов; инкубацию в холоде при 2-4°С в течение 18-20 ч; нанесение красителя ОФД в цитратном буфере (рН 4,7) во все лунки стрипов; нанесение во все лунки стоп-раствора; контроль реакции ИФА по оптической плотности во всех образцах при длине волны 492 нм на Мультискане.
4. Способ по п.3, в котором планшетом является одноразовый планшет с высокой сорбцией.
5. Способ по п.3, в котором ААС является AAC St. aureus.
6. Способ по п.3, в котором промывочный раствор содержит натрия хлорид, Твин 20, дистиллированную воду.
7. Способ по п.3, в котором раствор конъюгата получают путем помещения конъюгата, представляющего собой моноклональные антитела против эпсилон-цепи IgE человека, в буфер натриевой соли - Твин 20.
8. Способ по п.3, в котором цитратный буфер содержит лимонную кислоту 0,1 М, натрий фосфорнокислый однозамещенный 0,2 М, натрий фосфорнокислый двузамещенный 0,2 М, дистиллированную воду.
9. Способ по п.3, в котором красящий раствор получают путем растворения в цитратном буфере 1 таблетки ортофенилендиамина, с последующим внесением пергидроля 37%.
10. Способ по п.3, в котором стоп раствором является серная кислота (H2SO4) 50%.
11. Способ диагностики стафилококковой аллергии, включающий определение специфических IgE-антител к стафилококку в сыворотке крови больного с использованием способа по п.2, причем позитивная реакция оценивается 2-4 классом.
12. Способ по п.11, в котором стафилококковой аллергией является аллергия немедленного типа.
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФАГОЦИТОВ ПРИ АЛЛЕРГИИ | 2002 |
|
RU2225984C1 |
| СПОСОБ ДИАГНОСТИКИ СТАФИЛОКОККОВОЙ ИНФЕКЦИИ | 1998 |
|
RU2144190C1 |
| РОССИЙСКИЙ АЛЛЕРГОЛОГИЧЕСКИЙ ЖУРНАЛ., 2004, №1, с.17-21 ФЕДОСЕЕВА В.Н | |||
| и др | |||
| БАКТЕРИАЛЬНАЯ АЛЛЕРГИЯ | |||
| - Пенза, ЧТ | |||
| Тугушева, 2004, 214 с. | |||
Авторы
Даты
2011-12-10—Публикация
2010-03-25—Подача