Изобретение относится к пищевой промышленности, а именно к способу количественного анализа полисахарида, выделяемого молочнокислыми бактериями, в кефире, кефирной закваске, кефирных грибках, йогурте и других продуктов, полученных с использованием брожения молочнокислой закваски или кефирных грибков.
Количество полисахарида в молочнокислых продуктах может стать регламентным показателем, поскольку эти полисахариды обладают целым рядом полезных свойств. Они способствуют снижению кровяного давления и уровня холестерина в крови, также проявляют иммуномодулирующее, противоопухолевое, противовоспалительное, ранозаживляющее, противоастматическое действие.
Известны способы подготовки образца к анализу, включающие очистку исследуемого образца или осадка после осаждения этанолом диализом через мембрану, пропускающую вещества с молекулярной массой не выше 8000, в течение 48 часов при 4°С с четырехкратной сменой бидистиллированпой воды [Rimada P.S., Abraham A.G. Comparative study of different methodologies to determine the exopolysaccharide produced by kefir grains in milk and whey // Lait, 2003, Vol.83. - P.79-87].
Главным недостатком способов, основанных на диализе, является их длительность: анализ занимает несколько суток. Также требуется специальное оборудование, что ограничивает применение данного метода, особенно в случае параллельного анализа нескольких образцов. К достоинствам следует отнести высокую степень очистки полисахарида от простых углеводов, мешающих анализу.
Известны способы, включающие обработку исследуемого раствора трихлоруксусной кислотой для осаждения белка из раствора с последующим осаждением ацетоном, растворением осадка и диализом [Lemoine J. et al. Structural characterization of the exocellular polysaccharides produced by streptococcus thermophilus SFi39 and SFil2 // Applied and Environmental Microbiology, 1997, Vol.63. - P.3512-3518] или диализом без осаждения [Gancel F., Novel G. Exopolysaccharide production by Streptococcus salivarius ssp.thermophilus cultures. 1. Conditions of production // J of Dairy Science, 1994, Vol.77, №3. - P.685-688].
Помимо длительности, главным недостатком способов, включающих операцию осаждения белков трихлоруксусной кислотой, является искажение результатов анализа по причине частичного (около 50%) осаждения полисахарида [Rimada P.S., Abraham A.G. Comparative study of different methodologies to determine the exopolysaccharide produced by kefir grains in milk and whey // Lait, 2003, Vol.83. - P.79-87].
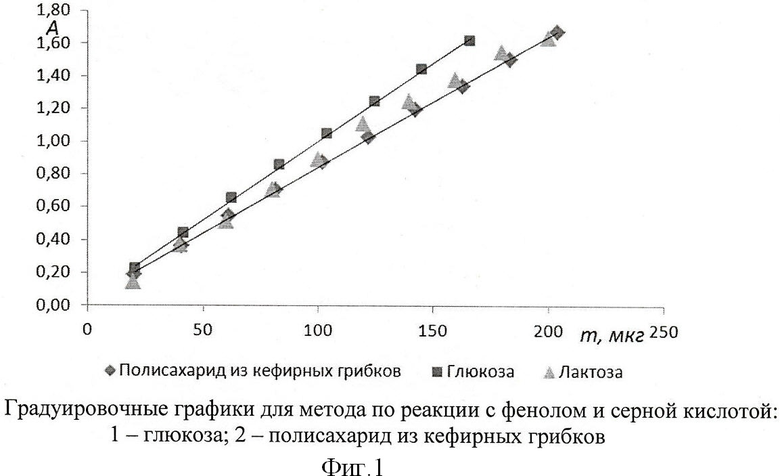
Количественное определение содержания полисахарида в образце проводят колориметрически реакцией с антроновым реактивом или с фенолом и серной кислотой. В качестве стандарта принимают лактозу или глюкозу.
Данные реакции неспецифичны, реагируют любые углеводы, поэтому образец должен быть свободен от простых углеводов. Оптическая плотность зависит не только от количества углеводов в исследуемом растворе, но и от самих веществ: для одной и той же концентрации вещества для глюкозы, лактозы, сахарозы, какого-либо полисахарида и т.п. оптическая плотность разная. Поэтому определение содержания полисахарида по градуировочному графику для глюкозы не отражает реальную концентрацию, а носит скорее сравнительный характер. Более достоверно определение по градуировочному графику для лактозы, поскольку этот углевод состоит из глюкозы и галактозы в равном соотношении (фиг.1). Приблизительно такой же состав полисахарида, производимого кефирными грибками - кефирана. В случае, когда состав полисахарида отличен (например, для бактерий L.casei, L.delbrueckii ssp.bulgaricus, являющиеся закваской для йогуртов), результат анализа будет некорректен.
Наиболее близким аналогом (прототип) является способ, включающий центрифугирование исследуемого раствора при 17000 g в течение 10 минут, осаждение полисахарида из надосадочной жидкости равным количеством холодного этанола. Полученный осадок собирают центрифугированием при 17000 g в течение 10 минут и растворяют в дистиллированной воде в объеме 10% от изначального раствора. Процедуру повторяют 3 раза для очистки полисахарида. Количество измеряют в пересчете на общий сахар по колориметрическому методу с фенолом и серной кислотой [Dubois M., Gilles К.А., Hamilton J.K., Rebers P.A., Smith, F. Colorimetric method for determination of sugars and related substances // Anal. Chem., 1956, Vol.28, №3. - P.250-356]. [Taniguchi m., Nomura m., Itaya Т., Tanaka Т. Kefiran production by lactobacillus kefiranofaciens under the culture conditions established by mimicking the existence and activities of yeast in kefir grains // Food Sci. Technol. Res., 2001, Vol.7 (4). - P.333-337].
Главным недостатком метода является его трудоемкость из-за многократного переосаждения, что также влияет на погрешность измерений. Помимо этого требуется высокооборотистая центрифуга для осаждения белков. Содержание полисахарида рассчитывается по градуировочному графику для глюкозы, поэтому метод не дает непосредственно значение концентрации самого полисахарида.
Техническим результатом предлагаемого способа является сокращение времени и снижение трудоемкости проведения анализа, упрощение материальной базы для проведения анализа, заключающееся в отсутствии необходимости применения высокооборотистой центрифуги или установки для диализа, а полученный результат непосредственно отражает содержание полисахарида в исследуемом образце.
Технический результат достигается тем, что анализируемый раствор получают путем выдерживания навески продукта на кипящей водяной бане при перемешивании в течение не менее 10 минут, раствор охлаждают и разбавляют с последующим отстаиванием осадка и отбирают порции раствора, выдерживают отобранный раствор в кислой среде при температуре 70-75°С в течение 5 минут, охлаждают и нейтрализуют раствор гидроксидом натрия с последующим осаждением полисахарида спиртом или ацетоном при центрифугировании, промывают осадок холодным 50%-ным раствором осадителя, проводят полный гидролиз полисахарида в 1М растворе серной кислоты в течение 2 часов при 100°С с последующей нейтрализацией гидроксидом натрия и определяют содержание полисахарида по градуировочному графику для глюкозы.
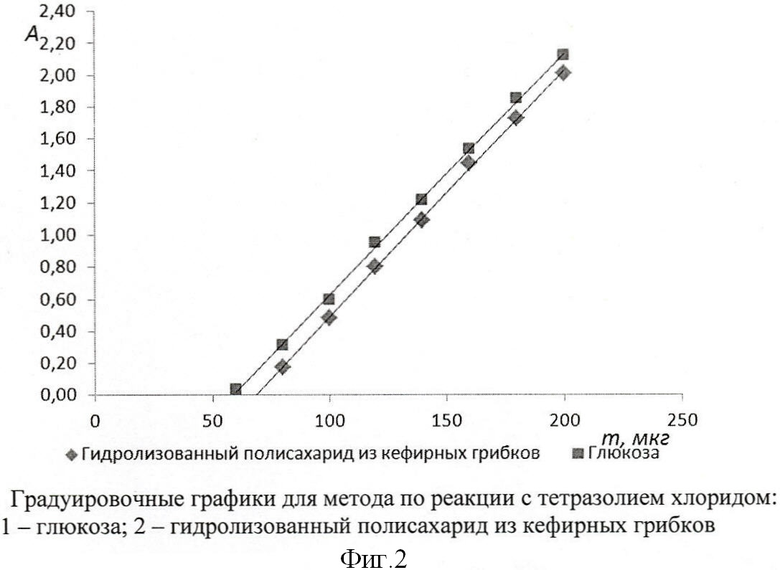
Для определения содержания количества полисахарида в молочнокислых продуктах проводят выдерживание навески продукта на кипящей водяной бане не менее 10 минут при перемешивании для экстракции полисахарида с поверхности клеток молочнокислых бактерий (капсулярный полисахарид). Полученный продукт охлаждают и доводят дистиллированной водой до определенного объема, чтобы можно было вычислить содержание продукта в 1 мл раствора, и тщательно перемешивают. По возможности нужно минимально разбавлять исходный продукт. Далее отбирают определенный объем отстоявшегося раствора в пробирку с делениями, не допуская попадания белкового осадка, при необходимости раствор можно отфильтровать или центрифугировать. К раствору добавляют концентрированную соляную кислоту, объемом приблизительно 0,1 от объема анализируемого раствора, и выдерживают при температуре около 70°С приблизительно 5 минут. Раствор охлаждают, нейтрализуют гидроксидом натрия в присутствии индикатора фенолфталеина, доводят водой до отметки и перемешивают. После отстаивания белкового осадка либо центрифугирования часть раствора переносят в пробирку для центрифугирования, приливают 1-2 объема холодного этилового спирта и выдерживают 0,5-1 час при температуре не выше 5°С. Далее раствор центрифугируют до полного осаждения полисахарида (при 3000 об/мин центрифугируют 20-30 минут). Центрифугат аккуратно отбирают, не встряхивая осадок. Осадок промывают холодным 50% раствором этилового спирта, снова центрифугируют и отбирают центрифугат. Далее осадок полностью растворяют в дистиллированной воде при нагревании и раствор переносят в пробирку с делениями. Проводят полный гидролиз полисахарида реакцией в 1М растворе серной кислоты в течение 2 часов при 100°С. Раствор охлаждают, нейтрализуют гидроксидом натрия в присутствии индикатора фенолфталеина, доводят водой до отметки и перемешивают. Полученный раствор отбирают для анализа на редуцирующие вещества [Fairbridge R.A., Willis K.J., Booth R.G. The direct colorimetric estimation of reducing sugars and other reducing substances with tetrazolium salts // Biochem J, 1951, Vol.49(4). - P.423-427]. Содержание полисахарида находят по градуировочному графику для глюкозы.
Пример выполнения способа.
Навеску кефира 50 г выдерживают на кипящей водяной бане при постоянном перемешивании 10 минут. Раствор охлаждают, доводят до 50 мл и перемешивают. Раствор фильтруют через бумажный фильтр и отбирают 10 мл фильтрата в пробирку на 20 мл с делениями. Приливают 1 мл концентрированной соляной кислоты и выдерживают в термостате при 70°С в течение 5 минут. Раствор охлаждают, добавляют 1 каплю 1% фенолфталеина и титруют 20% раствором гидроксида натрия до появления розового окрашивания, не исчезающего в течение минуты. Раствор доводят до 20 мл и перемешивают. После осаждения белкового осадка отбирают 4 мл надосадочной жидкости и переносят в пробирку для центрифугирования. Туда же вносят 8 мл холодного 96% этилового спирта, пробирку закрывают крышечкой, встряхивают и оставляют на 1 час в морозильной камере (температура минус 20°С). После раствор центрифугируют при 3000 об/мин в течение 20 минут. Жидкость аккуратно отбирают пипеткой, не встряхивая осадка, затем осадок промывают 12 мл холодного 50% этилового спирта, снова центрифугируют и отбирают надосадочную жидкость. Затем осадок растворяют в 5 мл дистиллированной воды и переносят в пробирку с делениями, вносят 0,3 мл концентрированной серной кислоты, перемешивают, закрывают крышечкой и ставят на кипящую водяную баню на 2 часа. По прошествии этого времени раствор остужают и нейтрализуют 20% раствором гидроксида натрия в присутствии фенолфталеина. Объем доводят до 10 мл. Затем отбирают 2 мл в пробирку, добавляют 1 мл щелочного раствора тетразолия хлорида (3 г тетразолия хлорида и 20 г гидроксида натрия на 1 л раствора), выдерживают на кипящей водяной бане в течение 3 минут, добавляют 1 мл 0,6М уксусной кислоты, остужают и добавляют 6 мл изопропилового спирта и перемешивают. В случае выпадения осадка солей, раствор центрифугируют. Параллельно проводят холостой опыт - вместо исследуемого раствора дистиллированная вода. Снимают показания оптической плотности исследуемого раствора относительно холостого при длине волны 485 нм и толщине оптического слоя 10 мм. По уравнению регрессии градуировочного графика для глюкозы (1) находят массу полисахарида в исследуемом растворе:
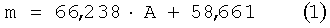
где m - масса полисахарида (глюкозный эквивалент), мкг; А - значение оптической плотности.
По уравнению (1):
m=66,238·0,129+58,661=67,2 мкг
С учетом разбавлений получим содержание полисахарида в 1 г продукта:
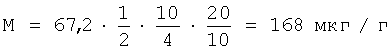
Таким образом, сокращение времени анализа и снижение трудоемкости достигается за счет исключения процедуры многократного переосаждения полисахарида. При отсутствии белка в осадке, достигающемся кислотной денатурацией белка с последующей нейтрализацией раствора, простые углеводы легко вымываются. На содержание полисахарида такая процедура не оказывает влияния, поскольку он устойчив к кислотному гидролизу в данных условиях.
Упрощение материальной базы достигается отсутствием необходимости применения высокооборотистой центрифуги для отделения белковых веществ. После обработки кислотой и нейтрализации белки полностью осаждаются.
Полученный результат непосредственно отражает содержание полисахарида в исследуемом образце за счет полного гидролиза полисахарида и анализа на редуцирующие вещества. При гидролизе продуктом реакции являются простые сахара - составляющие полисахарид, которые при анализе на редуцирующие вещества являются эквивалентом глюкозы. Например, полисахарид кефирных грибков состоит из глюкозы и галактозы в равном соотношении. Методы, основанные на образовании производных фурфурола (с антроновым реактивом, с фенолом и серной кислотой и т.п.), при анализе полисахарида могут дать достоверные данные при использовании градуировочного графика для данного полисахарида или лактозы, а в случае анализа других полисахаридов, не производимых кефирными грибками, необходим градуировочный график для данного полисахарида. Это вызывает дополнительные трудности, связанные с экстракцией и очисткой полисахарида для построения графика.
В дополнение, метод определения по реакции с тетразолием более точен: коэффициент наклона регрессии равен 0,0151 в сравнении с 0,008 для метода по реакции с фенолом и серной кислотой. Недостатком является более высокий порог обнаружения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КЕФИРАНА | 2010 |
|
RU2450021C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ 1,1'-ЭТИЛЕН-2,2'-ДИПИРИДИЛИЙДИБРОМИДА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2010 |
|
RU2425368C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФОСФОРА В РАСТИТЕЛЬНЫХ МАСЛАХ | 1994 |
|
RU2103681C1 |
| Способ определения содержания каррагинана в мясных продуктах | 2018 |
|
RU2697203C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ВОДОРАСТВОРИМЫХ УГЛЕВОДОВ В ТАБАКЕ | 2012 |
|
RU2504308C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ КАРРАГИНАНА В МОЛОКЕ И МОЛОЧНЫХ ПРОДУКТАХ | 2015 |
|
RU2597770C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ВОДОРАСТВОРИМЫХ УГЛЕВОДОВ И КРАХМАЛА ИЗ ОДНОЙ НАВЕСКИ | 2007 |
|
RU2406293C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЛИКОГЕНА В ЭКСТРАКТЕ ИЗ ОРГАНОВ И ТКАНЕЙ ПЧЕЛ | 2003 |
|
RU2256320C2 |
| Способ определения углеводного состава пищевых продуктов растительного происхождения | 1983 |
|
SU1176246A1 |
| Способ определения фракций гидроксипролина в биологическом материале | 2020 |
|
RU2735375C1 |
Изобретение относится к пищевой промышленности применительно к кефиру, кефирной закваске, кефирным грибкам, йогурту и другим продуктам, полученным с использованием брожения молочнокислой закваски или кефирных грибков. Способ включает получение анализируемого раствора путем выдерживания навески продукта на кипящей водяной бане при перемешивании в течение не менее 10 минут, охлаждение и разбавление раствора с последующим отстаиванием осадка и отбором порции раствора, выдержку отобранного раствора в кислой среде при температуре 70-75°С в течение 5 минут, охлаждение и нейтрализацию раствора гидроксидом натрия с последующим осаждением полисахарида спиртом или ацетоном при центрифугировании, промывание осадка холодным 50%-ным раствором осадителя, полный гидролиз полисахарида в 1М растворе серной кислоты в течение 2 часов при 100°С с последующей нейтрализацией гидроксидом натрия и определение содержания полисахарида по градуировочному графику для глюкозы. Достигается упрощение и ускорение анализа. 2 ил.
Способ количественного анализа содержания полисахарида, производимого молочнокислыми бактериями, включающий получение анализируемого раствора путем выдерживания навески продукта на кипящей водяной бане при перемешивании в течение не менее 10 мин, охлаждение и разбавление раствора с последующим отстаиванием осадка и отбором порции раствора, выдержку отобранного раствора в кислой среде при температуре 70-75°С в течение 5 мин, охлаждение и нейтрализацию раствора гидроксидом натрия с последующим осаждением полисахарида спиртом или ацетоном при центрифугировании, промывание осадка холодным 50%-ным раствором осадителя, полный гидролиз полисахарида в 1М растворе серной кислоты в течение 2 ч при 100°С с последующей нейтрализацией гидроксидом натрия и определение содержания полисахарида по градуировочному графику для глюкозы.
| TANIGUCHI M | |||
| et al | |||
| Food Sci | |||
| Technol | |||
| Res., 2001, vol | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ 1,3- β -ГЛЮКАНОВ | 1991 |
|
RU2017819C1 |
| СПОСОБ ХРОМАТОГРАФИЧЕСКОГО ОПРЕДЕЛЕНИЯ ПОЛИСАХАРИДОВ В ВОДНОЙ СРЕДЕ | 2000 |
|
RU2168170C1 |
| Способ определения водорастворимых полисахаридов в препаратах, выделенных из листьев мать-и-мачехи и подорожника | 1987 |
|
SU1536282A1 |
| Способ определения полисахаридов в препаратах, выделенных из растений | 1988 |
|
SU1622802A1 |
| Способ определения декстрана в сахаре-сырце | 1988 |
|
SU1597394A1 |
Авторы
Даты
2011-12-20—Публикация
2010-03-23—Подача