Изобретение относится к медицине, а именно к молекулярной генетике, и может найти применение в диагностике и терапии бактериальных и вирусных инфекций.
В клетках живых организмов рибонуклеиновая кислота (РНК) выполняет исключительно важную роль посредника в передаче генетической информации от ДНК к белку. На матрице геномной ДНК клеточные РНК-полимеразы синтезируют информационную РНК, которая в свою очередь является матрицей для синтеза молекулы белка на рибосомах. Так осуществляется синтез РНК in vivo. Большим достижением молекулярной генетики является разработка системы синтеза РНК in vitro, которая позволяет получать в препаративных количествах информационную РНК индивидуальных генов. В основе получения РНК in vitro лежит способность очищенных РНК-полимераз бактериофагов Т3, Т7 и SP6 синтезировать индивидуальную РНК на матрице рекомбинантной ДНК, содержащей промотор полимеразы и клонированный ген [Anal. Biochem., 1991, v.195, 207-213]. Метод получения РНК in vitro лег в основу создания высокочувствительных способов диагностики бактериальных и вирусных инфекции, таких как NASBA (nucleic acid-based amplification) [Anal. Biochem., 1991, v.195, 207-213] и ТМА (transcription-mediated amplification) [Hepatology, 2006, v.44, 360-367].
В настоящее время получение РНК in vitro осуществляют как с помощью стандартных лабораторных методик [Molecular Cloning, A Laboratory Manual, 3d Edition. 2001. CSHL Press], так и с помощью коммерческих наборов, таких как MEGAscript (Ambion), Riboprobe (Promega), MiniV (Epicentre), HiScrine (New England Biolabs) и других, в состав которых входит стандартный набор реагентов: реакционный буфер, смесь четырех рибонуклеотидтрифосфатов, РНК-полимераза фага Т3, или Т7, или SP6, контрольная плазмидная ДНК, а также фермент ДНКаза 1 для удаления плазмидной ДНК из конечной реакционной смеси, содержащей синтезированную in vitro РНК. Общим недостатком всех известных на сегодняшний день способов получения РНК in vitro является необходимость удаления ДНК по окончании реакции, поскольку ДНК мешает последующему использованию полученной РНК. Для удаления ДНК применяют ферментативную обработку смеси ДНКазой 1 с последующей термической инактивацией ДНКазы 1 при +60°С или удалением ДНКазы 1 из реакционной смеси экстракцией ее смесью фенола и хлороформа 1:1. Оба способа инактивации ДНКазы 1 усложняют процедуру получения РНК и делают ее достаточно продолжительной. Кроме того, любая термическая обработка крайне нежелательна РНК, так как она является термолабильным веществом. Экстракция ДНКазы 1 смесью фенола и хлороформа приводит к уменьшению выхода РНК из-за ее потерь в органическом и промежуточном слоях. При этом даже малейшие примеси фермента РНКазы в препаратах в коммерческих препаратах ДНКазы 1, используемых для этой цели, приводят к частичной деградации полученной РНК, что существенно снижает ее качество.
В качестве прототипа нами выбран способ получения РНК с помощью лабораторной методики [Molecular Cloning, A Laboratory Manual, 3d Edition. 2001. CSHL Press]. Способ заключается в том, что к 1 мкл водного раствора, содержащего 1 мг/мл плазмидной ДНК, добавляют 10 мкл воды, 1 мкл буферного раствора с рН 7,5, 2 мкл 0,005 М раствора рибонуклеотидтрифосфатов, 2 мкл 0,1 М раствора дитиотреитола, 1 мкл раствора, содержащего 2 мг/мл бычьего сывороточного альбумина, 1 мкл раствора, содержащего 10 единиц ингибитора РНКазы и 1 мкл раствора, содержащего 10 единиц РНК-полимеразы бактериофага Т3, или Т7, или SP6, после чего инкубируют полученную смесь 1 час при температуре +37°С. По окончании инкубации в смесь добавляют 1 мкл раствора, содержащего 10 мг/мл ДНКазы 1, инкубируют 15 мин при температуре +37°С, затем добавляют 100 мкл воды и 120 мкл смеси фенола и хлороформа 1:1 и полученную суспензию экстрагируют, после чего водную и органическую фазы разделяют центрифугированием при 16000 g в течение 10 мин. Водную фазу декантируют и РНК из водной фазы осаждают добавлением 30 мкл 10 М раствора ацетата аммония и 250 мкл этанола и последующей инкубацией смеси во льду в течение 30 минут, после чего осадок РНК собирают центрифугированием при 16000 g в течение 10 мин. Осадок РНК растворяют в 100 мкл воды и таким образом получат раствор искомой РНК в очищенном виде.
Прототип представляет, таким образом, сложный и длительный процесс получения РНК, пригодной для молекулярно-биологических целей. В частности, для очистки РНК используют обработку реакционной смеси ферментом ДНКазой 1 для удаления плазмидной ДНК с последующим удалением этого фермента из реакционной смеси экстракцией смесью фенола и хлороформа, осаждением полученной РНК, центрифугированием и растворением ее в воде. Все это значительно усложняет способ получения РНК и удлиняет его.
Технический результат настоящего изобретения состоит в упрощении и ускорении получения РНК за счет иммобилизации плазмидной ДНК на суперпарамагнитных частицах магнетита и последующего удаления связанной ДНК посредством воздействия магнитного поля.
Этот результат достигается тем, что в известном способе получения РНК, включающем добавление к 1 части водного раствора, содержащего 1 мг/мл плазмидной ДНК, 10 частей воды и 1 части буферного раствора с рН 7,5, 2 частей 0,005 М раствора рибонуклеотидтрифосфатов, 2 частей 0,1 М раствора дитиотреитола, 1 части раствора, содержащего 2 мг/мл бычьего сывороточного альбумина, 1 части раствора, содержащего 10 единиц ингибитора РНКазы, 1 части раствора, содержащего 10 единиц РНК-полимеразы бактериофага Т3, или Т7, или SP6, и последующую инкубацию реакционной смеси не менее 1 часа при температуре +37°С, согласно изобретению перед добавление буферного раствора с рН 7,5 к водному раствору плазмидной ДНК добавляют 1 часть суспензии, содержащей 4 г/мл суперпарамагнитных частиц магнетита, а после инкубации реакционную смесь помещают в магнитное поле напряженностью не менее 0,2 Тл на 1-3 минуты, после чего декантируют водную фазу, которая содержит искомую РНК.
Целесообразно в качестве буферного раствора с рН 7,5 использовать раствор, содержащий 0,4 М Трис (2-Амино-2-(гидроксиметил)-1,3-пропандиол), 0,06 М хлористого магния, 0,05 М хлористого натрия, 0,02 М спермидина.
Добавление суперпарамагнитных частиц магнетита к водному раствору плазмидной ДНК обеспечивает быстрое и эффективное связывание ее суперпарамагнитными частицами, в результате чего она сохраняет свои функциональные свойства, а именно - способность синтеза РНК. Поскольку плазмидная ДНК оказывается в связанном с суперпарамагнитными частицами состоянии, это дает возможность при последующем подведении к реакционной смеси магнитного поля быстро и полностью удалить ее из смеси. Это в свою очередь позволяет исключить из схемы получения РНК стадию ферментативной обработки смеси ДНКазной 1 с последующим ее удалением из реакционной смеси экстракцией смесью фенола и хлороформа. Все это значительно упрощает и сокращает процедуру получения РНК.
Полученная таким образом РНК обладает высоким качеством и пригодна, как нами показано, для молекулярно-биологических исследований структуры и функций генов, а также в медицинской практике для диагностических и терапевтических целей.
Сущность способа поясняется примером
Пример
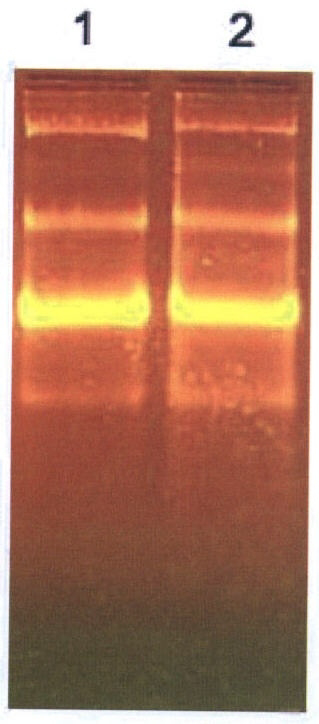
К 1 мкл водного раствора, содержащего 1 мкг плазмидной ДНК pTRI-Xef (Ambion), содержащей вставку кДНК фактора элонгации 1 из X. leavis размером 1700 пар оснований, добавляют 10 мкл воды и 1 мкл суспензии (4 г/мл) суперпарамагнитных частиц магнетита Fе3O4 [Fе2О3*FeO] размером 10-300 нм и встряхивают в течение 1-2 минут при температуре +20°С, после чего к смеси добавляют 1 мкл буферного раствора с рН 7,5 состава 0,4 М Трис (2-Амино-2-(гидроксиметил)-1,3-пропандиол), 0,06 М хлористого магния, 0,05 М хлористого натрия, 0,02 М спермидина, 2 мкл 0,005 М раствора рибонуклеотидтрифосфатов, 2 мкл 0,1 М раствора дитиотреитола, 1 мкл раствора, содержащего 2 мг/мл бычьего сывороточного альбумина, 1 мкл раствора, содержащего 10 единиц ингибитора РНКазы, 1 мкл раствора, содержащего 10 единиц РНК-полимеразы бактериофага Т3, или Т7, или SP6, и инкубируют 1 час при температуре +37°С. По окончании инкубации смесь помещают в магнитное поле напряженностью 0,4 Тл на 3 минуты, после чего водную фазу декантируют и определяют качество полученной РНК. Для этого проводят электрофорез аликвоты раствора в 1% агарозном геле (NuSieve GTG, FMC), содержащем стандартный трис-боратный буфер и 0,03 мг/мл бромистого этидия. Электрофорез проводят в течение 1 часа при постоянном напряжении 10 В/см. Затем осуществляют фотодокументацию и анализ геля в проходящем ультафиолетовом свете с длиной волны 312 нм (трансиллюминатор ЕСХ-15.М, Vibler Lourmat) с помощью цифровой системы EDAS 290 и программы 1D Image Analysis version 3.5 (Kodak Digital Science). Результаты представлены на чертеже, из которого видно, что количество и электрофоретический профиль РНК, полученной с использованием контрольной плазмидной ДНК pTRI-Xef (Ambion) в растворе (дорожка 1), и профиль РНК, полученной предлагаемым нами способом (дорожка 2), не отличаются, что свидетельствует о высоком качестве полученной РНК. Таким образом, полученная нами РНК пригодна для молекулярно-биологических исследований структуры и функций генов, а также в медицинской практике для диагностических и терапевтических целей.
Предлагаемый способ получения РНК по сравнению с известными имеет ряд существенных преимуществ.
1. Упрощает и ускоряет процедуру за счет иммобилизации плазмидной ДНК на суперпарамагнитных частицах магнетита и последующего удаления связанной ДНК посредством воздействия магнитного поля и таким образом исключения при очистке стадии РНК обработки реакционной смеси ферментом ДНКазной 1 и последующего удаления этого фермента из реакционной смеси экстракцией смесью фенола и хлороформа.
2. Обеспечивает высокое качество получаемой РНК.
Способ разработан в лаборатории генной инженерии ФГУ «РНЦРХТ». Получаемая РНК используется в дальнейшем для наработки РНК-стандарта при молекулярной диагностике гепатита С методом полимеразной цепной реакции с положительным результатом.
Изобретение относится к медицине, а именно к молекулярной генетике, и может найти применение в диагностике и терапии бактериальных и вирусных инфекций. Предложен способ получения рибонуклеиновой кислоты (РНК). Способ заключается в том, что к 1 части водного раствора, содержащего 1 мг/мл плазмидной ДНК, добавляют 10 частей воды и 1 часть суспензии, содержащей 4 г/мл суперпарамагнитных частиц магнетита. Затем в полученный раствор добавляют 1 часть буферного раствора с рН 7,5, 2 части 0,005 М раствора рибонуклеотидтрифосфатов, 2 части 0,1 М раствора дитиотреитола, 1 часть раствора, содержащего 2 мг/мл бычьего сывороточного альбумина, 1 часть раствора, содержащего 10 единиц ингибитора РНКазы и 1 часть раствора, содержащего 10 единиц РНК-полимеразы бактериофага Т3, или Т7, или SP6. Полученную смесь инкубируют не менее 1 часа при температуре +37°С и помещают в магнитное поле напряженностью не менее 0,2 Тл на 1-3 минуты. После этого декантируют водную фазу, которая содержит искомую РНК. Полученная таким образом РНК обладает высоким качеством и пригодна для молекулярно-биологических исследований структуры и функций генов, а также в медицинской практике для диагностических и терапевтических целей. 1 з.п. ф-лы, 1 ил.
1. Способ получения рибонуклеиновой кислоты (РНК), включающий добавление к 1 части водного раствора, содержащего 1 мг/мл плазмидной ДНК, 10 частей воды и 1 части буферного раствора с рН 7,5, 2 частей 0,005 М раствора рибонуклеотидтрифосфатов, 2 частей 0,1 М раствора дитиотреитола, 1 части раствора, содержащего 2 мг/мл бычьего сывороточного альбумина, 1 части раствора, содержащего 10 единиц ингибитора РНКазы, 1 части раствора, содержащего 10 единиц РНК-полимеразы бактериофага Т3, или Т7, или SP6, и последующую инкубацию реакционной смеси не менее 1 ч при температуре 37°С, отличающийся тем, что перед добавлением буферного раствора с рН 7,5 к водному раствору плазмидной ДНК добавляют 1 часть суспензии, содержащей 4 г/мл суперпарамагнитных частиц магнетита, а после инкубации реакционную смесь помещают в магнитное поле напряженностью не менее 0,2 Тл на 1-3 мин, после чего декантируют водную фазу, которая содержит искомую РНК.
2. Способ по п.1, отличающийся тем, что буферный раствор с рН 7,5 содержит 0,4 М трис(2-амино-2-(гидроксиметил)-1,3-пропандиол), 0,06 М хлористого магния, 0,05 М хлористого натрия, 0,02 М спермидина.
| SAMBROOK J | |||
| ет al | |||
| Molecular Cloning // A Laboratory Manual (Third Edition)", 2001, изд-во Cold Spring Harbor Laboratory press | |||
| BERENSMEIER S | |||
| ет al | |||
| Magnetic particles for the separation and purification of nucleic acids // Appi Microbiol Biotechnol, 2006, v | |||
| Способ подготовки рафинадного сахара к высушиванию | 0 |
|
SU73A1 |
| PALADICHUK A | |||
| et al | |||
| Isolating RNA: Pure and simple", 1999, The scientist | |||
Авторы
Даты
2012-01-10—Публикация
2009-11-24—Подача