ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к соединению, обладающему антагонистической активностью относительно кальцийчувствительных рецепторов (CaSR, здесь далее обозначены просто как кальциевые рецепторы).
УРОВЕНЬ ТЕХНИКИ
Известно, что кость является динамическим органом, в котором осуществляется восстановление кости посредством непрерывно повторяющегося образования и резорбции ради морфологического изменения самой кости или поддержания концентрации кальция в крови. В нормальной кости существует равновесное соотношение между остеогенезом, осуществляемом остеобластами, и резорбцией кости, осуществляемой остеокластами, что поддерживает массу кости в постоянном состоянии. Однако нарушение равновесного соотношения между остеогенезом и резорбцией костей вызывает метаболические болезни костей, такие как остеопороз (непатентные документы 1 и 2).
Сообщается о многих типах системных гормонов или локальных цитокинов как факторов, регулирующих метаболизм костной ткани, и остеогенез и сохранность костей управляются взаимодействием этих факторов (непатентные документы 1 и 3). Наличие остеопороза широко известно как возрастное изменение костной ткани. Однако так как механизм появления остеопороза включает много аспектов, в том числе пониженную секрецию половых гормонов или вызванную этим патологию рецепторов, изменения экспрессии цитокинов в отдельной кости, экспрессию и дифференциацию генов старения или ослабленную функцию остеокластов или остеобластов и т.д., трудно понять его как простое физиологическое явление, которое происходит при старении. Во-первых, остеопороз подразделяется, главным образом, на постклимактерический остеопороз, результат пониженной секреции эстрогена, и старческий остеопороз, результат старения. Для объяснения механизма появления остеопороза и разработки терапевтического агента для его лечения существенным является прогресс в фундаментальных исследованиях регуляторных механизмов при резорбции и остеогенезе костей.
Остеокласты представляют собой многоядерные клетки, возникающие из гематопоэтических стволовых клеток, и посредством высвобождения хлорид-ионов и ионов водорода на их стороне, прилепленной к кости, они подкисляют щель между клеткой и липкой стороной кости и одновременно секретируют катепсин K, который является кислотной протеазой (непатентный документ 4). В результате происходит разрушение матричного белка кости и фосфата кальция, что дает пополнение кальция в крови.
Концентрация кальция в сыворотке здоровых млекопитающих строго поддерживается около 9-10 мг/дл (примерно 2,5 мМ) (т.е., кальциевый гомеостаз). Паратиреоидный гормон (PTH) представляет собой гормон, который играет ключевую роль в поддержании гомеостаза кальция, и если концентрация Ca2+ в крови снижается, то немедленно активизируется секреция PTH паращитовидными железами. В кости секретированный таким образом PTH пополняет Ca2+ в крови, промотируя резорбцию костей, и в почках он промотирует повторное поглощение Ca2+ в дистальных канальцах, таким образом, функционирование повышенной концентрации Ca2+ в крови.
Так как известно, что PTH может повышать костную массу, когда его вводят периодически человеку или животному, его уже применяют клинически в качестве терапевтического агента для лечения остеопороза. Также согласно тестам на животных сообщается, что и остеогенез, и резорбция бедренной губчатой кости промотируются при непрерывном введении бычьего PTH (1-84) крысе, у которой удалены щитовидная/паращитовидные железы, что впоследствии приводит к фактическому снижению костной массы. Однако в результате периодического подкожного его введения не происходит промотирования резорбции костей, а только промотирование остеогенеза, что приводит к увеличению костной массы (непатентный документ 5). Дополнительно, если периодически вводить крысе человеческий PTH (1-34) в течение 15 недель через 4 недели после овариэктомии, то наблюдают промотирование остеогенеза и ингибирование резорбции костей в течение периода с 5-10 неделю после начала введения, демонстрирующие примерно двукратное увеличение костной массы по сравнению с имитационной рабочей группой (непатентный документ 6). В этом отчете предполагается, что PTH не только предупреждает снижение костной массы на модели остеопороза, но также имеет эффект восстановления костной массы даже у животных, уже страдающих от заметного уменьшения костной массы.
Хотя PTH-препараты являются терапевтическими агентами для лечения остеопороза, которые демонстрируют подтверждаемый существенный эффект уменьшения степеней переломов костей согласно клиническим тестам у пациентов, страдающих от постклимактерического остеопороза, будучи биологическими препаратами, они также имеют недостатки. Конкретно, в качестве способа введения следует применять инъекцию, и поэтому существует проблема, что пациент может испытывать связанную с этим боль. Таким образом, ожидается разработка фармацевтического препарата, который периодически повышает концентрацию PTH в крови и может вводиться перорально.
Кальциевый рецептор представляет собой G-белок, связанный с рецептором, который экспрессируется, главным образом, в клетках паращитовидных желез, и он регулирует секрецию PTH, чувствуя концентрацию Ca2+ в крови (непатентный документ 7). Человеческий кальциевый рецептор состоит из 1078 аминокислот, и сообщается, что человеческий кальциевый рецептор экспрессируется в почках, С-клетках щитовидной железы, головном мозге, клетках костного мозга и др., а также в паращитовидной железе. Кальциевый рецептор, как лиганд, связывая Ca2+, активирует фосфолипазу С посредством связывания с G-белком, вызывает производство инозиттрифосфата и повышение концентрации внутриклеточного Ca2+ и, как результат, подавляет секрецию PTH (непатентный документ 8). Таким образом, ожидается, что фармацевтический агент, который ингибирует активацию кальциевого рецептора, т.е. фармацевтический агент, который является антагонистом кальциевого рецептора, будет промотировать секрецию PTH из клеток паращитовидных желез и повышать концентрацию PTH в крови живого организма. В этом отношении, если повышение концентрации PTH в крови является скорее кратковременным, чем постоянным, ожидается получение такого же эффекта повышения костной массы, как эффект, обеспечиваемый при периодическом введении PTH.
Между тем, соединения, раскрытые в патентном документе 1, известны как соединения, содержащие инданильную группу. Однако хотя они аналогичны соединениям по изобретению, так как они включают инданильную группу, структура другого конца и др. отличается.
СПИСОК ЛИТЕРАТУРЫ
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
Непатентный документ 1: Endocrinological Review, (1992) 13, p 66-80.
Непатентный документ 2: Principles of Bone Biology, Academic Press, New York, (1996) p 87-102.
Непатентный документ 3: Endocrinological Review, (1996) 17, р 308-332
Непатентный документ 4: American Journal of Physiology, (1991) 260, C1315-C1324.
Непатентный документ 5: Endocrinology, 1982, 110, 506-512.
Непатентный документ 6: Endocrinology, 1993, 132, 823-831.
Непатентный документ 7: Brown, E. M., «Homeostatic mechanisms regulating extracellular and intracellular calcium metabolism in the parathyroids», (US), Raven press, 1994, 19.
Непатентный документ 8: Nature, 1993, 366, 575-580.
ПАТЕНТНЫЕ ДОКУМЕНТЫ
Патентный документ 1: WO2004/047751 (US 2006058391)
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Задачей изобретения является обеспечение новых низкомолекулярных соединений, которые демонстрируют антагонистическую активность относительно кальциевого рецептора, являются высокобезопасными и которые можно вводить перорально.
СРЕДСТВА РЕШЕНИЯ ЗАДАЧ
Фармацевтический препарат, который ингибирует активацию кальциевого рецептора, т.е. фармацевтический препарат, который является антагонистом кальциевого рецептора, промотирует секрецию PTH клетками паращитовидных желез, вызывая, таким образом, повышение концентрации PTH в крови живых организмов. В этом отношении, если повышение концентрации PTH в крови является скорее кратковременным, чем постоянным, то ожидается получение такого же эффекта увеличения костной массы, как эффект, обеспечиваемый периодическим введением PTH.
Инданильные соединения по изобретению представляют собой соединения, обладающие антагонистической активностью относительно кальциевых рецепторов. Выражение «обладающие антагонистической активностью относительно кальциевых рецепторов» означает, что происходит ингибирование одной или более активностей кальциевых рецепторов, которые индуцируются внеклеточным Ca2+.
Конкретно, изобретение относится к следующему.
(1) Соединение, представленное следующей далее формулой (I) или его фармацевтически приемлемая соль.
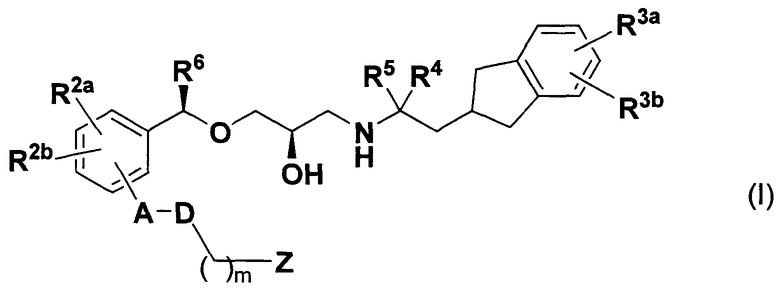
[в формуле каждая замещающая группа определена следующим образом:
А: одинарная связь, С1-С6 алкиленовая группа или фениленовая группа, которая может быть замещена R1;
R1: атом галогена, цианогруппа, С1-С6 алкильная группа, С1-С6 алкоксигруппа, галогенированная С1-С6 алкильная группа, или галогенированная С1-С6 алкоксигруппа;
D: одинарная связь, атом кислорода или атом серы;
R2a и R2b: одинаковые или отличные друг от друга, атом водорода, атом галогена, цианогруппа, С1-С6 алкильная группа, С1-С6 алкоксигруппа, галогенированная С1-С6 алкильная группа, или галогенированная С1-С6 алкоксигруппа;
R3a и R3b: одинаковые или отличные друг от друга, атом водорода, атом галогена, цианогруппа, С1-С6 алкильная группа, С1-С6 алкоксигруппа, галогенированная С1-С6 алкильная группа или галогенированная С1-С6 алкоксигруппа;
R4 и R5: одинаковые или отличные друг от друга, атом водорода, атом галогена или С1-С6 алкильная группа, или R4 и R5 связаны друг с другом с образованием С2-С6 алкиленовой группы;
R6: атом галогена, цианогруппа, С1-С6 алкильная группа, С1-C6 алкоксигруппа, галогенированная С1-С6 алкильная группа или галогенированная C1-С6 алкоксигруппа;
m: целое число от 0 до 6;
Z: карбоксигруппа или группа, эквивалентная карбоксигруппе (-SO 2NHRz, тетразолильная группа или подобные);
Rz: атом водорода или С1-С6 алкильная группа].
Предпочтительные варианты изобретения включают следующие.
(2) Соединение, описанное в (1), или его фармацевтически приемлемая соль, где R1 представляет собой атом водорода или метильную группу.
(3) Соединение, описанное в (1) или (2), или его фармацевтически приемлемая соль, где R2a и R2b, которые являются одинаковыми или отличаются друг от друга и представляют собой атом водорода, атом фтора, атом хлора, цианогруппу, метильную группу, метоксигруппу, этоксигруппу, трифторметильную группу или трифторметоксигруппу.
(4) Соединение, описанное выше в любом из пунктов (1)-(3), или его фармацевтически приемлемая соль, где R3a и R3b, одинаковые или отличные друг от друга, представляют собой атом водорода, атом фтора, атом хлора, цианогруппу, метильную группу, метоксигруппу, этоксигруппу, трифторметильную группу или трифторметоксигруппу.
(5) Соединение, описанное в любом из пунктов (1)-(4), или его фармацевтически приемлемая соль, где R4 и R5 представляют собой метильные группы.
(6) Соединение, описанное в любом из пунктов (1)-(4), или его фармацевтически приемлемая соль, где R4 и R5 представляют собой этиленовую группу.
(7) Соединение, описанное в любом из пунктов (1)-(6), или его фармацевтически приемлемая соль, где m равно 0 или 1.
(8) Соединение, описанное в любом из пунктов (1)-(6), или его фармацевтически приемлемая соль, где m равно от 2 до 4.
(9) Соединение, описанное в любом из пунктов (1)-(8), или его фармацевтически приемлемая соль, где A обозначает одинарную связь.
(10) Соединение, описанное в любом из пунктов (1)-(9), или его фармацевтически приемлемая соль, где D обозначает одинарную связь.
(11) Соединение, описанное в любом из пунктов (1)-(10), или его фармацевтически приемлемая соль, где Z обозначает карбоксигруппу.
(12) Соединение, описанное в любом из пунктов (1)-(11), или его фармацевтически приемлемая соль, где R6 представляет собой метильную группу или этильную группу.
(13) Соединение, выбранное из следующей группы соединений или их фармацевтически приемлемых солей:
{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота,
{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}бутановая кислота,
2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоновая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-метилфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-метилфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-фторфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-фторфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-(трифторметил)фенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-(трифторметил)фенил}пропановая кислота,
2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоновая кислота,
5-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пентановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-
гидроксипропил]окси}этил]фенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-фторфенил}пропановая кислота,
3-{2-хлор-6-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[2-(2,3-дигидро-1H-инден-2-ил)-1,1-диметилэтил]амино}-2-гидроксипропил]оксилпропил]-6-метоксифенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[2-(2,3-дигидро-1H-инден-2-ил)-1,1-диметилэтил]амино}-2-гидроксипропил]оксилэтил]-6-этоксифенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[2-(2,3-дигидро-1H-инден-2-ил)-1,1-диметилэтил]амино}-2-гидроксипропил]окси}этил]-4-фтор-6-метоксифенил}пропановая кислота.
(14) Соединение, описанное в любом из пунктов (1)-(13), или его фармацевтически приемлемая соль для применения в качестве антагониста кальциевого рецептора.
(15) Фармацевтическая композиция, которая содержит соединение, описанное в любом из пунктов (1)-(13), или его фармацевтически приемлемую соль в качестве эффективного компонента.
(16) Фармацевтическая композиция, описанная выше в (15), для применения в качестве антагониста кальциевого рецептора.
(17) Фармацевтическая композиция, описанная выше в (15), для применения для лечения или предупреждения расстройства, связанного с аномальным костным или минеральным гомеостазом.
(18) Фармацевтическая композиция, описанная выше в (17), где расстройство, связанное с аномальным костным или минеральным гомеостазом, является гипопаратиреозом; остеосаркомой; периодонтитом; срастанием переломов костей; деформационным артритом; ревматоидным артритом; болезнью Педжета; синдромом гуморальной гиперкальциемии, связанным со злокачественной опухолью и срастанием переломов костей; или остеопорозом.
(19) Фармацевтическая композиция, описанная выше в (17), где расстройство, связанное с аномальным костным или минеральным гомеостазом, является остеопорозом.
(20) Способ улучшения костного метаболизма, который характеризуется тем, что эффективное количество фармацевтической композиции, описанной выше в (15), вводят млекопитающему.
(21) Способ предупреждения или лечения остеопороза, который характеризуется тем, что эффективное количество фармацевтической композиции, описанной выше в (15), вводят млекопитающему.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Соединения по изобретению или их фармацевтически приемлемые соли пригодны для лечения или профилактики расстройства, связанного с аномальным костным или минеральным гомеостазом, например, гипопаратиреоза, остеосаркомы, периодонтита, срастания переломов костей, деформационного артрита, ревматоидного артрита, болезни Педжета, синдрома гуморальной гиперкальциемии, связанного со злокачественной опухолью и срастанием переломов костей, и остеопороза.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Изобретение будет объяснено далее ниже.
Предпочтительные примеры соединений, имеющих формулу (I), включают соединения, имеющие следующую комбинацию замещающих групп:
A и D обозначают одинарную связь,
R2a и R2b одинаковые или отличные друг от друга, представляют собой атом водорода, атом фтора, атом хлора, цианогруппу, метильную группу, метоксигруппу, трифторметильную группу или трифторметоксигруппу,
R3a и R3b, одинаковые или отличные друг от друга, представляют собой атом водорода, атом фтора, атом хлора, цианогруппу, метильную группу, метоксигруппу, этоксигруппу, трифторметильную группу или трифторметоксигруппу,
R4 и R5 обозначают метильную группу или этиленовую группу,
R6 обозначает метильную группу или этильную группу,
Z обозначает карбоксигруппу, и
m равно от 2 до 4.
Более предпочтительные примеры соединений, имеющих формулу (I), включают соединения, описанные в примерах.
«Атом галогена» относится, например, к атому фтора, атому хлора, атому брома или атому йода и предпочтительно к атому фтора или атому хлора.
«C1-C6 алкильная группа» относится к линейной или разветвленной алкильной группе, имеющей от 1 до 6 атомов углерода, и предпочтительно обозначает метильную группу, этильную группу, пропильную группу, изопропильную группу или трет-бутильную группу, более предпочтительно метильную группу.
«C1-C6 алкоксигруппа» относится к группе, в которой атом кислорода связан с указанной выше «C1-C6 алкильной группой», и предпочтительно обозначает метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу или трет-бутоксигруппу, более предпочтительно метоксигруппу.
«C1-C6 галогенированная алкильная группа» относится к группе, в которой атом галогена является заместителем на указанной выше «C1-C6 алкильной группе». Их примеры включают фторметильную группу, дифторметильную группу, трифторметильную группу, фторэтильную группу, дифторэтильную группу и трифторэтильную группу и предпочтительно трифторметильную группу.
«C1-C6 галогенированная алкоксигруппа» относится к группе, в которой атом галогена является заместителем на указанной выше «C1-C6 алкоксигруппе». Их примеры включают фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, фторэтоксигруппу, дифторэтоксигруппу и трифторэтоксигруппу и предпочтительно трифторметоксигруппу.
«С2-С6 алкиленовая группа» относится к линейной или разветвленной алкиленовой группе, имеющей от 2 до 6 атомов углерода, и предпочтительно обозначает этиленовую группу или пропиленовую группу и более предпочтительно этиленовую группу.
«Лечение» обозначает лечение или улучшение при расстройстве, или улучшение симптома, или ингибирование симптома.
«Его фармацевтически приемлемая соль» относится к соли, которую можно применять в качестве фармацевтического агента. Соединение по изобретению можно преобразовать в соль основания или соль кислоты посредством его взаимодействия с основанием или кислотой, если соединение имеет кислотную группу или основную группу, и эти соли обозначаются соответственно.
Примеры фармацевтически приемлемой «соли основания» и соединения по изобретению предпочтительно включают соли щелочных металлов, такие как соль натрия, соль калия и соль лития; соли щелочноземельных металлов, такие как соль магния и соль кальция; соли органических оснований, такие как соль N-метилморфолина, соль триэтиламина, соль трибутиламина, соль диизопропилэтиламина, соль дициклогексиламина, соль N-метилпиперидина, соль пиридина, соль 4-пирролидинопиридина и соль пиколина, или соли аминокислот, такие как соль глицина, соль лизина, соль аргинина, соль орнитина, соль глутаминовой кислоты и соль аспарагиновой кислоты. Предпочтительной является соль щелочного металла.
Предпочтительные примеры фармацевтически приемлемой «соли кислоты» и соединения по изобретению включают соли галогенводородной кислоты, такие как соль фтористого водорода, соль хлористого водорода, соль бромистого водорода и соль йодистого водорода, соли неорганических кислот, такие как нитрат, перхлорат, сульфат или фосфат; соли низших алкансульфонатов, такие как метансульфонат, трифторметансульфонат или этансульфонат, соли арилсульфонатов, такие как бензолсульфонат или пара-толуолсульфонат; соли органических кислот, такие как ацетат, малат, фумарат, сукцинат, цитрат, аскорбат, тартрат, оксалат или малеат; и соли аминокислот, такие как соль глицина, соль лизина, соль аргинина, соль орнитина, соль глутаминовой кислоты и соль аспарагиновой кислоты. Наиболее предпочтительна соль хлористо-водородной кислоты.
Соединение или его фармацевтически приемлемая соль по изобретению может дополнительно содержать абсорбционную воду или образовать гидрат, образующийся посредством включения молекул воды при стоянии в атмосфере или при перекристаллизации, и такие гидраты, а также сольваты и кристаллические полиморфы также включены в изобретение. Соединение, его соль или сольват соединения или соли по изобретению могут иметь различные изомеры, такие как геометрический изомер, например, цис-форму и транс-форму, или оптический изомер, например, таутомер, или d-форму и l-форму, и др. в зависимости от типа и комбинации замещающих групп. Пока нет конкретного ограничения, соединения по изобретению включают все изомеры, стереоизомеры и смеси изомеров и стереоизомеров в любом соотношении. Смеси изомеров можно разделить способами разделения, которые хорошо известны в данной области.
Соединение по изобретению включает меченые соединения, т.е. соединения, в которых один или более атомов соединения по изобретению замещены изотопом (например, 2H, 3H, 13C, 14C и 35S и т.д.).
Изобретение включает фармацевтически приемлемые пролекарственные соединения по изобретению. Под фармацевтически приемлемым пролекарством понимают соединение, имеющее группу, которую можно преобразовать в аминогруппу, гидроксигруппу или карбоксигруппу и другие группы соединения по изобретению посредством гидролиза или в физиологических условиях. Примеры групп, которые образуют такие пролекарства, включают группы, описанные в работе Prog. Med., Vol. 5, pages 2157-2161, 1985 или «Development of Drugs», Molecular Design (Hirokawa Shoten, 1990), Vol. 7, pages 163-198. Если в соединении по изобретению присутствует аминогруппа, конкретные примеры пролекарств включают соединение, в котором аминогруппа ацилирована, алкилирована или фосфорилирована (например, соединение, в котором аминогруппа эйкозаноилирована, аланилирована или пентиламинокарбонилирована, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонилирована, тетрагидрофуранилирована, пирролидилметилирована, пивалоилоксиметилирована или трет-бутилирована и др.) и др. Если в соединении по изобретению присутствует гидроксигруппа, примеры включают соединение, в котором гидроксигруппа ацилирована, алкилирована, фосфорилирована или борирована (например, соединение, в котором гидроксигруппа ацетилирована, пальмитоилирована, пропаноилирована, пивалоилирована, сукцинилирована, фумарилирована, аланилирована или диметиламинометилкарбонилирована и т.д.) и др. Кроме того, если в соединении по изобретению присутствует карбоксигруппа, примеры включают соединение, в котором карбоксигруппа этерифицирована или амидирована (например, соединение, в котором карбоксигруппа этилэтерифицирована, фенилэтерифицирована, карбоксиметилэтерифицирована, диметиламинометилэтерифицирована, пивалоилоксиметилэтерифицирована, этоксикарбонилоксиэтилэтерифицирована, амидирована или метиламидирована и т.д.) и др.
Дополниетльно, изобретение включает соединения, в которых функциональная группа соединения по изобретению замещена так называемой эквивалентной группой. Примеры так называемых эквивалентных групп включают группы, описанные, например, в работе The Practice of Medicinal Chemistry (Camille Georges Wermuth, Academic Press, 1996). В частности, группы, эквивалентные карбоксигруппе, описаны на страницах 215-217 работы The Practice of Medicinal Chemistry.
(Способ получения)
Соединение по изобретению можно получить, используя различные хорошо известные способы синтеза согласно характеристикам, которые базируются на основном каркасе или типе замещающих групп соединения. Примеры хорошо известных способов включают способы, описанные в работе «ORGANIC FUNCTIONAL GROUP PREPARATIONS», 2nd edition, ACADEMIC PRESS, INC., 1989 или «Comprehensive Organic Transformations», VCH Publishers Inc., 1989.
В таком случае в зависимости от типа функциональной группы может быть эффективно с точки зрения технологии производства защитить функциональную группу подходящей защитной группой на стадии перехода от исходного вещества к промежуточному продукту или заместить функциональную группу группой, которая легко преобразуется.
Примеры функциональных групп включают аминогруппу, гидроксигруппу, карбоксигруппу и др., и защитные группы для них включают группы, описанные в «Protective groups in Organic Synthesis», авторы T. W. Greene и P.G. Wuts, 3rd edition, (1999). В зависимости от реакционных условий их можно выбрать и применять подходящим образом. Согласно этим способам вводят защитную группу, проводят взаимодействие и, если необходимо, защитную группу удаляют или преобразуют в требуемую группу, получая требуемое соединение.
Кроме того, пролекарство из соединения по изобретению можно получить, вводя определенную группу на стадии преобразования исходного вещества в промежуточный продукт аналогично введению описанной выше защитной группы или проводя взаимодействие с использованием полученного соединения по изобретению. Можно проводить взаимодействие, используя способы, хорошо известные специалистам в данной области, основанные на обычной этерификации, амидировании, дегидратации, гидрировании и др.
Здесь далее будут объяснены способы получения соединений по изобретению. Однако способ получения не ограничен следующими способами.
Способ А

[в формуле R2 и R3 каждый имеет такие же значения, как R2a или R2b и R3a или R3b,
R4, R5, Z и m имеют такие же значения, как указанные выше, R6 представляет собой C1-C6 алкильную группу,
L1 и L2 представляют собой уходящую группу для реакции замещения, и
PGc представляет собой защитную группу для карбоксигруппы или группы, эквивалентной карбоксигруппе].
Стадия A-1:
Эта стадия представляет способ получения соединения (a-2) с использованием соединения (a-1), т.е. замещенной бензойной кислоты, и соли N,O-диметилгидроксиламин гидрохлорида, и его можно получить согласно способу, описанному в Tetrahedron 1999, 55, 13159-13170, Kunishima и др.
Стадия A-2:
Эта стадия является стадией получения соединения (a-3), т.е. кетона, с использованием соединения (a-2) и реагента Гриньяра.
Стадия A-3:
Эта стадия является стадией преобразования соединения (a-3) в соединение (a-4) посредством восстановления кетона.
Стадия A-4:
Эта стадия является стадией получения соединения (a-6) при связывании соединения (a-4) с соединением (a-5).
Стадии A-2-A-4 можно осуществить согласно способу, описанному на странице 40, International Publication Pamphlet No. WO 02/14259. Более конкретно, стадию A-2 можно осуществить согласно стадии 2 примера 23, которая описана на странице 49 WO 02/14259. Стадию A-3 можно осуществить согласно стадии 1 примера 21, которая описана на странице 66 WO 02/14259. Стадию A-4 можно осуществить согласно стадии 2 примера 1, которая описана на странице 50, WO 02/14259.
Стадия A-5:
Эта стадия является стадией получения соединения (a-8) по реакции сочетания между соединением (a-6) и соединением (a-7).
Стадия A-6:
Эта стадия является стадией получения соединения (a-10) по реакции сочетания между соединением (a-8) и соединением (a-9).
Стадия A-7:
Эта стадия является стадией получения соединения (a-11) посредством удаления защитной группы соединения (a-10).
Стадии A-5-A-7 можно осуществить согласно примеру взаимодействия, который описан в WO 04/106280 на странице 61. Более конкретно, стадию A-5 можно осуществить на основании стадии 2 примера 1, который описан в WO 04/106280 на странице 67. Стадию A-6 можно осуществить согласно стадии 4 примера 1, который описан в WO 04/106280 на странице 68. Стадию A-7 можно осуществить согласно стадии 5 примера 1, который описан в WO 04/106280 на странице 68.
Способ B
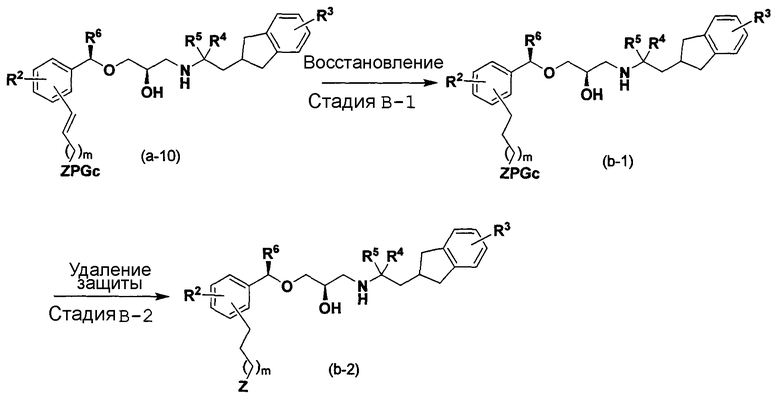
[в формуле R2, R3, R4, R5, R6, Z, PGc и m имеют такие же значения, как указанные выше].
Стадия В-1:
Эта стадия является стадией получения соединения (В-1) восстановлением соединения (а-10).
Стадия В-2
Эта стадия является стадией получения соединения (b-2) посредством удаления защитной группы соединения (В-1).
Стадию В-1 можно осуществить согласно примеру 2, показанному в WO 2005/07788 6 на странице 16. Стадию В-2 можно осуществить аналогично стадии А-7, описанной выше.
Способ С

[в формуле R1, R2, R3, R4, R5, R6, Z, L1, PGc и m имеют такие же значения, как указанные выше, и L3 представляет собой уходящую группу для реакции замещения].
Стадия C-1:
Эта стадия является стадией защиты карбокислотной группы соединения (c-1) или его эквивалентной группы при помощи защитной группы.
Стадия C-2:
Эта стадия является стадией получения соединения (c-3), то есть борного эфира, посредством реакции присоединения.
Стадия C-3:
Эта стадия является стадией получения соединения (c-4) по реакции сочетания между соединением (c-3) и соединением (a-6) с использованием катализатора.
Стадия C-4:
Эта стадия является стадией получения соединения (c-5) по реакции сочетания между соединением (c-4) и соединением (a-9) через реакцию замещения на эпоксиде.
Стадия C-5:
Эта стадия является стадией получения соединения (c-6) посредством удаления защитной группы соединения (c-5).
Стадии C-1-C-5 можно осуществить согласно примеру взаимодействия, показанному в WO 2004/094362 на странице 77. Более конкретно, стадию C-1 можно осуществить согласно стадии 2 примера 1-1, который описан в WO 2004/094362 на странице 99. Стадию C-2 и стадию C-3 можно осуществить согласно стадии 3 примера 1-1, который описан в WO 2004/094362 на странице 100. Стадию C-4 можно осуществить согласно стадии 8 примера 1-1, который описан в WO 2004/094362 на странице 103. Стадию C-5 можно осуществить согласно стадии 9 примера 1-1, который описан в WO 2004/094362 на странице 103.
Соединение (a-9) можно получить согласно примеру взаимодействия и примеру 1 из WO 01/53254, которые описаны на страницах 15 и 23, соответственно.
Соединение (d-2) можно получить согласно следующему способу D.
Способ D
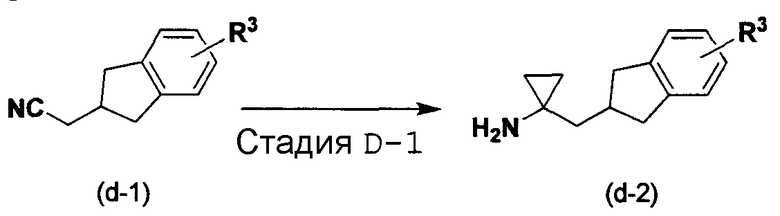
[в формуле R3 имеет такое же значение, как указанное выше].
Стадия D-1:
Ее можно осуществить согласно способу, описанному в J. Org. Chem. 2002, 67, 3965-3968, используя соединение (d-1), раскрытое в WO 98/05651.
Способ E
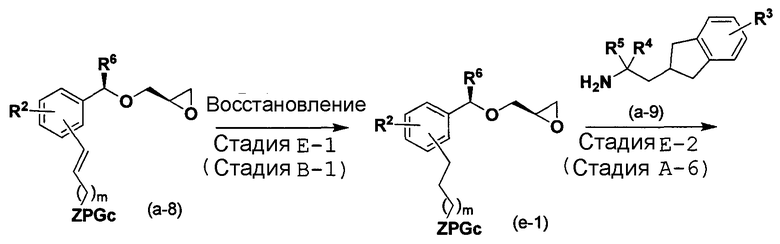
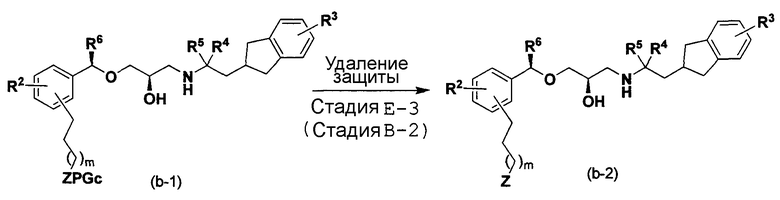
[в формуле R2, R3, R4, R5, R6, Z, L1, PGc и m имеют такие же значения, как указанные выше].
Способ E является способом получения соединения (b-2) по изобретению, аналогичный способу B.
Стадия E-1:
Эта стадия является стадией получения соединения (e-1) из соединения (a-8) посредством проведения реакции восстановления аналогично стадии B-1.
Стадия E-2:
Эта стадия является стадией получения соединения (b-1) посредством проведения реакции сочетания аналогично стадии A-6.
Стадия E-3:
Эта стадия является стадией получения соединения (b-2) посредством проведения реакции по удалению защитной группы аналогично стадии B-2.
Способ F является способом получения соединения (a-3)', которое представляет собой промежуточный продукт для соединений по изобретению.
Способ F
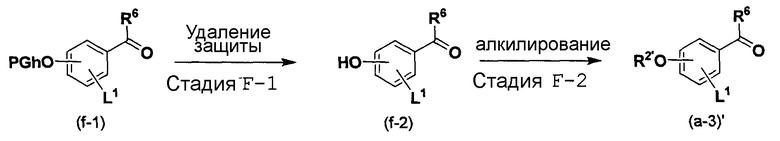
[в формуле R6 и L1 имеют такие же значения, как указанные выше, R2' представляет собой C1-C6 алкильную группу или галогенированная C1-C6 алкильную группу, и PGh представляет собой защитную группу для гидроксигруппы].
Стадия F-1:
Эта стадия является стадией получения соединения (f-2) посредством удаления защитной группы для гидроксигруппы соединения (f-1).
Стадия F-2:
Эта стадия является стадией получения соединения (a-3)' при взаимодействии гидроксигруппы соединения (f-2) с алкилирующим реагентом.
Способ G является способом получения соединения (a-1), которое представляет собой промежуточный продукт при получении соединения по изобретению.
Способ G
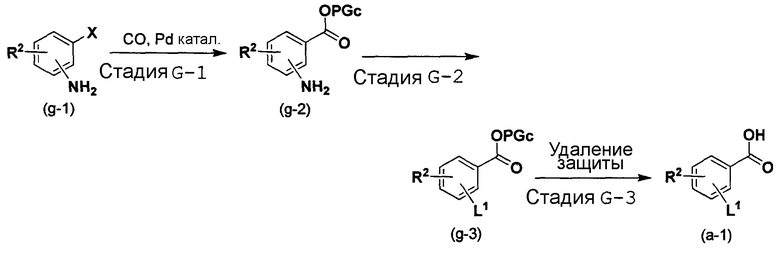
[в формуле R2, L1 и PGc имеют такие же значения, как указанные выше, и X представляет собой галогеновую группу].
Стадия G-1:
Эта стадия является стадией получения соединения (g-2) посредством проведения реакции включения CO в соединение (g-1) в присутствии палладиевого катализатора.
Стадия G-2:
Эта стадия является стадией получения соединения (g-3) посредством преобразования аминогруппы соединения (g-2) в уходящую группу.
Стадия G-3:
Эта стадия является стадией получения соединения (a-1) посредством удаления защитной группы для карбоксигруппы соединения (g-3).
Способ H является способом получения соединения (a-3)'', которое представляет собой промежуточный продукт при получении соединения по изобретению.
Способ H

[в формуле R2 и L1 имеют такие же значения, как указанные выше].
Стадия H-1:
Эта стадия является стадией получения соединения (h-2) посредством взаимодействия соединения (h-1) с оловоорганическим соединением в присутствии палладиевого катализатора.
Стадия H-2:
Эта стадия является стадией получения соединения (c-3)'' посредством проведения взаимодействия, аналогичного взаимодействию на описанной выше стадии G-2.
Способ I является способом получения соединения (c-3), которое представляет собой промежуточный продукт при получении соединения по изобретению.
Способ I

[в формуле R2, R6 и L1 имеют такие же значения, как указанные выше].
Стадия I-1:
Эта стадия является стадией получения соединения (i-1) посредством восстановления карбоксигруппы соединения (a-1).
Стадия I-2:
Эта стадия является стадией получения соединения (i-2) посредством окисления гидроксигруппы соединения (i-1) до альдегида.
Стадия I-3:
Эта стадия является стадией получения соединения (i-3) посредством взаимодействия соединения (i-2) с реагентом Гриньяра.
Стадия I-4:
Эта стадия является стадией получения соединения (a-3) посредством окисления гидроксигруппы соединения (i-3) до кетона.
Способ J является способом получения соединения (a-4)', которое представляет собой промежуточный продукт при получении соединения по изобретению.
Способ J
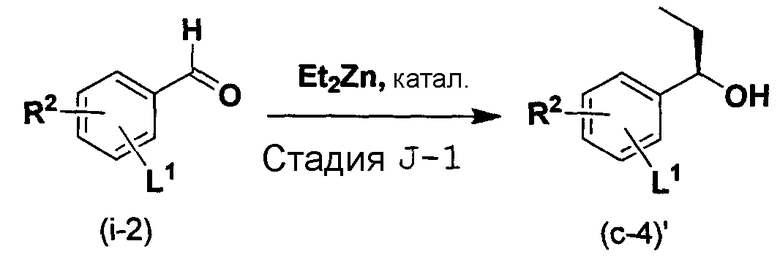
[в формуле R2 и L1 имеют такие же значения, как указанные выше].
Стадия J-1:
Эта стадия является стадией получения соединения (a-4)' посредством взаимодействия альдегидной группы соединения (i-2) с цинкорганическим реагентом.
Способ К
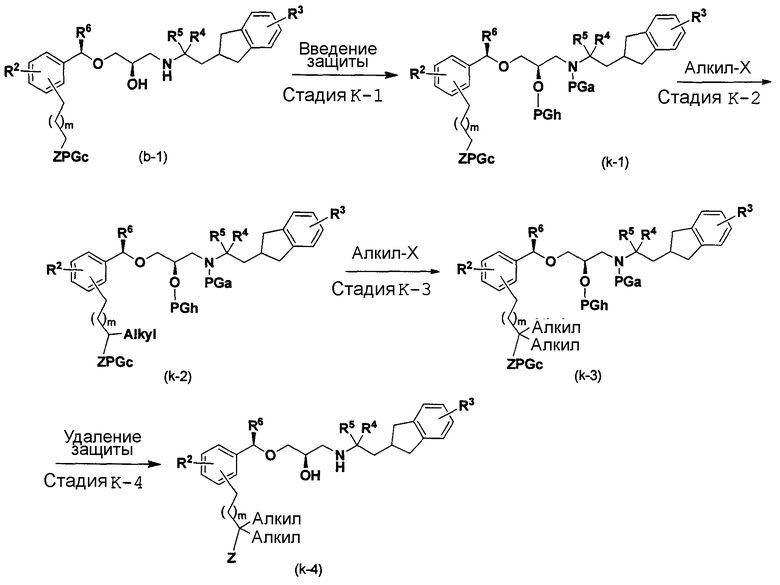
[в формуле R2, R3, R4, R5, R6, m, Z, PGc, PGh, PGa и X имеют такие же значения, как указанные выше, и алкил представляет собой C1-C6 алкильную группу].
Стадия K-1:
Эта стадия является стадией получения соединения (k-1) посредством введения защиты вторичной гидроксигруппы и аминогруппы соединения (B-1).
Стадия K-2 и стадия K-3:
Эта стадия является стадией получения соединения (k-3) посредством постадийного алкилирования соединения (k-1).
Стадия K-4:
Эта стадия является стадией получения соединения (k-4) посредством удаления защитной группы соединения (k-3).
Способ L

[в формуле R2, R3, R4, R5, R6, Z, PGc, PGh и PGa имеют такие же значения, как указанные выше].
Стадия L-1:
Эта стадия является стадией получения соединения (l-2) посредством взаимодействия соединения (l-1) с оловоорганическим соединением в присутствии палладиевого катализатора.
Стадия L-2:
Эта стадия является стадией получения соединения (l-3) через введение первичной гидроксигруппы посредством проведения реакции гидроборирования-окисления соединения (l-2).
Стадия L-3:
Эта стадия является стадией получения соединения (l-4) через введение карбоксигруппы посредством проведения реакции этерификации первичной гидроксигруппы соединения (l-3).
Соединения по изобретению, которые получают согласно описанным выше способам, можно выделить или очистить согласно хорошо известным способам, например, экстракцией, осаждением, перегонкой, хроматографией, фракционной перекристаллизацией, перекристаллизацией и др.
Кроме того, если соединение по изобретению, имеющее формулу (I), или промежуточный продукт в процессе получения имеет хиральный атом углерода, то присутствуют оптические изомеры. Оптические изомеры можно выделить и очистить в виде индивидуальных изомеров согласно общим способам, таким как фракционная перекристаллизация (разделение солей), которая включает перекристаллизацию с использованием подходящей соли, или колоночная хроматография и др. Примеры литературы со ссылками на способы разделения оптических изомеров из рацематов включают «Enantiomers, Racemates and Resolution, John Wiley and Sons, Inc.», J. Jacques и др.
Соединения по изобретению или их фармацевтически приемлемые соли пригодны для лечения или профилактики расстройства, связанного с аномальным костным или минеральным гомеостазом, например, гипопаратиреоза, остеосаркомы, периодонтита, деформационного артрита, ревматоидного артрита, болезни Педжета, синдрома гуморальной гиперкальциемии, связанного со злокачественной опухолью и срастанием переломов костей, и остеопороза.
Если соединение или его фармацевтически приемлемую соль по изобретению вводят млекопитающему (в частности, человеку), то можно применять пероральный или парентеральный способ введения, системно или локально.
После выбора формы, которая подходит для способа введения, можно приготовить фармацевтическую композицию по изобретению согласно различным способам получения препаратов, которые обычно применяют.
Примеры форм перорально вводимой фармацевтической композиции включают таблетку, пилюлю, порошок, гранулу, капсулу, жидкость, суспензию, эмульсию, сироп, эликсир и др. Если необходимо, препараты фармацевтических веществ в виде таких форм можно приготовить согласно обычным способам, используя добавку, которая выбрана подходящим образом из: наполнителя, связующего агента, разрыхлителя, лубриканта, агента набухания, агента, способствующего набуханию, агента покрытия, пластификатора, стабилизатора, консерванта, антиоксиданта, красящего агента, агента, способствующего растворению, суспендирующего агента, эмульгатора, подслащающего агента, консервирующего агента, буферного агента, разбавителя и смачивающего агента и др. агентов, обычно применяемых в качестве добавок.
Примеры парентеральных фармацевтических композиций включают раствор для инъекций, мазь, гель, крем, влажный агент, пластырь, пропеллент, агент для ингаляции, агент для распыления, глазные капли, назальные капли, суппозиторий и др. Если необходимо, получение фармацевтических препаратов в виде таких форм можно осуществить типичными способами, используя добавку, которая подходящим образом выбрана из: стабилизатора, консерванта, агента, способствующего растворению, смачивающего агента, консервирующего агента, антиоксиданта, вкусового агента, гелеобразующего агента, нейтрализующего агента, агента, способствующего растворению, буферного агента, агента изотоничности, поверхностно-активного агента, красящего агента, буферного агента, загустителя, смачивающего агента, наполнителя, промотора абсорбции, суспендирующего агента, связующего агента и др. агентов, которые обычно используют в качестве добавок.
Дозу соединения, имеющего формулу (I), или его фармацевтически приемлемой соли варьируют в зависимости от симптомов, возраста, массы тела и типа и дозировки фармацевтического агента, который вводят в комбинации, и т.д. Однако вообще пероральное или парентеральное введение можно осуществлять либо системно, либо локально, один или несколько раз в день, 0,001-1000 мг на дозу для взрослых (при массе тела примерено 60 кг) в пересчете на соединение, имеющее формулу (I), или предпочтительным является непрерывное внутривенное введение за период от 1 до 24 часов в день.
Кроме того, если необходимо, можно использовать фармацевтическую композицию по изобретению в комбинации с другими эффективными компонентами при таком их количестве, которое не ослабляют эффект изобретения.
Изобретение включает способ профилактики и/или лечения описанных выше расстройств, который отличается тем, что вводят соединение по изобретению или его фармацевтически приемлемую соль.
Кроме того, изобретение включает применение соединения по изобретению или его фармацевтически приемлемой соли для получения описанной выше фармацевтической композиции.
Пример получения 1 (порошки)
Порошок получают смешиванием 5 г соединения по изобретению, 895 г лактозы и 100 г кукурузного крахмала, применяя блендер.
Пример получения 2 (гранулы)
Смешивают 5 г соединения по изобретению, 865 г лактозы и 100 г низкозамещенной гидроксипропилцеллюлозы, добавляют 300 г 10% водного раствора гидроксипропилцеллюлозы и перемешивают до получения однородной массы. Смесь гранулируют, используя экструзионный гранулятор, и сушат, получая гранулы.
Пример получения 3 (таблетки)
Смешивают 5 г соединения по изобретению, 90 г лактозы, 34 г кукурузного крахмала, 20 г кристаллической целлюлоза и 1 г стеарата магния, применяя блендер, и таблетируют при помощи машины для изготовления таблеток, получая таблетки.
(Пример исследования 1)
Оценка ингибирующей активности на кальций-чувствительном рецепторе (CaSR), с использованием в качестве индикатора повышения количества внутриклеточного кальция.
Используя клетки CHO, которые трансформированы до стабильной экспрессии человеческого кальций-чувствительного рецептора (CaSR) (CHO/hCaSR), оценивают CaSR-антагонистическую активность, притом что за показатель принимают повышение исследуемым соединением степени ингибирования внутриклеточного кальция, индуцированное увеличением концентрации внеклеточного кальция.
Препарат, который получают, добавляя CHO/hCaSR к среде F12 (производства Invitrogen), содержащей 10% эмбриональной бычьей сыворотки, до концентрации 2×105 клеток/мл, наносят на 384-луночный планшет в количестве 50 мкл/ячейку и затем инкубируют в течение ночи в CO2-инкубаторе. Культуральный супернатант полностью удаляют, добавляют туда исследовательский буфер (20 мМ HEPES, HBSS (не содержащий Ca и Mg), содержащий 2,5 мМ пробенецид, pH 7,4), содержащий Calcium 3 (производства Molecular Devices), т.е. флуоресцентный индикатор внутриклеточного кальция, в количестве 25 мкл/ячейку, и смесь оставляют на 1 час в CO2-инкубаторе. Тем временем готовят Calcium 3 согласно протоколу, приложенному к исследовательскому набору FLIPR Calcium 3 Assay Kit (производства Molecular Devices). После выдерживания его в течение 1 часа добавляют туда раствор, в котором готовят исследуемое соединение с концентрацией от 2,1 до 20000 нМ (конечная концентрация от 1,05 до 10000 нМ) в исследовательском буфере, в количестве 25 мкл/ячейку и выдерживают в течение 15 мин в CO2-инкубаторе. Затем добавляют раствор CaCl2, приготовленный с концентрацией 8,1 нМ (конечная концентрация 2,7 нМ) с использованием исследовательского буфера, в количестве 25 мкл/ячейку и определяют результирующее повышение концентрации внутриклеточного Ca (т.е. интенсивность флуоресценции) во времени, применяя флуоресцентное планшетное считывающее устройство (FLIPR производства Molecular Devices). Из полученных данных рассчитывают разницу между интенсивностью флуоресценции до добавления раствора CaCl2 и максимальной интенсивностью флуоресценции после добавления раствора CaCl2 и получают концентрацию 50% ингибирования (IC50) для исследуемого соединения.
Согласно настоящему исследованию, соединения, показанные в примерах 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 16, 17, 18, 21, 22, 23, 25, 26, 27, 29, 30, 31 низкая полярность, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 58, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83 и 85 демонстрируют ингибирующую активность IC50 1,1 мкг/мл или менее.
(Пример исследования 2)
Оценка активности промотирования PTH-секреции у крыс
Самкам крыс F344 10-14-недельного возраста (Charles River Japan, Inc.), голодавшим в течение ночи, проводят анестезию эфиром и готовят сыворотку крови до введения, отбирая кровь из яремной вены животного. Затем вводят исследуемое соединение перорально при дозе 3 мг/5 мл/кг, используя растворитель (0,5% водный раствор метилцеллюлозы, содержащий 5% DMA). Отбирают кровь из яремной вены под анестезией через 5, 15, 30, 60, 120 и 240 мин после введения исследуемого соединения и готовят сыворотку крови. Концентрацию PTH в сыворотке крови определяют, используя набор ELISA для определения крысиного интактного PTH (производства Immutopics, Inc.).
Согласно настоящему исследованию, соединения, показанные в примерах 1, 2, 3, 4, 5, 7, 8, 9, 11, 13, 14, 17, 18, 21, 22, 23, 26, 27, 29, 33, 35, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 52, 53, 60, 61, 62, 63, 66, 67, 69, 70, 71, 73, 75, 76 и 78, повышают концентрацию PTH в сыворотке крови от 100 пг/мл или менее в момент времени, соответствующий минуте 0, до 400 пг/мл или более к минуте 15-30, и через 240 мин они понижают концентрацию до 200 пг/мл или ниже.
Конкретные результаты приведены в таблице 1 и таблице 2.
соединение
соединение
ПРИМЕРЫ
Пример 1
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота
(1a) Метил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}проп-2-еноат.
Смесь метил (2E)-3-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноата (342 мг, 1,30 ммоль), описанного в WO 2004/106280, 1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-амина (234 мг, 1,24 ммоль), описанного в WO 01/53254, и перхлората лития (79 мг, 0,74 ммоль) в толуоле (12 мл) перемешивают при комнатной температуре в течение 16 часов. Добавляют к реакционному раствору воду (10 мл), затем проводят экстракцию этилацетатом (10 мл ×3). После этого, органические слои объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (этилацетат), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (206 мг, выход 37%).
(1b) Метил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропаноат
В раствор метил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}проп-2-еноата (206 мг, 0,46 ммоль), который получен в примере 1(1a), в этаноле (4,6 мл) добавляют 10% палладий на угле (влажность 50 мас.%, 100 мг) и гидрируют при атмосферном давлении в течение 3 часов. Реакционный раствор фильтруют через целит и промывают этанолом. Отгоняют растворитель при пониженном давлении, получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (209 мг, количественно).
(1c) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота
К смеси раствора метил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропаноата (209 мг, 0,46 ммоль), который получен в примере 1(1b), в тетрагидрофуране (1,38 мл) и метаноле (1,38 мл) добавляют 2N водный раствор гидроксида натрия (0,69 мл, 1,38 ммоль) и перемешивают при комнатной температуре в течение 16 часов. Реакционный раствор концентрируют при пониженном давлении. К остатку добавляют воду (10 мл), затем 1N водный раствор хлористого водорода (1,38 мл) и далее проводят экстракцию этилацетатом (10 мл ×2). Органические слои объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении, получая указанное в заголовке соединение в виде белого аморфного вещества (178 мг, выход 88%).
Пример 2
4-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}бутановая кислота
(2a) Метил (3E)-4-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)бут-3-еноат
В атмосфере аргона перемешивают смесь (2R)-2-{[(1R)-1-(2-бромфенил)этокси]метил}оксирана (1,00 г, 3,89 ммоль), описанного в WO 2004/094362, метил бут-3-еноата (497 мкл, 4,67 ммоль), ацетата палладия (II) (44 мг, 0,19 ммоль), трис(2-метилфенил)фосфина (59 мг, 0,19 ммоль) и триэтиламина (0,65 мл, 4,67 ммоль) в ацетонитриле (10 мл), нагревая при кипячении с обратным холодильником в течение 3 часов. Реакционный раствор охлаждают до комнатной температуры, фильтруют через целит и промывают ацетонитрилом. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде желтого маслянистого вещества (246 мг, выход 23%).
(2b) Метил (3E)-4-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}бут-3-еноат
Используя метил (3E)-4-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил]фенил)бут-3-еноат, который получен в примере 2(2a), проводят взаимодействие также, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (выход 18%).
(2c) Метил 4-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}бутаноат
Используя метил (3E)-4-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}бут-3-еноат, который получен в примере 2(2b), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 81%).
(2d) 4-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}бутановая кислота
Используя метил 4-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}бутаноат, который получен в примере 2(2c), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде светло-коричневого аморфного вещества (выход 59%).
Пример 3
2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоновая кислота
(3a) Метил 2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоксилат
Используя метил 3-метил-2'-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}бифенил-4-карбоксилат, описанный в WO 2004/094362, проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 37%).
(3b) 2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоновая кислота
Используя метил 2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоксилат, который получен в примере 3(3a), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого аморфного вещества (выход 54%).
Пример 4
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}пропановая кислота
(4а) (1R)-1-(2-бром-3-метилфенил)этанол (+)-В-хлордиизопинокамфеилборан (8,46 г, 26,4 ммоль) растворяют в тетрагидрофуране (150 мл), охлаждают до -20°С, медленно добавляют по капле раствор 1-(2-бром-3-метилфенил)этанона (4,30 г, 20,3 ммоль), описанного в US 2007/167506, в тетрагидрофуране (50 мл) и перемешивают в течение 18 часов. К реакционному раствору добавляют диэтаноламин (6,38 г, 60,8 ммоль), охлажденный до комнатной температуры, и перемешивают при комнатной температуре в течение 3 часов. Реакционный раствор концентрируют при пониженном давлении и добавляют н-гексан (100 мл). Выпавшие в осадок твердые вещества отфильтровывают и отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат=4/1), получая указанное в заголовке соединение в виде белого твердого вещества (4,30 г, выход 99% 95,6%ее).
(4b) (2R)-2-{[(1R)-1-(2-бром-3-метилфенил)этокси]метил}оксиран
(1R)-1-(2-бром-3-метилфенил)этанол (2,00 г, 9,30 ммоль), полученный в примере 4 (4а), и (R)-глицидил 3-нитробензолсульфоновую кислоту (3,13 г, 12,1 ммоль) растворяют в N,N-диметилформамиде (45 мл), добавляют гидрид натрия (608 мг, содержание 55%, 14,0 ммоль) и перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют воду и проводят экстракцию этилацетатом. После этого органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (1,51 г, выход 60%).
(4c) Этил (2E)-3-(2-метил-6-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}-6-метилфенил)проп-2-еноат
(2R)-2-{[(1R)-1-(2-бром-3-метилфенил)этокси]метил}оксиран (1505 мг, 5,57 ммоль), который получен в примере 4(4b), этил проп-2-еноат (910 мкл, 8,36 ммоль), ацетат палладия (II) (126 мг, 0,56 ммоль), трис(2-метилфенил)фосфин (170 мг, 0,56 ммоль) и карбонат калия (1537 мг, 11,1 ммоль) суспендируют в смешанном растворителе (27,5 мл) пропионитрил-вода (2:1) и перемешивают, нагревая при кипячении с обратным холодильником в течение 5 часов. Реакционный раствор охлаждают до комнатной температуры, фильтруют, используя Millicup (зарегистрированная торговая марка, производства Millipore), и промывают этилацетатом. Органический слой промывают водой и насыщенным раствором соли и затем сушат над безводным сульфатом магния. После этого отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (1025 мг, выход 63%).
(4d) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}проп-2-еноат
Используя этил (2E)-3-(2-метил-6-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат, который получен в примере 4(4c), проводят взаимодействие также, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 37%).
(4e) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}проп-2-еноат, который получен в примере 4(4d), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 95%).
(4f) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}пропаноат, который получен в примере 4(4e), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого аморфного вещества (выход 87%).
Пример 5
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-метилфенил}пропановая кислота
(5a) (1R)-1-(2-бром-4-метилфенил)этанол
Используя 1-(2-бром-4-метилфенил)этанон, описанный в WO 2001/049649, проводят взаимодействие так же, как в способе, описанном в примере 4(4a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%, 95,3%ee).
(5b) (2R)-2-{[(1R)-1-(2-бром-4-метилфенил)этокси]метил}оксиран
Используя (1R)-1-(2-бром-4-метилфенил)этанол, который получен в примере 5(5a), проводят взаимодействие так же, как в способе, описанном в примере 4(4b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 57%).
(5c) Этил (2E)-3-(3-метил-6-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат
Используя (2R)-2-{[(1R)-1-(2-бром-4-метилфенил)этокси]метил}оксиран, который получен в примере 5(5b), проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (выход 51%).
(5d) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-метилфенил}проп-2-еноат
Используя этил (2E)-3-(3-метил-6-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат, который получен в примере 5(5c), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение (выход 99%) в виде бесцветного маслянистого вещества.
(5e) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-метилфенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси]этил]-5-метилфенил}проп-2-еноат, который получен в примере 5(5d), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 92%).
(5f) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-метилфенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-метилфенил}пропаноат, который получен в примере 5(5e), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого аморфного вещества (выход 84%).
Пример 6
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-метилфенил}пропановая кислота
(6a) (1R)-1-(2-бром-5-метилфенил)этанол
Используя 1-(2-бром-5-метилфенил)этанон, описанный в J. Org. Chem. 1960, 25, 1016-1020, проводят взаимодействие так же, как в способе, описанном в примере 4(4a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 96%, 95,4%ее).
(6b) (2R)-2-{[(1R)-1-(2-бром-5-метилфенил)этокси]метил}оксиран
Используя (1R)-1-(2-бром-5-метилфенил)этанол, который получен в примере 6(6a), проводят взаимодействие так же, как в способе, описанном в примере 4(4b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 66%).
(6c) Этил (2E)-3-(4-метил-2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат
Используя (2R)-2-{[(1R)-1-(2-бром-5-метилфенил)этокси]метил}оксиран, который получен в примере 6(6b), проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (выход 78%).
(6d) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-метилфенил}проп-2-еноат
Используя этил (2E)-3-(4-метил-2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат, который получен в примере 6(6c), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%).
(6e) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-метилфенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-метилфенил}проп-2-еноат, который получен в примере 6(6d), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 84%).
(6f) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-метилфенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-метилфенил}пропаноат, который получен в примере 6(6e), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого аморфного вещества (выход 87%).
Пример 7
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-фторфенил}пропановая кислота
(7a) (1R)-1-(2-бром-3-фторфенил)этанол
Используя 1-(2-бром-3-фторфенил)этанон, описанный в Tetrahedron Lett. 1995, 36, 881-884, проводят взаимодействие так же, как в способе, описанном в примере 4(4a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%, 96,3%ее).
(7b) (2R)-2-{[(1R)-1-(2-бром-3-фторфенил)этокси]метил}оксиран
Используя (1R)-1-(2-бром-3-фторфенил)этанол, который получен в примере 7(7a), проводят взаимодействие так же, как в способе, описанном в примере 4(4b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 55%).
(7c) Этил (2E)-3-(2-фтор-6-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат
Используя (2R)-2-{[(1R)-1-(2-бром-3-фторфенил)этокси]метил}оксиран, который получен в примере 7(7b), проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (выход 85%).
(7d) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-фторфенил}проп-2-еноат
Используя этил (2E)-3-(2-фтор-6-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат, который получен в примере 7(7c), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 75%).
(7e) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-фторфенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси]этил]-6-фторфенил}проп-2-еноат, который получен в примере 7(7d), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 85%).
(7f) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-фторфенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-фторфенил}пропаноат, который получен в примере 7(7e), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого аморфного вещества (выход 99%).
Пример 8
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}пропановая кислота
(8a) (1R)-1-(2-бром-4-фторфенил)этанол
Используя 1-(2-бром-4-фторфенил)этанон, описанный в WO 2008/025509, проводят взаимодействие так же, как в способе, описанном в примере 4(4a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%, 95,6%ее).
(8b) (2R)-2-{[(1R)-1-(2-бром-4-фторфенил)этокси]метил}оксиран
Используя (1R)-1-(2-бром-4-фторфенил)этанол, который получен в примере 8(8a), проводят взаимодействие так же, как в способе, описанном в примере 4(4b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 58%).
(8c) Этил (2E)-3-(3-фтор-6-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат
Используя (2R)-2-{[(1R)-1-(2-бром-4-фторфенил)этокси]метил}оксиран, который получен в примере 8(8b), проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (выход 78%).
(8d) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}проп-2-еноат
Используя этил (2E)-3-(3-фтор-6-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат, который получен в примере 8(8c), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 96%).
(8e) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}проп-2-еноат, который получен в примере 8(8d), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 86%).
(8f) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}пропаноат, который получен в примере 8(8e), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого аморфного вещества (выход 89%).
Пример 9
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-фторфенил}пропановая кислота
(9a) (1R)-1-(2-бром-5-фторфенил)этанол
Используя 1-(2-бром-5-фторфенил)этанон, проводят взаимодействие так же, как в способе, описанном в примере 4(4a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 96%, 95,7%ее).
(9b) (2R)-2-{[(1R)-1-(2-бром-5-фторфенил)этокси]метил}оксиран
Используя (1R)-1-(2-бром-5-фторфенил)этанол, который получен в примере 9(9a), проводят взаимодействие так же, как в способе, описанном в примере 4(4b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 77%).
(9c) Этил (2E)-3-(4-фтор-2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат
Используя (2R)-2-{[(1R)-1-(2-бром-5-фторфенил)этокси]метил}оксиран, который получен в примере 9(9b), проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (выход 54%).
(9d) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-фторфенил}проп-2-еноат
Используя этил (2E)-3-(4-фтор-2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат, который получен в примере 9(9c), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%).
(9e) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-фторфенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси]этил]-4-фторфенил}проп-2-еноат, который получен в примере 9(9d), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 76%).
(9f) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-фторфенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-фторфенил}пропаноат, который получен в примере 9(9e), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого твердого вещества (выход 79%).
Пример 10
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-(трифторметил)фенил}пропановая кислота
(10a) 1-[2-Бром-3-(трифторметил)фенил]этанон
Смесь раствора 2-бром-3-(трифторметил)бензойной кислоты (2,50 г, 9,29 ммоль), N,O-диметилгидроксиламингидрохлорида (1,18 г, 12,1 ммоль), N-метилморфолина (2,1 мл, 18,6 ммоль) и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолинийхлорида (3,78 г, 12,1 ммоль) в ацетонитриле (45 мл) перемешивают при комнатной температуре в течение 18 часов. Реакционный раствор концентрируют при пониженном давлении. К результирующему остатку добавляют 1N водный раствор хлористого водорода и проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток растворяют в тетрагидрофуране (90 мл), добавляют раствор (0,93 M) метилмагнийбромида в тетрагидрофуране (13,0 мл, 12,1 ммоль) при -20°C и перемешивают при комнатной температуре в течение 18 часов. Реакционный раствор выливают на 1N водный раствор хлористого водорода и проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (1,27 г, выход 44%).
(10b) (1R)-1-[2-Бром-3-(трифторметил)фенил]этанол
Используя 1-[2-бром-3-(трифторметил)фенил]этанон, который получен в примере 10(10a), проводят взаимодействие так же, как в способе, описанном в примере 4(4a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%, 97,5%ее).
(10c) (2R)-2-({(1R)-1-[2-бром-3-(трифторметил)фенил]этокси]метил)оксиран
Используя (1R)-1-[2-бром-3-(трифторметил)фенил]этанол, который получен в примере 10(10b), проводят взаимодействие так же, как в способе, описанном в примере 4(4b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 55%).
(10d) Этил (2E)-3-[2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}-6-(трифторметил)фенил]проп-2-еноат
Используя (2R)-2-({(1R)-1-[2-бром-3-(трифторметил)фенил]этокси}метил)оксиран, который получен в примере 10(10c), проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (выход 25%).
(10е) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-(трифторметил)фенил}проп-2-еноат
Используя этил (2E)-3-[2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}-6-(трифторметил)фенил]проп-2-еноат, который получен в примере 10(10d), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 82%).
(10f) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-(трифторметил)фенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-(трифторметил)фенил}проп-2-еноат, который получен в примере 10(10e), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 87%).
(10g) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-(трифторметил)фенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-(трифторметил)фенил}пропаноат, который получен в примере 10(10f), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого твердого вещества (выход 96%).
Пример 11
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-(трифторметил)фенил}пропановая кислота
(11a) 1-[2-Бром-4-(трифторметил)фенил]этанон
Используя 2-бром-4-(трифторметил)бензойную кислоту, проводят взаимодействие так же, как в способе, описанном в примере 10(10a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 84%).
(11b) (1R)-1-[2-Бром-4-(трифторметил)фенил]этанол
Используя 1-[2-бром-4-(трифторметил)фенил]этанон, который получен в примере 11(11a), проводят взаимодействие так же, как в способе, описанном в примере 4(4a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%, 94,7%ее).
(11c) (2R)-2-({(1R)-1-[2-Бром-4-(трифторметил)фенил]этокси}метил)оксиран
Используя (1R)-1-[2-бром-4-(трифторметил)фенил]этанол, который получен в примере 11(11b), проводят взаимодействие так же, как в способе, описанном в примере 4(4b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 70%).
(11d) Этил (2E)-3-[2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}-5-(трифторметил)фенил]проп-2-еноат
Используя (2R)-2-({(1R)-1-[2-бром-4-(трифторметил)фенил]этокси}метил)оксиран, который получен в примере 11(11c), проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 83%).
(11e) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-(трифторметил)фенил}проп-2-еноат
Используя этил (2E)-3-[2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}-5-(трифторметил)фенил]проп-2-еноат, который получен в примере 11(11d), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 98%).
(11f) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-(трифторметил)фенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-(трифторметил)фенил}проп-2-еноат, который получен в примере 11 (11e), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 97%).
(11g) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-(трифторметил)фенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-(трифторметил)фенил}пропаноат, который получен в примере 11(11f), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого аморфного вещества (выход 97%).
Пример 12
2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоновая кислота
(12a) 1-(2,3-дигидро-1H-инден-2-илметил)циклопропанамин
Используя 2,3-дигидро-1H-инден-2-ил ацетонитрил (157 мг, 1,00 ммоль), описанный в WO 1998/005651, этил магнийбромид (3M раствор в диэтиловом эфире, 0,67 мл, 2,00 ммоль), тетраизопропоксититан (0,33 мл, 1,10 ммоль) и комплекс трифторборан-диэтиловый эфир (0,25 мл, 2,00 ммоль), проводят взаимодействие так же, как в способе, описанном в J. Org. Chem. 2002, 67, 3965, получая указанное в заголовке соединение в виде белого твердого вещества (124 мг, выход 66%).
(12b) Метил 2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил-3-метилбифенил-4-карбоксилат
Используя 1-(2,3-дигидро-1H-инден-2-илметил)циклопропанамин, который получен в примере 12(12a), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 28%).
(12c) 2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси]этил]-3-метилбифенил-4-карбоновая кислота
Используя метил 2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил-3-метилбифенил-4-карбоксилат, который получен в примере 12(12b), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде белого твердого вещества (выход 93%).
Пример 13
5-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пентановая кислота
(13a) Этил (4E)-5-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)пент-4-еноат
Используя (2R)-2-{[(1R)-1-(2-бромфенил)этокси]метил}оксиран, описанный в WO 2004/094362 и этил пент-4-еноат, проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 82%).
(13b) Этил (4E)-5-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пент-4-еноат
Используя этил (4E)-5-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)пент-4-еноат, который получен в примере 13(13a), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 100%).
(13c) Этил 5-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пентаноат
Используя этил (4E)-5-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пент-4-еноат, который получен в примере 13(13b), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 90%).
(13d) 5-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пентановая кислота
Используя этил 5-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пентаноат, который получен в примере 13(13c), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде бесцветного аморфного вещества (выход 96%).
Пример 14
3-{2-[(1R)-1-{[(2R)-3-1[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота
(14a) Этил (2E)-3-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат
Используя (2R)-2-{[(1R)-1-(2-бромфенил)этокси]метил}оксиран, описанный в WO 2004/094362, проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде желтого маслянистого вещества (выход 95%).
(14b) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил]проп-2-еноат
Используя этил (2E)-3-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)проп-2-еноат, который получен в примере 14 (14a), и 1-(2,3-дигидро-1H-инден-2-илметил)циклопропанамин, который получен в примере 12(12a), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 39%).
(14c) Этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси]этил]фенил}пропаноат
Используя этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил]проп-2-еноат, который получен в примере 14(14b), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 39%).
(14d) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота
Используя этил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил]фенил}пропаноат, который получен в примере 14(14c), проводят взаимодействие так же, как в способе, описанном в примере 1(1c), получая указанное в заголовке соединение в виде бесцветного аморфного вещества (количественно).
Ниже приведены структуры и физико-химические данные соединений, которые описаны в примерах 1-14 (Таблица 3-13).
В качестве промежуточных соединений для получения соединений Примеров были получены следующие соединения. Получение было выполнено в соответствии со стадиями примера 4. В частности, пример 4(4а)-2, описанный ниже, показывает, что получение осуществляется согласно стадиям примера 4(4а). Другие соединения, обозначенные числом после дефиса, указывают, что соединения получаются в соответствии с теми же стадиями, как описано в примере, на которых они основаны (Таблица 14-34).
Соединения описанных ниже примеров получают со ссылкой на стадии, которые описаны выше в примерах 1-14. Например, в примерах 1-68 стадии получения выполняют в таком порядке: (1) реакция сочетания, (2) гидрирование олефина и (3) гидролиз сложного эфира, подобно стадиям получения 1(a), 1(b) и 1(c) примера 1 (Таблица 35-41).
Пример 31
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-фторфенил}пропановая кислота и 3-{2-[(1S)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-фторфенил}пропановая кислота
(31c) Этил 3-[2-(1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил)-3-фторфенил]пропаноат (115 мг, 0,25 ммоль), который получен в примере 31(31b), растворяют в смешанном растворителе тетрагидрофуран-метанол-вода (4:1:1, 1 мл), добавляют 4N водный раствор гидроксида натрия (62 мкл, 0,25 ммоль) и затем перемешивают при комнатной температуре в течение 4 часов. После нейтрализации посредством добавления 1N водного раствора хлористого водорода (0,25 ммоль) смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на диолсиликагеле (SHOKO SCIENTIFIC CO., LTD.; дихлорметан/метанол = 20/1), получая 53 мг 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-фторфенил}пропановой кислоты (низкая полярность, выход 46%) и 44 мг 3-{2-[(1S)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-фторфенил}пропановой кислоты (высокая полярность, выход 39%), каждая в виде бесцветного аморфного вещества (Таблица 42-59).
Соединения описанных ниже примеров получают со ссылкой на стадии, которые описаны выше в примерах 1-14. Например, в примерах 1-68 стадии получения выполняют в таком порядке: (1) реакция сочетания, (2) гидрирование олефина и (3) гидролиз сложного эфира, подобно стадиям получения 1(a), 1(b) и 1(c) примера 1. Однако примеры 69-80 отличаются тем, что стадии получения выполняют в таком порядке: (1) гидрирование олефина, (2) реакция сочетания и (3) гидролиз сложного эфира (Таблица 60-63).
Пример 81
(2R)-1-[(2S)-2-(3-Фтор-4-метилбензил)пирролидин-1-ил]-3-[(1R)-1-{2-[2-(2H-тетразол-5-ил)этил]фенил}этокси]пропан-2-ол
(81a) 5-Этенил-2-{[2-(триметилсилил)этокси]метил-2H-тетразол
5-Этенил-2H-тетразол (5,85 г, 60,9 ммоль), описанный в WO 2009/10530, [2-(хлорметокси)этил](триметил)силан (12,9 мл, 73,1 ммоль) и карбонат калия (16,8 г, 122 ммоль) растворяют в N,N-диметилформамиде (300 мл) и перемешивают в течение 22 часов при комнатной температуре в атмосфере азота. Реакционный раствор фракционируют посредством добавления в него смеси этилацетат/гексан (1:1, об./об.) и воды и экстрагируют водный слой смесью этилацетат/гексан (1:1, об./об.). Органические слои объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат, 100:0=70:30, об./об.), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (6,31 г, выход 46%).
(81b) 5-[(E)-2-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)этенил]-2-[[2-(триметилсилил)этокси]метил]-2H-тетразол
Используя 5-этенил-2-{[2-(триметилсилил)этокси]метил-2H-тетразол, который получен в примере 81(81a), проводят взаимодействие так же, как в способе, описанном в примере 4(4c), получая указанное в заголовке соединение в виде желтого маслянистого вещества (выход 88%).
(81c) (2R)-1-[[2-(2,3-дигидро-1H-инден-2-ил)-1,1-диметилэтил]амино]-3-[(1R)-1-{2-[(E)-2-(2-{[2-(триметилсилил)этокси]метил}-2H-тетразол-5-ил)этенил]фенил}этокси]пропан-2-ол
Используя 5-[(E)-2-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)этенил]-2-[[2-(триметилсилил)этокси]метил]-2H-тетразол, который получен в примере 81(81b), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (количественно).
(81d) (2R)-1-[[2-(2,3-дигидро-1H-инден-2-ил)-1,1-диметилэтил]амино]-3-[(1R)-1-{2-[2-(2-{[2-(триметилсилил)этокси]метил}-2H-тетразол-5-ил)этил]фенил}этокси]пропан-2-ол
Используя (2R)-1-[[2-(2,3-дигидро-1H-инден-2-ил)-1,1-диметилэтил]амино]-3-[(1R)-1-{2-[(E)-2-(2-{[2-(триметилсилил)этокси]метил}-2H-тетразол-5-ил)этенил]фенил}этокси]пропан-2-ол, который получен в примере 81(81c), проводят взаимодействие так же, как в способе, описанном в примере 1(1b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%).
(81e) (2R)-1-[[2-(2,3-дигидро-1H-инден-2-ил)-1,1-диметилэтил]амино]-3-[(1R)-1-{2-[2-(2H-тетразол-5-ил)этил]фенил}этокси]пропан-2-олформиат
(2R)-1-[[2-(2,3-дигидро-1H-инден-2-ил)-1,1-диметилэтил]амино]-3-[(1R)-1-{2-[2-(2-{[2-(триметилсилил)этокси]метил}-2H-тетразол-5-ил)этил]фенил}этокси]пропан-2-ол (580 мг, 0,977 ммоль), который получен в примере 81(81d), растворяют в тетрагидрофуране (4,0 мл), добавляют 1,0 M раствор фторида тетрабутиламмония в тетрагидрофуране (3,22 мл, 3,22 ммоль) и затем перемешивают при 45°C в течение 27 часов. Реакционный раствор охлаждают до комнатной температуры и отгоняют растворитель при пониженном давлении. К полученной смеси добавляют этилацетат и 1N водный раствор хлористого водорода с целью нейтрализации и проводят экстракцию этилацетатом. Растворитель удаляют при пониженном давлении. Остаток очищают методом ВЭЖХ с обращенной фазой (колонка: Develosil (NOMURA CHEMICAL) 28 мм ×10 см; скорость потока: 25 мл/мин; подвижная фаза: 0,1% водный раствор муравьиной кислоты: 0,1% раствор ацетонитрилформиата, 55:45, об./об.), получая указанное в заголовке соединение в виде бесцветного аморфного вещества (170 мг, выход 34%).
Пример 82
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}-2,2-диметилпропановая кислота
(82a) Метил 3-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}пропаноат
К раствору метил 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропаноата (557 мг, 1,23 ммоль), который получен в примере 1(1b), в тетрагидрофуране (12 мл) добавляют карбонилдиимидазол (398 мг, 2,46 ммоль) и 4-диметиламинопиридин (14,7 мг, 0,12 ммоль) и перемешивают при 50°C в течение 26 часов. По завершении взаимодействия реакционный раствор разбавляют этилацетатом, промывают 1N водным раствором хлористого водорода и насыщенным раствором соли и затем сушат над безводным сульфатом магния. После этого отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 65/35), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (493 мг, выход 84%).
(82b) Метил 3-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро--1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}-2-метилпропаноат
К диизопропиламину (0,028 мл, 0,20 ммоль) добавляют 2,69 M раствор н-бутиллития в гексане (0,74 мл, 0,20 ммоль) при -78°C с последующим перемешиванием в течение 15 мин. После добавления безводного тетрагидрофурана (0,2 мл) смесь дополнительно перемешивают в течение 5 мин при -78°C. Затем добавляют туда раствор метил 3-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}пропаноата (48 мг, 0,10 ммоль), который получен в примере 82(82a), в тетрагидрофуране (0,2 мл) и перемешивают при -78°C в течение 15 мин. После добавления метилйодида (0,013 мл, 0,20 ммоль) смесь перемешивают при -78°C в течение 1,25 часов. По завершении взаимодействия повышают температуру до комнатной. К смеси добавляют насыщенный водный раствор хлорида аммония и проводят экстракцию дихлорметаном. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 7/3), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (29,6 мг, выход 60%).
(82c) Метил 3-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}-2,2-диметилпропаноат
К диизопропиламину (0,07 мл, 0,50 ммоль) добавляют при -78°C 2,69 M раствор н-бутиллития в гексане (0,19 мл, 0,50 ммоль) с последующим перемешиванием в течение 20 минут. После добавления безводного тетрагидрофурана (0,5 мл) смесь дополнительно перемешивают в течение 15 мин при -78°C. Затем добавляют туда раствор метил 3-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}-2-метилпропаноата (245 мг, 0,50 ммоль), который получен в примере 82(82b), в тетрагидрофуране (0,5 мл) и перемешивают при -78°C в течение 1 часа. После добавления метилйодида (0,14 мл, 2,28 ммоль) смесь перемешивают при комнатной температуре в течение 22 часов. По завершении взаимодействия к смеси добавляют насыщенный водный раствор хлорида аммония и проводят экстракцию этилацетатом. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 75/25), получая указанное в заголовке соединение в виде светло-желтого маслянистого вещества (207 мг, выход 82%).
(82d) 3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}-2,2-диметилпропановая кислота
К раствору метил 3-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}-2,2-диметилпропаноата (206 мг, 0,41 ммоль), который получен в примере 82(82c), в метаноле (3 мл) добавляют 50% водный раствор гидроксида калия (1,5 мл) и перемешивают при 100°C в течение 26 часов. По завершении взаимодействия реакционный раствор нейтрализуют, добавляя 6N водный раствор хлористого водорода, разбавляют водой и проводят экстракцию этилацетатом. После этого отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (этилацетат/метанол = 85/15), получая указанное в заголовке соединение в виде белого твердого вещества (112 мг, выход 59%).
Пример 83
(2-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}этокси)уксусная кислота
(83a) (2R)-1-[(1R)-1-(2-бромфенил)этокси]-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}пропан-2-ол
Используя (2R)-2-{[(1R)-1-(2-бромфенил)этокси]метил}оксиран, описанный в WO 2004/106280, проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 99%).
(83b) (5R)-5-{[(1R)-1-(2-бромфенил)этокси]метил}-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-1,3-оксазолидин-2-он
Используя (2R)-1-[(1R)-1-(2-бромфенил)этокси]-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}пропан-2-ол, который получен в примере 83(83a), проводят взаимодействие так же, как в способе, описанном в примере 82(82a), получая указанное в заголовке соединение в виде маслянистого вещества (выход 94%).
(83c) (5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-5-{[(1R)-1-(2-этенилфенил)этокси]метил}-1,3-оксазолидин-2-он
(5R)-5-{[(1R)-1-(2-бромфенил)этокси]метил}-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-1,3-оксазолидин-2-он (1,12 г, 2,38 ммоль), который получен в примере 83(83b), растворяют в 1,4-диоксане (25 мл), добавляют трибутил(винил)олово (1,04 мл, 3,57 ммоль) и тетракистрифенилфосфинпалладий (277 мг, 0,24 ммоль) и перемешивают в течение 16 часов при 100°C. После охлаждения реакционного раствора до комнатной температуры отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (970 мг, выход 97%).
(83d) (5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-5-({(1R)-1-[2-(2-гидроксиэтил)фенил]этокси]метил)-1,3-оксазолидин-2-он
(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-5-{[(1R)-1-(2-этенилфенил)этокси]метил}-1,3-оксазолидин-2-он (970 мг, 2,32 ммоль), который получен в примере 83(83c), растворяют в тетрагидрофуране (20 мл) и добавляют при 0°C 0,5 M раствор 9-борабицикло[3,3,1]нонана (5,56 мл, 2,78 ммоль) в тетрагидрофуране. После повышения температуры до комнатной, смесь перемешивают в течение 16 часов. Реакционный раствор снова охлаждают до 0°C, добавляют 1N водный раствор гидроксида натрия (10 мл) и 30% раствор пероксида водорода (10 мл) и затем перемешивают в течение 4 часов. Реакционный раствор экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на основном силикагеле (н-гексан/этилацетат = 2/3), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (800 г, выход 79%).
(83e) Этил (2-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}этокси)ацетат
(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-5-({(1R)-1-[2-(2-гидроксиэтил)фенил]этокси}метил)-1,3-оксазолидин-2-он (371 мг, 0,82 ммоль), который получен в примере 83(83d), растворяют в метиленхлориде (10 мл), добавляют димер диацетата родия (36 мг, 0,082 ммоль) и этилдиазоацетат (128 мкл, 1,23 ммоль) при 0°C и перемешивают в течение 1,5 часов. К реакционному раствору добавляют этанол для прекращения взаимодействия. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на основном силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (298 мг, выход 68%).
(83f) (2-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}этокси)уксусная кислота
Этил (2-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}этокси)ацетат (298 мг, 0,56 ммоль), который получен в примере 83(83e), растворяют в смешанном растворителе метанол-вода (1:1, 8 мл), добавляют гидроксид калия (3,33 г, 50,5 ммоль) и затем кипятят с обратным холодильником при нагревании в течение 16 часов. Реакционный раствор охлаждают до 0°C, нейтрализуют, добавляя 10N водный раствор хлористого водорода (50,5 ммоль), и далее проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на диолсиликагеле (SHOKO SCIENTIFIC CO., LTD.; дихлорметан/метанол = 15/1), получая указанное в заголовке соединение в виде бесцветного аморфного вещества (165 мг, выход 63%).
Пример 84
{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}уксусная кислота
(84a) {2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}уксусная кислота
(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-5-({(1R)-1-[2-(2-гидроксиэтил)фенил]этокси}метил)-1,3-оксазолидин-2-он (200 мг, 0,46 ммоль), который получен в примере 83(83d), растворяют в смешанном растворителе ацетонитрил-вода (2:1, 4 мл), добавляют свободный радикал 2,2,6,6-тетраметилпиперидин-1-оксил (36 мг, 0,23 ммоль) и йодбензолдиацетат (589 мг, 1,83 ммоль) и перемешивают при комнатной температуре в течение 16 часов. К реакционному раствору добавляют 1N водный раствор хлористого водорода и затем проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 3/7), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (121 мг, выход 59%).
(84b) {2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}уксусная кислота
Используя {2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}уксусную кислоту, которая получена в примере 84(84a), проводят взаимодействие так же, как в способе, описанном в примере 83(83f), получая указанное в заголовке соединение в виде бесцветного аморфного вещества (выход 31%).
Пример 85
(3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропокси)уксусная кислота
(85a) Этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}проп-2-еноат
Используя этил (2E)-3-(2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил]фенил)проп-2-еноат, который получен в примере 14(14a), проводят взаимодействие так же, как в способе, описанном в примере 1(1a), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 92%).
(85b) (5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-5-({(1R)-1-[2-(3-гидроксипропил)фенил]этокси}метил)-1,3-оксазолидин-2-он
К раствору этил (2E)-3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}проп-2-еноата (710 мг, 1,53 ммоль), который получен в примере 85(85a), в тетрагидрофуране (15 мл) добавляют карбонилдиимидазол (4 97 мг, 3,07 ммоль) и 4-диметиламинопиридин (18 мг, 0,15 ммоль) и перемешивают при 50°C в течение 5 часов. Реакционный раствор охлаждают до комнатной температуры. Добавляют 1N водный раствор хлористого водорода к реакционному раствору, который затем экстрагируют этилацетатом. После этого органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Отгоняют растворитель при пониженном давлении. Остаток растворяют в этаноле (20 мл), добавляют 10% палладий на угле (влажный, 50% масс., 70 мг) и затем энергично перемешивают при комнатной температуре в течение 9 часов в атмосфере водорода. Реакционный раствор фильтруют через целит и промывают этанолом. Отгоняют растворитель при пониженном давлении. Затем растворяют остаток в тетрагидрофуране (15 мл), добавляют метанол (1 мл) и боргидрид натрия (116 мг, 3,06 ммоль) и затем перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют 1N водный раствор хлористого водорода и проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 2/3), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (548 мг, 3 стадия, выход 79%).
(85c) Этил (3-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}пропокси) ацетат
Используя (5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-5-({(1R)-1-[2-(3-гидроксипропил)фенил]этокси}метил)-1,3-оксазолидин-2-он, который получен в примере 85(85b), проводят взаимодействие так же, как в способе, описанном в примере 83(83e), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 72%).
(85d) (3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропокси)уксусная кислота
Используя этил (3-{2-[(1R)-1-({(5R)-3-[1-(2,3-дигидро-1H-инден-2-ил)-2-метилпропан-2-ил]-2-оксо-1,3-оксазолидин-5-ил}метокси)этил]фенил}пропокси)ацетат, который получен в примере 85(85c), проводят взаимодействие также, как в способе, описанном в примере 83(83f), получая указанное в заголовке соединение в виде бесцветного аморфного вещества (выход 83%).
Ниже приведены структуры и физико-химические данные соединений, которые описаны в примерах 81-85. Кроме того, если соединения описаны с указанием номера после дефиса, это указывает, что эти соединения получают таким же способом, как соответствующие соединения, взятые за основу. Конкретно, обозначение «сравнительный пример 1(1a)-2» указывает, что получение осуществляют таким же способом, как в сравнительном примере 1(1a) (Таблица 64-67).
(Сравнительные примеры)
Сравнительный пример 1
1-(2-Бром-3-этоксифенил)этанон
(1a) 2-Бром-N,3-диметокси-N-метилбензамид
2-Бром-3-метоксибензойную кислоту (14,2 г, 61,5 ммоль) растворяют в ацетонитриле (250 мл), добавляют 4-метилморфолин (13,5 мл, 123 ммоль), N-метоксиметанамингидрохлорид (7,19 г, 73,8 ммоль) и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин-4-ий хлорид (20,4 г, 73,8 ммоль) и перемешивают в течение 17 часов при комнатной температуре. 1N водный раствор соляной кислоты добавляют к реакционному раствору, который затем экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат, от 85:15 до 25:75, об./об.), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (16,8 г, количественно).
(1b) 1-(2-бром-3-метоксифенил)этанон
В атмосфере азота 2-бром-N,3-диметокси-N-метилбензамид (16,8 г, 61,5 ммоль), который получен в сравнительном примере 1(1a), растворяют в тетрагидрофуране (300 мл) и добавляют по капле 1,0 M раствор метилмагнийбромида в тетрагидрофуране (123 мл, 123 ммоль) при 0°C. По завершении капельного добавления температуру реакционного раствора повышают до комнатной и перемешивают в течение 15 часов. К реакционному раствору добавляют этилацетат и 1N водный раствор соляной кислоты для фракционирования и водный слой экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным водным раствором гидрокарбоната натрия и сушат над безводным сульфатом натрия. Отгоняют растворитель при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (гексан:этилацетат, от 100:0 до 60:40, об./об.), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (12,7 г, выход 90%).
(1c) 1-(2-Бром-3-гидроксифенил)этанон
В атмосфере азота растворяют 1-(2-бром-3-метоксифенил)этанон (30,5 г, 229 ммоль), который получен в сравнительном примере 1(1b), в метиленхлориде (500 мл) и добавляют по капле 1,0 M раствор трибромфосфина в дихлорметане (293 мл, 293 ммоль) при -80°C за 5 часов. По завершении капельного добавления смесь перемешивают в течение 17 часов при -40°C. Затем реакционный раствор охлаждают до -80°C и добавляют по капле метанол (500 мл). По завершении капельного добавления повышают температуру до -40°C с последующим перемешиванием в течение 3 часов. Температуру реакционного раствора повышают до комнатной температуры. Отгоняют растворитель при пониженном давлении, пока раствор не станет зеленым. После добавления этанола смесь экстрагируют смесью этилацетат/гексан (1:1, об./об.). После нейтрализации насыщенным водным раствором гидрокарбоната натрия отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (гексан:этилацетат, 100:0 - 55:45, об./об.), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (13,5 г, выход 47%).
(1d) 1-(2-бром-3-этокси фенил)этанон
В атмосфере азота растворяют 1-(2-бром-3-гидрокси фенил)этанон (6,50 г, 30,2 ммоль), который получен в сравнительном примере 1(1c), и карбонат калия (8,36 г, 60,5 ммоль) в N,N-диметилформамиде (60 мл) и перемешивают при комнатной температуре в течение 10 мин. Затем добавляют к смеси этилйодид (3,14 мл, 39,3 ммоль), смесь далее перемешивают в течение 21 часа. Добавляют к реакционному раствору смесь этилацетат/гексан (1:1, об./об.) и воду для фракционирования и экстрагируют водный слой смесью этилацетат/гексан (1:1, об./об.). Органические слои объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (гексан:этилацетат, 100:0 - 85:15, об./об.), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (4,89 г, выход 67%).
Сравнительный пример 2
1-[2-Бром-3-(дифторметокси)фенил]этанон
1-(2-бром-3-гидрокси фенил)этанон (6,50 г, 30,2 ммоль), который получен в сравнительном примере 1(1c), и йодид меди(I) (2,51 г, 13,2 ммоль) растворяют в ацетонитриле (150 мл), затем добавляют раствор дифтор(фторсульфонил)уксусной кислоты (50,0 г, 281 ммоль), растворенной в ацетонитриле (50 мл), за 1 час и 30 мин при нагревании при 55°C. По завершении капельного добавления реакционный раствор перемешивают при 55°C в течение 3 часов, охлаждают до комнатной температуры, добавляют воду и далее проводят экстракцию смесью этилацетат/гексан (2:1, об./об.). Органический слой промывают насыщенным водным раствором гидрокарбоната натрия и сушат над безводным сульфатом натрия. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (нейтральный силикагель, гексан:этилацетат, 100:0 - 75:25, об./об. и основный силикагель, гексан:этилацетат, 100:0 - 50:50, об./об.), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (1,53 г, выход 18%).
Сравнительный пример 3
1-(2-Бром-5-фтор-3-метоксифенил)этанон
(3a) 2-Бром-4-фтор-6-метоксианилин
4-Фтор-2-метоксианилин (8,25 г, 58,5 ммоль) растворяют в метиленхлориде (200 мл) и добавляют N-бромсукцинимид (11,4 г, 64,3 ммоль) при -78°C с последующим перемешиванием в течение 2 часов. Затем смесь перемешивают при 0°C в течение 1,5 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (4,80 г, выход 37%).
(3b) 1-(2-Амино-5-фтор-3-метоксифенил)этанон
К раствору 2-бром-4-фтор-6-метоксианилина (4,80 г, 21,8 ммоль), который получен в сравнительном примере 3(3a), в 1,4-диоксане (200 мл) добавляют трибутил(1-этоксивинил)олово (11,1 мл, 32,7 ммоль) и тетракистрифенилфосфинпалладий (2,52 г, 2,18 ммоль) и смесь перемешивают в течение 16 часов при 100°C. После охлаждения реакционного раствора до комнатной температуры добавляют 1N водный раствор хлористого водорода (100 мл) и перемешивают еще 2 часа. Реакционный раствор концентрируют при пониженном давлении, нейтрализуют, добавляя 1N водный раствор гидроксида натрия, и затем проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде желтого твердого вещества (2,80 г, выход 70%).
(3c) 1-(2-Бром-5-фтор-3-метоксифенил)этанон
1-(2-Амино-5-фтор-3-метоксифенил)этанон (2,66 г, 14,2 ммоль), который получен в сравнительном примере 3(3b), суспендируют в 10% водном растворе бромистого водорода (22 мл). Затем медленно добавляют туда по капле 9% водный раствор нитрита натрия (11 мл, 14,4 ммоль) при 0°C. После перемешивания смешанного раствора в течение 1 часа при 0°C добавляют туда раствор, в котором бромид меди(I) (2,24 г 15,7 ммоль) растворен в 47% водном растворе бромистого водорода (15 мл), и смесь кипятят с обратным холодильником при нагревании при 110°C в течение 2 часов. Реакционный раствор охлаждают до комнатной температуры и проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде светло-желтого твердого вещества (2,15 г, выход 61%).
Сравнительный пример 4
1-(2-Бром-3-фтор-4-метилфенил)этанон
(4a) 6-Бром-2-фтор-3-метиланилин
Используя 2-фтор-3-метиланилин, проводят взаимодействие так же, как в способе, описанном в сравнительном примере 3(3a), получая указанное в заголовке соединение в виде светло-красного твердого вещества (выход 60%).
(4b) 2-Фтор-3-метиланилин
6-Бром-2-фтор-3-метиланилин (9,00 г, 44,1 ммоль), который получен в сравнительном примере 4(4a), растворяют в смеси 1:1 (130 мл) N,N-диметил формамида и метанола и добавляют комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладий(II)дихлорид-дихлорметан (10,8 г, 13,2 ммоль) и N,N-диизопропилэтиламин (23 мл, 132,3 ммоль). Смесь энергично перемешивают при 85°C в течение 2 часов в атмосфере монооксида углерода. Реакционный раствор охлаждают до комнатной температуры, добавляют этилацетат и воду, фильтруют, применяя Millicup (зарегистрированная торговая марка)-LH, и промывают этилацетатом. Фильтрованный раствор экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая указанное в заголовке соединение в виде бесцветного твердого вещества (5,70 г, выход 71%).
(4c) 2-Бром-3-фтор-N-метокси-N,4-диметилбензамид
2-Фтор-3-метиланилин (5,70 г, 31,1 ммоль), который получен в сравнительном примере 4(4b), растворяют в ацетонитриле (75 мл), добавляют трет-бутилнитрит (4,85 мл) и бромид меди(II) (7,65 г, 34,3 ммоль) при 0°C и перемешивают при 65°C в течение 2 часов. После охлаждения до комнатной температуры добавляют 1N водный раствор хлористого водорода к смеси, которую затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток растворяют в смешанном растворителе тетрагидрофуран-метанол-вода (4:1:1, 200 мл), добавляют моногидрат гидроксида лития (1,38 г, 33,0 ммоль) и перемешивают при комнатной температуре в течение 4 часов. Смесь нейтрализуют, добавляя 1N водный раствор хлористого водорода, и затем проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток растворяют в ацетонитриле (200 мл), добавляют N,O-диметилгидроксиламингидрохлорид (3,80 г, 39,0 ммоль), N-метилморфолин (6,6 мл, 60,0 ммоль) и 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиний хлорид (12,2 г, 39,0 ммоль) и перемешивают при комнатной температуре в течение 18 часов. Реакционный раствор концентрируют при пониженном давлении. К результирующему остатку добавляют 1N водный раствор хлористого водорода и проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 3/2), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (5,58 г, выход 65%) .
(4d) 1-(2-бром-3-фтор-4-метилфенил)этанон
Используя 2-бром-3-фтор-N-метокси-N,4-диметилбензамид, который получен в сравнительном примере 4(4c), проводят взаимодействие так же, как в способе, описанном в сравнительном примере 3(3b), получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (выход 92%).
Сравнительный пример 5
1-(2-Бром-3-хлор фенил)бутан-1-он
(5a) (2-Бром-3-хлорфенил)метанол
К раствору 2-бром-4-хлорбензойной кислоты (5,0 г, 21,24 ммоль) в тетрагидрофуране (100 мл) добавляют 0,99 M раствор комплекса боран-тетрагидрофуран в тетрагидрофуране (32,2 мл, 21,24 ммоль) и перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор перегоняют при пониженном давлении для удаления растворителя и затем медленно добавляют воду (50 мл) при охлаждении на льду. Полученную смесь экстрагируют дихлорметаном (50 мл ×2). После этого органические слои промывают насыщенным раствором гидрокарбоната натрия (50 мл). Органические слои объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Отгоняют растворитель при пониженном давлении, получая указанное в заголовке соединение в виде белого твердого вещества (4,73 г, количественно).
(5b) 2-Бром-3-хлорбензальдегид
К раствору (2-бром-3-хлор фенил)метанола (4,73 г, 21,24 ммоль), который получен в сравнительном примере 5(5a), в метиленхлориде (120 мл) добавляют 1,1,1-трис(ацетокси)-1,1-дигидро-l,2-бензйодоксол-3-(1H)-он (10,8 г, 25,49 ммоль) при охлаждении на льду и перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют смесь насыщенного водного раствора гидрокарбоната натрия (60 мл) и насыщенного водного раствора тиосульфата натрия (30 мл) и затем перемешивают при комнатной температуре в течение 0,5 часов. Полученную смесь экстрагируют дихлорметаном (90 мл ×2). После этого органические слои объединяют и сушат над безводным сульфатом натрия. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 5/1), получая указанное в заголовке соединение в виде белого твердого вещества (4,36 г, выход 94%).
(5c) 1-(2-Бром-3-хлор фенил)бутан-1-ол
В атмосфере аргона добавляют хлорид цинка (0,68 г, 4,97 ммоль) к 2,0 M раствору н-пропилмагнийхлорида в диэтиловом эфире (12,42 мл, 24,93 ммоль) и смесь перемешивают при комнатной температуре. После перемешивания в течение 0,5 часа добавляют туда по капле раствор 2-бром-3-хлорбензальдегида (4,36 г, 19,87 ммоль), который получен в сравнительном примере 5(5b), в тетрагидрофуране (10 мл). После перемешивания в течение 2 часов при охлаждении на льду добавляют туда насыщенный водный раствор хлорида аммония (20 мл). Полученную смесь экстрагируют этилацетатом (20 мл ×2). После этого органические слои промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 5/1), получая указанное в заголовке соединение в виде белого твердого вещества (3,23 г, выход 62%).
(5d) 1-(2-Бром-3-хлорфенил)бутан-1-он
Используя 1-(2-бром-3-хлорфенил)бутан-1-ол, который получен в сравнительном примере 5(5c), проводят взаимодействие так же, как в способе, описанном в сравнительном примере 5(5a), получая указанное в заголовке соединение в виде желтого маслянистого вещества (выход 94%).
Сравнительный пример 6
(1R)-1-(2-бром-5-фторфенил)пропан-1-ол
Что касается Chirality, 2005, 17, 476-480, 1,06 M раствор диэтилцинка в гексане (18,6 мл, 19,7 ммоль) добавляют по капле при охлаждении на льду к раствору 1-[(S)-(2-метоксифенил){[(1S)-1-фенилэтил]амино}метил]-2-нафтола (0,38 г, 0,99 ммоль) в толуоле (5 мл). Смесь перемешивают при комнатной температуре в течение 1 часа. После перемешивания добавляют к смеси 2-бром-5-фторбензальдегид (2,0 г, 9,85 ммоль) при охлаждении на льду и перемешивают при комнатной температуре в течение 16 часов. К реакционному раствору добавляют 1N водный раствор хлористого водорода и проводят экстракцию дихлорметаном. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (гексан/этилацетат = 5/1), получая указанное в заголовке соединение в виде прозрачного маслянистого вещества (1,81 г, выход 79%).
Сравнительный пример 7
1-Бром-2-[(1R)-1-циклопропилэтил]бензол и 1-бром-2-[(1S)-1-циклопропилэтил]бензол
Бромбензальдегид (3,00 г, 16,2 ммоль) растворяют в тетрагидрофуране (50 мл) и добавляют при комнатной температуре 1 M раствор циклопропилмагнийбромида в тетрагидрофуране (19 мл, 19,0 ммоль) и перемешивают в течение 3 часов. К реакционному раствору добавляют 1N водный раствор хлористого водорода и проводят экстракцию этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (н-гексан/этилацетат=7/3), получая указанное в заголовке соединение в виде бесцветной маслянистой смеси энантиомеров (3,00 г). Смесь энантиомеров подвергают оптическому разделению методом сверхкритической жидкостной хроматографии (колонка: CHIRALPAK AD-H, 2×25 см; подвижная фаза: 10% МеОН в СО2; скорость потока: 20 мл/мин), получая оба указанных в заголовке соединения 1-бром-2-[(1R)-1-циклопропилэтил]бензол (1,22 г, RT: 8,5 мин, выход 33%) и 1-бром-2-[(1S)-1-циклопропилэтил]бензол (1,20 г, RT 12,5 мин, выход 33%), каждое в виде бесцветного маслянистого вещества.
Сравнительный пример 8
Этил 3-(5-хлор-2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)пропаноат
Этил (2Е)-3-(5-хлор-2-{(1R)-1-[(2R)-оксиран-2-илметокси]этил}фенил)акрилат (822 мг, 2,65 ммоль), который получен в примере 4(4с)-15, растворяют в этаноле (25 мл), добавляют родий/оксид алюминия (246 мг) и перемешивают в течение 5 часов при комнатной температуре в атмосфере водорода. Реакционный раствор фильтруют, используя целит. Отгоняют растворитель при пониженном давлении, получая указанное в заголовке соединение в виде бесцветного маслянистого вещества (816 мг, выход 99%).
Ниже приведены структуры и физико-химические данные соединений, которые получают в сравнительных примерах (Таблица 68-78).
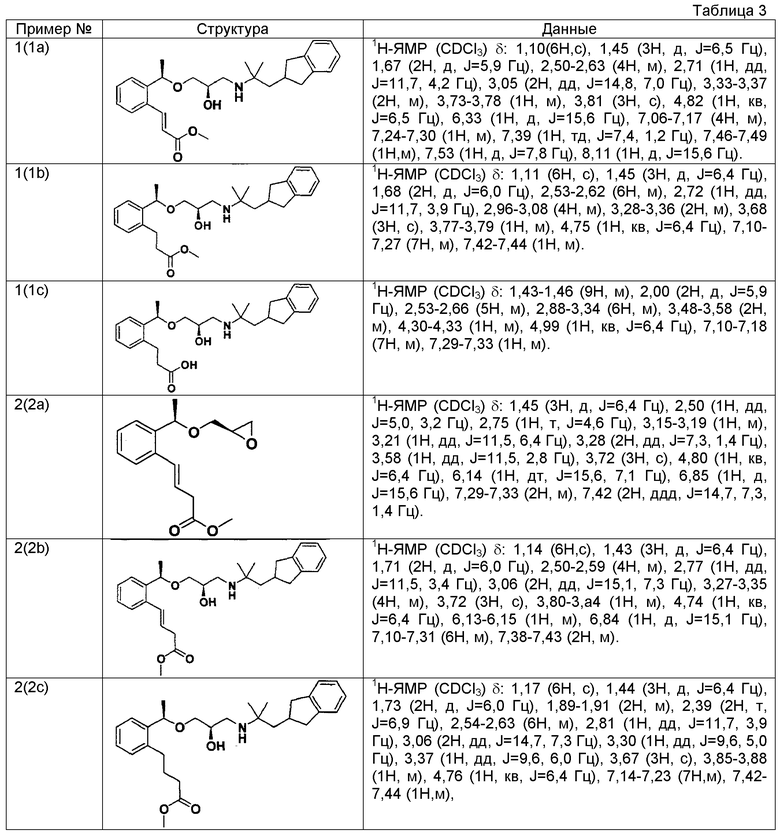
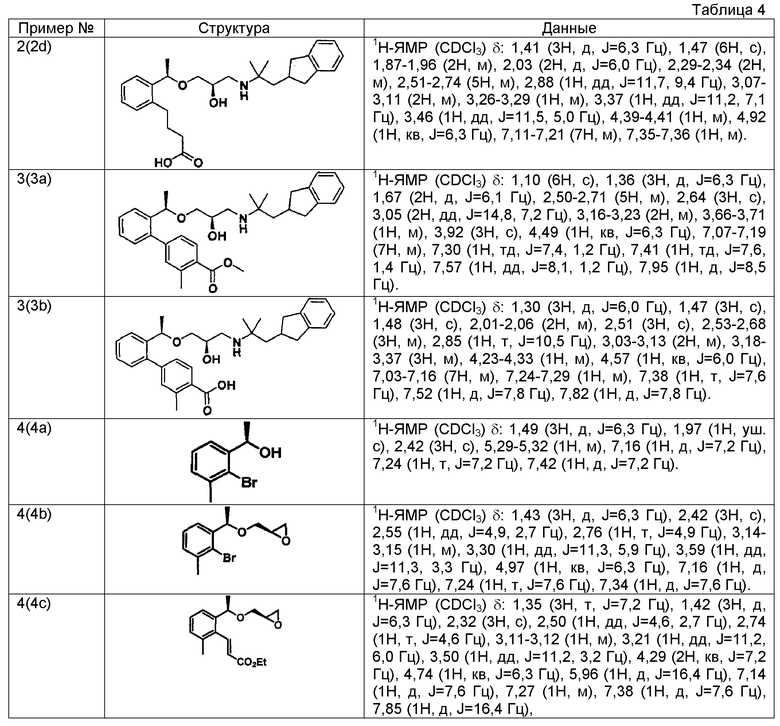

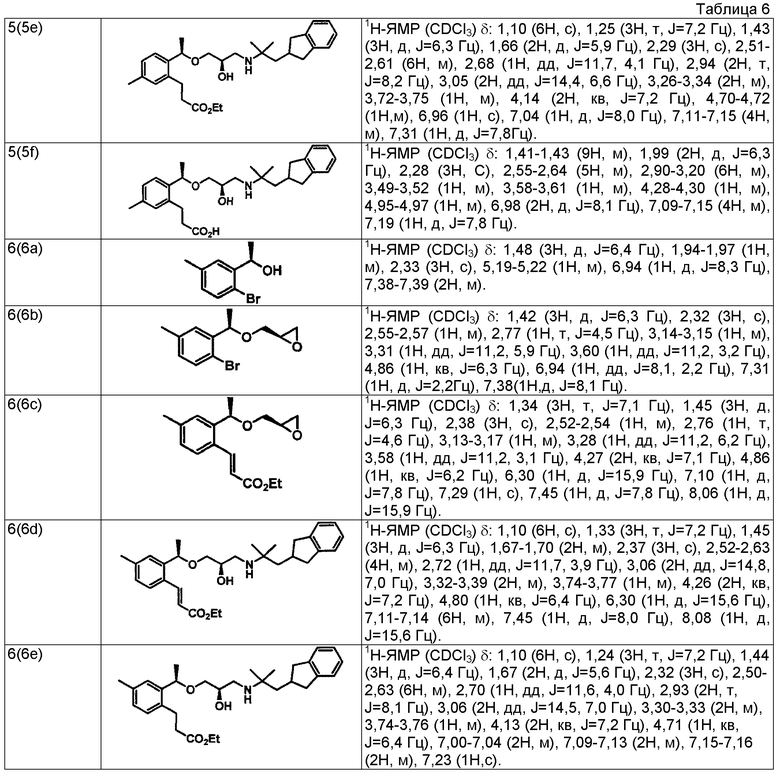


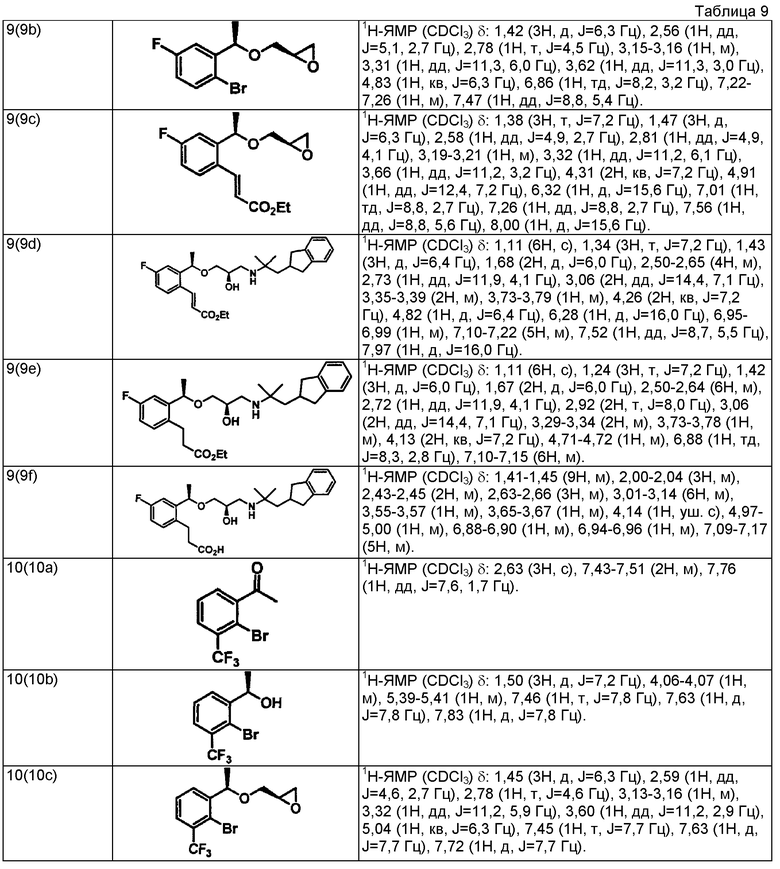



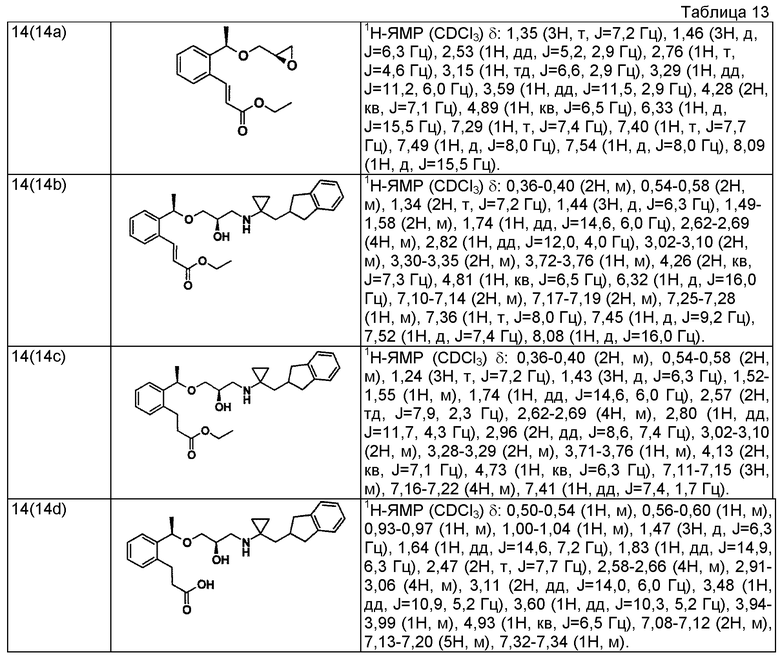

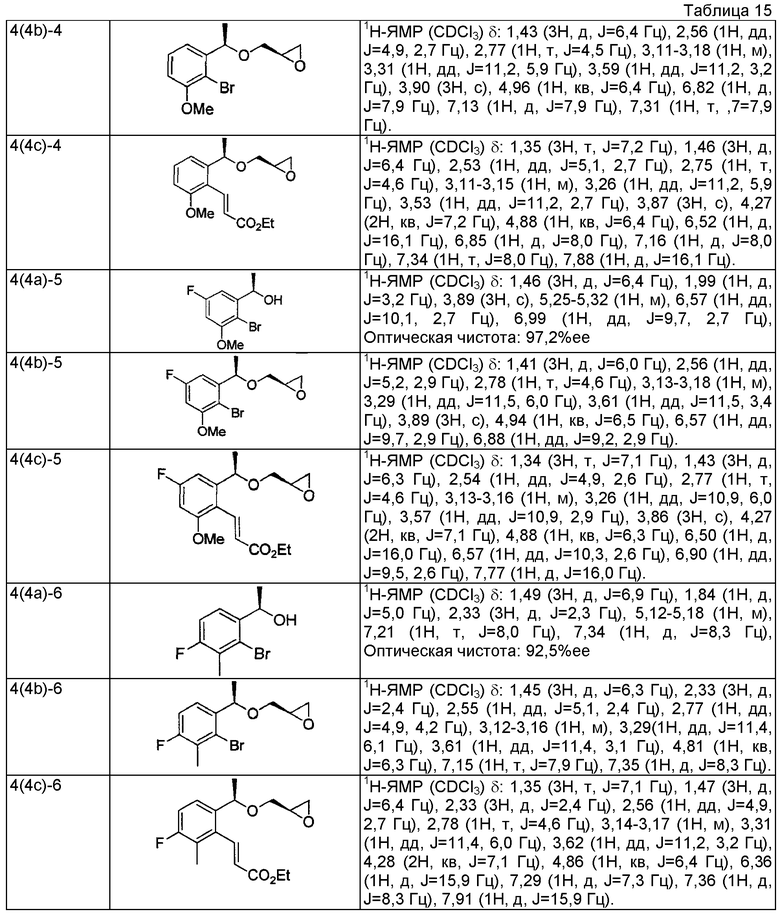



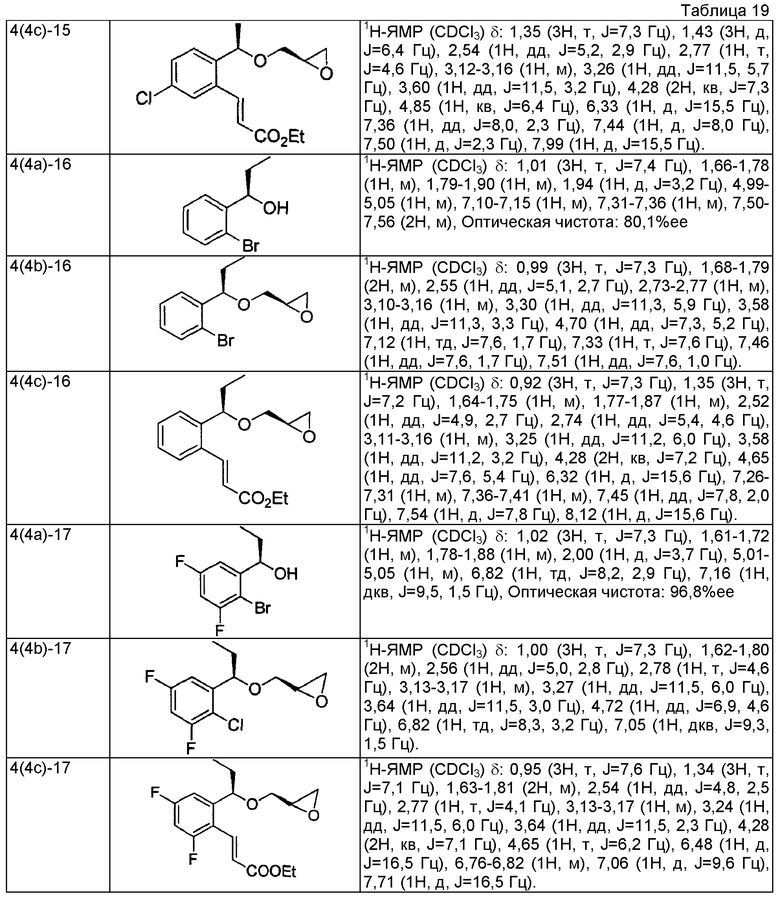
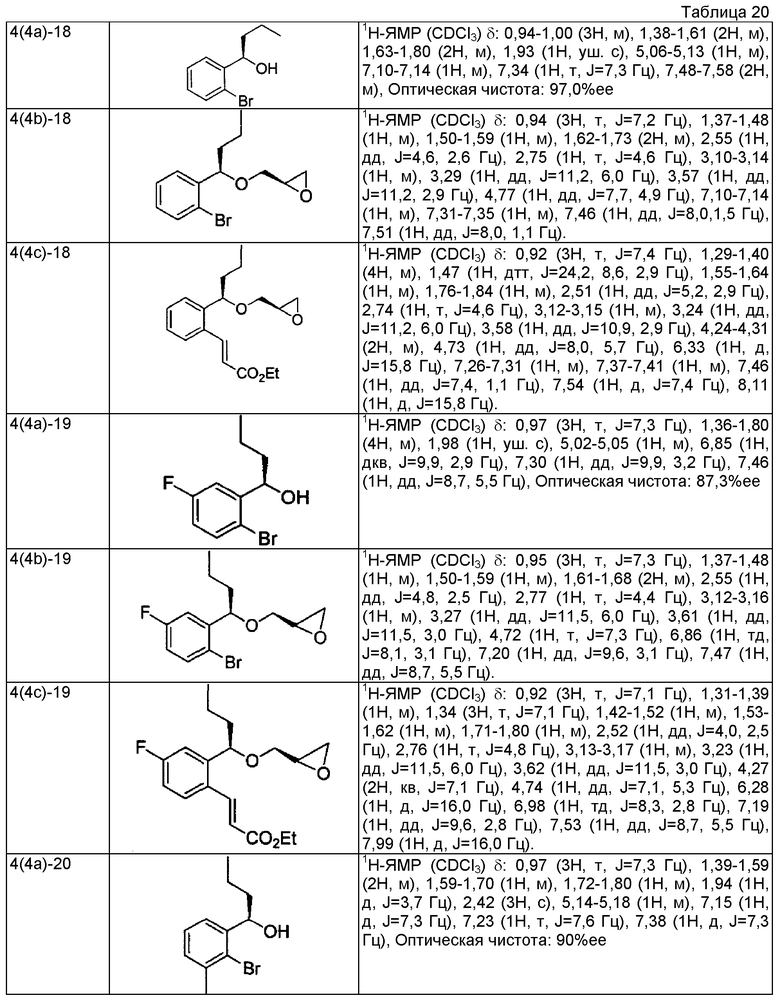



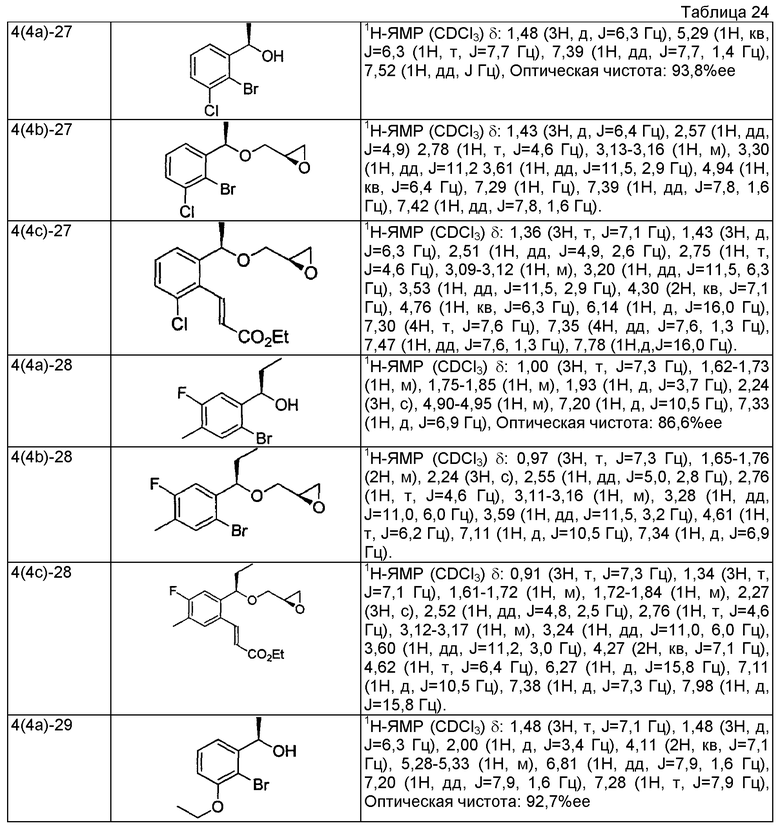

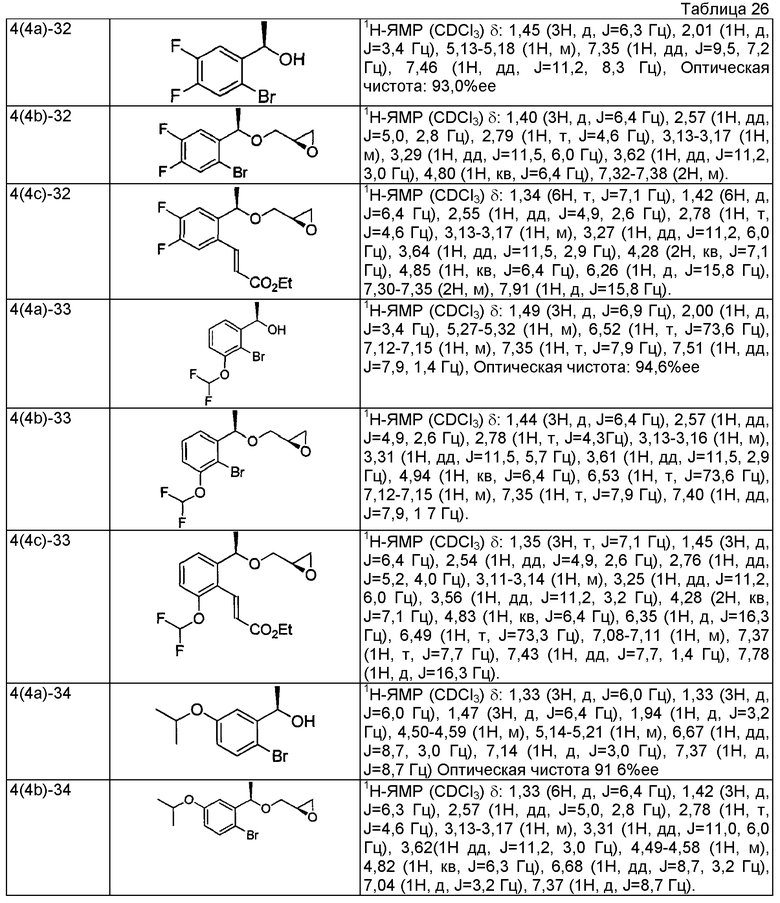
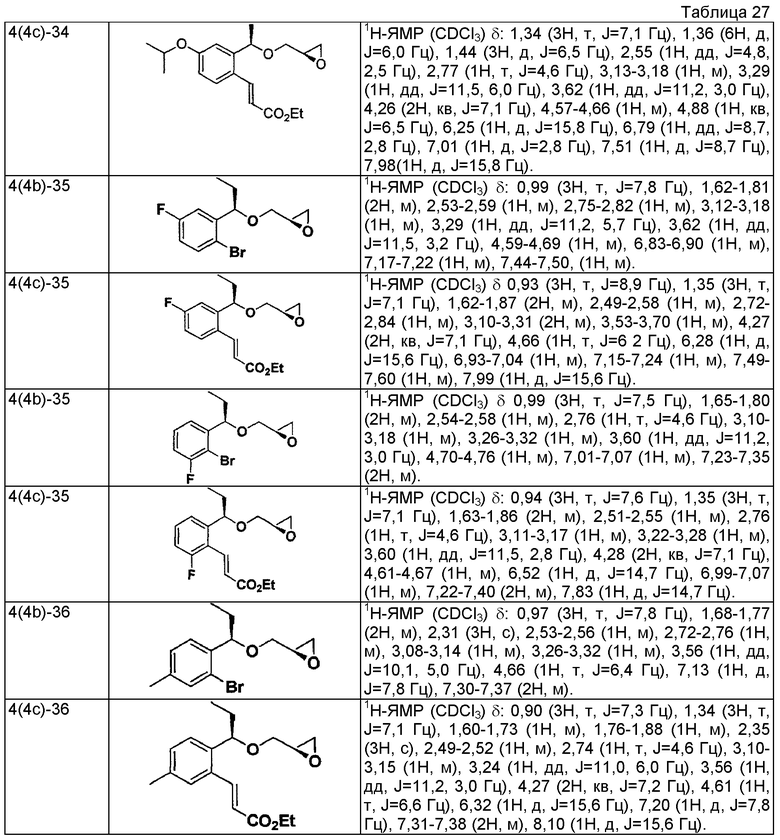

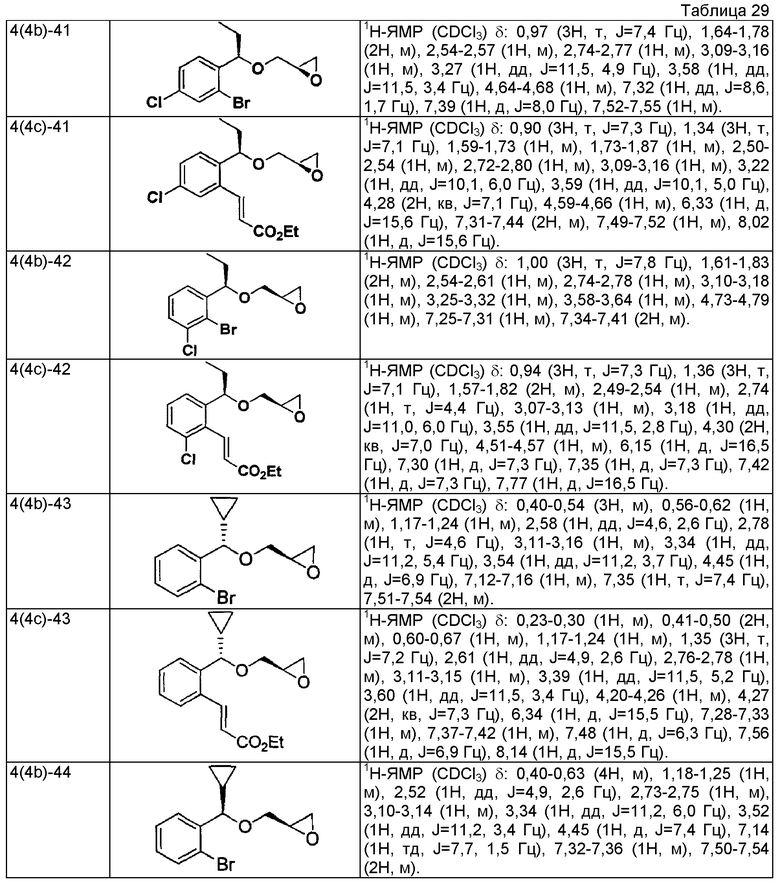
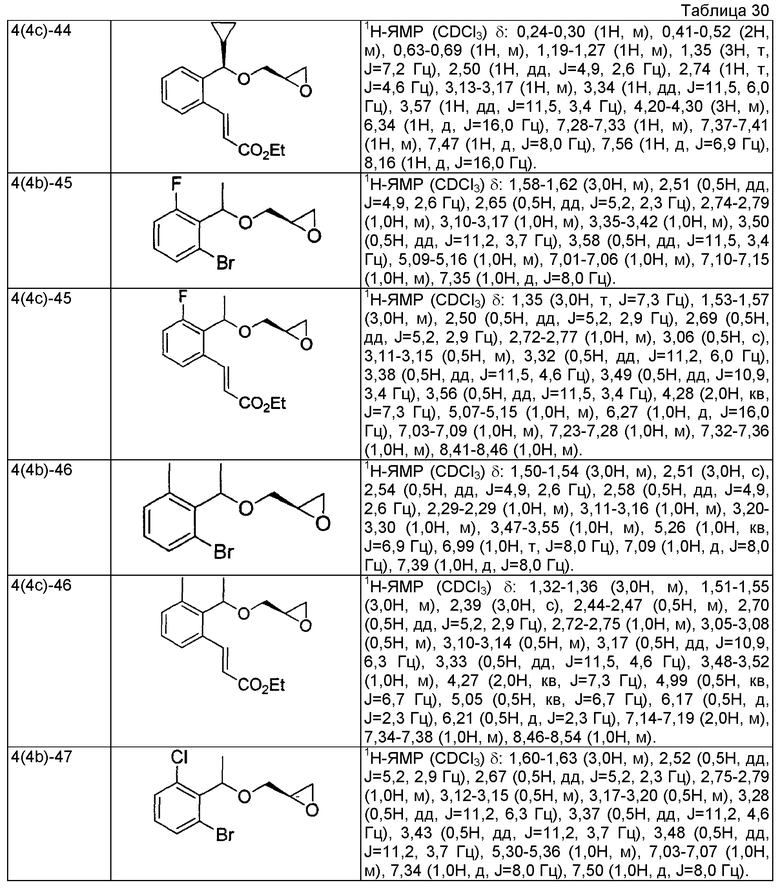
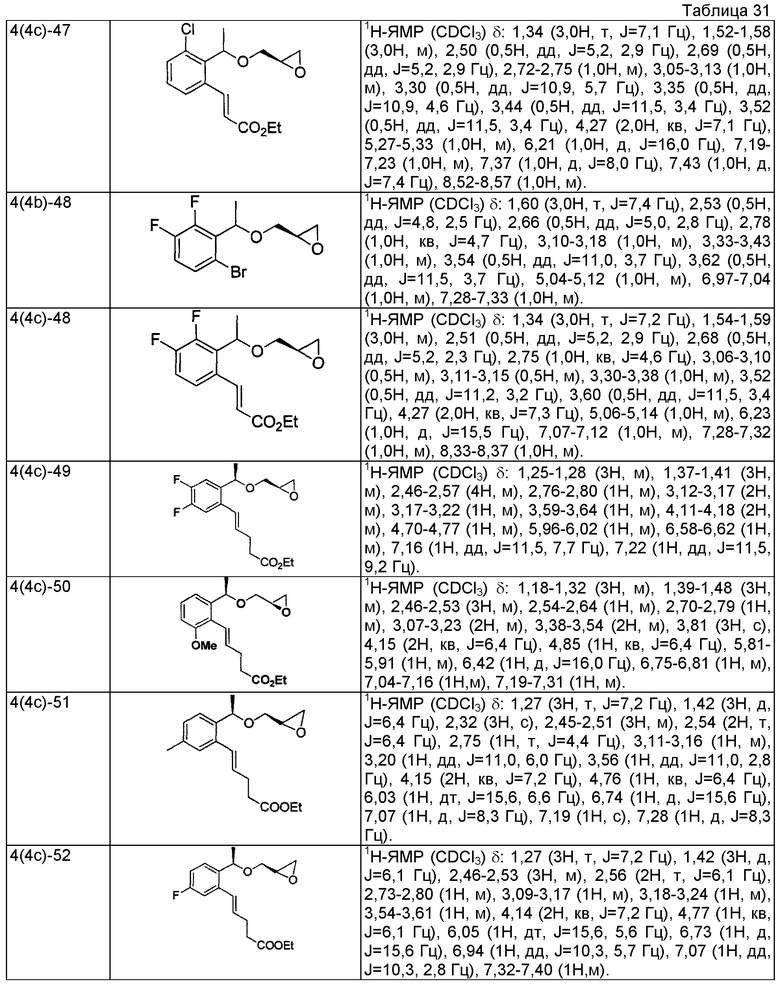
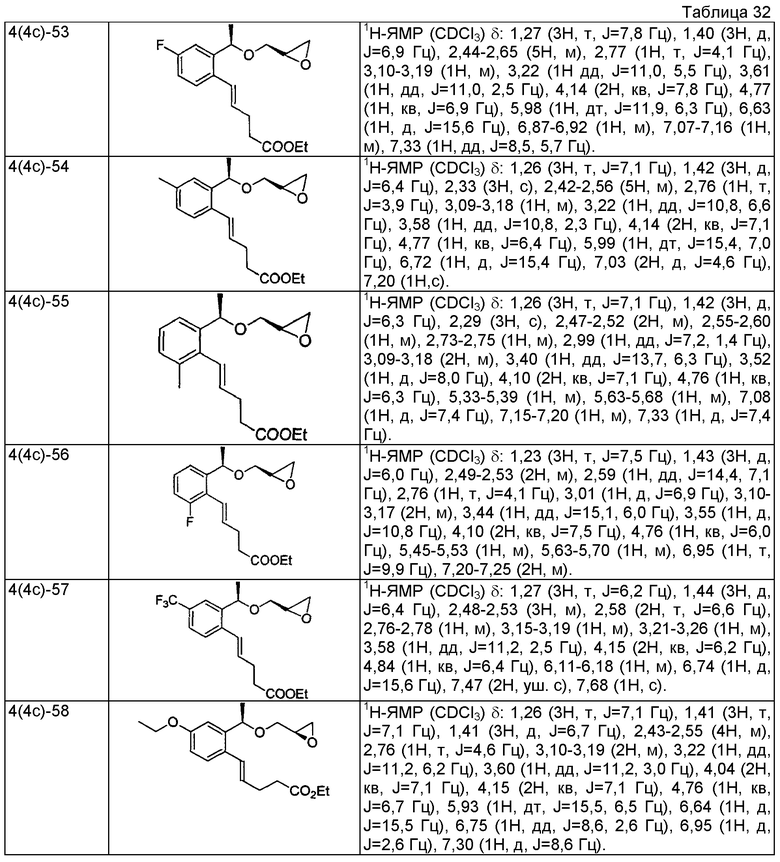
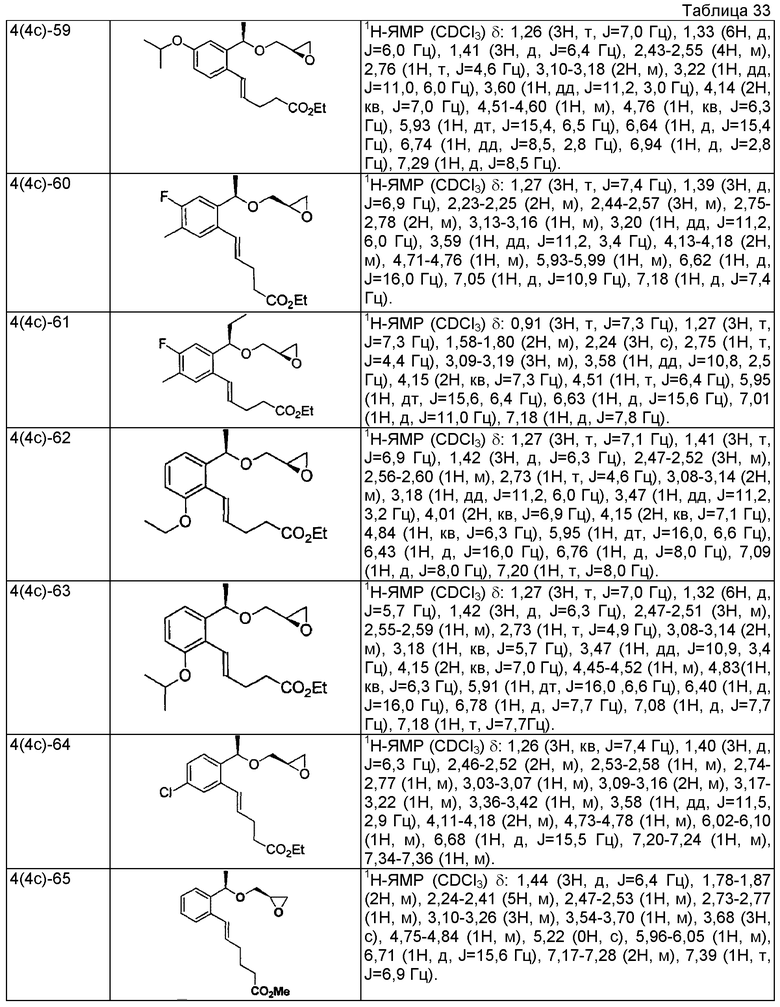
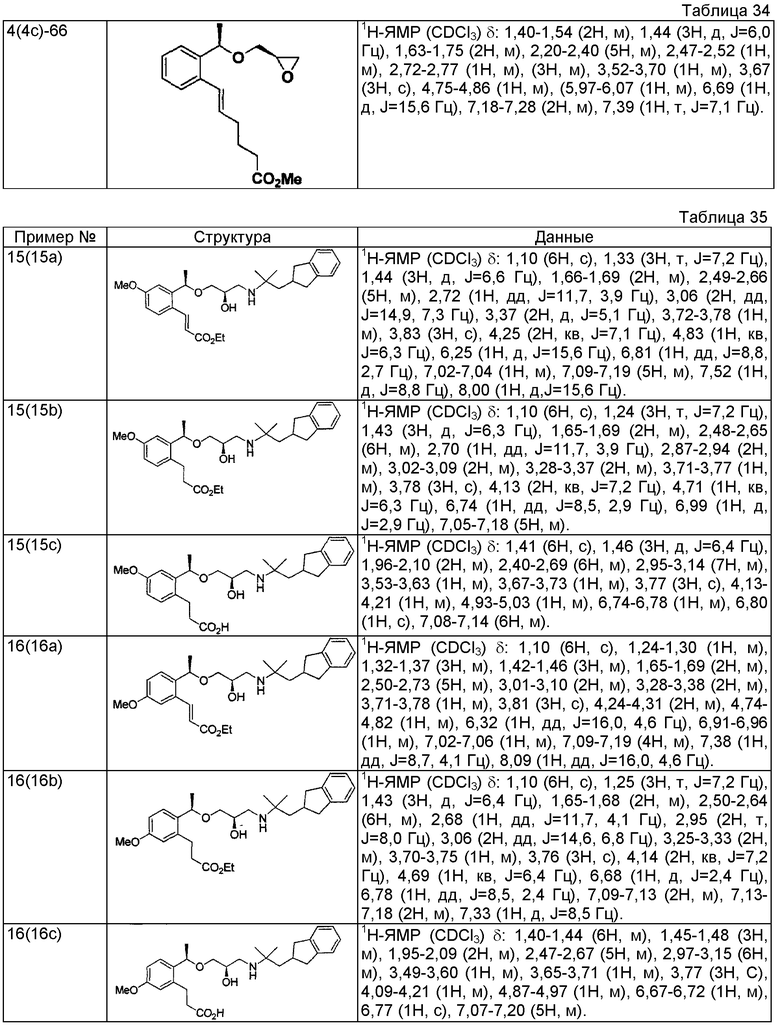



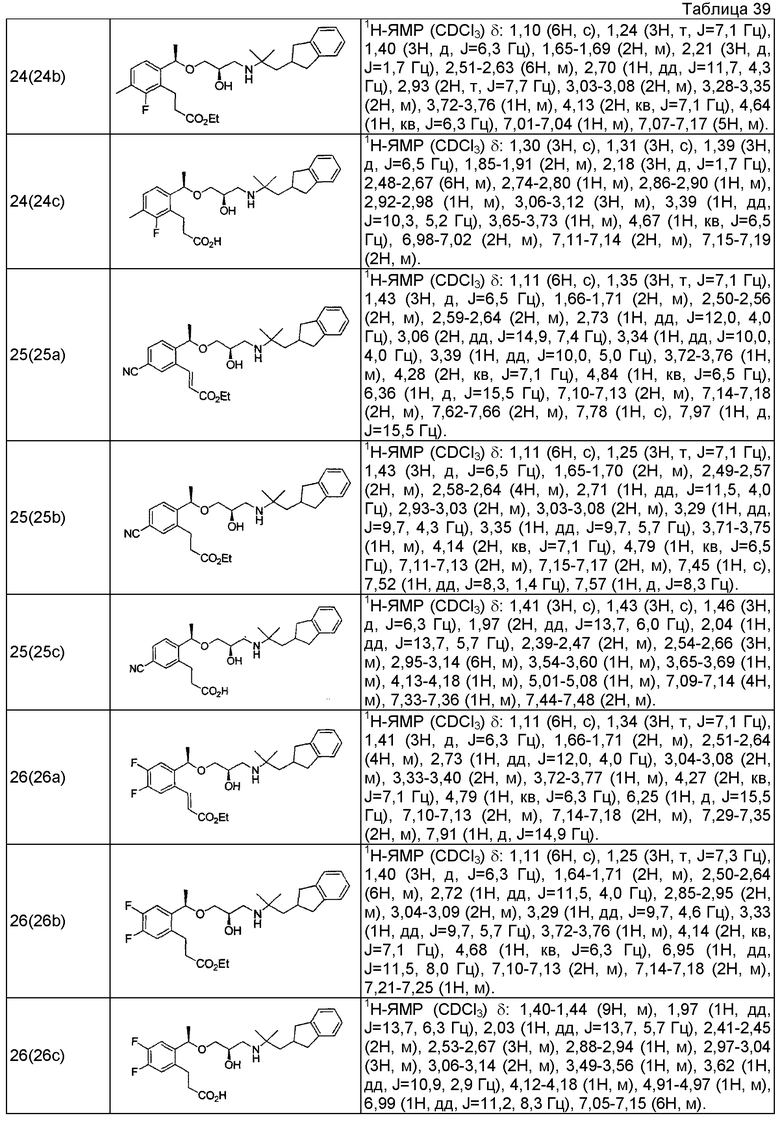
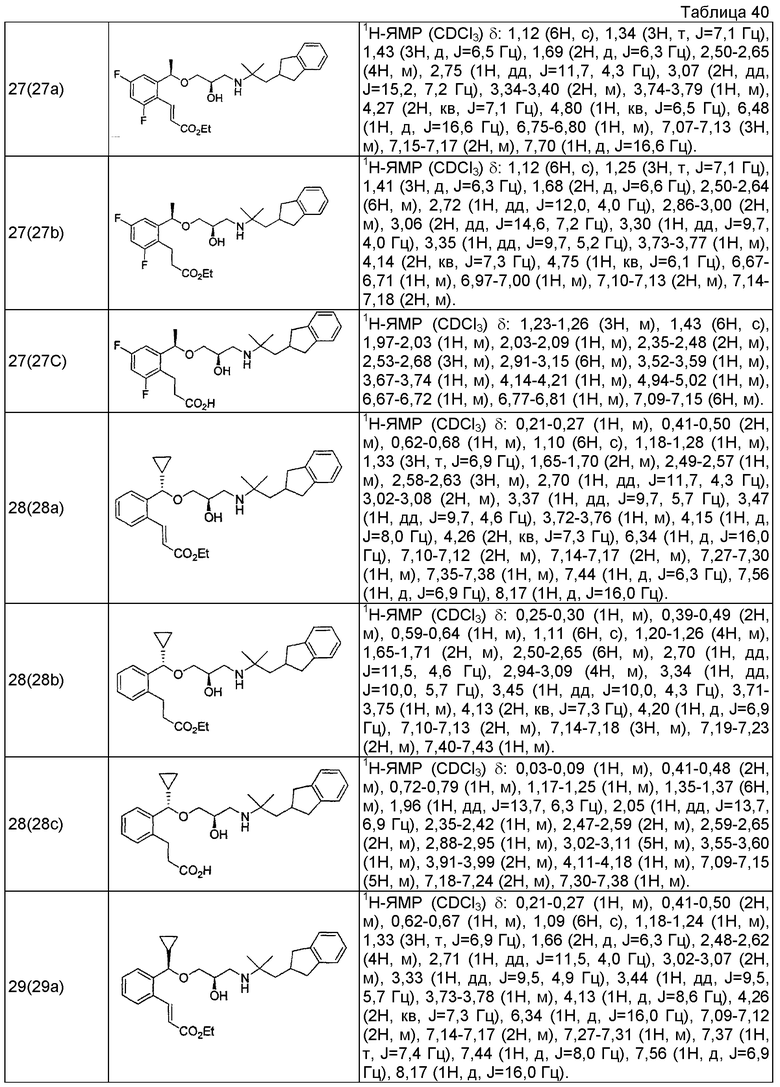

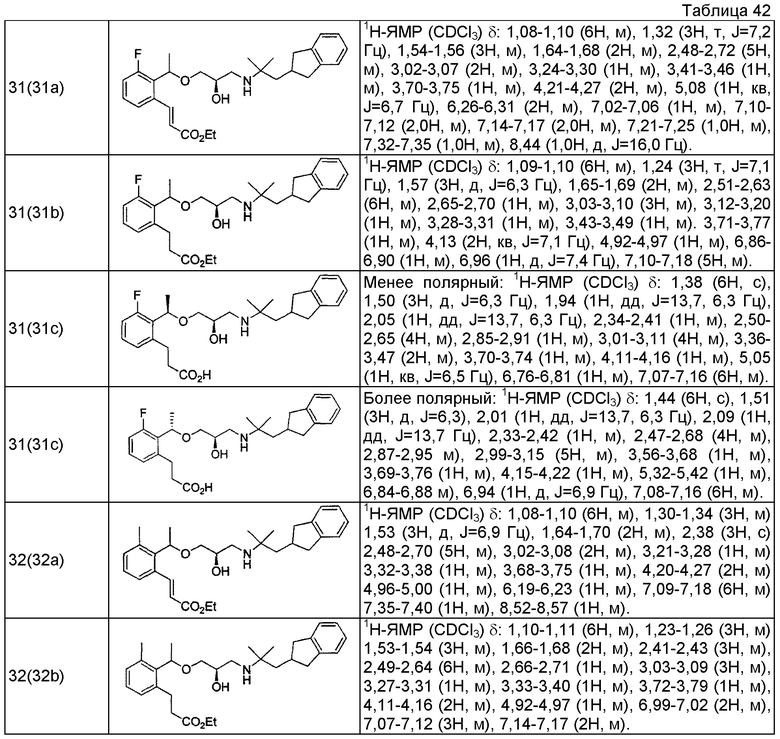

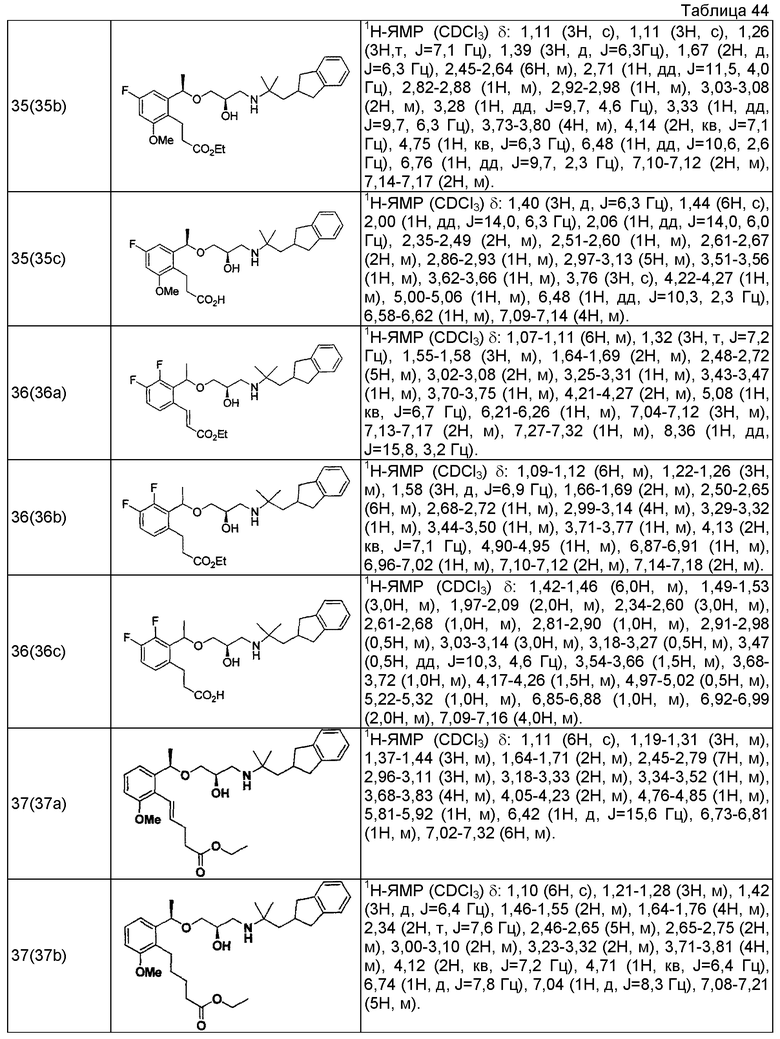
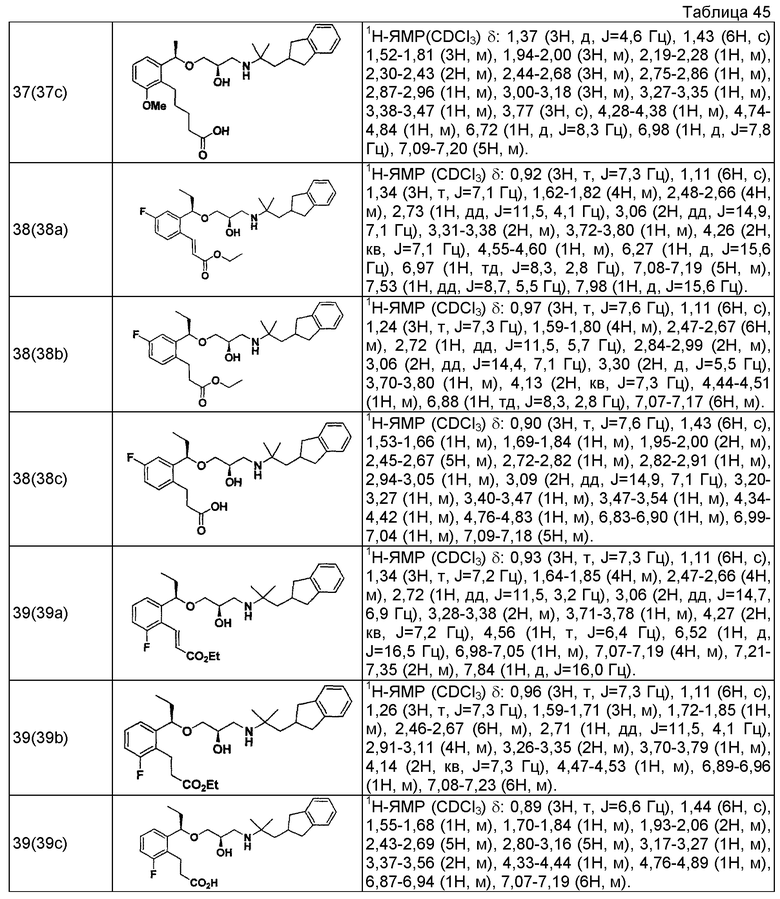

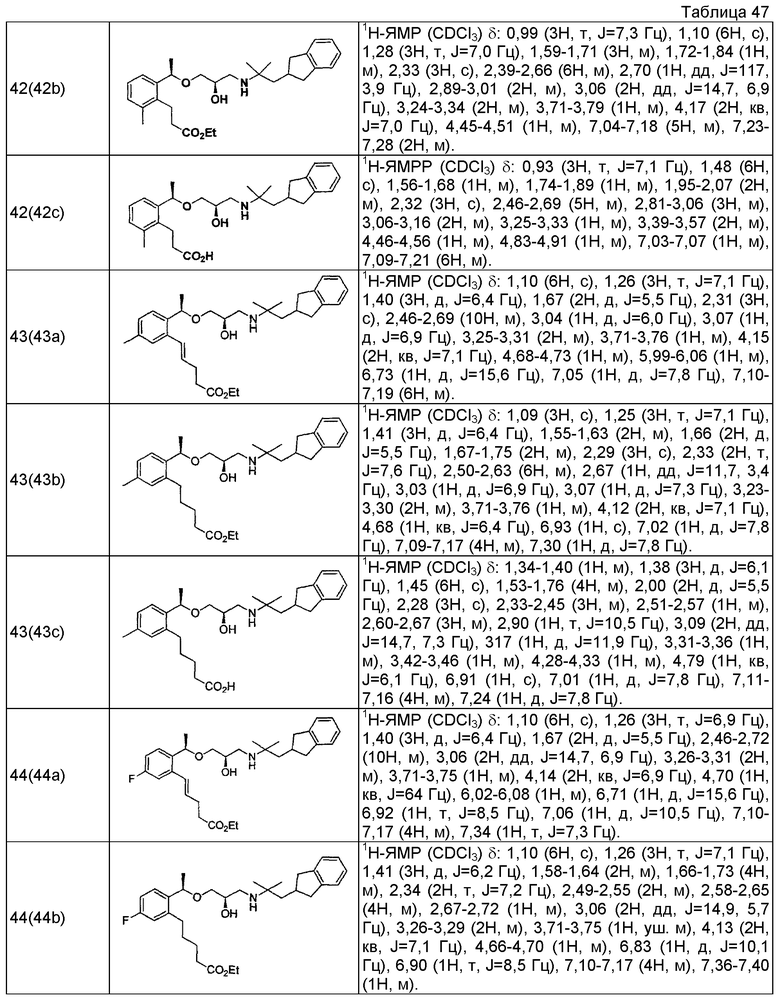

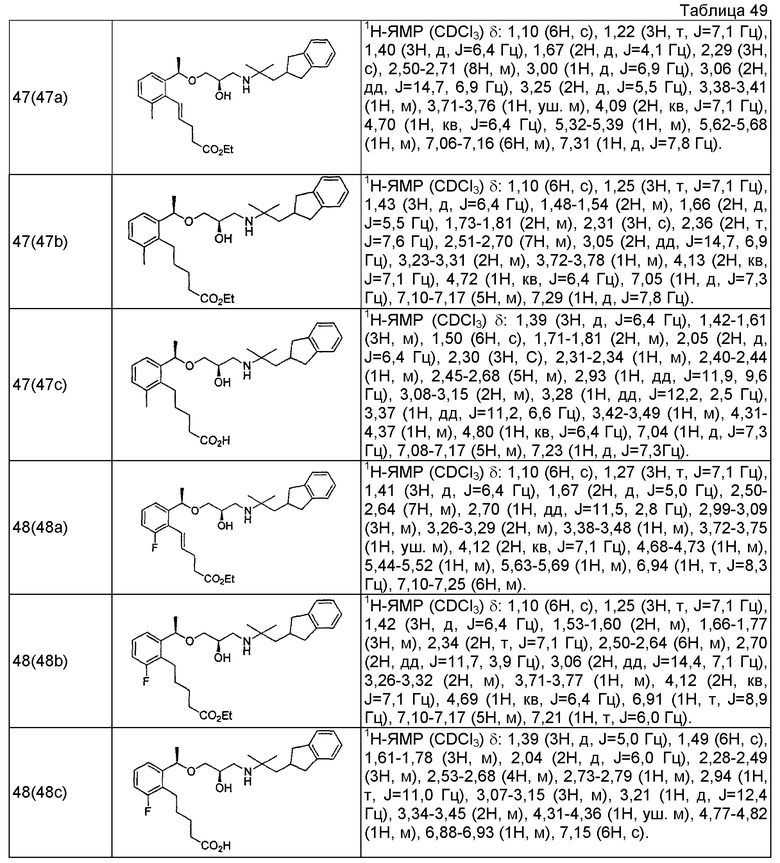
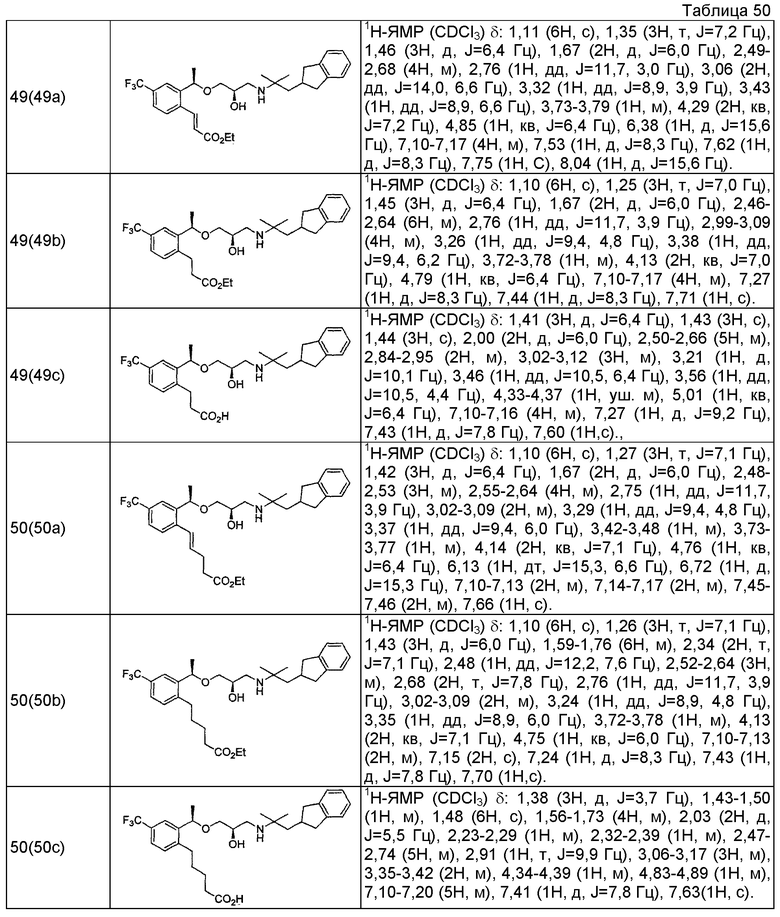



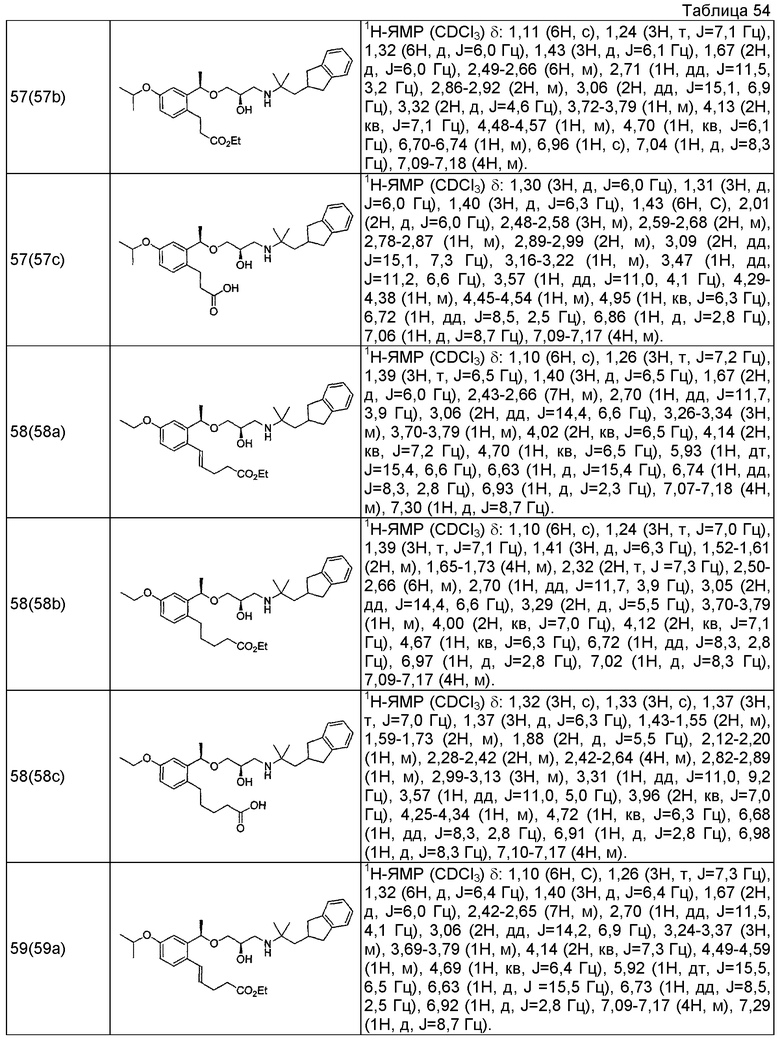

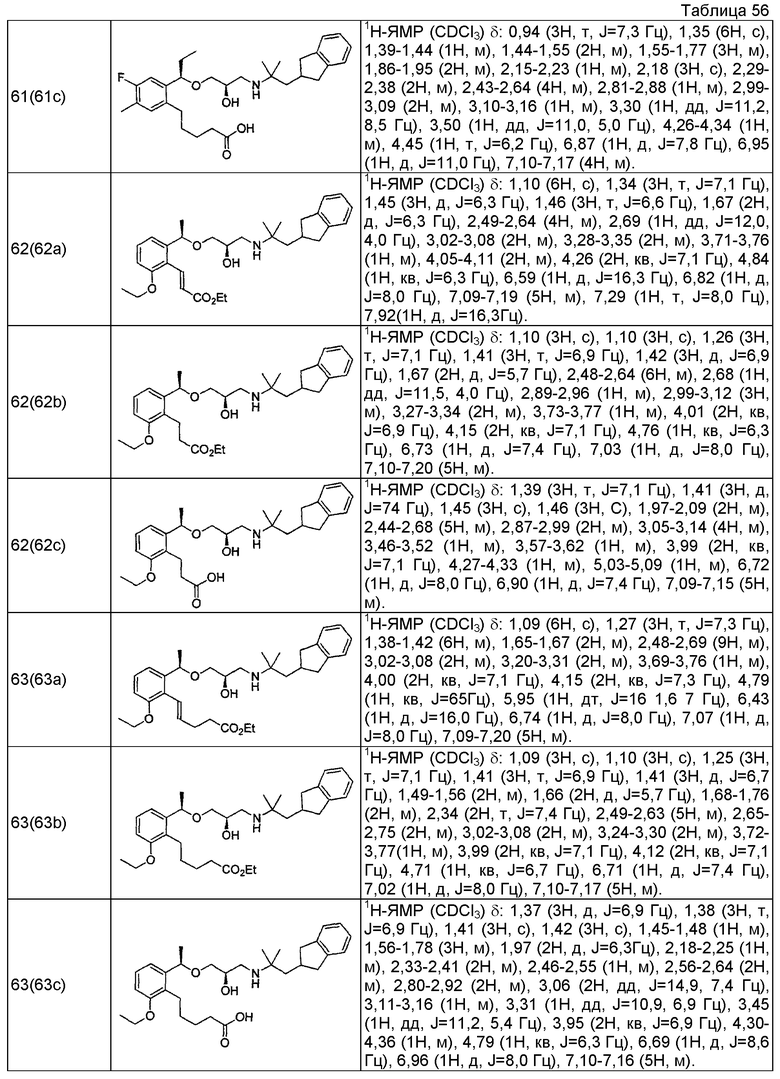
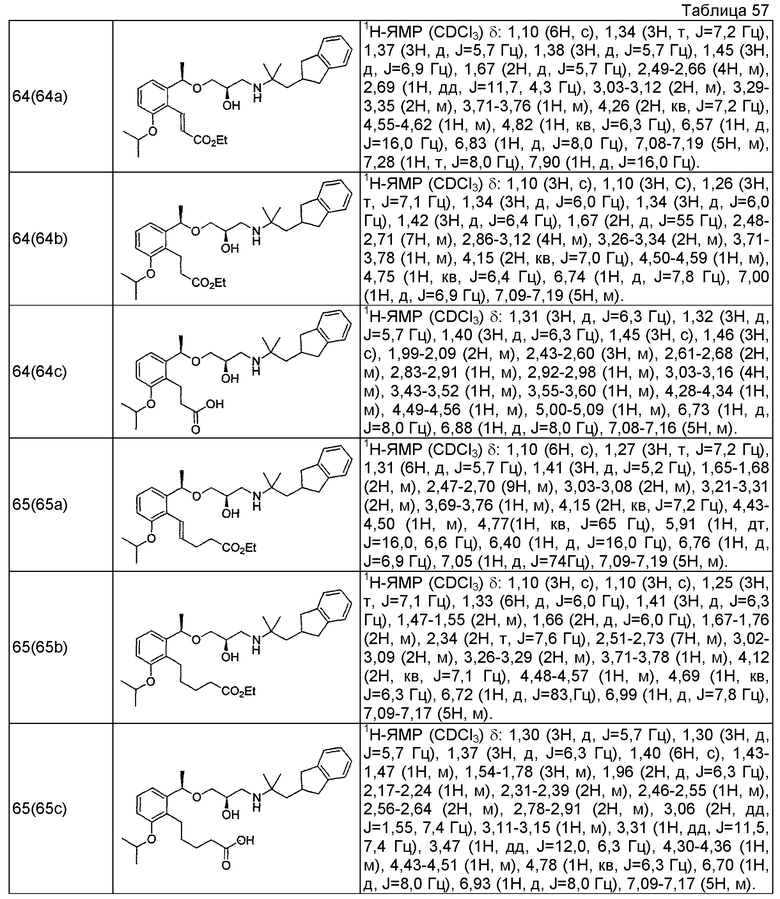


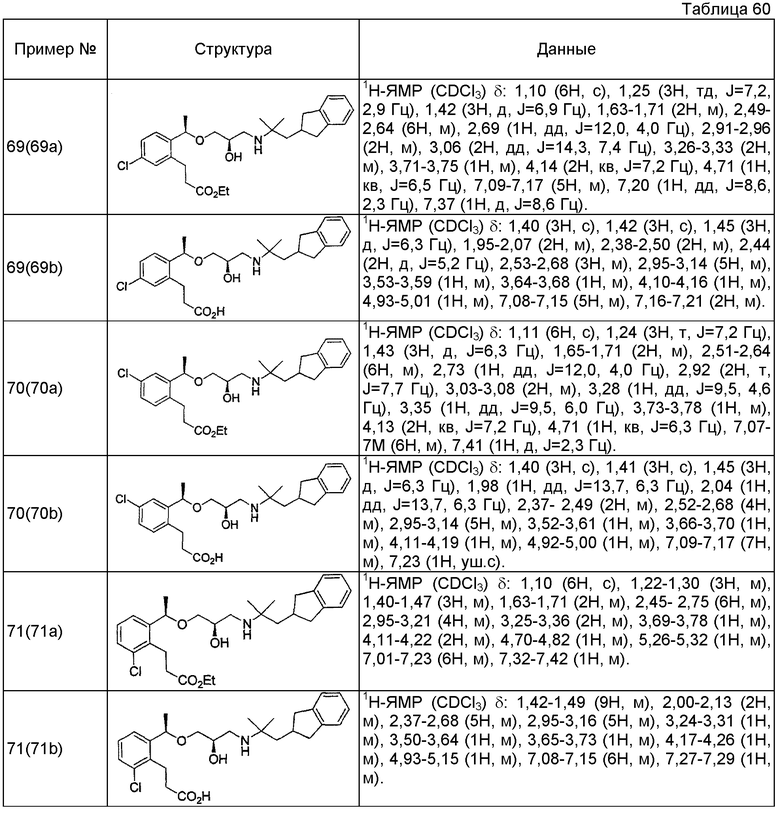

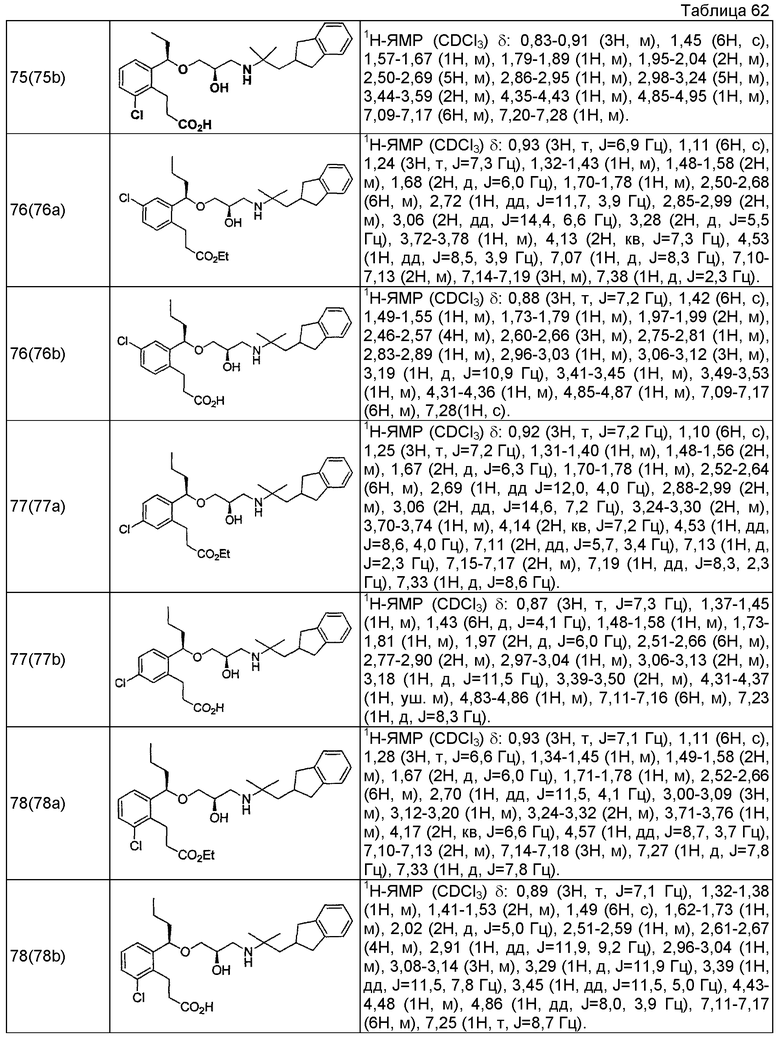

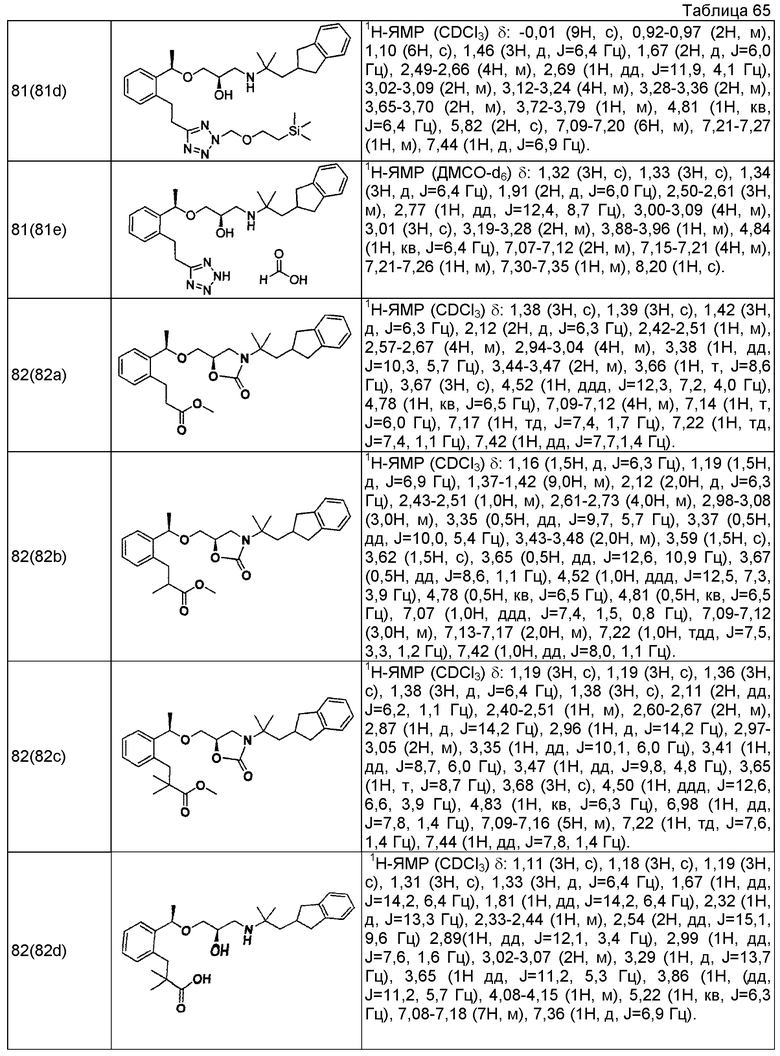
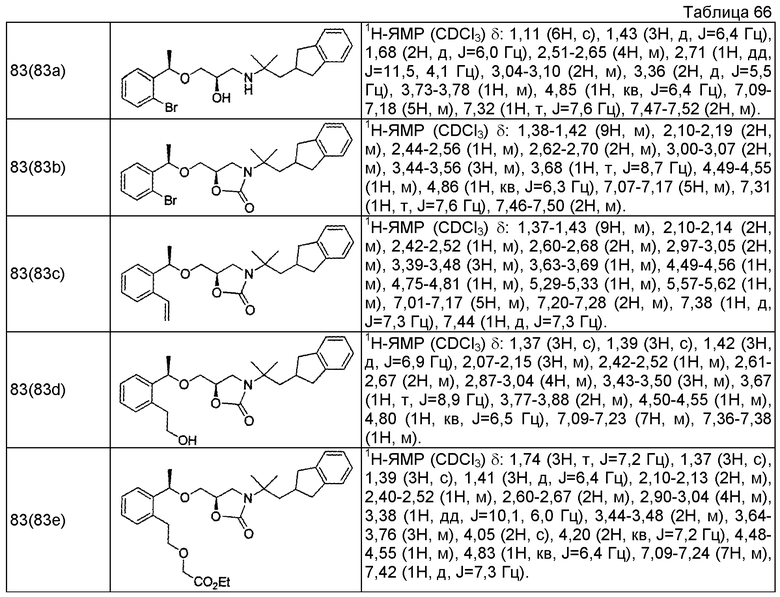
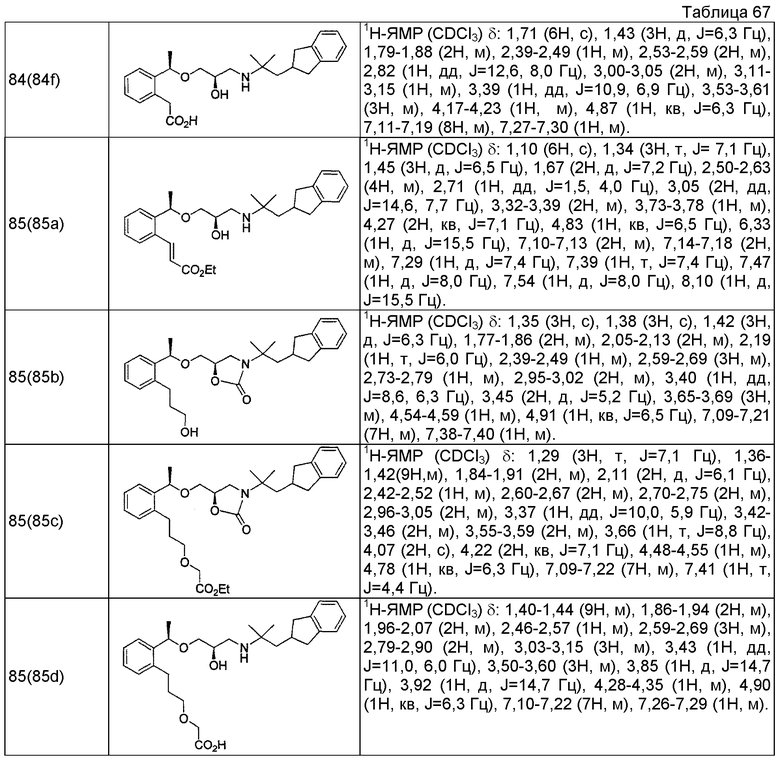
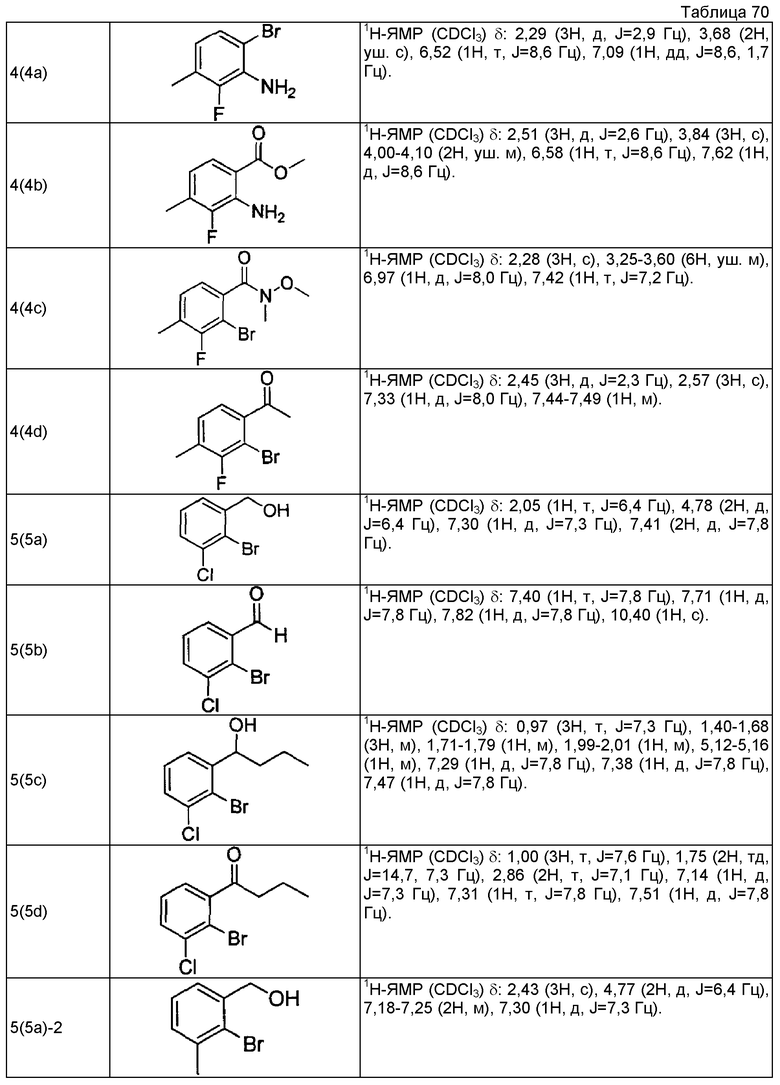
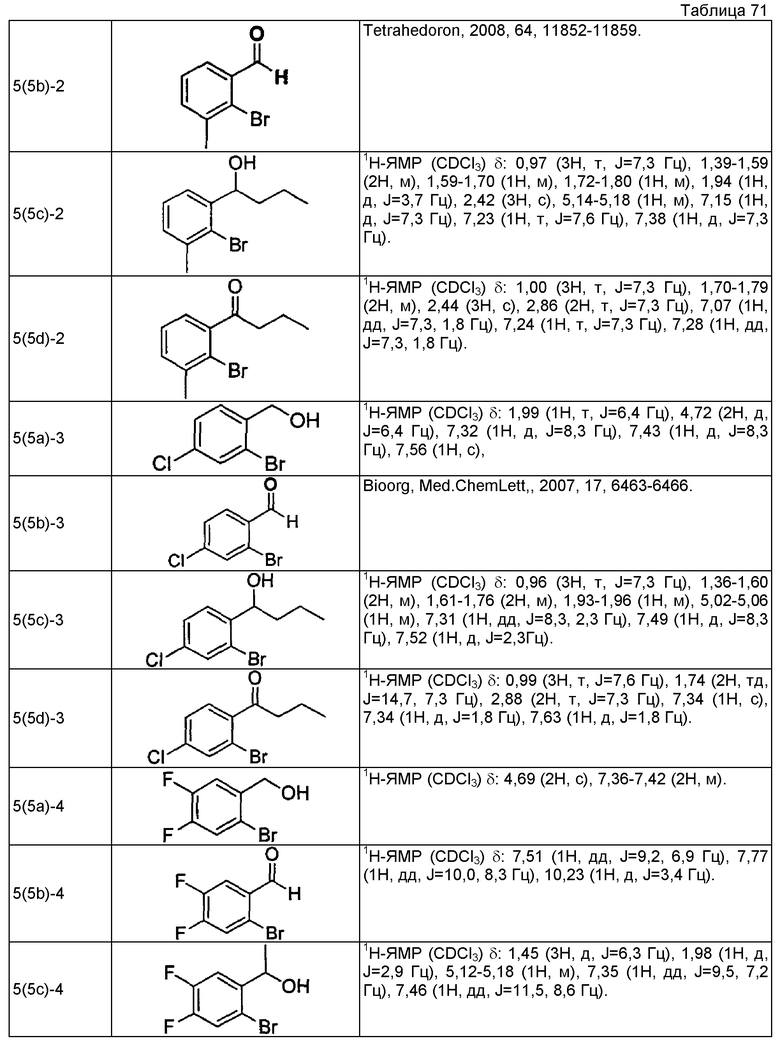




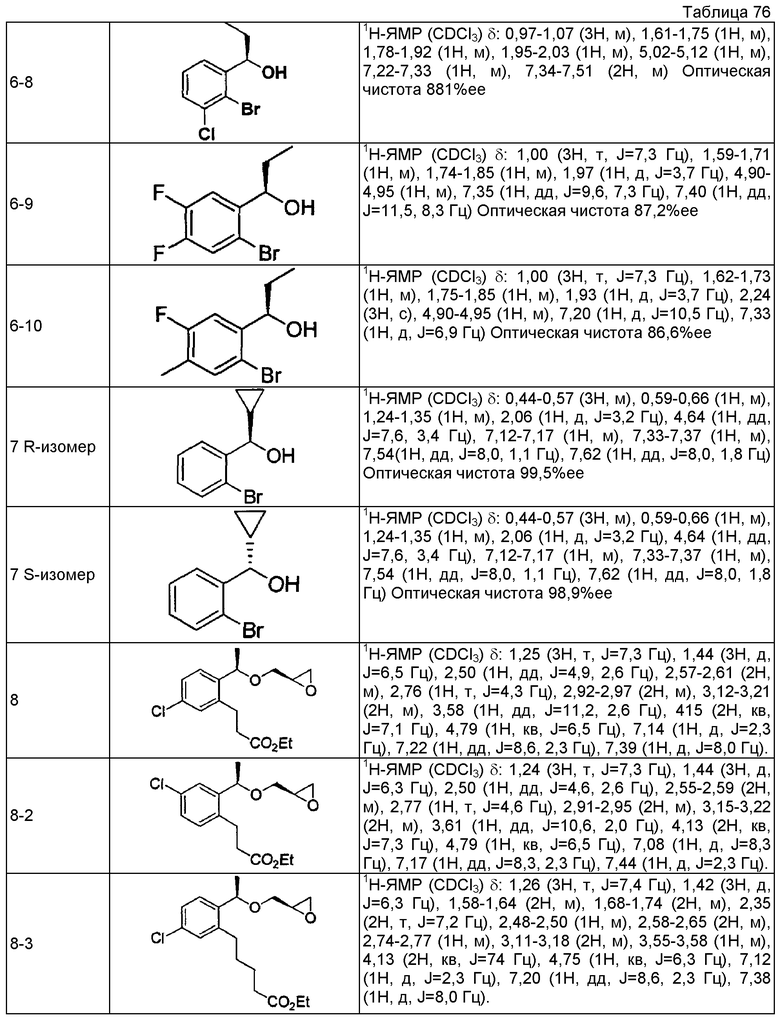


| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИКЛИЧЕСКИЕ АМИНОСОЕДИНЕНИЯ | 2009 |
|
RU2478616C2 |
| ЦИКЛОАЛКИЛНИТРИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС-КИНАЗЫ | 2014 |
|
RU2655380C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНИЛПИПЕРИДИНА В КАЧЕСТВЕ АНТАГОНИСТОВ ХЕМОКИНОВОГО РЕЦЕПТОРА | 2005 |
|
RU2369604C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИДИНОНА В КАЧЕСТВЕ TTX-S БЛОКАТОРОВ | 2013 |
|
RU2646754C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ МОЧЕВИНЫ, ТИОМОЧЕВИНЫ, ГУАНИДИНА И ЦИАНОГУАНИДИНА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ БОЛИ | 2013 |
|
RU2664541C2 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2020 |
|
RU2827641C1 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2744766C2 |
| ГЕМИНАЛЬНО-ЗАМЕЩЕННЫЕ ЦИАНОЭТИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ JANUS КИНАЗ | 2014 |
|
RU2664533C2 |
| БИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831535C1 |
| БИАРИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛОК-БЕЛКОВОГО ВЗАИМОДЕЙСТВИЯ YAP/TAZ-TEAD | 2021 |
|
RU2830596C1 |
Изобретение относится к новым инданильным производным и их фармацевтически приемлемым солям, обладающим активностью антагониста кальциевого рецептора. В формуле (I):
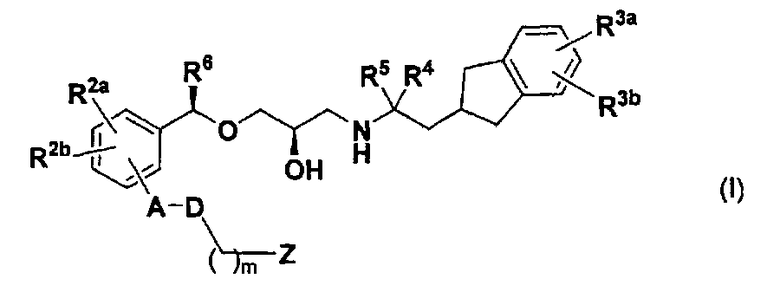
А - одинарная связь или фениленовая группа, которая замещена R1; R1 - метальная группа; D - одинарная связь; R2a и R2b - одинаковые или отличные друг от друга, означают атом водорода, атом фтора, атом хлора, метальную группа, метоксигруппу, этоксигруппу или трифторметильную группу; R3a и R3b - атом водорода; R4 и R5 - метальные группы, или R4 и R5 связаны друг с другом с образованием этиленовой группы; R6 - метильная группа или этильная группа; m - целое число от 0 до 4; Z - карбоксигруппа. Изобретение также относится к фармацевтической композиции, содержащей указанные соединения, к применению указанных соединений для производства лекарственного средства для лечения или предупреждения расстройства, связанного с аномальным костным или минеральным гомеостазом, такого как гипопаратиреоз, остеопороз, и к способу улучшения костного метаболизма. 5 н. и 10 з.п. ф-лы, 78 табл., 85 пр.
1. Соединение, имеющее следующую формулу (I), или его фармацевтически приемлемая соль:
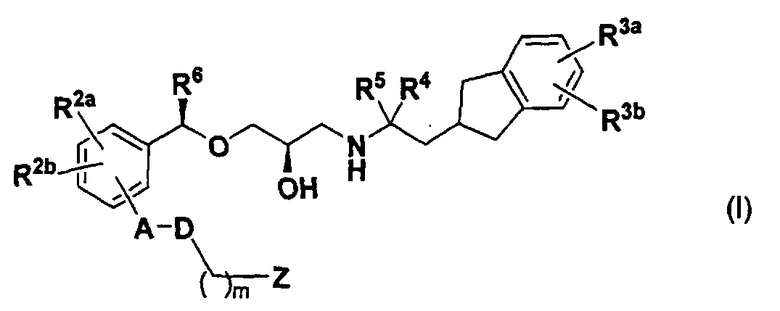
где каждая замещающая группа определена следующим образом:
А: одинарная связь или фениленовая группа, которая замещена R1;
R1: метальная группа;
D: одинарная связь;
R2a и R2b: одинаковые или отличные друг от друга, атом водорода, атом фтора, атом хлора, метильная группа, метоксигруппа, этоксигруппа или трифторметильная группа;
R3a и R3b: атом водорода;
R4 и R5: метальные группы,
или связаны друг с другом с образованием этиленовой группы;
R6: метильная группа или этильная группа;
m: целое число от 0 до 4;
Z: карбоксигруппа.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где m равно 0 или 1.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где m равно от 2 до 4.
4. Соединение по п.1 или его фармацевтически приемлемая соль, где А обозначает одинарную связь.
5. Соединение по п.1, выбранное из следующей группы соединений, или его фармацевтически приемлемая соль:
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота,
4-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}бутановая кислота,
2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоновая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-метилфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси]этил]-5-метилфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-метилфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-фторфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-фторфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-4-фторфенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-6-(трифторметил)фенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]-5-(трифторметил)фенил}пропановая кислота,
2'-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-илметил)циклопропил]амино}-2-гидроксипропил]окси}этил]-3-метилбифенил-4-карбоновая кислота,
5-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пентановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-илметил)циклопропил]-амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота,
3-{2-хлор-6-[(1R)-1-{[(2R)-3-{[1-(2,3-дигидро-1Н-инден-2-ил)-2-метилпропан-2-ил]амино}-2-гидроксипропил]окси}этил]фенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[2-(2,3-дигидро-1Н-инден-2-ил)-1,1-диметилэтил]амино}-2-гидроксипропил]окси}пропил]-6-метоксифенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[2-(2,3-дигидро-1Н-инден-2-ил)-1,1-диметилэтил]амино}-2-гидроксипропил]окси}этил]-6-этоксифенил}пропановая кислота,
3-{2-[(1R)-1-{[(2R)-3-{[2-(2,3-дигидро-1Н-инден-2-ил)-1,1-диметилэтил]амино}-2-гидроксипропил]окси}этил]-4-фтор-6-метоксифенил}пропановая кислота.
6. Соединение по любому из пп.1-5 или его фармацевтически приемлемая соль для применения в качестве антагониста кальциевого рецептора.
7. Применение соединения по любому из пп.1-5 или его фармацевтически приемлемой соли для производства лекарственного средства для лечения или предупреждения расстройства, связанного с аномальным костным или минеральным гомеостазом.
8. Применение по п.7, где расстройство, связанное с аномальным костным или минеральным гомеостазом, является гипопаратиреозом или остеопорозом.
9. Применение по п.7, где расстройство, связанное с аномальным костным или минеральным гомеостазом, является остеопорозом.
10. Фармацевтическая композиция, обладающая активностью антагониста кальциевого рецептора, которая содержит эффективное количество соединения по любому из пп.1-5 или его фармацевтически приемлемой соли в качестве эффективного компонента.
11. Фармацевтическая композиция по п.10 для применения для лечения или предупреждения расстройства, связанного с аномальным костным или минеральным гомеостазом.
12. Фармацевтическая композиция для применения по п.11, где расстройство, связанное с аномальным костным или минеральным гомеостазом, является гипопаратиреозом или остеопорозом.
13. Фармацевтическая композиция для применения по п.11, где расстройство, связанное с аномальным костным или минеральным гомеостазом, является остеопорозом.
14. Способ улучшения костного метаболизма, который характеризуется тем, что эффективное количество фармацевтической композиции по п.10 вводят млекопитающему.
15. Способ предупреждения или лечения остеопороза, который характеризуется тем, что эффективное количество фармацевтической композиции по п.10, вводят млекопитающему.
| Сверлильный станок для одновременной обработки отверстий с двух сторон | 1985 |
|
SU1308436A1 |
| WO 1999051569 A1, 14.10.1999 | |||
| EP 1630157 A1, 01.03.2006 | |||
| US 6916956 B2, 12.07.2005 | |||
| АНТАГОНИСТ CASR | 2004 |
|
RU2315036C2 |
| Семафор-индикатор | 1928 |
|
SU9603A1 |
Авторы
Даты
2013-02-10—Публикация
2009-12-22—Подача