Изобретение относится к биотехнологии, в частности к получению клеточных линий, используемых для гибридомной технологии как партнер для слияния клеток и синтеза моноклональных антител.
Гибридомная технология широко применяется в научных исследованиях для слияния клеток иммунной системы, прежде всего Т-лимфоцитов. Создание опухолевых клеточных линий, пригодных для использования в качестве партнера для слияния при проведении гибридизации, является актуальным. Моноклональные антитела широко используют в иммунодиагностике, иммунотерапии, для выделения различных биологически значимых молекул и с другими исследовательскими целями.
Потребность в человеческих моноклональных антителах, которые можно было бы использовать в иммунотерапии, очень велика. В настоящее время эта проблема решается с помощью молекулярно-генетических подходов [Ярилин А.А. Основы иммунологии: Учебник. Часть 2. М.: Медицина, 1999 г., с.119-120].
Известны клеточные линии, используемые для гибридомной технологии, которые были получены с помощью молекулярно-генетического метода «гуманизации» мышиных антител, суть которого состоит в создании «слитых» генетических комплексов, объединяющих V-ген мышиных моноклональных антител и С-гены иммуноглобулинов человека желаемого изотипа.
Известны также клеточные линии, полученные в результате объединения гипервариабельных частей V-генов мыши с генами, кодирующими каркасную последовательность V-гена человека, и человеческими С-генами [Martinsson-Niskanen Т., Riisbro R., Larsson L., et al. Monoclonal Antibody TB-403: A First-in-Human, Phase I, Double-Blind, Dose Escalation Study Directed Against Placental Growth Factor in Healthy Male Subjects. / Clin Ther. 2011 Sep; 33(9): 1142-1149].
Недостатками вышеперечисленных клеточных линий являются: трудоемкость, сложность технического исполнения и дороговизна их получения.
В качестве прототипа заявляемого изобретения использовали клеточные линии миеломы мыши P3X63Ag8.653 и P3-NS1-Ag4-1, устойчивые к 8-азагуанину не продуцирующие иммуноглубулины партнеры для получения гибридом [Zanella I, Verardi R, Negrini R. et al. New heteromyeloma cell lines for the production of human monoclonal antibodies. / J Immunol Methods. 1992 Dec 8; 156(2): 205-215]. Они происходят от продуцирующей IgG к-типа [Hancock R.J., Martin A., Laundy G.J. et al. Production of monoclonal human antibody to HLA-DR5 (DRw11) by mouse/human heterohybridomas. / Hum Immunol. 1988 Jun; 22(2): 135-142; Suzuki S, Masuko T, Takanashi К et al. Assay of cell surface-bound immunoliposomes using monoclonal antibody reactive with a cross-linking reagent. / Chem Pharm Bull (Tokyo). 1992 Jul; 40 (7): 1893-1896].
Недостаток: клеточные линии, представленные миеломными клетками мыши, не могут быть использованы для создания гибридом «человек-человек».
Задачей настоящего изобретения является получение новой клеточной линии множественной миеломы человека, пригодной в качестве партнера для слияния клеток с целью получения гибридом.
Поставленная задача решается тем, что получена новая генетически и фенотипически стабильная клеточная линия D11, сохраняющая гистогенетический фенотип множественной миеломы человека и адаптированная для роста в среде с 8-азагуанином.
Полученная клеточная линия обладает стабильными культуральными и морфологическими характеристиками.
Клеточная линия множественной миеломы человека D11 находится на хранении в Банке криоконсервированных биоматериалов РОНЦ им. Н.Н.Блохина РАМН под номером 1.2.6-3/D11.
Заявляемую клеточную линию множественной миеломы человека D11 получали из клеток исходной линии U-266, имеющих воспроизводимый фенотип клеток множественной миеломы человека.
Клеточную линию D11 получали в несколько этапов путем культивирования на питательной среде RPMI (ПанЭко, РФ), с добавлением 10% телячьей эмбриональной сыворотки (ТЭС), производство HyClone, США, гентамицина в концентрации 10 мг/мл (ПанЭко, РФ) и 8-азагуанина в концентрации 20 мкг/мл. Выращивание клеточной линии D11 проводили в культуральных флаконах объемом 25 см3 при температуре 37°C и 5%-ном содержании СО2 в инкубаторе. Пассаж проводили 1 раз в 2-3 суток.
При выращивании клеток в указанной культуральной среде добавляли 8-азагуанин в концентрации 20 мкг/мл. По истечении третьих суток наблюдали гибель 80-90% клеток и единичные клоны опухолевых клеток, устойчивых к 8-азагуанину, то есть имеющих альтернативный путь синтеза нуклеатидов. Затем в состав культуральной среды вводили 8-азагуанин в концентрации 10 мкг/мл, а концентрацию ТЭС увеличили до 20% с целью восполнения популяции при более мягких условиях культивирования. В течение последующих 10 пассажей пул клеток с альтернативным путем синтеза нуклеатидов восстановился полностью, что позволило применить исходные условия культивирования. Концентрация ТЭС была снижена до исходных 10% от состава культуральной среды, при этом гибель клеток не превышала 7%, скорость роста оставалась стабильной. Спустя 5 пассажей при данных условиях концентрацию 8-азагуанина вновь увеличили до 20 мкг/мл, гибель клеток составила не более 20%, скорость роста оставалась стабильной. В течение последующих 10 пассажей наблюдали дальнейший рост и жизнеспособность клеточной популяции. При обзорной микроскопии и динамическом наблюдении фенотипических изменений клеток не выявлено. Оценку скорости роста клеток и их подсчет осуществляли в инвертированном световом микроскопе DMIL (Leica Microsystems, Германия). Стабильно растущая клеточная линия получена на 20-м пассаже.
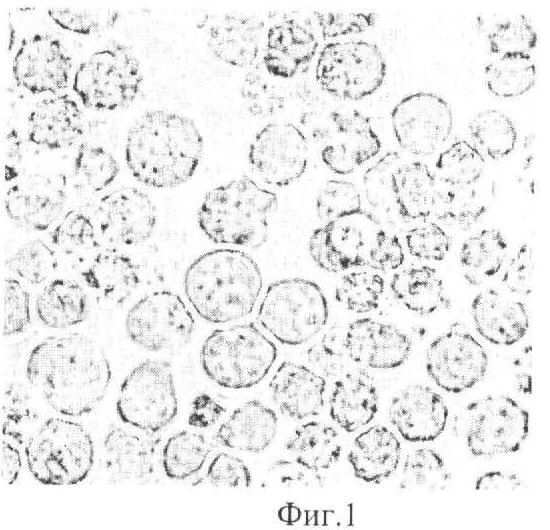
Морфологические признаки клеточной линии D11: В-лимфоциты. Клетки имели суспензионный тип роста. На Фиг.1 представлена картина микроскопии клеток множественной миеломы человека D11 в период экспоненциальной фазы роста: клетки округлой правильной формы, свободно расположены в среде в виде отдельных клеток или конгломератов по типу «гроздьев винограда». Клетки имели четко очерченную цитоплазму и хорошо выраженное ядро. Клетки D11 стабильно сохраняли свои свойства в течение всего периода наблюдения и культивирования.
Маркерные признаки клеточной линии D11: устойчива к 8-азагуанину.
Устойчивость клеточной линии D11 к 8-азагуанину означает, что у клеток блокирован запасной путь синтеза нуклеотидов из гипоксантина и гуанина, используемых в качестве предшественников.
Основной путь новообразования нуклеотидов, звеньев, входящих в состав нуклеиновых кислот, включает несколько этапов и блокируется противоопухолевым препаратом аминоптерином (А). Однако гибели клеток при этом не происходит, так как они обладают резервным путем синтеза нуклеотидов и нуклеиновых кислот, реутилизируя продукты распада ранее синтезированных нуклеиновых кислот: гипоксантина и тимидина. Добавление гипоксантина и тимидина в питательную среду, содержащую аминоптерин (среда HAT), снимает токсический эффект последнего. Аминоптерин блокирует основной путь биосинтеза нуклеотидов, гипоксантин и тимидин - субстраты для реализации запасных путей, заблокированных в миеломных клетках (о чем свидетельствует устойчивость к 8-азагуанину или 6-тиогуанину), но реализуемых в гибридных клетках, которые наследуют соответствующий ген от родительских клеток. В результате культивирования в среде HAT гибнут неслившиеся опухолевые клетки и естественным образом погибают неслившиеся нормальные клетки, а выживают только гибридные клетки, которые унаследовали бессмертие [Абелев Г.И. Моноклональные антитела / Соросовский Образовательный журнал. 1998 (1): 16-20].
Данное обстоятельство важно в связи с применяемым методом отбора гибридных клеток. Его суть состоит в следующем. Разнородные клетки, у которых слились оболочки, образуют двуядерные гибриды, которые сохраняют способность к клеточному делению. В процессе клеточного деления хромосомы обоих ядер образуют общее ядро. Таким образом, получен истинный гибрид - потомок двух соматических клеток или гибридома. Ее синтетический аппарат обладал способностью синтеза иммуноглобулинов. При соблюдении всех деталей технологии доля слившихся клеток невелика, поэтому их отбор является важной задачей.
Проведен тест выживаемости в среде HAT: гибель клеток зарегистрирована на 6 сутки культивирования в 20%-ной среде HAT, что подтверждает пригодность линии клеток D11 при использовании в качестве партнера для получения гибридом.
Оценка фенотипа линии клеток D11 представлена в таблице. Выявлена экспрессия CD10+ (31,3±1%).
Контаминация: бактерии и грибы в культуре клеток не обнаружены за весь период наблюдения и культивирования. Тест на микоплазму отрицателен.
Условия криоконсервации:
Линии клеток D11 ресуспендировали в среде для замораживания, содержащей полиглюкин (Биохимик, РФ) (95%), DMSO (ПанЭко, РФ) (5%). Криоконсервацию проводили в криопробирках в концентрации 1×105 клеток/мл среды в жидком азоте при снижении температуры на ГС в минуту до минус 25°C. Затем осуществляли быстрое замораживание до минус 70°C. Клетки хранили в жидком азоте при температуре минус 196°C. Размораживание проводили в течение 3-5 минут при t=37°C. Клетки разводили в 10 мл бессывороточной среды и осаждали центрифугированием при скорости 4000 об/мин в течение 2 минут. Супернатант удаляли, а осевшие клетки ресуспендировали в 5 мл той же среды, содержащей 10% эмбриональной телячьей сыворотки, и переносили в культуральный флакон. Жизнеспособность клеток оценивали по включению трипанового синего, после размораживания она составила 90%.
Полученная линия клеток множественной миеломы человека D11 обладала рядом качеств: устойчивостью к 8-азагуанину, отсутствием роста в среде HAT, пригодностью для осуществления гибридомной технологии.
Изобретение иллюстрировано следующим примером.
Пример.
Для получения человеческих гибридом путем слияния использовали линии клеток множественной миеломы человека D11 и лимфоцитов человека. В качестве реагента, используемого для слияния клеток, применяли раствор полиэтиленгликоля (ПЭГ).
В процессе гибридизации обнаружено 3 типа клеток: гибридомные клетки (гибридомы), родительские клетки множественной миеломы человека D11 и лимфоциты человека.
Родительские миеломные клетки погибали при росте в селективной среде HAT. Неслившиеся с миеломными клетками лимфоциты погибали в течение 6-7 суток.
Выявлено, что 50% гибридных клеток имели ожидаемые характеристики обоих родительских клеток: неограниченную пролиферацию в культуре клеток, способность активно синтезировать антитела от миеломных родительских клеток и специфичность антител от родительских лимфоцитов.
На Фиг.2 представлена обзорная микроскопия проведенной гибридизации, где указаны 3 типа клеток: 1 - гибридомы - крупные полиядерные клетки, полученные путем слияния клеток множественной миеломы человека D11 с лимфоцитами, 2 - свободно расположенные в среде клетки множественной миеломы человека D11, 3 - свободно расположенные в среде лимфоциты человека. Микрофотосъемка произведена с помощью оборудования Nikon (Nikon digital camera DXM1200F, инвертированный световой микроскоп Nikon Eclipse TE2000-u, Япония).
Показано, что клетки множественной миеломы человека D11 могут быть использованы в качестве партнера для слияния с лимфоцитами с целью получения гибридом.
Технический результат состоит в расширении арсенала клеточных линий, используемых для гибридомной технологии.
Изобретение относится к биотехнологии, конкретно к получению клеточных линий, используемых для гибридомной технологии. Получена генетически и фенотипически стабильная клеточная линия D11 множественной миеломы человека, сохраняющая гистогенетический фенотип множественной миеломы человека, пригодная для культивирования в среде, содержащей 8-азагуанин. Изобретение позволяет эффективно использовать клеточную линию D11 в качестве партнера для слияния клеток и синтеза моноклональных антител. 2 ил., 1 табл., 1 пр.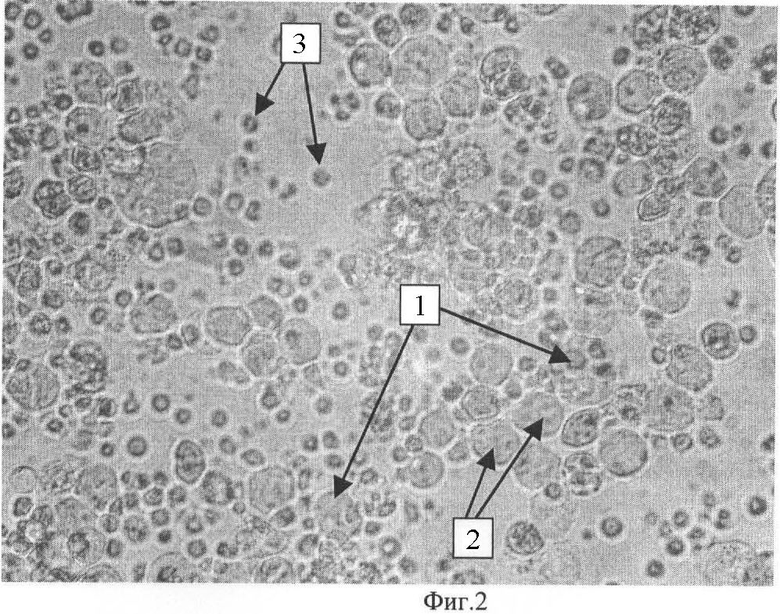
Клеточная линия множественной миеломы человека D11, используемая для гибридомной технологии, находится на хранении в Банке криоконсервированных биоматериалов РОНЦ им. Н.Н.Блохина РАМН под номером 1.2.6-3/D11.
| US 20090232736 A1, 17.09.2009 | |||
| АЛЕКСЕЕВА Л.П | |||
| и др | |||
| Способ подпочвенного орошения с применением труб | 1921 |
|
SU139A1 |
| Способ селекции популяции клеток IN VIVo | 1991 |
|
SU1806195A3 |
Авторы
Даты
2013-05-20—Публикация
2011-12-07—Подача