Изобретение относится к аналитической химии, а именно к способам определения ионов металлов, и может быть использовано в гидрогеологии, изысканиях в случае анализа вод различного происхождения (родники, геотермальные источники, смывы хвостов обогащения), а так же технологические сливы концентраций ионов рения методом кинетической инверсионной вольтамперометрии (КинИВ).
Известен метод полярографического определения рения, впервые изученный в растворах кислот (HCl, HClO4, H2SO4) и нейтральных растворах (KCl, фосфатном буфере). Определяемая концентрация рения (VII), использованная в исследованиях, составляла 1·10-3 М. [Lingan J.J. / J. Am. Chem. Soc. 64, 1001 (1942); Lingan J.J. // J. Am. Chem. Soc. 64, 2182 (1942)]. Недостатком метода является низкая чувствительность и использование больших количеств металлической ртути в ходе полярографических определений рения в растворе.
Известна методика определения рения в сернокислых и гидроксонатриевых растворах. Показано, что число волн восстановления и их характер меняются в зависимости от концентрации H2SO4. Потенциал полуволны Е1/2 для рения (VII) в 3,5 М H2SO4 равен от 0,2 до -0,45 В, в 2 М щелочного раствора Е1/2 для рения (VII) равна -1,4 В. Определяемая концентрация составила 1·10-4 М. [Geyer R. // Z. anorg. u. allgem. Chem., 263, 47 (1950)]. Недостатком методики является низкая чувствительность определяемых содержаний рения. Использование металлической ртути, пары которой являются токсичными. При определении рения мешают анионы Cl-, NO3 -, PO4 3-, а также ионы металлов Мо, Fe и Ti.
Известен способ восстановления перренат-иона па ртутно-капельном катоде. Величина диффузионного тока в 4М растворе HClO4 прямо пропорциональна концентрации ReO4 - в растворе в интервале от 1·10-4 до 1·10-3 М. В 2 М и 4,2 М растворах HCl E1/2 равны соответственно -0,45 В и -0,31 В (относительно н.к.э.). [Rulfs C.L., Elving P.J. // J. Am. Chem. Soc. 73, 3284 (1951)]. Недостатком способа является низкая чувствительность определяемых содержаний рения и использование металлической ртути пары, которой ядовиты.
Известна методика определения малых концентраций рения в нейтральных, щелочных и буферных растворах. На скорость каталитического выделения водорода существенное влияние оказывает рН раствора и буферная емкость раствора. В исследованиях использовался ртутно-капельный электрод, а вспомогательным и электродом сравнения служили насыщенные каломельные. Предельный ток достигает максимального значения в интервале рН 7-9. Концентрация перренат-иона использованная в исследованиях составляла 8·10-5 моль/л. [Рубинская Т.Я., Майрановский С.Г. О восстановлении перренат-иона на ртутном капельном электроде в щелочных и нейтральных средах. // Электрохимия, 1971, Т.7, №10, С.1403-1408]. Недостатком методики является существенное влияние рН раствора и его буферная емкость. Низкая чувствительность, каталитические волны, пригодные для аналитических целей, находятся в сильно отрицательной области -1,6 В, а также использование токсичной ртути.
Известен метод определения рения проводимый на фоне раствора NaCl+Na2SO3 (рН=11,3-11,5) E1/2=-0,45 В. Открываемый минимум равен 1·10-5 М. Определение проводят также после подготовки пробы, в ходе которой от рения отделяется молибден, вольфрам и другие сопутствующие элементы. [Duca: А., Stanescu D., Puscasu M. Studii si cercetari chim. Acad. RPR Fil. Cluj, 6, 123 (1955); 13, 197 (1962)]. Недостатком метода является использование ртути. При растворении проб содержащих рений используется азотная кислота, а нитрат-ионы мешают определению, поэтому необходимо удалять окислы азота.
Известна методика, где использовался ртутно-капающий электрод, а нас.к.э. - электродом сравнения. В качестве фонового электролита использовали раствор, состоящий из 3 М по NH3, 3 М по KSCN, 3 М по ЭДТА и 0,16 М по Na2SO3 для найденной новой электрохимической.реакции. Предел обнаружения составил 0,05 мг/л (2,5·10-7), что позволяет при навеске 2 г и конечном объеме 10 мл определять от 2·10-5% рения. Метод обладает высокой селективностью и не мешает большинство элементов: Mo, W, Fe, Cd, Zn, Sb, Bi, Ag, Al. Полярографирование проводят от -1,0 до -1,5 В. [Васильева Л.И., Семенова И.А., Юстус З.Л. Полярографическое определение рения в сложных продуктах цветной металлургии // Журнал аналитической химии. 1986, т.41, №2, с.293-297.]. Недостатком методики является использование ртути. В качестве фонового электролита используется много составной фон, который готовится в день использования. Метод обладая высокой селективность, однако, уступает в чувствительности определения рения.
Известна методика каталитического определения рения. [Győrbiro К. // Acta Chim. Acad. Sci. Hung., 27, 120 (1961)]. (прототип). В методе предложено использовать систему: 5 М H2SO4+2·10-3 М H6TeO6+x·ReO4 -. Рений катализирует процесс окисления теллура с появлением каталитической волны на ртутно-капающем электроде, что позволяет определять его в интервале от 4·10-7 до 1·10-5 М. Недостатком метода является длительное выдерживание системы перед определением. Использование достаточно большого количества ртути, которая относится к веществам первого класса опасности.
В работе была поставлена задача снизить предел и нижнюю границу определяемых содержаний рения (VII) по пику электрокаталитического разложения пероксида водорода, полученному после электроконцентрирования рения в виде ReO2 на ртутно-пленочном электроде (РПЭ) методом КинИВ.
Поставленная задача достигается тем, что ионы рения (VII) электрохимически концентрируют на поверхности РПЭ в форме ReO2 в перемешиваемом растворе в течении 10-20 с при потенциале электролиза Еэ равном -0,2 В на фоне 0,1 М H2SO4 с добавлением 0,3 мл 30% H2O2 с последующей регистрацией катодных пиков при скорости развертки 100 мВ/с, концентрацию ионов рения (VII) определяют по высоте катодного пика в диапазоне потенциалов от 0,0 до 0,20 В относительно насыщенного хлоридсеребряного электрода (нас.х.э.). Новым в способе является то, что для получения полезного сигнала, зависящего от концентрации рения (VII), используется определенное количество пероксида водорода для осуществления каталитической реакции ее разложения на ReO2, полученном в ходе электроконцентрирования ионов рения (VII) из раствора.
В предлагаемом способе установлена способность, осадка ReO2, разлагать пероксид водорода на поверхности ртутно-пленочных электродов.
В качестве индикаторного применяли РПЭ (в прототипе применяли ртутно-капающий электрод). Использование таких электродов обусловлено простотой обновления поверхности, а также значительно уменьшается расход ртути. Нижняя граница определяемых содержаний по данному методу составила 1·10-8 М (в прототипе 4·10-7 М).
В прототипе описано использование в качестве фона 5 М H2SO4 с 2·10-3 М H6TeO6. При использовании большей концентрации соли теллура на вольтамперной кривой появляется волна восстановления теллура мешающая определению ионов рения (VII), а при меньшем содержании ионы рения (VII) не катализирует процесс окисления соединений теллура, дающих пики на вольтамперной кривой. Использование серной кислоты с большой концентрацией фонового электролита опасно и не предпочтительно для инверсионных методов. Предлагаемый в заявляемом изобретении фон 0,1 М H2SO4 с добавлением 0,03 мл 30% H2O2 позволяет определять рений с хорошей воспроизводимостью. Использование большего количества 30% H2O2 приводит к появлению самой волны разложения пероксида водорода на РПЭ.
Другим отличительным признаком являются установленные условия электрохимического накопления: потенциал электролиза Еэ равным -0,2 В. Опытные данные показали зависимость тока окисления рения от Еэ, представленные в таблице 1, где CReO4 -=2 мг/л; τэ=10 с; фон 0,1 М H2SO4 с добавлением 0,03 мл 30% H2O2; Еп=0,10 В. Величина катодного тока увеличивалась и достигала максимального значения в области потенциалов (-0,2÷-0,4) В. Использование предварительного электролиза при значениях потенциала больше -0,4 В не увеличивает волну электрокаталитического разложения пероксида водорода. Меньший потенциал электролиза увеличивает срок службы электродов, что позволяет не прибегать к дополнительной очистке и регистрировать воспроизводимые вольтамперограммы. Это позволяет повысить точность и разрешающую способность предложенного метода.
Время предварительного электролиза (τэ) составляет 10-20 секунд, при этом достигается максимальное значение величин тока окисления пероксида водорода и увеличивается экспрессность определения.
Таким образом, установленные условия впервые позволили количественно определять содержание ионов рения (VII) на основе реакции каталитического разложения пероксида водорода с выделением кислорода на поверхности ртутно-пленочного электрода.
Предлагаемый вольтамперометрический способ позволил существенно улучшить метрологические характеристики анализа ионов рения (VII); повысить чувствительность определения (1·10-8 М=2·10-3 мг/дм3), что более чем на порядок ниже по сравнению с прототипом. Определению не мешают молибден, вольфрам и медь, являющиеся сопутствующими элементами.
Примеры конкретного выполнения
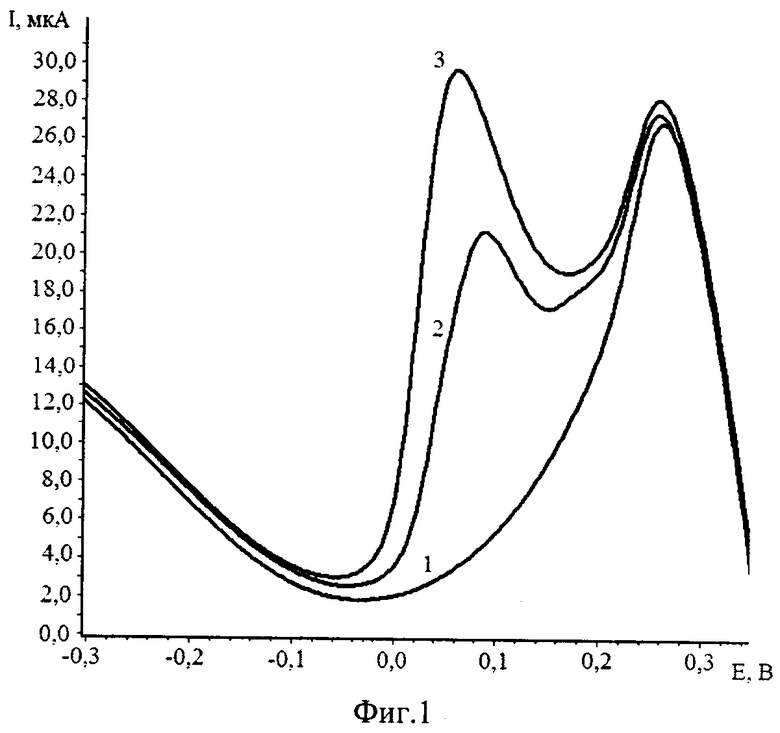
Пример №1. Измерения были проведены на искусственных смесях. 10 мл фонового электролита (0,1 М H2SO4 с добавлением 0,03 мл 30% H2O2) помещают в кварцевый стаканчик. Не прекращая перемешивания, проводят электролиз раствора, при Еэ=-0,2 В и при τэ=10 с, снимают вольтамперную кривую электроокисления при скорости развертки 100 мВ/с. Отсутствие пиков на вольтамперной кривой в интервале от 0,0 до плюс 0,2 В (относительно нас.х.э.) свидетельствует о чистоте фона. Затем добавляли аттестованный раствор ионов рения (VII) 0,02 мл из 0,1 мг/дм3 и снимали вольтамперную кривую электроокисления. Появляется пик электрокаталитического разложения пероксида водорода на ReO2 в интервале от 0,0 до плюс 0,2. Вносили добавку аттестованного раствора рения (VII) 0,02 мл из 0,1 мг/дм3 и снимали вольтамперную кривую электрокаталитического разложения пероксида на осадке оксида рения в интервале от 0,0 до плюс 0,2 (относительно нас.х.с.э.). По разнице токов пиков вычисляли концентрацию рения (VII) в растворе (фиг.1).
Пример №2. Измерения были проведены в водопроводной воде (табл.2).
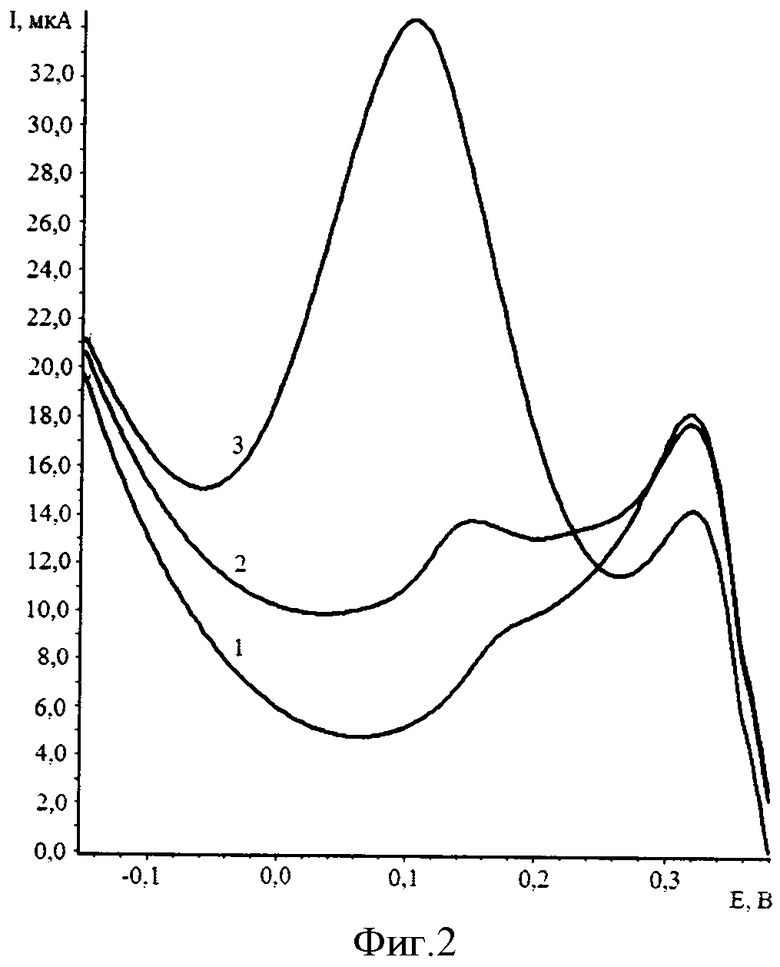
В 100 мл испытуемого раствора прибавляют 1 мл 1 М H2SO4 и упаривают при температуре не выше 150°С до минимального объема. В стаканчик с остатком приливают бидистиллированной воды до 10 мл, добавляют 0,03 мл 30% H2O2 и помещают в прибор. Не прекращая перемешивания, проводят электролиз на РПЭ раствора при условиях электроконцентрирования: Еэ=-0,2 В, τэ=10 с и регистрируют вольтамперную кривую электрокаталитического разложения пероксида водорода на ReO2 в интервале от 0,0 до плюс 0,2 (относительно нас.х.э.) при скорости развертки 100 мВ/с. Затем добавляют 0,02 мл аттестованной смеси ионов рения (VII) концентрацией 1 мг/дм3 и проводят электрохимическое концентрированно осадка при аналогичных условиях. Пик электрокаталитического разложения пероксида водорода на ReO2 в интервале от 0,0 до плюс 0,2 (относительно нас.х.э.) при скорости развертки 100 мВ/с. По разнице высоты пика вычисляют концентрацию ионов рения (VII) в растворе (фиг.2).
Таким образом, впервые установлена способность количественного определения ионов рения (VII) по пикам электрокаталитического разложения пероксида водорода на осадке ReO2.
Предложенный способ прост, используется значительно меньшее количество ртути по сравнению с ртутно-капающим электродом. Способ может быть применен в любой химической лаборатории, имеющей компьютеризированные анализаторы типа СТА или ТА.
Способ определения рения кинетическим инверсионно-вольтамперометрическим методом в водных растворах природного и техногенного происхождения.
Изобретение относится к аналитической химии и может быть использовано в гидрогеологии, изысканиях в случае анализа вод различного происхождения. Способ определения рения кинетическим инверсионно-вольтамперометрическим методом в водных растворах природного и техногенного происхождения заключается в том, что рений переводят в растворе в рений (VII) и проводят вольтамперометрическое определение, при этом проводят накопление ионов рения (VII) на ртутно-пленочном электроде в перемешиваемом растворе в течение 10-20 с при потенциале электролиза -0,2 В относительно насыщенного хлоридсеребряного электрода на фоне 0,1 М Н2SO4 с добавлением 0,03 мл 30% Н2O2 с последующей регистрацией катодных пиков, съемки вольтамперограмм при скорости развертки потенциала 100 мВ/с, концентрацию определяют по высоте пика в диапазоне потенциалов от 0,0 до 0,2 В методом добавок аттестованных смесей. Изобретение обеспечивает возможность снизить предел и нижнюю границу определяемых содержаний рения (VII) по пику электрокаталитического разложения пероксида водорода, полученному после электроконцентрирования рения в виде RеO2 на ртутно-пленочном электроде (РПЭ) методом кинетической инверсионной вольтамперометрии. 2 пр., 2 табл., 2 ил.
Способ определения рения кинетическим инверсионно-вольтамперометрическим методом в водных растворах природного и техногенного происхождения, заключающийся в том, что рений переводят в растворе в рений (VII) и проводят вольтамперометрическое определение, отличающийся тем, что проводят накопление ионов рения (VII) на ртутно-пленочном электроде в перемешиваемом растворе в течение 10-20 с при потенциале электролиза -0,2 В относительно насыщенного хлоридсеребряного электрода на фоне 0,1 М H2SO4 с добавлением 0,03 мл 30%-ного Н2О2 с последующей регистрацией катодных пиков, съемки вольтамперограмм при скорости развертки потенциала 100 мВ/с, концентрацию определяют по высоте пика в диапазоне потенциалов от 0,0 до 0,2 В методом добавок аттестованных смесей.
| GYORBIRO R | |||
| Acta Chim | |||
| Acad | |||
| Scient | |||
| Hung., 27, 120 (1961) | |||
| Chem | |||
| Abstr., 55, 21975 (1961) | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ РЕНИЯ И РЕНИЯ В ПРИСУТСТВИИ МОЛИБДЕНА МЕТОДОМ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ | 2003 |
|
RU2241983C1 |
| Электрохимический способ определения рения в присутствии элементов YI группы | 1989 |
|
SU1684654A1 |
| Способ полярографического определения рения | 1976 |
|
SU711453A1 |
Авторы
Даты
2013-08-20—Публикация
2012-03-14—Подача