Изобретение относится к химии производных адамантана, а именно к новому способу получения 2-нитрометиленадамантана, который является исходным соединением для получения 2-функциональных производных адамантана, проявляющих психостимулирующую и антикаталептическую активность [А.с. SU 1018361, МПК C07C 211/00, A61K 31/13, опубл. 30.04.1994].
Известен способ синтеза 2-нитрометиленадамантана путем взаимодействия 2-метилиденадамантана с ацетилнитратом с образованием 2-нитрометильного карбокатиона, стабилизация которого происходит за счет элиминирования протона. Выход целевого соединения составил 26%, а выделение включает в себя стадию очистки продукта методом колончатой хроматографии [Красников П.Е. Синтез мостиковых производных адамантана на основе реакций 2-алкилиденадамантанов с азотсодержащими электрофильными агентами: Автореф . … дис. канд. хим. наук. - Самара: СамГТУ, 2013. - 24 с., стр. 8-9].
К недостаткам данного способа относятся низкий выход и необходимость выделения методом колоночной хроматографии.
Известен способ получения 2-нитрометиладамантана путем кипячения в течение 24 часов смеси адамантанона, нитрометана и этилендиамина при мольном соотношении 1:100÷200:0.1 в атмосфере азота [A one pot, two step synthesis of 2,2-disubstituted 1-nitroalkenes / Yeong Jiunn Jang [at. al.] // Tetrahedron, Vol. 59 - 2003. - P. 4979-4992].
Основными недостатками данного способа являются: необходимость использования инертной атмосферы и большого избытка нитрометана, низкий выход целевого соединения (15%) и необходимость его дополнительной очистки от исходного адамантанона и образующихся смол методом колончатой хроматографии.
Наиболее близким является способ, при котором смесь адамантанона, нитрометана и этилендиамина, взятых в мольном соотношении 1:90:0,1, кипятят в течение 24 часов в атмосфере азота. После окончания реакции непрореагировавший нитрометан упаривают, а реакционную массу дополнительно очищают методом колончатой хроматографии. Выход целевого соединения составил 86% [An improved and easy method for the preparation of 2,2-disubstituted 1-nitroalkenes / Wen-Wei Lin [at. al.] // J.Org. Chem. - 2001. - Vol. 66. - N. 6. - P. 1984-1991].
Основными недостатками данного способа являются необходимость использования инертной атмосферы, использования большого избытка нитрометана и необходимость дополнительной очистки реакционной массы от исходного адамантанона и образующихся смол методом колончатой хроматографии.
Задачей предлагаемого технического решения является разработка нового технологичного способа получения 2-нитрометиленадамантана с хорошим выходом и высокой степенью чистоты.
Техническим результатом предлагаемого способа является упрощение способа получения с сохранением высокой чистоты и выхода целевого 2-нитрометиленадамантана.
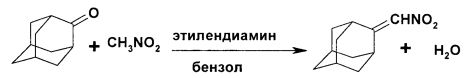
Технический результат достигается в способе получения 2-нитрометиленадамантана, заключающемся во взаимодействии 2-адамантанона и нитрометана при кипячении в течение 24 часов в присутствии этилендиамина, последующем упаривании реакционной массы и выделении продукта, при этом взаимодействие ведут в присутствии бензола при азеотропной отгонке воды при мольном соотношении 2-адамантанона:нитрометана:этилендиамина, равном 1:4:0.1, перед упариванием реакционную массу фильтруют через слой силикагеля, а продукт выделяют кристаллизацией из петролейного эфира.
Сущностью предлагаемого способа является то, что использование бензола позволяет азеотропной отгонкой удалять из реакционной массы воду, образующуюся в результате взаимодействия исходных компонентов смеси:
При этом равновесие реакции смещается в сторону образования продуктов, что позволило исключить необходимость использования большого избытка нитрометана и инертной атмосферы. Кроме этого, введение растворителя (в частности, бензола) позволило снизить температуру кипения реакционной массы, что в результате уменьшило количество образующихся в процессе реакции продуктов осмоления.
По окончании реакции, реакционную массу дополнительно очищают фильтрованием через слой силикагеля. После этого удаляют растворитель и выделяют продукт кристаллизацией его из петролейного эфира.
Наиболее оптимальным мольным соотношением используемых реагентов 2-адамантанона:нитрометана:этилендиамина является 1:4:0.1. Уменьшение времени реакции приводит к снижению выхода целевого продукта.
Пример
В кругло донную колбу на 500 мл, снабженную насадкой Дина-Старка, холодильником и хлоркальциевой трубкой, загружают 60 г (0.4 моль) 2-адамантанона, 97,6 г (1.6 моль) нитрометана, 2,4 г (0.04 моль) этилендиамина и 250 г (2.4 моль) бензола. Реакционную массу кипятят в течение 24 часов. При этом осуществляется азеотропная отгонка воды.
Затем раствор охлаждают и фильтруют через слой силикагеля на фильтре Шота. Бензол упаривают, к полученной твердой массе прибавляют 350 мл петролейного эфира. Смесь нагревают до полного растворения осадка и оставляют кристаллизоваться при комнатной температуре. Выпавший осадок отфильтровывают. Выход 2-нитрометиленадамантана 69.48 г (90%), температура плавления 80-82°C. Содержание основного вещества составляет 97%.
ЯМР (1H) в (CCl4) δ, м.д: 6.96 (s, 1H), 4.08 (s, 1H), 2.46 (s, 1H), 2.12-1.81 (m, 14H).
Таким образом, предложенное техническое решение является простым и эффективным способом, позволяющим получать 2-нитрометиленадамантан с хорошим выходом и высокой степенью чистоты.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-N-ФЕНИЛАМИНО-2-ЦИАНОАДАМАНТАНА ИЛИ ЕГО ПРОИЗВОДНЫХ | 2007 |
|
RU2344124C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ГИДРОКСИАДАМАНТАН-4-ОНА (ЛЕКАРСТВЕННОЕ СРЕДСТВО "КЕМАНТАН") | 1994 |
|
RU2104994C1 |
| СПИРО- ИЛИ ДИСПИРО-1, 2, 4-ТРИОКСОЛАН, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2002 |
|
RU2271357C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОАЛКИЛАМИНОВ | 2010 |
|
RU2425828C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ГИДРОКСИАДАМАНТАН-4-ОНА | 2006 |
|
RU2319688C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-АДАМАНТИЛИРОВАННЫХ АМИДОВ | 2013 |
|
RU2549901C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,2-ДИАЛКИЛ-4,5-ДИАРИЛФУРАН-3(2Н)-ОНОВ | 2014 |
|
RU2563876C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНО-2-ЦИАНОАДАМАНТАНА | 2013 |
|
RU2523462C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ СПИРОГЕТЕРОЦИКЛОВ | 2013 |
|
RU2529027C1 |
| ФОТОХРОМНЫЕ ПРОИЗВОДНЫЕ 5'-ВИНИЛ-6-НИТРО-СПИРОБЕНЗОПИРАНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2458927C1 |
Изобретение относится к способу получения 2-нитрометиленадамантана, который является исходным соединением для получения 2-функциональных производных адамантана, проявляющих психостимулирующую и антикаталептическую активность. Способ заключается во взаимодействии 2-адамантанона и нитрометана при кипячении в течение 24 ч в присутствии этилендиамина с последующим упариванием реакционной массы и выделением продукта. Способ характеризуется тем, что взаимодействие ведут в присутствии бензола при азеотропной отгонке воды при мольном соотношении 2-адамантанон:нитрометан:этилендиамин, равном 1:4:0.1. Перед упариванием реакционную массу фильтруют через слой силикагеля, а продукт выделяют кристаллизацией из петролейного эфира. Предлагаемый способ позволяет упростить процесс получения 2-нитрометиленадамантана при сохранении высокой чистоты и выхода целевого продукта. 1 пр.
Способ получения 2-нитрометиленадамантана, заключающийся во взаимодействии 2-адамантанона и нитрометана при кипячении в течение 24 ч в присутствии этилендиамина, последующем упаривании реакционной массы и выделении продукта, отличающийся тем, что взаимодействие ведут в присутствии бензола при азеотропной отгонке воды при мольном соотношении 2-адамантанон:нитрометан:этилендиамин, равном 1:4:0.1, перед упариванием реакционную массу фильтруют через слой силикагеля, а продукт выделяют кристаллизацией из петролейного эфира.
| W.-W | |||
| LIN et al., An Improved and Easy Method for the Preparation of 2,2-Disubstituted 1-Nitroalkenes, J | |||
| ORG | |||
| CHEM., 2001, Vol | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Автоматическая сварочная головка | 1949 |
|
SU87359A1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(АДАМАНТ-1-ИЛ)ЭТИЛАМИНА И ЕГО ГОМОЛОГОВ | 1998 |
|
RU2152924C1 |
Авторы
Даты
2016-02-10—Публикация
2014-11-05—Подача