ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к коринеформной бактерии, эффективно продуцирующей гетерологичный белок посредством секреторной продукции, и способу секреторной продукции гетерологичного белка.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Что касается секреторной продукции гетерологичных белков микроорганизмами, к настоящему моменту сообщают о секреторной продукции гетерологичных белков бактериями Bacillus (непатентный документ 1), ассимилирующими метанол дрожжами Pichia pastoris (непатентный документ 2), нитевидными грибами рода Aspergillus (непатентные документы 3 и 4) и т.д.
Также пытались осуществлять секреторную продукцию гетерологичных белков коринеформными бактериями. Что касается секреторной продукции гетерологичных белков коринеформными бактериями, сообщали о секреции нуклеазы и липазы Corynebacterium glutamicum (далее также сокращенно называемой C. glutamicum) (патентный документ 1, непатентный документ 5), секреции протеазы, такой как субтилизин (непатентный документ 6), секреции белка с использованием сигнальных пептидов белков поверхностного слоя клетки PS1 и PS2 (также обозначаемых как CspB) коринеформных бактерий (патентный документ 2), секреции фибронектин-связывающего белка с использованием сигнального пептида PS2 (CspB) (непатентный документ 7), секреции протрансглутаминазы с использованием сигнальных пептидов белков поверхностного слоя клетки PS2 (CspB) и SlpA (также обозначаемого как CspA) коринеформных бактерий (патентный документ 3), секреции белка с использованием систем секреции различных типов (патентный документ 4), секреции протрансглутаминазы вариантным штаммом (патентный документ 5), секреции белка с использованием Tat-зависимого сигнального пептида (патентный документ 6) и т.д.
В качестве белков, подлежащих продукции посредством секреторной продукции, рассматривают различные белки. Однако, что касается секреторной продукции гетерологичных белков коринеформными бактериями, не сообщали о секреторной продукции какого-либо мультимерного белка, состоящего из множества субъединиц, например, родственных антителам молекул.
Пенициллинсвязывающий белок (PBP) - это общее название связывающихся с β-лактамными антибиотиками белков, ферментативная функция которых ингибируется при связывании с β-лактамными антибиотиками. Как правило, PBP являются мембрано-связанными белками, и их считают важными для синтеза клеточной стенки эубактериями. PBP классифицируют на высокомолекулярные PBP (HMW-PBP) и низкомолекулярные PBP (LMW-PBP) согласно их молекулярным массам. Среди них, HMW-PBP дополнительно классифицируют на высокомолекулярные PBP класса A (HMW-PBP класса A), имеющие транспептидазный домен, обладающий транспептидазной активностью для сшивания остатков пептидогликанов, и трансгликозилазный домен, обладающий трансгликозилазной активностью для образования полисахаридной цепи из дисахаридов, и на высокомолекулярные PBP B (HMW-PBP класса B), имеющие только транспептидазный домен.
Данные о PBP C. glutamicum подробно представлены в непатентных документах 8, 9 и т.д. К настоящему моменту у C. glutamicum обнаружили по меньшей мере девять гомологов PBP. Пять из них являются HMW-PBP, включая два HMW-PBP класса A (PBP1a, PBP1b) и три HMW-PBP класса B (FtsI, PBP2a, PBP2b). Известно, что HMW-PBP класса A C. glutamicum являются факторами, ответственными за увеличение размеров клеток, и HMW-PBP класса B являются факторами, ответственными за образование пептидогликана перегородок во время деления клетки.
Белки поверхностного слоя клетки являются белками, составляющими поверхностные слои клеток (S-слои) бактерий и архей. Для коринеформных бактерий в качестве белков поверхностного слоя клетки известны PS1 и PS2 (CspB) C. glutamicum (непатентный документ 10), SlpA (CspA) C. stationis (патентный документ 2) и т.д. Что касается PS2 (CspB), например, сообщают об аминокислотных последовательностях гомологов CspB 28 штаммов C. glutamicum (непатентный документ 11). Как описано выше, сигнальные пептиды белков поверхностного слоя клетки коринеформных бактерий используют в секреторной продукции белков (патентные документы 2, 3 и т.д.).
Однако, взаимосвязь между снижением активности пенициллинсвязывающего белка и/или снижением активности белка поверхностного слоя клетки и секреторной продукцией гетерологичного белка не известна.
Ссылки на предшествующий уровень техники
Патентные документы
Патентный документ 1: патент США №4965197
Патентный документ 2: патентная заявка Японии (Kohyo) №6-502548
Патентный документ 3: патент Японии №4320769
Патентный документ 4: патентная заявка Японии (Kokai) №11-169182
Патентный документ 5: патент Японии №4362651
Патентный документ 6: Патент Японии №4730302
Непатентные документы
Непатентный документ 1: Microbiol, rev., 57, 109-137 (1993)
Непатентный документ 2: Biotechnol., 11, 905-910 (1993)
Непатентный документ 3: Biotechnol., 6, 1419-1422 (1988)
Непатентный документ 4: Biotechnol., 9, 976-981 (1991)
Непатентный документ 5: J. Bacteriol., 174, 1854-1861 (1992)
Непатентный документ 6: Appl. Environ. Microbiol., 61, 1610-1613 (1995)
Непатентный документ 7: Appl. Environ. Microbiol., 63, 4392-4400 (1997)
Непатентный документ 8: Mol. Microbiol., 66, 643-57 (2007)
Непатентный документ 9: Antonie Van Leeuwenhoek, 94, 99-109 (2008)
Непатентный документ 10: Mol. Microbiol., 9, 97-109 (1993)
Непатентный документ 11: J Biotechnol., 112, 177-193 (2004)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Цель изобретения
Целью настоящего изобретения является разработка нового способа улучшения способности коринеформной бактерии продуцировать гетерологичный белок посредством секреторной продукции, и, таким образом, предоставление коринеформной бактерии, продуцирующей гетерологичный белок посредством секреторной продукции, и способа секреторной продукции гетерологичного белка с использованием такой бактерии.
Средства достижения цели
Для достижения указанной выше цели авторы настоящего изобретения осуществляли различные исследования, и в результате они обнаруживали, что в способе продукции гетерологичного белка с использованием коринеформной бактерии в качестве экспрессирующего хозяина можно улучшать способность коринеформной бактерии продуцировать гетерологичный белок посредством секреторной продукции с помощью делеции гена, кодирующего пенициллинсвязывающий белок PBP1a, и гена, кодирующего белок поверхностного слоя клетки CspB коринеформной бактерии, и осуществлять настоящее изобретение.
Таким образом, настоящее изобретение относится к следующему.
[1] Коринеформной бактерии, обладающей способностью продуцировать гетерологичный белок посредством секреторной продукции,
модифицированной таким образом, что снижают активность пенициллинсвязывающего белка, и в которой снижена активность белка поверхностного слоя клетки, и
где пенициллинсвязывающий белок является белком, обладающим таким свойством, что, если его активность в коринеформной бактерии снижена, то количество гетерологичного белка, продуцируемого посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма.
[2] Указанной выше коринеформной бактерии, модифицированной таким образом, что активность пенициллинсвязывающего белка снижают посредством аттенуации экспрессии гена, кодирующего пенициллинсвязывающий белок, или разрушения гена.
[3] Указанной выше коринеформной бактерии, где пенициллинсвязывающий белок является PBP1a.
[4] Указанной выше коринеформной бактерии, где пенициллинсвязывающий белок является белком, определенным в следующих пп. (A) или (B):
(A) белок, имеющий аминокислотную последовательность SEQ ID NO: 82,
(B) белок, имеющий аминокислотную последовательность SEQ ID NO: 82, включающую замену, делецию, инсерцию или добавление от 1 до 10 аминокислотных остатков, и обладающий таким свойством, что, если его активность в коринеформной бактерии снижена, то количество гетерологичного белка, продуцируемого посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма.
[5] Указанной выше коринеформной бактерии, модифицированной таким образом, что активность белка поверхностного слоя клетки снижают посредством аттенуации экспрессии гена, кодирующего белок поверхностного слоя клетки, или разрушения гена.
[6] Указанной выше коринеформной бактерии, где белком поверхностного слоя клетки является CspB.
[7] Указанной выше коринеформной бактерии, где белком поверхностного слоя клетки является белок, определенный в следующих пп. (A) или (B):
(A) белок, имеющий аминокислотную последовательность SEQ ID NO: 98,
(B) белок, имеющий аминокислотную последовательность SEQ ID NO: 98, включающую замену, делецию, инсерцию или добавление от 1 до 10 аминокислотных остатков, и обладающий таким свойством, что, если его активность в коринеформной бактерии снижена, то количество гетерологичного белка, продуцируемого посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма.
[8] Указанной выше коринеформной бактерии, являющейся бактерией, принадлежащей к роду Corynebacterium или Brevibacterium.
[9] Указанной выше коринеформной бактерии, являющейся Corynebacterium glutamicum.
[10] Указанной выше коринеформной бактерии,
где коринеформная бактерия содержит генетическую конструкцию для секреторной экспрессии гетерологичного белка, и
где генетическая конструкция содержит последовательность промотора, функционирующую в коринеформной бактерии, последовательность нуклеиновой кислоты, кодирующую сигнальный пептид, функционирующий в коринеформной бактерии и лигированный ниже последовательности промотора, и последовательность нуклеиновой кислоты, кодирующую гетерологичный белок и лигированную ниже последовательности нуклеиновой кислоты, кодирующей сигнальный пептид.
[11] Указанной выше коринеформной бактерии, где гетерологичный белок является родственной антителу молекулой.
[12] Указанной выше коринеформной бактерии, где родственная антителу молекула состоит из одного или нескольких белков, выбранных из Fab, F(ab′)2/Fc-слитного белка и scFv.
[13] Способу продукции гетерологичного белка, включающему культивирование указанной выше коринеформной бактерии и сбор гетерологичного белка, продуцируемого посредством секреторной продукции.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 является фотографией, на которой представлены результаты электрофореза в ПААГ в присутствии SDS в восстанавливающих условиях, осуществляемого в случае, когда область H-цепи Fab-фрагмента трастузумаба экспрессировали в штамме YDK010 (родительском штамме) и штамме YDK010ΔPBP1a.
Фиг. 2 является фотографией, на которой представлены результаты электрофореза в ПААГ в присутствии SDS в восстанавливающих условиях, осуществляемого в случае, когда область H-цепи Fab-фрагмента трастузумаба экспрессировали в штамме YDK010 (родительском штамме), штамме YDK010ΔPBP1a и штамме YDK010ΔPBP1b.
Фиг. 3 является фотографией, на которой представлены результаты электрофореза в ПААГ в присутствии SDS в восстанавливающих условиях, осуществляемого в случае, когда область H-цепи Fab-фрагмента трастузумаба экспрессировали в штамме YDK010 (родительском штамме) и штамме YDK010ΔPBP1a.
Фиг. 4 является фотографией, на которой представлены результаты электрофореза в ПААГ в присутствии SDS в восстанавливающих условиях, осуществляемого в случае, когда область L-цепи Fab-фрагмента трастузумаба экспрессировали в штамме YDK010 (родительском штамме) и штамме YDK010ΔPBP1a.
Фиг. 5 является фотографией, на которой представлены результаты электрофореза в ПААГ в присутствии SDS в невосстанавливающих условиях, осуществляемого в случае, когда область H-цепи и область L-цепи Fab-фрагмента трастузумаба коэкспрессировали в штамме YDK010 (родительском штамме) и штамме YDK010ΔPBP1a.
Фиг. 6 является фотографией, на которой представлены результаты вестерн-блоттинга, осуществляемого в случае, когда F(ab′)2-фрагмент трастузумаба экспрессировали в штамме YDK010 (родительском штамме) и штамме YDK010ΔPBP1a.
Фиг. 7 является фотографией, на которой представлены результаты вестерн-блоттинга, осуществляемого в случае, когда Fc-фрагмент трастузумаба экспрессировали в штамме YDK010 (родительском штамме) и штамме YDK010ΔPBP1a.
Фиг. 8 является графиком, на котором показано количество протрансглутаминазы, экспрессирующейся в штамме YDK010 (родительском штамме) и штамме YDK010ΔΡBP1a.
Фиг. 9 является фотографией, на которой представлены результаты электрофореза в ПААГ в присутствии SDS в восстанавливающих условиях, осуществляемого в случае, когда одноцепочечное антитело против дигоксина экспрессировали в штамме YDK010 (родительском штамме) и штамме YDK010ΔPBP1a.
Фиг. 10 является фотографией, на которой представлены результаты электрофореза в ПААГ в присутствии SDS в невосстанавливающих условиях, осуществляемого в случае, когда Fab(H&L)-фрагмент адалимумаба экспрессировали в штамме YDK010 (родительском штамме) и штамме YDK010ΔPBP1a.
Фиг. 11 является фотографией, на которой представлены результаты электрофореза в ПААГ в присутствии SDS в невосстанавливающих условиях, осуществляемого в случае, когда Fab(H&L)-фрагмент трастузумаба экспрессировали в штамме ATCC13869 (родительском штамме), штамме ATCC13869ΔCspB, штамме ATCC13869ΔPBP1a, и штамме ATCC13869ΔCspBΔPBP1a.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
<1> Коринеформная бактерия по настоящему изобретению
Настоящее изобретение относится к коринеформной бактерии, обладающей способностью продуцировать гетерологичный белок посредством секреторной продукции, модифицированной таким образом, что снижают активность пенициллинсвязывающего белка, и в которой снижена активность белка поверхностного слоя клетки (далее также обозначаемой как "бактерия по настоящему изобретению" или "коринеформная бактерия по настоящему изобретению").
В настоящем изобретении выражение, что белок "секретируется", означает, что белок транспортируется из бактериальной клетки (транспортируется внеклеточно). Выражение, что белок "секретируется", конечно, включает случай, когда все молекулы белка в конечном итоге существуют в среде полностью в свободной форме, а также включает случай, когда все молекулы белка существуют в поверхностном слое клети, и случай, когда часть молекул белка существует в среде, а остальная часть молекул существует в поверхностном слое клетки.
Т.е. в настоящем изобретении "способность продуцировать гетерологичный белок посредством секреторной продукции" относится к способности бактерии по настоящему изобретению секретировать гетерологичный белок в среду или поверхностный слой клетки, и накапливать его в среде или поверхностном слое клетки до такой степени, что гетерологичный белок можно собирать из среды или поверхностного слоя клетки, если бактерию культивируют в среде. Что касается накопленного количества, например, накопленное количество в среде может составлять предпочтительно 10 мкг/л или более, более предпочтительно - 1 мг/л или более, особенно предпочтительно - 100 мг/л или более, еще более предпочтительно - 1 г/л или более. Кроме того, что касается накопленного количества, например, накопленное количество в поверхностном слое клетки может являться таким, что, если гетерологичный белок в поверхностном слое клетки собирают и суспендируют в том же объеме жидкости, что и среда, концентрация гетерологичного белка в суспензии составляет предпочтительно 10 мкг/л или более, более предпочтительно - 1 мг/л или более, особенно предпочтительно - 100 мг/л или более. Кроме того, в настоящем изобретении термин "белок", продуцируемый посредством секреторной продукции, относится к понятию белка, включая пептид или полипептид.
В настоящем изобретении "гетерологичный белок" относится к белку, экзогенному для коринеформной бактерии, экспрессирующей и секретирующей этот белок. Гетерологичный белок, например, может являться белком, полученным из микроорганизма, белком, полученным из растения, белком, полученным из животного, белком, полученным из вируса, или белком, аминокислотную последовательность которого конструируют искусственно. Гетерологичный белок может являться мономерным белком или мультимерным белком. Мультимерный белок относится к белку, который может существовать в виде мультимера, состоящего из двух или более субъединиц. В мультимере субъединицы могут быть связаны ковалентными связями, такими как дисульфидные связи, соединены нековалентными связями, такими как водородные связи и гидрофобные взаимодействия, или соединены комбинацией этих связей. Предпочтительно, мультимер содержит одну или несколько межмолекулярных дисульфидных связей. Мультимер может являться гомомультимером, состоящим из субъединиц одного типа, или может являться гетеромультимером, состоящим из субъединиц двух или более типов. В случае, когда мультимер является гетеромультимером, достаточного того, чтобы по меньшей мере одна субъединица, выбранная из субъединиц, составляющих гетеромультимер, являлась гетерологичным белком. Т.е. все субъединицы могут являться гетерогенными, или только часть субъединиц может являться гетерогенной. Хотя гетерологичный белок в природе может являться секреторным белком или несекреторным белком, предпочтительно, чтобы в природе он являлся секреторным белком. Конкретные примеры "гетерологичного белка" представлены ниже.
Подлежащий продукции гетерологичный белок может состоять из белка одного типа или белков двух или более типов. Кроме того, если гетерологичный белок является гетеромультимером, может продуцироваться субъединица только одного типа, или могут продуцироваться субъединицы двух или более типов. Т.е. "секреторная продукция гетерологичного белка" включает секреторную продукцию всех субъединиц, составляющих целевой гетерологичный белок, а также секреторную продукцию только части субъединиц, составляющих целевой гетерологичный белок.
В настоящем изобретении коринеформные бактерии являются аэробными грамположительными бациллами и включают бактерии Corynebacterium, бактерии Brevibacterium, бактерии Microbacterium и т.д. Коринеформные бактерии включают бактерии, ранее классифицируемые как род Brevibacterium, но в настоящее время объединенные в род Corynebacterium (Int. J. Syst. Bacteriol., 41, 255 (1991)). Коринеформные бактерии также включают бактерии, ранее классифицируемые как Corynebacterium ammoniagenes, но в настоящее время переклассифицированные в Corynebacterium stationis в результате анализа нуклеотидной последовательности 16S рРНК и т.д. (Int. J. Syst. Evol. Microbiol., 60, 874-879 (2010)). Преимущества использования коринеформных бактерий включают тот факт, что они от природы секретируют крайне малые количества белка вовне клеток по сравнению с грибами, дрожжами и бактериями Bacillus, общепринято используемыми для секреторной продукции белков, и, таким образом, можно упрощать или исключать способ очистки гетерологичного белка, продуцируемого посредством секреторной продукции, и тот факт, что они хорошо растут в простой среде содержащей сахариды, аммиак, минеральные соли и т.д., и, таким образом, они превосходны с точки зрения стоимости среды, способа культивирования и производительности культивирования и т.д.
Конкретные примеры таких коринеформных бактерий включают следующие виды:
Corynebacterium acetoacidophilum
Corynebacterium acetoglutamicum
Corynebacterium alkanolyticum
Corynebacterium callunae
Corynebacterium glutamicum
Corynebacterium lilium
Corynebacterium melassecola
Corynebacterium thermoaminogenes (Corynebacterium efficiens)
Corynebacterium herculis
Brevibacterium divaricatum
Brevibacterium flavum
Brevibacterium immariophilum
Brevibacterium lactofermentum (Corynebacterium glutamicum)
Brevibacterium roseum
Brevibacterium saccharolyticum
Brevibacterium thiogenitalis
Corynebacterium ammoniagenes (Corynebacterium stationis)
Brevibacterium album
Brevibacterium cerinum
Microbacterium ammoniaphilum
Конкретные примеры таких коринеформных бактерий включают следующие штаммы:
Corynebacterium acetoacidophilum ATCC 13870
Corynebacterium acetoglutamicum ATCC 15806
Corynebacterium alkanolyticum ATCC 21511
Corynebacterium callunae ATCC 15991
Corynebacterium glutamicum ATCC 13020, ATCC 13032,ATCC 13060, ATCC 13869, FERM BP-734
Corynebacterium lilium ATCC 15990
Corynebacterium melassecola ATCC 17965
Corynebacterium thermoaminogenes AJ12340 (FERM BP-1539)
Corynebacterium herculis ATCC 13868
Brevibacterium divaricatum ATCC 14020
Brevibacterium flavum ATCC 13826, ATCC 14067, AJ12418 (FERM BP-2205)
Brevibacterium immariophilum ATCC 14068
Brevibacterium lactofermentum ATCC 13869
Brevibacterium roseum ATCC 13825
Brevibacterium saccharolyticum ATCC 14066
Brevibacterium thiogenitalis ATCC 19240
Corynebacterium ammoniagenes (Corynebacterium stationis) ATCC 6871, ATCC 6872
Brevibacterium album ATCC 15111
Brevibacterium cerinum ATCC 15112
Microbacterium ammoniaphilum ATCC 15354
Эти штаммы доступны, например, в American Type Culture Collection (ATCC) (адрес: 12301 Parklawn Drive, Rockville, Maryland 20852, P.O. Box 1549, Manassas, VA 20108, United States of America). Т.е. каждому штамму присвоен уникальный регистрационный номер (http://www.atcc.org/), и его можно заказать с использованием этого регистрационного номера. Регистрационный номер каждого штамма приведен в каталоге ATCC.
В частности, предсказано, что штамм AJ12036 C. glutamicum (FERM BP-734), выделенный из штамма дикого типа ATCC 13869 C. glutamicum в качестве устойчивого к стрептомицину (Sm) мутантного штамма, содержит мутацию в функциональном гене, ответственном за секрецию белка, и он демонстрирует крайне высокую способность к секреторной продукции белков, до приблизительно 2-3 раз выше в терминах накопленного количества белка в оптимальных условиях культивирования по сравнению с родительским штаммом (штаммом дикого типа), и, таким образом, является предпочтительным в качестве бактерии-хозяина. Штамм AJ12036 (FERM BP-734) исходно хранили в National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology (в настоящее время корпоративное административное учреждение, National Institute of Technology and Evaluation, International Patent Organism Depositary, AIST TSukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan) на 26 марта 1984 года в качестве международного депозита, и ему присвоен учетный номер FERM BP-734.
Кроме того, штамм, обладающий повышенной способностью продуцировать белок посредством секреторной продукции, можно выбирать из коринеформных бактерий, полученных из таких коринеформных бактерий, как указано выше, в качестве родительского штамма, с использованием способа мутагенеза или способа генетической рекомбинации, и использовать в качестве хозяина. Например, после обработки родительского штамма ультрафиолетовым излучением или химическим мутагеном, таким как N-метил-N′-нитрозогуанидин, можно выбирать штамм, обладающий повышенной способностью продуцировать белок посредством секреторной продукции.
Кроме того, если штамм получали модификацией такого штамма, как указано выше, таким образом, что он не продуцирует белок поверхностного слоя клетки в качестве хозяина, очистка гетерологичного белка, секретируемого в среду, становится легкой, и, таким образом, это является особенно предпочтительным. Такую модификацию можно осуществлять путем встраивания мутации в кодирующую область белка поверхностного слоя клетки или область контроля его экспрессии на хромосоме посредством мутагенеза или генетической рекомбинации. Примеры коринеформной бактерии, модифицированной таким образом, что она не продуцирует белок поверхностного слоя клетки, включают штамм YDK010 C. glutamicum (WO 2004/029254), являющийся дефектной по белку поверхностного слоя клетки PS2 версией штамма AJ12036 C. glutamicum (FERM BP-734).
Коринеформную бактерию, обладающую способностью продуцировать гетерологичный белок посредством секреторной продукции, можно получать встраиванием генетической конструкции для секреторной экспрессии гетерологичного белка в такой коринеформной бактерии, как указано выше, таким образом, что бактерия содержит конструкцию. Т.е. бактерия по настоящему изобретению содержит генетическую конструкцию для секреторной экспрессии гетерологичного белка. Термин "генетическая конструкция для секреторной экспрессии гетерологичного белка" и способ ее встраивания будут приведены ниже.
Бактерию по настоящему изобретению можно получать, модифицируя коринеформную бактерию, обладающую способностью продуцировать гетерологичный белок посредством секреторной продукции таким образом, что снижают активность пенициллинсвязывающего белка и активность белка поверхностного слоя клетки. Альтернативно, бактерию по настоящему изобретению также можно получать, модифицируя коринеформную бактерию таким образом, что снижают активность пенициллинсвязывающего белка и активность белка поверхностного слоя клетки, и затем придавая ей способность продуцировать гетерологичный белок посредством секреторной продукции. Кроме того, бактерию по настоящему изобретению также можно получать, модифицируя коринеформную бактерию, активность белка поверхностного слоя клетки которой от природы снижена таким образом, что бактерия обладает способностью продуцировать гетерологичный белок, а активность пенициллинсвязывающего белка снижена. В настоящем изобретении модификацию бактерии по настоящему изобретению придание ей способности можно осуществлять в произвольном порядке. Бактерия по настоящему изобретению может являться бактерией, получаемой из бактерии, которая может продуцировать гетерологичный белок посредством секреторной продукции до ее модификации таким образом, что снижают активность пенициллинсвязывающего белка и/или активность белка поверхностного слоя клетки. Кроме того, бактерия по настоящему изобретению также может являться бактерией, получаемой из бактерии, которая не может продуцировать гетерологичный белок посредством секреторной продукции, даже если она содержит генетическую конструкцию для секреторной экспрессии гетерологичного белка до ее модификации таким образом, что снижают активность пенициллинсвязывающего белка и/или активность белка поверхностного слоя клетки, которая становится способной продуцировать гетерологичный белок посредством секреторной продукции в результате такой модификации, когда снижают активность пенициллинсвязывающего белка и/или активность белка поверхностного слоя клетки. Кроме того, бактерию по настоящему изобретению можно дополнительно модифицировать таким образом, что повышают экспрессию гена, кодирующего металлопептидазу, или гена, кодирующего белок, имеющий область, гомологичную мотиву металлопептидазы.
Далее описывают пенициллинсвязывающие белки и кодирующие их гены.
В основном, пенициллинсвязывающие белки (PBP) относятся к белкам, связывающимся с β-лактамными антибиотиками, ферментативная функция которых ингибируется при связывании с β-лактамными антибиотиками. Пенициллинсвязывающие белки включают высокомолекулярные PBP (HMW-PBP) и низкомолекулярные PBP (LMW-PBP). Высокомолекулярные PBP включают высокомолекулярные PBP класса A (HMW-PBP класса A) и высокомолекулярные PBP класса B (HMW-PBP класса B). HMW-PBP класса A содержат и транспептидазный домен, обладающий транспептидазной активностью для сшивания остатков пептидогликанов, и трансгликозилазный домен, обладающий трансгликозилазной активностью для образования полисахаридной цепи из дисахаридов. HMW-PBP класса B содержат транспептидазный домен. Например, что касается C. glutamicum, PBP1a и PBP1b можно обозначать как HMW-PBP класса A. Что касается C. glutamicum, FtsI, PBP2a и PBP2b можно обозначать как HMW-PBP класса B.
В настоящем изобретении снижают активность белка, являющегося пенициллинсвязывающим белком и обладающим таким свойством, что, если его активность снижают в коринеформной бактерии, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма. В связи с этим, пенициллинсвязывающий белок, например, один, выбранный из PBP1a, HMW-PBP класса B и LMW-PBP, является предпочтительным, один, выбранный из PBP1a и HMW-PBP класса B, является более предпочтительным, и PBP1a является особенно предпочтительным.
"Такое свойство, что, если снижают активность белка в коринеформной бактерии, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма" относится к такому свойству, что, если снижают активность белка в коринеформной бактерии, коринеформной бактерии придают способность продуцировать гетерологичный белок посредством секреторной продукции в количестве, большем, чем наблюдаемое для немодифицированного штамма, такого как штамм дикого типа или родительский штамм. Хотя степень повышения количества гетерологичного белка, подлежащего продукции посредством секреторной продукции, в частности, не ограничена при условии, что количество гетерологичного белка, продуцируемого посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма, продукция гетерологичного белка посредством секреторной продукции в количестве, большем, чем наблюдаемое для немодифицированного штамма, может означать, например, продукцию гетерологичного белка посредством секреторной продукции в количестве, большем, чем наблюдаемое для немодифицированного штамма предпочтительно на 10% или более, более предпочтительно - на 20% или более, в частности, предпочтительно - на 30% или более, еще более предпочтительно - на 100% или более в терминах накопленного количества в среде и/или поверхностном слое клетки. Кроме того, продукция гетерологичного белка посредством секреторной продукции в количестве, большем, чем наблюдаемое для немодифицированного штамма, может означать, что, в то время как гетерологичный белок нельзя определять, когда неконцентрированный супернатант культуры немодифицированного штамма подвергают электрофорезу в ПААГ в присутствии SDS и окрашивают с использованием CBB, гетерологичный белок можно определять, когда неконцентрированный супернатант культуры модифицированного штамма подвергают электрофорезу в ПААГ в присутствии SDS и окрашивают с использованием CBB.
Также, "такое свойство, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма" в отношении пенициллинсвязывающего белка включает такое свойство, что, если активность белка снижают в штамме, в котором активность белка поверхностного слоя клетки не снижена, способность штамма продуцировать гетерологичный белок посредством секреторной продукции не повышается, однако если активность белка снижают в штамме, в котором снижена активность белка поверхностного слоя клетки, способность штамма продуцировать гетерологичный белок посредством секреторной продукции повышается.
Наличие у белка такого свойства, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма, можно подтверждать посредством получения штамма из штамма, принадлежащего коринеформным бактериям, посредством такой модификации, которая снижает активность белка, подсчета количества гетерологичного белка, продуцируемого посредством секреторной продукции, наблюдаемого при культивировании штамма в среде, и сравнения этого количества с количеством гетерологичного белка, продуцируемого посредством секреторной продукции, если немодифицированный штамм культивируют в среде.
Ген Cgl0278, кодирующий белок PBP1a C. glutamicum ATCC 13032, соответствует последовательности, комплементарной последовательности положений с 294001 по 296388 в геномной последовательности, зарегистрированной в базе данных NCBI как учетный номер GenBank BA000036 (версия BA000036.3 GI: 42602314). Также, белок PBP1a C. glutamicum ATCC 13032 зарегистрирован как учетный номер GenBank NP_599531 (версия NP_599531,1 GI: 19551529, locus_tag="NCgl0274"). Нуклеотидная последовательность гена Cgl0278 C. glutamicum ATCC 13032 и аминокислотная последовательность белка PBP1a, кодируемого этим геном, представлены как SEQ ID NO: 81 и 82, соответственно.
Т.к. нуклеотидная последовательность гена, кодирующего пенициллинсвязывающий белок, может отличаться в зависимости от вида или штамма, к которому принадлежит коринеформная бактерия, ген, кодирующий пенициллинсвязывающий белок, может являться вариантом указанной выше нуклеотидной последовательности при условии, что ген кодирует белок, обладающий таким свойством, что, если в коринеформной бактерии снижена активность белка, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма. Кроме того, вариант гена Cgl0278 включает гомолог гена. Гомологи гена Cgl0278 легко можно получать из публичных баз данных с помощью поиска BLAST или поиска FASTA с использованием гена Cgl0278 дикого типа указанной выше C. glutamicum в качестве поисковой последовательности, а также их можно получать с помощью ПЦР с использованием хромосомы коринеформной бактерии в качестве матрицы и олигонуклеотидов, полученных на основе известной последовательности ген, такой как указано выше, в качестве праймеров.
Ген, кодирующий пенициллинсвязывающий белок, может являться геном, кодирующим белок, имеющий указанную выше аминокислотную последовательность, включающую замену, делецию, инсерцию или добавление одного или нескольких аминокислотных остатков в одном или нескольких положениях при условии, что ген кодирует белок, обладающий таким свойством, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма. В таком случае, как правило, 70% или более, предпочтительно - 80% или более, более предпочтительно - 90% или более такого свойства, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма, сохраняется благодаря тому, что белок не подвергают замене, делеции, инсерции или добавлению одного или нескольких аминокислотных остатков. Хотя количество "одного или нескольких" аминокислотных остатков может отличаться в зависимости от положения в трехмерной структуре или типов аминокислотных остатков в белке, в частности, оно составляет, предпочтительно, от 1 до 20, более предпочтительно - от 1 до 10, еще более предпочтительно - от 1 до 5.
Указанные выше замена, делеция, инсерция или добавление одного или нескольких аминокислотных остатков являются консервативными мутациями, поддерживающими нормальное функционирование белка. Типичными примерами консервативной мутации являются консервативные замены. Консервативная замена является мутацией, где замена происходит взаимно между Phe, Trp и Tyr, если участком замены является ароматическая аминокислота; среди Leu, Ile и Val, если им является гидрофобная аминокислота; между Gln и Asn, если им является полярная аминокислота; среди Lys, Arg и His, если им является основная аминокислота; между Asp и Glu, если им является кислая аминокислота; и между Ser и Thr, если им является аминокислота, содержащая гидроксильную группу. Примеры замен, рассматриваемых в качестве консервативных замен, включают, в частности, замену Ser или Thr на Ala, замену Gln, His или Lys на Arg, замену Glu, Gln, Lys, His или Asp на Asn, замену Asn, Glu или Gln на Asp, замену Ser или Ala на Cys, замену Asn, Glu, Lys, His, Asp или Arg на Gln, замену Gly, Asn, Gln, Lys или Asp на Glu, замену Pro на Gly, замену Asn, Lys, Gln, Arg или Tyr на His, замену Leu, Met, Val или Phe на Ile, замену Ile, Met, Val или Phe на Leu, замену Asn, Glu, Gln, His или Arg на Lys, замену Ile, Leu, Val или Phe на Met, замену Trp, Tyr, Met, Ile или Leu на Phe, замену Thr или Ala на Ser, замену Ser или Ala на Thr, замену Phe или Tyr на Trp, замену His, Phe или Trp на Tyr и замену Met, Ile или Leu на Val. Кроме того, такая замена, делеция, инсерция, добавление, инверсия или т.п. аминокислотных остатков, как указано выше, включает природную мутацию в результате индивидуальных отличий или отличий видов бактерий, из которых получают ген (мутант или вариант).
Кроме того, ген, содержащий такую консервативную мутацию, как указано выше, может являться геном, кодирующим белок, демонстрирующий гомологию 80% или более, предпочтительно - 90% или более, более предпочтительно - 95% или более, еще более предпочтительно - 97% или более, особенно предпочтительно 99% или более, с общей кодируемой аминокислотной последовательностью и обладающий таким свойством, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма. Кроме того, в настоящем описании "гомология" может означать "идентичность".
Кроме того, ген, кодирующий пенициллинсвязывающий белок, может являться ДНК, способной гибридизоваться с зондом, который можно получать из известной последовательности гена, например, последовательности, комплементарной части или всей указанной выше нуклеотидной последовательности, в строгих условиях, и кодирующей белок, обладающий таким свойством, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма. "Строгие условия" относятся к условиям, в которых образуется так называемый специфический гибрид, а неспецифический гибрид не образуется. Примеры строгих условий включают такие условия, в которых высокогомологичные ДНК гибридизуются друг с другом, например, ДНК, гомологичные не менее чем на 80%, предпочтительно - гомологичные не менее чем на 90%, более предпочтительно - гомологичные не менее чем на 95%, еще более предпочтительно - гомологичные не менее чем на 97%, особенно предпочтительно - гомологичные не менее чем на 99%, гибридизуются друг с другом, а ДНК, менее гомологичные, чем указанные выше, не гибридизуются друг с другом, или условия промывки при типичной Саузерн-гибридизации, т.е. условия промывки один раз, предпочтительно - 2 или 3 раза, при концентрации соли и температуре, соответствующей 1-кратному SSC, 0,1% SDS при 60°C, предпочтительно - 0,1-кратному SSC, 0,1% SDS при 60°C, более предпочтительно - 0,1-кратному SSC, 0,1% SDS при 68°C.
Зонд, используемый для указанной выше гибридизации, может являться частью последовательности, комплементарной гену, как описано выше. Такой зонд можно получать с помощью ПЦР с использованием олигонуклеотидов, полученных на основе известной последовательности гена, в качестве праймеров и фрагмента ДНК, содержащего нуклеотидную последовательность, в качестве матрицы. Например, если в качестве зонда используют фрагмент ДНК, имеющий длину приблизительно 300 п.н., условия промывки при гибридизации могут представлять собой, например, 50°C, 2-кратный SSC и 0,1% SDS.
Кроме того, указанные выше разъяснения, касающиеся вариантов генов и белков, также можно применять, внося соответствующие изменения, к произвольным белкам, таким как белок поверхностного слоя клетки и гетерологичный белок, подлежащий продукции посредством секреторной продукции по настоящему изобретению, и кодирующим их генам.
Далее описывают белки поверхностного слоя клетки и кодирующие их гены.
Белки поверхностного слоя клетки являются белками, составляющими поверхностные слои клетки (S-слой) бактерий и архей. Примеры белков поверхностного слоя клетки коринеформных бактерий включают PS1 и PS2 (также обозначаемый как CspB) C. glutamicum и SlpA (также обозначаемый как CspA) C. stationis. Среди них, предпочтительно снижать активность белка PS2.
Нуклеотидная последовательность гена cspB C. glutamicum ATCC 13869 и аминокислотная последовательность белка PS2, кодируемого этим геном, представлены как SEQ ID NO: 97 и 98, соответственно.
Также, например, сообщают об аминокислотных последовательностях гомологов CspB в 28 штаммах C. glutamicum (J Biotechnol., 112, 177-193 (2004)). Эти 28 штаммов C. glutamicum и учетные номера Genbank гомологов гена cspB в базе данных NCBI представлены ниже (учетные номера Genbank приведены в скобках).
C. glutamicum ATCC13058 (AY524990)
C. glutamicum ATCC13744 (AY524991)
C. glutamicum ATCC13745 (AY524992)
C. glutamicum ATCC14017 (AY524993)
C. glutamicum ATCC14020 (AY525009)
C. glutamicum ATCC14067 (AY524994)
C. glutamicum ATCC14068 (AY525010)
C. glutamicum ATCC14747 (AY525011)
C. glutamicum ATCC14751 (AY524995)
C. glutamicum ATCC14752 (AY524996)
C. glutamicum ATCC14915 (AY524997)
C. glutamicum ATCC15243 (AY524998)
C. glutamicum ATCC15354 (AY524999)
C. glutamicum ATCC17965 (AY525000)
C. glutamicum ATCC17966 (AY525001)
C. glutamicum ATCC19223 (AY525002)
C. glutamicum ATCC19240 (AY525012)
C. glutamicum ATCC21341 (AY525003)
C. glutamicum ATCC21645 (AY525004)
C. glutamicum ATCC31808 (AY525013)
C. glutamicum ATCC31830 (AY525007)
C. glutamicum ATCC31832 (AY525008)
C. glutamicum LP-6 (AY525014)
C. glutamicum DSM20137 (AY525015)
C. glutamicum DSM20598 (AY525016)
C. glutamicum DSM46307 (AY525017)
C. glutamicum 22220 (AY525005)
C. glutamicum 22243 (AY525006)
Т.к. нуклеотидная последовательность гена, кодирующего белок поверхностного слоя клетки, может отличаться в зависимости от вида или штамма, к которому принадлежит коринеформная бактерия, ген, кодирующий белок поверхностного слоя клетки, может являться вариантом указанной выше нуклеотидной последовательности при условии, что ген кодирует белок, обладающий таким свойством, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма. Например, ген, кодирующий белок поверхностного слоя клетки, может являться геном, кодирующим белок, имеющий указанную выше аминокислотную последовательность, включающую замену, делецию, инсерцию или добавление одного или нескольких аминокислотных остатков в одном или нескольких положениях при условии, что ген кодирует белок, обладающий таким свойством, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма. Указанные выше разъяснения, касающиеся вариантов пенициллинсвязывающего белка и кодирующего его гена также можно применять, внося соответствующие изменения, к вариантам белка поверхностного слоя клетки и кодирующему его гену.
Также, "такое свойство, что, если активность белка в коринеформной бактерии снижена, количество гетерологичного белка, подлежащего продукции посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма" в отношении белка поверхностного слоя клетки включает такое свойство, что, если снижают активность белка в штамме, в котором активность пенициллинсвязывающего белка не снижена, способность штамма продуцировать гетерологичный белок посредством секреторной продукции не повышается, однако если снижают активность белка в штамме, в котором активность пенициллинсвязывающего белка снижена, способность штамма продуцировать гетерологичный белок посредством секреторной продукции повышается.
В настоящем изобретении, выражение "активность белка поверхностного слоя клетки снижена" включает случай, когда коринеформную бактерию модифицируют таким образом, что снижают активность белка поверхностного слоя клетки, и случай, когда активность белка поверхностного слоя клетки в коринеформной бактерии от природы снижена. "Случай, когда активность белка поверхностного слоя клетки в коринеформной бактерии от природы снижена" включает случай, когда коринеформная бактерия от природы дефектна по белку поверхностного слоя клетки. Т.е. примеры коринеформной бактерии, в которых активность белка поверхностного слоя клетки снижена, включают коринеформную бактерию, от природы дефектную по белку поверхностного слоя клетки. Примеры "случая, когда коринеформная бактерия от природы дефектна по белку поверхностного слоя клетки" включают случай, когда коринеформная бактерия от природы дефектна по гену, кодирующему белок поверхностного слоя клетки. Выражение "коринеформная бактерия от природы дефектна по белку поверхностного слоя клетки" может означать, что коринеформная бактерия от природы дефектна по одному или нескольким белкам, выбранным из белков поверхностного слоя клетки, обнаруживаемых в других штаммах вида, к которому принадлежит коринеформная бактерия. Например, "C. glutamicum от природы дефектна по белку поверхностного слоя клетки" может означать, что штамм C. glutamicum от природы дефектен по одному или нескольким белкам, выбранным из белков поверхностного слоя клетки, обнаруживаемым в других штаммах C. glutamicum, т.е., например, дефектен по PS1 и/или PS2 (CspB). Примеры коринеформной бактерии, от природы дефектной по белку поверхностного слоя клетки, включают C. glutamicum ATCC 13032, от природы дефектный по гену cspB.
Далее описывают способы снижения активности белка.
Выражение "активность белка снижена" означает, что активность целевого белка снижена по сравнению с таковой для немодифицированного штамма, такого как штамм дикого типа и родительский штамм, что включает случай, когда активность полностью исчезает. В частности, выражение "активность белка снижена" означает, что снижено количество молекул белка на клетку и/или снижена функция каждой молекулы белка по сравнению с таковой для немодифицированного штамма. Т.е. термин "активность" в отношении выражения "активность белка снижена" может означать степень транскрипции (количество мРНК) гена, кодирующего белок, или количество белка, а также каталитическую активность белка. Кроме того, случай, когда "снижено количество молекул белка на клетку", включает случай, когда белок вообще не существует. Кроме того, случай, когда "снижена функция каждой молекулы белка", включает случай, когда функция каждой молекулы белка полностью исчезает.
Модификации для снижения активности белка можно достигать, например, снижением экспрессии гена, кодирующего белок. "Снижение экспрессии гена" также обозначают как "аттенуацию экспрессии гена". Снижение экспрессии гена можно индуцировать, например, снижением эффективности транскрипции, снижением эффективности трансляции или их комбинацией. Можно достигать снижения экспрессии гена, модифицируя последовательность контроля экспрессии гена, такую как промотор и последовательность Шайна-Дальгарно (SD). Если модифицируют последовательность контроля экспрессии, предпочтительно модифицируют один нуклеотид или более, более предпочтительно - два нуклеотида или более, особенно предпочтительно - три нуклеотида или более в последовательности контроля экспрессии. Кроме того, часть или всю последовательность контроля экспрессии можно подвергать делеции. Снижения экспрессии гена также можно достигать, например, воздействуя на фактор, ответственный за контроль экспрессии. Примеры фактора, ответственного за контроль экспрессии, включают низкомолекулярные вещества, ответственные за контроль транскрипции или трансляции (индукторы, ингибиторы и т.д.), белки, ответственные за контроль транскрипции или трансляции (факторы транскрипции и т.д.), нуклеиновые кислоты, ответственные за контроль транскрипции или трансляции (миРНК и т.д.) и т.д.
Модификации для снижения активности белка также можно достигать, например, разрушая ген, кодирующий белок. Разрушения гена можно достигать, например, делецией части или всей кодирующей области гена на хромосоме. Кроме того, можно подвергать делеции весь ген, включая последовательности выше и ниже гена на хромосоме. Область, подлежащая делеции, может являться любой областью, такой как N-концевая область, внутренняя область или C-концевая область, при условии, что достигают снижения активности белка. Делеция большей области, как правило, с большей вероятностью может инактивировать ген. Кроме того, предпочтительно, чтобы рамки считывания последовательностей выше и ниже подлежащей делеции области, не являлись одинаковыми.
Разрушения гена также можно достигать, например, внесением мутации для замены аминокислоты (миссенс-мутация), стоп-кодона (нонсенс-мутация), мутации сдвига рамки считывания, при которой добавляют или удаляют один или два нуклеотида в кодирующей области гена на хромосоме или т.п. (Journal of Biological Chemistry, 272:8611-8617 (1997); Proceedings of the National Academy of Sciences, USA, 95 5511-5515 (1998); Journal of Biological Chemistry, 26 116, 20833-20839 (1991)).
Разрушения ген также можно достигать, например, инсерцией другой последовательности в кодирующую область гена на хромосоме. Участком инсерции может являться любая область гена, и инсерция большей области, как правило, вернее может инактивировать ген. Предпочтительно, чтобы рамки считывания последовательностей выше и ниже участка инсерции не являлись одинаковыми. Другая последовательность, в частности, не является ограниченной при условии, что выбирают последовательность, снижающую или устраняющую активность кодируемого белка, и примеры включают, например, маркерный ген, такой как гены устойчивости к антибиотикам, ген, применимый для продукции гетерологичного белка, и т.д.
Такой модификации гена на хромосоме, как описано выше, можно достигать, например, получая ген дефектного типа, в котором часть последовательности гена подвергают делеции таким образом, что он не может приводить к продукции нормально функционирующего белка, и трансформируя бактерию с использованием рекомбинантной ДНК, содержащей ген дефектного типа, для вызывания гомологичной рекомбинации между геном дефектного типа и геном на хромосоме, и, таким образом, заменяя геном дефектного типа ген на хромосоме. В таком случае, если в рекомбинантную ДНК включают маркерный ген, выбранный согласно характеристикам хозяина, таким как ауксотрофия, манипуляция становится легкой. Белок, кодируемый геном дефектного типа, имеет конформацию, отличающуюся от белка дикого типа, даже если он продуцируется, и, таким образом, снижают или устраняют его функцию. Такое разрушение гена на основе замены гена с использованием гомологичной рекомбинации уже известно, и существует способ, названный "Red-зависимой интеграцией" (Datsenko, K.A, и Wanner, B.L., Proc. Natl. Acad. Sci. USA, 97:6640-6645 (2000)), способ с использованием линейной ДНК, такой как способ с использованием "Red-зависимой интеграции" в комбинации с системы эксцизии, полученной из фага λ (Cho, E.H., Gumport, R.I., Gardner, J.F., J. Bacteriol., 184:5200-5203 (2002)), способ с использованием плазмиды, содержащей термочувствительную точку начала репликации, способ с использованием плазмиды, способной к конъюгативному переносу, способ с использованием "вектора-самоубийцы", не имеющего точку начала репликации, функционирующую в хозяине (патент США № 6303383, патентная заявка Японии (Kokai) №05-007491), и т.д.
Модификации для снижения активности белка также можно достигать, например, с помощью мутагенной обработки. Примеры мутагенной обработки включают общепринятые способы мутагенной обработки, такие как обработка рентгеновским излучением или ультрафиолетовым излучением, и мутагенную обработку с использованием мутагена, такого как N-метил-N′-нитро-N-нитрозогуанидин (NNG), этилметансульфонат (EMS), и метилметансульфонат(MMS).
Снижение активности целевого белка можно подтверждать измерением активности белка. В случае пенициллинсвязывающего белка, снижение активности белка можно подтверждать, например, измеряя транспептидазную активность и/или трансгликозилазную активность в зависимости от класса, к которому принадлежит белок. Транспептидазную активность и/или трансгликозилазную активность можно измерять, например, способом, хорошо известным специалистам в этой области. В частности, например, транспептидазную и трансгликозилазную активности PBP1a можно измерять, измеряя реакцию олигомеризации липида II с полисахаридными цепями и образования поперечных сшивок пептида (Born P, et al., J Biol Chem. 2006 Sep 15; 281(37): 26985-93.). В частности, активность белка снижают, например, до 50% или менее, предпочтительно - до 20% или менее, более предпочтительно - до 10% или менее, еще более предпочтительно - до 5% или менее, или особенно предпочтительно до 0% от наблюдаемого для немодифицированного штамма.
Снижение экспрессии целевого гена можно подтверждать, подтверждая снижение степени транскрипции гена или снижение количества целевого белка, экспрессирующегося с гена.
Снижение степени транскрипции целевого гена можно подтверждать, сравнивая количество мРНК, транскрибируемой с гена, с наблюдаемым для немодифицированного штамма. Примеры способа измерения количества мРНК включают нозерн-гибридизацию, RT-ПЦР и т.д. (Molecular Cloning, Cold spring Harbor Laboratory Press, Cold Spring Harbor (USA), 2001). Количество мРНК, предпочтительно, снижают, например, до 50% или менее, до 20% или менее, до 10% или менее, до 5% или менее, или до 0% от наблюдаемого для немодифицированного штамма.
Снижение количества целевого белка можно подтверждать с помощью вестерн-блоттинга с использованием антител, связывающихся с белком (Molecular Cloning, Cold Spring Harbor Laboratory Press, Cold Spring Harbor (USA) 2001). Количество белка, предпочтительно, снижают, например, до 50% или менее, до 20% или менее, до 10% или менее, до 5% или менее, или до 0% от наблюдаемого для немодифицированного штамма.
Разрушение целевого гена можно подтверждать, определяя нуклеотидную последовательность или карту рестрикционных фрагментов части или всего гена, полноразмерного гена или т.п. в зависимости от способов, используемых для разрушения.
Указанные выше способы снижения активности белка также можно применять, внося соответствующие изменения, к произвольным белкам и кодирующим их генам, а также для снижения активности пенициллинсвязывающего белка и снижения активности белка поверхностного слоя клетки.
Далее описывают "генетическую конструкцию для секреторной экспрессии гетерологичного белка" и способ ее встраивания.
Известно, что секреторный белок, как правило, транслируется в виде пре-белка (также обозначаемого как пре-пептид) или пре-про-белка (также обозначаемого как пре-про-пептид), и затем становится зрелым белком посредством процессинга. В частности, секреторный белок, как правило, транслируется в виде пре-белка или пре-про-белка, затем сигнальный пептид в виде пре-части отщепляется протеазой (как правило, называемой сигнальной пептидазой), и секреторный белок, таким образом, преобразуется в зрелый белок или про-белок. Что касается про-белка, его про-часть дополнительно отщепляется протеазой, и, таким образом, про-белок становится зрелым белком. Таким образом, в способе по настоящему изобретению для секреторной продукции гетерологичного белка предпочтительно использовать сигнальный пептид. В настоящем изобретении, пре-белок и пре-про-белок секреторного белок собирательно можно обозначать как "предшественник секреторного белка". В настоящем изобретении "сигнальный пептид" (также обозначаемый как "сигнальная последовательность") относится к аминокислотной последовательности, находящейся на N- конце предшественника секреторного белка, и, как правило, не содержащейся в природном зрелом белке.
Хотя генетическая конструкция, используемая для настоящего изобретения, в частности, не ограничена при условии, что достигают секреторной продукции гетерологичного белка, она, предпочтительно, содержит последовательность промотора, функционирующую в коринеформной бактерии, последовательность нуклеиновой кислоты, кодирующую сигнальный пептид, лигированный ниже последовательности промотор и функционирующий в коринеформной бактерии, и последовательность нуклеиновой кислоты, кодирующую гетерологичный белок, лигированный ниже последовательности нуклеиновой кислоты, кодирующей сигнальный пептид. Последовательность нуклеиновой кислоты, кодирующую сигнальный пептид, можно лигировать ниже последовательности промотора таким образом, что сигнальный пептид экспрессируется под контролем промотора. Последовательность нуклеиновой кислоты, кодирующую гетерологичный белок, можно лигировать ниже последовательности нуклеиновой кислоты, кодирующей сигнальный пептид таким образом, что гетерологичный белок экспрессируется как слитный белок с сигнальным пептидом. Генетическая конструкция, используемая для настоящего изобретения также может содержать контрольную последовательность (оператор, терминатор и т.д.), эффективную для экспрессии гена гетерологичного белка в коринеформной бактерии в таком соответствующем положении, что он может функционировать.
Промотор, используемый в настоящем изобретении, в частности, не ограничен при условии, что выбирают промотор, функционирующий в коринеформной бактерии, и он может являться промотором, полученным из коринеформной бактерии, или гетерогенным промотором. "Промотор, функционирующий в коринеформной бактерии" относится к промотору, демонстрирующему промоторную активность в коринеформной бактерии. Конкретные примеры гетерогенного промотора включают, например, промоторы, полученные из E. coli, такие как промотор tac, промотор lac, промотор trp и промотор araBAD. Среди них предпочтительными являются сильные промоторы, такие как промотор tac, а также предпочтительными являются индуцибельные промоторы, такие как промотор araBAD.
Примеры промотора, полученного из коринеформной бактерии, включают, например, промоторы белков поверхностного слоя клетки PS1, PS2 (также обозначаемого как CspB) и SlpA (также обозначаемого как CspA), и промоторы различных генов системы биосинтеза аминокислот. Конкретные примеры промоторов различных генов системы биосинтеза аминокислот включают, например, промоторы гена глутаматдегидрогеназы из системы биосинтеза глутаминовой кислоты, гена глутаминсинтетазы из системы синтеза глутамина, гена аспартаткиназы из системы биосинтеза лизина, гена гомосериндегидрогеназы из системы биосинтеза треонина, гена синтетазы ацетогидроксикислот из системы биосинтеза изолейцина и валина, гена 2-изопропилмалатсинтетазы из системы биосинтеза лейцина, гена глутаматкиназы из системы биосинтеза пролина и аргинина, гена фосфорибозил-АТФ-пирофосфорилазы из системы биосинтеза гистидина, гена дезоксиарабиногептулозонатфосфат (DAHP)-синтазы из систем биосинтеза ароматических аминокислот, таких как триптофан, тирозин и фенилаланин, гена фосфорибозилпирофосфат (PRPP)-амидотрансферазы из систем биосинтеза нуклеиновых кислот, таких как инозиновая кислота и гуаниловая кислота, гена дегидрогеназы инозиновой кислоты, и гена синтетазы гуаниловой кислоты.
Что касается промотора, с использованием различных репортерных генов можно получать и использовать тип существующего промотора с высокой активностью. Например, можно повышать активность промотора, делая области -35 и -10 в промоторной области ближе к консенсусной последовательности (международная патентная публикация WO 00/18935). Примеры способа оценки силы промотора и сильных промоторов описывают в статье Goldstein et al. (Prokaryotic promoters in biotechnology, Biotechnol. Annu. Rev., 1, 105-128 (1995)) и т.д. Кроме того, известно, что замена, инсерция или делеция нескольких нуклеотидов в спейсерной области между участком связывания рибосомы (RBS) и кодоном инициации трансляции, особенно последовательности непосредственно выше инициирующего кодона (5′-UTR), значительно влияет на стабильность мРНК и эффективность трансляции мРНК, и, таким образом, можно модифицировать эту последовательность.
Сигнальный пептид, используемый в настоящем изобретении, в частности, не ограничен при условии, что выбирают сигнальный пептид, функционирующий в коринеформной бактерии, и он может являться сигнальным пептидом, полученным из коринеформной бактерии, или он может являться гетерогенным сигнальным пептидом. "Сигнальный пептид, функционирующий в коринеформной бактерии" относится к пептиду, который при лигировании с N-концом целевого белка позволяет коринеформной бактерии секретировать белок. Предпочтительно, сигнальный пептид является сигнальным пептидом секреторного белка коринеформной бактерии в качестве хозяина, более предпочтительно - сигнальным пептидом белка поверхностного слоя клетки коринеформной бактерии. Примеры белка поверхностного слоя клетки коринеформных бактерий включают PS1 и PS2 (CspB), полученные из C. glutamicum (патентная заявка Японии (Kohyo) №6-502548), и SlpA (CspA), полученный из C. ammoniagenes (C. stationis) (патентная заявка Японии (Kokai) №10-108675). Аминокислотная последовательность сигнального пептида PS1 представлена как SEQ ID NO: 83, аминокислотная последовательность сигнального пептида PS2 (CspB) представлена как SEQ ID NO: 84, и аминокислотная последовательность сигнального пептида SlpA (CspA) представлена как SEQ ID NO: 85. Кроме того, в патенте США №4965197 описывают, что существуют сигнальные пептиды для ДНКаз, полученных из коринеформных бактерий, и такие сигнальные пептиды также можно использовать для настоящего изобретения.
Хотя сигнальные пептиды имеют конкретные характеристики последовательности, общие для биологических видов, сигнальный пептид, демонстрирующий секреторную функцию в конкретном биологическом виде, не обязательно демонстрирует секреторную функцию в другом биологическом виде. Таким образом, если используют гетерогенный сигнальный пептид, соответствующим образом можно выбирать сигнальный пептид, функционирующий в коринеформной бактерии. Можно подтверждать, функционирует ли конкретный сигнальный пептид в коринеформной бактерии, например, экспрессируя целевой белок как слитный белок с этим сигнальным пептидом и подтверждая, секретируется ли белок или нет.
Сигнальный пептид может содержать часть N-концевой аминокислотной последовательности секреторного белка, из которого получают сигнальный пептид. Как правило, сигнальная последовательность расщепляется сигнальной пептидазой, если продукт трансляции секретируется из клетки. Кроме того, что касается гена, кодирующего сигнальный пептид, хотя в качестве него можно использовать природный ген, его можно модифицировать таким образом, что он содержит оптимальные кодоны в соответствии с частотой кодонов в используемом хозяине.
Примеры гетерологичного белка, продуцируемого посредством секреторной продукции способом по настоящему изобретению, включают, например, биологически активные белки, рецепторные белки, антигенные белки для использования в качестве вакцин, и ферменты. Примеры ферментов включают, например, трансглутаминазы, протеазы, эндопептидазы, экзопептидазы, аминопептидазы, карбоксипептидазы, коллагеназы, хитиназы и т.д.
Примеры биологически активных белков включают, например, факторы роста, гормоны, цитокины, родственные антителам молекулы.
Конкретные примеры факторов роста включают, например, эпидермальный фактор роста (EGF), инсулиноподобный фактор роста (IGF), трансформирующий фактор роста (TGF), фактор роста нервов (NGF), нейротрофический фактор головного мозга (BDNF), фактор роста эндотелия сосудов (VEGF), гранулоцитарный колониестимулирующий фактор (Г-КСФ), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), фактор роста тромбоцитов (PDGF), эритропоэтин (EPO), тромбопоэтин (TPO), кислый фактор роста фибробластов (aFGF или FGF1), основный фактор роста фибробластов (bFGF или FGF2), фактор роста кератиноцитов (KGF-1 или FGF7, и KGF-2 или FGF10) и фактор роста гепатоцитов (HGF).
Конкретные примеры гормонов включают, например, инсулин, глюкагон, соматостатин, гормон роста человека (hGH), паратиреоидный гормон (PTH) и кальцитонин.
Конкретные примеры цитокинов включают, например, интерлейкины, интерфероны, факторы некроза опухоли (ФНО).
Факторы роста, гормоны и цитокины могут не отличаться строго друг от друга. Например, биологически активный белок может являться белком, принадлежащим одной группе, выбранной из фактора роста, гормона и цитокина, или может являться белком, принадлежащим множеству групп, выбранных из них.
Биологически активный белок может являться интактным белком или может являться частью белка. Примеры части белка включают, например, часть, обладающую физиологической активностью. Конкретные примеры части, обладающей физиологической активностью включают, например, терипаратид, биоактивный пептид, состоящий из 34 аминокислотных остатков N-конца паратиреоидного гормона (PTH).
Родственная антителу молекула относится к белку, содержащему молекулярные структуры, состоящие из одного домена или комбинации двух или более доменов, выбранных из доменов составляющих полное антитело. Примеры доменов, составляющих полное антитело, включают VH, CH1, CH2 и CH3, являющиеся доменами тяжелой цепи, и VL и CL, являющиеся доменами легкой цепи. Родственная антителу молекула может являться мономерным белком или мультимерным белком при условии содержания указанных выше молекулярных структур. В случае, когда родственная антителу молекула является мультимерным белком, родственная антителу молекула может являться гомомультимером, состоящим из субъединиц одного типа, или может являться гетеромультимером, состоящим из субъединиц двух или более типов. Конкретные примеры родственной антителу молекулы включают, например, полные антитела, Fab, F(ab′), F(ab′)2, Fc, димер, состоящий из тяжелой цепи (H-цепи) и легкой цепи (L-цепи), Fc-слитные белки, тяжелую цепь (H-цепь), легкую цепь (L-цепь), одноцепочечный Fv (scFv), sc(Fv)2, Fv с дисульфидной связью (sdFv) и диатело.
Рецепторный белок, в частности, не ограничен и может являться, например, рецепторным белком для любых биологически активных белков и других биоактивных веществ. Примеры других биоактивных веществ включают, например, нейромедиаторы, такие как допамин. Кроме того, рецепторный белок также может являться орфановым рецептором, лиганд которого не идентифицирован.
Антигенный белок для использования в качестве вакцины, в частности, не ограничен при условии, что он является белком, вызывающим иммунный ответ, и антигенный белок соответствующим образом можно выбирать в соответствии с предполагаемой мишенью иммунного ответа.
Конкретные примеры мономерного белка включают, например, трансглутаминазы и инсулиноподобный фактор роста 1 (IGF-1). Примеры гена трансглутаминазы включают гены секреторных трансглутаминаз актиномицетов, таких как Streptoverticillium mobaraense IFO 13819, Streptoverticillium cinnamoneum IFO 12852, Streptoverticillium griseocarneum IFO 12776, Streptomyces lydicus [WO 9606931], нитевидных грибов, таких как Oomycetes [WO 96/22366], и т.д. Кроме того, конкретные примеры мономерного белка дополнительно включают мономерные белки в качестве родственных антителам молекул, например, тяжелую цепь (H-цепь), легкую цепь (L-цепь), scFv и sdFv.
Кроме того, конкретные примеры мультимерного белка включают, например, фактор роста эндотелия сосудов (VEGF), инсулин, интерлейкин-5, интерферон-, факторы некроза опухоли (ФНО). Кроме того, конкретные примеры мультимерного белка дополнительно включают мультимерные белки в качестве родственных антителам молекул, например, полные антитела, Fab, F(ab′), F(ab′)2, Fc, димер, состоящий из тяжелой цепи (H-цепи) и легкой цепи (L-цепь), Fc-слитные белки, sc(Fv)2 и диатело. Среди них предпочтительными являются Fab, F(ab′)2 и Fc-слитные белки.
Fab (антигенсвязывающий фрагмент) является частью полного антитела, за исключением Fc-области H-цепи, и он является фрагментом антитела, состоящим только из антигенсвязывающей области. Fab является димером, состоящим из одной молекулы Fab-фрагмента H-цепи и одной молекулы L-цепи, и они соединены дисульфидной связью на C-конце. Полное антитело является тетрамером H2L2 и обладает большой молекулярной массой приблизительно 150 кДа, в то время как Fab имеет небольшую молекулярную массу приблизительно 50 кДа, и, таким образом, считают, что Fab демонстрирует лучшую способность к проникновению в целевую ткань. Т.к. Fab не содержит Fc-область, он не обладает ни способностью активировать комплемент, ни способностью к кристаллизации, но т.к. он обладает антигенсвязывающей способностью, его, в основном, используют в целях нейтрализации антигена. Среди лекарственных средств на основе антител, Fab особенно привлекал внимание в последние годы.
F(ab′) является частью полного антитела, за исключением Fc′-области H-цепи. F(ab′) является димером, состоящим из одной молекулы F(ab′)-фрагмента H-цепи и одной молекулы L-цепи, и они соединены дисульфидной связью на C-конце. Остальная часть H-цепи в F(ab′) длиннее остальной части H-цепи в Fab, и, таким образом, в F(ab′) остается дисульфидная связь, связывающая H-цепи. Таким образом, две молекулы F(ab′) могут образовывать F(ab′)2 с помощью дисульфидной связи. F(ab′) и F(ab′)2 также можно использовать в качестве лекарственных средств на основе антител, как и Fab-фрагмент.
Fc (фрагмент, кристаллизующийся) является фрагментом антитела, состоящим только из Fc-области, участвующей в активации комплемента и способности к кристаллизации. Белок, состоящий из Fc-области H-цепи и другого функционального белка, слитных друг с другом, называют Fc-слитным белком.
Гены, кодирующие эти белки, можно модифицировать в зависимости от используемого хозяина и для получения желаемой активности. Например, гены, кодирующие эти белки, можно модифицировать таким образом, что белки включают добавление, делецию, замену или т.п. одного или нескольких аминокислотных остатков. Указанные выше разъяснения, касающиеся вариантов пенициллинсвязывающих белков и кодирующих их генов, также можно применять, внося соответствующие изменения, к гетерологичному белку, подлежащему продукции посредством секреторной продукции способом по настоящему изобретению, и кодирующему его гену. Кроме того, в генах, кодирующих эти белки, любой кодон можно заменять эквивалентным ему кодоном. Например, в генах, кодирующих эти белки, кодоны можно оптимизировать, при необходимости, в соответствии с частотами кодонов, наблюдаемыми у хозяина.
N-концевая область гетерологичного белка, в конечном итоге получаемая способом по настоящему изобретению, может являться такой же, как и в природном белке, или может не являться такой же, как в природном белке. Например, N-концевая область получаемого в конечном итоге гетерологичного белка может являться N-концевой областью природного белка, включающей добавление или делецию одного или нескольких аминокислотных остатков. Хотя количество "одного или нескольких" аминокислотных остатков может отличаться в зависимости от полного размера или структуры целевого гетерологичного белка, в частности, оно составляет, предпочтительно, от 1 до 20, более предпочтительно - от 1 до 10, еще более предпочтительно - от 1 до 5.
Кроме того, гетерологичный белок, подлежащий продукции посредством секреторной продукции, может являться белком, содержащим про-структурную часть (про-белком). В случае, когда гетерологичный белок, подлежащий продукции посредством секреторной продукции, является про-белком, получаемый в конечном итоге гетерологичный белок может являться про-белком или может не являться про-белком. Т.е. про-белок можно преобразовывать в зрелый белок посредством расщепления про-структурной части. Расщепление можно осуществлять, например, с помощью протеазы. Если используют протеазу, то, с учетом активности получаемого в конечном итоге белка, про-белок, как правило, расщепляют, предпочтительно, в положении, по существу, том же, что и в природном белке, или более предпочтительно - точно в том же положении, что и в природном белке, для получения такого же зрелого белка, что и природный зрелый белок. Таким образом, наиболее предпочтительной является специфическая протеаза, расщепляющая про-белок в таком положении, что получают такой же белок, что и природный зрелый белок. Однако N-концевая область получаемого в конечном итоге гетерологичного белка может являться не такой, как в природном белке, как описано выше. Например, в зависимости от типа, цели использования и т.д. подлежащего продукции гетерологичного белка, белок, имеющий N-конец, длиннее или короче на один или несколько аминокислотных остатков по сравнению с природным белком, может иметь более подходящую активность. Протеазы, подходящие для использования в настоящем изобретении, включают, например, коммерчески доступные протеазы, такие как диспаза (производимая Boehringer Mannheim), а также получаемые из культуральной жидкости микроорганизмов, такой как культуральная жидкость актиномицетов. Такие протеазы можно использовать в неочищенном состоянии, или их также можно использовать, при необходимости, после очистки до подходящей чистоты.
Способ встраивания генетической конструкции, используемой для настоящего изобретения, в коринеформную бактерию, в частности, не ограничен. В бактерии по настоящему изобретению генетическая конструкция, используемая для настоящего изобретения, может существовать в векторе, автономно реплицирующемся вне хромосомы, таком как плазмида, или его можно встраивать в хромосому. Кроме того, как описано выше, для конструирования бактерии по настоящему изобретению, модификации, такие как встраивание генетической конструкции, используемой для настоящего изобретения, придание способности или повышение способности продуцировать белок посредством секреторной продукции, снижение активности пенициллинсвязывающего белка и снижение активности белка поверхностного слоя клетки, можно осуществлять в произвольном порядке.
Генетическую конструкцию, используемую для настоящего изобретения, можно встраивать в хозяина с использованием, например, вектора, содержащего генетическую конструкцию. В частности, вектор не ограничен, при условии, что выбирают вектор, автономно реплицирующийся в коринеформной бактерии, и он может являться, например, вектором, полученным из бактериальной плазмиды, вектором, полученным из дрожжевой плазмиды, вектором, полученным из бактериофага, космиды, фагмиды, или т.п. Что касается вектора, например, предпочтительной является плазмида, полученная из коринеформной бактерии. Конкретные примеры вектора, автономно реплицирующегося в коринеформной бактерии, включают pHM1519 (Agric. Biol. Chem., 48, 2901-2903 (1984)); pAM330 (Agric. Biol. Chem., 48, 2901-2903 (1984)); плазмиды, получаемые их усовершенствованием и содержащие ген устойчивости к лекарственному средству; плазмиду pCRY30, описываемую в патентной заявке Японии (Kokai) №3-210184; плазмиды pCRY21, pCRY2KE, pCRY2KX, pCRY31, pCRY3KE и pCRY3KX, описываемые в патентной заявке Японии (Kokai) №2-72876 и патенте США № 5185262; плазмиды pCRY2 и pCRY3, описываемые в патентной заявке Японии (Kokai) №1-191686; pAJ655, pAJ611 и pAJ1844, описываемые в патентной заявке Японии (Kokai) №58-192900; pCG1, описываемую в патентной заявке Японии (Kokai) №57-134500; pCG2, описываемую в патентной заявке Японии (Kokai) №58-35197; pCG4 и pCG11, описываемые в патентной заявке Японии (Kokai) №57-183799; pVK7, описываемую в патентной заявке Японии (Kokai) №10-215883; pVC7, описываемую в патентной заявке Японии (Kokai) №9-070291 и т.д.
Кроме того, также можно использовать искусственный транспозон и т.д. При использовании транспозона ген гетерологичного белка встраивают в хромосому с помощью гомологичной рекомбинации или способности к транслокации самого транспозона. Другие примеры способа встраивания с использованием гомологичной рекомбинации включают, например, способы с использованием линейной ДНК, плазмиды, имеющей термочувствительную точку начала репликации, плазмиды, способной к конъюгативному переносу, вектора-самоубийцы, не имеющего точку начала репликации, функционирующую в хозяине, и т.д. Кроме того, если ген гетерологичного белка встраивают в хромосому, при условии, что генетическая конструкция, используемая для настоящего изобретения, находится на хромосоме, одна или обе из последовательности промотора и последовательности нуклеиновой кислоты, кодирующей сигнальный пептид, содержащиеся в генетической конструкции, могут являться последовательностями, исходно находящимися на хромосоме хозяина. В частности, например, используя последовательности промотора и последовательности нуклеиновой кислоты, кодирующей сигнальный пептид, лигированной ниже последовательности промотора, исходно существующие в хромосоме хозяина, как они есть, и заменяя только ген, лигированный ниже последовательности нуклеиновой кислоты, кодирующей сигнальный пептид, геном целевого гетерологичного белка, генетическую конструкцию, используемую в настоящем изобретении, также составляют на хромосоме, и, таким образом, можно конструировать бактерию по настоящему изобретению.
Также, в случае, когда экспрессируются белки двух или более типов, генетические конструкции для секреторной экспрессии белков могут содержаться бактерией по настоящему изобретению таким образом, что можно достигать секреторной экспрессии целевых гетерологичных белков. В частности, например, все генетические конструкции для секреторной экспрессии белков могут содержаться в одном векторе или могут содержаться на хромосоме. Кроме того, генетические конструкции для секреторной экспрессии белков могут содержаться раздельно во множестве векторов или могут содержаться раздельно на одном или множестве векторов и хромосоме. "Случай, когда экспрессируются белки двух или более типов" включает, например, случай, когда гетерологичные белки двух или более типов продуцируются посредством секреторной продукции, или случай, когда гетеромультимерный белок продуцируется посредством секреторной продукции.
Способ встраивания генетической конструкции, используемой для настоящего изобретения, в коринеформную бактерию, в частности, не ограничен, и можно использовать общеупотребительный способ, например, протопластный способ (Gene, 39, 281-286 (1985)), способ электропорации (Bio/Technology, 7, 1067-1070 (1989)) и т.д.
<2> Способ продукции гетерологичного белка по настоящему изобретению
Настоящее изобретение относится к способу продукции гетерологичного белка, включающему культивирование бактерии по настоящему изобретению и сбор гетерологичного белка, продуцируемого посредством секреторной продукции (далее также обозначаемый как "способ по настоящему изобретению" или "способ продукции гетерологичного белка по настоящему изобретению").
Бактерию по настоящему изобретению можно культивировать согласно общеупотребительному способу и условиям. Например, бактерию по настоящему изобретению можно культивировать в общепринятой среде, содержащей источник углерода, источник азота и неорганические ионы. Для достижения еще большей пролиферации, при необходимости также можно добавлять органические питательные микроэлементы, такие как витамины и аминокислоты.
В качестве источника углерода можно использовать углеводы, такие как глюкоза и сахароза, органические кислоты, такие как уксусная кислота, спирты и др. В качестве источника азота можно использовать газообразный аммиак, водный раствор аммиака, соли аммония и др. В качестве неорганических ионов, при необходимости, соответствующим образом используют ионы кальция, ионы магния, фосфатные ионы, ионы калия, ионы железа и т.д. Культивирование осуществляют при соответствующих диапазонах pH от 5,0 до 8,5 и при температуре от 15 до 37°C в течение периода от 1 до 7 дней в аэробных условиях. Кроме того, можно использовать условия культивирования для продукции L-аминокислот коринеформными бактериями и другие условия, описываемые в способах продукции белка с использованием сигнального пептида типа Sec или типа Tat (со ссылкой на WO 01/23591 и WO 2005/103278). Кроме того, если для экспрессии гетерологичного белка используют индуцибельный промотор, культивирование также можно осуществлять с добавлением в среду индуктора промотора. При культивировании бактерий по настоящему изобретению в таких условиях в клетках продуцируется большое количество целевого белка и эффективно секретируется из клеток. Кроме того, согласно способу по настоящему изобретению, продуцируемый гетерологичный белок секретируется из клеток, и, таким образом, белок, который может являться летальным при его накоплении в клетках микроорганизмов в большом количестве, такой как трансглутаминазы, также может непрерывно продуцироваться без летального эффекта.
Белок, секретируемый в среду согласно способу по настоящему изобретению, можно выделять из среды и очищать после культивирования способом, хорошо известным специалистам в этой области. Например, после удаления клеток посредством центрифугирования или т.п., белок можно выделять и очищать подходящим известным способом, таким как высаливание, осаждение этанолом, ультрафильтрация, хроматография с гель-фильтрацией, ионообменная хроматография, аффинная хроматография, средне- или высокоэффективная жидкостная хроматография, обращенно-фазовая хроматография и гидрофобная хроматография, или их комбинацией. Кроме того, в конкретном случае культуру или супернатант культуры можно использовать в неизменном виде. Белок, секретируемый в поверхностный слой клетки, согласно способу по настоящему изобретению также можно выделять и очищать тем же способом, что и в случае, когда белок секретируется в среду, после его солюбилизации способом, хорошо известным специалистам в этой области, таким как повышение концентрации соли и использование поверхностно-активного вещества. Кроме того, в конкретном случае белок, секретируемый в поверхностный слой клетки, можно использовать, например, в качестве иммобилизованного фермента, без его солюбилизации.
Секреторную продукцию целевого гетерологичного белка можно подтверждать, осуществляя электрофорез в ПААГ в присутствии SDS, используя супернатант культуры и/или фракцию, содержащую поверхностный слой клетки, в качестве образца, таким образом, подтверждая молекулярную массу по полосам выделенного белка на электрофореграмме. Кроме того, секреторную продукцию целевого гетерологичного белка можно подтверждать, осуществляя вестерн-блоттинг с использованием антител, используя супернатант культуры и/или фракцию, содержащую поверхностный слой клетки, в качестве образца (Molecular Cloning, Cold Spring Harbor Laboratory Press, Cold Spring Harbor (USA), 2001). Кроме того, секреторную продукцию целевого гетерологичного белка можно подтверждать, определяя аминокислотную последовательность N-конца с использованием белкового секвенатора. Кроме того, секреторную продукцию целевого гетерологичного белка можно подтверждать, измеряя его массу с использованием масс-спектрометра. Также, если целевой гетерологичный белок является ферментом или белком, имеющим биологическую активность какого-либо типа, которую можно измерять, секреторную продукцию целевого гетерологичного белка можно подтверждать, измеряя ферментативную активность или биологическую активность белка в супернатанте культуры и/или фракции, содержащей поверхностный слой клетки, используемых в качестве образца.
ПРИМЕРЫ
Далее настоящее изобретение дополнительно описывают со ссылкой на следующие примеры. Однако, в любом случае эти примеры нельзя истолковывать как ограничивающие объем настоящего изобретения.
Пример 1: Конструирование Corynebacterium glutamicum, дефектной по каждому из пенициллинсвязывающих белков PBP1a и PBP1b
(1) Конструирование вектора pBSΔCgl0278 для делеции гена Cgl0278, кодирующего PBP1a
Последовательность генома C. glutamicum ATCC13032 и нуклеотидная последовательность гена Cgl0278, кодирующего пенициллинсвязывающий белок PBP1a, уже определены (учетный номер GenBank BA000036, регистрационный номер в NCBI NCgl0274). Со ссылкой на эту последовательность синтезировали праймеры, представленные как SEQ ID NO: 01, 02, 03 и 04. С помощью ПЦР с использованием хромосомной ДНК штамма C. glutamicum ATCC 13869, полученной общепринятым способом (способ Saito и Miura [Biochim. Biophys. Acta, 72, 619 (1963)]) в качестве матрицы и праймеров SEQ ID NO: 01 и 02 и SEQ ID NO: 03 и 04, амплифицировали приблизительно 1 т.п.н. 5′-участка выше области и приблизительно 1 т.п.н. 3′-участка ниже области Cgl0278, кодирующей PBP1a, соответственно. Затем с помощью ПЦР с использованием обоих амплифицированных фрагментов ДНК в качестве матрицы и ДНК, представленной как SEQ ID NO: 01 и 04, в качестве праймеров получали фрагмент ДНК длиной приблизительно 2 т.п.н., состоящий из обоих фрагментов, слитых друг с другом. В праймеры SEQ ID NO: 01 и 04 включали последовательности распознавания для ферментов рестрикции BamHI и XbaI, соответственно. Для ПЦР использовали ДНК-полимеразу Pyrobest (производимую Takara Bio), и условия реакции соответствовали рекомендациям производителя. Этот фрагмент ДНК обрабатывали ферментами рестрикции BamHI и XbaI, и встраивали в участок BamHI-XbaI в pBS4, описываемой в WO 2005/113744, для получения вектора pBSΔCgl0278 для делеции гена Cgl0278. Для реакции лигирования использовали набор для лигирования ДНК версии 2.1 (производимый Takara Bio), и условия реакции соответствовали рекомендациям производителя.
(2) Конструирование вектора pBSΔCgl2986 для делеции гена Cgl2986, кодирующего PBP1b
Последовательность генома C. glutamicum ATCC13032 и нуклеотидная последовательность гена Cgl2986, кодирующего пенициллинсвязывающий белок PBP1b, уже определены (учетный номер GenBank BA000036, регистрационный номер в NCBI NCgl2884). Тем же способом, что и для Cgl0278, со ссылкой на эту последовательность синтезировали праймеры, представленные как SEQ ID NO: 05, 06, 07 и 08. С помощью ПЦР с использованием полученной хромосомной ДНК штамма C. glutamicum ATCC 13869 в качестве матрицы и праймеров SEQ ID NO: 05 и 06 и SEQ ID NO: 07 и 08, амплифицировали приблизительно 1,3 т.п.н. 5′-участка выше области и приблизительно 1,1 т.п.н. 3′-участка ниже области Cgl2986, кодирующий PBP1b, соответственно. Затем с помощью ПЦР с использованием обоих амплифицированных фрагментов ДНК в качестве матрицы и ДНК, представленной как SEQ ID NO: 05 и 08, в качестве праймеров, получали фрагмент ДНК длиной приблизительно 2,4 т.п.н., состоящий из обоих фрагментов, слитых друг с другом. Полученный фрагмент ДНК длиной приблизительно 2,4 т.п.н. содержал одну последовательность распознавания для фермента рестрикции PstI и одну последовательность распознавания для фермента рестрикции SalI. Для ПЦР использовали ДНК-полимеразу Pyrobest (производимую Takara Bio), и условия реакции соответствовали рекомендациям производителя. Фрагмент длиной приблизительно 2,2 т.п.н., получаемый обработкой указанного выше фрагмента ДНК ферментами рестрикции PstI и SalI, встраивали в участок PstI-SalI pBS5T, описываемой в 02006/057450, для получения вектора pBSΔCgl2986 для делеции гена Cgl2986.
(3) Конструирование PBP1a-дефектного штамма и PBP1b-дефектного штамма
Затем штамм C. glutamicum YDK010, описываемый в WO 2004/029254, трансформировали с использованием каждого из сконструированных pBSΔCgl0278 и pBSΔCgl2986. Штамм C. glutamicum YDK010 является дефектным по белку поверхностного слоя клетки PS2 штаммом, полученным из штамма C. glutamicum AJ12036 (FERM BP-734) (02004/029254). Штаммы выбирали из полученных трансформантов способами, описываемыми в WO 2005/113744 и WO2006/057450, для получения штамма YDK010ΔPBP1a, дефектного по гену Cgl0278, и штамма YDK010ΔPBP1b, дефектного по гену Cgl2986.
Пример 2: Секреторная экспрессия области H-цепи Fab-фрагмента антитела трастузумаб с использованием штаммов Corynebacterium glutamicum, дефектных по пенициллинсвязывающим белкам PBP1a и PBP1b, соответственно
(1) Конструирование плазмиды для секреторной экспрессии области H-цепи Fab-фрагмента антитела трастузумаб
Генетическая последовательность вариабельной области H-цепи в антителе трастузумабе, специфичном для злокачественных клеток молочной железы, уже определена (учетный номер GenBank AY513484). Со ссылкой на эту последовательность и последовательность невариабельной области H-цепи общего антитела, синтезировали ДНК, представленную как SEQ ID NO: 09-42, с учетом частот кодонов в C. glutamicum. Полноразмерную область H-цепи трастузумаба амплифицировали с помощью ПЦР с использованием указанных выше ДНК в качестве матрицы и отдельно синтезированных ДНК, представленных как SEQ ID NO: 43 и 44 и используемых, таким образом, в качестве праймеров для получения фрагмента ДНК длиной приблизительно 1,4 т.п.н., представленного как SEQ ID NO: 45. Аминокислотная последовательность H-цепи антитела трастузумаб, кодируемая ДНК SEQ ID NO: 45, представлена как SEQ ID NO: 86.
Затем с использованием pPKSPTG1, описываемого в WO 01/23591 (pPKSPTG1 является вектором для секреторной экспрессии протрансглутаминазы (трансглутаминазы, содержащей про-структурную часть) и содержит промотор, полученный из гена PS2 штамма C. glutamicum ATCC 13869, ДНК, кодирующую сигнальный пептид, полученный из SlpA штамма C. ammoniagenes (C. stationis) ATCC 6872, лигированную ниже промотора, и ген протрансглутаминазы, полученный из Streptoverticillium mobaraense, лигированный таким образом, что белок экспрессируется в виде слитного белка с указанным выше сигнальным пептидом), в качестве матрицы и праймерами, представленными как SEQ ID NO: 46 и 47, с помощью ПЦР амплифицировали область, включающую указанную выше промоторную область и указанную выше область сигнального пептида, таким образом, получая фрагмент ДНК длиной приблизительно 0,7 т.п.н.
Затем с помощью ПЦР с использованием обоих амплифицированных фрагментов ДНК (фрагмент, включающий полноразмерную область H-цепи трастузумаба, и фрагмент, включающий промоторную область и область сигнального пептида) в качестве матрицы и ДНК, представленной как SEQ ID NO: 44 и 46, в качестве праймеров, получали фрагмент ДНК длиной приблизительно 2,0 т.п.н., состоящий из обоих фрагментов ДНК, слитных друг с другом.
Затем с помощью ПЦР с использованием этого слитного фрагмента ДНК в качестве матрицы и ДНК, представленной как SEQ ID NO: 46 и 48, SEQ ID NO: 46 и 49, SEQ ID NO: 46 и 50, SEQ ID NO: 46 и 51, SEQ ID NO: 46 и 52, SEQ ID NO: 46 и 53, и SEQ ID NO: 46 и 54, в качестве праймеров, получали фрагменты ДНК длиной приблизительно 1,4 т.п.н. каждый, соответственно. В праймер SEQ ID NO: 46 включали последовательность распознавания для фермента рестрикции KpnI. В каждый из праймеров SEQ ID NO: 48, 49, 50, 51, 52, 53 и 54, включали стоп-кодон и последовательность распознавания для фермента рестрикции KpnI. Для ПЦР использовали ДНК-полимеразу Pyrobest (производимый Takara Bio), и условия реакции соответствовали рекомендациям производителя. Эти фрагменты ДНК обрабатывали ферментом рестрикции KpnI, и каждый из них встраивали в участок KpnI pPK4, описываемого в патентной заявке Японии (Kokai) №9-322774, для получения плазмид, делающих возможной секреторную экспрессию области H-цепи Fab-фрагмента трастузумаба, pPKStrast-FabH (1-223C), pPKStrast-FabH (1-228T), pPKStrast-FabH (1-229C), pPKStrast-FabH (1 -230P), pPKStrast-FabH (1-231P), pPKStrast-FabH (1-232C) и pPKStrast-FabH (1-233P). В частности, с использованием этих плазмид можно выражать аминокислотную последовательность H-цепи трастузумаба с первого аминокислотного остатка до 223-го, 228-го, 229-го, 230-го, 231-го, 232-го или 233-го аминокислотного остатка (номера выражаемых аминокислотных остатков включают в названия плазмид). Определяя нуклеотидные последовательности встроенных фрагментов, подтверждали конструирование ожидаемых генов. Нуклеотидные последовательности определяли с использованием набора для циклического секвенирования BigDye® Terminator v3.1 (производимого Applied Biosystems) и 3130 Genetic Analyzer (производимого Applied Biosystems).
(2) Секреторная экспрессия области H-цепи Fab-фрагмента антитела трастузумаб с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a, и штамма, дефектного по пенициллинсвязывающему белку PBP1b
Каждый из штаммов YDK010, YDK010ΔPBP1a и YDK010ΔPBP1b трансформировали с использованием плазмиды для секреторной экспрессии области H-цепи Fab-фрагмента антитела трастузумаб, сконструированной в примере 2 (1), pPKStrast-FabH (1-229C). Каждый из полученных трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 мкг гидрохлорида тиамина, 450 мкг биотина, 0,15 г DL-метионина и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 72 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в восстанавливающих условиях, а затем окрашивали с использованием SYPRO Orange (производимого Invitrogen). В результате в случае родительского штамма YDK010 и штамма YDK010ΔPBP1b не определяли полосу, соответствующую целевому белку, в то время как полосу, соответствующую белку той же молекулярной массы, что и у целевой H-цепи Fab-фрагмента антитела трастузумаб, определяли только в случае штамма YDK010ΔPBP1a (фиг. 1 и 2). Если N-концевую последовательность белка этой полосы определяли с помощью белкового секвенатора PPSQ-21A (производимого Shimadzu), последовательность соответствовала N-концевой последовательности целевой H-цепи Fab-фрагмента антитела трастузумаб, и, таким образом, можно подтверждать секреторную экспрессию H-цепи Fab-фрагмента антитела трастузумаб в супернатанте культуры.
Затем каждый из штаммов YDK010 и YDK010ΔPBP1a трансформировали с использованием каждой из плазмид для секреторной экспрессии области H-цепи Fab-фрагмента антитела трастузумаб, сконструированных в примере 2 (1), pPKStrast-FabH (1-223C), pPKStrast-FabH (1-228T), pPKStrast-FabH (1-229C), pPKStrast-FabH (1 -230P), pPKStrast-FabH (1-231P), pPKStrast-FabH (1-232C) и pPKStrast-FabH (1-233P). Каждый из получаемых трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 мкг гидрохлорида тиамина, 450 мкг биотина, 0,15 г DL-метионина, и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 72 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в восстанавливающих условиях, а затем окрашивали с использованием SYPRO Orange (производимого Invitrogen). В результате, даже при использовании каждой из плазмид для секреторной экспрессии, в случае родительского штамма YDK010 не определяли полосу, соответствующую целевому белку, в то время как полосу, соответствующую белку той же молекулярной массы, что и у H-цепи Fab-фрагмента целевого антитела трастузумаб, определяли только в случае штамма YDK010ΔPBP1a (фиг. 3).
Пример 3: Секреторная экспрессия области L-цепи Fab-фрагмента антитела трастузумаб с использованием Corynebacterium glutamicum, дефектных по пенициллинсвязывающему белку PBP1a
(1) Конструирование плазмиды для секреторной экспрессии области L-цепи Fab-фрагмента антитела трастузумаб
Генетическая последовательность вариабельной области L-цепи в антителе трастузумаб, специфичном для злокачественных клеток молочной железы, уже определена (учетный номер GenBank AY513485). Со ссылкой на эту последовательность и последовательность невариабельной области L-цепи общего антитела синтезировали ДНК, представленную как SEQ ID NO: 55-70 с учетом частот кодонов C. glutamicum. Полноразмерную область L-цепи трастузумаба амплифицировали с помощью ПЦР с использованием указанных выше ДНК в качестве матрицы и отдельно синтезированных ДНК, представленных как SEQ ID NO: 71 и 72 и используемых, таким образом, в качестве праймеров, для получения фрагмента ДНК, представленного как SEQ ID NO: 73, длиной приблизительно 0,6 т.п.н. Аминокислотная последовательность L-цепи антитела трастузумаб, кодируемого ДНК SEQ ID NO: 73, представлена в SEQ ID NO: 87. Затем с использованием pPKSPTG1, описываемого в WO 01/23591 (содержащего промотор, полученный из штамма C. glutamicum ATCC 13869, и область сигнального пептида, полученную из штамма C. ammoniagenes (C. stationis) ATCC 6872), в качестве матрицы и праймеров, представленных как SEQ ID NO: 74 и 75, с помощью ПЦР амплифицировали область, включающую указанную выше промоторную область и указанную выше область сигнального пептида, таким образом, получая фрагмент ДНК длиной приблизительно 0,7 т.п.н. Затем с помощью ПЦР с использованием обоих амплифицированных фрагментов ДНК (фрагмента, включающего область L-цепи трастузумаба, и фрагмента, включающего промоторную область и область сигнального пептида) в качестве матрицы и ДНК, представленной как SEQ ID NO: 74 и 76, в качестве праймеров получали фрагмент ДНК длиной приблизительно 1,3 т.п.н., состоящий из обоих фрагментов ДНК, слитных друг с другом. В праймеры SEQ ID NO: 74 и 76 добавляли последовательность распознавания для фермента рестрикции BamHI. Для ПЦР использовали ДНК-полимеразу Pyrobest (производимый Takara Bio), и условия реакции соответствовали рекомендациям производителя. Этот слитный фрагмент ДНК обрабатывали ферментом рестрикции BamHI и встраивали в участок BamHI pPK4, описываемого в патентной заявке Японии (Kokai) №9-322774, для получения плазмиды, делающей возможной секреторную экспрессию области L-цепи Fab-фрагмента трастузумаба, pPKStrast-FabL. Определяя нуклеотидную последовательность встроенного фрагмента, подтверждали конструирование ожидаемого гена. Нуклеотидную последовательность определяли с использованием Набора для циклического секвенирования BigDye® Terminator v3.1 (производимого Applied Biosystems) и 3130 Genetic Analyzer (производимого Applied Biosystems).
(2) Секреторная экспрессия области L-цепи Fab-фрагмента антитела трастузумаб с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a
Каждый из штаммов YDK010 и YDK010ΔPBP1a трансформировали с использованием плазмиды для секреторной экспрессии области L-цепи Fab-фрагмента антитела трастузумаб, сконструированной в примере 3 (1), pPKStrast-FabL. Каждый из получаемых трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 г гидрохлорида тиамина, 450 мкг биотина, 0,15 г DL-метионина и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 72 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в восстанавливающих условиях, а затем окрашивали с использованием CBB R250 (производимого Bio-Rad). В результате полосу, соответствующую белку той же молекулярной массы, что и у L-цепи Fab-фрагмента целевого антитела трастузумаб, определяли в случае штамма YD010ΔPBP1a с интенсивностью свечения полосы, по меньшей мере, в два раза выше интенсивности, наблюдаемой в случае родительского штамма YDK010 (фиг. 4). При определении N-концевой последовательности белка этой полосы с использованием белкового секвенатора PPSQ-21A (производимого Shimadzu) последовательность соответствовала N-концевой последовательности L-цепи Fab-фрагмента целевого антитела трастузумаб, и, таким образом, можно подтверждать секреторную экспрессию L-цепи Fab-фрагмента антитела трастузумаб в супернатанте культуры.
Пример 4: Секреторная экспрессия Fab(H&L)-фрагмента антитела трастузумаб с использованием штамма Corynebacterium glutamicum, дефектного по пенициллинсвязывающим белкам PBP1a
(1) Конструирование плазмиды для секреторной экспрессии Fab(H&L)-фрагмента антитела трастузумаб
Встраивая фрагменты ДНК длиной приблизительно 1,4 т.п.н. каждый, полученные расщеплением экспрессирующих плазмид для области H-цепи Fab-фрагмента антитела трастузумаб, сконструированных в примере 2 (1), с использованием фермента рестрикции KpnI, в участок KpnI pPKStrast-FabL, являвшейся экспрессирующей плазмидой для области L-цепи Fab-фрагмента антитела трастузумаб, сконструированной в примере 3 (1), получали плазмиды для коэкспрессии области H-цепи и области L-цепи Fab-фрагмента трастузумаба, pPKStrast-FabH (1-223C)+L, pPKStrast-FabH (1-228T)+L, pPKStrast-FabH (1-229C)+L, pPKStrast-FabH (1-230P)+L, pPKStrast-FabH (1-231P)+L, pPKStrast-FabH (1-232C)+L и pPKStrast-FabH (1-233P)+L.
(2) Секреторная экспрессия Fab(H&L)-фрагмента антитела трастузумаб с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a
Каждый из штаммов YDK010 и YDK010ΔPBP1a трансформировали с использованием плазмид для секреторной экспрессии Fab(H&L)-фрагмента антитела трастузумаб, сконструированных в примере 4 (1), pPKStrast-FabH (1-223C)+L, pPKStrast-FabH (1-228T)+L, pPKStrast-FabH (1-229C)+L, pPKStrast-FabH (1-230P)+L, pPKStrast-FabH (1-231P) +L, pPKStrast-FabH (1-232C)+L и pPKStrast-FabH (1-233P)+L. Каждый из полученных трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 мкг гидрохлорида тиамина, 450 г биотина, 0,15 г DL-метионина и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 96 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в невосстанавливающих условиях, а затем окрашивали с использованием SYPRO Orange (производимого Invitrogen), и сравнивали количества секретируемых Fab(H&L)-фрагментов антитела трастузумаб. В результате, даже при использовании любой из плазмид для секреторной экспрессии, количество секретируемого Fab(H&L)-фрагмента антитела трастузумаб значительно улучшалось в случае штамма YDK010ΔPBP1a по сравнению с наблюдаемым для родительского штамма YDK010 (фиг. 5). При определении N-концевой последовательности Fab(H&L)-белка в полосе, соответствующей трансформанту, полученному из штамма YDK010ΔPBP1a с использованием pPKStrast-FabH (1-229C)+L, с использованием белкового секвенатора PPSQ-21A (производимого Shimadzu), определяли включение обеих последовательностей из N-концевой последовательности H-цепи и N-концевой последовательности L-цепи Fab-фрагмента целевого антитела трастузумаб и, таким образом, можно подтверждать, что Fab(H&L)-фрагменты антитела трастузумаб экспрессировались и секретировались, образуя агрегаты в супернатанте культуры.
(3) Секреторная экспрессия F(ab′)2-фрагмента антитела трастузумаб с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a
Каждый из супернатантов культур, полученных в примере 4 (2), подвергали электрофорезу в ПААГ в присутствии SDS в невосстанавливающих условиях, а затем белки переносили на мембрану PVDF с использованием iBlot® Gel Transfer Stacks PVDF, Mini (производимой Invitrogen) и iBlot™ Gel Transfer System (производимой Invitrogen). Осуществляли вестерн-блоттинг для этой мембраны PVDF с использованием меченого щелочной фосфатазой антитела против IgG человека [H&L] (производимого ROCKLAND) и набора Alkaline Phosphatase Conjugate Substrate Kit (производимого Bio-Rad), таким образом, определяя F(ab′)2-фрагменты антитела трастузумаб. В результате полосу, соответствующую белку той же молекулярной массы, что и у F(ab′)2-фрагмента антитела трастузумаб, определяли в случае супернатанта культуры трансформанта, несущего каждую из pPKStrast-FabH (1-229C)+L, pPKStrast-FabH (1-230P)+L, pPKStrast-FabH (1-231P)+L, pPKStrast-FabH (1-232C)+L и pPKStrast-FabH (1-233P)+L, являющихся плазмидами для коэкспрессии области H-цепи, содержащей остаток Cys, образующий дисульфидную связь, соединяющую H-цепи, и область L-цепи. Кроме того, даже при использовании любой из этих плазмид для секреторной экспрессии, интенсивность свечения полосы, соответствующей белку той же молекулярной массы, что и у F(ab′)2-фрагмента антитела трастузумаб, значительно улучшалась в случае штамма YDK010ΔPBP1a по сравнению с наблюдаемым для родительского штамма YDK010 (фиг. 6).
Пример 5: Секреторная экспрессия Fc-фрагмента антитела трастузумаб с использованием Corynebacterium glutamicum, дефектной по пенициллинсвязывающему белку PBP1a
(1) Конструирование плазмиды для секреторной экспрессии Fc-фрагмента антитела трастузумаб
Fc-область H-цепи трастузумаба амплифицировали с помощью ПЦР с использованием ДНК, представленной как SEQ ID NO: 45, содержащей полноразмерную область H-цепи трастузумаба, синтезированной в примере 2 (1), в качестве матрицы, и отдельно синтезированных ДНК, представленных как SEQ ID NO: 77 и 78 и SEQ ID NO: 77 и 79, в качестве праймеров, таким образом, получая фрагменты ДНК длиной приблизительно 0,7 т.п.н. каждый. Затем с использованием pPKSPTG1, описываемого в WO 01/23591 (содержащего промоторную область, полученную из штамма C. glutamicum ATCC 13869, и область сигнального пептида, полученную из штамма C. ammoniagenes (C. stationis) ATCC 6872), в качестве матрицы и праймеров, представленных как SEQ ID NO: 46 и 80, с помощью ПЦР амплифицировали область, включающую указанную выше промоторную область и указанную выше область сигнального пептида, таким образом, получая фрагмент ДНК длиной приблизительно 0,7 т.п.н. Затем с помощью ПЦР с использованием обоих амплифицированных фрагментов ДНК (каждого из фрагментов, включающих Fc-область области H-цепи трастузумаба, и фрагмента, включающего промоторную область и область сигнального пептида) в качестве матрицы и ДНК, представленных как SEQ ID NO: 46 и 77, в качестве праймеров получали фрагменты ДНК длиной приблизительно 1,4 т.п.н., каждый из которых состоял из обоих фрагментов ДНК, слитных друг с другом. В праймеры SEQ ID NO: 46 и 77 включали последовательность распознавания для фермента рестрикции KpnI. Для ПЦР использовали ДНК-полимеразу Pyrobest (производимый Takara Bio), и условия реакции соответствовали рекомендациям производителя. Эти фрагменты ДНК обрабатывали ферментом рестрикции KpnI, а затем каждый из них встраивали в участок KpnI pPK4, описываемого в патентной заявке Японии (Kokai) № 9-322774, для получения плазмид, делающих возможной секреторную экспрессию Fc-области области H-цепи трастузумаба, pPKStrast-Fc (H224D-450) и pPKStrast-Fc (H231P-450). В частности, с использованием этих плазмид можно выражать аминокислотную последовательность H-цепи трастузумаба с 224-го или 231-го аминокислотного остатка до 450-го аминокислотного остатка (номера выраженных аминокислотных остатков включают в названия плазмид). Определяя нуклеотидные последовательности встроенных фрагментов, подтверждали конструирование ожидаемых генов. Нуклеотидные последовательности определяли с использованием набора для циклического секвенирования BigDye® Terminator v3.1 (производимого Applied Biosystems) и 3130 Genetic Analyzer (производимого Applied Biosystems).
(2) Секреторная экспрессия Fc-фрагмента антитела трастузумаб с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a
Каждый из штаммов YDK010 и YDK010ΔPBP1a трансформировали с использованием плазмид для секреторной экспрессии Fc-фрагмента антитела трастузумаб, сконструированных в примере 5 (1), pPKStrast-Fc (H224D-450) и pPKStrast-Fc (H231P-450). Каждый из полученных трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 мкг гидрохлорида тиамина, 450 пг биотина, 0,15 г DL-метионина, и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 72 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в восстанавливающих условиях, а затем белки переносили на мембрану PVDF с использованием iBlot® Gel Transfer Stacks PVDF Mini (производимого Invitrogen) и iBlot™ Gel Transfer System (производимой Invitrogen). Для этой мембраны PVDF осуществляли вестерн-блоттинг с использованием меченого щелочной фосфатазой антитела против IgG человека [H&L] (производимого ROCKLAND) и набора Alkaline Phosphatase Conjugate Substrate Kit (производимого Bio-Rad) для сравнения секретируемого количества Fc-фрагмента антитела трастузумаб. В результате даже при использовании любой из плазмид для секреторной экспрессии, секретируемое количество Fc-фрагмента антитела трастузумаб значительно улучшалось в случае штамма YDK010ΔPBP1a по сравнению с наблюдаемым для родительского штамма YDK010 (фиг. 7).
Пример 6: Секреторная экспрессия протрансглутаминазы с использованием Corynebacterium glutamicum, дефектной по пенициллинсвязывающему белку PBP1a
(1) Секреторная экспрессия протрансглутаминазы с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a
Уже сообщали о системе секреторной экспрессии протрансглутаминазы с использованием C. glutamicum (WO01/23591). Затем каждый из штаммов YDK010 и YDK010ΔPBP1a трансформировали с использованием плазмидного вектора pPKSPTG1 для секреторной экспрессии протрансглутаминазы, описываемого в WO 01/23591. Каждый из получаемых трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 мкг гидрохлорида тиамина, 450 мкг биотина, 0,15 г DL-метионина и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 72 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в восстанавливающих условиях, а затем окрашивали с использованием CBB R250 (производимого Bio-Rad). Секретируемые количества протрансглутаминазы определяли согласно ранее опубликованной статье (Protein Expr. Purif., 26:329-335) и сравнивали количества. В результате секретируемое количество протрансглутаминазы значительно улучшалось в штамме YDK010ΔPBP1a по сравнению с наблюдаемым для родительского штамма YDK010 (фиг. 8).
Пример 7: Секреторная экспрессия одноцепочечного антитела против дигоксина (scFv) с использованием Corynebacterium glutamicum, дефектной по пенициллинсвязывающему белку PBP1a
(1) Конструирование плазмиды для секреторной экспрессии одноцепочечного антитела против дигоксина (scFv)
Уже определена генетическая последовательность scFv против дигоксина и уже изучена его экспрессия с использованием Bacillus subtilis (Biotechnology (N Y)., 11(1): 71-76 (1993)). С учетом этой последовательности полностью синтезировали фрагмент ДНК, представленный в SEQ ID NO: 88, содержащий промотор, полученный из гена PS2 штамма C. glutamicum ATCC 13869, ДНК, кодирующую сигнальный пептид, полученный из SlpA штамма C. ammoniagenes (C. stationis) ATCC 6872, лигированную ниже промотора, и ДНК, кодирующую scFv против дигоксина, лигированную таким образом, что белок экспрессируется как слитный белок с указанным выше сигнальным пептидом. Синтезированная ДНК SEQ ID NO: 88 содержит участки распознавания фермента рестрикции XbaI на 5′-конце и 3′-конце. ДНК, кодирующую scFv против дигоксина, в синтезированной ДНК конструировали с учетом частоты использования кодонов в C. glutamicum. Нуклеотидная последовательность ДНК, кодирующей scFv против дигоксина, в синтезированной ДНК представлена в SEQ ID NO: 89, а аминокислотная последовательность scFv против дигоксина представлена в SEQ ID NO: 90. Полностью синтезированный фрагмент ДНК расщепляли ферментом рестрикции XbaI и встраивали в участок XbaI pPK4, описываемого в JP9-322774A, таким образом, получая плазмиду, делающую возможной экспрессию scFv против дигоксина pPKSSCA1.
(2) Секреторная экспрессия одноцепочечного антитела против дигоксина (scFv) с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a
Каждый из штаммов YDK010 и YDK010ΔPBP1a трансформировали с использованием плазмиды для секреторной экспрессии scFv против дигоксина, сконструированной в примере 7 (1), pPKSSCA1. Каждый из получаемых трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 мкг гидрохлорида тиамина, 450 г биотина, 0,15 г DL-метионина, и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 72 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в восстанавливающих условиях, а затем окрашивали с использованием SYPRO Orange (производимого Invitrogen). В результате полосу, соответствующую белку той же молекулярной массы, что и у целевого scFv против дигоксина, определяли в случае штамма YDK010ΔPBP1a при интенсивности свечения полосы, по меньшей мере в два раза большей, чем наблюдали для родительского штамма YDK010 (фиг. 9). При определении N-концевой последовательности белка этой полосы с использованием белкового секвенатора PPSQ-21A (производимого Shimadzu) последовательность соответствовала N-концевой последовательности целевого scFv против дигоксина, и, таким образом, можно подтверждать секреторную экспрессию scFv против дигоксина в супернатанте культуры.
Пример 8: Секреторная экспрессия Fab(H&L)-фрагмента антитела адалимумаб с использованием Corynebacterium glutamicum, дефектной по пенициллинсвязывающему белку PBP1a
(1) Конструирование плазмиды для секреторной экспрессии Fab(H&L)-фрагмента антитела адалимумаб
Аминокислотная последовательность антитела, специфичного для фактора некроза опухоли (ФНО), адалимумаба, уже определена (Доклад об оценке от 14 февраля 2008 года, Pharmaceuticals and Medical Devices Agency). С учетом этой последовательности полностью синтезировали фрагмент ДНК, представленный в SEQ ID NO: 91, содержащий промотор, полученный из гена PS2 штамма C. glutamicum ATCC 13869, ДНК, кодирующую сигнальный пептид, полученный из SlpA штамма C. ammoniagenes (C. stationis) ATCC 6872, лигированную ниже промотора, и ДНК, кодирующую аминокислотную последовательность от положения 1 до остатка Cys в положении 230 H-цепи адалимумаба, лигированную таким образом, что белок экспрессируется как слитный белок с указанным выше сигнальным пептидом, и дополнительно содержащий ниже его промотор, полученный из гена PS2 штамма C. glutamicum ATCC 13869, ДНК, кодирующую сигнальный пептид, полученный из SlpA штамма C. ammoniagenes (C. stationis) ATCC 6872, лигированную ниже промотора, и ДНК, кодирующую L-цепь адалимумаба, лигированную таким образом, что белок экспрессируется как слитный белок с указанным выше сигнальным пептидом. Аналогично, полностью синтезировали фрагмент ДНК, представленный в SEQ ID NO: 92, содержащий промотор, полученный из гена PS2 штамма C. glutamicum ATCC 13869, ДНК, кодирующую сигнальный пептид, полученный из SlpA штамма C. ammoniagenes (C. stationis) ATCC 6872, лигированную ниже промотора, и ДНК, кодирующую L-цепь адалимумаба, лигированную таким образом, что белок экспрессируется как слитный белок с указанным выше сигнальным пептидом, и дополнительно содержащий ниже его промотор, полученный из гена PS2 штамма C. glutamicum ATCC 13869, ДНК, кодирующую сигнальный пептид, полученный из SlpA штамма C. ammoniagenes (C. stationis) ATCC 6872, лигированную ниже промотора, и ДНК, кодирующую аминокислотную последовательность от положения 1 до остатка Cys в положении 230 H-цепи адалимумаба, лигированную таким образом, что белок экспрессируется как слитный белок с указанным выше сигнальным пептидом. Каждая из синтезированных ДНК SEQ ID NO: 91 и 92 содержит участок распознавания фермента рестрикции BamHI на 5′-конце и участок распознавания фермента рестрикции XbaI на 3′-конце. ДНК, кодирующую H-цепь и L-цепь адалимумаба в синтезированной ДНК, конструировали с учетом частоты использования кодонов в C. glutamicum. Нуклеотидная последовательность ДНК, кодирующей аминокислотную последовательность от положения 1 до положения 230 H-цепи адалимумаба, в синтезированной ДНК представлена в SEQ ID NO: 93, и аминокислотная последовательность представлена в SEQ ID NO: 94. Также, нуклеотидная последовательность ДНК, кодирующей L-цепь адалимумаба, в синтезированной ДНК представлена в SEQ ID NO: 95, и аминокислотная последовательность L-цепи адалимумаба представлена в SEQ ID NO: 96. Каждый из полностью синтезированных фрагментов ДНК длиной приблизительно 2,7 т.п.н. расщепляли с использованием ферментов рестрикции BamHI и XbaI, и встраивали в участок BamHI-XbaI pPK4, описываемого в JP9-322774A, таким образом, получая плазмиды, делающие возможной коэкспрессию H-цепи (1-230C) и L-цепи адалимумаба, pPKSada-FabHL и pPKSada-FabLH. "FabHL" и "FabLH" в названиях соответствующих плазмид свидетельствуют о порядке встраивания гена H-цепи и гена L-цепи адалимумаба в экспрессирующих плазмидах.
(2) Секреторная экспрессия Fab(H&L)-фрагмента антитела адалимумаба с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a
Каждый из штаммов YDK010 и YDK010ΔPBP1a трансформировали с использованием плазмид для секреторной экспрессии Fab(H&L)-фрагмента антитела адалимумаб, сконструированного в примере 8 (1), pPKSada-FabHL и pPKSada-FabLH. Каждый из получаемых трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 мкг гидрохлорида тиамина, 450 г биотина, 0,15 г DL-метионина и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 96 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в невосстанавливающих условиях, а затем окрашивали с использованием SYPRO Orange (производимого Invitrogen) и сравнивали секретируемые количества Fab(H&L)-фрагментов антитела адалимумаб. В результате, даже при использовании любой из плазмид для секреторной экспрессии, секретируемое количество Fab(H&L)-фрагмента антитела адалимумаб значительно улучшалось в случае штамма YDK010ΔPBP1a по сравнению с наблюдаемым для родительского штамма YDK010 (фиг. 10). При определении N-концевой последовательности белка Fab(H&L) в полосе, соответствующей трансформанту, получаемому из штамма YDK010ΔPBP1a с использованием pPKSada-FabHL, с помощью белкового секвенатора PPSQ-21A (производимого Shimadzu), были включены обе последовательности из N-концевой последовательности H-цепи и N-концевой последовательности L-цепи Fab-фрагмента целевого антитела адалимумаб, и, таким образом, можно подтверждать, что Fab(H&L)-фрагменты антитела адалимумаб экспрессировались и секретировались с образованием агрегатов в супернатанте культуры. Таким образом, выявляли, что секретируемое количество Fab(H&L)-фрагмента антитела можно улучшать с использованием штамма, дефектного по пенициллинсвязывающему белку PBP1a в случае экспрессии Fab(H&L)-фрагмента адалимумаба, а также в случае экспрессии Fab(H&L)-фрагмента трастузумаба.
Пример 9: Конструирование штамма Corynebacterium glutamicum ATCC13869, дефектного по пенициллинсвязывающему белку PBP1a, и секреторная экспрессия Fab(H&L)-фрагмента антитела трастузумаб
(1) Конструирование C. glutamicum ATCC13869ΔPBP1a
Штамм C. glutamicum ATCC13869 трансформировали с использованием pBSΔCgl0278, вектора для делеции гена пенициллинсвязывающего белка PBP1a, сконструированного в примере 1 (1). Штаммы выбирали из получаемых трансформантов согласно способу, описываемому в WO 2005/113744, для получения штамма ATCC13869ΔPBP1a, дефектного по гену Cgl0278.
(2) Секреторная экспрессия Fab(H&L)-фрагмента антитела трастузумаб C. glutamicum ATCC13869ΔPBP1a
Каждый из штаммов ATCC13869 и ATCC13869ΔΡΒΡ1a трансформировали с использованием плазмиды для секреторной экспрессии Fab(H&L)-фрагмента антитела трастузумаб, сконструированной в примере 4 (1), pPKStrast-FabH(1-229C)+L. Каждый из получаемых трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 мкг гидрохлорида тиамина, 450 г биотина, 0,15 г DL-метионина и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 96 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в невосстанавливающих условиях, а затем окрашивали с использованием SYPRO Orange (производимого Invitrogen) и сравнивали секретируемые количества Fab(H&L)-фрагментов антитела трастузумаб. В результате, в отличие от случая использования штамма YDK010 в качестве экспрессирующего хозяина, секретируемое количество Fab(H&L)-фрагмента антитела трастузумаб не улучшалось даже при использовании штамма, дефектного по пенициллинсвязывающему белку PBP1a, в случае использования штамма ATCC13869 в качестве экспрессирующего хозяина (дорожки 3 и 5 на фиг. 11).
Пример 10: Конструирование штамма Corynebacterium glutamicum ATCC13869 с двойным дефектом по белку поверхностного слоя клетки CspB и пенициллинсвязывающему белку PBP1a и секреторная экспрессия Fab(H&L)-фрагмента антитела трастузумаб
Штамм C. glutamicum YDK010, секретируемое количество белка в котором улучшалось в результате дефекта по пенициллинсвязывающему белку PBP1a, является дефектной по белку поверхностного слоя клетки PS2 (CspB) версией штамма C. glutamicum AJ12036 (FERM BP-734) (WO 2004/029254). Таким образом, конструировали дефектный по CspB штамм ATCC13869 и штамм ATCC13869 с двойным дефектом по CspB и PBP1a и осуществляли секреторную экспрессию Fab(H&L)-фрагмента антитела трастузумаб. Нуклеотидная последовательность гена, кодирующего CspB штамма ATCC13869, представлена в SEQ ID NO: 97, и аминокислотная последовательность CspB штамма ATCC13869 представлена в SEQ ID NO: 98.
(1) Конструирование C. glutamicum ATCC13869ΔCspB и ATCC13869ΔCspBΔPBP1a
С помощью ПЦР с использованием хромосомной ДНК штамма C. glutamicum YDK010, полученной общепринятым способом (способ Saito и Miura [Biochim. Biophys. Acta, 72, 619 (1963)]), в качестве матрицы, и ДНК SEQ ID NO: 99 и 100 в качестве праймеров амплифицировали фрагмент ДНК длиной приблизительно 2,0 т.п.н., содержащий область, по которой ген, кодирующий CspB, являлся дефектным. Для ПЦР использовали ДНК-полимеразу Pyrobest (производимый Takara Bio), и условия реакции соответствовали рекомендациям производителя. Этот фрагмент ДНК встраивали в участок SmaI pBS5T, описываемого в WO 2006/057450, для получения вектора pBS5T-AcspB для делеции гена CspB.
Затем штамм C. glutamicum ATCC13869 трансформировали с использованием сконструированного pBS5T-AcspB. Для получения штамма ATCC13869ΔCspB, дефектного по гену cspB из получаемых трансформантов выбирали штаммы согласно способу, описываемому в 02006/057450.
Затем штамм C. glutamicum ATCC13869ΔCspB трансформировали с использованием pBSΔCgl0278, вектора для делеции гена пенициллинсвязывающего белка PBP1a, сконструированного в примере 1 (1). Для получения штамма ATCC13869ΔCspBΔPBP1a, дефектного и по гену cspB, и по гену Cgl0278, выбирали из получаемых трансформантов штаммы согласно способу, описываемому в WO 2005/113744.
(2) Секреторная экспрессия Fab(H&L)-фрагмента антитела трастузумаба в ATCC13869ΔCspB и ATCC13869ΔCspBΔPBP1a
Каждый из штаммов ATCC13869ΔCspB и ATCC13869ΔCspBΔPBP1a штамм трансформировали с использованием плазмиды для секреторной экспрессии Fab(H&L)-фрагмента антитела трастузумаб, сконструированной в примере 4 (1), pPKStrast-FabH (1-229C)+L. Каждый из получаемых трансформантов культивировали в жидкой среде MM (120 г глюкозы, 3 г гептагидрата сульфата магния, 30 г сульфата аммония, 1,5 г дигидрофосфата калия, 0,03 г гептагидрата сульфата железа, 0,03 г пентагидрата сульфата марганца, 450 г гидрохлорида тиамина, 450 мкг биотина, 0,15 г DL-метионина и 50 г карбоната кальция в объеме 1 л с водой, pH доведен до 7,0), содержащей 25 мг/л канамицина, при 30°C в течение 96 часов. После завершения культивирования супернатант культуры, получаемый центрифугированием каждой культуральной жидкости, подвергали электрофорезу в ПААГ в присутствии SDS в невосстанавливающих условиях, а затем окрашивали с использованием SYPRO Orange (производимого Invitrogen) и сравнивали секретируемые количества Fab(H&L)-фрагментов антитела трастузумаб. В результате секретируемое количество Fab(H&L)-фрагмента антитела трастузумаб не улучшалось ни в штамме ATCC13869ΔCspB, ни в штамме ATCC13869ΔPBP1a, являвшимися штаммами, дефектными по CspB или PBP1a, по сравнению с наблюдаемым для родительского штамма ATCC13869, однако, секретируемое количество Fab(H&L)-фрагмента антитела трастузумаб значительно улучшалось в случае штамма ATCC13869ΔCspBΔPBP1a, являвшегося штаммом с двойным дефектом (фиг. 11). Таким образом, выявляли, что секретируемое количество Fab(H&L)-фрагмента антитела можно улучшать с использованием штамма с двойным дефектом и по белку поверхностного слоя клетки CspB, и по пенициллинсвязывающему белку PBP1a.
Промышленная применимость
По настоящему изобретению можно предоставлять коринеформную бактерию, которая может эффективно продуцировать гетерологичный белок посредством секреторной продукции. Кроме того, используя коринеформную бактерию по настоящему изобретению в качестве экспрессирующего хозяина, можно эффективно продуцировать гетерологичные белки, такие как промышленно применимые белки, посредством секреторной продукции.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СЕКРЕТОРНОЙ ПРОДУКЦИИ БЕЛКА | 2002 |
|
RU2264463C2 |
| СПОСОБ ПРОДУЦИРОВАНИЯ МИКРОБНОЙ ТРАНСГЛУТАМИНАЗЫ | 2004 |
|
RU2316594C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЛОГИЧНОГО СЕКРЕТОРНОГО БЕЛКА | 2000 |
|
RU2224796C2 |
| Микроорганизм Corynebacterium с улучшенной способностью продуцировать L-лизин и способ получения L-лизина с его помощью | 2014 |
|
RU2651505C1 |
| СПОСОБ ПРОДУКЦИИ БЕЛКА | 2006 |
|
RU2435863C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ДВУЦЕПОЧЕЧНЫХ БЕЛКОВ В БАКТЕРИЯХ | 2015 |
|
RU2705274C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ СЕМЕЙСТВА ГЛУТАМАТА С ИСПОЛЬЗОВАНИЕМ КОРИНЕФОРМНОЙ БАКТЕРИИ | 2011 |
|
RU2496867C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ | 2005 |
|
RU2433185C2 |
| РЕКОМБИНАНТНЫЙ МИКРООРГАНИЗМ, ОБЛАДАЮЩИЙ ПОВЫШЕННОЙ СПОСОБНОСТЬЮ ПРОДУЦИРОВАТЬ ПУТРЕСЦИН, И СПОСОБ ПОЛУЧЕНИЯ ПУТРЕСЦИНА С ПРИМЕНЕНИЕМ ЭТОГО МИКРООРГАНИЗМА | 2013 |
|
RU2604806C2 |
| СИСТЕМА ПОЛИЦИСТРОННОЙ ЭКСПРЕССИИ ДЛЯ БАКТЕРИЙ | 2012 |
|
RU2766157C2 |




























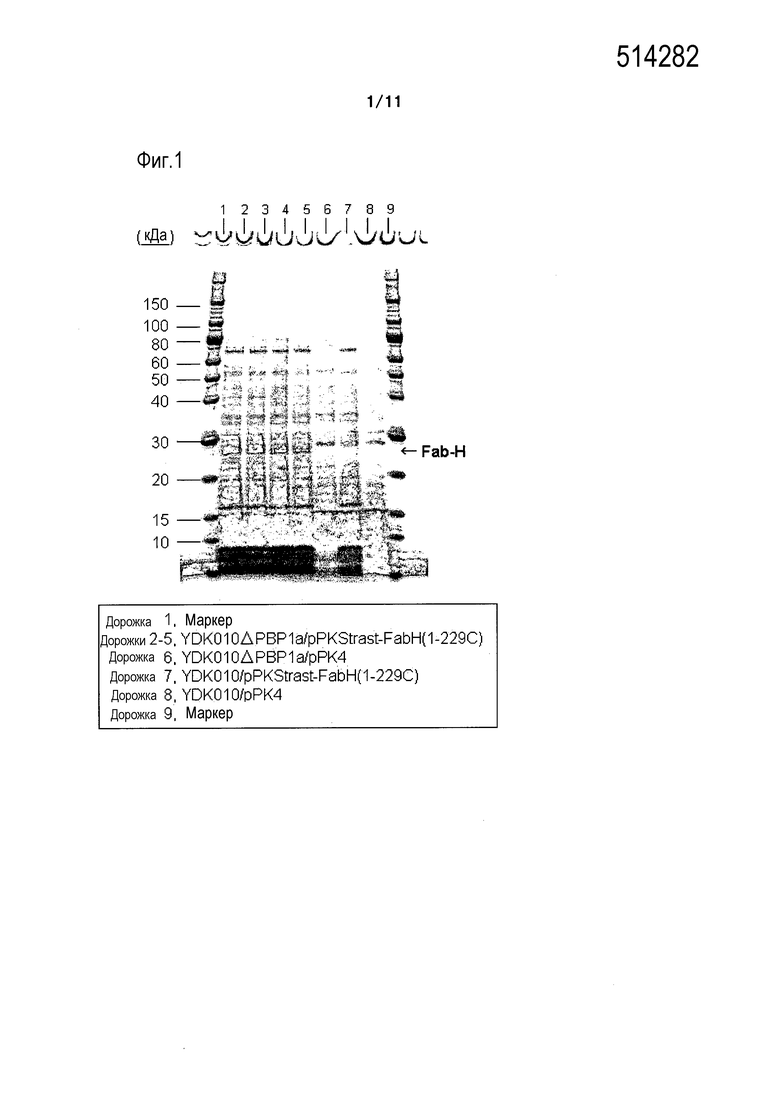
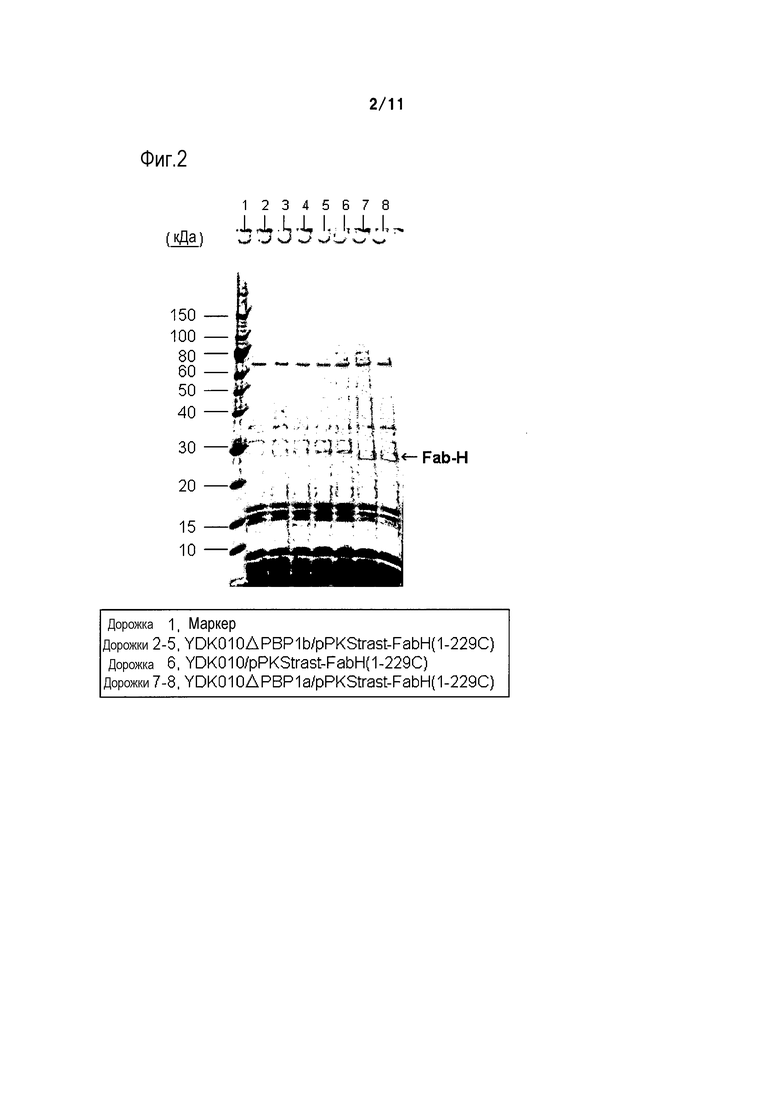
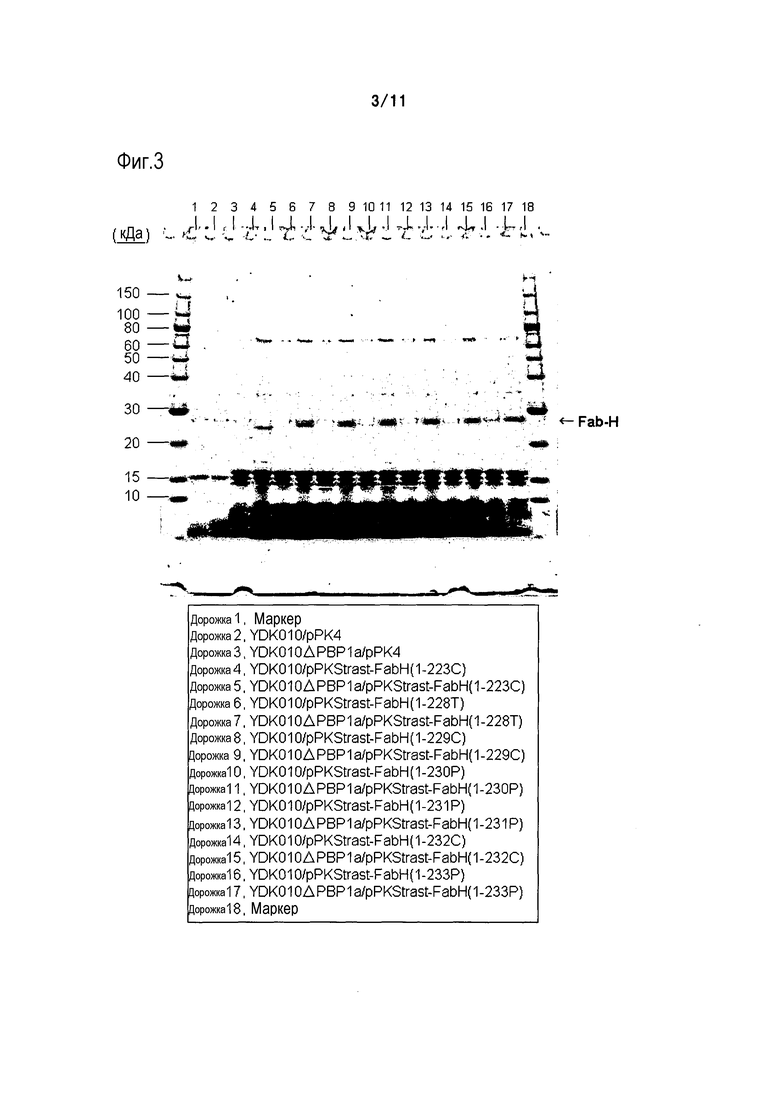

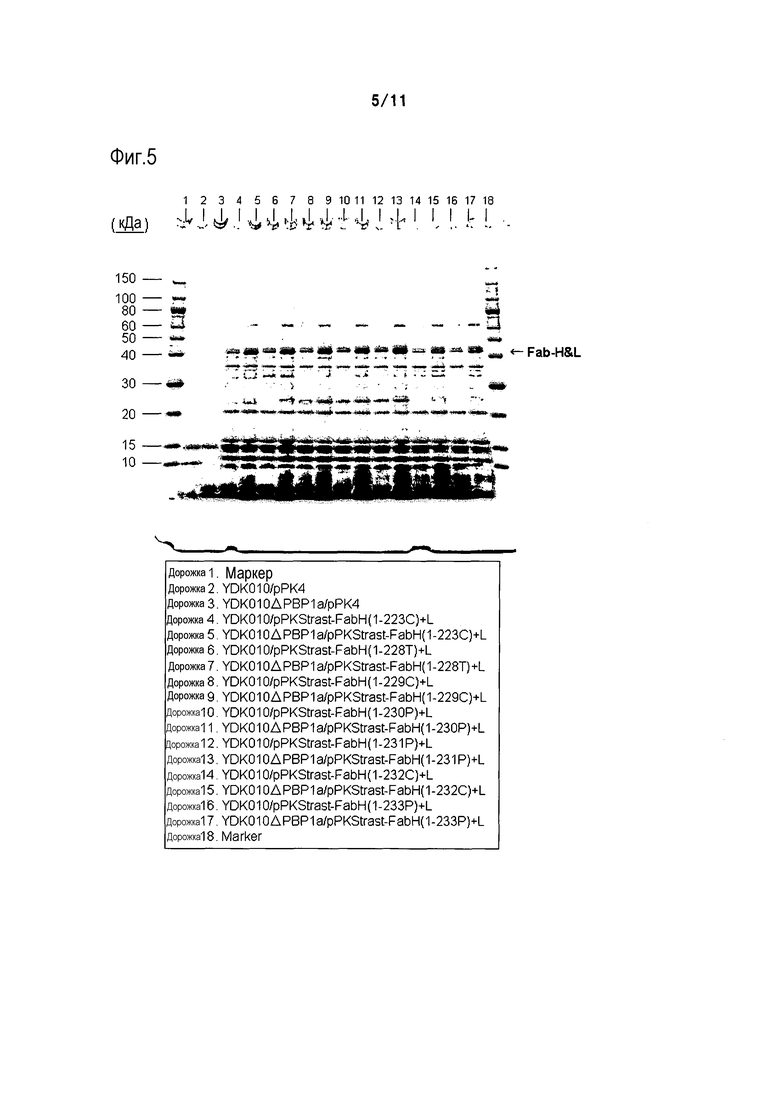


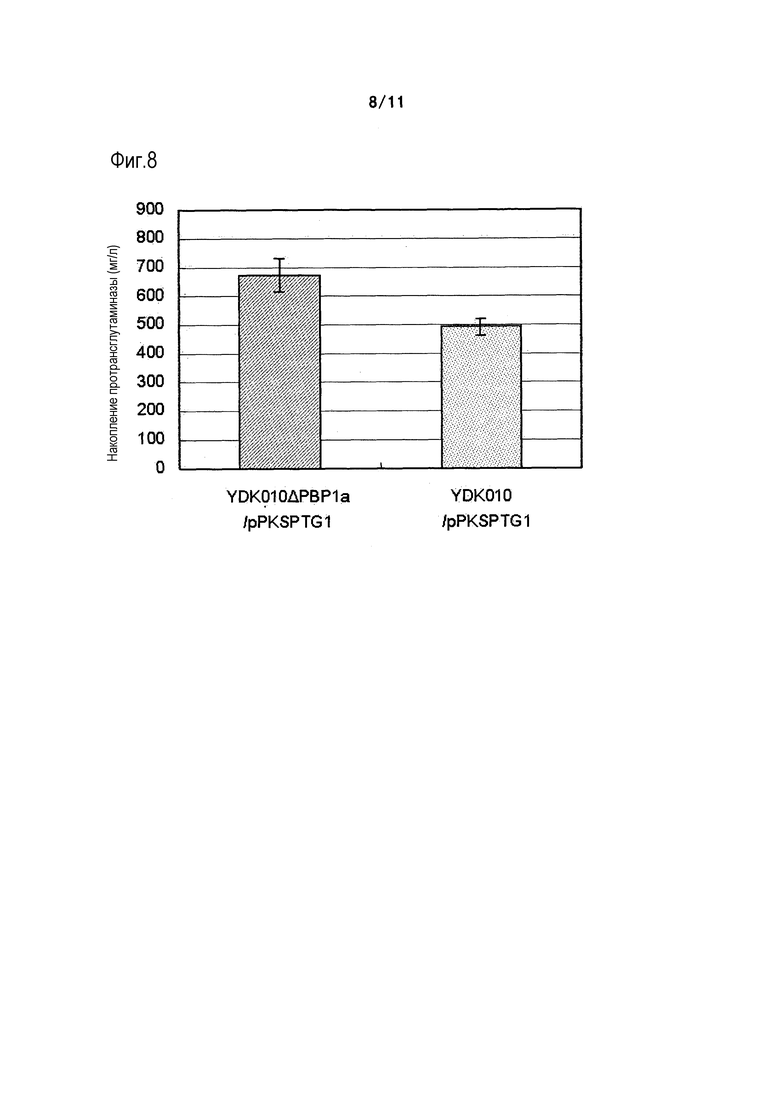
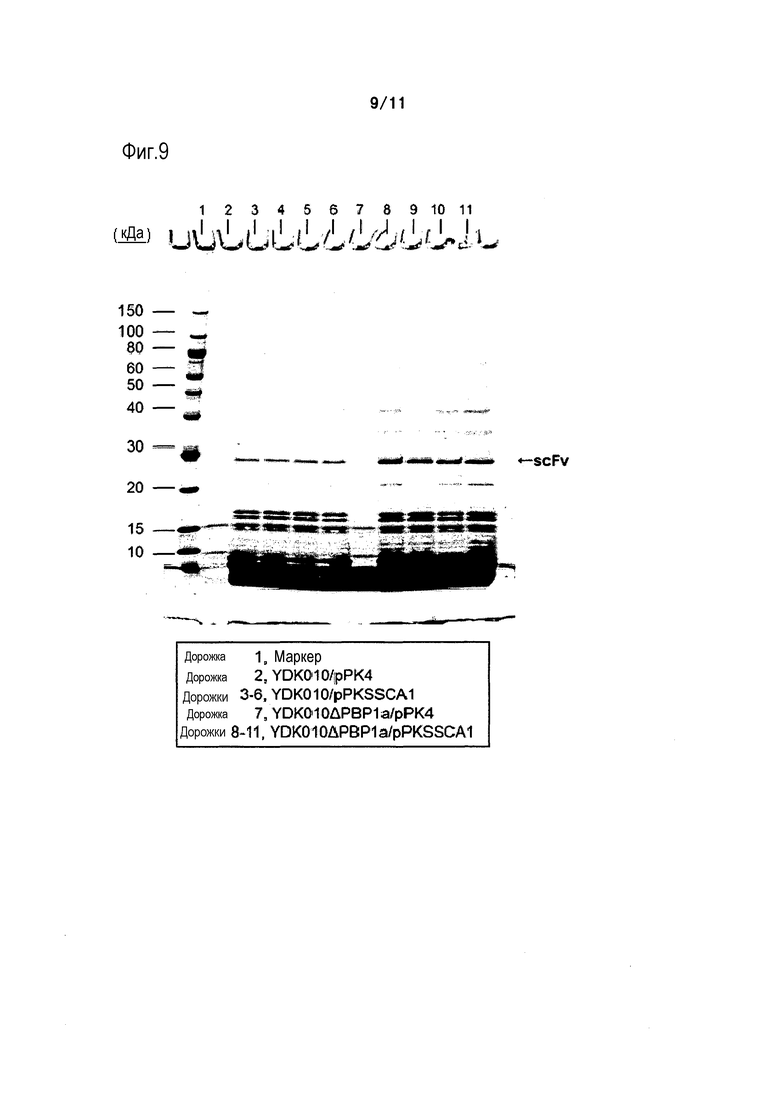

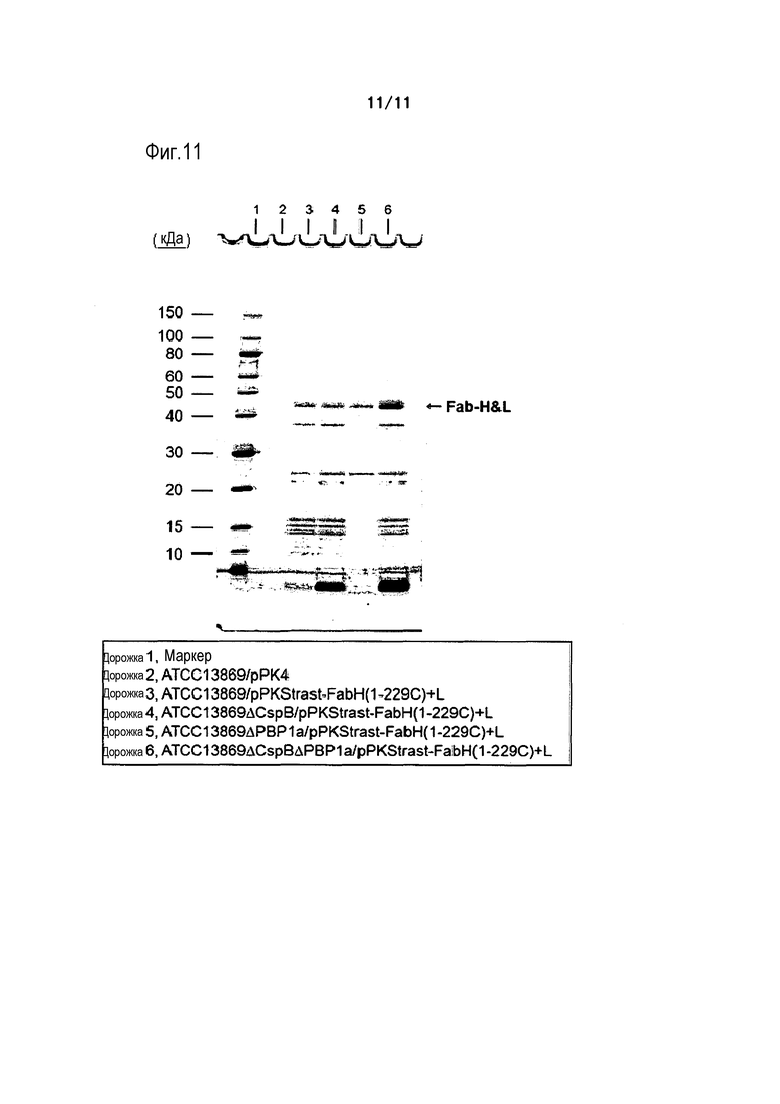
Изобретение относится к биотехнологии и представляет собой коринеформную бактерию, обладающую способностью продуцировать гетерологичный белок посредством секреторной продукции. При этом такая бактерия модифицирована таким образом, что устраняется активность пенициллинсвязывающего белка в результате разрушения гена, кодирующего пенициллинсвязывающий белок, и устраняется активность белка поверхностного слоя клетки в результате разрушения гена, кодирующего белок поверхностного слоя клетки, или по существу лишается белка поверхностного слоя клетки, где пенициллинсвязывающий белок является PBP1a, где белок поверхностного слоя клетки является CspB и где коринеформная бактерия содержит генетическую конструкцию, несущую ген гетерологичного белка, для секреторной экспрессии гетерологичного белка. Изобретение позволяет получать гетерологичный белок с высокой степенью эффективности. 2 н. и 7 з.п. ф-лы, 11 ил., 10 пр.
1. Коринеформная бактерия, обладающая способностью продуцировать гетерологичный белок посредством секреторной продукции, модифицированная таким образом, что устраняется активность пенициллинсвязывающего белка в результате разрушения гена, кодирующего пенициллинсвязывающий белок, и
устраняется активность белка поверхностного слоя клетки в результате разрушения гена, кодирующего белок поверхностного слоя клетки, или по существу лишается белка поверхностного слоя клетки,
где пенициллинсвязывающий белок является PBP1a,
где белок поверхностного слоя клетки является CspB и
где коринеформная бактерия содержит генетическую конструкцию, несущую ген гетерологичного белка, для секреторной экспрессии гетерологичного белка.
2. Коринеформная бактерия по п. 1, где пенициллинсвязывающий белок является белком, определенным в следующих пп. (А) или (В):
(A) белок, имеющий аминокислотную последовательность SEQ ID NO: 82,
(B) белок, имеющий аминокислотную последовательность SEQ ID NO: 82, включающую замену, делецию, инсерцию или добавление от 1 до 10 аминокислотных остатков, и обладающий таким свойством, что, если его активность в коринеформной бактерии снижена, количество гетерологичного белка, продуцируемого посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма.
3. Коринеформная бактерия по п. 1, где белком поверхностного слоя клетки является белок, определенный в следующих пп. (А) или (В):
(A) белок, имеющий аминокислотную последовательность SEQ ID NO: 98,
(B) белок, имеющий аминокислотную последовательность SEQ ID NO: 98, включающую замену, делецию, инсерцию или добавление от 1 до 10 аминокислотных остатков, и обладающий таким свойством, что, если его активность в коринеформной бактерии снижена, количество гетерологичного белка, продуцируемого посредством секреторной продукции, повышается по сравнению с наблюдаемым для немодифицированного штамма.
4. Коринеформная бактерия по п. 1, являющаяся бактерией, принадлежащей к роду Corynebacterium или Brevibacterium.
5. Коринеформная бактерия по п. 1, являющаяся Corynebacterium glutamicum.
6. Коринеформная бактерия по п. 1, где генетическая конструкция содержит промоторную последовательность, функционирующую в коринеформной бактерии, последовательность нуклеиновой кислоты, кодирующую сигнальный пептид, функционирующий в коринеформной бактерии, и лигированную ниже промоторной последовательности, и последовательность нуклеиновой кислоты, кодирующую гетерологичный белок и лигированную ниже последовательности нуклеиновой кислоты, кодирующей сигнальный пептид.
7. Коринеформная бактерия по п. 1, где гетерологичный белок является родственной антителу молекулой.
8. Коринеформная бактерия по п. 11, где родственная антителу молекула состоит из одного или нескольких белков, выбранных из Fab, F(ab′)2, Fc-слитного белка и scFv.
9. Способ продукции гетерологичного белка, включающий культивирование коринеформной бактерии по любому из пп. 1-8 и сбор гетерологичного белка, продуцируемого посредством секреторной продукции.
| Способ измерения амплитудного значения переменного напряжения | 1990 |
|
SU1748077A2 |
| Способ измерения химического и механического недожогов при совместном сжигании жидкого и твердого топлива | 1982 |
|
SU1059358A1 |
| YOTA TSUGE, et al "Deletion of cgR_1596 and cgR_2070, Encoding NlpC/P60 Proteins, Causes a Defect in Cell Separation in Corynebacterium glutamicum R", JOURNAL OF BACTERIOLOGY, Dec | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Ускоритель для воздушных тормозов при экстренном торможении | 1921 |
|
SU190A1 |
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| ЗАЖИМ ДЛЯ КАНАТНЫХ БЛОКОВ | 1928 |
|
SU8204A1 |
| КОРИНЕФОРМНАЯ БАКТЕРИЯ, ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2004 |
|
RU2333247C2 |
Авторы
Даты
2016-06-27—Публикация
2012-11-01—Подача