ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка испрашивает приоритет предварительной заявки США № 61/483, 698, поданной 8 мая 2011 г., содержание данной ссылки включено в настоящее изобретение посредством ссылки во всей ее полноте.
УРОВЕНЬ ТЕХНИКИ
(a) Область техники
Настоящее изобретение относится к конъюгату белок-активное вещество. Белок (например, олигопептид, полипептид, антитело или подобное) имеет субстратную специфичность к желаемой мишени, и активное вещество (например, лекарственное вещество, токсин, лиганд, детекторный зонд и т.п.) имеет определенную функцию или активность. Настоящее изобретение также обеспечивает способы получения конъюгата. Настоящее изобретение, кроме того, обеспечивает способы применения конъюгата для доставки активного вещества к клетке-мишени у субъекта, а также способы лечения субъекта, нуждающегося в активном веществе (например, у субъекта, имеющего рак).
(b) Уровень техники
Были предложены способы ингибирования роста раковых клеток посредством направленной доставки противоопухолевых агентов. Например, было показано, что направленная доставка конъюгата антитело-лекарственное вещество может убить конкретно раковую клетку. Так как антитело (или фрагмент антитела) специфически связывается с раковой клеткой, препарат поступает в раковую клетку-мишень. Направленная доставка лекарственного вещества гарантирует, что препарат оказывает действие на раковую клетку-мишень вместо нормальных клеток-хозяев, тем самым сводя к минимуму побочные эффекты в результате повреждения нормальных клеток.
Конъюгаты антител могут быть использованы для доставки химических и/или биологических молекул. Типичные химические и/или биологические молекулы включают лекарственные вещества, обычно используемые для лечения синтетическими молекулами, бактериальный белковый токсин (например, дифтерийный токсин), растительный белковый токсин (например, рицин), низкомолекулярный токсин (например, ауристатин, гельданамицин, майтансиноид, калихеамицин, дауномицин, метотрексат, виндезин и тубулизин), аффинный лиганд, детекторный зонд (например, флуоресцентный зонд, радиоактивный зонд) и тому подобное (в том числе их комбинации).
Конъюгаты антитело-лекарственное вещество, которые были предложены до сих пор, получали путем связывания лекарственного фрагмента с множеством лизиновых групп антитела. Альтернативно, конъюгаты антитело-лекарственное вещество получали путем восстановления всех или части межцепочечных дисульфидных связей антитела или восстановления всех межцепочечных дисульфидных связей с последующим частичным окислением с получением таким образом свободных тиольных групп цистеина, и затем связыванием свободных тиольных групп цистеина с фрагментом лекарственного вещества.
Существующие методы получения, однако, имеют некоторые проблемы. Например, общий способ получения осложняется тем, что конъюгаты антитело-лекарственное вещество, полученные посредством существующих способов получения, не являются одинаковыми (гомогенными). Когда конъюгаты антитело-лекарственное вещество получали посредством связывания фрагмента лекарственного вещества с лизиновыми группами, получались различные типы и формы конъюгатов антитело-лекарственное вещество в связи с наличием многих групп лизина в молекуле антитела (например, 100 лизиновых групп на антитело). Аналогичным образом, когда получали конъюгаты антитело-лекарственное вещество посредством связывания тиольных групп с молекулой лекарственного вещества, получали смесь диастереомеров за счет связывания между тиоловыми группами и малеимидными группами. Например, если конъюгируется n молекул лекарства, получается смесь 2n стереоизомеров. Таким образом, когда распределение количества молекул лекарства равно 0-8 (например, когда восстанавливаются межцепочечные дисульфидные связи), получается смесь из 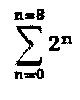 стереоизомеров. Кроме того, если i молекул лекарства конъюгируются с q сайтами, получается смесь из
стереоизомеров. Кроме того, если i молекул лекарства конъюгируются с q сайтами, получается смесь из 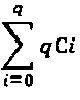 различных соединений.
различных соединений.
Кроме того, при получении конъюгатов антитело-лекарственное вещество посредством связывания лизиновых групп с молекулой лекарственного вещества, электрический заряд лизиновых групп может исчезнуть, в результате чего антитело потеряет свою уникальную антигенную специфичность. Аналогично, третичная или четвертичная структура антитела не может поддерживаться при получении конъюгатов антитело-лекарственное вещество при восстановлении дисульфидных связей, в результате чего антитело может инактивироваться или стать неспецифическим антителом. При получении конъюгатов антитело-лекарственное вещество с использованием связывания тиолов с малеимидом, лекарственное вещество может отщепиться (не специфически) от конъюгатов через, например, обратную реакцию.
Для преодоления проблем, связанных с известными способами получения, был предложен альтернативный метод, в котором аминокислотные группы в некоторых положениях антитела заменяются цистеиновыми группами. Хотя этот метод показывает лучший результат, чем предыдущие методы получения с точки зрения токсичности, активности и безопасности, этот способ еще включает связывание тиолов с малеимидом и, таким образом, он страдает из-за проблем с диастереомерами и неустойчивости, связанных со связыванием тиолов с малеимидом. Был предложен другой альтернативный метод, в котором селеноцистеиновые группы присоединялись к карбоксильным концам антитела.
В дополнение к использованию цистеиновых замен для контроля сайта конъюгации Ambrx Technology (http://www.ambrx.com) работает в направлении включения неприродных аминокислот в антитело, чтобы обеспечить функциональные группы, которые могут быть использованы для химии линкеров. Системы экспрессии Ambrx содержат синтетазы тРНК, которые аминоацилируют оригинальную тРНК неприродной аминокислотой, тем самым включая неприродную аминокислоту каждый раз, когда встречается амбер-стоп кодон.
Технология Redwood Bioscience в (http://www.redwoodbioscience.com) использует генетически закодированные альдегидные теги и предназначена для использования специфической последовательности, которая посттрансляционно узнается и модифицируется посредством фермента, т.е. фермента, образующего формилглицин, чтобы продуцировать так называемую альдегидную «химическую ручку». Включение последовательности CxPxR в определенных положениях в антитело обеспечивает средство для получения реакционноспособного альдегида способного к конъюгации с лекарственным веществом.
Тем не менее, ввиду вышеупомянутых проблем в этой области техники, относящихся к созданию конъюгатов антитело-лекарственное вещество, новые конъюгаты антитело-лекарственное вещество и новые способы получения конъюгатов антитело-лекарственное вещество весьма желательны.
Указанная информация представлена в данном разделе описания только для улучшения понимания уровня техники изобретения и, следовательно, она может содержать информацию, которая не образует предшествующий уровень техники, который уже является известным специалисту в данной области техники.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Как описано ниже, настоящее изобретение в общем представляет собой пример конъюгатов белок-активное вещество и способов изготовления конъюгатов белок-активное вещество. Изобретение также включает способы доставки конъюгата белок-активное вещество к клетке-мишени у субъекта, а также способы лечения субъекта, нуждающегося в активном веществе. Конъюгаты белок-активное вещество в соответствии с настоящим изобретением могут быть получены гомогенными и преимущественно используемыми для таргетного лечения заболевания.
В аспектах изобретение обеспечивает конъюгаты белок-активное вещество. В вариантах выполнения белок имеет аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы. В вариантах выполнения активное вещество ковалентно связано с белком в аминокислотном мотиве.
В вариантах выполнения белок имеет делецию на карбоксильном конце белка. В родственных вариантах выполнения модификация присоединяется к аминокислотному мотиву.
В вариантах выполнения белок имеет олигопептидную или полипептидную вставку на карбоксильном конце белка. В родственных вариантах выполнения модификация присоединяется к аминокислотному мотиву.
В вариантах выполнения белок имеет делецию на карбоксильном конце белка и олигопептидную или полипептидную вставку на карбоксильном конце белка. В родственных вариантах выполнения модификация присоединяется к аминокислотному мотиву.
В вариантах выполнения белок представляет собой антитело или фрагмент антигенного полипептида. В родственных вариантах выполнения белок представляет собой моноклональное антитело. В родственных вариантах выполнения по меньшей мере одна легкая цепь и/или по меньшей мере одна тяжелая цепь моноклонального антитела включает в себя аминокислотную область, имеющую аминокислотный мотив.
В любом из указанных выше аспектов или вариантов, изопреноид-трансфераза представляет собой FTase или GGTase.
В любом из указанных выше аспектов или вариантов выполнения активное вещество представляет собой лекарственное вещество, токсин, аффинный лиганд, детекторный зонд или их комбинацию.
В любом из указанных выше аспектов или вариантов выполнения, аминокислотный мотив представляет собой СААХ, ХХСС, ХСХС или СХХ, где С представляет собой цистеин, А представляет собой алифатическую аминокислоту и X представляет собой аминокислоту, которая определяет субстратную специфичность изопреноид-трансферазы.
В любом из указанных выше аспектов или вариантов выполнения аминокислотный мотив ковалентно связан с активным веществом через по меньшей мере один линкер. В родственных вариантах выполнения линкер представляет собой изопренильное производное, которое может быть распознано изопреноид-трансферазой.
В родственных вариантах выполнения линкер представляется следующей формулой (I):
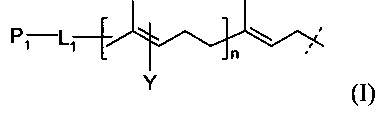
где P1 и Υ независимо представляют собой группу, содержащую первую функциональную группу (FG1), FG1 выбирается из группы, состоящей из: ацетилена, азида, альдегида, гидроксиламина, гидразина, кетона, нитробензофуразана (NBD), дансила, флуоресцеина, биотина и родамина,
L1 представляет собой (CH2)rXq(CH2)p,
X представляет собой кислород, серу, -NR1-, -C(O)NR1-, -NR1C(O)-, -NR1SO2-, -SO2NR1-, -(СН=СН)-, или ацетилен,
R1 представляет собой водород, С1-6-алкил, C1-6-алкил арил, или С1-6-алкил гетероарил,
r и p независимо представляют собой целое число от 0 до 6,
q представляет собой целое число от 0 до 1, и
n представляет собой целое число от 1 до 4.
В вариантах выполнения активное вещество присоединяется к группе, содержащей вторую функциональную группу (FG2), которая может реагировать с FG1. В родственных вариантах выполнения FG2 является ацетиленом, гидроксиламином, азидом, альдегидом, гидразином, кетоном или амином. В других родственных вариантах выполнения активное вещество присоединяется к группе, содержащей FG2 через -(CH2)rXq(CH2)p- или -[ZCH2CH2O(CH2CH2O)wCH2CH2Z]-, в которых
X представляет собой кислород, серу, -NR1-, -C(O)NR1-, -NR1C(O)-, -NR1SO2- или -SO2NR1-,
Ζ представляет собой кислород, серу или NR1,
R1 представляет собой водород, C1-6-алкил, C1-6-алкил арил, или C1-6-алкил гетероарил,
r и p независимо представляют собой целое число от 0 до 6,
q представляет собой целое число от 0 до 1, и
m представляет собой целое число от 0 до 6.
В еще дополнительных родственных вариантах выполнения -(CH2)rXq(CH2)p- или -[ZCH2CH2O(CH2CH2O)wCH2CH2Z]- присоединяется к (i) пептиду(ам), которые могут быть расщеплены катепсином В или (ii) а глюкурониду, который может быть расщеплен β-глюкуронидазой.
В вариантах выполнения пептид, который может быть расщеплен катепсином В, представляет собой
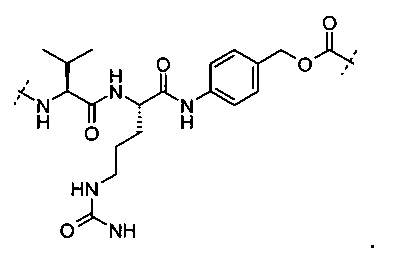
В вариантах выполнения глюкуронид, который может быть расщеплен β-глюкуронидазой представляет собой
В аспектах изобретение обеспечивает способы получения любого из конъюгатов белок-активное вещество, описанных в настоящем изобретении. В вариантах выполнения способы включают экспрессию белка, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы. В вариантах выполнения способы включают ферментативное взаимодействие с изопреноид-трансферазой экспрессированного белка и по меньшей мере одного изосубстрата, имеющего первую функциональную группу (FG1), с получением таким образом функционализированного белка. В вариантах выполнения способы включают присоединение второй функциональной группы (FG2) к активному веществу, с получением таким образом функционализированного активного вещества. В вариантах выполнения способы включают взаимодействие функционализированного белка с функционализированным активным веществом, с получением таким образом конъюгата белок-активное вещество.
В родственных вариантах выполнения аминокислотный мотив находится на карбоксильном конце белка.
В родственных вариантах выполнения аминокислотный мотив представляет собой СААХ, ХХСС, ХСХС или СХХ, где С представляет собой цистеин, А представляет собой алифатическую аминокислоту и X представляет собой аминокислоту, которая определяет субстратную специфичность изопреноид-трансферазы.
В родственных вариантах выполнения аминокислотный мотив представляет собой СААХ, и где способ дополнительно включает удаление ААХ из аминокислотного мотива после стадии (b).
В родственных вариантах выполнения FG2 присоединяется к активному веществу посредством по меньшей мере одного линкера.
В родственных вариантах выполнения реакция между функциональным белком и функционализированным активным веществом представляет собой реакцию клик-химии или образование гидразона и/или оксима. В вариантах выполнения FG1 представляет собой азидную группу, a FG2 представляет собой ацетиленовую группу. В вариантах выполнения FG1 представляет собой ацетиленовую группу, а FG2 представляет собой азидную группу. В вариантах выполнения FG1 представляет собой альдегидную или кетонную группу, a FG2 представляет собой гидразин или гидроксиламин. В вариантах выполнения FG1 представляет собой гидразин или гидроксиламин, a FG2 представляет собой альдегид или кетон.
В аспектах изобретение обеспечивает способы получения любого из конъюгатов белок-активное вещество, описанных в настоящем изобретении, и способы включают экспрессию белка, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы. В вариантах выполнения способы включают присоединение изосубстрата изопреноид-трансферазы в качестве активного вещества. В вариантах выполнения способы включают ферментативное взаимодействие с изопреноид-трансферазой экспрессированного белка и активного вещества, присоединенного к изосубстрату.
В родственных вариантах выполнения аминокислотный мотив находится на карбоксильном конце белка.
В родственных вариантах выполнения аминокислотный мотив представляет собой СААХ, ХХСС, ХСХС или СХХ, где С представляет собой цистеин, А представляет собой алифатическую аминокислоту и X представляет собой аминокислоту, которая определяет субстратную специфичность изопреноид-трансферазы.
В родственных вариантах выполнения изосубстрат присоединяется к активному веществу по меньшей мере посредством одного линкера.
В аспектах изобретение обеспечивает композиции, содержащие любой из конъюгатов белок-активное вещество, описанных в настоящем изобретении. В вариантах выполнения композиция представляет собой гомогенную смесь из конъюгата белок-активное вещество. В вариантах выполнения белок представляет собой антитело или фрагмент антигенного полипептида.
В аспектах изобретение предусматривает способы доставки активного вещества к клетке-мишени в субъекте. В вариантах выполнения способы включают введение по меньшей мере одного конъюгата белок-активное вещество или композиции, описанных в настоящем изобретении. В вариантах выполнения клетка-мишень представляет собой раковую клетку.
В аспектах изобретение обеспечивает способы лечения субъекта, нуждающегося в этом (т.е. который нуждается в активном веществе). В вариантах выполнения способы включают введение по меньшей мере одного из конъюгатов белок-активное вещество или композиции, описанных в настоящем изобретении. В вариантах выполнения субъект имеет рак. В вариантах выполнения субъект имеет инфекцию с патогенным агентом. Патогенный агент может быть вирусом, бактерией, грибком или паразитом.
В описанных выше конъюгатах белок-активное вещество, композициях и способах в некоторых вариантах выполнения активное вещество может быть иммуномодулирующим соединением, противоопухолевым средством, противовирусным средством, антибактериальным средством, противогрибковым средством или противопаразитарным средством.
Вышеуказанные и другие аспекты, признаки и преимущества настоящего изобретения будут очевидны из или описаны более подробно в прилагаемых чертежах, которые включены в и составляют часть этого описания, а также последующего подробного описания, которые вместе служат для объяснения в качестве примера принципов настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-GCVIM), полученного путем вставки GCVIM на С-конец тяжелой цепи Herceptin.
Фиг. 2 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-GCVIM), полученного путем вставки GCVIM на С-конец легкой цепи Herceptin.
Фиг. 3 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-G5CVIM), полученного путем вставки G5CVIM на С-конец тяжелой цепи Herceptin.
Фиг. 4 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-G5CVIM), полученного путем вставки G5CVIM на С-конец легкой цепи Herceptin.
Фиг. 5 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-G7CVIM), полученного путем вставки G7CVIM на С-конец тяжелой цепи Herceptin.
Фиг. 6 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-G7CVIM), полученного путем вставки G7CVIM на С-конец легкой цепи Herceptin.
Фиг. 7 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-G10CVIM), полученного путем вставки G10CVIM на С-конец тяжелой цепи Herceptin.
Фиг. 8 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-G10CVIM), полученного путем вставки G10CVIM на С-конец легкой цепи Herceptin.
Фиг. 9 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-HC-G10CVLL), полученного путем вставки G10CVLL на С-конец тяжелой цепи Herceptin.
Фиг. 10 показывает аминокислотную последовательность модифицированного антитела Herceptin (Herceptin-LC-G10CVLL), полученного путем вставки G10CVLL на С-конец легкой цепи Herceptin.
Фиг. 11 показывает SDS-PAGE гель, анализирующий модифицированное анти-сМЕТ антитело (анти-cMET-HC-G7CVIM), полученное посредством вставки G7CVIM на С-конец тяжелой цепи антитела анти-сМЕТ, модифицированное анти-сМЕТ антитело (анти-cMET-LC-G7CVIM), полученное посредством вставки G7CVIM на С-конец легкой цепи анти-сМЕТ антитела, модифицированное анти-сМЕТ антитело (анти-сМЕТ HC-G10CVIM), полученное посредством вставки G10CVIM на С-конец тяжелой цепи анти-сМЕТ антитела и модифицированное анти-сМЕТ антитело (анти-cMET-LC-G10CVIM), полученное посредством вставки G10CVIM на С-конец легкой цепи анти-сМЕТ антитела.
Фиг. 12 показывает SDS-PAGE гель, анализирующий пренилирование Herceptin-HC-GnCVIM с помощью FTase и NBD-GPP.
Фиг. 13 показывает SDS-PAGE гель, анализирующий пренилирование Herceptin-LC-GnCVIM с помощью FTase и NBD-GPP.
Фиг. 14 показывает SDS-PAGE гель, анализирующий пренилирование сМЕТ-НС-GnCVIM с помощью FTase и NBD-GPP.
Фиг. 15 показывает SDS-PAGE гель, анализирующий пренилирование cMET-LC-GnCVIM с помощью FTase и NBD-GPP.
Фиг. 16 показывает SDS-PAGE гель, анализирующий пренилирование Herceptin-HC-G10CVLL и Herceptin-LC-G10CVLL с помощью FTase/NBD-GPP или GGTase I/NBD-FPP.
Фиг. 17 показывает результаты ЖХ/МС анализа пренилированного Herceptin-LC-G7CVIM.
Фиг. 18 показывает результаты ЖХ/МС анализа пренилированного Herceptin-LC-G10CVIM.
Фиг. 19 показывает результаты ЖХ/МС и деконволиционного анализа масс-спектров LCB14-0104 (Herceptin-LC-G7CVIM-NC-MMAF-OMe).
Фиг. 20 показывает HIC-ВЭЖХ хроматограммы Herceptin-LC-G7CVIM, пренилированных Herceptin-LC-G7CVIM и LCB14-0101 (Herceptin-LC-G7CVIM-BG-MMAF).
Фиг. 21 показывает результаты из анти-пролиферативного анализа LCB14-0101 (Herceptin-LC-G7CVIM-BG-MMAF) с клеточными линиями рака молочной железы MCF-7, MDA-MB-468 и SK-BR-3.
Фиг. 22 показывает результаты анти-пролиферативного анализа LCB14-0102 (Herceptin-LC-G7CVIM-VC-MMAF-OMe) с клеточными линиями рака молочной железы MCF-7 и SK-BR-3.
Фиг. 23 показывает результаты анти-пролиферативного анализа LCB14-0103 (Herceptin-LC-G7CVIM-BG-MMAE) с клеточными линиями рака молочной железы MCF-7 и SK-BR-3.
Фиг. 24 показывает процесс посттрансляционной модификации белка (С-концевой CVIM).
Фиг. 25 показывает механизм высвобождения активных лекарственных веществ (за исключением нерасщепляемого линкера).
Фиг. 26 показывает химические структуры конъюгатов антитело-лекарственное вещество LCB14-0101, LCB14-0102, LCB14-0103 и LCB14-0104.
Фиг. 27 показывает схему, изображающую способ получения конъюгата белок-активное вещество с использованием изопреноид-трансферазы и ее изосубстрата, в котором алкилируется цистеин в мотиве СААХ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее будут подробно описаны варианты выполнения настоящего изобретения, примеры которых проиллюстрированы на прилагаемых чертежах далее, на которых одинаковые ссылочные позиции относятся к одинаковым элементам. Варианты выполнения описаны ниже для того, чтобы объяснить настоящее изобретение со ссылками на чертежи.
Определения
Посредством "агент" или "активное вещество" обозначаются любые низкомолекулярные химические соединения, антитела, молекулы нуклеиновой кислоты или полипептиды или их фрагменты. Примеры включают, но не ограничиваются этим, лекарственное вещество, токсин, аффинный лиганд, детекторный зонд или их комбинации.
Посредством "аналог" подразумевается молекула, которая не идентична, но имеет аналогичные функциональные или структурные особенности. Например, полипептидный аналог сохраняет биологическую активность, соответствующую природному полипептиду, в то же время обладая некоторыми биохимическими модификациями, которые улучшают функцию аналога по отношению к природному полипептиду. Такие биохимические модификации могут увеличить устойчивость аналога к протеазам, проницаемость через мембрану или период полураспада, не изменяя, например, связывание с лигандом. Аналог может включать в себя неприродную аминокислоту.
В настоящем изобретении "содержит", "содержащий", "включающий" и "имеющий" и т.п. могут иметь значение, указанное для них в патентном законодательстве США и могут обозначать «включает», «включающий» и тому подобное; «состоящий в основном из» или «в основном состоит» также имеет значение, описанное в патентном законодательстве США, и термин носит открытый характер, допуская присутствие большего, чем то, о чем рассказано, пока основные или новые особенности того, о чем рассказано, не изменены присутствием большего, чем то, о чем рассказано, но исключает варианты выполнения предшествующего состояния техники.
«Контактирование с клеткой» понимается в настоящем изобретении как доставка вещества к клетке, например, к клетке, подлежащей обработке в культуре, ex vivo или у животного, так чтобы вещество смогло бы взаимодействовать с клеткой (например, с клеткой, подлежащей лечению), потенциально могло быть поглощено клеткой, и оказывать воздействие на клетку. Вещество (например, адъювант) может быть доставлено в клетки непосредственно (например, путем добавления вещества в культуральную среду или путем инъекции в клетку или ткань, представляющих интерес), или путем доставки в организм с помощью местного или парентерального пути введения для доставки в клетку посредством сосудистого, лимфатического или другими способами. Специалист в данной области техники легко поймет, что введение конъюгатов белок-активное вещество в соответствии с настоящим изобретением субъекту включает контактирование конъюгата белок-активное вещество с клеткой субъекта.
«Болезнь» понимается как любое состояние или расстройство, которое повреждает или мешает нормальной функции клеток, тканей или органов.
Термины «эффективное количество», «терапевтически эффективное количество», «эффективная доза» или «терапевтически эффективная доза» относятся к такому количеству вещества, которое производит намеченный фармакологический, терапевтический или профилактический результат. Например, фармакологически эффективное количество приводит к предотвращению или задержке начала болезни, либо у индивидуума, либо что касается частоты заболевания в популяции. Более одной дозы может потребоваться, чтобы обеспечить эффективную дозу. Понятно, что эффективная доза в одной популяции может или не может быть достаточной во всех популяций. Таким образом, в связи с введением вещества или иммуногенной композиции, вещество или иммуногенная композиция является «эффективными против» заболевания или состояния, если введение в клинически приемлемым способом приводит к благотворному эффекту на по меньшей мере статистически значимой доли субъектов, такому как предотвращение начала заболевания, улучшение симптомов, лечение, сокращение признаков заболевания или симптомов, продление жизни, улучшение качества жизни или к другому эффекту, обычно рассматриваемому как положительный, врачами, знакомыми с лечением конкретного типа заболевания или состояния.
Под «усиливает» понимается положительное изменение по меньшей мере на 10%, 25%, 50%, 75%, 100% или любое число между ними.
"Фрагмент" означает часть молекулы полипептида или нуклеиновой кислоты. Эта часть содержит, предпочтительно по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% от всей длины молекулы сравнения нуклеиновой кислоты или полипептида. Фрагмент может содержать 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 нуклеотидов или аминокислот.
"Гибридизация" означает образование водородных связей, которые могут быть водородными связями Уотсона-Крика, Хугстина или обратными связями Хугстина между комплементарными нуклеотидными основаниями. Например, аденин и тимин являются комплементарными нуклеотидными основаниями этой пары через образование водородных связей.
"Получение" понимается в настоящем изобретении как изготовление, приобретение, синтезирование, выделение, очистка, или иным образом достижения обладания.
Выражение "фармацевтически приемлемый носитель, вспомогательное средство или разбавитель" является признанным в данной области техники и включает фармацевтически приемлемый материал, композицию или основу, пригодные для введения соединений в соответствии с настоящим изобретением млекопитающим. Как используется в настоящем изобретении, термин "фармацевтически приемлемый" означает, что будучи утвержденными регулирующими ведомствами федерального правительства или правительства штата или перечисленными в Фармакопеи США, Европейской Фармакопеи или другой общепризнанной Фармакопеи для применения у млекопитающих, например, людей.
"Уменьшает" означает отрицательное изменение по меньшей мере на 10%, 25%, 50%, 75%, 100% или любое число между ними.
"Эталон" подразумевает стандартные или контрольные условия.
«Образец», как используется в настоящем изобретении, относится к биологическому материалу, который выделен из окружающей среды (например, крови или ткани от животного, клетки или кондиционированных сред из тканевой культуры). В вариантах выполнения образец предположительно содержит, или известно, что содержит аналит, такой как белок, представляющий интерес (например, антитело, цитокин, и тому подобное). Образец также может быть частично очищенной фракцией из ткани или жидкости организма. Референтный образец может быть "нормальным" образцом, жидкостью от донора, не имеющего заболевания или состояния, или из нормальной ткани у субъекта, имеющего заболевание или состояние, или нелеченного субъекта (например, субъекта, нелеченного вакциной). Референтный образец также может быть взят в "нулевой момент времени", до контактирования клетки или субъекта, которые должны быть протестированы, с веществом или терапевтическим вмешательством.
«Специфически связывается» означает узнавание и связывание с мишенью (например, полипептидом, клеткой и т. п.), но который по существу не узнается и связывается другими молекулами в образце, например, в биологическом образце.
"Субъект", как используется в настоящем изобретении, относится к живому организму. В вариантах выполнения живой организм представляет собой животное. В вариантах выполнения субъектом является млекопитающее. В вариантах выполнения субъектом является одомашненное млекопитающее или примат, включая приматов, не являющихся человеком. Примеры субъектов включают, но не ограничиваются этим, человека, обезьян, собак, кошек, мышей, крыс, коров, лошадей, свиней, коз, овец и птиц. Субъект может также упоминаться как пациент.
Субъект «страдающий от или подозревается, как страдающий от» конкретного заболевания, состояния или синдрома имеет достаточное количество факторов риска или представляет достаточное количеством или комбинацию признаков или симптомов заболевания, состояния, или синдрома таких, что компетентный специалист будет в состоянии диагностировать или подозревать, что субъект страдает от заболевания, состояния или синдрома. Методы идентификации субъектов, страдающих или подозреваемых в страдании от заболевания или состояния, находится в пределах способности специалиста в данной области техники. Субъектов, страдающих и подозреваемых в страдании от конкретного заболевания, состояния или синдрома, не обязательно разделяются на две различные группы. Специалисту в данной области техники также легко понять, что субъект, нуждающийся в активном веществе, также может быть субъектом, страдающим от или предположительно страдающим от конкретного заболевания, состояния или синдрома.
Как используется в настоящем изобретении, термины "лечить", "лечение", "лечение", и т.п. относятся к сокращению или облегчению расстройства и/или симптомов, связанных с ними (например, рак или симптомы, связанные с раком). Следует иметь в виду, что, хотя это не исключается, лечение расстройства или состояния не требует, чтобы расстройство, состояние или симптомы, связанные с ним, полностью устранялись.
Диапазоны, обеспечиваемые в настоящем изобретении, понимаются как подразумевающие для всех значений в этом диапазоне. Например, диапазон от 1 до 50 понимается как включающий любое число, комбинации чисел или поддиапазон из группы, включающей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45,46, 47, 48, 49 или 50.
Если специально не оговорено или не очевидно из контекста, как используется в настоящем изобретении, термин "или" понимается включительно.
Если специально не оговорено или не очевидно из контекста, как это используется в настоящем изобретении, термины "a", "an" и "the" понимаются как в единственном, так во множественном числе.
Если специально не оговорено или не очевидно из контекста, как это используется в настоящем изобретении, термин "около" понимается как в диапазоне нормального предела допускаемой погрешности в данной области техники, например в интервале 2 стандартных отклонений от среднего значения. «Около» можно понимать как в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05% или 0,01 % от указанной величины. Если иное не ясно из контекста, все числовые значения, представленные в настоящем изобретении, не могут быть изменены термином «около».
Перечисление списка химических групп в любом определении переменной в настоящем изобретении, включает определения этой переменной как и любой единственной группы, так и комбинации перечисленных групп. Перечисление варианта выполнения для переменной или аспекта в настоящем изобретении включает этот вариант выполнения как любого единственного варианта выполнения, так и в комбинации с любыми другими вариантами выполнения или их частей.
Любые композиции или способы, представленные в настоящем изобретении, могут быть комбинированы с одним или более любыми другими композициями и способами, представленными в настоящем изобретении.
1. Способы получения конъюгатов белок-активное вещество
Способы получения конъюгатов белок-активное вещество в соответствии с настоящим изобретением и их варианты очевидны любому специалисту в данной области техники на основе раскрытия в соответствии с настоящим изобретением.
Ниже приводятся примеры способов, которые обеспечиваются посредством иллюстрации и не предназначены для ограничения настоящего изобретения.
Вариант выполнения 1
Способ получения конъюгата белок-активное вещество в соответствии с одним вариантом выполнения настоящего изобретения включает: (а) экспрессию белка, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы; (b) ферментативное взаимодействие с применением изопреноид-трансферазы, экспрессированного белка и по меньшей мере одного изосубстрата, имеющего первую функциональную группу (FG1), с получением, таким образом, функционализированного белка; (с) присоединение второй функциональной группы (FG2) к активному веществу с получением таким образом функционализированного активного вещества; и (d) взаимодействие функционализированного белка с функционализированным активным веществом, с получением таким образом конъюгата белок-активное вещество.
Термин «белок», используемый в настоящем изобретении, понимается как две или более независимо выбранными природных или неприродных аминокислоты, соединенные ковалентной связью (например, пептидной связью). Пептид может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более природных или неприродных аминокислот, соединенных пептидными связями. Полипептиды, как описано в настоящем изобретении, включают белки полной длины (например, процессированные белки), а также более короткие аминокислотные последовательности (например, фрагменты природных белков или синтетические полипептидные фрагменты).
Белок относится к олигопептидам или полипептидам, содержащим по меньшей мере один С-конец и по меньшей мере один N-конец. Используемый в настоящем изобретении термин включает интактный олигопептид или полипептид, модифицированную их форму, их фрагмент, а также их аналоги. Например, термин может относиться к олигопептиду или полипептиду, или олигопептиду или полипептиду, модифицированным путем присоединения к ним аминокислотной последовательности, которая может быть распознана с помощью изопреноид-трансферазы. Термин «фрагмент», используемый в настоящем изобретении, относится к части аминокислотной последовательности, состоящей из олигопептида или полипептида. Используемый в настоящем изобретении термин включает часть аминокислотной последовательности, имеющей субстратную специфичность олигопептида или полипептида. Термин «аналог» относится к олигопептиду или полипептиду, имеющим последовательность, идентичную по меньшей мере на 70% или 75%, по меньшей мере на 80% или 85%, по меньшей мере на 90%, 91%, 92%, 93%, 94% или 95% или по меньшей мере на 96, 97%, 98% или 99% с референтным олигопептидом или полипептидом.
Термин «белок», используемый в настоящем изобретении, также включает антитело, фрагмент антигенного полипептида, или аналог, или его производное. Термин «антитело» означает молекулу иммуноглобулина, которая распознает и специфически связывается с мишенью, такой как белок, полипептид, пептид, углевод, полинуклеотид, липиды или комбинации вышеуказанного через по меньшей мере один сайт узнавания антигена в вариабельной области молекулы иммуноглобулина. Как используется в настоящем изобретении, термин «антитело» включает интактные поликлональные антитела, интактные моноклональные антитела, фрагменты антител (например, Fab, Fabʹ, F(abʹ)2, Fd и Fv фрагменты), одноцепочечные мутанты Fv (scFv), мультиспецифические антитела, такие как биспецифические антитела, полученные от по меньшей мере из двух интактных антител, химерные антитела, гуманизированные антитела, человеческие антитела, слитые белки, содержащие антигенную детерминанту антитела, и любая другая модифицированная молекула иммуноглобулина, содержащая сайт узнавания антигена тех пор, пока антитело проявляют желаемую биологическую активность. Антитело может быть любым из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG, IgM или их подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IGA1 и IgA2), на основе идентичности константных доменов их тяжелых цепей, называемых альфа, дельта, эпсилон, гамма и мю, соответственно. Различные классы иммуноглобулинов имеют различные и хорошо известные структуры субъединиц и трехмерных конфигураций.
Термин «фрагмент антитела» относится к части интактного антитела и относится к антиген-определяющей вариабельной области интактного антитела. Примеры фрагментов антител включают, но не ограничиваются этим, Fab, Fabʹ, F(abʹ)2, Fd и Fv фрагменты, линейные антитела, одноцепочечные антитела и мультиспецифические антитела, образованные из фрагментов антител.
«Моноклональное антитело» относится к популяции гомогенных антител, участвующих в высокоспецифическом распознавании и связывании единственной антигенной детерминанты, или эпитопа. Оно отличается от поликлональных антител, которые обычно включают различные антитела, направленные против различных антигенных детерминант. Термин "моноклональное антитело" охватывает как интактные, так и полноразмерные моноклональные антитела, а также фрагменты антител (например, Fab, Fabʹ, F(abʹ)2, Fd и Fv), одноцепочечные мутанты (scFv), слитые белки, содержащие часть антитела, а также любой другой модифицированной молекулы иммуноглобулина, содержащей сайт узнавания антигена. Кроме того, «моноклональное антитело» относится к таким антителам, производимым в любом количестве способами, включая, но не ограничиваясь этим посредством гибридомы, фаговой селекцией, рекомбинантной экспрессии и посредством трансгенных животных.
Термин «гуманизированное антитело» относится к формам нечеловеческих (например, мышиных) антител, которые представляют собой специфические иммуноглобулиновые цепи, химерные иммуноглобулины или их фрагменты, которые содержат минимальные, не являющееся человеческими (например, мышиные) последовательности. Как правило, гуманизированные антитела представляют собой иммуноглобулины человека, в которых остатки из области, определяющей комплементарность (CDR), заменены остатками из CDR из не относящихся к человеку видов (например, мыши, крысы, кролика, хомячка), которые обладают необходимой специфичностью, аффинностью и функциональными возможностями (Jones et al., 1986, Nature, 321: 522-525; Riechmann et al., 1988, Nature, 332: 323-327; Verhoeyen et al., 1988, Science, 239: 1534-1536). В некоторых случаях остатки каркасной области Fv (FR) человеческого иммуноглобулина заменяются соответствующими остатками в антителах от нечеловеческого вида, который обладает нужной специфичностью, аффинностью и функциональными возможностями. Гуманизированное антитело может быть дополнительно модифицировано посредством замены дополнительного остатка либо в каркасной области Fv и/либо в пределах замененных нечеловеческих остатков для уточнения и оптимизации специфичности, аффинности антитела, и/или функциональных возможностей. В общем, гуманизированное антитело будет содержать по существу все из по меньшей мере одного, а обычно двух или трех, вариабельных доменов, содержащих все или по существу все области CDR, которые соответствуют нечеловеческому иммуноглобулину, в то время как все или по существу все области FR являются областями консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело может также содержать по меньшей мере часть константной области иммуноглобулина или домена (Fc), обычно человеческого иммуноглобулина. Примеры способов, используемых для получения гуманизированных антител, описаны в патенте США No. 5225539.
Термин «человеческое антитело» означает антитело, продуцируемое человеком, или антитело, имеющее аминокислотную последовательность, соответствующую антителу, продуцируемого человеком, с использованием любого метода, известного в данной области техники. Это определение человеческого антитела включает интактные или полноразмерные антитела, их фрагменты, и/или антитела, содержащие по меньшей мере одну человеческую тяжелую и/или легкую полипептидную цепь, такие как, например, антитело, содержащее полипептиды мышиной легкой цепи и человеческой тяжелой цепи.
Термин «химерные антитела» относится к антителам, в которых аминокислотная последовательность молекулы иммуноглобулина получена от двух или более видов. Как правило, вариабельная область как легких, так и тяжелых цепей соответствует вариабельной области антител, полученных из одного вида млекопитающих (например, мыши, крысы, кролика и т.д.) с желаемой специфичностью, аффинностью и функциональными возможностями, в то время как константные области гомологичны последовательностям в антителах, полученных от другого вида (как правило, человека), чтобы избежать формирования иммунного ответа у этого вида.
Термин «эпитоп» или «антигенная детерминанта» используются в настоящем изобретении взаимозаменяемо и относятся к той части антигена, которая может распознаваться и специфически связываться посредством конкретного антитела. Когда антиген представляет собой полипептид, эпитопы могут быть сформированы как из смежных аминокислот, так и несмежных аминокислот, расположенных рядом в третичной структуре белка. Эпитопы, образованные из смежных аминокислот, как правило, сохраняются при денатурации белка, тогда как эпитопы, образованные третичной структурой, как правило, теряются при денатурации белка. Эпитоп обычно включает в себя по меньшей мере 3, по меньшей мере 5 или по меньшей мере 8-10 аминокислот в уникальной пространственной конформации.
То, что антитело «специфически связывается» с эпитопом или антигенной молекулой означает, что антитело реагирует или ассоциируется более часто, более быстро, с большей длительностью, с большим сродством или с некоторой комбинацией вышеперечисленного с эпитопом или антигенной молекулой, чем с альтернативным веществом, включая неродственные белки. В некоторых вариантах выполнения «специфически связывается» означает, например, что антитело связывается с белком с KD около 0,1 мМ или менее, но более обычно менее чем около 1 мкМ. В некоторых вариантах выполнения «специфически связывается» означает, что антитело связывается с белком иногда с KD по меньшей мере около 0,1 мкМ или менее, а в других случаях по меньшей мере приблизительно 0,01 мкМ или менее. Из-за идентичности последовательностей между гомологичными белками в различных видах, специфическое связывание может включать в себя антитело, которое распознает конкретный белок в более чем одном виде. Понятно, что антитело или связывающий фрагмент, который специфически связывается с первой мишенью, может или не может специфически связываться со второй мишенью. Таким образом, «специфическое связывание» не обязательно требует (хотя он может включать в себя) эксклюзивного связывания, то есть связывания с единственной мишенью. Как правило, но не обязательно, ссылка на связывание означает специфическое связывание.
Антитела, включая фрагменты/их производные и моноклональные антитела, могут быть получены с использованием известных способов в данной области техники (см. McCafferty et al., Nature 348: 552-554 (1990); Clackson et al., Nature 352: 624-628; Marks et al., J. Mol. Biol. 222: 581-597 (1991); Marks et al., Bio/Technology 10:779-783 (1992); Waterhouse et al., Nucleic. Acids Res. 21: 2265-2266 (1993); Morimoto et al., Journal of Biochemical and Biophysical Methods 24: 107-117 (1992); Brennan et al., Science 229: 81(1985); Carter et al., Bio/Technology 10: 163-167 (1992); Kohler et al., Nature 256: 495 (1975); U.S. Pat. No. 4,816,567); Kilpatrick et al., Hybridoma 16(4): 381-389 (1997); Wring et al, J. Pharm. Biomed. Anal. 19(5): 695-707 (1999); Bynum et al., Hybridoma 18(5): 407-411 (1999), Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255-258 (1993); Bruggemann et al., Year in Immuno. 7: 33 (1993); Barbas et al., Proc. Nat. Acad. Sci. USA 91: 3809-3813 (1994); Schier et al., Gene 169: 147-155 (1995); Yelton et al., J. Immunol. 155: 1994-2004 (1995); Jackson et. al., J. Immunol. 154(7): 3310-9 (1995); Hawkins et al., J. Mol. Biol. 226: 889-896 (1992), патенты США №5514548, 5545806, 5569825, 5591669, 5545807; WO 97/17852, все из которых включены в настоящее изобретение посредством ссылки в полном объеме).
Неограничивающие примеры антитела включают, но не ограничиваются этим, муромонаб-CD3 абциксимаб, ритуксимаб, даклизумаб, паливизумаб, инфликсимаб, трастузумаб, этанерцепт, базиликсимаб, гемтузумаб озогамицин, алемтузумаб, ибритумомаб тиуксетан, адалимумаб, алефацепт, омализумаб, эфализумаб, тозитумомаб-I131, цетуксимаб, бевацизумаб, натализумаб, ранибизумаб, панитумумаб, эколизумаб, рилонацепт, цертолизумаб пегол, ромиплостим, AMG-531, CNTO-148, CNTO-1275, АВТ-874, LEA-29Y, белимумаб, TACI-Ig, 2nd ген. анти-CD2O, ACZ-885, тоцилизумаб (атлизумаб), меполизумаб, пертузумаб, Humax CD2O, СР-675, 206 (тицилимумаб), MDX-010, IDEC-114, инотузумаб озогамицин, HuMax EGFR, афлиберцепт, VEGF Trap-Eye, HuMax-CD4, Ala-Ala, ChAglyCD3; TRX4, котумаксомаб, IGN101, MT-201, преговомаб, СН-14.18, WX-G250, AMG-162, AAB-001, мотавизумаб; MEDI-524, эфумгумаб, Aurograb®, раксибакумаб, 3rd ген. анти-CD20, LY2469298, велтузумаб.
В некоторых вариантах выполнения, когда белок представляет собой моноклональное антитело, по меньшей мере одна легкая цепь моноклонального антитела, по меньшей мере одна тяжелая цепь моноклонального антитела, или обе могут содержать аминокислотную область, имеющую аминокислотный мотив, который может быть распознан изопреноид-трансферазой.
В вариантах выполнения С-конец легкой или тяжелой цепи модифицируется. Кроме того, СН2 области Fc области могут быть гликозилированы.
В некоторых вариантах выполнения С-конец белка (фрагмент, аналог или производное), может быть присоединен к аминокислотному мотиву, который может быть распознан изопреноид-трансферазой. В других вариантах выполнения С-конец может быть модифицирован. Модификация может быть (i) делецией на карбоксильном конце белка, (ii) вставкой олигопептида или полипептида на карбоксильном конце белка, или (iii) делецией на карбоксильном конце белка и вставкой олигопептида или полипептида на карбоксильном конце белка. В родственных вариантах выполнения модификацией может быть присоединением к аминокислотному мотиву.
Термин «изопреноид-трансфераза», используемый в настоящем изобретении, относится к ферменту, который может распознавать определенный аминокислотный мотив на или вблизи С-конца белка и осуществлять селективное алкилирование в положении (положениях) тиола остатка(ов) цистеина определенного аминокислотного мотива посредством присоединения изопреноидной единицы(ц) к белку, несущему определенный аминокислотный мотив.
Примеры изопреноид-трансферазы включают фарнезилтрансферазу (FTase) и геранилгеранилтрансферазу (GGTase), которые включают перенос фарнезильного или геранилгеранильного фрагментов на С-концевой цистеин(ы) белка-мишени, соответственно. GGTase может быть классифицирована на GGTase I и GGTase II. FTase и GGTase I могут распознавать СААХ-мотив, a GGTase II может распознавать ХХСС, ХСХС или СХХ-мотивы, в которых С представляет собой цистеин, А представляет собой алифатическую аминокислоту и X представляет собой аминокислоту, которая определяет субстратную специфичность изопреноид-трансферазы (Nature Rev. Cancer 2005, 5(5), pp. 405-12; Nature Chemical Biology, 2010, 17, pp. 498-506; Lane KT, Bees LS, Structural Biology of Protein of Farnesyltransferase and Geranylgeranyltransferase Type I, Journal of Lipid Research, 47, pp. 681-699 (2006); Patrick J. Kasey, Miguel C. Seabra; Protein Prenyltransferases, The Journal of Biological Chemistry, Vol. 271, No. 10, Issue of March 8, pp. 5289-5292 (1996), содержание этих источников включены в настоящее изобретение посредством ссылки во всей их полноте).
В настоящем изобретении, могут быть использованы изопреноид-трансферазы из различных источников, например, людей, животных, растений, бактерий, вирусов и т.п. В некоторых вариантах выполнения могут быть использованы встречающиеся в природе изопреноид-трансферазы. В некоторых других вариантах выполнения могут быть использованы природные или искусственно модифицированные изопреноид-трансферазы. Например, изопреноид-трансферазы, имеющие по меньшей мере одну естественно измененную аминокислотную последовательность (включая пост-трансляционную модификацию), естественно или искусственно укороченную форму в природной изопреноид-трансферазы, изопреноидную трансферазу, которая была модифицирована посредством по меньшей мере одним из (His)-tag, GST, GFP, МВР, СВР, Iospeptag, BCCP, Мус-tag, Calmodulin-tag, FLAG-tag, HA-tag, тег мальтозу связывающего белка, Hyc-tag, глутатион-8-трансферазы-тег, тег зеленого флуоресцентного белка, Thioredoxin-tag, S-tag, Softag 1, Softag 3, Strep-tag, SBP-tag, Ту tag и тому подобное.
Изопреноид-трансферазы могут распознавать изосубстрат, также как субстрат. Изосубстрат относится к субстратному аналогу, который имеет модификацию в субстрате. Изопреноид-трансферазы алкилируют определенные аминокислотные мотивы (например, мотив СААХ) на С-конце белка (Benjamin P. Duckworth et al, ChemBioChem 2007, 8, 98; Uyen Т.Т. Nguyen et al, ChemBioChem 2007, 8, 408; Guillermo R. Labadie et al, J. Org. Chem. 2007, 72(24), 9291; James W. Wollack et al, ChemBioChem 2009, 10, 2934, содержание которых включено в настоящее описание посредством ссылки). Функционализированный белок может быть продуцирован с использованием изопреноид-трансферазы и изосубстрата через алкилирование у С-концевого цистеина(ов).
Например, остаток цистеина из С-концевого мотива СААХ может быть подвергнут взаимодействию с изосубстратом с использованием изопреноид-трансферазы. В некоторых случаях ААХ затем может быть удален с помощью протеазы. Образовавшийся цистеин может быть метилирован на карбоксильном конце с помощью фермента (Iran Μ. Bell, J. Med. Chem. 2004, 47(8), 1869, которая включена в настоящее описание посредством ссылки).
В случае некоторых белков, цистеинилирование и глутатионилирование через образование дисульфидных связей может произойти вследствие посттрансляционной модификации. Такая дисульфидная связь, однако, может быть восстановлена, если такое алкилирование происходит посредством изопреноид-трансфераз.
Белки согласно настоящему изобретению могут быть изготовлены с использованием любого метода молекулярной биологии или клеточной биологии, хорошо известных в данной области техники. Например, могут быть использованы способы временной трансфекции. Генетические последовательности, кодирующие определенный аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы, может быть вставлен в известный плазмидный вектор с использованием стандартных технологий ПЦР, так чтобы экспрессировать белок (его фрагмент или аналог), имеющий определенный аминокислотный мотив на своем С-конце. Таким образом, белок, имеющий по меньшей мере один аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы, может быть экспрессирован. Экспрессированный белок может быть затем подвергнут ферментативному взаимодействию с изосубстратом изопреноид-трансферазы с использованием изопреноид-трансферазы для получения функционализированного белка. Изосубстрат содержит функциональную группу.
После того, как белок, имеющий аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы, экспрессируется, он может ферментативно реагировать с использованием изопреноид-трансферазы и по меньшей мере одного изосубстрата, имеющего первую функциональную группу (FG1) с получением таким образом функционализированного белка.
Термин «функциональная группа», используемый в настоящем изобретении, относится к группе, которая может привести, например, к реакциям 1,3-биполярного циклоприсоединения, гетеро-реакциям Дильса, реакциям нуклеофильного замещения (например, реакцию раскрытия кольца гетероциклическим электрофилом такими как эпоксид, азиридин, циклический сульфат и азиридий), неальдольному типу карбонильных реакций (например, образование оксимовых эфиров, мочевины, тиомочевины, ароматических гетероциклов, гидразонов и амидов), присоединению к углерод-углеродным кратным связям, реакциям окисления (например, эпоксидирование, азиридинирования и присоединению сульфенилгалогенидов), и клик-химии. Функциональная группа может включать в себя, но не ограничиваются этим, флуоресцентный тэг, триазол, малеимид, а также радиоизотоп (Angew. Chem. Int. Ed. 2001, 40, 2004-2021; Drug Discovery Today, 2003, 8(24), 1128-1137; Chem. Rev. 2008, 108, 2952-3015, содержание которых включено в настоящее описание посредством ссылки). В вариантах выполнения, функциональная группа может быть ацетиленовой группой и азидной группой.
Функциональная группа может быть присоединена к белку или активному веществу через по меньшей мере один линкер. В некоторых вариантах выполнения линкер представляет собой линейный линкер. В некоторых других вариантах выполнения линкер представляет собой разветвленный линкер. Когда связь осуществляется разветвленным линкером, активные агенты могут быть прикреплены ко всем ветвям. Каждая ветвь может иметь одинаковые или разные активные вещества. В некоторых вариантах выполнения линкер может быть расщепляемым. В некоторых других вариантах выполнения он может быть нерасщепляемым.
В некоторых вариантах выполнения функционализированное активное вещество производится посредством присоединения второй функциональной группы (FG2) к активному веществу. Примеры активных веществ включают, но не ограничиваются этим, лекарственное вещество, токсин, аффинный лиганд, детекторный зонд или их комбинации.
Примеры лекарственных средств включают, но не ограничиваются этим, эрлотиниба (TARCEVA; Genentech/OSI Pharm), бортезомиб (VELCADE; MilleniumPharm), фулвестрант (FASLODEX; AstraZeneca), сутент (SU11248; Pfizer), летрозол (FEMARA; Novartis), мезилат иматиниба (GLEEVEC; Novartis), PTK787/ZK 222584 (Novartis), оксалиплатин (Eloxatin; Sanofi), 5-фторурацил (5-ФУ), лейковорин, рапамицин (Sirolimus, Rapamune; Wyeth), лапатиниб (Tykerb, GSK572016; GlaxoSimthKline), лонафарниб (SCH 66336) сорафениб (BAY43-9006; Bayer Labs), гефитиниб (IRESSA; Astrazeneca), AG1478, AG1571 (SU 5271; Sugen), алкилирующие агенты, такие как тиотепа и циклофосфамид CYTOXAN®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимин и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карцелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатина; дуокармицин (включая синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодистин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлоретамин, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацилмустард (uracil mustard); нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма 1 I и калихеамицин омега I1 (см., например, Agnew, Chem Intl ed Engl., 33: 183-186 (1994)) и динемицин, включая динемицин; бисфосфонат, такие как клодронат; эсперамицином, хромофор неокарзиностатина и хромофоры родственных хромопротеиновых энедииновых антибиотиков, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и, липосомальный доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин и зорубицина; антиметаболиты, такие, как 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги такие, как флударабин, 6-меркаптопурин, тиамиприн, и тиогуанин; аналоги пиримидина, такие, как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; и андрогены, такие, как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, и тестолактон; антиадренергические вещества, такие, как аминоглютетимид, митотан, трилостан; и вещества, пополняющие содержание фолиевой кислоты, такое, как фолиновая кислота; ацеглатон; альдофосфамид гликозид, аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиниум ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лентинан; майтанзиноиды такие, как майтансин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, Oreg.); разоксан; ризоксин; сизофиран; спирогеманий; тенуазоновую кислоту; триазикон; 2,2ʹ,2ʹʹ-трихлортриэтиламин; трихотецены (особенно Т-2 токсин, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ('Ара-С'); циклофосфамид; тиотепа; таксоиды, например, TAXOL® паклитаксел (Bristol-Myers Squibb Oncology, Princeton, N.J.) ABRAXANE™ без кремофора, композиция наночастиц паклитаксела на основе альбумина (American Pharmaceutical Partners, Schaumber, I11.), и TAXOTERE® доксетаксель (Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; аналоги платины, такие, как цисплатин, карбоплатин; винбластин; платина; этопозид, ифосфамид; митоксантрон; винкристин; NAVELBINE® винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДФМО); ретиноиды, такие, как ретиноевая кислота; капецитабин; и их фармацевтически приемлемые соли, сольваты, кислоты или их производные.
Дополнительные лекарственные вещества включают, но не ограничиваются этим, (i) анти-гормональные средства, которые действуют, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы рецептора эстрогена (SERMs), включая, например, тамоксифен (включая NOLVADEX® тамоксифен), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FAREATON®; (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует продукцию эстрогена в надпочечниках, таких как, например, 4(5)-имидазолы, аминоглютетимид, MEGASE® мегестролацетат, AROMASIN® экземестан, FEMARA® летрозол, и ARIMIDEX® анастрозол; (iii) антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; а также троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); (iv) ингибиторы ароматазы; (v) ингибиторы протеинкиназы; (vi) ингибиторы липидкиназы; (vii) антисмысловые олигонуклеотиды, в частности такие, которые ингибируют экспрессию генов, вовлеченных в пути сигнализации при аберрантной пролиферации клеток, такие как, например, РКС-альфа, Raf, H-Ras, (viii), рибозим, например, VEGF-ингибитор, такие как ингибиторы ANGIOZYME-рибозима и ингибиторы экспрессии HER2; (ix) вакцины, такие как вакцины для генной терапии; ALLOVECTIN®-вакцина, LEUVECTIN-вакцина и VAXID-вакцина; PROLEUKIN®rlL-2; LURTOTECAN® ингибитор топоизомеразы 1, ABARELIX® rmRH; (x) анти-ангиогенный агент, такой как Bevacizumab (AVASTIN, Genentech); и (xi) фармацевтически приемлемые соли, сольваты, кислоты или их производные.
В некоторых вариантах выполнения цитокины могут быть использованы в качестве лекарственного вещества. Цитокины представляют собой небольшие белковые молекулы клеточной сигнализации, которые секретируются многочисленными клетками и представляют собой категорию сигнальных молекул, широко используемых в межклеточной коммуникации. Они включают в себя монокины, лимфокины, традиционные полипептидные гормоны и им подобные. Примеры цитокинов включают, но не ограничиваются этим, ростовой гормон, такой как человеческий гормон роста, N-метионил гормон роста человека и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (ФСГ), тиреостимулирующий гормон (ТТГ) и лютеинизирующий гормон (LH); печеночный фактор роста, фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухоли -α и -β; мюллерова ингибирующая субстанция; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как NGF-β; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие TGF-α и TGF-β; инсулиноподобный рост фактор-1 и -II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный CSF (G-CSF); интерлейкины (ILs), такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухолей, такой как TNF-α и TNF-β, а также другие полипептидные факторы, включая LIF и kit ligand (KL). Как используется в настоящем изобретении, термин цитокин включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с природной последовательностью.
Термин «токсин» относится к ядовитым веществам, продуцируемым в живых клетках или организмах. Токсины могут быть небольшими молекулами, пептидами или белками, которые способны вызывать заболевание при контакте с или поглощением тканями тела, взаимодействующими с биологическими макромолекулами, такими как фермент или клеточные рецепторы. Токсины включают растительные токсины и токсины животных. Примеры токсинов животных включают, но не ограничиваются этим, дифтерийный антитоксин, ботулинический токсин, столбнячный антитоксин, дизентерийный токсин, холерный токсин, тетродотоксин, бреветоксин, сигуатоксин. Примеры растительных токсинов включают, но не ограничиваются этим, рицин и АМ-токсин.
Примеры низкомолекулярных токсинов включают, но не ограничиваются этим, ауристатин, гельданамицин (Kerr et al., 1997, Bioconjugate Chem. 8(6): 781-784), майтанзиноиды (ЕР 1391213, ACR 2008, 41, 98-107), калихеамицин (US 2009105461, Cancer Res. 1993, 53, 3336-3342), дауномицин, доксорубицин, метотрексат, виндезин, SG2285 (Cancer Res. 2010, 70 (17), 6849-6858), доластатин, аналог доластатина ауристатин (US 563548603), криптофицин, камптотецин, производные ризоксина, аналоги или производные СС-1065, дуокармицин, энедииновые антибиотики, эсперамицин, эпотилон и анатоксины. Токсины могут проявлять цитотоксичность и ингибирующую активность к росту клеток посредством связывания с тубулином, связывания с ДНК, подавления топоизомеразы и тому подобное.
Термин «лиганд» относится к молекуле, которая может образовывать комплекс с биомолекулой-мишенью. Пример лиганда представляет собой молекулу, которая присоединяется в заданном положении белка-мишени и передает сигнал. Он может быть субстратом, ингибитором, стимулирующим агентом, нейромедиатором или радиоизотопом.
«Детектируемый остаток» или «метка» относится к композиции, обнаруживаемой спектроскопическими, фотохимическими, биохимическими, иммунохимическими, радиоактивными или химическими средствами. Например, полезные метки включают 32Р, 35S, флуоресцентные красители, электронно-плотные реагенты, ферменты (например, как правило, используемые в ELISA), биотин-стрептавидин, диоксигенин, гаптены и белки, для которых доступны антисыворотки или моноклональные антитела, или молекулы нуклеиновых кислот с последовательностью, комплементарной мишени. Детектируемый остаток часто генерирует измеряемый сигнал, например радиоактивный, хромогенный или флуоресцентный сигнал, который может быть использован для определения количества связанного детектируемого остатка в образце. Количественное определение сигнала достигается, например, посредством сцинтилляционного счетчика, денситометрии, проточной цитометрии, ELISA или прямого анализа с помощью масс-спектрометрии интактных или впоследствии расщепленных пептидов (один или несколько пептидов могут быть оценены). Специалисты в данной области техники знакомы с методами введения метки в соединения, представляющие интерес, и со средствами для обнаружения. Такие методики и способы являются общепринятыми и хорошо известны в данной области техники.
Термин «зонд», используемый в настоящем изобретении, относится к материалу, который может: (i) обеспечить обнаруживаемый сигнал; (ii) может взаимодействовать с первым зондом или со вторым зондом, модифицируя детектируемый сигнал, обеспечиваемый первой или второй меткой, такой как резонансный перенос энергии флуоресценции (FRET); (iii) может стабилизировать взаимодействие с антигеном или лигандом или увеличить аффинность связывания; (iv) может влиять на электрофоретическую подвижность или эффективность внедрения в клетку посредством физического параметра, такого как заряд, гидрофобность и т.д.; или (v) контролировать сродство лиганда, связывание антиген-антитело или образование ионного комплекса.
После того как функционализированный белок и функционализированное активное вещество получены, они взаимодействуют друг с другом, тем самым продуцируя конъюгат белок-активное вещество. В вариантах выполнения реакция между функционализировынным белком и функционализированным активным веществом может быть реакцией клик-химии или через образование гидразона и/или оксима. В вариантах выполнения FG1 представляет собой азидную группу и FG2 представляет собой ацетиленовую группу или наоборот. В других вариантах выполнения FG1 может быть альдегидной или кетонной группой, a FG2 представляет собой гидразин или гидроксиламин или наоборот.
Реакции клик-химии проводятся в мягких условиях, что делает возможным легко обрабатывать белки. Реакция клик-химии показывает очень высокую реакционную специфичность. Таким образом, даже если белок имеет другие функциональные группы (например, в остатке боковой цепи или на С-конце или на N-конце), эти функциональные группы не влияет на реакцию клик-химии. Например, реакция клик-химии между ацетиленовой группой и азидной группой белка может происходить в то время как другие функциональные группы белка не влияют на реакцию клик-химии. Кроме того, реакция клик-химии может специфически происходить без влияния какого-либо типа участвующего лиганда. В некоторых случаях лиганд может быть выбираться для улучшения общей эффективности реакции. Например, азид-ацетиленовая клик-химия может продуцировать триазол с высоким выходом (Rhiannon K. Iha et al, Chem. Rev. 2009, 109, 5620; Morten Meldal and Christian Wenzel Tornoe, Chem Rev., 2008, 108, 2952; Hartmuth C. Kolb et al, Angew. Chemie Int. Ed. Engl., 2001, 40, 2004, все из которых включены в настоящее описание посредством ссылки).
Азидные и ацетиленовые группы являются функциональными группами, которые не встречаются в аминокислотных последовательностей природных белков. Если реакция конъюгации происходит с использованием этих функциональных групп, ни один из остатков боковой цепи и ни N-концевые, ни С-концевые функциональные группы не подвергаются воздействию реакции клик-химии. Соответственно, может быть получен конъюгат белок-активное вещество, в котором активное вещество конъюгировано в нужном положении(ях).
Когда белок представляет собой антитело, все или часть антитела могут быть восстановлены до единственной цепи во время алкилирования с помощью изопреноид-трансферазы. Единственная цепь может быть окислена с образованием H2L2-формы антитела благодаря используемому окислителю, в реакции клик-химии.
Поскольку антитело имеет четыре цепи (2Н + 2L), алкилирование может происходить в от 1 до 4 положениях на антитело. Количество (молекул) активных веществ может быть больше чем 4, так как множество (молекул) активных веществ может быть присоединено к линкеру.
В некоторых вариантах выполнения, когда аминокислотный мотив, который может быть разпознан изопреноид-трансферазой, является СААХ, способ может дополнительно включать в себя удаление ААХ. В других вариантах выполнения способ может дополнительно включать присоединение метальной группы на С-конец после удаления ААХ (Journal of Lipid Research, 2006, 47, 681-699, который включен в настоящее изобретение посредством ссылки).
Вариант выполнения 2
Способ получения конъюгата белок-активное вещество согласно другому варианту выполнения включает: (а) экспрессию белка, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы; (b) присоединение изосубстрата изопреноид-трансферазы в качестве активного вещества; и (с) ферментативное взаимодействие с использованием изопреноид-трансферазы, экспрессированного белка с активным веществом, присоединенным к изосубстрату.
В этом варианте выполнения, как только белок, имеющий аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы, экспрессируется, белок взаимодействует с активным веществом, присоединенным к изосубстрату изопреноид-трансферазы. В этом случае может произойти конъюгация тиол-малеимид. Однако, даже если тиол-малеимидная конъюгация произойдет, активные вещества конъюгируют в намеченные положения только в соответствии с настоящим изобретением. Соответственно, проблема, связанная с предшествующим уровнем техники, заключающаяся в том, что образуется неоднородная смесь, преодолевается.
2. Конъюгаты белок-активное вещество
В другом аспекте настоящее изобретение обеспечивает конъюгат белок-активное вещество, содержащее белок, имеющий аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы, где активное вещество ковалентно связано с белком в аминокислотном мотиве.
Специалист в данной области техники легко может выбрать белок, который селективно связывается с мишенью, представляющую интерес (например, клетки-мишени у субъекта). Типичные белки включают, но не ограничиваются этим антитела или фрагменты антигенов, которые специфически связываются с мишенью, представляющей интерес.
СААХ-белок (СААХ-антитело)
Примером конъюгата белок-активное вещество, полученного по способу настоящего изобретения, представлен следующей формулой (I), в которой белок представляет собой антитело (его фрагмент или аналог) (Ab), активное вещество представляет собой лекарственное вещество (D), и аминокислотный мотив, который может быть распознан посредством изопреноид-трансферазы, представляет собой СААХ
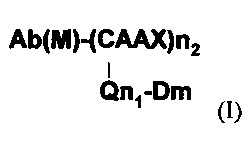
Ab(М) представляет это антитело или его фрагмент, которые могут содержать модификации. Модификация может быть: (i) делецией на карбоксильном конце антитела или его фрагмента; (ii) вставкой олигопептида или полипептида на карбоксильном конце антитела или его фрагмента; и (iii) делецией на карбоксильном конце антитела или его фрагмента и вставкой олигопептида или полипептида на в карбоксильном конце антитела или его фрагмента. Q представляет собой линкер. Линкер может представлять собой линейный линкер или разветвленный линкер. В одном варианте линкер может включать в себя первую функциональную группу (FG1). n1, n2 и m могут быть соответствующим образом определены в зависимости от антитела, аминокислотного мотива, линкера, активного вещества и т.д. Предпочтительно n1, n2 независимо представляют собой целые числа от 1 до 4, a m представляет собой целое число от 1 до 16.
В некоторых вариантах выполнения линкер может быть представлен следующей формулой (II):
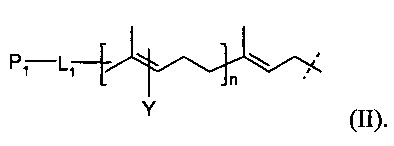
P1 и Υ независимо представляют собой группу, содержащую первую функциональную группу (FG1). FG 1 может быть выбрана из группы, состоящей из: ацетилена, азида, альдегида, гидроксиламина, гидразина, кетона, нитробензофуразана (NBD), дансила, флуоресцеина, биотина и родамина. L1 представляет собой (CH2)rXq(CH2)p, где X представляет собой кислород, серу, -NR1, -C(O)NR1, -NR1C(O)-, -NR1SO2-, -SO2NR1, -(CH=CH)- или ацетилен; R1 обозначает водород, С1-6-алкил, С1-6-алкил арил, или C1-6-алкил гетероарил; r и p независимо представляют собой целое число от 0 до 6; q представляет собой целое число от 0 до 1; и n представляет собой целое число от 1 до 4.
В некоторых определенных вариантах выполнения лекарственное вещество (D) может быть присоединено к линкеру через группу, содержащую вторую функциональную группу (FG2), которая может реагировать с FG1. FG2 может быть выбрана из группы, состоящей из: ацетилена, гидроксиламина, азида, альдегида, гидразина, кетона и амина.
В некоторых определенных вариантах выполнения лекарственное вещество (D) может быть присоединено к группе, содержащей FG2, через -(CH2)rXq(CH2)p- или -[ZCH2CH2O(CH2CH2O)wCH2CH2Z]-, где X представляет собой кислород, серу, -NR1, -C(O)NR1-, -NR1C(O)-, -NR1SO2- или -SO2NR1-, Ζ представляет собой кислород, серу или NR1; R1 представляет собой водород, -алкил, -алкил арил, или C1-6-алкил гетероарил; r и p независимо представляют собой целое число от 0 до 6; q является целым числом от 0 до 1; и w представляет собой целое число от 0 до 6.
В некоторых определенных вариантах выполнения (i) пептид(ы), которые могут быть расщеплены посредством катепсина В, или (ii) глюкуронид, который может быть расщеплен посредством β-глюкуронидазы, могут быть присоединены к -(СН2)rXq(СН2)р- или -[ZCH2CH2O(СН2СН2О)wCH2CH2Z]-.
В некоторых определенных вариантах выполнения несамоотщепляющаяся группа или самоотщепляющаяся группа может быть присоединена к (i) пептиду(ам), которые могут быть расщеплены посредством катепсина В или (ii) к глюкурониду, который может быть расщеплен посредством β-глюкуронидазы. Неограничивающие примеры самоотщепляющейся группы могут быть аминофенилметилоксикарбонильная и аминофенилметилоксикарбонильная.
В некоторых определенных вариантах выполнения пептид, который может быть расщеплен посредством катепсина В, представлен следующей формулой (III):
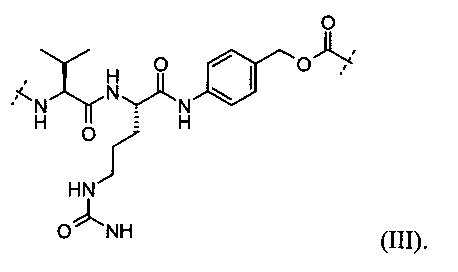
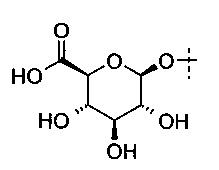
В некоторых определенных вариантах выполнения глюкуронид, который может быть расщеплен посредством β-глюкуронидазы, представлен следующей формулой (IV):
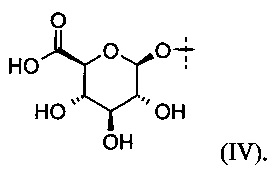
3. Композиции
В еще одном аспекте настоящее изобретение обеспечивает композицию, содержащую конъюгат белок-активное вещество, описанный в настоящем изобретении. В вариантах выполнения композиции используются для доставки активного вещества к клетке-мишени у субъекта. В вариантах выполнения композиции используются для лечения субъекта, нуждающегося в этом (т.е. нуждается в активном веществе).
Получение таких композиций известно специалистам в данной области техники, и такие композиции могут быть доставлены in vivo субъекту.
В аспектах композиции получали в виде инъекционных форм, либо в виде жидкого раствора, либо в виде суспензии. Твердые формы, пригодные для инъекций, также могут быть приготовлены в виде эмульсий или с полипептидами, инкапсулированными в липосомы. Конъюгаты белок-активное вещество могут быть комбинированы с фармацевтически приемлемым носителем, который включает в себя любой носитель, который не индуцирует выработку антител, вредных для субъекта, получающего носитель. Подходящие носители обычно содержат большие макромолекулы, которые медленно метаболизируется, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры, липидные агрегаты и тому подобное. Такие носители хорошо известны специалистам в данной области техники.
Композиции в соответствии с настоящим изобретением могут также содержать разбавители, такие как вода, физиологический раствор, глицерин, этанол. Вспомогательные вещества могут также присутствовать, такие как смачивающие или эмульгирующие агенты, рН-буферные вещества и тому подобное. Белки могут быть приготовлены в виде вакцины в нейтральной или солевой формах. Композиции могут быть введены парентерально, посредством инъекции, такие инъекции могут быть либо подкожными или внутримышечными. Для других форм введения, таких как суппозитории или пероральных, пригодны дополнительные формуляции. Пероральные композиции могут быть введены в виде раствора, суспензии, таблетки, пилюли, капсулы или композиции с замедленным высвобождением.
Композиции вводят способом, совместимым с дозовой формуляцией. Композиция содержит терапевтически эффективное количество конъюгата белок-активное вещество. Под терапевтически эффективным количеством подразумевают единичную дозу или композицию, вводимую в дробных дозах, которое является эффективным для лечения или профилактики заболевания или расстройства. Вводимая доза будет варьироваться в зависимости от субъекта, подлежащего лечению, здоровья и физического состояния, желаемой степени защиты и прочих существенных в этом смысле факторов. Точные количества необходимого активного ингредиента будет зависеть от оценки практикующего врача.
4. Способы применения конъюгатов белок-активное вещество и композиций
В еще одном аспекте настоящее изобретение относится к способу доставки активного вещества к клетке-мишени у субъекта, причем способ включает введение конъюгата белок-активное вещество или композиции. В еще одном аспекте настоящее изобретение предоставляет способ лечения субъекта, нуждающегося в этом (то есть, субъекта, нуждающегося в активном веществе), причем способ включает введение эффективного количества конъюгата белок-активное вещество или композиции, содержащей конъюгат, субъекту.
В вариантах выполнения конъюгат белок-активное вещество (например, конъюгат антитело-лекарственное вещество) или композиции, содержащей конъюгат в терапевтически эффективном количестве, могут быть введены пациенту, страдающему от рака или опухоли для лечения рака или опухоли.
В вариантах выполнения конъюгат белок-активное вещество (например, конъюгат антитело-лекарственное вещество) или композиции, содержащие конъюгат в терапевтически эффективном количестве, могут быть введены пациенту для лечения или профилактики инфекции, вызванной патогенным агентом (например, вирусом, бактериями, грибками, паразитом и т.п.). Такие способы включают в себя стадию введения млекопитающему терапевтического или профилактического количества конъюгата, достаточного для лечения заболевания или расстройства или его симптома, при таких условиях, которые предотвращают или вылечивают заболевание или расстройство.
В некоторых вариантах выполнения конъюгат белок-активное вещество или композиции могут быть введены в виде фармацевтически приемлемой соли или сольвата. В некоторых вариантах выполнения он может быть введен с фармацевтически приемлемым носителем, фармацевтически приемлемым вспомогательным веществом и/или фармацевтически приемлемой добавкой. Фармацевтически эффективное количество и тип фармацевтически приемлемой соли или сольвата, вспомогательного вещества и добавки могут быть определены с помощью стандартных методов (Remingtonʹs Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, 18th edition, 1990).
Термин "терапевтически эффективное количество" в отношении рака или опухоли означает количество, которое может: уменьшить число раковых клеток; уменьшить размер раковых клеток; препятствовать раковым клеткам проникать в периферийные системы или уменьшать проникновение; препятствовать раковым клеткам распространению на другие системы или уменьшать распространение; препятствовать росту раковых клеток, и/или облегчать по меньшей мере один из симптомов, связанных с раком. При лечении рака эффективность лекарственного вещества может быть оценена по времени до прогрессирования опухоли (ТТР) и/или частоты объективного ответа (RR, ЧОО).
Термин "терапевтически эффективное количество" в отношении инфекции, вызванной патогенным агентом, означает количество, которое может предотвращать, лечить или уменьшить симптомы, связанные с инфекцией.
Термин «фармацевтически приемлемые соли», используемые в настоящем изобретении, включают органические соли и неорганических соли. Их примеры включают, но не ограничиваются этим, гидрохлорид, гидробромид, гидроиодид, сульфат, цитрат, ацетат, оксалат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, изоникотинат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантонат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкоронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (то есть, 1,1ʹ-метилен-бис-(2-гидрокси-3-нафтоат)). Фармацевтически приемлемая соль может включать в себя другую молекулу (например, ацетат ионы, сукцинат ионы и другие противоионы и т.п.). Она также может включать по меньшей мере один заряженный атом. Она может также включать по меньшей мере один противоион.
Примеры сольватов, которые можно использовать в фармацевтически приемлемых сольватах соединений в соответствии с настоящим изобретением, включают, но не ограничиваются этим, воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин.
ПРИМЕРЫ
Следующие примеры иллюстрируют изобретение и не предназначены для его ограничения.
ПРИМЕР 1: ПОЛУЧЕНИЕ АВ (М)-СААХ
1-1. Конструирование, экспрессия и очистка Herceptin-CAAX
Модифицированные антитела Herceptin получали с использованием стандартной технологии рекомбинантной ДНК и протоколов ПЦР-клонирования с плазмидой pNATABH Herceptin НС или плазмидой pNATABL::Herceptin LC. Рекомбинантные плазмиды экспрессировали в клеточной линии HEK293E посредством временной трансфекции. Антитела отделяли и очищали с помощью хроматографии на колонке с белком А.
Конструирование Herceptin-HC-GCVIM и Herceptin-LC-GCVIM
Модифицированные антитела Herceptin получали с использованием стандартных ПЦР-протоколов клонирования. Как правило, плазмиды Herceptin-HC-GCVIM и Herceptin-LC-GCVIM конструировали при помощи вставки ДНК-последовательности, кодирующей мотив СААХ (например, GCVIM, G5CVIM, G7CVIM, G10CVIM или G10CVLL, на С-конец тяжелой цепи или легкой цепи, закодированной в плазмидах pNATABH::Herceptin НС или pNATABH::Herceptin LC).
Например, последовательность узнавания SacII присутствует при аминокислоте 172 на С-конце области IgG1-Fc человека. Соответственно, разработали прямой праймер для связывания с сайтом SacII в области Fc. Последовательность ДНК, которая должна быть введена (например, 15-членная, кодирующая 5-членную последовательность GCVIM), присоединяли к обратному праймеру, специфичному для С-концевой части Fc. Прямой и обратный праймеры использовали для амплификации ПЦР-продукта, и полученный продукт очищали с использованием набора для очистки ПЦР. Так как обратный праймер содержал сайт XhoI, продукт ПЦР расщепляли с помощью SacII и XhoI. Аналогичным образом, плазмида pNATABH::Herceptin НС расщепляли с помощью SacII и XhoI. Расщепленный скелет очищали с использованием набора для очистки в геле и лигировали с расщепленным продуктом ПЦР. Лигирование проводили посредством соответствующим образом подобранного соотношения вектора и вставки, и продукт лигирования трансформировали в компетентные бактериальные клетки для скрининга. Плазмиды Herceptin-HC-GCVIM и Herceptin-LC-GCVIM получали из секвенированных клонов.
Аминокислотные последовательности из полученных плазмид показаны на Фиг. 1-10. Разделы 1-4 и 1-7 ниже обеспечивают подробное описание каждого из конструктов.
Экспрессия и очистка Herceptin-HC-GCVIM и Herceptin-LC-GCVIM
Клетки HEK293Ε культивировали в DMEM/10% среде FBS на 150-мм планшетах (# 430599, Corning USA) до 70~80% конфлюентности. 13 мкг ДНК и 26 мкг PEI (# 23966, Polysciences, USA) смешивали в соотношении 1:2, инкубировали при комнатной температуре в течение около 20 минут, а затем добавляли к клеткам HEK193E. После 16-20 часов среду заменяли средой без сыворотки (No FBS DMEM (# SH30243.01, Hyclone Thermo., USA)) и супернатант собирали каждые два-три дня.
Супернатанты фильтровали через 0,22 мкм топ-фильтр (# PR02890, Millipore, USA), а затем связывали с 500 мкл гранул с белком А (#17-1279-03, GE Healthcare Sweden), упакованных в колонке на 5 мл. Связывание проводили с использованием перистальтического насоса в течение ночи при 0,9 мг/мин при 4°С. Колонку промывали PBS (100 мл или больше) (# 70011, Gibco, USA). Связанный белок элюировали 0,1 Μ глицин-HCl (# G7126, Sigma, USA) в 6 фракций и нейтрализовали 1 Μ Трис (# Т-1503, Sigma, USA) (рН 9,0). Определяли количество белка. 2 или 3 фракции, содержащие белок, собирали и концентрировали с помощью фильтрующих блоков Amicon Ultra (# UFC805024, Millipore, USA). Буфер заменяли около 10 раз на 1x PBS (# 70011, Gibco, USA). Белковый продукт идентифицировали, как Herceptin-HC-GCVIM или Herceptin-LC-GCVIM методом вестерн-блоттинга. Для идентификации полосы белка, содержащей Herceptin, использовали пероксидазу ImmunoPure, конъюгтрованную с козьими (антителами) против Fc человеческого IgG (# 31413, Pierce, USA). При очистке получали 1-2 мг Herceptin-HC-CGVIM или Herceptin-LC-GCVIM из 1 л среды культивирования клеток.
Продукты Herceptin-HC-CGVIM и Herceptin-LC-GCVIM также анализировали с помощью Agilent bioanalyzer. Вкратце, 8 мкл очищенного образца белка (приблизительно 1 мг/мл) анализировали с помощью Agilent Protein 230 Kit (5067-1515 Agilent Technologies, USA). Образец белка разделяли на две фракции (4 мкл каждый). 2 мкл невосстанавливающего буфера или восстанавливающего буфера добавляли к каждому образцу. Образец нагревали при 95-100°С в течение 5 минут и охлаждали льдом до 4°С. После осаждения к пробе и лэддеру добавляли 84 мкл денонсированной воды и интенсивно перемешивали. После этого образец загружали и анализировали с помощью набора в соответствии с инструкциями изготовителя.
1-2. Конструирование, экспрессия и очистка анти-сМЕТ-СААХ
Модифицированные анти-сМЕТ СААХ антитела также получали посредством вышеописанных способов. Например, модифицированные анти-сМЕТ-СААХ антитела получали с использованием стандартной технологии рекомбинантной ДНК и протоколов ПЦР-клонирования с помощью плазмиды рРМС-С1А5. Рекомбинантные плазмиды в клеточной линии HEK293T посредством временной трансфекции. Антитела отделяли и очищали с помощью хроматографической колонки с белком А.
1-3. Herceptin-HC-GnCVIM
Получали Herceptin-HC-GCVIM, Herceptin-HC-G5CVIM, Herceptin-HC-G7CVIM и Herceptin-HC-G10CVIM антитела. Антитела, соответственно, имеют 5-членную (GCVIM), 9-мерную (G5CVIM), 11-членную (G7CVIM) или 14-членную (G10CVIM) последовательность на С-конце тяжелой цепи (Фиг. 1, 3, 5 и 7).
1-4. Herceptin-LC-GnCVIM
Получали Herceptin-LC-GCVIM, Herceptin-LC-G5CVIM, Herceptin-LC-G7CVIM и Herceptin-LC-G10CVIM антитела. Антитела, соответственно, имеют 5-членную (GCVIM), 9-членную (G5CVIM), 11-членную (G7CVIM) или 14-членную (G10CVIM) последовательность на С-конце легкой цепи (Фиг. 2, 4, 6 и 8).
1-5. Herceptin-HC-G10CVLL
Получали Herceptin-HC-G10CVLL антитела. Антитело имеет 14-мерную (G10CVLL) последовательность на С-конце тяжелой цепи (Фиг. 9).
1-6. Herceptin-LC-G10CVLL
Получали Herceptin-LC-G10CVLL антитела. Антитело имеет 14-мерную (G10CVLL) последовательность на С-конце легкой цепи (Фиг. 10).
1-7. Анти-cMET-HC-GnCVIM
Получали анти-cMET-HC-G7CVIM и анти-cMET-HC-G10CVIM антитела. Антитела, соответственно, имеют 11-мерную (G7CVIM), или 14-мерную (G10CVIM) последовательность на С-конце тяжелой цепи (не показана). Фиг. 11 показывает анализ геля SDS-PAGE анти-cMET-HC-G7CVIM и анти-cMET-HC-G10CVIM антител.
1-8. Анти-cMET-LC-GnCVIM
Получали анти-cMET-LC-G7CVIM и анти-cMET-LC-G10CVIM антитела. Антитела, соответственно, имеют 11-членную (G7CVIM), или 14-членную (G10CVIM) последовательность на С-конце легкой цепи (не показана). Фиг. 11 показывает SDS-PAGE гель анализа анти-cMET-LC-G7CVIM и анти-cMET-LC-G10CVIM антитела.
ПРИМЕР 2: ФУНКЦИОНАЛИЗАЦИЯ АВ(М)-СААХ
2-1. Геранилалкин дифосфат (В, LCB14-0501)
Вышеупомянутое соединение получали в 6 стадий с гераниолом в качестве исходного материала с помощью способа, подобного способу, описанному в ChembioChem 207, 8, 98-105, содержание данной ссылки включено в настоящее изобретение посредством ссылки во всей ее полноте.
(В) 1Н-ЯМР (600 МГц, D2O) δ 5,38 (т, J=7,8 Гц, 1H), 5,30 (т, J=7,8 Гц, 1H), 4,31 (шир. с, 2Н), 3,96 (м, 2Н), 3,84 (с, 2Н), 2,70 (шир. с, 1H), 2,07 (м, 2Н), 1,98 (м, 2Н), 1,56 (с, 3Н), 1,48 (с, 3Н)
2-2. Декадиенилпропаргиловый эфир дифосфат (F, LCB14-0511) и декадиенилазид дифосфат (G, LCB14-0512)
Ацетоксидекандиенил альдегид (С) получали из фарнезола в 5 стадий. Из соединения (С), соединений (D) и (Е) получали в 6 стадий и 5 стадий соответственно. Из соединений (D) и (Е), вышеупомянутые соединения (F) и (G) получали способом, аналогичным способу, описанному в разделе 2-1, приведенного выше. Соединения (С), (D) и (Е) получали способом, аналогичным способу, описанному в JOC 2007, 72 (24), 9291-9297, содержание данной ссылки включено в настоящее описание посредством ссылки во всей ее полноте.
(F): 1Н-ЯМР (600 МГц, D2O) δ 5,44 (т, J=6 Гц, 1H), 5,22 (т, J=6 Гц, 1H), 4,46 (т, J=8,4 Гц, 2H), 4,16 (т, J=2,4 Гц, 2H), 3,55 (м, 2Н), 2,85 (м, 1Н), 2,15 (м, 2Н), 2,09 (т, J=7,2 Гц, 2Н), 2,03 (т, J=7,2 Гц, 2Н), 1,70~1,65 (м, 5Н), 1,60 (с, 3Н).
(G): 1Н-ЯМР (600 МГц, D2O) δ 5,43 (т, J=6,6 Гц, 1H), 5,23 (т, J=6,6 Гц, 1H), 4,40 (т, J=6 Гц, 2H), 3,26 (т, J=6,0 Гц, 2H), 2,15 (м, 2Н), 2,10~2,04 (м, 4Н), 1,70~1,65 (м, 5Н), 1,60 (с, 3Н).
2-3. NBD-GPP
Трис-аммоний [3,7-диметил-8-(7-нитро-бензо[1,2,5]оксадиазол-4-иламино)-окта-2,6-диен-1]пирофосфат (NBD-GPP) получали по способу, подобному способу, описанному в JACS 2006, 128, 2822-2835, содержание данной ссылки включено в настоящее изобретение посредством ссылки во всей полноте.
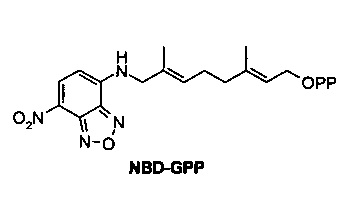
1Н-ЯМР (600 МГц, D2O) δ 8,51 (д, J=9 Гц, 1H), 6,37 (д, J=9 Гц, 1H), 5,50 (т, J=6,6 Гц, 1Н), 5,42 (т, J=6,6 Гц, 1H), 4,43 (т, J=6,6 Гц, 2Н), 4,08 (с, 2Н), 2,22 (м, 2Н), 2,10 (т, J=7,2 Гц, 2Н), 1,69 (с, 6Н)
2-4. Глюкуронид-линкер-MMAF (LCB14-0592)
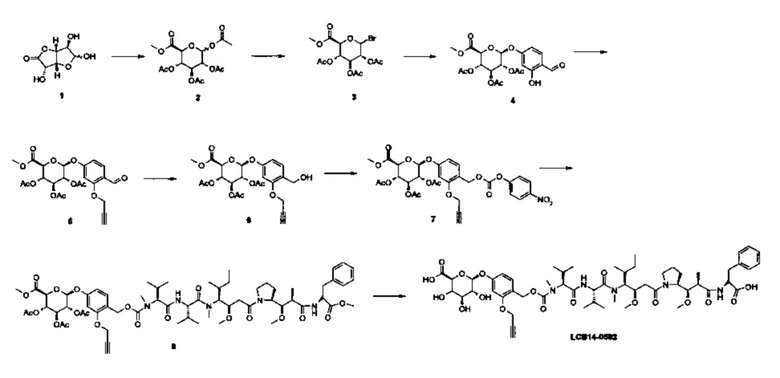
Соединение 2
К раствору D-глюкуроно-6,3-лактона (19 г, 107,88 ммоль) в метаноле (250 мл) в атмосфере азота медленно добавили раствор NaOH (100 мг) в метаноле (100 мл).
Полученную смесь перемешивали в течение 2 часов. Добавляли раствор NaOH (200 мг) в метаноле (15 мл). Полученную смесь перемешивали в течение 3 часов. Метанол удаляли при пониженном давлении. При 10°С или ниже последовательно добавляли пиридин (50 мл) и уксусный ангидрид (Ас2О, 54 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. После того как реакция была завершена, полученную смесь концентрировали при пониженном давлении и подвергали колоночной хроматографии с получением соединения 2 (20 г, 50%) в виде твердого вещества.
1Н-ЯМР (600 МГц, CDCl3) δ 5,77 (д, J=7,8 Гц, 1H), 5,31 (т, J=9,6 Гц, 1H), 5,24 (т, J=9,6 Гц, 1H), 5,14 (м, 1H), 4,17 (д, J=9 Гц, 1Н), 3,74 (с, 3Н), 2,12 (с, 3Н), 2,04 (м, 9Н)
Соединение 3
Соединение 2 (5 г, 13.28 ммоль) добавляли к раствору 33% HBr в АсОН (20 мл) при 0°С. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. После того как реакция была завершена, полученную смесь разбавляли толуолом (50 мл). Полученную смесь концентрировали при пониженном давлении. Этилацетат (100 мл) и насыщенный раствор NaHCO3 (100 мл) добавляли для экстракции органического слоя. Полученный таким образом органический слой сушили над безводным сульфатом натрия с получением соединения 3 (5,27 г, 100%).
1Н-ЯМР (600 МГц, CDCl3) δ 6,64 (д, J=3,6 Гц, 1H), 5,61 (т, J=3,6 Гц, 1Н), 5,24 (т, J=3,6 Гц, 1H), 4,85 (м, 1H), 4,58 (д, J=10,2 Гц, 1H), 3,76 (с, 3Н), 2,10 (с, 3Н), 2,06 (с, 3Н), 2,05 (с, 3Н)
Соединение 4
Раствор соединения 3 (4 г, 10.07 ммоль) и 2,4-дигидроксибензальдегида 1,67 г, 12,084 ммоль) в ацетонитриле (30 мл) последовательно обрабатывали молекулярными ситами (5 г) и Ag2O (9,33 г, 40,28 ммоль). Полученную смесь перемешивали в течение 3 часов при комнатной температуре. После того как реакция была завершена, твердое вещество отфильтровывали и фильтрат концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 4 (2 г, 43,5%).
1Н-ЯМР (400 МГц, CDCl3) δ 11,38 (с, 1H), 9,77 (с, 1Н), 7,48 (д, J=8,4 Гц, 1H), 6,61 (дд, J=8,4, 2,0 Гц, 1Н), 6,53 (д, J=2,0 Гц, 1H), 5,36~5,25 (м, 4Н), 4,23 (м, 1H), 3,73 (с, 1Н), 2,06 (с, 9Н)
Соединение 5
Раствор соединения 4 (1 г, 2,20 ммоль) в ацетоне (10 мл) обрабатывали карбонатом калия (760 мг, 5.50 ммоль) и 80% пропаргилбромидом в толуоле (735 мкг, 6.60 ммоль). Полученную смесь перемешивали при 45°С в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 5 (930 мг, 87%).
1H-ЯМР (600 МГц, CDCl3) δ 10,33 (с, 1H), 7,83 (д, J=9 Гц, 1Н), 6,75 (д, J=1,8 Гц, 1Н), 6,67 (дд, J=9 Гц, 1,8 Гц, 1Н), 5,39~5,34 (м, 2Н), 5,31~5,26 (м, 2Н), 4,79 (д, J=2,4 Гц, 2Н), 4,23 (м, 2Н), 3,72 (с, 3Н), 2,59 (т, J=2,4 Гц, 1Н), 2,07 (с, 3Н), 2,06 (с, 3Н), 2,05 (с, 3Н)
Соединение 6
Раствор соединения 5 (930 мг, 1,88 ммоль) в изопропиловом спирте (2 мл) и хлороформе (10 мл) при 0°С последовательно обрабатывали силикагелем (5 г) и NaBH4 (178 мг, 4.79 ммоль). Полученную смесь перемешивали в течение 3 часов. После того как реакция была завершена, силикагель отфильтровывали. Реакционную смесь экстрагировали дихлорметаном (100 мл) и дистиллированной водой (100 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток подвергали колоночной хроматографии с получением соединения 6 (610 мг, 65%).
1H-ЯМР (600 МГц, CDCl3) δ 7,23 (д, J=8,4 Гц, 1H), 6,72 (д, J=2,4 Гц, 1H), 6,61 (дд, 8,4, 2,4 Гц, 1H), 5,35~5,32 (м, 2Н), 5,27 (м, 1H), 5,13 (д, J=7,8 Гц, 1H), 4,72 (д, J=2,4 Гц, 2Н), 4,63 (д, J=5,4 Гц, 2Н), 4,17 (м, 1Н), 3,73 (с, 3Н), 2,07 (с, 3Н), 2,05 (с, 3Н), 2,04 (с, 3Н)
Соединение 7
Раствор соединения 6 (250 мг, 0,50 ммоль) в диметилформамиде (0,5 мл) обрабатывали бис(4-нитрофенил)карбонатом (308 мг, 100 ммоль) и диизопропилэтиламином (DIPEA, 132 мкг, 0,75 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, реакционную смесь концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 7 (310 мг, 94%).
1H-ЯМР (600 МГц, CDCl3) δ 8,26 (д, J=9 Гц, 2Н), 7,37 (д, J=9 Гц, 2Н), 7,34 (д, J=8,4 Гц, 1H), 6,77 (д, J=1,8 Гц, 1H), 6,64 (дд, 7,8, 2,4 Гц, 1Н), 5,37~5,33 (м, 2Н), 5,30~5,27 (м, 3Н), 5,17 (д, J=7,2 Гц, 1H), 4,74 (д, J=2,4 Гц, 2Н), 4,18 (м, 1Н), 3,74 (с, 3Н), 2,54 (т, J=2,4 Гц, 1Н), 2,07 (с, 3Н), 2,05 (с, 3Н), 2,04 (с, 3Н)
Соединение 8
К раствору соединения 7 (150 мг, 0.227 ммоль), MMAF-OMe (169,6 мг, 0,227 ммоль) и безводного 1-гидроксибензотриазола (HOBt, 6,2 мг, 0,0454 ммоль) в диметилформамиде (3 мл) добавляли пиридин (0,8 мл) и диизопропилэтиламин (40 мкл, 0,227 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 8 (146 мг, 50%).
Масс-спектр с m/z: 1067 (М+).
MMAF-OMe получали в соответствии с методикой, описанной в US 61/483,698, ChemPharmBull, 1995, 43 (10), 1706-1718, US 7423116, US 7498298 и WO 2002/088172, содержание каждой из этих ссылок включено в настоящее описание посредством ссылки в полном объеме.
LCB14-0592
Раствор соединения 8 (85 мг, 0.067 ммоль) в метаноле (2 мл) обрабатывали при 0°С раствором LiBH4 (28,2 мг, 0,670 ммоль) в дистиллированной воде (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, метанол удаляли при пониженном давлении. Остаток растворяли в дистиллированной воде (50 мл) и подкисляли уксусной кислотой до рН 3. Реакционную смесь экстрагировали три раза дихлорметаном (3×50 мл). Объединенный органический слой концентрировали при пониженном давлении с получением твердого вещества, которое промывали диэтиловым эфиром (50 мл) с получением соединения LCB14-0592 (62 мг, 83%).
ЭУ-MC m/z: 1112 (М+).
2-5. Глюкуронид-линкер-ММАЕ (LCB14-0598)
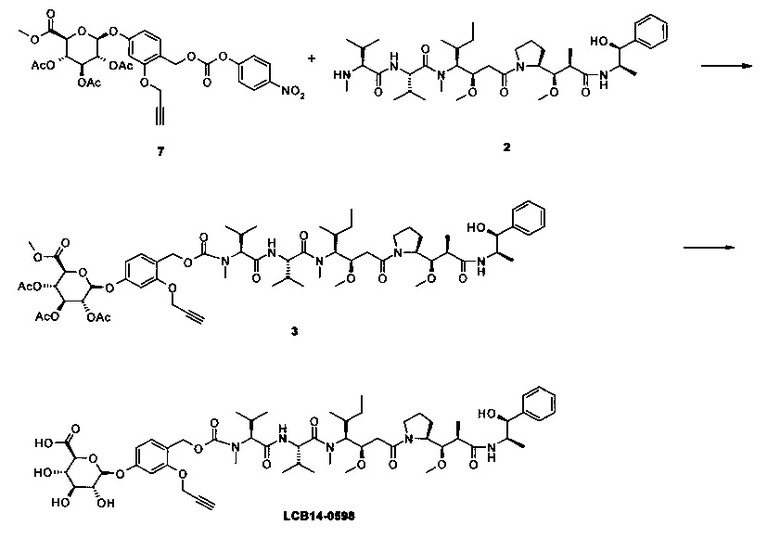
Соединение 3
Раствор соединения 7, полученного в примере 2-4 (150 мг, 0,227 ммоль), ММАЕ (163 мг, 0,227 ммоль; ChemPharmBull, 1995, 43 (10), 1706-1718, US 7423116, WO 2002/088172) и безводный 1-гидроксибензотриазол (HOBt, 6,2 мг, 0,0454 ммоль) в диметилформамиде (3 мл) обрабатывали пиридином (0,8 мл) и диизопропилэтиламином (40 мкл, 0,227 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. После того как реакция была завершена, полученную смесь разбавляли этилацетатом (100 мл), 0,5 н. HCl (10 мл) и дистиллированной водой (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 3 (30 мг, 10%).
ЭУ-МС m/z: 1238 (Μ+).
LCB14-0598
Раствор соединения 3 (30 мг, 0.024 ммоль) в метаноле (3 мл) обрабатывали при 0°С с LiOH (10 мг, 0,24 ммоль) в дистиллированной воде (0,5 мл). Полученную смесь перемешивали в течение 3 часов при комнатной температуре. После того как реакция была завершена, органический растворитель удаляли при пониженном давлении. Полученный продукт разбавляли дистиллированной водой (50 мл) и подкисляли 0,5 н. HCl до рН 3. Экстракция дихлорметаном (50 мл) с последующим концентрированием при пониженном давлении дает соединение LCB14-0598 (21 мг, 79%).
ЭУ-МС m/z: 1098 (М+).
2-6. Глюкуронид-линкер-MMAF-метиламид (LCB14-0600)
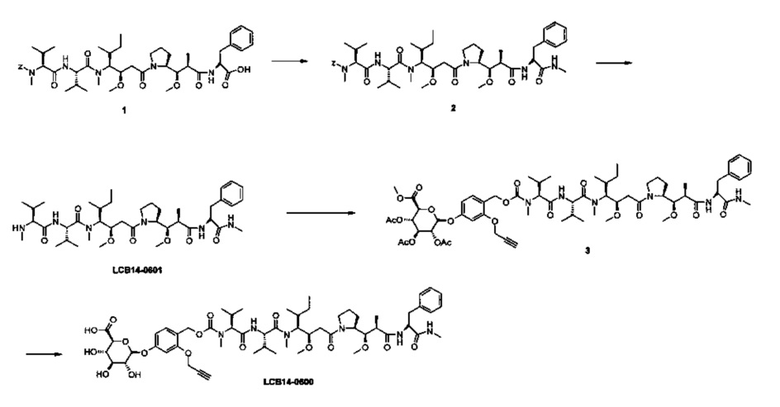
Соединение 2
Раствор соединения 1 (Z-MMAF, 558 мг, 0,644 ммоль, ChemPharmBull, 1995, 43 (10), 1706-1718) в диметилформамиде (5 мл) обрабатывали гидрохлоридом метиламина (130 мг, 1,932 ммоль), диэтилцианофосфонат (DEPC, 144 мг, 0,966 ммоль) и триэтиламина (270 мкг, 1,932 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 2 (490 мг, 86%).
Масс-спектр с m/z: 879 (Μ+).
LCB14-0601 (MMAF-метиламид)
Соединение 2 (470 мг, 0,53) растворяли в трет-бутаноле (tBuOH, 8 мл) и дистиллированной воде (0,8 мл). При 0°С добавляли 10% Pd/C (50 мг). Полученную смесь перемешивали в атмосфере газа Н2 в течение 2 часов. После того как реакция была завершена, Pd/C отфильтровывали через целит. Полученный отфильтрованный раствор концентрировали при пониженном давлении с получением соединения LCB14-0601 (340 мг, 85%).
Масс-спектр с m/z: 745 (М+).
Соединение 3
Раствор соединения 7, полученного в примере 2-4 (133 мг, 0,20 ммоль), LCB14-601 (150 мг, 0,20 ммоль) и безводный 1-гидроксибензотриазол (HOBt, 5.44 мг, 0,04 ммоль) в диметиламиде (3 мл) обрабатывали пиридином (0,8 мл) и диизопропилэтиламином (DIPEA, 35 мкг, 0,20 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (100 мл) и 0,5 н. раствор HCl (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 3 (123 мг, 48%).
ЭУ-МС m/z: 1265 (М+).
LCB 14-0600 (Глюкуронид-линкер-MMAF-метиламид)
Раствор соединения 3 (60 мг, 0,047 ммоль) в метаноле (3 мл) обрабатывали при 0°С с LiOH (20 мг, 0,47 ммоль) в дистиллированной воде (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После того как реакция была завершена, органический растворитель удаляли при пониженном давлении. Остаток разбавляли дистиллированной водой (50 мл) и подкисляли 0,5 н. HCl до рН 3. Экстракция дихлорметаном (50 мл) с последующим концентрированием дает соединение LCB14-0600 (25 мг, 47%).
ЭУ-MC m/z: 1125 (М+).
2-7. Азид-линкер-NBD: LCB14-0529
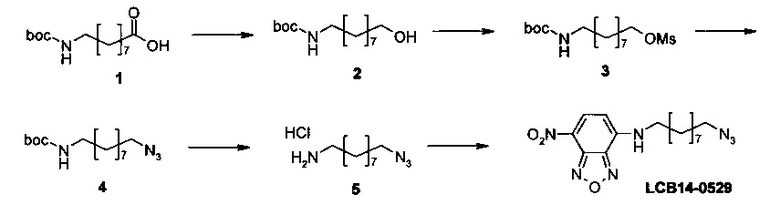
Соединение 2
Раствор соединения 1 (4 г, 12,67 ммоль) и N-метилморфолина (1,6 мл, 14,57 ммоль) в тетрагидрофуране (30 мл) медленно обрабатывали изобутилхлорформиатом (1,8 мл, 13,94 ммоль) в атмосфере азота при -15°С. Полученную смесь перемешивали при той же температуре в течение 30 минут. Полученную смесь медленно добавляли через фильтр к раствору боргидрида натрия (959 мг, 25,34 ммоль) в тетрагидрофуране/метаноле (36 мл/12 мл) при -78°С при эффективном перемешивании. Реагент медленно нагревали до комнатной температуры при перемешивании в течение 2 часов. После того как реакция была завершена, добавляли уксусную кислоту (4 мл) и перемешивали в течение 15 минут. Добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 2 (3,69 г, 96,5%).
1Н-ЯМР (600 МГц, CDCl3) δ 4,50 (с, 1H), 3,64 (д, J=6,6 Гц, 2Н), 3,11 (м, 2Н), 1,56 (м, 2Н), 1,44 (м, 11Н), 1,29 (м, 10Н).
Соединение 3
Раствор соединения 2 (450 мг, 1,73 ммоль) и N-метилморфолина (381 мкг, 3,46 ммоль) в тетрагидрофуране (5 мл) медленно обрабатывали ангидридом метансульфоновой кислоты (363 мг, 2,07 ммоль) в атмосфере азота при 0°С. Полученную смесь медленно нагревали до комнатной температуры при перемешивании в течение 1 часа. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 3 в виде белого твердого вещества (520 мг, 89%).
1H-ЯМР (600 МГц, CDCl3) δ 4,50 (с, 1H), 4,22 (т, J=6,6 Гц, 2Н), 3,11 (м, 2Н), 3,01 (с, 3Н), 1,74 (м, 2Н), 1,44 1,36 (м, 13Н), 1,29 (м, 8Н).
Соединение 4
Раствор соединения 3 (520 мг, 1,54 ммоль) в диметилформамиде (5 мл) обрабатывали азидом натрия (120 мг, 1,85 ммоль) в атмосфере азота и полученную смесь перемешивали при 70°С в течение 3 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением соединения 4 в жидкой форме (430 мг, 98%).
1Н-ЯМР (600 МГц, CDCl3) δ 4,49 (с, 1Н), 3,26 (т, J=6,9 Гц, 2Н), 3,09-3,12 (м, 2Н), 1,59 (м, 2Н), 1,44 (м, 11Н), 1,33 (м, 10Н).
Соединение 5
Раствор соединения 4 (430 мг, 1.51 ммоль) в дихлорметане (6 мл) обрабатывали 4 Μ HCl в 1,4-диоксане (4 мл) в атмосфере азота при 0°С. Полученную смесь перемешивали в течение 3 часов и концентрировали при пониженном давлении с получением соединения 5 (330 мг, 99%).
1Н-ЯМР (600 МГц, CDCl3) δ 8,29 (с, 2Н), 3,26 (т, J=6,9 Гц, 2Н), 2,98 (м, 2Н), 1,46 (м, 2Н), 1,59 (м, 2Н), 1,31-1,39 (м, 10Н).
LCB14-0529
Раствор соединения 5 (326 мг, 1,47 ммоль) в смеси растворителей (10 мл) ацетонитрила и 25 ммоль бикарбоната натрия обрабатывали 4-хлор-7-нитробензофуразаном (442 мг, 2,20 ммоль). Полученную смесь перемешивали в течение 3 часов при комнатной температуре. Добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения LCB14-0529 (250 мг, 49%).
1Н-ЯМР (600 МГц, CDCl3) δ 8,48 (д, J=8,4 Гц, 1H), 6,16 (д, 8,4 Гц, 1H), 3,47 (д, 6,6 Гц, 2Н), 3,24 (т, 6,9 Гц, 2Н), 1,79 (м, 2Н), 1,59 (м, 2Н), 1,42-1,48 (м, 2Н), 1,20-1,37 (м, 8Н)
2-8. Азид-линкер-NBD: LCB14-0530
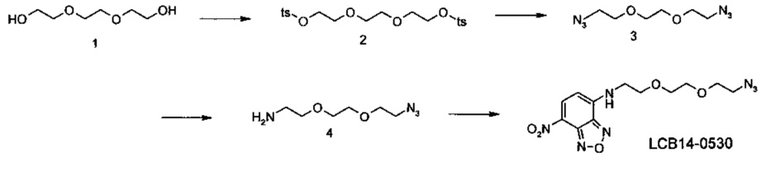
Соединение 2
Раствор три(этилен)гликоля (5 г, 33,29 ммоль) в дихлорметане (30 мл) обрабатывали п-толуолсульфонилхлоридом (13,96 г, 73,24 ммоль) и гидроксидом калия (8,96 г, 159,79 ммоль) в атмосфере азота при 0°С. Полученную смесь перемешивали в течение 3 часов при 0°С. Добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 2 (13,2 г, 86,5%) в виде белого твердого вещества.
1H-ЯМР (600 МГц, CDCl3) δ 7,79 (м, 4Н), 7,35 (м, 4Н), 4,14 (м, 4Н), 3,65 (м, 4Н), 3,53 (с, 4Н), 2,44 (с, 6Н).
Соединение 3
Раствор соединения 2 (4,5 г, 9,81 ммоль) в диметилформамиде (20 мл) обрабатывали азидом натрия (1,6 г, 24,52 ммоль) в атмосфере азота. Полученную смесь перемешивали при 65°С в течение 10 часов. Добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 3 (1,96 г, 99%).
1H-ЯМР (600 МГц, CDCl3) δ 3,68-3,66 (м, 8Н), 3,37 (т, J=4,8 Гц, 4H).
Соединение 4
Раствор соединения 3 (500 мг, 2.49 ммоль) в 6,6 мл смешанного растворителя из диэтилового эфира, тетрагидрофурана и 1 н. HCl (V:V:V=3:0,6:3). Раствор трифенилфосфина (655 мг, 2.49 ммоль) в диэтиловом эфире (3,5 мл) медленно добавляли в течение 5 мин. Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Полученную смесь разбавляли этилацетатом (50 мл) и дистиллированной водой (50 мл) и нейтрализовали 1 н. раствором NaOH. Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 4 (370 мг, 85%).
1H-ЯМР (600 ΜГц, CDCl3) δ 3,69-3,63 (м, 6Н), 3,52 (т, J=5,1 Гц, 2Н), 3,40 (т, J=4,8 Гц, 2Н), 2,87 (т, J=5,1 Гц, 2Н).
LCB14-0530
Раствор соединения 4 (200 мг, 1,14 ммоль) в тетрагидрофуране (4 мл) последовательно обрабатывали триэтиламином (320 мкг, 2.28 ммоль) и раствором 4-хлор-7-нитробензофуразана (442 мг, 2,20 ммоль) в тетрагидрофуране (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения LCB14-0530 (305 мг, 78,8%).
1H-ЯМР (600 МГц, CDCl3) δ 8,47 (д, J=8,4 Гц, 1Н), 6,75 (с, 1Н), 6,17 (д, J=8,4 Гц, 1Н), 3,86 (т, J=4,8 Гц, 2Н), 3,66-3,73 (м, 8Н), 3,41 (т, J=4,8 Гц, 2Н).
2-9. Азид-линкер-лекарственное вещество: LCB14-0505, -0531 и -0510
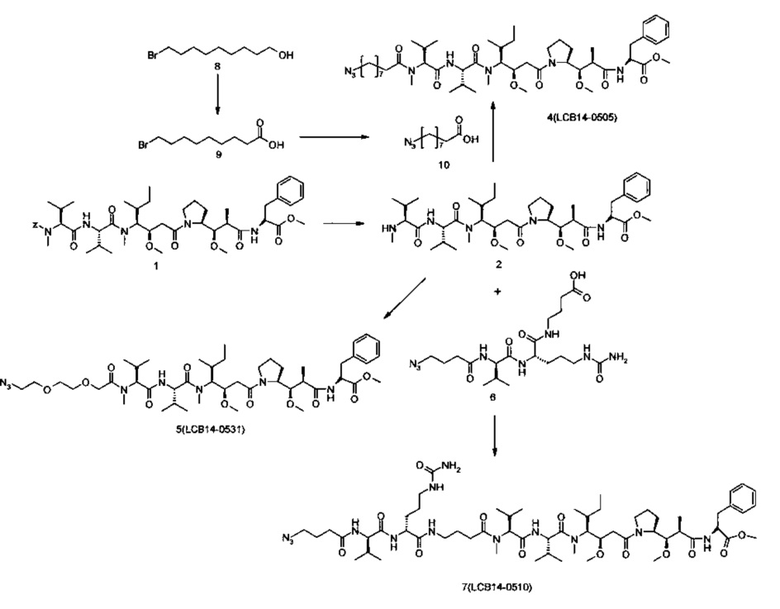
Соединение 2
Соединение 1 готовили на основании способа, описанного в ChemPharmBull, 1995, 43 (10), 1706-1718, содержание этого источника включено в настоящее изобретение посредством ссылки во всей полноте. Раствор соединения 1 (0,50 г, 0,57 ммоль) в трет-бутаноле (6 мл) и воде (0,6 мл) перемешивали в течение 4 часов в атмосфере водорода с Pd/C (6 мг, 0.06 ммоль). Рекционный раствор фильтровали через слой целита и фильтрат концентрировали при пониженном давлении с получением соединения 2 (0,42 г) в виде белого твердого вещества.
ЭУ-МС m/z: 747 (Μ+).
Соединение 9
Хром(VI) триоксид (CrO3, 7 г, 0,07 моль) растворяли в дистиллированной воде (10 мл) при 0°С. К раствору последовательно добавляли 18 Μ H2SO4 (6,1 мл, 0,11 моль) и дистиллированную воду (20 мл). Полученную смесь перемешивали в течение 5 минут (= реагента Джонса). Раствор 9-бром-1-нонанола (5 г, 22,4 ммоль) в ацетоне (250 мл) медленно обрабатывали реагентом Джонса (18 мл) при -5°С. После перемешивания полученной смеси в течение 3 часов при комнатной температуре зеленоватое твердое вещество отфильтровывали и фильтрат концентрировали. Остаток экстрагировали диэтиловым эфиром (100 мл) и водой (50 мл). Органический экстракт сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток подвергали колоночной флэш-хроматографии с получением соединения 9 (4,95 г, 93%).
1Н-ЯМР (600 МГц, CDCl3) δ 3,40 (т, J=6,6 Гц, 2Н), 2,35 (т, J=7,2 Гц, 2Н), 1,85 (м, 2Н), 1,62 (м, 2Н), 1,41 (м, 2Н), 1,32 (м, 6Н).
Соединение 10
Раствор соединения 9 (4 г, 16,86 ммоль) в Ν,Ν-диметилформамиде (15 мл) обрабатывали азидом натрия (1,64 г, 25,29 ммоль). Полученную смесь нагревали до 80°С в течение 6 часов при перемешивании. После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой отделяли, сушили над безводным Na2SO4, фильтровали и концентрировали в вакууме. Остаток подвергали колоночной флэш-хроматографией с получением соединения 10 (3,3 г, 98%).
1Н-ЯМР (600 МГц, CDCl3) δ 3,26 (т, J=7,2 Гц, 2Н), 2,35 (т, J=7,2 Гц, 2Н), 1,64 1,57 (м, 4Н), 1,35~1,32 (м, 8Н)
LCB14-0505
Раствор соединения 2 (0,16 г, 0,21 ммоль) и 9-азидо-нонановой кислоты (10) (47 мг, 0,24 ммоль) в метиленхлориде (3 мл) обрабатывали DIPEA (0,06 мл, 0,32 ммоль) и РуВОР (0,15 г, 0,28 ммоль) при 0°С. Полученную смесь перемешивали в течение 3 часов. Полученную смесь экстрагировали метиленхлоридом (100 мл) и водой (20 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения LCB14-0505 (0,12 г, 59%) в виде белого твердого вещества.
Масс-спектр с m/z: 928 (Μ+).
LCB 14-0531
Соединение LCB 14-0531 (65%) получали способом, аналогичным описанному выше способу.
Масс-спектр с m/z: 917 (М+).
LCB14-0510
Соединение 6 получали, используя способы, описанные в BioconjugateChem. 2002, 13, 855-869 и US 2005238649, содержание каждого из этих источников включено в настоящее описание посредством ссылки во всей их полноте. Раствор соединения 6 (69 мг, 0,15 ммоль) и соединение 2 (100 мг, 0,13 ммоль) в ДМФА (2 мл) обрабатывали DIPEA (0,04 мл, 0,2 ммоль) и РуВОР (0,09 г, 0,17 ммоль) при 0°С. Полученную смесь перемешивали в течение 3 часов. Этилацетат (100 мл) и воду (30 мл) использовали для извлечения органического слоя, который концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с метиленхлоридом и метанолом с получением соединения LCB14-0510 (94 мг, 64%) в виде коричневого твердого вещества.
Масс-спектр с m/z: 1199 (М+).
2-10. Ацетилен-линкер-NBD: LCB14-0532
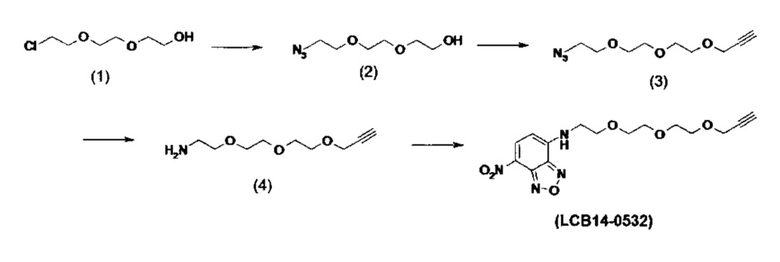
Соединение 2
Раствор соединения 1 (1 г, 5,93 ммоль) в 10 мл диметилформамида обрабатывали азидом натрия (578 мг, 8,89 ммоль) в атмосфере азота. Полученную смесь перемешивали при 80°С в течение 3 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением соединения 2 (1,03 г, 99%).
1Н-ЯМР (600 МГц, CDCl3) δ 3,75 (м, 2Н), 3,69 (м, 6Н), 3,62 (м, 2Н), 3,41 (т, J=3,5 Гц, 2Н), 2,30 (м, 1H).
Соединение 3
К суспензии гидрида натрия (55% в минеральном масле, 250 мг, 5,7 ммоль) в тетрагидрофуране (10 мл) при 0°С добавляли раствор соединения 2 (500 мг, 2,85 ммоль) в тетрагидрофуране (5 мл). Полученную смесь перемешивали в течение 1 часа. Полученную смесь затем нагревали до комнатной температуры и перемешивали в течение 2 часов. Добавляли пропаргилбромид (80% в толуоле, 800 мкл, 7,12 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 12 часов. Добавляли раствор хлорида аммония (20 мл) и диэтиловый эфир (30 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением соединения 3 (530 мг, 86,6%).
1H-ЯМР (600 МГц, CDCl3) δ 4,21 (д, J=2,4 Гц, 2Н), 3,66-3,72 (м, 10Н), 3,39 (т, J=5,1 Гц, 2Н), 2,43 (т, J=2,4 Гц, 1H)
Соединение 4
Раствор соединения 3 (250 мг, 1,17 ммоль) в 3 мл смешанного раствора тетрагидрофурана и дистиллированной воды (об:об 2:1) медленно обрабатывали трифенилфосфином (461 мг, 1,75 ммоль) в тетрагидрофуране (1 мл) в течение 5 минут. Полученную смесь перемешивали при комнатной температуре. После того как реакция была завершена, добавляли диэтиловый эфир (30 мл) и дистиллированную воду (30 мл). Полученную смесь подкисляли 1 н. HCl, и органический слой отделяли. Водный слой разбавляли дихлорметаном (50 мл) и нейтрализовали 1 н. раствором NaOH. Полученный таким образом органический слой отделяли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением светло-желтого соединения 4 (200 мг, 91,3 %).
1H-ЯМР (600 МГц, CDCl3) δ 4,18 (д, J=2,4 Гц, 2Н), 3,59-3,69 (м, 8Н), 3,48 (т, J=5,4 Гц, 2Н), 2,84 (с, 2Н), 2,40 (м, 1Н).
LCB14-0532
Раствор соединения 4 (195 мг, 1,04 ммоль) в тетрагидрофуране (4 мл) обрабатывали триэтиламином (290 мкг, 2,08 ммоль). Добавляли раствор 4-хлор-7-нитробензофуразана (270 мг, 1,35 ммоль) в тетрагидрофуране (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением соединения LCB14-0532 (280 мг, 77%).
1Н-ЯМР (600 МГц, CDCl3) δ 8,50 (д, J=8,4 Гц, 1H), 6,99 (с, 1H), 6,19 (д, J=8,4 Гц, 1H), 4,19 (д, J=2,4 Гц, 2Н), 3,89 (т, J=5,1 Гц, 2Н), 3.68-3.75 (м, 10Н), 2,41 (т, J=2,4 Гц, 1H).
2-11. Ацетилен-линкер-MMAF-OMe (LCB14-0536)

Соединение А
К суспензии NaH (55% в минеральном масле, 390 мг, 16,25 ммоль) в тетрагидрофуране (10 мл) при 0°С в атмосфере азота медленно добавляли раствор триэтиленгликоля (4 г, 26,63 ммоль) в тетрагидрофуране (20 мл). Добавляли медленно 80% пропаргилбромид в толуоле (1,97 г, 13,31 ммоль). Полученную смесь перемешивали при той же температуре в течение 2 часов. После того как реакция была завершена, добавляли дихлорметан (100 мл) и воду (100 мл). Полученный таким образом органический слой концентрировали, и остаток подвергали колоночной хроматографии с получением соединения (А) (1 г, 43%) в водной форме.
1H-ЯМР (600 МГц, CDCl3) δ 4,21-4,20 (м, 2Н), 3,74-3,66 (м, 10Н), 3,62-3,61 (м, 2Н), 2,43 (т, J=2,4 Гц, 1H).
Соединение В
К раствору соединения А (1 г, 5,31 ммоль) в ацетоне в атмосфере азота добавляли при 5°С медленно 5,3 мл реагента Джонса. Полученную смесь перемешивали в течение 3 часов, медленно нагревая до комнатной температуры. После того как реакция была завершена, добавляли этилацетат (100 мл) и воду (100 мл). Полученный таким образом органический слой концентрировали с получением соединения (В) (886 мг, 82 %) в виде желтой жидкости.
1H-ЯМР (600 МГц, CDCl3) δ 4,21 (д, J=2,4, 2Н), 4,18-4,17 (м, 2Н), 3,78-3,77 (м, 2Н), 3,74-3,70 (м, 6Н), 2,44 (т, J=2,4 Гц, 1H).
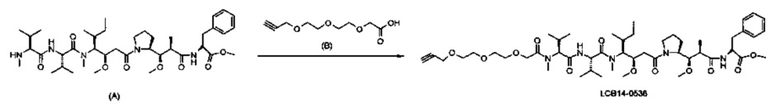
LCB14-0536
К раствору соединения (A) (MMAF-OMe, 100 мг, 0,13 ммоль) в ацетонитриле (2 мл) при комнатной температуре добавляли соединение (В) (27 мг, 0,13 ммоль), РуВОР (104 мг, 0,19 ммоль) и DIPEA (0,03 мл, 0,19 ммоль). Полученную смесь перемешивали в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и воду (20 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с дихлорметаном и метанолом с получением соединения LCB14-0536 (82 мг, 68%) в виде желтого твердого вещества.
Масс-спектр с m/z: 930 (Μ+).
2-12. Ацетилен-линкер(пептидная последовательность)-MMAF-ОМе (LCB14-0589)
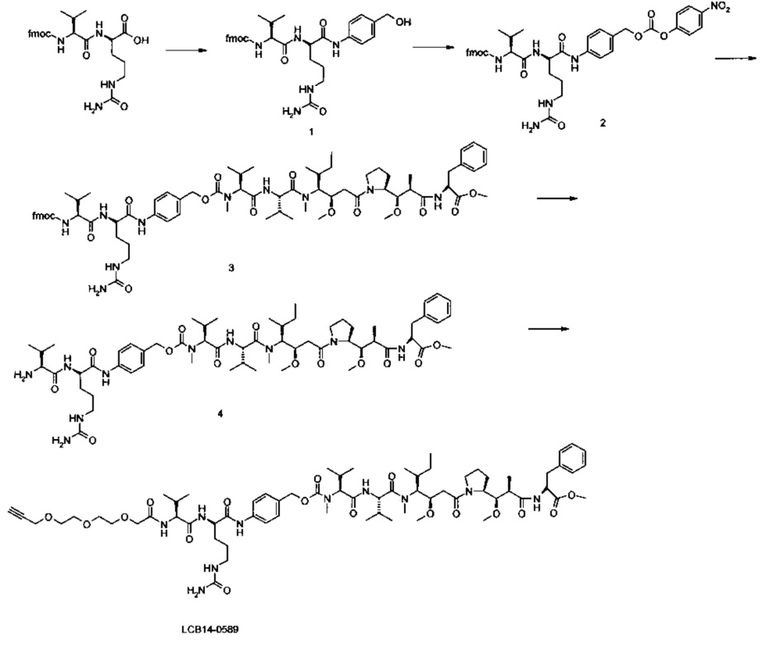
Соединение 1 (Fmoc-Val-Cit-PAB)
Fmoc-Val-Cit-OH получали по методике, описанной в WO 2007/008603, содержание данной ссылки включено в настоящее изобретение посредством ссылки во всей ее полноте. К раствору Fmoc-Val-Cit-OH (4,89 г, 9,85 ммоль) в дихлорметане (50 мл) и метанола (20 мл) в атмосфере азота добавляли пара-аминобензиловый спирт (2,43 г, 19,70 ммоль) и 1-этоксикарбонил-2-этокси-1,2-дигидрохинолин (1,98 г, 19,7 ммоль). Полученную смесь перемешивали в течение 12 часов при комнатной температуре. После того как реакция была завершена, растворитель концентрировали. Полученное твердое вещество промывали диэтиловым эфиром несколько раз, чтобы получить соединение 1 (4,12 г, 70 %) в виде желтого твердого вещества.
1Н-ЯМР (600 МГц, ДМСО-d6) δ 10,00 (с, 1Н), 8,12 (д, J=7,8 Гц, 1Н), 7,89 (д, J=7,8 Гц, 2Н), 7,75-7,72 (м, 2Н), 7,55 (д, J=7,8 Гц, 2Н), 7,44-7,41 (м, 2Н), 7,33-7,31 (м, 2Н), 7,23 (д, J=8,4 Гц, 2Н), 6,02 (шир. с, 1H), 5,41-5,38 (м, 2Н), 5,09 (шир. с, 1H), 4,42 (шс, 2Н), 4,30-4,28 (м, 1Н), 4,24-4,23 (м, 2Н), 3,94-3,91 (м, 1H), 3,02-2,99 (м, 1Н), 2,94-2,93 (м, 1H), 2,00-1,99 (м, 1H), 1,7 (шир. с, 1Н), 1,60 (шир. с, 1H), 1,43 (шир. с, 1H), 1,36 (шир., 1Н), 0,88-0,84 (м, 6Н).
Соединение 2 (Fmoc-Val-Cit-PABC-PNA)
Раствор соединения 1 (2 г, 3,32 ммоль) в ДМФА (8 мл) последовательно обрабатывали бис(4-нитрофенил)карбонатом (2,02 г, 6,64 ммоль) и диизопропилэтиламином (0,647 мл, 4,98 ммоль) в атмосфере азота. Полученную смесь перемешивали в течение 12 часов при комнатной температуре. После того как реакция была завершена, добавляли диэтиловый эфир для кристаллизации. Полученное твердое вещество промывали диэтиловым эфиром и водой несколько раз, чтобы получить соединение 2 (1,52 г, 60%) в виде желтого твердого вещества.
1H-ЯМР (600 МГц, ДМСО-d6) δ 10,19 (с, 1H), 8,31 (д, J=9,6 Гц, 2Н), 8,15 (д, J=7,8 Гц, 1H), 7,89 (д, J=7,2 Гц, 2Н), 7,75-7,72 (м, 2Н), 7,66 (д, J=8,4 Гц, 2Н), 7,57 (д, J=9,0 Гц, 2Н), 7,43-7,39 (м, 4Н), 7,32 (т, J=7,2 Гц, 2Н), 6,05-6,04 (м, 1H), 5,42 (м, 2Η), 5,24 (с, 2Η), 4,42 (м, 1Н), 4,30-4,28 (м, 1H), 425-4,23 (м, 2Н), 3,94-3,91 (м, 1H), 3,01-3,00 (м, 1H), 2,96-2,94 (м, 1Н), 2,00-1,99 (м, 1Н), 1,70 (м, 1Н), 1,59 (м, 1H), 1,45 (м, 1H), 1,37 (м, 1H), 0,89-0,83 (м, 6Н).
Масс-спектр с m/z: 767 (М+).
Соединение 3 (Fmoc-Val-Cit-PABC-MMAF-OMe)
Раствор соединения 2 (200 мг, 0.261 ммоль) и MMAF-OMe (194 мг, 0,261 ммоль) в ДМФА (2 мл) обрабатывали НОВТ (7,1 мг, 0,052 ммоль), пиридином (1 мл) и DIPEA (0,045 мл, 0,261 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 12 часов. После того как реакция была завершена, этилацетат (30 мл), воду (30 мл) и физиологический раствор (30 мл) использовали для экстракции органического слоя. Полученный таким образом органический слой концентрировали и подвергали колоночной хроматографии с получением соединения 3 (153 мг, 42%) в виде желтого твердого вещества.
Масс-спектр с m/z: 1375 (Μ+).
Соединение 4 (Val-Cit-PABC-MMAF-OMe)
К раствору соединения 3 (153 мг, 0,112 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре добавляли пиперидин (0,2 мл). Полученную смесь перемешивали при той же температуре в течение 2 часов. После того как реакция была завершена, проводили перекристаллизацию с эфиром и гексаном с получением соединения 4 (85 мг, 66%) в виде светло-желтого твердого вещества.
Масс-спектр с m/z: 1152 (М+).
LCB 14-0589 (Ацетилен-линкер-Val-Cit-PABC-MMAF-OMe)
К раствору соединения 4 (85 мг, 0.074 ммоль) и соединения В из примера 2-11 (18 мг, 0,088 ммоль) в ДМФА (2 мл) добавляли DIPEA (0,03 мл, 0,148 ммоль) и РуВОР (58 мг, 0,111 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. После того как реакция была завершена, смесь экстрагировали этилацетатом (20 мл) и водой (20 мл). Полученный сырой продукт подвергали колоночной хроматографии с получением соединения LCB14-0589 (35,4 мг, 36%) в виде белого твердого вещества.
ЭУ-MC m/z: 1336 (M+).
2-13. Ацетилен-линкер-Val-Cit-PABC-MMAE (LCB14-0602)
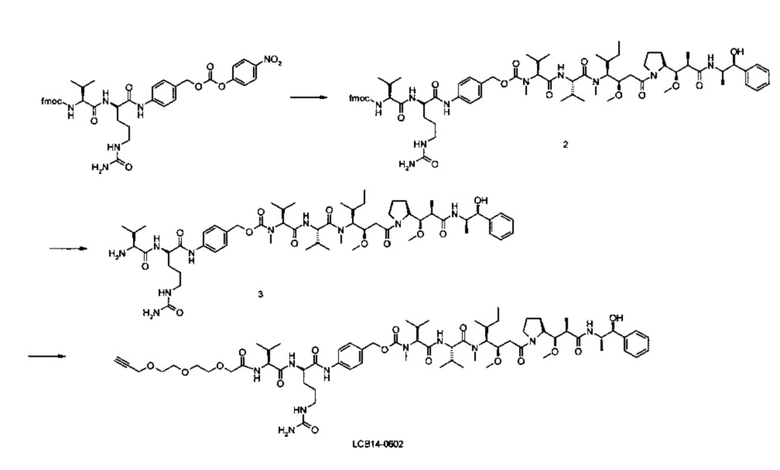
Соединение 2 (Fmoc-Val-Cit-PABC-MMAE)
К раствору Fmoc-Val-Cit-PABC-PNP (200 мг, 0,261 ммоль) и ММАЕ (187 мг, 0,261 ммоль) в ДМФА (2 мл) добавляли НОВТ (7,1 мг, 0,052 ммоль), пиридин (1 мл) и DIPEA (0,045 мл, 0,261 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 12 часов. После того как реакция была завершена, этилацетат (30 мл), воду (30 мл) и физиологический раствор (30 мл) использовали для экстракции органического слоя. Полученный таким образом органический слой концентрировали и подвергали колоночной хроматографии с получением соединения 2 (50 мг, 14,3%) в виде желтого твердого вещества.
ЭУ-MC m/z: 1346 (M+).
Соединение 3 (Val-Cit-PABC-MMAE)
К раствору соединения 2 (50 мг, 0,037 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре добавляли пиперидин (0,1 мл). Полученную смесь перемешивали при той же температуре в течение 2 часов. После того как реакция была завершена, проводили перекристаллизацию с эфиром и гексаном с получением соединения 3 (37 мг, 89%) в виде светло-желтого твердого вещества. ЭУ-MCm/z: 1124 (М+).
LCB14-0602 (Ацетилен-линкер-Val-Cit-PABC-MMAE)
К раствору соединения 3 (35 мг, 0,031 ммоль) и соединения В из примера 2-11 (7, 6 мг, 0,037 ммоль) в ДМФА (2 мл) при комнатной температуре добавляли DIPEA (0,011 мл, 0,062 ммоль) и РуВОР (24 мг, 0,47 ммоль). Полученную смесь перемешивали в течение 5 часов. После того как реакция была завершена, смесь экстрагировали этилацетатом (20 мл) и водой (20 мл). Полученный сырой продукт подвергали колоночной хроматографии с получением соединения LCB14-0602 (28, 5 мг, 70%) в виде белого твердого вещества.
Масс-спектр m/z: 1308 (М+).
2-14. Азид-линкер-димер PBD (пирролобензодиазепин) (LCB14-0577)
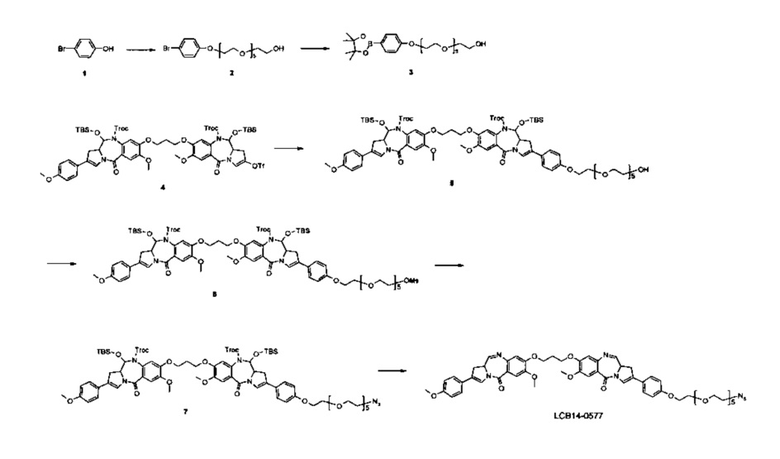
Соединение 2
К раствору соединения 1 (1,22 г, 7, 08 ммоль), трифенилфосфина (ТРР, 2,23 г, 8,50 ммоль) и гексаэтиленгликоля (2 г, 7,08 ммоль) в тетрагидрофуране (10 мл) при 0°С в атмосфере азота добавляли диизопропилазодикарбонат (DIAD, 1,67 мл, 8,50 ммоль). Полученную смесь перемешивали в течение 1 часа. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 2 (1,4 г, 45%).
1H-ЯМР (600 МГц, CDCl3) δ 7,35 (д, J=8,4 Гц, 2Н), 6,80 (д, J=8,4 Гц, 2Н), 4,09 (т, J=4,8 Гц, 2Н), 3,84 (т, J=4,8 Гц, 2Н), 3,72 (т, J=4,8 Гц, 4Н), 3,68~3,65 (м, 14Н), 3,60 (т, J=4,8 Гц, 2Н), 2,85 (шир. с, 1Н).
Соединение 3
К раствору соединения 2 (300 мг, 0,68 ммоль) в 1,4-диоксане (5 мл) последовательно добавляли ацетат калия (200 мг, 2,04 ммоль), PdCl2 (DPPF) (28 мг, 0,034 ммоль) и бис(пинаколато)дибор (174 мг, 0,68 ммоль). Полученную смесь перемешивали при 70°С в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 3 (300 мг, 90%).
1Н-ЯМР (600 МГц, CDCl3) δ 7,73 (д, J=8,4 Гц, 2Н), 6,90 (д, J=8,4 Гц, 2Н), 4,15 (т, J=4,8 Гц, 2Н), 3,86 (т, J=4,8 Гц, 2Н), 3,73~3,72 (м, 4Н), 3,68~3,64 (м, 14Н), 3,60 (т, J=4,8 Гц, 2Н), 1,33 (с, 12Н).
Соединение 4
Соединение 4 получали в соответствии с методикой, описанной в WO 2006/111759 A1, WO 2010/043880 А1 и WO 2010/010347 А1, содержание каждого из этих источников включено в настоящее описание посредством ссылки во всей их полноте.
1H-ЯМР (600 МГц, CDCl3) δ 7,35 (с, 1H), 7,29 (д, J=9 Гц, 2Н), 7,27 (с, 1Н), 7,23 (с, 1H), 7,17 (с, 1H), 6,89 (д, J=9 Гц, 2Н), 6,77 (с, 1H), 6,75 (с, 1H), 5,91 (м, 2Н), 5,23 (д, J=9 Гц, 2Н), 5,21 (д, J=9 Гц, 2Н), 4,29 (м, 2Н), 4,17~4,13 (м, 4Н), 3,96~3,91 (м, 8Н), 3,82 (с, 3Н), 3,33 (м, 2Н), 2,82 (м, 2Н), 2,44 (м, 2Н), 0,90 (2с, 18Н), 0,27 (2с, 12Н).
Соединение 5
Соединение 4 (83 мг, 0,059 ммоль), карбонат натрия (10 мг, 0,089 ммоль) и Pd(TPP)4 (3,4 мг, 0,003 ммоль) последовательно растворяли в смеси растворителей этанол/толуол/дистиллированная вода (0,3 мл / 0,3 мл / 0,3 мл). Добавляли раствор соединения 3 (31,6 мг, 0,065 ммоль) в толуоле (3 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 5 (79 мг, 74%).
1Н-ЯМР (600 МГц, CDCl3) δ 7,35 (м, 2Н), 7,31~7,27 (м, 6Н), 6,92~6,89 (м, 4Н), 6,78 (с, 2Н), 5,90 (д, J=9 Гц, 2Н), 5,23 (д, J=12,6 Гц, 2Н), 4,30 (м, 2Н), 4,16~4,13 (м, 6Н), 3,97~3,94 (м, 8Н), 3,87 (т, J=4,8 Гц, 2Н), 3,83 (с, 3Н), 3,74~3,64 (м, 18Н), 3,61 (м, 2Н), 3,34 (м, 2Н), 2,82 (м, 2Н), 2,45 (м, 2Н), 0,90 (с, 18Н), 0,25 (2с, 12Н).
Соединение 6
К раствору соединения 5 (250 мг, 0,155 ммоль) в тетрагидрофуране (3 мл) при 0°С добавляли 4-метилморфолин (34,2 мкг, 0,310 ммоль) и ангидрид метансульфокислоты (Ms2O, 32,5 мг, 0,186 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 6 (220 мг, 84%).
1Н-ЯМР (600 МГц, CDCl3) δ 7,33 (м, 2Н), 7,28~7,23 (м, 6Н), 6,89~6,86 (м, 4Н), 6,76 (с, 2Н), 5,88 (д, J=9 Гц, 2Н), 5,21 (д, J=12,6 Гц, 2Н), 4,35 (м, 2Н), 4,26 (м, 2Н), 4,13~4,11 (м, 6Н), 3,92 (с, 6Н), 3,84 (т, J=4,8 Гц, 2Н), 3,80 (с, 3Н), 3,74~3,60 (м, 20Н), 3,31 (м, 2Н), 3,06 (с, 3Н), 2,80 (м, 2Н), 2,43 (м, 2Н), 0,88 (с, 18Н), 0,23 (2с, 12Н).
Соединение 7
К раствору соединения 6 (100 мг, 0,059 ммоль) в диметилформамиде (2 мл) добавляли азид натрия (NaN3, 4,6 мг, 0,071 ммоль). Полученную смесь перемешивали при 55°С в течение 4 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 7 (85 мг, 88%).
1Н-ЯМР (600 МГц, CDCl3) δ 7,33 (шир. с, 2Н), 7,28~7,24 (м, 6Н), 6,89~6,87 (м, 4Н), 6,76 (с, 2Н), 5,88 (д, J=9 Гц, 2Н), 5,21 (д, J=12,6 Гц, 2Н), 4,26 (м, 2Н), 4,13~4,11 (м, 6Н), 3,92 (м, 8Н), 3,84 (т, J=4,8 Гц, 2Н), 3,80 (с, 3Н), 3,71 (м, 2Н), 3,67~3,64 (м, 16Н), 3,36 (т, J=4,8 Гц, 2Н), 3,31 (м, 2Н), 2,80 (м, 2Н), 2,43 (м, 2Н), 0,88 (с, 18Н), 0,23 (2с, 12Н).
LCB14-0577
К раствору соединения 7 (80 мг, 0,049 ммоль) в тетрагидрофуране (1,5 мл) добавляли 1 н. ацетат аммония (1 мл) и 10% пару кадмий/свинец (120 мг). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. После того как реакция была завершена, добавляли дихлорметан (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения LCB14-0577 (9 мг, 18%).
1Н-ЯМР (600 МГц, CDCl3) δ 7,86 (д, J=4,2 Гц, 2Н), 7,36 (м, 2Н), 7,31~7,23 (м, 6Н), 6,89~6,80 (м, 6Н), 4,34~4,22 (м, 6Н), 4,11 (м, 2Н), 3,92 (м, 6Н), 3,84~3,77 (м, 5Н), 3,71 (м, 2Н), 3,67-3,63 (, 18Н), 3,36 (м, 2Н), 3,03 (м, 2Н), 2,44~2,40 (м, 2Н).
ЭУ-MC m/z: 1017 (М+).
2-15. Ацетилен-линкер-димер PBD (LCB14-0578)
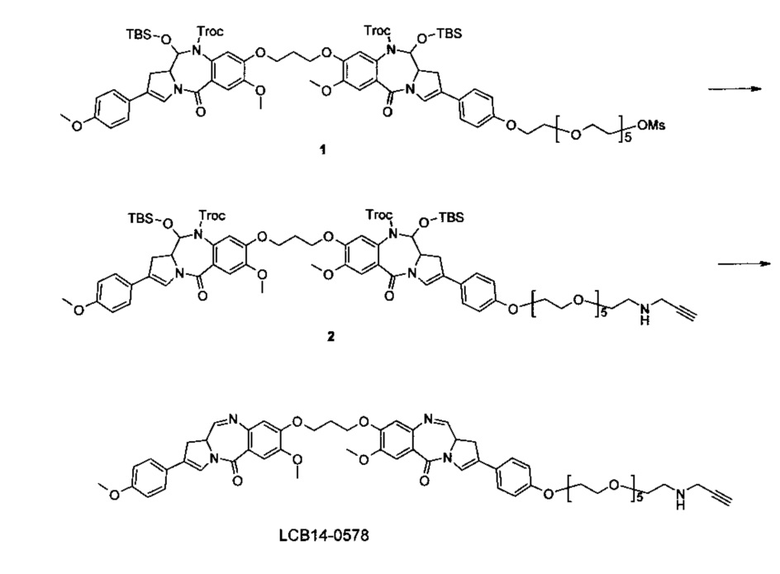
Соединение 2
К раствору соединения 6 примера 2-14 (95 мг, 0,056 ммоль) в ацетонитриле (1 мл) добавляли раствор карбоната натрия (18 мг, 0,168 ммоль) в пропаргиламине (18 мкл, 0,28 ммоль) и дистиллированную воду (500 мкл). Полученную смесь перемешивали при 40°С в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 2 (45 мг, 48%).
1Н-ЯМР (600 МГц, CDCl3) δ 7,35 (м, 2Н), 7,30~7,27 (м, 6Н), 6,91~6,89 (м, 4Н), 6,78 (с, 2Н), 5,91 (д, J=9 Гц, 2Н), 5,23 (д, J=11,4 Гц, 2Н), 4,30 (м, 2Н), 4,16~4,11 (м, 6Н), 3,94 (с, 6Н), 3,87 (т, J=4,8 Гц, 2Н), 3,83 (с, 3Н), 3,73 (м, 2Н), 3,69~3,60 (м 18Н), 3,45 (д, J=2,4 Гц, 2Н), 3,33 (м, 2Н), 2,87 (т, J=4,8 Гц, 2Н), 2,82 (м, 2Н), 2,45 (м, 2Н), 2,22 (т, J=4,4 Гц, 1Н), 0,90 (с, 18Н), 0,24 (2с, 12Н).
LCB14-0578
К раствору соединения 2 (40 мг, 0,024 ммоль) в тетрагидрофуране (750 мкг) добавляли 1 н. ацетат аммония (0,5 мл) и 10% кадмий-свинцовую пару (70 мг). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. После того как реакция была завершена, добавляли дихлорметан (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения LCB14-0578 (13 мг, 52%).
1H-ЯМР (600 МГц, CDCl3) δ 7,88 (д, J=4,2 Гц, 2Н), 7,38 (м, 2Н), 7,33~7,28 (м, 6Н), 6,91~6,86 (м, 6Н), 4,38~4,20 (м, 6Н), 4,13 (м, 2Н), 3,94 (с, 6Н), 3,88~3,80 (м, 5Н), 3,73 (м, 2Н), 3,69~3,61 (м, 16Н), 3,46 (д, J=2,4 Гц, 2Н), 3,39 (м, 2Н), 3,30 (м, 2Н), 2,88 (т, J=4,8 Гц, 2Н), 2,43 (м, 2Н), 2,23 (т, J=4,4 Гц, 1H).
ЭУ-MC m/z: 1028 (М+).
2-16. Ацетилен-линкер-димер PBD (пиридиниевая версия) (LCB14-0582)
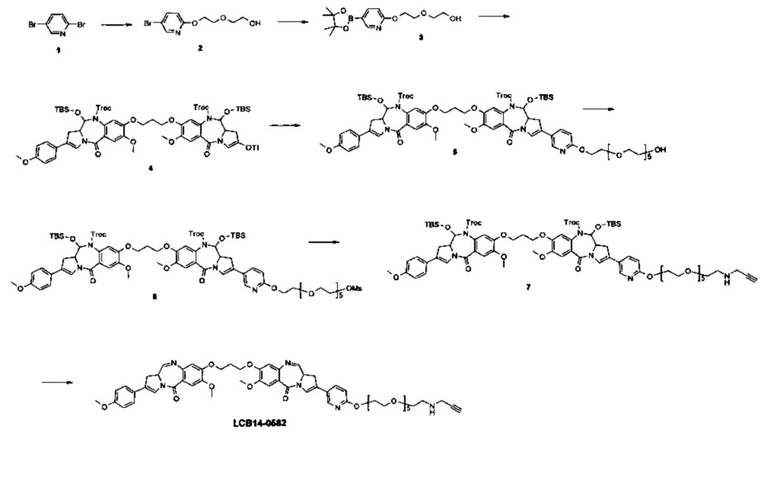
Соединение 2
К суспензии NaH (55% в минеральном масле, 184 мг, 4,22 ммоль) в тетрагидрофуране (5 мл) при 0°С в атмосфере азота добавляли гексаэтиленгликоль (2,4 г, 8,44 ммоль) в тетрагидрофуране (3 мл). Полученную смесь перемешивали в течение 10 минут при 0°С. Медленно добавляли раствор смеси, полученный путем растворения соединения 1 (1 г, 4,22 ммоль) в диметилформамиде (0,5 мл) и тетрагидрофуране (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа и затем перемешивали при 70°С в течение 12 часов. После охлаждения полученной смеси до 0°С, добавляли дистиллированную воду (2 мл). После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 2 (1,5 г, 81%).
1H-ЯМР (600 МГц, CDCl3) δ 8,13 (д, J=2,4 Гц, 1Н), 7,61 (дд, J=8,4, 2,4 Гц, 1H), 6,67 (д, J=9 Гц, 1H), 4,41 (м, 2Н), 3,81 (м, 2Н), 3,70~3,61 (м, 18Н), 3,58 (м, 2Н), 2,71 (шир. с, 1H).
Соединение 3
Раствор соединения 2 (500 мг, 1,14 ммоль) в диметилформамиде (5 мл) последовательно обрабатывали ацетатом калия (336 мг, 3,42 ммоль), PdCl2 (DPPF) (46,5 мг, 0,057 ммоль) и бис(пинаколато)дибором (318 мг, 1,25 ммоль). Полученную смесь перемешивали при 70°С в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 3 (250 мг, 45%).
1Н-ЯМР (400 МГц, CDCl3) δ 8,50 (с, 1H), 7,90 (д, J=8,4 Гц, 1Н), 6,74 (д, J=8,4 Гц, 1H), 4,50 (т, J=4,8 Гц, 2Н), 3,84 (м, 2Н), 3,74~3,70 (м, 20Н), 1,33 (с, 12Н).
Соединение 5
Соединение 4 (245 мг, 0,175 ммоль), карбонат натрия (28 мг, 0,262 ммоль) и Pd(TPP)4 (10 мг, 0,009 ммоль) последовательно растворяли в растворе смеси этанол/толуол/дистиллированная вода (1,5 мл / 1,5 мл / 1,5 мл). Добавляли раствор соединения 3 (94 мг, 0,192 ммоль) в толуоле (1,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 5 (100 мг, 35,5%).
1H-ЯМР (600 МГц, CDCl3) δ 8,02 (д, J=2,4 Гц, 1Н), 7,66 (м, 1H), 7,38 (с, 1H), 7,35 (с, 1Н), 7,29 (д, J=9 Гц, 2Н), 7,27 (м, 2Н), 6,89 (д, J=9 Гц, 2Н), 6,80 (д, J=8,4 Гц, 1H), 6,78 (с, 2Н), 5,90 (д, J=9 Гц, 2Н), 5,23 (дд, J=11,4, 4,2 Гц, 2Н), 4,47 (м, 2Н), 4,29 (м, 2Н), 4,17~4,12 (м, 2Н), 3,4 (м, 8Н), 3,86 (т, J=4,8 Гц, 2Н), 3,82 (м, 4Н), 3,74~3,65 (м, 18Н), 3,61 (м, 2Н), 3,33 (м, 2Н), 2,83 (м, 2Н), 2,45 (м, 2Н), 0,90 (с, 18Н), 0,25 (2с, 12Н).
Соединение 6
К раствору соединения 5 (180 мг, 0,11 мМ) в тетрагидрофуране (3 мл) при 0°С добавляли 4-метилморфолин (NMM, 61,5 мкг, 0,55 мМ) и ангидрид метансульфокислоты (Ms2O, 22 мг, 0,121 мМ). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл) для экстракции органического слоя. Органический слой сушили безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 6 (80 мг, 43%).
1Н-ЯМР (600 МГц, CDCl3) δ 8,03 (д, J=2,4 Гц, 1Н), 7,66 (дд, J=7,8, 2,4 Гц, 1H), 7,38 (с, 1Н), 7,35 (с, 1Н), 7,30 (д, J=9 Гц, 2Н), 7,27 (м, 2Н), 6,89 (д, J=9 Гц, 2Н), 6,80 (д, J=9 Гц, 1Н), 6,78 (с, 2Н), 5,90 (д, J=9 Гц, 2Н), 5,22 (дд, J=12, 4,2 Гц, 2Н), 4,47 (м, 2Н), 4,38 (м, 2Н), 4,30 (м, 2Н), 4,15 (м, 3Н), 3,99~3,93 (м, 7Н), 3,86 (м, 2Н), 3,83 (с, 3Н), 3,76 (м, 2Н), 3,71 (м, 2Н), 3,69~3,63 (м, 16Н), 3,34 (м, 2Н), 3,08 (с, 3Н), 2,83 (м, 2Н), 2,45 (м, 2Н), 0,90 (2 с, 18Н), 0,25 (2с, 12Н).
Соединение 7
К раствору соединения 6 (80 мг, 0,047 ммоль) в ацетонитриле (4 мл) добавляли раствор карбоната натрия (20 мг, 0,141 ммоль) в пропаргиламине (30 мкл, 0,47 ммоль) и дистиллированную воду (500 мкл). Полученную смесь перемешивали при 50°С в течение 12 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 7 (25 мг, 32%).
1Н-ЯМР (600 МГц, CDCl3) δ 8,03 (д, J=1,8 Гц, 1H), 7,66 (дд, J=8,4, 2,4 Гц, 1H), 7,38 (с, 1Н), 7,35 (с, 1Н), 7,30 (д, J=8,4 Гц, 2Н), 7,28 (м, 2Н), 6,89 (д, J=9 Гц, 2Н), 6,79 (д, J=9 Гц, 1Н), 6,78 (с, 2Н),), 5,90 (д, J=9 Гц, 2Н), 5,22 (дд, J=12, 4,2 Гц, 2Н), 4,47 (м, 2Н), 4,30 (м, 2Н), 4,17~4,14 (м, 3Н), 3,98~3,93 (м, 7Н), 3,86 (м, 2Н), 3,82 (с, 3Н), 3,72 (м, 2Н), 3,69~3,60 (м, 18Н), 3,45 (д, J=2,4 Гц, 2Н), 3,34 (м, 2Н), 2,87 (т, J=4,8 Гц, 2Н), 2,83 (м, 2Н), 2,45 (м, 2Н), 2,22 (м, 1H), 0,90 (2с, 18Н), 0,25 (2с, 12Н).
LCB14-0582
К раствору соединения 7 (25 мг, 0.015 ммоль) в тетрагидрофуране (750 мкг) добавляли 1 н. ацетат аммония (0,5 мл) и 10% кадмий-свинцовую пару (50 мг). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, добавляли диметилхлорметан (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения LCB14-0582 (6 мг, 38,4%).
1Н-ЯМР (600 МГц, CDCl3) δ 8,00 (м, 1Н), 7,88 (м, 2Н), 7,60 (м, 1H), 7,41~7,28 (м, 6Н), 6,90~6,71 (м, 5Н), 4,46 (м, 2Н), 4,35~4,24 (м, 4Н), 3,95~3,79 (м, 11Н), 3,70 (м, 2Н), 3,68~3,61 (м, 18Н), 3,47 (м, 2Н), 3,38 (м, 2Н), 3,04 (м, 2Н), 2,89 (т, J=5,4 Гц, 2Н), 2,40 (м, 2Н), 2,23 (шир. с, 1H).
Масс-спектр с m/z: 1029 (М+).
2-17. Амино-Peg5-димер PBD (LCB14-0594)
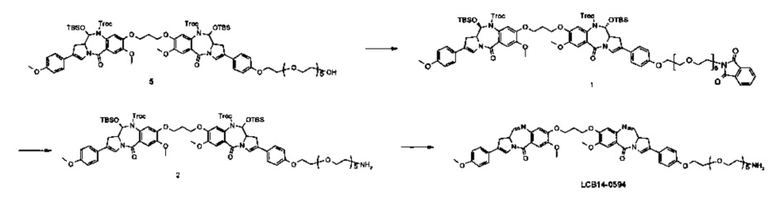
Соединение 1
К раствору соединения 5 примера 2-14 (456 мг, 0,284 ммоль) в тетрагидрофуране добавляли трифенилфосфин (108 мг, 0,411 ммоль) и фталимид (50 мг, 0,341 ммоль). DIAD (0,058 мл, 0,340 ммоль) медленно добавляли при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После того как реакция была завершена, смесь экстрагировали дихлорметаном (40 мл) и водой (40 мл). Остаток подвергали колоночной хроматографии с получением соединения 1 (492 мг, выход количественный) в виде желтого твердого вещества.
1Н-ЯМР (600 МГц, CDCl3) δ 7,84-7,82 (м, 2Н), 7,70-7,69 (м, 2Н), 7,34 (м, 2Н), 7,29-7,25 (м, 6Н), 6,90 (д, J=7,2, 4Н), 6,78 (с, 2Н), 5,92 (д, J=9,0, 2Н), 5,21 (д, J=12,6, 2Н), 4,28 (м, 2Н), 4,19-4,10 (м, 4Н), 3,93 (м, 6Н), 3,89-3,87 (м, 2Н), 3,86-3,84 (м, 2Н), 3,82 (с, 3Н), 3,74-3,71 (м, 4Н), 3,67-3,66 (м, 2Н), 3,63-3,62 (м, 6Н), 3,59-3,58 (м, 6Н), 3,33 (м, 2Н), 2,85-2,82 (м, 2Н), 2,42 (м, 2Н), 0,91 (с, 18Н), 0,27 (2с, 12Н).
Соединение 2
К раствору соединения 1 (492 мг, 0,283 ммоль) в этиловом спирте (2 мл) и тетрагидрофуране (2 мл) добавляли моногидрат гидразина (0,07 мл, 1,417 ммоль). Полученную смесь перемешивали при 60°С в течение 5 часов. После того как реакция была завершена, добавляли 2 мл этилацетата. Твердое вещество отфильтровывали. Фильтрат концентрировали и подвергали колоночной хроматографии с получением соединения 2 (380 мг, 83%) в виде желтого твердого вещества.
1H-ЯМР (600 МГц, CDCl3) δ 7,35 (шир. с, 2Н), 7,29-7,26 (м, 6Н), 6,92-6,88 (м, 4Н), 6,79 (шир. с, 2Н), 5,92 (д, J=8,4, 2Н), 5,21 (д, J=12, 2Н), 4,29-4,28 (м, 2Н), 4,19-4,17 (м, 6Н), 3,93-3,90 (м, 6Н), 3,89-3,87 (м, 2Н), 3,82 (с, 3Н), 3,75-3,73 (м, 2Н), 3,69-3,63 (м, 12Н), 3,35-3,31 (м, 2Н), 2,96 (шс, 2Н), 2,85 (д, J=16,8, 2Н), 2,43 (м, 2Н), 0,91 (с, 18Н), 0,27 (2с, 12Н). Масс-спектр с m/z: 1606 (М+).
LCB14-0594
Раствор соединения 2 (25 мг, 0,015 ммоль) в тетрагидрофуране (1 мл) при комнатной температуре добавляли к 1 н. ацетату аммония (0,4 мл) и 10% кадмий-свинцовой паре (40 мг). Полученную смесь перемешивали при той же температуре в течение 12 часов. После того как реакция была завершена, полученную смесь фильтровали с дихлорметаном. Отфильтрованный раствор концентрировали и подвергали колоночной хроматографии с получением LCB14-0594 (4 мг, 26%) в виде желтого твердого вещества.
Масс-спектр с m/z: 990 (М+).
2-18. Глюкуронид-линкер-PBD мономер (LCB14-0596)
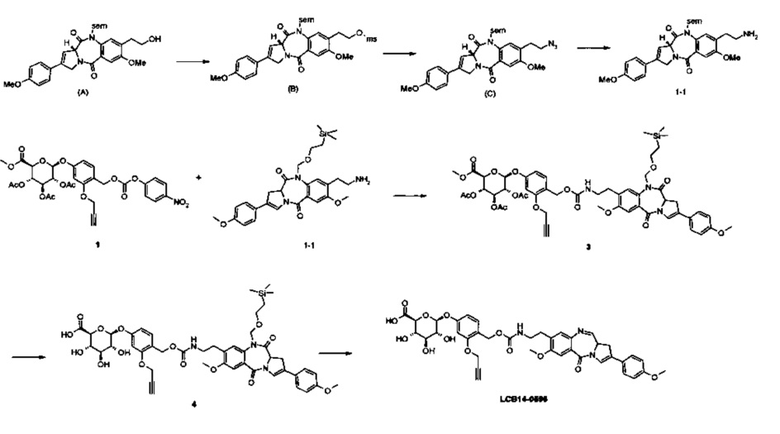
Соединение (В)
К раствору соединения (А) (300 мг, 0,57 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре добавляли N-метилморфолин (0,16 мл, 1,43 ммоль) и ангидрид метансульфоновой кислоты (120 мг, 0,69 ммоль). Полученную смесь перемешивали в течение 4 часов, Добавляли этилацетат (100 мл) и воду (50 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения (В) (330 мг, 96%).
1H-ЯМР (600 МГц, CDCl3) δ: 7,53 (с. 1H), 7,40 (с. 1Н), 7,39-7,37 (м, 2Н), 7,33 (т. J=1,8 Гц, 1H), 6,90-6,89 (м. 2Н), 5,47 (д. J=10,2 Гц, 1Н), 4,81 (д. J=10,2 Гц, 1H), 4,62 (дд. J=7,2, 3,0 Гц, 1H), 4,49-4,41 (м. 2Н), 3,97-3,93 (м. 1H), 3,92 (с. 3Н), 3,83 (с. 3Н), 3,76-3,72 (м. 1Н), 3,68-3,64 (м. 1H), 3,17-3,10 (м. 3Н), 2,96 (с. 3Н), 0,98 (т. J=8,4 Гц, 2Н), 0,02 (с. 9Н).
ЭУ-МС m/z: 603 (М+).
Соединение (C)
К раствору соединения (С) (330 мг, 0,55 ммоль) в ДМФА (3 мл) при комнатной температуре добавляли азид натрия (43 мг, 0,66 ммоль). Полученную смесь перемешивали при 60°С в течение 3 часов. Добавляли этилацетат (100 мл) и воду (50 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения (С) (307 мг, 99%) в виде желтого твердого вещества.
1H-ЯМР (600 МГц, CDCl3) δ: 7,54 (с, 1H), 7,38-7,37 (м, 3Н), 7,34 (т, J=1,8 Гц, 1H), 6,90-6,88 (м, 2Н), 5,49 (д, J=10,2 Гц, 1Н), 4,76 (д, J=10,2 Гц, 1H), 4,63 (дд, J=7,2, 3,0 Гц, 1H), 3,96-3,93 (м, 1H), 3,92 (с, 3Н), 3,83 (с, 3Н), 3,79-3,75 (м, 1H), 3,69-3,65 (м, 1H), 3,52-3,50 (м, 2Н), 3,16-3,12 (м, 1H), 3,03-2,99 (м, 1H), 2,96-2,91 (м, 1Н), 0,99 (т, J=8,4 Гц, 2Н), 0,02 (с, 9Н).
ЭУ-МС m/z: 550 (Μ+).
Соединение (1-1)
К раствору соединения (С) (500 мг, 0,91 ммоль) в тетрагидрофуране (2 мл) и дистиллированной воде (0,5 мл) при комнатной температуре добавляли трифенилфосфин (285 мг, 1,09 ммоль). Полученную смесь перемешивали при 40°С в течение 13 часов. Добавляли этилацетат (200 мл) и воду (100 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения (1-1) (435 мг, 93%) в виде желтого твердого вещества.
1Н-ЯМР (600 МГц, CDCl3) δ: 7,50 (с, 1H), 7,38-7,36 (м, 3Н), 7,33 (т, J=1,8 Гц, 1Н), 6,90-6,88 (м, 2Н), 5,47 (д, J=9,6 Гц, 1H), 4,81 (д, J=9,6 Гц, 1Н), 4,67 (дд, J=7,2, 3,0 Гц, 1H), 3,95-3,92 (м, 1Н), 3,91 (с, 3Н), 3,83 (с, 3Н), 3,76-3,72 (м, 1Н), 3,68-3,64 (м, 1H), 3,15-3,10 (м, 2Η), 3,06-2,96 (м, 2Η), 2,94-2,88 (м, 1Η), 2,86-2,80 (м, 1Η), 0,98 (т, J=8,4 Гц, 2Η), 0,02 (с, 9Н).
Масс-спектр с m/z: 524 (Μ+).
Соединение 3
К раствору соединения 7, полученного в примере 2-4 (126 мг, 0.190 ммоль), и соединения (1-1) (100 мг, 0.190 ммоль) в диметилформамиде (3 мл) добавляли триэтиламин (TEA, 80 мкг, 0,57 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 3 (178 мг, 89%).
1Н-ЯМР (400 МГц, мг) δ 7,46 (с, 1Н), 7,37 (д, J=8,8 Гц, 2Н), 7,34 (м, 2Н), 7,22 (м, 1H), 6,87 (д, J=8,8 Гц, 2Н), 6,71 (д, J=2,0 Гц, 1Н), 6,60 (м, 1H), 5,44 (д, J=10,4 Гц, 1Н), 5,34 (м, 2Н), 5,27 (м, 1Н), 5,16 (д, J=7,6 Гц, 1Н), 5,07 (с, 2Н), 4,82~4,77 (м, 2Н), 4,68 (д, J=2,0 Гц, 2Н), 4,60 (м, 1H), 4,19 (д, J=9,2 Гц, 1H), 3,93 (м, 1H), 3,87 (с, 3Н), 3,82 (с, 3Н), 3,72~3,61 (м, 5Н), 3,45 (м, 2Н), 3,11 (м, 1H), 2,93~2,84 (м, 2Н), 2,51 (шир. с, 1H), 2,05 (с, 3Н), 2,04 (с, 3Н), 2,03 (с, 3Н), 0,97 (т, J=7,2 Гц, 2Н), 0,01 (с, 9Н).
Соединение 4
К раствору соединения 3 (100 мг, 0,094 ммоль) в метаноле (5 мл) при 0°С добавляли гидроксид лития (40 мг, 1,880 ммоль) в дистиллированной воде (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, метанол удаляли при пониженном давлении. Остаток разбавляли дистиллированной водой (50 мл) и медленно подкисляли уксусной кислотой до рН 3. Экстракцию проводили три раза дихлорметаном (3×50 мл). Полученный продукт концентрировали при пониженном давлении с получением твердого соединения. Твердое соединение промывали диэтиловым эфиром (50 мл) с получением соединения 4 (86,5 мг, 100%).
1Н-ЯМР (600 МГц, CD3OD) δ 7,43 (с, 1H), 7,41 (д, J=9 Гц, 2Н), 7,30 (д, J=10,2 Гц, 2Н), 7,14 (д, J=7,8 Гц, 1Н), 6,90 (д, J=9 Гц, 2Н), 6,86 (м, 1H), 6,66 (м, 1H), 5,22 (м, 2Н), 4,98~4,94 (м, 3Н), 4,71~4,67 (м, 3Н), 3,96 (м, 1Н), 3,87 (с, 3Н), 3,78 (с, 3Н), 3,75 (м, 1Н), 3,59~3,47 (м, 5Н), 3,36 (м, 2Н), 3,25 (м, 1Н), 3,13 (м, 1Н), 2,90 (шир. с, 1H), 2,85 (м, 2Н), 0,83 (м, 2Н), 0,01 (с, 9Н).
ЭУ-МС m/z: 904 (Μ+).
LCB 14-0596
К раствору соединения 4 (86,5 мг, 0,094 ммоль) в тетрагидрофуране (1 мл) и этанола (1 мл) при 0°С добавляли 2М раствор боргидрида лития в тетрагидрофуране (940 мкг, 1,88 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 12 часов. Добавляли дополнительный 2М раствор борогидрид лития в тетрагидрофуране, (1,41 мл, 2,82 ммоль). Полученную смесь перемешивали в течение 5 часов и охлаждали до 0°С. Реакцию гасили добавлением 1%-ного раствора муравьиной кислоты (33 мл). Полученную смесь перемешивали в течение 3 часов. После того как реакция была завершена, смесь экстрагировали дистиллированной водой (50 мл) и раствором смеси этилацетата (20 мл) и метанола (10 мл). Остаток подвергали колоночной хроматографии с использованием хлороформа/метанола/муравьиной кислоты (V:V:V=9:1:0,05) с получением соединения LCB14-0596 (50 мг, 69%).
ЭУ-МС m/z: 756 (М+).
2-19. Глюкуронид-линкер-димер PBD (LCB14-0597)
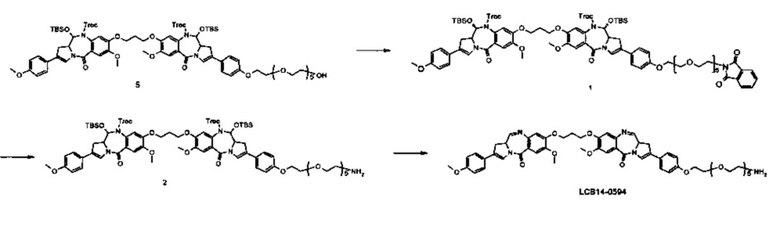
Соединение 3
К раствору соединения 7, полученного в примере 2-4 (150 мг, 0,220 ммоль), и соединения 2 примера 2-17 (365 мг, 0,220 ммоль) в диметилформамиде (3 мл) добавляли триэтиламин (95 мкг, 0,66 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После того как реакция была завершена, добавляли этилацетат (100 мл) и дистиллированную воду (100 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 3 (310 мг, 64%).
1H-ЯМР (600 МГц, CDCl3) δ 7,35 (м, 2Н), 7,30~7,25 (м, 7Н), 6,90 (м, 4Н), 6,78 (с, 2Н), 6,73 (д, J=2,4 Гц, 1H), 6,60 (дд, 8,4, 1,8 Гц, 1Н), 5,90 (д, J=2,4 Гц, 2Н), 5,36~5,32 (м, 2Н), 5,27 (м, 2Н), 5,22 (м, 2Н), 5,13 (д, J=7,2 Гц, 1H), 5,09 (с, 2Н), 4,69 (д, J=2,4 Гц, 2Н), 4,29 (м, 2Н), 4,17~4,13 (м, 6Н), 3,94 (м, 8Н), 3,85 (т, J=4,8 Гц, 2Н), 3,82 (с, 3Н), 3,73 (с, 3Н), 3,71 (м, 2Н), 3,67~3,59 (м, 14Н), 3,54 (т, J=4,8 Гц, 2Н), 3,39~3,31 (м, 4Н), 2,82 (м, 2Н), 2,52 (т, J=2,4 Гц, 1H), 2,44 (м, 2Н), 2,06 (с, 3Н), 2,05 (с, 3Н), 2,04 (с, 3Н), 0,91 (с, 18Н), 0,26 (2с, 12Н).
Соединение 4
К раствору соединения 3 (100 мг, 0,047 ммоль) в метаноле (3 мл) и тетрагидрофуране (1,5 мл) при 0°С добавляли гидроксид лития (20 мг, 0,47 ммоль) в дистиллированной воде (1,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, органический растворитель удаляли при пониженном давлении. Остаток разбавляли дистиллированной водой (50 мл) и медленно подкисляли с 0,5 н. раствором HCl до рН 3. Экстракцию проводили три раза дихлорметаном (3×50 мл). Экстракт концентрировали при пониженном давлении с получением соединения 4 (93,4 мг, 100%).
1Н-ЯМР (600 МГц, CDCl3) δ 7,35 (м, 2Н), 7,30~7,24 (м, 7Н), 4,89 (м, 4Н), 6,78 (м, 3Н), 6,64 (м, 1Н), 5,91 (м, 2Н), 5,65 (м, 1H), 5,21 (м, 2Н), 5,07 (м, 2Н), 4,89 (м, 1Н), 4,67 (м, 2Н), 4,28 (м, 2Н), 4,18~4,12 (м, 6Н), 3,93 (м, 8Н), 3,85~3,82 (м, 5Н), 3,72 (м, 2Н), 3,65~3,54 (м, 20Н), 3,34~3,32 (м, 4Н), 2,82 (м, 2Н), 2,56 (м, 1Н), 2,44 (м, 2Н), 0,90 (2 с, 18Н), 0,25 (2 с, 12Н).
LCB14-0597
К раствору соединения 4 (90 мг, 0,045 ммоль) в тетрагидрофуране (1,5 мл) добавляли 1 н. ацетат аммония (1,2 мл) и 10% кадмий-свинцовой пары (120 мг). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. После того как реакция была завершена, добавляли этилацетат (50 мл) и дистиллированную воду (50 мл). Полученный таким образом органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения LCB14-0597 (16,4 мг, 26%).
ЭУ-MC m/z: 1371 (М+).
2-20. Амино-Peg1-димер PBD (LCB14-0599)
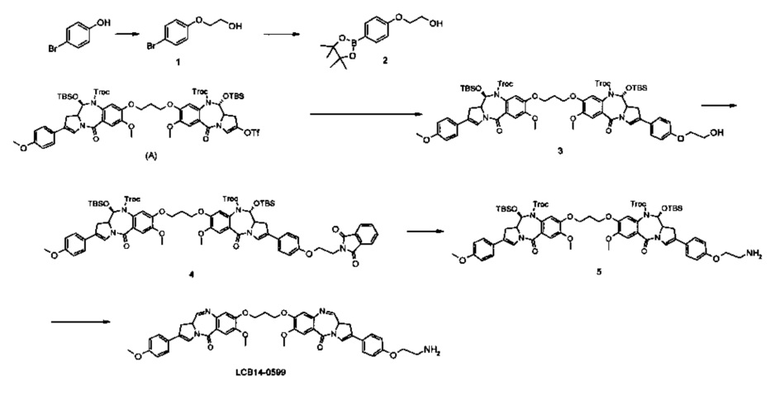
Соединение 1
К раствору 4-бромфенола (4,0 г, 23,1 ммоль) в этаноле (18 мл) при комнатной температуре добавляли гидроксид натрия (1,0 г, 25,40 ммоль) и 2-бромэтанол (1,7 мл, 23,10 ммоль). Добавляли этилацетат (500 мл) и воду (200 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения 1 (4,3 г, 86%) в жидкой форме.
1Н-ЯМР (600 МГц, CDCl3) δ: 7,39-7,36 (м, 2Н), 6,81-6,78 (м, 2Н), 4,05-4,03 (м, 2Н), 3,95 (т, J=4,2 Гц, 2Н), 2,18 (шир. с, 1Н).
Соединение 2
К раствору соединения 1 (0,3 г, 1,38 ммоль) в 1,4-диоксане (10 мл) при комнатной температуре добавляли бис(пинаколато)дибор (0,35 г, 1,38 ммоль), ацетат калия (0,41 г, 4,14 ммоль) и PdCl2 (DPPF) (56 мг, 0,07 ммоль). Полученную смесь перемешивали при 70°С в течение 12 часов и затем концентрировали при пониженном давлении. Фильтрование проводили с этилацетатом. Отфильтрованный раствор концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения 2 (0,36 г, 97%).
1H-ЯМР (600 МГц, CDCl3) δ: 7,76-7,75 (м, 2Н), 6,92-6,91 (м, 2Н), 4,11 (т, J=4,2 Гц, 2Н), 3,97-3,96 (м, 2Н), 1,99 (шир. с, 1H), 1,33 (с, 12Н).
Соединение 3
Раствор соединения (А) (85 мг, 0,11 ммоль), который был получен в соответствии со способами, описанными в WO 2006/111759, WO 2010/043880 и WO 2010/010347, содержание каждого из этих источников включены в настоящее изобретение посредством ссылки во всей полноте, и соединение 2 (35 мг, 0,13 ммоль) в толуоле (2 мл) добавляли к карбонату натрия (17 мг, 0,16 ммоль), дистиллированной воде (1 мл) и этанолу (1 мл). Затем полученную смесь перемешивали в течение 5 мин, добавляли Pd(ТРР3)4 (22 мг, 0,02 ммоль). Полученную смесь перемешивали в течение 2 часов. Добавляли этилацетат (10 мл) и воду (10 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения 3 (79 мг, 53%) в виде желтого твердого вещества.
1Н-ЯМР (600 МГц, CDCl3) δ: 7,36-7,35 (м, 2Н), 7,32-7,25 (м, 6Н), 6,92-6,89 (м, 4Н), 6,78 (с, 2Н), 5,92 (д, J=9,0 Гц, 2Н), 5,22 (д, J=12,0 Гц, 2Н), 4,30-4,28 (м, 2Н), 4,17-4,10 (м, 6Н), 3,98-3,94 (м, 4Н), 3,94 (с, 6Н), 3,83 (с, 3Н), 3,37-3,32 (м, 2Н), 2,85-2,82 (м, 2Н), 2,46-2,44 (м, 2Н), 1,98 (шир. с, 1Н), 0,91 (с, 18Н), 0,26 (2с, 12Н).
ЭУ-MC m/z: 1387 (М+).
Соединение 4
К раствору соединения 3 (77 мг, 0,06 ммоль) в тетрагидрофуране (2 мл) при комнатной температуре последовательно добавляли трифенилфосфин (18 мг, 0,07 ммоль), фталимид (10 мг, 0,07 ммоль) и DIAD (13 мкл, 0,07 ммоль). Полученную смесь перемешивали в течение 12 часов. Добавляли этилацетат (10 мл) и воду (10 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения 4 (72 мг, 87 %) в виде желтого твердого вещества.
1Н-ЯМР (600 МГц, CDCl3) δ: 7,88-7,86 (м, 2Н), 7,77-7,75 (м, 2Н), 7,39-7,36 (м, 2Н), 7,30-7,24 (м, 6Н), 6,90-6,86 (м, 4Н), 6,78 (д, J=1,8 Гц, 2Н), 5,92-5,88 (м, 2Н), 5,24-5,22 (м, 2Н), 4,28-4,24 (м, 4Н), 4,17-4,11 (м, 6Н), 3,98-3,90 (м, 8Н), 3,83 (с, 3Н), 3,36-3,29 (м, 2Н), 2,85-2,78 (м, 2Н), 2,47-2,43 (м, 2Н), 0,91 (д, J=1,8 Гц, 18Н), 0,27-0,24 (м, 12Н).
ЭУ-MC m/z: 1516 (М+).
Соединение 5
Раствор соединения 4 (70 мг, 0,05 ммоль) в этаноле (2 мл) при комнатной температуре обрабатывали моногидратом гидразина (12 мкл, 0,23 ммоль). Полученную смесь перемешивали при 60°С в течение 5 часов. Твердое вещество отфильтровывали с помощью этилацетата (10 мл). Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с дихлорметаном и метанолом с получением соединения 5 (64 мг, 63%).
1H-ЯМР (600 МГц, CDCl3) δ: 7,36-7,35 (м, 2Н), 7,32-7,25 (м, 6Н), 6,92-6,89 (м, 4Н), 6,78 (с, 2Н), 5,92 (д, J=9,0 Гц, 2Н), 5,22 (д, J=12,0 Гц, 2Н), 4,30-4,28 (м, 2Н), 4,17-4,10 (м, 6Н), 3,98-3,94 (м, 4Н), 3,94 (с, 6Н), 3,83 (с, 3Н), 3,37-3,32 (м, 2Н), 2,85-2,82 (м, 2Н), 2,46-2,44 (м, 2Н), 1,98 (шир. с, 1H), 0,91 (с, 18Н), 0,26 (2с, 12Н).
Масс-спектр с m/z: 1386 (М+).
LCB14-0599
К раствору соединения 5 (30 мг, 0,02 ммоль) в тетрагидрофуране (2 мл) при комнатной температуре добавляли 1 н. раствор ацетата аммония (0,6 мл) и кадмий/свинцовую пару (60 мг). Полученную смесь перемешивали в течение 4 часов. Твердое вещество отфильтровывали с помощью этилацетата (10 мл).
Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с дихлорметаном и метанолом с получением соединения LCB14-0599 (9,0 мг, 60%) в виде желтого твердого вещества.
1Н-ЯМР (600 МГц, CDCl3, CD3OD _1 капля) δ: 7,54-7,49 (м, 3Н), 7,35-7,30 (м, 5Н), 7,26 (с, 1Н), 6,93-6,86 (м, 5Н), 6,51 (с, 1Н), 6,29 (с, 1H), 4,67-4,59 (м, 2Н), 4,28-4,09 (м, 6Н), 3,85 (с, 9Н), 3,31-3,27 (м, 1H), 3,07-3,03 (м, 2Н), 2,92-2,89 (м, 1Н), 2,39-2,30 (м, 2Н), 2,05-2,03 (м, 2Н).
Масс-спектр с m/z: 770 (М+).
2-21. Модифицированное GPP-производное, включающее карбонильную группу (LCB14-0606)
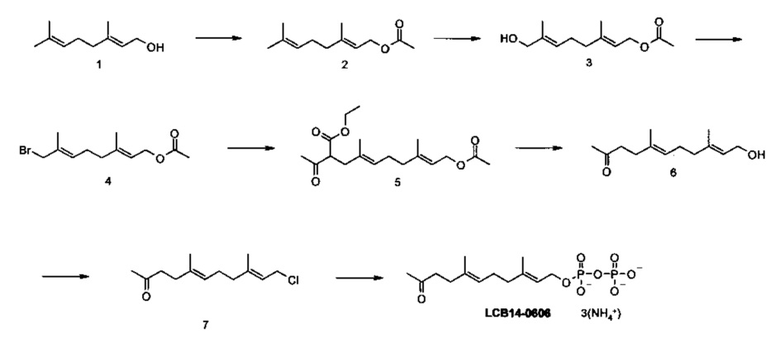
Соединение 2
К раствору соединения 1 (3 г, 19.45 ммоль) в пиридине при комнатной температуре добавляли уксусный ангидрид (7,9 мл, 77,8 ммоль). Полученную смесь перемешивали в течение 2 часов. Добавляли петролейный эфир (100 мл) и 0,1 н. HCl (100 мл). Полученный таким образом органический слой концентрировали при пониженном давлении с получением соединения 2 (3,81 г, 100%) в водной форме.
1H-ЯМР (600 МГц, CDCl3) δ 5,35-5,33 (м, 1H), 5,08-4,58 (м, 1H), 4,59 (д, J=6,6 Гц, 2Н), 2,11-2,03 (м, 4Н), 2,05 (с, 3Н), 1,70 (с, 3Н), 1,68 (с, 3Н), 1,60 (с, 3Н).
Соединение 3
К раствору соединения 2 (3,81 г, 19,41 ммоль) в дихлорметане (30 мл) при комнатной температуре последовательно добавляли диоксид селена (65 мг, 0.58 ммоль) и 70% трет-бутилгидропероксид (6,72 мл, 48,52 ммоль). Полученную смесь перемешивали в течение 20 часов. После того как реакция была завершена, добавляли дихлорметан (100 мл) и воду (100 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения 3 (1,8 г, 43 %) в виде жидкости.
1Н-ЯМР (600 МГц, CDCl3) δ 5,38-5,30 (м, 2Н), 4,59 (д, J=7,2 Гц, 2Н), 4,00-3,99 (д, J=6 Гц, 2Н), 2,18-2,15 (м, 2Н), 2,10-2,06 (м, 2Н), 2,05 (с, 3Н), 1,70 (с, 3Н), 1,66 (с, 3Н).
Соединение 4
К раствору соединения 3 (1,8 г, 8,48 ммоль) в дихлорметане (18 мл) при 0°С добавляли трифенилфосфин (3,33 г, 12,72 ммоль) и тетрабромид углерода (3,37 г, 10,18 ммоль). Полученную смесь перемешивали при 0°С в течение 4 часов. Добавляли дихлорметан (100 мл) и воду (100 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения 4 (2,33 г, 100%) в жидкой форме.
1H-ЯМР (600 МГц, CDCl3) δ 5,57-5,55 (м, 1Н), 5,35-5,32 (м, 2Н), 4,59 (д, J=7,2 Гц, 2Н), 3,96 (с, 2Н), 2,18-2,15 (м, 2Н), 2,10-2,07 (м, 2Н), 2,05 (с, 3Н), 1,75 (с, 3Н), 1,70 (с, 3Н).
Соединение 5
К раствору гидрида натрия (348 мг, 8,71 ммоль) в тетрагидрофуране (35 мл) при 0°С добавляли по каплям раствор этилацетоацетата (1,85 мл, 14,52 ммоль) в тетрагидрофуране (5 мл). Затем полученную смесь перемешивали при 0°С в течение 30 минут, соединение 4 (2 г, 7,26 ммоль), растворенное в тетрагидрофуране (5 мл), медленно добавляли при 0°С. Полученную смесь перемешивали при 80°С в течение 4 часов. Добавляли этилацетат (80 мл) и воду (80 мл). Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с этилацетатом и гексаном с получением соединения 5 (1,56 г, 66 %) в виде белой жидкости.
1Н-ЯМР (600 МГц, CDCl3) δ 5,34-5,31 (м, 1H), 5,17-5,14 (м, 1Н), 4,60-4,58 (м, 2Н), 4,20-4,16 (м, 2Н), 3,61 (т, J=7,2 Гц, 2Н), 2,55-2,51 (м, 2Н), 2,22 (с, 3Н), 2,12-2,02 (м, 4Н), 2,06 (с, 3Н), 1,27 (т, J=7,2 Гц, 3Н).
Соединение 6
К раствору соединения 5 (1,56 г, 4,81 ммоль) в этаноле (20 мл) добавляли гидроксид калия (2,16 г, 38,47 ммоль) с этанолом (20 мл). Полученную смесь перемешивали в 100°С в течение 4 часов, разбавляли этиловым эфиром (100 мл) и 0,1 н. раствором HCl (50 мл), а затем нейтрализовали раствором Na2CO3. Полученный таким образом органический слой концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии с получением соединения 6 (819 мг, 81%).
1H-ЯМР (600 МГц, CDCl3) δ 5,39-5,37 (м, 1Н), 5,09-5,07 (м, 1Н), 4,15 (д, J=6,6 Гц, 2Н), 2,53-2,51 (м, 2Н), 2,27-2,24 (м, 2Н), 2,13 (с, 3Н), 2,12-2,09 (м, 2Н), 2,04-2,01 (м, 2Н), 1,66 (с, 3Н), 1,60 (с, 3Н).
Соединение 7
К раствору N-хлорсукцинимида (210 мг, 1,57 ммоль) в дихлорметане (10 мл) в атмосфере азота медленно добавляли диметилсульфид (126 мкг, 1,71 ммоль). Полученную смесь перемешивали при 0°С в течение 5 минут. Раствор соединения 6 (300 мг, 1,43 ммоль), растворенного в дихлорметане (5 мл), добавляли при 30°С. Полученную смесь перемешивали при 0°С в течение 2 часов. После того как реакция была завершена, добавляли н-пентан (100 мл) и воду (100 мл). Полученный таким образом органический слой концентрировали при пониженном давлении с получением соединения 7 (325 мг, 99%).
1H-ЯМР (600 МГц, CDCl3) δ 5,42 (м, 2Н), 5,09 (м, 2Н), 4,11 (д, J=8,4 Гц, 2Н), 2,52 (м, 2Н), 2,24 (м, 2Н), 2,14 (с, 3Н), 2,11 (м, 2Н), 2,05 (м, 2Н), 1,71 (с, 3Н), 1,60 (с, 3Н).
LCB14-0606
Соединение LCB14-0606 получали в соответствии с аналогичным способом, описанным в JACS, 2010, 132 (12), 4281, содержание данной ссылки включено в настоящее изобретение посредством ссылки во всей ее полноте. К раствору соединения 7 (320 мг, 1,40 ммоль) в 7 мл ацетонитрила при комнатной температуре медленно добавляли раствор трис(тетрабутиламмоний)гидропирофосфата (2,25 г, 2,80 ммоль) в ацетонитриле (7 мл). Полученную смесь перемешивали в течение 1 часа. После того как реакция была завершена, полученную смесь концентрировали при пониженном давлении ниже при 25°С. Остаток подвергали колоночной хроматографии (упакованная BioRad AG 50W-X8 смола, водородная форма, 15 г) с аммиачной водой:разбавленной водой (v:v=3:1) и 25 мМ бикарбонатом аммония:изопропиловым спиртом (V:V=50:1) с получением соединения LCB14-0606 (585 мг, 99%).
1H-ЯМР (600 МГц, D2O) δ 5,42 (м, 1H), 5,16 (м, 1Н), 4,46 (т, J=6,6 Гц, 2Н), 2,66 (т, J=7,2 Гц, 2Н), 2,25 (т, J=7,2 Гц, 2Н), 2,19 (с, 3Н), 2,14 (м, 2Н), 2,06 (м, 2Н), 1,69 (с, 3Н), 1,60 (с, 3Н).
ПРИМЕР 3: ПРЕНИЛИРОВАНИЕ АВ(М)-СААХ
3-1. Способы пренилирования
Пренилирование Ab(М)-СААХ проводили с использованием NBD-GPP (трис-аммоний [3,7-диметал-8-(7-нитро-бензо[1,2,5]оксадиазол-4-иламино)окта-2,6-диен-1]пирофосфата) и FTase (# 344146, Calbiochem, USA) или NBD-FPP (#LI-013, Jena Bioscience, Germany) и GGTase I (# 345852, Calbiochem, USA).
Реакцию пренилирования проводили при 30°С в течение 3 часов с использованием 50 мМ Трис-HCl (рН 7,4) буферного раствора, содержащего 5 мМ MgCl2, 10 мкМ ZnCl2 и 5 мМ ДТТ. После того как реакция была завершена, проводили анализ SDS-PAGE. Анализатор изображений (ChemiDoc РРС +, BioRad, USA) использовали для идентификации полосы(с) флуоресцентного белка, чтобы подтвердить, что реакция пренилирования произошла.
3-2. Пренилирование Herceptin-HC-CAAX с помощью FTase и NBD-GPP
Антитела Herceptin-HC-GCVIM, Herceptin-HC-G5CVIM (не показан), Herceptin-HC-G7CVIM и Herceptin-HC-G10CVIM, пренилировали с помощью NBD-GPP и FTase в способе, описанном выше. Флуоресценцию детектировали на полосе(ах) белка, соответствующего тяжелой цепи(ям) (около 50K дальтон) соответствующих антител. Этот результат подтверждает, что антитела Herceptin-HC-CAAX, каждый из которых имеет спейсер с различными длинами, могут быть пренилированы (Фиг. 12).
3-3. Пренилирование Herceptin-LC-CAAX с помощью FTase и NBD-GPP
Антитела Herceptin-LC-GCVIM, Herceptin-LC-G5CVIM, Herceptin-LC-G7CVIM, и Herceptin-LC-G10CVIM, пренилировали с помощью NBD-GPP и FTase в способе, описанном выше. Флуоресценцию детектировали на полосе(ах) белка, соответствующей легкой цепи(ям) (около 25K дальтон) соответствующих антител. Этот результат подтвердил, что антитела Herceptin-LC-CAAX, каждый из которых имеет спейсер с различными длинами, могут быть пренилированы (Фиг. 13).
3-4. Пренилирование анти-сМЕТ-НС-СААХ с использованием FTase и NBD-GPP
Анти-cMET-HC-G7CVIM и анти-cMET-HC-G10CVIM антитела пренилировали с помощью NBD-GPP и FTase в способе, описанном выше. Флуоресценцию детектировали на полосе(ах) белка, соответствующего тяжелой цепи(ям) (около 50K дальтон) соответствующих антител. Этот результат подтвердил, что антитела анти-сМЕТ-НС-СААХ, каждый из которых имеет спейсер с различными длинами, могут быть пренилированы (Фиг. 14).
3-5. Пренилирование анти-cMET-LC-CAAX использованием FTase и NBD-GPP
Анти-cMET-LC-G7CVIM и анти-cMET-LC-G10CVIM антитела пренилировали с помощью NBD-GPP и FTase в способе, описанном выше. Флуоресценцию детектировали на полосе(ах) белка, соответствующего легкой цепи(ям) (около 25K дальтон) соответствующих антител. Этот результат подтвердил, что анти-сМЕТ-LC-CAAX антитела, каждый из которых имеет спейсер с различными длинами, могут быть пренилированы (Фиг. 15).
3-6. Пренилирование Herceptin-HC-CAAX с помощью GGTase I и NBD-FPP
Антитело Herceptin-HC-G10CVLL пренилировали с помощью NBD-FPP и GGTase I в способе, описанном выше. Флуоресценцию детектировали на полосе белка, соответствующей тяжелой цепи(ям) (около 50K дальтон) антитела, которое соединено с СААХ-мотивом на С-конце через G10 спейсер. Этот результат подтвердил, что антитела Herceptin-HC-CAAX могут быть пренилированы с помощью GGTase I (Фиг. 16).
3-7. Пренилирование Herceptin-LC-CAAX с помощью GGTase I и NBD-FPP
Антитело Herceptin-LC-G10CVLL пренилировали с помощью NBD-FPP и GGTase I в способе, описанном выше. Флуоресценцию детектировали на полосе белка, соответствующей легкой цепи(ям) (около 25K дальтон) антитела, которое соединено с СААХ-мотивом на С-конце через G10 спейсер. Этот результат подтвердил, что антитела Herceptin-LC-CAAX могут быть пренилированы с помощью GGTase I (Фиг. 16).
3-8. Пренилирование Herceptin-LC-CAAX с помощью FTase и изосубстрата
Herceptin-LC-G7CVIM
Антитело Herceptin-LC-G7CVIM пренилировали с использованием LCB14-0512 и FTase в способе, описанном выше. В случае, когда пренилированные антитела Herceptin-LC-G7CVIM подвергали анализу ЖХ/МС в восстанавливающих условиях без обработки посредством PNGase F, было предсказано, что теоретические молекулярные массы тяжелой цепи и легкой цепи будут 50597 дальтон и 24480 дальтон, соответственно. Как показано на Фиг. 17, экспериментальные молекулярные массы тяжелой цепи и легкой цепи по результатам измерения оказались 50600 дальтон и 24479 дальтон соответственно. Разница между теоретическими значениями молекулярной массы и экспериментальными значениями молекулярной массы была в пределах стандартного диапазона ошибок. Этот результат подтвердил, что антитело Herceptin-LC-G7CVIM пренилировано с помощью FTase и изосубстрата (LCB14-0512).
Herceptin-LC-G10CVIM
Антитело Herceptin-LC-G10CVIM пренилировали с использованием LCB14-0512 и FTase в способе, описанном выше. В случае, когда пренилированные антитела Herceptin-LC-G10CVIM подвергали анализу ЖХ/МС в восстанавливающих условиях без обработки посредством PNGase F, было предсказано, что теоретические молекулярные массы тяжелой цепи и легкой цепи будут 50596 дальтон и 24651 дальтон, соответственно. Как показано на Фиг. 18, экспериментальные молекулярные массы тяжелой цепи и легкой цепи по результатам измерения оказались 50601 дальтон и 24651 дальтон соответственно. Разница между теоретическими значениями молекулярной массы и экспериментальными значениями молекулярной массы была в пределах стандартного диапазона ошибок. Этот результат подтвердил, что антитело Herceptin-LC-G10CVIM пренилировано с помощью FTase и изосубстрата (LCB14-0512).
ПРИМЕР 4: КОНЪЮГАЦИЯ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА С ИСПОЛЬЗОВАНИЕМ КЛИК-ХИМИИ
4-1. Повторное окисление пренилированных Ab(М)-СААХ
Диафильтрацию проводили для удаления избытка реагентов в пренилированном Herceptin-LC-G7CVIM, полученным в соответствии с описанным выше способом. Антитело окисляется с использованием CuSO4. Диафильтрацию осуществляли для удаления CuSO4.
4-2. Конъюгация лекарственного вещества Ab(М) -СААХ и линкером-лекарственное вещество с помощью клик-химии
Реакцию клик-химии между повторно окисленным пренилированным Herceptin-LC-G7CVIM и соединением LCB14-0536 осуществляли в течение 10 минут. Полученный конъюгат (LCB14-0104) (Фиг. 26) подвергали анализу ЖХ/МС. В случае, когда антитело подвергали анализу ЖХ/МС в восстанавливающих условиях без обработки посредством PNGase F, было предсказано, что теоретические молекулярные массы тяжелой цепи и легкой цепи будут 49153 дальтон и 25410 дальтон соответственно. Как показано на Фиг. 19, экспериментальные молекулярные массы тяжелой цепи и легкой цепи по результатам измерения оказались 49154 дальтон и 25408 альтон соответственно. Разница между теоретическими значениями молекулярной массы и экспериментальными значениями молекулярной массы была в пределах стандартного диапазона ошибок. Этот результат подтверждает, что пренилированное антитело Herceptin-LC-G7CVIM образует конъюгат с лекарственным веществом посредством реакции клик-химии.
4-3. Анализ конъюгатов Herceptin-LC-CAAX-лекарственное вещество
Конъюгат LCB14-0101 подвергали гидрофобной хроматографии, высокоэффективной жидкостной хроматографии на колонке Ether-5PW (7,5×75 мм, 10 мкм, Tosoh Bioscience, USA). 50 мМ калий-фосфатный буфер (рН 7,0), содержащий 1,5 Μ сульфат аммония, использовали в качестве буфера А и 50 мМ калий-фосфатный буфер (рН 7,0), содержащий 20% изопропиловый спирт, использовали в качестве буфера В. 90% А/10% В выдерживали в течение 5 минут. Элюирование проводили с использованием линейного градиента от 90% А/10% В до 10% А/90% В в течение следующих 30 минут. Расход и температура были установлены следующие: 0,8 мг/мин и 25°С соответственно. Детекцию проводили как при 254, так и при 280 нм. Немодифицированный Herceptin-LC-G7CVIM и пренилированный Herceptin-LC-G7CVIM использовали в качестве контроля. Время удерживания немодифицированного Herceptin-LC-G7CVIM, пренилированного Herceptin-LC-G7CVIM и конъюгированного LCB14-0101 были 9,6, 11,7 и 12,4 минут (Фиг. 20) соответственно.
ПРИМЕР 5: АНТИПРОЛИФЕРАЦИЯ ADC
5-1. Клеточные линии
Использовали коммерчески доступные линии клеток рака молочной железы человека MCF-7 (HER2 отрицательный к нормальному), MDA-MB-468 (HER2 отрицательный) и SK-BR-3 (HER2 положительный). Клеточные линии культивировали в соответствии с рекомендуемыми спецификациями, которыми обеспечиваются коммерчески доступные клеточные линии.
5-2. Образцы для исследований
В качестве антител использовали коммерчески доступные антитела Herceptin и Herceptin-LC-G7CVIM. В качестве лекарственного вещества использовали LCB14-0537 (MMAF), LCB14-0508 (MMAF-OMe) и LCB14-0562 (ММАЕ). В качестве конъюгата белок-активное вещество использовали LCB14-0101, LCB14-0102 и LCB14-0103 (Фиг. 26). Herceptin-LC-G7CVIM пренилировали с помощью LCB14-0512. Пренилированный Herceptin-LC-G7CVIM подвергали клик-реакции с использованием LCB14-0592 для конъюгации с β-глюкуронид-линкер(ВО)-ММАР, таким образом получая LCB14-0101. Кроме того, пренилированный Herceptin-LC-G7CVIM подвергали клик-реакции с использованием LCB14-0589 для конъюгации с Val-Cit линкер(VC)-MMAF-ОМе, в результате получая LCB14-0102. Кроме того, пренилированный Herceptin-LC-G7CVIM подвергали клик-реакции с помощью LCB14-0598 для конъюгации с β-глюкуронид-линкер(BG)-ММАЕ, таким образом получая LCB14-0103.
5-3. Методы исследования
Измеряли антипролиферативные активности антител, лекарственных веществ и конъюгатов в отношении опухолевых клеточных линий. Клетки высевали в 96-луночные планшеты для культивирования тканей по 1×104 клеток на лунку. После 24-часовой инкубации антитела, лекарственные вещества и конъюгаты добавляли в различных концентрациях. Через 72 часа число жизнеспособных клеток подсчитывали с использованием красителя SRB. Поглощение измеряли при 540 нм с использованием SpectraMax 190 (Molecular Devices, USA).
5-4. Результаты исследований
LCB 14-0101 (Herceptin-LC-G7C VIM-BG-ΜΜαF)
Herceptin-LC-G7CVIM имел IC50, равную 10 мкг/мл или выше с MCF-7, MDA-MB-468 и SK-BR-3. LCB14-0101 (MMAF-конъюгат) имел значение IC50, равное 8,09 мкг/мл и 4,18 мкг/мл с MCF-7 и MDA-MB-468 соответственно, которые не экспрессировали или экспрессировали низкий уровень HER2, в то время он имел IC50, равную 0,11 мкг/мл с SK-BR-3, который сверхэкспрессирует HER2. В дополнение к своей превосходной ингибирующей активности, LCB14-0101 обладал лучшей селективностью почти в 40-80 раз более селективен, чем Herceptin-LC-G7CVIM. Соответственно это подтверждало, что LCB14-0101 обладал как цитотоксической лекарственной активностью, так и антиHER2 селективностью (Фиг. 21).
LCB 14-0102 (Herceptin-LC-G7CVIM-VC-MMAF-OM)
Herceptin-LC-G7CVIM имел IC50, равную 10 мкг/мл с MCF-7 и SK-BR-3. LCB14-0102 (MMAF-OMe-конъюгат) имел IC50, равную 4,38 мкг/мл с MCF-7, в то время с SK-BR-3 он имел IC50, равную 0,15 мкг/мл. В дополнение к своей превосходной ингибирующей активности LCB14-0102 был почти в 30 раз более селективным, чем Herceptin-LC-G7CVIM. Соответственно это подтверждало, что LCB14-0102 обладал как цитотоксической лекарственной активностью, так и антиHER2 селективностью (Фиг. 22).
LCB 14-0103 (Herceptin-LC-G7CVIM-BG-MMAE)
LCB 14-0103 (ММАЕ-конъюгат) имел IC50, равную 7,25 мкг/мл с MCF-7, в то время как с SK-BR-3 он имел IC50 равную 0,072 мкг/мл. В дополнение к своей превосходной ингибирующей активности, LCB14-0103 был почти в 100 раз более селективным, чем Herceptin-LC-G7CVIM. Соответственно, это подтверждало, что LCB14-0103 обладал как цитотоксической лекарственной активностью, так и антиHER2 селективностью (Фиг. 23).
Другие варианты выполнения
Из вышеприведенного описания будет очевидно, что изменения и модификации могут быть сделаны в изобретении, описанные здесь, чтобы адоптировать его к различным применениям и условиям. Такие варианты выполнения также входят в объем прилагаемой формулы изобретения.
Перечисление перечня элементов в любом определении переменной в настоящем изобретении включает определения этой переменной как любого отдельного элемента или комбинации (или субкомбинации) из перечисленных элементов. Перечисление вариантов выполнения настоящего изобретения включает в себя такой вариант выполнения, как любой единственный вариант выполнения или в сочетании с любыми другими вариантами выполнения или их частей.
Все патенты и публикации, упомянутые в этом описании, включены посредством ссылки в той же степени, как если бы каждый независимый патент и публикация были бы конкретно и индивидуально указаны как включенные посредством ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ, ВКЛЮЧАЮЩИЕ САМОРАСЩЕПЛЯЮЩУЮСЯ ГРУППУ | 2015 |
|
RU2712744C2 |
| СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ РАСЩЕПЛЯЕМЫЙ ЛИНКЕР, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2795168C2 |
| НОВОЕ ПРОИЗВОДНОЕ ОКСАЗОЛИДИНОНА И ВКЛЮЧАЮЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2012 |
|
RU2617408C2 |
| АКТИВАТОРЫ ГЛЮКОКИНАЗЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2008 |
|
RU2450001C2 |
| КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО, СОДЕРЖАЩИЙ НОВОЕ ПРОИЗВОДНОЕ ЦИКЛИЧЕСКОГО ДИНУКЛЕОТИДА | 2021 |
|
RU2836814C1 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРИМИДИНОНА И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2818954C1 |
| 1, 2, 4-ТРИАЗОЛЬНОЕ ПРОИЗВОДНОЕ, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2288223C2 |
| 2-ПИРИДИЛЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ КАК ИНГИБИТОРЫ РЕЦЕПТОРОВ ALK5 И/ИЛИ ALK4 | 2004 |
|
RU2348626C2 |
| Новые соединения пиридопиримидинона для модулирования каталитической активности гистонлизиндеметилаз (KDMS) | 2015 |
|
RU2684396C2 |
| Производные изохинолинона, способ их получения и фармацевтическая композиция для профилактики или лечения заболеваний, связанных с поли(АДФ-рибоза)полимеразой-1, содержащая их в качестве активного ингредиента | 2020 |
|
RU2815480C1 |











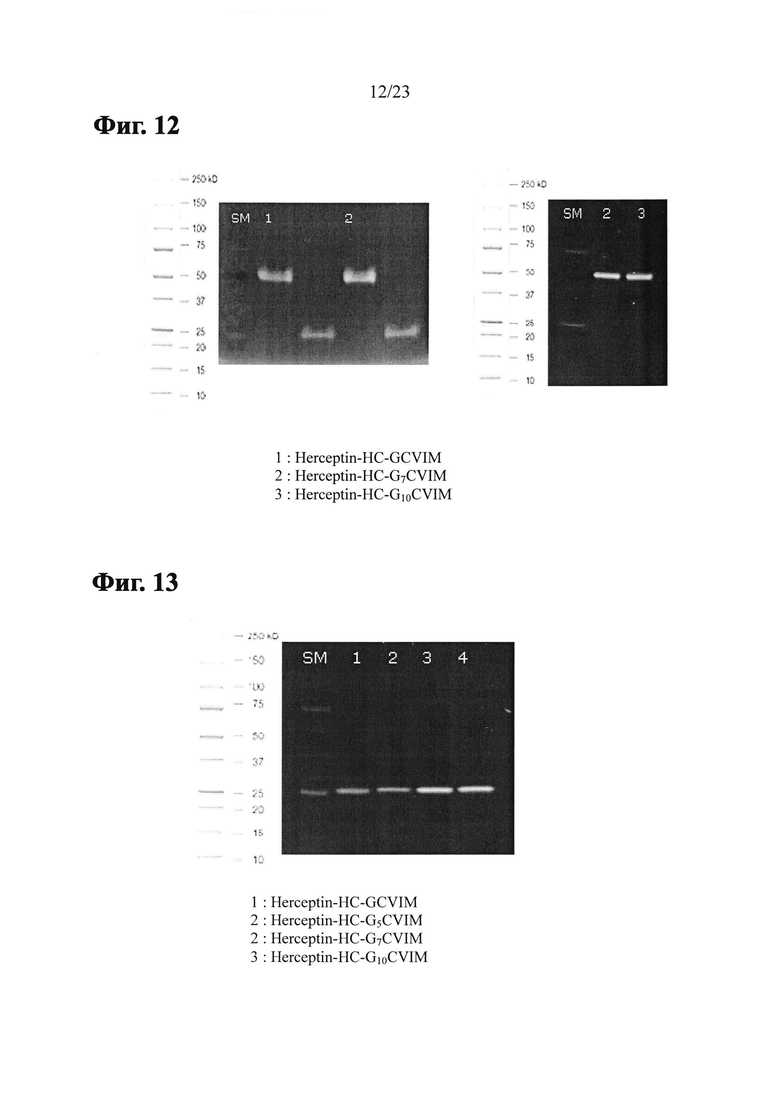
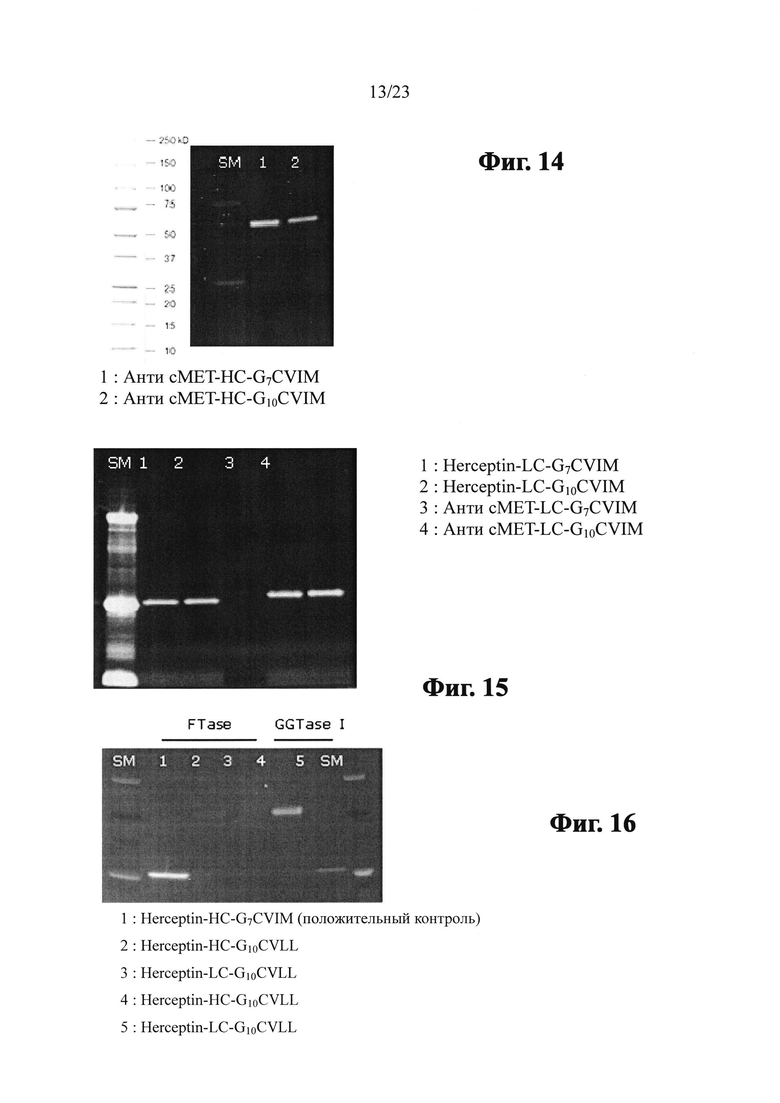

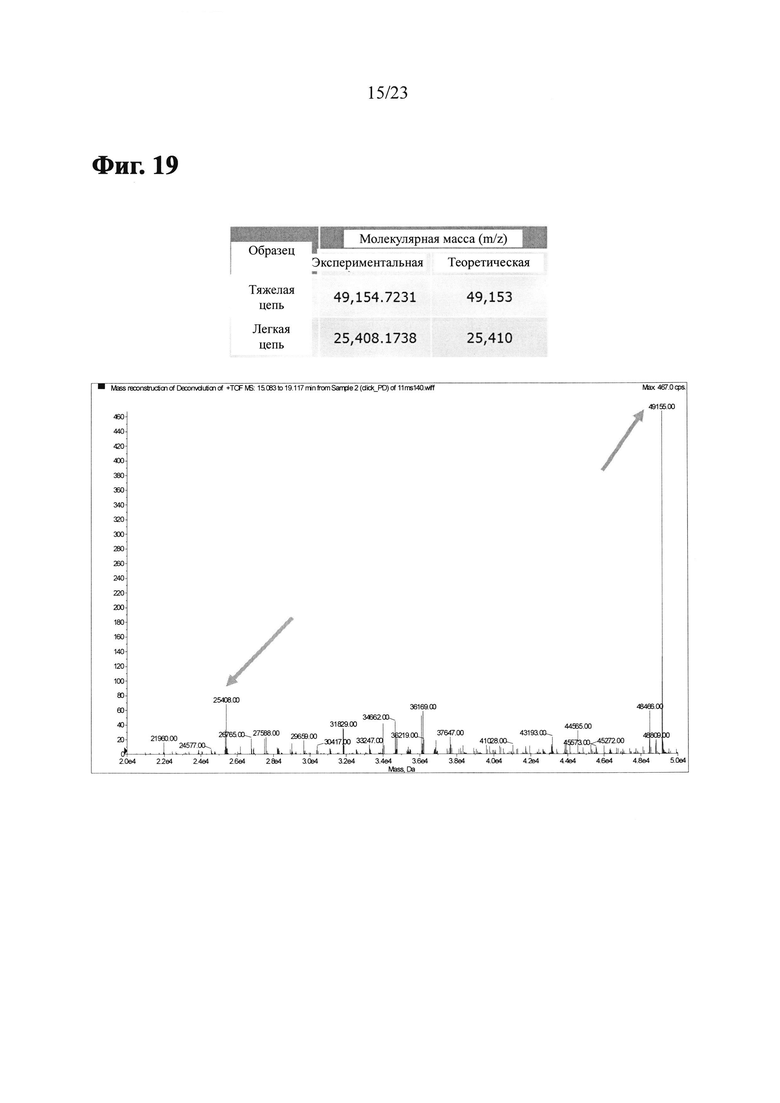
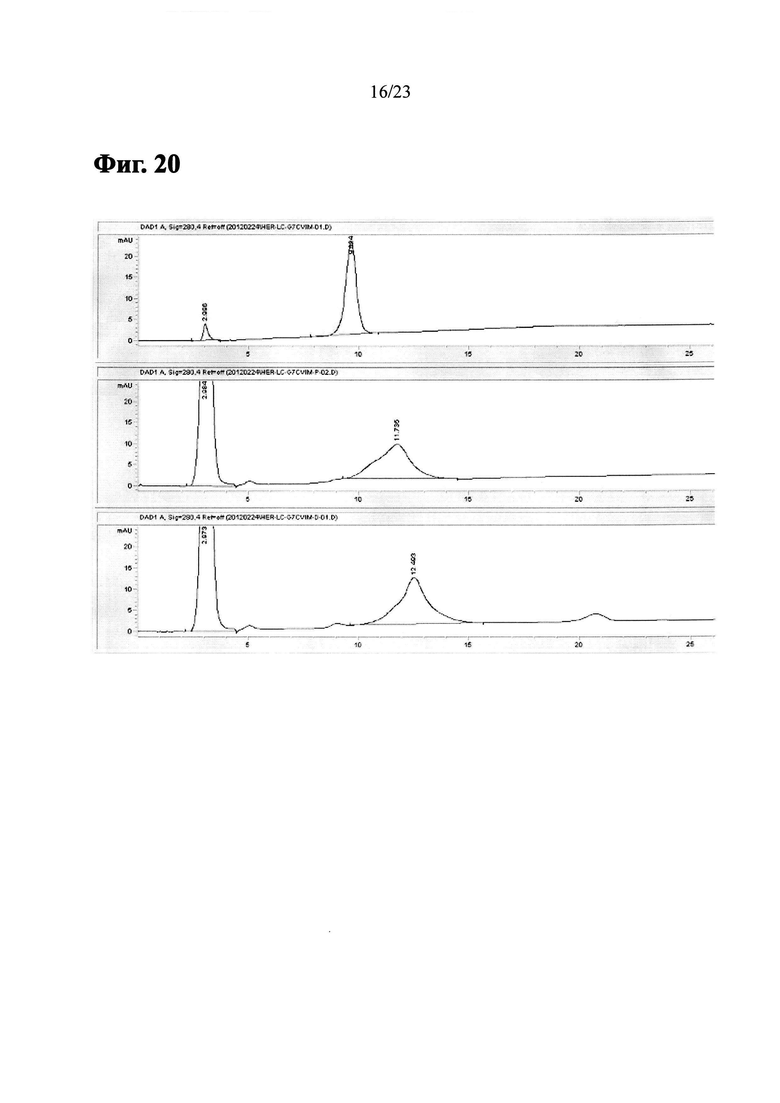
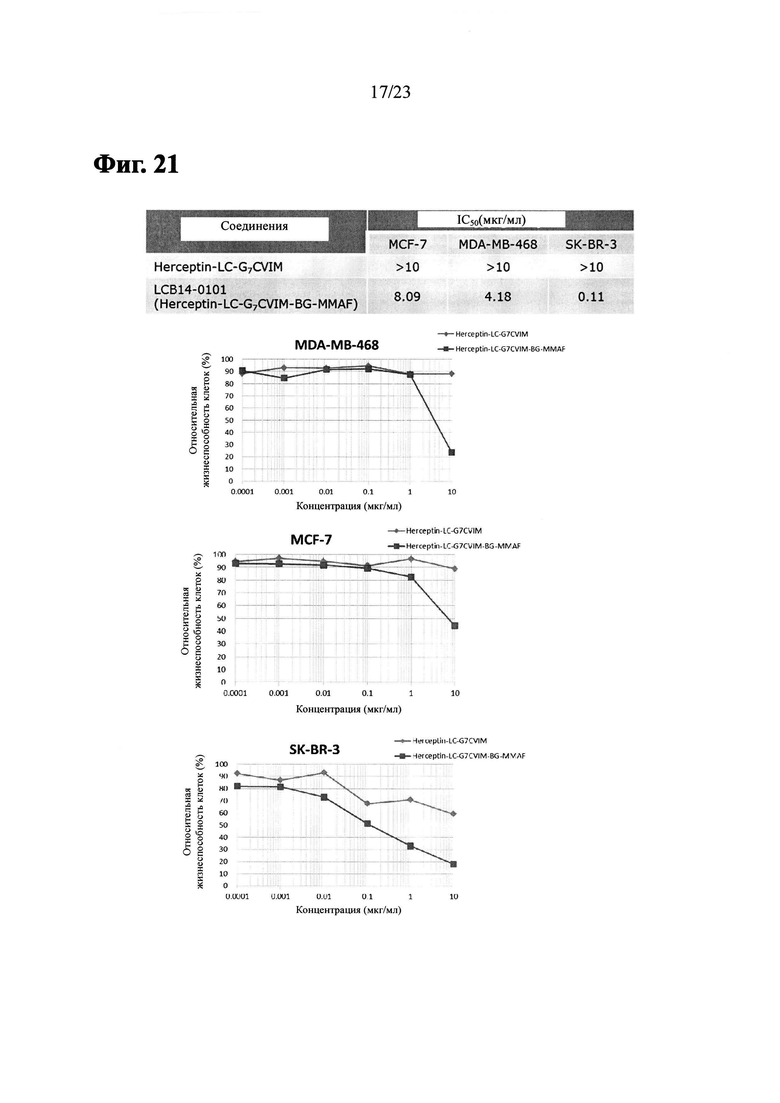
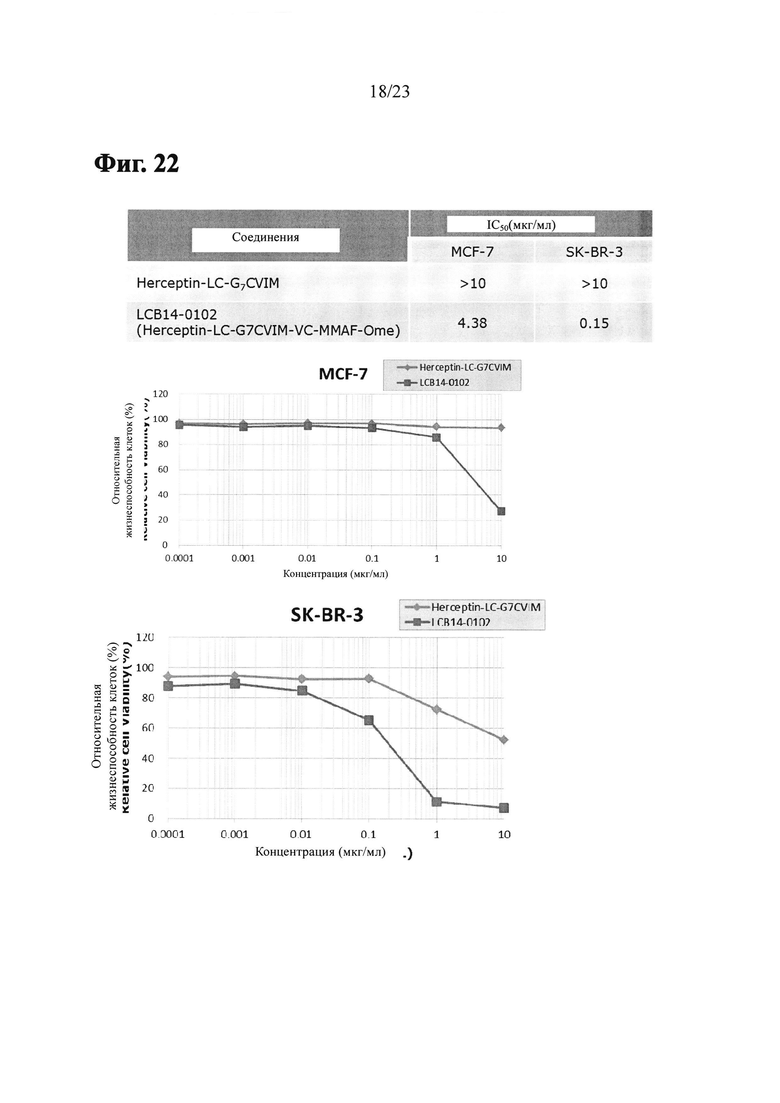
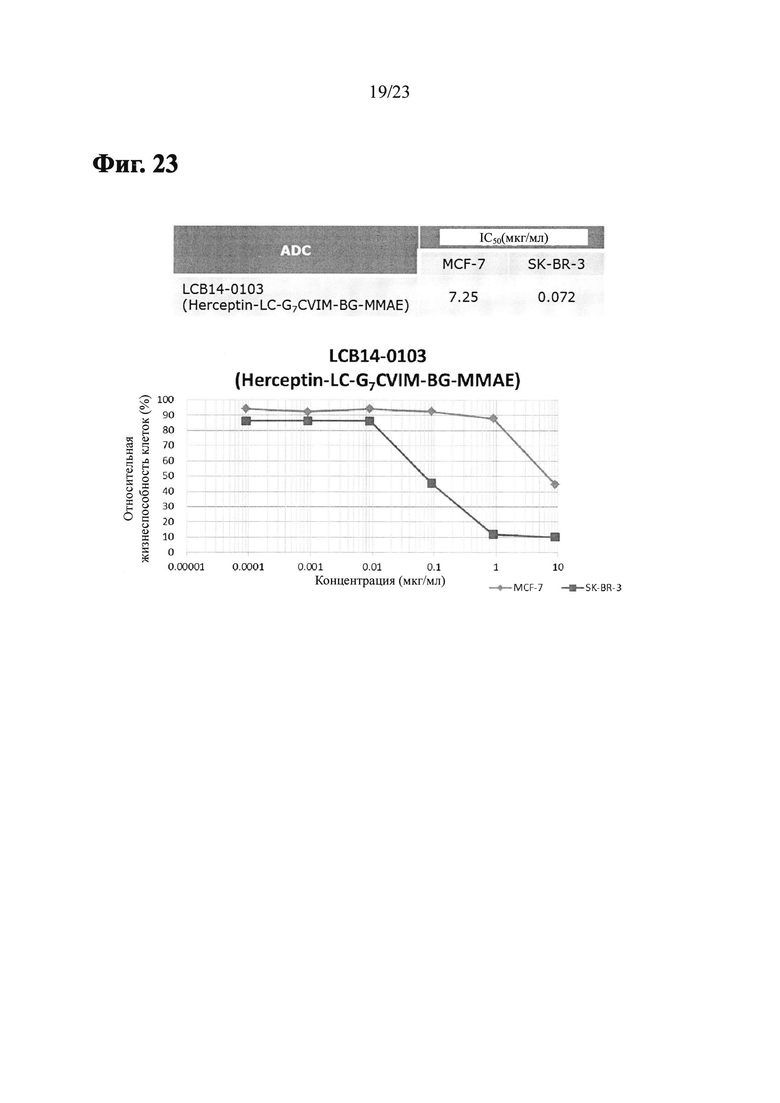
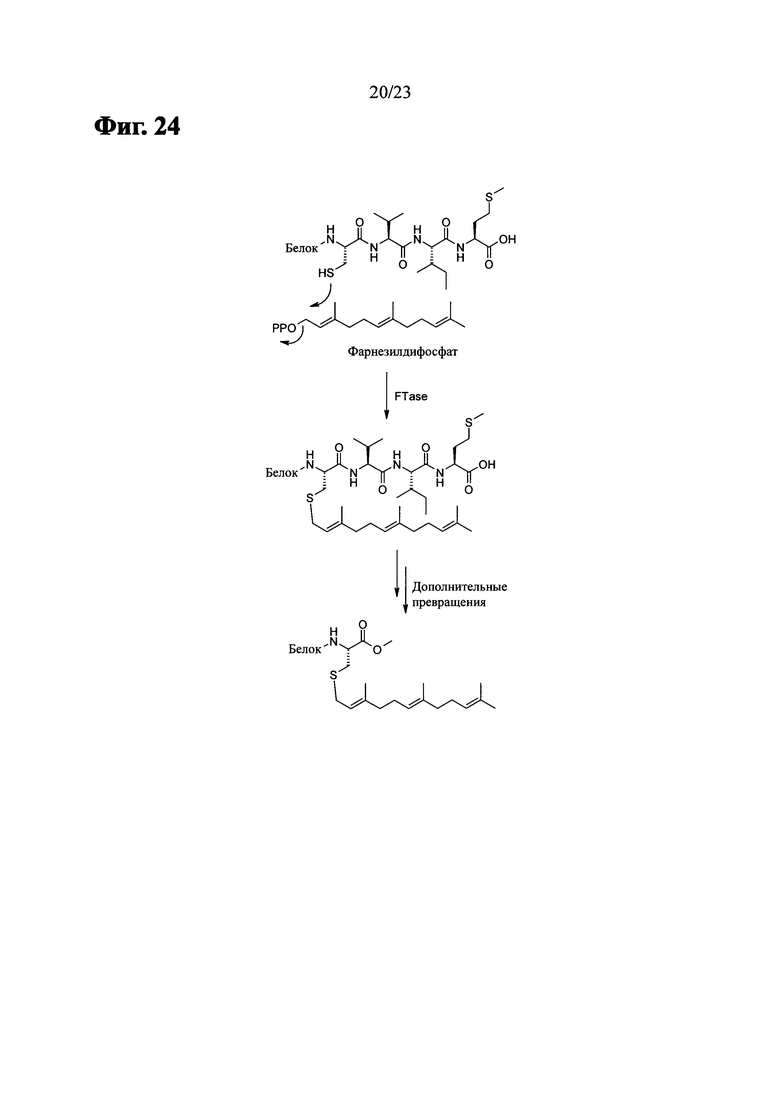
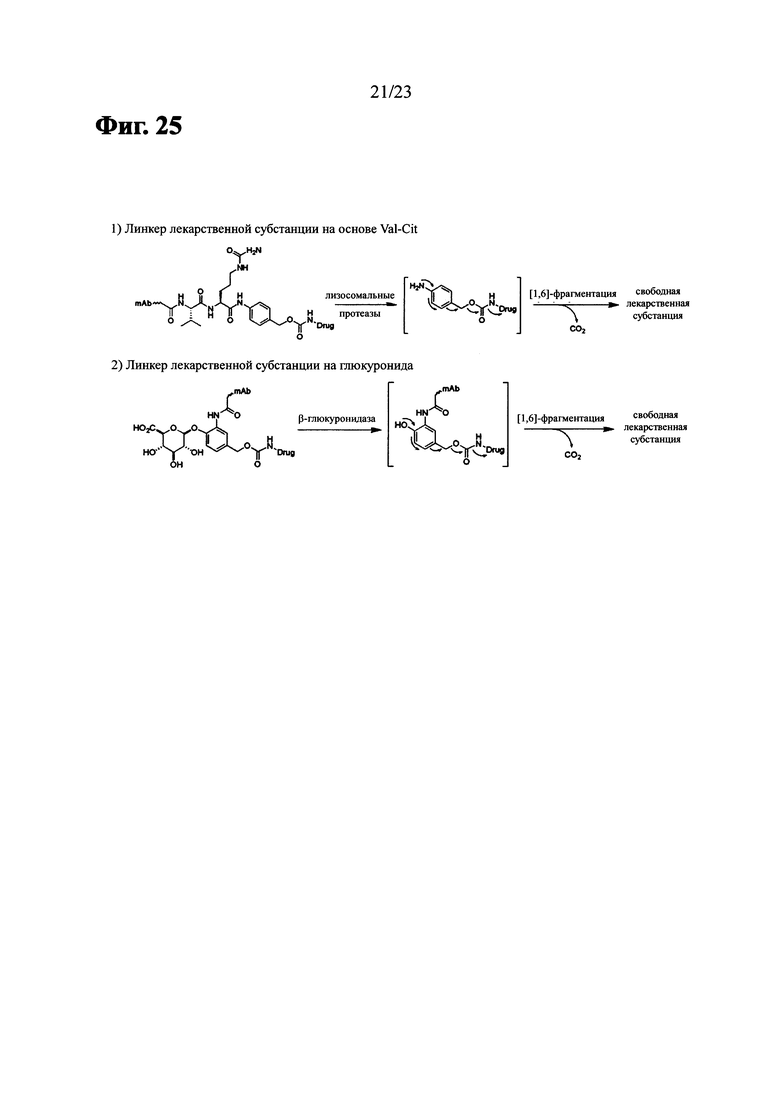

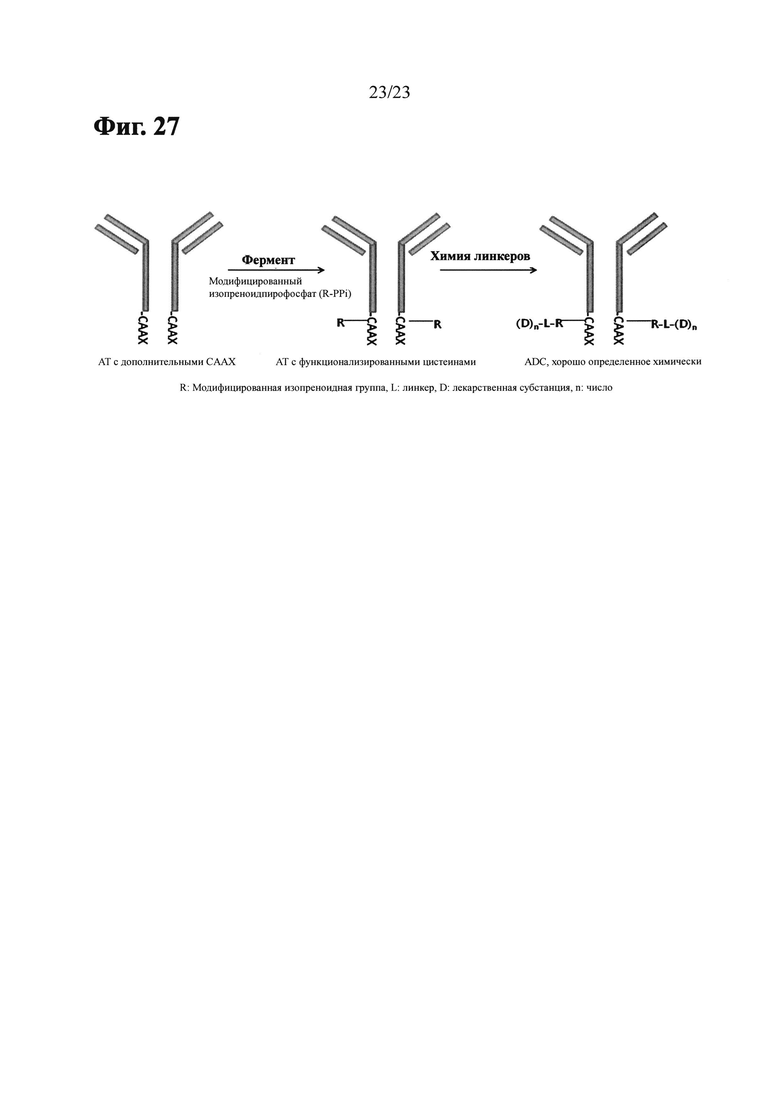
Группа изобретений относится к области фармацевтики и медицины и касается конъюгата белок-активное вещество, имеющего аминокислотный мотив, который может распознаваться с помощью изопреноид-трансферазы, где активное вещество ковалентно связано посредством по меньшей мере одного линкера с изосубстратом, где изосубстрат содержит по меньшей мере одну изопреноидную единицу и является распознаваемым изопреноид-трансферазой, которая присоединена к цистеиновому остатку аминокислотного мотива. Изобретение также относится к композиции, содержащей конъюгаты, а также к способам получения конъюгатов и композиций. Группа изобретений обеспечивает использование конъюгатов для доставки активного вещества в клетки-мишени с высокой селективностью. 8 н. и 8 з.п. ф-лы, 27 ил., 5 пр.
1. Конъюгат антитело-активное вещество для доставки активного вещества к клетке-мишени у субъекта, содержащий антитело, имеющее карбоксильный конец, присоединенный к аминокислотному мотиву, который может распознаваться с помощью изопреноид-трансферазы, где активное вещество ковалентно связано посредством по меньшей мере одного линкера с изосубстратом, где изосубстрат содержит по меньшей мере одну изопреноидную единицу и является распознаваемым изопреноид-трансферазой, которая присоединена к цистеиновому остатку аминокислотного мотива.
2. Конъюгат антитело-активное вещество по п. 1, где антителом является моноклональное антитело, антиген-связывающий фрагмент, одноцепочечный Fv (scFv), мультиспецифическое антитело, биспецифическое антитело, химерное антитело, гуманизированное антитело, человеческое антитело, слитый белок, содержащий антиген-связывающую часть антитела.
3. Конъюгат антитело-активное вещество по п. 1, в котором аминокислотным мотивом является СААХ, где С представляет собой цистеин, А представляет собой алифатическую аминокислоту и X представляет собой аминокислоту, которая определяет субстратную специфичность изопреноид-трансферазы.
4. Конъюгат антитело-активное вещество по п. 1, в котором линкер имеет структуру формулы (I):
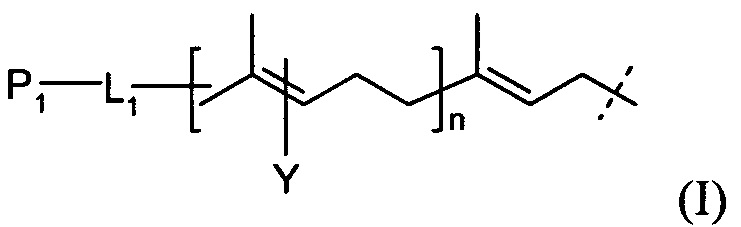
где P1 и Y независимо представляют собой группу, содержащую первую функциональную группу (FG1),
L1 представляет собой (CH2)rXq(CH2)p,
X представляет собой кислород, серу, -NR1-, -C(O)NR1-, -NR1C(O)-, -NR1SO2-, -SO2NR1-, -(CH=CH)- или ацетилен,
R1 представляет собой водород, C1-6-алкил, С1-6-алкиларил или C1-6-алкилгетероарил,
r и р независимо представляют собой целое число от 0 до 6,
q представляет собой целое число от 0 до 1, и
n представляет собой целое число от 1 до 4.
5. Конъюгат антитело-активное вещество по любому из пп. 1-3, в котором линкер содержит -(СН2)rXq(СН2)р- или -[ZCH2CH2O(CH2CH2O)wCH2CH2Z]-,
в которых X представляет собой кислород, серу, -NR1-, -C(O)NR1-, -NR1C(O)-, -NR1SO2- или -SO2NR1-,
Z представляет собой кислород, серу или NR1,
R1 представляет собой водород, С1-6-алкил, С1-6-алкиларил или С1-6-алкилгетероарил,
r и р независимо представляют собой целое число от 0 до 6,
q представляет собой целое число от 0 до 1,
w представляет собой целое число от 0 до 6.
6. Конъюгат антитело-активное вещество по п. 5, в котором -(СН2)rXq(СН2)p- или -[ZCH2CH2O(CH2CH2O)wCH2CH2Z]- присоединяется к глюкурониду, который может быть расщеплен β-глюкуронидазой.
7. Конъюгат антитело-активное вещество по п. 6, в котором глюкуронид, который может быть расщеплен β-глюкуронидазой, представляет собой
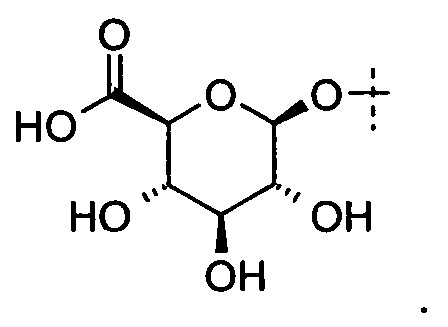
8. Способ получения конъюгата антитело-активное вещество по любому из пп. 1-7, включающий:
(a) ферментативное взаимодействие с применением изопреноид-трансферазы, антитела, присоединенного к аминокислотному мотиву, который может распознаваться изопреноид-трансферазой, по меньшей мере с одним изосубстратом, имеющим первую функциональную группу (FG1), с получением, таким образом, функционализированного антитела; и
(b) взаимодействие функционализированного антитела с функционализированным активным веществом, присоединенным ко второй функциональной группе (FG2), которая реагирует с первой функциональной группой (FG1), где FG2 присоединяется к активному веществу посредством по меньшей мере одного линкера, с получением, таким образом, конъюгата антитело-активное вещество.
9. Способ получения конъюгата антитело-активное вещество по любому из пп. 1-7, включающий:
(a) ферментативное взаимодействие с применением изопреноид-трансферазы антитела, присоединенного к аминокислотному мотиву, который может распознаваться изопреноид-трансферазой, по меньшей мере с одним изосубстратом, имеющим первую функциональную группу (FG1), с получением, таким образом, функционализированного антитела;
(b) присоединение второй функциональной группы (FG2) к активному веществу, где FG2 присоединяется к активному веществу посредством по меньшей мере одного линкера, с получением, таким образом, функционализированного активного вещества; и
(c) взаимодействие функционализированного антитела с функционализированным активным веществом, с получением, таким образом, конъюгата антитело-активное вещество.
10. Способ по п. 8 или 9, в котором реакцией между функционализированным антителом и функционализированным активным веществом является реакция клик-химии или образование гидразона и/или оксима.
11. Способ по п. 8 или 9, в котором
(i) FG1 представляет собой азидную группу, и FG2 представляет собой ацетиленовую группу, или FG1 представляет собой ацетиленовую группу, и FG2 представляет собой азидную группу, или
(ii) FG1 представляет собой альдегидную или кетонную группу, и FG2 представляет собой гидразин или гидроксиламин, или где FG1 представляет собой гидразин или гидроксиламин, и FG2 представляет собой альдегид или кетон.
12. Способ получения конъюгата антитело-активное вещество по любому из пп. 1-7, включающий ферментативное взаимодействие с применением изопреноид-трансферазы антитела, присоединенного к аминокислотному мотиву, который может распознаваться изопреноид-трансферазой, с изосубстратом изопреноид-трансферазы, присоединенной к активному веществу, где активное вещество ковалентно связано посредством по меньшей мере одного линкера с изосубстратом.
13. Способ получения конъюгата антитело-активное вещество по любому из пп. 1-7, включающий:
(a) присоединение изосубстрата изопреноид-трансферазы к активному веществу, где активное вещество ковалентно связано посредством по меньшей мере одного линкера с изосубстратом; и
(b) ферментативное взаимодействие с применением изопреноид-трансферазы, антитела, присоединенного к аминокислотному мотиву, который может распознаваться изопреноид-трансферазой, с активным веществом, присоединенным к изосубстрату.
14. Конъюгат антитело-активное вещество для доставки активного вещества к клетке-мишени у субъекта, полученный способом по любому из пп. 8-13.
15. Композиция для доставки активного вещества к клетке-мишени у субъекта, содержащая фармацевтически приемлемое вспомогательное вещество и конъюгат антитело-активное вещество по любому из пп. 1-7 или 14.
16. Применение конъюгата антитело-активное вещество по любому из пп. 1-7 или 14 для лечения рака.
| WOLLACK JW et al | |||
| A minimalist substrate for enzymatic peptide and protein conjugation | |||
| Chembiochem, 2009 Dec 14,10(18):2934-43 | |||
| S MAURER-STROH et al | |||
| Refinement and prediction of protein prenylation motifs | |||
| Genome Biology, 27 May 2005,6:R55 | |||
| WO 2007048127 A, 26.04.2007 | |||
| СПОСОБ КОНЪЮГАЦИИ ПЕПТИДОВ, ОПОСРЕДОВАННОЙ ТРАНСГЛУТАМИНАЗОЙ | 2005 |
|
RU2385879C2 |
Авторы
Даты
2017-03-21—Публикация
2012-05-08—Подача