Изобретение относится к новым синтетическим иммунодепрессантам и конкретнее к иммунодепрессантам, содержащим гетероциклические соединения из класса арил-, индолилалканкарбоновых кислот, и может быть использовано в медицине в качестве основы для создания лекарственных препаратов для лечения аутоиммунных и аллергических заболеваний.
Аутоиммунные нарушения в организме обусловлены прежде всего повышением функциональной активности Т-лимфоцитов и других иммунокомпетентных клеток. К веществам, обладающим способностью активно влиять на течение аутоиммунного процесса, подавлять патологические пролиферативные процессы в лимфоидных (иммунокомпетентных) тканях относятся иммунодепрессанты.
Известен синтетический иммунодепрессант - азатиоприн, обладающий цитостатической активностью и оказывающий иммунодепрессивный эффект (М.Д. Машковский. Лекарственные средства. Ч. 2, М.: «Медицина», 1987, стр. 175-177).
Недостатком этого иммунодепрессанта является угнетающее влияние на кроветворение, а также повреждающее действие на желудочно-кишечный тракт и вероятность развития токсического гепатита при длительном применении.
К разряду иммуносупрессоров относят также циклоспорин (циклический полипептид, состоящий из 11 аминокислот, избирательно воздействующий на Т-лимфоциты и применяемый для терапии аутоиммунных заболеваний. Однако данный препарат вызывает ряд серьезных побочных эффектов (действие на желудочно-кишечный тракт, нарушение функции почек и печени, повышение АД), что существенно затрудняет его широкое применение (Справочник ВИДАЛЬ. М.: «АстраФармСервис», 1996).
Задачей данного изобретения является поиск иммунодепрессанта, обладающего меньшим количеством побочных эффектов, в частности уменьшением угнетающего влияния на кроветворение.
С целью расширения арсенала синтетических средств, обладающих иммуносупрессивными свойствами, предлагается использовать производное оксазолидиния:хлорид 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния (авт. свид. СССР №139729, C07D 263/10, 1985) в качестве иммунодепрессанта. Производные оксазолидиния могут найти применение в создании лекарственных препаратов.
Известны оксазолидинины и их применение в терапии (RU 98100257, С07С 413/04, 2000), а также для лечения и профилактики расстройств сердечной деятельности (RU 2404740, А61K 31/5377, 2012).
Исследования показали, в частности, что производные оксазолидиния хлориды 2-алкилтиометилен-3,3-диалкил-1,3-оксазолидония обладают широким спектром антибактериального и противоопухолевого действия (ВИЛИМ. Доклинические исследования. Новосибирск, 2008, с. 5-6). Производные оксазолидиния отличаются самыми разнообразными биологическими свойствами. Хлориды 2-(алкилтиометилен)-3,3-диалкил-1,3 оксазолидиния (в т.ч. хлорид 2-(этилтиометилен)-3,3диметил-1,3-оксазолидиния обладают широким спектром антибактериального действия (Материалы 7-й отчетной конференции ГУ НИИ клинической иммунологии СО РАМН, Новосибирск, 2006, стр. 103).
Сущность изобретения заключается в том, что при изучении in vivo и in vitro миелоактивных и иммунотропных свойств нового биологически активного вещества: хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния был выявлен его иммунодепрессивный эффект.
В работе использовали здоровых половозрелых животных мышей линии СВА, DBA/2 и гибридов (CBAxC57BL/6)F1 (CBF1) и (C57BI/6xDBA/2)F1 обоего пола, 8-10 недельного возраста массой тела 18-20 г. Разброс в группах по исходной массе тела не превышал ±10%. Контрольные и опытные животные были одного возраста и получены одновременно из одного питомника ("Рассвет", г. Томск). До и в период эксперимента контрольные и опытные животные содержались в виварии в одинаковых условиях в стандартных пластиковых клетках 40×20×20 не более 10 особей в клетке с подстилкой из мелкой древесной стружки на стандартном рационе. Все исследования проводились в одно и то же время суток (утром).
Пример 1. Определение миелоактивных и иммунотропных свойств хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния
Установлено, что LD50 для соединения составляет 125 мг/кг при внутрибрюшинном способе введения и 1000 мг/кг при внутрижелудочном способе введения мышам и в соответствии с классификацией может быть отнесено к среднетоксичным веществам.
Соединение хлорид 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния вводили внутрижелудочно в дозе 750 мг/кг мышам в течение 7 дней. Результаты оценивали по массе и числу клеток лимфоидных органов (табл. 1).
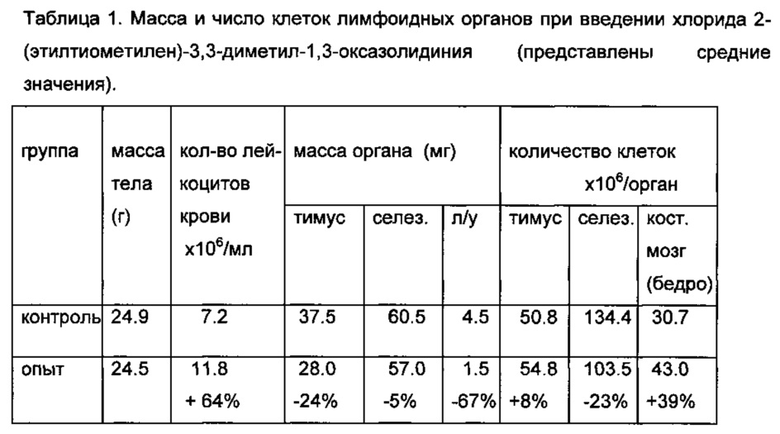
Как видно из таблицы 1, при введении хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния выявляются миелостимулирующие свойства (на 64% увеличивается количество лейкоцитов в периферической крови и на 39% клеточность костного мозга) и иммунотропные свойства: снижена масса тимуса, лимфоузлов, масса и клеточность селезенки.
Пример 2. Определение влияния хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния оксазолидиния на функциональную активность лимфоидных клеток in vitro.
Изучение влияния хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния на функциональную активность лимфоидных клеток in vitro проводили добавлением соединения в культуральную среду при тестировании спонтанной и Т- и В-митоген-индуцированной пролиферации клеток селезенки.
Селезенки мышей забирали в стерильных условиях и готовили клеточную суспензию: селезенки помещали во флакончики со средой, расстригали ножницами, многократно пропускали через шприц с иглами уменьшающегося диаметра, фильтровали через металлическую сеточку и 3 раза отмывали центрифугированием при 1000 об/мин в течение 10 мин со сменой среды. Осадок клеток селезенки ресуспендировали в полной среде RPMI-164, содержащей 10% эмбриональной сыворотки телят, 10 мМ Hepes, 4×10-5 М 2-меркаптоэтанола, 2 Мм L-глутамина, 50 мкг/мл гентамицина, и подсчитывали их общее количество. Полученную клеточную суспензию доводили до концентрации 0,7×106 клеток/мл полной среды и помещали в 96-луночные круглодонные планшеты для культивирования по 100×103 клеток/лунку в объеме 150 мкл/лунку. Добавляли оптимальные дозы митогенов LPS E.coli 055:В5, Con A, PWM, определенные в предварительных опытах: 30 мкг/мл, 2 мкг/мл и 1 мкг/мл соответственно в объеме 10 мкл. Для оценки спонтанной пролиферации в лунки добавляли 10 мкл среды RPMI-1640. Все пробы проводились в триплетах. Соединение в трех дозах (2, 20 и 200 мкг/мл) вносили в лунки одновременно с митогенами. Инкубацию клеточной культуры проводили при +37°C в атмосфере, содержащей 5% CO2, в течение 72 часов. Пролиферативную активность клеток оценивали по включению Н3-тимидина в ДНК делящихся клеток. Метку вносили за 16 час до конца культивирования по 1 мкКи в каждую лунку планшета. Для этого основной раствор Н3-тимидина сначала растворяли в среде RPMI-1640 до концентрации 100 мкКи/мл, а затем по 10 мкл раствора добавляли в каждую лунку планшета. По окончании инкубации клетки собирали на стеклянно-волокнистые фильтры (Flow Lab) с помощью аппарата «Harvester» (TITERTEK). Фильтры помещали во флаконы для сцинтилляционного счета и радиоактивность подсчитывали в сцинтилляторе (4 г дифенилоксазола и 0,1 г дифенилоксазолилбензола на 1 л толуола) в жидкостном сцинтилляционном счетчике «Delta» (США). Результаты оценивали в имп./мин на 100×103 клеток, подсчитывали средние значения по триплету. Оценка данных проводилась как в абсолютных значениях (имп./мин), так и в относительных (%).
Таблица 2. Спонтанная и митоген-индуцированная пролиферация клеток селезенки при добавлении в культуральную среду хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния (представлены средние данные в имп./мин и % подавления).
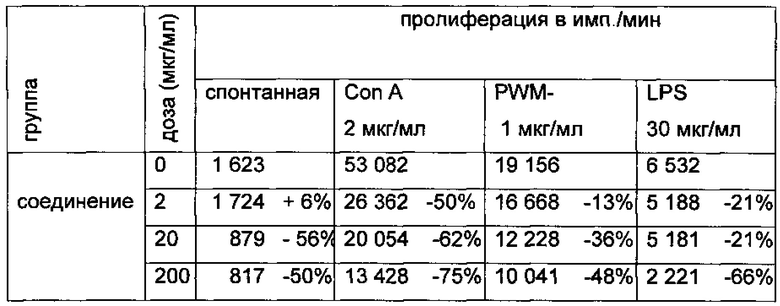
Как видно из табл. 2, при добавлении в культуральную среду хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния функциональная активность лимфоидных клеток снижается: результаты указывают на дозозависимую супрессию спонтанной и Т- и В-митоген-индуцированной пролиферации клеток селезенки интактных животных.
Пример 3. Определение влияния хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния на пролиферацию других тканей
Для изучения способности препарата хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния подавлять пролиферацию других тканей оценивали его влияние на процессы деления клеток опухолевых линий.
Изучали действие препарата на пролиферацию клеток нескольких разных линий: L1210, клетки лимфомы; Г27, клетки гепатомы; В16, клетки меланомы. Культивирование клеток и оценка их пролиферативной активности проводились согласно протоколу для культивирования лимфоидных клеток (описано выше); количество клеток линии составляло 104/лунку, время культивирования 24 часа, 3Н-тимидин добавляли за 4 часа до конца культивирования. Препарат в разных дозах вносили в культуральную среду в начальный момент культивирования в объеме 10 мкл. В качестве растворителя препарата использовали воду (в) или спирт (с). Эффект препарата определялся в процентах как разность между пролиферацией в присутствии препарата минус пролиферация без препарата, деленная на пролиферацию без препарата и умноженная на 100% по следующей формуле:
Э=(ПП-П)/П× 100%, где
Пп - пролиферация в присутствии препарата,
П - пролиферация без препарата.
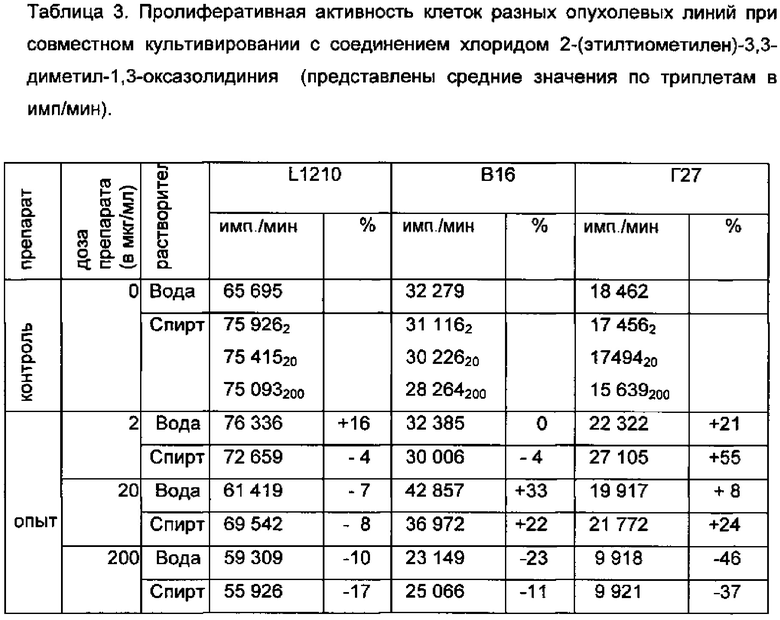
Как видно из таблицы 3, хлорид 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния не оказывает заметного влияния на пролиферативную активность клеток опухолевых линий в условиях in vitro; не обнаружено какой-либо дозозависимости эффекта.
Оценивая в целом результаты, можно утверждать, что синтетическое соединение хлорид 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния в дозах, далеких от токсических, оказывает антипролиферативный эффект на активно делящиеся лимфоидные клетки, но не клетки опухолевых линий и не ингибирует кроветворение. Обнаруженные избирательные иммунодепрессивные свойства хлорида 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния позволяют отнести его к разряду иммунодепрессантов и в будущем создавать на его основе лекарственные средства для лечения аутоиммунных и аллергических заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОДЕПРЕССАНТ | 2016 |
|
RU2637642C1 |
| ИММУНОМОДУЛЯТОР | 2003 |
|
RU2253444C1 |
| ИММУНОДЕПРЕССАНТ | 2003 |
|
RU2253448C1 |
| ИММУНОМОДУЛЯТОР | 2003 |
|
RU2224512C1 |
| ИММУНОМОДУЛЯТОР | 2003 |
|
RU2224513C1 |
| ИММУНОМОДУЛЯТОР | 2003 |
|
RU2252757C1 |
| ИММУНОМОДУЛЯТОР | 2003 |
|
RU2245142C1 |
| ИММУНОДЕПРЕССАНТ | 2002 |
|
RU2228178C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОРЕГУЛЯТОРНОГО ГЛОБУЛИНА | 1996 |
|
RU2122863C1 |
| ИММУНОМОДУЛЯТОР | 2003 |
|
RU2240794C1 |
Изобретение относится к медицине, а именно к иммунологии, и относится к новым синтетическим иммунодепрессантам. В качестве иммунодепрессанта применяют соединения хлорид 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния. Применение соединения хлорид 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния, ранее известного как антибактериальное средство, в качестве иммунодепрессанта может быть использовано в медицине в качестве основы для создания лекарственных препаратов для лечения аутоиммунных и аллергических заболеваний. 3 табл., 3 пр.
Применение соединения хлорид 2-(этилтиометилен)-3,3-диметил-1,3-оксазолидиния в качестве иммунодепрессанта.
| Способ получения 2-алкилтиометилен-3,3-диалкил-1,3-оксазолидиний хлоридов | 1983 |
|
SU1139729A1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ИММУНОДЕПРЕССИВНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2448696C1 |
| WO 9638444 A1, 05.12.1996 | |||
| US 2010267700 A1, 21.10.2010. | |||
Авторы
Даты
2017-12-05—Публикация
2016-09-05—Подача