Область техники, к которой относится изобретение
Изобретение относится к области молекулярной биофармакологии, биотехнологии и генной инженерии, может быть использовано в фармацевтической промышленности и касается способа получения рекомбинантного бифункционального фермента - дестабилазы медицинской пиявки Hirudo medicinalis.
Уровень техники
По данным Всемирной организации здравоохранения сердечно-сосудистые заболевания остаются главной причиной смертности в развитых странах. Одной из основных предпосылок к возникновению этих заболеваний является тромбоз артерий и вен. В России очень высокий показатель смертности от тромбоза на тысячу населения (1,41/1000). Поэтому разработка принципиально новых, инновационных лекарственных средств, предупреждающих тромбообразование, и препаратов, направленных на растворение тромбов при профилактике повторного образования тромбов является неотложной задачей современной биотехнологии и фармацевтики.
Дестабилаза медицинской пиявки - первый описанный представитель полифункциональных лизоцимов беспозвоночных. Данный фермент сочетает лизоцимную (КФ 3.2.1.17) и эндо-ε-(γ-Glu)-Lys-изопептидазную (КФ 3.5.1.44) активности.
Впервые дестабилаза была обнаружена в составе секрета слюнных желез медицинской пиявки и выделена из него [Баскова И.П., Никонов Г.И. Дестабилаза - фермент секрета слюнных желез медицинской пиявки гидролизует изопептидные связи в стабилизированном фибрине // Биохимия. - 1985. - Т. 50. - С. 424-431]. Действие фермента направлено на растворение стабилизированного фибрина и на расщепление Д-димера до мономеров [Баскова И.П., Завалова Л.Л., Басанова А.В., Григорьева О.В. Гидролиз Glu(γ-ε)Lys-амидных связей в D-димере, фрагменте стабилизированного фибрина, дестабилазой из медицинской пиявки // Биоорганическая химия. - 1999. - №25(6) - С. 435-438] не путем протеолиза, а путем изопептидолиза связей ε-(γ-Glu)-Lys, соединяющих мономеры [Баскова И.П., Завалова Л.Л., Кузина Е.В. Эндо-ε-(γ-GLu)Lys-изопептидолиз как проявление высокоспецифического протеолиза // Биоорганическая химия. - 1994. - №20(5) - С. 492-497]. В экспериментах на животных установлено, что такой механизм приводит к медленному разрушению старых, предобразованных тромбов [Baskova I.P., Nikonov G.I. Destabilase, the novel epsilon-(gamma-Glu)-Lys isopeptidase with thrombolytic activity. Blood Coagul Fibrinolysis. - 1991. - V. 2. - P. 167-172], т.е. дестабилаза является несрочным тромболитическим ферментом. Также была выявлена лизоцимная (мурамидазная) активность дестабилазы при разрушении клеточных стенок Micrococcus lysodeikticus [Zavalova L.L., Baskova I.P., Lukyanov S.A., Sass A.V., Snezhkov E.V., Akopov S.B., Artamonova I.I., Archipova V.S., Nesmeyanov V.A., Kozlov D.G., Benevolensky S.V., Kiseleva V.I., Poverenny A.M., Sverdlov E.D. Destabilase from the medicinal leech is a representative of a novel family of lysozymes. Biochim Biophys Acta. - 2000. - V. 1478. - P. 69-77]. Кроме того, даже инактивированный фермент обладает антимикробной активностью и блокирует рост микроорганизмов [Завалова Л.Л., Лазарев В.Н., Левицкий С.А., Юдина Т.Г., Баскова И.П. Дестабилаза-лизоцим медицинской пиявки. Полифункциональность рекомбинантного белка. // Биохимия. - 2010. - №75(9) - С. 1314-1324].
Из всех активностей фермента дестабилазы медицинской пиявки, безусловно, наибольший интерес представляет тромболитическая активность. Известно, что Д-димер является маркером тромбообразования. Его повышенный уровень в крови отмечается как результат вторичного фибринолиза в участке поврежденного тромбообразованием сосуда в ответ на воздействие тромбина, который стимулирует активацию фибринолиза путем секреции активаторов плазминогена тканевого и урокиназного типов [Kleinegris М.С., ten Cate Н., ten Cate-Hoek A.J. D-dimer as a marker for cardiovascular and arterial thrombotic events in patients with peripheral arterial disease. A systematic review. Thromb Haemost. 2013. - V. 110. - Р. 233-243]. Накопление Д-димера, конечного продукта тромболизиса, влияет на состояние гемостаза таким образом, что сдвигает равновесие в сторону превращения фибриногена в фибрин и дальнейшего тромбообразования. Одним из путей, способных сдвинуть это равновесие в сторону эндогенной активации фибринолиза, является утилизация Д-димера в результате его мономеризации.
Ранее было показано, что препараты дестабилазы проявляли медленное тромболитическое действие при внутривенном введении крысам [Baskova I.P., Nikonov G.I. Destabilase, the novel epsilon-(gamma-Glu)-Lys isopeptidase with thrombolytic activity. Blood Coagul Fibrinolysis. - 1991. - V. 2. - P. 167-172]. Спустя 67 часов после введения препарата тромбы лизировались на 67% и только спустя 137 часов наблюдалось полное их растворение. Низкая скорость тромболизиса под действием этого фермента коррелирует с низкой скоростью репарации поврежденной сосудистой стенки. Несоответствие этих параметров при срочной тромболитической терапии приводит более чем в 30% случаев к ретромбозам, чего, практически, не наблюдается при гирудотерапии (лечении медицинскими пиявками).
Таким образом, в предварительных исследованиях дестабилаза медицинской пиявки проявила себя как вещество, потенциально способное выступить в качестве основы для создания нового поколения лекарственных средств - несрочных тромболитиков.
Для проведения доклинических и клинических исследований необходимо получение больших количеств высокоочищенного рекомбинантного белка.
В работе Заваловой Л.Л. и др. [Завалова Л.Л., Лазарев В.Н., Левицкий С.А., Юдина Т.Г., Баскова И.П. Дестабилаза-лизоцим медицинской пиявки. Полифункциональность рекомбинантного белка. // Биохимия. - 2010. - №75(9) - С. 1314-1324] (ближайший аналог) была получена рекомбинантная дестабилаза медицинской пиявки Hirudo medicinalis (rec-Dest) в клетках E. coli в виде слитого белка с полигистидиновой последовательностью. Выделение rec-Dest проводили в денатурирующих условиях с использованием металлохелатной аффинной хроматографии с последующей ренатурацией полипептида путем быстрого разбавления. Для этого способа характерен небольшой выход целевого белка и дополнительная стадия концентрирования раствора целевого белка.
Раскрытие изобретения
Задачей настоящего изобретения является увеличение уровня биосинтеза полипептида rec-Dest, создание более продуктивного штамма-продуцента rec-Dest и разработка простого способа получения бифункционального фермента - рекомбинантной дестабилазы медицинской пиявки Hirudo medicinalis с высоким выходом и чистотой целевого продукта.
Поставленная задача решается описываемой рекомбинантной плазмидной ДНК pET15/N-Dest+ для экспрессии в клетках Escherichia coli гена дестабилазы медицинской пиявки Hirudo medicinalis, имеющей размер 6072 п. н., содержащей: фрагмент BamHI - Sall вектора pET15-MCS, промотор и терминатор РНК-полимеразы фага Т7.
Предпочтительно использовать фрагмент BamHI - SalI вектора pET15-MCS, несущего ген устойчивости к ампициллину ampR, при этом рекомбинантная плазмида pET15/N-Dest+ содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: PstI - 5323, EcoRI - 6071, BglII - 859.
Поставленная задача решается также описываемым способом получения рекомбинантной плазмиды pET15/N-Dest+, заключающимся в клонировании по сайтам BamHI - SalI последовательности гена дестабилазы медицинской пиявки размером 420 п. н., оптимизированного по кодонному составу, и полученного с помощью ферментативной достройки синтезированных олигонуклеотидов длиной от 29 до 46 нуклеотидов.
Поставленная задача решается также описываемым штаммом Escherichia coli BL21(DE3)Gold, трансформированным рекомбинантной ДНК pET15/N-Dest+, охарактеризованной выше, который является продуцентом рекомбинантной дестабилазы медицинской пиявки, а также способом ее получения, заключающимся в получении рекомбинантной плазмиды pET15/N-Dest+ с последующим трансформированием штамма Escherichia coli BL21(DE3)Gold полученной плазмидой.
Поставленная задача решается также описываемым способом получения рекомбинантной дестабилазы медицинской пиявки, заключающимся в том, что культивируют штамм-продуцент E. coli, трансформированный рекомбинантной плазмидой pET15/N-Dest+, который охарактеризован выше, полученную биомассу концентрируют, затем подвергают ее разрушению с помощью ультразвукового дезинтегратора, выделяют тельца-включения, содержащие рекомбинантную дестабилазу, которые очищают методом металлохелатной аффинной хроматографией.
Предпочтительно культивирование штамма осуществляют при температуре 20-42°C в питательной среде на основе бульона SB или на агаризованной LB-среде. Наилучший результат достигается при культивировании штамма при 37°C в питательной среде на основе бульона SB при рН 7,2.
Предпочтительно концентрирование биомассы осуществляют центрифугированием культуральной жидкости при предварительном ее охлаждении до +4-+8°C. Наилучший результат достигается при охлаждении биомассы до +4°C.
Предпочтительно очистку рекомбинантной дестабилазы проводят в денатурирующих условиях, используя в качестве сорбента Ni Sepharose High Performance (GE Healthcare, США) с последующей ренатурацией полипептида дестабилазы медицинской пиявки путем проведения ступенчатого диализа против фосфатно-солевого буфера.
Заявленную рекомбинантную плазмиду, физическая карта которой представлена на фиг. 1, получают с помощью генно-инженерных манипуляций из плазмиды рЕТ-15b (Novagen, США) и синтетических олигонуклеотидов, представленных в табл. 1.
Штамм-продуцент rec-Dest получают путем трансформации компетентных клеток E. coli BL21(DE3)Gold сконструированной рекомбинантной плазмидной ДНК pET15/N-Dest+.
Полученный штамм бактерий BL21(DE3)Gold/pET15/N-Dest+, несущий плазмиду pET15/N-Dest+, характеризуется следующими признаками.
Морфологические признаки: клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки: клетки хорошо растут на обычно используемых питательных средах. Время генерации около 30 мин в жидкой SB-среде. При росте на агаризованной LB-среде колонии круглые, гладкие, полупрозрачные, блестящие, серые, край ровный; диаметр колоний 2-3 мм; консистенция пастообразная. Рост в жидкой среде SB характеризуется равномерным помутнением среды.
Физиолого-биохимические признаки: клетки штамма продуцента могут расти в диапазоне температур 20-42°C, при этом оптимум составляет 37°C. Наиболее благоприятные для роста значения рН находятся в интервале 6,8-7,2.
Устойчивость к антибиотикам: клетки проявляют устойчивость к ампициллину (до 150 мг/л), обусловленную наличием в плазмиде pET15/N-Dest+ гена ampR.
Способ, условия и состав среды для хранения штамма: SB-бульон с 15% глицерином, при температуре -70°C, в криовиалах.
Перечень иллюстраций изобретения:
На фигуре 1 представлена физическая карта рекомбинантной плазмиды pET15/N-Dest+.
На фигуре 2 представлена полная нуклеотидная последовательность гена дестабилазы медицинской пиявки, инициирующий и терминирующий кодоны выделены жирным шрифтом и подчеркнуты.
На фигуре 3 представлен пример хроматографического разделения rec-Dest. Электрофоретический анализ в 15% ПААГ фракций, полученных в результате металлхелатной хроматографии раствора телец включения, содержащих rec-Dest. 1 - исходный образец до очитки; 2 - фракция белков, не связавшихся с сорбентом; 3 - фракция белков, связавшаяся с сорбентом. М - маркеры молекулярных масс (кДа). Окраска геля Кумасси G-250; a, b и с - тример, димер и мономер белка соответственно.
На фигуре 4 представлены результаты определения фибринолитической активности rec-Dest. 1 - зона лизиса фибринового геля после нанесения препарата rec-Dest и инкубации при комнатной температуре в течение 48 часов. 2 - зона лизиса фибринового геля после нанесения буферного раствора, содержащего 20 мМ фосфата натрия, 0,15 М NaCl (отрицательный контроль).
Осуществление изобретения
Изобретение иллюстрируется следующими примерами:
Пример 1. Конструирование рекомбинантной плазмиды pET15/N-Dest+
Вектор pET-15b (Novagen, США) расщепляют эндонуклеазами рестрикции NdeI и BamHI. Расщепленную плазмиду осаждают этанолом и используют в реакции лигирования с олигонуклеотидами 15MCS-F и 15MCS-R (табл. 1). Лигазной смесью трансформируют штамм E. coli ТОР10. Среди полученных клонов отбирают устойчивые к ампициллину клоны. Из отобранных клонов выделяют плазмиды и проводят их рестрикционный анализ. В результате, получают модифицированную плазмиду рЕТ15-MCS, несущую участок ДНК с дополнительными сайтами рестрикции (полилинкер).

Для получения рекомбинантной плазмиды pET15/N-Dest+ проводят достройку гибридизованных олигонуклеотидных праймеров, преставленных в табл. 1, с последующей полимеразной цепной реакцией. Полученный в результате реакции фрагмент ДНК длиной 420 п. н. и вектор pET15-MCS (Novagen, США) расщепляют эндонуклеазами рестрикции BamHI и SalI. После этого ферменты осаждают этанолом и проводят реакцию лигирования. Лигазной смесью трансформируют штамм E. coli ТОР10. Среди полученных клонов отбирают устойчивые к ампициллину клоны. Из отобранных клонов выделяют плазмиды и проводят их рестрикционный анализ.
Структуру клонированного гена в отобранных клонах подтверждают определением нуклеотидной последовательности с использованием набора BigDye Terminator Cycle Sequencing Kit (v. 3.11) (Applied Biosystems, США). В результате получают экспрессионную плазмиду pET15/N-Dest+ (фиг. 1). Плазмида pET15/N-Dest+ содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: PstI - 5323, EcoRI - 6071, BglII - 859.
Пример 2. Получение штамма-продуцента
Рекомбинантной плазмидной ДНК pET15/N-Dest+ трансформируют компетентные клетки Escherichia coli BL21(DE3)Gold (Novagen, США) и после выращивания рекомбинантных клонов на LB-агаре с ампициллином (100 мг/л) при 37°C получают штамм-продуцент полипептида rec-Dest.
Пример 3. Выращивание штамма-продуцента E. coli BL21(DE3)Gold/pET15/N-Dest+) в ферментере
Ферментацию проводят с использованием оборудования Techfors (Infors, Швейцария) (50-литровый биореактор с электромагнитным импеллером и контроллером, обеспечивающим, в частности, мониторинг уровня растворенного кислорода, рН, некоторых ионов, глюкозы и пенообразования.
Объем ферментации составляет 30 л, в среде LB, содержавшей дополнительно 1% глюкозы, 50 мМ калий-фосфата и 0.5 мМ MgCl2. Значение рН среды при инокуляции 7.6 в дальнейшем поддерживают в диапазоне 7-7.2 титрованием NaOH. Начальная концентрация антибиотика (ампициллин) составляет 100 мкг/мл.
Инокулят (2 л) готовят в 5 л ферментере Brunswick BioFlo 110 Fermentor/Bioreactor (Fisher Scientific) в среде 2xYT, содержащей 5% глицерина, 5% глюкозы, 80 мМ калий-фосфата и 3 мМ MgCl2. Начальная концентрация антибиотика (карбенициллин) составляет 100 мкг/мл. Инокулят растят с использованием 100 мл "разгонной" культуры, приготовленной в среде SOB с добавлением 5% глюкозы. Разгонную культуру готовят из одной колонии продуцента, наращивая биомассу в течение 7 часов при концентрации карбенциллина 100 мкг/мл. Температура роста разгонной культуры и инокулята составляет 37°C.
Инокулят вводят в предварительно разогретую до 37°C культуральную среду, в основной ферментер, и растят культуру на протяжении 8 часов, контролируя рН (7-7.2) и % растворенного кислорода (28-30%). После этого добавляют Изопропил-β-D-1-тиогалактопиранозид до 0.3 мМ. После индукции контролируют параметры культуры и при истощении добавляют смесь, содержащую 800 г/л глюкозы и 2 г/л ампициллина, используя автоматику ферментера. Через 1 ч после индукции активируют аппаратуру введения пеногасителя (раствор 5% AntifoamB, Sigma).
Наработку продукта проводят в течение 12 часов. По окончании продукции биомассу отделяют от среды с использованием проточной центрифуги Centritech VP Pilot и хранят при -80°C.
Содержание rec-Dest в биомассе рекомбинантного штамма-продуцента составляет около 20% от суммарного белка клетки. Накопление rec-Dest в клетках достигает 50 мг на литр бактериальной культуры.
Пример 4. Очистка rec-Dest из выращенной в ферментере биомассы
Клеточную массу, полученную из 30 л бактериальной культуры, ресуспендируют в 2 л буфера для лизиса (20 мМ TisCl, 100 мМ NaCl, 0,1% Triton Х-100), после чего разрушают с помощью ультразвукового дезинтегратора Branson 250 Sonifier (Branson, США) при 22 кГц 30 мин. Лизат центрифугируют (15000 g, 30 мин). Полученный осадок ресуспендируют в 1% раствором Triton Х-100 и осаждают центрифугированием при 15000 g в течение 30 мин. Отмывку детергентом повторяют пятикратно. Отмытые тельца включения солюбилизируют в 0,5 л буфера (8 М мочевина, 20 мМ Na+-фосфатный буфер, 10 мМ имидазол, 0,5 М NaCl, 0,1% β-меркаптоэтанола, рН 7,5). Для эффективного растворения инкубируют в течение ночи при комнатной температуре и перемешивании. Растворимую фракцию отделяют от осадка центрифугированием (15000 g, 30 мин), отбирают и фильтруют через фильтр с диаметром пор 0,45 мкм (Sartorius, США).
К полученному раствору rec-Dest добавляют 20 мл сорбента Ni Sepharose High Performance (GE Healthcare, США), промытого тем же буфером, который используют для растворения телец включения. Инкубируют при комнатной температуре и перемешивании не менее часа. Сорбент осаждают центрифугированием 10 мин при 1500 g и переносят в хроматографическую колонку XK-16/20 (GE Healthcare, США). Колонку промывают 200 мл отмывочного буфера (8 М мочевина, 20 мМ Na+-фосфатный буфер, 40 мМ имидазол, 0,5 М NaCl, рН 7,5), а затем элюируют связавшиеся с сорбентом полипептиды буфером для элюции (20 мМ Na+-фосфатный буфер, 8 М мочевина, 0,5 М NaCl, 0,5 М имидазол, рН 7,4). После схождения пика оптической плотности колонку оставляют заполненной элюционным буфером на 12 часов, после чего элюируют повторно. Скорость протока буфера составляет 1 мл/мин, контроль процесса и сбор фракций осуществляют на основании проточного измерения оптической плотности элюата при длине волны 280 нм. Все операции по хроматографическому разделению выполняют с помощью хроматографа AKTA FPLC (GE Healthcare, США). Нахождение дестабилазы в полученных фракциях определяют методом денатурирующего электрофореза в ПААГ по Лэммли.
Очищенный с помощью металлхелатной хроматографии препарат rec-Dest разводят буфером (8 М мочевина, 20 мМ Na+-фосфатный буфер, рН 5) до концентрации белка 0,5 мг/мл. Полученный препарат диализуют против 10 объемов раствора 4 М мочевины, 20 мМ фосфата натрия, 0,15 М NaCl. Далее, последовательно диализуют против буфера того же состава, содержащего 2 М мочевину, 1 М мочевину, и на последней стадии без мочевины. Каждую стадию диализа проводят не менее 8 ч при температуре +4°C.
Полученный препарат очищают от выпавшего в осадок белка центрифугированием при 20000 g 20 мин. Раствор, содержащий rec-Dest, хранят в замороженном виде при -20°C. При необходимости, для повышения концентрации дестабилазы применяют ультрафильтрацию. Для этого используют центрифужные ультрафильтрационные ячейки Amicon Ultra-15 Centrifugal Filter Units 3,000 NMWL (Millipore, США). Центрифугируют при ускорении 4500 g до достижения необходимой концентрации дестабилазы в растворе. Замороженные образцы в дальнейшем подвергают лиофильной сушке.
Полученный продукт полностью удовлетворяет требованиям, предъявляемым к иммунобиологическим рекомбинантным препаратам по содержанию примесных бактериальных белков E. coli.
Пример хроматографического разделения rec-Dest приведен на фиг. 3.
Пример 5. Определение фибринолитической активности rec-Dest
Фибринолитическую активность rec-Dest определяют на фибриновых пластинах, приготовленных следующим образом. 6 мг фибриногена (Технология-Стандарт, Россия) растворяют в 15 мл 0,1 М натрий-фосфатного буфера, рН 7.4, содержащего 0,15 М NaCl. К этому раствору добавляют 0,5 ед. тромбина (Технология-Стандарт, Россия), быстро перемешивают и выливают на чашку Петри (150 мм), помещенную на ровную поверхность, и инкубируют в течение 4 часов при комнатной температуре.
На подготовленную фибриновую пластину аккуратно наносят по 5 мкл rec-Dest, с концентрацией 1 мг/мл в буферном растворе, содержащем 20 мМ фосфата натрия, 0,15 М NaCl. Также в объеме 5 мкл наносят буферный раствор, содержащий 20 мМ фосфата натрия, 0,15 М NaCl (отрицательный контроль). Пластинку накрывают крышкой и инкубируют при комнатной температуре 48 часов. Затем измеряют диаметр зоны лизиса фибринового геля. Пример определения фибринолитической активности rec-Dest приведен на фиг. 4.
Пример 6. Определение лизоцимной активности rec-Dest
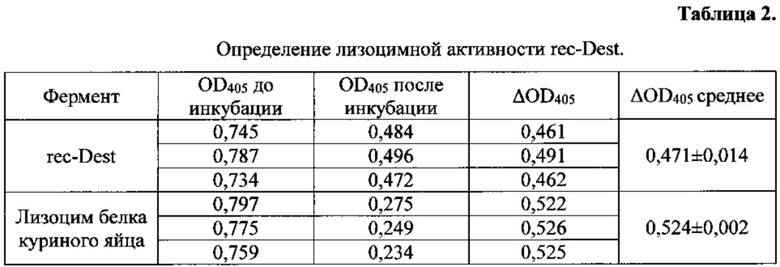
Лизоцимную активность rec-Dest определяют по уровню просветления суспензии клеточных стенок Micrococcus luteus (Sigma, США). Клеточные стенки разводят в 20 мМ натрий-фосфатном буфере с рН 6.8 до концентрации 0,5 мг/мл. Суспензию помещают в шейкер на три часа при комнатной температуре. Далее, в лунки 96-луночного планшета добавляют суспензию клеточных стенок и rec-Dest в конечной концентрации 20 мкг/мл. Объем пробы составляет 200 мкл. В качестве отрицательного контроля используют буферный раствор, содержащий 20 мМ фосфата натрия, 0,15 М NaCl (отрицательный контроль). В качестве положительного контроля используют лизоцим белка куриного яйца (Sigma, США) в концентрации 1 мкг/мл с известной активностью. Образцы инкубируют 30 мин при комнатной температуре. Оптическую плотность измеряют на планшетном фотометре при длине волны 405 нм. Абсолютную активность рассчитывают по разнице оптических плотностей до и после инкубации. Относительную активность рассчитывают относительно лизоцима белка куриного яйца с известной активностью. Пример определения лизоцимной активности rec-Dest приведен в табл. 2.
Активность контрольного лизоцима 14700 единиц. Концентрация дестабилазы в 20 раз больше концентрации лизоцима, активность rec-Dest рассчитывают по формуле:
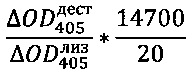
Таким образом, активность данного препарата rec-Dest составляет 660±20 единиц.
Таким образом, заявленная рекомбинантная плазмидная ДНК pET15/N-Dest+ и способ ее получения, штамм-продуцент Escherichia coli BL21(DE3)Gold/pET15/N-Dest+ и способ его получения обеспечивают возможность получения заявленным способом рекомбинантной дестабилазы медицинской пиявки с высоким выходом и достаточной чистотой.



Изобретение относится к области биохимии и биотехнологии, в частности к рекомбинантной плазмидной ДНК pET15/N-Dest+. Указанная плазмидная ДНК предназначена для экспрессии в клетках Escherichia coli гена дестабилазы медицинской пиявки Hirudo medicinalis. Настоящее изобретение также относится к способу получения плазмидной ДНК pET15/N-Dest+ и к штамму Escherichia coli BL21(DE3)Gold/pET15/N-Dest+, полученному путем трансформации штамма Escherichia coli BL21(DE3)Gold плазмидой ДНК pET15/N-Dest+. Настоящий штамм является продуцентом рекомбинантной дестабилазы. Изобретение также относится к способу получения штамма Escherichia coli BL21(DE3)Gold/pET15/N-Dest+ и к способу получения рекомбинантной дестабилазы с использованием указанного штамма. Изобретение позволяет получить рекомбинантную дестабилазу с высоким выходом и чистотой. 5 н. и 5 з.п. ф-лы, 4 ил., 2 табл., 6 пр.
1. Рекомбинантная плазмидная ДНК pET15/N-Dest+ для экспрессии в клетках Escherichia coli гена дестабилазы медицинской пиявки Hirudo medicinalis, имеющая размер 6072 п. н. и содержащая:
а) вектор pET-15-MCS, полученный путем расщепления плазмиды рЕТ-15b эндонуклеазами рестрикции NdeI и BamHI и лигирования с олигонуклеотидами 15MCS-F и 15MCS-R, приведенных в Табл. 1, расщепленный эндонуклеазами рестрикции BamHI и SalI;
б) синтетический фрагмент ДНК, кодирующий зрелую дестабилазу медицинской пиявки Hirudo medicinalis, имеющий последовательность, приведенную на Фиг. 2.
2. Рекомбинантная плазмидная ДНК по п. 1, характеризующаяся тем, что вектор рЕТ15-MCS, расщепленный эндонуклеазами рестрикции BamHI и SalI, несет ген устойчивости к ампициллину ampR.
3. Рекомбинантная плазмида по п. 1, характеризующаяся тем, что она содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: PstI - 5323, EcoRI - 6071, BglII - 859.
4. Способ получения рекомбинантной плазмиды по п. 1, включающий расщепление плазмиды рЕТ-15b эндонуклеазами рестрикции NdeI и BamHI и лигирование с олигонуклеотидами 15MCS-F и 15MCS-R, приведенными в Табл. 1, с получением вектора pET-15-MCS, затем расщепление полученного вектора эндонуклеазами рестрикции BamHI и SalI и встраивание синтетического фрагмента ДНК размером 420 п. н., приведенного на Фиг. 2, полученного с помощью ферментативной достройки химически синтезированных олигонуклеотидов, приведенных в Табл. 1, за исключением олигонуклеотидов 15MCS-F и 15MCS-R, который кодирует зрелую дестабилазу.
5. Штамм Escherichia coli BL21(DE3)Gold/pET15/N-Dest+ - продуцент рекомбинантной дестабилазы, полученный путем трансформации штамма Escherichia coli BL21(DE3)Gold рекомбинантной плазмидой по п. 1.
6. Способ получения штамма-продуцента по п. 5, включающий получение плазмиды по п. 1 с последующим трансформированием штамма Escherichia coli BL21(DE3)Gold полученной плазмидой.
7. Способ получения рекомбинантной дестабилазы, включающий культивирование штамма-продуцента по п. 5, концентрирование полученной биомассы, разрушение с помощью ультразвукового дезинтегратора, выделение телец включения, содержащих рекомбинантную дестабилазу, солюбилизацию телец включения в денатурирующем буфере и очищение методом металлохелатной аффинной хроматографии.
8. Способ по п. 7, характеризующийся тем, что культивирование штамма осуществляют при 20-42°С в питательной среде на основе бульона SB или на агаризированной LB-среде.
9. Способ по п. 7, характеризующийся тем, что концентрирование биомассы осуществляют центрифугированием культуральной жидкости, при предварительном ее охлаждении до +4-+8°С.
10. Способ по п. 7, характеризующийся тем, что очистку рекомбинантной дестабилазы проводят в денатурирующих условиях с использованием в качестве сорбента Ni Sepharose High Performance с последующей ренатурацией полипептида дестабилазы медицинской пиявки путем проведения ступенчатого диализа против фосфатно-солевого буфера.
| ЗАВАЛОВА И ДР | |||
| Дестабилаза-лизоцим из медицинской пиявки | |||
| Полифункциональность рекомбинантного белка, БИОХИМИЯ, 2010 | |||
| ЗАВАЛОВА И ДР | |||
| Рекомбинантная дестабилаза-лизоцим: синтез de novo в E | |||
| coli и механизм действия фермента, экспрессированного в Spodoptera frugiperda, БИОХИМИЯ, 2004 | |||
| JOSKOVA ET AL | |||
| Identification and cloning of an invertebrate-type lysozyme from Eisenia andrei, DEVELOPMENTAL AND COMPARATIVE IMMUNOLOGY, 2009. |
Авторы
Даты
2018-06-21—Публикация
2015-07-29—Подача