Изобретение относится к медицине, а именно к травматологии, и касается лечения повреждений опорно-двигательного аппарата, связанных с нарушением целостности кости (трещинах и переломах), в том числе при закрытых переломах лучевой кости, и может быть применено для более быстрого формирования костной мозоли при переломах и трещинах.
Сращение кости при трещинах или переломах - закономерный биологический процесс, который в подавляющем большинстве случаев должен приводить к восстановлению ее целостности и возобновлению физиологических функций. В регенерации тканей после травмы основная роль принадлежит закрепленному в эволюции биологическому процессу, который происходит автоматически, стереотипно и этап за этапом приводит к заключительному явлению - регенерация. Однако многие факторы могут повлиять на этот процесс: пол, возраст, индивидуальные особенности организма, наличие сопутствующих заболеваний, таких как сахарный диабет, которые достоверно снижают сроки сращения травмированной ткани.
Особенно важным является тот факт, что травму получают и люди молодого возраста, у которых надолго снижается трудоспособность, и пожилые пациенты у которых вследствие патологических процессов нарушен процесс восстановление костной ткани. Поэтому очевидно, что проблема сокращения сроков сращения перелома является не только медицинской, но и социально-экономической проблемой.
В настоящее время проводится активный поиск новых средств, стимулирующих регенерацию костной ткани. Поэтому было предложено исследовать действие препарата хондроитина сульфата на регенераторные процессы костной ткани.
При лечении переломов костей в дополнение к стандартной базовой терапией (фиксация кости путем наложения гипсовой повязки и назначение анальгетиков) используют также и «сопутствующую терапию».
Так известно дополнительное внутримышечное введение витаминов при лечении переломов костей параллельно со стандартной базовой терапией. (АС СССР №1268169 Способ лечения переломов костей. Заявка: 4802826. Дата подачи: 07.12.1989. Опубликовано: 23.01.1993). Введение витаминов повышает защитные силы организма, однако не воздействует напрямую на регенерацию костной ткани.
Известна лиофилизированная фармацевтическая композиция, содержащая в основе хондроитин сульфат с добавлением в качестве стабилизатора натрия метабисульфит. (Патент РФ №2458693 Лиофилизированная фармацевтическая композиция для приготовления раствора для инъекций для лечения дегенеративно-дистрофических заболеваний опорно-двигательного аппарата и способ ее получения. Заявка: 2011131516/15. Дата подачи: 28.07.2011. Опубликовано: 20.08.2012). Основными областями применения данной композиции являются дегенеративно-дистрофические заболевания суставов и позвоночника: первичный артроз, межпозвонковый остеохондроз, остеоартроз, остеопороз, пародонтопатия, переломы костей (для ускорения образования костной мозоли).
Однако в указанном источнике не приводятся методики использования заявленной композиции при переломах. Нет данных о необходимых дозировках и сроках проведения лечения.
Наиболее близким к предложенному изобретению является способ лечения переломов включающий дополнительное внутримышечное введение хондроитина сульфата. (Патент РФ №2416411 Способ лечения переломов длинных трубчатых костей. Заявка: 2008150987/14. Дата подачи: 22.12.2008. Дата публикации заявки: 27.06.2010. Опубликовано: 20.04.2011.).
При этом хондроитин сульфат вводят ежедневно в течении 3-4 недель на 14-й день после начала стандартной базовой терапии (после сопоставления и фиксации обломков).
По мнению заявителей, «Назначение препарата именно на 14 день обусловлено механизмом минерализации хрящей, а именно в эти сроки кости нуждаются в глюкозамингликане хондроитин сульфат.» (конец цитаты)
Однако, как выявили проведенные исследования, костная мозоль начинает образовываться ранее 14 дней. Поэтому столь позднее введение препарата не будет способствовать ускорению регенерации костной ткани. Кроме того не обосновано ежедневное (1 раз в день) введение препарата. Пациент получает лишние неудобства без улучшения лечебного эффекта.
Задачей, на решение которой направлено изобретение является расширение арсенала используемых средств, повышение частоты формирования костной мозоли и увеличение скорости формирования костной мозоли за счет ускорения появления фиброзно-хрящевой мозоли и ее минерализации.
Поставленная задача решается за счет того, что в способе лечения повреждений опорно-двигательного аппарата, связанных с нарушением целостности кости, включающем введение хондроитина сульфата внутримышечно, согласно изобретению, хондроитин сульфат вводят от 100 до 200 мг через 1 день, при этом 1-ую инъекцию хондроитин сульфат вводят в максимально короткий срок с момента получения повреждения, преимущественно в день получения повреждения или на следующий день, предпочтительно после фиксации кости. Особенность может заключаться в том, что с 1 -ой инъекции хондроитин сульфат могут вводить по 100 мг, а начиная с 3-ей или 4-ой или 5-ой или 6-ой инъекции - по 200 мг. Общий курс лечения может составлять не менее 10-14 инъекций, а в качестве объекта лечения, наряду с другими видами переломов, может быть выбран закрытый перелом лучевой кости.
Для осуществления способа может быть использован фармацевтический препарат, включающий в качестве активного компонента хондроитин сульфат, характеризующийся тем, что он выполнен в форме раствора, готового к употреблению или лиофилизата для приготовления раствора для внутримышечного введения, каждый из которых содержит 100 мг хондроитин сульфата.
Другим аспектом изобретения является применение хондроитина сульфата для ускорения формирования фиброзно-хрящевой мозоли при лечении заболеваний опорно-двигательного аппарата, связанных с нарушением целостности кости, например, но не исключительно, при закрытом переломе лучевой кости. При этом применение хондроитин сульфата осуществляют путем внутримышечного введения дозой от 100 до 200 мг через 1 день в максимально короткий срок с момента получения повреждения, преимущественно в день получения повреждения или на следующий день, предпочтительно после фиксации кости, а общий курс применения хондроитина сульфата может составлять не менее 10 инъекций до начала минерализации фиброзно-хрящевой мозоли.
Хондроитинсульфаты - полимерные сульфатированные гликозаминогликаны. Являются специфическими компонентами хряща. Вырабатываются хрящевой тканью суставов, входят в состав синовиальной жидкости. Необходимым строительным компонентом хондроитинсульфата является глюкозамин, при недостатке глюкозамина в составе синовиальной жидкости образуется недостаток хондроитинсульфата, что ухудшает качество синовиальной жидкости и может вызвать хруст в суставах.
Хондроитинсульфат обладает тропностью к хрящевой ткани, инициирует процесс фиксации серы в процессе синтеза хондроитин-серной кислоты, что, в свою очередь, способствует отложению кальция в костях. Стимулирует синтез гиалуроновой кислоты, укрепляя соединительнотканные структуры: хряща, сухожилий, связок, кожи. Оказывает анальгетическое и противовоспалительное действие, является хондропротектором, способствует активной регенерации хряща.
Особенностью хондроитина среди протеогликанов является его способность сохранять воду в толще хряща в виде водных полостей, создающих хорошую амортизацию и поглощающих удары, что в итоге повышает прочность соединительной ткани. Важным действием хондроитина является его способность угнетать действие специфических ферментов, разрушающих соединительную ткань, в том числе лизосомальных ферментов, высвобождающихся в результате разрушения хондроцитов (эластаза, пептидаза, катепсин, интерлейкин-1 и др.).
Естественное потребление хондроитинсульфата и других хондропротекторных веществ осуществлялось с употреблением в пищу сухожилий, кожи и хрящей животных, особенно рыб. В связи с уменьшением доли этих продуктов в рационе современного человека (иногда и с полным исключением), а также при метаболических нарушениях, чрезмерных функциональных нагрузках и особенно возрастном снижении активности синтетических процессов хондроитинсульфат должен поступать уже в готовом виде (или в виде предшественников синтеза) извне, в том числе с пищей
Хондроитина сульфат замедляет резорбцию костной ткани и снижает потерю Ca2+. Улучшает фосфорно-кальциевый обмен в хрящевой ткани, ускоряет процессы ее восстановления, тормозит процессы дегенерации хрящевой и соединительной ткани. Подавляет активность ферментов, вызывающих поражение хрящевой ткани, стимулирует синтез гликозаминогликанов, способствует регенерации суставной сумки и хрящевых поверхностей суставов, увеличивает продукцию внутрисуставной жидкости. Уменьшает болезненность и увеличивает подвижность пораженных суставов. Обладая структурной схожестью с гепарином, потенциально может препятствовать образованию фибриновых тромбов в синовиальном и субхондральном микроциркуляторном русле.
Из приведенного выше уровня техники известно применение хондроитин сульфата в виде внутримышечных инъекций при переломах. Однако отсутствует информация о точных методиках использования препарата с приведением данных доказательных исследований, либо описанные методики не позволяют существенно повысить частоту формирования костной мозоли и сократить сроки начала формирования костной мозоли.
Исследуя целесообразность применения хондроитина сульфата при переломах, неожиданно было обнаружено, что введение препарата внутримышечно по 100 мг через 1 день с последующим увеличением дозы до 200 мг приводит к существенному сокращению срока лечения. Так при лечении закрытого перелома лучевой кости срок лечения составил 3-4 недели. Достаточно было осуществить 10-14 инъекций.
Далее будут приведены данные исследований использования хондроитина сульфата при лечении перелома лучевой кости. Но поскольку процессы лечения аналогичны для различных типов переломов, применение изложенной схемы лечения распространяется и на эти типы.
Исследование относилось к III фазе: проведение клинического исследования с целью установления безопасности лекарственного препарата и его эффективности для пациентов с определенным заболеванием.
Исследование являлось открытым, т.е. и пациент, и врач-исследователь знали, что получал пациент - исследуемый препарат или стандартную базовую терапию (наложение гипсовой повязки, назначение анальгетиков в том числе парацетамола). Подготовка к введению препарата осуществлялась в отдельном помещении клинической базы - процедурном кабинете.
Общая длительность исследования для пациента составила не более 28±1 дней, разделенных на 3 периода:
- период скрининга - 0-1 день
- период лечения - 28±1 дней (4 недели)
препарат назначали по 100 мг через 1 день внутримышечно в течение 5 дней исследования с последующим увеличением дозы препарата до 200 мг через день внутримышечно, начиная с 4-ой инъекции (7-й день исследования). Пациентам основной группы исследуемый препарат вводился в условиях стационара. Всего в рамках данного исследования было предусмотрено 14 инъекций исследуемого препарата;
на 14, 21 и 28 день проводились рентгенография лучевой кости (в двух проекциях) для определения степени образования костной мозоли, коагулограмма;
- период завершения исследования - 1 день
Во время периода скрининга V0 (день 0-1) проводилась оценка критериев включения/невключения и производились: биохимический анализ крови, клинический анализ крови, общий анализ мочи, коагулограмма, рентгенография лучевой кости (в двух проекциях), сбор жалоб и анамнеза, ЭКГ (электрокардиограмма), физикальный осмотр, измерение АД, ЧСС, тест на беременность (для женщин репродуктивного возраста), регистрация сопутствующей терапии;
Период лечения начнется на визите V1 (день 1). После заключительной оценки критериев включения/невключения по результатам выполненных обследований принималось решение о включении пациента в исследование, и проводилась рандомизация 1:1 в одну из двух групп лечения: назначался и вводился раствор препарата Хондроитин сульфат (100 мг 1 инъекция через день внутримышечно с последующим увеличением дозы до 200 мг через день внутримышечно, начиная с 4-ой инъекции (7-й день исследования)) или назначалась стандартная базовая терапия (наложение гипсовой повязки, назначение анальгетиков, в том числе парацетамола); проводились: физикальный осмотр, оценка нежелательных явлений/серьезных нежелательных явлений, сбор жалоб и анамнеза, регистрация сопутствующей терапии;
На визитах V2 (14 день) и V3 (21 день) проводились, рентгенография лучевой кости (в двух проекциях), физикальный осмотр (включая измерение АД и ЧСС) сбор жалоб и анамнеза, коагулограмма, регистрация/коррекция (при необходимости) стандартной базовой терапии, оценка нежелательных явлений/серьезных нежелательных явлений, регистрация сопутствующей терапии;
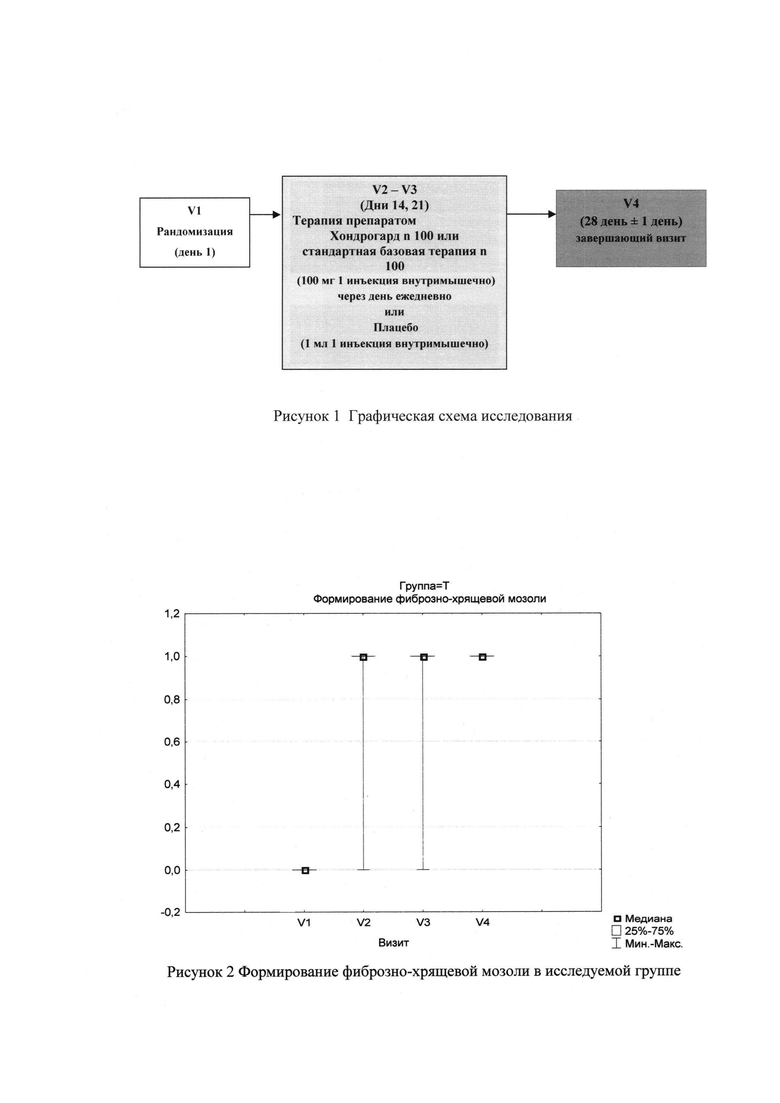
Период завершения исследования - визит V4 был назначен на 28±1 день лечения, натощак. На данном визите проводились: физикальное обследование, ЭКГ (электрокардиограмма), клиническое и лабораторное обследование, измерение АД, ЧСС, оценка нежелательных явлений, клинический анализ крови и мочи, биохимические анализы, рентгенография лучевой кости (в двух проекциях), коагулограмма, сбор жалоб и анамнеза, регистрация сопутствующей терапии, регистрация стандартной базовой терапии, (рис. 1)
Исследуемую популяцию представляли 200 пациентов обоего пола в возрасте от 18 до 75 лет с установленным и документально подтвержденным диагнозом закрытый перелом лучевой кости, включенные в исследование из нескольких стационаров Российской Федерации.
Все пациенты, прошедшие скрининг были рандомизированны в группу, получающую терапию препаратом «раствор Хондроитин сульфата» (100 человек) и группу без терапии (группу сравнения) - стандартная базовая терапия (100 человек).
Режим дозирования и способ введения был выбран на основании многочисленных исследований: по 1 инъекции (100 мг) через день глубоко в/м. Было предусмотрено увеличение дозы исследуемого препарата до 200 мг через день внутримышечно, начиная с 4-ой инъекции (7-й день исследования) вплоть до завершения исследования. Хотя в определенных условиях увеличение дозы может быть произведено и на 3-ей, 5-ой или 6-ой инъекции. Пациентам основной группы лечения приходили в клинику дополнительно для введения препарата в условиях стационара (10 дополнительных визитов). Всего в рамках данного исследования проводилось 14 инъекций исследуемого препарата. Увеличение дозы может не происходить в зависимости от переносимости хондроитина сульфата пациентом.
Сравнение эффективности было проведено путем тестирования гипотезы равенства основного показателя исследования (частота формирования костной мозоли по данным рентгенологического исследования) в терапевтических группах исследования (Группа 1: терапия препаратом «раствор Хондроитин сульфата», Группа 2: стандартная базовая терапия).
Параметры эффективности
- Скорость формирования костной мозоли (по данным рентгенологического исследования)
- Частота формирования костной мозоли (по данным рентгенологического исследования)
Рентгенологические исследования были проведены у каждого пациента на момент визита скрининга (день 0 настоящего исследования), а также на Визитах 2-4 (день 14, день 21 и день 28 настоящего исследования). В ходе рентгенологических исследований на указанных визитах оценивались следующие параметры формирования костной мозоли (стадия образования ангиогенных костных структур и минерализации белковой основы регенерата):
- формирование фиброзно-хрящевой мозоли (номинальный показатель с возможными категориями «да»/«нет»);
- минерализация фиброзно-хрящевой мозоли (номинальный показатель с возможными категориями «да»/«нет»);
- рентгенологическая визуализация линии перелома (номинальный показатель с возможными категориями «да»/«нет»)
Для указанных рентгенологических показателей формирования костной мозоли зафиксировано время фиксации показателя (день 14, день 21 или день 28), таким образом, будут получены показатели скорости формирования костной мозоли:
- скорость формирования фиброзно-хрящевой костной мозоли (порядковый показатель с возможными категориями «день 14», «день 21», «день 28»);
- скорость минерализации фиброзно-хрящевой мозоли (порядковый показатель с возможными категориями «день 14», «день 21», «день 28»);
- время до исчезновения визуально отмечаемой линии перелома (порядковый показатель с возможными категориями «день 14», «день 21», «день 28»).
Основным критерием эффективности терапии являлась оценка частоты формирования костной мозоли. Анализ проводился путем оценки рентгенограмм на всех визитах по номинальному показателю, оцененному как «да», «нет». Были рассмотрены три показателя: частота формирования фиброзно-хрящевой мозоли, частота минерализация костной мозоли (при этом за положительный ответ считали начало минерализации мозоли) и частота рентгенологическая визуализация линии перелома.
Дополнительным критерием эффективности был показатель скорости формирования костной мозоли, который рассчитывался в днях путем оценки рентгенограмм по номинальному показателю, оцененному как «да», «нет». Были рассмотрены три показателя: скорость формирования фиброзно-хрящевой костной мозоли, скорость минерализации фиброзно-хрящевой мозоли, время до исчезновения визуально отмечаемой линии перелома.
Был проведен статистический анализ для оценки эффективности, включавший описательную статистику по группам, анализ с использованием Q критерия Кохрена для зависимых выборок (внутригрупповой анализ) и сравнительный анализ контрольной и исследуемой группы с использованием критерия Манна-Уитни (межгрупповой анализ).
Результаты данных расчетов представлены в таблицах 1-3.
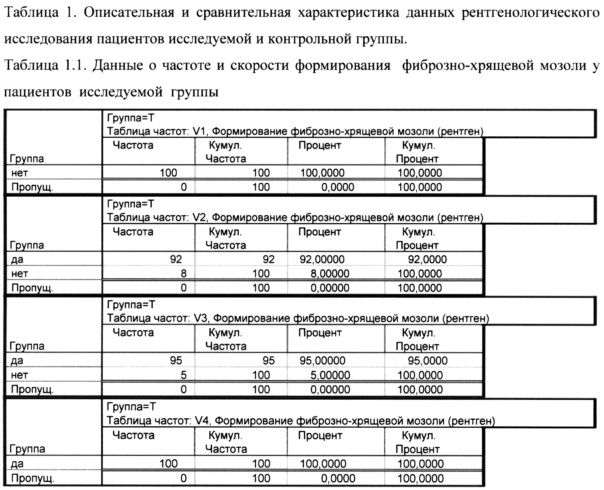
Как показано в таблице 1.1 на визите 1 ни у одного пациента в исследуемой группе не сформировалась фиброзно-хрящевая мозоль, на визите 2 она сформировалась у 92% пациентов, к визиту 3 этот процент составил 95%, а к визиту 4 - 100%. Показатель скорости формирования мозоли у 92% составил 14 дней, у 3% - 21 день и у 5% - 28 дней.
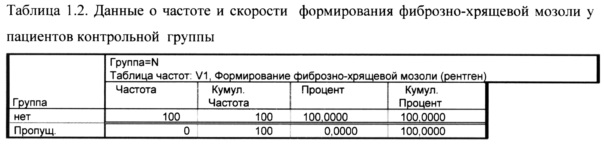
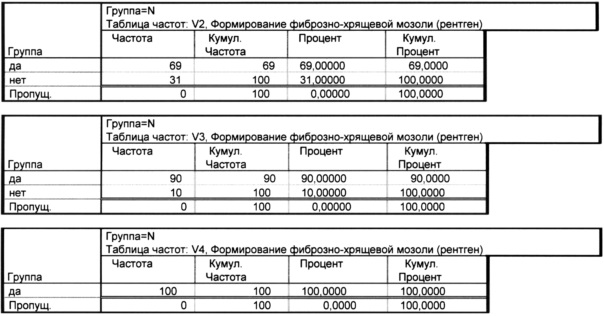
Как показано в таблице 1.2 на визите 1 ни у одного пациента в контрольной группе не сформировалась фиброзно-хрящевая мозоль, на визите 2 она сформировалась у 69% пациентов, к визиту 3 этот процент составил 90%, а к визиту 4 - 100%.
Показатель скорости формирования мозоли у 69% пациентов составил 14 дней, у 21% - 21 день и у 10% - 28 дней.
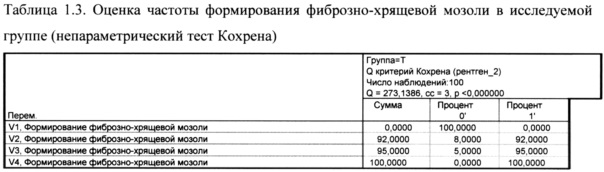
Как показано в таблице 1.3 разница между визитами 3 и 2 по показателю частоты формирования фиброзно-хрящевой мозоли в исследуемой группе составила 3%, а между визитами 4 и 3 - 5%.
Таблица 1.4. Оценка частоты формирования фиброзно-хрящевой мозоли в контрольной группе (непараметрический тест Кохрена)

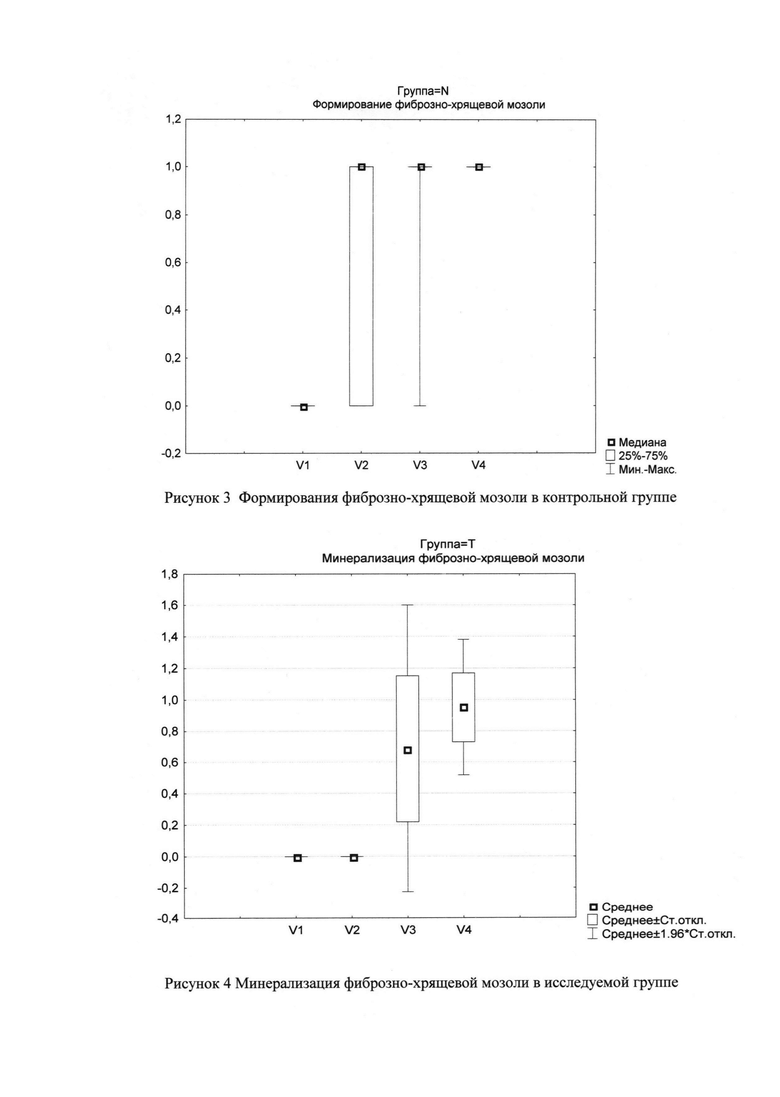
Как показано в таблице 1.4 разница между визитами 3 и 2 по показателю частоты формирования фиброзно-хрящевой мозоли в контрольной группе составила 21%, а между визитами 4 и 3 - 10%. (Рис. 2)
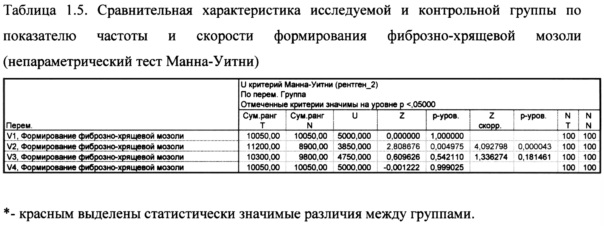
Как показано в таблице 1.5. на визите 2 и визите 3 были выявлены статистически значимые различия (при p=0,005) между исследуемой контрольной группой по показателю частоты и скорости формирования фиброзно-хрящевой мозоли. (Рис. 3)
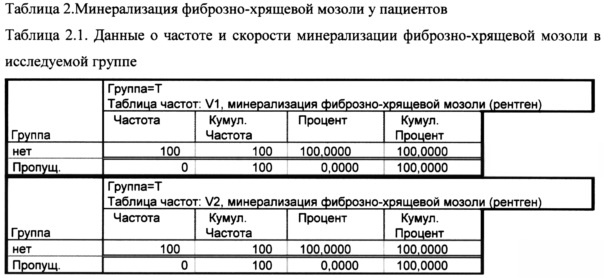
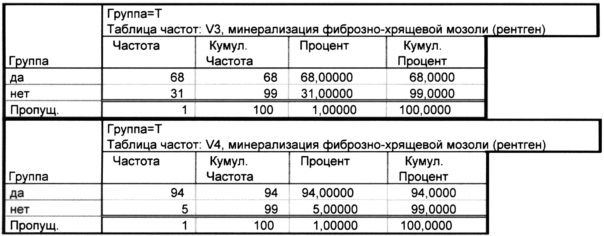
Как показано в таблице 2.1. на визите 1 и 2 ни у одного пациента в исследуемой группе не наблюдалось минерализация фиброзно-хрящевой мозоли, к визиту 3 этот процесс начался у 68% пациентов, а к визиту 4 - 94%.
Время начала минерализации фиброзно-хрящевой мозоли (скорость минерализации) в исследуемой группе у 68% - 21 день и у 26% - 28 дней.
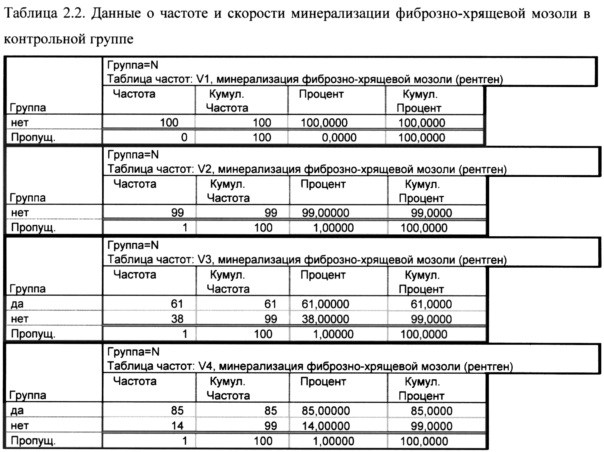
Как показано в таблице 2.2. на визите 1 и 2 ни у одного пациента в контрольной группе не наблюдалось минерализации фиброзно-хрящевой мозоли, к визиту 3 этот начался у 61% пациентов, а к визиту 4 - у 85%.
Время начала минерализации фиброзно-хрящевой мозоли (скорость минерализации) в контрольной группе составила у 61% - 21 день и у 24% - 28 дней.
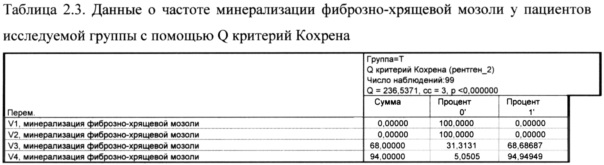
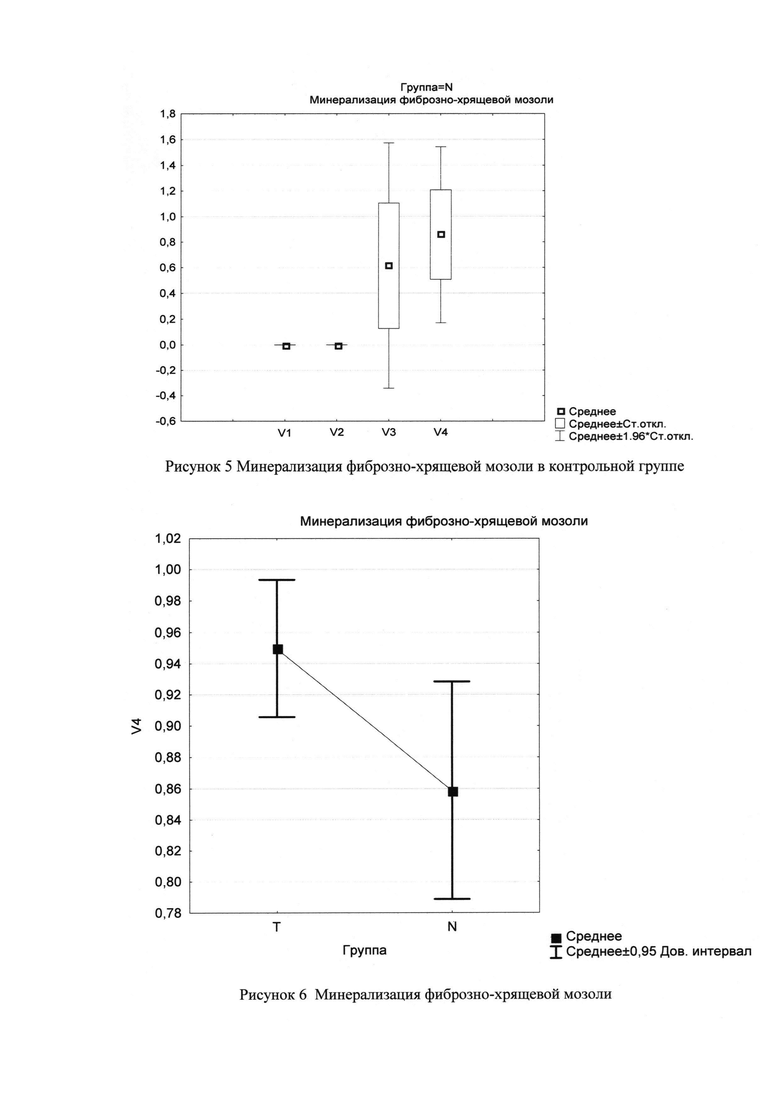
Как показано в таблице 2.3. разница между визитами 4 и 3 по показателю частоты начала минерализации фиброзно-хрящевой мозоли в исследуемой группе составила 26% (рис. 4).
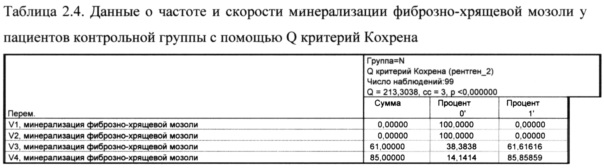
Как показано в таблице 2.4. разница между визитами 4 и 3 по показателю частоты начала и скорости минерализации фиброзно-хрящевой мозоли в контрольной группе составила 24%. (рис. 5)
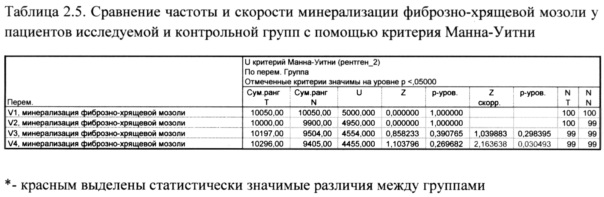
Как показано в таблице 2.5. были установлены значимые различия (p=0,003) между исследуемой и контрольной группой по показателю частоты и скорости минерализации фиброзно-хрящевой мозоли (рис. 6).

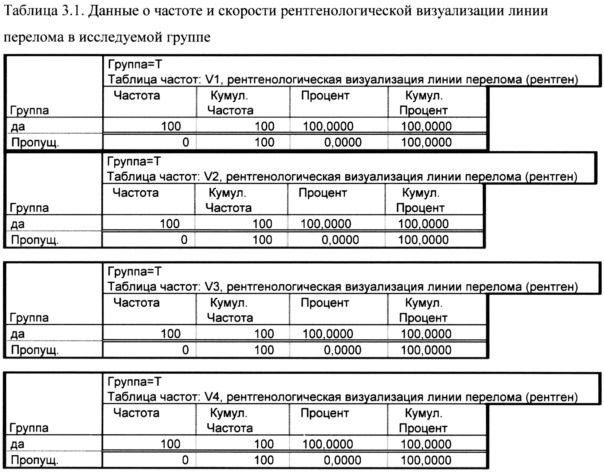
У всех пациентов исследуемой группы до конца исследования линия перелом визуализировалась.
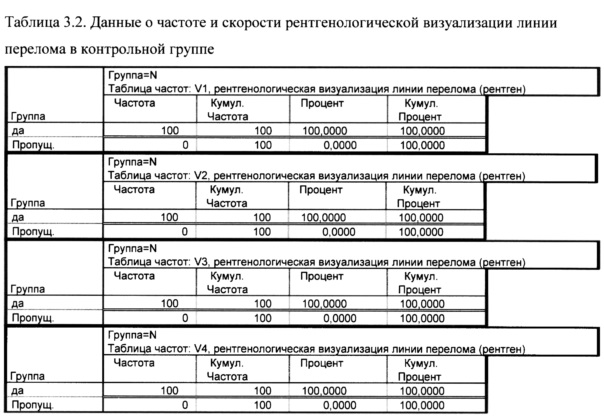
У всех пациентов контрольной группы линия перелома визуализировалась до конца исследования.
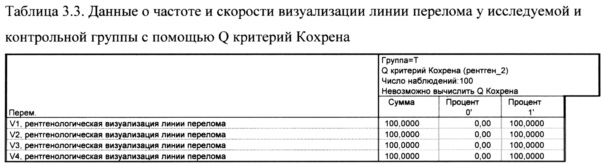
Статистически значимых различий между значением, зарегистрированным на 1 визите и значениями, установленными на последующих 2, 3 и 4 визитах, не установлено

Статистически значимых различий между значением, зарегистрированным на 1 визите и значениями, установленными на последующих 2, 3 и 4 визитах, не установлено.
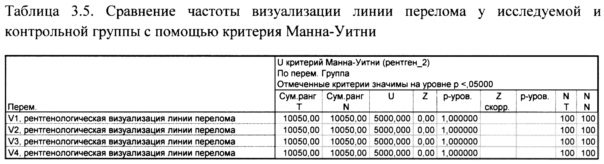
По частоте рентгенологической визуализации линии перелома и скорости исчезновения линии перелома, при сравнении пациентов исследуемой и контрольной группы значимых различий не установлено.
На основании приведенных данных сделаны следующие выводы:
1. По показателю частоты формирования фиброзно-хрящевой мозоли на визите 1 ни у одного пациента в исследуемой и контрольной группах не произошло формирования данной структуры, на визите 2 она сформировалась у 92% пациентов в исследуемой группе, к визиту 3 этот процент составил 95%, а к визиту 4 - 100%. В контрольной группе этот показатель составил 69% к визиту 2, к визиту 3 - 90%, а к визиту 4 - 100%. Разница между визитами 3 и 2 по показателю частоты формирования фиброзно-хрящевой мозоли в исследуемой группе составила 3% (в контрольной группе - 21%), а между визитами 4 и 3 - 5% (в контрольной группе - 10%).
2. Скорость формирования мозоли в исследуемой группе у 92% пациентов составила 14 дней, у 3% - 21 день и у 5% - 28 дней. В контрольной группе данный показатель равнялся у 69% пациентов - 14 дней, у 21% - 21 день и у 10% - 28 дней.
3. Были выявлены статистически значимые различия между исследуемой и контрольной группами (при p=0,005) по показателям частоты и скорости формирования фиброзно-хрящевой мозоли.
4. На визите 1 и 2 у всех пациентов в обеих группах минерализации фиброзно-хрящевой мозоли не наблюдалось, к визиту 3 этот процесс начался у 68% пациентов, а к визиту 4 - у 94%. В контрольной группе начало минерализации наблюдалась у 61% пациентов на визите 3, к визиту 4 этот процент составил 85%. Разница между визитами 4 и 3 по показателю частоты начала минерализации фиброзно-хрящевой мозоли в исследуемой группе составила 26%, а в контрольной группе - 24%.
5. Время начала минерализации (скорость минерализации) фиброзно-хрящевой мозоли в исследуемой группе у 68% - 21 день и у 26% - 28 дней (в контрольной группе у 68% - 21 день и у 21% - 28 дней).
6. Были установлены статистически значимые различия (при p=0,003) между исследуемой и контрольной группами по показателям частоты и скорости минерализации фиброзно-хрящевой мозоли на четвертом визите.
7. У всех пациентов в исследуемой и контрольной группе визуально отмечаемая линия перелома наблюдалась на всех визитах до конца исследования.
Таким образом, проведенный анализ может свидетельствовать об эффективности препарата хондроитина сульфата при лечении пациентов с закрытыми переломами, как лучевой кости, так и других видов переломов по предложенной методике.
Препарат, используемый в соответствии с изобретением, может быть выполнен в форме раствора, готового к употреблению или лиофилизата для приготовления раствора для внутримышечного введения, каждый из которых содержит 100 мг хондроитин сульфата.
Важным условием является как можно более раннее назначение курса введения хондроитина сульфата - в максимально короткий срок с момента получения повреждения. Самым оптимальным является обеспечение введения препарата сразу в день получения травмы или на следующий день. Однако в случае невозможности этого (отсутствие в данный момент препарата, нахождение пациента вне быстрой досягаемости лечебных учреждений и т.п.), введение хондроитина сульфата может быть начато и в любой из следующих дней (3-ий, 4-ый, 5-ый и т.д.). Естественно, следует понимать, что чем позже будет начато введение препарата, тем позднее произойдет начало формирования фиброзно-хрящевой мозоли и ее последующая минерализация.
В зависимости от типа и сложности перелома курс лечения препаратом хондроитин сульфат может быть увеличен до 25-30 инъекций.
Так же, в зависимости от переносимости пациентом хондроитина сульфата, увеличение дозы до 200 мг может не производиться. В этом случае весь курс проводится с дозировкой 100 мг.
Оптимальной является схема, когда повышение дозы происходит на 4-ой инъекции (7-й день курса - окончание первой недели). Хотя в определенных условиях увеличение дозы может быть произведено и на 3-ей, 5-ой или 6-ой инъекции. Не исключается, что в определенных условиях весь курс может быть осуществлен при дозировке 200 мг.
Введение хондроитина сульфата начиная с первого дня способствует более ранней активации клеток хрящевой ткани. Это в свою очередь позволяет ускорить формирование фиброзно-хрящевой мозоли и обеспечить более ранние сроки начала ее минерализации. Что в итоге способствует более быстрому формированию костной мозоли при переломах и трещинах.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ПЕРЕЛОМОВ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ | 2008 |
|
RU2416411C2 |
| ПРИМЕНЕНИЕ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2024 |
|
RU2840197C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНЕЙ СУСТАВОВ | 2022 |
|
RU2800537C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРЕЛОМОВ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ ПРИ ЙОДОДЕФИЦИТНЫХ ЗАБОЛЕВАНИЯХ | 2008 |
|
RU2421223C2 |
| Средство, обладающее корректирующим действием на метаболизм хрящевой ткани и способ его получения | 2017 |
|
RU2644724C1 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2024 |
|
RU2835423C1 |
| КОМБИНИРОВАННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2024 |
|
RU2827069C1 |
| Способ фармакологической коррекции оксидативных нарушений при переломах на фоне остеопороза в эксперименте хондроитином сульфатом | 2024 |
|
RU2832054C1 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2023 |
|
RU2813891C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ АРТРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ В ЛИОФИЛИЗИРОВАННОЙ ФОРМЕ ДЛЯ ИНЪЕКЦИЙ | 2024 |
|
RU2827073C1 |
Группа изобретений относится к медицине и касается способа лечения повреждений опорно-двигательного аппарата, связанных с нарушением целостности кости, путем стимуляции образования костной мозоли, включающего инъекционное введение хондроитина сульфата внутримышечно. Хондроитин сульфат вводят в дозе от 100 до 200 мг через 1 день, общим курсом 10-14 инъекций, при этом 1-ю инъекцию хондроитина сульфата проводят в максимально короткий срок с момента получения повреждения, преимущественно в день получения повреждения или на следующий день. Причем с 1-й инъекции хондроитина сульфат вводят по 100 мг, а начиная с 3-й, или 4-й, или 5-й, или 6-й инъекции хондроитина сульфат вводят по 200 мг. Группа изобретений также касается применения хондроитина сульфата в количестве 10-14 инъекций по 100-200 мг для ускорения формирования костной мозоли при лечении повреждений опорно-двигательного аппарата, связанных с нарушением целостности кости. Группа изобретений обеспечивает повышение частоты формирования костной мозоли и увеличение скорости формирования костной мозоли за счет ускорения появления фиброзно-хрящевой мозоли и ее минерализации. 2 н. и 1 з.п. ф-лы, 6 ил., 15 табл., 1 пр.
1. Способ лечения повреждений опорно-двигательного аппарата, связанных с нарушением целостности кости, путем стимуляции образования костной мозоли, включающий инъекционное введение хондроитина сульфата внутримышечно, отличающийся тем, что хондроитина сульфат вводят в дозе от 100 до 200 мг через 1 день, общим курсом 10-14 инъекций, при этом 1-ю инъекцию хондроитина сульфата проводят в максимально короткий срок с момента получения повреждения, преимущественно в день получения повреждения или на следующий день, причем с 1-й инъекции хондроитина сульфат вводят по 100 мг, а начиная с 3-й, или 4-й, или 5-й, или 6-й инъекции хондроитина сульфат вводят по 200 мг.
2. Способ по п. 1 отличающийся тем, что в качестве повреждения опорно-двигательного аппарата, связанного с нарушением целостности кости, выбирают закрытый перелом лучевой кости.
3. Применение хондроитина сульфата в количестве 10-14 инъекций по 100-200 мг для ускорения формирования костной мозоли при лечении повреждений опорно-двигательного аппарата, связанных с нарушением целостности кости.
Авторы
Даты
2018-09-19—Публикация
2014-08-06—Подача