Изобретение относится к области органической химии, а именно к способу получения новых индивидуальных соединений класса 1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-диона, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии.
Известны структурные аналоги заявленных соединений – алкил 3-арил-1,5-диоксо-2,3,5,6-тетрагидро-1H-пиримидо[1,6-a]хиноксалин-4-карбоксилаты, получаемые из алкил 3-оксо-1,2,3,4-тетрагидрохиноксалин-2-илиденацетатов и α-хлорбензилизоцианатов, путем кипячения реагентов в дихлорметане в течение 3 ч (Кушнир О.В., Вовк М.В., ЖОрХ, 2010, Т. 46, Вып. 6, с. 894–897). Синтез структурных аналогов осуществляется по следующей схеме:
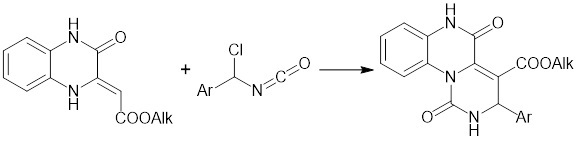
К недостаткам данного способа относится невозможность получения 1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дионов и использование растворителя для проведения реакции.
Задачей изобретения является разработка простого способа синтеза неописанных в литературе 1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дионов без использования растворителя для проведения реакции.
Поставленная задача осуществляется путем нагревания смеси 3-ароил-5-фенилпирроло[1,2-а]хиноксалин-1,2,4(5H)-трионов с основаниями Шиффа до 190–200°C по следующей схеме:
 ,
,
где
I: Ar = Ph (а), C6H4OMe-4 (б);
II: R1 = Bn, R2 = C6H4Br-4 (а); R1 = R2 = Ph (б);
III: Ar = Ph, R1 = Bn, R2 = C6H4Br-4 (а); Ar = C6H4OMe-4, R1 = R2 = Ph (б); Ar = C6H4OMe-4, R1 = Bn, R2 = C6H4Br-4 (в).
Процесс ведут при температуре 190–200°С, без использования растворителя.
Из патентной и технической литературы не были выявлены способы получения 1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дионов, имеющие сходные признаки с заявленным способом, а именно, не использовались исходные продукты, реакция не проводилась без использования растворителя, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. 2-Бензил-4-бензоил-1-(4-бромфенил)-6-фенил-1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дион (IIIа).
Тонко измельченную смесь 1.0 ммоль 3-бензоил-5-фенилпирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Iа) и 1.5 ммоль N-бензил-1-(4-бромфенил)метанимина (IIа) нагревали при 195°С в течение 3 мин (до прекращения выделения CO), охлаждали, перекристаллизовывали из толуола. Выход 71%, т.пл. 175–177°С (разл., толуол). Соединение (IIIа) C37H26BrN3O3.
Найдено, %: C 69.46; H 4.19; N 6.36.
Вычислено, %: C 69.38; H 4.09; N 6.56.
Соединение (IIIа) – желтое кристаллическое вещество, плавящееся с разложением, легкорастворимое в ДМСО и ДМФА, труднорастворимое в обычных органических растворителях, нерастворимое в алканах и воде. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIа), записанного в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний бензоильной карбонильной группы при 1666 см-1, двух лактамных карбонильных групп при 1674 см-1.
В спектре ЯМР 1Н соединения (IIIа), записанного в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют дублеты бензильных протонов при 4.51 м.д. (1H, J 15.1 Гц) и 5.31 м.д. (1H, J 14.1 Гц), уширенный синглет метинового протона CH при 7.72 м.д.
Пример 2. 4-(4-Метоксибензоил)-1,2,6-трифенил-1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дион (IIIб).
Тонко измельченную смесь 1.0 ммоль 3-(4-метоксибензоил)-5-фенилпирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Iб) и 1.5 ммоль бензальанилина (IIб) нагревали при 195°С в течение 3 мин (до прекращения выделения CO), охлаждали, перекристаллизовывали из толуола. Выход 70%, т.пл. 225–227°С (разл., толуол). Соединение (IIIб) C37H27N3O4.
Найдено, %: C 76.99, H 4.65, N 7.33.
Вычислено, %: C 76.93, H 4.71, N 7.27.
Соединение (IIIб) – желтое кристаллическое вещество, плавящееся с разложением, легкорастворимое в ДМСО и ДМФА, труднорастворимое в обычных органических растворителях, нерастворимое в алканах и воде. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIб), записанного в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний ароильной карбонильной группы при 1673 см-1, двух лактамных карбонильных групп при 1679 см-1.
В спектре ЯМР 1Н соединения (IIIб), записанного в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп присутствует уширенный синглет метинового протона CH при 7.87 м.д.
Пример 3. 2-Бензил-1-(4-бромфенил)-4-(4-метоксибензоил)-6-фенил-1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дион (IIIв).
Тонко измельченную смесь 1.0 ммоль 3-(4-метоксибензоил)-5-фенилпирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Iб) и 1.5 ммоль N-бензил-1-(4-бромфенил)метанимина (IIа) нагревали при 195°С в течение 3 мин (до прекращения выделения CO), охлаждали, перекристаллизовывали из толуола. Выход 75%, т.пл. 243–245°С (разл., толуол). Соединение (IIIв) C38H28BrN3O4.
Найдено, %: C 68.09; H 4.35; N 6.32.
Вычислено, %: C 68.06; H 4.21; N 6.27.
Соединение (IIIв) – желтое кристаллическое вещество, плавящееся с разложением, легкорастворимое в ДМСО и ДМФА, труднорастворимое в обычных органических растворителях, нерастворимое в алканах и воде. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIIв), записанного в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний ароильной карбонильной группы при 1660 см-1, двух лактамных карбонильных групп при 1671 см-1.
В спектре ЯМР 1Н соединения (IIIв), записанного в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец и связанных с ними групп присутствуют уширенные синглеты бензильных протонов при 4.52 и 5.25 м.д., уширенный синглет метинового протона CH при 7.72 м.д.
Пример 4. Фармакологическое исследование 1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дионов (IIIа-в) на наличие антигипоксической активности.
Антигипоксическая активность изучалась на модели гемической, а также на модели нормобарической гипоксии с гиперкапнией [Хабриев Р.У., Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ/ Р.У.Хабриев – М., 2000 – 155с.].
Антигипоксическое действие веществ (IIIа-в) исследовали на белых беспородных мышах-самцах массой 19–22 г.
Острую гемическую гипоксию вызывали внутрибрюшинным введением метгемоглобинообразователя – нитрата натрия в дозе 100 мкг/кг. Исследуемые соединения и эталон сравнения в дозе 50 мг/кг вводили внутрибрюшинно в виде суспензии с изотоническим раствором хлорида натрия за 30 мин до начала эксперимента. В качестве эталона сравнения использовали лекарственный препарат Гутимин в дозе 100 мг/кг. Результаты исследования приведены в таблице 1.
Острую гипоксию с гиперкапнией, вызывали помещением каждой мыши в герметичную емкость из прозрачного стекла объемом 250 мл, определяли время положения мышей «на бок». За 1 ч до помещения в гермообъем животным вводили однократно внутрибрюшинно исследуемые химические вещества в дозе 50 мг/кг в виде суспензии с эквиобъемным количеством 2% крахмальной слизи. Животным контрольной группы в тот же срок и тем же путем вводили равный объем растворителя. Результаты исследования приведены в таблице 2.
Антигипоксическую активность сравнивали с известным антигипоксантом – 2-этил-6-метил-3-гидроксипиридина сукцинатом (раствор для инъекций «Мексидол»), в дозе 50 мг/кг за 30 мин до начала эксперимента.
Антигипоксический эффект определялся по продолжительности жизни мышей в эксперименте в сравнении с контролем [Лукьянова Л.Д. Методические рекомендации по изучению препаратов, предлагаемых для изучения в качестве антигипоксических средств/ Л.Д.Лукьянова// М. 1990 – с.10; Лукьянова Л.Д. Новые подходы к созданию антигипоксантов метаболического действия / Л.Д.Лукьянова// Вестник РАМН – 1999 – №3 – с. 18-25].
Статистическую обработку цифровых данных проводили с помощью пакета стандартных программ STATISTICA for Windows 6.0. Для оценки достоверности различий сравниваемых величин использовали t-критерий Стьюдента [Беленький М.Л. Элементы клинической оценки фармакологического эффекта. 2-е изд. - Л., 1963 – с.152]. Эффект считали достоверным при p<0,05.
Таблица 1. Результаты исследования антигипоксического действия соединений (IIIа-в) на модели гемической гипоксии.

Таблица 2. Результаты исследования антигипоксического действия соединений (IIIа,в) на модели нормобарической гипоксии с гиперкапнией.

В результате фармакологического исследования выявлено, что соединения (IIIа,в) достоверно проявляют антигипоксический эффект.
Изобретение относится к новому способу получения новых 1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дионов формулы IIIa-в. Соединения обладают антигипоксической активностью и могут быть использованы для получения антигипоксантов метаболического действия. Способ заключается в том, что тонко измельченную смесь 3-ароил-5-фенилпирроло[1,2-а]хиноксалин-1,2,4(5H)-трионов с основаниями Шиффа нагревают до 190–200°C (до прекращения выделения СО), с последующим выделением целевых продуктов. Реакцию осуществляют по следующей схеме:
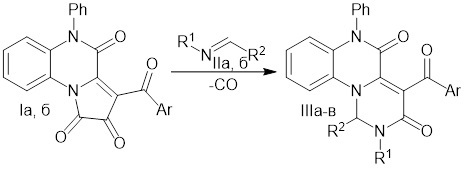
В формулах Iа,б, IIa,б и IIIa-в заместители Ar, R1, R2 имеют следующие значения (I): Ar = Ph (а), C6H4OMe-4 (б); (II): R1 = Bn, R2 = C6H4Br-4 (а); R1 = R2 = Ph (б); (III): Ar = Ph, R1 = Bn, R2 = C6H4Br-4 (а); Ar = C6H4OMe-4, R1 = R2 = Ph (б); Ar = C6H4OMe-4, R1 = Bn, R2 = C6H4Br-4 (в). 2 табл., 4 пр.
Способ получения 1,2-дигидро-3H-пиримидо[1,6-a]хиноксалин-3,5(6H)-дионов, заключающийся в том, что тонко измельченную смесь 3-ароил-5-фенилпирроло[1,2-а]хиноксалин-1,2,4(5H)-трионов с основаниями Шиффа нагревают до 190–200°C (до прекращения выделения СО) со схеме
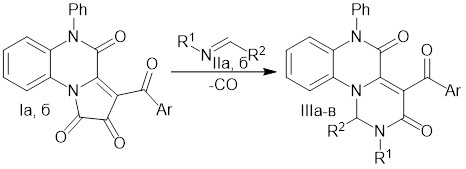 ,
,
где
I: Ar = Ph (а), C6H4OMe-4 (б);
II: R1 = Bn, R2 = C6H4Br-4 (а); R1 = R2 = Ph (б);
III: Ar = Ph, R1 = Bn, R2 = C6H4Br-4 (а); Ar = C6H4OMe-4, R1 = R2 = Ph (б); Ar = C6H4OMe-4, R1 = Bn, R2 = C6H4Br-4 (в), с последующим выделением целевых продуктов.
| Разрядник для защиты маслонаполненных машин и аппаратов | 1934 |
|
SU45349A1 |
| Масливец и др | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| РАДИОПРИЕМНИК - ВОЛНОМЕР | 1923 |
|
SU563A1 |
| МЕТИЛ 3-МЕТИЛ-5-[2-(4-АРИЛАМИНО)-2-ОКСОАЦЕТИЛ]-1,6-ДИФЕНИЛ-1Н-ПИРАЗОЛО[3,4-b]ПИРИДИН-4-КАРБОКСИЛАТЫ И МЕТИЛ 3-МЕТИЛ-5-[2-(4-АРИЛАМИНО)-2-ОКСОАЦЕТИЛ]-6-СТИРИЛ-1-ФЕНИЛ-1Н-ПИРАЗОЛО[3,4-b]ПИРИДИН-4-КАРБОКСИЛАТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2495039C1 |
| Кушнир О.В и др | |||
| Гетероциклизация функционализированных гетерокумуленов С-, С,N-, C,O- и C,S-нуклеофилами | |||
| XII’ | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Журнал органической химии, 2010, т.46, вып.6, стр.894-897. | |||
Авторы
Даты
2019-01-10—Публикация
2018-03-29—Подача