Изобретение относится к области медицины, а именно к противогепатитным средствам, и может быть использовано для лечения и профилактики заболеваний печени.
Токсические поражения печени являются одной из актуальных проблем современной медицины, что обусловлено, в первую очередь, лавинообразным ростом числа новых лекарственных препаратов, внедряемых в клиническую практику, широким и часто бесконтрольным использованием биологически активных добавок и средств нетрадиционной медицины.
Одним из ключевых факторов развития различных патологических состояний, включая токсический гепатит (ТГ), является окислительный стресс (ОС) [Vrba J. Oxidative burst of Kupffer cells: target for liver injury treatment / J. Vrba, M. Modriansky // Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. - 2002. - V. 146, №2. - P. 15-20]. Повреждение печени, как правило, включает совокупность процессов апоптоза, некроза, воспаления, иммунного ответа, фиброза, ишемии, изменения экспрессии генов и регенерации, с вовлечением гепатоцитов, звездчатых, эндотелиальных клеток и клеток Купфера [Loguercio С. Oxidative stress in viral and alcoholic hepatitis / C. Loguercio, A. Federico // Free Radic Biol Med. - 2003. - V. 34, №1. - P. 1-10; Stehbens W.E. Oxidative stress in viral hepatitis and AIDS / W.E. Stehbens // Exp Mol Pathol. - 2004. - V. 77, №2. - P. 121-32]. Тяжелый ОС при этом приводит к некрозу гепатоцитов, тогда как менее выраженный - к апоптозу.
В настоящее время остается высокой потребность в гепатопротекторных средствах, повышающих резистентность печени к действию химических агентов и нормализующих ее метаболизм в условиях напряжения детоксицирующей функции.
Имеются литературные данные о клиническом и экспериментальном применении гепатопротекторных средств, обладающих антиоксидантной активностью при нарушениях функции печени [Новиков В.Е. Фармакология гепатопротекторов / В.Е. Новиков, Е.И. Климкина // Обзоры по клинической фармакологии и лекарственной терапии. - 2005. - Т. 4, №1. - С. 2-20; Венгеровский А.И. Фармакологические подходы к регуляции функции печени / А.И. Венгеровский // Бюллетень сибирской медицины. - 2002. - №1. - С. 25-29; Матвеев А.В. Гепатопротекторы. Анализ международных исследований по препаратам группы лекарств для печени - Симферополь: ИТ «АРИАЛ», 2013. - 384 с; Макеева А.В. Действие тиоктовой кислоты на функционирование антиоксидантной глутатионзависимой системы при токсическом гепатите у крыс / А.В. Макеева, Т.Н. Попова, Л.В. Матасова // Биомедицинская химия. - 2007. - Т. 53, вып. 2. - С. 181-189; Гепатопротекторы в клинической практике. Алгоритм выбора / Е.И. Бусалаева, Л.В. Тарасова, Т.С.Матвеева // Здравоохранение Чувашии. - 2015. - №2. - С. 56-64]. Известно, что фосфолипидные препараты, обладающие способностью восполнять дефицит фосфолипидов клеточной мембраны и снижать активность пероксидного окисления липидов, при острых и хронических вирусных гепатитах могут способствовать усилению холестатического синдрома и увеличению цитолиза гепатоцитов. Адеметионин, производное метионина и аденозина, обладает антиоксидантным и детоксицирующим эффектами, однако результаты исследований по его клинической эффективности в настоящее время являются отрывочными и спорными. Ряд препаратов растительного происхождения, в частности Лив-52, способен оказывать антитоксический эффект и стимулировать регенерацию клеток печени. Вместе с тем, имеются данные, свидетельствующие о возможности усугубления выраженности цитолитического и мезенхимально-воспалительного синдромов на фоне приема данного препарата при острой патологии печени. Известно использование синтетического гепатопротектора тиотриазолина из группы тиазола, обладающего антиоксидантным действием, в составе лекарственного средства комбинированного действия [патент РФ 2597785, МПК A61K 31/198, A61K 31/41, А61Р 9/00, опубл. 20.09.2016]. Его эффективность была показана при лечении больных с хроническим гепатитом [Харченко, Н.В. Современные гепатопротекторы в комплексном лечении больных хроническим гепатитом / Н.В. Харченко, Т.В. Бородина // Провизор. - 1999. - Вып. 5. - URL: http://www.provisor.com.ua/]. Вместе с тем, применение данного средства может вызывать гипертермическую реакцию, лихорадку, кожные высыпания [Ушкалова Е.А. Проблемы применения гепатопротекторов / Е.А. Ушкалова // Фарматека. - 2004. - №4. - С. 45-55].
На рынке среди гепатопротекторов основную долю занимают препараты, содержащие естественные или полусинтетические флавоноиды расторопши пятнистой (Silybum marianum). В настоящее время в России широко применяется гепатопротектор Карсил (®Sopharma, Болгария), который был выбран для проведения исследований в качестве прототипа. Главным действующим компонентом Карсила® является силимарин, представляющий собой смесь четырех основных изомерных соединений - силикристина, силидианина, силибинина и изосилибина. Известно также гепатопротекторное средство по патенту РФ 2205637 (МПК A61K 31/357, A61K 35/78, A61K 9/20, А61Р 1/00, опубл. 10.06.2003), содержащее в качестве активного вещества силимарин в количестве 10-20% от массы ядра таблетки и целевые добавки. Клинические исследования показали, что применение силимарина с потенциально гепатотоксичными лекарствами уменьшает или предотвращает нежелательные эффекты последних. Рациональность такой комбинации связана с антиоксидантной активностью и антиапоптотическим действием силимарина. Положительное воздействие силимарина при лекарственных поражениях печени традиционно связывают с выраженным антиоксидантным потенциалом, а также с мембраностабилизирующим действием. Антиоксидантный эффект силимарина обусловлен его взаимодействием со свободными радикалами в печени и превращением их в менее агрессивные соединения, тем самым прерывается процесс перекисного окисления липидов и не происходит дальнейшего разрушения клеточных структур. Силимарин выявляет метаболические и клеточно-регулирующие эффекты, контролируя проницаемость клеточной мембраны, подавляя 5-липооксигеназный путь, особенно лейкотриена В4, а также связываясь с активными формами кислорода (АФК).
Однако прием карсила может сопровождаться рядом нежелательных побочных эффектов, таких как диарея, рвота, дезориентация в пространстве. Кроме того, для достижения значимого эффекта, как правило, назначают достаточно длительные курсы приема препарата (до трех месяцев). Таким образом, интерес представляют исследования, направленные на поиск новых веществ - аналогов имеющихся лекарственных средств.
Помимо этого, имеются сведения о наличии гепатопротекторных свойств у сантохина - 6-этокси-2,2,4-триметил-1,2-дигидрохинолина. Так, известен способ профилактики патологии печени у свиней с помощью средства на основе антиоксиданта сантохина и неочищенной морской соли, которые вводят в дозах 250 г и 50 кг на тонну комбикорма [RU 2483695 С1 10.06.2013]. Существуют также данные о применении этоксихина в качестве протектора для защиты печени от канцерогенеза [Cha Y.N. Comparative effects of dietary administration of antioxidants and inducers on the activities of several hepatic enzymes in mice / Y.N. Cha, H.S. Heine, S. Ansher // Drug Nutr Interact. - 1983. - V. 2, N 1. - P. 35-45; Metabolic basis for the protective effect of the antioxidant ethoxyquin on anatoxin B1 hepatocarcinogenesis in the rat // H.G. Mandel [et al.] // Cancer Res. - 1987. - V. 47, N 19. - P. 5218-5223] и токсического действия амброзии трехнадрезной [Protective effects of antioxidants on bitterweed (Hymenoxys odorata DC) toxicity in sheep / H.L. Kim [et al.] // Am J Vet Res. - 1982. - V. 43, N 11. - P. 1945-1950]. Наряду с этим, имеются сведения о токсических и прооксидантных свойствах этоксихина. Так, у собак, получавших с пищей данное соединение, наблюдались такие симптомы, как печеночная, почечная, щитовидная и репродуктивная дисфункция, тератогенные и канцерогенные эффекты, аллергические реакции, нарушения кожных и волосяных покровов [Dzanis D.A. Safety of ethoxyquin in dog foods / D.A. Dzanis // J Nutr. - 1991. - V. 121 (11 Suppl). - P. 163-164]. Негативные эффекты этоксихина наблюдались также при проведении экспериментов на уровне метаболизма клеток. Было проанализировано влияние сантохина на метаболические пути крысиных почечных и печеночных клеток, а также на митохондрии и субмитохондриальные частицы, полученные из бычьего сердца и почек. Показано, что этоксихин ингибировал почечную активность Na+, K+-АТФазы, связанную с переносом ионов. Авторы предположили, что этоксихин взаимодействует с комплексом I митохондриальной дыхательной цепи, что приводит к ингибированию потребления кислорода в митохондриях почек и клеток печени при использовании глюкозы в качестве энергетического субстрата [Inhibition of the renal uptake of p-aminohippurate and tetraethylammonium by the antioxidant ethoxyquin in the rat / M.E. Hernández [et al.] // Food Chem Toxicol. - 1993. - V. 31, N 5. - P. 363-367; Inhibitory effect of the antioxidant ethoxyquin on electron transport in the mitochondrial respiratory chain / J.L. Reyes [et al.] // Biochem Pharmacol. - 1995. - V. 49, N 3. - P. 283-289]. Существуют определенные сведения о наличии у этоксихина способности усиливать мутагенные свойства других соединений [Effect of micronutrients, antioxidants and related compounds on the mutagenicity of 3,2'-dimethyl-4-aminobiphenyl, a colon and breast carcinogen / B.S. Reddy [et al.] // Food Chem Toxicol. - 1983. - V. 21, N 2.=P. 129-132]. Этоксихин вызывал также повреждение ДНК, выявленное путем кометного анализа [ A. DNA damage induced by ethoxyquin in human peripheral lymphocytes / A.
A. DNA damage induced by ethoxyquin in human peripheral lymphocytes / A.  // Toxicol Lett. - 2006. - V. 163, N 1. - P. 77-83], однако большинство повреждений могли быть восстановлены с помощью систем репарации клеточной ДНК [Modulation of ethoxyquin genotoxicity by free radical scavengers and DNA damage repair in human lymphocytes / J.J. Skolimowski [et al.] // Toxicol Lett. - 2010. - V. 193, N 2. - P. 194-199]. С другой стороны, результаты, полученные с использованием теста на аберрацию хромосом, показали, что повреждение ДНК без восстановления, вызванное этоксихином, может привести к постоянным изменениям в генетическом материале. Показано, что это вещество индуцирует хромосомные аберрации, такие как разрывы, дицентризм, атипичность транслоцированных хромосом или хроматидные обмены в лимфоцитах человека и клетках яичника китайского хомяка [Blaszczyk A. Induction of chromosome aberrations in cultured human lymphocytes treated with ethoxyquin / A. Blaszczyk, R. Osiecka, J. Skolimowski // Mutat Res. - 2003. - V. 542 (1-2). - P. 117-128; Effect of antioxidants on hyperoxia-induced chromosomal breakage in Chinese hamster ovary cells: protection by carnosine / J.J. Gille [et al.] // Mutagenesis. - 1991. - V. 6, N 4. - P. 313-318]. Известно, что эти аберрации имеют серьезные биологические последствия [Rabbitts Т.Н. Chromosomal translocations in human cancer / Т.Н. Rabbitts // Nature. - 1994. - V. 372, N 6502. - P. 143-149].
// Toxicol Lett. - 2006. - V. 163, N 1. - P. 77-83], однако большинство повреждений могли быть восстановлены с помощью систем репарации клеточной ДНК [Modulation of ethoxyquin genotoxicity by free radical scavengers and DNA damage repair in human lymphocytes / J.J. Skolimowski [et al.] // Toxicol Lett. - 2010. - V. 193, N 2. - P. 194-199]. С другой стороны, результаты, полученные с использованием теста на аберрацию хромосом, показали, что повреждение ДНК без восстановления, вызванное этоксихином, может привести к постоянным изменениям в генетическом материале. Показано, что это вещество индуцирует хромосомные аберрации, такие как разрывы, дицентризм, атипичность транслоцированных хромосом или хроматидные обмены в лимфоцитах человека и клетках яичника китайского хомяка [Blaszczyk A. Induction of chromosome aberrations in cultured human lymphocytes treated with ethoxyquin / A. Blaszczyk, R. Osiecka, J. Skolimowski // Mutat Res. - 2003. - V. 542 (1-2). - P. 117-128; Effect of antioxidants on hyperoxia-induced chromosomal breakage in Chinese hamster ovary cells: protection by carnosine / J.J. Gille [et al.] // Mutagenesis. - 1991. - V. 6, N 4. - P. 313-318]. Известно, что эти аберрации имеют серьезные биологические последствия [Rabbitts Т.Н. Chromosomal translocations in human cancer / Т.Н. Rabbitts // Nature. - 1994. - V. 372, N 6502. - P. 143-149].
Технический результат заключается в расширении ассортимента гепатопротекторов за счет нового более активного средства.
Технический результат достигается применением в качестве гепатопротекторного средства 6-гидрокси-2,2,4-триметил-1,2-дигидрохинолина общей формулы I:
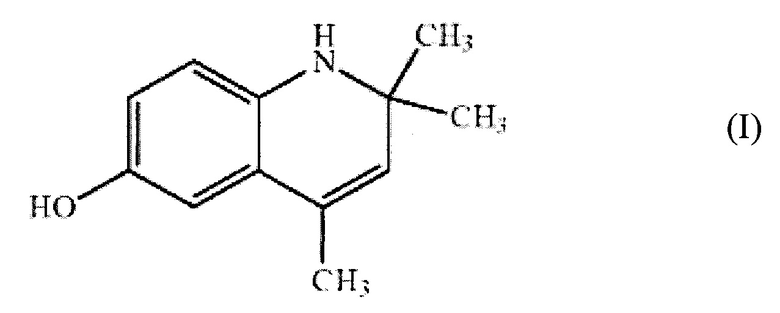
Соединение I известно из патента US 20140303203 (МПК C07D 215/20, C12Q 1/34, C07D 215/48, G01N 33/50, опубл. 09.10.2014) как обладающее способностью предотвращать нервную дегенерацию при периферических невропатиях и других нейродегенеративных заболеваниях, включая вызванную химиотерапией периферическую невропатию.
Известно, что в ряду производных хинолина имеются вещества с антиоксидантным свойствами. Так, 2,2,4-триметил-6-этокси-1,2-дигидрохинолин (коммерческие названия Хинол ЭД, Антиоксидант ES) и поли-2,2,4-триметил-1,2-дигидрохинолин (Ацетонанил Н) применяются как антиоксиданты для стабилизации каучуков и сшитого полиэтилена. 2,2,4-триметил-6-этокси-1,2-дигидрохинолин под названиями Этоксихин и Сантохин применяется в качестве пищевой добавки-антиоксиданта Е324, в частности, при производстве специй и кормов для животных [Наставление по применению этоксихина (сантохина) в животноводстве и при производстве травяной муки. Департамент ветеринарии, Минсельхозпрод России №13-5-2/1144. ТУ 6-02-1288-84 ИЗМ, 1-5, 07.09.2004]. Препарат дигидроэтоксихин представляет собой гидрированное производное антиоксиданта этоксихина и используется для повышения продуктивности цыплят-бройлеров [Патент РФ №2364246, МПК A23K 1/00, опубл. 20.08. 2009].
Технический результат подтверждают проведенные исследования с выявлением гепатопротекторного действия 6-гидрокси-2,2,4-триметил-1,2-дигидрохинолина.
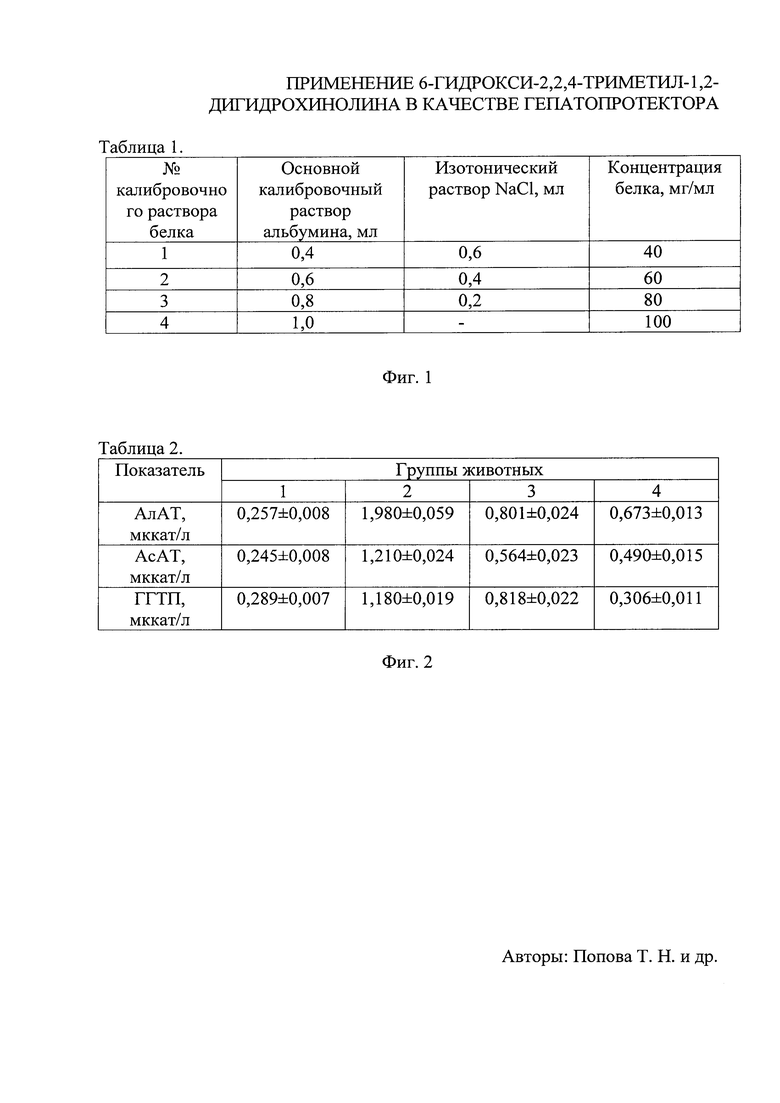
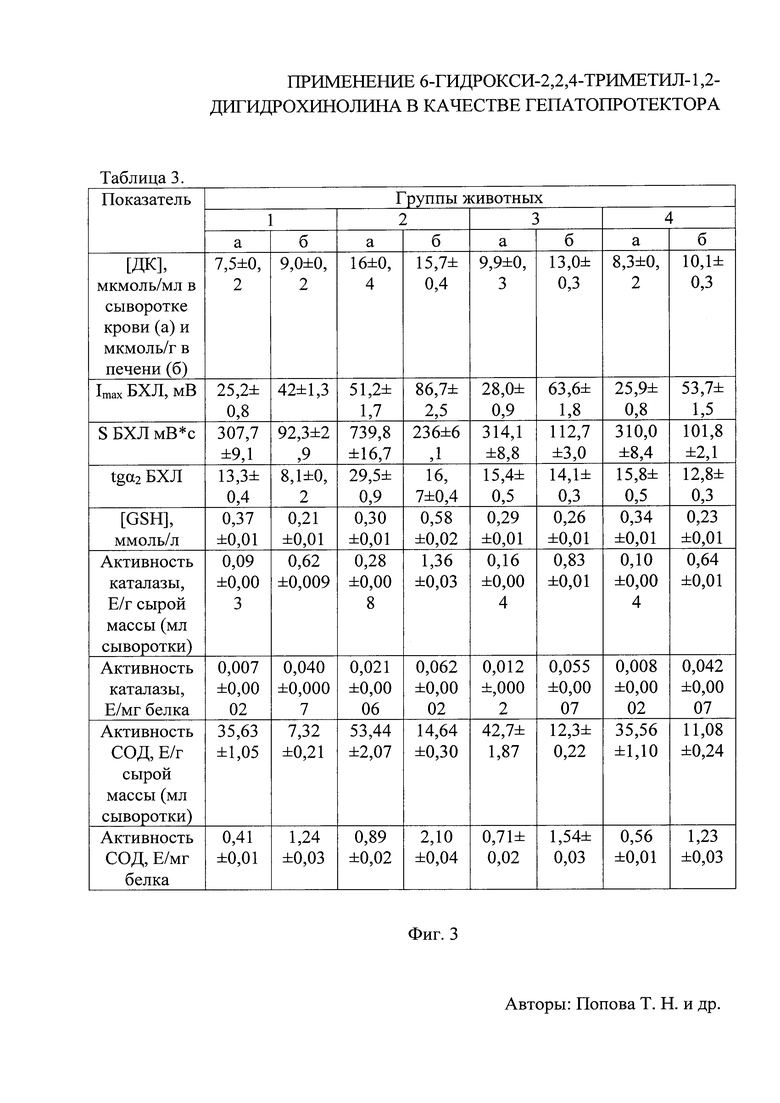
На фиг. 1 приведена Таблица 1 вариантов объемных соотношений (мл) компонентов рабочих калибровочных растворов белка и концентраций белка в них (г/л);
На фиг. 2 приведена Таблица 2 значений маркерных показателей цитолиза клеток печени - активности ферментов (мккат/л), анализируемых в сыворотке крови крыс в норме (1), при развитии ТГ (2), с введением карсила (3) и соединения I (4) на фоне развития патологии;
На фиг. 3 приведена Таблица 3 значений параметров окислительно-восстановительного гомеостаза, анализируемые в сыворотке крови (а) и печени (б) крыс в норме (1), при развитии ТГ без лечения (2), при введении карсила (3) и соединения I (4) на фоне развития патологии.
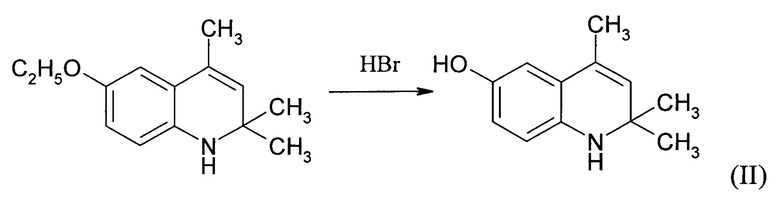
6-окси-2,2,4-триметил-1,2-дигидрохинолин синтезировали дезалкилированием 6-этокси-2,2,4-триметил-1,2-дигидрохинолина (этоксихина) при воздействии бромоводородной кислотой по известной методике [Ю.А. Иванов, Н.Л. Зайченко, С.В. Рыков, О.Я. Гринберг, А.А. Дубинский, С.Д. Пирожков, Е.Г. Розанцев, И.Е. Покровская, А.Б. Шапиро // Синтез окси-, ацило-, оксо-, N-окисей оксо- и морфолиллоксопроизводныхгидрированных хинолинов и изучение их радикальных аналогов методом ЭПР / Изв. АН СССР, Сер. хим. - 1979. - Т. 8 - С. 1800-1807]. Выход 48%. Т пл. 173-174°С, лит. т. пл. 173-175°С.
Ниже приведены результаты испытаний гепатопротекторных свойств соединения I в сравнении с Карсилом ®.
Использованные в эксперименте реактивы: четыреххлористый углерод (CCl4, Вектон, Россия), хлорид натрия (NaCl, Вектон, Россия), трис (Panreac, Испания), соляная кислота (HCl, Вектон, Россия), этилендиаминтетраацетат (ЭДТА, Вектон, Россия), β-меркаптоэтанол (Вектон, Россия), калий фосфорнокислый однозамещенный (Вектон, Россия), калий фосфорнокислый двузамещенный (Вектон, Россия), нитросиний тетразолий (Biomol, Германия), феназинметасульфат (ФМС, AppliChem, Германия), никотинамидадениндинуклеотид восстановленный (НАДН, AppliChem, Германия), пероксид водорода (Н2О2, Вектон, Россия), аммоний молибденовокислый (Вектон, Россия), этанол (Вектон, Россия), 2,4-дитионитробензойная кислота (Sigma Aldrich, США), бычий сывороточный альбумин лиофилизированный. (Sigma Aldrich, США), биуретовый реактив (Ольвекс диагностикум, Россия), сульфат железа (II) (Вектон, Россия), гидроперит (Вектон, Россия), гептан (Вектон, Россия), изопропанол (Вектон, Россия).
В качестве объекта исследования были выбраны самцы белых лабораторных крыс массой 200-250 г, которые содержались на стандартном режиме вивария при 12-часовом световом дне. Исследования проводили в соответствии с требованиями ГОСТ ИСО/МЭК 17025-2009, ГОСТ Р ИСО 5725-2002 и «Правил лабораторной практики», утвержденных приказом Минздравсоцразвития РФ от 23 августа 2010 №708н, с соблюдением «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» [Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes Official Journal L 276, 20.10.2010, p. 33-79 (revising Directive 86/609/EEC).].
В ходе работы было создано четыре экспериментальные группы животных: крысы 1-ой группы (n=8) содержались на стандартном режиме вивария; крысам 2-ой группы (n=8), индуцировали ТГ однократным введением тетрахлорметана (CCl4) в дозе 0,064 мл после суточной пищевой депривации в виде раствора в 1 мл вазелинового масла на 100 г веса животного [Федорова Н.Ю. Состояние системы глутатионпероксидазы-глутатионредуктазы в стимулированном к регенерации органе и ее роль в клеточной пролиферации: дисс. канд. биол. наук. Воронежская государсвтенная медицинская академия им. Н.Н. Бурденко, Воронеж, 1999]; 3-я группа (n=8) - животные, которым после индуцирования ТГ вводили внутрибрюшинно карсил в дозе 50 мг/кг веса животного в виде раствора в 0,9% NaCl ежедневно в течение 3-х дней; крысам 4-й (n=8) группы после индукции патологии вводили внутрибрюшинно соединение I в дозе 50 мг/кг веса животного по вышеуказанной схеме.
Материал для исследования забирали на 3 день после начала эксперимента.
Для получения гомогената навеску печени крысы гомогенизировали в четырехкратном объеме охлажденной среды выделения (0,1М трис-HCl-буфер (pH 7,8), содержащий 1 мМ ЭДТА, 1% β-меркаптоэтанол) и центрифугировали при 5000 g в течение 15 мин. Для получения сыворотки использовали венозную кровь.
Активность ферментов: аланинаминотраснферазы (АлАТ), аспартатаминотрансферазы (АсАТ), γ-глутамилтранспептидазы (ГГТП), оценивали с помощью диагностических наборов фирмы «Витал Девелопмент Корпорэйшн» (Россия) на спектрофотометре Hitachi U1800 (Япония).
Интенсивность процессов свободнорадикального окисления (СО) оценивали с помощью метода железоиндуцированной хемилюминесценции пероксидом водорода, в основе которого лежит каталитическое разложение Н2О2 ионами металла с переходной валентностью (Fe2+) по реакции Фентона: 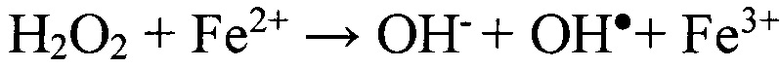 . Образующиеся при этом АФК (
. Образующиеся при этом АФК (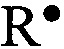 ,
,  ,
,  ,
,  ,
, 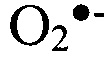 ) инициируют СО в исследуемом биологическом образце. Рекомбинация образовавшихся радикалов
) инициируют СО в исследуемом биологическом образце. Рекомбинация образовавшихся радикалов 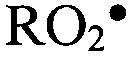 приводит к генерации неустойчивого тетроксида, разложение которого происходит с выделением кванта света. Интенсивность свободнорадикальных процессов анализировали при помощи биохемилюминометра БХЛ-07М. Кинетическую кривую биохемилюминесценции (БХЛ) регистрировали на протяжении 30 секунд (периода наибольшей информации о ее динамике) и оценивали следующие параметры: светосумму хемилюминесценции (S) и интенсивность вспышки (Imax), отражающие интенсивность свободнорадикальных процессов, и величину тангенса угла наклона кривой (tgα2), характеризующую общую антиоксидантную активность [Журавлев А.И. Биохемилюминесценция / А.И. Журавлев. - М.: Наука, 1983. - 298 с; Хемилюминесцентные методы в оценке свободнорадикальных реакций / В.А. Косолапов, О.В. Островский, А.А. Спасов // Клиническая и лабораторная диагностика. - 1999. - Т. 9. - С. 41]. Активность исследуемого процесса зависит от воздействия полного комплекса соединений, обладающих как прооксидантным, так и антиоксидантным эффектом, что дает возможность оценить уровень компенсаторных механизмов свободнорадикального окисления в тканях. Помимо этого, данный метод является высокочувствительным по отношению к патологическим процессам в организме.
приводит к генерации неустойчивого тетроксида, разложение которого происходит с выделением кванта света. Интенсивность свободнорадикальных процессов анализировали при помощи биохемилюминометра БХЛ-07М. Кинетическую кривую биохемилюминесценции (БХЛ) регистрировали на протяжении 30 секунд (периода наибольшей информации о ее динамике) и оценивали следующие параметры: светосумму хемилюминесценции (S) и интенсивность вспышки (Imax), отражающие интенсивность свободнорадикальных процессов, и величину тангенса угла наклона кривой (tgα2), характеризующую общую антиоксидантную активность [Журавлев А.И. Биохемилюминесценция / А.И. Журавлев. - М.: Наука, 1983. - 298 с; Хемилюминесцентные методы в оценке свободнорадикальных реакций / В.А. Косолапов, О.В. Островский, А.А. Спасов // Клиническая и лабораторная диагностика. - 1999. - Т. 9. - С. 41]. Активность исследуемого процесса зависит от воздействия полного комплекса соединений, обладающих как прооксидантным, так и антиоксидантным эффектом, что дает возможность оценить уровень компенсаторных механизмов свободнорадикального окисления в тканях. Помимо этого, данный метод является высокочувствительным по отношению к патологическим процессам в организме.
Для определения интенсивности биохемилюминесценции использовали среду следующего состава: 0,4 мл 0,1М калий-фосфатного буфера (pH 7,5), 0,4 мл 0,01 мМ FeSO4, 0,2 мл 2%-ного раствора Н2О2 (вносимого непосредственно перед измерением). Исследуемый образец вносили в количестве 0,1 мл перед добавлением 2%-ного раствора Н2О2.
Концентрацию диеновых конъюгатов (ДК) определяли спектрофотометрическим методом. Принцип данного метода состоит в том, что в процессе перекисного окисления липидов (ПОЛ) на стадии образования свободных радикалов в молекулах полиненасыщенных жирных кислот образуется система сопряженных двойных связей, ассоциированная с появлением максимума в спектре поглощения при 233 нм [Стальная И.Д. Метод определения диеновой конъюгации ненасыщенных высших жирных кислот / И.Д. Стальная // Современные методы в биохимии / Под ред. В.Н. Ореховича. - М.: Медицина, 1972. - С. 63-64].
К 0,125 мл исследуемого образца приливали 0,125 мл физиологического раствора, затем гептан с изопропиловым спиртом по 1,5 мл. Полученную суспензию помещали в пробирки с плотно закрывающимися пробками и центрифугировали при 3000 g в течение 10 мин. Супернатант переносили в градуированные пробирки и приливали 1/10 объема дистиллированной воды. После встряхивания и расслаивания фаз отбирали в новую пробирку гептановую фазу, к которой приливали по 0,5 мл этиловый спирт в объемном отношении 1:5 - 1:10. В качестве контроля использовали 96% этанол.
Содержание диеновых конъюгатов в гомогенатах тканей (б) рассчитывали по формуле:
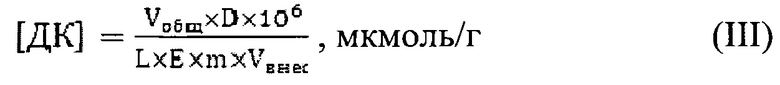
где [ДК] - концентрация диеновых конъюгатов; Vобщ - объем полученного образца, мл; D - величина оптической плотности, ед.; L - длина оптического пути, см; Е - коэффициент молярной экстинкции, равный 2,2*105 M-1c-1; Vвнес - объем вносимой пробы, мл.
В сыворотке (а) содержание ДК определяли по формуле:
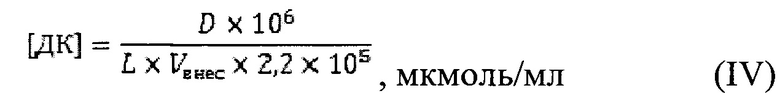
где С - концентрация ДК, мкмоль/мл; D - величина оптической плотности, ед.; L - длина оптического пути, см; 2,2*105 - коэффициент молярной экстинкции, M-1с-1; Vвнес - объем вносимой пробы, мл.
Анализ активности супероксиддисмутазы (СОД) осуществляли спектрофотометрически при длине волны 540 нм. Активность фермента оценивали по ингибированию скорости восстановления тетразолия нитросинего в неэнзимотической системе феназинметасульфата и уикотинамидадениндинуклеотида (НАДН) [Матюшин Б.Н. Определение супероксиддисмутазной активности в материале пункционной биопсии печени при ее хроническом поражении / Б.Н. Матюшин, А.С. Логинов, В.Д. Ткачев // Лаб. дело. - 1991. - №7. - С. 16-19]. Исследование активности СОД производили в среде следующего состава: 0,1 М калий-фосфатный-буфер (pH 7,8); содержащий 0,33 мМ ЭДТА; 0,41 мМ нитросинего тетразолия; 0,01 мМ ФМС; 0,8 мМ НАДН. Субстрат вносили из расчета 0,03 мл на 1 мл среды инкубации. Реакцию инициировали добавлением НАДН, детектировали прирост оптической плотности в течение 5 минут. За единицу активности СОД принимали количество фермента, необходимого для 50% ингибирования восстановления нитросинего тетразолия. Расчет осуществляли по формуле:

где Е0 и EK - среднее значение прироста экстинции за 5 минут в опытной и контрольной пробах соответственно.
Активность каталазы определяли спектрофотометрически при длине волны 410 нм. В основе данного метода лежит способность Н2О2 и молибдата аммония образовывать стойкий окрашенный комплекс, имеющий максим поглощения при 410 нм [Мирошниченко О.С. Биогенез, физиологическая роль и свойства каталазы / О.С. Мирошниченко // Биополимеры и клетка. - 1992. - Т 8, №6. - С. 3-9]. Реактивы для проведения анализа: 0,08% раствор Н2О2; 4,5% раствор аммония молибденовокислого; 0,1 М трис-HCl-буфер, pH 7,4; буферно-субстратная смесь (10 мл трис-HCl-буфера pH 7,4+30 мл 0,08% Н2О2). В контрольную и опытную пробирки вносили по 2 мл буферно-субстратной смеси, инкубировали 10 минут при 37°С. После этого в опытную пробирку добавляли 0,1 мл исследуемого образца, инкубировали при 37°С еще 3 минуты. Затем в обе пробирки приливали по 2 мл раствора аммония молибденовокислого, после чего в контрольную пробирку добавляли 0,1 мл исследуемого образца. Измеряли оптическую плотность опытного (Еo) и контрольного (Ек) растворов.
Расчет результата
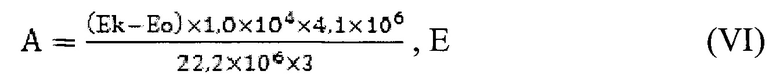
4,1 - конечный объем пробы;
1,0×104 фактор разведения;
106 - коэффициент пересчета на мкм;
22,2×106 - коэффициент молярной экстинции Н2О2;
3 минуты - время инкубации.
Активность СОД и каталазы в тканях крыс выражали в Е на грамм сырой массы (б), Е на мл сыворотки (а) и Е на мг белка (фиг. 3). За единицу ферментативной активности (Е) принимали количество фермента, катализирующее образование 1 мкМ продукта реакции за 1 мин при температуре 25°С. Активность ферментов исследовали на спектрофотометре Hitachi U-1900 с программным обеспечением.
Содержание глутатиона (GSH) оценивали, основываясь на способности сульфгидрильной группы GSH вступать в реакцию с 5,5-дитио-бис-(2-нитробензойной) кислотой (реактив Эллмана), при этом в эквимолярных количествах образуется тионитрофенильный анион, имеющий желтую окраску и максимум поглощения при 412 нм [Волоскова А.В. Исследование влияния различных доз тиоктовой кислоты на активность глутатионовой системы в печени крыс в норме и при экспериментальном токсическом гепатите / А.В. Волоскова, Т.Н. Попова, Л.В. Матасова // Вестник ВГУ. Серия: Химия. Биология. Фармация - 2005. - №1. - С. 87-90].
Ход определения содержания GSH:
В химическую пробирку наливали 0,5 мл пробы, 3,5 мл 0,1 М фосфатного буфера pH 7,4 и хорошо перемешивали; 2,0 мл разведенной в 8 раз пробы переносили в центрифужную пробирку и добавляли к ней 1,0 мл 20% трихлоруксусной кислоты (ТХУ). Тщательно перемешивали и оставляли в холодильнике на 15-20 минут. Смесь вынимали из холодильника и центрифугировали 15 минут при 3000 об/мин при 0…+4°С. В химические пробирки наливали по 0,5 мл фосфатного буфера и в каждую вносили по 1,0 мл супернатанта. В опытную пробирку №1 приливали 0,05 мл реактива Эллмана, а в контрольную пробирку №2 - 0,05 мл этанола. Содержимое пробирок хорошо перемешивали. Анализировали оптическую плотность опытной и контрольной проб против фосфатного буфера при λ 412 нм в 10 мм-вой кювете. Концентрация GSH рассчитывается по формуле:
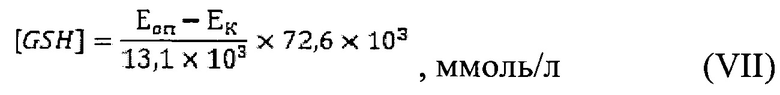
где [GSH] - содержание GSH, ммоль/л; Eоп - оптическая плотность опытной пробы; Ек - оптическая плотность контрольной пробы; 13,1*103 - коэффициент молярной экстинкции реактива Эллмана при 412 нм; 72,6 - фактор разведения.
Содержание общего белка определяли унифицированным методом с помощью биуретовой реакции.
Ход определения. В пробирку вносили 5 мл биуретового реактива, добавляли 0,1 мл исследуемого образца, перемешивали. Через 30 мин измеряли оптическую плотность против контроля при длине волны 540-560 нм (зеленый светофильтр). В качестве контроля использовали пробу, которая вместо исследуемого образца содержала физиологический раствор.
Расчет концентрации белка осуществляли по калибровочному графику, для построения которого из калибровочного раствора альбумина готовили рабочие растворы с различной концентрацией белка. Из каждого разведения раствора альбумина отбирали по 0,1 мл и добавляли в пробирки с биуретовым реактивом. Через 30 мин все пробы фотометрировали против контроля при 540-560 нм. По полученным данным строили график зависимости оптической плотности образца от концентрации белка. Калибровочный график линеен до величины экстинкции 0,5. При более высокой величине экстинкции сыворотку разводят изотоническим раствором NaCl в соотношении 1:1 [Меньшикова В.В. Справочник Лабораторные методы исследования в клинике / В.В. Меншикова. - М.: Медицина, 1987. - 368 с].
Опыты проводили в 8-кратных биологических повторностях. Аналитические повторы были проведены дважды для каждой пробы. Для проверки гипотезы о соответствии распределения полученных вариант нормальному распределению использовали критерий Колмогорова-Смирнова в модификации Лиллиефорса. Результаты исследования обрабатывали с использованием показателей описательной статистики:
выборочного среднего  , выборочного стандартного отклонения
, выборочного стандартного отклонения  , стандартной ошибки среднего
, стандартной ошибки среднего  по следующим формулам:
по следующим формулам:
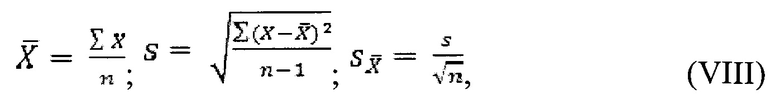
где X - значение параметра, n - объем выборки, s - выборочное стандартное отклонение.
Полученные результаты опытных образцов сравнивали с контролем. В таблицах представлены данные как среднее значение с допустимой погрешностью. Результаты эксперимента анализировали с использованием t-критерия Стьюдента с расчетом среднего значения, стандартного отклонения. Достоверно различающимися считали значения, для которых p≤0,5 [Калаева Е.А. Теоретические основы и практическое применение математической статистики в биологических исследованиях и образовании / Е.А. Калаева, В.Г. Артюхов, В.Н. Калаев. - Воронеж: Издательский дом ВГУ, 2016. - 283 с.; Ллойд Э. Справочник по прикладной статистике / Э. Ллойд, У. Ледерман. - М.: Финансы и статистика, 1990. - 525 с.].
Результаты проведенных тестов показали, что активность маркерных ферментов цитолиза клеток печени, возраставшая при развитии ТГ, снижалась после введения животным карсила и соединения I. Так, активность АлАТ, AcAT и ГГТП в 3-й группе уменьшалась в сыворотке крови крыс в 2,5, 2,2 и 1,4 раза относительно показателей 2-й группы, при этом снижение вышеуказанных параметров в 4-й группе составило 2,9, 2,5 и 3,9 раза соответственно, относительно животных с ТГ (фиг. 2). Полученные данные, позволяют сделать вывод о наличии более мощного гепатопротекторного эффекта у соединения I по сравнению с карсилом.
В ходе работы была проведена оценка ряда показателей окислительно-восстановительного гомеостаза в тканях экспериментальных животных. Показано, что развитие ТГ (2) сопровождалось увеличением в сыворотке крови (а) и печени крыс (б) содержания ДК, представляющих собой первичные продукты пероксидного окисления липидов, в 2,1 и 1,7 раза в сравнении с контролем (1). Применение соединения I (4) способствовало снижению данного параметра в исследуемых тканях в 1,9 и 1,6 раза относительно (2). На содержание ДК тестируемое соединение I воздействовало более эффективно, чем карсил, на 19 и 29% соответственно. Развитие ТГ сопровождалось также возрастанием показателей биохемилюминесценции. Так, Imax, S и tgα2 во 2-й группе возрастали в сыворотке крови (а) в 2,0, 2,4 и 2,2 раза относительно 1-й группы животных. В печени (б) крыс Imax и tgα2 увеличивались в 2,1 раза, а S - в 2,6 раза относительно контроля. Применение соединения I привело к снижению исследуемых параметров практически до уровня контрольных показателей. Карсил при этом оказывал более слабый эффект, однако данные различия были незначительны (фиг. 3).
При тестировании соединения I изучалось также содержание GSH - важнейшего компонента неферментативного звена антиоксидантной системы, и активность СОД и каталазы - ключевых ферментов элиминации супероксидного анион-радикала. Было показано, что развитие ТГ (2) сопровождалось снижением содержания GSH в сыворотке крови (а) животных в 1,2 раза, и увеличением данного параметра в печени (б) в 2,8 раза, относительно показателей контрольной группы (1). При этом, активность СОД, выраженная в Е/мл сыворотки (а) и Е/г сырой массы печени (б), увеличивалась в 1,5 и 2,0 раза, а активность каталазы - в 3,1 и 2,2 раза соответственно (см. фиг. 3). Изменения активности исследуемых ферментов у животных 2-й группы, представленной в виде Е/мг белка, носили схожий характер. По-видимому, развитие ТГ - патологического состояния, сопряженного с ОС, способствовало активации антиоксидантной системы в организме лабораторных животных, носящей адаптационный характер. Содержание GSH в сыворотке крови снижалось в данных условиях, вероятно, вследствие уменьшения его поставки гепатоцитами, обусловленного необходимостью детоксикации больших количеств АФК в клетках печени [Сафонова О.А. Влияние цитрата на функционирование глутатионовой антиоксидантной системы в тканях крыс при экспериментальном токсическом гепатите / О.А. Сафонова, Т.Н. Попова, Л. Саиди // Вестник воронежского государственного университета. Серия: химия. Биология. Фармация. - 2008. - №2. - С. 112-116]. Введение карсила приводило к изменению исследуемых параметров в направлении контрольных значений. Так, активность СОД и каталазы, представленная в виде Е/мл сыворотки крови (а), снижалась в 1,3 и 1,8 раза, в виде Е/г сырой массы печени (б) - в 1,2 и 1,6 раза соответственно, относительно контрольных показателей (1). Удельная активность ферментов изменялась сходным образом. Уровень GSH при этом достоверно не изменялся в сыворотке крови (а) и понижался в печени (б) животных в 2,2 раза (см. фиг. 3). Вместе с тем, было показано, что введение соединения I (4) на фоне ТГ приводило к следующим изменениям. Активность СОД и каталазы, выраженная в Е/мл сыворотки крови (а), снижалась в 1,5 и 2,8 раза, в виде Е/г сырой массы печени (б) - в 1,3 и 2,1 раза соответственно, относительно животных 2 группы. Удельная активность исследуемых ферментов при этом также изменялась в направлении нормы более эффективно по сравнению с данными, полученными на фоне введения карсила (3). Содержание GSH в данных условиях возрастало в сыворотке крови на 13% и снижалось в печени в 2,5 раза, относительно показателей животных с ТГ.
Полученные данные свидетельствуют о снижении нагрузки на показатели, характеризующие степень мобилизации антиоксидантной системы организма животных, что может быть связано с наличием у соединения I антиоксидантной активности. При этом показана более выраженная эффективность воздействия тестируемого соединения по сравнению с карсилом в дозе 50 мг/кг веса тела животного на показатели окислительно-восстановительного гомеостаза. По-видимому, гепатопротекторный эффект соединения I был связан с его способностью снижать степень развития ОС при ТГ.
Таким образом, тестирование соединения I на животных с ТГ выявило наличие у него гепатопротекторных свойств.
Показано, что в дозе 50 мг/кг веса животного соединение I приводило к статистически достоверному снижению активности АлАТ, АсАТ, ГГТП, СОД, каталазы, содержания ДК и нормализации содержания GSH, оказывая действие, подобное карсилу.
Соединение I, вводимое животным на фоне ТГ, статистически достоверно превосходило карсил по влиянию на большинство тестируемых показателей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ГЕПАТОПРОТЕКТИВНЫМ ДЕЙСТВИЕМ | 2020 |
|
RU2727931C1 |
| СПОСОБ ПОВЫШЕНИЯ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ ЦЫПЛЯТ-БРОЙЛЕРОВ | 2007 |
|
RU2370094C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАРИТМИЧЕСКИМИ И ГЕПАТОПРОТЕКТОРНЫМИ СВОЙСТВАМИ | 2011 |
|
RU2469720C1 |
| ГЕПАТОПРОТЕКТОРНОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2310467C2 |
| СРЕДСТВО РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ, ОБЛАДАЮЩЕЕ ГЕПАТОЗАЩИТНЫМ ДЕЙСТВИЕМ | 2014 |
|
RU2554493C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАСТОЙКИ СЕМЯН СОСНЫ КЕДРОВОЙ СИБИРСКОЙ И ГЕПАТОЗАЩИТНЫЙ ПРЕПАРАТ, ПОЛУЧЕННЫЙ ТАКИМ СПОСОБОМ | 2014 |
|
RU2545700C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ РАЗЛИЧНОГО ГЕНЕЗА | 2009 |
|
RU2400233C1 |
| Гепатопротекторное средство | 2015 |
|
RU2614691C2 |
| СПОСОБ КОРРЕКЦИИ ОКСИДАТИВНОГО СТАТУСА ПРИ БОЛЕЗНИ ПАРКИНСОНА В ЭКСПЕРИМЕНТЕ | 2023 |
|
RU2800859C1 |
| СРЕДСТВО С ПАНКРЕО- И ГЕПАТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ ДЛЯ ПАРЕНТЕРАЛЬНОГО ВВЕДЕНИЯ | 2017 |
|
RU2662324C1 |
Изобретение относится к области медицины, а именно к противогепатитным средствам, и может быть использовано для лечения и профилактики заболеваний печени. Предложено применение в качестве гепатопротекторного средства 6-гидрокси-2,2,4-триметил-1,2-дигидрохинолина общей формулы I. Технический результат заключается в расширении ассортимента гепатопротекторов за счет нового более активного средства, которое снижает степень развития окислительного стресса при токсическом гепатите. 3 ил.
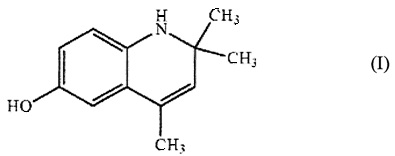
Применение 6-гидрокси-2,2,4-триметил-1,2-дигидрохинолина общей формулы
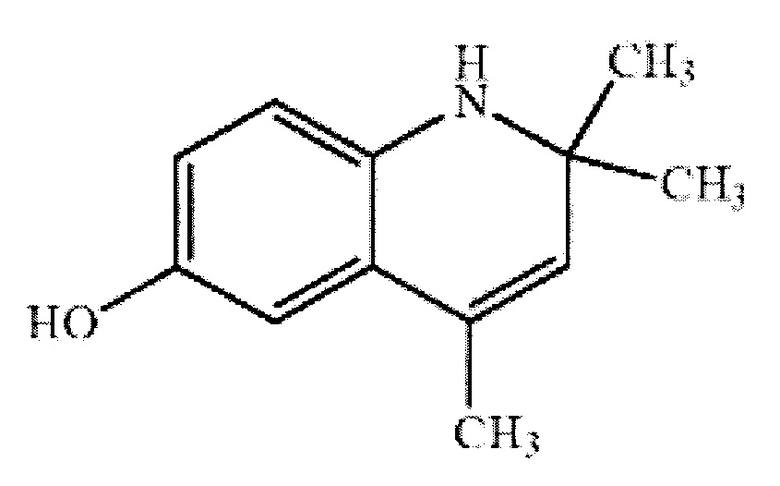
в качестве гепатопротекторного средства.
| СПОСОБ ПРОФИЛАКТИКИ ПАТОЛОГИИ ПЕЧЕНИ У СВИНЕЙ | 2012 |
|
RU2483695C1 |
| MANDEL H.G | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Cancer Res | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Oct | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| KIM H.L | |||
| et al | |||
| Protective effects of antioxidants on bitterweed (Hymenoxys odorata DC) toxicity in sheep | |||
| Am.J.Vet | |||
| Res | |||
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| CHA Y.N | |||
| et al | |||
| Comparative effects of dietary administration of antioxidants and inducers on the activities of several hepatic enzymes in mice | |||
| Drug Nutr, Interact | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ ЦЫПЛЯТ-БРОЙЛЕРОВ | 2007 |
|
RU2364246C2 |
| БМЭС БОЛЬШОЙ МЕДИЦИНСКИЙ ЭНЦИКЛОПЕДИЧЕСКИЙ СЛОВАРЬ | |||
| М., РИПОЛ КЛАССИК 2007, с.179, статья Гепатопротекторы | |||
| GB 1577391 A, 22.10.1980. | |||
Авторы
Даты
2019-01-22—Публикация
2017-10-13—Подача