ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к способу получения L-триптофана посредством усиления активности префенатдегидратазы (PheA).
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
L-триптофан, представляющий собой незаменимую аминокислоту, широко применялся в качестве пищевой добавки, исходного сырья для лекарственных средств, таких как инфузионные растворы, и материала для продуктов лечебного питания. В настоящее время для получения L-триптофана в основном применяют способ прямой ферментации с использованием микроорганизмов.
Что касается микроорганизмов, применяющихся для продуцирования L-триптофана, в первое время в основном использовались штаммы, демонстрирующие устойчивость к аналогам L-триптофана, полученные в результате мутации, индуцированной химическими или физическими факторами, однако преимущественно использовались рекомбинантные штаммы, полученные при помощи генно-инженерных технологий благодаря быстрому развитию технологии рекомбинации генов и установления различных механизмов регуляции на молекулярном уровне в 1990-х годах.
Что касается рекомбинантных штаммов для продуцирования L-триптофана, обычно предпринимали попытки максимизировать выход ферментации триптофана путем делеции или ослабления пути биосинтеза фенилаланина (Phe) или тирозина (Tyr) в путях, конкурирующих за хоризмат (J Ind Microbiol Biotechnol. 2011 Dec;38(12):1921-9 и Appl Environ Microbiol. 1999 Jun;65(6):2497-502).
Однако, штаммы, продуцирующие L-триптофан, нуждающиеся в фенилаланине или тирозине, вызывали трудности в связи с необходимостью по-разному регулировать подаваемое количество двух аминокислот (фенилаланина и тирозина) в фазе роста и фазе продуцирования, увеличение дополнительных затрат при массовом производстве и трудности при приготовлении основной и подпитывающей среды вследствие медленной растворимости двух аминокислот (фенилаланина и тирозина).
Для решения таких проблем авторы данного изобретения создали штамм Corynebacterium, продуцирующий L-триптофан с высоким выходом, из штаммов Corynebacterium дикого типа без делеции или ослабления фенилаланинового или тирозинового пути (US 2020-0063219 А1). Применение штамма Corynebacterium, продуцирующего L-триптофан с высоким выходом, не вызывало накопления фенилаланина в культуре при культивировании с высокой концентрацией в ферментативном чане и обеспечивало продуцирование тирозина на уровне 0,2 г/л до конца культивирования. Однако, штамм продуцировал антранилат на последней стадии культивирования и поэтому максимизировать продуцирование L-триптофана не удавалось.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая задача
Авторы данного изобретения дополнительно оптимизировали распределение потока метаболитов между фенилаланином и тирозином из префената за счет усиления активности префенатдегидратазы (PheA) в дополнение к штамму Corynebacterium, продуцирующему L-триптофан с высоким выходом. Авторы изобретения подтвердили, что ребалансировка продукции аминокислот в конкурирующих путях регулировала итоговое количество фенилаланина или тирозина, продуцируемых в культуре, и снижало продукцию антранилата на более поздней стадии культивирования и, в итоге авторы данного изобретения подтвердили существенное улучшение количества продуцируемого L-триптофана, завершив данное изобретение.
Техническое решение
Аспектом данного изобретения является предложение микроорганизма, продуцирующего L-триптофан и обладающего усиленной активностью префенатдегидратазы.
Аспектом данного изобретения является предложение способа получения L-триптофана, включающего культивирование в среде микроорганизма, продуцирующего L-триптофан и обладающего усиленной активностью префенатдегидратазы.
Аспектом данного изобретения является предложение композиции для получения L-триптофана, содержащей микроорганизм, продуцирующий L-триптофан и обладающий усиленной активностью префенатдегидратазы.
Полезные эффекты
Микроорганизм, продуцирующий L-триптофан и обладающий усиленной активностью префенатдегидратазы по данному изобретению, способен минимизировать накопление антранилата и продуцировать L-триптофан с высоким выходом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
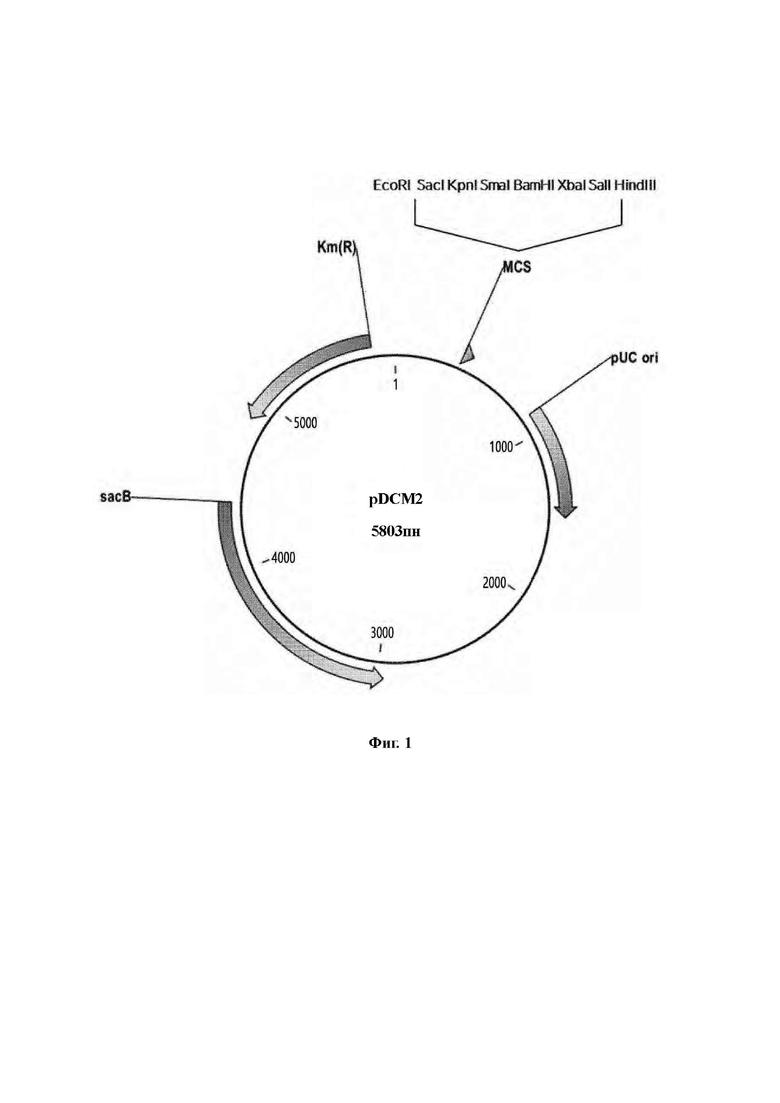
На Фиг. 1 приведено схематическое изображение плазмиды pDCM2.
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее данное изобретение будет описано более подробно. Каждое из описаний и воплощений данного изобретения также может быть применено к другим описаниям и воплощениям. Таким образом, все комбинации различных элементов данного изобретения входят в объем данного изобретения. Более того, объем данного изобретения не ограничивается конкретным описанием, приведенным ниже.
Аспектом данного изобретения является предложение микроорганизма, продуцирующего L-триптофан и обладающего усиленной активностью префенатдегидратазы.
В данном документе термин «L-триптофан» относится к одной из 20 α-аминокислот, которая является незаменимой аминокислотой, биосинтез которой не осуществляется у многих организмов, включая человека. Триптофан известен как биохимический предшественник, и различные вещества, например, такой нейромедиатор, как серотонин, такой нейрогормон как мелатонин, ниацин и ауксин синтезируются из триптофана.
L-триптофан синтезируется из хоризмата (хоризмовой кислоты), и группа генов, кодирующих ферменты, вовлеченные в данный процесс, известна как триптофановый оперон (Trp оперон). Известно, что триптофановый оперон включает структурные гены и регуляторную область. Обычный триптофановый оперон активно транскрибируется, чтобы продуцировалось достаточное количество триптофана, необходимого клеткам, но, когда в клетках присутствует достаточно триптофана, с триптофаном связывается репрессор, в результате приводя к инактивации триптофанового оперона, тем самым подавляя транскрипцию. Триптофановый оперон может происходить из различных микроорганизмов, таких как микроорганизм рода Corynebacterium и микроорганизм рода Escherichia. «Регуляторная область» триптофанового оперона относится к сайту, расположенному в направлении против хода транскрипции от структурных генов, образующих триптофановый оперон, и может регулировать экспрессию структурных генов. Структурные гены, образующие триптофановый оперон в микроорганизме рода Corynebacterium, могут включать гены trpE, trpG, trpD, trpC, trpB и trpA, а структурные гены, образующие триптофановый оперон в микроорганизме рода Escherichia, могут включать гены trpE, trpD, trpC, trpB и trpA. «Регуляторная область» триптофанового оперона может быть расположена в направлении против хода транскрипции относительно trpE в 5' положении от структурных генов триптофанового оперона. В частности, регуляторная область триптофанового оперона может включать триптофановый регулятор (trp регулятор; trpR), промотор (trp промотор), оператор (trp оператор), триптофановый лидерный пептид (trp лидерный пептид; trp L) и триптофановый фактор аттенюации (trp аттенюатор), за исключением структурных генов, которые могут составлять триптофановый оперон. Более конкретно, регуляторная области триптофанового оперона может включать промотор (trp промотор), оператор (trp оператор), триптофановый лидерный пептид (trp лидерный пептид; trp L) и триптофановый фактор аттенюации (trp аттенюатор).
В данном описании термин «префенатдегидратаза» (далее обозначаемая «PheA») относится к ферменту пути продуцирования L-фенилаланина из хоризмата или префената, где префенатдегидратаза известна как фермент, конкурирующий с путем биосинтеза тирозина. Белок может также носить название бифункциональной хоризматмутазы/префенатдегидратазы. Примером гена, кодирующего белок, может быть ген pheA, без ограничения, и ген pheA может регуироваться триптофановым опреоном, описанным выше. В данном документе «ген pheA» может использоваться взаимозаменяемо с «геном, кодирующим префенатдегидратазу» и «геном pheA».
PheA может иметь аминокислотную последовательность SEQ ID NO: 1, состоять из аминокислотной последовательности SEQ ID NO: 1 или содержать аминокислотную последовательность, приведенную в SEQ ID NO: 1, без ограничения. Последовательность SEQ ID NO: 1 может быть подтверждена по известной базе данных GenBank NCBI.
В частности, PheA может иметь аминокислотную последовательность SEQ ID NO: 1 и/или аминокислотную последовательность по меньшей мере на 70%, 80%, 85%, 90%, 95%, 96%, 97% или 99% гомологичную или идентичную SEQ ID NO: 1. Кроме того, очевидно, что даже PheA, имеющий аминокислотную последовательность с делецией, модификацией, заменой или вставкой в ее части, также может входить в объем данного изобретения, при условии, что аминокислотная последовательность обладает такой гомологией или идентичностью и демонстрирует активность, соответствующую PheA.
В данном описании термин «гомология и идентичность» относится к степени соответствия двух заданных аминокислотных последовательностей или нуклеотидных последовательностей и может выражаться в процентах. Термины гомология и идентичность зачастую могут использоваться взаимозаменяемо.
Гомология или идентичность последовательностей консервативных полинуклеотидов или полипептидов может быть установлена при помощи стандартных алгоритмов выравнивания, с которыми можно применять значения штрафов за открытие гэпа, установленные в используемой программе по умолчанию. По существу, гомологичные или идентичные последовательности обычно могут гибридизоваться друг с другом в условиях умеренной или высокой жесткости по всей длине последовательностей или по меньшей мере на протяжение приблизительно 50%, 60%, 70%, 80%, 80% или 90% от полноразмерных последовательностей. При гибридизации также учитывают полинуклеотиды, включающие вместо кодона вырожденные кодоны.
Гомологию или идентичность полипептидных или полинуклеотидных последовательностей можно установить, например, с применением алгоритма BLAST, описанного в литературе (см. Karlin and Altschul, Pro. Natl. Acad. Sci. USA, 90, 5873(1993)) или FASTA, предложенного Pearson (см. Methods Enzymol, 183, 63, 1990). На основе указанного алгоритма BLAST была разработана программа под названием BLASTN или BLASTX (см. http://www.ncbi.nlm.nih.gov). Кроме того, гомологию, сходство или идентичность любых аминокислотных или полинуклеотидных последовательностей можно устанавливать путем сравнения последовательностей с применением гибридизации по Саузерну в условиях определенной жесткости, и соответствующие определенные условия гибридизации можно установить в рамках уровня техники способом, известным специалисту в области техники (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; и F.M. Ausubel et al., Current Protocols in Molecular Biology).
В данном описании термин «микроорганизм, продуцирующий L-триптофан» относится к микроорганизму, обладающему естественной способностью продуцировать L-триптофан, или к микроорганизму, полученному путем придания способности продуцировать L-триптофан родительскому штамму, не обладающему способностью продуцировать L-триптофан. В частности, микроорганизм может представлять собой микроорганизм, продуцирующий L-триптофан и обладающий усиленной активностью PheA, без ограничения.
В частности, «микроорганизм, продуцирующий L-триптофан», включает микроорганизмы дикого типа или микроорганизмы, генетически модифицированные естественным или искусственным образом. Более конкретно, микроорганизм, продуцирующий L-триптофан, может представлять собой микроорганизм, в котором конкретный механизм ослаблен или усилен вследствие вставки экзогенного гена или усиления или инактивации активности эндогенного гена, где микроорганизм может представлять собой микроорганизм, имеющий генетическую мутацию или усиленную L-триптофан-продуцирующую активность для продуцирования целевого L-триптофана. В рамках данного изобретения микроорганизм, продуцирующий L-триптофан, обладает усиленной способностью продуцировать желаемый L-триптофан благодаря усилению активности PheA, и такой микроорганизм может быть генетически модифицированным микроорганизмом или рекомбинантным микроорганизмом, без ограничения.
В данном описании термин «усиление активности» белка относится к увеличению активности белка по сравнению с его эндогенной активностью. В данном описании термин «эндогенная активность» относится к активности конкретного белка, которой исходно обладал родительский штамм до трансформации или немодифицированный микроорганизм, в случае, когда трансформация происходит вследствие генетической мутации, вызванной факторами естественного или искусственного происхождения. Данный термин может использоваться взаимозаменяемо с «активностью до модификации». Термин «повышение» активности белка по сравнению с его эндогенной активностью означает, что активность белка усиливается по сравнению с активностью конкретного белка, которой исходно обладал родительский штамм до трансформации или немодифицированный микроорганизм.
«Повышение активности» может достигаться посредством внедрения экзогенного белка или посредством усиления активности эндогенного белка, но в частности, может достигаться посредством усиления активности эндогенного белка. Подтвердить, усилилась или нет активность белка, можно по степени активности или уровню экспрессии соответствующего белка или по увеличению количества продукта, продуцируемого соответствующим белком.
В данном изобретении белком, являющимся мишенью для усиления активности, то есть целевым белком, может быть PheA, без ограничения.
В данном изобретении продукт, который продуцируется соответствующим белком, может представлять собой L-триптофан, без ограничения.
Усиление активности белка может достигаться путем применения различных способов, хорошо известных в области техники, и способы не ограничиваются конкретными способами, при условии, что эти способы могут усиливать активность целевого белка по сравнению с таковой у микроорганизма до трансформации. Способ может включать генную инженерию или белковую инженерию, без ограничения.
Усиление активности белка с применением генной инженерии может осуществляться, например, посредством:
1) повышения внутри клетки числа копий гена, кодирующего белок;
2) способа замены последовательности, регулирующей экспрессию, на хромосоме, кодирующей белок, последовательностью, обладающей сильной активностью;
3) способа модификации нуклеотидной последовательности инициирующего кодона или 5'-нетранслируемой области белка для повышения активности белка;
4) способа модификации полинуклеотидной последовательности на хромосоме, чтобы повысить активность белка;
5) внедрения экзогенного полинуклеотида, демонстрирующего активность белка, или модифицированного полинуклеотида с оптимизированным составом кодонов полинуклеотида; или
6) комбинации способов, без ограничения.
Усиление активности белка с применением белковой инженерии может быть реализовано, например, посредством: способа анализа третичной структуры белка, чтобы выбрать экспонированный сайт, и модификации или химической модификации сайта, без ограничения.
Увеличение внутриклеточного числа копий гена, кодирующего белок в (1), может осуществляться способом, известным в области техники, например, посредством внедрения в клетку-хозяина вектора, который функционально связан с геном, кодирующим соответствующий белок, и способен реплицироваться и функционировать независимо от хозяина. В альтернативном варианте увеличение может осуществляться путем внедрения в клетку-хозяина вектора, который функционально связан с геном и способен встраивать ген в хромосому клетки-хозяина, без ограничения.
В данном описании термин «вектор» относится к ДНК-конструкции, содержащей полинуклеотидную последовательность, кодирующую целевой белок в форме, функционально связанной с последовательностью, регулирующей экспрессию, подходящей для экспрессии целевого белка в клетке-хозяине. Регулирующая экспрессию последовательность может включать промотор, способный инициировать транскрипцию, любую последовательность оператора для регуляции транскрипции, последовательность, кодирующую подходящий сайт связывания рибосомы в составе мРНК, и последовательности для регуляции терминации транскрипции и трансляции. После трансформации подходящей клетки-хозяина вектор может реплицироваться или функционировать независимо от генома хозяина или может интегрироваться в сам геном.
Вектор, используемый в данном изобретении, не ограничивается какими-либо конкретными, при условии, что вектор способен реплицироваться в клетке-хозяине, и можно использовать любой вектор, известный в области техники. Примеры обычно используемых векторов могут включать плазмиды, космиды, вирусы и бактериофаги естественного происхождения или рекомбинантные. Например, в качестве фаговых векторов или космидных векторов могут применяться pWE15, М13, λMBL3, λMBL4, λIXII, λASHII, λAPII, λt10, λt11, Charon4A и Charon21A, а в качестве плазмидных векторов могут применяться векторы на основе pDZ, на основе pBR, на основе pUC, на основе pBluescriptII, на основе pGEM, на основе pTZ, на основе pCL и на основе рЕТ. В частности, вектор, который можно применять в данном изобретении, может представлять собой pDCM2 (Фиг. 1, SEQ ID NO: 3), сконструированный для вставки и замены гена в хромосоме Corynebacterium, но не обязательно ограничивается им, и можно применять известный экспрессирующий вектор.
В данном описании термин «трансформация» указывает, что рекомбинантный вектор, содержащий полинуклеотид, кодирующий целевой белок, внедряют в клетку хозяина для экспрессии белка, кодируемого полинуклеотидом, в клетке-хозяине. Примеры трансформированного полинуклеотида могут включать любой полипептид, который может экспрессироваться в клетке-хозяине, независимо от того, встроен ли полипептид в хромосому клетки-хозяина и находится в ней или находится за пределами хромосомы. Способ трансформации включает любой способ внедрения нуклеиновой кислоты в клетку и может осуществляться путем выбора известной в области техники подходящей стандартной методики, в зависимости от клетки-хозяина. Примерами может быть электропорация, преципитация фосфатом кальция (CaPO4), преципитация хлоридом кальция (CaCl2), микроинъекция, способ с полиэтиленгликолем (PEG) и способ с DEAE (диэтиламиноэтил)-декстраном, способ с катионными липосомами, способ с ацетатом лития-DMSO (диметилсульфоксид) и тому подобные, без ограничения.
Кроме того, термин «функционально связан» относится к функциональной связи между полинуклеотидной последовательностью и последовательностью промотора или последовательностью, регулирующей экспрессию, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего целевой белок по данному изобретению. Функциональная связь может быть создана с применением технологии рекомбинации генов, хорошо известной в области техники, и сайт-специфического расщепления ДНК, и связь может быть создана с применением расщепляющих и связывающих ферментов, известных в области техники, и тому подобного, без ограничения.
Способ замены последовательности, регулирующей экспрессию гена на хромосоме, кодирующей белок, последовательностью, обладающей сильной активностью, в (2) может осуществляться любым способом, известным в области техники, например посредством индукции мутации последовательности в нуклеиновокислотной последовательности посредством делеции, вставки, неконсервативной или консервативной замены или их комбинации для дополнительного усиления активности последовательности, регулирующей экспрессию, или путем замены нуклеиновокислотной последовательностью, обладающей более сильной активностью. Последовательность, регулирующая экспрессию, может включать промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, последовательности для регулирования терминации транскрипции и трансляции, и тому подобные, без конкретного ограничения. В частности, способ может осуществляться посредством связывания с сильным гетерологичным промотором вместо исходного промотора, без ограничения.
Известные примеры сильного промотора могут включать промотор lysC (US 8426577), промотор CJ7 (US 7662943 В2), промотор CJ1 (US 7662943 В2), промотор lac, промотор Trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL и промотор tet, без ограничения. В частности, сильный промотор, который может применяться в данном изобретении, может представлять собой PlysCm1 (SEQ ID NO: 4), полученный путем модификации части последовательности мутированного промотора lysC (US 8426577), без конкретного ограничения, и может применяться известный промотор.
Способ модификации нуклеотидной последовательности инициирующего кодона или 5'-нетранслируемой области белка в (3) можно осуществлять любым известным в области техники способом, например, путем замены эндогенного инициирующего кодона белка другим инициирующим кодоном, имеющим более высокую степень экспрессии белка по сравнению с эндогенным инициирующим кодоном, без ограничения.
Способ модификации полинуклеотидной последовательности на хромосоме для усиления активности белка в (4) может осуществляться любым способом, известным в области техники, например, посредством индукции мутации в нуклеиновокислотной последовательности посредством делеции, вставки, неконсервативной или консервативной замены или их комбинации для дополнительного усиления активности полинуклеотидной последовательности, или путем замены полинуклеотидной последовательностью, которая улучшена так, чтобы обладать более сильной активностью. В частности, замена может представлять собой встраивание гена в хромосому посредством гомологичной рекомбинации, без ограничения.
Используемый при этом вектор может дополнительно включать в себя селективный маркер для подтверждения встраивания в хромосому. Селективный маркер предназначен для отбора клеток, трансформированных вектором, то есть для подтверждения встраивания гена, и могут применяться маркеры, придающие фенотип, позволяющий осуществлять отбор, такой как устойчивость к лекарственным средствам, ауксотрофия, устойчивость к цитотоксическим агентам или экспрессия поверхностных белков, без ограничения. В среде, обработанной селективным агентом, могут выживать или демонстрировать отличающийся фенотип только клетки, экспрессирующие селективный маркер, таким образом можно осуществлять отбор трансформированных клеток.
Внедрение экзогенного полинуклеотида, обладающего активностью белка, в (5) может осуществляться путем внедрения в клетку-хозяина экзогенного полинуклеотида, кодирующего белок, демонстрирующий такую же/схожую активность, что касается белка, или мутантный полинуклеотид с оптимизированным составом кодонов. Экзогенный полинуклеотид может применяться без ограничения по его происхождению или последовательности при условии, что полинуклеотид демонстрирует такую же/схожую активность, что касается белка. Кроме того, для оптимизированной транскрипции и трансляции внедренного экзогенного полинуклеотида в клетке-хозяине его кодоны могут быть оптимизированы и внедрены в клетку-хозяина. Внедрение может осуществляться посредством любого известного способа трансформации, надлежащим образом выбранного специалистом в области техники, и внедренный полинуклеотид экспрессируется в клетке-хозяине для продуцирования белка, тем самым усиливая его активность.
Наконец, комбинация способов в (6) может осуществляться путем применения любого одного или более от (1) до (5).
Такое усиление активности белка может указывать, что активность или концентрация соответствующего белка повышается по сравнению с активностью или концентрацией белка, экспрессируемого в штамме микроорганизма дикого типа или микроорганизме до модификации, или количество продукта, получаемого из соответствующего белка увеличивается, без ограничения. В данном описании термин «штамм до модификации» или «микроорганизм до модификации» не исключает штамма, содержащего мутацию, которая может возникнуть в микроорганизме естественным путем, и относится к самому нативному штамму или штамму до изменения признака вследствие генетической мутации, вызванной искусственными факторами. В данном изобретении изменение признака может представлять собой усиление активности PheA. «Штамм до модификации» или «микроорганизм до модификации» может использоваться взаимозаменяемо с «немутированным штаммом», «немодифицированным штаммом», «немутированным микроорганизмом», «немодифицированным микроорганизмом» или «референсным микроорганизмом».
В данном изобретении референсный микроорганизм не ограничен каким-либо конкретным при условии, что референсный микроорганизм продуцирует L-триптофан, и мутированный штамм, обладающий усиленной способностью продуцировать L-триптофан по сравнению с микроорганизмом дикого типа, также входит в объем изобретения, без ограничения. Его примеры могут включать штамм Corynebacterium glutamicum АТСС13869, штамм CJ04-8321 (WO 2019-164346 A1) или штамм, в котором одна или более генетических модификаций добавлена к указанным выше штаммам для усиления пути биосинтеза L-триптофана, без ограничения.
Одна или более генетических модификаций могут быть, например, одной или более генетическими модификациями, выбранными из: способности сверхэкспрессировать L-триптофановый оперон; улучшения подачи и эффективности предшественника L-триптофана; улучшения экспорта L-триптофана; ослабления или инактивации гена конкурирующего пути, управляемого триптофановым опероном, гена для внедрения L-триптофана и генов для внедрения и разрушения триптофана, без ограничения.
Генетическая модификация в виде сверхэкспрессии активности L-триптофанового оперона может представлять собой, например (1) усиление промотора оперона гена биосинтеза L-триптофана, (2) снятие ингибирования по принципу обратной связи белка TrpE в соответствии с улучшением продукции L-триптофанового оперона и (3) усиление промотора оперона гена биосинтеза L-триптофана и, в частности, (1) может представлять собой усиление посредством замены промотора оперона гена биосинтеза L-триптофана на сильный промотор SPL7, (2) может быть внедрением trpE(P21S)DCBA или trpE(S38R)DCBA, который представляет собой L-триптофановый оперон, обладающий признаком ингибирования trpE по принципу обратной связи, и (3) может быть усилением путем замены промотора оперона гена биосинтеза L-триптофана на сильный промотор SPL7, без ограничения.
Генетическая модификация, обеспечивающая улучшение запасов и эффективности предшественника L-триптофана, может представлять собой, например, усиление экспрессии связанного гена для непрерывной подачи предшественника L-триптофана, такого как эритрозо-4-фосфат (Е4Р) и эффективного использования энергии и, в частности, внедрение гена, кодирующего транскетолазу (tkt) или усиление ее экспрессии, без ограничения.
Генетическая модификация в виде улучшения экспорта L-триптофана может представлять собой, например, внедрение экзогенного мембранного белка, улучшающего экспорт L-триптофана и, в частности, внедрение гена (регистрационный номер NZ_LFLU01000012.1), кодирующего мембранный белок, происходящий из Herbaspirillum rhizosphaerae, без ограничения.
Штамм, имеющий по меньшей мере одну генетическую модификацию, может представлять собой, например, СА04-8325, сконструированный путем внедрения trpE(S38R)DCBA, L-триптофанового оперона, содержащего SPL7 в качестве сильного промотора, и обладающего признаком ограничения trpE по принципу обратной связи, в штамм АТСС13869 (US 2020-0063219 A1); СА04-8352, где в штамм СА04-8325 встроен ген tkt (WO 2019-164346 A1), или штамм СА04-8405, сконструированный путем внедрения гена, кодирующего мембранный белок, происходящий из Herbaspilium risospere, в штамм CJ04-8352 (US 2020-0063219 A1), без ограничения.
В рамках данного изобретения возможен любой микроорганизм, продуцирующий L-триптофан, при условии, что этот микроорганизм способен продуцировать L-триптофан в результате усиления активности PheA. В данном документе «микроорганизм, продуцирующий L-триптофан» может использоваться взаимозаменяемо с «L-триптофан-продуцирующим микроорганизмом» или «микроорганизмом, обладающим способностью продуцировать L-триптофан».
Примеры микроорганизмов могут включать микроорганизмы, относящиеся к роду Corynebacterium, Escherichia, Enterobacter, Erwinia, Serratia, Providencia и Brevibacterium, и, в частности, могут представлять собой микроорганизм рода Corynebacterium.
Более конкретно, микроорганизм рода Corynebacterium может представлять собой Corynebacterium glutamicum, Corynebacterium ammoniagenes, Corynebacterium crudilactis, Corynebacterium deserti, Corynebacterium efficiens, Corynebacterium callunae, Corynebacterium stationis, Corynebacterium singulare, Corynebacterium halotolerans, Corynebacterium striatum, Corynebacterium pollutisoli, Cxorynebacterium imitans, Corynebacterium testudinoris, Corynebacterium flavescens или им подобный, и микроорганизм рода Corynebacterium может представлять собой Corynebacterium glutamicum. Кроме того, может рассматриваться любой микроорганизм, относящийся к роду Corynebacterium, без ограничения.
Согласно другому аспекту данного изобретения предложен способ получения L-триптофана, включающий культивирование в среде микроорганизма, продуцирующего L-триптофан и обладающего усиленной активностью префенатдегидратазы.
Префенатдегидратаза, усиление активности и микроорганизм, продуцирующий L-триптофан, являются такими, как описано выше.
В способе культивирование микроорганизма может осуществляться известным периодическим культивированием, непрерывным культивированием, культивированием с подпиткой и тому подобным, без ограничения. Условия культивирования не ограничены какими-либо конкретными, однако можно доводить значения рН до оптимальных (например, рН 5-9, в частности, рН 6-8, и более конкретно, рН 7,0) с помощью основного соединения (например гидроксида натрия, гидроксида калия или аммония) или кислого соединения (например фосфорной кислоты или серной кислоты), аэробные условия могут поддерживаться путем введения в культуру кислорода или кислородсодержащей газовой смеси. Температуру культивирования можно поддерживать от 20°С до 45°С, и в частности, от 25°С до 40°С, а культивирование можно осуществлять в течение приблизительно 10-160 часов, без ограничения. Продуцируемая в ходе культивирования аминокислота может секретироваться в среду или оставаться в клетках.
В качестве источников углерода в среде для культивирования можно использовать сахара и углеводы (например глюкозу, сахарозу, лактозу, фруктозу, мальтозу, мелассу, крахмал и целлюлозу), масла и жиры (например соевое масло, масло семян подсолнечника, арахисовое масло и кокосовое масло), жирные кислоты (например пальмитиновую кислоту, стеариновую кислоту и линолевую кислоту), спирты (например глицерин и этанол), органические кислоты (например уксусную кислоту) и тому подобное, как в отдельности, так и в смеси, однако источники углерода не ограничиваются перечисленными. В качестве источников азота можно использовать азотсодержащие органические соединения (например пептон, дрожжевой экстракт, мясной экстракт, мальтозный экстракт, кукурузный экстракт, соевую муку и мочевину) или неорганическое соединение (например сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония) и тому подобное, как в отдельности, так и в смеси, однако источники азота не ограничиваются перечисленными. В качестве источника фосфора можно использовать однозамещенный фосфат калия, двузамещенный фосфат калия, соответствующую им натрий-содержащую соль и тому подобное, как в отдельности, так и в смеси, однако источники фосфора не ограничиваются перечисленными. Среда также может содержать незаменимые способствующие росту соединения, такие как другие соли металлов (например, сульфат магния или сульфат железа), аминокислоты и витамины.
Способ по данному изобретению может дополнительно включать выделение L-триптофана из культуральной среды или микроорганизма. Выделение аминокислоты, продуцированной на стадии культивирования, может представлять собой сбор целевой аминокислоты из культуры подходящим способом, известным в области техники, соответствующим способу культивирования. Например, можно применять центрифугирование, фильтрацию, анионообменную хроматографию, кристаллизацию, ВЭЖХ и тому подобное, и необходимую аминокислоту можно выделять из среды или микроорганизма с помощью соответствующего способа, известного в области техники.
Стадия выделения может включать процесс очистки, который можно осуществлять подходящим способом, известным в области техники. Таким образом, выделенная аминокислота может быть в очищенной форме или может представлять собой ферментированную микроорганизмом среду, содержащую аминокислоту (Introduction to Biotechnology and Genetic Engineering, A. J. Nair, 2008). Выделение целевой аминокислоты можно эффективно осуществлять путем включения подходящего способа, известного в области техники, до и после стадии культивирования или до и после стадии выделения.
В соответствии с другим аспектом данного изобретения предложена композиция для получения L-триптофана, содержащая микроорганизм, продуцирующий L-триптофан и обладающий усиленной активностью префенатдегидратазы.
Префенатдегидратаза, усиление активности и микроорганизм, продуцирующий L-триптофан, являются такими, как описано выше.
Композиция для получения L-триптофана может содержать ген pheA, кодирующий PheA, и может включать, без ограничения, элемент, способный усиливать PheA или ген pheA. В частности, элемент может быть в форме, содержащейся в векторе, чтобы экспрессировать ген, функционально связанный с внедренным в клетку-хозяина, а форма является такой, как описано выше. В частности, экспрессия гена pheA, который представляет собой ген, кодирующий префенатдегидратазу, может быть усилена посредством увеличения числа копий или замены промотора на сильный промотор.
В соответствии с другим аспектом данного изобретения предложено применение этой композиции для продуцирования L-триптофана.
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее данное изобретение будет описано более подробно с отсылкой к приведенным в качестве примера воплощениям. Однако, эти приведенные в качестве примера воплощения служат исключительно для иллюстрации данного изобретения, и объем данного изобретения не ограничен этими приведенными в качестве примера воплощениями.
Пример 1. Конструирование плазмиды
Создавали плазмиду (pDCM2, Фиг. 1, SEQ ID NO: 3) для встраивания и замены гена в хромосоме Corynebacterium. Плазмиду синтезировали с привлечением службы синтеза генов Bionix Co., Ltd. Плазмиду конструировали таким образом, чтобы она включала рестрикционный фермент, который можно с удобством использовать в клонировании, на основании публикации, связанной с широко известной системой sacB (Gene, 145 (1994) 69-73). Синтезировали плазмиду pDCM2, обладающую следующими характеристиками.
1) Плазмида имела ориджин репликации, функционирующий только в Е. coli, и поэтому плазмида могла самореплицироваться в Е. coli, но не могла самореплицироваться в Corynebacterium.
2) В качестве селективного маркера плазмида имела ген резистентности к канамицину.
3) Плазмида имела ген левансахарозы (sacB) в качестве второго положительного селективного маркера.
4) В итоговом сконструированном штамме не оставалось генетической информации, происходящей из плазмиды pDCM2.
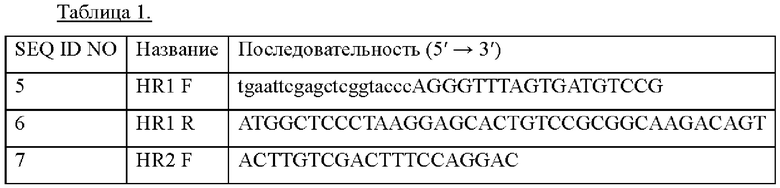
Пример 2. Конструирование плазмиды для усиления префенатдегидратазы Для усиления активности префенатдегидратазы (далее "pheA") создавали SEQ ID NO: 4 путем модифицирования частичной последовательности на основе мутированного промотора lysC (US 8426577 В2), известного как сильный промотор, синтезированного с привлечением службы синтеза генов Bionix Co., Ltd., и обозначенного PlysCm1. Промотор PlysCm1 использовали для конструирования плазмиды для усиления активности префенатдегидратазы посредством дополнительной вставки гена pheA или замены промотора дикого типа гена pheA на PlysCm1. Пример 2-1. Конструирование плазмиды для встраивания гена Для дополнительного встраивания гена pheA с промотором PlysCm1, расположенные в направлении против и по ходу транскрипции области для гомологичной рекомбинации с хромосомой амплифицировали с применением хромосомной ДНК Corynebacterium glutamicum дикого типа АТСС13869 в качестве матрицы наряду с парой праймеров с SEQ ID NO: 5 и SEQ ID NO: 6, а также пары праймеров с SEQ ID NO: 7 и SEQ ID NO: 8, с получением генных фрагментов, соответственно. Использованные последовательности праймеров приведены в Таблице 1 ниже.

Осуществляли ПЦР для получения фрагментов. В качестве полимеразы использовали ДНК-полимеразу Solg™ Pfu-X и проводили ПЦР-амплификацию в следующих условиях: денатурация при 95°С в течение 4 мин; 30 циклов денатурации при 95°С в течение 30 сек, отжига при 60°С в течение 30 сек и полимеризации при 72°С в течение 50 сек; и затем элонгация при 72°С в течение 5 мин.
Фрагмент промотора PlysCm1 получали с применением синтезированной ранее SEQ ID NO: 4 в качестве матрицы наряду с SEQ ID NO: 9 и SEQ ID NO: 10. Дополнительно получали фрагмент гена pheA (SEQ ID NO: 2) с использованием хромосомной ДНК Corynebacterium glutamicum дикого типа АТСС13869 в качестве матрицы наряду с SEQ ID NO: 11 и SEQ ID NO: 12. Использованные последовательности праймеров приведены в Таблице 2 ниже.

В качестве полимеразы использовали ДНК-полимеразу Solg™ Pfu-X и проводили ПЦР-амплификацию в следующих условиях: денатурация при 95°С в течение 4 мин; 27 циклов денатурации при 95°С в течение 30 сек, отжига при 60°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и затем элонгация при 72°С в течение 5 мин.
Расположенные в направлении против и по ходу транскрипции фрагменты для гомологичной рекомбинации с хромосомой, фрагмент промотора PlysCm1 и фрагмент гена pheA и вектор pDCM2 для трансформации хромосомы, расщепленный рестрикционным ферментом SmaI, которые получали при помощи процессов, указанных выше, клонировали, используя метод сборки по Гибсону (D.G. Gibson et al., NATURE METHODS, Vol.6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix) с получением рекомбинантной плазмиды, которую далее обозначали pDCM2-Tn::PlysCm1_pheA.
Пример 2-2. Конструирование плазмиды для замены промотора
Предпринимали попытку конструирования плазмиды, обладающей усиленной активностью префенатдегидратазы, путем замены промотора дикого типа гена pheA на PlysCm1. В частности, генный фрагмент расположенной в направлении против хода транскрипции области промотора дикого типа гена pheA для гомологичной рекомбинации с хромосомой получали с применением хромосомной ДНК Corynebacterium glutamicum дикого типа (АТСС13869) в качестве матрицы наряду с парой праймеров с SEQ ID NO: 13 и SEQ ID NO: 14. Кроме того, получали генный фрагмент, содержащий как промотор PlysCm1, так и область, расположенную в направлении по ходу транскрипции от него, с использованием ранее сконструированной плазмиды pDCM2-Tn::PlysCm1_pheA в качестве матрицы наряду с SEQ ID NO: 15 и SEQ ID NO: 16. Использованные последовательности праймеров приведены в Таблице 3 ниже.

Для получения вышеупомянутых фрагментов в качестве полимеразы использовали ДНК-полимеразу Solg™ Pfu-X и проводили ПЦР-амплификацию в следующих условиях: денатурация при 95°С в течение 4 мин; 27 циклов денатурации при 95°С в течение 30 сек, отжига при 60°С в течение 30 сек и полимеризации при 72°С в течение 50 сек; и затем элонгация при 72°С в течение 5 мин.
Расположенный в направлении против хода транскрипции фрагмент промотора pheA, промотор и расположенный в направлении по ходу транскрипции фрагмент, содержащий PlysCm1, и вектор pDCM2 для трансформации хромосомы, расщепленный рестрикционным ферментом SmaI, которые получали при помощи процессов, указанных выше, клонировали, используя метод сборки по Гибсону с получением рекомбинантной плазмиды, которую далее обозначали pDCM2-Pn::PlysCm1_pheA.
Пример 3. Конструирование штамма, обладающего усиленной активностью префенатдегидратазы, и продуцирование триптофана
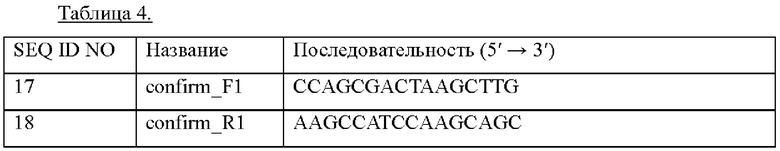
Сконструированной в Примере 2-1 pDCM2-Tn::PlysCm1_pheA трансформировали посредством электропорации (Appl. Microbiol. Biotechnol. (1999) 52:541-545), штамм СА04-8405 (KCCM12099P, US 2020-0063219 A1), сконструированный путем внедрения гена (Регистрационный номер NZ_LFLU01000012.1), кодирующего мембранный белок, происходящий из Herbaspirillum rhizosphaerae, в штамм СА04-8352 (патент Кореи №10-1968317), с последующим вторичным кроссинговером с получением штамма, в который был дополнительно встроен ген PlysCm1_pheA. Встраивание соответствующего гена верифицировали при помощи ПЦР-амплификации и секвенирования генома с использованием пары праймеров с SEQ ID NO: 17 и SEQ ID NO: 18, способных амплифицировать сайты, расположенные в направлении против и по ходу транскрипции от областей, где произошла гомологичная рекомбинация, соответственно. Штамм с встроенным геном обозначали СМ05-9157. Использованные последовательности праймеров приведены в Таблице 4 ниже.
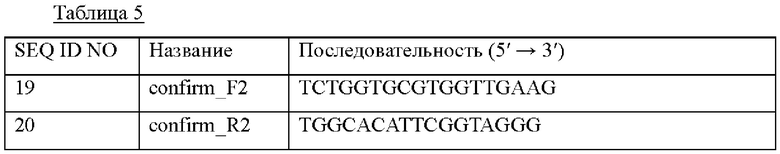
Сконструированной в Примере 2-2 pDCM2-Pn::PlysCm1_pheA трансформировали штамм СА04-8405 посредством электропорации согласно способу, описанному выше, с последующим вторичным кроссинговером, получая штамм, в котором промотор дикого типа pheA был заменен промотором PlysCm1. Замену промотора подтверждали при помощи ПЦР-амплификации и секвенирования генома с использованием пары праймеров с SEQ ID NO: 19 и SEQ ID NO: 20, способных амплифицировать сайты, расположенные в направлении против и по ходу транскрипции от областей, где произошла гомологичная рекомбинация, соответственно. Штамм с замененным промотором обозначали СМ05-9158. Использованные последовательности праймеров приведены в Таблице 5 ниже.
Для исследования продуцирования триптофана штаммами СМ05-9157 и СМ05-9158, сконструированными посредством вышеупомянутых способов, осуществляли культивирование таким же способом, как описано ниже, и сравнивали полученное количество триптофана с таковым штамма СА04-8405, служившего контролем. Каждым штаммом инокулировали 25 мл среды для посева, находящейся в конической колбе с дефлекторами объемом 250 мл, и культивировали при встряхивании со скоростью 200 об./мин при температуре 30°С в течение 20 часов. После культивирования 1 мл посевной культуры инокулировали в 25 мл среды для продуцирования, находящейся в конической колбе с дефлекторами объемом 250 мл, приготовленной для каждого штамма в трипликатах, и культивировали при встряхивании со скоростью 200 об./мин при температуре 30°С в течение 24 часов. По окончании культивирования при встряхивании измеряли количество полученного L-триптофана при помощи ВЭЖХ (высокоэффективная жидкостная хроматография).
Среда для посева (рН 7,0)
глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4 × 7 H2O 0,5 г, биотин 100 мкг, тиамин-HCl 1000 мкг, кальция пантотенат 2000 мкг, никотинамид 2000 мкг (из расчета на 1 л дистиллированной воды).
Среда для продуцирования (рН 7,0)
Глюкоза 30 г, (NH4)2SO4 15 г, MgSO4 × 7H2O 1,2 г, KH2PO4 1 г, дрожжевой экстракт 5 г, биотин 900 мкг, тиамина гидрохлорид 4500 мкг, кальция пантотенат 4500 мкг, СаСО3 30 г (из расчета на 1 л дистиллированной воды).
Результаты, демонстрирующие продуцирование L-триптофана штаммом СА04-8405 и штаммами СМ05-9157 и СМ05-9158 с усиленной экспрессией pheA в среде, приведены в Таблице 6 ниже.
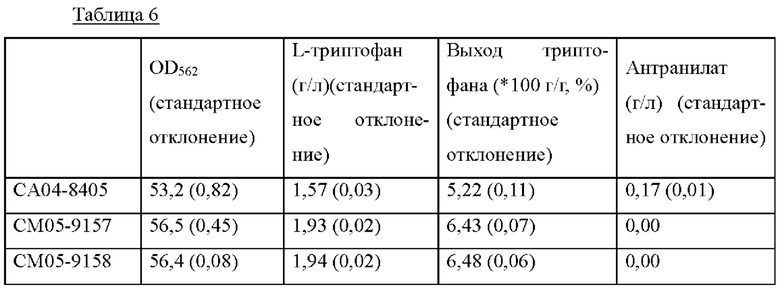
В результате культивирования штаммов СМ05-9157 и СМ05-9158 с усиленной экспрессией pheA штаммы продуцировали L-триптофан в количестве 1,93 г/л и 1,94 г/л, соответственно. Эти результаты указывают на увеличение приблизительно на 0,37 г/л и улучшение выхода ферментации приблизительно на 23-24% по сравнению с контрольным штаммом СА04-8405. Также подтвердили, что вследствие усиления экспрессии pheA снижалось продуцирование антранилата, что приводило к увеличению количества продуцируемого триптофана.
Штамм СМ05-9157 был депонирован в Корейском центре культур микроорганизмов (KCCM), являющемся международным органом по депонированию, 20 февраля 2020 г, в соответствии с положениями Будапештского договора, и ему был присвоен регистрационный номер KCCM12670P.
На основании вышеизложенного специалисты в области техники, к которой относится данное изобретение, поймут, что возможны и другие воплощения данного изобретения, не изменяющие технической концепции или существенных признаков данного изобретения. Таким образом, описанные выше воплощения следует рассматривать только в качестве примеров, не ограничивающих объем данного изобретения. Следует понимать, что объем изобретения ограничен прилагаемой формулой, и все изменения или модификации, вытекающие из определений и объема формулы изобретения, а также их эквиваленты, входят в объем данного изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> СПОСОБ ПОЛУЧЕНИЯ L-ТРИПТОФАНА ПОСРЕДСТВОМ УСИЛЕНИЯ АКТИВНОСТИ
ПРЕФЕНАТДЕГИДРАТАЗЫ
<130> OPA21060
<150> KR 10-2020-0032783
<151> 2020-03-17
<160> 20
<170> KoPatentIn 3.0
<210> 1
<211> 201
<212> PRT
<213> Unknown
<220>
<223> C.glutamicum pheA
<400> 1
Met Ser Asp Ala Pro Ile Val Val Ala Tyr Leu Gly Pro Ala Gly Thr
1 5 10 15
Phe Thr Glu Glu Ala Leu Tyr Lys Phe Ala Asp Ala Gly Val Phe Gly
20 25 30
Asp Gly Glu Ile Glu Gln Leu Pro Ala Lys Ser Pro Gln Glu Ala Val
35 40 45
Asp Ala Val Arg His Gly Thr Ala Gln Phe Ala Val Val Ala Ile Glu
50 55 60
Asn Phe Val Asp Gly Pro Val Thr Pro Thr Phe Asp Ala Leu Asp Gln
65 70 75 80
Gly Ser Asn Val Gln Ile Ile Ala Glu Glu Glu Leu Asp Ile Ala Phe
85 90 95
Ser Ile Met Val Arg Pro Gly Thr Ser Leu Ala Asp Val Lys Thr Leu
100 105 110
Ala Thr His Pro Val Gly Tyr Gln Gln Val Lys Asn Trp Met Ala Thr
115 120 125
Thr Ile Pro Asp Ala Met Tyr Leu Ser Ala Ser Ser Asn Gly Ala Gly
130 135 140
Ala Gln Met Val Ala Glu Gly Thr Ala Asp Ala Ala Ala Ala Pro Ser
145 150 155 160
Arg Ala Ala Glu Leu Phe Gly Leu Glu Arg Leu Val Asp Asp Val Ala
165 170 175
Asp Val Arg Gly Ala Arg Thr Arg Phe Val Ala Val Gln Ala Gln Ala
180 185 190
Ala Val Ser Glu Pro Thr Gly His Asp
195 200
<210> 2
<211> 603
<212> DNA
<213> Unknown
<220>
<223> C.glutamicum pheA
<400> 2
atgagcgacg caccaattgt tgtggcctat ttggggcctg ccggaacctt caccgaagaa 60
gccctctaca aatttgccga cgccggcgta ttcggcgacg gtgagatcga gcagctacca 120
gccaaatcgc cacaagaagc tgtcgacgcg gtccgccacg gcaccgccca gttcgcggtg 180
gtcgccatcg aaaacttcgt cgacggcccc gtcaccccca ccttcgacgc ccttgaccag 240
ggctccaacg tgcaaatcat cgccgaagaa gaactcgata ttgccttttc catcatggtc 300
cggccaggga cttcgcttgc cgacgtcaaa accctcgcca cccacccggt tgggtaccaa 360
caagtgaaaa actggatggc aaccaccatt ccggacgcca tgtatctttc agcaagctcc 420
aacggcgccg gcgcacaaat ggttgccgaa ggaaccgccg acgcagccgc agcgccctcc 480
cgcgcagccg aactcttcgg actggaacgc cttgttgatg atgtcgccga cgtccgcggc 540
gcccgcaccc gcttcgttgc agtccaagcc caagcagccg tttccgaacc gaccggccac 600
gac 603
<210> 3
<211> 5803
<212> DNA
<213> Artificial Sequence
<220>
<223> pDCM2
<400> 3
gttcgcttgc tgtccataaa accgcccagt ctagctatcg ccatgtaagc ccactgcaag 60
ctacctgctt tctctttgcg cttgcgtttt cccttgtcca gatagcccag tagctgacat 120
tcatccgggg tcagcaccgt ttctgcggac tggctttcta cgtgttccgc ttcctttagc 180
agcccttgcg ccctgagtgc ttgcggcagc gtgaagctag cttttatcgc cattcgccat 240
tcaggctgcg caactgttgg gaagggcgat cggtgcgggc ctcttcgcta ttacgccagc 300
tggcgaaagg gggatgtgct gcaaggcgat taagttgggt aacgccaggg ttttcccagt 360
cacgacgttg taaaacgacg gccagtgaat tcgagctcgg tacccgggga tcctctagag 420
tcgacctgca ggcatgcaag cttggcgtaa tcatggtcat agctgtttcc tgtgtgaaat 480
tgttatccgc tcacaattcc acacaacata cgagccggaa gcataaagtg taaagcctgg 540
ggtgcctaat gagtgagcta actcacatta attgcgttgc gctcactgcc cgctttccag 600
tcgggaaacc tgtcgtgcca gctgcattaa tgaatcggcc aacgcgcggg gagaggcggt 660
ttgcgtattg ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc ggtcgttcgg 720
ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac agaatcaggg 780
gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa ccgtaaaaag 840
gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca caaaaatcga 900
cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc gtttccccct 960
ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata cctgtccgcc 1020
tttctccctt cgggaagcgt ggcgctttct caatgctcac gctgtaggta tctcagttcg 1080
gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca gcccgaccgc 1140
tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga cttatcgcca 1200
ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg tgctacagag 1260
ttcttgaagt ggtggcctaa ctacggctac actagaagga cagtatttgg tatctgcgct 1320
ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg caaacaaacc 1380
accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag aaaaaaagga 1440
tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa cgaaaactca 1500
cgttaaggga ttttggtcat gagattatca aaaaggatct tcacctagat ccttttgggg 1560
tgggcgaaga actccagcat gagatccccg cgctggagga tcatccagcc ctgatagaaa 1620
cagaagccac tggagcacct caaaaacacc atcatacact aaatcagtaa gttggcagca 1680
tcacccgacg cactttgcgc cgaataaata cctgtgacgg aagatcactt cgcagaataa 1740
ataaatcctg gtgtccctgt tgataccggg aagccctggg ccaacttttg gcgaaaatga 1800
gacgttgatc ggcacgtaag aggttccaac tttcaccata atgaaataag atcactaccg 1860
ggcgtatttt ttgagttatc gagattttca ggagctgata gaaacagaag ccactggagc 1920
acctcaaaaa caccatcata cactaaatca gtaagttggc agcatcaccc gacgcacttt 1980
gcgccgaata aatacctgtg acggaagatc acttcgcaga ataaataaat cctggtgtcc 2040
ctgttgatac cgggaagccc tgggccaact tttggcgaaa atgagacgtt gatcggcacg 2100
taagaggttc caactttcac cataatgaaa taagatcact accgggcgta ttttttgagt 2160
tatcgagatt ttcaggagct ctttggcatc gtctctcgcc tgtcccctca gttcagtaat 2220
ttcctgcatt tgcctgtttc cagtcggtag atattccaca aaacagcagg gaagcagcgc 2280
ttttccgctg cataaccctg cttcggggtc attatagcga ttttttcggt atatccatcc 2340
tttttcgcac gatatacagg attttgccaa agggttcgtg tagactttcc ttggtgtatc 2400
caacggcgtc agccgggcag gataggtgaa gtaggcccac ccgcgagcgg gtgttccttc 2460
ttcactgtcc cttattcgca cctggcggtg ctcaacggga atcctgctct gcgaggctgg 2520
ccggctaccg ccggcgtaac agatgagggc aagcggatgg ctgatgaaac caagccaacc 2580
aggaagggca gcccacctat caaggtgtac tgccttccag acgaacgaag agcgattgag 2640
gaaaaggcgg cggcggccgg catgagcctg tcggcctacc tgctggccgt cggccagggc 2700
tacaaaatca cgggcgtcgt ggactatgag cacgtccgcg agggcgtccc ggaaaacgat 2760
tccgaagccc aacctttcat agaaggcggc ggtggaatcg aaatctcgtg atggcaggtt 2820
gggcgtcgct tggtcggtca tttcgaaaaa ggttaggaat acggttagcc atttgcctgc 2880
ttttatatag ttcantatgg gattcacctt tatgttgata agaaataaaa gaaaatgcca 2940
ataggatatc ggcattttct tttgcgtttt tatttgttaa ctgttaattg tccttgttca 3000
aggatgctgt ctttgacaac agatgttttc ttgcctttga tgttcagcag gaagctcggc 3060
gcaaacgttg attgtttgtc tgcgtagaat cctctgtttg tcatatagct tgtaatcacg 3120
acattgtttc ctttcgcttg aggtacagcg aagtgtgagt aagtaaaggt tacatcgtta 3180
ggcggatcaa gatccatttt taacacaagg ccagttttgt tcagcggctt gtatgggcca 3240
gttaaagaat tagaaacata accaagcatg taaatatcgt tagacgtaat gccgtcaatc 3300
gtcatttttg atccgcggga gtcagtgaac aggtaccatt tgccgttcat tttaaagacg 3360
ttcgcgcgtt caatttcatc tgttactgtg ttagatgcaa tcagcggttt catcactttt 3420
ttcagtgtgt aatcatcgtt tagctcaatc ataccgagag cgccgtttgc taactcagcc 3480
gtgcgttttt tatcgctttg cagaagtttt tgactttctt gacggaagaa tgatgtgctt 3540
ttgccatagt atgctttgtt aaataaagat tcttcgcctt ggtagccatc ttcagttcca 3600
gtgtttgctt caaatactaa gtatttgtgg cctttatctt ctacgtagtg aggatctctc 3660
agcgtatggt tgtcgcctga gctgtagttg ccttcatcga tgaactgctg tacattttga 3720
tacgtttttc cgtcaccgtc aaagattgat ttataatcct ctacaccgtt gatgttcaaa 3780
gagctgtctg atgctgatac gttaacttgt gcagttgtca gtgtttgttt gccgtaatgt 3840
ttaccggaga aatcagtgta gaataaacgg atttttccgt cagatgtaaa tgtggctgaa 3900
cctgaccatt cttgtgtttg gtcttttagg atagaatcat ttgcatcgaa tttgtcgctg 3960
tctttaaaga cgcggccagc gtttttccag ctgtcaatag aagtttcgcc gactttttga 4020
tagaacatgt aaatcgatgt gtcatccgca tttttaggat ctccggctaa tgcaaagacg 4080
atgtggtagc cgtgatagtt tgcgacagtg ccgtcagcgt tttgtaatgg ccagctgtcc 4140
caaacgtcca ggccttttgc agaagagata tttttaattg tggacgaatc aaattcagaa 4200
acttgatatt tttcattttt ttgctgttca gggatttgca gcatatcatg gcgtgtaata 4260
tgggaaatgc cgtatgtttc cttatatggc ttttggttcg tttctttcgc aaacgcttga 4320
gttgcgcctc ctgccagcag tgcggtagta aaggttaata ctgttgcttg ttttgcaaac 4380
tttttgatgt tcatcgttca tgtctccttt tttatgtact gtgttagcgg tctgcttctt 4440
ccagccctcc tgtttgaaga tggcaagtta gttacgcaca ataaaaaaag acctaaaata 4500
tgtaaggggt gacgccaaag tatacacttt gccctttaca cattttaggt cttgcctgct 4560
ttatcagtaa caaacccgcg cgatttactt ttcgacctca ttctattaga ctctcgtttg 4620
gattgcaact ggtctatttt cctcttttgt ttgatagaaa atcataaaag gatttgcaga 4680
ctacgggcct aaagaactaa aaaatctatc tgtttctttt cattctctgt attttttata 4740
gtttctgttg catgggcata aagttgcctt tttaatcaca attcagaaaa tatcataata 4800
tctcatttca ctaaataata gtgaacggca ggtatatgtg atgggttaaa aaggatcacc 4860
ccagagtccc gctcagaaga actcgtcaag aaggcgatag aaggcgatgc gctgcgaatc 4920
gggagcggcg ataccgtaaa gcacgaggaa gcggtcagcc cattcgccgc caagctcttc 4980
agcaatatca cgggtagcca acgctatgtc ctgatagcgg tccgccacac ccagccggcc 5040
acagtcgatg aatccagaaa agcggccatt ttccaccatg atattcggca agcaggcatc 5100
gccatgggtc acgacgagat cctcgccgtc gggcatccgc gccttgagcc tggcgaacag 5160
ttcggctggc gcgagcccct gatgctcttc gtccagatca tcctgatcga caagaccggc 5220
ttccatccga gtacgtgctc gctcgatgcg atgtttcgct tggtggtcga atgggcaggt 5280
agccggatca agcgtatgca gccgccgcat tgcatcagcc atgatggata ctttctcggc 5340
aggagcaagg tgagatgaca ggagatcctg ccccggcact tcgcccaata gcagccagtc 5400
ccttcccgct tcagtgacaa cgtcgagaca gctgcgcaag gaacgcccgt cgtggccagc 5460
cacgatagcc gcgctgcctc gtcttggagt tcattcaggg caccggacag gtcggtcttg 5520
acaaaaagaa ccgggcgccc ctgcgctgac agccggaaca cggcggcatc agagcagccg 5580
attgtctgtt gtgcccagtc atagccgaat agcctctcca cccaagcggc cggagaacct 5640
gcgtgcaatc catcttgttc aatcatgcga aacgatcctc atcctgtctc ttgatcagat 5700
cttgatcccc tgcgccatca gatccttggc ggcaagaaag ccatccagtt tactttgcag 5760
ggcttcccaa ccttaccaga gggcgcccca gctggcaatt ccg 5803
<210> 4
<211> 366
<212> DNA
<213> Artificial Sequence
<220>
<223> PlysCm1
<400> 4
gctccttagg gagccatctt ttggggtgcg gagcgcgatc cggtgtctga ccacggtgcc 60
ccatgcgatt gttaatgccg atgctagggc gaaaagcacg gcgagcagat tgctttgcac 120
ttgattcagg gtagttgact aaagagttgc tcgcgaagta gcacctgtca cttttgtctc 180
aaatattaaa tcgaatatca atatatggtc tgtttattgg aacgcgtccc agtggctgag 240
acgcatccgc taaagcccca ggaaccctgt gcagaaagaa aacactcctc tggctaggta 300
gacacagttt attgtggtag agttgagcgg gtaactgtca gcacgtagat cgaaaggtgc 360
acacat 366
<210> 5
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> HR1 F
<400> 5
tgaattcgag ctcggtaccc agggtttagt gatgtccg 38
<210> 6
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> HR1 R
<400> 6
atggctccct aaggagcact gtccgcggca agacagt 37
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> HR2 F
<400> 7
acttgtcgac tttccaggac 20
<210> 8
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> HR2 R
<400> 8
gtcgactcta gaggatcccc cgcaacgcat gctgaa 36
<210> 9
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> PlysCm1 F
<400> 9
actgtcttgc cgcggacagt gctccttagg gagccat 37
<210> 10
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> PlysCm1 R
<400> 10
cgtcgctcat atgtgtgcac ctttcga 27
<210> 11
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> PheA F
<400> 11
gtgcacacat atgagcgacg caccaat 27
<210> 12
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> PheA R
<400> 12
gtcctggaaa gtcgacaagt ctagttaagt ttccttcctt cg 42
<210> 13
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> UP F
<400> 13
tgaattcgag ctcggtaccc acgcacttgg gtggccac 38
<210> 14
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> UP R
<400> 14
atggctccct aaggagcact gtccgcggca agacagt 37
<210> 15
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> PlysCm1 F2
<400> 15
acttgtcgac tttccaggac 20
<210> 16
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> pheA partial R
<400> 16
gtcgactcta gaggatcccc cgcaacgcat gctgaa 36
<210> 17
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> confirm_F1
<400> 17
ccagcgacta agcttg 16
<210> 18
<211> 16
<212> DNA
<213> Artificial Sequence
<220>
<223> confirm_R1
<400> 18
aagccatcca agcagc 16
<210> 19
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> confirm_F2
<400> 19
tctggtgcgt ggttgaag 18
<210> 20
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> confirm_R2
<400> 20
tggcacattc ggtaggg 17
<---
Изобретение относится к биотехнологии. Предложен микроорганизм, обладающий повышенной способностью продуцировать L-триптофан по сравнению с микроорганизмом дикого типа и обладающий усиленной по сравнению с эндогенной активностью префенатдегидратазы, где указанная усиленная активность получена путем увеличения числа копий гена, кодирующего префенатдегидратазу, или замены промотора указанного гена сильным промотором. Также предложены способ получения L-триптофана, включающий культивирование указанного микроорганизма, композиция для получения L-триптофана, содержащая указанный микроорганизм, применение указанного микроорганизма для получения L-триптофана. Изобретение обеспечивает получение L-триптофана с высоким выходом. 4 н. и 4 з.п. ф-лы, 1 ил., 6 табл., 3 пр.
1. Микроорганизм, обладающий повышенной способностью продуцировать L-триптофан по сравнению с микроорганизмом дикого типа и обладающий усиленной по сравнению с эндогенной активностью префенатдегидратазы, где указанная усиленная активность получена путем увеличения числа копий гена, кодирующего префенатдегидратазу, или замены промотора указанного гена сильным промотором.
2. Микроорганизм по п. 1, где префенатдегидратаза содержит аминокислотную последовательность SEQ ID NO: 1 или аминокислотную последовательность, идентичную ей по меньшей мере на 90%.
3. Микроорганизм по п. 1, где указанный микроорганизм представляет собой Corynebacterium sp.
4. Микроорганизм по п. 3, где указанный микроорганизм представляет собой Corynebacterium glutamicum.
5. Способ получения L-триптофана, включающий культивирование микроорганизма по любому из пп. 1-4.
6. Способ по п. 5, дополнительно включающий выделение L-триптофана из культуральной среды или микроорганизма.
7. Композиция для получения L-триптофана, содержащая микроорганизм по любому из пп. 1-4 и культуральную среду.
8. Применение микроорганизма для получения L-триптофана, где указанный микроорганизм обладает повышенной способностью продуцировать L-триптофан по сравнению с микроорганизмом дикого типа и усиленной по сравнению с эндогенной активностью префенатдегидратазы, где указанная усиленная активность получена путем увеличения числа копий гена, кодирующего префенатдегидратазу, или замены промотора указанного гена сильным промотором.
| IKEDA М | |||
| et al | |||
| Metabolic Engineering To Produce Tyrosine or Phenylalanine in a Tryptophan-Producing Corynebacterium glutamicum Strain | |||
| APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Mar | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ ИСПОЛЬЗОВАНИЯ АТМОСФЕРНОГО ЭЛЕКТРИЧЕСТВА | 1924 |
|
SU781A1 |
| база данных NCBI Reference Sequence: WP_060565330.1, 26.12.2019 | |||
| MULTISPECIES: prephenate dehydratase [Corynebacterium] | |||
| Найдено | |||
Авторы
Даты
2024-03-05—Публикация
2021-03-05—Подача