Изобретение относится к санитарной и медицинской микробиологии и может быть использовано для выявления молочнокислых микроорганизмов в пищевых продуктах, кормах для животных, выяснения причин возникновения порчи пищевых продуктов, испытания проб окружающей среды, отобранных из зоны производства и переработки пищевых продуктов, а также для исследования микробиоты кишечника.
Молочнокислые бактерии играют важную роль в хозяйственной деятельности человека, в частности используются для ферментации молока, мяса, овощей, кормов для животных путем молочнокислого сбраживания. Многие виды молочнокислых микроорганизмов являются представителями нормофлоры кишечника человека и изменение их концентрации или видового состава может свидетельствовать о патологических изменениях в организме. В некоторых случаях данные микроорганизмы могут вызывать порчу продуктов питания, например пива или вареных колбас. В связи с этим выявление молочнокислых микроорганизмов является важной задачей. Основные схемы исследования по выявлению молочнокислых микроорганизмов, как в санитарной, так и в медицинской микробиологии ориентированы на классические культуральные методы с посевом на питательные среды.
В соответствии с ГОСТ 10444.11-2013 (ISO 15214:1998) «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов» рекомендован ряд питательных сред для культивирования молочнокислых микроорганизмов.
Для культивирования и выделения лактобактерий известна питательная среда MRS, в состав которой входят:
Недостатком данной питательной среды является то, что она предназначена только для культивирования представителей рода Lactobacillus и не предназначена для культивирования других молочнокислых микроорганизмов, кроме того она не обладает индикаторными свойствами, позволяющими определить изменения значения рН в процессе роста лактобактерий.
Для выделения молочнокислых микроорганизмов известны среда Бликфельдта плотная, в состав которой входят:
и среда Ли, в состав которой входят:
Недостатками данных питательных сред являются: наличие в составе кальция углекислого, который мало растворим в воде, что может приводить к неоднородности готовой питательной среды; необходимость дополнительно создавать микроаэрофильные условия для культивирования молочнокислых микроорганизмов, растущих при повышенной концентрации углекислого газа.
Наиболее близкой к предлагаемой питательной среде является Бликфельдта жидкая, в состав которой входят:
Для приготовления питательной среды растворяют компоненты или сухую готовую среду в воде при нагревании. С помощью рН-метра устанавливают значение рН, так чтобы после стерилизации он составлял от 7,2 до 7,4. Раствор компонентов разливают в пробирки и стерилизуют в автоклаве при температуре (117±1)°С в течение 15 мин. Приготовленная вышеуказанным способом питательная среда имеет светло-синий цвет и изменяет цвет до бледно-желтого при снижении рН ниже 6,0 в процессе роста молочнокислых микроорганизмов.
Питательная среда позволяет идентифицировать рост молочнокислых бактерий по изменению окраски среды с пурпурного (синего) на желтый благодаря наличию в составе кислотно-основного индикатора бромкрезолового пурпурового и не требует дополнительного создания микроаэрофильных условий при культивировании.
Недостатками данной питательной среды являются отсутствие компонентов, позволяющих стабилизировать начальное значение рН в диапазоне от 7,2 до 7,4, низкая чувствительность среды и скорость роста молочнокислых микроорганизмов, невозможность проведения первичной дифференциации выросших культур микроорганизмов по морфологии колоний, а также их количественный подсчет.
Техническим результатом предлагаемого изобретения является улучшение биологических показателей питательной среды, а именно стабилизация начального значения рН среды в диапазоне от 7,2 до 7,4, возможность проведения количественного подсчета выросших микроорганизмов, повышение чувствительности питательной среды (определяемая как минимальная концентрация засеянных микроорганизмов, позволяющая обнаружить их рост), увеличение скорости роста микроорганизмов (определяемое как время появления признаков роста микроорганизмов), улучшения дифференцирующих свойств среды (определяемых по изменению цвета питательной среды и типичной морфологии колоний различных видов микроорганизмов).
Технический результат при осуществлении изобретения по первому варианту достигается тем, что предлагаемая питательная среда для выявления молочнокислых бактерий, содержащая питательную основу, лактозу, глюкозу, экстракт дрожжевой и бромкрезоловый пурпуровый, в качестве питательной основы содержит панкреатический гидролизат казеина и дополнительно содержит полисорбат-80, натрий углекислый при следующем количественном содержании компонентов г/л:
Второй вариант предлагаемой питательной среды для выявления молочнокислых бактерий, содержащей питательную основу, лактозу, глюкозу, экстракт дрожжевой и бромкрезоловый пурпуровый, в качестве питательной основы содержит панкреатический гидролизат казеина и дополнительно содержит полисорбат-80, натрий углекислый и агар бактериологический при следующем количественном содержании компонентов г/л:
Отличием предлагаемой питательной среды от прототипа является замена в составе питательной среды пептона на панкреатический гидролизат казеина в концентрации 5,0 г/л и введение в состав среды полисорбата-80 в концентрации 0,5 г/л., что приводит к улучшению биологических показателей питательной среды. Введение в состав среды полисорбата-80 обосновывается тем, что этот компонент является источником жирных кислот для молочнокислых микроорганизмов и увеличивает скорость их роста. Экспериментальные данные, свидетельствуют о повышении чувствительности питательной среды по сравнению с прототипом.
Стабилизация значения рН питательной среды решается введением в состав питательной среды натрия углекислого в концентрации от 0,05 до 0,15 г/л в зависимости от значения рН остальных компонентов среды. Натрий углекислый в питательной среде не обладает буферным эффектом и не препятствует снижению значения рН в процессе роста молочнокислых микроорганизмов, что важно для их выявления по изменению окраски кислотно-основного индикатора бромкрезолового пурпурового.
Улучшение дифференцирующих свойств питательной среды решается увеличением концентрации бромкрезолового пурпурового с 0,01 до 0,025 г/л и снижением концентрации экстракта дрожжевого с 10,0 г/л до 4,0 г/л. Увеличение концентрации брокрезолового пурпурового повышает яркость цвета среды, что способствует более контрастному изменению ее цвета при изменении значения рН. Снижение концентрации экстракта дрожжевого обусловлено тем, что снижение белкового питания вероятно способствует более быстрому сбраживанию углеводов молочнокислыми микроорганизмами, что увеличивает скорость снижения значения рН и ведет к более быстрому изменению окраски среды с пурпурного (синего) на желтый.
Придание питательной среде свойств, позволяющих проводить количественный подсчет выросших микроорганизмов и их первичную дифференциацию по морфологии колоний, решается введением в состав питательной среды агара бактериологического в концентрации 0,9 г/л.
Ниже приведены примеры обоснования соотношения компонентов питательной среды для выделения молочнокислых микроорганизмов.
Пример приготовления питательной среды по первому варианту.
Навески компонентов питательной среды:
размешивают в 1 л дистиллированной воды, кипятят 2 мин, разливают по 9,0 мл в стеклянные пробирки и стерилизуют автоклавированием при температуре 112°С в течение 20 мин. Готовая питательная среда имеет насыщенный цвет от синего до пурпурного. В процессе культивирования молочнокислых микроорганизмов окраска питательной среды изменяется на интенсивный желтый при снижении значения рН ниже 6,0.
Пример приготовления питательной среды по второму варианту
Навески компонентов питательной среды:
размешивают в 1 л дистиллированной воды, кипятят 2 мин, разливают по 9,0 мл в стеклянные пробирки и стерилизуют автоклавированием при температуре 112°С в течение 20 мин. Готовая питательная среда имеет насыщенный цвет от синего до пурпурного. В процессе культивирования молочнокислых микроорганизмов окраска питательной среды изменяется на интенсивный желтый при снижении значения рН ниже 6,0.
В качестве тест-штаммов использовали культуры из Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск»:Lactobacillus plantarum В-4403 (8Р-А3) и Streptococcus thermophilus В-4517 (СТ-1). Посев осуществляли в 9,0 мл питательной среды по 1,0 мл микробных взвесей с концентрациями 103, 102 и 10 КОЕ/мл. Инкубацию проводили при температуре (37±1)°С.
Пример 1. Прототип питательной среды. Тест штаммы выращивали на питательной среде, содержащей пептон 5,0 г, лактозу 10,0 г, глюкозу 10,0 г, экстракт дрожжевой 10,0 г, бромкрезоловый пурпуровый 0,01 г, вода дистиллированная 1 л. Значение рН готовой среды 7,3 устанавливали с помощью раствора гидроокиси натрия концентрации 100 г/л. Готовая питательная среда имела бледно-синий цвет.
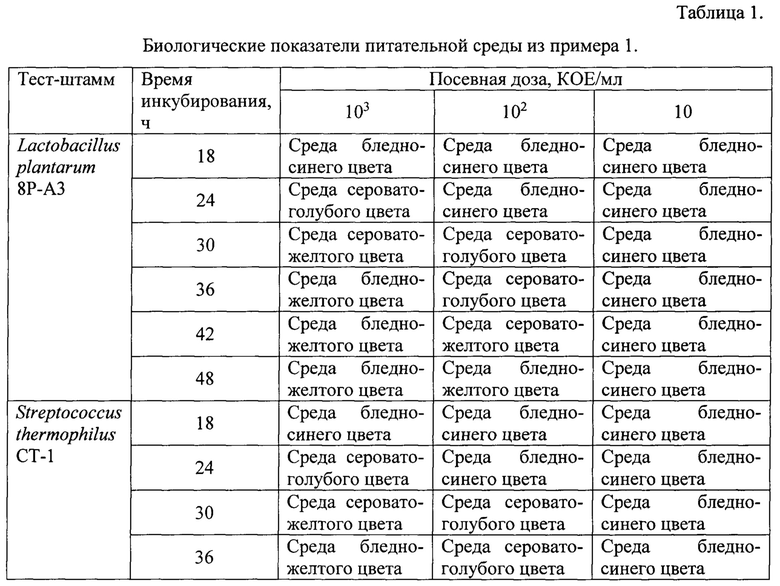

Результат инкубирования Streptococcus thermophilus СТ-1 через 36 ч представлен на фиг. 1 (приложение 1).
Пример 2. Тест штаммы выращивали на питательной среде, содержащей панкреатический гидролизат казеина 5,0 г, лактозу 10,0 г, глюкозу 10,0 г, экстракт дрожжевой 10,0 г, натрий углекислый 0,12 г, бромкрезоловый пурпуровый 0,01 г, вода дистиллированная 1 л. Значение рН готовой питательной среды 7,3. Готовая питательная среда имела бледно-синий цвет.
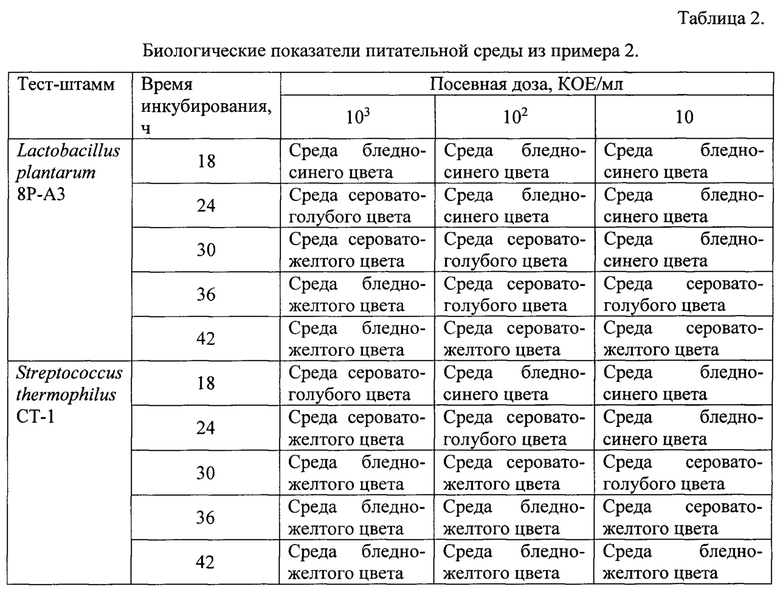
Питательная среда указанного состава не требовала дополнительного подведения значения рН и обладала более высокой чувствительностью по сравнению с прототипом, что позволило получить рост L. plantarum В-4403 и S. thermophilus В-4517 при посеве в 9,0 мл питательной среды по 1,0 мл микробных взвесей с концентрациями 10 КОЕ/мл.
Пример 3. Тест штаммы выращивали на питательной среде, содержащей панкреатический гидролизат казеина 5,0 г, лактозу 10,0 г, глюкозу 10,0 г, экстракт дрожжевой 10,0 г, натрий углекислый 0,12 г, бромкрезоловый пурпуровый 0,025 г, вода дистиллированная 1 л. Значение рН готовой питательной среды 7,3. Готовая питательная среда имела насыщенный синий цвет.
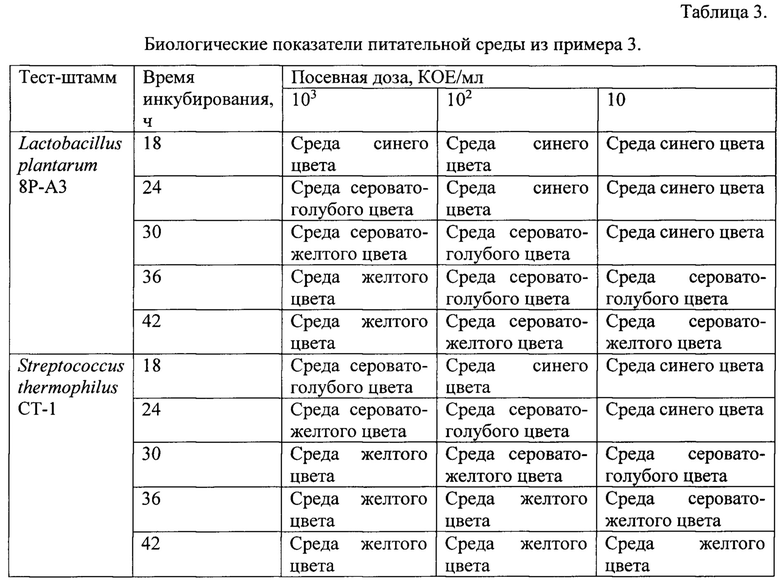
Питательная среда указанного состава обладала преимуществами среды из примера 2, при этом имела более яркий цвет, что способствовало более контрастному изменению ее цвета при изменении значения рН в процессе роста молочнокислых микроорганизмов.
Пример 4. Тест штаммы выращивали на питательной среде, содержащей панкреатический гидролизат казеина 5,0 г, лактозу 10,0 г, глюкозу 10,0 г, экстракт дрожжевой 4,0 г, натрий углекислый 0,12 г, бромкрезоловый пурпуровый 0,025 г, вода дистиллированная 1 л. Значение рН готовой питательной среды 7,3. Готовая питательная среда имела насыщенный синий цвет.

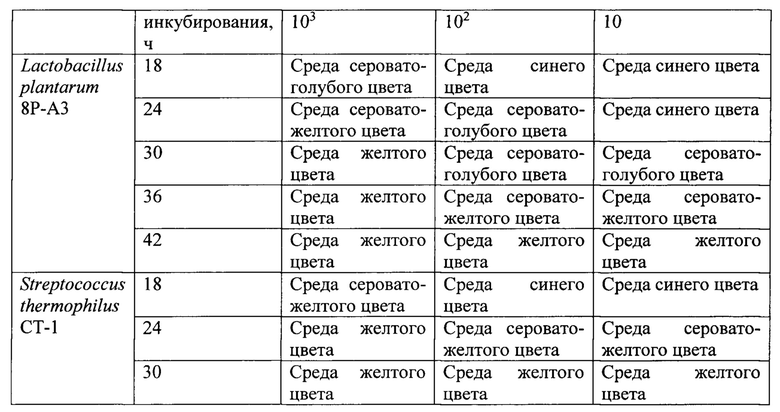
Питательная среда указанного состава обладала преимуществами среды из примера 3, при этом имела улучшенные дифференцирующие свойства.
Пример 5. Тест штаммы выращивали на питательной среде, содержащей панкреатический гидролизат казеина 5,0 г, полисорбат-80 0,5 г, лактозу 10,0 г, глюкозу 10,0 г, экстракт дрожжевой 4,0 г, натрий углекислый 0,12 г, бромкрезоловый пурпуровый 0,025 г, вода дистиллированная 1 л. Значение рН готовой питательной среды 7,3. Готовая питательная среда имела насыщенный синий цвет.
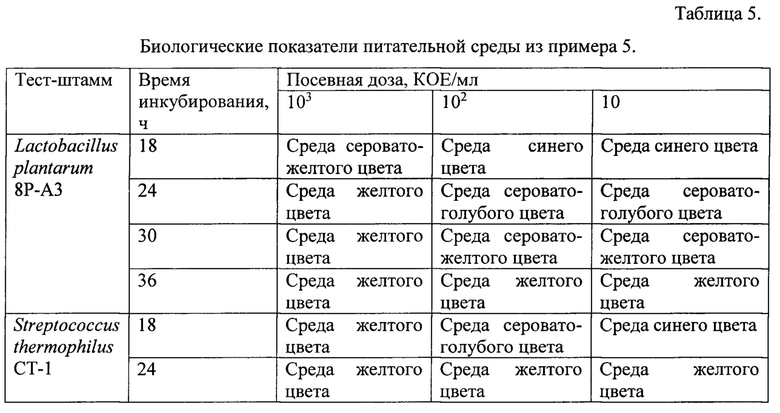
Питательная среда указанного состава обладала преимуществами среды из примера 4 и отличалась более высокой скоростью роста L. plantarum В-4403 и S. thermophilus В-4517. Результат инкубирования Streptococcus thermophilus СТ-1 через 20 ч представлен на фиг. 2 (приложение 2).
Пример 6. Тест штаммы выращивали на питательной среде, содержащей панкреатический гидролизат казеина 5,0 г, полисорбат-80 0,5 г, лактозу 10,0 г, глюкозу 10,0 г, экстракт дрожжевой 4,0 г, натрий углекислый 0,12 г, бромкрезоловый пурпуровый 0,025 г, агар бактериологический 0,9 г, вода дистиллированная 1 л. Значение рН готовой питательной среды 7,3. Готовая питательная среда имела насыщенный синий цвет.
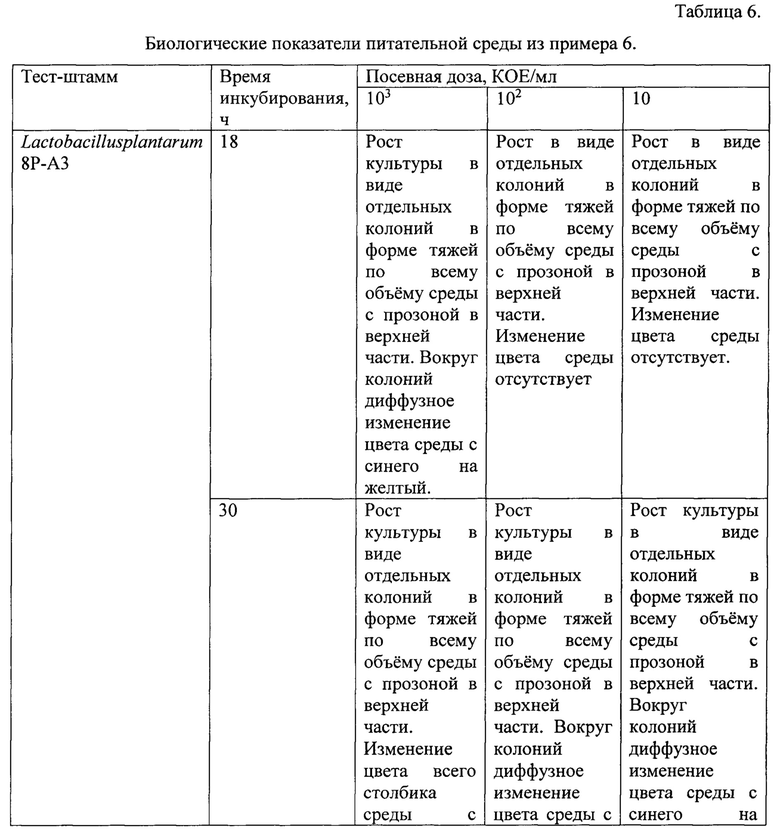
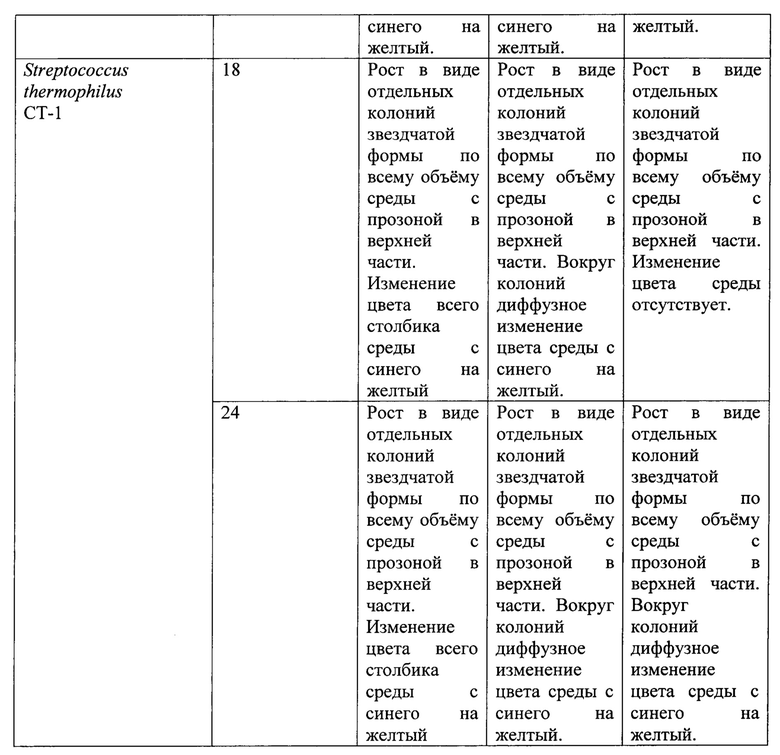
Питательная среда указанного состава обладала преимуществами среды из примера 5 и позволяла проводить количественный подсчет выросших микроорганизмов и их первичную дифференциацию по морфологии колоний. Результат инкубирования Streptococcus thermophilus СТ-1 через 20 ч представлен на фиг. 3 (приложение 3).
Таким образом, преимущества предлагаемой питательной среды в том, что она превосходит прототип по биологическим показателям, не требует дополнительного подведения начального значения рН, имеют более яркую цветовую дифференциацию при изменении значения рН, что облегчает визуальное определение роста микроорганизмов. Питательная среда по варианту 2 позволяет проводить количественный подсчет выросших микроорганизмов и их первичную дифференциацию по морфологии колоний.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ СТРЕПТОКОККОВ | 2006 |
|
RU2323969C1 |
| Питательная среда для выделения и культивирования Lactobacillus iners и других представителей вагинальной микробиоты | 2022 |
|
RU2794804C1 |
| Способ промышленного получения сухой питательной среды для выделения и культивирования Lactobacillus iners и других представителей вагинальной микробиоты | 2023 |
|
RU2825461C1 |
| СУХАЯ ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ОБНАРУЖЕНИЯ И УЧЕТА E.coli И КОЛИФОРМНЫХ БАКТЕРИЙ | 2012 |
|
RU2508399C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ | 2008 |
|
RU2399660C2 |
| Питательная среда для селективного выявления патогенных маннитположительных стафилококков | 2015 |
|
RU2620965C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ МЕНИНГОКОККОВ (МЕНИНГОАГАР) | 1996 |
|
RU2103368C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТАТИВНОГО ГИДРОЛИЗАТА ИЗ СВЕЖЕЙ БЕЛОКОЧАННОЙ КАПУСТЫ И ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ЛАКТОБАКТЕРИЙ НА ЕГО ОСНОВЕ | 2009 |
|
RU2415923C1 |
| СЕЛЕКТИВНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ПСЕВДОМОНАД, СУХАЯ | 2013 |
|
RU2530549C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ОПРЕДЕЛЕНИЯ ЛЕЦИТИНАЗНОЙ АКТИВНОСТИ У БАКТЕРИЙ РОДА Listeria | 2011 |
|
RU2444567C1 |



Группа изобретений относится к микробиологии и включает два варианта питательной среды для выявления молочнокислых бактерий. Жидкая питательная среда содержит панкреатический гидролизат казеина, лактозу, глюкозу, дрожжевой экстракт, полисорбат-80, натрий углекислый, бромкрезоловый пурпуровый и дистиллированную воду при заданном содержании компонентов. Плотная питательная среда дополнительно содержит агар бактериологический в заданном количестве. Предлагаемые питательные среды позволяют определять молочнокислых бактерий, проводить количественный подсчет выросших микроорганизмов, их первичную дифференциацию по морфологии колоний. 2 н.п. ф-лы, 3 ил., 6 табл., 6 пр.
1. Питательная среда для выявления молочнокислых бактерий, включающая в себя питательную основу, лактозу, глюкозу, экстракт дрожжевой, бромкрезоловый пурпуровый, воду дистиллированную, отличающаяся тем, что в качестве питательной основы она содержит панкреатический гидролизат казеина и дополнительно содержит полисорбат-80, натрий углекислый при следующем количественном содержании компонентов, г/л:
2. Питательная среда для выявления молочнокислых бактерий, включающая в себя питательную основу, лактозу, глюкозу, экстракт дрожжевой, бромкрезоловый пурпуровый, воду дистиллированную, отличающаяся тем, что в качестве питательной основы она содержит панкреатический гидролизат казеина и дополнительно содержит полисорбат-80, натрий углекислый и агар бактериологический при следующем количественном содержании компонентов, г/л:
| Электромагнитный ловильный аппарат для извлечения из буровых скважин металлических предметов | 1926 |
|
SU10444A1 |
| Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов | |||
| М.: Стандартинформ, 2014, с | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Устройство для автоматического контроля параметров электрических цепей | 1974 |
|
SU513331A1 |
| Продукты молочные | |||
| Йогурты | |||
| Общие технические условия, М.: Стадартинформ, 2008 с | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| ДОМОТЕНКО Л.В., ШЕПЕЛИН А.П., ДЕТУШЕВ К.В., Сравнительные испытания лактобакагара и MRS агара, Курский научно-практический Вестник "Человек и его здоровье", 2014, N 4, с | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Прибор для печатания коносаментов | 1930 |
|
SU29843A1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БИФИДОБАКТЕРИЙ | 2009 |
|
RU2388815C1 |
Авторы
Даты
2019-09-26—Публикация
2018-09-03—Подача