Настоящее изобретение относится к определенным конструкциям мультиспецифичных антител, к фармацевтическим композициям, содержащим эти конструкции, к ДНК, кодирующим эти конструкции, и к содержащим эти конструкции векторам. В объем настоящего изобретения также входит способ экспрессии таких конструкций, например, в клетке-хозяине, и способы создания фармацевтической композиции из этих конструкций. Настоящее изобретение также относится к применению конструкций мультиспецифичных антител и композиций для лечения.
Существует целый ряд подходов к созданию биспецифичных антител, многие из которых основаны на способе, впервые описанном авторами Morrison et al. (Coloma and Morrison 1997, Nat. Biotechnol. 15, 159-163). В этот способ входит слияние одноцепочечных вариабельных фрагментов (scFv) с целыми антителами, например, иммуноглобулином IgG, или с фрагментами антител, например, Fab или F(аb')2.
В патенте US2008/0050370 раскрыты некоторые молекулы биспецифичных антител, которые содержат "стабилизированные" scFv. Молекулы этого типа обладают хорошей аффинностью связывания с антигенами, к которым они специфичны, и в этой структуре не происходит значительной окклюзии антигенсвязывающих сайтов. Вариабельные домены VH и VL из scFv, задействованные в таких биспецифичных молекулах, удерживаются вместе с помощью пептидных линкеров. Тем не менее, в некоторых комбинациях вариабельных VH и VL доменов пептидные линкеры не способны придать scFv достаточную стабильность, что приводит к "дыханию" вариабельного домена и беспорядочному межмолекулярному спариванию с вариабельными доменами и, таким образом, во время экспрессии и после их очистки молекулы приобретают склонность к образованию мультимеров с помощью их одноцепочечного вариабельного фрагмента Fv.
Авторы настоящего изобретения заново сконструировали молекулы мультиспецифичных антител в целях придания молекулам антител таких же функциональных возможностей, и одновременно минимизировали их агрегацию во время экспрессии и после очистки, что способствовало увеличению количества полученного "мономерного" материала и обеспечило получение молекул подходящей стабильности после их очистки, концентрации и создания композиции для применения в лечении.
Таким образом, в одном аспекте настоящее изобретение относится к молекуле мультиспецифичного антитела, которая содержит или состоит из:
а) полипептидной цепи, имеющей формулу (I):
VH-CH1-CH2-CH3-X-(V1)p; и
b) полипептидной цепи, имеющей формулу (II)
VL-CL-Y-(V2)q;
в которой:
VH1 представляет собой вариабельный домен тяжелой цепи;
CH1 представляет собой домен константной области тяжелой цепи, например, ее домен 1;
СН2 представляет собой домен константной области тяжелой цепи, например, ее домен 2;
СН3 представляет собой домен константной области тяжелой цепи, например, ее домен 3;
Х представляет собой связь или линкер;
Y представляет собой связь или линкер;
V1 представляет собой двухцепочечный вариабельный фрагмент dsFv, однодоменное антитело sdAb, стабилизированный дисульфидной связью одноцепочечный вариабельный фрагмент dsscFv или scFv, например, dsFv, dsscFv или scFv;
VL представляет собой вариабельный домен, например, вариабельный домен легкой цепи;
CL представляет собой домен константной области, например, домен константной области легкой цепи, такой как C-каппа;
V2 представляет собой dsFv, sdAb, dsscFv или scFv, например, dsFv, dsscFv или scFv;
р равно 0 или 1;
q равно 0 или 1;
при этом, по меньшей мере, одно из значений р или q равно 1, и
при этом, по меньшей мере, один из V1 или V2 представляет собой dsFv, и
если V1 представляет собой dsFv, и р равно 1, и q равно 0, то молекулу получают в виде димера с двумя тяжелыми цепями формулы (I) и двумя связанными легкими цепями формулы (II).
В одном варианте осуществления, если V2 представляет собой dsFv, и р равно 0, и q равно 1, то молекулу получают в виде димера с двумя тяжелыми цепями формулы (I) и двумя связанными легкими цепями формулы (II).
В одном варианте осуществления р равно 1, V1 представляет собой dsFv и q равно 0, и имеются по меньшей мере две полипептидные цепи формулы (I), например, в виде полноразмерного антитела с двумя тяжелыми цепями (с формулой (I)) и двумя легкими цепями (с формулой (II)), которые собраны в Y-образную молекулу.
В одном варианте осуществления изобретение относится к молекуле мультиспецифичного антитела, которая содержит или состоит из:
а) полипептидной цепи формулы (Iа):
VH-CH1-CH2-CH3-X-V1;
b) полипептидной цепи формулы (IIa):
VL-CL;
для которой:
определения VH, CH1, СН2, СН3, Х, VL, CL и V1 приведены выше.
Если V1 в полипептиде формулы (Iа) представляет собой dsFv, то мультиспецифичное антитело содержит третий полипептид, кодирующий соответствующий свободный домен VH или VL, который не присоединен к X. Этот "свободный вариабельный домен" обычно встречается в обеих тяжелых цепях и связывается с вариабельным доменом, прикрепленным к X, посредством дисульфидной связи. Таким образом, при том, что реальный вариабельный домен, слитый или связанный с полипептидом посредством X, может быть разным в двух тяжелых цепях в виде "полноразмерного антитела", спаренные с ними свободные вариабельные домены обычно являются идентичными друг другу. Обычно вариабельный домен, слитый или связанный посредством X с остальной частью полипептида, является одинаковым в обеих тяжелых цепях димера.
В одном варианте осуществления изобретение относится к димеру, который содержит два полипептида формулы (I), при этом V1 в каждом полипептиде являются одинаковыми, и, необязательно, указанный димер дополнительно содержит два полипептида формулы (II).
В одном варианте осуществления изобретение относится к молекуле мультиспецифичного антитела, которая содержит или состоит из:
а) полипептидной цепи формулы (Ib):
VH-CH1-СН2-СН3; и
b) полипептидной цепи формулы (IIb):
VL-CL-Y-V2;
для которой:
определения VH, CH1, СН2, СН3, Y, VL, CL, Y и V2 приведены выше.
Если V2 в полипептиде формулы (IIb) представляет собой dsFv, то мультиспецифичное антитело содержит третий полипептид, кодирующий соответствующий свободный домен VH или VL, который не присоединен к Y. Этот "свободный вариабельный домен" встречается в обеих легких цепях и связывается с вариабельным доменом, присоединенным к Y посредством дисульфидной связи. Таким образом, при том, что реальный вариабельный домен, слитый или связанный с полипептидом посредством Y, может быть разным в двух легких цепях в виде "полноразмерного антитела", спаренные с ними свободные вариабельные домены обычно идентичны друг другу. Обычно вариабельный домен, слитый или связанный посредством X с остальной частью полипептида, является одинаковым в обеих легких цепях димера.
В одном варианте осуществления изобретение относится к молекуле мультиспецифичного антитела, которая содержит или состоит из:
а) полипептидной цепи, имеющей формулу (Iа):
VH-CH11-CH2-CH3-X-V1;
b) полипептидной цепи, имеющей формулу (IIb):
VL-CL-Y-V2;
в которой:
VH, CH1, CH2, CH3, Y, VL, CL, X, Y, V1 и V2 имеют указанные выше значения.
Если V1 и V2 в полипептиде, имеющим формулы (Iа) и (IIb), соответственно, одновременно представляют собой dsFv, то мультиспецифичное антитело содержит третий полипептид, кодирующий соответствующий свободный VH или VL, который не присоединен к Y или X. Этот "свободный вариабельный домен" обычно встречается и в тяжелых и в легких цепях, и связывается с вариабельным доменом, присоединенным к Y и X посредством дисульфидной связи. Таким образом, при том, что реальный вариабельный домен, слитый или связанный с полипептидом посредством X или Y, может отличаться в тяжелой или легкой цепи в виде "полноразмерного антитела", спаренные с ним свободные вариабельные домены обычно идентичны друг другу.
В одном варианте осуществления, где р равно 0, отсутствует Х. В одном варианте осуществления, где q равно 0, отсутствует Y.
Преимуществом является то, что молекулы мультиспецифичных антител по настоящему изобретению количественно уменьшают агрегацию, наблюдаемую после очистки, и увеличивают количество мономера в композициях упомянутой конструкции при фармацевтических концентрациях. Например, количество мономера в очищенном белке, присутствующем в качестве "мономера", может составлять 50%, 60%, 70% или 75% или больше, например, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% или больше.
Подробное описание изобретения
Используемый в изобретении термин "мультиспецифичное антитело" относится к описанной в изобретении молекуле антитела, которая имеет два или больше связывающих домена, например, два или три связывающих домена.
В одном варианте осуществления конструкция антитела представляет собой триспецифичное антитело.
Используемый в изобретении термин "триспецифичное антитело" относится к молекуле антитела с тремя сайтами связывания антигенов, которые могут независимо друг от друга связываться с одинаковыми или разными антигенами.
В одном варианте осуществления конструкция представляет собой биспецифичное антитело.
Используемый в изобретении термин "биспецифичная молекула" относится к молекуле с двумя сайтами связывания антигенов, которые могут связываться с одинаковыми или разными антигенами.
В одном варианте осуществления все домены связываются с одним и тем же антигеном, включая связывание с одинаковыми эпитопами на антигене или связывание с разными эпитопами на антигене.
В одном варианте осуществления имеется три связывающих домена и каждый из этих трех связывающих доменов связывается с разными (отличными друг от друга) антигенами.
В одном варианте осуществления имеется три связывающих домена, при этом два связывающих домена связываются с одним и тем же антигеном, включая связывание с одинаковыми эпитопами или с разными эпитопами на одном и том же антигене, а третий связывающий домен связывается с другим (отличным от первых) антигеном.
В одном варианте осуществления молекула мультиспецифичного антитела по настоящему изобретению имеет только два сайта связывания антигена. Следует понимать, что если молекула мультиспецифичного антитела димеризована таким образом, что имеются четыре антигенсвязывающих сайта, они, как правило, будут связываться только с двумя разными антигенами. Таким образом, в одном варианте осуществления имеется четыре связывающих домена, из которых одна пара связывающих доменов связывается с одним антигеном, и другая пара связывающих доменов связывается со вторым антигеном, отличным от первого.
Используемый в изобретении термин "антигенсвязывающий сайт" относится к участку молекулы, которая содержит пару вариабельных областей, в частности, когнатную пару, которая специфично взаимодействует с антигеном-мишенью.
Связывающие домены, используемые в изобретении, включают однодоменное антитело, т.е. вариабельную область и антигенсвязывающие сайты.
Используемое в изобретении понятие "специфично" означает сайт связывания, только распознающий антиген, к которому этот сайт специфичен, или сайт связывания, обладающий значительно более высокой аффинностью связывания, например, выше в 5, 6, 7, 8, 9, в 10 раз, с антигеном, к которому этот сайт специфичен, по сравнению с аффинностью к антигенам, к которым он не является специфичным.
Аффинность связывания может быть измерена с помощью стандартного анализа, такого как измерение поверхностного плазмонного резонанса, например, BIAcore.
"Белок", используемый в изобретении, относится к аминокислотной последовательности в 100 аминокислот или больше. В одном варианте осуществления используемый в изобретении "белок" относится к аминокислотной последовательности с вторичной или третичной структурой. В одном варианте осуществления белок представляет собой не столько количество аминокислот, составляющих основу его последовательности, но и определяется уровнем вторичной и/или третичной структуры и укладкой в молекуле.
Термин "антитело", используемый в изобретении, относится к молекуле иммуноглобулина, способной к специфичному связыванию с антигеном-мишенью, таким как углевод, полинуклеотид, липид, полипептид, пептид и т.д., с помощью по меньшей мере одного сайта распознавания антигена (также называемого в изобретении сайтом связывания), расположенного в вариабельной области молекулы иммуноглобулина.
Используемый в изобретении термин "молекула антитела" включает антитела и их связывающие фрагменты.
Используемый в изобретении термин "фрагменты антител" относится к фрагментам связывания антител, включающим без ограничения Fab, модифицированный Fab, Fab', модифицированный Fab', F(аb')2, Fv, однодоменные антитела, scFv, би-, три- или тетра-валентные антитела, бис-scFv, диатела, триатела, тетратела и эпитопсвязывающие фрагменты любого из указанных фрагментов (см., например, Holliger and Hudson, 2005, Nature Biotech. 23(9):1126-1136; Adair and Lawson, 2005, Drug Design Reviews - Online 2(3), 209-217). Способы создания и получения указанных фрагментов антител хорошо известны в данной области (см., например, Verma et al 1998, Journal of Immunological Methods, 216:165-181). Другие фрагменты антител, используемые в настоящем изобретении, включают Fab и фрагменты Fab', описанные в международных патентных заявках WO05/003169, WO05/003170 и WO05/003171. Поливалентные антитела могут содержать несколько специфичностей, например, могут быть биспецифичными или моноспецифичными (см., например, WO92/22853, WO05/113605, WO2009/040562 и WO2010/035012).
Используемый в изобретении термин "связывающий фрагмент" относится к фрагменту, способному связываться с целевым пептидом или антигеном с аффинностью, достаточной, чтобы фрагмент можно было считать специфичным для этого пептида или антигена.
Используемый в изобретении термин "Fab-фрагмент" относится к фрагменту антитела, содержащему фрагмент легкой цепи, который содержит домен VL (вариабельный домен легкой цепи) и константный домен легкой цепи (CL), и домен VH (вариабельный домен тяжелой цепи) и первый константный домен (CH1) тяжелой цепи. Обычно фрагмент Fab не содержит шарнирную область, тогда как Fab' содержит шарнирную область.
Домены константной области молекулы антитела согласно настоящему изобретению могут быть выбраны с учетом предполагаемой функции молекулы антитела, и, в частности, желательных эффекторных функций. Например, домены константной области могут представлять собой человеческие домены IgA, IgD, IgE, IgG или IgM. В частности, если молекула антитела предназначена для терапевтических применений и требуются эффекторные функции антитела, можно использовать домены константной области человеческого IgG, в особенности изотипы IgG1 и IgG3. В качестве альтернативы, можно использовать изотипы IgG2 и IgG4, если молекула антитела предназначена для терапевтических целей и эффекторные функции антител не являются обязательными.
В одном варианте осуществления константные домены, используемые в конструкциях настоящего изобретения, представляют собой изотип IgG, например, независимо выбранный среди IgG1, IgG2, IgG3, IgG4 и их комбинаций, в частности, из изотипа IgG1 или IgG4.
Следует понимать, что также можно использовать варианты последовательностей указанных доменов константной области. Например, можно использовать молекулы IgG4, в которых серин в положении 241 был заменен на пролин, как описано авторами Angal et al. 1993, Molecular Immunology, 1993, 30: 105-108. Таким образом, в варианте осуществления, в котором антитело представляет собой IgG4-антитело, это антитело может включать мутации S241P.
Специалисту в данной области техники также будет очевидно, что можно проводить различные посттрансляционные модификации антител. Тип и степень этих модификаций часто зависит от линии клетки-хозяина, которая используется для экспрессии антитела, а также условий культивирования. Такие модификации могут включать изменения в гликозилировании, окислении метионина, образовании дикетопиперазина, изомеризации аспартата и дезамидировании аспарагина. Частой модификацией является потеря карбокси-концевого основного остатка (например, лизина или аргинина), обусловленная действием карбоксипептидазы (как описано Harris, RJ. Journal of Chromatography 705:129-134, 1995). Соответственно, в тяжелой цепи антитела может отсутствовать С-концевой лизин.
Специалисту в данной области будет очевидно, что если в соединениях по настоящему изобретению V1 представляет собой dsFv, то полипептид, имеющий формулу (I) (или другую формулу, согласно настоящему изобретению) включает один вариабельный домен (участок из V1), связанный посредством дисульфидной связи с вариабельным доменом, который является частью слитого полипептида формулы (I).
Специалисту в данной области будет очевидно, что если в соединениях по настоящему изобретению V2 представляет собой dsFv, то полипептид, имеющий формулу (I) (или другую формулу, согласно настоящему изобретению) включает один вариабельный домен (участок из V2), связанный посредством дисульфидной связи с вариабельным доменом, который является частью слитого полипептида формулы (I).
Слитый полипептид, используемый в изобретении, представляет собой непрерывную полипептидную цепь, обычно содержащую компоненты, которые вместе не встречаются в природе, например, компоненты, полученные с помощью рекомбинантной технологии.
В одном варианте осуществления молекула мультиспецифичного антитела согласно настоящему изобретению представлена в виде димера из тяжелой и легкой цепи, которые имеют:
формулы (I) и (II), соответственно, где часть VН-СН1 вместе с частью VL-CL образуют функциональный фрагмент Fab или Fab'; или
формулы (Ia) и (IIa), соответственно, где часть VН-СН1 вместе с частью VL-CL образуют функциональный фрагмент Fab или Fab'; или
формулы (Ib) и (IIb), соответственно, где часть VН-СН1 вместе с частью VL-CL образуют функциональный фрагмент Fab или Fab'; или
формулы (Ia) и (IIb), соответственно, где часть VН-СН1 вместе с частью VL-CL образуют функциональный фрагмент Fab или Fab'; или
В другом варианте осуществления молекула мультиспецифичного антитела согласно настоящему изобретению представлена в виде тетрамера, который содержит 2 пары димеров из тяжелой и легкой цепи, имеющих:
формулы (I) и (II), соответственно, где часть VН-СН1-СН2-СН3 вместе с частью VL-CL, например, образуют функциональный IgG; или
формулы (Ia) и (IIa), соответственно, где часть VН-СН1-СН2-СН3 вместе с частью VL-CL, например, образуют функциональный IgG; или
формулы (Ib) и (IIb), соответственно, где часть VН-СН1-СН2-СН3 вместе с частью VL-CL, например, образуют функциональный IgG; или
формулы (Ia) и (IIb), соответственно, где часть VН-СН1-СН2-СН3 вместе с частью VL-CL, например, образуют функциональный IgG; или
VН представляет собой вариабельный домен, например, вариабельный домен тяжелой цепи. В одном варианте осуществления VН представляет собой вариабельный домен тяжелой цепи. В одном варианте осуществления VН представляет собой химерный вариабельный домен, то есть он содержит компоненты, происходящие, по меньшей мере, из двух видов, например, человеческие каркасные области и нечеловеческие области, определяющие комплиментарность (CDR). В одном варианте осуществления VН является гуманизированным. В одном варианте осуществления VН является человеческим.
VL представляет собой вариабельный домен, например, вариабельный домен легкой цепи. В одном варианте осуществления VL представляет собой вариабельный домен легкой цепи. В одном варианте осуществления VL представляет собой химерный вариабельный домен, то есть он содержит компоненты, происходящие, по меньшей мере, из двух видов, например, человеческие каркасные области и нечеловеческие CDR. В одном варианте осуществления VL является гуманизированным. В одном варианте осуществления VL является человеческим.
В общем, VH и VL вместе образуют антигенсвязывающий домен. В одном варианте осуществления VH и VL образуют когнатную пару.
Используемый в изобретении термин "когнатная пара" относится к паре вариабельных доменов из одного антитела, которые были созданы in vivo, то есть, к спаренным вариабельным доменам природного происхождения, выделенным из хозяина. Таким образом, когнатная пара представляет собой пару VH и VL. В одном примере когнатная пара совместно связывается с антигеном. Когнатные пары могут иметь преимущество, поскольку они часто обладают зрелой аффинностью в хозяине и, следовательно, могут иметь высокую аффинность к антигену, к которому они специфичны.
Используемый в изобретении термин "вариабельная область" относится к участку в цепи антитела, который содержит области CDR и каркас, в частности, подходящий каркас.
Вариабельные области, используемые в настоящем изобретении, обычно получены из антитела, которое может быть создано любым известным в данной области способом.
Используемое в изобретении понятие "происходит от" означает, что используемая последовательность или последовательность с высокой степенью подобия по отношению к используемой последовательности, была получена из исходного генетического материала, например, из легкой или тяжелой цепи антитела.
Используемое в изобретении понятие "производное природного домена" означает, что одна, две, три, четыре или пять аминокислот в природной последовательности были заменены или удалены, например, для оптимизации свойств домена, например, путем устранения нежелательных свойств, но при этом сохранился отличительный признак (признаки) этого домена. Примерами модификаций являются удаление сайтов гликозилирования, гликозилфосфатидилинозитола (GPI-якоря) или лизинов, на которые воздействуют растворителем. Эти модификации можно осуществлять путем замещения соответствующих аминокислотных остатков на заменяющие консервативные аминокислоты.
В одном варианте осуществления выполняют обработку молекулы антитела по настоящему изобретению или компонентов/фрагментов антитела для достижения улучшенной аффинности к целевому антигену или антигенам. Такие варианты могут быть получены с помощью ряда протоколов созревания аффинности, включающих мутацию областей CDR (Yang et al J. Mol. Biol., 254, 392-403, 1995), перетасовки цепей (Marks et al Bio/Technology, 10, 779-783, 1992), использование мутаторных штаммов E.coli (Low et al J. Mol. Biol., 250, 359-368, 1996), перетасовку ДНК (Patten et al Curr. Opin. Biotechnol 8, 724-733, 1997), технологию фаговых дисплеев (Thompson et al J. Mol. Biol., 256, 77-88, 1996) и ПЦР с имитацией полового размножения (Crameri et al Nature, 391, 288-291, 1998). Эти способы созревания аффинности рассмотрены авторами Vaughan et al. (см. выше)
Понятие "высокая степень подобия" используется в изобретении для обозначения аминокислотной последовательности, которая по всей своей длине имеет 95% подобия или больше, например, 96, 97, 98 или 99% подобия.
Вариабельные области, используемые в настоящем изобретении, как описано выше для областей VH и VL, могут происходить от любого подходящего источника, и могут быть, например, полностью человеческими или гуманизированными.
В одном варианте осуществления связывающий домен, образованный VH и VL, является специфичным для первого антигена.
В одном варианте осуществления связывающий домен, образованный V1, специфичен для второго антигена.
В одном варианте осуществления связывающий домен, образованный V2, специфичен для второго или третьего антигена.
В одном варианте осуществления домен CH1 представляет собой природный домен 1 из тяжелой цепи антитела или его производное. В одном варианте осуществления СН2 домен представляет собой природный домен 2 из тяжелой цепи антитела или его производное. В одном варианте осуществления домен СН3 представляет собой природный домен 3 из тяжелой цепи антитела или его производное.
В одном варианте осуществления фрагмент СL в легкой цепи представляет собой константную последовательность каппа, или константную последовательность лямбда или их производное.
Понятие "производное природного домена", используемое в изобретении, означает, что одна, две, три, четыре или пять аминокислот в природной последовательности были заменены или удалены, например, для оптимизации свойств домена, например, путем устранения нежелательных свойств, но при этом сохранился отличительный признак (признаки) этого домена.
В одном варианте осуществления одна или несколько природных или сконструированных дисульфидных связей между цепями (а именно, между легкой и тяжелой цепями) присутствуют в участке функционального Fab или Fab' в молекуле мультиспецифичного антитела.
В одном варианте осуществления "природная" дисульфидная связь присутствует между CH1 и CL в полипептидных цепях, имеющих:
формулу (I) и (II), или формулу (Iа) и (IIа), или формулу (Ib) и (IIb) или формулу (Ia) и (IIb).
Если домен CL получен из последовательности каппа или лямбда, то естественным положением для образующего связь цистеина является положение 214 в человеческой c-каппа и c-лямбда (Система нумерации Kabat, 4-е издание, 1987).
Точное местоположение образующего дисульфидную связь цистеина в CH1 зависит от конкретного фактически используемого домена. Так, например, в человеческой цепи гамма-1 природным местоположением дисульфидной связи является положение 233 (Система нумерации Kabat, 4-е издание, 1987). Известно положение образующего связь цистеина для других человеческих изотипов, таких как гамма 2, 3, 4, IgM и IgD, например, положение 127 в человеческом IgM, IgE, IgG2, IgG3, IgG4 и положение 128 в тяжелой цепи человеческого IgD и IgA2B.
Необязательно, в полипептидах формулы I и II может присутствовать дисульфидная связь между VH и VL.
В одном варианте осуществления мультиспецифичное антитело по изобретению имеет дисульфидную связь в положении, эквивалентном или соответствующим ее природному расположению между CH1 и CL.
В одном варианте осуществления содержащая CH1 константная область, и константная область, такая как CL, имеют дисульфидную связь в положении, которое не встречается в природе. Такая связь может быть создана в молекуле генноинженерным способом путем введения цистеина (цистеинов) в аминокислотную цепь в желательном положении или положениях. Такая неприродная дисульфидная связь существует в качестве дополнения или альтернативы природной дисульфидной связи, которая расположена между CH1 и CL. Цистеин (цистеины) в природных положениях могут быть заменены аминокислотой, такой как серин, которая не способна к образованию дисульфидного мостика.
Сконструированные цистеины можно вводить с использованием любого известного в данной области способа.
Эти способы включают без ограничения мутагенез путем ПЦР с удлинением и перекрытием, сайт-направленный мутагенез или кассетный мутагенез (см. обзорную информацию: Sambrook et al Molecular Cloning, A Laboratory Manual, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, NY, 1989; Ausbel et al Current Protocols in Molecular Biology, Greene Publishing & Wiley-Interscience, NY, 1993). Наборы для сайт-направленного мутагенеза коммерчески доступны, например, набор для сайт-направленного мутагенеза QuikChange® (Stratagene, La Jolla, CA). Кассетный мутагенез может быть выполнен в соответствии с публикацией Wells et al., 1985, Gene, 34: 315-323. Альтернативно, мутанты могут быть получены с помощью полного генного синтеза путем отжига, лигирования и ПЦР-амплификации и клонирования перекрывающихся олигонуклеотидов.
В одном варианте осуществления дисульфидная связь между CH1 и CL полностью отсутствует, например межцепочечные цистеины могут быть заменены на другую аминокислоту, такую как серин. Таким образом, в одном варианте осуществления в молекуле мультиспецифичного антитела отсутствуют межцепочечные дисульфидные связи в функциональной части Fab или Fab'. В ряде патентов, таких как WO2005/003170, включенном в настоящее изобретение в качестве ссылки, описано получение Fab-фрагментов без межцепочечной дисульфидной связи.
В одном варианте осуществления соединения/конструкции по настоящему изобретению содержат шарнирную область, например, в природном местоположении между CH1 и CH2. В одном варианте осуществления последовательность шарнира является природной или модифицированной. Природная шарнирная последовательность, согласно изобретению, представляет собой последовательность, встречающуюся в природе в любом изотипе антитела (даже если этот шарнир содержится в другом изотипе, отличном от изотипа, в котором шарнир встречается в природе). Модифицированным считается шарнир, в котором от 1 до 5 аминокислот подверглись замене, удалению или комбинации этих модификаций. В одном варианте осуществления шарнир получен из IgG, например, из IgG1, IgG2, IgG3 или IgG4.
В одном варианте осуществления соединения/конструкции по настоящему изобретению не содержат шарнир, например, CH1 слит с CH2 напрямую или соединен с помощью линкера, например, линкера, описанного в изобретении, или с помощью элементов G4S.
В одном варианте осуществления СН3 не содержит никаких мутаций.
В одном варианте осуществления молекула антитела не содержит каких-либо мутаций типа "выступ-во-впадину".
В одном варианте осуществления молекула антитела по настоящему изобретению содержит мутации типа "выступ-во-впадину".
Используемые в изобретении понятия "выступ-во-впадину" или "выступы и впадины" относятся к выпуклостям на поверхности первого полипептида и соответствующим углублениям на поверхности второго полипептида, таким образом, что эта выпуклость располагается внутри углубления, тем самым способствуя образованию гетеромультимера и препятствуя образованию гомомультимера. В этой связи, можно упомянуть патент US8216805, в котором описано применение этого способа получения гетеромультимерных полипептидов, таких как биспецифичные антитела, и содержание указанного патента включено в настоящее изобретение.
В одном варианте осуществления, если р равно 1, V1 представляет собой dsFv и q равно 0, то присутствуют по меньшей мере две полипептидные цепи формулы (I).
V1 представляет собой sdAb, dsscFv или scFv, например, dsFv, sdAb или dsscFv. В одном варианте осуществления V1 представляет собой dsFv, dsscFv или scFv. В одном варианте осуществления V1 представляет собой dsscFv. В одном варианте осуществления V1 представляет собой dsFv.
V2 представляет собой sdAb, dsscFv или scFv, например, dsFv, sdAb, или dsscFv. В одном варианте осуществления V1 представляет собой dsFv, dsscFv или scFv. В одном варианте осуществления V2 представляет собой dsscFv. В одном варианте осуществления V2 представляет собой dsFv.
В одном варианте осуществления V1 и V2 представляют собой, например, dsFv, при этом вариабельные легкие домены представляет собой домены, всего лишь связанные дисульфидной связью с остальной частью полипептида, и V1 и V2 являются идентичными или очень похожими.
В одном варианте осуществления V2 представляет собой dsFv и V1 отсутствует или отличается от dsFv. В одном варианте осуществления V1 представляет собой dsFv, и V2 отсутствует или отличается от dsFv. В одном варианте осуществления V2 представляет собой dsFv и V1 представляет собой scFv. В одном варианте осуществления V1 представляет собой dsFv и V2 представляет собой scFv. В одном варианте осуществления V2 представляет собой dsFv и V1 представляет собой dsscFv. В одном варианте осуществления V1 представляет собой dsFv и V2 представляет собой dsscFv. В одном варианте осуществления V1 и V2 независимо друг от друга представляют собой dsscFv. В одном варианте осуществления V2 представляет собой dsscFv и V1 представляет собой scFv. В одном варианте осуществления V1 представляет собой dsscFv и V2 представляет собой scFv.
Используемый в изобретении термин "одноцепочечный вариабельный фрагмент" или "scFv" относится к одноцепочечному вариабельному фрагменту, который содержит или состоит из вариабельного домена тяжелой цепи (VH) и вариабельного домена легкой цепи (VL), и стабилизирован с помощью пептидного линкера между доменами VH и VL. Вариабельные домены VH и VL могут располагаться в любой подходящей ориентации, например, С-конец VH может быть связан с N-концом VL, или С-конец VL может быть связан с N-концом VH.
Используемый в изобретении термин "стабилизированный дисульфидной связью одноцепочечный вариабельный фрагмент" или "dsscFv" относится к одноцепочечному вариабельному фрагменту, который стабилизирован с помощью пептидного линкера между вариабельными доменами VH и VL, и также включает междоменную дисульфидную связь между VH и VL.
Используемый в изобретении термин "стабилизированный дисульфидной связью вариабельный фрагмент" или "dsFv" относится к одноцепочечному вариабельному фрагменту, в который не входит пептидный линкер между вариабельными доменами VH и VL, и вместо этого, такой фрагмент стабилизирован междоменной дисульфидной связью между VH и VL.
Используемый в изобретении термин "однодоменное антитело" или "sdAb" относится к фрагменту антитела, состоящему из единственного мономерного вариабельного домена антитела, такого как VH или VL.
В одном варианте осуществления и р и q равны 1. В одном варианте осуществления р равно 1 и q равно 0. В одном варианте осуществления р равно 0 и q равно 1.
В одном из вариантов осуществления, если V1 и/или V2 представляют собой dsFv или dsscFv, дисульфидная связь между вариабельными доменами VH и VL из V1 и/или вариабельными доменами VH и VL из V2 является связью между двумя из нижеперечисленных остатков (если из контекста не следует иное; в списке ниже используется нумерация по системе Kabat). Везде, где упомянута нумерация по системе Kabat, см. соответствующую ссылку Kabat et al 1987, в издании Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA.
В одном варианте осуществления дисульфидная связь находится в положении, выбранном из группы, содержащей:
- VH37+VL95C, см., например, Protein Science 6, 781-788 Zhu et al. (1997);
- VH44+VL100, см., например, Biochemistry 33 5451-5459 Reiter et al (1994); или Journal of Biological Chemistr, том. 269 No. 28 стр.18327-18331 Reiter et al (1994); или Protein Engineering, том10 no.12, стр.1453-1459 Rajagopal et al (1997);
- VH44+VL105, см., например, J. Biochem. 118, 825-831 Luo et al (1995);
- VH45+VL87, см., например, Protein Science 6, 781-788 Zhu et al. (1997);
- VH 55+VL101, см., например, FEBS Letters 377 135-139 Young et al. (1995);
- VH100+VL50, см., например, Biochemistry 29 1362-1367 Glockshuber et al. (1990);
- VH100b+VL49;
- VH98+VL46, см., например, Protein Science 6, 781-788 Zhu et al. (1997);
- VH101+VL46;
- VH105+VL43, см., например, Proc. Natl. Acad. Sci. USA Vol. 90 pp.7538-7542 Brinkmann et al (1993); или Proteins 19, 35-47 Jung et al (1994),
- VH106+VL57, см., например, FEBS Letters 377 135-139 Young et al. (1995)
и соответствующие указанные положения в парной вариабельной области, расположенной в этой молекуле.
В одном варианте осуществления дисульфидная связь образуется между положениями VH44 и VL100 в V1 и/или V2.
Указанные выше пары аминокислот находятся в положениях, способствующих их замещению на цистеины, с тем, чтобы могли быть образованы дисульфидные связи. Конструкцию с цистеинами в этих желаемых местоположениях можно создать с помощью известных методик. Таким образом, в одном варианте осуществления сконструированный цистеин, согласно настоящему изобретению, означает, что встречающийся в природе остаток в данном аминокислотном положении заменен на остаток цистеина.
Введение сконструированных цистеинов может быть осуществлено с использованием любого способа, известного в данной области. Эти способы включают без ограничения мутагенез с помощью ПЦР с удлинением и перекрытием, сайт-направленный мутагенез или кассетный мутагенез (см. обзорную информацию: Sambrook et al Molecular Cloning, A Laboratory Manual, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, NY, 1989; Ausbel et al Current Protocols in Molecular Biology, Greene Publishing & Wiley-Interscience, NY, 1993). Наборы для сайт-направленного мутагенеза коммерчески доступны, например, набор для сайт-направленного мутагенеза QuikChange® (Stratagene, La Jolla, CA). Кассетный мутагенез может быть выполнен в соответствии с публикацией Wells et al., 1985, Gene, 34: 315-323. Альтернативно, мутанты могут быть получены с помощью полного генного синтеза путем отжига, лигирования и ПЦР-амплификации и клонирования перекрывающихся олигонуклеотидов.
Соответственно, в одном варианте осуществления, если V1 и/или V2 представляют собой dsFv или dsscFv, вариабельные домены VH и VL в каждом из V1 и/или V2 могут быть связаны дисульфидной связью между двумя цистеиновыми остатками, при этом местоположение пары остатков цистеина независимо выбрано из группы, состоящей из: VН37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VH100 и VL50, VH100b и VL49, VH98 и VL46, VH101 и VL46, VH105 и VL43, и VH106 и VL57.
В одном варианте осуществления, если V1 и/или V2 представляют собой dsFv или dsscFv, вариабельные домены VH и VL из V1 и/или вариабельные домены VH и VL из V2 могут быть связаны дисульфидной связью между двумя остатками цистеина, один из которых расположен в VH, и другой остаток в VL, находящийся/находящиеся за пределами областей CDR, при этом положение пары остатков цистеина независимо выбрано из группы, состоящей из VH37 и VL95, VH44 и VL100, VН44 и VL105, VH45 и VL87, VH100 и VL50, VH98 и VL46, VH105 и VL43, и VH106 и VL57.
В одном варианте осуществления, если V1 представляет собой dsFv или dsscFv, вариабельные домены VH и VL из V1 связаны дисульфидной связью между двумя сконструированными остатками цистеина, один из которых находится в положении VH44, и другой в положении VL100.
В одном варианте осуществления, если V2 представляет собой dsFv или dsscFv, вариабельные домены VH и VL из V2 связаны дисульфидной связью между двумя сконструированными остатками цистеина, один из которых находится в положении VH44, и другой в положении VL100.
В одном варианте осуществления, если V1 представляет собой dsFv, dsscFv или scFv, то домен VH из V1 присоединен к X. В одном варианте осуществления, если V1 представляет собой dsFv, dsscFv или scFv, то домен VL из V1 присоединен к X. В одном варианте осуществления, если V2 представляет собой dsFv, dsscFv или scFv, то домен VH из V2 присоединен к Y. В одном варианте осуществления, если V2 представляет собой dsFv, dsscFv или scFv, VL домен из V2 присоединен к Y.
В одном варианте осуществления Х представляет собой связь. В одном варианте осуществления Y представляет собой связь. В одном из вариантов осуществления и X и Y представляют собой связи.
В одном варианте осуществления Х представляет собой линкер, предпочтительно пептидный линкер, например, подходящий пептид для соединения частей CH3 и V1. В одном варианте осуществления Y представляет собой линкер, предпочтительно пептидный линкер, например, подходящий пептид для соединения частей СL и V2. В одном варианте осуществления Х и Y являются линкерами, предпочтительно, пептидными линкерами.
Используемый в изобретении термин "пептидный линкер" относится к пептиду с аминокислотными последовательностями. Разнообразные подходящие пептидные линкеры известны специалистам в данной области.
В одном из вариантов осуществления пептидный линкер может иметь синтетическое происхождение, то есть, может быть получен способами химического синтеза.
В одном варианте осуществления длина пептидного линкера составляет 50 аминокислот или меньше, например, 20 аминокислот или меньше, например, 9, 10, 11, 12, 13 или 14 аминокислот. В одном из вариантов осуществления пептидный линкер имеет длину от 5 до 15 аминокислот.
В одном варианте осуществления линкер выбран из последовательности, представленной в перечне последовательностей от 1 до 67.
В одном варианте осуществления линкер выбран из последовательностей SEQ ID NO: 1 или SEQ NO: 2.
В одном варианте осуществления Х имеет последовательность SGGGGSGGGGS (SEQ ID NO: 1).
В одном варианте осуществления Y имеет последовательность SGGGGSGGGGS (SEQ ID NO: 1).
В одном варианте осуществления Х имеет последовательность SGGGGTGGGGS (SEQ ID NO: 2).
В одном варианте осуществления Y имеет последовательность SGGGGTGGGGS (SEQ ID NO: 2).
Таблица 1. Последовательности шарнирного линкера
Таблица 2. Последовательности гибких линкеров
(S) является необязательным в последовательностях от 14 до 18.
Х представляет собой аминокислоту.
Примеры жестких линкеров включают пептидные последовательности GAPAPAAPAPA (SEQ ID NO: 52), РРРР (SEQ ID NO: 53) и PPP.
В одном варианте осуществления пептидный линкер представляет собой альбумин-связывающий пептид.
Примеры альбумин-связывающих пептидов представлены в патенте WO2007/106120 и включают следующее:
Таблица 3
Преимущество использования альбумин-связывающих пептидов в качестве линкера состоит в возможности увеличения периода полужизни молекулы мультиспецифичного антитела.
В одном варианте осуществления линкеры Х и/или Y не содержат сайта расщепления протеазы, т.е., не содержат аминокислотной последовательности или мотива, который расщепляется протеазой. В частности, в одном варианте осуществления линкеры Х и/или Y не содержат специфичного сайта расщепления фуриновой протеазы
В одном варианте осуществления в используемом линкере X и/или Y имеется от 4 до 16 аминокислот, составляющих длину линкера, например, кратные количества мономера (G4S).
В одном варианте осуществления, в котором V1 представляет собой scFv или dsscFv, присутствует линкер, например, подходящий пептид для соединения вариабельных доменов VH и VL. В одном варианте осуществления, в котором V1 представляет собой scFv или dsscFv, линкер, соединяющий вариабельные домены VH и VL из V1, имеет последовательность GGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 68). В одном варианте осуществления, в котором V2 представляет собой scFv или dsscFv, присутствует линкер, например, подходящий пептид для соединения вариабельных доменов VH и VL. В одном варианте осуществления, в котором V2 представляет собой scFv или dsscFv, линкер, соединяющий вариабельные домены VH и VL из V2, имеет последовательность GGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 68).
В одном варианте осуществления, в котором V1 представляет собой scFv или dsscFv, линкер, соединяющий вариабельные домены VH и VL из V1, имеет последовательность SGGGGSGGGGSGGGGS (SEQ ID NO: 69). В одном варианте осуществления, в котором V2 представляет собой scFv или dsscFv, линкер, соединяющий вариабельные домены VH и VL из V2, имеет последовательность SGGGGSGGGGSGGGGS (SEQ ID NO: 69).
В одном варианте осуществления, в котором V1 представляет собой scFv или dsscFv, линкер, соединяющий вариабельные домены VH и VL из V1, имеет последовательность SGGGGSGGGGTGGGGS (SEQ ID NO: 70). В одном варианте осуществления, в котором V2 представляет собой scFv или dsscFv, линкер, соединяющий вариабельные домены VH и VL из V2, имеет последовательность SGGGGSGGGGTGGGGS (SEQ ID NO: 70).
Настоящее изобретение также относится к последовательностям, которые на 80%, 90%, 91%, 92%, 93% 94%, 95% 96%, 97%, 98% или 99% подобны последовательности, раскрытой в данном изобретении.
Используемый в изобретении термин "идентичность" указывает на то, что в любом конкретном положении сопоставляемых последовательностей аминокислотный остаток в этих последовательностях является идентичным.
Используемый в изобретении термин "подобие" указывает на то, что в любом конкретном положении сопоставляемых последовательностей тип аминокислотного остатка в этих последовательностях является сходным. Например, лейцин может быть заменен на изолейцин или валин. Другие аминокислоты, которые часто могут заменяться на другую аминокислоту, включают без ограничения:
- фенилаланин, тирозин и триптофан (аминокислоты, имеющие ароматические боковые цепи);
- лизин, аргинин и гистидин (аминокислоты, имеющие основные боковые цепи);
- аспартат и глутамат (аминокислоты, имеющие кислотные боковые цепи);
- аспарагин и глутамин (аминокислоты, имеющие амидные боковые цепи); и
- цистеин и метионин (аминокислоты, имеющие серосодержащие боковые цепи).
Степени идентичности и подобия можно легко вычислить. (См. следующие источники: Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing. Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987, Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991, программное обеспечение BLAST™, доступное в NCBI - Национальном центре биотехнологической информации США (Altschul, S.F. et al., 1990, J. Mol. Biol. 215:403-410; Gish, W. & States, D.J. 1993, Nature Genet. 3:266-272. Madden, T.L. et al 1996, Meth. Enzymol. 266:131-141; Altschul, S.F. et al 1997, Nucleic Acids Res. 25:3389-3402; Zhang, J. & Madden, T.L. 1997, Genome Res. 7:649-656).
Термин "вариант", используемый в данном изобретении, относится к пептиду или белку, которые содержат по меньшей мере одно изменение в аминокислотной последовательности или нуклеотидной последовательности, по сравнению с аминокислотной или нуклеотидной последовательностью в соответствующем пептиде или белке дикого типа. Вариант может содержать последовательности, которые идентичны по меньшей мере на 80%, или 85%, или 90%, или 95%, или 98% или на 99% соответствующему пептиду или белку дикого типа. Вместе с тем, вариант может содержать последовательности с идентичностью менее 80%, при условии, что вариант проявляет функции, по существу аналогичные функциям соответствующего пептида или белка дикого типа.
Антитела для применения в настоящем изобретении могут быть получены любым подходящим способом, известным в данной области. Если необходима иммунизация животного, можно получать антитела против полипептидного антигена путем введения полипептидов животному, предпочтительно, животному, не являющемуся человеком, с помощью общеизвестных и рутинных протоколов, см., например, Справочник по экспериментальной иммунологии (Handbook of Experimental Immunology, D. M. Weir (ed.), Vol 4, Blackwell Scientific Publishers, Oxford, England, 1986). Можно иммунизировать ряд теплокровных животных, таких как кролики, мыши, крысы, овцы, коровы, верблюды или свиньи. Вместе с тем, наиболее подходящими обычно являются мыши, кролики, свиньи и крысы.
Моноклональные антитела могут быть получены любым способом, известным в данной области, например, с помощью технологии гибридом (Kohler & Milstein, 1975, Nature, 256: 495-497), технологии триом, технологии человеческих В-клеточных гибридом (Kozbor et al. 1983, Immunology Today, 4:72) и технологии EBV-гибридом (с вирусом Эпштейна-Барра) (Cole et al., Monoclonal Antibodies and Cancer Therapy, pp77-96, Alan R Liss, Inc., 1985).
Также можно создавать антитела с использованием способов с антителом единственного лимфоцита путем клонирования и экспрессии кДНК вариабельной области, созданных из единичных лимфоцитов, которые были выбраны для получения специфичных антител, например, с помощью, способов, описанных в публикациях Babcook, J. et al 1996, Proc. Natl. Acad. Sci. USA 93(15):7843-7848l; WO92/02551, WO2004/051268 и WO2004/106377.
Антитела, используемые в настоящем изобретении, также могут быть получены с помощью различных способов фагового дисплея, известных в данной области и включающих способы, раскрытые в следующих публикациях: Brinkman et al. (in J. Immunol. Methods, 1995, 182: 41-50), Ames et al. (J. Immunol. Methods, 1995, 184:177-186), Kettleborough et a. (Eur. J. Immunol. 1994, 24:952-958), Persic et al. (Gene, 1997 187 9-18), Burton et al. (Advances in Immunology, 1994, 57:191-280), и WO90/02809, WO91/10737, WO92/01047, W092/18619, W093/11236, W095/15982, WO95/20401, и US5698426, 5223409, 5403484, 5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727, 5733743, 5969108 и WO20011/30305.
В одном варианте осуществления мультиспецифичные молекулы по изобретению являются гуманизированными. Используемое в изобретении понятие "гуманизированная молекула" (которая включает CDR-трансплантированные антитела), относится к молекулам, имеющим одну или несколько областей, определяющих комплиментарность (CDR), из нечеловеческих видов, и каркасную область из молекулы человеческого иммуноглобулина (см., например, US5585089, WO91/09967). Следует понимать, что может быть необходимым перенос только остатков областей CDR, определяющих специфичность, а не всей области CDR (см., например, Kashmiri et al 2005, Methods, 36, 25-34). Гуманизированные антитела могут дополнительно, но необязательно, содержать один или несколько каркасных остатков, полученных из нечеловеческих видов, из которых были получены области CDR.
Используемый в изобретении термин "молекула гуманизированного антитела" относится к молекуле антитела, в которой тяжелая и/или легкая цепь содержит одну или несколько областей CDR, (в том числе, если это желательно, одну или несколько модифицированных CDR) из донорного антитела (например, из мышиного моноклонального антитела), которые были трансплантированы в тяжелую и/или легкую цепь вариабельной области каркаса акцепторного антитела (например, человеческого антитела). Обзорная информация приведена в публикации Vaughan et al. Nature Biotechnology, 16, 535-539, 1998. В одном варианте осуществления, вместо переноса всей области CDR, выполняют перенос в каркас человеческого антитела только одного или нескольких остатков, определяющих специфичность, из любой одной из описанных выше областей CDR (см., например, Kashmiri et al 2005, Methods, 36, 25-34). В одном варианте осуществления в каркас человеческого антитела переносятся только остатки, определяющие специфичность, из одной или нескольких из вышеописанных областей CDR. В другом варианте осуществления в каркас человеческого антитела переносятся только остатки, определяющие специфичность, из каждой из областей CDR, описанных в настоящем изобретении выше.
При трансплантации областей CDR или остатков, определяющих специфичность, можно использовать любую подходящую акцепторную каркасную последовательность вариабельной области с учетом класса/типа донорного антитела, из которого получены CDR, в том числе каркасные области мыши, примата и человека. Соответственно, гуманизированное антитело по настоящему изобретению имеет вариабельный домен, содержащий человеческие акцепторные каркасные области, а также одну или несколько областей CDR по изобретению.
Примеры человеческих каркасных областей, которые могут быть использованы в настоящем изобретении, представляют собой KOL, NEWM, REI, ЕС, TUR, TEI, LAY и POM (Kabat et al, см. выше). Например, KOL и NEWM могут быть использованы для тяжелой цепи, REI может быть использована для легкой цепи и ЕС, LAY и РОМ могут быть использованы как для тяжелой цепи так и для легкой цепи. В качестве альтернативы, можно использовать последовательности зародышевой линии человека; их перечень доступен в интернете по адресу: http://www2.mrc-lmb.cam.ac.uk/vbase/list2.php.
В молекуле гуманизированного антитела согласно настоящему изобретению акцепторные тяжелые и легкие цепи не обязательно должны быть получены из того же антитела. Если это желательно, они могут содержать составные цепи с каркасными областями, происходящими из разных цепей.
Каркасные области не обязательно должны иметь точно такую же последовательность, как последовательность акцепторного антитела. Например, необычные остатки можно заменять на остатки этого класса или типа, которые чаще встречаются в акцепторной цепи. Альтернативно, выбранные остатки в акцепторных каркасных областях могут быть заменены таким образом, чтобы они соответствовали остатку, который находится в том же положении в донорном антителе (см. Reichmann et al. 1998, Nature, 332, 323-324). Такие изменения должны быть сведены к минимуму, необходимому для восстановления аффинности донорного антитела. Протокол отбора остатков в акцепторных каркасных областях, для которых может требоваться замена, приведен в заявке WO91/09967.
В производных каркасных областей может находиться 1, 2, 3 или 4 аминокислотные замены на альтернативную аминокислоту, например, несущую донорский остаток.
Донорские остатки представляют собой остатки из донорного антитела, то есть антитела, из которого были первоначально получены эти области CDR. Донорские остатки могут быть заменены на подходящие остатки, полученные из рецепторного человеческого каркаса (остатки-акцепторы). В одном варианте осуществления мультиспецифичные антитела по настоящему изобретению являются полностью человеческими, в частности, один или несколько вариабельных доменов являются полностью человеческими.
Полностью человеческими молекулами являются молекулы, в которых все вариабельные области и константные области (при их наличии) и тяжелых и легких цепей имеют человеческое происхождение, или, по существу, идентичны последовательностям человеческого происхождения, не обязательно из того же антитела. Примеры полностью человеческих антител могут включать антитела, которые были получены, например, с помощью описанных выше способов фагового дисплея, и антитела, продуцируемые мышами, у которых гены вариабельной и, необязательно, константной области мышиного иммуноглобулина были заменены соответствующими человеческими копиями, например, согласно общему описанию в патентах EP0546073, US5545806, US5569825, US5625126, US5633425, US5661016, US5770429, EP0438474 и EP0463151.
В одном варианте осуществления молекулы мультиспецифичных антител по изобретению способны селективно связываться с двумя, тремя или с большим количеством разных антигенов, представляющих интерес.
В одном варианте осуществления представляющие интерес антигены, связанные посредством антиген-связывающего домена, который образован VН/VL, или V1 или V2, независимо друг от друга выбраны из клеточно-ассоциированного белка, например, белка клеточной поверхности на таких клетках, как бактериальные клетки, дрожжевые клетки, Т-клетки, эндотелиальные клетки или опухолевые клетки, и из растворимого белка.
Представляющие интерес антигены также могут представлять собой любой подходящий с медицинской точки зрения белок, такой, как белки, регуляция которых во время болезни или инфекции повышается, например, рецепторы и/или соответствующие им лиганды. Конкретные примеры антигенов включают рецепторы клеточной поверхности, такие как рецепторы Т-клеточного или В-клеточного сигнального пути, костимулирующие молекулы, ингибиторы контрольных точек, рецепторы клеток - естественных киллеров, рецепторы иммуноглобулинов, рецепторы семейства факторов некроза опухолей (TNFR), рецепторы семейства B7, молекулы адгезии, интегрины, рецепторы цитокина/хемокина, рецепторы, сопряженные с G-белком (GPCR), рецепторы фактора роста, рецепторы киназы, ткань-специфичные антигены, раковые антигены, рецепторы распознавания патогенов, рецепторы комплемента, рецепторы гормонов или растворимые молекулы, такие как цитокины, хемокины, лейкотриены, факторы роста, гормоны, или ферменты, или ионные каналы, эпитопы, фрагменты и их посттрансляционно модифицированные формы.
В одном варианте осуществления белок антитела по изобретению может быть использован для функционального изменения активности представляющего интерес антигена (антигенов). Например, слитый белок антитела может нейтрализовать, оказывать антагонистическое действие или агонистическое действие на активность указанного антигена, прямым или опосредованным путем.
В одном варианте осуществления V1 и V2 являются специфичными для одного и того же антигена, например, связываются с одинаковым или с другим эпитопом этого антигена.
В одном варианте осуществления V1 является специфичным для человеческого сывороточного альбумина. В одном варианте осуществления V2 является специфичным для человеческого сывороточного альбумина. В одном варианте осуществления V1 и V2 являются специфичными для одних и тех же антигенов, например, для человеческого сывороточного альбумина, например, для одного и того же эпитопа на том же антигене. В одном варианте осуществления V1 и V2 являются специфичными для двух разных антигенов.
В одном варианте осуществления представляющий интерес антиген, который связан посредством VH/VL, или V1 или V2, дает возможность рекрутинга эффекторных функций, таких как активация пути комплемента и/или рекрутинг эффекторных клеток.
Рекрутинг эффекторной функции может происходить напрямую, то есть эффекторная функция связана с клеткой, и эта клетка несет на своей поверхности молекулу рекрутинга. Опосредованный рекрутинг может происходить, если связывание антигена с антиген-связывающим доменом (например, V1 или V2) в молекуле по изобретению с полипептидом рекрутинга приводит к высвобождению, например, фактора, который, в свою очередь, может прямо или опосредованно осуществлять рекрутинг эффекторной функции, или может происходить посредством активации сигнального пути. Примеры включают интерлейкины IL2, IL6, IL8, интерферон IFNγ, гистамин, C1q, опсонин и другие члены классических и альтернативных каскадов активации комплемента, такие как C2, C4, C3-конвертазы и С5-С9.
Используемый в изобретении термин "полипептид рекрутинга" включает FcγR, например, FcγRI, FcγRII и FcγRIII, белок сигнального пути комплемента, например, но без ограничений, Clq и С3, маркерный белок CD (маркер кластера дифференцировки) или фрагмент любого из указанных белков, обладающий способностью к рекрутингу клеточно-опосредованной эффекторной функции, как напрямую, таки и опосредованно. Полипептид регрутинга также включает молекулы иммуноглобулина, такие как IgG1, IgG2, IgG3, IgG4, IgE и IgA, которые обладают эффекторной функцией.
В одном варианте осуществления антиген-связывающий домен (например, V1 или V2) в молекуле мультиспецифичного антитела согласно настоящему изобретению имеет специфичность в отношении белка сигнального пути комплемента, и особенно предпочтительным является Clq.
Дополнительно, молекулы мультиспецифичного антитела по настоящему изобретению могут быть использованы для хелатных радионуклидов благодаря однодоменному антителу, которое связывается с белком хелатного радионуклида. Такие слитые белки имеют терапевтическое применение в способах визуализации или радионуклидного нацеливания.
В одном варианте осуществления антиген-связывающий домен в молекуле по изобретению (например, V1 или V2) обладает специфичностью в отношении сывороточного белка-носителя, циркулирующей молекулы иммуноглобулина или CD35/CR1, например, для достижения увеличенного периода полужизни фрагмента антитела, обладающего специфичностью для указанного представляющего интерес антигена, путем связывания с указанным сывороточным белком-носителем, циркулирующей молекулой иммуноглобулина или CD35/CR1.
Используемые в изобретении "сывороточные белки-носители" включают тироксин-связывающий белок, транстиретин, α1-кислый гликопротеин, трансферрин, фибриноген и альбумин или фрагмент любого из упомянутых белков.
Используемая в изобретении "циркулирующая молекула иммуноглобулина" включает IgG1, IgG2, IgG3, IgG4, slgA, IgM и IgD, или фрагмент любого из этих иммуноглобулинов.
CD35/CR1 представляет собой белок, присутствующий на эритроцитах, который имеет период полужизни 36 дней (нормальный диапазон составляет от 28 до 47 дней; Lanaro et al 1971, Cancer, 28(3):658-661).
В одном варианте осуществления представляющий интерес антиген, к которому VH/VL обладает специфичностью, является сывороточным белком-носителем, таким как человеческий сывороточный носитель.
В одном варианте осуществления представляющий интерес антиген, к которому V1 обладает специфичностью, является сывороточным белком-носителем, таким как человеческий сывороточный носитель.
В одном варианте осуществления представляющий интерес антиген, к которому V2 обладает специфичностью, является сывороточным белком-носителем, таким как человеческий сывороточный носитель.
В одном варианте осуществления мультиспецифичную молекулу антитела по настоящему изобретению подвергают обработке для достижения улучшенной аффинности к целевому антигену или антигенам. Такие варианты могут быть получены с помощью ряда протоколов созревания аффинности, включающих мутацию областей CDR (Yang et al J. Mol. Biol., 254, 392-403, 1995), перетасовки цепей (Marks et al Bio/Technology, 10, 779-783, 1992), использование мутаторных штаммов E.coli (Low et al J. Mol. Biol., 250, 359-368, 1996), перетасовку ДНК (Patten et al Curr. Opin. Biotechnol 8, 724-733, 1997), технологию фаговых дисплеев (Thompson et al J. Mol. Biol., 256, 77-88, 1996) и ПЦР с имитацией полового размножения (Crameri et al Nature, 391, 288-291, 1998). Эти способы созревания аффинности рассмотрены авторами Vaughan et al. (см. выше).
Улучшенная аффинность, согласно изобретению, в данном контексте относится к улучшению по сравнению с исходной молекулой.
Молекула антитела, используемая в настоящем изобретении, может быть конъюгирована с одной или несколькими эффекторными молекулами, если это желательно. Следует понимать, что эффекторная молекула может содержать единственную эффекторную молекулу или две или больше таких молекул, связанных между собой с образованием единой функциональной группы, которая может быть присоединена к антителам по изобретению. Если желательно получить фрагмент антитела, связанный с эффекторной молекулой, это можно выполнить с помощью стандартных химических способов или методик рекомбинантной ДНК, согласно которым фрагмент антитела присоединяется к эффекторной молекуле или напрямую, или посредством сшивающего агента. Технологии конъюгации таких эффекторных молекул с антителами хорошо известны в данной области (см. Hellstrom et al Controlled Drug Delivery, 2nd Ed., Robinson et al eds., 1987, pp. 623-53; Thorpe et al 1982, Immunol. Rev., 62:119-58 and Dubowchik et al 1999, Pharmacology and Therapeutics, 83, 67-123). Конкретные химические способы включают, например, способы, описанные в заявках WO93/06231, WO92/22583, WO89/00195, WO89/01476 и WO03031581. В качестве альтернативы, если эффекторная молекула представляет собой белок или полипептид, присоединение выполняют с помощью технологии рекомбинантных ДНК, например, согласно заявкам WO86/01533 и EP0392745.
Термин "эффекторные молекулы", используемый в изобретении, включает, например, биологически активные белки, например, ферменты, другие антитела или фрагменты антител, синтетические или природные полимеры, нуклеиновые кислоты и их фрагменты, например, ДНК, РНК и их фрагменты, радионуклиды, в частности, радиойод, радиоизотопы, хелатные металлы, наночастицы и репортерные группы, такие как флуоресцентные соединения или соединения, которые могут быть обнаружены с помощью спектроскопии ядерного магнитного резонанса (ЯМР) или спектроскопии электронного парамагнитного резонанса (ЭПР).
Другие эффекторные молекулы могут включать хелатные радионуклиды, такие как 111In и 90Y, Lu177, висмут213, калифорний252, иридий192 и вольфрам188/рений188; или лекарственные средства, в качестве примера, но без ограничения, алкилфосфохинолины, ингибиторы топоизомеразы I, таксоиды и сурамин.
Другие эффекторные молекулы включают белки, пептиды и ферменты. Представляющие интерес ферменты включают без ограничения протеолитические ферменты, гидролазы, лиазы, изомеразы, трансферазы. Представляющие интерес белки, полипептиды и пептиды включают без ограничения иммуноглобулины, токсины, такие как абрин, рицин A, экзотоксин Pseudomonas или дифтерийный токсин, белок, такой как инсулин, интерферон, бета-интерферон, фактор роста нервов, тромбоцитарный фактор роста или тканевый активатор плазминогена, тромботический агент или антиангиогенный агент, например, ангиостатин или эндостатин, или, биологический модификатор, такой как лимфокин, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), фактор роста нервов (NGF) или другой фактор роста и иммуноглобулины.
В число других эффекторных молекул могут входить детектируемые вещества, полезные, например, при диагностике. Примеры детектируемых веществ включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы, радионуклиды, позитронно-активные металлы (для использования в позитронно-эмиссионной томографии), и ионы нерадиоактивных парамагнитных металлов. См. обзорную информацию в патенте США № 4741900 относительно ионов металлов, которые могут быть конъюгированы с антителами, для использования в качестве диагностических веществ. Подходящие ферменты включают пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразы; подходящие простетические группы включают стрептавидин, авидин и биотин; подходящие флуоресцентные материалы включают умбеллиферон, флуоресцеин, изотиоцианат флуоресцеин, родамин, дихлортриазиниламин флуоресцеин, дансилхлорид и фикоэритрин; подходящие люминесцентные материалы включают люминол; подходящие биолюминесцентные материалы включают люциферазу, люциферин и экворин; и подходящие радионуклиды включают 125I, 131I, 111In и 99Tc.
В другом варианте осуществления эффекторная молекула может увеличивать время полужизни антитела in vivo, и/или снижать иммуногенность антитела и/или улучшать доставку антитела через эпителиальный барьер к иммунной системе. Примеры подходящих эффекторных молекул этого типа включают полимеры, альбумин, альбумин-связывающие белки или альбумин-связывающие соединения, такие как соединения, описанные в WO05/179841.
Если эффекторная молекула является полимером, в общем, это может быть синтетический полимер или полимер природного происхождения, например, полиалкиленовый, полиалкениленовый или полиоксиалкиленовый полимер с необязательно замещенной прямой или разветвленной цепью, или разветвленный или неразветвленный полисахарид, например, гомо- или гетеро-полисахарид.
Конкретные необязательные заместители, которые могут присутствовать в указанных выше синтетических полимерах, включают одну или несколько групп гидрокси, метила или метокси.
Конкретные примеры синтетических полимеров включают поли(этиленгликоль), поли(пропиленгликол), поли(виниловый спирт), необязательно с замещенной прямой или разветвленной цепью, или их производные, в частности, необязательно замещенный поли(этиленгликоль), например, метоксиполи(этиленгликоль) или его производные.
Конкретные природные полимеры включают лактозу, амилозу, декстран, гликоген или их производные.
Используемый в изобретении "производные" включают реакционноспособные производные, например, тиол-селективные реакционноспособные группы, такие как малеимид, и тому подобное. Реакционноспособная группа может быть присоединена к полимеру непосредственно или посредством линкерного сегмента. Следует понимать, что остаток такой группы в некоторых случаях образует часть продукта в виде связывающей группы между фрагментом антитела и полимером.
Размер полимера можно варьировать по желанию, но обычно средняя молекулярная масса составляет от 500 Да до 50000 Да, например, от 5000 до 40000 Да, например, от 20000 до 40000 Да. Размер полимера может быть выбран, в частности, исходя из предполагаемого применения продукта, например, для возможности локализации определенных тканей, таких как опухоли, или продления периода полужизни в кровотоке (см. обзорную публикацию Chapman, 2002, Advanced Drug Delivery Reviews, 54, 531-545). Так, например, если продукт предназначен для выхода из циркуляторного русла и проникновения в ткани, например, для применения в лечении опухоли, предпочтительным может быть использование полимера с малой молекулярной массой, например, с молекулярной массой около 5000 Да. Для применений с условием пребывания продукта в циркуляторном русле может иметь преимущество использование полимера с более высокой молекулярной массой, например, полимера с молекулярной массой в диапазоне от 20000 Да до 40000 Да.
Подходящие полимеры включают полиалкиленовый полимер, например, поли(этиленгликоль) или, в частности, метоксиполи(этиленгликоль) или его производное, и особенно с молекулярной массой в диапазоне приблизительно от 15000 Да приблизительно до 40000 Да.
В одном варианте осуществления антитела, применяемые в настоящем изобретении, присоединены к функциональным группам поли(этиленгликоля) (ПЭГ). В одном конкретном примере антитело представляет собой фрагмент антитела, и молекулы ПЭГ могут быть присоединены через любую доступную аминокислотную боковую цепь или концевую аминокислотную функциональную группу, расположенную в фрагменте антитела, например, через любую свободную амино, имино, тиольную, гидроксильную или карбоксильную группу. Такие аминокислоты могут встречаться во фрагменте антитела в природе или могут быть вставлены во фрагмент генноинженерным способом с использованием технологии рекомбинантных ДНК (см., например, US5219996, US5667425, W098/25971, WO2008/038024). В одном варианте осуществления молекула антитела по изобретению является модифицированным фрагментом Fab, и эта модификация представляет собой добавление одной или нескольких аминокислот к С-концу его тяжелой цепи, что позволяет присоединять эффекторную молекулу. Соответственно, дополнительные аминокислоты образуют модифицированную шарнирную область, содержащую один или несколько остатков цистеина, к которым может присоединяться эффекторная молекула. Для присоединения двух или нескольких молекул ПЭГ можно использовать несколько сайтов.
Подходящие молекулы ПЭГ ковалентно связаны через тиольную группу, которая принадлежит по меньшей мере одному остатку цистеина, расположенному во фрагменте антитела. Каждая молекула полимера, присоединенная к фрагменту модифицированного антитела, может быть ковалентно связана с атомом серы в остатке цистеина, расположенного в этом фрагменте. Ковалентная связь обычно представляет собой дисульфидную связь или, в частности, связь сера-углерод. Если в качестве точки присоединения подходящим образом активированных эффекторных молекул используется тиоловая группа, можно использовать, например, тиоловые селективные производные, такие как малеимид, и производные цистеина. Активированный полимер может быть использован в качестве исходного материала при получении фрагментов антитела, модифицированных полимером, как описано выше. Активированный полимер может представлять собой любой полимер, содержащий тиольную реакционноспособную группу, такую как α-галогенкарбоновую кислоту или сложный эфир, например, иодацетамид, имид, например, малеимид, винилсульфон или дисульфид. Такие исходные материалы могут быть коммерчески доступны (например, от компании Nektar, ранее Shearwater Polymers Inc., Huntsville, AL, USA), или могут быть получены из коммерчески доступных исходных материалов с использованием обычных химических технологий. Конкретные молекулы ПЭГ включают 20K метокси-ПЭГ-амин (доступный от компании Nektar, ранее Shearwater; Rapp Polymere и SunBio) и M-PEG-SPA (доступный от компании Nektar, ранее Shearwater).
В одном варианте осуществления IgG, F(аb')2, Fab или Fab' в молекуле являются пегилированными, то есть имеют ПЭГ (поли(этиленгликоль)), ковалентно присоединенный к ним, например, в соответствии со способом, описанным в патентах ЕР0948544 или ЕР1090037 ["Poly(ethyleneglycol) Chemistry, Biotechnical and Biomedical Applications", 1992, J. Milton Harris (ed), Plenum Press, New York, "Poly(ethyleneglycol) Chemistry and Biological Applications", 1997, J. Milton Harris and S. Zalipsky (eds), American Chemical Society, Washington DC and "Bioconjugation Protein Coupling Techniques for the Biomedical Sciences", 1998, M. Aslam and A. Dent, Grove Publishers, New York; Chapman, A. 2002, Advanced Drug Delivery Reviews 2002, 54:531-545]. В одном варианте осуществления ПЭГ присоединен к цистеину в шарнирной области. В одном примере, модифицированный ПЭГ Fab-фрагмент имеет малеимидную группу, ковалентно связанную с одной тиольной группой в модифицированной шарнирной области. Остаток лизина может быть ковалентно связан с малеимидной группой, и к каждой из аминных групп на остатке лизина может быть присоединен полимер метоксиполи(этиленгликоль), имеющий молекулярную массу приблизительно 20000 Да. Таким образом, общая молекулярная масса ПЭГ, присоединенного к Fab фрагменту, может составлять приблизительно 40000 Да.
Конкретные молекулы ПЭГ включают лизин, модифицированный с помощью 2-[3-(N-малеимидо)пропионамидо]этиламид Ν,Ν'-бис(метоксиполи(этиленгликоля), молекулярная масса 20000 Да), также известного как PEG2MAL40K (доступного в компании Nektar, ранее Shearwater).
В число альтернативных поставщиков ПЭГ-линкеров входит компания NOF, которая поставляет GL2-400MA2 (m в приведенной ниже структуре равен 5) и GL2-400MA (m в приведенной ниже структуре равен 2) и n составляет приблизительно 450:
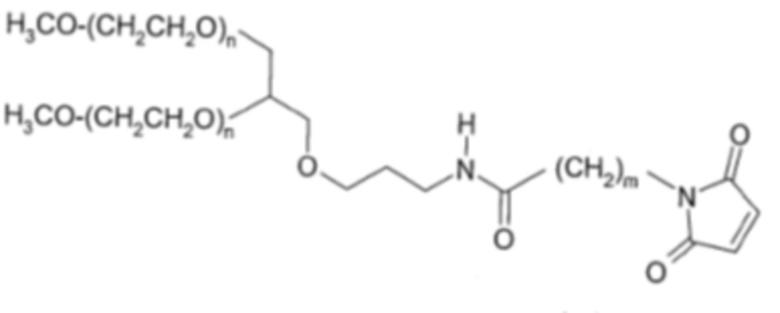
То есть каждый из ПЭГ имеет молекулярную массу приблизительно 20000 Да.
Другие альтернативные ПЭГ-эффекторные молекулы имеют следующую типовую формулу:
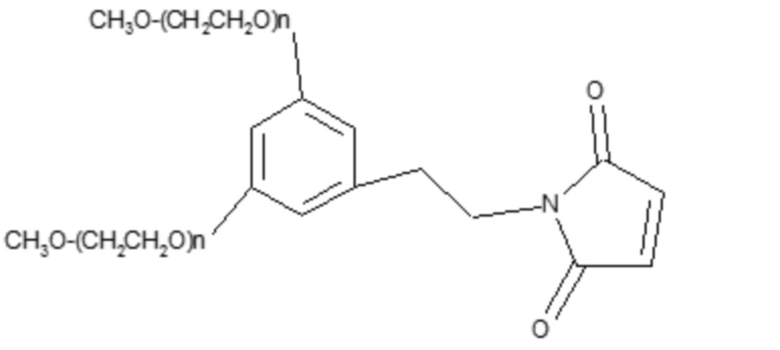
и их можно приобрести в компаниях Dr. Reddy, NOF и Jenkem.
В одном варианте осуществления изобретение относится к молекуле антитела, которая является пегилированной (например, с помощью вышеописанного ПЭГ) путем присоединения через аминокислотный цистеиновый остаток, расположенный в положении аминокислоты 226 в цепи, или приблизительно в этом положении, например, в аминокислоте 226 тяжелой цепи (при последовательной нумерации).
В одном варианте осуществления изобретение относится к полинуклеотидной последовательности, кодирующей молекулу по изобретению, например, к ДНК-последовательности.
В одном варианте осуществления изобретение относится к полинуклеотидной последовательности, кодирующей один или несколько полипептидных компонентов, например, два или больше, или три или больше полипептидных компонентов молекулы по изобретению.
В одном варианте осуществления полипептиды не содержат мутации типа "выступ-во-впадину".
"Мутации", используемые в изобретении, относятся к нуклеиновой или аминокислотной последовательности, содержащей одно или несколько природных или сконструированных изменений последовательности нуклеиновой кислоты/аминокислоты, по сравнению с соответствующей последовательностью дикого типа.
Используемые в изобретении понятия "выступ-во-впадину" или "выступы и впадины" относятся к выпуклостям на поверхности первого полипептида и соответствующим углублениям на поверхности второго полипептида, таким образом, что эта выпуклость может располагаться внутри углубления, тем самым способствуя образованию гетеромультимера и препятствуя образованию гомомультимера. В этой связи, можно упомянуть патент US8216805, в котором описано применение этого способа получения гетеромультимерных полипептидов, таких как биспецифичные антитела, и содержание указанного патента включено в настоящее изобретение.
В одном варианте осуществления полинуклеотид, например, ДНК, содержится в векторе.
Общие способы конструирования векторов, способы трансфекции и способы культивирования хорошо известны специалистам в данной области. В этой связи можно сделать ссылки на издание ʺCurrent Protocols in Molecular Biologyʺ, 1999, F. M. Ausubel (ed), Wiley Interscience, New York, и руководство Maniatis Manual, опубликованное Cold Spring Harbor Publishing.
Настоящее изобретение также относится к клетке-хозяину, содержащей один или несколько векторов клонирования или экспрессии, которые содержат одну или несколько последовательностей ДНК, кодирующих антитела по настоящему изобретению. Можно использовать любую подходящую клетку-хозяин/векторную систему для экспрессии последовательностей ДНК, кодирующих молекулу антитела по настоящему изобретению. Можно использовать бактериальные системы, например, E.coli, и другие микробные системы, или также можно использовать экспрессионные системы в клетке-хозяине с эукариотическими клетками, например, клетками млекопитающих. Подходящие клетки-хозяева млекопитающих включают клетки яичника китайского хомячка CHO, клетки миеломы или гибридомы.
Как описано в изобретении выше, мультиспецифичные белки по настоящему изобретению содержат три полипептидные цепи, тяжелую и легкую цепь, и третий "свободный" вариабельный домен, который присоединен посредством дисульфидной связи, для образования dsFv, который представляет собой V1 и/или V2. Таким образом, настоящее изобретение также относится к способу получения молекулы мультиспецифичного антитела по настоящему изобретению, и указанный способ содержит культивирование клетки-хозяина, несущей вектор или векторы по изобретению, в условиях, подходящих для осуществления экспрессии белка из ДНК, кодирующей упомянутые три полипептидные цепи молекулы мультиспецифичного антитела по изобретению, и выделение молекулы мультиспецифичного антитела. В одном примере такого способа одна полипептидная цепь состоит из вариабельного домена из V1 и/или V2, то есть "свободного" вариабельного домена, который образует пару с комплементарным к нему доменом VH или VL из V1 и/или V2 посредством дисульфидной связи. Также изобретение относится к мультиспецифичным антителам, которые получены или могут быть получены с помощью этого способа.
Для получения продуктов, содержащих и тяжелые и легкие цепи, клеточная линия может быть трансфицирована двумя векторами, при этом первый вектор кодирует полипептид легкой цепи и второй вектор кодирует полипептид тяжелой цепи. Альтернативно, можно использовать единственный вектор, который включает последовательности, кодирующие легкую цепь и тяжелую цепь полипептидов. В одном примере клеточная линия может быть трансфицирована тремя векторами, каждый из которых кодирует полипептидную цепь молекулы антитела по изобретению. В качестве альтернативы, может быть использован единственный вектор, который включает последовательностей, кодирующие три полипептидных цепи.
В одном варианте осуществления клеточная линия трансфицирована двумя векторами, каждая из которых кодирует разный полипептид, выбранный из раскрытых в данном изобретении полипептидов, например:
а) полипептидная цепь, имеющая формулу (I):
VH-CH1-CH2-CH3-X-(V1)p; и
b) полипептидная цепь, имеющая формулу (II)
VL-CL-Y-(V2)q;
в которой:
VH представляет собой вариабельный домен тяжелой цепи;
CH1 представляет собой домен константной области тяжелой цепи, например, ее домен 1;
СН2 представляет собой домен константной области тяжелой цепи, например, ее домен 2;
СН3 представляет собой домен константной области тяжелой цепи, например, ее домен 3;
Х представляет собой связь или линкер;
Y представляет собой связь или линкер;
V1 представляет собой dsFv, sdAb, dsscFv или scFv;
VL представляет собой вариабельный домен, например, вариабельный домен легкой цепи;
CL представляет собой домен из константной области, например, домен из константной области легкой цепи, такой как C-каппа;
V2 представляет dsFv, sdAb, dsscFv или scFv;
р равен 0 или 1;
q равен 0 или 1;
при этом по меньшей мере один из V1 или V2 является dsFv, и
если V1 представляет собой dsFv, и р равно 1, и q равно 0, то молекула представлена в виде димера с двумя тяжелыми цепями формулы (I) и двумя присоединенными легких цепями формулы (II).
В одном варианте осуществления, в котором р равно 1, V1 представляет собой dsFv, и q равно 0, имеются по меньшей мере две полипептидные цепи формулы (I).
В одном варианте осуществления, в котором V1 представляет собой dsFv и домен VH из V1 присоединен к X, клеточная линия может быть трансфицирована третьим вектором, который кодирует домен VL из V1.
В одном варианте осуществления, в котором V1 представляет собой dsFv и домен VL из V1 присоединен к X, клеточная линия может быть трансфицирована третьим вектором, который кодирует домен VH из V1.
В одном варианте осуществления, в котором V2 представляет собой dsFv и домен VH из V2 присоединен к Y, клеточная линия может быть трансфицирована третьим вектором, который кодирует домен VL из V2.
В одном варианте осуществления, в котором V2 представляет собой dsFv и домен VL из V2 присоединен к Y, клеточная линия может быть трансфицирована третьим вектором, который кодирует домен VH из V2.
Следует понимать, что пропорцию каждого вектора, трансфицированного в клетку-хозяина, можно варьировать с целью оптимизации экспрессии продукта - мультиспецифичного антитела. В одном варианте осуществления соотношение векторов равно 1: 1: 1. Следует понимать, что специалист в данной области способен найти оптимальное соотношение путем рутинного анализа уровня экспрессии белка после трансфекции.
Следует также понимать, что, когда два или больше полипептидных компонентов, в частности, три или больше полипептидных компонентов кодируются полинуклеотидом в единственном векторе, относительную экспрессию каждого полипептидного компонента можно варьировать, если это желательно, путем использования разных промоторов для каждого полинуклеотида, кодирующего полипептидный компонент по настоящему изобретению.
В одном варианте осуществления вектор содержит единственную полинуклеотидную последовательность, кодирующую все три полипептидные цепи молекулы мультиспецифичного антитела согласно настоящему изобретению, под контролем единственного промотора.
В одном варианте осуществления вектор содержит единственную полинуклеотидную последовательность, кодирующую все три полипептидные цепи молекулы мультиспецифичного антитела согласно настоящему изобретению, при этом каждая полинуклеотидная последовательность, кодирующая каждую полипептидную цепь, контролируется разными промоторами.
Хороший уровень экспрессии антител и их фрагментов согласно настоящему изобретению достигается из клеток-хозяев. Таким образом, предполагается, что свойства антител и/или их фрагментов оптимизированы и способствуют промышленной обработке.
Преимуществом является то, что молекулы мультиспецифичных антител по настоящему изобретению количественно уменьшают агрегацию, наблюдаемую после очистки, и увеличивают количество мономера в композициях упомянутой конструкции при фармацевтических концентрациях. Например, количество мономера в очищенном белке, присутствующем в качестве "мономера", может составлять 50%, 60%, 70% или 75% или больше, например, 80, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% или больше.
Антитела по настоящему изобретению и содержащие их композиции являются полезными для лечения, например, для лечения и/или профилактики патологического состояния, в частности, описанного в изобретении.
Патологическое состояние или расстройство может быть выбрано, например, из группы, состоящей из следующего: инфекции (вирусные, бактериальные, грибковые и паразитарные), эндотоксиновый шок, обусловленный инфекцией, артрит, например, ревматоидный артрит, астма, например, тяжелая астма, хроническая обструктивная болезнь легких (ХОБЛ), воспалительное заболевание тазовых органов, болезнь Альцгеймера, воспалительное заболевание кишечника, болезнь Крона, неспецифичный язвенный колит, болезнь Пейрони, целиакия, заболевание желчного пузыря, пилонидальная болезнь, перитонит, псориаз, васкулит, хирургические спайки, инсульт, диабет I типа, болезнь Лайма, менингоэнцефалит, аутоиммунный увеит, иммунно-опосредованные воспалительные заболевания центральной и периферической нервной системы, такие как рассеянный склероз, волчанка (например, системная красная волчанка) и синдром Гийена-Барре, атопический дерматит, аутоиммунный гепатит, фиброзирующий альвеолит, болезнь Грейвса, IgA-нефропатия, идиопатическая тромбоцитопеническая пурпура, болезнь Меньера, пузырчатка, первичный билиарный цирроз печени, саркоидоз, склеродермия, гранулематоз Вегенера, другие аутоиммунные заболевания, панкреатит, травма (операция), реакция трансплантат против хозяина, отторжение трансплантата, заболевания сердца, включающие ишемические болезни, такие как инфаркт миокарда, а также атеросклероз, внутрисосудистое свертывание, резорбция кости, остеопороз, остеоартрит, периодонтит и гипохлоридия.
Настоящее изобретение также относится к молекуле мультиспецифичного антитела согласно настоящему изобретению для применения в лечении или профилактике боли, в частности, боли, связанной с воспалением.
Настоящее изобретение также относится к фармацевтической или диагностической композиции, содержащей молекулу антитела по изобретению в комбинации с одним или несколькими фармацевтически приемлемыми наполнителем, разбавителем или носителем.
Упомянутая композиция обычно поставляется в виде части стерильной фармацевтической композиции, которая, как правило, включает фармацевтически приемлемый носитель. Фармацевтическая композиция по настоящему изобретению может дополнительно содержать фармацевтически приемлемое вспомогательное вещество.
Настоящее изобретение также относится к способу получения фармацевтической или диагностической композиции, и указанный способ включает добавление и смешивание молекулы антитела по изобретению вместе с одним или несколькими веществами, такими как фармацевтически приемлемые наполнитель, разбавитель или носитель.
Молекула антитела может быть единственным активным ингредиентом в фармацевтической или диагностической композиции или может находиться в комбинации с другими активными ингредиентами, включающими другие ингредиенты в виде антител, например, антитело против IL-1β, антитело против Т-клеток, антитело против IFNγ или антитело против липополисахарида (LPS), или ингредиенты, отличные от антител, например, ксантины. Другие подходящие активные ингредиенты включают антитела, способные индуцировать толерантность, например, антитело против CD3 или антитело против CD4.
В дополнительном варианте осуществления антитело, фрагмент или композиции по изобретению используют в комбинации с дополнительным фармацевтически активным агентом.
Фармацевтические композиции, соответственно, содержат терапевтически эффективное количество антитела по изобретению или его кратные количества.
Термин "терапевтически эффективное количество", используемый в изобретении, относится к количеству терапевтического вещества, необходимому для лечения, ослабления или предотвращения целевого заболевания или состояния, или для достижения определяемого терапевтического или профилактического эффекта. Терапевтически эффективное количество для любого антитела может быть изначально определено или в анализах на клеточных культурах или в моделях на животных, обычно на грызунах, кроликах, собаках, свиньях или приматах. Животная модель может быть также использована для определения подходящего диапазона концентраций и способа введения. Такую информацию можно использовать для определения подходящих доз и способов их введения человеку.
Точное терапевтически эффективное количество для человека будет зависеть от тяжести состояния заболевания, общего состояния здоровья пациента, от его возраста, веса и пола, рациона питания, времени и частоты введения, комбинации (комбинаций) лекарственных средств, реакции чувствительности и переносимости/реакции на лечение. Это количество может быть определено с помощью рутинных экспериментов и находится на усмотрении врача. Обычно терапевтически эффективное количество составляет от 0,01 мг/кг до 50 мг/кг, например, от 0,1 мг/кг до 20 мг/кг. Альтернативно, эта доза может составлять от 1 до 500 мг в сутки, например, от 10 до 100, 200, 300 или 400 мг в сутки. Фармацевтические композиции могут для удобства поставляться в стандартной дозированной форме, содержащей заранее определенное количество активного вещества по изобретению.
Композиции можно вводить пациенту по отдельности или можно вводить в комбинации (например, одновременно, последовательно или раздельно) с другими веществами, лекарственными средствами или гормонами.
Доза, в которой вводят молекулу антитела по изобретению, зависит от характера состояния, подлежащего лечению, степени имеющегося воспаления и от цели введения молекулы антитела, а именно, введения с профилактической целью или для лечения существующего состояния.
Частота введения дозы зависит от периода полужизни молекулы антитела и продолжительности ее эффекта. Если молекула антитела имеет короткий период полужизни (например, от 2 до 10 часов), может быть необходимым введение одной или нескольких доз в сутки. Альтернативно, если молекула антитела имеет большой период полужизни (например, от 2 до 15 дней), может потребоваться введение дозы только один раз в сутки, один раз в неделю или даже один раз за один или два месяца.
Фармацевтически приемлемый носитель не должен сам по себе индуцировать выработку антител, вредных для получающего композицию человека, и не должен быть токсичным. Подходящими носителями могут быть крупные, медленно метаболизируемые макромолекулы, такие как белки, полипептиды, липосомы, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы.
Можно использовать фармацевтически приемлемые соли, например, соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты, или соли органических кислот, такие как ацетаты, пропионаты, малонаты и бензоаты.
Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, например, воду, физиологический раствор, глицерин и этанол. Дополнительно, в таких композициях могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие вещества или рН-буферные вещества. Такие носители позволяют приготовить фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей и суспензий, для приема внутрь пациентом.
Подходящие формы для введения включают формы, пригодные для парентерального введения, например, путем инъекции или инфузии, например, путем болюсной инъекции или непрерывной инфузии. Если продукт предназначен для инъекции или инфузии, он может быть в виде суспензии, раствора или эмульсии в масляном или водном носителе, и может содержать вспомогательные вещества, такие как суспендирующие, консервирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, молекула антитела может быть в сухой форме, предназначенной для восстановления перед использованием путем добавления подходящей стерильной жидкости.
После приготовления композицию по изобретению можно вводить непосредственно субъекту. Субъектами, подлежащими лечению, могут быть животные. Вместе с тем, в одном или нескольких вариантах осуществления композиции сделаны подходящими для введения человеку.
В одном варианте осуществления в композициях по изобретению рН конечной композиции не совпадает со значением изоэлектрической точки (pI) антитела или его фрагмента, то есть, если значение рН композиции равно 7, то значение pI от 8-9 или выше может быть целесообразным. Без связи с конкретно теорией, предполагается, что в конечном счете это приведет к получению конечной композиции с улучшенной стабильностью, например, когда антитело или его фрагмент остаются в растворе.
Фармацевтические композиции по изобретению можно вводить любым количеством способов, включающих без ограничения пероральный, внутривенный, внутримышечный, внутриартериальный, интрамедуллярный, интратекальный, внутрижелудочковый, трансдермальный, чрескожный (например, см. WO98/20734), подкожный, внутрибрюшинный, интраназальный, энтеральный, местный, сублингвальный, интравагинальный или ректальный пути введения. Также для введения фармацевтических композиций по настоящему изобретению могут быть использованы безыгольные шприцы. Обычно терапевтические композиции могут быть приготовлены в форме для инъекций, в виде жидких растворов или суспензий. Также можно делать твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией. Предпочтительно, молекулы антитела по настоящему изобретению вводят подкожно, путем ингаляции или местно.
Прямую доставку композиций обычно осуществляют путем инъекции, подкожно, внутрибрюшинно, внутривенно или внутримышечно, или путем доставки в интерстициальное пространство ткани. Композиции можно также вводить в определенную ткань, представляющую интерес. При этом лечение можно проводить по схеме с однократным введением или с многократным введением дозы.
Следует понимать, что активным ингредиентом в композиции является молекула антитела. Как таковая, она подвержена расщеплению в желудочно-кишечном тракте. Таким образом, если для введения композиция задействован желудочно-кишечный тракт, такая композиция должна содержать вещества, которые защищают антитело от расщепления, но при этом высвобождают антитело после его всасывания из желудочно-кишечного тракта.
Подробное рассмотрение фармацевтически приемлемых носителей см. в издании Remington's Pharmaceutical Sciences (Mack Publishing Company, N.J. 1991).
В одном варианте осуществления композиция представлена в виде композиции для местного применения, в том числе путем ингаляции.
Подходящие ингаляционные препараты включают ингаляционные порошки, аэрозоли, содержащие газы-пропелленты, или ингаляционные растворы, не содержащие газы-пропелленты (например, распыляемые растворы или суспензии). Ингаляционные порошки по изобретению, содержащие активное вещество, могут состоять исключительно из вышеуказанных активных веществ или из смеси вышеуказанных активных веществ с физиологически приемлемым наполнителем.
Эти ингаляционные порошки могут включать моносахариды (например, глюкозу или арабинозу), дисахариды (например, лактозу, сахарозу, мальтозу) олиго- и полисахариды (например, декстраны), полиспирты (например, сорбит, маннит, ксилит), соли (например, хлорид натрия, карбонат кальция) или их смеси друг с другом. Удобно использовать моно- или дисахариды. Лактоза или глюкоза применяются, в частности, но не исключительно, в виде их гидратов.
Требуемый размер частиц для осаждения в легких составляет менее 10 мкм, например, от 1 до 9 мкм, например от 0,1 до 5 мкм, в частности, от 1 до 5 мкм. Размер частиц активного вещества (например, антитела или фрагмента антитела) имеет первостепенное значение.
Газы-пропелленты, которые можно использовать для получения ингаляционных аэрозолей, известны в данной области. Подходящие газы-пропелленты выбраны из группы, включающей углеводороды, такие как n-пропан, n-бутан или изобутан, и галогенсодержащие углеводороды, такие как хлорированные и/или фторированные производные метана, этана, пропана, бутана, циклопропана или циклобутана. Упомянутые газы-пропелленты могут быть использованы как есть или в виде смесей.
Особенно подходящими газами-пропеллентами являются галогенированные производные алканов, выбранные из группы TG 11, TG 12, TG 134а и TG227. Из вышеуказанных галогенированных углеводородов особенно подходящими являются TG134a (1,1,1,2-тетрафторэтан) и TG227 (1,1,1,2,3,3,3-гептафторпропан) и их смеси.
Содержащие газ-пропеллент ингаляционные аэрозоли могут также содержать другие ингредиенты, такие как сорастворители, стабилизаторы, поверхностно-активные вещества (ПАВ), антиокислители, смазочные материалы и средства для регулирования рН. Все эти компоненты известны в данной области техники.
Ингаляционные аэрозоли, содержащие газ-пропеллент по изобретению, могут содержать активное вещество в количестве до 5% по массе. Аэрозоли по изобретению содержат активное вещество в количестве, например, от 0,002 до 5% по массе, от 0,01 до 3% по массе, от 0,015 до 2% по массе, от 0,1 до 2% по массе, от 0,5 до 2% по массе или от 0,5 до 1% по массе.
В качестве альтернативы, также можно применять местное введение композиции жидкого раствора или суспензии в легкие, например, с использованием устройства, такого как небулайзер, например, с помощью соединенного с компрессором небулайзера (например, небулайзера PARI LC-Jet Plus(R), подключенного к компрессору Pari Master(R) производства Pari Respiratory Equipment, Inc., Richmond, Va.).
В одном варианте осуществления композиция представлена в виде раздельных ампул, содержащих однократную дозу для доставки путем распыления.
В одном варианте осуществления антитело поставляется в лиофилизированной форме, для восстановления или, альтернативно, в виде суспензионной композиции.
Антитело по настоящему изобретению может доставляться в диспергированном виде в растворителе, например, в виде раствора или суспензии. Его можно суспендировать в соответствующем физиологическом растворе, например, физиологическом солевом растворе, фармакологически приемлемом растворителе или в буферном растворе. Буферные растворы, известные в данной области, могут содержать динатрия эдетат в количестве от 0,05 мг до 0,15 мг, NaCl в количестве от 8,0 мг до 9,0 мг, полисорбат в количестве от 0,15 мг до 0,25 мг, безводную лимонную кислоту в количестве от 0,25 мг до 0,30 мг и цитрат натрия в количестве от 0,45 мг до 0,55 мг на 1 мл воды, с целью достижения уровня рН приблизительно от 4,0 до 5,0. Как упоминалось выше, можно приготовить суспензию, например, из лиофилизированного антитела.
Композиция может, необязательно, содержать другие молекулы, способные изменить характеристики популяции антител по изобретению, например, способные уменьшать, стабилизировать, замедлять, модулировать и/или активировать функции антител.
Терапевтические композиции суспензий или растворов также могут содержать один или несколько наполнителей. Наполнители хорошо известны в данной области и включают буферы (например, цитратный буфер, фосфатный буфер, ацетатный буфер и бикарбонатный буфер), аминокислоты, мочевину, спирты, аскорбиновую кислоту, фосфолипиды, белки (например, сывороточный альбумин), ЭДТА, хлорид натрия, липосомы, маннит, сорбит и глицерин. Растворы или суспензии могут быть инкапсулированы в липосомы или биоразлагаемые микросферы. Эти композиции обычно поставляются по существу в стерильной форме и изготовлены в стерильных производственных условиях.
Такие способы изготовления включают производство и стерилизацию путем фильтрации раствора буферного растворителя, используемого в рецептуре, асептическое суспендирование антитела в стерильном растворе буферного растворителя и диспергирование композиции в стерильные сосуды способами, хорошо известными специалистам в данной области.
Распыляемая композиция по изобретению может быть предоставлена, например, в виде упаковок однократных доз (например, в герметичных пластиковых контейнерах или флаконах), упакованных в пакетики из фольги. Каждый флакон содержит стандартную дозу в объеме растворителя/буферного раствора, который составляет, например, 2 мл.
Антитела по настоящему изобретению считаются подходящими для доставки путем распыления.
Также предполагается, что антитело по изобретению можно вводить, применяя генную терапию. Для этого пациенту вводят последовательности ДНК, кодирующие тяжелую и легкую цепи молекулы антитела под контролем соответствующих компонентов ДНК, таким образом, что цепи антитела экспрессируются из ДНК-последовательностей и собираются in situ.
В одном варианте осуществления изобретение относится к способу очистки мультиспецифичных антител (в частности, антитела или его фрагмента по изобретению).
В одном варианте осуществления изобретение относится к способу очистки мультиспецифичных антител (в частности, антитела или его фрагмента по изобретению), и указанный способ включает следующие этапы: проведение анионообменной хроматографии в режиме без связывания, таким образом, что примеси задерживаются на колонке и антитело сохраняется в несвязанной фракции. Этот этап можно осуществлять, например, при уровне рН приблизительно от 6 до 8.
Указанный способ может дополнительно включать начальный этап захвата с помощью катионообменной хроматографии, которую проводят, например, при уровне рН приблизительно от 4 до 5.
Указанный способ может дополнительно включать дополнительные этап (этапы) хроматографии с целью гарантированного надлежащего отделения продукта и примесей, возникающих в ходе этапов, из потока продуктов.
Способ очистки может также включать один или несколько этапов ультрафильтрации, например, этапы концентрирования и диафильтрации.
Упомянутая выше очищенная форма означает, что степень ее чистоты составляет по меньшей мере 90%, например, 91, 92, 93, 94, 95, 96, 97, 98, 99% вес/вес или более высокую степень чистоты.
Продукт, по существу не содержащий эндотоксина, обычно означает продукт, в котором содержание эндотоксина составляет 1 EU (единицу эндотоксина) на 1 мг продукта антитела или меньше, например, 0,5 или 0,1 EU на 1 мг продукта.
Отсутствие по существу белка или ДНК клетки-хозяина обычно означает, что содержание белка или ДНК клетки-хозяина составляет 400 мкг на 1 мг продукта-антитела или меньше, например, 100 мкг на 1 мг или меньше, в частности, 20 мкг на 1 мг, в зависимости от требований.
Молекулы антитела по настоящему изобретению также могут быть использованы в диагностике, например, для диагностики и визуализации in vivo.
"Содержащий" в контексте настоящей заявки имеет включительное толкование. Там, где это технически возможно, варианты осуществления настоящего изобретения можно комбинировать. Варианты осуществления описаны в данном документе как содержащие определенные признаки/элементы. Настоящее изобретение также распространяется на отдельные варианты осуществления, состоящие или по существу состоящие из указанных признаков/элементов. Технические ссылки, такие как патенты и патентные заявки, включены в настоящее изобретение в качестве ссылки.
Любые варианты осуществления, указанные в изобретении конкретно и в явном виде, могут стать основой для отказа от формулы, как по отдельности, так и в сочетании с одним или несколькими дополнительными вариантами осуществления.
Настоящее изобретение далее описано с помощью следующих примеров, приведенных только в качестве иллюстрации, со ссылкой на прилагаемые чертежи:
Краткое описание чертежей
Фигура 1 показывает различные конструкции мультиспецифичного антитела по настоящему изобретению.
В виде IgG-dsFv.
Фигура 2 показывает анализ способом электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) различных связанных конструкций белок А - очищенная тяжелая цепь (HC) по изобретению.
(А) невосстановленные образцы.
(B) восстановленные образцы.
Фигура 3 показывает анализ SDS-PAGE различных связанных конструкций белок А - очищенная легкая цепь (LC) по изобретению.
(A) невосстановленные образцы.
(B) восстановленные образцы
ПРИМЕРЫ
Антитела/фрагменты к АНТИГЕНУ 1 обозначены # 1
Антитела/фрагменты к АНТИГЕНУ 2 обозначены # 2
Антитела/фрагменты к АНТИГЕНУ 3 обозначены # 3
Антитела/фрагменты к АНТИГЕНУ 4 обозначены # 4
Пример 1. Создание молекул антител настоящего изобретения (IgG-dsFv)
Конструирование плазмид для экспрессии в клетках млекопитающих
Для конструкций антител IgG #2-dsFv #1
Плазмиды для экспрессии IgG #2-dsFv #1 (см. фиг. 1) были сконструированы путем слияния #1VL или #1VH к С-концом человеческой константной области каппа Km3 аллотипа из легкой цепи # 2, с использованием гибкого линкера SGGGGSGGGGS [также называемого в изобретении S, 2xG4S] (SEQ ID NO: 1), или путем слияния #1VL или #1VH с С-концом константной области человеческой гамма-1 СН3 изотипа γ1 из тяжелой цепи #2, с использованием гибкого линкера SGGGGSGGGGS (SEQ ID NO: 1). Дополнительно, были введены точечные мутации в ДНК-последовательности в выбранных остатках в каркасной области и в #1VL и в #1VH. Мутации были введены (в тяжелую цепь G44C и легкую цепь G100C) с целью создания межцепочечной дисульфидной связи между тяжелой и легкой цепями #1Fv.
Фрагменты генов, кодирующие свободный домен #1dsvL и свободный домен #1dsvH, были изготовлены химически и слиты с IgG #2, как описано выше, с целью создания следующего:
IgG #2 легкая цепь - (SGGGGSGGGGS)-dsvL #1 [Плазмида A];
IgG #2 легкая цепь - (SGGGGSGGGGS)-dsvH #1 [Плазмида B];
IgG #2 тяжелая цепь - (SGGGGSGGGGS)-dsvL #1 [Плазмида C]; и
IgG #2 тяжелая цепь - (SGGGGSGGGGS)-dsvH #1 [Плазмида D].
Для конструкций антител IgG #2-dsscFv #1 и IgG #2-scFv #1
Плазмиды для экспрессии IgG #2-dsscFv #1 и IgG #2-scFv #1 были сконструированы следующим образом. Одноцепочечный фрагмент Fv (scFv) был создан путем присоединения N-конца #1VL к С-концу #1VH с помощью гибкого линкера GGGGSGGGGSGGGGSGGGGS [также называемого в изобретении 4xG4S] (SEQ ID NO: 68). Для создания dsscFv были введены точечные мутации в ДНК-последовательности, в каркасные остатки G10°C в #1VL и G44C в #1VH для образования дисульфидной связи в scFv (dsscFv).
Фрагменты генов, кодирующие scFv #1 и dsscFv #1, были изготовлены химическим путем и слиты или с С-концом константной области человеческой каппа, Km3 аллотип из легкой цепи #2, с использованием гибкого линкера SGGGGSGGGGS (SEQ ID NO: 1), с целью создания следующего:
#2 легкая цепь - (SGGGGSGGGGS)-dsscFv #1 (dsvH-4xG4S-dsvL) [Плазмида E1];
#2 легкая цепь - (SGGGGSGGGGS)-dsscFv #1 (dsvL-4xG4S-dsvH) [Плазмида E2];
#2 легкая цепь - (SGGGGSGGGGS)-scFv #1 (vH-4xG4S-vL) [Плазмида F1]; и
#2 легкая цепь - (SGGGGSGGGGS)-scFv # л (vL-4xG4S-vH) [Плазмида F2];
или с С-концом константной области человеческой гамма-1 СН3 изотипа γ1 из тяжелой цепи #2, с использованием гибкого линкера SGGGGSGGGGS (SEQ ID NO: 1), с целью создания следующего:
#2 тяжелая цепь - (SGGGGSGGGGS)-dsscFv #1 (dsvH-4xG4S-dsvL) [Плазмида G1];
#2 тяжелая цепь - (SGGGGSGGGGS)-dsscFv #1 (dsvL-4xG4S-dsvH) [Плазмида G2];
#2 тяжелая цепь - (SGGGGSGGGGS)-scFv #1 (vH-4xG4S-vL) [Плазмида H1]; и
#2 тяжелая цепь - (SGGGGSGGGGS)-scFv # л (vL-4xG4S-vH) [Плазмида H2].
Все слитые формы IgG были клонированы в экспрессирующие векторы млекопитающих под контролем промотора HCMV-MIE и последовательности SV40E полиА. Легкая цепь IgG #2 [Плазмида J], тяжелая цепь IgG #2 [Плазмида I], свободный домен dsvL #1 [Плазмида K] и свободный домен dsvH #1 [Плазмида L] были изготовлены химическим путем и по отдельности клонированы в векторы экспрессии млекопитающих под контролем промотора HCMV-MIE и последовательности SV40E полиА.
HEK293 - экспрессия:
IgG #2 (LC)-dsFv #1, IgG #2 (HC)-dsFv #1, IgG #2 (LC)-dsscFv #1, IgG #2 (HC)-dsscFv #1, IgG #2 (LC)-scFv #1 и IgG #2 (HC)-scFv #1.
Клетки НЕК293 трансфицировали соответствующими плазмидами с использованием реагента для трансфекции 293 фектин (Invitrogen) в соответствии с инструкциями изготовителя. Плазмиды были смешаны, как показано в таблице 4, с целью экспрессии разных конструкций:
Таблица 4
2. Плазмида I
3. Плазмида K
2. Плазмида I
3. Плазмида L
2. Плазмида J
3. Плазмида K
2. Плазмида J
3. Плазмида L
2. Плазмида E1
2. Плазмида F1
2. Плазмида E2
2. Плазмида F2
2. Плазмида G1
2. Плазмида H1
2. Плазмида G2
2. Плазмида H2
Соотношение плазмид, используемых для трансфекций, было вариабельным: для комбинаций из 2 плазмид соотношение составляло 1: 1, тогда как для комбинаций из 3 плазмид были протестированы разные соотношения. В общей сложности 5 мкг плазмидной ДНК инкубировали с 125 мкл фектина 293+4,25 мл среды OptiMEM в течение 20 минут при комнатной температуре. Затем эту смесь добавляли в 50 мл клеток НЕК293 в виде суспензии 1 × 106 клеток/мл и инкубировали при 37 °С на шейкере. Супернатанты собирали на 10-й день путем центрифугирования при 1500 g для удаления клеток и супернатант пропускали через фильтр 0,22 мкм. Уровень экспрессии определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с белком G.
В таблице 5 приведены результаты ВЭЖХ с белком G. Можно заметить, что уровни экспрессии всех конструкций сравнимы друг с другом и охватывают диапазон от 7 до 22 мкг/мл. Уровень экспрессии IgG-dsFv составляет от 7 до 22 мкг/мл, уровень экспрессии IgG-dsscFv составляет от 9 до 17 мкг/мл и уровень экспрессии IgG-scFv составляет от 10 до 16 мкг/мл. Имеются литературные данные, что экспрессия Fv-областей, в которых отсутствует или линкер между V1 и VH или мотив димеризации, соединяющий вместе V1 и VH, происходит на значительно более низком уровне, чем экспрессия связанных областей Fv. Удивительно, но из этих данных не следует, что не наблюдаются какие-либо существенные различия между наилучшей экспрессией каждого типа конструкций. VL-связанные белки, содержащие несвязанные VH, показывали более высокие уровни экспрессии (от 10 до 22 мкг/мл) по сравнению с VH-связанными белками, содержащими несвязанные VL (7-8 мкг/мл).
Таблица 5
Очистка с помощью белка А IgG # 2-dsFv #1, IgG # 2-dsscFv #1 и IgG # 2-scFv #1, экспрессированных в клетках HEK293
Приблизительно 50 мл супернатантов HEK293 концентрировали примерно в 25 раз приблизительно до 2 мл с помощью центрифугирования с концентрацией, используя отсечку по молекулярной массе 30 кДа. Концентрированные супернатанты вносили в 1 мл-колонку HiTrap MabSelectSure (GE Healthcare), уравновешенную 20 мМ фосфата, 40 мМ NaCl с уровнем рН 7,4. Колонку промывали 20 мМ фосфата, 40 мМ NaCl, рН 7,4, и связанный материал элюировали 0,1 М цитратом, pH 3,4. Собирали пиковую элюцию и рН доводили примерно до рН 7,0 с помощью 2 М Трис/HCl, pH 8,5. Элюированный материал с отрегулированным уровнем рН концентрировали и буфер заменяли на фосфатно-буферный раствор, рН 7,4, путем центрифугирования с концентрацией, используя отсечку по молекулярной массе 30 кДа.
Пример 2. Анализ молекул IgG-dsFv
Анализ SDS-PAGE очищенных с помощью белка А IgG #2-dsFv #1, IgG #2-dsscFv #1 и IgG #2-scFv #1, экспрессируемых клетками HEK293.
Образцы (2 мкг) были разведены ФБР до объема 9,75 мкл. К этому объему добавляли 3,75 мкл 4xLDS буфера для образцов и 1,5 мкл 100 мМ N-этилмалеимида (невосстановленные образцы) или 1,5 мкл 10 × NuPAGE восстановителя (восстановленные образцы). Образцы взбалтывали на вортексе, инкубировали при 70 °С в течение 10 минут, охлаждали и центрифугировали при 12500 оборотах в минуту в течение 30 секунд. Подготовленные образцы наносили на гель: 4-20% акриламид+Трис/глицин SDS, и пропускали в течение приблизительно 100 минут при 125 В и постоянном напряжении. Использовали лестницу маркеров молекулярной массы SeeBluePlus2 (Life Technologies). Гели окрашивали с помощью белковым красителем Instant Blue (Expedeon) и промывали от красителя дистиллированной водой.
Результаты SDS-PAGE представлены на фигурах 2 и 3. Предполагаемые размеры полос после восстанавливающей и невосстанавливающей SDS-PAGE указаны в таблице 6. Формы IgG пропускались параллельно для сравнения размеров.
Таблица 6:
(H=тяжелая цепь, L=легкая цепь, +/- восстанавливающее вещество (восст.)
Для IgG: предполагалось, что с невосстанавливающим гелем полоса будет проявляться примерно при 147 кДа, тогда как восстанавливающие гели должны были показать полосы примерно при 50 кДа и 24 кДа, приблизительно удваивая окрашивание в верхней полосе.
Для IgG (HC)-scFv и IgG(HC)-dsscFv: предполагалось, что с невосстанавливающим гелем полоса будет проявляться примерно при 201 кДа, тогда как восстанавливающий гель должен был показать полосы примерно при 77 кДа и 24 кДа, приблизительно утраивая окрашивание в верхней полосе.
Для IgG(HC)-dsFv: предполагалось, что с невосстанавливающим гелем полоса будет проявляться примерно при 201 кДа, тогда как восстанавливающий гель должен был показать полосы примерно при 64 кДа, 24 кДа и 12 кДа, с окрашиванием примерно в соотношении 3: 2: 1 от верхней до нижней полосы.
Для IgG(LC)-scFv и IgG(LC)-dsscFv: предполагалось, что с невосстанавливающим гелем полоса будет проявляться примерно при 201 кДа, тогда как восстанавливающий гель должен был показать двойную полосу примерно при 50 кДа, и приблизительно эквивалентное окрашивание обеих полос.
Для IgG(LC)-dsFv: предполагалось, что с невосстанавливающим гелем полоса будет проявляться примерно при 201 кДа, тогда как восстанавливающий гель должен был показать полосы примерно при 50 кДа, 37 кДа и 12 кДа, с окрашиванием примерно в соотношении 3: 2: 1 от верхней до нижней полосы.
С восстанавливающими SDS-PAGE гелями была выявлена структура исчерченности, указывающая, что конструкции экспрессировались правильно с точки зрения и расположения продвижения и интенсивности окрашивания. Исключение составили только IgG#2(HC)-dsFv #1 (присоединение HC-vH) (соотношение трансфекции 1: 1: 2 HC-vH: LC:vL), где имелись дополнительные полосы примерно при 55 кДа и ~45 кДа (фигура 2B, полоса 10), и IgG#2(LC)-dsFv#1 (присоединение LC-vH) (соотношение 1: 1: 1 LC-vH: HC:vL) (фигура 3В, полоса 6), где имелась дополнительная полоса примерно при 65 кДа. Вместе с тем, подобная дополнительная исчерченность также наблюдалась в исходном белке IgG#2-scFv#1 (HC-HLscFv) (дополнительная исчерченность примерно при 65 кДа и ~55 кДа, фигуре 2В, полоса 5) и в исходном белке IgG#2-dsscFv#1 (LC-HLscFv) (дополнительная исчерченность примерно при 65 кДа, фигура 3B, полоса 3).
Таким образом, в то время как в связанных белках HC-vH и связанных белках LC-vH наблюдались дополнительные полосы, которые могут соответствовать некоторой незначительной деградации/агрегации, в связанных белках HC-vL и связанных белках LC-vL был выявлен ожидаемый характер исчерченности. С невосстанавливающими SDS-PAGE гелями выявлена структура исчерченности > 200 кДа для IgG-dsscFv, что соответствует мультимеризации (фигура 2А, полосы 6 и 8, фигура 3А, полосы 3 и 5), но эти виды с высокой молекулярной массой отсутствовали во всех образцах IgG-dsFv (фигура 2А, полосы 9-12, фигура 3А, полосы 6-9).
Анализ S200 SE-ВЭЖХ очищенных с помощью белка А IgG #2-dsFv #1 и IgG #2-dsscFv #1, экспрессируемых клетками HEK293
10 мкг очищенных образцов белка (100 мкл 0,1 мг/мл стокового раствора, разведенного в ФБР) вводили в колонку Superdex 200 10/300 GL Tricorn (GE Healthcare) на 3-й день после очистки и пропускали с изократическим градиентом ФБР рН 7,4 со скоростью 1 мл/мин, с непрерывным обнаружением по оптической плотности при 280 нм.
После очистки белком А образец IgG#2 (HC)-dsscFv#1 был на 64-75% мономерным, образец IgG#2(LC)-dsscFv#1 был на 53-54% мономерным, тогда как IgG#2(HC)-dsFv#1 (присоединение HC-vH) было на 91-92% мономерным, IgG#2(HC)-dsFv#1 (присоединение HC-vL) было на 97-99% мономерным, IgG#2(LC)-dsFv#1 (присоединение LC-vH) было на 60-76% мономерным и IgG#2(LC)-dsFv#1 (присоединение LC-vL) было на 100% мономерным.
Известно, что Fv#1 имеет особенную склонность к мультимеризации. Учитывая, что мультимеры IgG-dsscFv физически соединены линкером dsscFv, при замене dsscFv#1 на dsFv#1 (в котором отсутствует линкер scFv) наблюдалось значительное увеличение уровня полученных мономеров (в некоторых случаях 100%). В зависимости от склонности Fv к мультимеризации, в некоторых случаях использование dsFv вместо dsscFv будет иметь преимущество. Отсутствие линкера между vL и vH исключает возможность неадекватных межмолекулярных доменных взаимодействий и, следовательно, уменьшает склонность к образованию мультимеров и агрегации во время и после экспрессии. Присутствие дисульфидной связи с dsFv гарантирует стабильность продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИИ ПОЛИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2015 |
|
RU2725812C2 |
| КОНСТРУКЦИИ ПОЛИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2015 |
|
RU2784673C2 |
| ОДНОЛИНКЕРНЫЕ АНТИТЕЛА FabFv И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2714159C2 |
| МУЛЬТИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО СО СПЕЦИФИЧНОСТЬЮ СВЯЗЫВАНИЯ IL-13 И IL-17 ЧЕЛОВЕКА | 2020 |
|
RU2827946C1 |
| МОЛЕКУЛЫ СО СПЕЦИФИЧНОСТЬЮ К CD45 И CD79 | 2015 |
|
RU2747980C2 |
| МОЛЕКУЛЫ СО СПЕЦИФИЧНОСТЬЮ В ОТНОШЕНИИ CD79 И CD22 | 2015 |
|
RU2743590C2 |
| НЕЙТРАЛИЗУЮЩИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, НАПРАВЛЕННЫЕ ПРОТИВ ВИРУСА ГРИППА, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2721706C2 |
| ТРИ- ИЛИ ТЕТРАСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2010 |
|
RU2570633C2 |
| ДВУХВАЛЕНТНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2008 |
|
RU2587616C2 |
| ДВУХВАЛЕНТНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2008 |
|
RU2547615C2 |
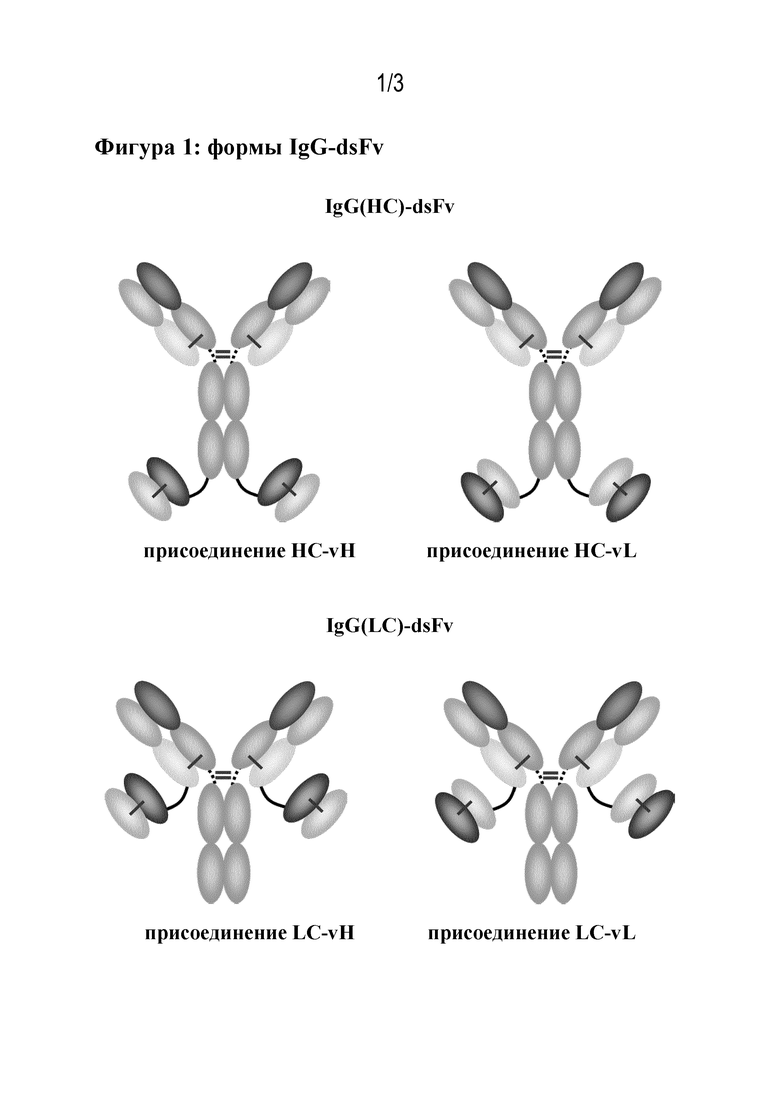
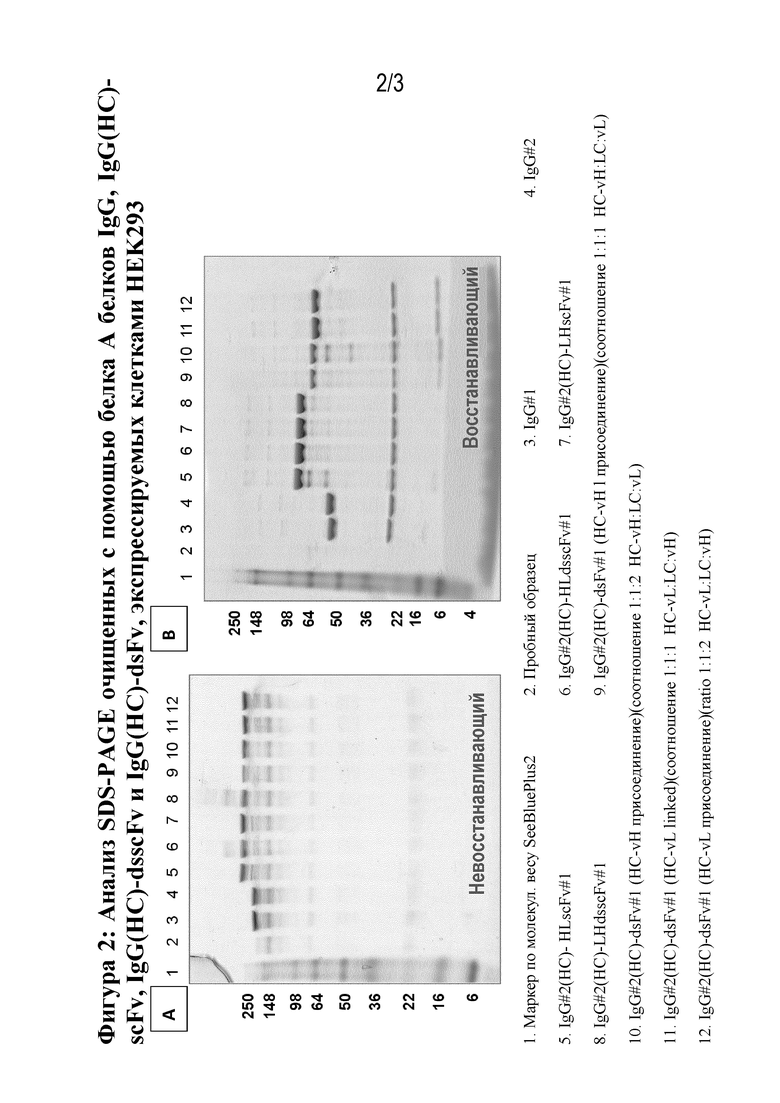
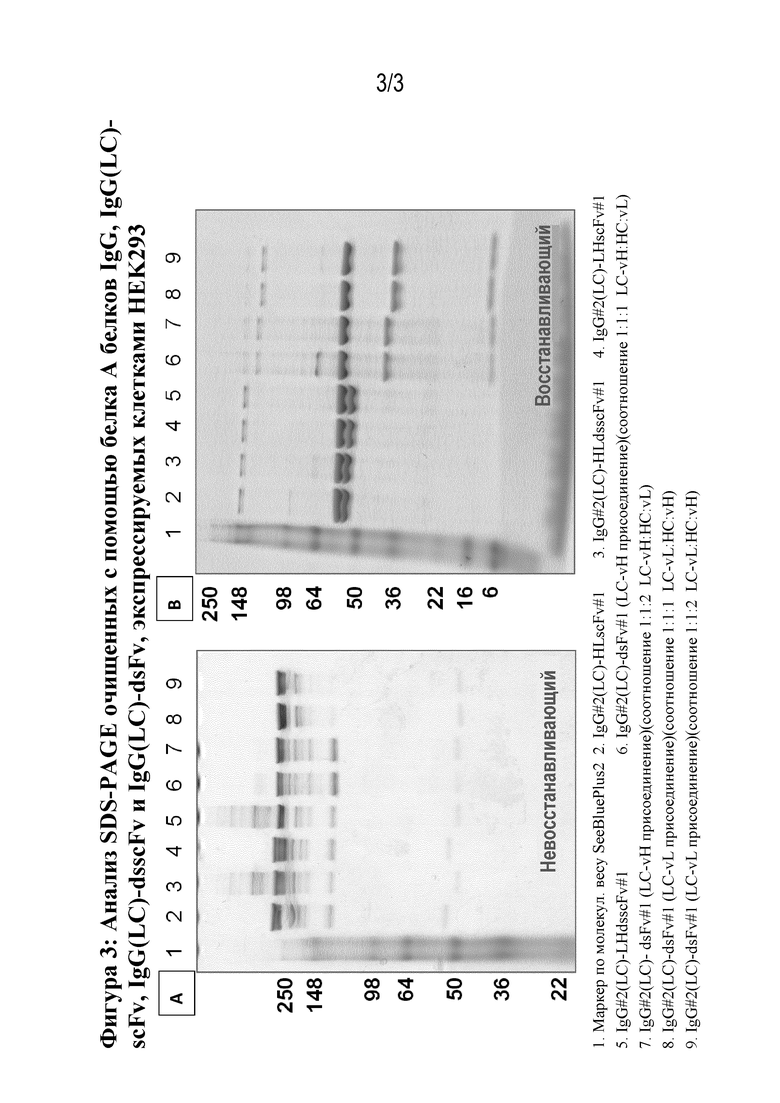
Изобретение относится к области биохимии, в частности к полинуклеотиду, кодирующему стабилизированную конструкцию мультиспецифичного антитела. Также раскрыты фармацевтическая композиция, содержащая указанное антитело, вектор экспрессии, содержащий указанный полинуклеотид, клетка-хозяин, содержащая указанный полинуклеотид. Раскрыты способ получения указанного антитела, а также применение указанного антитела или указанной фармацевтической композиции для лечения. Изобретение позволяет получать стабилизированную конструкцию мультиспецифичного антитела. 8 н. и 4 з.п. ф-лы, 3 ил., 6 табл., 2 пр.
1. Полинуклеотид, кодирующий стабилизированную конструкцию мультиспецифичного антитела, которая содержит или состоит из:
а) полипептидной цепи, имеющей формулу (Ia):
VH-CH1-СН2-СН3-X-V1; и
b) полипептидной цепи, имеющей формулу (IIa)
VL-CL;
в которой:
VН представляет собой вариабельный домен тяжелой цепи;
CH1 представляет собой домен константной области тяжелой цепи, например ее домен 1;
СН2 представляет собой домен константной области тяжелой цепи, например ее домен 2;
СН3 представляет собой домен константной области тяжелой цепи, например ее домен 3;
Х представляет собой связь или линкер;
где линкер представляет собой 20 аминокислот или менее;
V1 представляет собой dsFv;
VL представляет собой вариабельный домен, например вариабельный домен легкой цепи;
CL представляет собой домен константной области, например домен константной области легкой цепи, такой как C-каппа;
и
конструкция представлена в виде димера с двумя тяжелыми цепями формулы (Ia) и двумя связанными легкими цепями формулы (IIa).
2. Полинуклеотид по п.1, где Х представляет собой пептидный линкер, например последовательность SEQ ID NO: 1 или SEQ ID NO: 2.
3. Полинуклеотид по п.1, где Х представляет собой связь.
4. Полинуклеотид по любому из пп.1-3, где дисульфидная связь внутри вариабельной области в V1 независимо выбрана из группы, которая содержит или состоит из: VН37 и VL95, VH44 и VL100, VH44 и VL105, VH45 и VL87, VH100 и VL50, VH100b и VL49, VH98 и VL46, VH101 и VL46, VH105 и VL43 и VH106 и VL57, и в которой значения VH и VL независимо друг от друга находятся в пределах заданных V1, например VH44 и VL100, и где нумерация осуществляется согласно системе нумерации Kabat.
5. Полинуклеотид по п.4, где дисульфидная связь внутри вариабельной области в V1 находится в положении VH44 и VL100.
6. Вектор экспрессии, содержащий полинуклеотид по любому из пп.1-5.
7. Клетка-хозяин для экспрессии конструкции мультиспецифичного антитела, содержащая полинуклеотид по любому из пп.1-5 или вектор по п.6.
8. Способ получения конструкции мультиспецифичного антитела, включающий экспрессию конструкции мультиспецифичного антитела из клетки-хозяина по п.7.
9. Фармацевтическая композиция для лечения патологического состояния, содержащая эффективное количество конструкции мультиспецифичного антитела, кодируемой полинуклеотидом по любому из пп.1-5, и по меньшей мере один наполнитель.
10. Применение конструкции мультиспецифичного антитела, кодируемой полинуклеотидом по любому из пп.1-5 в лечении патологического состояния.
11. Применение фармацевтической композиции по п.9 в лечении патологического состояния.
12. Способ лечения нуждающегося в этом пациента, включающий введение терапевтически эффективного количества конструкции мультиспецифичного антитела, кодируемой полинуклеотидом по любому из пп.1-5, или фармацевтической композиции по п.9.
| US 2010081796 A1, 01.04.2010 | |||
| СПОСОБ И НАБОР ДЛЯ ВЫЯВЛЕНИЯ ГЕНА, КОДИРУЮЩЕГО МЕМБРАНОСВЯЗАННЫЙ БЕЛОК, ВЕКТОР (ВАРИАНТЫ) | 1999 |
|
RU2246538C2 |
| US 20140051833 A1, 20.02.2014 | |||
| ОПТИЧЕСКИЙ ОТРАЖАТЕЛЬ С ПОЛУОТРАЖАЮЩИМИ ПЛАСТИНАМИ ДЛЯ УСТРОЙСТВА ОТСЛЕЖИВАНИЯ ПОЛОЖЕНИЯ ШЛЕМА И ШЛЕМ, СОДЕРЖАЩИЙ ТАКОЕ УСТРОЙСТВО | 2010 |
|
RU2543680C2 |
| US 8193321 B2, 05.06.2012. | |||
Авторы
Даты
2020-01-10—Публикация
2015-06-25—Подача