Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к новым способам лечения фиброза. В частности, приведенное описание относится к применению кинуренина, кинуреновой кислоты, ксантуреновой кислоты, и/или родственных соединений для лечения фиброзирующего заболевания, в частности, заболеваний или состояний кожи, таких как келоидные и гипертрофические рубцы.
Предшествующий уровень техники
Фиброз, заболевание, относящееся к группе фибропролиферативных состояний, наблюдается в различных органах, таких как кожа, печень, легкие, почки и артерии. Установлено, что примерно 40% всех смертей в Соединенных Штатах обусловлены, в частности, фибропролиферативными заболеваниями. Избыточное накопление экстрацеллюлярного матрикса из-за чрезмерной продукции матрикса, такого как фибронектин, коллагены I и III типа, низкие уровни ферментов, разрушающих матрикс, таких как матриксные металлопротеиназы (ММП), или то и другое являются общими характеристиками таких фиброзирующих состояний.
Как и во всех других органах, заживление ран кожи является динамическим процессом, включающим тканевой ответ на различные типы повреждений. Этот процесс включает непрерывную последовательность сигналов и ответов, в которой тромбоциты, фибробласты, эпителиальные, эндотелиальные и иммунные клетки выходят из их обычного домена для участия в очень сложном процессе восстановления ткани. Эти сигналы, которые являются главным образом факторами роста (ФР) и цитокинами, организуют инициацию, продолжение и окончание заживления раны (Scott et al. 1994). Дисбаланс синтеза и высвобождения цитокинов и ФР в раневом участке может приводить либо к замедлению заживления раны (например, в популяциях больных диабетом и пожилых лиц), либо к избыточному заживлению (например, фибропролиферативным расстройствам, осложнению после хирургического разреза, травматических ран и тяжелого термического повреждения). Таким образом, важным компонентом заживления ран является своевременное прекращение, и без такого своевременного прекращения возможно накопление избыточного матрикса, что является вредным фиброзирующим состоянием, наблюдаемым у миллионов пациентов по всему миру.
Матриксные металлопротеиназы (ММП) представляют группу разнообразных протеолитических ферментов, вовлеченных в обновление ЭЦМ и ремоделирование соединительной ткани при физиологических состояниях, таких как рост и развитие эмбриона, инволюция матки, рост кости, резорбция кости и заживление ран. Уровень экспрессии ММП в нормальных клетках является низким, и таким образом, обеспечивает ремоделирование здоровой соединительной ткани. Однако нарушение баланса экспрессии ММП связано с рядом патологических состояний, таких как фиброз кожи, ревматоидный артрит, атеросклероз, и инвазия и метастазирование опухолей.
Современные способы лечения фиброзирующего состояния, включая фибропролиферативные заболевания кожи, такие как гипертрофическое рубцевание (ГР) и келоид, остаются неудовлетворительными. Соответственно, необходимо иметь терапевтические стратегии лечения различных фиброзирующих заболеваний и состояний.
Раскрытие изобретения
Настоящее изобретение основано, в частности, на неожиданном открытии того, что некоторые соединения - кинуренин и его аналоги/изоформы, кинуреновая кислота, и ксантуреновая кислота - способны к стимуляции экспрессии ММП-1 и ММП-3, при ингибировании экспрессии коллагена и фибронектина. Далее, как описано в настоящей заявке, эти соединения при применении in vivo способны к ингибированию, предотвращению или уменьшению образования келоидного рубца.
В одном варианте осуществления обеспечивается применение соединения, имеющего структуру Формулы I:
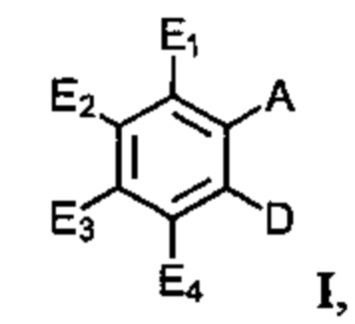 где E1 может быть Н, ОН, NH2, R, OR, NHR, NR2, SH, SR, F, Cl, Br или I; E2 может быть H, OH, NH2, R, О, NHR, NR2, SH, SR, F, Cl, Br или I; E3 может быть H, ОН, NH2, R, OR, NHR, NR2, SH, SR, F, Cl, Br или I; E4 может быть H, OH, NH2, R, OR, NHR, NR2, SH, SR, F, Cl, Br или I; R может быть группой из 1-20 углеродных атомов, которая необязательно может быть насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической, где каждый атом углерода может быть необязательно заменен О, S, SO, SO2, NH или NR', и каждый атом углерода может быть необязательно замещен одним или более из: ОН, OR', R', F, Cl, Br, I, =O, SH, SR', NH2, NHR', N(R')2, OSO3H, ОРО3Н3, СO2Н, CON(R')2 и CO2R'; R' может быть независимо выбран из группы, состоящей из: группы из одного-десяти углеродных атомов, которая необязательно является насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической; А может быть Н или NH2; D может быть
где E1 может быть Н, ОН, NH2, R, OR, NHR, NR2, SH, SR, F, Cl, Br или I; E2 может быть H, OH, NH2, R, О, NHR, NR2, SH, SR, F, Cl, Br или I; E3 может быть H, ОН, NH2, R, OR, NHR, NR2, SH, SR, F, Cl, Br или I; E4 может быть H, OH, NH2, R, OR, NHR, NR2, SH, SR, F, Cl, Br или I; R может быть группой из 1-20 углеродных атомов, которая необязательно может быть насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической, где каждый атом углерода может быть необязательно заменен О, S, SO, SO2, NH или NR', и каждый атом углерода может быть необязательно замещен одним или более из: ОН, OR', R', F, Cl, Br, I, =O, SH, SR', NH2, NHR', N(R')2, OSO3H, ОРО3Н3, СO2Н, CON(R')2 и CO2R'; R' может быть независимо выбран из группы, состоящей из: группы из одного-десяти углеродных атомов, которая необязательно является насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической; А может быть Н или NH2; D может быть
 или
или 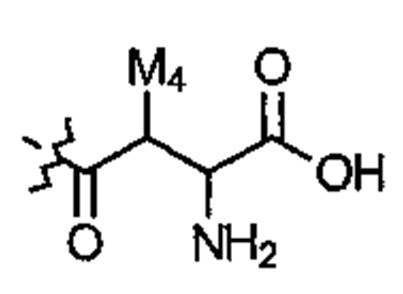 ; или A и D могут формировать шестичленное кольцо, выбранное из следующего:
; или A и D могут формировать шестичленное кольцо, выбранное из следующего:
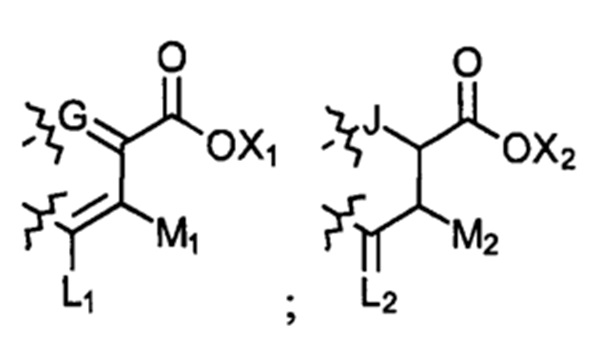 ; или
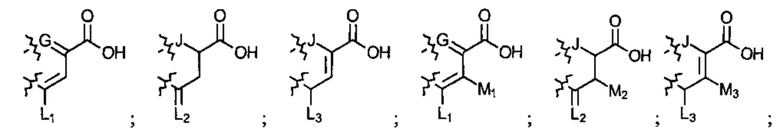
; или 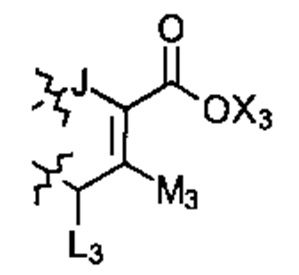 ; G может быть СН или N; J может быть S или О; L1 может быть ОН, OQ, NH2, NHQ, NQ2, SH или SQ; L2 может быть О, SQ' или NQ'; L3 может быть ОН, OQ, NH2, NHQ, NQ2, SH или SQ; Q может быть группой из 1-20 углеродных атомов, которая может быть необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической, где каждый атом углерода может быть необязательно заменен О, S, SO, SO2, NH или NQ', и каждый углеродный атом может быть необязательно замещен одним или более из: ОН, OQ', Q', F, Cl, Br, I, =O, SH, SQ', NH2, NHQ', N(Q')2, OSO3H, OРO3Н3, СO2Н, CON(Q')2 и CO2Q'; Q' может быть независимо выбран из группы, состоящей из: группы из 1-10 углеродных атомов, необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической, или не ароматической; M1 может быть Н, ОН, NH2, Т, ОТ, NHT, NT2, SH, ST, F, Cl, Br или I; M2 может быть H, OH, NH2, Т, ОТ, NHT, NT2, SH, ST, F, Cl, Br или I; M3 может быть H, OH, NH2, Т, ОТ, NHT, NT2, SH, ST, F, Cl, Br или I; M4 может быть OH, NH2, T, ОТ, NHT, NT2, SH, ST, F, Cl, Br или I; T может быть H или группой из 1-20 углеродных атомов, которая может быть необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической, где каждый атом углерода может быть необязательно заменен О, S, SO, SO2, NH или NT', и каждый атом углерода может быть необязательно замещен одним или более из: ОН, ОТ', Т', F, Cl, Br, I, =O, SH, ST', NH2, NHT', N(T')2, OSO3H, OPO3H3, CO2H, CON(T')2 и СO2Т'; T' может быть независимо выбран из группы, состоящей из: группы из 1-10 атомов углерода, которая может быть необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической; X1 может быть Н, ОН, NH2, Z, OZ, NHZ, NZ2, SH, SZ, F, Cl, Br или I; X2 может быть H, OH, NH2, Z, OZ, NHZ, NZ2, SH, SZ, F, Cl, Br или I; X3 является H, OH, NH2, Z, OZ, NHZ, NZ2, SH, SZ, F, Cl, Br или I; и Z может быть группой из 1-20 углеродных атомов, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической, где каждый атом углерода может быть необязательно заменен О, S, SO, SO2, NH или NZ', и каждый атом углерода может быть необязательно замещен одним или более из: ОН, OZ', Z', F, Cl, Br, I, =O, SH, SZ', NH2, NHZ', N(Z')2, OSO3H, ОРО3Н3, СO2Н, CON(Z')2 и CO2Z'; и Z' может быть независимо выбран из группы, состоящей из: группы из 1-10 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической; для лечения фиброзирующего заболевания или для изготовления лекарственного средства для лечения фиброзирующего заболевания.
; G может быть СН или N; J может быть S или О; L1 может быть ОН, OQ, NH2, NHQ, NQ2, SH или SQ; L2 может быть О, SQ' или NQ'; L3 может быть ОН, OQ, NH2, NHQ, NQ2, SH или SQ; Q может быть группой из 1-20 углеродных атомов, которая может быть необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической, где каждый атом углерода может быть необязательно заменен О, S, SO, SO2, NH или NQ', и каждый углеродный атом может быть необязательно замещен одним или более из: ОН, OQ', Q', F, Cl, Br, I, =O, SH, SQ', NH2, NHQ', N(Q')2, OSO3H, OРO3Н3, СO2Н, CON(Q')2 и CO2Q'; Q' может быть независимо выбран из группы, состоящей из: группы из 1-10 углеродных атомов, необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической, или не ароматической; M1 может быть Н, ОН, NH2, Т, ОТ, NHT, NT2, SH, ST, F, Cl, Br или I; M2 может быть H, OH, NH2, Т, ОТ, NHT, NT2, SH, ST, F, Cl, Br или I; M3 может быть H, OH, NH2, Т, ОТ, NHT, NT2, SH, ST, F, Cl, Br или I; M4 может быть OH, NH2, T, ОТ, NHT, NT2, SH, ST, F, Cl, Br или I; T может быть H или группой из 1-20 углеродных атомов, которая может быть необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической, где каждый атом углерода может быть необязательно заменен О, S, SO, SO2, NH или NT', и каждый атом углерода может быть необязательно замещен одним или более из: ОН, ОТ', Т', F, Cl, Br, I, =O, SH, ST', NH2, NHT', N(T')2, OSO3H, OPO3H3, CO2H, CON(T')2 и СO2Т'; T' может быть независимо выбран из группы, состоящей из: группы из 1-10 атомов углерода, которая может быть необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической; X1 может быть Н, ОН, NH2, Z, OZ, NHZ, NZ2, SH, SZ, F, Cl, Br или I; X2 может быть H, OH, NH2, Z, OZ, NHZ, NZ2, SH, SZ, F, Cl, Br или I; X3 является H, OH, NH2, Z, OZ, NHZ, NZ2, SH, SZ, F, Cl, Br или I; и Z может быть группой из 1-20 углеродных атомов, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической, где каждый атом углерода может быть необязательно заменен О, S, SO, SO2, NH или NZ', и каждый атом углерода может быть необязательно замещен одним или более из: ОН, OZ', Z', F, Cl, Br, I, =O, SH, SZ', NH2, NHZ', N(Z')2, OSO3H, ОРО3Н3, СO2Н, CON(Z')2 и CO2Z'; и Z' может быть независимо выбран из группы, состоящей из: группы из 1-10 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической; для лечения фиброзирующего заболевания или для изготовления лекарственного средства для лечения фиброзирующего заболевания.
В другом варианте осуществления обеспечивается способ лечения фиброзирующего заболевания, включающий введение в клетку млекопитающего соединения или его фармацевтически приемлемой соли, где соединение имеет структуру Формулы I.
В другом варианте осуществления обеспечивается способ лечения фиброзирующего заболевания, включающий введение в клетку млекопитающего соединения или его фармацевтически приемлемой соли, где соединение имеет структуру Формулы II.
В другом варианте осуществления обеспечивается способ лечения фиброзирующего заболевания, включающий введение в клетку млекопитающего соединения или его фармацевтически приемлемой соли, где соединение имеет структуру Формулы III.
В другом варианте осуществления обеспечивается способ лечения фиброзирующего заболевания, включающий введение субъекту, нуждающемуся в нем, соединения или его фармацевтически приемлемой соли, где соединение имеет структуру Формулы I.
В другом варианте осуществления обеспечивается способ лечения фиброзирующего заболевания, включающий введение субъекту, нуждающемуся в нем, соединения или его фармацевтически приемлемой соли, где соединение имеет структуру Формулы II.
В другом варианте осуществления обеспечивается способ лечения фиброзирующего заболевания, включающий введение субъекту, нуждающемуся в нем, соединения или его фармацевтически приемлемой соли, где соединение имеет структуру Формулы III.
В другом варианте осуществления обеспечивается фармацевтическая композиция для лечения фиброзирующего заболевания, включающая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество, где соединение имеет структуру Формулы I.
В другом варианте осуществления обеспечивается фармацевтическая композиция для лечения фиброзирующего заболевания, включающая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество, где соединение имеет структуру Формулы II.
В другом варианте осуществления обеспечивается фармацевтическая композиция для лечения фиброзирующего заболевания, включающая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество, где соединение имеет структуру Формулы III.
В другом варианте осуществления обеспечивается фармацевтическая композиция, включающая соединение или его фармацевтически приемлемую соль, и фармацевтически приемлемое вспомогательное вещество, где соединение имеет структуру Формулы I.
В другом варианте осуществления обеспечивается фармацевтическая композиция, включающая соединение или его фармацевтически приемлемую соль, и фармацевтически приемлемое вспомогательное вещество, где соединение имеет структуру Формулы И.
В другом варианте осуществления обеспечивается фармацевтическая композиция, включающая соединение или его фармацевтически приемлемую соль, и фармацевтически приемлемое вспомогательное вещество, где соединение имеет структуру Формулы III.
В другом варианте осуществления обеспечивается коммерческая упаковка, включающая (а) фармацевтическую композицию, описанную в настоящей заявке; и (b) инструкции по ее применению для лечения фиброзирующего заболевания.
В другом варианте осуществления обеспечивается коммерческая упаковка, включающая (а) соединение Формулы I; и (b) инструкции по его применению для лечения фиброзирующего заболевания.
В другом варианте осуществления обеспечивается коммерческая упаковка, включающая (а) соединение Формулы II; и (b) инструкции по его применению для лечения фиброзирующего заболевания.
В другом варианте осуществления обеспечивается коммерческая упаковка, включающая (а) соединение Формулы III; и (b) инструкции по его применению для лечения фиброзирующего заболевания.
В другом варианте осуществления обеспечивается соединение Формулы I для лечения фиброзирующего заболевания.
В другом варианте осуществления обеспечивается соединение Формулы II для лечения фиброзирующего заболевания.
В другом варианте осуществления обеспечивается соединение Формулы III для лечения фиброзирующего заболевания.
Фиброзирующее заболевание может быть выбрано из одного или нескольких из следующего: келоид, гипертрофическое рубцевание, фиброз легкого, фиброз почки, цирроз печени, хроническое воспаление белочной оболочки (CITA); эндомиокардиальньш фиброз, медиастинальный фиброз, миелофиброз, ретроперитонеальный фиброз, прогрессирующий массивный фиброз, нефрогенный системный фиброз, болезнь Крона, перенесенный инфаркт миокарда, склеродермия, системный склероз, фибромиома матки, и рестеноз.
Q может быть группой из 1-6 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической. R может быть группой из 1-6 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической. Т может быть группой из 1-6 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической. Z может быть группой из 1-6 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической.
Q' может быть группой из 1-6 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической. R' может быть группой из 1-6 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической. Т' может быть группой из 1-6 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической. Z' может быть группой из 1-6 атомов углерода, которая является необязательно насыщенной, ненасыщенной, линейной, разветвленной линейной, циклической, разветвленной циклической, ароматической, частично ароматической или не ароматической.
E1 может быть Н, ОН, NH2, OCH3, CH3, SH, F, Cl, Br или I. Е2 может быть Н, ОН, NH2, OCH3, CH3, SH, F, Cl, Br или I. Е3 может быть Н, ОН, NH2, OCH3, CH3, SH, F, Cl, Br или I. Е4 может быть Н, ОН, NH2, OCH3, CH3, SH, F, Cl, Br или I. А может быть Н или NH2. D может быть 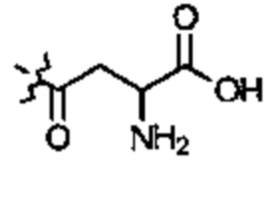 или
или 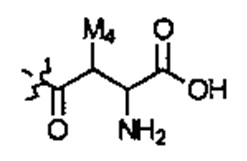 . Альтернативно, А и D могут формировать 6-членное кольцо, выбранное из следующего:
. Альтернативно, А и D могут формировать 6-членное кольцо, выбранное из следующего: 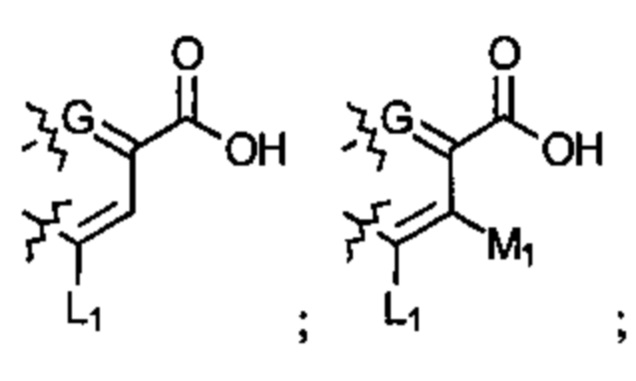 или
или 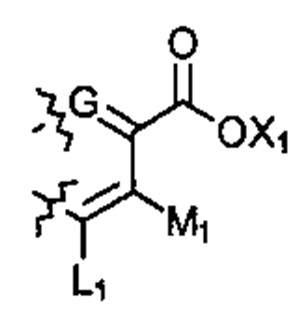 ; G может быть СН или N. L1 является ОН, NH2 или SH. M1 может быть Н, ОН, NH2, SH, F, Cl, Br или I. М4 может быть ОН, NH2, SH, F, Cl, Br или I. X1 может быть Н, ОН, NH2, SH, F, Cl, Br или I.
; G может быть СН или N. L1 является ОН, NH2 или SH. M1 может быть Н, ОН, NH2, SH, F, Cl, Br или I. М4 может быть ОН, NH2, SH, F, Cl, Br или I. X1 может быть Н, ОН, NH2, SH, F, Cl, Br или I.
E1 может быть H, OH, NH2, OCH3, или CH3. Е2 может быть Н, ОН, NH2, OCH3 или CH3. Е3 может быть Н, ОН, NH2, OCH3 или CH3. Е4 может быть Н, ОН, NH2, OCH3 или CH3. А может быть Н или NH2. D может быть 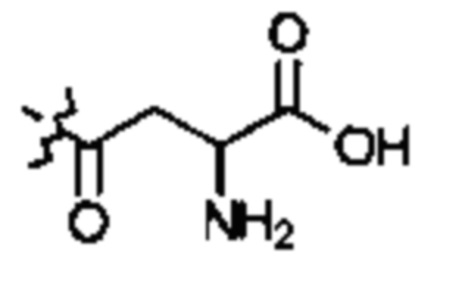 . Альтернативно, А и D могут формировать 6-членное кольцо, выбранное из следующего:
. Альтернативно, А и D могут формировать 6-членное кольцо, выбранное из следующего: 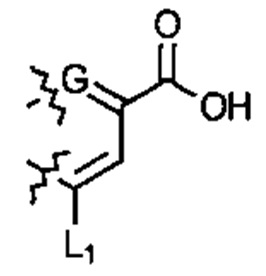 ; или
; или 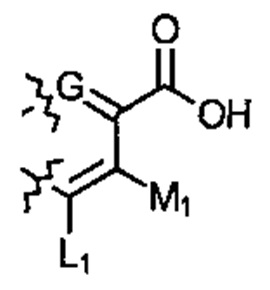 . G может быть СН или N. L1 может быть ОН или NH2. M1 является Н, ОН, или NH2.
. G может быть СН или N. L1 может быть ОН или NH2. M1 является Н, ОН, или NH2.
E1 может быть Н, ОН, NH2, OCH3 или CH3. Е2 может быть Н, ОН, NH2, OCH3 или CH3. Е3 может быть Н, ОН, NH2, OCH3 или CH3. Е4 может быть Н, ОН, NH2, OCH3 или CH3. А может быть Н или NH2. D может быть 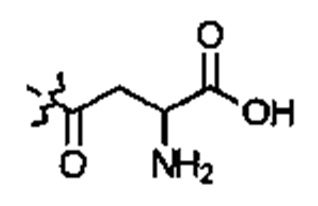 . Альтернативно, А и D могут формировать 6-членное кольцо, имеющее следующую структуру:
. Альтернативно, А и D могут формировать 6-членное кольцо, имеющее следующую структуру: 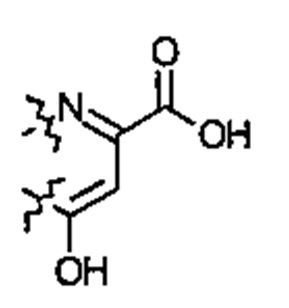 .
.
E1 может быть Н, ОН или NH2. Е2 может быть Н, ОН или NH2. Е3 может быть Н, ОН или NH2. Е4 может быть Н, ОН или NH2. А может быть Н или NH2. D может быть 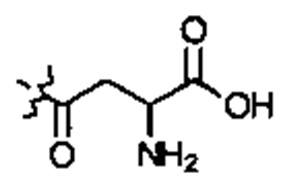 . Альтернативно, А и D могут формировать 6-членное кольцо, имеющее следующую структуру:
. Альтернативно, А и D могут формировать 6-членное кольцо, имеющее следующую структуру: 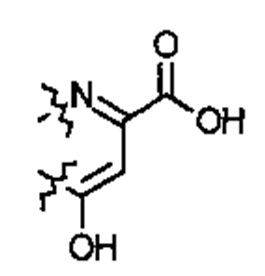 .
.
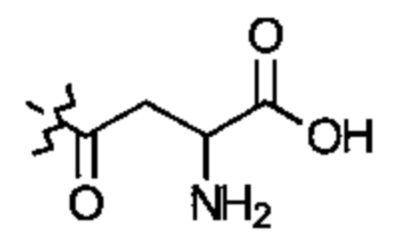
Соединение может иметь структуру Формулы II: 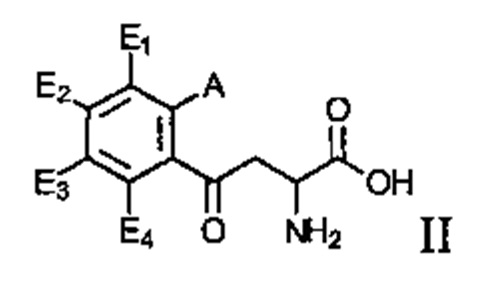 .
.
Соединение может иметь структуру Формулы III: 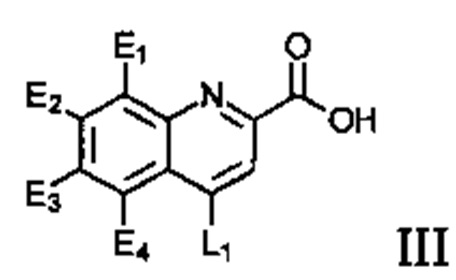 .
.
L1 может быть ОН или NH2. L1 может быть ОН. E1 может быть Н или ОН. Е2 может быть Н, ОН или NH2. Е3 может быть Н, ОН или NH2. Е4 может быть Н, ОН или NH2.
E1 может быть Н, ОН или NH2. Е2 может быть Н или ОН. Е3 может быть Н, ОН или NH2. Е4 может быть Н, ОН или NH2.
E1 может быть Н, ОН или NH2. Е2 может быть Н, ОН или NH2. Е3 может быть Н или ОН. Е4 может быть Н, ОН или NH2.
E1 может быть Н, ОН или NH2. Е2 может быть Н, ОН или NH2. Е3 может быть Н или ОН. Е4 может быть Н или NH2.
E1 может быть Н или ОН. Е2 может быть Н или ОН. Е3 может быть Н или ОН. Е4 может быть Н или NH2.
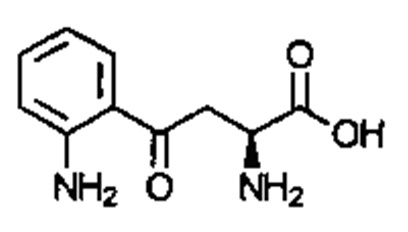
Соединение может быть выбрано из одного или более из следующего:
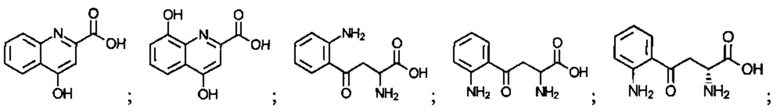
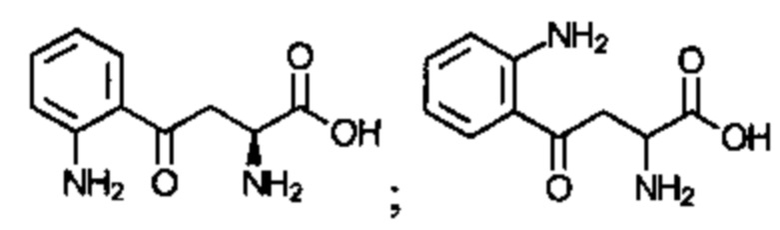 ; и
; и 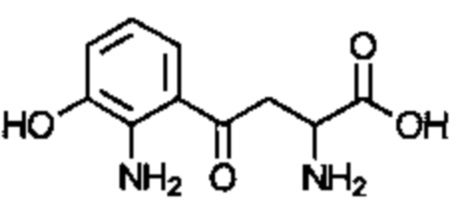
Соединение может быть выбрано из одного или более из следующего:
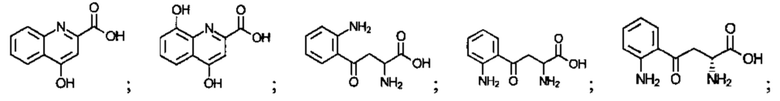
 ; и
; и 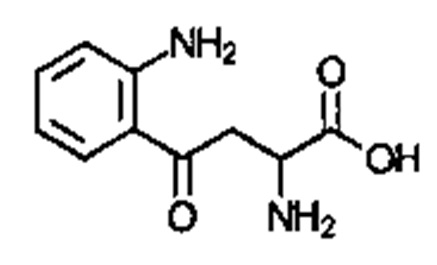 . Соединение может быть
. Соединение может быть 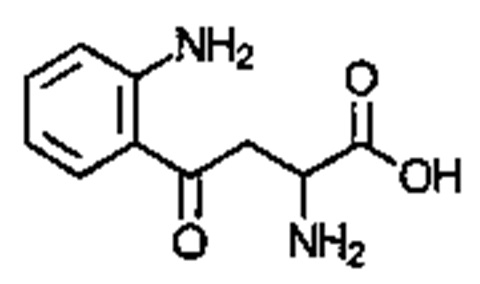 . Соединение может быть
. Соединение может быть 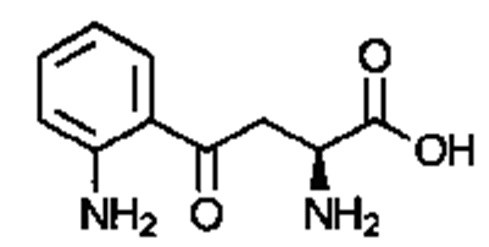 . Соединение может быть
. Соединение может быть 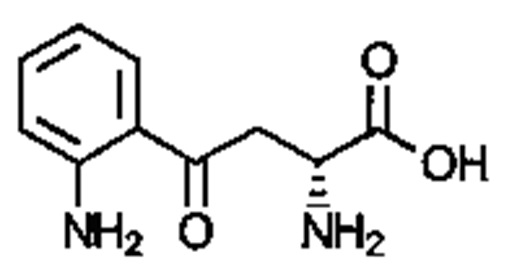 . Соединение может быть
. Соединение может быть 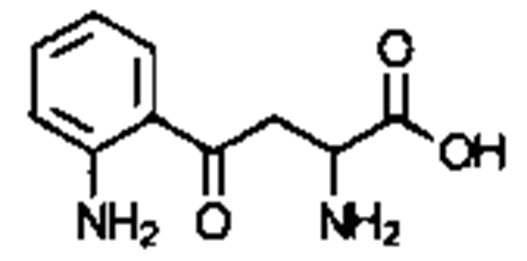 . Соединение может быть
. Соединение может быть 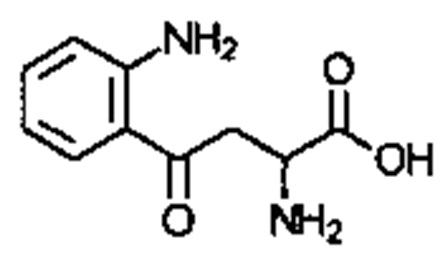 . Соединение может быть
. Соединение может быть 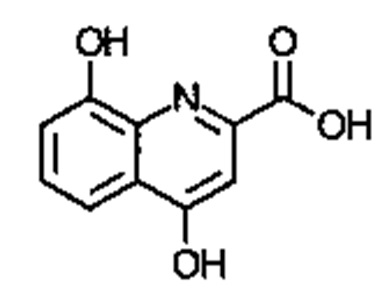 . Соединение может быть
. Соединение может быть 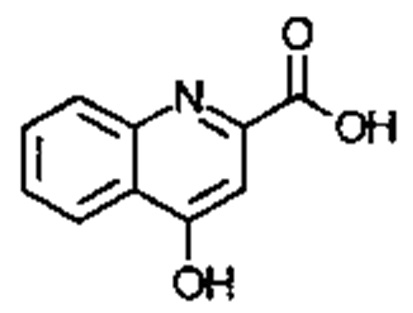 .
.
Краткое описание чертежей
Фигура 1. Повышающая регуляция индоламин-2,3-диоксигеназой (ИДО) экспрессии ММП-1 в фибробластах кожи человека. На панели A показаны фибробласты, которые либо не трансдуцировали (С), либо трансдуцировали аденовирусным вектором (V) или вектором, несущим рекомбинантный ген ИДО (IDO) в течение 48 часов, где ИДО и ее активность определяли посредством вестерн-блоттинга (левая панель) и измерением уровней кинуренина (правая панель), соответственно (N.D. указывает, что уровни кинуренина не выявлялись). На панели B показаны необработанные, трансдуцированные аденовирусным вектором и IDO фибробласты, которые были подвергнуты лизису после культивирования в течение 48 часов, затем определяли экспрессию ММП-1 посредством вестерн-блоттинга. На панели С показаны фибробласты, которые инкубировали с кондиционированными средами, взятыми от контрольных, не трансдуцированных, или трансдуцированных IDO аденовирусным вектором фибробластов в течение 48 часов, где экспрессию ММП-1 анализировали посредством вестерн-блоттинга. β-актин использовали в качестве контроля загрузки на панелях A, В и С. * указывает p<0,001.
Фигура 2. Влияние кинуренина и триптофана на экспрессию ММП-1 в фибробластах кожи человека. На панелях A и B показаны фибробласты кожи, которые культивировали в присутствии различных концентраций кинуренина в течение 48 часов, затем клетки собирали и лизировали, затем проводили вестерн-блоттинг; показанное отношение ММП-1 к β-актину представлено на панели В. На панели С показаны фибробласты кожи, которые культивировали в присутствии или при отсутствии триптофана (25 мг/мл) в течение 48 часов, затем клетки собирали и лизировали, и оценивали экспрессию ММП-1 посредством вестерн-блоттинга. На панели D показаны фибробласты, которые культивировали в присутствии различных концентраций триптофана в течение 48 часов, затем оценивали экспрессию ММП-1 посредством вестерн-блоттинга. β-актин использовали в качестве контроля загрузки на всех панелях.
Фигура 3. Влияние кинуренина на экспрессию ММП-2 и -3 в фибробластах кожи человека - показаны фибробласты кожи, которые культивировали в присутствии различных концентраций кинуренина в течение 48 часов, затем клетки собирали и лизировали, и проводили вестерн-блоттинг с применением либо кроличьего моноклонального антитела против ММП-2 человека (Панель А), либо мышиного моноклонального антитела против ММП-3 (Панель В). На панели C показано отношение экспрессии ММП-3 к бета-актину в трех независимых антителах, β-актин использовали в качестве контроля загрузки во всех экспериментах.
Фигура 4. Определение активности ММП в кондиционированных средах фибробластов кожи человека с применением набора для общего флуориметрического анализа ММП SensoLyte 520. Показаны фибробласты, которые культивировали в присутствии (Kyn) или при отсутствии (CTL) 50 мкг/мл кинуренина в течение 48 часов, затем собирали кондиционированные клеточные среды, центрифугировали при 1000 g в течение 10 минут, использовали надосадочную жидкость для определения активности ММП в соответствии с инструкциями производителя (среды инкубировали с 1 мМ АРМА при 37°C в течение 3 часов. Затем 50 мкл на ячейку образца, содержащего ММП, смешивали с 50 мкл раствора субстрата ММП, а среду без клеточной культуры смешивали с 50 мкл раствора субстрата ММП, и использовали в качестве контроля субстрата, и спустя 1 час инкубации измеряли интенсивность флуоресценции при ЕХ/ЕМ=490 нм/520 нм. Активность ММП представлена в качестве относительных единиц флуоресценции (RFU). Данные выражали в виде среднего значения ± СКО (n=3). * указывает p<0,05.
Фигура 5. Влияние кинуренина на экспрессию ММП-1 в различных типах мезенхимальных клеток. Показаны клетки, которые культивировали и обрабатывали кинуренином в концентрациях от 12,5 до 150 мкг/мл в течение 48 часов, и анализировали экспрессию ММП-1 посредством вестерн-блоттинга, с применением β-актина в качестве контроля загрузки во всех экспериментах. На панели A показана экспрессия ММП-1 в синовиоцитах. На панели B показана экспрессия ММП-1 в линии легочных фибробластов IMR-90.
Фигура 6. Влияние кинуренина на экспрессию ММП-1 в различных типах эпителиальных клеток. Показаны клетки, которые культивировали и обрабатывали кинуренином в концентрациях от 12,5 до 150 мкг/мл в течение 48 часов, и анализировали экспрессию ММП-1 посредством вестерн-блоттинга, с применением β-актина в качестве контроля загрузки во всех экспериментах, где на верхних панелях и нижней левой панели показаны лизаты фибробластов, не обработанных или обработанных кинуренином, которые применяли в качестве отрицательного и положительного контроля, соответственно.
Фигура 7. Кинуренин стимулирует фосфорилирование ERK1/2 в фибробластах кожи человека. Показаны фибробласты кожи, которые культивировали при отсутствии или в присутствии 100 мкг/мл кинуренина в течение 60 минут, затем клетки собирали и лизировали буфером для лизиса клеток, затем проводили анализ матрицы антител с применением набора для анализа фосфокиназы человека (R&D System™), где пятно 1 представляет положительный контроль, пятно 2 представляет фосфо-Р38α; пятно 3 представляет фocфo-ERK1/2; пятно 4 представляет фосфо-GSK-3α/β; пятно 5 представляет фосфо-р53, пятно 6 представляет положительный контроль.
Фигура 8. Стимуляция кинуренином МЕК и ERK1/2 фосфорилирования в фибробластах кожи человека. Показаны фибробласты кожи, которые культивировали в присутствии 100 мкг/мл кинуренина в указанные моменты времени, затем клетки собирали и лизировали, затем проводили вестерн-блоттинг с применением антител против фосфорилированного МЕК или фосфорилированного ERK1/2 β-актин использовали в качестве контроля загрузки).
Фигура 9. Добавление ингибиторов фосфорилирования МЕК или ERK1/2 отменяет эффект стимулированной кинуренином экспрессии ММП-1 в фибробластах кожи. На панели A показаны фибробласты кожи, которые культивировали при отсутствии или в присутствии 100 мкг/мл кинуренина при различных концентрациях PD98059 или без него. На панели B показаны фибробласты кожи, которые культивировали при отсутствии или в присутствии 100 мкг/мл кинуренина при отсутствии или в присутствии 30 мкМ PD98059 (ингибитора ERK1/2), 30 мкМ U0126 (ингибитора МЕК) или 10 мкМ U0126. Экспрессию ММП-1 оценивали посредством вестерн-блоттинга (β-актин использовали в качестве контроля загрузки во всех экспериментах).
Фигура 10. Влияние кинуренина. кинуреновой кислоты и ксантуреновой кислоты на экспрессию проколлагена 1 типа в фибробластах кожи. Фибробласты кожи человека обрабатывали указанными концентрациями кинуренина в течение 48 часов (вверху), затем клетки собирали и лизировали буфером для лизиса клеток, и всего 50 мкг белка фракционировали посредством 8% ДСН-ПАГЭ, затем проводили вестерн-блоттинг с применением антител к проколлагену. β-актин использовали в качестве контроля загрузки, также тестировали кинуреновую кислоту (КА) и ксантуреновую кислоту (ХА) (внизу).
Фигура 11. Влияние кинуренина на пролиферацию фибробластов. Фибробласты кожи человека культивировали в присутствии указанных концентраций кинуренина в течение 48 часов. Анализ пролиферации МТТ клеток проводили, как описано в настоящей заявке, с указанием клеточной пролиферации в виде клеточного индекса (ОП570нм) в МТТ анализе.
Фигура 12. Клинические проявления и гистология раны и рубцов. Показаны раны уха кролика, которые либо не обрабатывали (CTL), либо обрабатывали КМЦ гелем по отдельности (Gel), либо 50 мкг кинуренина (Kyn) в 0,1 мл КМЦ геля, начиная с 8 дня в течение всего 3 недель. На панели A показан микроскопический анализ ран без лечения, (CTL), с лечением КМЦ гелем (Gel) или кинуренином в КМЦ геле (Kyn) при увеличении 25. На панели В показан индекс высоты рубца (SEI) при измерении (среднее значение ± СКО SEI для необработанных ран, с обработкой КМЦ гелем, и кинуренином в КМЦ геле). * показывает достоверную разницу между обработкой кинуренином и необработанным контролем (P<0,001); ** показывает достоверную разницу между группой с обработкой кинуренином и контрольной группой с обработкой КМЦ гелем (Р<0,01). На панели C показаны секции кожи полной толщины при окраске трихромом по Массону от необработанных ран кожи (левые панели), обработанных кремом ран кожи (средние панели), или обработанных кинуренином ран кожи (правые панели) при увеличении ×25 и ×100. На панели D показано общее содержание гидроксипролина в коже в необработанных ранах (всего 4 раны), обработанных кремом ранах (всего 4 раны), или обработанных кинуренином ранах (всего 8 ран). * указывает p<0,01.
Фигура 13. Местное применение кинуренина снижает α1 коллаген 1 типа и повышает экспрессию ММП-1 в коже уха кролика. Показаны раны уха кролика, которые либо не обрабатывали (CTL), либо обрабатывали гелем по отдельности (Gel) или гелем с кинуренином (Kyn), как описано выше, где раны кожи использовали для экстракции общей РНК посредством Trizol™, и 1 мкг РНК использовали для синтеза кДНК для количественной ПЦР в режиме реального времени для α1 коллагена 1 типа, ММП-1 и β-актина. На панели A показан уровень относительной экспрессии α1 коллагена 1 типа в ткани кожи уха кролика. На панели В показан уровень относительной экспрессии ММП-1 в ткани кожи уха кролика. * указывает p<0,05.
Фигура 14 - Влияние изоформы кинуренина на экспрессию ММП-1 в фибробластах кожи человека. Показаны фибробласты кожи человека, которые культивировали при отсутствии (CTL) или в присутствии 50 мкг/мл DL-кинуренина (DL-Kyn) или D-кинуренина (D-Kyn) или L-кинуренина (L-Kyn) в течение 48 часов, после чего клетки собирали и лизировали в буфере для лизиса клеток (50 мкг общего белка загружали на 10% ДСН-акриламидный гель), затем проводили вестерн-блоттинг с антителами к ММП-1 человека, с применением β-актина в качестве контроля загрузки; при этом показано, что все тестируемые изоформы кинуренина повышали экспрессию ММП-1 в фибробластах кожи, однако, L-кинуренин, как кажется, был более активным, по сравнению с двумя другими изоформами.
Фигура 15. Влияние аналогов кинуренина (FS1) на экспрессию коллагена в фибробластах кожи человека. Фибробласты кожи обрабатывали различными концентрациями DL-кинуренина (FS1), L-кинуренина, D-кинуренина или кинуреновой кислоты (FS2), и определяли соответствующую экспрессию коллагена по уровням мРНК посредством ПЦР в режиме реального времени, с применением β-актина в качестве контроля загрузки.
Фигура 16. Влияние аналогов кинуренина (FS1) на экспрессию фибронектина в фибробластах кожи человека. Фибробласты кожи человека обрабатывали различными концентрациями DL-кинуренина (FS1), L-кинуренина, D-кинуренина или кинуреновой кислоты (FS2), и определяли соответствующую экспрессию фибронектина по уровням мРНК посредством ПЦР в режиме реального времени, с применением β-актина в качестве контроля загрузки.
Фигура 17. Сравнение супрессивного влияния 50, 100, 150 мкг/мл метаболитов триптофана (FS1, LK, FS2, DK) на КонA-стимулированную пролиферацию спленоцитов. Отмечалось почти 5-кратное снижение пролиферации спленоцитов после обработки 100 и 150 мкг/мл D-Kyn, L-Kyn, DL-Kyn (FS-1) и кинуреновой кислоты (FS2) спустя 96 часов (P<0,05), хотя пролиферация спленоцитов значительно снижалась примерно в 2 раза при использовании D-Kyn, L-Kyn и DL-Kyn при 100 и 150 мкг/мл спустя 48 часов, но FS2 оказывала меньшее влияние на пролиферацию.
Фигура 18. Анализ матрицы белков иммунных факторов в необработанных и обработанных FS1 (DE-кинуренином) спленопитах мыши. Показано, что FS1 оказывал иммуносупрессивное влияние на продукцию некоторых провоспалительных цитокинов и хемокинов, таких как ИЛ-1, ИЛ-2, CXCL9 и CXCL10, и FS1 показал существенное снижение продукции ИЛ-17, который, как полагают, играет важную роль при воспалении. На панели A показаны активированные спленоциты, которые были не обработанными (ConA) или обработанными 100 мкг/мл Kyn (ConA+Kyn) в течение 48 часов, после чего собирали кондиционированную среду (КМ) от необработанных и обработанных клеток, и затем подвергали анализу на мембране Proteome Profiler Antibody Array™; процентные значения плотности показаны для обработанных и необработанных клеток для каждого контрольного пятна, как видно на Панели В. На панели В показаны сигналы, идентифицированные мембраной Proteome Profiler Antibody Array. На панели C показан номер пятна, изображенного на панели B, представляющий контрольный белок.
Фигура 19. Длительное влияние FS1 и FS2 на экспрессию ММП-1 в фибробластах кожи человека. На панели A показано длительное влияние кинуренина (FS1) и кинуреновой кислоты (FS2) на экспрессию ММП-1, где фибробласты обрабатывали FS1 или FS2 (100 мкг/мл) в течение 48 часов, и среду заменяли, и клетки немедленно собирали, и спустя 12, 24 и 48 после обработки удаляли, с последующей оценкой экспрессии ММП-1 в фибробластах кожи с применением вестерн-блоттинга. На панели B показано отношение экспрессии ММП-1/β-актина, рассчитанное для обработанных фибробластов. Данные являются средним значением ± СКО от 4 независимых экспериментов (* значение p<0,05 и ** значение p<0,01, n=4).
Осуществление изобретения
Любые термины, не определенные непосредственно в настоящей заявке, необходимо понимать, как имеющие значения, обычно ассоциируемые с ними, как принято в области техники, к которой относится изобретении. Как применяется в настоящем описании, следующие термины, если не указано иное, нужно понимать, как имеющие следующие значения.
Как применяется в настоящей заявке «субъект» означает животное, такое как птица или млекопитающее. Специфические примеры включают крысу, мышь, собаку, кошку, корову, овцу, лошадь, свинью или примата. Субъект может дополнительно быть человеком, альтернативно обозначаемым как пациент. Субъект может дополнительно быть трансгенным животным. Субъект может быть также грызуном, таким как бобер, мышь или крыса.
Как применяется в настоящей заявке, «ингибитор» означает лекарство, соединение или агент, ограничивающий или замедляющий физиологическое, химическое или ферментативное действие или функцию. Ингибитор может вызывать по меньшей мере 5% снижение ферментативной активности. Ингибитор может также означать лекарство, соединение или агент, предотвращающий или снижающий экспрессию, транскрипцию или трансляцию гена или белка.
«Индоламин-2,3-диоксигеназа» или «IDO» является гем-содержащим скорость-лимитирующим ферментом, катализирующим превращение триптофана в N-формилкинуренин а затем в кинуренин (Kyn), и находящимся в не-печеночных клетках, главным образом в макрофагах и трофобластах. Недавние исследования установили сложный катаболизм триптофана, незаменимой аминокислоты, посредством IDO, вовлеченный в иммунную толерантность (Kahari and Saarialho-Kere 1997). Как показано в настоящей заявке, кинуренин, а также продукты его распада кинуреновая кислота и ксантуреновая кислота, индуцируют ММП-1 и ММП-3, а также обеспечивают снижение фиброза in vitro и in vivo.
Семейство «матриксных металлопротеиназ» или «ММП» состоит из 25 цинк- и кальций-зависимых протеиназ в системе млекопитающего. В соответствии с их субстратной специфичностью, первичной структурой и клеточной локализацией, идентифицировано 5 различных субсемейств тесно связанных членов, известных как коллагеназы, желатиназы, стромелизины, матрилизины, и ММП мембранного типа (Murphy et al. 2002). Из этих ММП ММП-1 является главным ферментом, вовлеченным в коллагенолитический процесс разрушения интерстициальных коллагенов, таких как коллагены I, II и III типов, в то время как ММП-3 (стромелизин-1) является протеазой, которая, как известно, разрушает главным образом не-коллагеновую часть ЭЦМ, такую как фибронектин, протеогликаны и ламинин (Kahari and Saarialho-Kere 1997). Повышение экспрессии и высвобождение фибробластами ММП-1 и ММП-3 может инициировать деградацию почти всех основных компонентов ЭЦМ (Saus et al. 1988). В настоящее время считается, что ММП, продуцируемые кератиноцитами, облегчают эпителиальную миграцию, в то время как ММП, экспрессируемые фибробластами, стимулируют ремоделирование ткани (Salo et al. 1991).
«Фиброз» является общим термином, включающим образование или развитие избыточной фиброзной соединительной ткани в органе или ткани в результате восстановительного или реактивного процесса, в отличие от образования фиброзной ткани как нормального компонента органа или ткани. Рубцевание является сливным фиброзом, облитерирующим структуру лежащего в основе органа или ткани. Имеется много заболеваний и/или состояний, характеризующихся или связанных с фиброзом, включая келоид, гипертрофический рубец, фиброз легкого, фиброз почки, цирроз печени, хроническое воспаление белочной оболочки (CITA), эндомиокардиальный фиброз, медиастинальный фиброз, миелофиброз, ретроперитонеальный фиброз, прогрессирующий массивный фиброз, нефрогенный системный фиброз, болезнь Крона, перенесенный инфаркт миокарда, склеродермию, и системный склероз, но не ограничиваясь ими.
Обеспечивается ряд соединений для применения в лечении заболеваний или состояний, характеризующихся или связанных с фиброзом. В контексте настоящего описания термин «лечение» может означать лечение существующего фиброза или фиброзирующего заболевания, или альтернативно может означать лечение, осуществляемое до или во время фиброзирующего процесса, для предотвращения развития или прогрессирования фиброза. Соединения, описанные в настоящей заявке, могут быть предоставлены по отдельности, или могут быть связаны или находиться в комбинации с соединениями с меченым атомом, липосомами, углеводными носителями, полимерными носителями, или другими агентами или вспомогательными веществами, известными специалистам в данной области техники. В альтернативном варианте осуществления такие соединения могут составлять медикамент, где такие соединения могут присутствовать в фармакологически эффективном количестве. Соединения могут быть приемлемыми для применения у субъекта, нуждающегося в них, благодаря тому факту, что субъект может получать пользу от профилактики или лечения фиброза или фиброзирующего заболевания. Соединения могут также включать таутомеры или стереоизомеры.
Как применяется в настоящей заявке, «FS» означает «FibroStop» (например, FS1 применяют для обозначения кинуренина (DL-кинуренина или DL-Kyn), a FS2 или КА может применяться для обозначения кинуреновой кислоты). L-кинуренин может быть обозначен в настоящей заявке как L-Kyn, а D-кинуренин может быть представлен как D-Kyn. Подобным образом, ксантуреновая кислота может быть обозначена как ХА.
Термин «лекарственное средство», как применяется в настоящей заявке, означает композицию, которую можно применять у пациента, и способную к обеспечению эффекта у пациента или экспериментального субъекта. Эффект может быть химическим, биологическим или физическим, а пациент или экспериментальный субъект может быть человеком, не являющимся человеком животным, таким как грызун или трансгенная мышь, или собака, кошка, корова, овца, лошадь, хомяк, морская свинка, кролик или свинья. Медикамент может состоять из эффективного химического компонента по отдельности или в комбинации с фармацевтически приемлемым вспомогательным веществом.
Термин «фармацевтически приемлемое вспомогательное вещество может включать любые растворители, дисперсионные среды, оболочки, антибактериальные, противомикробные или противогрибковые агенты, изотонические и замедляющие абсорбцию агенты, и тому подобные, которые являются физиологически совместимыми. Вспомогательное вещество может быть приемлемым для внутривенного, интраперитонеального, внутримышечного, подкожного, интратекального, местного или перорального применения. Вспомогательное вещество может включать стерильные водные растворы или дисперсии для немедленного приготовления стерильных растворов для инъекций или дисперсии. Применение таких сред для приготовления медикаментов известно в данной области техники.
Композиции или соединения в соответствии с некоторыми вариантами осуществления можно применять любым из множества известных способов. Примеры способов, которые могут быть приемлемыми для применения соединения, включают пероральный, внутривенный, ингаляционный, внутримышечный, подкожный, местный, интраперитонеальный, с ректальными или вагинальными суппозиториями, сублингвальный, и тому подобные. Соединения, описанные в настоящей заявке, могут применяться в стерильном водном растворе, или могут применяться в жирорастворимом вспомогательном веществе, или другом формате раствора, суспензии, пластыря, таблетки или пасты, если приемлемо. Композиция, содержащая соединения, описанные в настоящей заявке, может быть составлена для применения путем ингаляции. Например, соединение может быть комбинировано с вспомогательным веществом для обеспечения диспергирования в аэрозоле. Примеры рецептур для ингаляции известны специалисту в данной области техники. Другие агенты могут быть включены в комбинации с соединениями, описанными в настоящей заявке, для поглощения или метаболизма, или замедления диспергирования у реципиента, так как в рецептуре с контролируемым высвобождением. Примеры рецептур для контролируемого высвобождения известны специалистам в данной области техники, и могут включать микроинкапсулирование, встраивание в углеводный или полимерный матрикс, и тому подобное. Другие способы, известные в данной области техники для изготовления рецептур, можно найти, например, в «Remington's Pharmaceutical Sciences», (19th edition), ed. A. Gennaro, 1995, Mack Publishing Company, Easton, Pa («Фармацевтический справочник Ремингтона», 19-е издание).
Дозировка композиций или соединений из некоторых вариантов осуществления, описанных в настоящей заявке, может варьировать, в зависимости от способа применения (перорального, внутривенного, ингаляционного, или тому подобного), и формы, в которой применяют композицию или соединения (раствор, для контролируемого высвобождения, или тому подобное). Определение подходящих доз известно специалисту в данной области техники. Как применяется в настоящей заявке, «эффективное количество», «терапевтически эффективное количество» или «фармакологически эффективное количество» лекарственного средства означает количество лекарственного средства, присутствующего в концентрации, обеспечивающей терапевтический уровень лекарства, доставляемого после применения лекарства. Это может зависеть от способа доставки, периода, времени приема дозы, возраста, массы тела, общего состояния здоровья, пола и рациона субъекта, принимающего медикамент. Способы определения эффективных количеств известны в данной области техники.
В одном варианте осуществления обеспечивает способ лечения субъекта, у которого имеется или предполагается наличие фиброзирующего заболевания, где способ включает введение субъекту терапевтически эффективного количества соединения, имеющего структуру, соответствующую Формуле I, II или III. Фиброзирующее заболевание может быть одним из следующего: келоид, гипертрофическое рубцевание, фиброз легкого, фиброз почки, цирроз печени, хроническое воспаление белочной оболочки (CITA); эндомиокардиальный фиброз, медиастинальный фиброз, миелофиброз, ретроперитонеальный фиброз, прогрессирующий массивный фиброз, нефрогенный системный фиброз, болезнь Крона, перенесенный инфаркт миокарда, склеродермия, системный склероз, фибромиома матки, и рестеноз.
Материалы и методы
Клеточные культуры
Крайнюю плоть и суставы новорожденных применяли в качестве источника фибробластов, кератиноцитов и синовиоцитов. Процедуры проводили на основе разрешения Этического комитета по исследованиям у человека Университета Британской Колумбии. Культуры фибробластов крайней плоти человека готовили, как описано ранее (Li et al., 2006). Вкратце, крайнюю плоть собирали, промывали три раза модифицированной Дульбекко средой Игла университета Британской Колумбии (DMEM; GIBCO™, Гранд-Исланд, Нью-Йорк) с добавлением антибиотиков и противогрибковых препаратов (100 Ед./мл пенициллина, 100 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина В) (Invitrogen Life Technologies™, Гейтерсберг, Мэриленд). Образцы освобождали от жира и разделяли на мелкие куски диаметром меньше 2,0 мм, промывали три раза DMEM, распределяли на 60×15 мм чашки Петри, и инкубировали при 37°C в оснащенном водяной рубашкой инкубаторе с увлажнением в атмосфере 5% CO2. Среду заменяли два раза в неделю. При достижении слияния клетки освобождали посредством трипсинизации (0,1% трипсин, Invitrogen Life Technologies™ и 0,02% ЭДТУК, Sigma™, Сент-Льюис, Миссури), разделяли для субкультуры в отношении 1:6, и повторно высевали на 75 см флаконы. Для этого исследования использовали фибробласты от 3-7 пассажей.
Кератиноциты крайней плоти человека готовили, как описано раньше (Ghahary et al., 1998). Клетки культивировали в бессывороточной среде для кератиноцитов (KSFM; Invitrogen Life Technologies™) с добавлением экстракта гипофиза быка (50 мкг/мл) и ЭФР (0,2 нг/мл). Использовали клетки от 2-5 пассажей.
Синовиоциты получали путем ферментативного расщепления синовиальной мембраны пациентов с ревматоидным артритом при замене сустава с 1 мг/мл коллагеназы (Sigma™) в RPMI1640 (Invitrogen Life Technologies™) в течение 4 часов при 37°C. Диссоциированные клетки помещали в среду для выращивания синовиоцитов (Cell Applications Inc.™, Сан-Диего, Калифорния) с добавлением пенициллина G натрия (100 Ед/мл), стрептомицина сульфата (100 мкг/мл), и амфотерицина B (0,25 мкг/мл). Было установлено, что синовиоциты были морфологически однородными фибробластоподобными клетками, и их применяли после 2-5 пассажей.
Линию плоскоклеточной карциномы (UMSCC), полученную от больных раком головы и шеи (АТСС™, Манассас, Виржиния) хранили в среде RPMI-1640 с 10% ЭТС. Клеточную линию кератиноцитов человека НАСАТ (АТСС) и клеточную линию карциномы альвеолярного базального эпителия А549 (АТСС™) культивировали в DMEM с 10% ЭТС. Диплоидные легочные фибробласты IMR-90 (АТСС™) поддерживали в минимальной эссенциальной среде (MEM, Invitrogen™) с 10% ЭТС.
Трансфекция генов с помощью аденовирусного вектора
Конструкция аденовирусного вектора, экспрессирующего индоламин-2,3-диоксигеназу (IDO), была такой, как описано раньше (Li et al., 2004). Рекомбинантные аденовирусы использовали для инфицирования фибробластов кожи человека при множественности заражения (MOI) 100. Свободные вирусные частицы удаляли из культуральной среды спустя 30 часов после инфицирования. Успех инфицирования определяли посредством флуоресцентной микроскопии с применением инвертированного микроскопа Motic™, оснащенного фильтром для флуоресцеин изотиоцианата (FITC) (Motic Instruments™, Ричмонд, Британская Колумбия, Канада) для визуализации репортерного гена зеленого флуоресцентного белка. Экспрессию IDO оценивали посредством вестерн-блоттинга с применением антител против IDO человека, как описано раньше (Li et al., 2004). Биологическую активность IDO оценивали путем измерения уровней продукта разрушения триптофана, кинуренина, присутствующего в кондиционированной среде.
Определение кинуренина в кондиционированной среде
Уровни кинуренина измеряли способом, описанным раньше (Tokikawa et al., 1988). Вкратце, примерно 2 мл кондиционированной среды собирали из клеточной культуры с тем же самым номером спустя 3 дня после трансфекции. Белки из кондиционированной среды осаждали трихлоруксусной кислотой. После центрифугирования для удаления осажденных белков примерно 0,5 мл надосадочной жидкости переносили в новую 1,5 мл пробирку и инкубировали с равным объемом реагента Эрлиха (Sigma™) в течение 10 минут при комнатной температуре. Поглощение полученного раствора измеряли при 490 нм спектрофотометром в пределах 2 часов. Содержание кинуренина в кондиционированной среде рассчитывали с помощью стандартной кривой с определенной концентрацией кинуренина (0-20 мкг/мл).
Обработка клеток
Для сбора кондиционированной среды фибробласты либо не трансдуцировали, либо трансдуцировали контрольным имитационным вектором, или IDO аденовирусом в течение 30 часов. Вирусы удаляли путем промывания ФБР. Добавляли свежую среду DMEM, содержащую 10% ЭТС и антибиотики, и клетки культивировали в течение 48 часов. Затем собирали кондиционированную среду от необработанных, трансдуцированных имитирующим вектором или IDO аденовирусом фибробластов. Фибробласты с 80% слиянием обрабатывали средой, содержащей 90% кондиционированной среды плюс 10% свежей среды в присутствии 10% ЭТС. Затем клетки собирали спустя 48 часов и проводили анализ посредством вестерн-блоттинга.
В другой серии экспериментов фибробласты с 80% слиянием обрабатывали кинуренином или триптофаном в указанных концентрациях, как упомянуто в разделе «Результаты», в среде DMEM, содержащей 2% ЭТС и антибиотики, в течение 48 часов. Клетки собирали посредством трипсинизации, и проводили анализ посредством вестерн-блоттинга.
Подобным образом, другие клетки, такие как синовиоциты, IMR-90, кератиноциты, UMSCC и А549, обрабатывали кинуренином в концентрациях 12,5-150 мкг/мл в подходящей среде для каждого типа клеток, как описано выше, в течение 48 часов. Клетки собирали для проведения вестерн-блоттинга.
Анализ посредством вестерн-блоттинга
Клетки собирали с помощью трипсина/ЭДТУК и лизировали буфером для лизиса клеток, содержащим 50 мМ Трис-HCl (pH 7,40), 150 мМ NaCl, 10 мМ ЭДТУК, 5 мМ ЭГТУК, 1% Тритона Х-100™, 0,5% Igepal СА-630, 0,025% NaN3 и коктейль из ингибиторов протеаз (Sigma™). Клеточный детрит удаляли посредством центрифугирования при 20,000 g в течение 10 минут. Концентрацию белка в надосадочной жидкости определяли с применением метода MicroBCA™ (Pierce™, Рокфорд, Иллинойс). Белки в надосадочной жидкости смешивали с буфером для загрузки образца белка (конечная концентрация: 60 мМ Трис-HCl (pH 6,80), 2% ДСН, 10% глицерин, 1,5% β-меркаптоэтанола, 0,002% бромфенолового синего) и разделяли по размеру в 10% ДСН-полиакриламидном геле. После переноса белков на нитроцеллюлозную мембрану посредством iBlot™ (Invitrogen Life Technologies™), блокировали неспецифическое связывание фосфатно-солевым буфером 20 (PBS-T), содержащим 5% снятого молока, в течение 1 часа. Затем мембрану инкубировали с первичным антителом в течение ночи. После инкубации со вторым антителом в течение 1 часа белковые полосы визуализировали посредством системы детекции с усиленной хемилюминесценцией (ECL™) (Santa Cruz Biotechnology™, Санта-Круз, Калифорния). Первичными антителами, используемыми в этом исследовании, были: мышиные моноклональные антитела против ММП-1 человека (R&D Systems™, Миннеаполис), мышиные моноклональные антитела против ММП-3 человека (R&D System™), кроличьи моноклональные антитела против ММП-2 человека (Epitomics™, Берлингейм, Калифорния), кроличьи поликлональные анти-фосфо-МЕК1/2 (Ser217/221™) (Cell Signaling Technology™, Данверс, Массачусетс), кроличьи поликлональные анти-фосфо-р44/42 МАРК (Thr202/Tyr204) (Cell Signaling Technology™), моноклональные антитела к β-актину (Sigma™), и мышиные антитела к проколлагену 1 типа (Developmental Studies Hybridoma Bank™, Айова-Сити, Айова). Вторыми антителами были либо конъюгаты козьих антител к IgG (H+L) мыши с пероксидазой хрена, либо конъюгаты козьих антител к IgG (H+L) кролика с пероксидазой хрена (Bio-rad Laboratory™ (Миссиссога, Онтарио, Канада). Вторые антитела использовали в концентрации 1:3000.
Определение активности ММП
Активность ММП оценивали с применением пептида для резонансного переноса энергии флуоресценции (FRET) F-FAM/QXL 520 в качестве субстрата ММП с непатентованным набором для анализа активности ММП SensoLyte 520™ (AnaSpec, Inc.™, Фремонт, Калифорния) в соответствии с инструкциями производителя. Вкратце, клетки обрабатывали с 50 мкг/мл кинуренина или без него в течение 48 часов. Кондиционированные среды собирали и инкубировали с 1 мМ АРМА (4-аминофенил-ртути ацетат, в компоненте C, AnaSpect™) при 37°C в течение 3 часов. После активации ММП с АРМА, 50 мкл на ячейку в 96-луночном планшете кондиционированной среды смешивали с 50 мкл раствора субстрата ММП. После инкубации при комнатной температуре в течение 60 минут измеряли интенсивность флуоресценции при EX/ЕМ=490 нм/520 нм в каждом образце, включая контроль субстрата, с применением флуоресцентного ридера микропланшетов Infinite F500™ (Tecan Group Ltd™, Моррисвиль, Северная Каролина).
Анализ фосфорилирования белков
Человеческие фибробласты со слиянием 90% истощали в среде DMEM без ЭТС в течение ночи, затем обрабатывали с 100 мкг/мл кинуренина или без него в течение 2 часов. Фосфорилирование белков оценивали с применением набора для анализа фосфокиназы человека Human Phospho-Kinase Array™ (R&D System™) в соответствии с инструкциями производителя. Вкратце, улавливающие и контрольные антитела наносили в двух повторностях на нитроцеллюлозные мембраны (в целом 46 участков киназного фосфорилирования). Клеточные лизаты (300 мкг общего белка на матрицу) инкубировали с матрицей в течение ночи. Матрицу промывали для удаления не связавшихся белков, затем инкубировали с коктейлем из биотинилированных антител для детекции. После инкубации со стрептавидином-ПОХ в течение 30 минут визуализировали сигналы ЭХЛ системы детекции (Santa Cruz™). Пятна визуализировали посредством денситометрии, и фосфорилирование белков нормализовали до положительного контроля, который был представлен на каждой мембране.
Модель гипертрофического рубца уха кролика и местное применение кинуренина B этом исследовании использовали крольчих-самок (новозеландских белых) массой тела 4,5-5 кг. Протокол был рассмотрен и утвержден Комитетом по исследованиям на животных Университета Британской Колумбии. Модель гипертрофического рубца уха кролика была разработана и описана ранее (Rahmani-Neishaboor, et al., 2010). Вкратце, у 2 кроликов проводили анестезию путем внутримышечного введения кетамина (22,5 мг/кг) и ксилазина (2,5 мг/кг) с последующим введением газа изофлюрана посредством интубации трахеи. Создавали четыре раны до обнажения хряща на вентральной стороне каждого уха с применением 8 мм перфоратора для биопсии кожи для удаления срезов кожи полной толщины. На раны наносили антибиотики каждый день до начала обработки кинуренином.
Кинуренин в КМЦ геле (Rahmani-Neishabooref al., 2010) в концентрации 500 мкг/мл наносили местно на раны в экспериментальной группе (0,1 мл на рану) каждый день в течение 3 недель, начиная от 1 недели после нанесения раны. Раны в контрольной группе обрабатывали равным количеством одного крема каждый день.
Животных умерщвляли на 3 неделе после лечения. Собирали рубцы (10 мм биоптаты, полученные перфоратором). Каждый рубец разделяли на две части по продольной оси, и одну половину подвергали рутинному гистологическому анализу, а другую половину хранили при -80°C для последующего использования.
Высоту рубца определяли путем измерения индекса высоты рубца (SEI) в срезе ткани, окрашенном гематоксилином и эозином. SEI является отношением общей высоты раневой ткани к нормальной ткани ниже гипертрофического рубца. SEI 1 указывает, что высота рубца равна окружающей неповрежденной коже; SEI>1 указывает на повышенный гипертрофический рубец.
МТТ анализ
Влияние кинуренина на пролиферацию фибробластов кожи человека определяли посредством МТТ [3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромидного] анализа. Вкратце, 10,000 клеток высевали на 24-луночный планшет и инкубировали с различными концентрациями кинуренина в течение 48 часов. Среду удаляли, и добавляли 0,2 мл МТТ (5 мг/мл в среде DMEM, содержащей 2% ЭТС). Клетки инкубировали с МТТ в течение 4 часов. После трехкратного отмывания с ФБР добавляли 0,2 мл ДМСО для растворения кристаллов. Измеряли поглощение при 570 нм.
Измерение содержания гидроксипролина в образце кожи
В соответствии с ранее описанным способом (Gawronskao-Kozak B. et al. 2006), половину биоптатов кожи диаметром 8 мм взвешивали и замораживали при -80°C. Кожу гомогенизировали в 2 мл ФБР и хранили при 4°C в течение ночи. На следующий день добавляли 1 мл 6 н HCl, и смесь нагревали до 120°C в течение 5 часов. 20 мкл охлажденных образцов и 50 мкл раствора хлорамина Т добавляли в 96-луночный планшет и инкубировали при комнатной температуре в течение 20 минут. Затем добавляли 50 мкл раствора Эрлиха, и смесь инкубировали при 65°C в течение 15 минут. Поглощение определяли при 570 нм. Концентрацию гидроксипролина рассчитывали по стандартной кривой.
Экстракция РНК, синтез кДНК и количественная ПЦР в режиме реального времени. РНК экстрагировали посредством способа (Invitrogen Life Technologies™). Вкратце, 1 мл Trizol™ добавляли к гомогенизированной кожной ткани. После выдерживания смеси при комнатной температуре в течение 5 минут добавляли 250 мкл хлороформа. Верхнюю водную фазу переносили в новую пробирку Эппендорф после центрифугирования в течение 10 минут при 20,000 g. К водной фазе добавляли равный объем изопропанола и осторожно перемешивали. Осадок промывали 1 мл 75% этанола после центрифугирования в течение 20 минут. РНК растворяли в ДЭПК, обработанном водой, и измеряли ее концентрацию с помощью Nanodrop2000™. Синтез кДНК проводили посредством набора для синтеза кДНК от Roche в соответствии с инструкциями производителя, с применением 1 мкг общей РНК в каждом образце. Количественную ПЦР в режиме реального времени для кроличьего α1 коллагена 1 типа, ММП-1 и конститутивного гена β-актина проводили в ViiA7 (Invitrogen™). Образцы кДНК добавляли к реакционной мастер-смеси ПЦР, содержащей STBR Green Master Mix™ (Rox) (Roche™, Индианаполис, Индиана). Все реакции проводили в двух повторностях с применением следующих условий цикла: 1 цикл 95°C в течение 10 минут, 40 циклов 95°C в течение 15 секунд и 60°C в течение 1 минуты. Уровень экспрессии α1 коллагена 1 типа и ММП-1 в каждом образце нормализовали по β-актину. Праймеры РВ-ПЦР: для кроличьего α1 коллагена 1 типа: 5'-ACAAGGGTGAGAAGGCGAAC-3' (прямой), 5'-GCCGTTGAGTCCATCTTTCCC-3' (обратный); для ММР-1: 5'-TCTGGCCACATCTGCCAATGG-3' (прямой), 5'-AGGGAAGCCAAAGGAGCTGTG-3' (обратный); для β-актина: 5'-AACGAGCGCTTCCGTTGGCCC-3' (прямой), 5'-CTTCTGCATGCGGTCCGCGA-3'(обратный).
Примеры
Пример 1. Экспрессия индоламин-2,3-диоксигеназы IDO) обеспечивает повышающую регуляцию экспрессии ММП-1 в фибробластах кожи человека
Для оценки влияния IDO на экспрессию ММП-1 использовали человеческий IDO рекомбинантный аденовирусный вектор для трансдукции гена в фибробласты кожи человека посредством ранее описанной процедуры (Li et al., 2004). Эффективность трансфекции оценивали путем детекции экспрессии IDO белка и его активности посредством вестерн-блоттинга и определения кинуренина в кондиционированной среде, соответственно. Как показано на левой панели на Фигуре 1A, белок IDO экспрессировался в фибробластах, трансдуцированных аденовирусом, но не выявлялся в контрольных и трандсдуцированных имитирующим аденовирусом фибробластах. Уровень кинуренина, показателя IDO активности, был существенно выше в фибробластах, трансдуцированных IDO аденовирусом (14,3±0,46 мкг/мл, n=3), по сравнению с контрольными фибробластами, не трансдуцированными или трансдуцированными имитирующим вектором (Фигура 1А, правая панель).
Экспрессию ММП-1 в контрольных, ложно трансфицированных и IDO-экспрессирующих фибробластах оценивали с применением вестерн-блоттинга. Как показано на Фигуре 1В, отмечено более чем девятикратное повышение экспрессии ММП-1 в IDO-экспрессирующих фибробластах (12,56±2,37, n=3), по сравнению с ложно-трансдуцированными (1,37±0,59, n=3) и необработанными контрольными фибробластами (1±0, n=3). Эти наблюдения позволяют предположить, что повышающая регуляция экспрессии ММП-1 в IDO-экспрессирующих фибробластах не обусловлена аденовирусной инфекцией, поскольку ложно трансдуцированные фибробласты не показали существенной разницы экспрессии ММП-1 от необработанных фибробластов.
IDO является внутриклеточным ферментом, превращающим триптофан в кинуренин. Таким образом, необходимо выяснить, действительно ли влияние стимуляции ММП-1 в IDO-экспрессирующих фибробластах обусловлено самим белком IDO или метаболитами триптофана. Чтобы выяснить это, кондиционированную среду от IDO-экспрессирующих и контрольных фибробластов собирали спустя 48 часов. Комбинацию 90% собранной кондиционированной среды и 10% свежей среды использовали затем для обработки фибробластов кожи. Клетки собирали спустя 48 часов после обработки. Как показано на Фигуре 1С, наблюдалось существенное повышение экспрессии ММП-1 в клетках, обработанных кондиционированной средой от IDO-трансдуцированных фибробластов (2,06±0,62, n=3), по сравнению с ложно трансдуцированными (1,16±0,31, n=3) или необработанными контрольными фибробластами (1±0, n=3). Этот результат позволяет предположить, что фактор или факторы в кондиционированной среде от фибробластов, инфицированных IDO-аденовирусом, а не внутриклеточный IDO белок, ответственны за повышенный уровень экспрессии ММП-1 в фибробластах.
Пример 2. Кинуренин, а не истощение триптофана индуцирует экспрессию ММП-1 в фибробластах кожи человека
IDO является ферментом, превращающим триптофан в кинуренин. Чтобы проверить, какой фактор (истощение триптофана или повышение кинуренина) ответствен за IDO повышающую регуляцию экспрессии ММП-1, фибробласты выращивали в культуральной среде, обедненной триптофаном, или обычной среде с различными концентрациями кинуренина. В клетках затем оценивали экспрессию ММП-1 с помощью вестерн-блоттинга. Как показано на Фигуре 2С, не отмечалось существенной разницы экспрессии ММП-1 в фибробластах, выращенных в присутствии 25 мкг/мл триптофана или культуральной среде, обедненной триптофаном. Однако экспрессия ММП-1 существенно повышалась в ответ на различные дозы (25-150 мкг/мл) кинуренина (Фигура 2А и Фигура 2В). Эти наблюдения позволяют предположить, что присутствие кинуренина, но не истощение триптофана вносит вклад в повышающую регуляцию ММП-1 в IDO-экспрессирующих клетках. Далее, мы установили, что всего 12,5 мкг/мл кинуренина позволяет стимулировать экспрессию ММП-1 в фибробластах человека (данные не показаны). Эта концентрация кинуренина подобна той, которую выявляли в кондиционированной среде от IDO-экспрессирующих фибробластов (Фигура 1А, правая панель). Таким образом, стимуляция ММП-1 в фибробластах явно связана с кинуренином, поскольку добавление различных концентраций триптофана с подобной структурой не вызывало повышения экспрессии ММП-1 в фибробластах кожи (Фигура 2D).
Пример 3. Влияние кинуренина на экспрессию ММП-2 и 3 в фибробластах кожи
Чтобы определить, действительно ли кинуренин также влияет на экспрессию других ММП, мы обрабатывали фибробласты кожи кинуренином в концентрациях, подобных тем, которые использовали на Фигуре 2. Вестерн-блоттинг использовали для детекции экспрессии ММП-2 и 3 с применением необработанных клеток в качестве контроля. Как показано на Фигуре 3А, не было существенной разницы экспрессии ММП-2 в обработанных кинуренином и необработанных фибробластах. Однако в подобных условиях обработка кинуренином существенно повышала экспрессию ММП-3 в фибробластах кожи дозозависимым образом (Фигура 3В/3С). Далее, чтобы проверить, действительно ли повышенные уровни ММП в фибробластах, обработанных кинуренином, сопровождались повышением активности ММП, кондиционированные среды от фибробластов в присутствии или при отсутствии 50 мкг/мл кинуренина собирали спустя 48 часов после обработки. Активность ММП в кондиционированных средах определяли с помощью непатентованного набора для анализа ММП SensoLyte 520™ с применением пептида для резонансного переноса энергии флуоресценции (FRET) F-FAM/QXL™ 520 в качестве субстрата ММП. Как показано на Фигуре 4, средняя активность ММП в кондиционированных средах от фибробластов, обработанных кинуренином, была значительно выше, чем в контрольных средах. Это указывает, что повышенные ММП в фибробластах, обработанных кинуренином, обладают ферментативной активностью.
Пример 4. Мезенхимальные и эпителиальные клетки по-разному отвечают на обработку кинуренином
Чтобы определить, какие типы клеток чувствительны к кинуренин-индуцированной экспрессии ММП-1, использовали мезенхимальные клетки (такие, как иммобилизованные клетки линии легочных фибробластов IMR-90 и фибробласто-подобные синовиоциты) и эпителиальные клетки (такие, как клетки линии эпителиальной карциномы легких А549, первичные дермальные кератиноциты, иммобилизованные клетки человеческой кератиноцитарной линии НАСАТ, и клетки плоскоклеточной карциномы головы и шеи UMSCC). Как и в фибробластах кожи, экспрессия ММП-1 в синовиоцитах и IMR-90 подвергалась повышающей регуляции при обработке кинуренином в концентрациях от 12,5 мкг/мл до 150 мкг/мл, как показано на Фигуре 5. Однако экспрессия ММП-1 во всех тестированных эпителиальных клетках, включая кератиноциты кожи, НАСАТ, А549 и UMSCC, по существу не отличалась от необработанных контролей в ответ на различные концентрации кинуренина (Фигура 6). Эти результаты позволяют предположить, что имеется различие между мезенхимальными и эпителиальными клетками в ответе на стимулированную кинуренином экспрессию ММП-1.
Пример 5. Идентификация фосфорилированных сигнальных молекул фосфокиназной матрицей в клетках, обработанных кинуренином
Для определения возможного механизма повышающей регуляции кинуренином экспрессии ММП-1 в фибробластах кожи, мы анализировали активацию множества серин-треонин- или тирозинкиназ, с применением фосфор-киназной матрицы. Эта матрица обеспечивает возможность одновременного определения статуса активации 46 различных протеинкиназ и их последующих факторов транскрипции. Как показано на Фигуре 7, спустя 1 час обработки фибробластов кожи кинуренином, были активированы экстраклеточные сигнал-регулируемые киназы 1/2 (ERK1/2).
Для подтверждения этих результатов фосфокиназной матрицы фибробласты кожи обрабатывали 100 мкг/мл кинуренина в различное время. Затем использовали иммуноблоттинг с применением антитела, отличающегося от тех, которые использовали в матрице, для детекции фосфорилирования ERK1/2 и его предыдущей молекулы митоген-активируемого белка/регулируемой экстраклеточным сигналом киназы (МЕК). Как показано на Фигуре 8, ERK1/2 был фосфорилирован в клетках, обработанных кинуренином. Результат был дополнительно подтвержден детекцией фосфорилирования предшествующей ERK1/2 сигнальной молекулы МЕК в клетках, обработанных кинуренином (Фигура 8). Как ERK1/2, так и МЕК показали подобный характер активации, с пиком 8 часов после обработки кинуренином (Фигура 8).
Пример 6. Добавление ингибиторов фосфорилирования MEK-ERK1/2 отменяет эффекты стимулированной кинуренином экспрессии ММП-1 в фибробластах кожи
В другой серии экспериментов мы проверяли, действительно ли активация МЕК-ERK1/2 МАРК пути кинуренином связана со стимулированной кинуренином экспрессией ММП-1 в фибробластах кожи. Для этого мы оценивали эффекты ингибиторов фосфорилирования МЕК или ERK1/2 на стимулированную кинуренином экспрессию ММП-1. Как показано на Фигуре 9А, добавление PD98059, специфического ингибитора активации ERK1/2, эффективно предотвращает стимулирующий эффект кинуренина в отношении экспрессии ММП-1 дозозависимым образом. Подобным образом, обработка клеток 10 мкМ и 30 мкМ U0126, специфического ингибитора активации МЕК, также существенно снижает повышающую регуляцию экспрессии ММП-1 кинуренином (Фигура 9В). Эти результаты показывают, что активация сигнального пути MEK-ERK1/2 вносит вклад в повышающую регуляцию экспрессии ММП-1, индуцированной кинуренином в фибробластах кожи.
Пример 7. Влияние кинуренина на экспрессию коллагена в фибробластах кожи и пролиферацию фибробластов
Перед изучением антифибротической роли in vivo тестировали влияние кинуренина на экспрессию коллагена и пролиферацию клеток. Как показано на Фигуре 10 (вверху), добавление 25-150 мкг/мл кинуренина снижает экспрессию проколлагена 1 типа. Однако не отмечено существенного влияния на пролиферацию фибробластов, даже когда клетки культивировали при концентрациях кинуренина до 150 мкг/мл (Фигура 11). Кроме того, тестирование аналогов/метаболитов кинуренина, кинуреновой кислоты и ксантуреновой кислоты, показало, что эти соединения являются также эффективными в ингибировании экспрессии проколлагена 1 типа (Фигура 10 (внизу)).
Пример 8. Местное нанесение кинуренина на раны уха кролика уменьшает рубцевание
Поскольку обработка фибробластов кожи кинуренином приводила к повышению экспрессии ММП-1 и 3, а также к снижению экспрессии проколлагена типа-1, мы хотели узнать, действительно ли кинуренин можно применять в качестве антифибротического агента для лечения или профилактики гипертрофического рубцевания. Для достижения этого, как описано ранее (Rahmani-Neishaboor et al., 2010; Kloeters et al., 2007; Xie et al., 2008), использовали модель гипертрофического рубца уха кролика. Раны обрабатывали ежедневно 0,1 мл карбоксиметилцеллюлозного (КМЦ) геля, содержащего 50 мкг кинуренина, в течение трех недель, начиная с 8 дня после нанесения раны. Доза 50 мг кинуренина на рану совпадала с дозой, используемой в системе in vitro с оптимальным результатом. Результат не показал существенного различия закрытия ран, обработанных кинуренином, по сравнению с необработанным или обработанным КМЦ гелем контролем (данные не показаны). Однако, как показано на Фигуре 12А, отмечалось существенно меньшее рубцевание ран, обработанных кинуренином, чем необработанных ран или контрольных ран, обработанных только носителем, спустя три недели. Средний индекс высоты рубца (SEI) существенно снижался в группе, леченной кинуренином (1,172±0,156, n=8), по сравнению с группой, леченной только носителем (1,978±0,442, n=4, p<0,01) и нелеченой группой (2,098±0,324, n=4, p<0,001) (Фигура 12В). Окрашивание трихромом по Массону для коллагена выявило существенное снижение содержания коллагена в ранах, обработанных кинуренином, по сравнению с теми ранами, которые не обрабатывали или обрабатывали одним гелем (Фигура 12С). В соответствии с этими наблюдениями, содержание гидроксипролина (используемое в качестве показателя содержания коллагена в ткани) было существенно ниже в ранах, обработанных кинуренином, по сравнению с ранами, не обработанными или обработанными одним гелем (Фигура 12D).
Наконец, мы показали, что местное применение кинуренина на фибротической модели ран уха кролика снижало экспрессию α1 коллагена 1 типа и повышало экспрессию ММП-1, по сравнению с ранами, не обработанными или обработанными одним гелем (Фигура 13). Эти результаты дополнительно поддерживают предположение о том, что кинуренин можно применять в качестве антифибротического фактора для лечения гипертрофических рубцов и даже келоида, которые часто наблюдаются у пациентов с ожоговыми повреждениями или хирургическими разрезами.
Пример 9. Влияние изоформ кинуренина на экспрессию ММП-1 в фибробластах кожи человека
Тестировали способность различных изоформ кинуренина к влиянию к экспрессию ММП-1. Тестированными изоформами были DL-кинуренин (DL-Kyn) или D-кинуренин (D-Kyn) и L-кинуренин (L-Kyn). Результаты показали, что все изоформы повышают экспрессию ММП-1 в фибробластах кожи, однако, L-кинуренин казался более активным по сравнению с двумя другими изоформами, см. Фигуру 14.
Пример 10. Влияние различных изоформ/аналогов кинуренина на экспрессию коллагена в фибробластах кожи человека
Фибробласты кожи обрабатывали FS-1 (DL-кинуренином) или D-кинуренином, или L-кинуренином, или FS-2 9 (кинуреновой кислотой), как показано на Фигуре 15. Экспрессию α1-коллагена 1 типа выявляли посредством ПЦР в режиме реального времени. Результаты показывают, что эти изоформы/аналоги обладают схожей эффективностью в отношении снижения экспрессии коллагена.
Пример 11. Кинуренин и его метаболиты осуществляют понижающую регуляцию экспрессии фибронектина в культивируемых фибробластах
Фибробласты кожи обрабатывали различными концентрациями DL-кинуренина (FS1), L-кинуренина, D-кинуренина или кинуреновой кислоты (FS2), как показано на Фигуре 16. Экспрессию фибронектина выявляли посредством ПЦР в режиме реального времени. Результаты показывают, что кинуренин, DL-кинуренин и L-кинуренин все были способными к понижающей регуляции экспрессии фибронектина, что указывало, что метаболиты кинуренина могут также быть приемлемыми для профилактики или лечения фибропролиферативных нарушений.
Пример 12. Кинуренин и его метаболиты/аналоги оказывают значительное влияние на спленоциты
Наблюдения на Фигуре 17 показывают почти 5-кратное снижение КонА-индуцированной пролиферации спленоцитов после обработки 100 и 150 мкг/мл D-кинуренина, L-кинуренина или DL-кинуренина спустя 96 часов (p<0,05), хотя пролиферация спленоцитов достоверно снижалась примерно в 2 раза при обработке D-кинуренином, L-кинуренином и DL-кинуренином в дозе 100 и 150 мкг/мл спустя 48 часов. FS2 оказывал меньшее влияние на пролиферацию, чем другие метаболиты. Наблюдения на Фигуре 18 показали, что FS1 оказывает иммуносупрессивное влияние на продукцию некоторых из провоспалительных цитокинов и хемокинов, таких как ИЛ-1, ИЛ-2, CXCL9 и CXCL10. Кроме того, он существенно снижал продукцию ИЛ-17, который, как полагают, играет важную роль в воспалении.
Пример 13. Длительное влияние кинуреновой кислоты и кинуренина на экспрессию ММП-1 в фибробластах
Для определения длительного влияния кинуреновой кислоты (KynA) и кинуренина (Kyn) на экспрессию ММП-1 в фибробластах, клетки обрабатывали 100 мкг/мл лекарства. После 48 часов обработки среду заменяли на свежую, и затем клетки собирали спустя 0, 12, 24 или 48 часов после удаления лекарства. Отмечалось существенное повышение экспрессии ММП-1 в фибробластах в ответ на воздействие KynA или Kyn спустя 48 часов после обработки. После удаления Kyn и KynA экспрессия ММП-1 оставалась существенно более высокой, чем в необработанных клетках еще 24 часа (Фигура 19А). Интересно, что в то время как экспрессия белка ММП-1 постепенно снижалась до нормального уровня в пределах 48 часов после удаления Куп, экспрессия ММП-1 в ответ на обработку KynA оставалась более высокой, чем в контроле (Фигура 19А). Фигура 19В представляет количественный анализ данных с Фигуры 19А (* значение p<0,05, ** значение p<0,01, n=4). Из этих результатов видно, что KynA оказывает более продолжительное влияние на экспрессию ММП-1, по сравнению с Kyn в обработанных фибробластах.
Хотя раскрыты различные варианты осуществления, многие адаптации и модификации возможны в пределах объема изобретения, в соответствии с общеизвестными знаниями специалистов в данной области техники. Такие модификации включают замену известных эквивалентов для любого аспекта изобретения для достижения того же самого результата по существу таким же способом. Численные диапазоны включают значения, определяющие диапазон. Слово «включающий» применяется в настоящей заявке в качестве открытого термина, по существу эквивалентного выражению «включая, но не ограничиваясь», а выражение «включает» имеет соответствующее значение. Как применяется в настоящей заявке, формы единственного числа включают множественное число, если только в контексте ясно не указано иное. Таким образом, например, ссылка на «предмет» включает более одного такого предмета. Цитирование ссылок в настоящей заявке не является допущением того, что такие ссылки являются предшествующими уровнем техники для варианта осуществления настоящего изобретения. Изобретение включает все варианты осуществления и разновидности, по существу как описано выше, и со ссылкой на примеры и чертежи.
Ссылки
Gawronskao-Kozak В. et al. Wound Repair Regeneration (2006) Scarless skin repair in immunodeficient mice 14:265-276.
Ghahary A, Tredget EE, Chang LJ, et al. (1998) Genetically modified dermal keratinocytes express high levels of transforming growth factor-β1. J Invest Dermatol 110: 800-805.
Kahari, V.M. and U. Saarialho-Kere (1997). "Matrix metalloproteinases in skin." ExpDermatol6 (5): 199-213.
Kloeters O, Tandara A, Mustoe T (2007) Hypertrophic scar model in the rabbit ear: a reproducible model for studying scar tissue behavior with new observation on silicone gel sheeting for scar reduction. Wound Repair Regen 15: S40-S45.
Li Y, Tredget EE, Ghaffari A, et al. (2006) Local expression of indoleamine 2,3-dioxygenase protects engraftment of xenogeneic skin substitutes. JInvest Dermatol 126: 128-136.
Li Y, Tredget EE, Kilani RT, et al. (2004) Expression of indoleamine 2,3-dioxygenase in dermal fibroblasts functions as a local immunosuppressive factor. J Invest Dermatol 122: 953-964.
Rahmani-Neishaboor E, Yau FM, Jalili R, et al. (2010) Improvement of hypertrophic scarring by using topical anti-fibrogenic/anti-inflammatory factors in a rabbit ear model. Wound Repair Regen 18: 401-408.
Salo, Т., J. G. Lyons, et al. (1991). "Transforming growth factor-beta 1 up-regulates type IV collagenase expression in cultured human keratinocytes." J BiolChem266 (18): 11436-41.
Saus, J., S. Quinones, et al. (1988). "The complete primary structure of human matrix metalloproteinase-3. Identity with stromelysin." J BiolChem 263 (14): 6742-5.
Scott, P. G., A. Ghahary, et al. (1994). In: Advances in Structural Biology3: 157-201.
Tokikawa O, Kuroiwa T, Yamazaki F, et al. (1988) Mechanism of interferon-γ action: characterization of indoleamine 2,3-dioxygenase in cultured human cells by intefron-γ and evaluation of the enzyme-mediated tryptophan degradation in its anticellular activity. J BiolChem 263: 2041-2048.
Xie JL, Bian HN, Qi SH, et al. (2008) Basic fibroblast growth factor (bFGF) alleviates the scar of the rabbit ear model in wound healing. Wound Repair Regen 16: 576-581.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКОЕ СОЕДИНЕНИЕ | 2016 |
|
RU2730842C2 |
| КОМБИНАЦИЯ КИНУРЕНИНА И АНТИГЕНПРЕДСТАВЛЯЮЩИЕ КЛЕТКИ (APC) В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ И СПОСОБ ИХ ПРИМЕНЕНИЯ В ИММУНОМОДУЛЯЦИИ | 2015 |
|
RU2727573C2 |
| СПОСОБ ПОЛУЧЕНИЯ СТАБИЛЬНЫХ БАКТЕРИАЛЬНЫХ ЭКСТРАКТОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ | 2020 |
|
RU2820605C2 |
| СРЕДСТВА И СПОСОБЫ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ РАКА, ЗАВИСИМОГО ОТ ПРИРОДНОГО ЛИГАНДА AHR | 2012 |
|
RU2640913C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗАЗЕПИНА | 2003 |
|
RU2423353C1 |
| АНТИ-LRP6 АНТИТЕЛА | 2011 |
|
RU2587625C2 |
| СПЕЦИФИЧЕСКИЕ СОЕДИНЕНИЯ ДИАРИЛГИДАНТОИНА И ДИАРИЛТИОГИДАНТОИНА | 2010 |
|
RU2548918C2 |
| АНТИСМЫСЛОВЫЕ ОЛИГОНУКЛЕОТИДЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ-1 | 2019 |
|
RU2802418C2 |
| ПРИМЕНЕНИЕ СЛИТОГО КОНСТРУКТА ТИМП-ГФИ И СПОСОБ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЙ КОЖИ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ИНГИБИРОВАНИЯ ОБРАЗОВАНИЯ РУБЦА | 2006 |
|
RU2428479C2 |
| БИЦИКЛИЧЕСКИЕ АРИЛЬНЫЕ МОНОБАКТАМОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2017 |
|
RU2733402C2 |
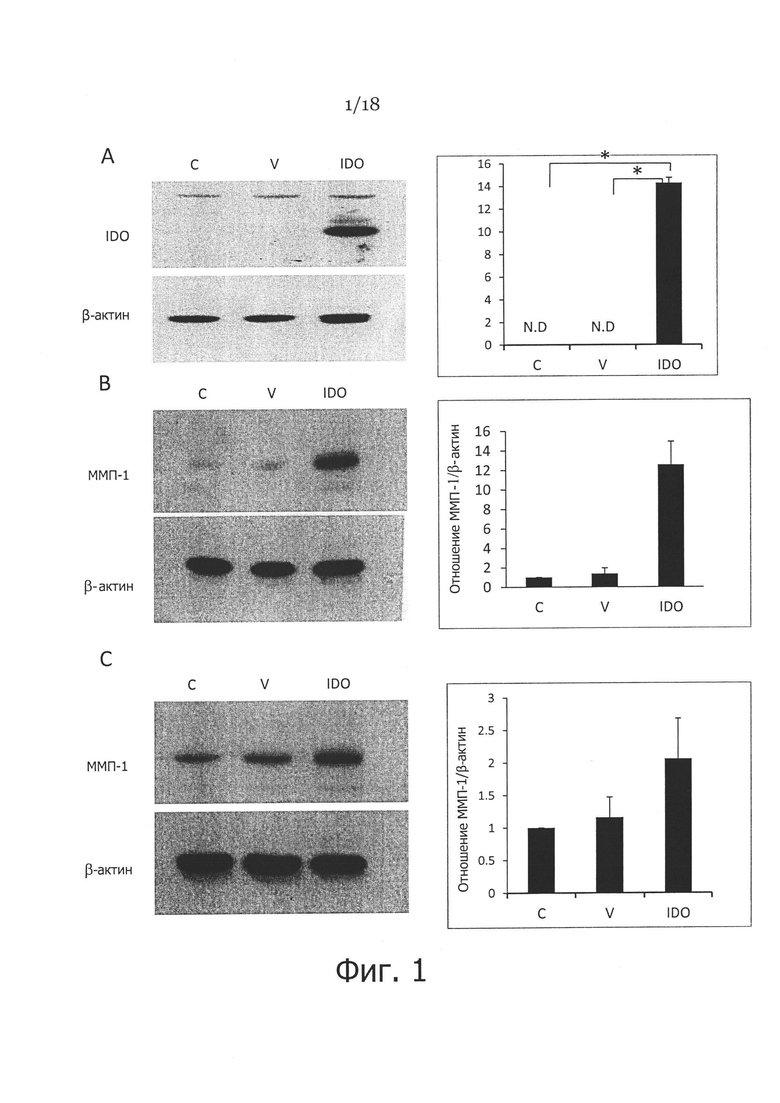
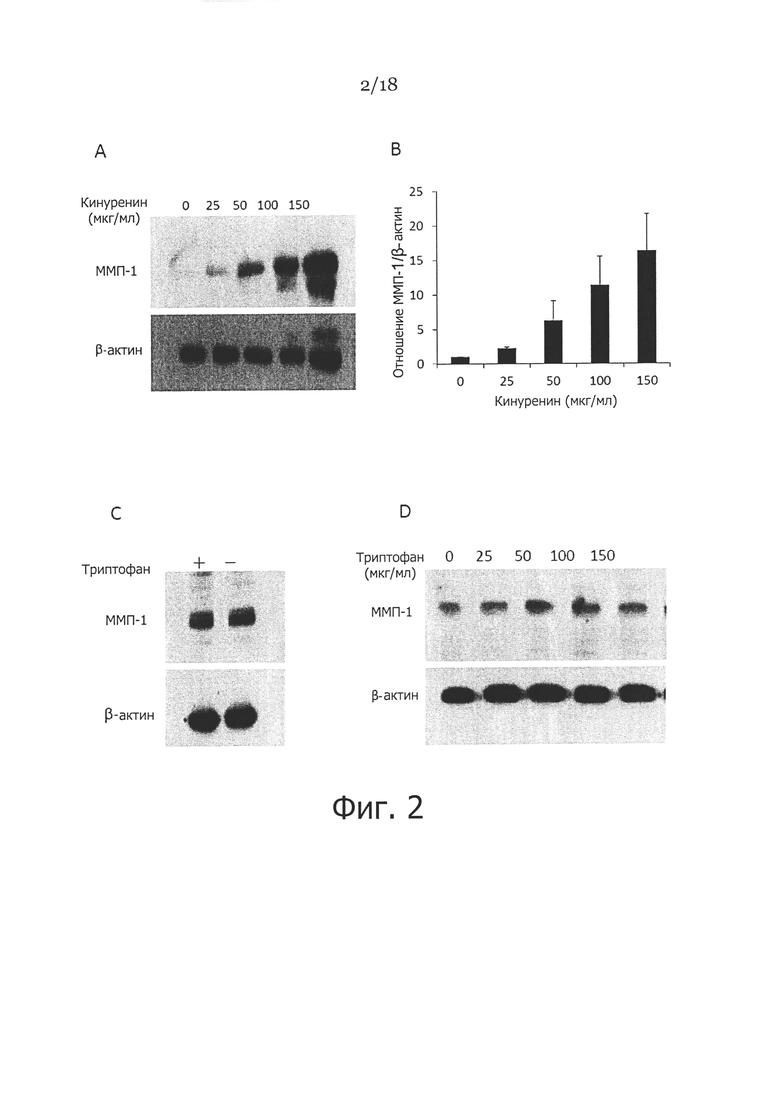
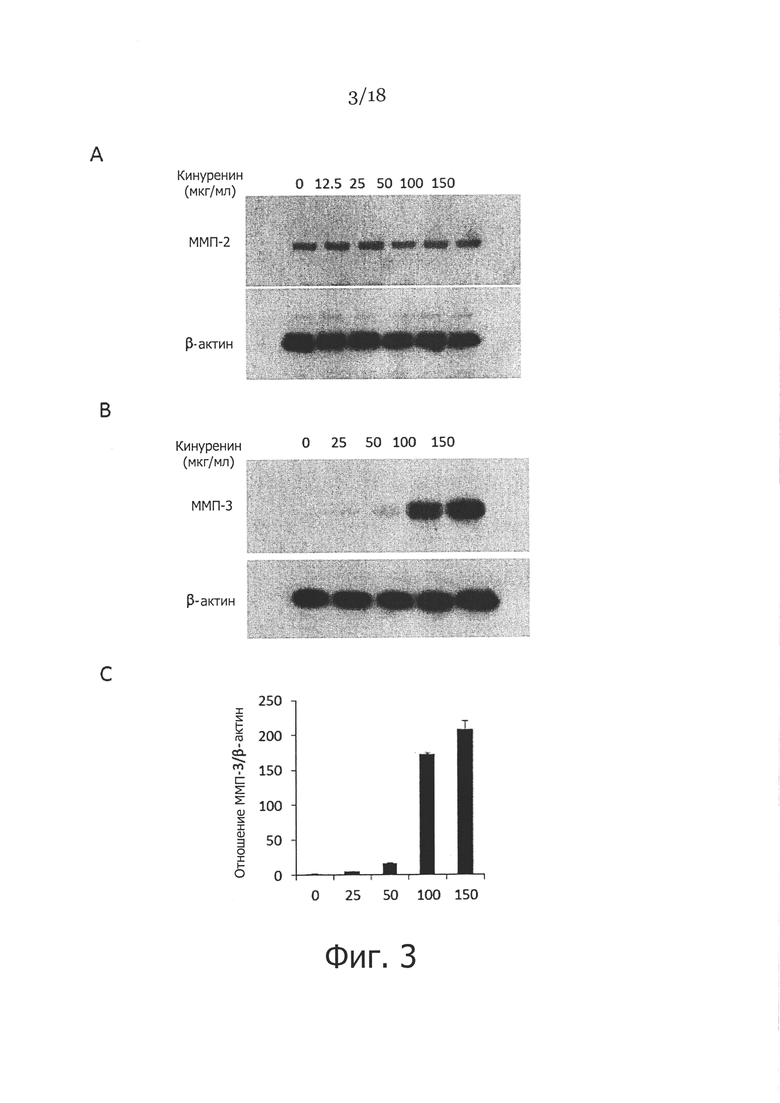
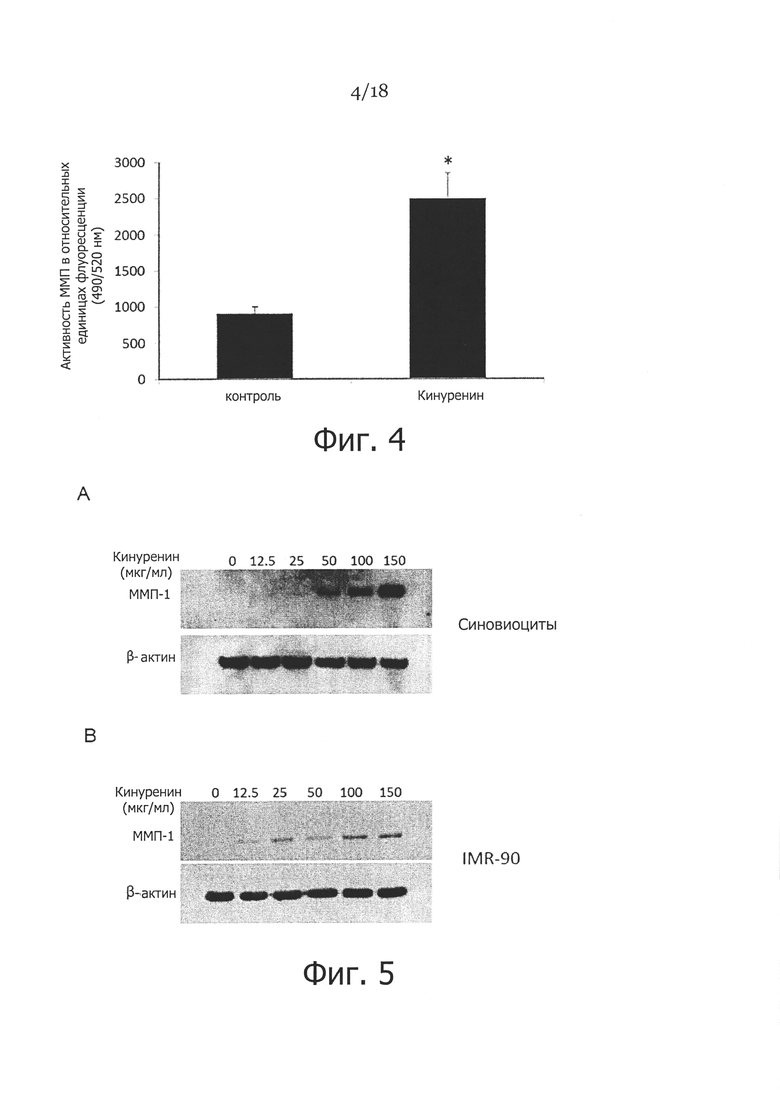
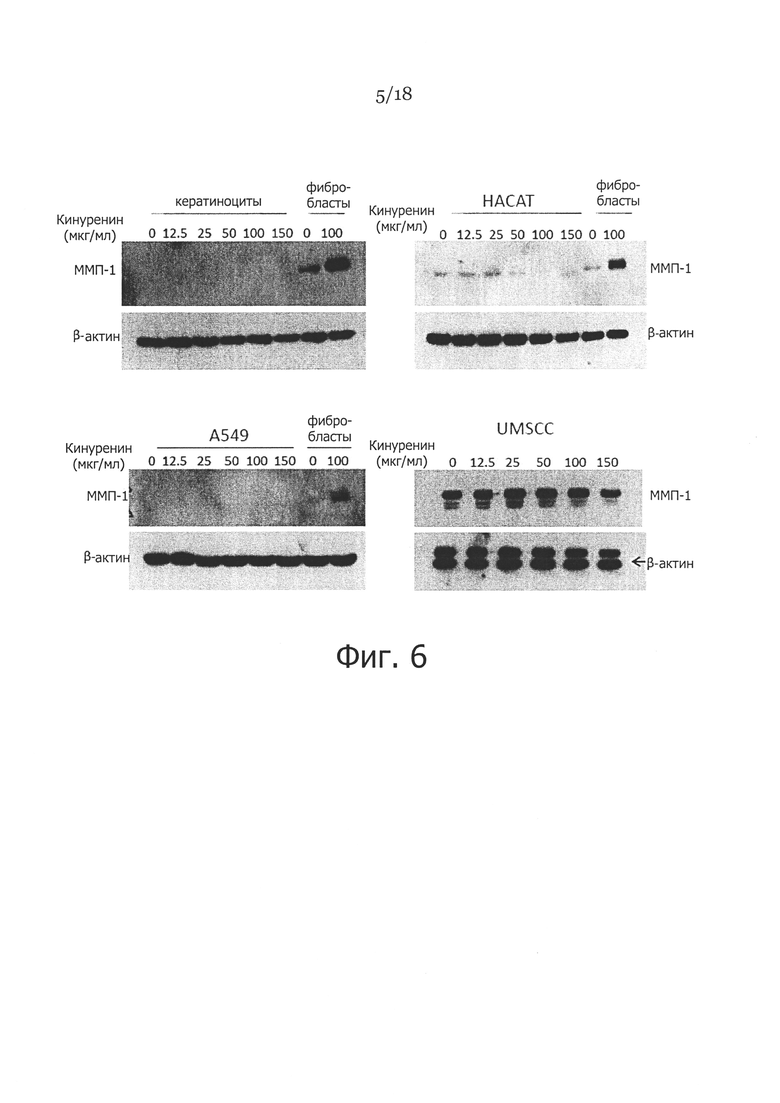

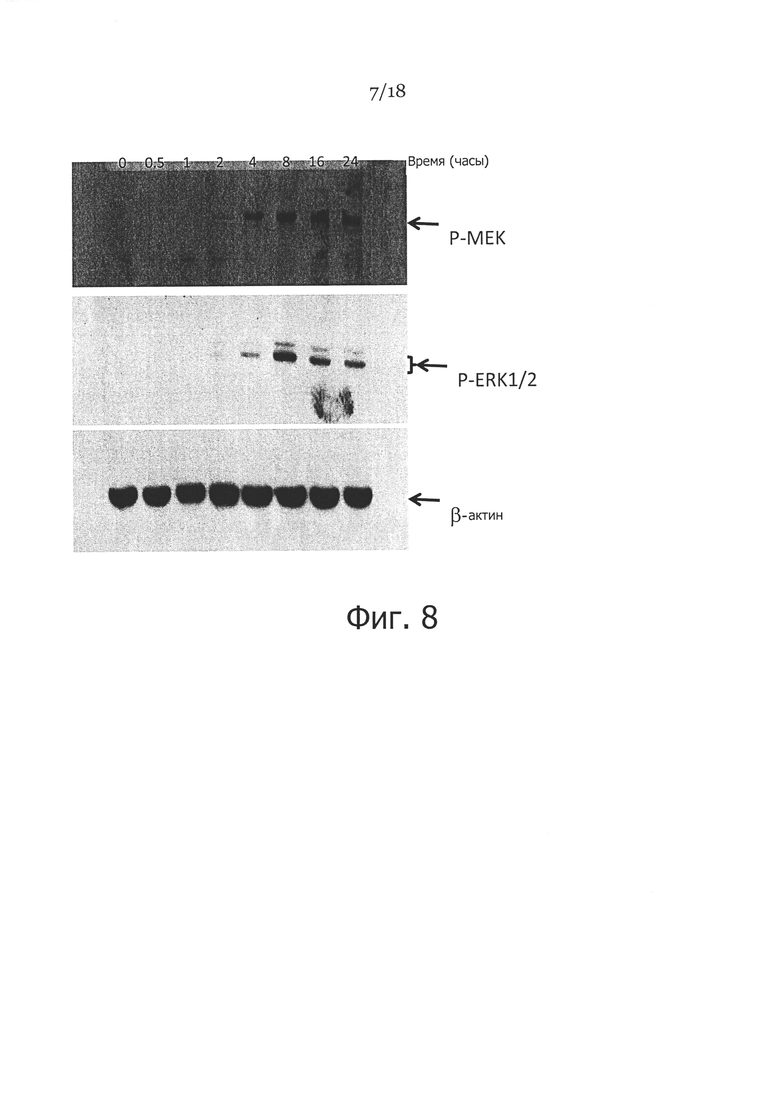
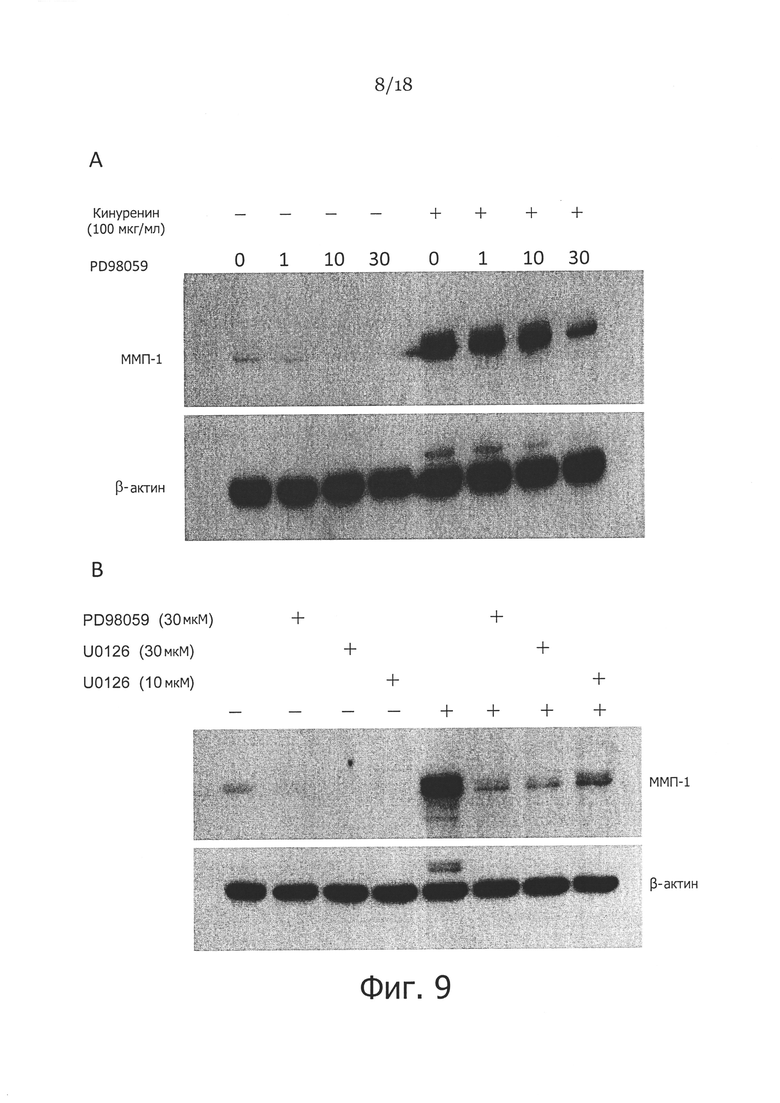
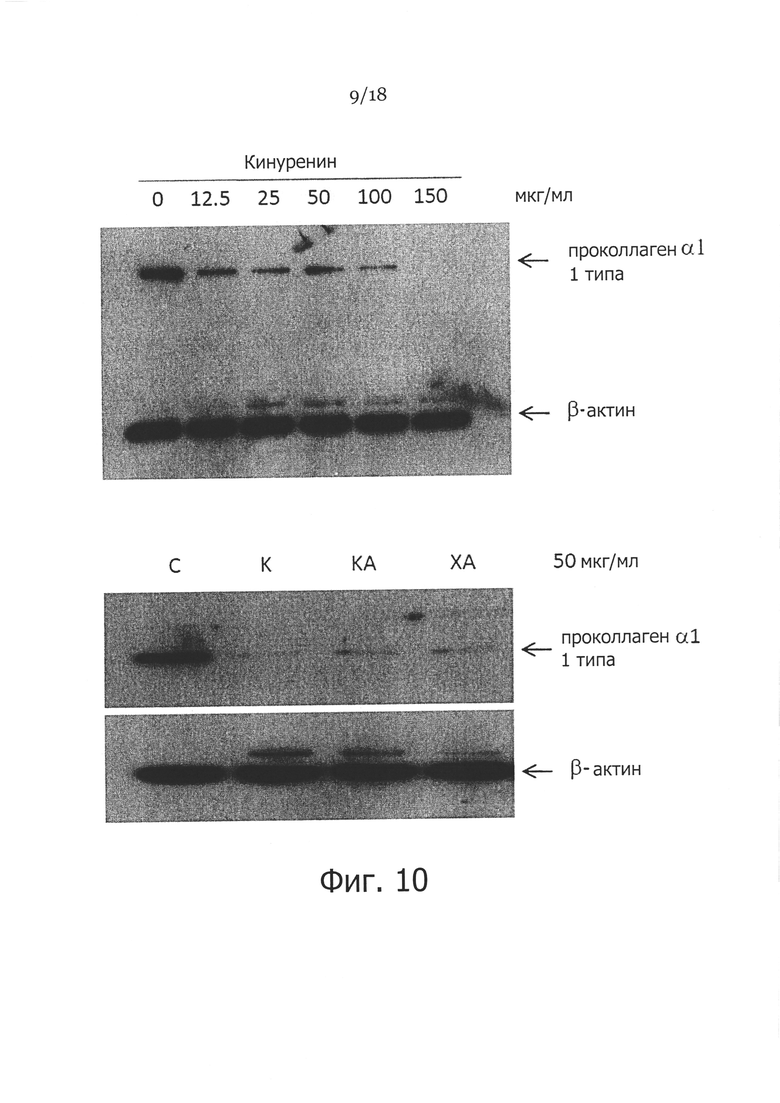
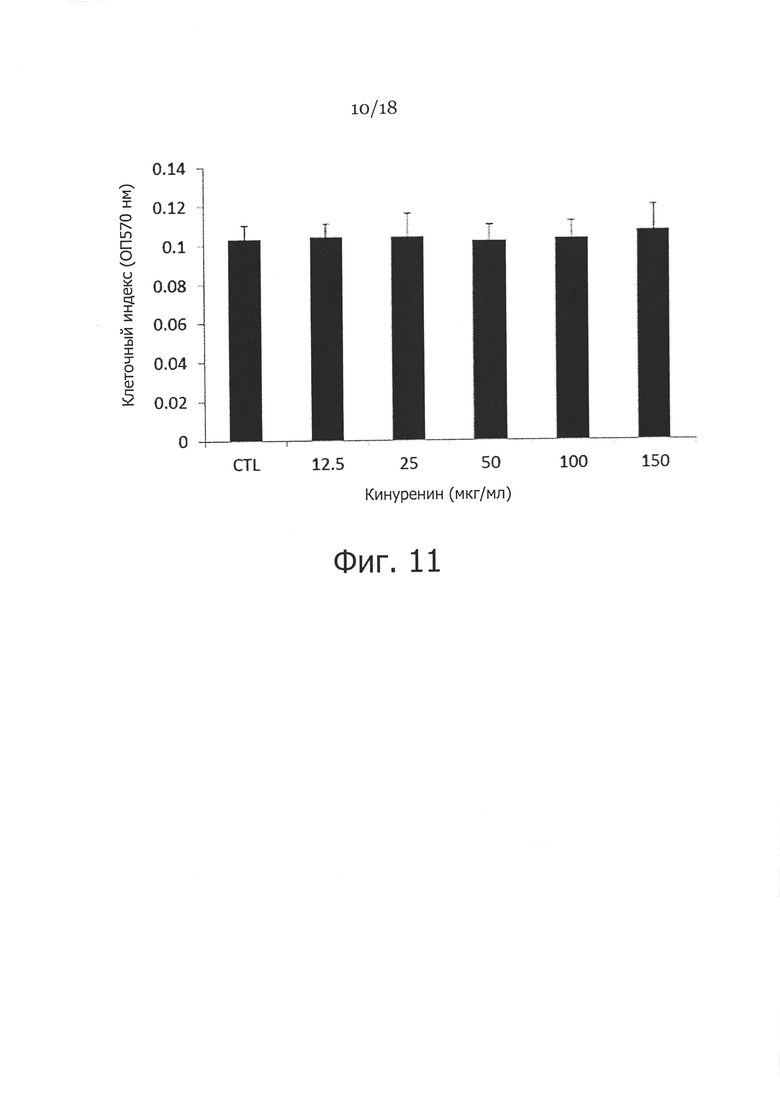
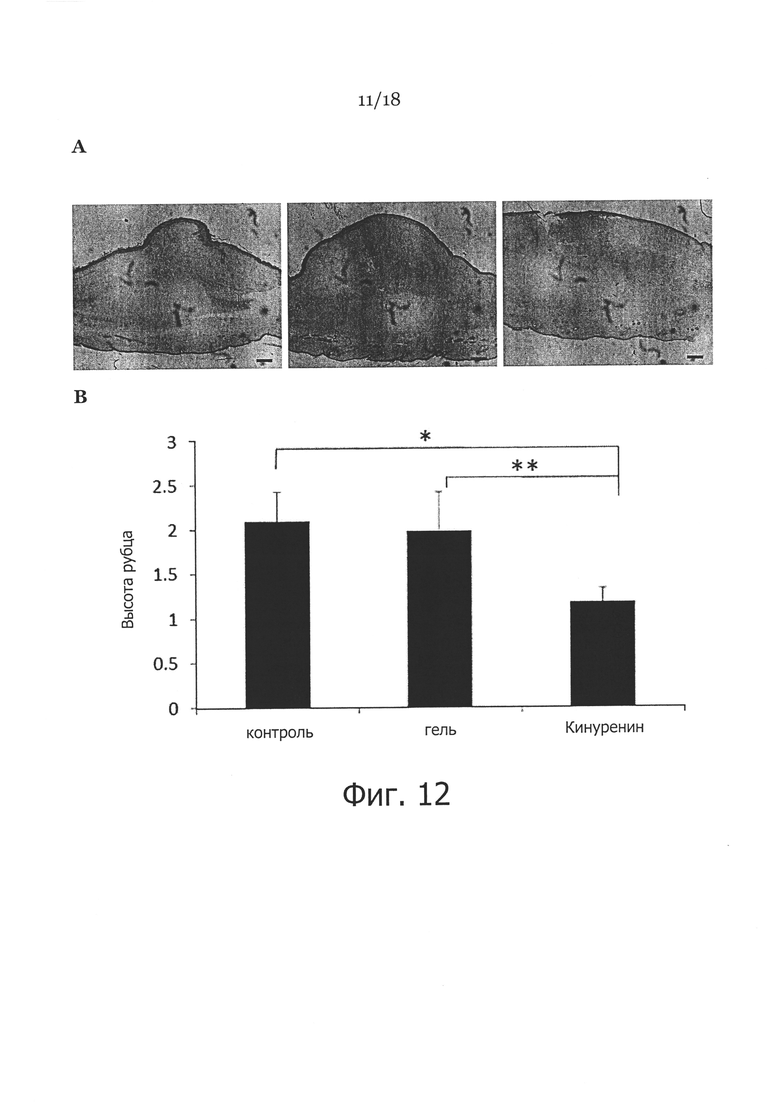
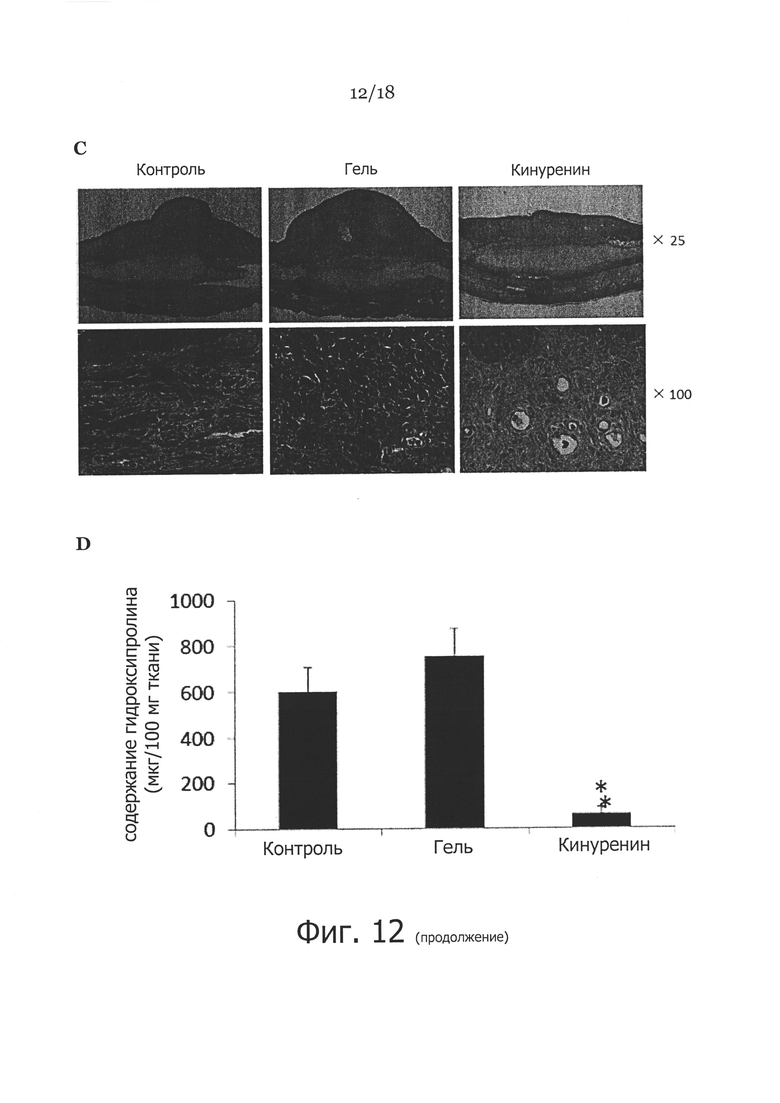
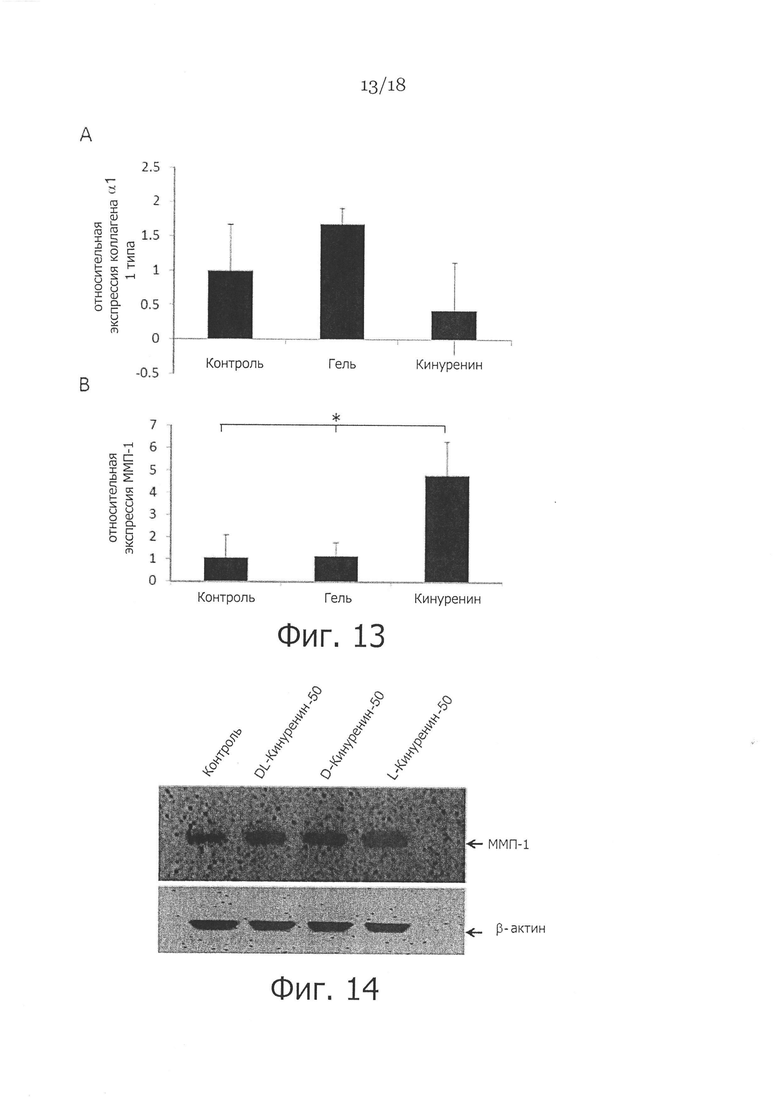
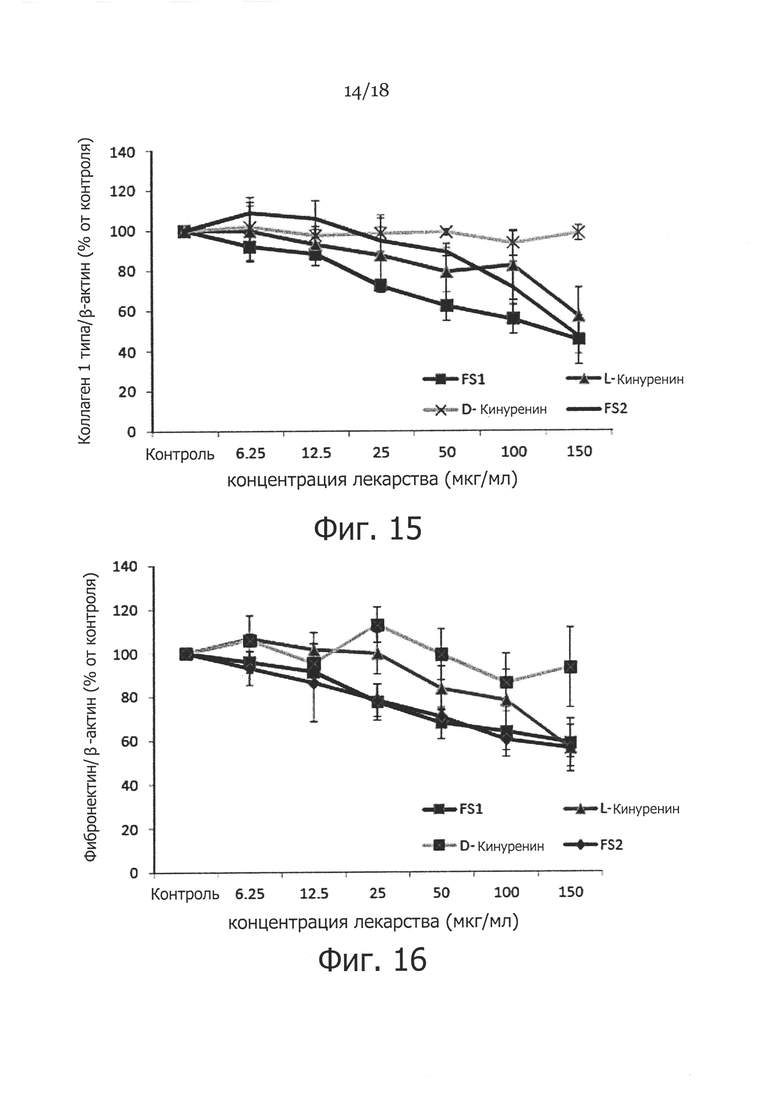
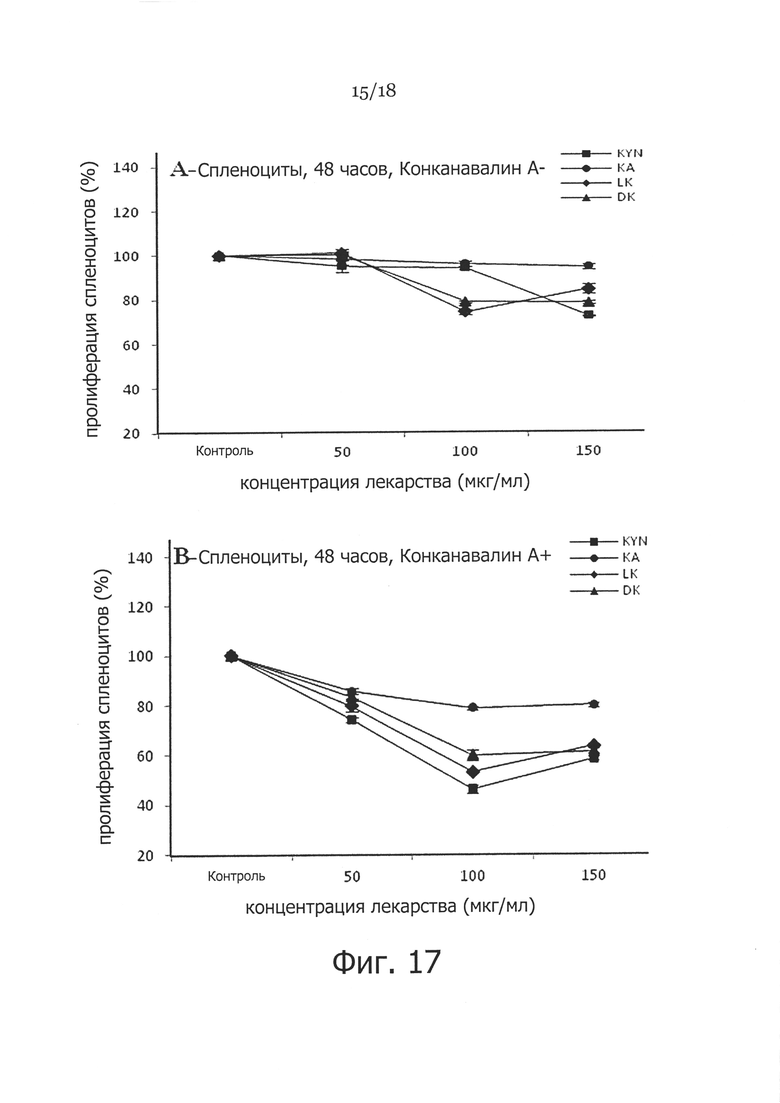
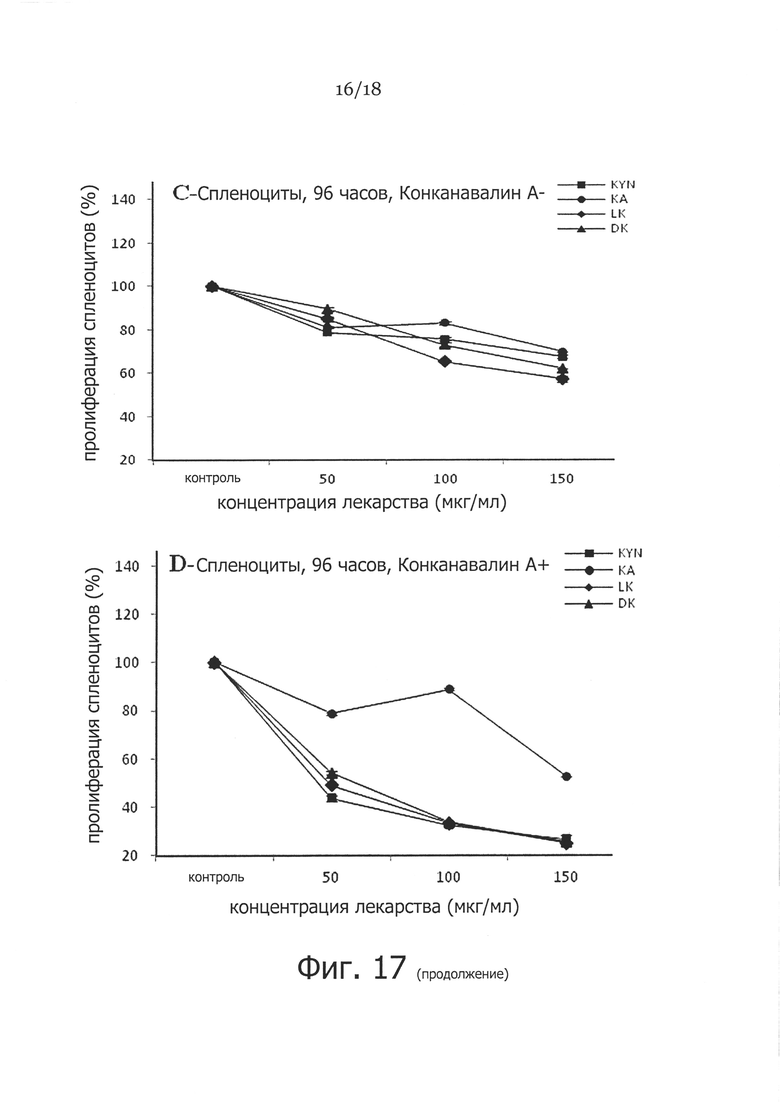
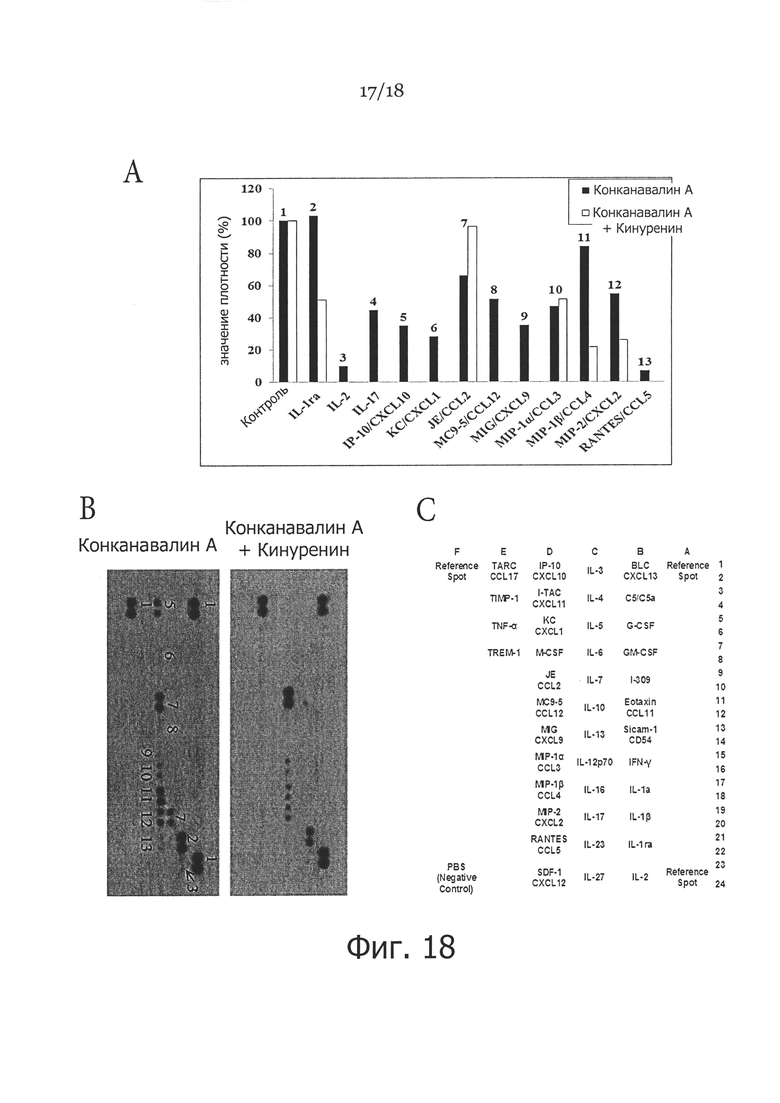
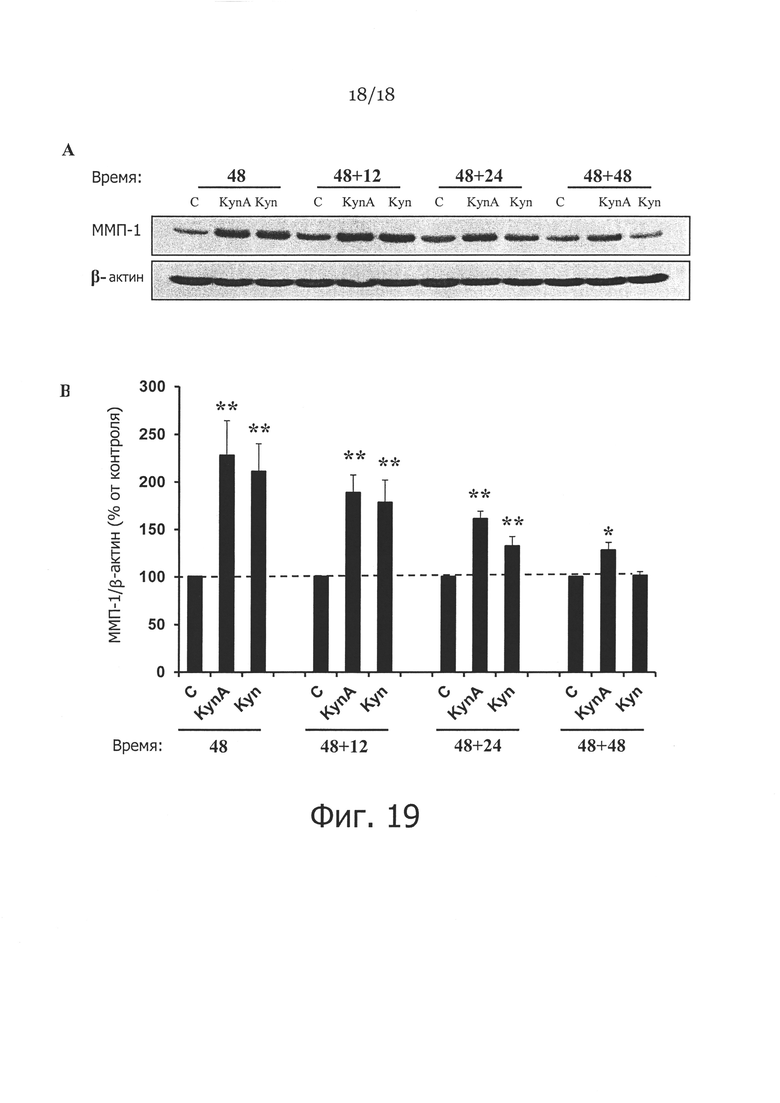
Группа изобретений относится к области медицины и фармацевтики, а именно к применению соединения формулы I: 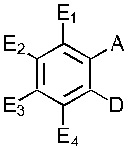 I, где E1 является H, OH или NH2; E2 является H, OH или NH2; E3 является H, OH или NH2; E4 является H, OH или NH2; A является H или NH2; D является
I, где E1 является H, OH или NH2; E2 является H, OH или NH2; E3 является H, OH или NH2; E4 является H, OH или NH2; A является H или NH2; D является 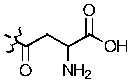 ; или A и D образуют 6-членное кольцо формулы:
; или A и D образуют 6-членное кольцо формулы: 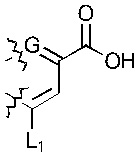 ; G является N; L1 является OH; для лечения фиброзирующего заболевания. Также группа изобретений относится к способу лечения фиброзирующего заболевания путем введения указанных соединений; фармацевтической композиции, содержащей указанные соединения, и коммерческой упаковке, содержащей указанные композиции. Группа изобретений обеспечивает новые средства и способы лечения фиброза. 5 н. и 30 з.п. ф-лы, 13 пр., 19 ил.
; G является N; L1 является OH; для лечения фиброзирующего заболевания. Также группа изобретений относится к способу лечения фиброзирующего заболевания путем введения указанных соединений; фармацевтической композиции, содержащей указанные соединения, и коммерческой упаковке, содержащей указанные композиции. Группа изобретений обеспечивает новые средства и способы лечения фиброза. 5 н. и 30 з.п. ф-лы, 13 пр., 19 ил.
1. Применение соединения, имеющего структуру формулы I:
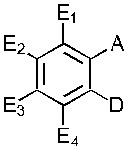 I, где
I, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H, OH или NH2;
A является H или NH2;
D является 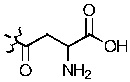 ; или
; или
A и D образуют 6-членное кольцо формулы:
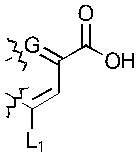 ;
;
G является N;
L1 является OH;
для лечения фиброзирующего заболевания,
где фиброзирующее заболевание выбрано из одного или более из следующего: келоид; гипертрофическое рубцевание; фиброз легкого; фиброз почки; цирроз печени; эндомиокардиальный фиброз; медиастинальный фиброз; миелофиброз; ретроперитонеальный фиброз; прогрессирующий массивный фиброз; нефрогенный системный фиброз; перенесенный инфаркт миокарда; склеродермия; системный склероз; фибромиома матки.
2. Применение соединения, имеющего структуру формулы I:
 I, где
I, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H, OH или NH2;
A является H или NH2;
D является  ; или
; или
A и D образуют 6-членное кольцо формулы:
 ;
;
G является N;
L1 является OH;
для изготовления лекарственного средства для лечения фиброзирующего заболевания,
где фиброзирующее заболевание выбрано из одного или более из следующего: келоид; гипертрофическое рубцевание; фиброз легкого; фиброз почки; цирроз печени; эндомиокардиальный фиброз; медиастинальный фиброз; миелофиброз; ретроперитонеальный фиброз; прогрессирующий массивный фиброз; нефрогенный системный фиброз; перенесенный инфаркт миокарда; склеродермия; системный склероз; фибромиома матки.
3. Применение по п.1, где фиброзирующее заболевание выбрано из одного или более из следующего: келоид, и гипертрофическое рубцевание.
4. Применение по п.1, где
E1 является H или OH;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H, OH или NH2.
5. Применение по п.1, где
E1 является H, OH или NH2;
E2 является H или OH;
E3 является H, OH или NH2;
E4 является H, OH или NH2.
6. Применение по п.1, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H или OH;
E4 является H, OH или NH2.
7. Применение по п.1, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H или OH.
8. Применение по п.1, где соединение имеет структуру формулы II:
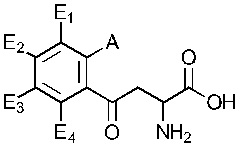 II.
II.
9. Применение по п.1, где соединение имеет структуру формулы III:
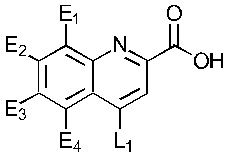 III.
III.
10. Применение по п.9, где L1 является OH.
11. Применение по п.1, где
(а)
E1 является H или OH;
E2 является H, OH или NH2;
E3 является H, OH или NH2; и
E4 является H, OH или NH2;
(b)
E1 является H, OH или NH2;
E2 является H или OH;
E3 является H, OH или NH2; и
E4 является H, OH или NH2;
(с)
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H или OH; и
E4 является H, OH или NH2;
(d)
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H или OH; и
E4 является H или NH2; или
(е)
E1 является H или OH;
E2 является H или OH;
E3 является H или OH; и
E4 является H или NH2.
12. Применение по п.1, где соединение выбрано из одного или более из следующего:
 ;
;  ;
;  ;
; 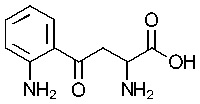 ;
; 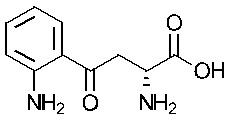 ;
; 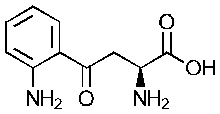 ;
; 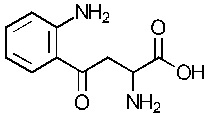 ; и
; и 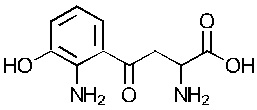 .
.
13. Способ лечения фиброзирующего заболевания, включающий введение субъекту, нуждающемуся в лечении, соединения или его фармацевтически приемлемой соли, где соединение имеет структуру формулы I:
 I, где
I, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H, OH или NH2;
A является H или NH2;
D является  ; или
; или
A и D образуют 6-членное кольцо формулы:
 ;
;
G является N;
L1 является OH;
где фиброзирующее заболевание выбрано из одного или более из следующего: келоид; гипертрофическое рубцевание; фиброз легкого; фиброз почки; цирроз печени; эндомиокардиальный фиброз; медиастинальный фиброз; миелофиброз; ретроперитонеальный фиброз; прогрессирующий массивный фиброз; нефрогенный системный фиброз; перенесенный инфаркт миокарда; склеродермия; системный склероз; фибромиома матки.
14. Способ по п.13, где фиброзирующее заболевание выбрано из одного или более из следующего: келоид, и гипертрофическое рубцевание.
15. Способ по п.13, где
E1 является H или OH;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H, OH или NH2.
16. Способ по п.13, где
E1 является H, OH или NH2;
E2 является H или OH;
E3 является H, OH или NH2;
E4 является H, OH или NH2.
17. Способ по п.13, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H, или OH;
E4 является H, OH или NH2.
18. Способ по п.13, где:
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H или OH.
19. Способ по п.13, где соединение имеет структуру формулы II:
 II.
II.
20. Способ по п.13, где соединение имеет структуру формулы III:
 III.
III.
21. Способ по п. 20, где L1 является OH.
22. Способ по п.13, где
(а)
E1 является H или OH;
E2 является H, OH или NH2;
E3 является H, OH или NH2; и
E4 является H, OH или NH2;
(b)
E1 является H, OH или NH2;
E2 является H или OH;
E3 является H, OH или NH2; и
E4 является H, OH или NH2;
(с)
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H или OH; и
E4 является H, OH или NH2;
(d)
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H или OH; и
E4 является H или NH2; или
(e)
E1 является H или OH;
E2 является H или OH;
E3 является H или OH; и
E4 является H или NH2.
23. Способ по п.13, где соединение выбрано из одного или более из следующего:
 ;
;  ;
;  ;
;  ;
;  ;
;  ;
;  ; и
; и  .
.
24. Фармацевтическая композиция для лечения фиброзирующего заболевания, включающая соединение или его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество, где соединение имеет структуру формулы I:
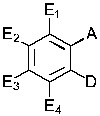 I, где
I, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H, OH или NH2;
A является H или NH2;
D является  ; или
; или
A и D образуют 6-членное кольцо формулы:
 ;
;
G является N;
L1 является OH;
для лечения фиброзирующего заболевания,
где фиброзирующее заболевание выбрано из одного или более из следующего: келоид; гипертрофическое рубцевание; фиброз легкого; фиброз почки; цирроз печени; эндомиокардиальный фиброз; медиастинальный фиброз; миелофиброз; ретроперитонеальный фиброз; прогрессирующий массивный фиброз; нефрогенный системный фиброз; перенесенный инфаркт миокарда; склеродермия; системный склероз; фибромиома матки.
25. Фармацевтическая композиция по п.24, где фиброзирующее заболевание выбрано из одного или более из следующего: келоид, и гипертрофическое рубцевание.
26. Фармацевтическая композиция по п.24, где
E1 является H или OH;
E2 является H, OH или NH2;
E3 является H, OH, или NH2;
E4 является H, OH или NH2.
27. Фармацевтическая композиция по п.24, где
E1 является H, OH или NH2;
E2 является H или OH;
E3 является H, OH или NH2;
E4 является H, OH или NH2.
28. Фармацевтическая композиция по п.24, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H или OH;
E4 является H, OH или NH2.
29. Фармацевтическая композиция по п.24, где
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H, OH или NH2;
E4 является H или OH.
30. Фармацевтическая композиция по п.24, где соединение имеет структуру формулы II:
 II.
II.
31. Фармацевтическая композиция по п.24, где соединение имеет структуру формулы III:
 III.
III.
32. Фармацевтическая композиция по п.31, где L1 является OH.
33. Фармацевтическая композиция по п.24, где
E1 является H или OH;
E2 является H, OH или NH2;
E3 является H, OH или NH2; и
E4 является H, OH или NH2;
(b)
E1 является H, OH или NH2;
E2 является H или OH;
E3 является H, OH или NH2; и
E4 является H, OH или NH2;
(с)
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H или OH; и
E4 является H, OH или NH2;
(d)
E1 является H, OH или NH2;
E2 является H, OH или NH2;
E3 является H или OH; и
E4 является H или NH2; или
(е)
E1 является H или OH;
E2 является H или OH;
E3 является H или OH; и
E4 является H или NH2.
34. Фармацевтическая композиция по п.24, где соединение выбрано из одного или более из следующего:
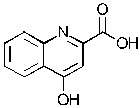 ;
; 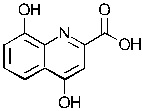 ;
; 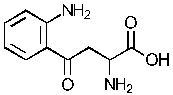 ;
;  ;
; 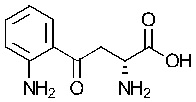 ;
; 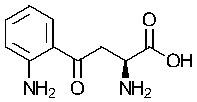 ;
; 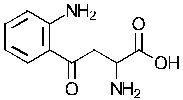 ; и
; и 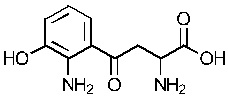 .
.
35. Коммерческая упаковка, включающая (а) фармацевтическую композицию по п.24; и (b) инструкции по ее применению для лечения фиброзирующего заболевания;
где фиброзирующее заболевание выбрано из одного или более из следующего: келоид; гипертрофическое рубцевание; фиброз легкого; фиброз почки; цирроз печени; эндомиокардиальный фиброз; медиастинальный фиброз; миелофиброз; ретроперитонеальный фиброз; прогрессирующий массивный фиброз; нефрогенный системный фиброз; перенесенный инфаркт миокарда; склеродермия; системный склероз; фибромиома матки.
| WO 2008087461 A2, 24.07.2008 | |||
| СТАБИЛИЗИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ЛИОФИЛИЗИРОВАННОЙ ФОРМЕ | 2000 |
|
RU2251411C2 |
| US 20080161353 A1, 03.07.2008 | |||
| БЕЛИКОВ В.Г | |||
| Фармацевтическая химия | |||
| М.: Высшая школа, 1993, с | |||
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
Авторы
Даты
2020-07-14—Публикация
2014-06-04—Подача