Область техники, к которой относится изобретение
Настоящее изобретение относится к химерным антигенным рецепторам (CAR). CAR обладают способностью перенаправлять специфичность и реактивность иммунных клеток на выбранные мишени благодаря свойствам лиганд-связывающего домена. В частности, настоящее изобретение относится к химерному антигенному рецептору, в котором внеклеточный лиганд-связывающий домен представляет собой scFV, выведенный из моноклонального антитела к CD19, предпочтительно 4G7. Настоящее изобретение относится также к полинуклеотидам, векторам, кодирующим указанный CAR, и к выделенным клеткам, экспрессирующим указанный CAR на своей поверхности. Настоящее изобретение относится также к способам создания иммунных клеток, экспрессирующих 4G7-CAR на своей поверхности, который обеспечивает пролонгированное «активированное» состояние трансдуцированной клетки.
Настоящее изобретение наиболее пригодно для лечения В-клеточных лимфом и лейкоза.
Предпосылки создания изобретения
Адаптивная иммунотерапия, в которой применяют перенос аутологичных антигенспецифических Т-клеток, созданных ex vivo, представляет собой перспективную стратегию для лечения вирусных инфекций и рака. Т-клетки, применяемые для адаптивной иммунотерапии, можно создавать либо путем размножения антигенспецифических Т-клеток, либо посредством перенаправления Т-клеток с помощью методов генетической инженерии (Park, Rosenberg и др., 2011). Перенос Т-клеток, специфических в отношении вирусных антигенов, является хорошо зарекомендовавшей себя процедурой, которую применяют для лечения ассоциированных с трансплантацией вирусных инфекций и редких связанных с вирусами злокачественных заболеваний. Продемонстрировано также, что выделение и перенос специфических в отношении опухоли Т-клеток приводит к успеху при лечении меланомы.
В Т-клетках были успешно созданы новые специфичности посредством генетического переноса трансгенных T-клеточных рецепторов или химерных антигенных рецепторов (CAR) (Jena, Dotti и др., 2010). CAR представляют собой синтетические рецепторы, состоящие из «нацеливающего» фрагмента, ассоциированного с одним или несколькими сигнальными доменами в одной слитой молекуле. В целом, связывающий фрагмент CAR состоит из антигенсвязывающего домена одноцепочечного антитела (scFv), который содержит фрагменты моноклонального антитела, представляющие собой вариабельные домены легкой и тяжелой цепи, соединенные гибким линкером. Успешно применяли также связывающие фрагменты на основе доменов рецептора или лиганда. Сигнальные домены для первого поколения CAR выводили из цитоплазматической области цепей зета CD3 или гамма Fc-рецептора. Было продемонстрировано, что первое поколение CAR позволяло успешно перенаправлять T-клеточную цитотоксичность, однако для них не удалось обеспечить пролонгированное размножение и противоопухолевую активность in vivo. Для повышения выживаемости и усиления пролиферации модифицированных с помощью CAR Т-клеток осуществляли добавление сигнальных доменов из костимуляторных молекул, включая CD28, ОХ-40 (CD134) и 4-1BB (CD137), по отдельности (второе поколение) или в комбинации (третье поколение). CAR позволяли успешно перенаправлять Т-клетки на антигены, экспрессируемые на поверхности опухолевых клеток при различных злокачественных заболеваниях, включая лимфомы и солидные опухоли (Jena, Dotti и др., 2010).
CD19 представляет собой привлекательную мишень для иммунотерапии, поскольку огромное большинство клеток острого B-клеточного лимфобластного лейкоза (B-ALL) постоянно экспрессируют CD19, в то время как экспрессия отсутствует на не гематопоэтических клетках, а также на миелоидных, эритроидных и Т-клетках и стволовых клетках костного мозга. В настоящее время проводятся клинические опыты по оценке направленного воздействия на CD19 при B-клеточных злокачественных заболеваниях, в которых получены обнадеживающие противоопухолевые ответы. В большинстве случаев вводимые путем инфузии Т-клетки генетически модифицировали таким образом, чтобы они экспрессировали химерный антигенный рецептор (CAR) со специфичностью, выведенной из scFv-области CD19-специфического мышиного моноклонального антитела FMC63 (Nicholson, Lenton и др., 1997; Cooper, Торр и др., 2003; Cooper, Jena и др., 2012) (международная заявка на патент: WO 2013/126712). Однако все еще существует необходимость в улучшении конструкции CAR, которая была бы в большей степени совместима с T-клеточной пролиферацией, для того, чтобы клетки, экспрессирующие такие CAR, обладали значимым с клинической точки зрения преимуществом.
Краткое изложение сущности изобретения
При создании изобретения был создан CD19-специфический CAR (4G7-CAR), который содержит scFV, выведенный из CD19-специфического моноклонального антитела, а именно, 4G7, и неожиданно было установлено, что интродукция созданного 4G7-CAR в первичные Т-клетки может обеспечивать пролонгированное «активированное» состояние трансдуцированных клеток независимо от связывания с антигеном. После неспецифической активации in vitro (например, с использованием покрытых антителом к CD3/CD28 гранул и рекомбинантного IL2), указанные клетки характеризовались увеличенным клеточным размером (образование бластов), а также экспрессией маркеров активации (CD25) в течение более длительного периода времени по сравнению с клетками, трансдуцированными сходным CAR, содержащим scFV FMC63. Такая продолжительная активация дает возможность осуществления более продолжительной пролиферации и обеспечивает независимый от антигена механизм размножения несущих 4G7-CAR клеток in vitro.
Таким образом, в настоящем изобретении предложен химерный антигенный рецептор, содержащий по меньшей мере один внеклеточный лиганд-связывающий домен, трансмембранный домен и по меньшей мере один домен трансдукции сигнала, в котором указанный внеклеточный лиганд-связывающий домен содержит scFV, выведенный из специфического моноклонального антитела, 4G7. В частности, предлагаемый в изобретении CAR после трансдукции в иммунную клетку вносит вклад в независимую от антигена активацию и пролиферацию клетки. Настоящее изобретение относится также к нуклеиновой кислоте, векторам, кодирующим CAR, который содержит scFV, выведенный из CD19-специфического моноклонального антитела 4G7, и способам конструирования иммунных клеток, заключающимся в том, что в указанную клетку интродуцируют 4G7-CAR. Настоящее изобретение относится также к генетически модифицированным иммунным клеткам, экспрессирующим на своей поверхности 4G7, прежде всего к иммунным клеткам, пролиферация которых не зависит от опосредуемого антигеном механизма. Генетически модифицированные иммунные клетки, предлагаемые в настоящем изобретении, наиболее пригодны для таких терапевтических применений, как лечение B-клеточной лимфомы и лейкоза.
Краткое описание чертежей
На чертежах показано:
На фиг. 1 - сравнение пролиферации Т-клеток с инактивированным TCR-альфа (KO), трансдуцированных несущим 4G7-CAR лентивирусным вектором, и нетрансдуцированных KO Т-клеток (NTD). Мониторинг пролиферации осуществляли в течение 30 дней после осуществления стадии реактивации растворимым антителом к CD28 (IL2+CD28) или без осуществления стадии реактивации (IL2);
На фиг. 2 - результаты анализа экспрессии маркера активации CD25 на поверхности Т-клеток с инактивированным TCR-альфа, трансдуцированных несущим 4G7-CAR лентивирусным вектором, где дискриминационное окно устанавливали на основе наличия экспрессии 4G7-CAR (CAR+, CAR-), результаты сравнивали с экспрессией CD25 на TCR-альфа-позитивных не подвергнутых электропорации (NЕР) или несущих разрушенный TCR-альфа, но не подвергнутых трансдукции (NTD) клетках. Экспрессию CD25 анализировали после осуществления стадии реактивации растворимым антителом к CD28 (IL2+CD28) или без осуществления стадии реактивации (IL2);
На фиг. 3 - результаты анализа экспрессии CAR на поверхности Т-клеток, трансдуцированных лентивирусным вектором, кодирующим либо 4G7-CAR, либо FMC63-CAR. Анализ проводили методом проточной цитометрии через 3, 8 и 15 дней после трансдукции. NT обозначает не подвергнутые трансдукции Т-клетки;
На фиг. 4 - результаты анализа экспрессии CD25 на поверхности Т-клеток, трансдуцированных лентивирусным вектором, кодирующим либо 4G7-CAR, либо FMC63-CAR. Анализ проводили методом проточной цитометрии через 3, 8 и 15 дней после трансдукции. NT обозначает не подвергнутые трансдукции Т-клетки;
На фиг. 5 - результаты анализа размера Т-клеток, трансдуцированных лентивирусным вектором, кодирующим либо 4G7-CAR, либо FMC63-CAR. Анализ проводили методом проточной цитометрии через 3, 8 и 15 дней после трансдукции. NT обозначает не подвергнутые трансдукции Т-клетки;
На фиг. 6 - сравнение пролиферации Т-клеток, трансдуцированных несущим 4G7-CAR и несущим FMC63 лентивирусным вектором. Мониторинг пролиферации осуществляли в течение 20 дней после осуществления стадии реактивации растворимым антителом к CD28 (CD28) или без осуществления стадии реактивации (-). NTD обозначает не подвергнутые трансдукции Т-клетки.
Подробное описание изобретения
Если специально не указано иное, то все технические и научные понятия, использованные в настоящем описании, имеют значение, которое является общепринятым для специалистов в области генной терапии, биохимии, генетики и молекулярной биологии.
Для осуществления на практике или тестирования настоящего изобретения можно применять все методы и материалы, сходные или эквивалентные тем, которые указаны настоящем описании, при этом в настоящей заявке описаны пригодные методы и материалы. Все публикации, заявки на патент, патенты и другие ссылки, упомянутые в настоящем описании, полностью включены в настоящее описание в качестве ссылки. В случае разночтения следует руководствоваться настоящим описанием, включая определения. Кроме того, материалы, методы и примеры представлены только для иллюстрации и не направлены на ограничение объема изобретения, если не указано иное.
При осуществлении на практике настоящего изобретения следует применять, если не указано иное, общепринятые методы клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, известные специалисту в данной области. Такие методы подробно описаны в литературе, см., например, Current Protocols in Molecular Biology (Frederick M. AUSUBEL, изд-во Wiley and son Inc, Library of Congress, USA, 2000); Molecular Cloning: A Laboratory Manual, 3-е изд. (Sambrook и др., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 2001); Oligonucleotide Synthesis, под ред. M.J. Gait, 1984; Mullis и др., U.S. №4683195; Nucleic Acid Hybridization (под ред. В.D. Harries и S.J. Higgins, 1984); Transcription And Translation (под ред. В.D. Hames и S.J. Higgins, 1984); Culture Of Animal Cells (R.I. Freshney, изд-во Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (изд-во IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); серия: Methods In ENZYMOLOGY (под. ред J. Abelson и M. Simon, изд-во Academic Press, Inc., New York), прежде всего том 154 и том 155 (под ред. Wu и др.) и том 185, «Gene Expression Technology)) (под ред. D. Goeddel); Gene Transfer Vectors For Mammalian Cells (под ред. J.H. Miller и M.P. Calos, 1987, изд-во Cold Spring Harbor Laboratory); Immunochemical Methods In Cell And Molecular Biology (под ред. Mayer и Walker, изд-во Academic Press, London, 1987); Handbook Of Experimental Immunology, тома I-IV (под ред. D.M. Weir и С.С.Blackwell, 1986); и Manipulating the Mouse Embryo, (изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986).
CD19-специфический химерный антигенный рецептор
Настоящее изобретение относится к химерному антигенному рецептору (CAR), содержащему внеклеточный лиганд-связывающий домен, трансмембранный домен и домен трансдукции сигнала.
Понятие «внеклеточный лиганд-связывающий домен» в контексте настоящего описания обозначает олиго- или полипептид, обладающий способностью связываться с лигандом. Предпочтительно домен должен обладать способностью взаимодействовать с молекулой клеточной поверхности. Например, можно выбирать внеклеточный лиганд-связывающий домен, позволяющий распознавать лиганд, который функционирует в качестве маркера клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием.
В предпочтительном варианте осуществления изобретения указанный внеклеточный лиганд-связывающий домен содержит фрагмент одноцепочечного антитела (scFv), содержащий вариабельный фрагмент легкой (VL) и тяжелой (VH) цепи специфического в отношении антигена-мишени моноклонального антитела, соединенные гибким линкером. В предпочтительном варианте осуществления изобретения указанный scFV выводят из моноклонального антитела к CD19 4G7 (Peipp, Saul и др., 2004), предпочтительно указанный scFv, предлагаемый в настоящем изобретении, содержит часть иммуноглобулиновой тяжелой гамма 1-цепи моноклонального антитела к CD19 4G7 (GenBank: CAD88275.1; SEQ ID NO: 1) и часть иммуноглобулиновой легкой каппа-цепи моноклонального антитела к CD19 4G7 (GenBank: CAD88204.1; SEQ ID NO: 2), предпочтительно сцепленные друг с другом с помощью гибкого линкера. В предпочтительном варианте осуществления изобретения указанный scFV, предлагаемый в настоящем изобретении, содержит вариабельные фрагменты иммуноглобулиновой тяжелой гамма 1-цепи моноклонального антитела к CD19 4G7 (SEQ ID NO: 3) и вариабельные фрагменты иммуноглобулиновой легкой каппа-цепи моноклонального антитела к CD19 4G7 (SEQ ID NO: 4 или SEQ ID NO: 5), сцепленные друг с другом с помощью гибкого линкера. В конкретном варианте осуществления изобретения указанный гибкий линкер имеет аминокислотную последовательность (SEQ ID NO: 6).
Иными словами, указанный CAR содержит внеклеточный лиганд-связывающий домен, который содержит одноцепочечный Fv-фрагмент, выведенный из CD19-специфического моноклонального антитела 4G7. В конкретном варианте осуществления изобретения указанный scFv содержит часть аминокислотных последовательностей, выбранных из группы, состоящей из: SEQ ID NO: 1-5. В предпочтительном варианте осуществления изобретения последовательность указанного scFv идентична по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90, 95, 97 или 99% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 7 и SEQ ID NO: 8.
Домен трансдукции сигнала или внутриклеточный сигнальный домен CAR, предлагаемого в настоящем изобретении, ответствен за внутриклеточную передачу сигнала после связывания внеклеточного лиганд-связывающего домена с мишенью, приводящую к активации иммунной клетки и иммунному ответу. Иными словами, домен трансдукции сигнала ответствен за активацию по меньшей мере одной из обычных эффекторных функций иммунной клетки, в которой имеет место экспрессия CAR. Например, эффекторная функция Т-клетки может представлять собой цитолитическую активность или хелперную активность, включая секрецию цитокинов. Таким образом, понятие «домен трансдукции сигнала» относится к части белка, которая осуществляет трансдукцию сигнала эффекторной сигнальной функции и «направляет» клетку на выполнение специализированной функции.
Предпочтительными примерами домена трансдукции сигнала, которые можно использовать в CAR, могут служить цитоплазматические последовательности Т-клеточного рецептора и корецепторов, которые функционируют согласованно, инициируя трансдукцию сигнала после привлечения антигенного рецептора, а также любые производные или варианты указанных последовательностей и любая синтетическая последовательность, обладающая такой же функциональной способностью. Домен трансдукции сигнала содержит два различных класса цитоплазматических сигнальных последовательностей, а именно, те, которые инициируют антигензависимую первичную активацию, и те, которые функционируют независимым от антигена образом, обеспечивая вторичный или костимулирующий сигнал. Первичная цитоплазматическая сигнальная последовательность может содержать сигнальные мотивы, известные как мотивы активации иммунных рецепторов на основе тирозина, ITAM. ITAM представляют собой хорошо известные сигнальные мотивы, присутствующие во внутрицитоплазматическом «хвосте» различных рецепторов, которые служат в качестве сайтов связывания для класса syk/zap70 тирозинкиназ. Примерами ITAM, применяемых согласно изобретению, могут служить (но не ограничиваясь только ими) ITAM, выведенные из ТCRзета, FcRгамма, FcRбета, FcRэпсилон, CD3гамма, CD3дельта, CD3эпсилон, CD5, CD22, CD79a, CD79b и CD66d. В предпочтительном варианте осуществления изобретения домен трансдукции сигнала CAR может содержать выведенный из CD3зета сигнальный домен, который имеет аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90, 95, 97 или 99% аминокислотной последовательности, выбранной из группы, состоящей из (SEQ ID NO: 10).
В конкретном варианте осуществления изобретения домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит костимуляторную сигнальную молекулу. Костимуляторная молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или его лигандов, которая требуется для эффективного иммунного ответа. Понятие «костимуляторный лиганд» относится к молекуле на антигенпрезентирующей клетке, которая специфически связывается с когнатной костимуляторной молекулой на Т-клетке, создавая тем самым сигнал, который, в дополнение к первичному сигналу, создаваемому, например, при связывании комплекса TCR/CD3 с молекулой ГКГС, загруженной пептидом, опосредует T-клеточный ответ, включая (но не ограничиваясь только этим) активацию пролиферации, дифференцировку и т.п. Костимуляторный лиганд может включать (но не ограничиваясь только ими) CD7, В7-1 (CD80), В7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцибельный костимуляторный лиганд (ICOS-L), молекулу межклеточной адгезии (ICAM, CD30L, CD40, CD70, CD83, HLA-G, MICA, М1СВ, HVEM, рецептор лимфотоксина бета, 3/TR6, ILT3, ILT4, агонист или антитело, который/которое связывается с лигандом Толл-рецептора, и лиганд, который специфически связывается с В7-Н3. Под понятие «костимуляторный лиганд» подпадает, среди прочего, антитело, которое специфически связывается с костимуляторной молекулой, присутствующей на Т-клетке, такой, как (но не ограничиваясь только ими) CD27, CD28, 4-1ВВ, ОХ40, CD30, CD40, PD-1, ICOS, антиген-1, ассоциированный с функцией лимфоцитов (LFA-1), CD2, CD7, LTGHT, NKG2C, B7-H3, лиганд, специфически связывающийся с CD83.
Понятие «костимуляторная молекула» относится к когнатному (родственному!!!) связывающему партнеру, присутствующему на Т-клетке, который специфически связывается с костимуляторным лигандом, опосредуя тем самым костимулирующий ответ клетки, такой как (но не ограничиваясь только им) пролиферация. Костимуляторные молекулы включают (но не ограничиваясь только ими) молекулу ГКГС класса I, BTLA и лиганд Толл-рецептора. Примерами костимуляторных молекул являются CD27, CD28, CD8, 4-1ВВ (CD137), ОХ40, CD30, CD40, PD-1, ICOS, антиген-1, ассоциированный с функцией лимфоцитов (LFA-1), CD2, CD7, LIGHT, NKG2C, В7-Н3 и лиганд, специфически связывающийся с CD83, и т.п.
В предпочтительном варианте осуществления изобретения домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит часть костимуляторной сигнальной молекулы, выбранной из группы, состоящей из фрагмента 4-1ВВ (GenBank: ААА53133.) и CD28 (NP_006130.1). В частности, домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90, 95, 97 или 99% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 11 и SEQ ID NO: 12.
CAR, предлагаемый в настоящем изобретении, экспрессируется на поверхности клеточной мембраны. Таким образом, CAR может содержать трансмембранный домен. Отличительными особенностями соответствующих трансмембранных доменов являются способность экспрессироваться на поверхности клетки, согласно настоящему изобретению предпочтительно на поверхности иммунной клетки, прежде всего лимфоцитов или естественных клеток-киллеров (NK), и взаимодействовать друг с другом, направляя клеточный ответ иммунной клетки на заранее определенную клетку-мишень. Трансмембранный домен можно выводить как из встречающегося в естественных условиях, так и синтетического источника. Трансмембранный домен можно выводить из любого связанного с мембраной или трансмембранного белка. Примерами трансмембранных полипептидов могут служить (но не ограничиваясь только ими) субъединица T-клеточного рецептора, такая как α-, β-, γ- или δ-субъединица, полипептид, образующий комплекс CD3, р55 (α-цепь), р75 (β-цепь) или γ-цепь рецептора IL2, цепь субъединиц Fc-рецепторов, в частности, Fcγ-рецептора III или CD-белки. Альтернативно этому трансмембранный домен может быть синтетическим, и он может содержать преимущественно гидрофобные остатки, такие как лейцин и валин. В предпочтительном варианте осуществления изобретения указанный трансмембранный домен выводят из альфа-цепи человеческого CD8 (например, NP_001139345.1). Трансмембранный домен может содержать также «стеблевую область» между указанным внеклеточным лиганд-связывающим доменом и указанным трансмембранным доменом. В контексте настоящего описания понятие «стеблевая область», как правило, обозначает олиго- или полипептид, функция которого заключается в сцеплении трансмембранного домена с внеклеточным лиганд-связывающим доменом. В частности, «стеблевую область» используют для обеспечения большей гибкости и доступности внеклеточного лиганд-связывающего домена. «Стеблевая область» может содержать вплоть до 300 аминокислот, предпочтительно от 10 до 100 аминокислот, и наиболее предпочтительно от 25 до 50 аминокислот.«Стеблевую область» можно выводить из полных встречающихся в естественных условиях молекул, или их частей, таких как полная внеклеточная область CD8, CD4 или CD28, или ее часть, или полная константная область антитела или ее часть. Альтернативно этому «стеблевая область» может представлять собой синтетическую последовательность, которая соответствует встречающейся в естественных условиях «стеблевой» последовательности, или может представлять собой полностью синтетическую «стеблевую» последовательность. В предпочтительном варианте осуществления изобретения указанная «стеблевая область» представляет собой часть альфа-цепи человеческого CD8 (например, NP_001139345.1). В другом конкретном варианте осуществления изобретения указанный трансмембранный домен и шарнирный домен содержат часть альфа-цепи человеческого CD8, последовательность которой идентична предпочтительно по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90, 95, 97 или 99% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 13.
В конкретном варианте осуществления изобретения указанный химерный антигенный рецептор, предлагаемый в настоящем изобретении, содержит scFv, выведенный из моноклонального антитела к CD19 4G7, шарнирного и трансмембранного домена альфа-цепи человеческого CD8, сигнального домена CD3-зета и сигнального домена 4-1ВВ. Предпочтительно последовательность 4G7-CAR, предлагаемого в настоящем изобретении, идентична по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90, 95, 97 или 99% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 14 и 15.
В раковых клетках часто имеет место понижающая регуляция или мутация антигенов-мишеней, что приводит к появлению так называемых вариантов «потерянных антигенов», т.е. антигенов, ускользающих от иммунологического надзора. Таким образом, для того, чтобы противостоять ускользанию опухоли от иммунологического надзора и придавать иммунной клетке большую специфичность в отношении мишени, CD19-специфический CAR может содержать другие внеклеточные лиганд-связывающие домены, предназначенные для одновременного связывания с другими элементами на мишени и усиления тем самым активации и функции иммунной клетки. В одном из вариантов осуществления изобретения внеклеточные лиганд-связывающие домены можно размещать тандемно на одном и том же трансмембранном полипептиде и их необязательно можно отделять друг от друга с помощью линкера. В другом варианте осуществления изобретения указанные другие внеклеточные лиганд-связывающие домены можно размещать на различных трансмембранных полипептидах, из которых состоит CAR. Другой вариант осуществления настоящего изобретения относится к популяции CAR, каждый из которых содержит различные внеклеточные лиганд-связывающие домены. В частности, настоящее изобретение относится к способу создания иммунных клеток, заключающемуся в том, что получают иммунную клетку и экспрессируют на поверхности указанной клетки популяцию, каждый из которых содержит различные внеклеточные лиганд-связывающие домены. Другой конкретный вариант осуществления настоящего изобретения относится к способу создания иммунной клетки, заключающемуся в том, что получают иммунную клетку и интродуцируют в указанную клетку полинуклеотиды, кодирующие полипептиды, из которых состоит популяция CAR, каждый из которых содержит различные внеклеточные лиганд-связывающие домены. Под популяцией CAR подразумевают по меньшей мере два, три, четыре, пять, шесть или большее количество CAR, каждый из которых содержит различные внеклеточные лиганд-связывающие домены. Согласно настоящему изобретению различные внеклеточные лиганд-связывающие домены, предлагаемые в настоящем изобретении, предпочтительно могут связываться одновременно с различными элементами на мишени, усиливая тем самым активацию и функцию иммунной клетки. Настоящее изобретение относится также к выделенной иммунной клетке, которая содержит популяцию CAR, каждый из которых содержит различные внеклеточные лиганд-связывающие домены.
Полинуклеотиды, векторы:
Настоящее изобретение относится также к полинуклеотидам, векторам, кодирующим описанный выше CAR, предлагаемый в изобретении. Предпочтительным вариантом осуществления настоящего изобретения является полинуклеотид, содержащий нуклеотидную последовательность SEQ ID NO: 17. В предпочтительном варианте осуществления изобретения последовательность полинуклеотида идентична по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90, 95, 97 или 99% нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 17.
Полинуклеотид может содержаться в кассете экспрессии или экспрессионном векторе (например, в плазмиде, предназначенной для интродукции в бактериальную клетку-хозяина, или вирусном векторе, таком как бакуловирусный вектор, предназначенный для трансфекции клетки насекомого-хозяина, или плазмидном или вирусном векторе, таком как лентивирус, предназначенном для трансфекции клетки млекопитающего-хозяина.
В конкретном варианте осуществления изобретения можно включать различные нуклеотидные последовательности в один полинуклеотид или вектор, который содержит нуклеотидную последовательность, кодирующую рибосомальную skip-последовательность, такую как последовательность, кодирующую пептид 2А. Пептиды 2А, которые были идентифицированы в подгруппе афтовирусов группы пикорнавирусов, приводят к рибосомальному «перескоку» (skip) от одного кодона к следующему без образования пептидной связи между двумя аминокислотами, кодируемыми кодонами (см. Donnelly и Elliott, 2001; Atkins, Wills и др., 2007; Doronina, Wu и др., 2008). Под «кодовом» понимают три нуклеотида на мРНК (или на смысловой цепи молекулы ДНК), которые транслируются рибосомой в один аминокислотный остаток. Таким образом, можно синтезировать два полипептида из одной непрерывной рамки считывания в мРНК, если полипептиды разделены последовательностью олигопептида 2А, присутствующей в рамке считывания. Такие рибосомальные skip-механизмы хорошо известны в данной области и известно их применение в нескольких векторах для экспрессии нескольких белков, кодируемых одной матричной РНК.
Для направления трансмембранного полипептида в секреторный путь клетки-хозяина, в последовательность полинуклеотида или в последовательность вектора помещают секреторную сигнальную последовательность (известную также как лидерная последовательность, пре-про-последовательность или пре-последовательность). Секреторную сигнальную последовательность функционально связывают с трансмембранной нуклеотидной последовательностью, т.е. две последовательности соединяют в правильной рамке считывания и размещают так, чтобы направлять новый синтезированный полипептид в секреторный путь клетки-хозяина. Секреторные сигнальные последовательности, как правило, размещают в 5'-направлении относительно нуклеотидной последовательности, кодирующей представляющий интерес полипептид, хотя некоторые секреторные сигнальные последовательности можно размещать и в другом месте представляющей интерес нуклеотидной последовательности (см., например, Welch и др., U.S. №5037743; Holland и др., U.S. №5143830). В предпочтительном варианте осуществления изобретения сигнальный пептид содержит аминокислотные последовательности SEQ ID NO: 18 и 19.
Специалистам в данной области должно быть очевидно, что с учетом вырожденности генетического кода могут иметь место значительные вариации последовательности указанных полинуклеотидных молекул. Предпочтительно нуклеотидные последовательности, предлагаемые в настоящем изобретении, имеют оптимизированные кодоны для экспрессии в клетках млекопитающих, предпочтительно для экспрессии в человеческих клетках. Оптимизация кодонов относится к замене в представляющей интерес последовательности кодонов, встречающихся относительно редко в генах с высоким уровнем экспрессии, на кодоны, которые, как правило, часто встречаются в генах с высоким уровнем экспрессии в указанных видах, такие кодоны кодируют те же аминокислоты, что и подлежащие замене кодоны.
В предпочтительном варианте осуществления изобретения полинуклеотид, предлагаемый в настоящем изобретении, содержит нуклеотидную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 17. Настоящее изобретение относится к полинуклеотидам, содержащим нуклеотидную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90, 95, 97 или 99% нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 17.
Способы создания иммунной клетки:
Конкретные варианты осуществления, подпадающие под объем настоящего изобретения, относятся к способу получения иммунных клеток для иммунотерапии, заключающемуся в том, что интродуцируют в указанные иммунные клетки CAR, предлагаемый в настоящем изобретении, и размножают указанные клетки. Конкретный вариант осуществления изобретения относится к способу создания иммунной клетки, заключающемуся в том, что получают клетку и экспрессируют на поверхности указанной клетки по меньшей мере один CAR, описанный выше. В конкретном варианте осуществления изобретения способ заключается в том, что трансформируют клетку по меньшей мере одним полинуклеотидом, кодирующим CAR, описанный выше, и экспрессируют указанные полинуклеотиды в указанной клетке.
В предпочтительном варианте осуществления изобретения указанные полинуклеотиды включают в лентивирусные векторы, принимая во внимание, что они стабильно экспрессируются в клетках.
В другом варианте осуществления изобретения указанный способ дополнительно включает стадию, на которой генетически модифицируют указанную клетку путем инактивации по меньшей мере одного гена, экспрессирующего один компонент TCR, мишень иммуносупрессорного агента, ген HLA и/или ген иммунных чекпойнтов, такой как PDCD1 или CTLA-4. В предпочтительном варианте осуществления изобретения указанный ген выбирают из группы, состоящей из TCRальфа, TCRбета, CD52, GR, PD1 и CTLA-4. В предпочтительном варианте осуществления изобретения указанный способ дополнительно заключается в том, что интродуцируют в указанные Т-клетки редко расщепляющую эндонуклеазу, обладающую способностью осуществлять избирательную инактивацию путем расщепления ДНК указанных генов. В более предпочтительном варианте осуществления изобретения указанная редко расщепляющая эндонуклеаза представляет собой TALE-нуклеазу или эндонуклеазу Cas9.
Методы доставки
Различные методы, описанные выше, предполагают интродукцию CAR в клетку. Например (но не ограничиваясь только этим), указанный CAR можно интродуцировать в виде трансгенов, кодируемых одним плазмидным вектором. Указанный плазмидный вектор может содержать также селектируемый маркер, обеспечивающий идентификацию и/или отбор клеток, в которые встроен указанный вектор.
Полипептиды можно синтезировать in situ в клетке в результате интродукции в клетку полинуклеотидов, кодирующих указанные полипептиды. Альтернативно этому указанные полипептиды можно получать вне клетки и затем интродуцировать в нее. Методы интродукции полинуклеотидных конструкций в клетки известны в данной области и их примерами являются (но не ограничиваясь только ими) методы стабильной трансформации, в которых полинуклеотидную конструкцию интегрируют в геном клетки, методы кратковременной трансформации, в которых полинуклеотидную конструкцию не интегрируют в геном клетки, и методы, основанные на использовании вирусов. Указанные полинуклеотиды можно интродуцировать в клетку, например, с использованием рекомбинантных вирусных векторов (например, ретровирусов, аденовирусов), липосом и т.п. Например, методы кратковременной трансформации включают микроинъекцию, электропорацию или бомбардировку частицами. Указанные полинуклеотиды можно включать в векторы, более конкретно, в плазмиды или вирусы, с целью экспрессии в клетках.
Сконструированные иммунные клетки
Настоящее изобретение относится также к выделенным клеткам или клеточным линиям, которые можно получать указанным способом создания клеток. В частности, указанная выделенная клетка содержит по меньшей мере один описанный выше CAR. В другом варианте осуществления изобретения указанная выделенная клетка содержит популяцию CAR, каждый из которых содержит различные внеклеточные лиганд-связывающие домены. В частности, указанная выделенная клетка содержит экзогенную полинуклеотидную последовательность, кодирующую CAR. Активация и пролиферация генетически модифицированных иммунных клеток, предлагаемых в настоящем изобретении, происходит независимо от механизмов связывания с антигеном.
Под объем настоящего изобретения подпадает также выделенная иммунная клетка, предпочтительно Т-клетка, полученная с помощью одного из описанных ранее способов. Указанная иммунная клетка представляет собой клетку, происходящую из гематопоэтической клетки, функционально участвующую в инициации и/или реализации врожденного или адаптивного иммунного ответа. Указанную иммунную клетку, предлагаемую в настоящем изобретении, можно выводить из стволовой клетки. Стволовые клетки могут представлять собой зрелые стволовые клетки, нечеловеческие эмбриональные стволовые клетки из организма кроме человека, более предпочтительно нечеловеческие стволовые клетки, стволовые клетки из пуповинной крови, клетки-предшественники, стволовые клетки костного мозга, индуцированные плюрипотентные стволовые клетки, тотипотентные стволовые клетки или гематопоэтические стволовые клетки. Репрезентативными человеческими клетками являются CD34+-клетки. Указанная выделенная клетка может представлять собой также дендритную клетку, дендритную клетку-киллер, тучную клетку, NK-клетку, В-клетку или Т-клетку, выбранную из группы, состоящей из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хэлперных Т-лимфоцитов. В другом варианте осуществления изобретения указанную клетку можно выводить из группы, состоящей из CD4+-Т-лимфоцитов и CD8+-Т-лимфоцитов. Перед осуществлением размножения и генетической модификации клеток, предлагаемых в изобретении, из организма индивидуума можно получать источник клеток с помощью различных методов, не ограничивающих объем изобретения. Клетки можно получать из многочисленных источников, включая (но не ограничиваясь только ими) мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из инфицированной области, асциты, плевральный выпот, ткань селезенки и опухоли. В некоторых вариантах осуществления настоящего изобретения можно применять любое количество T-клеточных линий, доступных и известных специалистам в данной области. В другом варианте осуществления изобретения указанную клетку можно получать из организма здорового донора, пациента, у которого диагностирован рак или пациента, у которого диагностирована инфекция. В другом варианте осуществления изобретения указанная клетка представляет собой часть смешанной популяции клеток, обладающих различными фенотипическими характеристиками. Под объем настоящего изобретения подпадает также клеточная линия, полученная из трансформированной Т-клетки согласно ранее описанному способу. Под объем настоящего изобретения подпадают модифицированные клетки, полученные с помощью ранее описанного способа, которые являются устойчивыми или чувствительными к иммуносупрессорной обработке.
В другом варианте осуществления изобретения указанная выделенная клетка, предлагаемая в настоящем изобретении, содержит полинуклеотид, кодирующий CAR.
Активация и размножение Т-клеток
Как до, так и после осуществления генетической модификации Т-клеток, даже в том случае, если активация и пролиферация генетически модифицированных иммунных клеток, предлагаемых в настоящем изобретении, не зависит от механизмов связывания с антигеном, иммунные клетки, прежде всего Т-клетки, предлагаемые в настоящем изобретении, можно подвергать дополнительной активации и размножать с помощью методов, описанных, например, в U.S. №№6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041 и публикации заявки на патент США №2006/0121005. Т-клетки можно размножать in vitro или in vivo.
Как правило, Т-клетки, предлагаемые в изобретении, размножают путем приведения в контакт с агентом, который стимулирует комплекс CD3 TCR, и костимуляторной молекулой на поверхности Т-клеток с целью создания сигнала активации для Т-клетки.
Например, для создания сигнала активации для Т-клетки можно применять химические соединения, такие как ионофор кальция А23187, форбол-12-миристат-13-ацетат (ФМА), или митогенные лектины, такие как фитогемагглютинин (ФГА).
Например (но не ограничиваясь только этим), популяции Т-клеток можно стимулировать in vitro путем приведения в контакт с антителом к CD3 или его антигенсвязывающим фрагментом, или антителом к CD2, иммобилизованным на поверхности, или путем приведения в контакт с активатором протеинкиназы С (например, бриостатином) в сочетании с ионофором кальция. Для костимуляции вспомогательной молекулы на поверхности Т-клеток можно использовать лиганд, который связывается с вспомогательной молекулой. Например, популяцию Т-клеток можно приводить в контакт с антителом к CD3 и антителом к CD28 в условиях, обеспечивающих стимуляцию пролиферации Т-клеток. Условия, пригодные для культивирования Т-клеток, включают соответствующие среды (например, минимальную поддерживающую среду или среду RPMI 1640, или Х-vivo 5, (фирма Lonza)), которые могут содержать факторы, необходимые для обеспечения пролиферации и жизнеспособности, включая сыворотку (например, фетальную бычью сыворотку или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-g, 1L-4, 1L-7, GM-CSF, -10, - 2, 1L-15, TGFp и TNF-, или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают (но не ограничиваясь только ими) сурфактант, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут представлять собой RPMI 1640, A1M-V, DMEM, MEM, а-МЕМ, F-12, X-Vivo 1 и X-Vivo 20, Optimizer, содержащие в качестве добавок аминокислоты, пируват натрия и витамины, они могут быть бессывороточными или могут содержать в качестве добавок в определенном количестве сыворотку (или плазму) или определенный набор гормонов, и/или цитокин(ы) в количестве, достаточном для роста и размножения Т-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые предназначены для введения путем инфузии индивидууму. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, при 37°C) и атмосфере (например, в воздухе плюс 5% СО2). Клетки, которые подвергали стимуляции в течение различных промежутков времени, могут обладать различными характеристиками.
В другом конкретном варианте осуществления изобретения указанные клетки можно размножать путем совместного культивирования с тканью или клетками. Указанные клетки можно размножать также in vivo, например, в крови индивидуума после введения указанной клетки индивидууму.
Терапевтические применения
В другом варианте осуществления изобретения выделенные клетки, полученные различными методами, или клеточную линию, выведенную из указанной выделенной клетки, согласно описанному ранее методу, можно применять в качестве лекарственного средства. В другом варианте осуществления изобретения указанное лекарственное средство можно применять для лечения рака, прежде всего для лечения B-клеточных лимфом и лейкозов у пациента, нуждающегося в этом. В другом варианте осуществления изобретения указанную выделенную клетку, предлагаемую в изобретении, или клеточную линию, выведенную из указанной выделенной клетки, можно применять для изготовления лекарственного средства, предназначенного для лечения рака у пациента, нуждающегося в этом.
Другой объект настоящего изобретения относится к способам лечения пациентов, нуждающихся в этом, где указанный способ заключается в том, что осуществляют по меньшей мере одну из следующих стадий, на которых:
(а) получают иммунную клетку, которую можно создавать с помощью одного из ранее описанных методов;
(б) вводят указанные трансформированные иммунные клетки указанному пациенту.
В одном из вариантов осуществления изобретения указанные Т-клетки, предлагаемые в изобретении, можно подвергать интенсивному T-клеточному размножению in vivo и их можно сохранять в течение продолжительного периода времени.
Указанное лечение может быть облегчающим, терапевтическим или профилактическим. Оно может представлять собой либо составную часть аутологичного иммунотерапевтического лечения, либо составную часть аллогенного иммунотерапевтического лечения. Понятие «аутологичный» означает, что клетки, клеточная линия или популяция клеток, применяемые для лечения пациентов, происходят из организма указанного пациента или из организма совместимого по человеческому лейкоцитарному антигену (HLA) донора. Понятие «аллогенный» означает, что клетки или популяция клеток, применяемые для лечения пациентов, не происходят из организма указанного пациента, но происходят из организма донора.
Клетки, которые можно применять в заявляемых способах, описаны в предыдущем разделе. Указанное лечение можно применять для лечения пациентов, у которых диагностирован рак. Типы рака, которые можно лечить, включают несолидные опухоли (такие как гематологические опухоли, включая (но не ограничиваясь только ими) пре-В ALL (при педиатрических показаниях), ALL взрослых, лимфому из клеток мантии, диффузную крупноклеточную B-клеточную лимфому и т.п.Типы рака, которые можно лечить с помощью CAR, предлагаемых в изобретении, включают (но не ограничиваясь только ими) некоторые типы лейкозов или лимфоидных злокачественных заболеваний. Они включают также опухоли/типы рака взрослых и детские опухоли/типы рака.
Лечение можно осуществлять в сочетании с применением одного или нескольких типов противораковой терапии, выбранных из группы, включающей терапию на основе антител, химиотерапию, цитокиновую терапию, терапию с использованием дендритных клеток, генную терапию, гормональную терапию, свето-лазерную терапию и лучевую терапию.
Согласно предпочтительному варианту осуществления изобретения указанное лечение можно применять для пациентов, подвергающихся иммуносупрессорной терапии. Фактически, настоящее изобретение основано предпочтительно на применении клеток или популяции клеток, которые приобрели устойчивость по меньшей мере к одному иммунодепрессанту в результате инактивации гена, кодирующего рецептор для такого иммунодепрессанта. С этой точки зрения, иммуносупрессорная терапия должна способствовать отбору и размножению Т-клеток, предлагаемых в изобретении, в организме пациента.
Введение клеток или популяции клеток, предлагаемых в настоящем изобретении, можно осуществлять любым пригодным методом, включая ингаляцию аэрозоля, инъекцию, прием внутрь, трансфузию, имплантацию или трансплантацию. Композиции, представленные в настоящем описании, можно вводить пациенту подкожно, внутрикожно, внутрь опухоли, интранодально, интрамедуллярно, внутримышечно, путем внутривенной или внутрилимфатической инъекции, или внутрибрюшинно. В одном из вариантов осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, предпочтительно вводят путем внутривенной инъекции.
Введение клеток или популяции клеток может заключаться во введении 104-109 клеток/кг веса тела, предпочтительно от 105 до 106 клеток/кг веса тела, включая все целочисленные количества клеток в указанных диапазонах. Клетки или популяцию клеток можно вводить в виде одной или нескольких доз. В другом варианте осуществления изобретения указанное эффективное количество клеток вводят в виде однократной дозы. В другом варианте осуществления изобретения указанное эффективное количество клеток вводят в виде более чем одной дозы в течение некоторого периода времени. График введения находится в компетенции лечащего врача и зависит от клинического состояния пациента. Клетки или популяцию клеток можно получать из любого источника, такого как банк крови или донор. Поскольку индивидуальные потребности варьируются, определение оптимальных диапазонов эффективных количеств рассматриваемого типа клеток для конкретного заболевания или состояний, находится в компетенции специалиста в данной области. Эффективное количество представляет собой количество, которое обеспечивает терапевтическое или профилактическое полезное действие. Вводимая доза должна зависеть от возраста, состояния здоровья и веса реципиента, вида одновременно применяемого лечения, если это имеет место, частоты обработки и природы требуемого действия.
В другом варианте осуществления изобретения клетки или композицию, содержащую эти клетки, вводят в указанном эффективном количестве парентерально. Указанное введение может представлять собой внутривенное введение. Указанное введение можно осуществлять непосредственно путем инъекции в опухоль.
В некоторых вариантах осуществления настоящего изобретения клетки вводят пациенту в сочетании с осуществлением (например, до, одновременно или после) любого количества соответствующих форм лечения, включая (но не ограничиваясь только ими) лечение с помощью средств противовирусной терапии, таких как цидофовир и интерлейкин-2, цитарабин (известный также под названием ARA-C), или лечение натализумабом пациентов с MS (рассеянный склероз), или лечение эфализумабом пациентов с псориазом, или другие виды лечения пациентов с PML (прогрессирующая многоочаговая лейкоэнцефалопатия). В других вариантах осуществления изобретения Т-клетки, предлагаемые в изобретении, можно применять в сочетании с химиотерапией, лучевой терапией, иммунодепрессантами, такими как циклоспорин, азатиоприн, метотрексат, микофенолят и FK506, антителами или другими иммунодеструктивными агентами, такими как САМРАТН, антитела к CD3, или с другими видами терапии на основе антител, цитоксином, флударибином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и облучением. Эти лекарственные средства ингибируют или кальций-зависимую фосфатазу, кальцинеурин (циклоспорин и FK506), или ингибируют киназу p70S6, которая важна для индуцируемой фактором роста передачи сигнала (рапамицин) (Henderson, Naya и др., 1991; Liu, Albers и др., 1992; Bierer, Hollander и др., 1993). В другом варианте осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, вводят пациенту в сочетании с (например, до, одновременно или после) трансплантацией костного мозга, Т-клеточной абляционной терапией с использованием либо химиотерапевтических средств, таких как флударабин, либо внешней лучевой терапии (XRT), циклофосфамида, либо антител, таких как ОКТ3 или САМРАТН. В другом варианте осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, вводят после осуществления В-клеточной абляционной терапии с использованием агентов, которые взаимодействуют с CD20, таких, например, как ритуксан. Например, в одном из вариантов осуществления изобретения индивидуумов можно подвергать стандартной обработке химиотерапевтическими средствами в высокой дозе с последующей трансплантацией стволовых клеток периферической крови. В некоторых вариантах осуществления изобретения после трансплантации индивидуумам вводят путем инфузии размноженные иммунные клетки, предлагаемые в настоящем изобретении. В еще одном варианте осуществления изобретения размноженные клетки вводят до или после хирургического вмешательства.
Другие определения
- Если специально не указано иное, то множественное число и единственное число и понятие «по меньшей мере один» используются взаимозаменяемо и означают «один» или «более чем один».
- Аминокислотные остатки в полипептидной последовательности обозначают в настоящем описании с помощью однобуквенного кода, согласно которому, например, Q обозначает Gln или остаток глутамина, R обозначает Arg или остаток аргинина и D обозначает Asp или остаток аспарагиновой кислоты.
- Аминокислотная замена обозначает замену одного аминокислотного остатка на другой, например, замена остатка аргинина на остаток глутамина в пептидной последовательности представляет собой аминокислотную замену.
- Нуклеотиды обозначают следующим образом: однобуквенный код используют для обозначения основания нуклеозида: а обозначает аденин, t обозначает тимин, с обозначает цитозин и g обозначает гуанин. Для вырожденных нуклеотидов г обозначает g или а (пуриновые нуклеотиды), к обозначает g или t, s обозначает g или с, w обозначает а или t, m обозначает а или с, y обозначает t или с (пиримидиновые нуклеотиды), d обозначает g, а или t, v обозначает g, а или с, b обозначает g, t или с, h обозначает a, t или c и n обозначает g, a, t или с.
- В контексте настоящего описания понятия «нуклеиновая кислота» или «полинуклеотиды» относятся к нуклеотидам и/или полинуклеотидам, таким как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК), олигонуклеотидам, фрагментам, созданным с помощью полимеразной цепной реакции (ПЦР), и фрагментам, созданным путем лигирования, расщепления, обработки эндонуклеазами и обработки экзонуклеазами. Молекулы нуклеиновой кислоты могут состоять из мономеров, которые являются встречающимися в естественных условиях нуклеотидами (такими как ДНК или РНК) или аналогами встречающихся в естественных условиях нуклеотидов (например, энантиомерными формами встречающихся в естественных условиях нуклеотидов), или представляют собой их комбинацию. Модифицированные нуклеотиды могут иметь изменения в сахарных фрагментах и/или во фрагментах, содержащих пиримидиновые или пуриновые основания. Модификации Сахаров включают, например, замену одной или нескольких гидроксильных групп на галогены, алкильные группы, амины и азидогруппы, или сахара могут быть функционализированы до простых или сложных эфиров. Кроме того, весь сахарный фрагмент может быть заменен стерически и электронно сходными структурами, такими как аза-сахара и карбоциклические аналоги Сахаров. Примерами модификаций во фрагменте, представляющем собой основание, могут служить алкилированные пурины и пиримидины, ацилированные пурины или пиримидины, или другие хорошо известные гетероциклические заместители. Мономеры нуклеиновой кислоты могут быть сшиты фосфодиэфирными связями или аналогами таких связей. Нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными.
- Под химерным антигенным рецептором (CAR) подразумевают молекулы, в которых объединен связывающий домен, направленный против компонента, присутствующего на клетке-мишени, например, присущую антителу специфичность в отношении требуемого антигена (например, опухолевого антигена), с активирующим Т-клеточный рецептор внутриклеточным доменом, в результате чего образуется химерный белок, обладающий специфической клеточной иммунной активностью в отношении мишени. Как правило, CAR состоит из внеклеточного одноцепочечного антитела (scFvFc), слитого с внутриклеточным сигнальным доменом зета-цепи комплекса Т-клеточный антиген-рецептор (scFvFc:ζ), и при экспрессии в Т-клетках он обладает способностью перенаправлять распознавание антигена благодаря специфичности моноклонального антитела. Одним из примеров CAR, применяемого в настоящем изобретении, является CAR, направленный против антигена CD19, и он может, например, содержать (но не ограничиваясь только ей) аминокислотную последовательность: SEQ ID NO: 14.
Понятие «эндонуклеаза» относится к ферменту дикого типа или его варианту, обладающему способностью катализировать гидролиз (расщепление) связей между нуклеиновыми кислотами в молекуле ДНК или РНК, предпочтительно в молекуле ДНК. Эндонуклеазы не расщепляют молекулу ДНК или РНК независимо от ее последовательности, но они распознают и расщепляют молекулу ДНК или РНК в специфических полинуклеотидных последовательностях, в дальнейшем обозначенных как «последовательности-мишени» или «сайты-мишени». Эндонуклеазы можно классифицировать как редко расщепляющие эндонуклеазы, для которых, как правило, полинуклеотидный сайт распознавания имеет длину более 12 пар оснований (bp), более предпочтительно 14-55 пар оснований. Редко расщепляющие эндонуклеазы значительно повышают гомологичную рекомбинацию (HR), индуцируя двухцепочечные разрывы ДНК (DSB) в определенном локусе (Perrin, Buckle и др., 1993; Rouet, Smih и др., 1994; Choulika, Perrin и др., 1995; Pingoud и Silva, 2007). Редко расщепляющие эндонуклеазы могут представлять собой, например, хоминг-эндонуклеазу (Paques и Duchateau, 2007), химерную нуклеазу с «цинковыми пальцами» (ZFN), образованную слиянием сконструированных доменов «цинковых пальцев» с каталитическим доменом рестриктазы, такой как Fokl (Porteus и Carroll, 2005), эндонуклеазу Cas9 из системы CRISPR (Gasiunas, Barrangou и др., 2012; Jinek, Chylinski и др., 2012; Cong, Ran и др., 2013; Mali, Yang и др., 2013) или химическую эндонуклеазу (Eisenschmidt, Lanio и др., 2005; Arimondo, Thomas и др., 2006). В химических эндонуклеазах химический или пептидный расщепляющий компонент конъюгируют либо с полимером нуклеиновой кислоты, либо с другой ДНК, распознающей специфическую последовательность-мишень, тем самым обеспечивая направление расщепляющей активности на специфическую последовательность. Химические эндонуклеазы включают также синтетические нуклеазы типа конъюгатов ортофенантролина, ДНК-расщепляющей молекулы и триплекс-образующих олигонуклеотидов (TFO), которые, как известно, связываются со специфическими последовательностями ДНК (Kalish и Glazer, 2005). Такие химические эндонуклеазы подпадают под понятие «эндонуклеазы» в контексте настоящего изобретения.
- Под «TALE-нуклеазой» (TALEN) понимают слитый белок, который состоит из связывающего нуклеиновую кислоту домена, как правило, выведенного из подобного активатору транскрипции эффектора (TALE), и одного нуклеазного каталитического домена для расщепления последовательности нуклеиновой кислоты-мишени. Каталитический домен предпочтительно представляет собой нуклеазный домен и более предпочтительно домен, обладающий эндонуклеазной активностью, например, типа I-TevI, ColE7, NucA и Fok-I. В конкретном варианте осуществления изобретения домен TALE может быть слит с мегануклеазой, например, типа I-CreI и I-OnuI, или ее функциональным вариантом. В более предпочтительном варианте осуществления изобретения указанная нуклеаза представляет собой мономерную TALE-нуклеазу. Мономерная TALE-нуклеаза представляет собой TALE-нуклеазу, которая не требует димеризации для специфического распознавания и расщепления, например, в виде слияний сконструированных повторов TAL с каталитическим доменом I-TevI, описанным в WO 2012/138927. Подобные активатору транскрипции эффекторы (TALE) представляют собой белки из видов бактерий рода Xanthomonas, содержащие несколько повторяющихся последовательностей, где каждый повтор содержит di-остатки (двойные остатки) в положениях 12 и 13 (RVD), обладающие специфичностью в отношении каждого нуклеотидного основания последовательности нуклеиновой кислоты-мишени. Связывающие домены, обладающие сходными модульными свойствами связывания нуклеиновых кислот по типу основание-с основанием («base-per-base») (MBBBD) могут быть выведены также из новых модульных белков, недавно обнаруженных заявителями в различных видах бактерий. Преимущество новых модульных белков заключается в том, что они характеризуются большей вариабельностью последовательности, чем TAL-повторы. Предпочтительно RVD, ассоциированные с распознаванием различных нуклеотидов, представляют собой HD для распознавания С, NG для распознавания Т, NI для распознавания А, NN для распознавания G или A, NS для распознавания А, С, G или Т, HG для распознавания Т, IG для распознавания Т, NK для распознавания G, НА для распознавания С, ND для распознавания С, HI для распознавания С, HN для распознавания G, NA для распознавания G, SN для распознавания G или А и YG для распознавания Т, TL для распознавания А, VT для распознавания А или G и SW для распознавания А. В другом варианте осуществления изобретения имеющие решающее значение аминокислоты 12 и 13 можно изменять путем мутации на другие аминокислотные остатки для модуляции их специфичности в отношении нуклеотидов А, Т, С и G и, прежде всего, для повышения их специфичности. Ранее уже была описана TALE-нуклеаза, и ее применяют для стимуляции генного нацеливания и генных модификаций (Boch, Scholze и др., 2009; Moscou и Bogdanove, 2009; Christian, Cermak и др., 2010; Li, Huang и др., 2011). Сконструированные TAL-нуклеазы поступают в продажу под товарным знаком TALEN™ (фирма Cellectis, 8 rue de la Croix Jarry, 75013, Париж, Франция).
Редко расщепляющая эндонуклеаза, предлагаемая в настоящем изобретении, может представлять собой также эндонуклеазу Cas9. В последние годы был разработан новый инструмент для генетической инженерии на основе РНК-направляемой нуклеазы Cas9 (Gasiunas, Barrangou и др., 2012; Jinek, Chylinski и др., 2012; Cong, Ran и др., 2013; Mali, Yang и др., 2013) из адаптивной иммунной системы CRISPR (короткие палиндромные повторы, регулярно расположенные группами (Clustered Regularly Interspaced Short palindromic Repeats)) типа II прокариот (см. обзор Sorek, Lawrence и др., 2013). CRISPR-ассоциированная (Cas) система впервые была обнаружена в бактериях, и ее функция состоит в защите от чужой вирусной или плазмидной ДНК. При осуществлении опосредуемой CRISPR генетической инженерии сначала проводят отбор последовательности-мишени, часто фланкированной короткой последовательностью мотива, который обозначают как примыкающий к протоспейсеру мотив (РАМ). После отбора последовательности-мишени конструируют специфическую crРНК (CRISPR-РНК), комплементарную указанной последовательности-мишени. Для систем CRISPR типа II требуется трансактивирующая crРНК (tracrРНК), спаренная с crRNA и связанная с внесенным белком Cas9. Cas9 функционирует в качестве молекулярного якоря, облегчающего спаривание оснований tracРНК с сРНК (Deltcheva, Chylinski и др., 2011). В этом тройном комплексе двойная структура tracrРНК:crРНК функционирует в качестве направляющей РНК, которая направляет эндонуклеазу Cas9 к когнатной последовательности-мишени. Распознавание мишени комплексом Cas9-tracrРНК:crРНК инициируется путем сканирования последовательности-мишени для обнаружения гомологии между последовательностью-мишенью и crРНК. Помимо комплементарности последовательности-мишени и crРНК, нацеливание ДНК требует присутствия короткого мотива, примыкающего к протоспейсеру (примыкающий к протоспейсеру мотив - РАМ). После спаривания двойной РНК и последовательности-мишени Cas9 интродуцирует «тупой» двухцепочечный разрыв на расстоянии 3 пар оснований в обратном направлении относительно мотива РАМ (Garneau, Dupuis и др., 2010).
Редко расщепляющая эндонуклеаза может представлять собой хоминг-эндонуклеазу, также известную под названием мегануклеаза. Такие хоминг-эндонуклеазы хорошо известны в данной области (Stoddard, 2005). Хоминг-эндонуклеазы распознают последовательность ДНК-мишени и создают одноцепочечный или двухцепочечный разрыв. Хоминг-эндонуклеазы обладают высокой специфичностью, распознавая сайты ДНК-мишени длиной от 12 до 45 пар оснований (bp), как правило, длиной от 14 до 40 пар оснований. Хоминг-эндонуклеаза, предлагаемая в изобретении, может соответствовать, например, эндонуклеазе LAGLIDADG, эндонуклеазе HNH или эндонуклеазе GIY-YIG. Предпочтительно хоминг-эндонуклеаза, предлагаемая в настоящем изобретении, может представлять собой вариант I-CreI.
- Под «вектором для доставки» или «векторами для доставки» понимают любой доставляющий вектор, который можно применять согласно настоящему изобретению для приведения в контакт с клеткой (т.е. для «контактирования») или доставки внутрь клетки или в субклеточные компартменты (т.е. для «интродукции») агентов/химических веществ и молекул (белков или нуклеиновых кислот), требующихся для осуществления настоящего изобретения. К ним относятся (но не ограничиваясь только ими) липосомальные векторы для доставки, вирусные векторы для доставки, векторы для доставки лекарственного средства, химические носители, полимерные носители, липоплексы, полиплексы, дендримеры, микропузырьки (ультразвуковые контрастные агенты), наночастицы, эмульсии или другие пригодные векторы для переноса. Такие векторы для доставки позволяют доставлять молекулы, химические вещества, макромолекулы (гены, белки) или другие векторы, такие как плазмиды, пептиды, разработанные фирмой Diatos. В этих случаях векторы для доставки представляют собой молекулы-носители. Под «вектором для доставки» или «векторами для доставки» понимают также методы доставки, предназначенные для осуществления трансфекции.
- Понятия «вектор» или «векторы» относятся к молекуле нуклеиновой кислоты, обладающей способностью транспортировать другую нуклеиновую кислоту, с которой она сцеплена. К «векторам», применяемым согласно настоящему изобретению, относятся (но не ограничиваясь только ими) вирусный вектор, плазмида, РНКовый вектор или молекула линейной или кольцевой ДНК или РНК, которые могут состоять из хромосомальных, нехромосомальных, полусинтетических или синтетических нуклеиновых кислот. Предпочтительными векторами являются векторы, которые способны автономно реплицировать (эписомальный вектор) и/или экспрессировать нуклеиновые кислоты, с которыми они сцеплены (экспрессионные векторы). Специалистам в данной области известно большое количество пригодных векторов, которые поступают в продажу.
К вирусным векторам относятся ретровирус, аденовирус, парвовирус (например, аденоассоциированный вирусы), коронавирус, РНК-вирусы с негативной цепью, такие как ортомиксовирус (например, вирус гриппа), рабдовирус (например, вирус бешенства и вирус везикулярного стоматита), парамиксовирус (например, вирус кори и вирус Сендай), РНК-вирусы с позитивной цепью, такие как пикорнавирус и альфавирус, и вирусы с двухцепочечной ДНК, включая аденовирус, вирус герпеса (например, вирус герпеса простого типов 1 и 2, вирус Эпшейна-Барра, цитомегаловирус) и вирус оспы (например, вирус коровьей оспы, вирус оспы птиц и вирус оспы канарейки). Другие вирусы включают, например, вирус Норвалк, тогавирус, флавивирус, реовирусы, паповирус, гепаднавирус и вирус гепатита. Примерами ретровирусов являются: вирус птичьего лейкоза-саркомы, вирусы млекопитающих С-типа, В-типа, вирусы D-типа, группа HTLV-BLV, лентивирус, спумавирус (Coffin J.М., Retroviridae: The viruses and their replication, в: Fundamental Virology, 3-е изд., под ред. В.N. Fields и др., изд-во Lippincott-Raven Publishers, Philadelphia, 1996).
- Под «лентивирусным вектором» подразумевают лентивирусные векторы на основе ВИЧ, которые являются очень перспективными с точки зрения доставки гена благодаря их относительно большой способности к упаковке, пониженной иммуногенности и их способности стабильно трансдуцировать с высокой эффективностью большой спектр различных типов клеток. Лентивирусные векторы, как правило, создают посредством кратковременной трансфекции клеток-продуцентов тремя (упаковывающая плазмида, оболочечная плазмида и плазмида переноса) или большим количеством плазмид. Подобно ВИЧ, лентивирусные векторы проникают в клетку-мишень посредством взаимодействия гликопротеинов вирусной поверхности с рецепторами на клеточной поверхности. После проникновения вирусная РНК подвергается обратной транскрипции, опосредуемой комплексом вирусной обратной транскриптазы. Продуктом обратной транскрипции является двухцепочечная линейная вирусная ДНК, которая служит субстратом для вирусной интеграции в ДНК инфицированных клеток. Понятие «интегрирующие лентивирусные векторы (или LV)» обозначает, например (но не ограничиваясь только ими), такие векторы, которые способны интегрироваться в геном клетки-мишени. В противоположность этому, понятие «неинтегрирующие лентивирусные векторы (или NILV)» обозначает эффективные векторы для доставки генов, которые не интегрируются в геном клетки-мишени под действием вирусной интегразы.
- Векторы для доставки и векторы можно объединять или комбинировать с любыми методами клеточной пермеабилизации, такими как сонопорация или электропорация, или вариантами этих методов.
- Под клеткой или клетками подразумевают любые эукариотические живые клетки, первичные клетки и клеточные линии, выведенные из указанных организмов для получения культур in vitro.
- Под «первичной клеткой» или «первичными клетками» подразумевают клетки, взятые непосредственно из живой ткани (т.е. материал, полученный путем биопсии) и подготовленные для выращивания in vitro, в популяции которых имело место лишь небольшое количество удвоений и следовательно они являются более репрезентативными с точки зрения основных функциональных компонентов и характеристик тканей, из которых они выведены, по сравнению с непрерывно поддерживаемыми или искусственно иммортализованными онкогенными клеточными линиями.
Примерами таких клеточных линий могут являться (но не ограничиваясь только ими) клеточные линии, выбранные из группы, состоящей из клеток линии СНО-K1; клеток линии HEK293; клеток линии Сасо2; клеток линии U2-OS; клеток линии NIH 3Т3; клеток линии NSO; клеток линии SP2; клеток линии CHO-S; клеток линии DG44; клеток линии K-562, клеток линии U-937; клеток линии MRC5; клеток линии IMR90; клеток линии Jurkat; клеток линии HepG2; клеток линии HeLa; клеток линии НТ-1080; клеток линии HCT-116; клеток линии Hu-h7; клеток линии Huvec; клеток линии Molt 4.
Все эти клеточные линии можно модифицировать с помощью способа, предлагаемого в настоящем изобретении, создавая модели клеточных линий для получения, экспрессии, количественной оценки, обнаружения, изучения представляющего интерес гена или белка; эти модели можно применять также скрининга представляющих интерес биологически активных молекул для исследовательских и промышленных целей в различных областях, например, таких как (но не ограничиваясь только ими) химия, биотопливо, терапевтические средства и агрономия.
- Под «мутацией» подразумевают замену, делецию или инсерцию одного/одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, двадцати, двадцати пяти, тридцати, сорока, пятидесяти или большего количества нуклеотидов/аминокислот в полинуклеотидной (кДНК, ген) или полипептидной последовательности. Мутация может влиять на кодирующую последовательность гена или его регуляторную последовательность. Она может влиять также на структуру геномной последовательности или структуру/стабильность кодируемой мРНК.
- Под «вариантом(ами)» подразумевают вариант повтора, вариант, ДНК-связывающий вариант, вариант TALE-нуклеазы, вариант полипептида, полученный в результате мутации или замены по меньшей мере одного остатка в аминокислотной последовательности родительской молекулы.
- Под «функциональным вариантом» подразумевают обладающий каталитической активностью мутант белка или домена белка; такой мутант может обладать такой же активностью, что и родительский белок или домен белка, или дополнительными свойствами, или более высокой или более низкой активностью.
- Понятие «идентичность» относится к идентичности последовательностей двух молекул нуклеиновых кислот или полипептидов. Идентичность можно оценивать путем сравнения положений в каждой из последовательностей, которые можно выравнивать для целей сравнения. Если положение в сравниваемой последовательности занято тем же самым основанием, то молекулы являются идентичными в этом положении. Степень сходства или идентичности между двумя нуклеотидными или аминокислотными последовательностями является функцией количества идентичных или совпадающих нуклеотидов в положениях нуклеотидных последовательностей. Для расчета идентичности двух последовательностей можно использовать различные алгоритмы и/или программы сравнительного анализа первичной структуры последовательностей, включая FASTA или BLAST, которые доступны в виде компонента пакета программ анализа последовательностей GCG (Университет Висконсина, Мэдисон, шт. Висконсин), и их можно применять, например, с использованием задаваемых по умолчанию параметров. Например, можно рассматривать полипептиды, обладающие идентичностью, составляющей по меньшей мере 70, 85, 90, 95, 98 или 99%, с конкретными полипептидами, представленными в настоящем описании, и предпочтительно обладающие практически такими же функциями, а также полинуклеотиды, кодирующие такие полипептиды.
- Понятие «сходство» характеризует степень родства между аминокислотными последовательностями двух или большего количества полипептидов. BLASTP можно применять также для идентификации аминокислотной последовательности, идентичной по меньшей мере на 70, 75, 80, 85, 87,5, 90, 92,5, 95, 97,5, 98, 99% аминокислотной референс-последовательности, с использованием матриц сходства, таких как BLOSUM45, BLOSUM62 или BLOSUM80. Если специально не указано иное, то указанные в описании баллы сходства получены с использованием BLOSUM62. При использовании BLASTP процент сходства основан на рассчитанном программой BLASTP балле положительных оценок, а процент идентичности последовательностей основан на рассчитанном BLASTP балле идентичности. Рассчитанные с помощью BLASTP «идентичности» представляют собой количество и пропорцию идентичных остатков относительно общего количества остатков в парах последовательностей с высокими баллами; а рассчитанные с помощью BLASTP «положительные оценки» представляют собой количество и пропорцию остатков, для которых полученные при сравнительном анализе первичной структуры последовательностей баллы, являются положительными, и которые сходны друг с другом. В настоящей заявке предложены и подпадают под объем изобретения аминокислотные последовательности, имеющие указанные степени идентичности или сходства, или любую промежуточную степень идентичности или сходства с представленными в настоящем описании аминокислотными последовательностями. Полинуклеотидные последовательности сходных полипептидов выводят с использованием генетического кода и их можно получать с помощью общепринятых методов. Полинуклеотид, кодирующий такой функциональный вариант, можно получать путем обратной трансляции его аминокислотной последовательности с использованием генетического кода.
- Понятия «домен трансдукции сигнала» или «костимуляторный лиганд» относятся к молекуле на антигенпрезентирующей клетке, которая специфически связывается с когнатной костимуляторной молекулой на Т-клетке, обеспечивая тем самым сигнал, который в дополнение к первичному сигналу, обеспечиваемому, например, связыванием комплекса TCR/CD3 с молекулой ГКГС, загруженной пептидом, опосредует T-клеточный ответ, включая (но не ограничиваясь только ими) активацию пролиферации, дифференцировку и т.п. Костимуляторным лигандом могут служить (но не ограничиваясь только ими) CD7, В7-1 (CD80), В7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцибельный костимуляторный лиганд (ICOS-L), молекула межклеточной адгезии (ICAM, CD30L, CD40, CD70, CD83, HLA-G, MICA, М1СВ, HVEM, рецептор лимфотоксина бета, 3/TR6, ILT3, ILT4, агонист или антитело, который/которое связывается с лигандом Толл-рецептора, и лиганд, который специфически связывается с В7-Н3. Костимуляторный лиганд включает также, среди прочего, антитело, которое специфически связывается с костимуляторной молекулой, присутствующей на Т-клетке, такой как (но не ограничиваясь только ими) CD27, CD28, 4-IBB, OX40, CD30, CD40, PD-1, ICOS, ассоциированный с функцией лимфоцитов антиген-1 (LFA-1), CD2, CD7, LTGHT, NKG2C, В7-Н3, лиганд, который специфически связывается с CD83.
Понятие «костимуляторная молекула» относится к когнатному связывающему партнеру на Т-клетке, который специфически связывается с костимуляторным лигандом, опосредуя тем самым костимуляторный ответ клетки, такой как (но не ограничиваясь только им) пролиферация. Костимуляторные молекулы включают (но не ограничиваясь только ими) молекулу ГКГС класса I, BTLA и лиганд Толл-рецептора.
В контексте настоящего описания понятие «костимуляторный сигнал» относится к сигналу, который в сочетании с первичным сигналом, таким как сигнал, обусловленный сцеплением TCR/CD3, приводит к пролиферации Т-клеток и/или повышающей или понижающей регуляции имеющих решающее значение молекул.
- В контексте настоящего описания понятие «внеклеточный лиганд-связывающий домен» обозначает олиго- или полипептид, который обладает способностью связываться с лигандом. Предпочтительно домен должен обладать способностью взаимодействовать с молекулой клеточной поверхности. Например, можно выбирать внеклеточный лиганд-связывающий домен для распознавания лиганда, который функционирует в качестве маркера клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием. Так, примерами маркеров клеточной поверхности, которые могут функционировать в качестве лигандов, являются маркеры, ассоциированные с вирусными, бактериальными и паразитарными инфекциями, аутоиммунным заболеванием и раковыми клетками.
В контексте настоящего описания понятие «индивидуум» или «пациент» включает всех представителей царства животных, в том числе приматов кроме человека и человека.
В представленном выше описании изобретения изложены подход и способ его осуществления и применения, так что любой специалист в данной области способен осуществлять и применять его, эта возможность относится, прежде всего, к сущности изобретения, изложенной в прилагаемой формуле изобретения, которая представляет собой составную часть исходного описания.
Если в настоящем описании указаны численные пределы или численный диапазон, то они включают их границы. Кроме того, считается, что включены все значения и поддиапазоны, находящиеся в указанных пределах или указанном численном диапазоне, как если бы они были специально указаны.
Приведенное выше описание представлено для того, чтобы дать возможность специалисту в данной области осуществлять и применять изобретение, и оно изложено в контексте конкретного применения и требуемых для этого условий. Специалистам в данной области должны быть очевидны различные модификации предпочтительных вариантов осуществления изобретения, и общие принципы, указанные в нем могут быть применены для других вариантов осуществления изобретения и применений без отклонения от сущности и объема изобретения. Таким образом, не следует считать, что настоящее изобретение ограничено представленными вариантами осуществления изобретения, напротив, оно соответствует наиболее широкому объему, согласующемуся с принципами и отличительными признаками, указанными в настоящем описании.
Имея общее описание настоящего изобретения, можно достичь более полного понимания после ознакомления с некоторыми конкретными примерами, которые представлены в настоящем описании только для целей иллюстрации и не направлены на ограничение объема, если специально не указано иное.
Примеры
Пример 1: Пролиферация клеток с инактивированным ТСRальфа, экспрессирующих 4G7-CAR.
Конструировали и создавали гетеродимерную TALE-нуклеазу, нацеленную на две последовательности длиной 17 пар оснований (которые обозначали как полумишени), разделенные состоящим из 15 пар оснований спейсером в гене константной области альфа-цепи T-клеточного рецептора (TRAC). Каждая из полумишеней распознавалась повторами половин TALE-нуклеаз, представленными в таблице 1.

Каждую конструкцию TALE-нуклеазы субклонировали с использованием расщепления рестриктазами в экспрессионном векторе млекопитающих под контролем промотора Т7. мРНК, кодирующую TALE-нуклеазу, которая расщепляла геномную последовательность TRAC, синтезировали с использованием плазмиды, несущей кодирующую последовательность, расположенную в прямом направлении относительно промотора Т7.
Очищенные Т-клетки, предварительно активированные в течение 72 ч покрытыми антителом к CD3/CD28 гранулами, трансфектировали каждой из 2 мРНК, кодирующих обе половины TRAC_Т01 TALE-нуклеаз. Через 48 ч после трансфекции Т-клетки трансдуцировали лентивирусным вектором, кодирующим 4G7-CAR (SEQ ID NO: 14). Через 2 для после трансдукции CD3NEG-клетки очищали с использованием покрытых антителом к CD3 магнитных гранул и через 5 дней после трансдукции клетки реактивировали растворимым антителом к CD28 (5 мкг/мл).
Мониторинг клеточной пролиферации осуществляли в течение периода времени вплоть до 30 дней после реактивации, подсчитывая количество клеток 2 раза в неделю. На фиг. 1 представлена кратность индукции в виде отношения количества клеток к количеству клеток, присутствовавших в день 2 после реактивации, для двух различных доноров. Обнаружено увеличение пролиферации клеток с инактивированным TCR альфа, экспрессирующих 4G7-CAR, прежде всего в том случае, когда их реактивировали антителом к CD28, по сравнению с нетрансдуцированными клетками.
Для изучения вопроса о том, находятся ли человеческие Т-клетки, экспрессирующие 4G7-CAR, в активированном состоянии, анализировали экспрессию маркера активации CD25 с помощью FACS через 7 дней после трансдукции. Как проиллюстрировано на фиг. 2, очищенные клетки, трансдуцированные лентивирусным вектором, кодирующим 4G7-CAR, экспрессировали значительно в большем количестве CD25 на своей поверхности, чем нетрансдуцированные клетки. Повышенный уровень экспрессии CD25 обнаружен как в условиях после реактивации антителом к CD28, так и в условиях без реактивации.
Пример 2: Сравнение исходной активации первичных человеческих Т-клеток, экспрессирующих 4G7-CAR и классический FMC63-CAR
Для определения того, обеспечивает ли scFv 4G7 пролонгированное «активированное» состояние трансдуцированной клетки, сравнивали исходную активацию Т-клетки, трансдуцированной CAR, который нес scFv 4G7 (SEQ ID NO: 17, кодируемая SEQ ID NO: 15) или классический scFv FMC63 (SEQ ID NO: 16).
Очищенные человеческие Т-клетки трансдуцировали согласно представленному ниже протоколу: в целом он состоял в следующем: 1×106 CD3+-клеток, предварительно активированных в течение 3 дней с использованием покрытых антителом к CD3/CD28 гранул и рекомбинантным IL2, трансдуцировали лентивирусными векторами, кодирующими 4G7-CAR (SEQ ID NO: 15) и FMC63-CAR (SEQ ID NO: 16), с величиной MOI, равной 5, в 12-луночных не предназначенных для культур ткани планшетах, сенсибилизированных 30 мкг/мл ретронектина. Через 24 ч после трансдукции среду удаляли и заменяли свежей средой. После этого клетки поддерживали в концентрации 1×106 клеток/мл в течение периода культивирования, осуществляя подсчет клеток каждые 2-3 дня.
Через 3, 8 и 15 дней после трансдукции лентивирусным вектором, кодирующим либо 4G7-CAR, либо FMC63-CAR, оценивали процент экспрессирующих CAR клеток с помощью проточной цитометрии. Установлено, что эффективность трансдукции была примерно эквивалентна эффективности трансдукции двумя лентивирусными векторами, что продемонстрировано на фиг.3.
Затем проводили изучение того, характеризуются ли человеческие Т-клетки, экспрессирующие 4G7-CAR, более активированным состоянием, чем человеческие Т-клетки, экспрессирующие FMC63-CAR. Для этого сравнивали экспрессию маркера активации CD25 на поверхности Т-клеток, трансдуцированных 2 лентивирусными векторами, в различные моменты времени. Как продемонстрировано на фиг. 4, через 3 и 8 дней после трансдукции уровень экспрессии CD25 на поверхности клеток, трансдуцированных лентивирусным вектором, кодирующим 4G7-CAR, был значительно выше, чем на поверхности клеток, трансдуцированных лентивирусным вектором, кодирующим FMC63-CAR.
Размер клеток, трансдуцированных 4G7-CAR или FMC63-CAR, оценивали также с помощью проточной цитометрии в различные моменты времени. Установлено, что через 3, 8 и 15 дней после трансдукции клетки, экспрессирующие 4G7-CAR, имели больший размер, чем клетки, экспрессирующие FMC63-CAR, см. фиг. 5.
После неспецифической активации in vitro трансдуцированные 4G7-CAR клетки имели больший размер (образование бластов), а также уровень экспрессии маркеров активации (CD25) в течение более продолжительного периода времени. Такая более продолжительная активация позволяет обеспечивать более продолжительную пролиферацию по сравнениями с клетками, трансдуцированными сходным CAR, содержащим FMC63 ScFv.
Пример 3: Сравнение пролиферации первичных человеческих Т-клеток, экспрессирующих 4G7-CAR и классический FMC63-CAR.
Для определения того, обеспечивает ли scFv 4G7 более высокую пролиферирующую активность, оценивали пролиферацию Т-клеток, трансдуцированных CAR, несущим scFv 4G7 (SEQ ID NO: 17 кодируемая SEQ ID NO: 15) или классический scFv FMC63 (SEQ ID NO: 16), в течение периода времени вплоть до 20 дней, осуществляя подсчет количества клеток два раза в неделю. Очищенные человеческие Т-клетки трансдуцировали согласно представленному ниже протоколу: в целом он состоял в следующем: 1×106 CD3+-клеток, предварительно активированных в течение 3 дней с использованием покрытых антителом к CD3/CD28 гранул и рекомбинантным IL2, трансдуцировали лентивирусными векторами, кодирующими 4G7-CAR (SEQ ID NO: 15) и FMC63-CAR (SEQ ID NO: 16). После этого клетки поддерживали в классических условиях и реактивировали в день 12. Клетки высевали с одинаковой плотностью и подсчитывали их количество два раза в неделю в течение 20 дней. Как проиллюстрировано на фиг.6, пролиферирующая активность Т-клеток, экспрессирующих 4G7-CAR, была в два раза выше, чем активность клеток, экспрессирующих классический FMC63-CAR.
Ссылки
Arimondo Р.В., С.J. Thomas и др., "Exploring the cellular activity of camptothecin-triple-helix-forming oligonucleotide conjugates", Mol Cell Biol 26(1), 2006, cc. 324-333;
Atkins J.F., N.M. Wills и др., "A case for "StopGo": reprogramming translation to augment codon meaning of GGN by promoting unconventional termination (Stop) after addition of glycine and then allowing continued translation (Go)", Rna 13(6), 2007, cc. 803-810;
Bierer В.E., G. Hollander и др., "Cyclosporin A and FK506: molecular mechanisms of immunosuppression and probes for transplantation biology", Curr Opin Immunol 5(5), 1993), cc. 763-773%;
Boch J., H. Scholze и др., "Breaking the code of DNA binding specificity of TAL-type III effectors", Science 326(5959), 2009, cc. 1509-1512;
Choulika A., A. Perrin и др., "Induction of homologous recombination in mammalian chromosomes by using the I-Scel system of Saccharomyces cerevisiae", Mol Cell Biol 15(4), 1995, cc. 1968-1973;
Christian M., T. Cermak и др., "Targeting DNA double-strand breaks with TAL effector nucleases", Genetics 186(2), 2010, cc. 757-761;
Cong L., F.A. Ran и др., "Multiplex genome engineering using CRISPR/Cas systems", Science 339(6121), 2013, cc. 819-823;
Deltcheva E., K. Chylinski и др., "CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III", Nature 471(7340), 2011, cc. 602-607;
Donnelly M. и G. Elliott, "Nuclear localization and shuttling of herpes simplex virus tegument protein VP13/14," J Virol 75(6), 2001, cc. 2566-2574;
Doronina V.A., C. Wu и др., "Site-specific release of nascent chains from ribosomes at a sense codon", Mol Cell Biol 28(13), 2008, cc. 4227-4239;
Eisenschmidt K., T. Lanio и др., "Developing a programmed restriction endonuclease for highly specific DNA cleavage", Nucleic Acids Res 33(22), 2005, cc. 7039-7047;
Garneau J.E., M.E. Dupuis и др., "The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA", Nature 468(7320), 2010, cc. 67-71;
Gasiunas G., R. Barrangou и др., "Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria", Proc Natl Acad Sci USA 109(39), 2012, cc. E2579-2586;
Henderson D.J., I. Naya и др., "Comparison of the effects of FK-506, cyclosporin A and rapamycin on IL-2 production", Immunology 73(3), 1991, cc. 316-321;
Jena В., G. Dotti и др., "Redirecting T-cell specificity by introducing a tumor-specific chimeric antigen receptor ", Blood 116(7), 2010), cc. 1035-1044;
Jinek M., K. Chylinski и др., "A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity", Science 337(6096), 2012, cc. 816-821;
Kalish J.M. и P.M. Glazer, "Targeted genome modification via triple helix formation", Ann NY Acad Sci 1058, 2005, cc. 151-161;
Li Т., S. Huang и др., "TAL nucleases (TALNs): hybrid proteins composed of TAL effectors and Fokl DNA-cleavage domain", Nucleic Acids Res 39(1), 2011, cc. 359-372;
Liu J., M.W. Albers и др., "Inhibition of T cell signaling by immunophilin-ligand complexes correlates with loss of calcineurin phosphatase activity", Biochemistry 31(16), 1992, cc. 3896-3901.
Mali P., L. Yang и др., "RNA-guided human genome engineering via Cas9", Science 339(6121), 2013, cc. 823-826;
Moscou M.J. и A.J. Bogdanove, "A simple cipher governs DNA recognition by TAL effectors", Science 326(5959), 2009, c. 1501;
Paques F. и P. Duchateau, "Meganucleases and DNA double-strand break-induced recombination: perspectives for gene therapy", Curr Gene Ther 7(1), 2007, cc. 49-66;
Park T.S., S.A. Rosenberg и др., "Treating cancer with genetically engineered T cells", Trends Biotechnol 29(11), 2011, cc. 550-557;
Peipp M., D. Saul и др., "Efficient eukaryotic expression of fluorescent scFv fusion proteins directed against CD antigens for FACS applications", J Immunol Methods 285(2), 2004, cc. 265-280;
Perrin A., M. Buckle и др., "Asymmetrical recognition and activity of the I-Scel endonuclease on its site and on intron-exon junctions", Embo J 12(7), 1993, cc. 2939-2947;
Pingoud А. и G.H. Silva, "Precision genome surgery", Nat Biotechnol 25(7), 2007, cc. 743-744;
Porteus M.H. и D. Carroll, "Gene targeting using zinc finger nucleases", Nat Biotechnol 23(8), 2005, cc. 967-973;
Rouet P., F. Smih и др., "Introduction of double-strand breaks into the genome of mouse cells by expression of a rare-cutting endonuclease", Mol Cell Biol 14(12), 1994, cc. 8096-8106;
Sorek R., С.M. Lawrence и др., "CRISPR-mediated Adaptive Immune Systems in Bacteria and Archaea", Annu Rev Biochem. 2013;
Stoddard B.L., "Homing endonuclease structure and function", Q Rev Biophys 38(1), 2005, cc. 49-95.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> селлектис
<120> CD19-специфический химерный антигенный рецептор и его применения
<130> P81403460PCT00
<150> PCT/US2013/040755
<151> 2013-05-13
<150> PCT/US2013/040766
<151> 2013-05-13
<150> US 13/892,805
<151> 2013-05-13
<150> USP 61/888,259
<151> 2013-10-08
<160> 24
<170> PatentIn, версия 3.5
<210> 1
<211> 464
<212> PRT
<213> mus musculus
<220>
<223> иммуноглобулиновая тяжелая цепь гамма 1 античеловеческого моноклонального антитела к CD19 4G7
<400> 1
Met Glu Trp Ser Trp Ile Phe Leu Phe Leu Leu Ser Gly Thr Ala Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Ile Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn
65 70 75 80
Glu Lys Phe Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Gly Thr Tyr Tyr Tyr Gly Ser Arg Val Phe Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Lys Thr Thr
130 135 140
Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala Ala Gln Thr Asn
145 150 155 160
Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro
165 170 175
Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr
180 185 190
Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val
195 200 205
Thr Val Pro Ser Ser Thr Trp Pro Ser Glu Thr Val Thr Cys Asn Val
210 215 220
Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Val Pro Arg
225 230 235 240
Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro Glu Val Ser Ser
245 250 255
Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu Thr Ile Thr Leu
260 265 270
Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser Lys Asp Asp Pro
275 280 285
Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu Val His Thr Ala
290 295 300
Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Ser Val
305 310 315 320
Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn Gly Lys Glu Phe
325 330 335
Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro Ile Glu Lys Thr
340 345 350
Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln Val Tyr Thr Ile
355 360 365
Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val Ser Leu Thr Cys
370 375 380
Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val Glu Trp Gln Trp
385 390 395 400
Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln Pro Ile Met Asp
405 410 415
Thr Asp Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn Val Gln Lys Ser
420 425 430
Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val Leu His Glu Gly
435 440 445
Leu His Asn His His Thr Glu Lys Ser Leu Ser His Ser Pro Gly Lys
450 455 460
<210> 2
<211> 239
<212> PRT
<213> mus musculus
<220>
<223> иммуноглобулиновая легкая цепь каппа античеловеческого моноклонального антитела к CD19 4G7
<400> 2
Met Arg Cys Leu Ala Glu Phe Leu Gly Leu Leu Val Leu Trp Ile Pro
1 5 10 15
Gly Ala Ile Gly Asp Ile Val Met Thr Gln Ala Ala Pro Ser Ile Pro
20 25 30
Val Thr Pro Gly Glu Ser Val Ser Ile Ser Cys Arg Ser Ser Lys Ser
35 40 45
Leu Leu Asn Ser Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Arg
50 55 60
Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala
65 70 75 80
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe
85 90 95
Thr Leu Arg Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr
100 105 110
Cys Met Gln His Leu Glu Tyr Pro Phe Thr Phe Gly Ala Gly Thr Lys
115 120 125
Leu Glu Leu Lys Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro
130 135 140
Pro Ser Ser Glu Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe
145 150 155 160
Leu Asn Asn Phe Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp
165 170 175
Gly Ser Glu Arg Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp
180 185 190
Ser Lys Asp Ser Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys
195 200 205
Asp Glu Tyr Glu Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys
210 215 220
Thr Ser Thr Ser Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
225 230 235
<210> 3
<211> 121
<212> PRT
<213> mus musculus
<220>
<223> фрагмент иммуноглобулиновой тяжелой цепи гамма 1 античеловеческого моноклонального антитела к CD19 4G7 (остатки 20-140)
<400> 3
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Ile Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Thr Tyr Tyr Tyr Gly Ser Arg Val Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 4
<211> 115
<212> PRT
<213> mus musculus
<220>
<223> фрагмент иммуноглобулиновой легкой цепи каппа античеловеческого моноклонального антитела к CD19 4G7 (остатки 21-130)
<400> 4
Asp Ile Val Met Thr Gln Ala Ala Pro Ser Ile Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Asn Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His
85 90 95
Leu Glu Tyr Pro Phe Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
Arg Ala Asp
115
<210> 5
<211> 116
<212> PRT
<213> искусственная последовательность
<220>
<223> фрагмент иммуноглобулиновой легкой цепи каппа античеловеческого моноклонального антитела к CD19 4G7
<400> 5
Asp Ile Val Met Thr Gln Ala Ala Pro Ser Ile Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Val Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Asn Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His
85 90 95
Leu Glu Tyr Pro Phe Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
Arg Ser Asp Pro
115
<210> 6
<211> 15
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственная последовательность: синтетический олигопептид
<220>
<223> линкер
<400> 6
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 7
<211> 252
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический пептид
<220>
<223> scFV 4G7, версия 1
<400> 7
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Ile Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Thr Tyr Tyr Tyr Gly Ser Arg Val Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ala Ala
130 135 140
Pro Ser Ile Pro Val Thr Pro Gly Glu Ser Val Ser Ile Ser Cys Arg
145 150 155 160
Ser Ser Lys Ser Leu Leu Asn Ser Asn Gly Asn Thr Tyr Leu Tyr Trp
165 170 175
Phe Leu Gln Arg Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Arg Met
180 185 190
Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser
195 200 205
Gly Thr Ala Phe Thr Leu Arg Ile Ser Arg Val Glu Ala Glu Asp Val
210 215 220
Gly Val Tyr Tyr Cys Met Gln His Leu Glu Tyr Pro Phe Thr Phe Gly
225 230 235 240
Ala Gly Thr Lys Leu Glu Leu Lys Arg Ser Asp Pro
245 250
<210> 8
<211> 251
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический полипептид
<220>
<223> scFV 4G7, версия 2
<400> 8
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Ile Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Thr Tyr Tyr Tyr Gly Ser Arg Val Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ala Ala
130 135 140
Pro Ser Ile Pro Val Thr Pro Gly Glu Ser Val Ser Ile Ser Cys Arg
145 150 155 160
Ser Ser Lys Ser Leu Leu Asn Ser Asn Gly Asn Thr Tyr Leu Tyr Trp
165 170 175
Phe Leu Gln Arg Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Arg Met
180 185 190
Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser
195 200 205
Gly Thr Ala Phe Thr Leu Arg Ile Ser Arg Val Glu Ala Glu Asp Val
210 215 220
Gly Val Tyr Tyr Cys Met Gln His Leu Glu Tyr Pro Phe Thr Phe Gly
225 230 235 240
Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp
245 250
<210> 9
<211> 250
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический полипептид
<220>
<223> scFV FMC63
<400> 9
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Lys Ala Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Glu Val Lys Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser
130 135 140
Gln Ser Leu Ser Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp
145 150 155 160
Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp
165 170 175
Leu Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu
180 185 190
Lys Ser Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe
195 200 205
Leu Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys
210 215 220
Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Ser Val Thr Val Ser Ser Asp
245 250
<210> 10
<211> 112
<212> PRT
<213> homo sapiens
<220>
<223> фрагмент зета-цепи гликопротеина CD3 Т-клеточной поверхности
<400> 10
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 11
<211> 42
<212> PRT
<213> homo sapiens
<220>
<223> фрагмент 4-1BB (остатки 214-255)
<400> 11
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 12
<211> 41
<212> PRT
<213> homo sapiens
<220>
<223> фрагмент специфического в отношении T-клетки поверхностного гликопротеина CD28
<400> 12
Arg Ser Lys Arg Ser Arg Gly Gly His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 13
<211> 69
<212> PRT
<213> homo sapiens
<220>
<223> фрагмент предшественника изоформы 1 альфа-цепи поверхностного гликопротеина CD8, специфического в отношении T-клетки (остатки 138-206)
<400> 13
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Leu Tyr Cys
65
<210> 14
<211> 495
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический полипептид
<220>
<223> 4G7-CAR, версия 1
<400> 14
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu
20 25 30
Ile Lys Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Val Met His Trp Val Lys Gln Lys Pro Gly Gln
50 55 60
Gly Leu Glu Trp Ile Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys
65 70 75 80
Tyr Asn Glu Lys Phe Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser
85 90 95
Ser Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Thr Tyr Tyr Tyr Gly Ser Arg Val
115 120 125
Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val
145 150 155 160
Met Thr Gln Ala Ala Pro Ser Ile Pro Val Thr Pro Gly Glu Ser Val
165 170 175
Ser Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Asn Ser Asn Gly Asn
180 185 190
Thr Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser Pro Gln Leu
195 200 205
Leu Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe
210 215 220
Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Arg Ile Ser Arg Val
225 230 235 240
Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His Leu Glu Tyr
245 250 255
Pro Phe Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp
260 265 270
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
275 280 285
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
290 295 300
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
305 310 315 320
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
325 330 335
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
340 345 350
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
355 360 365
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
370 375 380
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
385 390 395 400
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
405 410 415
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
420 425 430
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
435 440 445
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
450 455 460
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
465 470 475 480
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<210> 15
<211> 495
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический полипептид
<220>
<223> 4G7-CAR, версия 2
<400> 15
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Ile
20 25 30
Lys Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr
35 40 45
Phe Thr Ser Tyr Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly
50 55 60
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr
65 70 75 80
Asn Glu Lys Phe Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser
85 90 95
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala
100 105 110
Val Tyr Tyr Cys Ala Arg Gly Thr Tyr Tyr Tyr Gly Ser Arg Val Phe
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met
145 150 155 160
Thr Gln Ala Ala Pro Ser Ile Pro Val Thr Pro Gly Glu Ser Val Ser
165 170 175
Ile Ser Cys Arg Ser Ser Lys Ser Leu Leu Asn Ser Asn Gly Asn Thr
180 185 190
Tyr Leu Tyr Trp Phe Leu Gln Arg Pro Gly Gln Ser Pro Gln Leu Leu
195 200 205
Ile Tyr Arg Met Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser
210 215 220
Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Arg Ile Ser Arg Val Glu
225 230 235 240
Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln His Leu Glu Tyr Pro
245 250 255
Phe Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ser Asp Pro
260 265 270
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
275 280 285
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
290 295 300
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
305 310 315 320
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
325 330 335
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
340 345 350
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
355 360 365
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
370 375 380
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
385 390 395 400
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
405 410 415
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
420 425 430
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
435 440 445
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
450 455 460
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
465 470 475 480
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490 495
<210> 16
<211> 494
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический полипептид
<220>
<223> FMC63-CAR
<400> 16
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser
20 25 30
Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp
35 40 45
Ile Ser Lys Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val
50 55 60
Lys Leu Leu Ile Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser
85 90 95
Asn Leu Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn
100 105 110
Thr Leu Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Lys
115 120 125
Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Glu Val Lys Leu Gln Glu Ser Gly Pro Gly Leu
145 150 155 160
Val Ala Pro Ser Gln Ser Leu Ser Val Thr Cys Thr Val Ser Gly Val
165 170 175
Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Arg Lys
180 185 190
Gly Leu Glu Trp Leu Gly Val Ile Trp Gly Ser Glu Thr Thr Tyr Tyr
195 200 205
Asn Ser Ala Leu Lys Ser Arg Leu Thr Ile Ile Lys Asp Asn Ser Lys
210 215 220
Ser Gln Val Phe Leu Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala
225 230 235 240
Ile Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met
245 250 255
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Asp Pro Thr
260 265 270
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
275 280 285
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
290 295 300
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
305 310 315 320
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
325 330 335
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
340 345 350
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
355 360 365
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
370 375 380
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
385 390 395 400
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
405 410 415
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
420 425 430
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
435 440 445
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
450 455 460
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
465 470 475 480
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 17
<211> 1488
<212> DNA
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> 4G7-CAR, версия 2
<400> 17
atggagaccg acaccctgct gctgtgggtg ctgctgctgt gggtgccagg cagcaccggc 60
gaggtgcagc tgcagcagag cggacccgag ctgatcaagc caggcgccag cgtgaagatg 120
agctgcaagg ccagcggcta caccttcacc agctacgtga tgcactgggt gaagcagaag 180
ccaggccagg gcctggagtg gatcggctac atcaacccct acaacgacgg caccaagtac 240
aacgagaagt tcaagggcaa ggccaccctg accagcgaca agagcagcag caccgcctac 300
atggagctga gcagcctgac cagcgaggac agcgccgtgt actactgcgc cagaggcacc 360
tactactacg gcagccgggt gttcgactac tggggccagg gcaccaccct gaccgtgagc 420
tctggcggag gcggctctgg cggaggcggc tctggcggag gcggcagcga catcgtgatg 480
acccaggctg cccccagcat ccccgtgacc ccaggcgaga gcgtgagcat cagctgccgg 540
agcagcaaga gcctgctgaa cagcaacggc aacacctacc tgtactggtt cctgcagcgg 600
ccaggccaga gcccccagct gctgatctac cggatgagca acctggccag cggcgtgccc 660
gaccggttca gcggcagcgg cagcggcacc gccttcaccc tgcggatcag ccgggtggag 720
gccgaggacg tgggcgtgta ctactgcatg cagcacctgg agtacccctt caccttcgga 780
gccggcacca agctggagct gaagcggtcg gatcccacca ccaccccagc cccacggcca 840
cctacccctg ccccaaccat cgccagccag cccctgagcc tgcggcctga agcctgcagg 900
cctgccgccg gaggagccgt gcacacaagg ggcctggact tcgcctgcga catctatatc 960
tgggcccccc tggccgggac atgcggggtg ctgctgctgt ccctggtgat tacactgtat 1020
tgcaaacggg gccggaagaa gctgctgtac atcttcaagc agcccttcat gcggcccgtg 1080
cagaccaccc aggaggagga cggctgcagc tgccggttcc ccgaggaaga ggaaggcggc 1140
tgcgagctgc gggtgaagtt cagccggagc gccgacgccc cagcctacca gcagggccag 1200
aaccagctgt acaacgagct gaacctggga cggcgggagg agtacgacgt gctggacaag 1260
cggcggggac gggaccccga gatgggcggc aagcctcgcc ggaagaatcc ccaggagggc 1320
ctgtacaacg agctgcagaa ggacaagatg gccgaggcct acagcgagat cggcatgaag 1380
ggcgagcggc gccggggcaa gggccacgac ggcctgtacc agggcctgag caccgccacc 1440
aaggacacct acgacgccct gcacatgcag gccctgccac cccggtga 1488
<210> 18
<211> 20
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический олигопептид
<220>
<223> сигнальный пептид
<400> 18
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly
20
<210> 19
<211> 21
<212> PRT
<213> искусственная последовательность
<220>
<223> описание искусственной последовательности: синтетический олигопептид
<220>
<223> сигнальный пептид
<400> 19
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 20
<211> 49
<212> DNA
<213> Homo sapiens
<400> 1
ttgtcccaca gatatccaga accctgaccc tgccgtgtac cagctgaga 49
<210> 21
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<220>
<223> повтор TRAC_T01-L
<400> 21
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
65 70 75 80
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
370 375 380
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
435 440 445
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
465 470 475 480
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 22
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<220>
<223> повтор TRAC_T01-R
<400> 22
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
130 135 140
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
370 375 380
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
435 440 445
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
465 470 475 480
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 23
<211> 2814
<212> DNA
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<220>
<223> TRAC_T01-R TALEN
<400> 23
atgggcgatc ctaaaaagaa acgtaaggtc atcgattacc catacgatgt tccagattac 60
gctatcgata tcgccgatct acgcacgctc ggctacagcc agcagcaaca ggagaagatc 120
aaaccgaagg ttcgttcgac agtggcgcag caccacgagg cactggtcgg ccacgggttt 180
acacacgcgc acatcgttgc gttaagccaa cacccggcag cgttagggac cgtcgctgtc 240
aagtatcagg acatgatcgc agcgttgcca gaggcgacac acgaagcgat cgttggcgtc 300
ggcaaacagt ggtccggcgc acgcgctctg gaggccttgc tcacggtggc gggagagttg 360
agaggtccac cgttacagtt ggacacaggc caacttctca agattgcaaa acgtggcggc 420
gtgaccgcag tggaggcagt gcatgcatgg cgcaatgcac tgacgggtgc cccgctcaac 480
ttgacccccc agcaggtggt ggccatcgcc agcaatggcg gtggcaagca ggcgctggag 540
acggtccagc ggctgttgcc ggtgctgtgc caggcccacg gcttgacccc ccagcaggtg 600
gtggccatcg ccagcaataa tggtggcaag caggcgctgg agacggtcca gcggctgttg 660
ccggtgctgt gccaggccca cggcttgacc ccccagcagg tggtggccat cgccagcaat 720
ggcggtggca agcaggcgct ggagacggtc cagcggctgt tgccggtgct gtgccaggcc 780
cacggcttga ccccggagca ggtggtggcc atcgccagcc acgatggcgg caagcaggcg 840
ctggagacgg tccagcggct gttgccggtg ctgtgccagg cccacggctt gaccccggag 900
caggtggtgg ccatcgccag ccacgatggc ggcaagcagg cgctggagac ggtccagcgg 960
ctgttgccgg tgctgtgcca ggcccacggc ttgaccccgg agcaggtggt ggccatcgcc 1020
agccacgatg gcggcaagca ggcgctggag acggtccagc ggctgttgcc ggtgctgtgc 1080
caggcccacg gcttgacccc ggagcaggtg gtggccatcg ccagcaatat tggtggcaag 1140
caggcgctgg agacggtgca ggcgctgttg ccggtgctgt gccaggccca cggcttgacc 1200
ccggagcagg tggtggccat cgccagccac gatggcggca agcaggcgct ggagacggtc 1260
cagcggctgt tgccggtgct gtgccaggcc cacggcttga ccccggagca ggtggtggcc 1320
atcgccagca atattggtgg caagcaggcg ctggagacgg tgcaggcgct gttgccggtg 1380
ctgtgccagg cccacggctt gaccccccag caggtggtgg ccatcgccag caataatggt 1440
ggcaagcagg cgctggagac ggtccagcgg ctgttgccgg tgctgtgcca ggcccacggc 1500
ttgaccccgg agcaggtggt ggccatcgcc agcaatattg gtggcaagca ggcgctggag 1560
acggtgcagg cgctgttgcc ggtgctgtgc caggcccacg gcttgacccc ccagcaggtg 1620
gtggccatcg ccagcaatgg cggtggcaag caggcgctgg agacggtcca gcggctgttg 1680
ccggtgctgt gccaggccca cggcttgacc ccggagcagg tggtggccat cgccagcaat 1740
attggtggca agcaggcgct ggagacggtg caggcgctgt tgccggtgct gtgccaggcc 1800
cacggcttga ccccccagca ggtggtggcc atcgccagca atggcggtgg caagcaggcg 1860
ctggagacgg tccagcggct gttgccggtg ctgtgccagg cccacggctt gaccccggag 1920
caggtggtgg ccatcgccag ccacgatggc ggcaagcagg cgctggagac ggtccagcgg 1980
ctgttgccgg tgctgtgcca ggcccacggc ttgacccctc agcaggtggt ggccatcgcc 2040
agcaatggcg gcggcaggcc ggcgctggag agcattgttg cccagttatc tcgccctgat 2100
ccggcgttgg ccgcgttgac caacgaccac ctcgtcgcct tggcctgcct cggcgggcgt 2160
cctgcgctgg atgcagtgaa aaagggattg ggggatccta tcagccgttc ccagctggtg 2220
aagtccgagc tggaggagaa gaaatccgag ttgaggcaca agctgaagta cgtgccccac 2280
gagtacatcg agctgatcga gatcgcccgg aacagcaccc aggaccgtat cctggagatg 2340
aaggtgatgg agttcttcat gaaggtgtac ggctacaggg gcaagcacct gggcggctcc 2400
aggaagcccg acggcgccat ctacaccgtg ggctccccca tcgactacgg cgtgatcgtg 2460
gacaccaagg cctactccgg cggctacaac ctgcccatcg gccaggccga cgaaatgcag 2520
aggtacgtgg aggagaacca gaccaggaac aagcacatca accccaacga gtggtggaag 2580
gtgtacccct ccagcgtgac cgagttcaag ttcctgttcg tgtccggcca cttcaagggc 2640
aactacaagg cccagctgac caggctgaac cacatcacca actgcaacgg cgccgtgctg 2700
tccgtggagg agctcctgat cggcggcgag atgatcaagg ccggcaccct gaccctggag 2760
gaggtgagga ggaagttcaa caacggcgag atcaacttcg cggccgactg ataa 2814
<210> 24
<211> 2832
<212> DNA
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический полинуклеотид
<400> 24
atgggcgatc ctaaaaagaa acgtaaggtc atcgataagg agaccgccgc tgccaagttc 60
gagagacagc acatggacag catcgatatc gccgatctac gcacgctcgg ctacagccag 120
cagcaacagg agaagatcaa accgaaggtt cgttcgacag tggcgcagca ccacgaggca 180
ctggtcggcc acgggtttac acacgcgcac atcgttgcgt taagccaaca cccggcagcg 240
ttagggaccg tcgctgtcaa gtatcaggac atgatcgcag cgttgccaga ggcgacacac 300
gaagcgatcg ttggcgtcgg caaacagtgg tccggcgcac gcgctctgga ggccttgctc 360
acggtggcgg gagagttgag aggtccaccg ttacagttgg acacaggcca acttctcaag 420
attgcaaaac gtggcggcgt gaccgcagtg gaggcagtgc atgcatggcg caatgcactg 480
acgggtgccc cgctcaactt gaccccggag caggtggtgg ccatcgccag ccacgatggc 540
ggcaagcagg cgctggagac ggtccagcgg ctgttgccgg tgctgtgcca ggcccacggc 600
ttgacccccc agcaggtggt ggccatcgcc agcaatggcg gtggcaagca ggcgctggag 660
acggtccagc ggctgttgcc ggtgctgtgc caggcccacg gcttgacccc ggagcaggtg 720
gtggccatcg ccagccacga tggcggcaag caggcgctgg agacggtcca gcggctgttg 780
ccggtgctgt gccaggccca cggcttgacc ccggagcagg tggtggccat cgccagcaat 840
attggtggca agcaggcgct ggagacggtg caggcgctgt tgccggtgct gtgccaggcc 900
cacggcttga ccccccagca ggtggtggcc atcgccagca ataatggtgg caagcaggcg 960
ctggagacgg tccagcggct gttgccggtg ctgtgccagg cccacggctt gaccccggag 1020
caggtggtgg ccatcgccag ccacgatggc ggcaagcagg cgctggagac ggtccagcgg 1080
ctgttgccgg tgctgtgcca ggcccacggc ttgacccccc agcaggtggt ggccatcgcc 1140
agcaatggcg gtggcaagca ggcgctggag acggtccagc ggctgttgcc ggtgctgtgc 1200
caggcccacg gcttgacccc ccagcaggtg gtggccatcg ccagcaataa tggtggcaag 1260
caggcgctgg agacggtcca gcggctgttg ccggtgctgt gccaggccca cggcttgacc 1320
ccccagcagg tggtggccat cgccagcaat aatggtggca agcaggcgct ggagacggtc 1380
cagcggctgt tgccggtgct gtgccaggcc cacggcttga ccccccagca ggtggtggcc 1440
atcgccagca atggcggtgg caagcaggcg ctggagacgg tccagcggct gttgccggtg 1500
ctgtgccagg cccacggctt gaccccggag caggtggtgg ccatcgccag caatattggt 1560
ggcaagcagg cgctggagac ggtgcaggcg ctgttgccgg tgctgtgcca ggcccacggc 1620
ttgaccccgg agcaggtggt ggccatcgcc agccacgatg gcggcaagca ggcgctggag 1680
acggtccagc ggctgttgcc ggtgctgtgc caggcccacg gcttgacccc ggagcaggtg 1740
gtggccatcg ccagcaatat tggtggcaag caggcgctgg agacggtgca ggcgctgttg 1800
ccggtgctgt gccaggccca cggcttgacc ccggagcagg tggtggccat cgccagccac 1860
gatggcggca agcaggcgct ggagacggtc cagcggctgt tgccggtgct gtgccaggcc 1920
cacggcttga ccccccagca ggtggtggcc atcgccagca ataatggtgg caagcaggcg 1980
ctggagacgg tccagcggct gttgccggtg ctgtgccagg cccacggctt gacccctcag 2040
caggtggtgg ccatcgccag caatggcggc ggcaggccgg cgctggagag cattgttgcc 2100
cagttatctc gccctgatcc ggcgttggcc gcgttgacca acgaccacct cgtcgccttg 2160
gcctgcctcg gcgggcgtcc tgcgctggat gcagtgaaaa agggattggg ggatcctatc 2220
agccgttccc agctggtgaa gtccgagctg gaggagaaga aatccgagtt gaggcacaag 2280
ctgaagtacg tgccccacga gtacatcgag ctgatcgaga tcgcccggaa cagcacccag 2340
gaccgtatcc tggagatgaa ggtgatggag ttcttcatga aggtgtacgg ctacaggggc 2400
aagcacctgg gcggctccag gaagcccgac ggcgccatct acaccgtggg ctcccccatc 2460
gactacggcg tgatcgtgga caccaaggcc tactccggcg gctacaacct gcccatcggc 2520
caggccgacg aaatgcagag gtacgtggag gagaaccaga ccaggaacaa gcacatcaac 2580
cccaacgagt ggtggaaggt gtacccctcc agcgtgaccg agttcaagtt cctgttcgtg 2640
tccggccact tcaagggcaa ctacaaggcc cagctgacca ggctgaacca catcaccaac 2700
tgcaacggcg ccgtgctgtc cgtggaggag ctcctgatcg gcggcgagat gatcaaggcc 2760
ggcaccctga ccctggagga ggtgaggagg aagttcaaca acggcgagat caacttcgcg 2820
gccgactgat aa 2832
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРАМ, ПОЛУЧЕННЫМ ИЗ 4G7 | 2020 |
|
RU2826051C2 |
| УСТОЙЧИВЫЕ К РИТУКСИМАБУ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2816370C2 |
| КЛЕТКА | 2014 |
|
RU2717984C2 |
| КЛЕТКА | 2014 |
|
RU2732236C2 |
| КЛЕТКА | 2015 |
|
RU2768019C2 |
| CD20 ТЕРАПИЯ, CD22 ТЕРАПИЯ И КОМБИНИРОВАННАЯ ТЕРАПИЯ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) K CD19 | 2016 |
|
RU2752918C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНА, НАЦЕЛЕННЫЕ НА HER2 | 2016 |
|
RU2753695C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНОВ | 2015 |
|
RU2745705C2 |
| Т-КЛЕТКИ С КОСТИМУЛИРУЮЩИМ ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ, НАЦЕЛЕННЫЕ НА IL13Rα2 | 2015 |
|
RU2749922C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1 | 2017 |
|
RU2809160C2 |
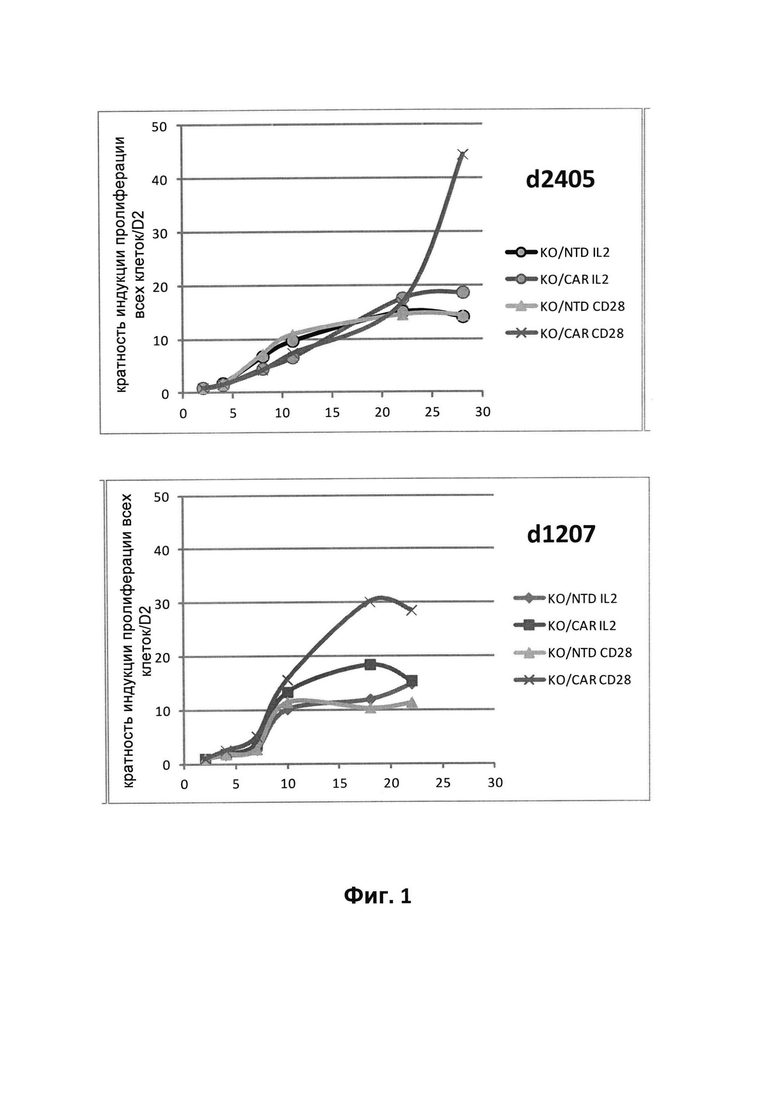
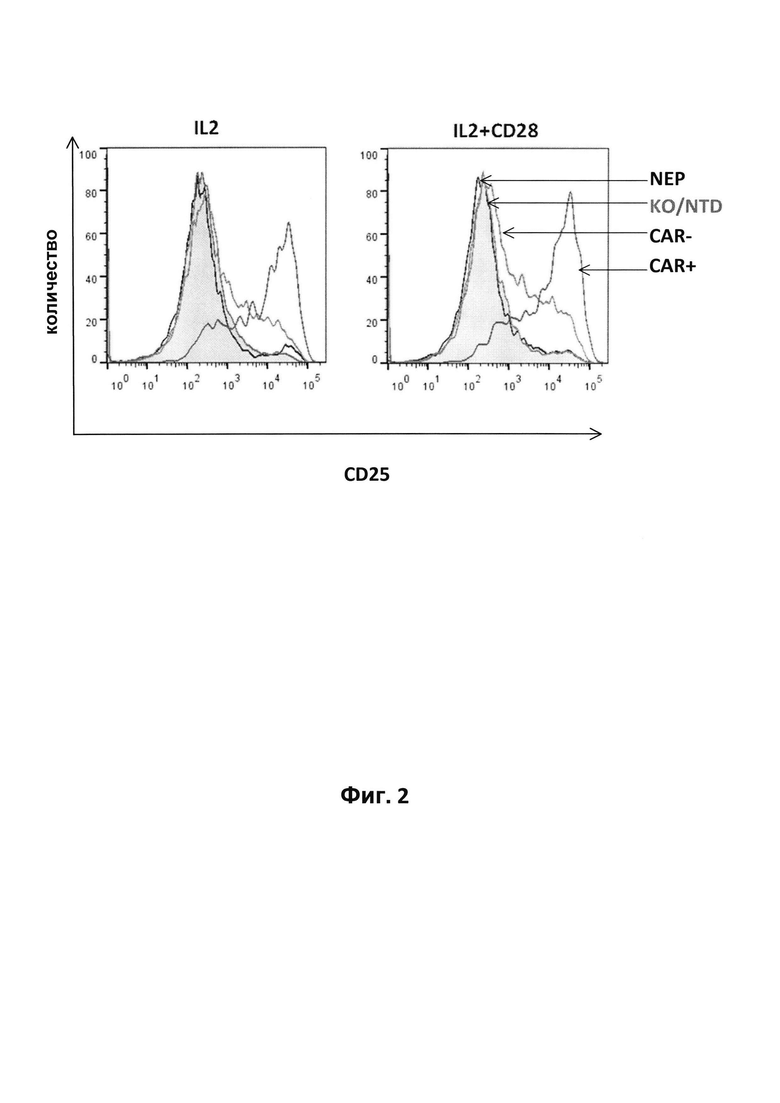

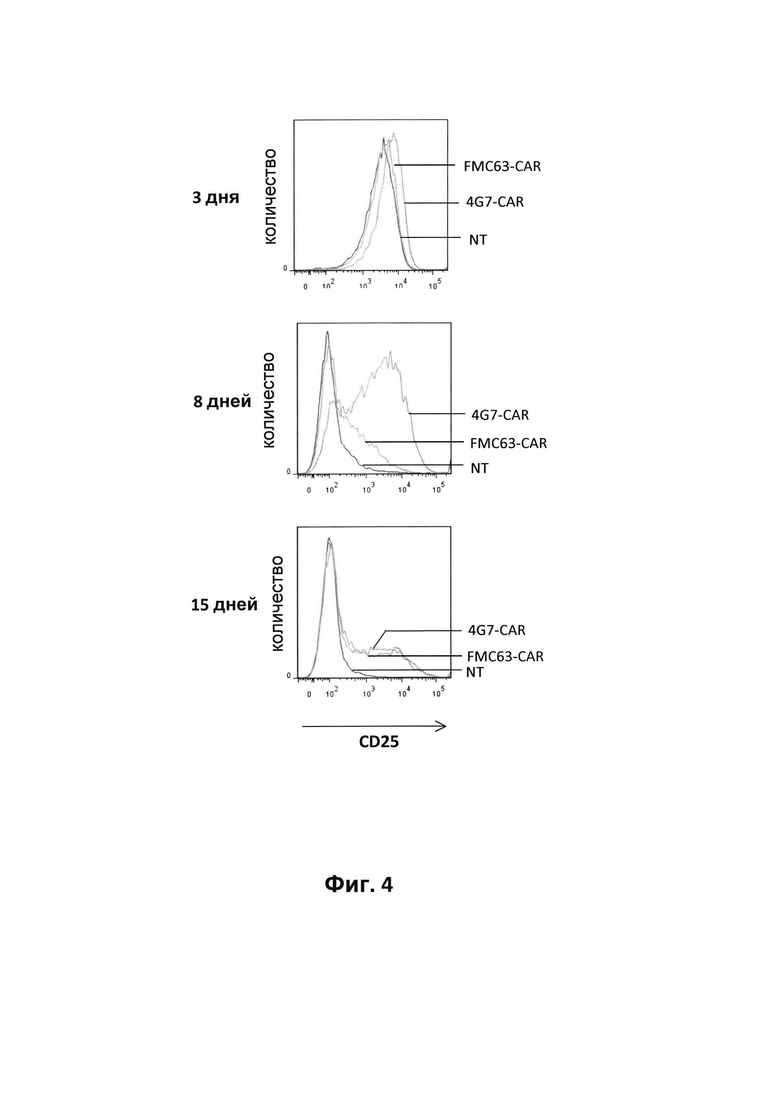
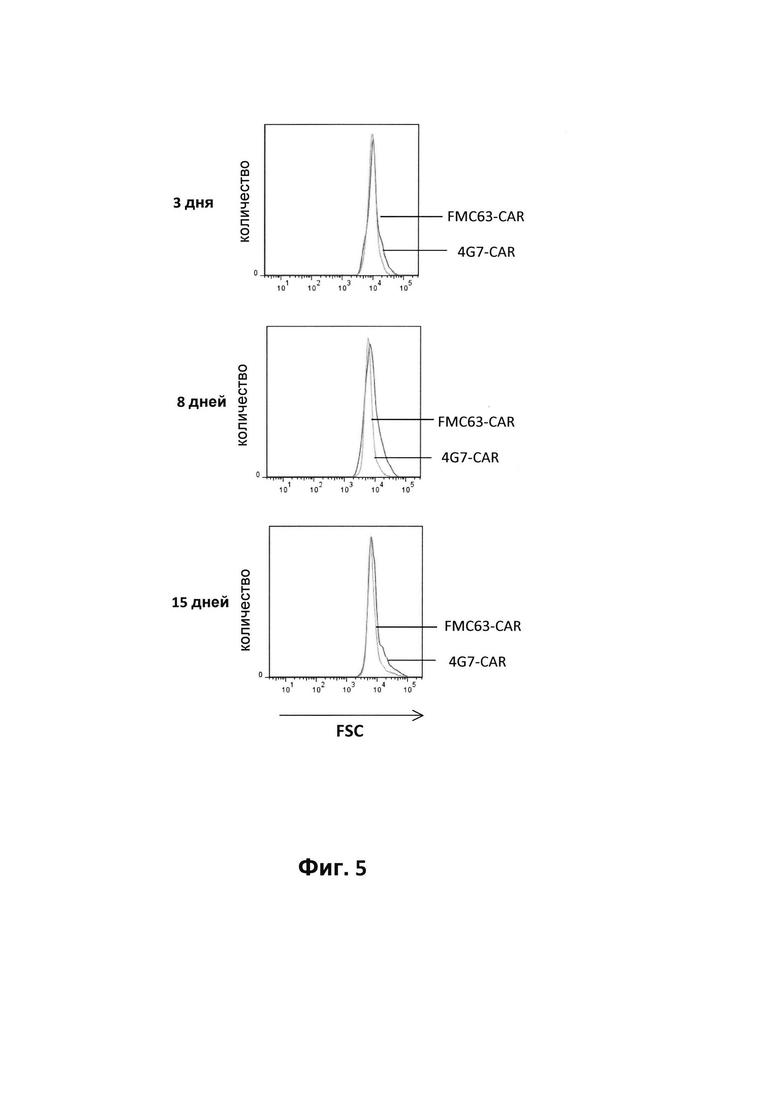
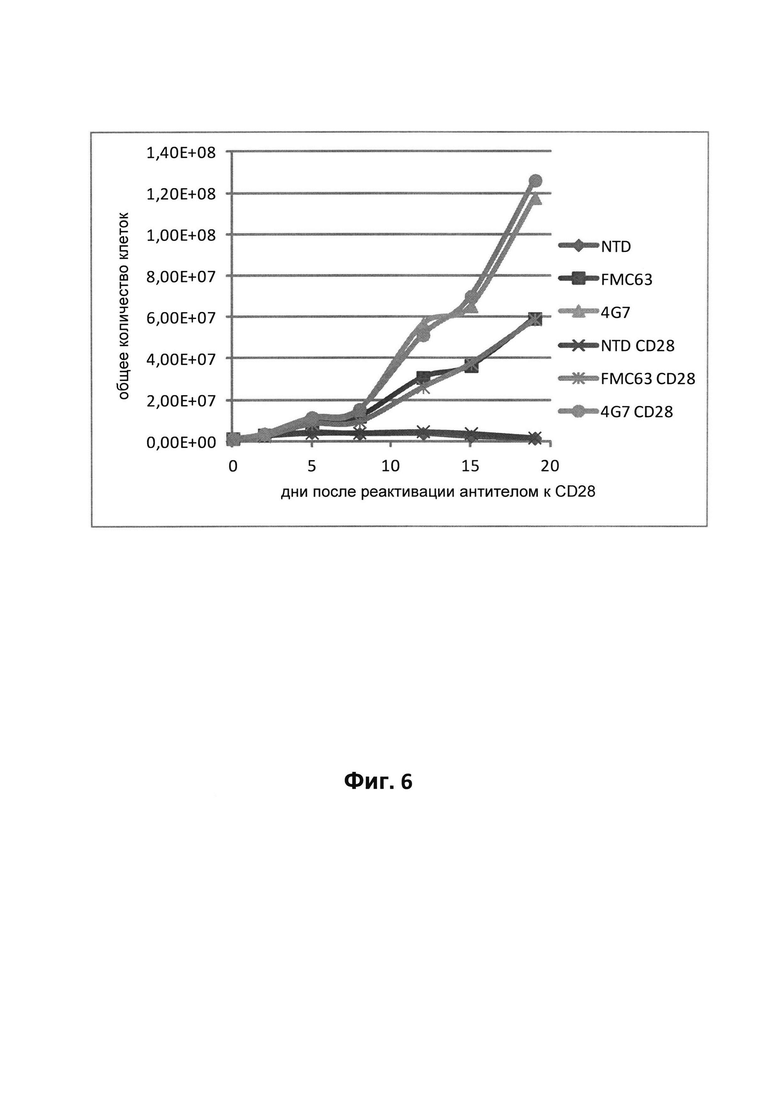
Настоящее изобретение относится к области иммунологии. Предложен CD19-специфичный химерный антигенный рецептор. Также рассмотрены полинуклеотид, экспрессионный вектор, созданные с помощью генетической инженерии Т-лимфоциты. Кроме того, описан способ создания Т-лимфоцита, способы лечения В-клеточной лимфомы или лейкоза. Данное изобретение может найти дальнейшее применение в терапии В-клеточной лимфомы и лейкозы. 8 н. и 18 з.п. ф-лы, 6 ил., 1 табл., 3 пр.
1. СD19-специфичный химерный антигенный рецептор, содержащий по меньшей мере один внеклеточный лиганд-связывающий домен, трансмембранный домен и по меньшей мере один внутриклеточный сигнальный домен, в котором указанный внеклеточный домен содержит одноцепочечный FV-фрагмент, происходящий из моноклонального антитела 4G7, специфичного к CD19, причем указанный одноцепочечный FV-фрагмент содержит вариабельный фрагмент тяжелой цепи моноклонального антитела 4G7, специфичного к CD19, иммуноглобулина гамма 1, представленный в SEQ ID NO: 3, и вариабельный фрагмент легкой каппа-цепи моноклонального антитела 4G7, специфичного к CD19, иммуноглобулина, представленный в SEQ ID NO: 4 или SEQ ID NO: 5.
2. CD19-специфичный химерный антигенный рецептор по п. 1, в котором указанный одноцепочечный FV-фрагмент содержит аминокислотную последовательность SEQ ID NO: 7 или SEQ ID NO: 8.
3. CD19-специфичный химерный антигенный рецептор по п. 1 или 2, в котором указанный внутриклеточный сигнальный домен содержит сигнальный домен CD3 зета.
4. CD19-специфичный химерный антигенный рецептор по п. 1 или 2, в котором указанный внутриклеточный сигнальный домен содержит домен 4-1ВВ.
5. CD19-специфичный химерный антигенный рецептор по п. 1 или 2, где указанный внутриклеточный сигнальный домен содержит CD3 зета сигнальный домен и 4-1ВВ домен.
6. CD19-специфичный химерный антигенный рецептор по .п. 1 или 2, содержащий трансмембранный и «стеблевой» домен альфа-цепи человеческого CD8.
7. CD-19-специфичный химерный антигенный рецептор по п. 1 или 2, содержащий трансмембранный и «стеблевой» домен альфа-цепи человеческого CD8, где указанный внутриклеточный сигнальный домен содержит CD3 зета сигнальный домен.
8. CD-19-специфичный химерный антигенный рецептор по п. 1 или 2, содержащий трансмембранный и «стеблевой» домен альфа-цепи человеческого CD8, где указанный внутриклеточный сигнальный домен содержит домен 4-1ВВ.
9. CD19-специфичный химерный антигенный рецептор по п. 1 или 2, содержащий аминокислотную последовательность, идентичную по меньшей мере на 75%, предпочтительно на 80, 85, 90, 95%, аминокислотной последовательности SEQ ID NO: 14 или 15.
10. CD19-специфичный химерный антигенный рецептор по п. 1 или 2, дополнительно содержащий другой внеклеточный лиганд-связывающий домен, не обладающий специфичностью в отношении CD19.
11. Полинуклеотид, кодирующий указанный химерный антигенный рецептор по одному из пп. 1-10.
12. Полинуклеотид по п. 11, содержащий нуклеотидную последовательность, идентичную по меньшей мере на 75%, предпочтительно на 80, 85, 90, 95%, нуклеотидной последовательности SEQ ID NO: 17.
13. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 11 или 12.
14. Созданный с помощью генетической инженерии Т-лимфоцит, экспрессирующий на мембране клеточной поверхности CD19-специфичный химерный антигенный рецептор, который содержит по меньшей мере один внеклеточный лиганд-связывающий домен и по меньшей мере один внутриклеточный сигнальный домен, где указанный внеклеточный домен содержит одноцепочечный FV-фрагмент, происходящий из моноклонального антитела 4G7, специфичного в отношении CD19, причем указанный одноцепочечный FV-фрагмент содержит вариабельный фрагмент тяжелой цепи моноклонального антитела 4G7, специфичного к CD19, иммуноглобулина гамма 1, представленный в SEQ ID NO: 3, и вариабельный фрагмент легкой каппа-цепи моноклонального антитела 4G7, специфичного к CD19, иммуноглобулина, представленный в SEQ ID NO: 4 или SEQ ID NO: 5.
15. Созданный с помощью генетической инженерии Т-лимфоцит по п. 14, где указанный одноцепочечный FV-фрагмент содержит аминокислотную последовательность SEQ ID NO: 7 или 8.
16. Созданный с помощью генетической инженерии Т-лимфоцит, экспрессирующий на мембране клеточной поверхности CD19-специфичный химерный антигенный рецептор по одному из пп. 1-10.
17. Созданный с помощью генетической инженерии Т-лимфоцит по п. 14 или 16, дополнительно содержащий другой химерный антигенный рецептор, который не обладает специфичностью в отношении CD19.
18. Созданный с помощью генетической инженерии Т-лимфоцит по п. 14 или 16, выбранный из группы, состоящей из CD4+ Т-лимфоцитов и CD8+ Т-лимфоцитов.
19. Созданный с помощью генетической инженерии Т-лимфоцит по п. 14 или 16, полученный от здорового донора.
20. Созданный с помощью генетической инженерии Т-лимфоцит по п. 14 или 16, полученный от пациента, у которого диагностирован рак.
21. Созданный с помощью генетической инженерии Т-лимфоцит по п. 14 или 16, предназначенный для применения в терапии.
22. Созданный с помощью генетической инженерии Т-лимфоцит по п. 14 или 16, предназначенный для применения при В-клеточной лимфоме или лейкозе.
23. Способ создания Т-лимфоцита, включающий:
(а) получение Т-лимфоцита,
(б) введение в указанный Т-лимфоцит по меньшей мере одного полинуклеотида, кодирующего CD19 специфичный химерный антигенный рецептор по любому из пп. 1-10,
(в) экспрессию на поверхности указанного Т-лимфоцита указанного CD19-специфичного химерного антигенного рецептора.
24. Способ создания Т-лимфоцита по п. 23, включающий:
(а) получение Т-лимфоцита,
(б) введение в указанный Т-лимфоцит по меньшей мере одного полинуклеотида, кодирующего указанный CD19-специфичный химерный антигенный рецептор,
(в) введение по меньшей мере одного другого химерного антигенного рецептора, не обладающего специфичностью в отношении CD19.
25. Способ лечения В-клеточной лимфомы или лейкоза у нуждающегося в этом пациента, заключающийся в:
(а) получении Т-лимфоцита от указанного пациента;
(б) введении в указанный Т-лимфоцит по меньшей мере одного полинуклеотида, кодирующего CD19-специфичный химерный антигенный рецептор по любому из пп. 1-10, который экспрессируется на поверхности указанного Т-лимфоцита; и
(в) введении указанного Т-лимфоцита, сконструированного с помощью генной инженерии, указанному пациенту.
26. Способ лечения В-клеточной лимфомы или лейкемии у нуждающегося в этом пациента, включающий:
а) получение Т-лимфоцита от здорового донора;
б) инактивирование по меньшей мере одного гена, экспрессирующего один компонент Т-клеточного рецептора (TCR) в указанный Т-лимфоцит;
в) введение в указанный Т-лимфоцит по меньшей мере одного полинуклеотида, кодирующего CD19-специфичный химерный антигенный рецептор по любому из пп. 1-10, который экспрессируется на поверхности указанного Т-лимфоцита; и
г) введение указанного Т-лимфоцита, сконструированного с помощью генной инженерии, указанному пациенту.
| US 20100272723 A1, 28.10.2010 | |||
| WO 2009091826 A2, 23.07.2009 | |||
| US 20040126363 A1, 01.07.2004 | |||
| US 20130071414 A1, 21.03.2013 | |||
| WO 2012129514 A1, 27.09.2012 | |||
| WO 2010025177 A1, 04.03.2010 | |||
| WO 2012050374 A2, 19.04.2012 | |||
| CD19-СВЯЗЫВАЮЩИЕ СРЕДСТВА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2476441C2 |
Авторы
Даты
2020-07-21—Публикация
2014-05-12—Подача