Область техники
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии.
Уровень техники
Генная терапия - это современный медицинский подход, направленный на лечение наследственных и приобретенных заболеваний путем введения нового генетического материала в клетки пациента с целью компенсации или подавления функции мутантного гена и/или исправления генетического дефекта. Конечным продуктом экспрессии гена может являться молекула РНК или белка. Однако осуществление большей части физиологических процессов в организме связано с функциональной активностью белковых молекул, тогда как молекулы РНК являются либо промежуточным продуктом в синтезе белков, либо осуществляют регуляторные функции. Таким образом, целью генной терапии является, в большинстве случаев, введение в организм генов, обеспечивающих транскрипцию и последующую трансляцию белковых молекул, кодируемых этими генами. В рамках описания настоящего изобретения под экспрессией гена подразумевается продукция белковой молекулы, аминокислотная последовательность которой кодируется этим геном.
Гены SHH, CTNNB1, WNT7A, NOG (другое название NOGG), входящие в группу генов, играют ключевую роль в ряде процессов в организме человека и животных. Показана связь низких/недостаточных концентраций этих белков с различными неблагоприятными состояниями человека, которая, в ряде случаев, подтверждена нарушениями в нормальной экспрессии генов, кодирующих эти белки. Таким образом, повышение экспрессии гена, выбранного из группы генов SHH, CTNNB1, WNT7A, NOG (другое название NOGG), обладает потенциалом для коррекции различных состояний человека и животных.
Ген SHH (другое название гена - HPE3) кодирует белок SHH (Sonic Hedgehog), который необходим для процесса эмбриогенеза и регулирует рост клеток, дифференциацию и нормальное формирование органов, в том числе, пространственное. Этот белок важен для развития головного и спинного мозга (центральной нервной системы), глаз, конечностей и других частей тела.
Sonic Hedgehog необходим для развития передней части мозга и участвует в пространственном разделении правой и левой стороны переднего мозга (формирование средней линии вентральной поверхности). Также Sonic Hedgehog и другие сигнальные белки регулируют формирование правой и левой половин (полушарий) головного мозга и пары глаз.
Мутации в гене SHH и недостаточная активность белка SHH в процессе эмбриогенеза приводят к голопрозэнцефалии - тяжелому нарушению формирования мозга, при котором фиксируется полное или частичное отсутствие разделения на полушария в сочетании с другими пороками развития головы и лица. Наблюдаются генерализованные судороги и другие нарушения. Хотя большая часть таких пациентов погибает внутриутробно или в младенческом возрасте, некоторые пациенты, как правило гетерозиготные по мутациям в гене SHH, отличаются менее выраженными симптомами и, при условии сопутствующей терапии, доживают до взрослого возраста (Weiss K et al. // Genet Med. 2018 Jan;20(1):14-23).
Другими наследственным заболеваниями, вызванным мутациями в гене SHH, являются микрофтальмия и колобома, для которой характерно изолированное или комбинированное расщепление радужки, сетчатки, сосудистой оболочки, зрительного нерва или века. При данных патологиях возможна коррекция с сохранением зрения, работоспособности и качества жизни пациентов (Reis LM, Semina EV // Birth Defects Res C Embryo Today. 2015 Jun;105(2):96-113).
Описанные синдромы сопряжены с нарушениями, развивающимися в ходе постнатального развития. Генотерапевтические подходы к предотвращению и поддерживающей терапии таких наследственных заболеваний в настоящее время только начали разрабатываться, но, возможно, в сочетании с технологиями редактирования генома станут возможны в будущем (Ma H et al. // Nature. 2017 Aug 24;548(7668):413-419).
Снижение экспрессии гена SHH может быть вызвано соматическими мутациями или нарушениями в регуляции, не связанными напрямую с белок-кодирующей последовательностью гена. Результатом чего могут быть различные заболевания, патологические и дефицитные состояния организма, коррекция которых возможна, в том числе с использованием генотерапевтического подхода. Так, например, ген SHH участвует в процессе миогенеза, в том числе в репарации и восстановлении повреждений мышечной ткани, а генотерапевтический подход с использованием ДНК-вектора, экспрессирующего ген SHH, приводил к улучшению заживления индуцированного инфаркта миокарда у мышей (Roncalli J et al. // Journal of the American College of Cardiology. 2011;57(24):2444-2452). Более того, клеточная терапия с использованием CD34+ клеток, гиперэкспрессирующих ген SHH, также приводила к лучшему заживлению повреждений миокарда у животных (Ahmed et al. // PLoS ONE, 2010, 5(1), e8576).
Внутрикожное введение мышам генотерапевтического ДНК-вектора pCS2-SHH, экспрессирующего ген SHH, приводило к ускорению заживления ран и способствовало ангиогенезу в зоне повреждений (Park HJ et al. // Biomaterials. 2012 Dec;33(35):9148-56).
Формирование волосяных фолликулов и их активность также регулируется геном SHH. Мыши нокаутные по гену SHH характеризуются полным отсутствием шерсти, при этом экспрессия трансгена SHH восстанавливает волосяной покров животных (Cui CY et al. // Cell Cycle. 2011 Oct 1;10(19):3379-86). Топические аппликации молекулы-агониста SHH приводили к активации волосяных фолликулов у мышей, что является основой для разработки препаратов на основе SHH против алопеции у человека (Paladini RD et al. // J Invest Dermatol.2005 Oct;125(4):638-46).
Ген CTNNB1 кодирует белок - катенин бета 1 (или бета-катенин), который участвует в формировании свойства адгезивности эпителиальных клеток и формировании целостности покровных тканей. Описано несколько клинических случаев de novo мутаций этого гена, приводящих к потере его экспрессии. Фенотип таких пациентов характеризуется постнатальной микроцефалией и рядом нейродегенеративных нарушений (Kharbanda M et al. // Eur J Med Genet. 2017 Feb;60(2):130-135).
Экспрессия гена также значительно снижена в геморрагических постинсультных бляшках, что может свидетельствовать о роли CTNNB1 в патогенезе нарушений гематоэнцефалического барьера за счет снижения адгезивных функций эндотелиальных клеток (Tran KA et al. // Circulation. 2016 Jan 12;133(2):177-86).
Транскриптомный анализ у пациентов с остеопорозом выявил корреляцию сниженной экспрессии гена CTNNB1 с нарушениями дифференциации остеобластов и формирования костей (Zhang Y et al. // Eur Rev Med Pharmacol Sci. 2016;20(3):433-40). А при псевдоартрозе бета-катенин рассматривается как одна из основных терапевтических молекул (Ghadakzadeh S et al. // FASEB J. 2016 Sep;30(9):3227-37).
Некоторые мутации в гене CTNNB1 ассоциированы с раковыми опухолями, в частности, делеция гена CTNNB1 характерна для мезотелиом, а трансфекция ДНК-вектором, экспрессирующим этот ген, восстанавливает нормальный фенотип клеток в условиях in vitro (Usami N et al. // Oncogene. 2003 Sep 11;22(39):7923-30).
В другой экспериментальной работе было показано, что экспрессия гена CTNNB1 защищает клетки от метаболического стресса при ишемии почки (Wang Z et al. // J Am Soc Nephrol. 2009 Sep;20(9):1919-28).
Генотерапевтический подход с использование рекомбинантного аденовирусного вектора, экспрессирующего ген CTNNB1, показал свою эффективность в заживлении тканей после инфаркта миокарда за счет протекции и активации как клеток миоцитов, так и фибробластов в зоне повреждения (Hahn JY et al. // J Biol Chem. 2006 Oct 13;281(41):30979-89).
При изучении процесса дифференциации и роста волосковых клеток органа Корти, являющихся основным компонентом слухового и вестибулярного аппарата всех млекопитающих, было показано, что экспрессия CTNNB1 необходима для регуляции транскрипционных факторов Wnt1 и Atoh1. Белок катенин бета 1 играет ключевую роль в образовании клеток-предшественников волосковых клеток, а в отсутствии экспрессии гена CTNNB1 у мышей не происходит их образования (Shi F et al. // J Neurosci. 2014 May 7;34(19):6470-9). In vivo подход, позволяющий вносить единичную мутацию в ген CTNNB1, которая увеличивает стабильность белка катенина бета 1 и его концентрацию в ткани, приводил к повышению количества волосковых клеток у мышей и может рассматриваться как основа для разработки терапевтических средств для коррекции нарушений функции слухового и вестибулярного аппарата (Yeh WH et al. // Nat Commun. 2018 Jun 5;9(1):2184).
Интересно, что пигментация и окраска волос также зависят от экспрессии гена CTNNB1 и, в экспериментах на мышах, было показано, что, воздействуя на уровень экспрессии CTNNB1, возможно получать животных с различным окрасом волосяного покрова (Enshell-Seijffers D et al. // Proc Natl Acad Sci U S A. 2010 Dec 14;107(50):21564-9).
Формирование и созревание волосяных фолликулов также проходит с участием катенина 1 бета. Хотя данные о патогенетической роли экспрессии гена CTNNB1 при потере волосяного покрова, в том числе алопеции, неоднозначны (Fiuraskova M et al. // Arch Dermatol Res. 2005 Sep;297(3):143-6), клинические испытания некоторых молекул, стимулирующих катенин бета 1, показали эффективность в увеличении как числа волос, так и их качества (Tosti A et al. // J Cosmet Dermatol. 2016 Dec;15(4):469-474).
Ген NOG (другое название NOGG) кодирует секретируемый белок NOG, являющийся плейотропным фактором. Белок NOG участвует в формировании нервной трубки, зубов, волосяных фолликулов, глаз, костей и суставов. Нокаутные по гену NOG животные погибают в процессе раннего эмбриогенеза, однако известны мутации, которые связаны с различными заболеваниями человека и животных. Например, проксимальный симфалангизм (отсутствие разделения фаланг пальцев) является одной из фенотипических форм проявления мутаций в гене NOG. Другим проявлением мутаций гена NOG является потеря слуха в детском возрасте из-за анкилозов костей уха. Интересно, что топические аппликации белка NOG могут менять фенотип зубов, вызывая рост маляров вместо резцов (Tucker AS, Matthews KL, Sharpe PT // Science 1998;282:1136–8).
Недостаточная экспрессия гена NOG связана с нарушением баланса клеток, образующих костную ткань, у больных анкилозирующим спондилитом (Xie Z et al. // Arthritis Rheumatol. 2016 Feb;68(2):430-40). Также с использованием генетически модифицированных клеток, экспрессирующих ген NOG, была показана возможность предотвращения ресиностоза костей после хирургического вмешательства (Cooper GM et al. // Plast Reconstr Surg. 2009 Feb;123(2 Suppl):94S-103S). Похожие результаты по предотвращению избыточной оссификации были получены с использованием рекомбинантного аденовирусного вектора, экспрессирующего ген NOG (Glaser et al. // 48th Annual Meeting of the Orthopaedic Research Society; Poster No: 0493).
В экспериментальной работе на мышах было показано, что введение рекомбинантного белка NOG ускоряет регенерацию тканей и восстановление нормальной функции мозга после ишемического инсульта (Shin JA et al. // Brain Behav Immun. 2014 Aug;40:143-54).
В тканях кожи экспрессия гена NOG необходима для активации роста волосяных фолликулов, а молекулярный механизм этого процесса связан, в том числе, с увеличением экспрессии гена SHH, описанного выше (Botchkarev VA et al. // FASEB J. 2001 Oct;15(12):2205-14). В небольшом клиническом эксперименте у женщин с алопецией было показано, что топические аппликации смеси ростовых факторов, в том числе белка NOG, с последующей микроигловой терапией позволяли добиться клинически значимых результатов, а также повышения удовлетворенности пациентов (Lee YB et al. // J Dermatol. 2013 Jan;40(1):81-3).
В экспериментальной модели болезни Хантингтона у крыс использование аденоассоциированного вирусного вектора, экспрессирующего ген NOG, стимулировало рост нейронов и позволило замедлить прогрессию этого заболевания (Benraiss A et al. // Gene Ther. 2012 May;19(5):483-93).
Ген WNT7A кодирует секретируемый сигнальный белок WNT7A. Этот ген является членом семейства генов WNT, которые вовлечены в онкогенез и в некоторые процессы развития организма, в том числе в регуляцию дифференцировки клеток и паттернов во время эмбриогенеза. Также ген WNT7A участвует в развитии передней-задней оси во время формирования женского репродуктивного тракта и играет ключевую роль в функциональной активности гладких мышц матки. Мутации в этом гене связаны с синдромами Фурманна и синдрома фокомелии Аль-Авади/Рааса- Ротшильда/Шинцеля, а также вовлечен в патогенез некоторых заболеваний и состояний, неблагоприятных для организма.
При анализе биопсийных образцов кишечника, пораженных язвенным колитом, было установлено, что экспрессия гена WNT7A значительно снижена в сравнении с образцами тканей из здоровых участков (You J et al. // Dig Dis Sci. 2008 Apr;53(4):1013-9).
При мышечной дистрофии Дюшена введение белка WNT7A увеличивало функциональную активность и улучшало морфологические характеристики мышечных волокон (von Maltzahn J et al. // Proc Natl Acad Sci U S A. 2012 Dec 11;109(50):20614-9). В другом исследовании было показано, что при введении в мышцы клеток, стимулированных WNT7A, также наблюдается увеличение мышечной массы и функциональной активности (Bentzinger CF et al. // J Cell Biol. 2014 Apr 14;205(1):97-111).
Образование волосяных фолликулов в процессе рубцевания ран в значительной степени повышается при гиперэкспрессии гена WNT7A (Ito et al. // Nature, vol. 447, no. 7142, pp.316–320, 2007). В другой работе было показано, что введение в область раны клеток, экспрессирующих WNT7A, приводило к ускорению заживления раны и регенерации роста волос за счет изменения клеточного микроокружения и межклеточных взаимодействий (Dong et al. // Stem Cells Int. 2017;2017:3738071).
Таким образом предшествующий уровень техники свидетельствует о том, что мутации в генах SHH, CTNNB1, NOG, WNT7A или недостаточная экспрессия белков, кодируемых этими генами, связаны с развитием спектра заболеваний, включающих в себя, но не ограничивающихся, аллопецией, аутоиммунными заболеваниями, раком, наследственными и приобретенными патологическими состояниями, такими как повреждения соединительной ткани, и другими процессами. Этим обусловлено объединение генов SHH, CTNNB1, NOG, WNT7A в рамках данного патента в группу генов. Генетические конструкции, обеспечивающие экспрессию белков, кодируемых генами из группы SHH, CTNNB1, NOG, WNT7A, могут быть использованы для разработки лекарственных препаратов для предотвращения и терапии различных заболеваний и патологических состояний.
Более того, приведенные данные свидетельствуют о том, что недостаточная экспрессия белков, кодируемых генами SHH, CTNNB1, NOG, WNT7A, входящими в группу генов, связана не только с патологическими состояниями, но и с предрасположенностью к их развитию. Также приведенные данные свидетельствуют о том, что недостаточная экспрессия данных белков может не проявляться в явном виде в форме патологии, которая может быть однозначно описана в рамках существующих стандартов клинической практики (например, с применением кода МКБ), однако при этом вызывать состояния, которые неблагоприятны для человека и животных и связанны с ухудшением качества жизни.
Анализ подходов для повышения экспрессии целевых генов подразумевает возможность использования различных генотерапевтических векторов.
Генотерапевтические векторы разделяют на вирусные, клеточные и ДНК-векторы (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products EMA/CAT/80183/2014). В последнее время в генной терапии все большее внимание уделяется разработке невирусных систем доставки генетического материала, среди которых лидируют плазмидные векторы. Плазмидные векторы лишены недостатков, присущих клеточным и вирусным векторам. В клетке-мишени они существуют в эписомальной форме, не интегрируют в геном, производство их достаточно дешево, отсутствие иммунного ответа и побочных реакций на введение плазмидного вектора делают их удобным инструментом генной терапии и генетической профилактики (ДНК-вакцины) (Li L, Petrovsky N. // Expert Rev Vaccines. 2016;15(3):313-29).
Тем не менее, ограничениями для использования плазмидных векторов для генной терапии являются: 1) наличие генов устойчивости к антибиотикам для наработки в бактериальных штаммах, 2) наличие различных регуляторных элементов, представленных последовательностями вирусных геномов 3) размер терапевтического плазмидного вектора, определяющий эффективность проникновения вектора в клетку-мишень.
Известно, что Европейское агентство по лекарственным средствам считает необходимым избегать введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies). Данная рекомендация связана, в первую очередь, с потенциальной опасностью проникновения ДНК-вектора или горизонтального переноса генов антибиотикорезистентности в клетки бактерий, представленных в организме в составе нормальной или оппортунистической микрофлоры. Помимо этого, наличие генов антибиотикорезистентности значительно увеличивает размер ДНК-вектора, что приводит к снижению эффективности его проникновения в эукариотические клетки.
Необходимо отметить, что гены антибиотикорезистентности также вносят принципиальный вклад в способ получения ДНК-векторов. В случае наличия генов антибиотикорезистентности штаммы для наработки ДНК-векторов обычно культивируются в среде, содержащей селективный антибиотик, что создает риск наличия следовых количеств антибиотика в недостаточно очищенных препаратах ДНК-векторов. Таким образом, получение ДНК-векторов для генной терапии, в которых отсутствуют гены антибиотикорезистентности, связано с получением штаммов, обладающих такой отличительной особенностью как способность к стабильной амплификации целевых ДНК-векторов в среде без содержания антибиотиков.
Кроме того, Европейское Медицинское Агентство рекомендует избегать наличия в составе терапевтических плазмидных векторов регуляторных элементов для повышения экспрессии целевых генов (промоторов, энхансеров, посттрансляционных регуляторных элементов), являющихся нуклеотидными последовательностями геномов различных вирусов (Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products,http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf). Данные последовательности, хотя и могут увеличивать уровень экспрессии целевого трансгена, однако создают риск рекомбинации с генетическим материалом вирусов дикого типа и интеграции в геном эукариотической клетки. Более того, целесообразность гиперэкспрессии того или иного гена в целях терапии остается нерешенным вопросом.
Также, существенным моментом является размер терапевтического вектора. Известно, что современные плазмидные векторы зачастую перегружены нефункциональными участками, серьезно увеличивающими размер вектора (Mairhofer J, Grabherr R. // Mol Biotechnol. 2008.39(2):97-104). Например, ген устойчивости к ампициллину в векторах серии pBR322, как правило, состоит из не менее чем 1000 п.н., что составляет более 20% от размера самого вектора. При этом наблюдается обратная зависимость между размером вектора и его способностью проникать в эукариотические клетки - ДНК-векторы с небольшим размером эффективней проникаю в клетки человека и животных. Так, например, в серии экспериментов по трансфекции клеток HeLa ДНК-векторами с размером от 383 до 4548 п.н. было показано, что разница в эффективности проникновения может достигать двух порядков (отличаться в 100 раз) (Hornstein BD et al. // PLoS ONE. 2016;11(12): e0167537.).
Таким образом, при выборе ДНК-вектора в целях безопасности и наибольшей эффективности следует отдавать предпочтение тем конструкциям, в которых не содержатся гены устойчивости к антибиотикам, последовательности вирусного происхождения и размер которых позволяет эффективно проникать в эукариотические клетки. Штамм для получения такого ДНК-вектора в количествах, достаточных для целей генной терапии, должен обеспечивать возможность стабильной амплификации ДНК-вектора с использованием питательных сред, не содержащих антибиотики.
Примером использования рекомбинантных ДНК-векторов для генной терапии является способ получения рекомбинантного вектора для генетической иммунизации по патенту US 9550998 В2. Плазмидный вектор представляет собой суперскрученную ДНК и предназначен для экспрессии клонированных генов в клетках животных и человека. Вектор состоит из ориджина репликации, регуляторных элементов, включающих промотор и энхансер цитомегаловируса человека, регуляторные элементы из Т-лимфотропного вируса человека.
Накопление вектора проводят в специальном штамме E.coli без использования антибиотиков за счет антисенс-комплементации гена sacB, введенного в штамм посредством бактериофага. Недостатком данного изобретения является наличие в составе ДНК-вектора регуляторных элементов, представляющих собой последовательности вирусных геномов.
Прототипами настоящего изобретения в части использования генотерапевтических подходов для повышения уровня экспрессии генов из группы SHH, CTNNB1, NOG, WNT7A являются следующие заявки.
В заявке US 20060105950 A1 описан метод заживления ран, заключающийся в использовании генотерапевтических ДНК или вирусных векторов, экспрессирующих ген SHH. Недостатком данного метода является неопределенность требований к безопасности используемых векторов и ограниченность способа использования регенерацией повреждений.
В заявке WO 2000031134 A1 описан метод стимулирования роста волос, одним из способов реализации которого является использование векторов, преимущественно вирусных, экспрессирующих ген CTNNB1. Недостатком данного изобретения является ограниченность способа использования только стимуляцией роста волос, неопределенные требования к безопасности используемых векторов, а также ограниченность возможных промоторов, контролирующих экспрессию гена CTNNB1, в число которых не входит промотор EF1a.
В патенте US 5843775 A описано изобретение, представляющее собой вектор, экспрессирующий ген NOG, которое может быть потенциально использовано для создания средств диагностики, терапии и биотехнологии. Недостатком данного изобретения являются неопределенные требования к безопасности используемых векторов, а также их способности проникать и экспрессировать ген в тканях человека и животных.
В заявке WO 2013040341 A2 описана композиция, в основе которой находится белок WNT7A, а также способ ее использования для стимуляции стволовых клеток и регенерации тканей in vitro, ex vivo и in vivo. Одним из вариантов реализации данного изобретения является использование векторов, экспрессирующих ген WNT7A, однако в данной заявке не предъявляется определенных требований к безопасности используемых векторов. Также недостатком данного изобретения является ограниченность реализации способа использования дегенеративными заболеваниями и регенерацией повреждений.
Раскрытие изобретения
Задачей изобретения является конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии группы генов SHH, CTNNB1, NOG (другое название NOGG), WNT7A в организме человека и животных, сочетающих в себе следующие свойства:
I) Эффективность генотерапевтического ДНК-вектора для повышения уровня экспрессии целевых генов в эукариотических клетках.
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов.
III) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности.
IV) Технологичность получения и возможность наработки генотерапевтического ДНК-вектора в промышленных масштабах.
Пункты II и III предусмотрены в данном техническом решении в соответствии с рекомендациями государственных регуляторов к лекарственным средствам для генной терапии, в частности, Европейского Агентства по лекарственным средствам касательно отказа от введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011, EMA/CAT/GTWP/44236/2009 Committee for advanced therapies) и касательно отказа от введения в разрабатываемые плазмидные векторы для генной терапии элементов вирусных геномов (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products / 23 March 2015, EMA/CAT/80183/2014, Committee for Advanced Therapies).
Задачей изобретения также является конструирование штаммов, несущих эти генотерапевтические ДНК-вектора, для наработки и производства в промышленных масштабах генотерапевтических ДНК-векторов.
Поставленная задача решается за счет того, что создан генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A, для повышения уровня экспрессии этого целевого гена в организме человека и животных, при этом генотерапевтический ДНК-вектор VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A имеет нуклеотидную последовательность SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 соответственно. При этом каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки и экспрессировать клонированный в него целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A соответственно. В составе генотерапевтического ДНК-вектора отсутствуют нуклеотидные последовательности вирусного происхождения и отсутствуют гены антибиотикорезистентности, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
Создан также способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген SHH, ген CTNNB1, ген NOG, ген WNT7A, который заключается в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A получают следующим образом: кодирующую часть целевого гена из группы SHH, или CTNNB1, или NOG, или WNT7A клонируют в ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17-SHH, SEQ ID №1, или VTvaf17-CTNNB1, SEQ ID №2, или VTvaf17-NOG, SEQ ID №3, или VTvaf17-WNT7A, SEQ ID №4 соответственно.
Способ применения созданного генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген SHH, ген CTNNB1, ген NOG, ген WNT7A для повышения уровня экспрессии этих целевых генов, заключается во введении выбранного генотерапевтического ДНК-вектора или нескольких выбранных генотерапевтических ДНК-векторов в клетки, органы и ткани человека или животного, и/или во введении в органы и ткани человека или животного аутологичных клеток человека или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором или несколькими выбранными генотерапевтическими ДНК-векторами, или в сочетании обозначенных способов.
Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-SHH, или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A заключается в электропорации компетентных клеток штамма Escherichia coli SCS110-AF созданным генотерапевтическим ДНК-вектором и последующей селекцией стабильных клонов штамма с использованием селективной среды.
Заявлен штамм Escherichia coli SCS110-AF/VTvaf17-SHH, или штамм Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамм Escherichia coli SCS110-AF/VTvaf17-NOG, или штамм Escherichia coli SCS110-AF/VTvaf17-WNT7A, несущий генотерапевтический ДНК-вектор для его наработки с возможностью культивирования штамма без использования антибиотиков.
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора заключается в масштабировании бактериальной культуры штамма до количеств, необходимых для наращивания бактериальной биомассы в промышленном ферментере, после чего биомассу используют для выделения фракции, содержащей целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-SHH или VTvaf17-CTNNB1 или VTvaf17-NOG или VTvaf17-WNT7A многостадийно фильтруют и очищают хроматографическими методами.
Изобретение поясняется чертежами, где:
На фиг. 1
приведена схема генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A, который представляет собой кольцевую двуцепочечную молекулу ДНК, способную к автономной репликации в клетках бактерии Escherichia coli.
На фиг.1 приведены схемы, соответствующие:
A - генотерапевтический ДНК-вектор VTvaf17-SHH,
B - генотерапевтический ДНК-вектор VTvaf17-CTNNB1,
C - генотерапевтический ДНК-вектор VTvaf17-NOG,
D - генотерапевтический ДНК-вектор VTvaf17-WNT7A.
На схемах отмечены следующие структурные элементы вектора:
EF1a - промоторная область гена человеческого фактора элонгации EF1A с собственным энхансером, содержащимся в первом интроне гена. Служит для обеспечения высокого уровня транскрипции рекомбинантного гена в большинстве тканей человека;
Рамка считывания целевого гена, соответствующая кодирующей части гена SHH (фиг. 1A), или CTNNB1 (фиг. 1B), или NOG (фиг. 1C), или WNT7A (фиг. 1D) соответственно;
hGH-TA - терминатор транскрипции и сайт полиаденилирования гена фактора роста человека;
ori - ориджин репликации, служащий для автономной репликации с однонуклеотидной заменой для повышения копийности плазмиды в клетках большинства штаммов Escherichia coli;
RNA-out - регуляторный элемент РНК-out транспозона Tn 10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании штамма Eshcerichia coli SCS 110.
Отмечены уникальные сайты рестрикции.
На фиг.2
показаны графики накопления ампликонов кДНК целевого гена, а именно, гена SHH, в первичной культуре клеток фибробластов кожи человека HDFa (ATCC PCS-201-012) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-SHH с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.2 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена SHH в первичной культуре клеток фибробластов кожи человека HDFa до трансфекции ДНК-вектором VTvaf17-SHH
2 - кДНК гена SHH в первичной культуре клеток фибробластов кожи человека HDFa после трансфекции ДНК-вектором VTvaf17-SHH
3 - кДНК гена B2M в первичной культуре клеток фибробластов кожи человека HDFa до трансфекции ДНК-вектором VTvaf17-SHH
4 - кДНК гена B2M в первичной культуре клеток фибробластов кожи человека HDFa после трансфекции ДНК-вектором VTvaf17-SHH.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 3
показаны графики накопления ампликонов кДНК целевого гена, а именно гена CTNNB1, в первичной культуре первичной культуры кератиноцитов эпидермиса человека HEKa (ATCC PCS-200-011) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-CTNNB1 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.3 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена CTNNB1 в первичной культуре первичной культуры кератиноцитов эпидермиса человека HEKa до трансфекции ДНК-вектором VTvaf17-CTNNB1.
2 - кДНК гена CTNNB1 первичной культуре первичной культуры кератиноцитов эпидермиса человека HEKa после трансфекции ДНК-вектором VTvaf17-CTNNB1.
3 - кДНК гена B2M в первичной культуре первичной культуры кератиноцитов эпидермиса человека HEKa до трансфекции ДНК-вектором VTvaf17-CTNNB1.
4 - кДНК гена B2M первичной культуре первичной культуры кератиноцитов эпидермиса человека HEKa после трансфекции ДНК-вектором VTvaf17-CTNNB1.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.4
показаны графики накопления ампликонов кДНК целевого гена, а именно гена NOG в клетках фибробластов кожи человека линии HT 297.T (ATCC® CRL-7782™) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-NOG с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.4 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена NOG в клетках фибробластов кожи человека линии HT 297.T до трансфекции ДНК-вектором VTvaf17-NOG.
2 - кДНК гена NOG клетках фибробластов кожи человека линии HT 297.T после трансфекции ДНК-вектором VTvaf17-NOG.
3 - кДНК гена B2M клетках фибробластов кожи человека линии HT 297.T до трансфекции ДНК-вектором VTvaf17-NOG.
4 - кДНК гена B2M клетках фибробластов кожи человека линии HT 297.T после трансфекции ДНК-вектором VTvaf17-NOG.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.5
показаны графики накопления ампликонов кДНК целевого гена, а именно гена WNT7A, в первичной культуре клеток меланоцитов эпидермиса человека линии Primary Epidermal Melanocytes; Normal, Human, Adult (HEMa) (ATCC® PCS-200-013™) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-WNT7A с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.5 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена WNT7A в первичной культуре клеток меланоцитов эпидермиса человека HEMa до трансфекции ДНК-вектором VTvaf17-WNT7A.
2 - кДНК гена WNT7A в первичной культуре клеток меланоцитов эпидермиса человека HEMa после трансфекции ДНК-вектором VTvaf17-WNT7A.
3 - кДНК гена B2M в первичной культуре клеток меланоцитов эпидермиса человека HEMa до трансфекции ДНК-вектором VTvaf17-WNT7A.
4 - кДНК гена B2M в первичной культуре клеток меланоцитов эпидермиса человека HEMa после трансфекции ДНК-вектором VTvaf17-WNT7A.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 6
показана диаграмма концентрации белка SHH в клеточном лизате первичной культуры фибробластов кожи человека HDFa (ATCC PCS-201-01) после трансфекции этих клеток ДНК-вектором VTvaf17-SHH с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка SHH в лизате клеток.
На фиг.6 отмечены следующие элементы:
культура А - культура клеток первичных фибробластов кожи человека HDFa, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток первичных фибробластов кожи человека HDFa, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток первичных фибробластов кожи человека HDFa, трансфицированных ДНК-вектором VTvaf17-SHH.
На фиг.7
показана диаграмма концентрации белка CTNNB1 в лизате клеток первичной культуры кератиноцитов эпидермиса человека HEKa (ATCC PCS-200-01), после трансфекции этих клеток ДНК-вектором VTvaf17-CTNNB1 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CTNNB1.
На фиг.7 отмечены следующие элементы:
культура А - первичная культура клеток кератиноцитов эпидермиса человека HEKa, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - первичная культура клеток кератиноцитов эпидермиса человека HEKa, трансфицированная ДНК-вектором VTvaf17;
культура C - первичная культура клеток кератиноцитов эпидермиса человека HEKa, трансфицированных ДНК-вектором VTvaf17-CTNNB1.
На фиг.8
показана диаграмма концентрации белка NOG в лизате клеток фибробластов кожи человека линии HT 297.T (ATCC® CRL-7782™) после трансфекции этих клеток ДНК-вектором VTvaf17-NOG с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген NOG.
На фиг.8 отмечены следующие элементы:
культура А - культура клеток фибробластов кожи человека линии HT 297.T, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток фибробластов кожи человека линии HT 297.T, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток фибробластов кожи человека линии HT 297.T, трансфицированных ДНК-вектором VTvaf17-NOG.
На фиг.9
показана диаграмма концентрации белка WNT7A в лизате клеток первичной культуры меланоцитов эпидермиса человека линии Primary Epidermal Melanocytes; Normal, Human, Adult (HEMa) (ATCC® PCS-200-013™) после трансфекции этих клеток ДНК-вектором VTvaf17-WNT7A с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген WNT7A.
На фиг.9 отмечены следующие элементы:
культура А - культура клеток меланоцитов эпидермиса человека линии HEMa, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток меланоцитов эпидермиса человека линии HEMa, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток меланоцитов эпидермиса человека линии HEMa, трансфицированных ДНК-вектором VTvaf17-WNT7A.
На фиг.10
показана диаграмма концентрации белка WNT7A в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-WNT7A с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген WNT7A.
На фиг.10 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-WNT7A;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат кожи пациента П1 из интактного участка;
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-WNT7A
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-WNT7A;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
На фиг.11
показана диаграмма концентрации белка NOG в биоптатах икроножной мышцы трех пациентов после введения в икроножную мышцу этих пациентов генотерапевтического ДНК-вектора VTvaf17- NOG, с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген NOG.
На фиг. 11 отмечены следующие элементы:
П1I - биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-NOG;
П1II - биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат интактного участка икроножной мышцы пациента П1;
П2I - биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17- NOG;
П2II - биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат интактного участка икроножной мышцы пациента П2;
П3I - биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17- NOG;
П3II - биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат интактного участка икроножной мышцы пациента П3.
На фиг. 12
показана диаграмма концентрации белка CTNNB1 в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-CTNNB1 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген CTNNB1.
На фиг. 12 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-CTNNB1;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо)
П1III - биоптат кожи пациента П1 из интактного участка;
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-CTNNB1;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-CTNNB1;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
На фиг. 13
показана диаграмма концентрации белка CTNNB1 в биоптатах кожи человека после введения в кожу культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1 с целью демонстрации способа применения путем введения аутологичных клеток, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1
На фиг. 13 отмечены следующие элементы:
П1С - биоптат кожи пациента П1 в зоне введения культуры аутогенных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1;
П1B - биоптат кожи пациента П1 в зоне введения аутогенных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17;
П1A - биоптат кожи пациента П1 из интактного участка.
На фиг. 14
показана диаграмма концентраций белков: белка SHH человека, белка CTNNB1 человека, белка NOG человека, белка WNT7A человека в биоптатах кожи трех крыс в предварительно эпилированной зоне у крыс линии Wistar-Bratislava после инъекционного введения в эпилированную зону смеси генотерапевтических векторов: генотерапевтического ДНК-вектора VTvaf17-SHH, генотерапевтического ДНК-вектора VTvaf17-CTNNB1, генотерапевтического ДНК-вектора VTvaf17-NOG, генотерапевтического ДНК-вектора VTvaf17-WNT7A с целью демонстрации способа применения смеси генотерапевтических ДНК-векторов.
На фиг.14 отмечены следующие элементы:
К1I - биоптат кожи крысы К1 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-SHH, VTvaf17-CTNNB1, VTvaf17-NOG и VTvaf17-WNT7A;
К1II - биоптат кожи крысы К1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К1III - биоптат контрольного интактного участка кожи крысы К1;
К2I - биоптат кожи крысы К2 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-SHH, VTvaf17-CTNNB1, VTvaf17-NOG и VTvaf17-WNT7A;
К2II - биоптат кожи крысы К2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К2III - биоптат контрольного интактного участка кожи крысы К2;
К3I - биоптат кожи крысы К3 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-SHH, VTvaf17-CTNNB1, VTvaf17-NOG и VTvaf17-WNT7A;
К3II - биоптат кожи крысы К3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К3III - биоптат контрольного интактного участка кожи крысы К3.
На фиг. 15
показаны графики накопления ампликонов кДНК целевого гена NOG в клетках фибробластов кожи быка (ScienCell, Кат. #B2300) до и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- NOG с целью демонстрации способа применения путем введения генотерапевтического ДНК-вектора животным
На фиг. 15 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена NOG в клетках фибробластов кожи быка до трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOG;
2 - кДНК гена NOG в клетках фибробластов кожи быка после трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOG;
3 - кДНК гена ACT в клетках фибробластов кожи быка до трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOG;
4 - кДНК гена ACT в клетках фибробластов кожи быка после трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOG.
В качестве референтного гена использовали ген актина быка/ коровы (АСТ), приведенного в базе данных GenBank под номером AH001130.2.
Реализация изобретения
На основе ДНК-вектора VTvaf17 размером 3165 п.н. созданы генотерапевтические ДНК-векторы, несущие целевые гены человека, предназначенные для повышения уровня экспрессии этих целевых генов в тканях человека и животных. При этом способ получения каждого генотерапевтического ДНК-вектора, несущего целевые гены заключается в том, что в полилинкер генотерапевтического ДНК-вектора VTvaf17 клонируют белок-кодирующую последовательность целевого гена, выбранного из группы генов: ген SHH (кодирует белок SHH), ген CTNNB1 (кодирует белок CTNNB1), ген NOG (другое название NOGG, кодирует белок NOG (ноггин)), ген WNT7A (кодирует белок WNT7A) человека. Известно, что способность ДНК-векторов проникать в эукариотические клетки обусловлена, главным образом, размером вектора. При этом ДНК-вектора с наименьшим размером обладают более высокой проникающей способностью. Таким образом, предпочтительным является отсутствие в составе вектора элементов, которые не несут функциональной нагрузки, но при этом увеличивают размер ДНК-вектора. Данные особенности ДНК-векторов были учтены при получении генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A путем отсутствия в составе вектора крупных нефункциональных последовательностей и генов антибиотикорезистентности, что позволило, помимо технологических преимуществ и преимуществ в плане безопасности применения, значительно уменьшить размер полученного генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A. Таким образом, способность проникать в эукариотические клетки полученного генотерапевтического ДНК-вектора обусловлена его небольшими размерами.
Каждый из генотерапевтических ДНК-векторов: ДНК-вектор VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A получали следующим образом: кодирующую часть целевого гена SHH, или CTNNB1, или NOG, или WNT7A клонировали в генотерапевтический ДНК-вектор VTvaf17 и получали генотерапевтический ДНК-вектор VTvaf17-SHH, SEQ ID №1, или VTvaf17-CTNNB1, SEQ ID №2 или VTvaf17-NOG, SEQ ID №3, или VTvaf17-WNT7A, SEQ ID №4 соответственно. Кодирующую часть гена SHH размером 2228 п.н., или гена CTNNB1 размером 1252 п.н., или гена NOG размером 704 п.н., или гена WNT7A размером 1146 п.н. получали путем выделения суммарной РНК из биологического образца ткани здорового человека. Для получения первой цепи кДНК генов SHH, CTNNB1, NOG, WNT7A человека использовали реакцию обратной транскрипции. Амплификацию проводили с использованием созданных для этого методом химического синтеза олигонуклеотидов. Расщепление продукта амплификации специфическими эндонуклеазами рестрикции проводили с учетом оптимальной процедуры дальнейшего клонирования, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводили по сайтам рестрикции BamHI, EcoRI, HindIII расположенными в полилинкере вектора VTvaf17. Выбор сайтов рестрикции проводили таким образом, чтобы клонированный фрагмент попадал в рамку считывания экспрессионной кассеты вектора VTvaf17, при этом белок-кодирующая последовательность не содержала сайты рестрикции для выбранных эндонуклеаз. При этом специалистам в данной области техники понятно, что методическая реализация получения генотерапевтического ДНК-вектора VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A может варьировать в рамках выбора известных методов молекулярного клонирования генов, при этом эти способы подпадают под объем настоящего изобретения. Так, например, могут быть использованы различные последовательности олигонуклеотидов для амплификации гена SHH, или CTNNB1, или NOG, или WNT7A различные эндонуклеазы рестрикции или такие лабораторные техники как безлигазное клонирование генов.
Генотерапевтический ДНК-вектор VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A обладает нуклеотидной последовательностью SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 соответственно. При этом специалистам в данной области техники известно свойство вырожденности генетического кода, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей, отличающихся инсерцией, делецией или заменой нуклеотидов, которые не приводят к изменению полипептидной последовательности, кодируемой целевым геном, и/или не приводят к потере функциональной активности регуляторных элементов вектора VTvaf17. При этом специалистам в данной области техники известно явление генетического полиморфизма, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей генов из группы генов SHH, CTNNB1, NOG, WNT7A, которые при этом кодируют различные варианты аминокислотных последовательностей белков SHH, CTNNB1, NOG, WNT7A, не отличающихся от приведенных по своей функциональной активности при физиологических условиях.
Способность проникать в эукариотические клетки и функциональную активность, то есть способность экспрессировать целевой ген, полученного генотерапевтического ДНК-вектора VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A подтверждают путем введения в эукариотические клетки полученного вектора и последующим анализом экспрессии специфической мРНК и/или белкового продукта целевого гена. Наличие специфической мРНК в клетках, в которые был введен генотерапевтический ДНК-вектор VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A свидетельствует как о способности полученного вектора проникать в эукариотические клетки, так и о его способности экспрессировать мРНК целевого гена. При этом, как известно специалистам в данной области техники, наличие мРНК гена является обязательным условием, но не доказательством трансляции белка, кодируемого целевым геном. Поэтому для подтверждения свойства генотерапевтического ДНК-вектора VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A экспрессировать целевой ген на уровне белка в эукариотических клетках, в которые был введен генотерапевтический ДНК-вектор, проводят анализ концентрации белков, кодируемых целевыми генами, с использованием иммунологических методов. Наличие белка SHH, или CTNNB1, или NOG, или WNT7A подтверждает эффективность экспрессии целевых генов в эукариотических клетках и возможность повышения уровня концентрации белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A. Таким образом для подтверждения эффективности экспрессии созданного генотерапевтического ДНК-вектора VTvaf17-SHH, несущего целевой ген, а именно, ген SHH, генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего целевой ген, а именно, ген CTNNB1, генотерапевтического ДНК-вектора VTvaf17-NOG, несущего целевой ген, а именно, ген NOG, генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего целевой ген, а именно, ген WNT7A использовали следующие методы:
А) ПЦР в реальном времени - изменение накопления ампликонов кДНК целевых генов в лизате клеток человека и животного, после трансфекции различных клеточных линий человека и животного генотерапевтическим ДНК-векторами;
B) Иммуноферментный анализ - изменение количественного уровня целевых белков в лизате клеток человека, после трансфекции различных клеточных линий человека генотерапевтическими ДНК-векторами;
C) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека и животного, после введения в эти ткани генотерапевтических ДНК-векторов;
D) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека, после введения в эти ткани аутологичных клеток этого человека, трансфицированных генотерапевтическими ДНК-векторами.
Для подтверждения реализуемости способа применения созданного генотерапевтического ДНК-вектора VTvaf17-SHH, несущего целевой ген, а именно, ген SHH, генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего целевой ген, а именно, ген CTNNB1, генотерапевтического ДНК-вектора VTvaf17-NOG, несущего целевой ген, а именно, ген NOG, генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего целевой ген, а именно, ген WNT7A выполняли:
А) трансфекцию генотерапевтическими ДНК-векторами различных клеточных линий человека и животного;
B) введение генотерапевтических ДНК-векторов в различные ткани человека и животного;
С) введение в ткани животного смеси генотерапевтических ДНК-векторов;
D) введение в ткани человека аутологичных клеток, трансфицированных генотерапевтическими ДНК-векторами.
Указанные способы применения характеризуются отсутствием потенциальных рисков для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов, и за счет отсутствия в составе генотерапевтического ДНК-вектора генов устойчивости к антибиотикам, что подтверждается отсутствием участков, гомологичных вирусным геномам и генам антибиотикорезистентности в нуклеотидных последовательностях генотерапевтического ДНК-вектора VTvaf17-SHH, или генотерапевтического ДНК-вектора VTvaf17-CTNNB1, или генотерапевтического ДНК-вектора VTvaf17-NOG, или генотерапевтического ДНК-вектора VTvaf17-WNT7A (SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 соответственно).
Как известно специалистам в данной области техники, гены антибиотикорезистентности в составе генотерапевтических ДНК-векторов используются с целью получения этих векторов в препаративных количествах путем наращивания бактериальной биомассы в питательной среде, содержащей селективный антибиотик. В рамках настоящего изобретения в целях возможности безопасного применения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген SHH или CTNNB1, или NOG или WNT7A, использование селективных питательных сред, содержащих антибиотик, не представляется возможным. В качестве технологического решения для получения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A для возможности масштабирования до промышленных масштабов получения генотерапевтических векторов предлагается способ получения штаммов для наработки указанных генотерапевтических векторов на основе бактерии Escherichia coli SCS110-AF. Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-SHH или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A заключается в получении компетентных клеток штамма Escherichia coli SCS110-AF с введением в эти клетки генотерапевтического ДНК-вектора VTvaf17-SHH, или ДНК-вектора VTvaf17-CTNNB1, или ДНК-вектора VTvaf17-NOG, или ДНК-вектора VTvaf17-WNT7A соответственно с помощью методов трансформации (электропорации), общеизвестных специалистам в данной области техники. Полученный штамм Escherichia coli SCS110-AF/VTvaf17-SHH, или штамм Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамм Escherichia coli SCS110-AF/VTvaf17-NOG, или штамм Escherichia coli SCS110-AF/VTvaf17-WNT7A используется для наработки генотерапевтического ДНК-вектора VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A соответственно с возможностью использования сред без содержания антибиотиков.
Для подтверждения получения штамма Escherichia coli SCS110-AF/VTvaf17-SHH, или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A проводили трансформацию, селекцию и последующее наращивание с выделением плазмидной ДНК.
Для подтверждения технологичности получения и возможности масштабирования до промышленного производства генотерапевтического ДНК-вектора VTvaf17-SHH, несущего целевой ген, а именно, ген SHH, генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего целевой ген, а именно, ген CTNNB1, генотерапевтического ДНК-вектора VTvaf17-NOG, несущего целевой ген, а именно, ген NOG генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего целевой ген, а именно, ген WNT7A, выполняли ферментацию в промышленном масштабе штамма Escherichia coli SCS110-AF/VTvaf17-SHH или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1 или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно SHH, или CTNNB1, или NOG, или WNT7A.
Способ масштабирования получения бактериальной массы до промышленных масштабов для выделения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A, заключается в том, что затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-SHH, или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A инкубируют в объеме питательной среды без содержания антибиотика обеспечивающим подходящую динамику накопления биомассы, по достижению достаточного количества биомассы в логарифмической фазе роста, бактериальную культуру переносят в промышленный ферментер, после чего растят до достижения стационарной фазы роста, затем выделяют фракцию, содержащую целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-SHH, или генотерапевтический ДНК-вектор VTvaf17-CTNNB1, или генотерапевтический ДНК-вектор VTvaf17-NOG, или генотерапевтический ДНК-вектор VTvaf17-WNT7A многостадийно фильтруют и очищают хроматографическими методами. При этом специалистам в данной области техники понятно, что условия культивирования штаммов, состав питательных сред (за исключением содержания антибиотиков), используемое оборудование, методы очистки ДНК могут варьировать в рамках стандартных операционных процедур в зависимости от отдельно взятой производственной линии, но известные подходы к масштабированию, промышленному получению и очистке ДНК-векторов с использованием штамма Escherichia coli SCS110-AF/VTvaf17-SHH, или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A, или подпадают под объем настоящего изобретения.
Описанное раскрытие изобретения подтверждается примерами реализации настоящего изобретения.
Изобретение поясняется следующими примерами.
Пример 1.
Получение генотерапевтического ДНК-вектора VTvaf17-SHH, несущего целевой ген, а именно, гена SHH.
Генотерапевтический ДНК-вектор VTvaf17-SHH конструировали клонированием кодирующей части гена SHH размером 1388 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI и HindIII. Кодирующую часть гена SHH размером 1388 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
SHH_F AGGATCCACCATGCTGCTGCTGGCGAGATGTC
SHH_R TATAAGCTTTCAGCTGGACTTGACCGCCAT
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США).
Генотерапевтический ДНК-вектор VTvaf17 конструировали объединением шести фрагментов ДНК, полученных из разных источников:
(а) ориджин репликации получали путем ПЦР-амплификации участка коммерческой плазмиды pBR322 с внесением точечной мутации;
(б) промоторный регион EF1a получали путем ПЦР-амплификации участка геномной ДНК человека;
(в) терминатор транскрипции hGH-TA получали путем ПЦР-амплификации участка геномной ДНК человека;
(г) регуляторный участок транспозона Tn10 РНК-out получали путем синтеза из олигонуклеотидов;
(д) ген устойчивости к канамицину получали путем ПЦР-амплификации участка коммерческой плазмиды pET-28 человека;
(е) полилинкер получали отжигом двух синтетических олигонуклеотидов.
ПЦР-амплификацию проводили с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) в соответствии с инструкцией производителя. Фрагменты имеют перекрывающиеся области для возможности их объединения с последующей ПЦР-амплификацией. Объединяли фрагменты (а) и (б) с использованием олигонуклеотидов Ori-F и EF1-R, а также фрагменты (в), (г) и (д) с использованием олигонуклеотидов hGH-F и Kan-R. Далее, полученные участки объединяли путем рестрикции с последующим лигированием по сайтам BamHI и NcoI. В результате получали плазмиду, пока еще не содержащую полилинкер. Для его введения проводили расщепление плазмиды по сайтам BamHI и EcoRI, и лигирование с фрагментом (е). Таким образом, получали вектор размером 3165 п.н., несущий ген устойчивости к канамицину, который фланкирован сайтами рестрикции SpeI. Далее этот участок выщепляли по сайтам рестрикции SpeI, после чего оставшийся фрагмент лигировали сам на себя. Таким образом, получали генотерапевтический ДНК-вектор VTvaf17 размером 3165 п.н., который является рекомбинантным, с возможностью селекции без антибиотиков.
Расщепление продукта амплификации кодирующей части гена SHH и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и HindIII (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-SHH размером 4545 п.н. с нуклеотидной последовательностью SEQ ID №1 и общей структурой изображенной на фиг. 1A.
Пример 2.
Получение генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего целевой ген, а именно, гена CTNNB1.
Генотерапевтический ДНК-вектор VTvaf17-CTNNB1 конструировали клонированием кодирующей части гена CTNNB1 размером 2345 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции SalI и KpnI. Кодирующую часть гена CTNNB1 размером 2345 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
CTNNB1_F ATCGTCGACCACCATGGCTACCCAAGCTGATTTG
CTNNB1_R TTCGGTACCTTACAGGTCAGTATCAAACCAG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции SaII и KpnI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-CTNNB1 размером 5509 п.н. с нуклеотидной последовательностью SEQ ID №2 и общей структурой изображенной на фиг. 1B.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 3
Получение ДНК-вектора VTvaf17-NOG, несущего целевой ген, а именно, гена NOG человека.
Генотерапевтический ДНК-вектор VTvaf17-NOG конструировали клонированием кодирующей части гена NOG размером 698 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена NOG размером 698 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
NOG_F GGATCCACCATGGAGCGCTGCCCCAG
NOG_R ATAGAATTCTAGCACGAGCACTTGCACT
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-NOG размером 4859 п.н. с нуклеотидной последовательностью SEQ ID №3 и общей структурой изображенной на фиг. 1C.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 4.
Получение генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего целевой ген, а именно, гена WNT7A.
Генотерапевтический ДНК-вектор VTvaf17-WNT7A конструировали клонированием кодирующей части гена WNT7A размером 1049 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHII и KpnI. Кодирующую часть гена WNT7A размером 1049 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
WNT7A_F ATCGTCGACCACCATGAACCGGAAAGCGCGGCGCT
WNT7A_R TTCGGTACCTCACTTGCACGTGTACATCTCCGT
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHII и KpnI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-WNT7A размером 4213 п.н. с нуклеотидной последовательностью SEQ ID №4 и общей структурой изображенной на фиг. 1D.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 5.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-SHH, несущего целевой ген, а именно, ген SHH, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена SHH, в первичной культуре фибробластов кожи человека HDFa (ATCC PCS-201-01) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-SHH, несущим ген SHH человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Для оценки изменения накопления мРНК целевого гена SHH, использовалась первичная культура фибробластов кожи человека HDFa. Клеточную культуру HDFa выращивали в стандартных условиях (37°С, 5% СО2) с использованием питательной среды Fibroblast Growth Kit–Serum-Free (ATCC® PCS-201-040). В процессе культивирования каждые 48 ч происходила смена ростовой среды.
Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-SHH, экспрессирующим ген SHH человека, проводили с использованием Lipofectamine 3000 (ThermoFisher Scientific, США) согласно рекомендациям производителя. В пробирке №1 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора ДНК-вектора VTvaf17-SHH (концентрация 500 нг/мкл) и 1 мкл реагента Р3000. Аккуратно перемешивали легким встряхиванием. В пробирке №2 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора Lipofectamin 3000. Аккуратно перемешивали легким встряхиванием. Добавляли содержимое пробирки №1 к содержимому пробирки №2, инкубировали 5 мин при комнатной температуре. Полученный раствор по каплям добавляли к клеткам в объеме 40 мкл.
В качестве контроля использовали клетки HDFa, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена SHH до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано выше.
Суммарную РНК из клеток HDFa выделяли с использованием Trizol Reagent (Invitrogen, США) согласно рекомендациям производителя. В лунку с клетками добавляли 1 мл Trizol Reagent и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С. Далее образец центрифугировали при 14000g в течении 10 мин и снова прогревали в течении 10 мин при 65°С. Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14000g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия, рН 5.2 и равный объем изопропилового спирта. Инкубировали образец при -20°С в течении 10 мин с последующим центрифугированием при 14 000g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Определение уровня экспрессии мРНК гена SHH после трансфекции проводили путем оценки динамики накопления ампликонов кДНК методом ПЦР в режиме реального времени. Для получения и амплификации кДНК, специфичной для гена SHH человека, использовали олигонуклеотиды SHH_SF и SHH_SR:
SHH_SF TTATCCCCAATGTGGCCGAG
SHH_FR CTGAGTCATCAGCCTGTCCG
Длина продукта амплификации - 161 п.н.
Реакцию обратной транскрипции и ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT–PCR Kit (Qiagen, США) для ПЦР в режиме реального времени. Реакцию проводили в объеме 20 мкл, содержащих: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 мМ хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, США) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°C - 30 сек и элонгацию 72°С - 30 сек. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов SHH и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество динамику накопления ампликонов кДНК генов SHH и B2M оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг.2.
Из фигуры 2 следует, что в результате трансфекции первичной культуры клеток фибробластов человека HDFa генотерапевтическим ДНК-вектором VTvaf17-SHH, уровень специфической мРНК гена SHH человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген SHH на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-SHH для повышения уровня экспрессии гена SHH в эукариотических клетках.
Пример 6.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего целевой ген, а именно, ген CTNNB1, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена CTNNB1, в первичной культуре кератиноцитов эпидермиса человека HEKa (ATCC PCS-200-011) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, несущим ген CTNNB1 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Первичную культуру клеток кератиноцитов эпидермиса человека HEKa выращивали в среде Keratinocyte Growth Kit (ATCC® PCS-200-040™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, экспрессирующим ген CTNNB1 человека, проводили как описано в примере 5. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток HEKa, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена CTNNB1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 5, за исключением олигонуклеотидов с отличающимися от примера 5 последовательностями. Для амплификации кДНК, специфичной для гена CTNNB1 человека, использовали олигонуклеотиды CTNNB1_SF и CTNNB1_SR:
CTNNB_SF ATGACTCGAGCTCAGAGGGT
CTNNB_SR ATTGCACGTGTGGCAAGTTC
Длина продукта амплификации - 197 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов CTNNB1 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов CTNNB1 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг.3.
Из фигуры 3 следует, что в результате трансфекции культуры клеток HEKa генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, уровень специфической мРНК гена CTNNB1 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген CTNNB1 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-CTNNB1 для повышения уровня экспрессии гена CTNNB1 в эукариотических клетках.
Пример 7.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-NOG, несущего целевой ген, а именно, ген NOG, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена NOG в культуре клеток фибробластов кожи человека линии HT 297.T (ATCC® CRL-7782™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-NOG, несущим ген NOG человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток фибробластов кожи человека линии HT 297.T выращивали в среде Dulbecco's Modified Eagle's Medium (DMEM) (ATCC® 30-2002™) с добавлением 10% сыворотки крупного рогатого скота (ATCC® 30-2020™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-NOG, экспрессирующим ген NOG человека, проводили как описано в примере 5. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток HT 297.T, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена NOG до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 5, за исключением олигонуклеотидов с отличающимися от примера 5 последовательностями. Для амплификации кДНК, специфичной для гена NOG человека, использовали олигонуклеотиды NOG_SF и NOG_SR:
NOG_SF GATCTGAACGAGACGCTGCT
NOG_SR TAGCCCTTTGATCTCGCTCG
Длина продукта амплификации - 192 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов NOG и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов NOG и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг.4.
Из фигуры 4 следует, что в результате трансфекции культуры клеток фибробластов кожи человека линии HT 297.T генотерапевтическим ДНК-вектором VTvaf17-NOG уровень специфической мРНК гена NOG человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген NOG на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-NOG для повышения уровня экспрессии гена NOG в эукариотических клетках.
Пример 8.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего целевой ген, а именно, ген WNT7A, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена WNT7A, в первичной культуре клеток меланоцитов эпидермиса человека линии Primary Epidermal Melanocytes; Normal, Human, Adult (HEMa) (ATCC® PCS-200-013™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-WNT7A, несущим ген WNT7A человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток меланоцитов эпидермиса человека линии HEMa выращивали в среде Dermal Cell Basal Medium (ATCC® PCS-200-030™) с добавлением Adult Melanocyte Growth Kit (ATCC® PCS-200-042™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-WNT7A, экспрессирующим ген WNT7A человека, проводили как описано в примере 5. В качестве контроля использовали культуру клеток HEMa, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена WNT7A до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 5, за исключением олигонуклеотидов с отличающимися от примера 5 последовательностями. Для амплификации кДНК, специфичной для гена WNT7A человека, использовали олигонуклеотиды WNT7A_SF и WNT7A_SR:
WNT_SF GCGACAAAGAGAAGCAAGGC
WNT_SR CTCCTCCAGGATCTTTCGGC
Длина продукта амплификации - 185 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов WNT7A и B2M. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов WNT7A и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг.5.
Из фигуры 5 следует, что в результате трансфекции культуры клеток меланоцитов эпидермиса человека линии HEMa генотерапевтическим ДНК-вектором VTvaf17-WNT7A, уровень специфической мРНК гена WNT7A человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген WNT7A на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-WNT7A для повышения уровня экспрессии гена WNT7A в эукариотических клетках.
Пример 9.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-SHH, несущего ген SHH, для повышения экспрессии белка SHH в клетках млекопитающих.
Оценивали изменение количества белка SHH в лизате фибробластов кожи человека HDFa (ATCC PCS-201-01) после трансфекции этих клеток ДНК-вектором VTvaf17-SHH, несущим ген SHH человека.
Клеточную культуру фибробластов кожи человека выращивали как это описано в примере 5.
Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена SHH (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-SHH, несущий ген SHH человека. Приготовление комплекса ДНК/дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли культуральную среду до конечного объема 60 мкл, затем добавляли 5 мкл SuperFect Transfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл среды, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% СО2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли среду, содержащую 10 мкг/мл гентамицина, и инкубировали 24-48 часов при 37°С в атмосфере 5% СО2.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15000 об/мин в течение 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка SHH проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Sonic Hedgehog / Shh N-Terminus ELISA (R&D Systems Кат.DSHH00, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка SHH, входящим в состав набора. Чувствительность метода составляла не менее 3,92 пг/мл, диапазон измерения - от 15.60 пг/мл до 1,000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг.6.
Из фигуры 6 следует, что трансфекция клеток фибробластов кожи человека HDFa генотерапевтическим ДНК-вектором VTvaf17-SHH приводит к увеличению количества белка SHH по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген SHH на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-SHH для повышения уровня экспрессии SHH в эукариотических клетках.
Пример 10.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего ген CTNNB1, для повышения экспрессии белка CTNNB1 в клетках млекопитающих.
Оценивали изменение количества белка CTNNB1 в кондиционированной среде лизате клеток первичной культуры кератиноцитов эпидермиса человека HEKa (ATCC PCS-200-01) после трансфекции этих клеток ДНК-вектором VTvaf17-CTNNB1, несущим ген CTNNB1 человека. Клетки выращивали как описано в примере 6.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена CTNNB1 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-CTNNB1, несущий ген CTNNB1 человека (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток HEKa проводили как описано в примере 9.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка CTNNB1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human CTNNB1 / Beta Catenin ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences Кат.LS-F4396-1, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка CTNNB1, входящим в состав набора. Чувствительность метода составляла не менее 5,6 пг/мл, диапазон измерения - от 15.63 пг/мл до 1000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг.7.
Из фигуры 7 следует, что трансфекция первичной культуры кератиноцитов эпидермиса человека HEKa человека генотерапевтическим ДНК-вектором VTvaf17-CTNNB1 приводит к увеличению количества белка CTNNB1 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген CTNNB1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-CTNNB1 для повышения уровня экспрессии CTNNB1 в эукариотических клетках.
Пример 11.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-NOG, несущего ген NOG, для повышения экспрессии белка NOG в клетках млекопитающих.
Оценивали изменение количества белка NOG в лизате клеток фибробластов кожи человека линии HT 297.T (ATCC® CRL-7782™) после трансфекции этих клеток ДНК-вектором VTvaf17-NOG, несущим ген NOG человека. Клетки культивировали как описано в примере 7.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена NOG (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-NOG, несущий ген NOG человека. Приготовление комплекса ДНК-дендример и трансфекцию клеток HT 297.T проводили как описано в примере 9.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка NOG проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human NOG / NOG ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences Кат.LS-F24239-1, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка NOG, входящим в состав набора. Чувствительность метода составляла не менее 125 пг/мл, диапазон измерения - от 125 пг/мл до 8000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг.8.
Из фигуры 8 следует, что трансфекция культуры клеток фибробластов кожи человека линии HT 297.T (ATCC® CRL-7782™) генотерапевтическим ДНК-вектором VTvaf17-NOG приводит к увеличению количества белка NOG по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген NOG на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-NOG для повышения уровня экспрессии NOG в эукариотических клетках.
Пример 12.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего ген WNT7A, для повышения экспрессии белка WNT7A в клетках млекопитающих.
Оценивали изменение количества белка WNT7A в лизате культуры клеток меланоцитов эпидермиса человека линии Primary Epidermal Melanocytes; Normal, Human, Adult (HEMa) (ATCC® PCS-200-013™) после трансфекции этих клеток ДНК-вектором VTvaf17-WNT7A, несущим ген WNT7A человека. Клетки культивировали как описано в примере 8.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена WNT7A (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-WNT7A, несущий ген WNT7A человека. Приготовление комплекса ДНК-дендримеры и трансфекцию клеток HEMa проводили как описано в примере 9.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка WNT7A проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human WNT7A ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences Кат.LS-F7014-1, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка WNT7A, входящим в состав набора. Чувствительность метода составляла не менее 31,25 пг/мл, диапазон измерения - от 31,25 пг/мл до 2000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг.9.
Из фигуры 9 следует, что трансфекция культуры клеток эндотелия капилляров кожи человека линии HEMa генотерапевтическим ДНК-вектором VTvaf17-WNT7A приводит к увеличению количества белка WNT7A по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген WNT7A на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-WNT7A для повышения уровня экспрессии WNT7A в эукариотических клетках.
Пример 13.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего ген WNT7A, для повышения экспрессии белка WNT7A в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего целевой ген, а именно, ген WNT7A и реализуемости способа его применения оценивали изменения количества белка WNT7A в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего ген человека WNT7A.
С целью анализа изменения количества белка WNT7A трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-WNT7A, несущий ген WNT7A и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена WNT7A.
Пациент 1, мужчина 60 лет, (П1); пациент 2, женщина 66 лет, П2); пациент 3, мужчина, 53 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-WNT7A, который содержит кДНК гена WNT7A и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена WNT7A, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК-cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-WNT7A, несущий ген WNT7A вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-WNT7A, несущего ген WNT7A - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-WNT7A, несущего ген WNT7A (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг.Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка методом твердофазного иммуноферментного анализа (ELISA). Количественное определение белка WNT7A проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human WNT7A ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences Кат.LS-F7014-1, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка WNT7A, входящим в состав набора. Чувствительность метода составляла не менее 31,25 пг/мл, диапазон измерения - от 31,25 пг/мл до 2000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США). Графики, полученные в результате анализа, представлены на фиг.10.
Из фигуры 10 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17- WNT7A, несущего целевой ген WNT7A человека, произошло увеличение количества белка WNT7A в сравнении с количеством белка WNT7A в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген WNT7A человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-WNT7A и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 14.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-NOG, несущего ген NOG, для повышения экспрессии белка NOG в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-NOG, несущего целевой ген NOG и реализуемости способа его применения оценивали изменение количества белка NOG в мышечной ткани человека при введении генотерапевтического ДНК-вектора VTvaf17-NOG, несущего целевой ген, а именно, ген NOG человека.
С целью анализа изменения количества белка NOG трем пациентам вводили в ткань икроножной мышцы генотерапевтический ДНК-вектор VTvaf17- NOG, несущий ген NOG с транспортной молекулой, и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена NOG с транспортной молекулой.
Пациент 1, женщина 49 лет, (П1); пациент 2, мужчина 53 года (П2); пациент 3, мужчина 64 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция), пробоподготовку проводили в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-NOG, несущий ген NOG вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину около 10 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-NOG, несущего ген NOG - 0,3 мл для каждой генетической конструкции.
Очаги введения каждой генетической конструкции располагали медиально на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков мышечной ткани пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-NOG, несущего ген NOG (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактного участка икроножной мышцы (III), используя устройство для взятия биопсии MAGNUM (BARD, США). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 20 куб. мм, масса - около 22 мг.Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка NOG проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human NOG / NOG ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences Кат.LS-F24239-1, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка NOG, входящим в состав набора. Чувствительность метода составляла не менее 125 пг/мл, диапазон измерения - от 125 пг/мл до 8000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг.11.
Из фигуры 11 следует, что в икроножной мышце всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-NOG, несущего целевой ген, а именно, ген NOG человека, произошло увеличение количества белка NOG в сравнении с количеством белка NOG в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген NOG человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-NOG и подтверждает реализуемость способа его применения, в частности при внутримышечном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 15.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего ген CTNNB1, для повышения экспрессии белка CTNNB1 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего целевой ген, а именно, ген CTNNB1 и реализуемости способа его применения оценивали изменения количества белка CTNNB1 в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего ген человека CTNNB1.
С целью анализа изменения количества белка CTNNB1 трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-CTNNB1, несущий ген CTNNB1 и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена CTNNB1.
Пациент 1, женщина 57 лет (П1); пациент 2, мужчина 50 лет (П2); пациент 3, мужчина, 59 лет (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-CTNNB1, который содержит кДНК гена CTNNB1 и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена CTNNB1, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-CTNNB1, несущий ген CTNNB1 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-CTNNB1, несущего ген CTNNB1 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-CTNNB1, несущего ген CTNNB1 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия).
Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг.Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка методом твердофазного иммуноферментного анализа (ELISA), используя набор используя набор Human CTNNB1 / Beta Catenin ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences Кат.LS-F4396-1, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка CTNNB1, входящим в состав набора. Чувствительность метода составляла не менее 5,6 пг/мл, диапазон измерения - от 15.63 пг/мл до 1000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг.12.
Из фигуры 12 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17- CTNNB1, несущего целевой ген CTNNB1 человека, произошло увеличение количества белка CTNNB1 в сравнении с количеством белка CTNNB1 в области введения генотерапевтического ДНК-
вектора VTvaf17 (плацебо), не содержащего ген CTNNB1 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-CTNNB1 и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 16.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего ген CTNNB1 и реализуемости способа его применения для повышения уровня экспрессии белка CTNNB1 в тканях человека путем введения аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего ген CTNNB1 и реализуемости способа его применения оценивали изменения количества белка CTNNB1 в коже человека при введении в кожу пациента культуры аутогенных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1.
Пациенту вводили в кожу предплечья соответствующую культуру аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, несущим ген CTNNB1, и параллельно вводили плацебо, представляющее собой культуру аутогенных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген CTNNB1.
Первичную культуру фибробластов человека выделяли из биоптатов кожи пациента. Используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL, Италия) брали образец биоптата кожи из зоны, защищенной от действия ультрафиолета, а именно за ушной раковиной или с боковой внутренней поверхности в зоне локтевого сустава, размером около 10 кв. мм, массой - около 11 мг.Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Культивирование первичной культуры клеток осуществляли при 37°С в атмосфере, содержащей 5% СО2 в среде DMEM с 10% фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Пересев культуры и смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 5×104 клеток. Культуру фибробластов пациента трансфицировали генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, несущим ген CTNNB1 или плацебо - вектор VTvaf17, не несущий целевой ген CTNNB1.
Трансфекцию осуществляли с помощью катионного полимера полиэтиленимина JETPEI (Polyplus Transfection, Франция), согласно инструкции фирмы-производителя. Клетки культивировали 72 часа и затем вводили пациенту. Введение пациенту культуры аутогенных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, и плацебо, представляющее собой культуру аутогенных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, осуществляли туннельным методом в область предплечья иглой 30G длиной 13 мм на глубину около 3 мм. Концентрация модифицированных аутогенных фибробластов в вводимой суспензии составляла примерно 5 млн клеток на 1 мл суспензии, количество вводимых клеток не превышало 15 млн. Очаги введения культуры аутогенных фибробластов располагались на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 4-е сутки после введения культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, несущим целевой ген, а именно, ген CTNNB1 и плацебо. Взятие биопсии осуществляли из участков кожи пациента в зоне введения культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, несущим целевой ген, а именно, ген CTNNB1 (C), культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген CTNNB1 (плацебо) (B), а также из участков интактной кожи (A), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу в зоне отбора биоптата пациентов предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг.Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка как это описано в примере 15.
Графики, полученные в результате анализа, представлены на фиг.13.
Из фигуры 13 следует, что в коже пациента в области введения культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1, несущим ген CTNNB1, произошло увеличение количества белка CTNNB1 в сравнении с количеством белка CTNNB1 в области введения культуры аутогенных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген CTNNB1 (плацебо), что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-CTNNB1 и подтверждает реализуемость способа его применения для повышения уровня экспрессии CTNNB1 в тканях человека, в частности при введении аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-CTNNB1.
Пример 17.
Подтверждение эффективности и реализуемости способа сочетанного применения генотерапевтического ДНК-вектора VTvaf17-SHH, несущего ген SHH, генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего ген CTNNB1, генотерапевтического ДНК-вектора VTvaf17-NOG, несущего ген NOG, генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего ген WNT7A, для повышения уровня экспрессии белков SHH, CTNNB1, NOG и WNT7A в тканях млекопитающих.
Оценивали изменение количества белков SHH, CTNNB1, NOG и WNT7A в зоне предварительно эпилированной кожи крысы при введении в эту зону смеси генотерапевтических векторов.
Эпиляцию у группы из 3 крыс линии Вистар проводили под общей анестезией на участке размером 2х4 см согласно известной методике (Li H et al. // Sci Rep.2017 Aug 4; 7(1):7272).
В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Эквимолярную смесь генотерапевтических ДНК-векторов растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя. Объем вводимого раствора составлял 0,3 мл с суммарным количеством ДНК 100 мкг.Введение раствора осуществляли тоннельным методом иглой 30G на глубину 2 - 3 мм в зону предварительно эпилированной коже крысы через 48 часов после процедуры.
Биопсийные образцы отбирали на 2 сутки после введения генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков на коже животных в зоне введения смеси четырех генотерапевтических ДНК-векторов, несущих гены SHH, CTNNB1, NOG, WNT7A (зона I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (зона II), а также из участков аналогичного участка кожи, не подвергавшегося никаким манипуляциям (зона III), используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL). Зону отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер каждого биопсийного образца составлял около 10 куб. мм, масса - около 11 мг.Каждый образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевых белков как это описано в примере 9 (количественное определение белка SHH), примере 10 (количественное определение белка CTNNB1), примере 11 (количественное определение белка NOG), примере 12 (количественное определение белка WNT7A). Графики, полученные в результате анализа, представлены на фиг.14.
Из фигур 14A и 14B следует, что в зоне предварительно эпилированной кожи крыс (зона I), в которую вводилась смесь генотерапевтических векторов: генотерапевтического ДНК-вектора VTvaf17-SHH, несущего целевой ген SHH, генотерапевтического ДНК-вектора VTvaf17-CTNNB1, несущего целевой ген CTNNB1, генотерапевтического ДНК-вектора VTvaf17-NOG, несущего целевой ген NOG, генотерапевтического ДНК-вектора VTvaf17-WNT7A, несущего целевой ген WNT7A, произошло увеличение количества белков SHH, CTNNB1, NOG и WNT7A по сравнению с зоной II (зона плацебо) и зоной III (интактная зона). Полученные результаты свидетельствуют об эффективности сочетанного применения генотерапевтических ДНК-векторов и подтверждает реализуемость способа применения для повышения уровня экспрессии целевых белков в тканях млекопитающих.
Пример 18.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-NOG, несущего ген NOG и реализуемости способа его применения для повышения уровня экспрессии белка NOG в клетках млекопитающих.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-NOG, несущего ген NOG оценивали изменение накопления мРНК целевого гена NOG в клетках фибробластов кожи быка (ScienCell, Кат. #B2300) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- NOG, несущим ген NOG человека.
Клетки фибробластов кожи быка BDF (ScienCell, Кат. #B2300) выращивали в среде FM-2 (ScienCell, Кат. #2331). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17- NOG, несущим ген NOG человека и ДНК-вектором VTvaf17, не несущим ген NOG человека (контроль), выделение РНК, реакцию обратной транскрипции, ПЦР амплификации и анализ данных проводили как описано в примере 7. В качестве референтного гена использовали ген актина быка/ коровы (АСТ), приведенного в базе данных GenBank под номером AH001130.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности генов NOG и ACT. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов – кДНК генов NOG и ACT, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1. (Bio-Rad, USA).
Графики, полученные в результате анализа представлены на фиг.15.
Из фигуры 15 следует, что в результате трансфекции клеток фибробластов кожи быка BDF генотерапевтическим ДНК-вектором VTvaf17-NOG, уровень специфической мРНК гена NOG человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген NOG на уровне мРНК. Представленные результаты подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-NOG для повышения уровня экспрессии гена NOG в клетках млекопитающих.
Пример 19.
Штамм Escherichia coli SCS110-AF/VTvaf17-SHH или штамм Escherichia coli SCS110-AF/VTvaf17-CTNNB1 или штамм Escherichia coli SCS110-AF/VTvaf17-NOG или штамм Escherichia coli SCS110-AF/VTvaf17-WNT7A, несущий генотерапевтический ДНК-вектор, и способ его получения.
Конструирование штамма для наработки в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: SHH, CTNNB1, NOG, WNT7A, а именно штамма Escherichia coli SCS110-AF/VTvaf17-SHH, или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A, несущего генотерапевтический ДНК-вектор VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A соответственно для его наработки с возможностью селекции без использования антибиотиков заключается в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-SHH, или ДНК-вектором VTvaf17-CTNNB1, или ДНК-вектором VTvaf17-NOG, или ДНК-вектором VTvaf17-WNT7A, после чего клетки высеваются на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. При этом штамм Escherichia coli SCS110-AF для наработки генотерапевтического ДНК-вектора VTvaf17 или генотерапевтических ДНК-векторов на его основе с возможностью положительной селекции без использования антибиотиков получали путем конструирования линейного фрагмента ДНК, содержащего регуляторный элемент RNA-in транспозона Tn10 для селекции без применения антибиотиков размером 64 п.н., ген левансахаразы sacB, продукт которого обеспечивает селекцию на сахарозо-содержащей среде размером 1422 п.н., ген устойчивости к хлорамфениколу catR, необходимый для отбора клонов штамма, в которых прошла гомологичная рекомбинация размером 763 п.н. и две гомологичные последовательности, обеспечивающие процесс гомологичной рекомбинации в области гена recA с одновременной его инактивацией размером 329 п.н. и 233 п.н., после чего проводили трансформацию клеток Escherichia coli путем электропорации и отбирали клоны, выжившие на среде, содержащей 10 мкг/мл хлорамфеникола.
Полученные штаммы для наработки были внесены в коллекции Национального биоресурсного центра - Всероссийская коллекция промышленных микроорганизмов (НБЦ ВКПМ), РФ и NCIMB Patent Deposit Service, UK с присвоением регистрационных номеров:
штамм Escherichia coli SCS110-AF/VTvaf17-SHH - регистрационный №ВКПМ: В-13253, дата депонирования: 24.09.2018; accession №NCIMB: 43211, дата депонирования: 20.09.2018.
штамм Escherichia coli SCS110-AF/VTvaf17-CTNNB1 - регистрационный №ВКПМ B-13275, дата депонирования: 16.10.2018; accession №NCIMB: 43301, дата депонирования: 13.12.2018.
штамм Escherichia coli SCS110-AF/VTvaf17-NOG - регистрационный №ВКПМ: В-13256, дата депонирования: 24.09.2018; accession №NCIMB: 43208, дата депонирования: 20.09.2018.
штамм Escherichia coli SCS110-AF/VTvaf17-WNT7A - регистрационный №ВКПМ: B-13270, дата депонирования: 16.10.2018, accession №NCIMB: 43305, дата депонирования: 13.12.2018.
Пример 20.
Способ масштабирования получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: SHH, CTNNB1, NOG, WNT7A до промышленного масштаба.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-SHH (SEQ ID №1), или VTvaf17-CTNNB1 (SEQ ID №2), или VTvaf17-NOG (SEQ ID №3), или VTvaf17-WNT7A (SEQ ID №4), или проводили масштабную ферментацию штамма Escherichia coli SCS110-AF/VTvaf17-SHH, или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно SHH, или CTNNB1, или NOG, или WNT7A. Каждый штамм Escherichia coli SCS110-AF/VTvaf17-SHH, или Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или Escherichia coli SCS110-AF/VTvaf17-NOG, или Escherichia coli SCS110-AF/VTvaf17-WNT7A получали на базе штамма Escherichia coli SCS110-AF (Cell and Gene Therapy LLC, Великобритания) по примеру 21 путем электропорации компетентных клеток этого штамма генотерапевтическим ДНК-вектором VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A, несущим целевой ген, а именно, SHH, или CTNNB1, или NOG, или WNT7A с последующим высевом трансформированных клеток на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы и отбором отдельных клонов.
Ферментацию полученного штамма Escherichia coli SCS110-AF/VTvaf17-SHH, несущего генотерапевтический ДНК-вектор VTvaf17-SHH проводили в ферментере объемом 10 л с последующим выделением генотерапевтического ДНК-вектора VTvaf17-SHH.
Для ферментации штамма Escherichia coli SCS110-AF/VTvaf17-SHH готовили среду, содержащую на 10 л: 100 г триптон, 50 г дрожжевой экстракт (Becton Dickinson, США), доводили водой до 8800 мл и автоклавировали при 121 0С 20 мин, затем добавляли 1200 мл 50% (вес/объем) сахарозы. Далее засевали в колбу затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-SHH в объеме 100 мл. Инкубировали в шейкере-инкубаторе 16 ч при 30°С.Переносили затравочную культуру в ферментер Techfors S (Infors HT, Швейцария), растили до достижения стационарной фазы. Контроль осуществляли измерением оптической плотности культуры при длине волны 600 нм. Клетки осаждали центрифугированием 30 мин при 5000-10000 g. Супернатант удаляли, клеточную массу ресуспендировали в 10% по объему фосфатно-солевого буфера. Повторно центрифугировали 30 мин при 5000-10000g. Супернатант удаляли, к клеточной массе добавляли раствор 20 мМ TrisCl, 1 мМ ЭДТА, 200 г/л сахароза, рН 8,0 в объеме 1000 мл, тщательно перемешивали до образования гомогенной суспензии. Добавляли раствор яичного лизоцима до конечной концентрации 100 мкг/мл. Инкубировали 20 мин на льду при бережном перемешивании. Далее, добавляли 2500 мл раствора 0,2 М NaOH, 10 г/л додецилсульфат натрия, инкубировали 10 мин на льду при бережном перемешивании, затем добавляли 3500 мл раствора 3M ацетат натрия, 2М уксусная кислота, рН 5-5,5, инкубировали 10 мин на льду при бережном перемешивании. Полученный образец центрифугировали 20-30 мин при 15000 g или более. Раствор аккуратно декантировали, от остатков осадка избавлялись фильтрацией через грубый фильтр (фильтровальную бумагу). Добавляли РНКазу А (Sigma, США) до конечной концентрации 20 нг/мл, инкубировали ночь 16 ч при комнатной температуре. Раствор центрифугировали 20-30 мин при 15000g, затем фильтровали через мембранный фильтр с порами 0,45 мкм (Millipore, США). Далее проводили ультрафильтрацию через мембрану размером отсечения 100кДа (Millipore, США) и разбавляли до начального объема буфером 25 мМ TrisCl, pH 7.0. Операцию повторяли три - четыре раза. Наносили раствор, на колонку с 250 мл сорбента DEAE sepharose HP (GE, США), уравновешенную раствором 25 мМ TrisCl, pH 7.0. После нанесения образца колонку промывали тремя объемами этого же раствора, а затем проводили элюцию генотерапевтического ДНК-вектора VTvaf17-SHH линейным градиентом от раствора 25 мМ TrisCl, pH 7.0 до раствора 25 мМ TrisCl, pH 7.0, 1М NaCl в объеме пяти объемов колонки. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм. Хроматографические фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-SHH, объединяли и проводили гель-фильтрацию на сорбенте Superdex 200 (GE, США). Колонку уравновешивали фосфатно-солевым буфером. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм, фракции анализировали электрофорезом в агарозном геле. Фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-SHH объединяли и хранили при -20°С. Для оценки воспроизводимости техпроцесса обозначенные технологические операции повторяли пятикратно. Все технологические операции для штаммов Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или Escherichia coli SCS110-AF/VTvaf17-NOG, или Escherichia coli SCS110-AF/VTvaf17-WNT7A проводили аналогичным образом.
Воспроизводимость техпроцесса и количественные характеристики выхода конечного продукта подтверждают технологичность получения и возможность производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A.
Таким образом, созданный генотерапевтический ДНК-вектор с целевым геном может быть использован для введения в клетки организма животных и человека, характеризующихся сниженной или недостаточной экспрессией белка, кодируемого данным геном, обеспечивая таким образом достижение терапевтического эффекта.
Задача, поставленная в данном изобретении, а именно: конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии генов SHH, CTNNB1, NOG, WNT7A, сочетающих в себе следующие свойства:
I) Эффективность повышения экспрессии целевых генов в эукариотических клетках за счет полученных генотерапевтических векторов с минимальным размером;
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов и генов антибиотикорезистентности;
III) Технологичность получения и возможность наработки в штаммах в промышленных масштабах;
IV) также задача по конструированию штаммов, несущих эти генотерапевтические ДНК-вектора для производства этих генотерапевтических ДНК-векторов решена, что подтверждается примерами:
для п.I - пример 1, 2, 3, 4, 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18.
для п.II - пример 1, 2, 3, 4.
для п.III и п.IV - пример 19, 20.
Промышленная применимость:
Все представленные выше примеры подтверждают промышленную применимость предлагаемого генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген SHH, ген CTNNB1, ген NOG, ген WNT7A для повышения уровня экспрессии этих целевых генов, штамма Escherichia coli SCS110-AF/VTvaf17-SHH или Escherichia coli SCS110-AF/VTvaf17-CTNNB1 или Escherichia coli SCS110-AF/VTvaf17-NOG или Escherichia coli SCS110-AF/VTvaf17-WNT7A, несущего генотерапевтический ДНК-вектор, способа получения генотерапевтического ДНК-вектора, способа производства в промышленных масштабах генотерапевтического ДНК-вектора.
Перечень сокращений
VTvaf17 - вектор генотерапевтический, не содержащий последовательностей вирусных геномов и маркеров антибиотико-резистентности (vector therapeutic virus-antibiotic-free)
ДНК - дезоксирибонуклеиновая кислота
кДНК - комплементарная дезоксирибонуклеиновая кислота
РНК - рибонуклеиновая кислота
мРНК - матричная рибонуклеиновая кислота
п.н. - пар нуклеотидов
ПЦР - полимеразная цепная реакция
мл - миллилитр, мкл - микролитр
куб. мм - кубический миллиметр
л - литр
мкг - микрограмм
мг - миллиграмм
г - грамм
мкМ - микромоль
мМ - миллимоль
мин - минута
сек - секунда
об/мин - обороты в минуту
нм - нанометр
см - сантиметр
мВт - милливатт
о.е. ф - относительная единица флуоресценции
РВС - фосфатно-солевой буфер.
Список литературы
1. Ahmed, R. P. H., Haider, K. H., Shujia, J., Afzal, M. R., & Ashraf, M. (2010). Sonic Hedgehog Gene Delivery to the Rodent Heart Promotes Angiogenesis via iNOS/Netrin-1/PKC Pathway. PLoS ONE, 5(1), e8576.
2. Benraiss A, Bruel-Jungerman E, Lu G, Economides AN, Davidson B, Goldman SA. Sustained induction of neuronal addition to the adult rat neostriatum by AAV4-delivered NOG and BDNF. Gene Ther. 2012 May; 19(5):483-93.
3. Bentzinger CF, von Maltzahn J, Dumont NA, Stark DA, Wang YX, Nhan K, Frenette J, Cornelison DD, Rudnicki MA. Wnt7a stimulates myogenic stem cell motility and engraftment resulting in improved muscle strength. J Cell Biol. 2014 Apr 14; 205(1):97-111.
4. Botchkarev VA, Botchkareva NV, Nakamura M, Huber O, Funa K, Lauster R, Paus R, Gilchrest BA. NOG is required for induction of the hair follicle growth phase in postnatal skin. FASEB J. 2001 Oct; 15(12):2205-14.
5. Cooper GM, Usas A, Olshanski A, Mooney MP, Losee JE, Huard J. Ex vivo NOG gene therapy inhibits bone formation in a mouse model of postoperative resynostosis. Plast Reconstr Surg. 2009 Feb; 123(2 Suppl):94S-103S.
6. Cui CY, Kunisada M, Childress V, Michel M, Schlessinger D. Shh is required for Tabby hair follicle development. Cell Cycle. 2011 Oct 1; 10(19):3379-86.
7. daughter. N Engl J Med 263:839–842.
8. daughter. N Engl J Med 263:839–842.
9. daughter. N Engl J Med 263:839–842.
10. Dong L, Hao H, Liu J, Ti D, Tong C, Hou Q, Li M, Zheng J, Liu G, Fu X, Han W. A Conditioned Medium of Umbilical Cord Mesenchymal Stem Cells Overexpressing Wnt7a Promotes Wound Repair and Regeneration of Hair Follicles in Mice. Stem Cells Int. 2017; 2017:3738071.
11. Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products, http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC 500187020.pdf.
12. Enshell-Seijffers D, Lindon C, Wu E, Taketo MM, Morgan BA. Beta-catenin activity in the dermal papilla of the hair follicle regulates pigment-type switching. Proc Natl Acad Sci U S A. 2010 Dec 14; 107(50):21564-9.
13. Fiuraskova M, Brychtova S, Kolar Z, Kucerova R, Bienova M. Expression of beta-catenin, p63 and CD34 in hair follicles during the course of androgenetic alopecia. Arch Dermatol Res. 2005 Sep; 297(3):143-6. Epub 2005 Sep 29.
14. Ghadakzadeh S, Kannu P, Whetstone H, Howard A, Alman BA. в-Catenin modulation in neurofibromatosis type 1 bone repair: therapeutic implications. FASEB J. 2016 Sep; 30(9):3227-37.
15. Glaser, Kaplan, Wang, Wilson, Stahl, Shore NOG GENE THERAPY FOR THE PREVENTION OF BMP INDUCED HETEROTOPIC OSSIFICATION IN THE MOUSE: IMPLICATIONS FOR THE TREATMENT OF FIBRODYSPLASIA OSSIFICANS PROGRESSIVA AND OTHER DISORDERS OF ECTOPIC OSSIFICATION IN HUMANS. 48th Annual Meeting of the Orthopaedic Research Society; Poster No: 0493.
16. Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products EMA/CAT/80183/2014.
17. Hahn JY, Cho HJ, Bae JW, Yuk HS, Kim KI, Park KW, Koo BK, Chae IH, Shin CS, Oh BH, Choi YS, Park YB, Kim HS. Beta-catenin overexpression reduces myocardial infarct size through differential effects on cardiomyocytes and cardiac fibroblasts. J Biol Chem. 2006 Oct 13; 281(41):30979-89.
18. Hornstein BD, Roman D, Arévalo-Soliz LM, Engevik MA, Zechiedrich L. Effects of Circular DNA Length on Transfection Efficiency by Electroporation into HeLa Cells. Ceña V, ed. PLoS ONE. 2016; 11(12):e0167537. doi:10.1371/journal.pone.0167537.
19. Ito, Z. Yang, T. Andl et al., “Wnt-dependent de novo hair follicle regeneration in adult mouse skin after wounding,” Nature, vol. 447, no. 7142, pp. 316–320, 2007.
20. Kharbanda M, Pilz DT, Tomkins S, Chandler K, Saggar A, Fryer A, McKay V, Louro P, Smith JC, Burn J, Kini U, De Burca A, FitzPatrick DR, Kinning E; DDD Study.Clinical features associated with CTNNB1 de novo loss of function mutations in ten individuals. Eur J Med Genet. 2017 Feb; 60(2):130-135.
21. Lee YB, Eun YS, Lee JH, Cheon MS, Park YG, Cho BK, Park HJ. Effects of topical application of growth factors followed by microneedle therapy in women with female pattern hair loss: a pilot study. J Dermatol. 2013 Jan; 40(1):81-3.
22. Li H, Fan L, Zhu S, Shin MK, Lu F, Qu J, Hou L. Epilation induces hair and skin pigmentation through an EDN3/EDNRB-dependent regenerative response of melanocyte stem cells. Sci Rep.2017 Aug 4; 7(1):7272.
23. Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines. 2016; 15(3):313-29.
24. Ma H, Marti-Gutierrez N, Park SW, Wu J, Lee Y, Suzuki K, Koski A, Ji D, Hayama T, Ahmed R, Darby H, Van Dyken C, Li Y, Kang E, Park AR, Kim D, Kim ST, Gong J, Gu Y, Xu X, Battaglia D, Krieg SA, Lee DM, Wu DH, Wolf DP, Heitner SB, Belmonte JCI, Amato P, Kim JS, Kaul S, Mitalipov S. Correction of a pathogenic gene mutation in human embryos. Nature. 2017 Aug 24; 548(7668):413-419.
25. Mairhofer J, Grabherr R. Rational vector design for efficient non-viral gene delivery: challenges facing the use of plasmid DNA. Mol Biotechnol. 2008. 39(2):97-104.
26. McCollum PT, Bush JA, James G, Mason T, O'Kane S, McCollum C, Krievins D, Shiralkar S, Ferguson MW. Randomized phase II clinical trial of avotermin versus placebo for scar improvement. Br J Surg. 2011 Jul; 98(7):925-34.
27. Mullor JL, Sánchez P, Ruiz i Altaba A. Pathways and consequences: Hedgehog signaling in human disease. Trends Cell Biol. 2002 Dec; 12(12):562-9.
28. Paladini RD, Saleh J, Qian C, Xu GX, Rubin LL. Modulation of hair growth with small molecule agonists of the hedgehog signaling pathway. J Invest Dermatol. 2005 Oct; 125(4):638-46.
29. Park HJ, Lee J, Kim MJ, Kang TJ, Jeong Y, Um SH, Cho SW. Sonic hedgehog intradermal gene therapy using a biodegradable poly(в-amino esters) nanoparticle to enhance wound healing. Biomaterials. 2012 Dec; 33(35):9148-56.
30. Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies.
31. Reis LM, Semina EV. Conserved genetic pathways associated with microphthalmia, anophthalmia, and coloboma. Birth Defects Res C Embryo Today. 2015 Jun; 105(2):96-113.
32. Roncalli J, Renault M-A, Tongers J, et al. Sonic-hedgehog–induced functional recovery after myocardial infarction is enhanced by AMD3100-mediated progenitor-cell mobilization. Journal of the American College of Cardiology. 2011; 57(24):2444-2452.
33. Shi F, Hu L, Jacques BE, Mulvaney JF, Dabdoub A, Edge AS. β-Catenin is required for hair-cell differentiation in the cochlea. J Neurosci. 2014 May 7; 34(19):6470-9.
34. Shin JA, Lim SM, Jeong SI, Kang JL, Park EM. NOG improves ischemic brain tissue repair and promotes alternative activation of microglia in mice. Brain Behav Immun. 2014 Aug; 40:143-54.
35. Tosti A, Zaiac MN, Canazza A, Sanchis-Gomar F, Pareja-Galeano H, Alis R, Lucia A, Emanuele E. Topical application of the Wnt/в-catenin activator methyl vanillate increases hair count and hair mass index in women with androgenetic alopecia. J Cosmet Dermatol. 2016 Dec; 15(4):469-474.
36. Tran KA, Zhang X, Predescu D, Huang X, Machado RF, Gцthert JR, Malik AB, Valyi-Nagy T, Zhao YY. Endothelial в-Catenin Signaling Is Required for Maintaining Adult Blood-Brain Barrier Integrity and Central Nervous System Homeostasis. Circulation. 2016 Jan 12; 133(2):177-86.
37. Tucker AS, Matthews KL, Sharpe PT. Transformation of tooth type induced by inhibition of BMP signaling. Science 1998; 282:1136–8.
38. Usami N, Sekido Y, Maeda O, Yamamoto K, Minna JD, Hasegawa Y, Yoshioka H, Imaizumi M, Ueda Y, Takahashi M, Shimokata K. Beta-catenin inhibits cell growth of a malignant mesothelioma cell line, NCI-H28, with a 3p21.3 homozygous deletion. Oncogene. 2003 Sep 11; 22(39):7923-30.
39. Vesell ES. 1960. Symphalangism, strabismus and hearing loss in mother and.
40. Vesell ES. 1960. Symphalangism, strabismus and hearing loss in mother and.
41. Vesell ES. 1960. Symphalangism, strabismus and hearing loss in mother and.
42. von Maltzahn J, Renaud JM, Parise G, Rudnicki MA. Wnt7a treatment ameliorates muscular dystrophy. Proc Natl Acad Sci U S A. 2012 Dec 11; 109(50):20614-9.
43. Wang Z, Havasi A, Gall JM, Mao H, Schwartz JH, Borkan SC. Beta-catenin promotes survival of renal epithelial cells by inhibiting Bax. J Am Soc Nephrol. 2009 Sep; 20(9):1919-28.
44. Weiss K, Kruszka P, Guillen Sacoto MJ, Addissie YA, Hadley DW, Hadsall CK, Stokes B, Hu P, Roessler E, Solomon B, Wiggs E, Thurm A, Hufnagel RB, Zein WM, Hahn JS, Stashinko E, Levey E, Baldwin D, Clegg NJ, Delgado MR, Muenke M. In-depth investigations of adolescents and adults with holoprosencephaly identify unique characteristics. Genet Med. 2018 Jan; 20(1):14-23.
45. Williams JA. Hedgehog and spinal cord injury. Expert Opin Ther Targets. 2005 Dec; 9(6):1137-45.
46. Xie Z, Wang P, Li Y, Deng W, Zhang X, Su H, Li D, Wu Y, Shen H. Imbalance Between Bone Morphogenetic Protein 2 and NOG Induces Abnormal Osteogenic Differentiation of Mesenchymal Stem Cells in Ankylosing Spondylitis. Arthritis Rheumatol. 2016 Feb; 68(2):430-40.
47. Yeh WH, Chiang H, Rees HA, Edge ASB, Liu DR. In vivo base editing of post-mitotic sensory cells. Nat Commun. 2018 Jun 5; 9(1):2184.
48. You J, Nguyen AV, Albers CG, Lin F, Holcombe RF. Wnt pathway-related gene expression in inflammatory bowel disease. Dig Dis Sci. 2008 Apr; 53(4):1013-9.
49. Zhang Y, Wang N, Ma J, Chen XC, Li Z, Zhao W. Expression profile analysis of new candidate genes for the therapy of primary osteoporosis. Eur Rev Med Pharmacol Sci. 2016; 20(3):433-40.
50. Заявка US 20060105950 A1.
51. Заявка WO 2000031134 A1.
52. Заявка WO 2013040341 A2.
53. Молекулярная биология, 2011, том 45, №1, с. 44-55.
54. Патент US 9550998 В2.
55. Патент US 5843775 A.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>Селл энд Джин Терапи Лтд (CELL and GENE THERAPY Ltd), Общество с ограниченной ответственностью «Прорывные Инновационные Технологии»,
<120>Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм Escherichia coli SCS110-AF/VTvaf17-SHH или Escherichia coli SCS110-AF/VTvaf17-CTNNB1 или Escherichia coli SCS110-AF/VTvaf17-NOG или Escherichia coli SCS110-AF/VTvaf17-WNT7A, несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора.
<160>4
<170>BiSSAP 1.3.6
<210>1
<211>4545
<212>DNA
<213>Homo Sapiens
<400>1
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatgc tgctgctggc gagatgtctg ctgctagtcc tcgtctcctc 1260
gctgctggta tgctcgggac tggcgtgcgg accgggcagg gggttcggga agaggaggca 1320
ccccaaaaag ctgacccctt tagcctacaa gcagtttatc cccaatgtgg ccgagaagac 1380
cctaggcgcc agcggaaggt atgaagggaa gatctccaga aactccgagc gatttaagga 1440
actcaccccc aattacaacc ccgacatcat atttaaggat gaagaaaaca ccggagcgga 1500
caggctgatg actcagaggt gtaaggacaa gttgaacgct ttggccatct cggtgatgaa 1560
ccagtggcca ggagtgaaac tgcgggtgac cgagggctgg gacgaagatg gccaccactc 1620
agaggagtct ctgcactacg agggccgcgc agtggacatc accacgtctg accgcgaccg 1680
cagcaagtac ggcatgctgg cccgcctggc ggtggaggcc ggcttcgact gggtgtacta 1740
cgagtccaag gcacatatcc actgctcggt gaaagcagag aactcggtgg cggccaaatc 1800
gggaggctgc ttcccgggct cggccacggt gcacctggag cagggcggca ccaagctggt 1860
gaaggacctg agccccgggg accgcgtgct ggcggcggac gaccagggcc ggctgctcta 1920
cagcgacttc ctcactttcc tggaccgcga cgacggcgcc aagaaggtct tctacgtgat 1980
cgagacgcgg gagccgcgcg agcgcctgct gctcaccgcc gcgcacctgc tctttgtggc 2040
gccgcacaac gactcggcca ccggggagcc cgaggcgtcc tcgggctcgg ggccgccttc 2100
cgggggcgca ctggggcctc gggcgctgtt cgccagccgc gtgcgcccgg gccagcgcgt 2160
gtacgtggtg gccgagcgtg acggggaccg ccggctcctg cccgccgctg tgcacagcgt 2220
gaccctaagc gaggaggccg cgggcgccta cgcgccgctc acggcccagg gcaccattct 2280
catcaaccgg gtgctggcct cgtgctacgc ggtcatcgag gagcacagct gggcgcaccg 2340
ggccttcgcg cccttccgcc tggcgcacgc gctcctggct gcactggcgc ccgcgcgcac 2400
ggaccgcggc ggggacagcg gcggcgggga ccgcgggggc ggcggcggca gagtagccct 2460
aaccgctcca ggtgctgccg acgctccggg tgcgggggcc accgcgggca tccactggta 2520
ctcgcagctg ctctaccaaa taggcacctg gctcctggac agcgaggccc tgcacccgct 2580
gggcatggcg gtcaagtcca gctgaaagct tggtaccgaa ttccctgtga cccctcccca 2640
gtgcctctcc tggccctgga agttgccact ccagtgccca ccagccttgt cctaataaaa 2700
ttaagttgca tcattttgtc tgactaggtg tccttctata atattatggg gtggaggggg 2760
gtggtatgga gcaaggggca agttgggaag acaacctgta gggcctgcgg ggtctattgg 2820
gaaccaagct ggagtgcagt ggcacaatct tggctcactg caatctccgc ctcctgggtt 2880
caagcgattc tcctgcctca gcctcccgag ttgttgggat tccaggcatg catgaccagg 2940
ctcagctaat ttttgttttt ttggtagaga cggggtttca ccatattggc caggctggtc 3000
tccaactcct aatctcaggt gatctaccca ccttggcctc ccaaattgct gggattacag 3060
gcgtgaacca ctgctccctt ccctgtcctt acgcgtagaa ttggtaaaga gagtcgtgta 3120
aaatatcgag ttcgcacatc ttgttgtctg attattgatt tttggcgaaa ccatttgatc 3180
atatgacaag atgtgtatct accttaactt aatgattttg ataaaaatca ttaactagtc 3240
catggctgcc tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg 3300
gagacggtca cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg 3360
tcagcgggtg ttggcgggtg tcggggcgca gccatgaccc agtcacgtag cgatagcgga 3420
gtgtatactg gcttaactat gcggcatcag agcagattgt actgagagtg caccatatgc 3480
ggtgtgaaat accgcacaga tgcgtaagga gaaaataccg catcaggcgc tcttccgctt 3540
cctcgctcac tgactcgctg cgctcggtcg ttcggctgcg gcgagcggta tcagctcact 3600
caaaggcggt aatacggtta tccacagaat caggggataa cgcaggaaag aacatgtgag 3660
caaaaggcca gcaaaaggcc aggaaccgta aaaaggccgc gttgctggcg tttttccata 3720
ggctccgccc ccctgacgag catcacaaaa atcgacgctc aagtcagagg tggcgaaacc 3780
cgacaggact ataaagatac caggcgtttc cccctggaag ctccctcgtg cgctctcctg 3840
ttccgaccct gccgcttacc ggatacctgt ccgcctttct cccttcggga agcgtggcgc 3900
tttctcatag ctcacgctgt aggtatctca gttcggtgta ggtcgttcgc tccaagctgg 3960
gctgtgtgca cgaacccccc gttcagcccg accgctgcgc cttatccggt aactatcgtc 4020
ttgagtccaa cccggtaaga cacgacttat cgccactggc agcagccact ggtaacagga 4080
ttagcagagc gaggtatgta ggcggtgcta cagagttctt gaagtggtgg cctaactacg 4140
gctacactag aagaacagta tttggtatct gcgctctgct gaagccagtt accttcggaa 4200
aaagagttgg tagctcttga tccggcaaac aaaccaccgc tggtagcggt ggtttttttg 4260
tttgcaagca gcagattacg cgcagaaaaa aaggatctca agaagatcct ttgatctttt 4320
ctacggggtc tgacgctcag tggaacgaaa actcacgtta agggattttg gtcatgagat 4380
tatcaaaaag gatcttcacc tagatccttt taaattaaaa atgaagtttt aaatcaatct 4440
aaagtatata tgagtaaact tggtctgaca gttaccaatg cttaatcagt gaggcaccta 4500
tctcagcgat ctgtctattt cgttcatcca tagttgcctg actcc 4545
<210>2
<211>5509
<212>DNA
<213>Homo Sapiens
<400>2
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tggctaccca agctgatttg atggagttgg 1260
acatggccat ggaaccagac agaaaagcgg ctgttagtca ctggcagcaa cagtcttacc 1320
tggactctgg aatccattct ggtgccacta ccacagctcc ttctctgagt ggtaaaggca 1380
atcctgagga agaggatgtg gatacctccc aagtcctgta tgagtgggaa cagggatttt 1440
ctcagtcctt cactcaagaa caagtagctg atattgatgg acagtatgca atgactcgag 1500
ctcagagggt acgagctgct atgttccctg agacattaga tgagggcatg cagatcccat 1560
ctacacagtt tgatgctgct catcccacta atgtccagcg tttggctgaa ccatcacaga 1620
tgctgaaaca tgcagttgta aacttgatta actatcaaga tgatgcagaa cttgccacac 1680
gtgcaatccc tgaactgaca aaactgctaa atgacgagga ccaggtggtg gttaataagg 1740
ctgcagttat ggtccatcag ctttctaaaa aggaagcttc cagacacgct atcatgcgtt 1800
ctcctcagat ggtgtctgct attgtacgta ccatgcagaa tacaaatgat gtagaaacag 1860
ctcgttgtac cgctgggacc ttgcataacc tttcccatca tcgtgagggc ttactggcca 1920
tctttaagtc tggaggcatt cctgccctgg tgaaaatgct tggttcacca gtggattctg 1980
tgttgtttta tgccattaca actctccaca accttttatt acatcaagaa ggagctaaaa 2040
tggcagtgcg tttagctggt gggctgcaga aaatggttgc cttgctcaac aaaacaaatg 2100
ttaaattctt ggctattacg acagactgcc ttcaaatttt agcttatggc aaccaagaaa 2160
gcaagctcat catactggct agtggtggac cccaagcttt agtaaatata atgaggacct 2220
atacttacga aaaactactg tggaccacaa gcagagtgct gaaggtgcta tctgtctgct 2280
ctagtaataa gccggctatt gtagaagctg gtggaatgca agctttagga cttcacctga 2340
cagatccaag tcaacgtctt gttcagaact gtctttggac tctcaggaat ctttcagatg 2400
ctgcaactaa acaggaaggg atggaaggtc tccttgggac tcttgttcag cttctgggtt 2460
cagatgatat aaatgtggtc acctgtgcag ctggaattct ttctaacctc acttgcaata 2520
attataagaa caagatgatg gtctgccaag tgggtggtat agaggctctt gtgcgtactg 2580
tccttcgggc tggtgacagg gaagacatca ctgagcctgc catctgtgct cttcgtcatc 2640
tgaccagccg acaccaagaa gcagagatgg cccagaatgc agttcgcctt cactatggac 2700
taccagttgt ggttaagctc ttacacccac catcccactg gcctctgata aaggctactg 2760
ttggattgat tcgaaatctt gccctttgtc ccgcaaatca tgcacctttg cgtgagcagg 2820
gtgccattcc acgactggtt cagttgcttg ttcgtgcaca tcaggatacc cagcgccgta 2880
cgtccatggg tgggacacag cagcaatttg tggagggggt ccgcatggaa gaaatagttg 2940
aaggttgtac cggagccctt cacatcctag ctcgggatgt tcacaaccga attgttatca 3000
gaggactaaa taccattcca ttgtttgtgc agctgcttta ttctcccatt gaaaacatcc 3060
aaagagtagc tgcaggggtc ctctgtgaac ttgctcagga caaggaagct gcagaagcta 3120
ttgaagctga gggagccaca gctcctctga cagagttact tcactctagg aatgaaggtg 3180
tggcgacata tgcagctgct gttttgttcc gaatgtctga ggacaagcca caagattaca 3240
agaaacggct ttcagttgag ctgaccagct ctctcttcag aacagagcca atggcttgga 3300
atgagactgc tgatcttgga cttgatattg gtgcccaggg agaacccctt ggatatcgcc 3360
aggatgatcc tagctatcgt tcttttcact ctggtggata tggccaggat gccttgggta 3420
tggaccccat gatggaacat gagatgggtg gccaccaccc tggtgctgac tatccagttg 3480
atgggctgcc agatctgggg catgcccagg acctcatgga tgggctgcct ccaggtgaca 3540
gcaatcagct ggcctggttt gatactgacc tgtaaggtac cgaattccct gtgacccctc 3600
cccagtgcct ctcctggccc tggaagttgc cactccagtg cccaccagcc ttgtcctaat 3660
aaaattaagt tgcatcattt tgtctgacta ggtgtccttc tataatatta tggggtggag 3720
gggggtggta tggagcaagg ggcaagttgg gaagacaacc tgtagggcct gcggggtcta 3780
ttgggaacca agctggagtg cagtggcaca atcttggctc actgcaatct ccgcctcctg 3840
ggttcaagcg attctcctgc ctcagcctcc cgagttgttg ggattccagg catgcatgac 3900
caggctcagc taatttttgt ttttttggta gagacggggt ttcaccatat tggccaggct 3960
ggtctccaac tcctaatctc aggtgatcta cccaccttgg cctcccaaat tgctgggatt 4020
acaggcgtga accactgctc ccttccctgt ccttacgcgt agaattggta aagagagtcg 4080
tgtaaaatat cgagttcgca catcttgttg tctgattatt gatttttggc gaaaccattt 4140
gatcatatga caagatgtgt atctacctta acttaatgat tttgataaaa atcattaact 4200
agtccatggc tgcctcgcgc gtttcggtga tgacggtgaa aacctctgac acatgcagct 4260
cccggagacg gtcacagctt gtctgtaagc ggatgccggg agcagacaag cccgtcaggg 4320
cgcgtcagcg ggtgttggcg ggtgtcgggg cgcagccatg acccagtcac gtagcgatag 4380
cggagtgtat actggcttaa ctatgcggca tcagagcaga ttgtactgag agtgcaccat 4440
atgcggtgtg aaataccgca cagatgcgta aggagaaaat accgcatcag gcgctcttcc 4500
gcttcctcgc tcactgactc gctgcgctcg gtcgttcggc tgcggcgagc ggtatcagct 4560
cactcaaagg cggtaatacg gttatccaca gaatcagggg ataacgcagg aaagaacatg 4620
tgagcaaaag gccagcaaaa ggccaggaac cgtaaaaagg ccgcgttgct ggcgtttttc 4680
cataggctcc gcccccctga cgagcatcac aaaaatcgac gctcaagtca gaggtggcga 4740
aacccgacag gactataaag ataccaggcg tttccccctg gaagctccct cgtgcgctct 4800
cctgttccga ccctgccgct taccggatac ctgtccgcct ttctcccttc gggaagcgtg 4860
gcgctttctc atagctcacg ctgtaggtat ctcagttcgg tgtaggtcgt tcgctccaag 4920
ctgggctgtg tgcacgaacc ccccgttcag cccgaccgct gcgccttatc cggtaactat 4980
cgtcttgagt ccaacccggt aagacacgac ttatcgccac tggcagcagc cactggtaac 5040
aggattagca gagcgaggta tgtaggcggt gctacagagt tcttgaagtg gtggcctaac 5100
tacggctaca ctagaagaac agtatttggt atctgcgctc tgctgaagcc agttaccttc 5160
ggaaaaagag ttggtagctc ttgatccggc aaacaaacca ccgctggtag cggtggtttt 5220
tttgtttgca agcagcagat tacgcgcaga aaaaaaggat ctcaagaaga tcctttgatc 5280
ttttctacgg ggtctgacgc tcagtggaac gaaaactcac gttaagggat tttggtcatg 5340
agattatcaa aaaggatctt cacctagatc cttttaaatt aaaaatgaag ttttaaatca 5400
atctaaagta tatatgagta aacttggtct gacagttacc aatgcttaat cagtgaggca 5460
cctatctcag cgatctgtct atttcgttca tccatagttg cctgactcc 5509
<210>3
<211>4859
<212>DNA
<213>Homo Sapiens
<400>3
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatgg agcgctgccc cagcctaggg gtcaccctct acgccctggt 1260
ggtggtcctg gggctgcggg cgacaccggc cggcggccag cactatctcc acatccgccc 1320
ggcacccagc gacaacctgc ccctggtgga cctcatcgaa cacccagacc ctatctttga 1380
ccccaaggaa aaggatctga acgagacgct gctgcgctcg ctgctcgggg gccactacga 1440
cccaggcttc atggccacct cgccccccga ggaccggccc ggcgggggcg ggggtgcagc 1500
tgggggcgcg gaggacctgg cggagctgga ccagctgctg cggcagcggc cgtcgggggc 1560
catgccgagc gagatcaaag ggctagagtt ctccgagggc ttggcccagg gcaagaagca 1620
gcgcctaagc aagaagctgc ggaggaagtt acagatgtgg ctgtggtcgc agacattctg 1680
ccccgtgctg tacgcgtgga acgacctggg cagccgcttt tggccgcgct acgtgaaggt 1740
gggcagctgc ttcagtaagc gctcgtgctc cgtgcccgag ggcatggtgt gcaagccgtc 1800
caagtccgtg cacctcacgg tgctgcggtg gcgctgtcag cggcgcgggg gccagcgctg 1860
cggctggatt cccatccagt accccatcat ttccgagtgc aagtgctcgt gctagaattc 1920
cctgtgaccc ctccccagtg cctctcctgg ccctggaagt tgccactcca gtgcccacca 1980
gccttgtcct aataaaatta agttgcatca ttttgtctga ctaggtgtcc ttctataata 2040
ttatggggtg gaggggggtg gtatggagca aggggcaagt tgggaagaca acctgtaggg 2100
cctgcggggt ctattgggaa ccaagctgga gtgcagtggc acaatcttgg ctcactgcaa 2160
tctccgcctc ctgggttcaa gcgattctcc tgcctcagcc tcccgagttg ttgggattcc 2220
aggcatgcat gaccaggctc agctaatttt tgtttttttg gtagagacgg ggtttcacca 2280
tattggccag gctggtctcc aactcctaat ctcaggtgat ctacccacct tggcctccca 2340
aattgctggg attacaggcg tgaaccactg ctcccttccc tgtccttacg cgtagaattg 2400
gtaaagagag tcgtgtaaaa tatcgagttc gcacatcttg ttgtctgatt attgattttt 2460
ggcgaaacca tttgatcata tgacaagatg tgtatctacc ttaacttaat gattttgata 2520
aaaatcatta actagttttc tacggggtct gacgctcagt ggaacgaaaa ctcacgttaa 2580
gggattttgg tcatgaacaa taaaactgtc tgcttacata aacagtaata caaggggtgt 2640
tatgagccat attcaacggg aaacgtcttg ctctaggccg cgattaaatt ccaacatgga 2700
tgctgattta tatgggtata aatgggctcg cgataatgtc gggcaatcag gtgcgacaat 2760
ctatcgattg tatgggaagc ccgatgcgcc agagttgttt ctgaaacatg gcaaaggtag 2820
cgttgccaat gatgttacag atgagatggt cagactaaac tggctgacgg aatttatgcc 2880
tcttccgacc atcaagcatt ttatccgtac tcctgatgat gcatggttac tcaccactgc 2940
gatccccggg aaaacagcat tccaggtatt agaagaatat cctgattcag gtgaaaatat 3000
tgttgatgcg ctggcagtgt tcctgcgccg gttgcattcg attcctgttt gtaattgtcc 3060
ttttaacagc gatcgcgtat ttcgtctcgc tcaggcgcaa tcacgaatga ataacggttt 3120
ggttgatgcg agtgattttg atgacgagcg taatggctgg cctgttgaac aagtctggaa 3180
agaaatgcat aaacttttgc cattctcacc ggattcagtc gtcactcatg gtgatttctc 3240
acttgataac cttatttttg acgaggggaa attaataggt tgtattgatg ttggacgagt 3300
cggaatcgca gaccgatacc aggatcttgc catcctatgg aactgcctcg gtgagttttc 3360
tccttcatta cagaaacggc tttttcaaaa atatggtatt gataatcctg atatgaataa 3420
attgcagttt catttgatgc tcgatgagtt tttctaagaa ttaattcatg agcggataca 3480
tatttgaatg tatttagaaa aataaacaaa taggggttcc gcgcacattt ccccgaaaag 3540
tgccaccact agtccatggc tgcctcgcgc gtttcggtga tgacggtgaa aacctctgac 3600
acatgcagct cccggagacg gtcacagctt gtctgtaagc ggatgccggg agcagacaag 3660
cccgtcaggg cgcgtcagcg ggtgttggcg ggtgtcgggg cgcagccatg acccagtcac 3720
gtagcgatag cggagtgtat actggcttaa ctatgcggca tcagagcaga ttgtactgag 3780
agtgcaccat atgcggtgtg aaataccgca cagatgcgta aggagaaaat accgcatcag 3840
gcgctcttcc gcttcctcgc tcactgactc gctgcgctcg gtcgttcggc tgcggcgagc 3900
ggtatcagct cactcaaagg cggtaatacg gttatccaca gaatcagggg ataacgcagg 3960
aaagaacatg tgagcaaaag gccagcaaaa ggccaggaac cgtaaaaagg ccgcgttgct 4020
ggcgtttttc cataggctcc gcccccctga cgagcatcac aaaaatcgac gctcaagtca 4080
gaggtggcga aacccgacag gactataaag ataccaggcg tttccccctg gaagctccct 4140
cgtgcgctct cctgttccga ccctgccgct taccggatac ctgtccgcct ttctcccttc 4200
gggaagcgtg gcgctttctc atagctcacg ctgtaggtat ctcagttcgg tgtaggtcgt 4260
tcgctccaag ctgggctgtg tgcacgaacc ccccgttcag cccgaccgct gcgccttatc 4320
cggtaactat cgtcttgagt ccaacccggt aagacacgac ttatcgccac tggcagcagc 4380
cactggtaac aggattagca gagcgaggta tgtaggcggt gctacagagt tcttgaagtg 4440
gtggcctaac tacggctaca ctagaagaac agtatttggt atctgcgctc tgctgaagcc 4500
agttaccttc ggaaaaagag ttggtagctc ttgatccggc aaacaaacca ccgctggtag 4560
cggtggtttt tttgtttgca agcagcagat tacgcgcaga aaaaaaggat ctcaagaaga 4620
tcctttgatc ttttctacgg ggtctgacgc tcagtggaac gaaaactcac gttaagggat 4680
tttggtcatg agattatcaa aaaggatctt cacctagatc cttttaaatt aaaaatgaag 4740
ttttaaatca atctaaagta tatatgagta aacttggtct gacagttacc aatgcttaat 4800
cagtgaggca cctatctcag cgatctgtct atttcgttca tccatagttg cctgactcc 4859
<210>4
<211>4275
<212>DNA
<213>Homo Sapiens
<400>4
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tgaaccggaa agcgcggcgc tgcctgggcc 1260
acctctttct cagcctgggc atggtctacc tccggatcgg tggcttctcc tcagtggtag 1320
ctctgggcgc aagcatcatc tgtaacaaga tcccaggcct ggctcccaga cagcgggcga 1380
tctgccagag ccggcccgac gccatcatcg tcataggaga aggctcacaa atgggcctgg 1440
acgagtgtca gtttcagttc cgcaatggcc gctggaactg ctctgcactg ggagagcgca 1500
ccgtcttcgg gaaggagctc aaagtgggga gccgggaggc tgcgttcacc tacgccatca 1560
ttgccgccgg cgtggcccac gccatcacag ctgcctgtac ccagggcaac ctgagcgact 1620
gtggctgcga caaagagaag caaggccagt accaccggga cgagggctgg aagtggggtg 1680
gctgctctgc cgacatccgc tacggcatcg gcttcgccaa ggtctttgtg gatgcccggg 1740
agatcaagca gaatgcccgg actctcatga acttgcacaa caacgaggca ggccgaaaga 1800
tcctggagga gaacatgaag ctggaatgta agtgccacgg cgtgtcaggc tcgtgcacca 1860
ccaagacgtg ctggaccaca ctgccacagt ttcgggagct gggctacgtg ctcaaggaca 1920
agtacaacga ggccgttcac gtggagcctg tgcgtgccag ccgcaacaag cggcccacct 1980
tcctgaagat caagaagcca ctgtcgtacc gcaagcccat ggacacggac ctggtgtaca 2040
tcgagaagtc gcccaactac tgcgaggagg acccggtgac cggcagtgtg ggcacccagg 2100
gccgcgcctg caacaagacg gctccccagg ccagcggctg tgacctcatg tgctgtgggc 2160
gtggctacaa cacccaccag tacgcccgcg tgtggcagtg caactgtaag ttccactggt 2220
gctgctatgt caagtgcaac acgtgcagcg agcgcacgga gatgtacacg tgcaagtgag 2280
gtaccgaatt ccctgtgacc cctccccagt gcctctcctg gccctggaag ttgccactcc 2340
agtgcccacc agccttgtcc taataaaatt aagttgcatc attttgtctg actaggtgtc 2400
cttctataat attatggggt ggaggggggt ggtatggagc aaggggcaag ttgggaagac 2460
aacctgtagg gcctgcgggg tctattggga accaagctgg agtgcagtgg cacaatcttg 2520
gctcactgca atctccgcct cctgggttca agcgattctc ctgcctcagc ctcccgagtt 2580
gttgggattc caggcatgca tgaccaggct cagctaattt ttgttttttt ggtagagacg 2640
gggtttcacc atattggcca ggctggtctc caactcctaa tctcaggtga tctacccacc 2700
ttggcctccc aaattgctgg gattacaggc gtgaaccact gctcccttcc ctgtccttac 2760
gcgtagaatt ggtaaagaga gtcgtgtaaa atatcgagtt cgcacatctt gttgtctgat 2820
tattgatttt tggcgaaacc atttgatcat atgacaagat gtgtatctac cttaacttaa 2880
tgattttgat aaaaatcatt aactagtcca tggctgcctc gcgcgtttcg gtgatgacgg 2940
tgaaaacctc tgacacatgc agctcccgga gacggtcaca gcttgtctgt aagcggatgc 3000
cgggagcaga caagcccgtc agggcgcgtc agcgggtgtt ggcgggtgtc ggggcgcagc 3060
catgacccag tcacgtagcg atagcggagt gtatactggc ttaactatgc ggcatcagag 3120
cagattgtac tgagagtgca ccatatgcgg tgtgaaatac cgcacagatg cgtaaggaga 3180
aaataccgca tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt 3240
cggctgcggc gagcggtatc agctcactca aaggcggtaa tacggttatc cacagaatca 3300
ggggataacg caggaaagaa catgtgagca aaaggccagc aaaaggccag gaaccgtaaa 3360
aaggccgcgt tgctggcgtt tttccatagg ctccgccccc ctgacgagca tcacaaaaat 3420
cgacgctcaa gtcagaggtg gcgaaacccg acaggactat aaagatacca ggcgtttccc 3480
cctggaagct ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc 3540
gcctttctcc cttcgggaag cgtggcgctt tctcatagct cacgctgtag gtatctcagt 3600
tcggtgtagg tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt tcagcccgac 3660
cgctgcgcct tatccggtaa ctatcgtctt gagtccaacc cggtaagaca cgacttatcg 3720
ccactggcag cagccactgg taacaggatt agcagagcga ggtatgtagg cggtgctaca 3780
gagttcttga agtggtggcc taactacggc tacactagaa gaacagtatt tggtatctgc 3840
gctctgctga agccagttac cttcggaaaa agagttggta gctcttgatc cggcaaacaa 3900
accaccgctg gtagcggtgg tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa 3960
ggatctcaag aagatccttt gatcttttct acggggtctg acgctcagtg gaacgaaaac 4020
tcacgttaag ggattttggt catgagatta tcaaaaagga tcttcaccta gatcctttta 4080
aattaaaaat gaagttttaa atcaatctaa agtatatatg agtaaacttg gtctgacagt 4140
taccaatgct taatcagtga ggcacctatc tcagcgatct gtctatttcg ttcatccata 4200
gttgcctgac tcc 4213
<---
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ОЛИГОНУКЛЕОТИДОВ
(1) SHH_F AGGATCCACCATGCTGCTGCTGGCGAGATGTC
(2) SHH_R TATAAGCTTTCAGCTGGACTTGACCGCCAT
(3) SHH_SF TTATCCCCAATGTGGCCGAG
(4) SHH_FR CTGAGTCATCAGCCTGTCCG
(5) CTNNB_F ATCGTCGACCACCATGGCTACCCAAGCTGATTTG
(6) CTNNB_R TTCGGTACCTTACAGGTCAGTATCAAACCAG
(7) CTNNB_SF ATGACTCGAGCTCAGAGGGT
(8) CTNNB_SR ATTGCACGTGTGGCAAGTTC
(9) NOG_F GGATCCACCATGGAGCGCTGCCCCAG
(10) NOG_R ATAGAATTCTAGCACGAGCACTTGCACT
(11) NOG_SF GATCTGAACGAGACGCTGCT
(12) NOG_SR TAGCCCTTTGATCTCGCTCG
(13) WNT_F ATCGTCGACCACCATGAACCGGAAAGCGCGGCGCT
(14) WNT_R TTCGGTACCTCACTTGCACGTGTACATCTCCGT
(15) WNT_SF GCGACAAAGAGAAGCAAGGC
(16) WNT_SR CTCCTCCAGGATCTTTCGGC
<---
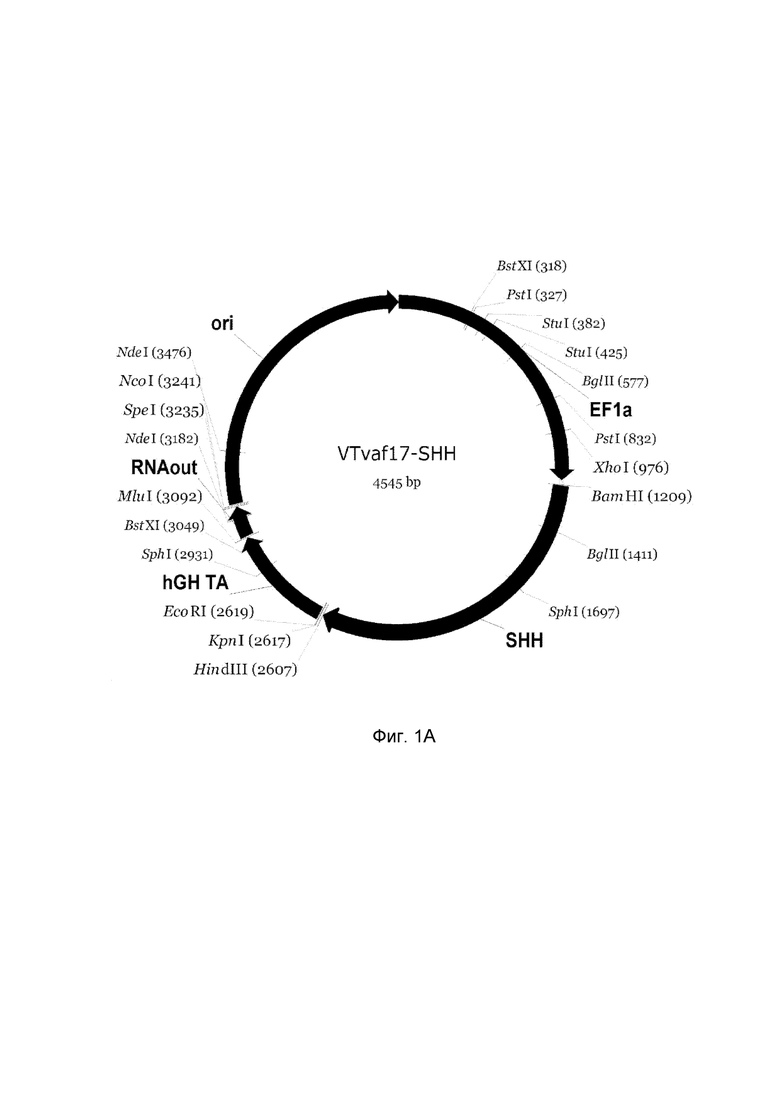
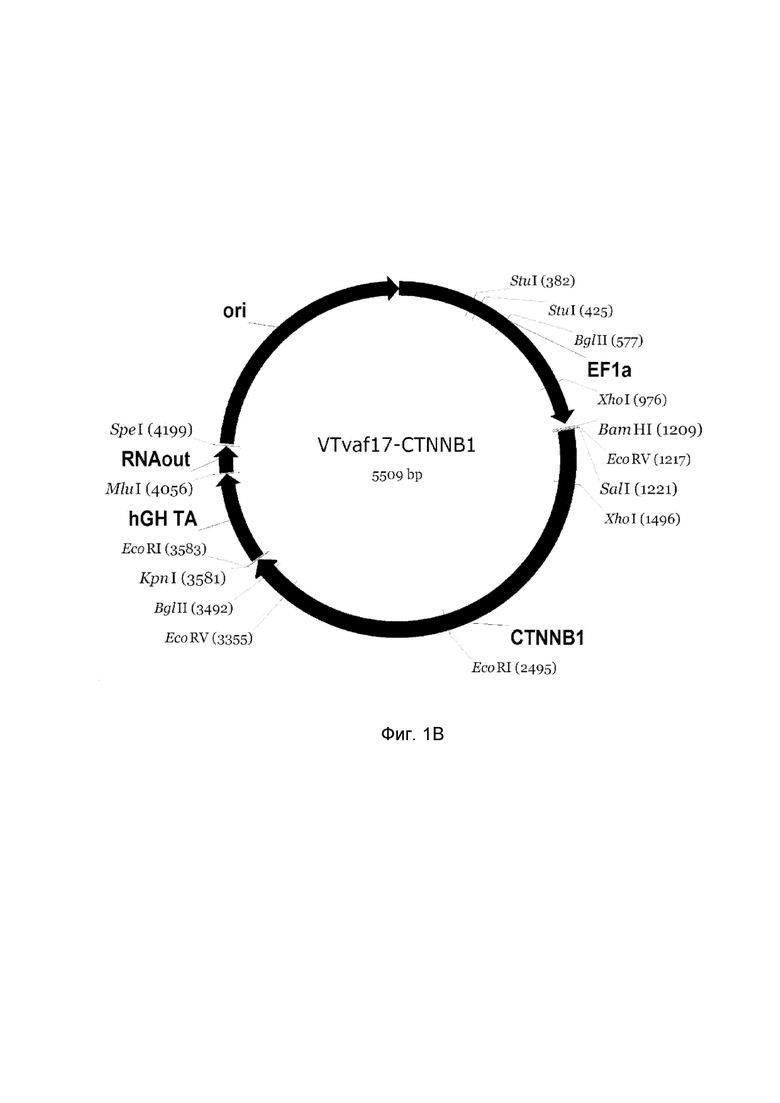
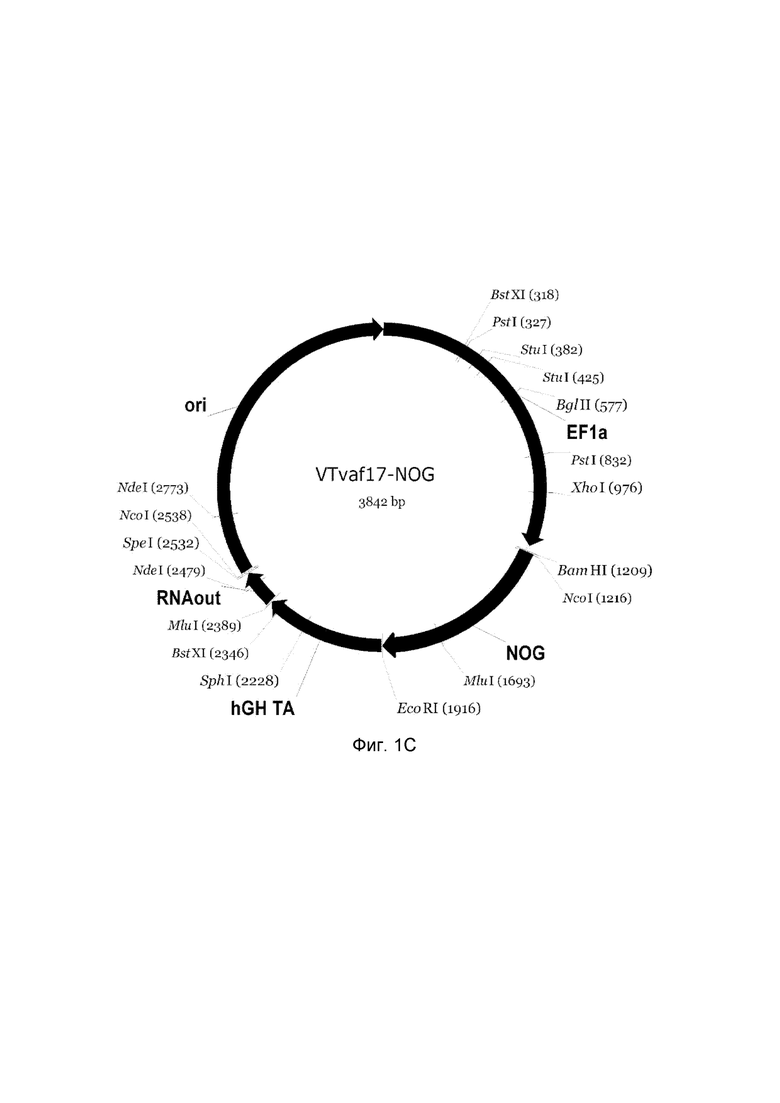
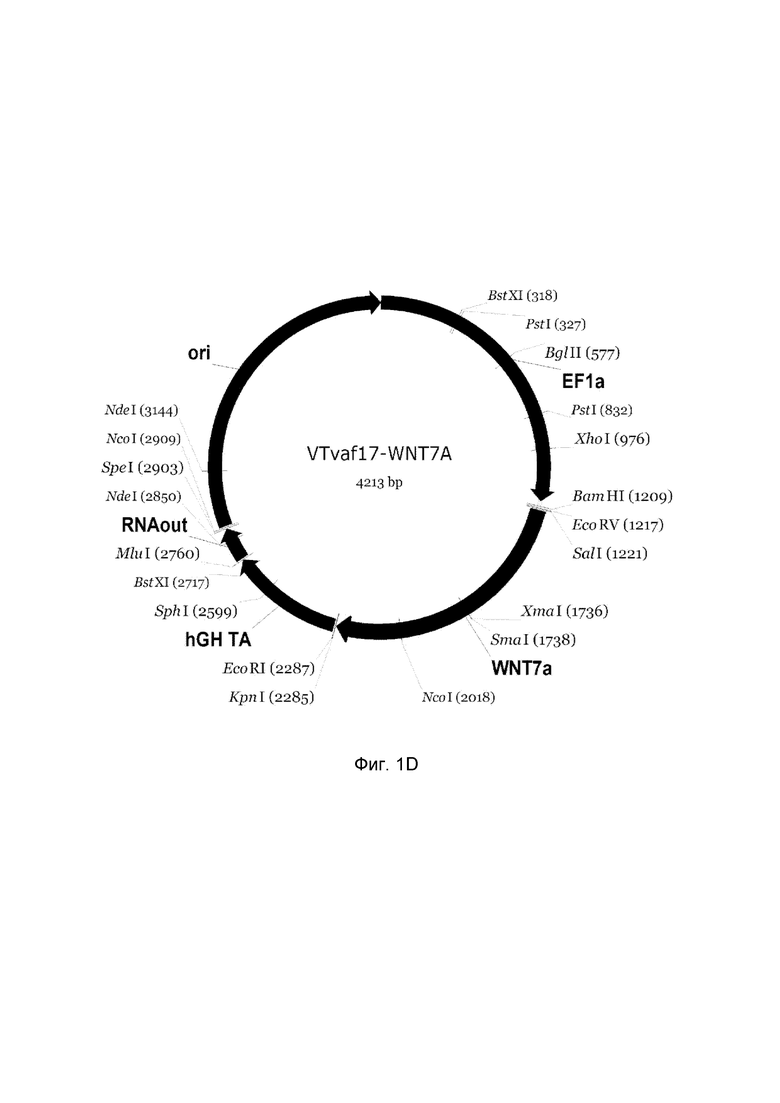

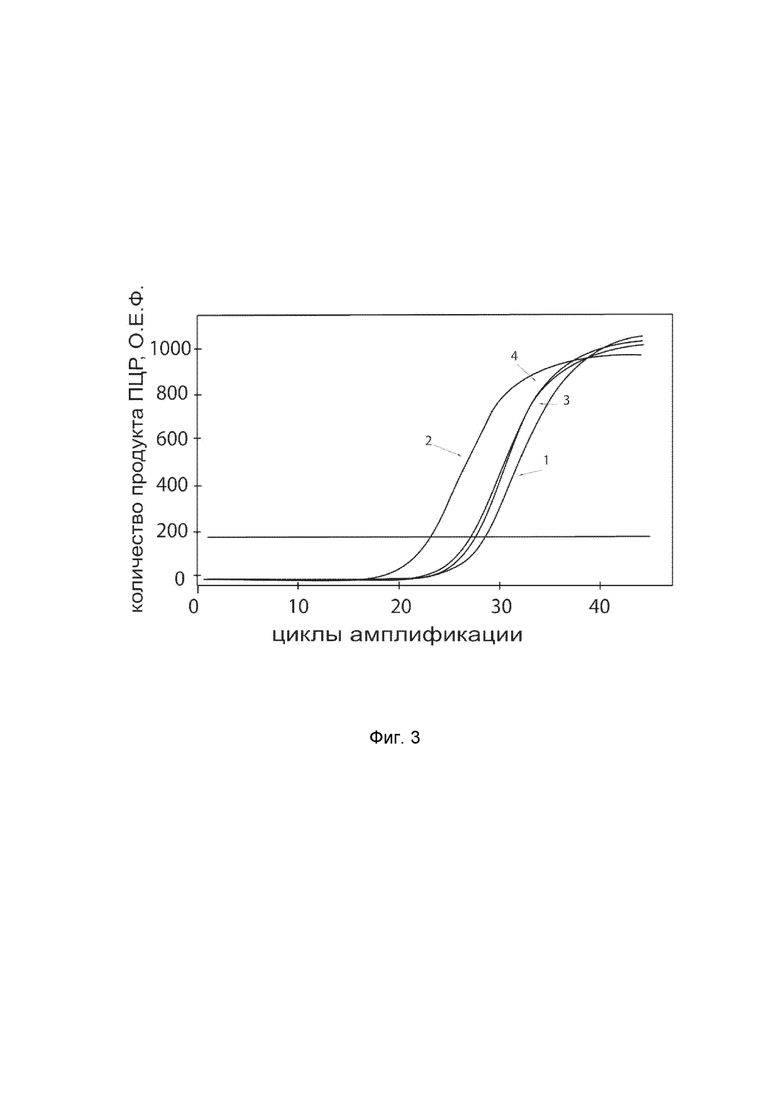
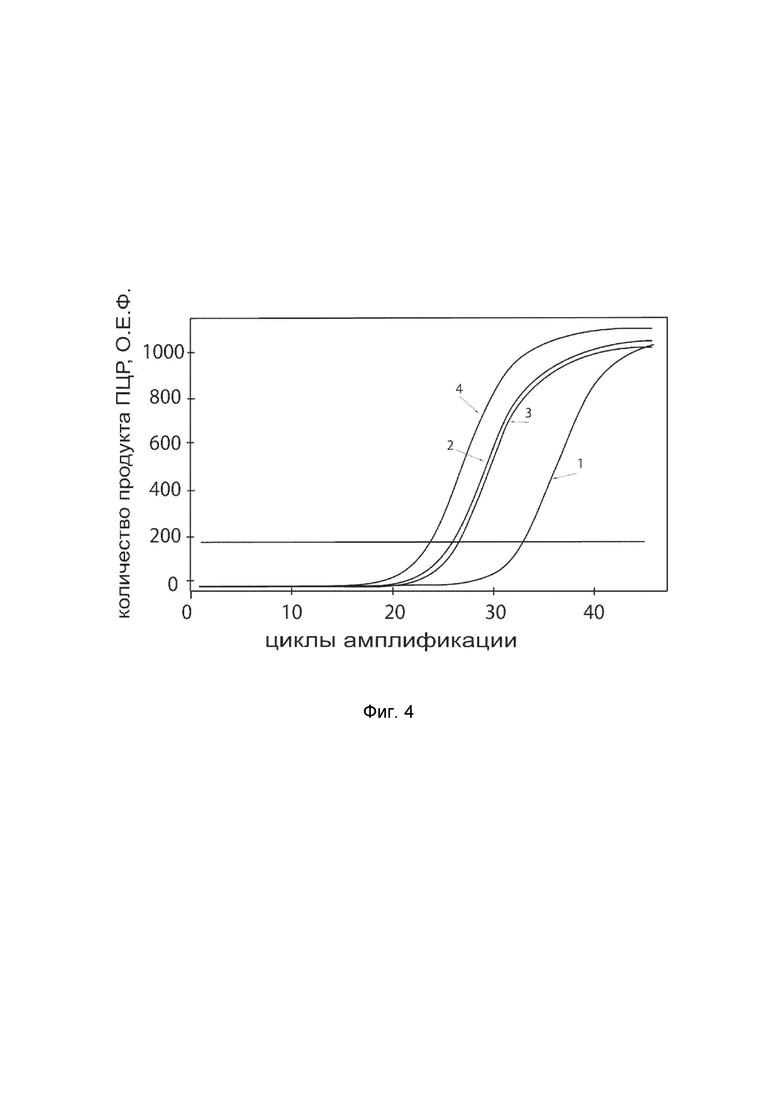
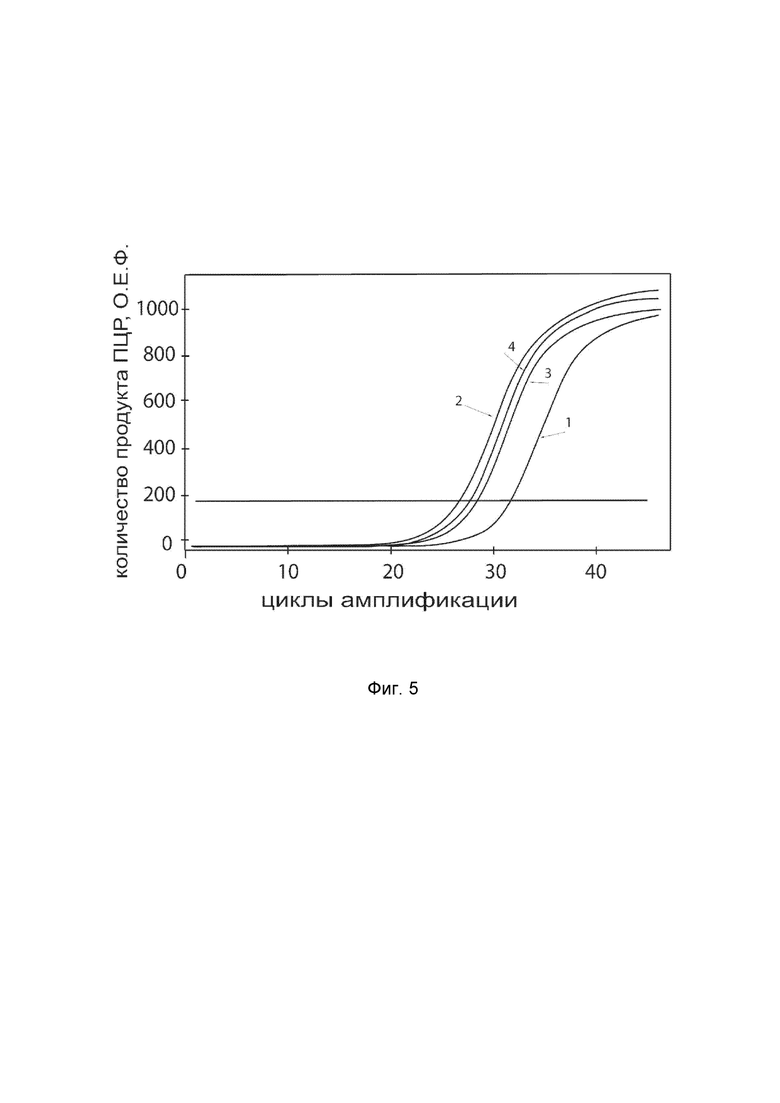
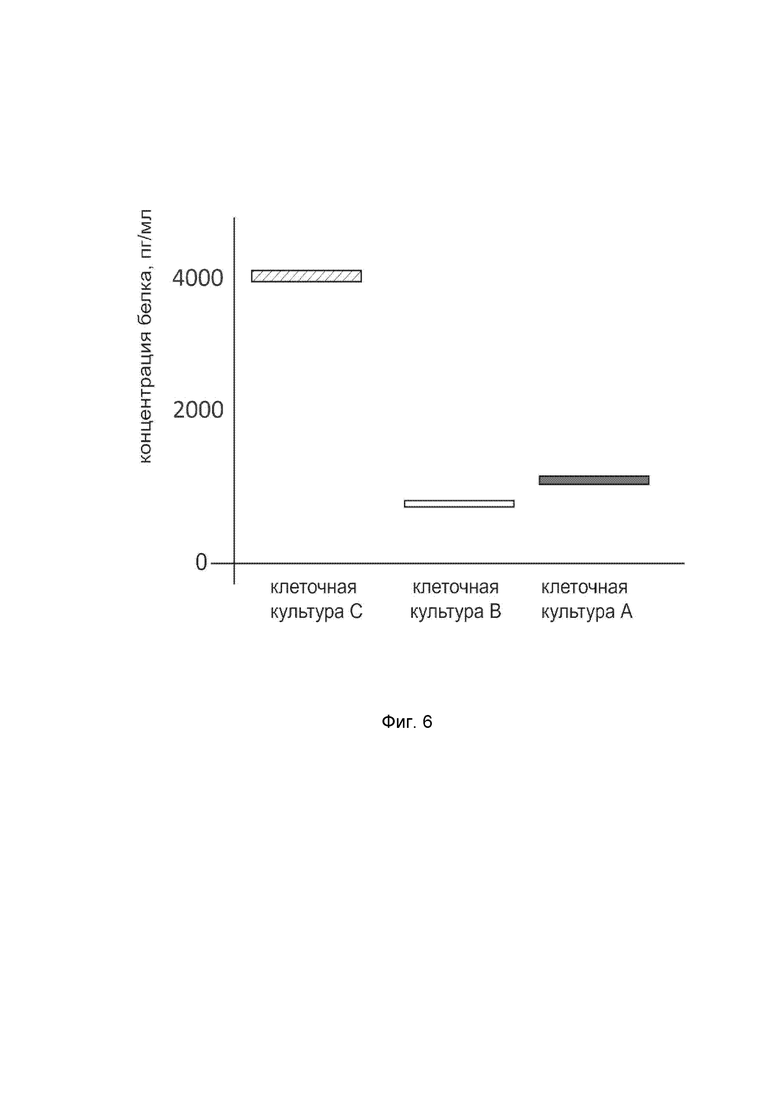

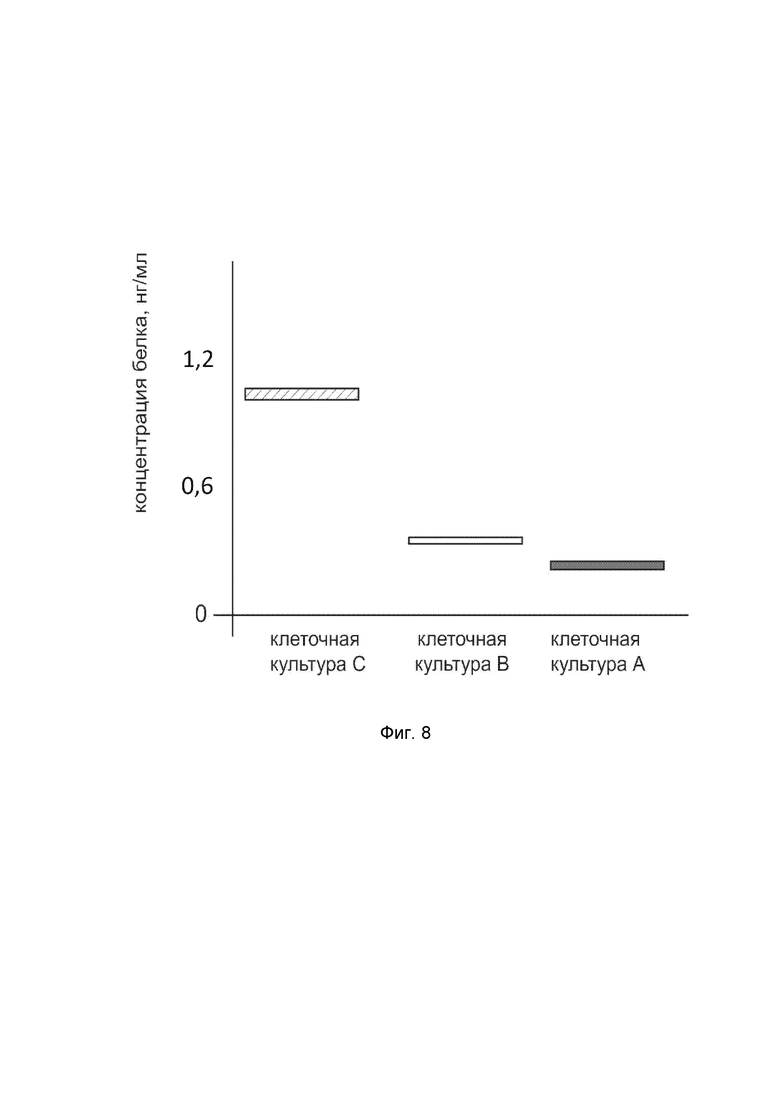

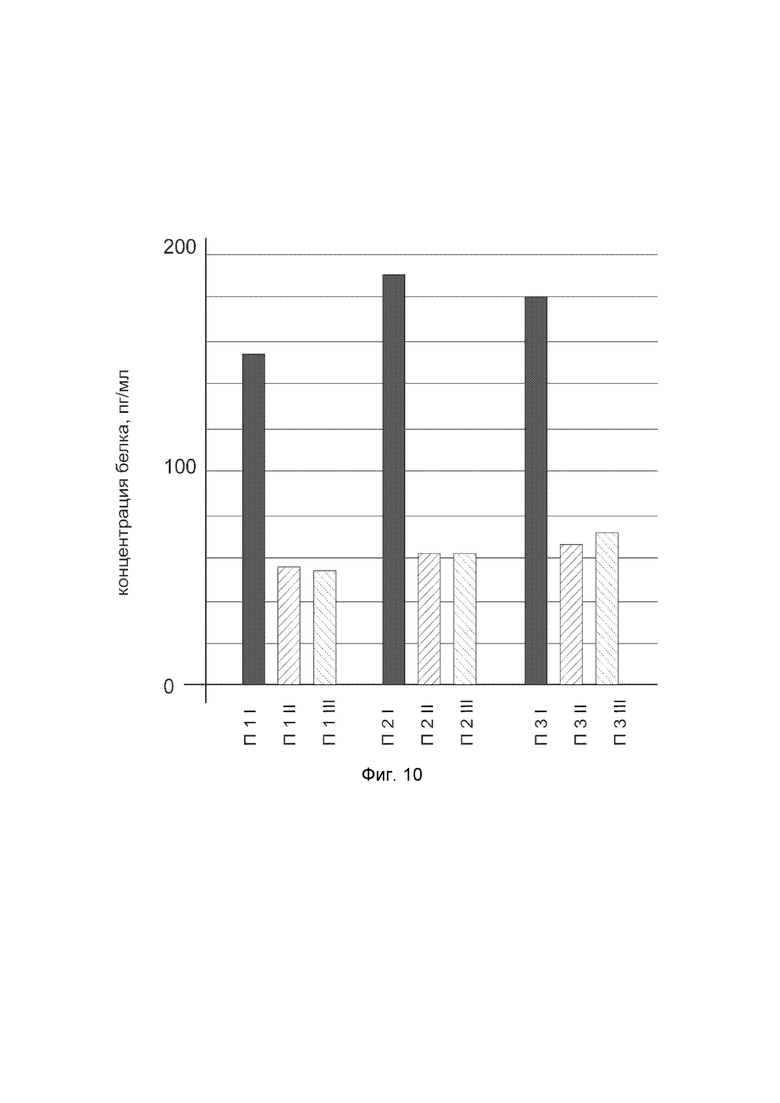
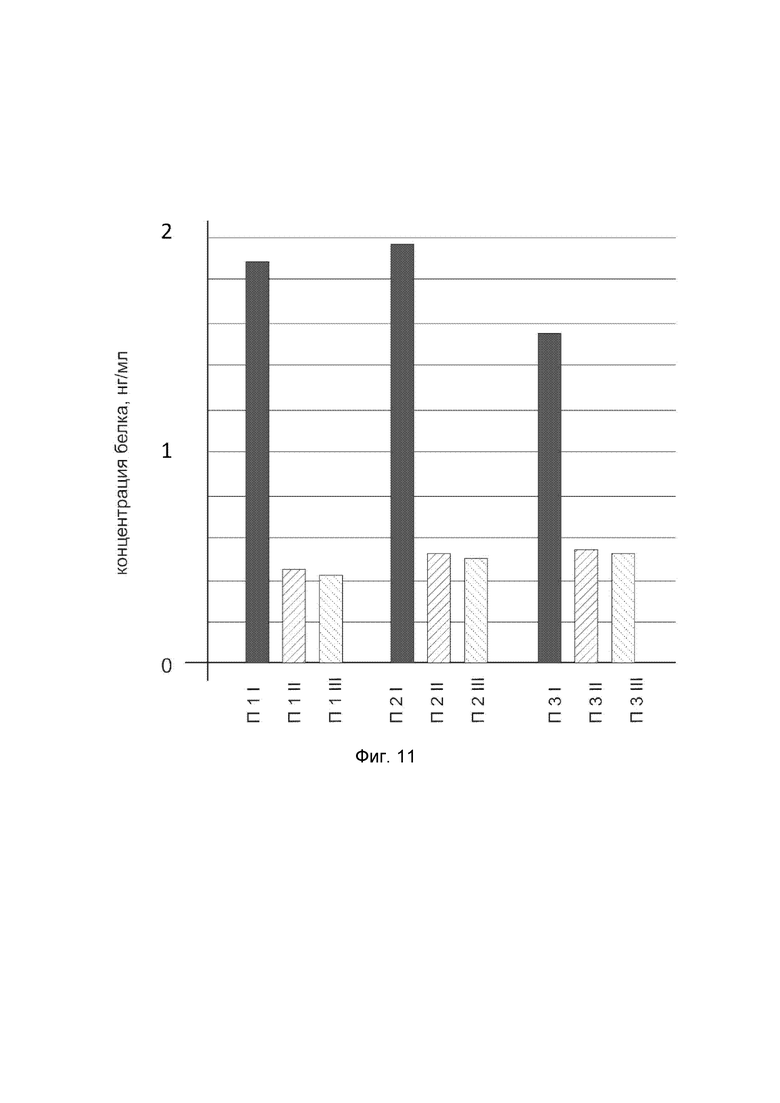
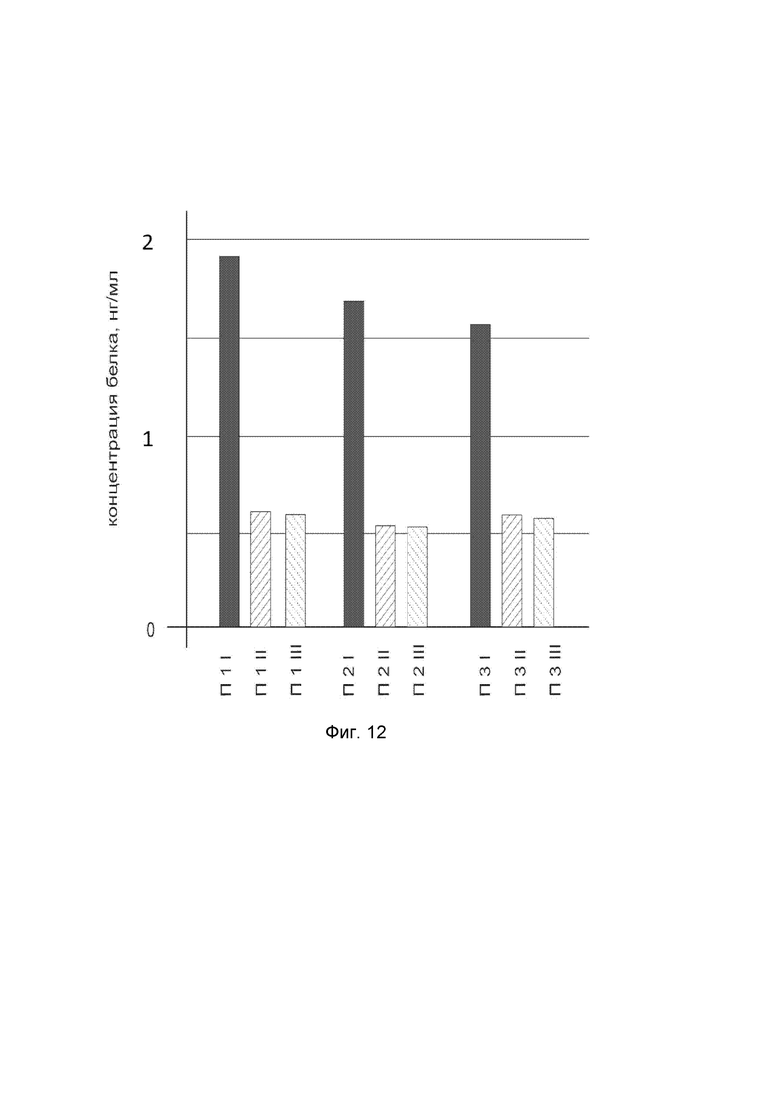
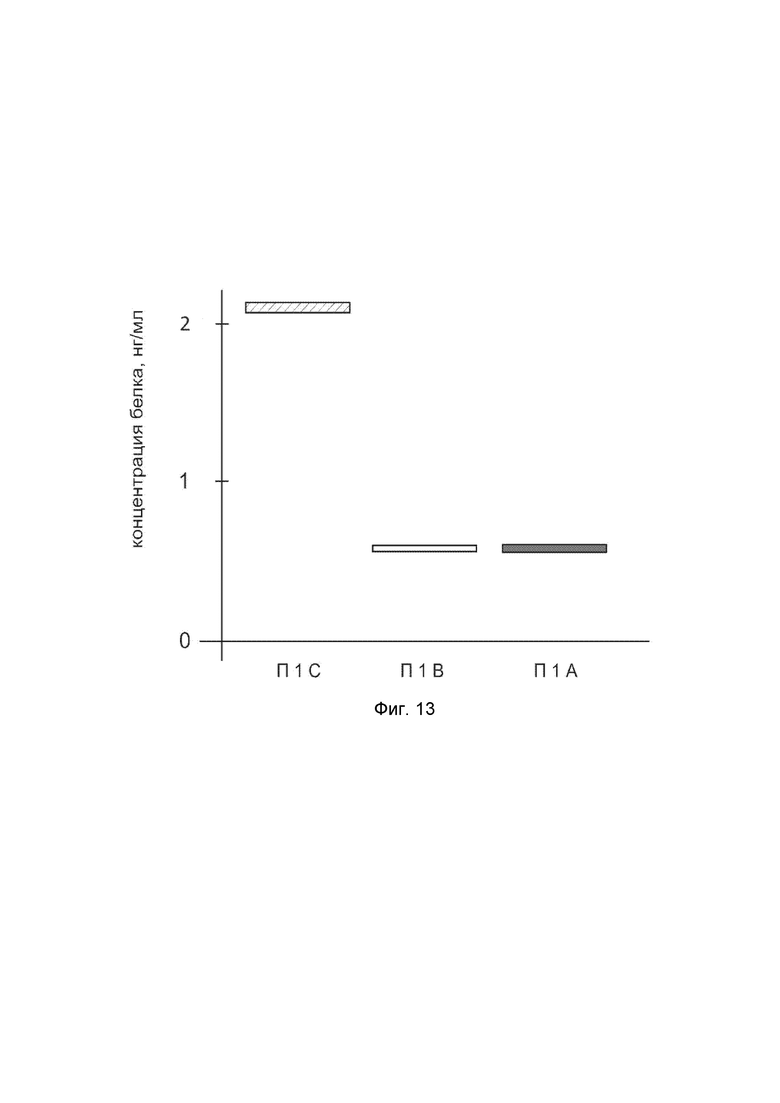

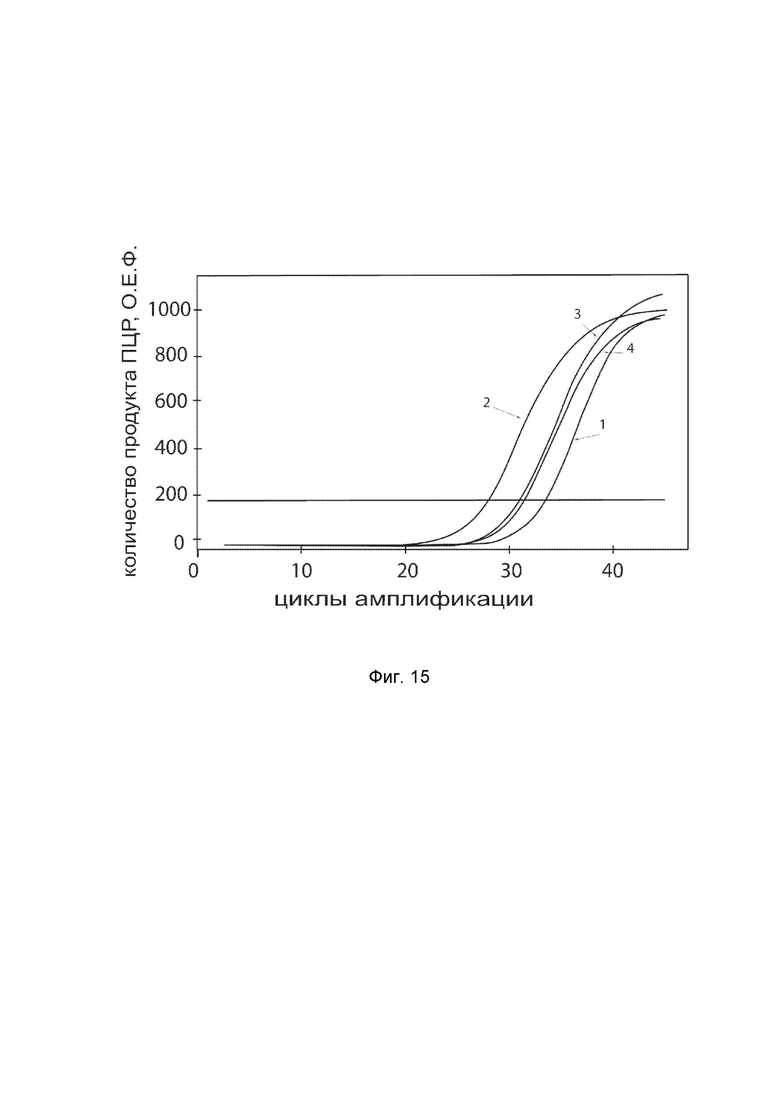
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии. Предложен генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов SHH, CTNNB1, NOG, WNT7A, для повышения уровня экспрессии этого целевого гена в организме человека и животных. При этом генотерапевтический ДНК-вектор VTvaf17-SHH, или VTvaf17-CTNNB1, или VTvaf17-NOG, или VTvaf17-WNT7A имеет нуклеотидную последовательность SEQ ID №1, или SEQ ID №2, или SEQ ID №3, или SEQ ID №4 соответственно. Предложены также способ получения указанного вектора, применение вектора, штамм Escherichia coli, несущий указанный вектор, а также способ производства в промышленных масштабах указанного вектора. Изобретение может быть использовано для безопасного применения для генетической терапии человека и животных. 12 н. и 2 з.п. ф-лы, 20 пр., 15 ил.
1. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена SHH, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-SHH, с нуклеотидной последовательностью SEQ ID №1.
2. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена CTNNB1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17- CTNNB1, с нуклеотидной последовательностью SEQ ID №2.
3. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена NOG, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-NOG, с нуклеотидной последовательностью SEQ ID №3.
4. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена WNT7A, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-WNT7A, с нуклеотидной последовательностью SEQ ID №. 4.
5. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген SHH, CTNNB1, NOG, WNT7A по пп.1, 2, 3 или 4, отличающийся тем, что каждый из созданных генотерапевтических ДНК-векторов: VTvaf17- SHH, или VTvaf17- CTNNB1, или VTvaf17-NOG, или VTvaf17- WNT7A по пп.1, 2, 3 или 4, за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки человека и животных и экспрессировать клонированный в него целевой ген SHH, или CTNNB1, или NOG, или WNT7A.
6. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген SHH, CTNNB1, NOG, WNT7A по пп.1, 2, 3 или 4, отличающийся тем, что в составе каждого из созданных генотерапевтических ДНК-векторов: VTvaf17- SHH, или VTvaf17- CTNNB1, или VTvaf17-NOG, или VTvaf17- WNT7A по пп.1, 2, 3, или 4 в качестве структурных элементов используются нуклеотидные последовательности, которые не являются генами антибиотикорезистентности, вирусными генами и регуляторными элементами вирусных геномов, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
7. Способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген SHH, CTNNB1, NOG, WNT7A по пп.1, 2, 3 или 4, заключающийся в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17- SHH, или VTvaf17- CTNNB1, или VTvaf17- NOG, или VTvaf17-WNT7A получают следующим образом: кодирующую часть целевого гена SHH, CTNNB1, NOG, WNT7A по пп.1, 2, 3 или 4 клонируют в генотерапевтический ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17- SHH, SEQ ID №1, или VTvaf17-CTNNB1, SEQ ID №2 или VTvaf17- NOG, SEQ ID №3, или VTvaf17-WNT7A, SEQ ID №4, соответственно, при этом кодирующую часть целевого гена SHH, или CTNNB1, или NOG, или WNT7A получают путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщеплением продукта амплификации соответствующими эндонуклеазами рестрикции, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводят по сайтам рестрикции BamHI и HindIII, или SalI и KpnI, или BamHI и EcoRI, причем селекцию проводят без антибиотиков,
при этом при получении генотерапевтического ДНК-вектора VTvaf17-SHH, SEQID №1 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
SHH_F AGGATCCACCATGCTGCTGCTGGCGAGATGTC
SHH_R TATAAGCTTTCAGCTGGACTTGACCGCCAT,
а расщепление продукта амплификации и клонирование кодирующей части гена SHH в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и HindIII,
причем при получении генотерапевтического ДНК-вектора VTvaf17-CTNNB1, SEQID №2 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
CTNNB1_F ATCGTCGACCACCATGGCTACCCAAGCTGATTTG
CTNNB1_R TTCGGTACCTTACAGGTCAGTATCAAACCAG,
а расщепление продукта амплификации и клонирование кодирующей части гена CTNNB1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SaII и KpnI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-NOG, SEQID №3 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
NOG_F GGATCCACCATGGAGCGCTGCCCCAG
NOG_R ATAGAATTCTAGCACGAGCACTTGCACT,
а расщепление продукта амплификации и клонирование кодирующей части гена NOG в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-WNT7A, SEQID №4 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
WNT7A_F ATCGTCGACCACCATGAACCGGAAAGCGCGGCGCT
WNT7A_R TTCGGTACCTCACTTGCACGTGTACATCTCCGT,
а расщепление продукта амплификации и клонирование кодирующей части гена WNT7A в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI.
8. Способ использования генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген SHH, CTNNB1, NOG, WNT7A по пп.1, 2, 3 или 4 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, заключающийся в трансфекции выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17, или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, клеток органов и тканей пациента или животного, и/или во введении в органы и ткани пациента или животного аутологичных клеток этого пациента или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17 и/или во введении в органы и ткани пациента или животного выбранного генотерапевтического ДНК-вектора, несущего целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или нескольких выбранных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, или в сочетании обозначенных способов.
9. Способ получения штамма для производства генотерапевтического ДНК-вектора по пп.1, 2, 3 или 4 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, заключающийся в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с последующим проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-SHH, или ДНК-вектором VTvaf17-CTNNB1, или ДНК-вектором VTvaf17-NOG, или ДНК-вектором VTvaf17-WNT7A, после чего клетки высеивают на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола с получением в результате штамма Escherichia coli SCS110-AF/VTvaf17-SHH или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A.
10. Штамм Escherichia coli SCS110-AF/VTvaf17-SHH, полученный способом по п.9, несущий генотерапевтический ДНК-вектор VTvaf17-SHH, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
11. Штамм Escherichia coli SCS110-AF/VTvaf17-CTNNB1, полученный способом по п.9, несущий генотерапевтический ДНК-вектор VTvaf17-CTNNB1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
12. Штамм Escherichia coli SCS110-AF/VTvaf17-NOG, полученный способом по п.9, несущий генотерапевтический ДНК-вектор VTvaf17-NOG, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
13. Штамм Escherichia coli SCS110-AF/VTvaf17-WNT7A, полученный способом по п.9, несущий генотерапевтический ДНК-вектор VTvaf17- WNT7A, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
14. Способ производства в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген SHH, CTNNB1, NOG, WNT7A по пп.1, 2, 3 или 4 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, заключающийся в том, что генотерапевтический ДНК-вектор VTvaf17-SHH, или генотерапевтический ДНК-вектор VTvaf17-CTNNB1, или генотерапевтический ДНК-вектор VTvaf17-NOG, или генотерапевтический ДНК-вектор VTvaf17-WNT7A получают путем того, что засевают в колбу с приготовленной средой затравочную культуру, выбранную из штамма Escherichia coli SCS110-AF/VTvaf17-SHH, или штамма Escherichia coli SCS110-AF/VTvaf17-CTNNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-NOG, или штамма Escherichia coli SCS110-AF/VTvaf17-WNT7A, затем инкубируют затравочную среду в шейкере-инкубаторе и переносят ее в промышленный ферментер, после чего растят до достижения стационарной фазы, затем выделяют фракцию, содержащую целевой ДНК-продукт, многостадийно фильтруют и очищают хроматографическими методами.
| WO 2013040341 A2, 21.03.2013 | |||
| ИНТЕГРИРУЮЩИЙ ДЕТЕКТОР С РЕГИСТРАЦИЕЙ СЧЕТА | 2008 |
|
RU2489733C2 |
| Способ снятия полуды | 1932 |
|
SU31134A1 |
| ГЕННАЯ ТЕРАПИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ НАРУШЕНИЙ | 2010 |
|
RU2603740C2 |
| BENRAISS A | |||
| ET AL | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Gene Ther | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
Авторы
Даты
2020-09-03—Публикация
2018-12-21—Подача