Настоящее изобретение относится к области антител, направленных на альфа-субъединицу рецептора для интерлейкина 7 (IL-7), обозначаемую CD127, или р90 IL-7R, или IL-7Rальфа, или IL-7Rα, иногда также называемую IL-7Ra, в особенности, на альфа-цепь рецептора для человеческого IL-7, экспрессируемого на человеческих клетках. Эти антитела характеризуются антагонистическими свойствами в отношении взаимодействия IL-7-IL-7R, могут проявлять цитотоксическую активность в отношении CD127-положительных клеток, но не повышают созревание дендритных клеток (DC), индуцируемое TSLP, цитокином, также использующим CD127 в составе своего рецептора. В качестве альтернативы или дополнения, эти антитела не индуцируют интернализацию CD127 и/или ингибируют индуцируемую IL-7 интернализацию CD127. В соответствии с другим аспектом настоящего изобретения предполагаются антитела, которые распознают эпитоп человеческого CD127, содержащий последовательности из сайта 2b в CD127, в частности, эпитоп содержит последовательности человеческого CD127 из домена D1 и из сайта 2b в CD127, в частности, эпитоп содержит по меньшей мере одну последовательность из D1, содержащую SEQ ID No: 115 (в частности, содержащую SEQ ID No: 110), и последовательность из сайта 2b, содержащую, последовательность SEQ ID No: 116, и необязательно также содержит SEQ ID No: 117 (в частности, содержит SEQ ID No: 111).
Соответственно, антитела в соответствии с настоящим изобретением являются подходящими для применения с целью излечения состояния, диагностируемого у пациента-человека, которое является результатом патогенеза, связанного с лимфопоэзом, когда пути передачи сигнала с участием IL-7 вносят вклад в указанный патогенез, в особенности, когда нежелательным является повышение созревания дендритных клеток, более точно, повышение экспрессии костимулирующих молекул в них.
Биохимия
CD127 является общим для рецептора IL-7 (IL-7R) и для рецептора TSLP (TSLPR). IL-7R составлен гетеродимером из CD127 и общей гамма-цепи (γc) интерлейкиновых рецепторов. Общая гамма-цепь γc иногда называется в данном документе и в литературе CD132. IL-7R связывается с интерлейкином 7. Рецептор TSLP представляет собой гетеродимер из CD127 и фактора 2, подобного цитокиновому рецептору (CRLF2). Рецептор TSLP связывается TSLP. В литературе TSLPR иногда используется для обозначения как CRLF2-цепи рецептора, так и комплекса CD127/CRLF2. Во избежание путаницы, в дальнейшем TSLPR обычно обозначает комплекс.
CD127 (номер доступа в базе данных Swiss Prot P16871) может существовать в четырех изформах. Каноническая изоформа, также называемая Н20 (Swiss Prot P16871.1), представляет собой однократно проходящий через мембрану трансмембранный белок, имеет 459 аминокислот и состоит, в направлении от N-конца к С-концу, из 20-аминокислотного сигнального пептида, 219-аминокислотного внеклеточного домена, 25-аминокислотного трансмембранного домена и 195-аминокислотного внутриклеточного домена. У других изоформ одинаковой является последовательность всего (или большей части) внеклеточного домена Н20 и проявляются изменяющиеся С-концевые последовательности. Изоформы 2 и 4 являются секретируемыми (Swiss Prot P16871-4 и P16871-3), тогда как изоформа 3 (Swiss Prot P16871-2) также представляет собой трансмембранный белок. Последовательность CD127 без сигнального пептида представлена в данном документе в виде SEQ ID No: 57. Что касается пронумерованных аминокислот в CD127 в настоящей заявке, указанная последовательность будет служить в качестве эталона для нумерации. Сообщалось, что CD127 имеет последовательность SEQ ID No: 113, и его внеклеточный домен, когда сигнальный пептид удален, имеет последовательность SEQ ID No: 114. Если не указано иное, нумерация, используемая в данном документе, для аминокислот в CD127 представляет собой нумерацию из SEQ ID No: 114.
CD127 представляет собой рецептор класса I цитокиновых рецепторов (CRH I). Как широко известно в уровне техники, внеклеточный домен этих рецепторов состоит из двух доменов фибронектина типа 3, называемых D1 и D2. Точная кристаллографическая структура CD127 была опубликована и обсуждалась, например, в McElroy et al., 2009; McElroy et al., 2012, и Walsh, 2012, и, в частности, была раскрыта в виде данных о структуре белка в базе данных Research Collaboratory for Structural Bioinformatics Protein Data Bank (RCSB PDB) под номером доступа 3UP1. В общем, D1 считается вовлеченным в связывание с IL-7, тогда как D2 вовлечен в связывание с γc-цепью (а также с IL-7). Важно, что сайт 2b в домене D2, состоящий, по сути, из аминокислот 109-127 в SEQ ID No: 114 (см. Walsh, 2012), является критически важным для взаимодействия CD127-γc, в частности, обеспечивая возможность связывания или повышая связывание CD127 с γc в присутствии IL-7. В частности, полагают, что мутации в Р112 и L115, которые были идентифицированы у пациентов, страдающих от тяжелого комбинированного иммунодефицита (SCID), дестабилизируют гидрофобную сердцевину домена D2, что, вероятно, приводит в результате к их патогенетическим проявлениям. Как указано выше, сайт 2b состоит, по сути, из аминокислот 109-127; специалист в данной области техники поймет, что крайние точки такого домена не обязательно могут определяться однозначно с точностью до одного основания, и что сайт 2b, как можно понять, содержит либо на одном из концов, либо на обоих концах упомянутой последовательности на 1, 2 или 3 аминокислоты больше или меньше. Таким образом, при упоминании в данном документе сайта 2b в CD127, он, как следует понимать, относится к последовательности в CD127, начиная с положения 106, 107, 108, 109, 110, 111 или 112 и заканчивая положением 124, 125, 126 или 127; в частности, к такой последовательности, которая, как полагают или как показано, составляет необходимый сайт связывания с γc-цепью в IL-7-R, в частности, в присутствии IL-7.
Передача сигнала с участием IL-7R
Связывание IL-7 с IL-7R запускает активацию нескольких путей передачи сигнала, в том числе Янус-киназ (JAK) 1 и 3, передатчика сигнала и активатора транскрипции 5 (STAT5) и фосфатидилинозитол-3-киназы (PI3-k). Сообщается, что активируются пути с участием STAT1 и STAT3, хотя они не представляются главными путями. Активация пути STAT5 требуется для индукции антиапоптотического белка Bcl-2 и предотвращения попадания проапоптотического белка Bax в митохондрию и, следовательно, для выживания развивающихся предшественников Т-клеток в тимусе. Активация пути PI3-k приводит в результате к фосфорилированию и удержанию в цитоплазме проапоптотического белка Bad.
Передача сигнала с участием TSLPR
Тимический стромальный лимфопоэтин (TSLP) представляет собой цитокин эпителиальных клеток, который является активным при лимфопоэзе и, в частности, вовлечен в регуляцию развития клеток иммунной системы, причем указанная регуляция затрагивает, в частности, созревание указанных клеток. Человеческий TSLP (номер доступа в Genbank AF338732) представляет собой фактор, который вызывает поляризацию дендритных клеток и стимулирует пролиферацию и дифференцировку Т- и В-клеток. TSLP также подавляет образование Treg клеток (Lei et al., 2011).
Было показано, что индуцируемые TSLP пути передачи сигнала отличаются на молекулярном уровне от индуцируемых IL-7 путей. В частности, хотя связывание TSLP с его рецептором также активирует Jak-1, оно не активирует Jak-3, а активирует Jak-2. Эти отличия согласуются с наблюдением, что Jak-1 соединяется с CD127, который является общим для обоих рецепторов, тогда как Jak-2 соединяется с CRLF2, и Jak-3 - с γc (Rochman et al., 2010). Об активации пути с участием STAT5 также сообщалось для индуцируемой TSLP передачи сигнала (Zhong et al., 2014). Один главный эффект TSLP заключается в том, что он приводит к активации дендритных клеток, в том числе к сверхэкспрессии костимулирующих молекул, таких как CD80, тем самым стимулируя опосредованные ТН-2 воспалительные реакции (Reche et al., 2001).
Клеточная биология
Термин «CD127-положительные клетки» обозначает клетки, экспрессирующие CD127 на своей клеточной поверхности. В большинстве случаев, CD127-положительные клетки экспрессируют CD127 в комплексе, образующем IL-7R (IL-7R-положительные клетки) и/или в комплексе, образующем TSLPR (TSLPR-положительные клетки). CD127 экспрессируется различными клетками, в том числе как Т-клетками памяти, так и наивные Т-клетками. CD127 экспрессируется, в частности, эффекторными Т-клетками (Teff), в том числе покоящимися Т-клетками и Т-клетками памяти, и незрелыми В-клетками, но не экспрессируется, в частности, покоящимися натуральными регуляторными Т-клетками (натуральными Treg). IL-7Rα является необходимым для стимуляции дифференцировки тимоцитов и клонального размножения лимфоцитов.
Важность пути с участием IL-7-CD127 для гомеостаза наивных Т-клеток подчеркивается несколькими недавними исследованиями, показывающими, что уровни экспрессии мембраносвязанного IL-7Rα на обычных CD4+ Т-клетках коррелируют с частотами обнаружения CD4+ Т-клеток-недавних эмигрантов из тимуса (RTE) у здоровых индивидов и ВИЧ-инфицированных пациентов, а также у пациентов с MS (Albuquerque et al., 2007) (Broux et al., 2010). IL-7Rα также является компонентом рецептора TSLP. Было продемонстрировано, что секреция TSLP тельцами Гассаля, структурами, состоящими из эпителиальных клеток в медуллярной области тимуса, создает условия для индукции CD11c+ миелоидными дендритными клетками (MDC) дифференцировки тимоцитов в Treg (Watanabe et al., 2005a). Соответственно, для развития Treg требуются сигналы от рецептора IL-7, как показано у нокаутных по IL-7Rα мышей (Mazzucchelli et al., 2008). В статье (Haas et al., 2011) авторы показали пониженную экспрессию IL-7Rα на обычных Т-клетках и повышенные уровни IL-7 в плазме вместе со снижением частот обнаружения Treg-недавних эмигрантов из тимуса и функцией Treg при MS без явного генетического влияния (Haas et al., 2011).
Анализ того, как IL-7 регулирует перемещение своего когнатного рецептора через мембрану, является ключевым для исчерпывающего понимания роли IL-7/IL-7R в функционировании лимфоцитов. В предыдущих исследованиях предполагалось, что стимуляция Т-клеток IL-7 ведет к понижающей модуляции экспрессии CD127 на поверхности в течение 30 минут, возможно, вследствие интернализации рецептора. В последующие моменты времени (2-6 часов) IL-7, как было показано, индуцирует понижающую регуляцию транскрипции CD127. Тем не менее, фактические динамические характеристики интернализации CD127 и регуляцию IL-7 механизмов его перемещения через мембрану все еще следует выяснить (Henriques et al., 2010). Также предполагалось, что индуцируемая IL-7 передача сигнала зависит от интернализации CD127, и что дальнейшее разрушение рецептора обусловлено активностью JAK3 и опосредовано как протеасомами, так и лизосомами.
Патофизиология
Дендритные клетки после созревания экспрессируют высокие уровни костимулирующих молекул, таких как CD80, который стимулирует опосредованные Т-клетками иммунные реакции. Они также продуцируют цитокин TARC (CCL17), который индуцирует хемотаксис у Т-клеток. Сами по себе зрелые дендритные клетки вносят вклад в патофизиологию нескольких иммуноопосредованных заболеваний, в которых играют роль Т-клеточные реакции, как например, при астме, ревматоидном артрите, колите, рассеянном склерозе и увейте. Зрелые дендритные клетки также играют ключевую роль в процессе отторжения аллотрансплантатов клеток, тканей или органов. Таким образом, целью многих терапевтических стратегий является предотвращение созревания дендритных клеток.
Наличие или отсутствие костимулирующих молекул на антигенпрезентирующих клетках (АРС), таких как дендритные клетки, оказывает значительное влияние на качественный и количественный характер иммунной реакции. Сверхэкспрессия CD80 дендритными клетками вызывает созревание DC и повышает активацию Т-клеток памяти (Bour-Jordan et al., 2011). В точки зрения механизма взаимодействие CD28 с CD80 затрагивает центральный кластер иммунологического синапса и локализуется совместно с занятым TCR, тем самым стабилизируя иммунный синапс (Dustin and Shaw, 1999) (Grakoui et al., 1999). Взаимодействие между CD28 и CD80 фактически создает надлежащее размещение в пространстве для эффективного взаимодействия TCR с молекулами HLA (Shaw and Dustin, 1997).
Рассеянный склероз (MS) представляет собой воспалительное демиелинизирующее заболевание центральной нервной системы (CNS). Возникновение демиелинизирующих бляшек в CNS пациентов с MS связано с воспалительным инфильтратом, состоящим, главным образом, из макрофагов и Т-лимфоцитов. На уровне механизма MS считается аутоиммунным заболеванием. Как правило, MS считается заболеванием, опосредованным преимущественно CD4+ Т-клетками. Конкретные субпопуляции CD4+, Th1 и, как стало известно в последнее время, Th17, вовлечены в патофизиологию заболевания. В настоящее время все еще сложно определить конкретные роли каждой субпопуляции Th1 и Th17. Более того, ингибирование перемещения лейкоцитов за счет антагонизма альфа-4(α4)-интегрина теперь утверждено в качестве терапевтического подхода для лечения воспалительных заболеваний, таких как MS и воспалительное заболевание кишечника (IBD), а также для лечения атеросклероза (Zhi et al., 2014). α4β7 экспрессируется на более ограниченном наборе лейкоцитов, включающем в себя активированные макрофаги, субпопуляции лимфоцитов, NK-клетки, тучные клетки и эозинофилы.
Человеческий IL-7 индуцирует сильную экспрессию α4- и β7-интегринов in vitro на человеческих Т-лимфоцитах и резко повышает частоту обнаружения человеческих Т-лимфоцитов, экспрессирующих α4-, β7- и α4/β7-интегрины (фиг. 19), которые требуются для хоуминга Т-лимфоцитов и их удержания в тканях, не относящихся к лимфоидным, таких как ткани кишечника, головного мозга и кожи (Denucci et al., 2009; Gorfu et al., 2009).
Наивные Т-клетки отчасти ответственны за острое отторжение трансплантированных органов и тканей. Эти клетки могут подвергаться контролю современными иммунодепрессивными лекарственными средствами (ингибиторы кальциневрина) и моноклональными антителами, которые блокируют костимуляцию (средства, противодействующие адгезии, ингибиторы CD80/86). Т-клетки памяти также являются ответственными за отторжение трансплантата. Т-клетки памяти накапливаются у человека в результате проявлявшихся за время жизни иммунных реакций, главным образом, предшествующих реакций против вирусов. Было показано, что Т-клетки памяти могут повторно активироваться аллоантигенами в результате «гетерологичного иммунитета», который представляет собой перекрестную реакцию противовирусных защитных механизмов человека с аллоантигенами (Adams et al., 2003). Гетерологичный иммунитет представляет собой сильное препятствие для индукции толерантности, поскольку Т-клетки памяти, в отличие от наивных Т-клеток, запрограммированы на быструю активацию с уменьшенными требованиями в отношении костимулирующих сигналов. Т-клетки памяти также могут быть вовлечены в хроническое отторжение. Наряду с их ролью в трансплантации органов и тканей, наивные Т-клетки и Т-клетки памяти также совместно ответственны за многие аутоиммунные заболевания. Это относится к язвенному колиту (Shinohara et al., 2011), ревматоидному артриту, псориазу или реакции «трансплантат против хозяина».
Более того, было показано, что у некоторых злокачественных клеток проявляется IL-7R. Это относится к кожной лимфоме при синдроме Сезари (60% из них) или детскому острому лимфобластному лейкозу, при котором приблизительно в 15% случаев проявляется мутация с приобретением функции в CD127, делающая эти опухоли частично IL-7-зависимыми (Shochat et al., 2011).
Сокращение количества Т-лимфоцитов являлось очевидным подходом в иммуносупрессии для противодействия отторжению аллотрансплантата или борьбы с аутоиммуными реакциями. Тем не менее, полное истощение Т-клеток может не быть благоприятным для индукции иммунологической толерантности. Целенаправленное воздействие на субпопуляции Т-клеток или избирательно активированные Т-клетки без модификации Treg клеток может составлять про-толерогенный подход (Haudebourg et al., 2009). Таким образом, CD127 можно считать потенциальным привлекательным терапевтическим средством для моноклональных антител (Mab), направленных на модуляцию иммунных реакций, поскольку такие моноклональные антитела могут иметь потенциал в плане сокращению количества эффекторных, а не регуляторных лимфоцитов. Соответственно, предполагалось, что они могут проявлять эффективность при трансплантации, аутоиммунных реакциях (Michel et al., 2008) и злокачественных опухолях за счет противодействия доступу IL-7 к IL-7-R и, таким образом, ограничения функционирования и роста Т- и В-клеток.
Терапия моноклональным антителом в отношении СВ127+-клеток, которое создает препятствие на пути с участием IL-7, может достигнуть этой цели за счет ликвидации/нейтрализации наивных Т-клеток и Т-клеток памяти и/или снижения их количества при сохранении Treg клеток или за счет ликвидации или снижения количества CD127-положительных злокачественных клеток. Тем не менее терапия моноклональным антителом против CD127+-клеток может действовать как обоюдоострый меч, если она приводит к активации дендритных клеток. В действительности, CD127 также экспрессируется дендритными клетками в сочетании с CRLF2, образуя рецептор TSLP. В присутствии TSLP дендритные клетки становятся активированными и стимулируют опосредуемые Т-клетками иммунные реакции. Некоторые моноклональные антитела к CD127, предположительно за счет модификации характера взаимодействия TSLP с рецептором TSLP, характеризуются свойством, заключающимся в повышении созревания дендритных клеток, индуцируемого TSLP (как показано на фиг. 7 при типичных условиях). Как следствие, терапия моноклональным антителом к CD127, которое не будет повышать созревание дендритных клеток, индуцируемое TSLP, будет предоставлять терапевтическое преимущество. Она будет предоставлять преимущество блокады IL-7R без недостатка, заключающегося в активации дендритных клеток в подвергшейся воспалению среде, содержащей TSLP.
В публикации ( et al., 2009) авторы анализировали значение альфа-рецептора IL-7 (IL-7Rα) в качестве возможной терапевтической мишени при трансплантации. Рассмотрев экспрессию IL-7Rα на различных Т-клетках и восприимчивых к IL-7 клетках, авторы определяли, может ли целенаправленное воздействие на Т-клетки памяти, экспрессирующие IL-7Rα, продлить срок выживания аллотрансплантата у мышей, и сделали выводы, что целенаправленное воздействие на IL-7 или IL-7Rα преимущественно не будет затрагивать Treg клетки. Из перспектив авторы обратили внимание на то, что целенаправленное воздействие либо на IL-7, либо на IL-7Rα при терапевтическом лечении может иметь разные последствия для выживания клеток, экспрессирующих CD127, и может вызывать разные типы лимфопении. Вопрос эффектов антител, которые будут направлены на IL-7Rα, в зависимости от того, будут ли они представлять собой блокирующие, или нейтрализующие, или цитотоксичные антитела, также ставился с концептуальной точки зрения. Тем не менее авторы не показали получение и анализ таких антител, а скорее выразили потребность в дальнейшем изучении для оценки обоснованности данной гипотезы.
et al., 2009) авторы анализировали значение альфа-рецептора IL-7 (IL-7Rα) в качестве возможной терапевтической мишени при трансплантации. Рассмотрев экспрессию IL-7Rα на различных Т-клетках и восприимчивых к IL-7 клетках, авторы определяли, может ли целенаправленное воздействие на Т-клетки памяти, экспрессирующие IL-7Rα, продлить срок выживания аллотрансплантата у мышей, и сделали выводы, что целенаправленное воздействие на IL-7 или IL-7Rα преимущественно не будет затрагивать Treg клетки. Из перспектив авторы обратили внимание на то, что целенаправленное воздействие либо на IL-7, либо на IL-7Rα при терапевтическом лечении может иметь разные последствия для выживания клеток, экспрессирующих CD127, и может вызывать разные типы лимфопении. Вопрос эффектов антител, которые будут направлены на IL-7Rα, в зависимости от того, будут ли они представлять собой блокирующие, или нейтрализующие, или цитотоксичные антитела, также ставился с концептуальной точки зрения. Тем не менее авторы не показали получение и анализ таких антител, а скорее выразили потребность в дальнейшем изучении для оценки обоснованности данной гипотезы.
С учетом недостатков доступных терапевтических подходов при связанных с иммунными реакциями заболеваниях, а также при других заболеваниях, в которых задействованы IL-7/IL-7Rα, таких как разные типы злокачественных опухолей, в том числе некоторые злокачественные опухоли молочной железы, все еще существует потребность в дополнительных кандидатах на роль лекарственного средства, в особенности, в кандидатах, активных в отношении более избирательных мишеней, с целью контроля, например модуляции, активации иммунных реакций у пациентов-людей.
В этом контексте моноклональные антитела к IL-7Rα, характеризующиеся антагонистическими свойствами в отношении IL-7Rα, были раскрыты в международной заявке WO 2010/017468, а их гуманизированные варианты - в международной заявке WO 2011/094259 с целью лечения аутоиммунных заболеваний, подобных рассеянному склерозу. Указано, что описанные антитела противодействуют связыванию IL-7 с его рецептором и являются активными в отношении размножения и выживания TH17 и TH1 клеток, для которых, как было указано, требуется взаимодействие IL-7 с рецептором CD127 на них. Эффект этих антител в отношении созревания иммунных клеток и, в особенности, дендритных клеток, не рассматривался. Кроме того, эти антитела, как указано, не ингибируют индуцируемую TSLP продукцию TARC (с. 107 в международной заявке WO 2011/094259). Аналогично, антитела к CD127, описанные в международной заявке WO 2011/104687 или WO 2013/056984, которые предусматриваются для применения в лечении диабета, волчанки, ревматоидного артрита и других аутоиммунных заболеваний, не обсуждались в отношении их возможного воздействия на созревание дендритных клеток, и об их взаимодействии с индуцируемой TSLP передачей сигнала не сообщалось. Кроме того, как опубликовано Kern и соавт. (Kern et al., 2013; Kern et al., 2015) и как показано в данном документе, антитела к CD127 из уровня техники индуцируют интернализацию рецептора. Поскольку антагонистические антитела к CD127, которые также индуцируют интернализацию CD127, не способны контролировать кожную гиперчувствительность IV типа (фиг. 10), тогда как антагонистические антитела к CD127, которые не индуцируют интернализацию, способны на это, представляется возможным, что процесс интернализации активирует путь передачи сигнала, ослабляющий антагонистический эффект антител. Наконец, антитела из уровня техники распознают эпитоп, который не содержит какой-либо последовательности из сайта 2b в CD127 (т.е., в частности, из аминокислот 109-127 в SEQ ID No: 114); и не было показано, что они нарушают связывание CD127 с γc-цепью в IL-7-R.
Несмотря на современный интерес к разработке антител к CD127, усилия, следовательно, концентрировались на ингибировании индуцируемой IL-7 передачи сигнала с участием IL-7R. При этом TSLP и TSLPR были вовлечены в ряд патологий. Было показано, что TSLP играет роль в заболеваниях кожи и легких (Не and Geha, 2010) и связан с различными патологиями, в том числе с воспалительным заболеванием дыхательных путей и атопическим дерматитом у человека и мышей (Ying et al., 2008) (Jariwala et al., 2011). Кроме того, было показано, что TSLP связан с регуляцией иммунных реакций и воспаления в кишечнике (Taylor et al., 2009). Другие патологии, в которые вовлечен TSLP и TSLPR, включают в себя детский В-клеточный лейкоз (van Bodegom et al., 2012), аллергические расстройства, специфичные в отношении легких и кожи, заболевания, связанные с аутоиммунными реакциями (Roan et al., 2012), и злокачественную опухоль, в том числе злокачественную опухоль молочной железы (Olkhanud et al., 2011).
Таким образом, хотя в уровне техники в большом количестве источников подтверждается, что антитела к CD127 являются перспективными кандидатами для лечения заболеваний, связанных с аутоиммунными реакциями, посредством противодействия индуцируемым IL-7 и/или опосредуемым IL-7-R механизмам, и что такие антитела также будут связываться с CD127 в контексте рецептора TSLP и препятствовать индуцируемым TSLP и/или опосредуемым рецептором TSLP механизмам, их возможное участие в созревании дендритных клеток не исследовалось, и в уровне техники не сообщалось об улучшении, заключающемся в получении антител, которые не проявляют эффект, заключающийся в повышении созревания дендритных клеток, и/или которые не индуцируют интернализацию CD127, и/или которые ингибируют индуцируемую IL-7 интернализацию.
После неожиданного открытия индуцируемого существующими антителами к CD127 нежелательного повышения созревания дендритных клеток, индуцируемого TSLP (хотя антитела ингибируют индуцируемую TSLP продукцию TARC), авторами настоящего изобретения были разработаны антитела, которые не проявляют такого повышения и, следовательно, являются более подходящими для лечения заболеваний, в частности, аутоиммунных заболеваний. Более того, авторами настоящего изобретения было обнаружено, что антитела, которые не индуцируют интернализацию и/или ингибируют индуцируемую IL-7 интернализацию CD127 характеризуются высокой эффективностью, в особенности in vivo, по сравнению с антителами из уровня техники, такими как MD707-13.
Настоящим изобретением предполагаются средства, подходящие в данных условиях, относящиеся к моноклональным антителам к IL-7Rα, которые оказывают отрицательное воздействие только на путь с участием TSLP. Соответственно, моноклональные антитела (Mab) в соответствии с настоящим изобретением не повышают индуцируемое TSLP созревание дендритных клеток, в противоположность тому, что наблюдалось авторами настоящего изобретения с традиционными антителами к CD127. В качестве дополнения или альтернативы, антитела в соответствии с настоящим изобретением не индуцируют интернализацию CD127 и/или ингибируют индуцируемую IL-7 интернализацию CD127. В соответствии с конкретным вариантом осуществления в антителах, обеспечиваемых в соответствии с настоящим изобретением, объединены эти свойства, относящиеся к созреванию DC и/или интернализации, с антагонистической активностью в отношении передачи сигнала с участием IL-7/IL-7-R. В соответствии с конкретными вариантами осуществления антитела согласно настоящему изобретению ингибируют индуцируемую IL-7 экспрессию α4-, β7- и α4/β7-интегринов в Т-клетках, в частности, in vivo. Эти Mab с новыми механизмами действия, таким образом, являются составной частью новых продуктов для оценки терапевтических благоприятных эффектов целенаправленного воздействия на CD127.
Более того, авторами настоящего изобретения раскрыт эпитоп, распознаваемый предпочтительным антителом в соответствии с настоящим изобретением, тем самым обеспечивая возможность непосредственной разработки альтернативных антител и/или их фрагментов, или антигенсвязывающих доменов, или структурно связанных антигенсвязывающих доменов из других типов полипептидов, которые связываются с соответствующим эпитопом и сохраняют желаемые характеристики.
Эпитопы в CD127, распознаваемые N13B2, идентифицировали с помощью сканирования на матрице с пришитыми олигопептидами (иногда называемого сканированием перекрывающимися пептидами или pepscan-анализом), и они содержат аминокислотные последовательности человеческого CD127, состоящие из последовательностей ep1 (SEQ ID No: 110), ер2 (SEQ ID No: 111) и ep3 (SEQ ID No: 86). В этой методике используется библиотека олигопептидных последовательностей из перекрывающихся и неперекрывающихся сегментов белка-мишени, и ее исследуют в отношении способности данных последовательностей к связыванию с антителом, представляющим интерес. Комбинируя несмежные пептидные последовательности из разных частей белка-мишени и обеспечивая конформационную жесткость этого комбинированного пептида (как например, за счет использования остовов CLIPS) (Timmerman et al., 2007), прерывающиеся эпитопы можно картировать с очень высокой вероятностью и точностью (Cragg, 2011) (Gaseitsiwe et al., 2010). Дополнительное определение эпитопа с использованием процедур защиты от протеолиза позволяет определить, что конформационный эпитоп содержит аминокислотные последовательности человеческого CD127, имеющие последовательности SEQ ID No: 115, SEQ ID No: 116 и SEQ ID No: 117. Таким образом, эпитоп содержит последовательности из сайта 2b в CD127. Более того, эпитоп содержит последовательности в обоих доменах D1 и D2 в CD127 и, более конкретно, последовательности из домена D1 вместе с последовательностями из сайта 2b. Эпитопы в соответствии с настоящим изобретением более подробно описаны ниже. В частности, указанные эпитопы состоят из SEQ ID No: 115 (или SEQ ID No: 110), SEQ ID No: 116 (или SEQ ID No: 86) и SEQ ID No: 117 (или SEQ ID No: 111) в их конформационном расположении в нативном CD127.
В соответствии с конкретным вариантом осуществления моноклональные антитела также проявляют цитотоксическое действие в отношении CD127+-клеток-мишеней, что также физически уменьшает их количество (сокращение субпопуляции).
Таким образом, настоящее изобретение относится к макромолекуле, такой как антитело, антигенсвязывающий фрагмент антитела или химерная молекула, содержащая антитело или его фрагмент, которая (i) специфично связывается с альфа-цепью рецептора к IL-7 (обозначаемого CD127) посредством взаимодействия антитело-антиген, в особенности, с альфа-цепью рецептора IL-7, экспрессируемого человеческими CD127-положительными клетками, и которая (ii) не повышает созревание дендритных клеток, индуцируемое TSLP (характеризующееся, например, повышенной экспрессией антигенов CD80 и/или CD40 на клеточной поверхности), и/или (iii) не индуцирует интернализацию CD127, и/или ингибирует индуцируемую IL-7 интернализацию CD127.
В соответствии с конкретным вариантом осуществления настоящего изобретения указанная макромолекула содержит VH-цепь, содержащую по меньшей мере одну из следующих аминокислотных последовательностей:
- VHCDR1 SEQ ID No: 10;
- VHCDR2 SEQ ID No: 12;
- VHCDR3 SEQ ID No: 14 или SEQ ID No: 48;
- VH SEQ ID No:22;
и/или VL-цепь, содержащую по меньшей мере одну из следующих аминокислотных последовательностей:
- VLCDR1 SEQ ID No: 16 или SEQ ID No: 50;
- VLCDR2 SEQ ID No: 18 или SEQ ID No: 52;
- VLCDR3 SEQ ID No: 20;
- VL SEQ ID No: 24.
В соответствии с конкретными вариантами осуществления макромолекула проявляет цитотоксическую активность в отношении человеческих Т-клеток, экспрессирующих CD127 (CD127+-клетки). В соответствии с другими вариантами осуществления макромолекула не проявляет цитотоксическую активность в отношении человеческих Т-клеток, экспрессирующих CD127 (CD127+-клетки).
Настоящее изобретение также относится к композициям, содержащим указанную макромолекулу, способам получения указанных макромолекул и применениям указанных макромолекул и композиций.
Как используется в данном документе, макромолекула обозначает любую молекулу, в особенности, молекулу биологического происхождения или молекулу, содержащую фрагменты биологического происхождения, с молекулярным весом более 500 Да. Макромолекулы включают в себя полипептиды и модифицированные полипептиды, такие как гликозилированные полипептиды и их конъюгаты, но не ограничиваются ими. Как используется в данном документе, макромолекула, которая «специфично связывается с CD127 посредством взаимодействий антитело-антиген», означает, что взаимодействия между указанной макромолекулой и CD127 состоят, по сути, из тех же взаимодействий, что и взаимодействия между антителом, специфичным к CD127, и CD127. В частности, указанная макромолекула может содержать остатки в антителе, которые вовлечены в указанное взаимодействие, в пространственной конфигурации, обеспечивающей возможность образования тех же химических связей с белком CD127. В соответствии с конкретным вариантом осуществления макромолекула содержит по меньшей мере одну последовательность CDR VH-цепи и/или VL-цепи антитела. В соответствии с предпочтительным вариантом осуществления макромолекула содержит все из последовательностей CDR VH-цепи и/или VL-цепи антитела. В соответствии с предпочтительным вариантом осуществления макромолекула содержит полную VH-цепь и/или полную VL-цепь антитела.
В соответствии с конкретными вариантами осуществления макромолекулу получают, конструируют или подвергают отбору таким образом, чтобы она распознавала эпитоп, определяемый следующими признаками (определяемый по меньшей мере одним из следующих признаков):
(a) эпитоп содержит последовательности, в частности, по меньшей мере 3, 4, 5, 6 или 7 последовательных аминокислот, взятых из сайта 2b в CD127, в частности, из аминокислот 109-127 в SEQ ID No: 114, более конкретно, из аминокислот 110-125, 110-120,112-120 в SEQ ID No: 114, более конкретно из аминокислот 114-119 в SEQ ID No: 114 (соответствующих SEQ ID No: 116); в частности, эпитоп содержит SEQ ID No: 116, в частности, содержит SEQ ID No: 86; в частности, эпитоп содержит Р112 или L115 в CD127;
(b) в дополнение к признакам из пункта (a) выше эпитоп содержит последовательности, в частности, по меньшей мере 3, 4, 5, 6 или 7 последовательных аминокислот, взятых из домена D1 в CD127, в частности, из аминокислот 1-98 в SEQ ID No: 114; в частности, эпитоп содержит аминокислотные последовательности SEQ ID No: 115 (в частности, содержит аминокислотную последовательность ep1 (SEQ ID No: 110));
(c) в дополнение к признакам из пункта (a) и необязательно из пункта (b) выше эпитоп содержит последовательности, в частности, 3, 4, 5, 6 или 7 последовательных аминокислот, взятых из аминокислот 180-220 в SEQ ID No: 114, в частности, из аминокислот 190-200; в частности, эпитоп содержит аминокислотную последовательность SEQ ID No: 117; в частности, содержит аминокислотную последовательность ер2 (SEQ ID No: 111);
(d) эпитоп содержит последовательности SEQ ID No: 115 и последовательности SEQ ID No: 116, или эпитоп содержит последовательность SEQ ID No: 117 и последовательности SEQ ID No: 116; в частности, эпитоп содержит последовательности SEQ ID No: 115, SEQ ID No: 116 и SEQ ID No: 117;
(e) эпитоп содержит последовательности в CD 127, которые определены в пунктах (а), (b) (c) и/или (d) выше, и не содержит аминокислотные последовательности (из более чем 3, 4 или 5 последовательных аминокислот) в CD127, отличающиеся от напрямую упомянутых, т.е., в частности, эпитоп содержит только следующие последовательности в CD127:
- одну последовательность, взятую из сайта 2b, в частности, состоящую из аминокислот 109-127 в SEQ ID No: 114, или аминокислот 110-125, 110-120 или 112-120 в SEQ ID No: 114, или аминокислот 114-119 в SEQ ID No: 114 (соответствующих SEQ ID No: 116), или последовательность, соответствующую SEQ ID No: 86 и/или состоящую из последовательности из 3 аминокислот или более чем 3, 4, 5, 6, 7 аминокислот и из 19 аминокислот или менее чем 19, 18, 15, 11 аминокислот, взятых из сайта 2b, в частности, такую последовательность, содержащую Р112 или L115 в CD127;
- необязательно, в дополнение к последовательности сайта 2b, одну последовательность, взятую из домена D1 в CD 127, в частности, из 98 аминокислот в SEQ ID No: 114, в частности, одну последовательность, состоящую из SEQ ID No: 110 или из SEQ ID No: 115, и/или состоящую из последовательности из 3 аминокислот или более чем 3, 4, 5, 6, 7 аминокислот и из 20 аминокислот или менее чем 20, 18, 16, 11 аминокислот, содержащих SEQ ID No: 115 или содержащихся в последовательности SEQ ID No: 115;
- необязательно, в дополнение к последовательности сайта 2b и к необязательной последовательности из домена D1, если они присутствуют, одну последовательность, взятую из аминокислот 180-220 в SEQ ID No: 114; в частности, одну последовательность, состоящую из SEQ ID No: 111 или из SEQ ID No: 117 и/или состоящую из последовательности из 3 аминокислот или более чем 3, 4, 5, 6, 7 аминокислот и из 20 аминокислот или менее чем 20, 18, 16, 11 аминокислот, содержащих SEQ ID No: 117 или содержащихся в последовательности SEQ ID No: 117;
причем указанный эпитоп, возможно, содержит дополнительные аминокислоты при условии, что эти дополнительные аминокислоты не взяты из последовательности CD127 (т.е. при условии, что эпитоп не содержит более чем 3, 4 или 5 последовательных аминокислот из последовательности CD127, за исключением последовательности из сайта 2b, и, возможно, необязательных последовательностей из домена D1 и из аминокислот 180-220 в SEQ ID No: 114, описанной выше);
(f) эпитоп, в дополнение к признаку, описанному в пункте (a), (b), (c) или (d) выше, не содержит более чем 3, 4 или 5 последовательных аминокислот, взятых из участка 99-108 в SEQ ID No: 114, не содержит более чем 3, 4 или 5 последовательных аминокислот, взятых из участка 128-179 в SEQ ID No: 114, и/или не содержит более чем 3, 4 или 5 последовательных аминокислот из участка 220-239 в SEQ ID No: 114, в частности, не содержит более чем 3, 4 или 5 последовательных аминокислот из любого из участков 99-108, 128-179 и 220-239 в SEQ ID No: 114;
(g) эпитоп содержит комбинацию последовательностей из CD127, которые определены в пунктах (a), (b), (c), (d), (e) и/или (f) выше, причем некоторые аминокислоты подверглись мутации, в частности, делеции и/или замене, в частности, замене на аминокислоты с подобными свойствами (консервативные замены); в частности, эпитоп состоит из последовательностей или содержит последовательности, по меньшей мере на 80%, 85%, 90% или 95% идентичные последовательностям в CD127, которые определены в пунктах (a), (b), (c), (d), (e) и/или (f) выше, в комбинации, как определено в пунктах (b), (c) или (d), в случае, когда это является уместным;
(h) эпитоп представляет собой конформационный эпитоп, имеющий признаки, определенные в пунктах (a), (b), (c), (d), (e), (f) и/или (g) выше, т.е. содержит последовательности или состоит из последовательностей, которые определены в пунктах (a), (b), (c), (d), (e), (f) и/или (g) выше, в конформации, которая имитирует конформацию указанных последовательностей в нативном CD127 (либо в виде мономера, либо в виде димера с γc и/или связанного с IL-7);
(i) эпитоп содержит фрагмент CD127 (т.е. отрезок из последовательных аминокислот) с признаками из пунктов (a), (b), (c), (d), (g) и/или (h) выше;
(j) эпитоп имеет признаки, определенные в пункте (g) выше, и его получают с помощью технологии, такой как технология CLIPS, которая обеспечивает возможность синтеза сборных пептидных ансамблей с предсказуемой структурой.
В соответствии с конкретными вариантами осуществления эпитопов с признаками из пунктов (b) и (c), эпитоп включает в себя аминокислотную последовательность в CD127, которая лежит между двумя последовательностями ep1 и ер2 и необязательно не продолжалась с включением в себя какой-либо аминокислоты или не продолжалась с включением в себя более чем одной аминокислоты в последовательности человеческого CD127, лежащей выше (т.е. в направлении N-конца относительно последовательности ep1) и/или ниже (т.е. в направлении С-конца относительно последовательности ер2) этих последовательностей. В соответствии с другими конкретными вариантами осуществления эпитоп является таким, чтобы ни одна из последовательностей ep1 или ер2 не продолжалась с включением в себя любой из аминокислот, смежных с ними в последовательности человеческого CD127, или с включением в себя более чем 7, 5 или 1 последовательной аминокислоты из аминокислот, смежных с ними в последовательности человеческого CD127, которая лежит между ep1 и ер2; продолжение последовательностей ep1 и ер2 в этом случае также может ограничиваться выше (относительно ep1) или ниже (относительно ер2), как указано выше. В соответствии с конкретными вариантами осуществления последовательности CD127, которые содержат последовательности эпитопов, указанные выше, не продолжаются так, чтобы они содержали смежные с ними аминокислоты из последовательности человеческого CD127, которые являются смежными с ep1 более чем на 1 аминокислоту с N-конца или более чем на 7 аминокислот с С-конца, или являются смежными с ер2 более чем на 30 аминокислот с N-конца или на 30 аминокислот с С-конца.
В соответствии с вариантами осуществления, при которых макромолекулу получают, конструируют или подвергают отбору таким образом, чтобы она распознавала эпитоп, содержащий несколько несмежных аминокислотных последовательностей в CD127 (т.е. последовательностей, которые не являются смежными в первичной последовательности CD127), возможно получить или отобрать антитела, которые распознают эпитоп, содержащий одну из указанных последовательностей в CD127, а затем отобрать из числа этих антител те, которые распознают другую последовательность (последовательности) в CD127 (указанный последующий отбор можно осуществлять посредством последовательных процедур отбора, если распознаваться должны более чем две несмежные последовательности в CD127).
Настоящее изобретение также включает в себя конформационный эпитоп, распознаваемый антагонистическими антителами в соответствии с настоящим изобретением. Настоящее изобретение также включает в себя антитела, которые связываются с этим конформационным эпитопом. Варианты осуществления включают в себя конформационный эпитоп в CD127, содержащий (i) домен с последовательностью, по меньшей мере на 80%, 85%, 90% или 95% идентичной SEQ ID NO. 115, и/или домен с последовательностью, по меньшей мере на 80%, 85%, 90% или 95% идентичной SEQ ID NO. 117, и (ii) домен с последовательностью, по меньшей мере на 80%, 85%, 90% или 95% идентичной SEQ ID NO. 116. Более конкретно, конформационный эпитоп в CD127 содержит аминокислотные остатки 73-79 и/или 114-119 и аминокислотные остатки 193-196 в SEQ ID No: 114. Настоящее изобретение включает в себя антитела, которые связываются с этим конформационным эпитопом. В соответствии с конкретными вариантами осуществления макромолекулу получают, конструируют или подвергают отбору таким образом, чтобы она распознавала конформационный эпитоп, содержащий аминокислотные последовательности в человеческом CD127, имеющие последовательности SEQ ID No: 115, SEQ ID No: 116 и SEQ ID No: 117.
В частности, в соответствии с описанными выше вариантами осуществления образование антитела индуцируется в ответ на иммуноген, который состоит из описанного эпитопа или содержит описанный эпитоп, т.е. первоначально получают посредством иммунизации животного, которое не является человеком, в частности, млекопитающего, антигеном, содержащим указанный эпитоп или состоящим из него. Соответственно, настоящее изобретение также относится к антигену, который содержит эпитоп, описанный выше, в частности, к его применению в качестве иммуногена при получении антител и/или к его применению в способах отбора и/или исследования для получения антитела, или антигенсвязывающего фрагмента, или другой макромолекулы. Настоящее изобретение также относится к указанным способам применения указанного антигена. Поскольку антигены могут содержать непептидные составляющие в дополнение к пептидным составляющим и/или могут содержать пептидные составляющие, которые не образуют часть эпитопа, в данном документе следует понимать, что, если не указано иное, или это очевидно из контекста, в случае, когда это относится к последовательности антигена и/или к признакам указанной последовательности, указанные последовательность или признаки, как следует понимать, обозначают последовательность (или ее признаки) части антигена, представляющей собой эпитоп. Если антиген содержит аминокислоты, которые не образуют часть эпитопа, указанные аминокислоты предпочтительно не содержат более чем 3, 4 или 5 последовательных аминокислот в CD127.
Если они являются соответствующими, и если они не являются неприменимыми с технической точки зрения, определения и признаки, раскрытые в данном документе в отношении антител или их фрагментов, подобным образом применяются к любой макромолекуле в соответствии с настоящим изобретением.
Связывание CD127
В соответствии с настоящим изобретением «связывание» с белком IL-7Rα относится к взаимодействию типа антиген-антитело и охватывает свойства «специфичного связывания» антител или их антигенсвязывающих фрагментов, причем специфичное связывание означает, что антитела или антигенсвязывающие фрагменты связываются с белком IL-7Rα, в то время как они не связываются или связываются со значительно более слабой аффинностью с другими белками (например, общей γ-цепью цитокинового рецептора). Специфичное связывание предпочтительно характеризуют и/или определяют в физиологических условиях, в особенности, с учетом pH исследуемого раствора и содержания в нем соли. Связывание и специфичность связывания можно исследовать в соответствии с анализами, раскрытыми в разделе Примеры, и их, в частности, можно исследовать с помощью анализа методом Biacore, ELISA или вестерн-блоттинг.
В соответствии с конкретным вариантом осуществления настоящего изобретения антитела или их антигенсвязывающие фрагменты целенаправленно воздействуют на альфа-цепь IL-7-R и связываются с альфа-цепью IL-7-R, когда она находится в комплексе с рецептором TSLP (с CCRF2; номер доступа в Genbank AF338733; Reche et al., 2001).
В соответствии с конкретным вариантом осуществления антитела или их фрагменты или химерные молекулы согласно настоящему изобретению связываются с CD127 в виде выделенного белка с константой диссоциации (Kd), которая ниже чем 5Е-10 М. В соответствии с предпочтительным вариантом осуществления константа диссоциации (Kd) ниже чем 1Е-10 М, или ниже чем 9Е-11 М, или ниже чем 5Е-11 М.
В соответствии с конкретными вариантами осуществления антитела или их фрагменты, или химерная молекула, или другая макромолекула согласно настоящему изобретению связываются с антигеном человеческого CD127, содержащим последовательности ep1 (SEQ ID No: 110) и/или ep2 (SEQ ID No: 111). В соответствии с конкретными вариантами осуществления антиген содержит фрагмент человеческого CD127, содержащий как ep1, так и ер2 (т.е. антиген содержит последовательности ep1 и ер2 и лежащие между ними последовательности человеческого CD127). В соответствии с другими вариантами осуществления антиген содержит только последовательности ep1 и ер2 из человеческого CD127, возможно, дополнительно к другим последовательностям из другого источника, которые отличаются от последовательностей человеческого CD127. В соответствии с другими вариантами осуществления последовательности ep1 и/или ер2 продолжаются с включением в себя нескольких дополнительных аминокислот из человеческого CD127, в частности, до одной аминокислоты с N-конца относительно ep1, до 7 аминокислот с С-конца относительно ep1, до 1, 10, 20 или 30 аминокислот с N-конца относительно ер2, до 7, 10, 20 или 30 аминокислот с С-конца относительно ер2. Конкретные антигены включают в себя антиген, который описан выше, предпочтительно содержащий как ep1, так и ер2, причем последовательность CD127, содержащая ep1, не продолжается так, чтобы она содержала аминокислоты, смежные с указанной последовательностью в последовательности человеческого CD127, или не продолжается так, чтобы она содержала более чем 1 аминокислоту с N-конца или более чем 7 аминокислот с С-конца относительно ep1 в последовательности человеческого CD127; и антиген, который описан выше, причем последовательность CD127, содержащая ер2, не продолжается так, чтобы она содержала аминокислоты, смежные с указанной последовательностью в последовательности человеческого CD127, или не продолжается так, чтобы она содержала более чем 30 аминокислот с N-конца или более чем 30 аминокислот с С-конца относительно ер2 в последовательности человеческого CD127; и антигены, имеющие оба эти признака. В соответствии с конкретными вариантами осуществления антитела или их фрагменты, или химерная молекула, или другая макромолекула в соответствии с настоящим изобретением связываются с антигеном человеческого CD127, содержащим последовательности SEQ ID No: 115, SEQ ID No: 116 и SEQ ID No: 117.
В соответствии с некоторыми вариантами осуществления антиген не перекрывается с эпитопом или не содержит эпитоп в IL-7R, который распознается моноклональным антителом, выбранным из группы, состоящей из C1GM, С2М3, Р3А9, Р4В3, P2D2, Р2Е11, HAL403a и HAL403b (описаны в международной заявке WO 2011104687 А1). В соответствии с некоторыми вариантами осуществления образование антитела индуцируется в ответ на антиген, или антитело связывается с эпитопом, которое не содержит какой-либо остаток или не содержит некоторые из остатков I82, K84, K100, T105 и Y192 альфа-рецептора интерлейкина 7, в частности, не содержит K100 и/или не содержит T105. В соответствии с некоторыми вариантами осуществления антиген или эпитоп не содержит K194 или не содержит какой-либо из остатков или не содержит все из остатков, выбранных из группы, состоящей из остатков D190, Н191 и K194 в человеческом IL-7R. В соответствии с конкретными вариантами осуществления антиген или эпитоп не содержит ни 182, ни K84, или не содержит ни K100, ни T105, или не содержит Y192, или содержит ни D190, Н191, Y192, ни K194.
Хотя CD127 является общим как для IL-7R, так и TSLPR, следует отметить, что антитело к CD127 не обязательно будет распознавать (т.е. связываться в подходящих условиях) CD127 в обоих контекстах. Более того, даже если антитело связывается с CD127 как в контексте IL-7R, так и TSLPR, оно не обязательно будет оказывать одинаковый эффект в отношении взаимодействия IL-7-IL-7R и взаимодействия TSLP-TSLPR. Оно, например, может предотвращать связывание IL-7 с IL-7R, но не связывание TSLP с TSLPR. Более того, связывание антитела с любым из рецепторов может оказывать разные эффекты помимо разных эффектов в отношении взаимодействия лиганд-рецептор. В действительности, связывание антитела может модифицировать конформацию рецептора независимо от лиганда или в сочетании с лигандом и тем самым активировать или инактивировать рецептор. Эффект может отличаться для любого из рецепторов, и фактически он может быть обратным: антитело, которое инактивирует IL-7R, может активировать TSLPR и наоборот.
Как используется в данном документе, активация рецептора означает запуск по меньшей мере некоторых из биохимических изменений, которые происходят после связывания лиганда с его рецептором. Эти изменения могут включать в себя модификацию структуры рецептора (например, димеризацию); фосфорилирование рецептора и привлечение и/или фосфорилирование связывающихся с рецептором белков (таких как Янус-киназы, транскрипционные факторы STAT и т.д.) и/или изменения в клеточной локализации рецептора (например, интернализации рецептора). Как используется в данном документе, деактивация рецептора означает предотвращение или обращение по меньшей мере одной из биохимических модификаций, связанных со связыванием его лиганда с рецептором. Например, рецептор может активироваться конститутивно (т.е. активироваться даже в отсутствие лиганда) и деактивироваться в присутствии средства, такого как антитело в соответствии с настоящим изобретением. В качестве альтернативы или дополнения, индуцируемая лигандом активация может полностью или частично ингибироваться при деактивации рецептора. Таким образом, деактивация может происходить, среди прочих механизмов, посредством предотвращения связывания лиганда (и последующих событий «активации»), и/или предотвращения структурных изменений, связанных со связыванием лиганда (например, димеризации), и/или модификации положения рецептора в клетке (например, деактивирующее средство может запускать интернализацию и/или разрушение рецептора и, следовательно, предотвращает активацию лигандом).
Отсутствие повышенного созревания дендритных клеток, индуцируемого TSLP
Антитела в соответствии с настоящим изобретением могут связываться с CD127 в рецепторе TSLP (т.е. могут связываться с CD127, когда он находится в комплексе с CRLF2, образуя рецептор TSLP). Таким образом, антитела в соответствии с настоящим изобретением может препятствовать индуцируемой TSLP и/или опосредованной рецептором TSLP передачи сигнала.
Авторы настоящего изобретения неожиданно обнаружили, что существующие антитела, которые направлены на CD127 (или которые распознают CD127) в рецепторе TLSP, и которые проявляют некоторый антагонизм в отношении взаимодействия TSLP-TSLPR, все-таки повышают созревание дендритных клеток, индуцируемое TSLP: указанное созревание выше в клетках, обработанных TSLP и антителами, чем в клетках, обработанных только TSLP. Эти традиционные антитела повышают зависимое от TSLP созревание дендритных клеток. В соответствии с предпочтительными вариантами осуществления антитела или фрагменты в соответствии с настоящим изобретением не проявляют синергию с TSLP в отношении созревания иммунных клеток, в частности, дендритных клеток. Иными словами, антитела в соответствии с настоящим изобретением не повышают созревание иммунных клеток, индуцируемое TSLP. Этот эффект является особенно желаемым в отношении созревания дендритных клеток.
Следует отметить, что способность антител к CD127 к ингибированию индуцируемой TSLP продукцией TARC нельзя считать обоснованным прогностическим фактором для отрицательного (или по меньшей мере не относящегося к положительному) эффекта антител в отношении индуцируемой TSLP передачи сигнала и ее дальнейших последствий (в частности, созревания дендритных клеток). В действительности, как обнаружили авторы настоящего изобретения, даже антитела, эффективно ингибирующие индуцируемую TSLP выработку TARC, могут повышать зависимое от TSLP созревание дендритных клеток, которое измеряют по экспрессии CD40 или CD80 с TSLPR.
Индуцируемое TSLP созревание дендритных клеток можно измерить по экспрессии клеточного маркера CD40 и/или CD80 (Inaba et al., 1995; Watanabe et al., 2005b) в качестве маркера, который является определяющим фактором созревания некоторых иммунных клеток, в особенности, так называемой дифференцировки ТН-2, наблюдаемой при некоторых аутоиммунных заболеваниях, астме и трансплантации. В соответствии с конкретными вариантами осуществления повышение созревания дендритных клеток, индуцируемое TSLP, оценивают посредством определения повышенной экспрессии маркера(маркеров) клеточной поверхности CD40 и/или CD80 в TSLPR-положительных клетках, обработанных TSLP и макромолекулой в соответствии с настоящим изобретением по сравнению с TSLPR-положительными клетками, обработанными только TSLP.
В соответствии с конкретным вариантом осуществления макромолекулы, в частности, антитела или их фрагмент, которые не повышают индуцируемое TSLP созревание дендритных клеток, не повышают экспрессию CD80 более чем на 25% по сравнению со стимуляцией только TSLP (без макромолекулы). Предпочтительно, экспрессия CD80 не повышается более чем на 20%, предпочтительно не более чем на 10% и еще более предпочтительно не более чем на 5%. В соответствии с конкретным предпочтительным вариантом осуществления экспрессия CD80 не повышается или снижается в клетках, стимулируемых TSLP и макромолекулой, по сравнению с клетками, стимулируемыми только TSLP.
В соответствии с конкретным вариантом осуществления макромолекулы, которые не повышают индуцируемое TSLP созревание дендритных клеток, не повышают экспрессию CD40 более чем на 50% по сравнению со стимуляцией только TSLP (без макромолекулы). Предпочтительно, экспрессия CD40 не повышается более чем на 25%, предпочтительно не более чем на 10% и еще более предпочтительно не более чем на 5%. В соответствии с конкретным предпочтительным вариантом осуществления экспрессия CD40 не повышается или снижается в клетках, стимулируемых TSLP и макромолекулой, по сравнению с клетками, стимулируемыми только TSLP.
Процедуры по измерению созревания дендритных клеток также иллюстрируется в разделе Примеры (см. в частности, пример 9), и их можно проводить в соответствии с любым стандартным способом, известным любому специалисту в данной области техники, в частности, любым способом, подходящим для определения экспрессии CD80 и/или CD40 на дендритных клетках, в качестве маркера созревания дендритных клеток.
Для анализа свойств антител к CD127 в отношении отсутствия нежелательного усиления передачи сигнала с участием TSLP можно использовать клетки, экспрессирующие TSLPR, такие как про-В-клетки млекопитающего (такие как BA/F3 клетки, проиллюстрированные в данном документе).
Ингибирование индуцируемой IL-7 экспрессии α4-, β7- и α4/β7-интегринов
В соответствии с конкретными вариантами осуществления антитела (или макромолекулы) согласно настоящему изобретению ингибируют индуцируемую IL-7 экспрессию α4-, β7- и α4/β7-интегринов in vitro. Индуцируемая IL-7 экспрессия α4-, β7- и α4/β7-интегринов, как используется в данном документе, обозначает любое из или оба из повышения уровня экспрессии α4- и β7-интегринов и повышения количества или доли Т-лимфоцитов, экспрессирующих α4-, β7- и/или α4/β7-интегрины. Ингибирование может быть частичным, т.е. уровень экспрессии α4-, β7- и α4/β7-интегринов в присутствии IL-7 повышен по сравнению с фоновым уровнем (т.е. уровнем и без антитела, и без IL-7) в присутствии антител, но повышен меньше, чем в отсутствие антител; или ингибирование может быть полным, т.е. уровень экспрессии α4-, β7- и α4/β7-интегринов в присутствии IL-7 и антитела не превышает фонового уровня.
В соответствии с конкретными вариантами осуществления антитела в соответствии с настоящим изобретением ингибируют экспрессию α4-, β7- и/или α4/β7-интегринов in vitro, т.е. уровень экспрессии α4-, β7- и/или α4/β7-интегринов ниже в клетках, обработанных антителами (и с IL-7 и/или без IL-7), чем в необработанных клетках (т.е. без антитела или IL-7). Степень ингибирования может быть дозозависимой. Ингибирование экспрессии можно измерить, как изложено в разделе Примеры, причем специалист в данной области техники может адаптировать измерение, например, к специфичным антителам, фрагментам антител, или антигенсвязывающим доменам, или другим макромолекулам, раскрытым в данном документе, и/или к конкретным моделям заболеваний, если это необходимо.
В соответствии с предпочтительными вариантами осуществления антитела (или макромолекулы) согласно настоящему изобретению ингибируют экспрессию α4-, β7- и/или α4/β7-интегринов in vivo. Как используется в данном документе, эта экспрессия означает, что (i) экспрессия α4-, β7- и/или α4/β7-интегринов, (ii) количество и/или доля α4-, β7- и/или α4/β7-положительных Т-лимфоцитов и/или (iii) приживление α4-, β7- и/или α4/β7-положительных Т-лимфоцитов снижены в образцах, полученных из животных, обработанных антителами, в сравнении с необработанными животными. Как используется в данном документе, приживление обозначает включение пересаженной ткани или клеток в организм хозяина, процесс, который, как правило, происходит за период времени, составляющий от нескольких часов до нескольких суток. В соответствии с конкретными вариантами осуществления животное представляет собой млекопитающее, в частности, млекопитающее, не являющееся человеком, в особенности, мышь. В соответствии с конкретными вариантами осуществления животное представляет собой человек. В соответствии с конкретными вариантами осуществления эффект наблюдается на человеческих лимфоцитах, вводимых инъекцией животному-реципиенту, предпочтительно, иммунодефицитной мыши. В соответствии с конкретными вариантами осуществления через две недели после инъекции человеческих РВМС иммунодефицитным мышам средний процент β7-интегрин-положительных Т-клеток снижается по меньшей мере на 25%, предпочтительно по меньшей мере на 50% у обработанных антителом мышей в сравнении с необработанными мышами. В соответствии с конкретными вариантами осуществления через две недели после инъекции человеческих РВМС иммунодефицитным мышам средний процент β7-интегрин-положительных прижившихся Т-клеток снижается по меньшей мере на 25%, предпочтительно по меньшей мере на 50% и еще более предпочтительно по меньшей мере на 70% у обработанных антителом мышей в сравнении с необработанными мышами. Эффект антитела или макромолекулы в соответствии с настоящим изобретением можно определить с помощью методов, приведенных в разделе Примеры, в частности, в примере 16 для экспрессии α4/β7-интегринов и приживления, причем специалист в данной области техники может адаптировать данные методы, если это необходимо, например, к конкретному антителу, его фрагменту или антигенсвязывающему домену или другой макромолекуле и/или к конкретной модели заболевания.
Ингибиторы интернализации CD127
Интернализация является процессом в клетке, посредством которого рецептор клеточной поверхности, такой как CD127, транспортируется внутрь цитоплазматического пространства клетки (возможно, на/у поверхности внутриклеточных компартментов или мембран) и, следовательно, больше не доступен из внеклеточного пространства, т.е. интернализированный рецептор не может напрямую контактировать с лигандом во внеклеточном пространстве. Лиганд, либо природный лиганд рецептора, либо любой искусственный лиганд или другая молекула, связанная с рецептором, может интернализироваться вместе с рецептором. Большинство рецепторов подвергаются постоянной интернализации, и их экспрессия на клеточной поверхности сохраняется постоянной либо вследствие замены интернализированных и разрушившихся рецепторов заново синтезированными/созревшими рецепторами, либо вследствие непосредственного возвращения, т.е. транспорта интернализированного рецептора обратно на клеточную поверхность.
Некоторые стимулы могут приводить к повышенной частоте интернализации и/или пониженной частоте замены/возвращения, таким образом приводя к чистому уменьшению экспрессии рецептора на клеточной поверхности. Как используется в данном документе, индуцируемая IL-7 интернализация CD127 обозначает снижение экспрессии CD127 на клеточной поверхности, индуцируемое присутствием IL-7 (или наблюдаемое в присутствии IL-7) во внеклеточной среде, которое наблюдается in vitro после ограниченного периода инкубирования с целью исключения долговременных эффектов, таких как понижающая регуляция транскрипции. Указанный ограниченный период, как правило, составляет порядка десятков минут, предпочтительно менее 2 часов, более предпочтительно менее 1 часа и еще более предпочтительно 45 минут или менее, 30 минут или менее или 15 минут или менее.
В соответствии с предпочтительным вариантом осуществления антитело в соответствии с настоящим изобретением ингибирует индуцируемую IL-7 интернализацию CD127. Таким образом, при инкубировании с антителом в соответствии с настоящим изобретением присутствие IL-7 не индуцирует снижения экспрессии CD127 на клеточной поверхности или индуцирует менее сильное снижение экспрессии CD127 на клеточной поверхности, чем у клеток, инкубируемых без антител. В соответствии с конкретными вариантами осуществления при инкубировании с антителами в соответствии с настоящим изобретением уровень экспрессии CD127 на клеточной поверхности, когда клетки инкубируют при 37°С в течение 15 минут с 5 нг/мл IL-7, составляет по меньшей мере 80%, предпочтительно по меньшей мере 90% от уровня экспрессия на клеточной поверхности в клетках, инкубируемых без IL-7. Экспрессию на клеточной поверхности предпочтительно измеряли in vitro после ограниченного периода, как указано выше. Кроме того, большинство процессов интернализации в клетку ингибируются при низкой температуре, эффект обычно лучше всего наблюдается при физиологической температуре, в частности, 37°С. Тем не менее также предполагается инкубирование клеток при низкой температуре, в частности, 4°С.
Известно, что антитела к рецептору могут индуцировать интернализацию рецептора, это означает, что экспрессия рецептора на клеточной поверхности понижается в присутствии антитела. Это, в частности, может являться результатом индукции изменения конформации рецептора, которое имитирует изменение, индуцируемое природным лигандом, индуцирующим интернализацию, и этот эффект может зависеть от эпитопа, распознаваемого антителами. Как используется в данном документе, «антитело индуцирует интернализацию CD127» означает, что клетки, инкубируемые в присутствии антитела, проявляют пониженную экспрессию CD127 на клеточной поверхности по сравнению с клетками, инкубируемыми в отсутствие антитела. Экспрессию на клеточной поверхности предпочтительно измеряют in vitro после ограниченного периода инкубирования и в температурных условиях, как упомянуто выше. В соответствии с предпочтительным вариантом осуществления антитело согласно настоящему изобретению не индуцирует интернализацию CD127. Таким образом, экспрессия CD127 на клеточной поверхности у клеток, инкубируемых в присутствии антитела, не снижается или не снижается значительно в сравнении с экспрессией на клеточной поверхности у клеток, инкубируемых в идентичных в других отношениях условиях, но в отсутствие антитела. В соответствии с конкретными вариантами осуществления при инкубировании при 37°С в течение 30-45 минут в присутствии 50 нг/мл антитела уровень экспрессии CD127 на клеточной поверхности составляет по меньшей мере 80%, предпочтительно по меньшей мере 90% от уровня у клеток, инкубируемых в отсутствие антитела. Этот эффект можно наблюдать в отсутствие IL-7 (как у обработанных антителом, так и необработанных антителом клеток), в присутствии IL-7 и/или в обоих случаях.
Любой из двух относящихся к интернализации CD127 признаков, описанных выше (т.е. ингибирование индуцируемой IL-7 интернализацией или отсутствие индукции интернализации), может вносить вклад в повышенную эффективность антител, в то время как комбинация обоих признаков, возможно, будет еще более эффективной. В данном документе раскрыто антитело, представляющее собой предпочтительный вариант осуществления, причем в присутствии как IL-7, так и указанного антитела экспрессия CD127 на клеточной поверхности не снижается значительно. В соответствии с такими предпочтительными вариантами осуществления после 45-минутного инкубирования в присутствии 50 нг/мл антитела, включающего 15 минут в присутствии 5 нг/мл IL-7, при 37°С, уровень экспрессии CD127 на клеточной поверхности составляет по меньшей мере 80%, предпочтительно по меньшей мере 90% от этого уровня в контрольных клетках, инкубируемых в среде, не содержащей антитело или IL-7.
Нарушение взаимодействия CD127 - γс-цепь
В соответствии с конкретным вариантом осуществления макромолекула, в частности, антитело или его антигенсвязывающий фрагмент, согласно настоящему изобретению может нарушать связывание CD127 с γс-цепью в IL-7-R. Это означает, что в условиях (в частности, химических и физических условиях), когда CD127 и γс-цепь связываются вместе в отсутствие антитела и, в частности, в присутствии IL-7, присутствие антитела значительно снижает указанное связывание. В соответствии с конкретными вариантами осуществления, в присутствии антитела и IL-7 CD127 не связывается с γс. В частности, в присутствии антитела и IL-7 количество γс-цепи, которое обнаруживается связавшимся (или связавшимся) с CD127 составляет менее чем 80%, предпочтительно менее чем 50%, еще более предпочтительно менее чем 25% или 10% от количества, связавшегося в отсутствие антитела (или в присутствии другого антитела к CD-127, такого как MD707-13) в идентичных в других отношениях условиях, в частности, в присутствии IL-7. Такой признак антитела можно оценивать, в частности, с помощью методов совместного иммуноосаждения, хорошо известных специалисту в данной области техники для исследования взаимодействия белков и проиллюстрированных в данном документе в примере 21. В частности, клетки можно инкубировать в присутствии или в отсутствие исследуемого антитела, затем солюбилизировать в условиях, обеспечивающих возможность сохранения белковых комплексов, и полученный в результате лизат можно подвергнуть иммуноосаждению с использованием антитела к CD127, а присутствие γс в содержащем CD127 и подвергшемся иммуноосаждению комплексе можно оценивать с помощью вестерн-блоттинга с использованием антител к γс (и наоборот, иммуноосаждение можно осуществлять с использованием антител к γс, а присутствие CD127 можно оценивать с использованием антител к CD127).
Один способ получения таких антител заключается в индукции образования указанных антител к эпитопу, содержащему последовательности из сайта 2b в CD127, или в отборе антител, которые распознают такой эпитоп. В действительности, связывание антитела с этим сайтом, критически важным для взаимодействия с γс, вероятно, нарушает взаимодействие γс с CD127, например, за счет конкуренции или стерического несоответствия.
Также представляется возможным, в частности, отбор антител, имеющих этот желательный признак, из антител к CD127, например, из библиотеки антител (в том числе, когда эта библиотека не получена с использованием иммуногена, содержащего последовательности сайта 2b) посредством традиционных процедур скрининга, известных специалисту в данной области техники и легко адаптируемых для такой цели. В частности, например, CD127 (или только его внеклеточный домен) может быть связан с 96-луночными планшетами или подобными подложками, зачастую используемыми для такого скрининга. Антитела, составляющие библиотеку, можно добавлять по отдельности, каждое в одну лунку, а γс-цепь можно добавлять в каждую лунку. После промывания планшетов можно исследовать присутствие γс в каждой лунке, например, с помощью методов, основывающихся на флуоресценции. В лунках, содержащих антитело с желаемым признаком, не выявлялся γс (или его малые количества). Очевидно, что возможно модифицировать эту процедуру, например, наоборот, нанести антитела на твердую подложку в виде отдельных пятен; обеспечить возможность связывания CD127 с нанесенными в виде пятен антителами и обеспечить возможность связывания γс-цепи с иммобилизированными таким образом цепями CD127.
Антагонист в отношении взаимодействия IL-7 - IL-7R
В соответствии с конкретным вариантом осуществления, макромолекула, в частности, антитело или его антигенсвязывающий фрагмент, в соответствии с настоящим изобретением дополнительно характеризуется антагонистическими свойствами в отношении интерлейкина 7 (IL-7), тем самым противодействуя доступу, т.е. связыванию IL-7 с CD127, на СВ127-положительных клетках.
Выражение «антагонистические свойства в отношении взаимодействия IL-7-IL-7R» означает, что антитела или их антигенсвязывающие фрагменты в соответствии с настоящим изобретением, которые целенаправленно воздействуют на IL-7Rальфа, оказывают эффект, заключающийся в ограничении доступности рецептора IL-7, экспрессируемого на CD127-клетках, в особенности, на человеческих эффекторных Т-клетках, в частности, на человеческих Т-клетках памяти, для его партнера по образованию связи, IL-7, в особенности, человеческого IL-7. В результате противодействия связыванию IL-7 антитела в соответствии с настоящим изобретением или их функциональные фрагменты приводят к лимфопении, предотвращая зависимое от IL-7 образование Т-клеток в тимусе.
Антагонистические свойства могут представлять собой, в частности, антагонизм в отношении передачи сигнала с участием IL-7R, индуцируемой IL-7. Антагонист передачи сигнала с участием IL-7R, индуцируемой IL-7, можно идентифицировать посредством измерения ингибирования фосфорилирования STAT5, как описано в разделе Примеры. Индуцируемое IL-7 фосфорилирование STAT5 является маркером активации IL-7R, и антитело, противодействующее взаимодействию IL-7-IL-7R, как ожидается, снижает индуцируемое IL-7 фосфорилирование STAT5.
В соответствии с конкретными вариантами осуществления макромолекула согласно настоящему изобретению представляет собой антагонист передачи сигнала с участием IL-7R, индуцируемой IL-7. В соответствии с конкретным вариантом осуществления макромолекула согласно настоящему изобретению ингибирует индуцируемое IL-7 фосфорилирование STAT5. В соответствии с предпочтительными вариантами осуществления ингибирование фосфорилирования STAT5 составляет более чем 50% при концентрациях антитела до 50 нг/мл, и/или ингибирование фосфорилирования STAT5 составляет более чем 80% при концентрациях антитела до 100 нг/мл. Ингибирование фосфорилирования STAT5 можно оценить с помощью методов, известных специалисту в данной области техники, и, в частности, с помощью метода, изложенного в разделе Примеры (в частности, примере 3).
Антагонист в отношении связывания TSLP
Поскольку антитела в соответствии с настоящим изобретением связываются с CD127 в IL-7R, они также могут связываться с CD127 в TSLPR, и они могут ингибировать связывание TSLP с TSLPR, в частности, за счет стерического несоответствия и/или за счет конкуренции в общих сайтах связывания. Иными словами, антитела в соответствии с настоящим изобретением могут проявлять антагонистическую активность в отношении связывания TSLP.
Ингибитор индуцируемой TSLP продукции TARC
В соответствии с конкретным вариантом осуществления антитела согласно настоящему изобретению могут ингибировать индуцируемую TSLP продукцию TARC у CD127-положительных клеток. Как упоминается выше, стимулируемые TSLP дендритные клетки продуцируют повышенные уровни TARC. Это может являться результатом их связывания с TSLPR и их потенциального действия в качестве антагонистов связывания TSLP.
В соответствии с конкретным вариантом осуществления антитела согласно настоящему изобретению и их антигенсвязывающие фрагменты подверглись отбору в отношении своей способности не повышать созревание (причем созревание определяется, например, повышением экспрессии маркера клеточной поверхности CD40 и/или CD80).
Уровень индуцируемой TSLP продукции TARC может быть ниже у клеток, обработанных TSLP вместе с антителами к CD127 или их фрагментами или химерными молекулами, которые описаны в данном документе, чем у клеток, обработанных только TSLP. Иными словами, макромолекулы в соответствии с настоящим изобретением могут представлять собой ингибиторы индуцируемой TSLP продукции TARC. В соответствии с вариантом осуществления настоящего изобретения антитело или его фрагмент или химерная молекула, которые описаны в данном документе, снижают уровни продукции TARC. В соответствии с конкретным вариантом осуществления настоящего изобретения уровень продукции TARC в клетках, обработанных TSLP и антителом, фрагментом или химерной молекулой снижается более чем на 10%, предпочтительно более чем на 20% по сравнению с уровнем в клетках, обработанных только TSLP, при концентрациях антитела до 1 мкг/мл. Измерение продукции TARC иллюстрируется в разделе Примеры (в частности, в примере 9), и его можно выполнять на СD127-положительных иммунных клетках, в частности, дендритных клетках, из образца крови с использованием стандартного метода, известного специалисту в данной области техники.
Цитотоксическая активность
В соответствии с конкретным вариантом осуществления настоящего изобретения антитела в соответствии с настоящим изобретением или их антигенсвязывающие фрагменты, направленные на молекулу CD127, присутствующую в рецепторе IL-7, характеризуются дополнительным свойством, заключающемся в цитотоксичности в отношении человеческих клеток, в особенности, человеческих Т-клеток, экспрессирующих указанный рецептор. Человеческие клетки, экспрессирующие CD127 в виде цепи рецептора IL-7, которые являются мишенями антител в соответствии с настоящим изобретением и их фрагментов, представляют собой, главным образом, Т-лимфоциты, и более точно, они представляют собой субпопуляции эффекторных Т-лимфоцитов, включающие в себя наивные Т-клетки и Т-клетки памяти, но не представляют собой регуляторные Т-клетки (Treg), в особенности, не представляют собой покоящиеся натуральные Treg. Т-клетки памяти образуются в результате примирования антигеном и определяются, главным образом, по своим функциональным характеристикам, в том числе по способности подвергаться пролиферации при вторичном иммунном ответе после повторной активации и дифференцировки во вторичные эффекторные клетки и клетки памяти. Подобным образом, являющийся мишенью рецептор TSLP (в виде комплекса, включающего в себя альфа-цепь IL-7-R) регулирует дифференцировку Т-хелперных лимфоцитов, В-клеток и дендритных клеток.
В соответствии с вариантом осуществления настоящего изобретения антитела и их антигенсвязывающие фрагменты, характеризующиеся «цитотоксической активностью в отношении Т-клеток» или цитотоксическими свойствами (цитотоксические антитела), вызывают сокращение популяции эффекторных Т-клеток посредством цитолиза этих клеток, и, соответственно, количество этих клеток снижается при их введении. Тем не менее, эти антитела не изменяют субпопуляцию регуляторных Т-клеток или не изменяют ее в значительной мере, позволяя Treg клеткам выполнять свою функцию. В этом контексте, в соответствии с конкретным вариантом осуществления наблюдалось, что доля регуляторных Т-клеток (Treg) в сравнении с эффекторными Т-клетками (Teff) возрастает после введения антител в соответствии с настоящим изобретением. В соответствии с конкретным вариантом осуществления антитела согласно настоящему изобретению обеспечивают возможность роста указанной приблизительно на 10% или более. В соответствии с конкретным вариантом осуществления повышение доли Treg в сравнении с Teff составляет приблизительно 20%.
В соответствии с конкретным вариантом осуществления настоящего изобретения цитотоксические антитела проявляют антителозависимую клеточную цитотоксичность (ADCC). В соответствии с другим вариантом осуществления антитела согласно настоящему изобретению не характеризуются свойствами ADCC. Потенциал антитела к ADCC считается положительным, когда специфичная цитотоксичность превышала 10%. Свойства ADCC можно оценить в анализе ADCC, таком как анализ, описанный в разделе Примеры (в частности, в примере 10). Если антитело представляет собой крысиное антитело, эффекторные клетки, используемые в анализе ADCC, представляют собой LAK (лимфокин-активированные киллеры) клетки крысы. Если антитела являются гуманизированными, анализ ADCC можно выполнять на человеческих NK-клетках.
Антитела в соответствии с настоящим изобретением, которые характеризуются свойствами как цитотоксичности, так и антагонизма в отношении CD127-положительных клеток, обеспечивают возможность кумулятивных эффектов от этих свойств в отношении сокращения количества эффекторных Т-клеток, в особенности, Т-клеток памяти, тем самым обеспечивая возможность более сильного сокращения (истощения пула CD127+-клеток) и соответствующего снижения количества Т-клеток-мишеней.
В абзацах выше, а также в разделе Примеры описывается то, как исследовать эти функциональные характеристики. В следующих разделах будут подробно описываются различные структурные характеристики и возможные модификации антител, или фрагментов, или химерных молекул. С учетом этих указаний специалист в данной области техники будет способен получить антитела или фрагменты с нижеприведенными структурными характеристиками вместе с желаемыми функциональными характеристиками, в частности, исходя из антитела, которое имеет желаемые функциональные характеристики, такого как N13B2, поскольку в некоторых случаях можно спрогнозировать, что заимствование некоторых из структурных признаков не будет модифицировать функциональные признаки, и/или при помощи анализа в отношении потери функциональных характеристик после введения новой структурной характеристики. Более того, в соответствии с раскрытием в данном документе эпитопа, распознаваемого антителом, разработка других антител, у которых присутствуют те же функциональные признаки, является стандартной процедурой, поскольку антитела, образование которых индуцируют против одинакового или подобного эпитопа, можно подвергнуть отбору в отношении их способности вызывать подобные эффекты при связывании с CD127. Более того, в данном документе раскрыты несложные процедуры анализа, специалист в данной области техники может использовать эти анализы для отбора подходящих антител.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения макромолекула представляет собой N13B2 или антитело, имеющее по меньшей мере один из CDR N13B2, или фрагменты представляют собой фрагменты N13B2. Соответственно, настоящее изобретение относится к антителу или его фрагменту, VH которых содержит по меньшей мере одну из следующих аминокислотных последовательностей или один из их предпочтительных гуманизированных вариантов, описанных ниже:
- VHCDR1 SEQ ID No: 10;
- VHCDR2 SEQ ID No: 12;
- VHCDR3 SEQ ID No: 14;
и/или VL которых содержит по меньшей мере одну из следующих аминокислотных последовательностей или один из их предпочтительных гуманизированных вариантов, описанных ниже:
- VLCDR1 SEQ ID No: 16;
- VLCDR2 SEQ ID No: 18;
- VLCDR3 SEQ ID No: 20.
В соответствии с конкретным вариантом осуществления макромолекула содержит по меньшей мере 2, 3, 4 или 5 из последовательностей CDR N13B2, т.е. VHCDR1 SEQ ID No: 10, VHCDR2 SEQ ID No: 12, VHCDR3 SEQ ID No: 14, VLCDR1 SEQ ID No: 16, VLCDR2 SEQ ID No: 18 и VLCDR3 SEQ ID No: 20, любое количество из которых может быть заменено одним из их предпочтительных гуманизированных вариантов, описанных ниже. В соответствии с конкретным вариантом осуществления макромолекула содержит все шесть последовательностей CDR N13B2, любое количество из которых может быть заменено одним из их предпочтительных гуманизированных вариантов, описанных ниже. В соответствии с конкретными вариантами осуществления макромолекула содержит VH-цепь, имеющую аминокислотную последовательность SEQ ID No: 22, и/или VL-цепь, имеющую аминокислотную последовательность SEQ ID No: 24. В соответствии с конкретными вариантами осуществления макромолекула содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID No: 2 и/или SEQ ID No: 6, и/или легкую цепь, имеющую аминокислотную последовательность SEQ ID No: 4. Другие конкретные варианты осуществления, относящиеся к VH- и VL-цепям, представляют собой гуманизированные варианты, раскрытые ниже. В соответствии с конкретным вариантом осуществления константная цепь имеет последовательность Fc-цепи крысиного IgG1 с фиг. 12 (Uniprot Р20759) и/или последовательность SEQ ID No: 34.
Фрагменты
«Антигенсвязывающий фрагмент» антитела в соответствии с настоящим изобретением представляет собой часть антитела, т.е. молекулу, соответствующую части структуры антитела в соответствии с настоящим изобретением, которая проявляет способность антигенсвязывающую способность в отношении альфа-цепи рецептора IL-7 для человеческого IL-7, возможно, в его нативной форме; такой фрагмент, в особенности, проявляет такую же или практически такую же специфичность связывания с антигеном в отношении указанного антигена по сравнению со специфичностью связывания с антигеном у соответствующего четырехцепочечного антитела. Преимущественно, антигенсвязывающие фрагменты характеризуются аналогичной аффинностью связывания, что и соответствующие 4-цепочечные антитела. Тем не менее антигенсвязывающий фрагмент, который характеризуется пониженной аффинностью связывания антигена в сравнении с соответствующими 4-цепочечными антителами, также охватывается настоящим изобретением. Антигенсвязывающую способность можно определить посредством измерения аффинности антитела и рассматриваемого фрагмента. Эти антигенсвязывающие фрагменты можно также называть функциональными фрагментами антител.
Антигенсвязывающие фрагменты антител представляют собой фрагменты, которые содержат их гипервариабельные домены, обозначаемые CDR (определяющие комплементарность участки), или их часть(части), охватывающие сайт распознавания для антигена, т.е. IL-7Ra для человеческого IL-7, тем самым определяя специфичность распознавания антигена. Каждая легкая и тяжелая цепь (соответственно, VL и VH) в четырехцепочечном иммуноглобулине имеет три CDR, обозначаемые VL-CDR1, VL-CDR2, VL-CDR3 и VH-CDR1, VH-CDR2, VH-CDR3, соответственно. Таким образом, настоящее изобретение относится, в частности, к фрагментам антител в соответствии с настоящим изобретением, которые содержат или состоят из всех CDR или набора CDR из числа VL-CDR1 (SEQ ID No: 16), VL-CDR2 (SEQ ID No: 18), VL-CDR3 (SEQ ID No: 20) и VH-CDR1 (SEQ ID No: 10), VH-CDR2 (SEQ ID No: 12) и VH-CDR3 (SEQ ID No: 14), их гуманизированным вариантам, раскрытым ниже, или их функциональным частям, т.е. частям, которые проявляют желаемую специфичность связывания, предпочтительно с высокой аффинностью в отношении IL-7Ra для человеческого IL-7.
Конкретные антигенсвязывающие фрагменты в соответствии с настоящим изобретением представляют собой фрагменты VH-цепи антитела в соответствии с настоящим изобретением, в которых объединены его CDR1, CDR2 и CDR3 домены, в частности, домены, имеющие аминокислотную последовательность, раскрытую в данном документе, в том числе гуманизированные варианты, раскрытые ниже. Другие фрагменты в соответствии с настоящим изобретением представляют собой фрагменты VL-цепи антитела в соответствии с настоящим изобретением, в которых объединены его CDR1, CDR2 и CDR3 домены, в частности, домены, имеющие аминокислотную последовательность, раскрытую в данном документе, в том числе гуманизированные варианты, раскрытые ниже. Фрагменты, которые содержат или состоят из VH-CDR3 и/или VL-CDR3, в частности, имеющих аминокислотную последовательность, раскрытую в данном документе, в том числе гуманизированные варианты, раскрытые ниже, или их функциональные части являются особенно предпочтительными, когда CDR3 участки оказываются детерминантами специфичности распознавания антигена.
Специалист в данной области техники будет способен определить расположение различных участков/доменов антител, исходя из стандартных определений, изложенных в этой связи, включая эталонную систему нумерации (Martin, 2001), или исходя из системы нумерации по Kabat (Kabat et al., 1992), или посредством применения IMGT алгоритма «collier de perle» (http://www.imgt.org/IMGTindex/Colliers.html, Lefranc et al., 1999). В связи с этим для определения последовательностей в соответствии с настоящим изобретением, следует отметить, что разграничение участков/доменов может изменяться от одной эталонной системы к другой. Соответственно, участки/домены, которые определены в соответствии с настоящим изобретением, охватывают последовательности, у которых проявляются изменения в длине или локализации рассматриваемых последовательностей в пределах полноразмерной последовательности вариабельных доменов антител, составляющие примерно +/-10%.
Кроме того, деиммунизирующие остатки могут присутствовать в CDR доменах вариабельного участка у антител или их антигенсвязывающих фрагментов. В соответствии с конкретным вариантом осуществления антитело или его фрагмент являются деиммунизированными.
Исходя из структуры четырехцепочечных иммуноглобулинов, антигенсвязывающие фрагменты можно, таким образом, определить посредством сравнения с последовательностями антител в доступных базах данных и в источниках из уровня техники (Martin, 2001) и, в особенности, посредством сравнения расположения функциональных доменов в этих последовательностях, учитывая, что положения каркасных и константных доменов хорошо определены для различных классов антител, в особенности, для IgG, в частности, для IgG млекопитающих. Такое сравнение также включает данные, относящиеся к 3-мерным структурам антител.
С целью иллюстрации конкретных вариантов осуществления настоящего изобретения антигенсвязывающие фрагменты антитела, которые содержат вариабельные домены, содержащие CDR указанного антитела, охватывают Fv, dsFv, scFv, Fab, Fab', F(ab')2, которые хорошо определены в источниках (Kabat et al., 1992), (Martin, 2001), а также (Delves et al., 2011). Fv фрагменты состоят из VL- и VH-доменов антитела, связанных вместе за счет гидрофобных взаимодействий; в dsFv фрагментах гетеродимер VH:VL стабилизируется дисульфидной связью; в scFv фрагментах VL- и VH-домены соединены друг с другом посредством гибкого пептидного линкера, образуя таким образом одноцепочечный белок. Fab фрагменты представляют собой мономерные фрагменты, которые можно получить посредством расщепления антитела папаином; они содержат полную L-цепь и VH-CH1 фрагмент Н-цепи, связанные вместе посредством дисульфидной связи. F(ab')2 фрагмент можно получить посредством расщепления антитела пепсином ниже дисульфидной связи в шарнирном участке; он содержит два Fab' фрагмента и дополнительно часть шарнирного участка молекулы иммуноглобулина. Fab' фрагменты можно получить из F(ab')2 фрагментов посредством разрезания дисульфидной связи в шарнирном участке. F(ab')2 фрагменты являются бивалентными, т.е. они содержат два антигенсвязывающих сайта, подобно нативной молекуле иммуноглобулина; с другой стороны Fv (димер VH-VL, составляющий вариабельную часть Fab), dsFv, scFv, Fab и Fab' фрагменты являются моновалентными, т.е. они содержат один антигенсвязывающий сайт.
Химерные антитела
В соответствии с другим вариантом осуществления настоящего изобретения антитела являются модифицированными и в результате представляют собой химерные антитела, содержащие домены или нить(нити) аминокислотных остатков из разных антител, в частности, антител, полученных из животных разных видов, объединенные вместе в функциональном антителе. В соответствии с конкретным вариантом осуществления макромолекула в соответствии с настоящим изобретением представляет собой химерное антитело, состоящее из сборки фрагментов антитела по меньшей мере из двух разных видов. В соответствии с конкретным вариантом осуществления химерное антитело содержит константный участок человеческого антитела. Такие константные участки иллюстрируются в примерах Fc фрагментами G1 (SEQ ID No: 26) или Fc фрагментами G4 (SEQ ID No: 28) или CL фрагментом каппа-цепи (SEQ ID No: 30). В качестве альтернативы, можно применять человеческие Fc фрагменты, представленные на фиг. 12 (Uniprot Р01857, Uniprot Р01859, Uniprot Р01861) и/или имеющие последовательности SEQ ID No: 31, SEQ ID No: 32, SEQ ID No: 33 или SEQ ID No: 112. В соответствии с конкретным вариантом осуществления химерное антитело содержит вариабельный участок из антитела грызуна и константный участок из человеческого антитела. В соответствии с конкретным вариантом осуществления химерное антитело содержит VH-цепь с последовательностью SEQ ID No: 2 (N13B2-G1m-VH-FcG1m(E333A)) или последовательностью SEQ ID No: 6 (N13B2-G4m-VH-FcG4m(S228P)) и VL-цепь с последовательностью SEQ ID No: 4 (N13B2-G1m-VL-CLkappa).
Аффитины, антикалины и другие миметики антител
Макромолекулы в соответствии с настоящим изобретением также содержат искусственные белки со способностью связываться с антигенами, имитируя такую способность антител, также называемые в данном документе антигенсвязывающим миметиком антитела. Такие белки включают аффитины и антикалины. Аффитины представляют собой искусственные белки со способностью к селективному связыванию с антигенами. В плане структуры они происходят из ДНК-связывающего белка Sac7d, обнаруженного в Sulfolobus acidocaldarius, микроорганизму, относящемуся к домену архей. Располагая в случайном порядке аминокислоты на участвующей в связывании поверхности Sac7d, например, создавая варианты, соответствующие случайным заменам 11 остатков на участвующей в связывании поверхности Sac7d, можно создать библиотеку аффитинов и подвергнуть полученный в результате библиотеку белков раундам рибосомного дисплея, аффинность может быть направлена в отношении различных мишеней, таких как пептиды, белки, вирусы и бактерии. Аффитины представляют собой миметики антител, и их разрабатывают в качестве инструментов в биотехнологии. Их также использовали в качестве специфичных ингибиторов для различных ферментов (Krehenbrink et al., 2008). Специалист в данной области техники легко сможет разработать аффитины с требующимися свойствами связывания с использованием способов, известных в уровне техники, в частности, раскрытых в патентной заявке WO 2008068637 и в вышеприведенной публикации, в частности, создание библиотек для фагового дисплея и/или рибосомного дисплея и их скрининг с использованием антигена, который раскрыт в данном документе. Антикалины представляют собой искусственные белки, которые способны к связыванию с антигенами, либо с белками, либо с малыми молекулами. Они представляют собой миметики антитела, полученные из человеческих липокалинов, которые являются семейством природных связывающих белков. Антикалины приблизительно в восемь раз меньше, причем их длина составляет приблизительно 180 аминокислот, а масса приблизительно 20 кДа (Skerra, 2008). Были созданы библиотеки фагового дисплея антикалинов, которые обеспечивают возможность скрининга и отбора, в частности, антикалинов со свойствами специфичного связывания. Специалист в данной области техники легко сможет разработать аффитины с требующимися свойствами связывания с использованием способов, известных в уровне техники, в частности, раскрытых в европейском патенте ЕР 1270725 В1, патенте США US8536307 В2, (Schlehuber and Skerra, 2002) и в вышеприведенной публикации, в частности, создание библиотек для фагового дисплея и/или рибосомного дисплея и их скрининг с использованием антигена, который раскрыт в данном документе. Как и антикалины, так и аффитины можно получать в ряде экспрессионных систем, включающем бактериальные экспрессионные системы. Таким образом, настоящим изобретением предполагаются аффитины, антикалины и другие подобные миметики антител с признаками антител, описанных в данном документе, в частности, в том, что касается связывания с CD127, отсутствия индукции и/или ингибирования интернализации CD127, созревания DC, причем все они предполагаются в качестве макромолекул в соответствии с настоящим изобретением.
Гуманизация
В соответствии с конкретным вариантом осуществления макромолекулы в согласно настоящему изобретению представляют собой гуманизированные антитела или их антигенсвязывающие фрагменты. Соответственно, будучи первоначально полученными у животных, в особенности, у грызунов и, в частности, у крыс после иммунизации животных и получения моноклональных антител из гибридомы, у антител в соответствии с настоящим изобретением модифицируют последовательности их VH и/или VL посредством замены аминокислотных остатков в каркасной области и, необязательно, дополнительно в последовательностях CDR. Гуманизацию можно осуществлять посредством рекомбинации поверхностных остатков или посредством CDR-прививки в соответствии с известными методиками. Рекомбинации поверхностных остатков, в частности, достигают посредством замены остатков из грызуна на человеческие аминокислотные остатки. Замену выполняют таким образом, чтобы сохранялась структура каркасной области исходного антитела, а также презентирование CDR, тем самым обеспечивая возможность того, что взаимодействия каркасных областей и CDR в антителе, подвергшемся рекомбинации поверхностных остатков, сохраняют нативную конформацию поверхности, контактирующей с антигеном для того, чтобы у антитела сохранялась аффинность связывания с антигеном.
Предпочтительные варианты осуществления антитела в соответствии с настоящим изобретением представлены гуманизированными вариантами антитела N13B2 (крысиного), содержащего следующие легкие и тяжелые цепи:
Тяжелая цепь N13B2-h1, имеющая последовательность SEQ ID No: 36, в котором последовательности CDR крысиного N13B2 были сохранены, также как и несколько других аминокислот за пределами последовательностей CDR, и в котором все остальные аминокислоты совпадают с последовательностью человеческого антитела. Эта тяжелая цепь на 87,8% идентична тяжелой цепи человеческого антитела. Следующие остатки за пределами последовательностей CDR были сохранены: V в положении Н24 по Kabat (положение 24 на фиг. 23; А - в человеческой последовательности), V в положении Н37 по Kabat (положение 37 на фиг. 23; I - в человеческой последовательности), А в положении Н49 по Kabat (положение 49 на фиг. 23; S - в человеческой последовательности) и D в положении Н73 по Kabat (положение 74 на фиг. 23; N - в человеческой последовательности);
Тяжелая цепь N13B2-h2, имеющая последовательность SEQ ID No: 38, в которой, в сравнении с тяжелой цепью N13B2-h1, аминокислоты в положениях Н37, Н49 и Н73 по Kabat за пределами последовательностей CDR были модифицированы таким образом, чтобы они совпадали с последовательностью тяжелой цепи человеческого антитела;
Тяжелая цепь N13B2-h3, имеющая последовательность SEQ ID No: 40, в которой, в сравнении с тяжелой цепью N13B2-h2, М в положении Н96 по Kabat (положение 100 на фиг. 23) в пределах последовательности CDR3 был мутирован в L для того, чтобы она совпадала с последовательностью тяжелой цепи человеческого антитела и/или во избежание посттрансляционной модификации. Другие возможные остатки для этого положения включают в себя, в частности, A, F и I и, более предпочтительно, F или I. Соответственно, возможный гуманизированный вариант для последовательности CDR3 в VH N13B2 имеет последовательность SEQ ID No: 48.
Легкая цепь N13B2-h1, имеющая последовательность SEQ ID No: 42, в котором последовательности CDR крысиного N13B2 были сохранены, также как и несколько других аминокислот за пределами последовательностей CDR, и в котором все остальные аминокислоты совпадают с последовательностью человеческого антитела. Эта легкая цепь на 80% идентична легкой цепи человеческого антитела. Следующие остатки за пределами последовательностей CDR были сохранены: V в положении L48 по Kabat (положение 48 на фиг. 24; I - в человеческой последовательности), Y в положении L71 по Kabat (положение 71 на фиг. 24; F - в человеческой последовательности) и F в положении L87 по Kabat (положение 87 на фиг. 24; Y - в человеческой последовательности);
Легкая цепь N13B2-h2, имеющая последовательность SEQ ID No: 44, в которой, в сравнении с легкой цепью N13B2-hl, аминокислоты в положениях L48, L71 и L87 по Kabat за пределами последовательностей CDR были модифицированы таким образом, чтобы они совпадали с последовательностью легкой цепи человеческого антитела;
Легкая цепь N13B2-h3, имеющая последовательность SEQ ID No: 46, в которой, в сравнении с легкой цепью N13B2-h2, аминокислоты в положениях L31 (положение 31 на фиг. 24) и/или L52 (положение 53 на фиг. 24) по Kabat в пределах последовательностей CDR1 и CDR2, соответственно, были мутированы c N в Q и с S в T, соответственно, для того, чтобы она совпадала с последовательностью легкой цепи человеческого антитела и/или во избежание посттрансляционной модификации. Другие возможные аминокислоты для положения L31 включают в себя Н и R. Другие возможные мутации для последовательности CDR3 включают сохранение S в положении L52 и мутирование N в положении L51 (положение 52 на фиг. 24) в Q, H, K или R. Соответственно, возможный гуманизированный вариант для последовательности CDR1 в VL N13B2 имеет последовательность SEQ ID No: 50, и возможный гуманизированный вариант для последовательности CDR2 в VL N13B2 имеет последовательность SEQ ID No: 52.
Мультифункциональные антитела или фрагменты
Эти основные антигенсвязывающие фрагменты в соответствии с настоящим изобретением можно объединить вместе с получением мультивалентных антигенсвязывающих фрагментов, таких как диатела, триотела или тетратела. Эти мультивалентные антигенсвязывающие фрагменты также являются частью настоящего изобретения.
Вышеупомянутые модификации можно комбинировать в тех случаях, когда это уместно. В соответствии с конкретными вариантами осуществления макромолекула представляет собой антитело, которое представляет собой химерное антитело, или гуманизированное антитело, и/или деиммунизированное антитело.
Способы получения антител в соответствии с настоящим изобретением
Образование антитела или его антигенсвязывающего фрагмента в соответствии с настоящим изобретением преимущественно индуцируют, в частности, в отношении молекулы, которая представляет собой CD127, экспрессируемый человеческими Т-клетками, возможно, их образование также индуцируется иммунизацией под действием формы нативного полипептида или рекомбинантной молекулы.
Иммунизацию можно выполнять в соответствии с протоколом, раскрытым в разделе Примеры ниже: Рекомбинантную химеру CD127-Fc (10975-H03H Sino Biological, Пекин, Китай) использовали для иммунизации крыс, таких как крысы линии LOU/C Igk1a, доступной от Левенского университета, Бельгия). В качестве альтернативы, антиген, содержащий аминокислотные последовательности SEQ ID No: 115 (в частности, содержащий SEQ ID No: 110), и/или SEQ ID No: 117 (в частности, содержащий SEQ ID No: 111), и/или SEQ ID No: 116, причем указанный антиген дополнительно содержит другие последовательности, в частности, другие последовательности из человеческого CD127, которые раскрыты выше, или не содержащий их, можно применять в качестве иммуногена. Гибридому получали посредством слияния мононуклеарных клеток селезенки с клетками линии LOU, линии несекретирующих и устойчивых к азагуанину Т-клеток крысиной иммуноцитомы IR983F, в соответствии с ранее описанной процедурой (Chassoux et al., 1988). Гибридому вначале подвергали скринингу по признаку способности секретируемых моноклональных антител связываться с рекомбинантной молекулой CD127 (химера CD127-Fc; 10975-H03H, Sino Biological, Пекин, Китай). Гибридомы затем подвергали скринингу в отношении способности моноклональных антител из нее к связыванию с CD127, экспрессируемым человеческими Т-клетками и в отношении способности к ингибированию индукции фосфорилирования STAT-5, индуцируемого IL-7 в человеческих лейкоцитах, что проиллюстрировано на фиг. 1, и в отношении их способности не повышать созревание дендритных клеток, индуцируемое TSLP.
В соответствии с конкретным вариантом осуществления настоящего изобретения гуманизированное антитело согласно настоящему изобретению получают из антитела, обозначенного N13B2, посредством мутации одного или нескольких из CDR участков в его вариабельной тяжелой цепи (VH) и/или в вариабельной легкой цепи (VL), в частности, антитело сохраняет по меньшей мере один или два исходных CDR участка из числа CDR3, CDR2 и CDR1 участков в любом из VH и/или VL, причем указанное модифицированное антитело имеет менее чем 10% мутированных аминокислотных остатков, предпочтительно, один мутированный аминокислотный остаток или не имеет мутированных аминокислотных остатков в рассматриваемых по отдельности CDR участках в сравнении с исходным CDR1, CDR2 или CDR3 участком, причем указанные исходные CDR участки представляют собой:
i. VHCDR1, имеющий аминокислотную последовательность SEQ ID No 10;
ii. VHCDR2, имеющий аминокислотную последовательность SEQ ID No 12;
iii. VHCDR3, имеющий аминокислотную последовательность SEQ ID No 14;
iv. VLCDR1, имеющий аминокислотную последовательность SEQ ID No: 16;
v. VLCDR2, имеющий аминокислотную последовательность SEQ ID No: 18;
vi. VLCDR3, имеющий аминокислотную последовательность SEQ ID No: 20.
Соответственно, VHCDR3 может иметь аминокислотную последовательность SEQ ID No: 48; VLCDR1 может иметь аминокислотную последовательность SEQ ID No: 50; VLCDR2 может иметь аминокислотную последовательность SEQ ID No: 52.
В соответствии с конкретным вариантом осуществления антигенсвязывающий фрагмент согласно настоящему изобретению представляет собой антигенсвязывающий фрагмент антитела N13B2, который модифицирован, как описано в предыдущих абзацах, причем указанный модифицированный антигенсвязывающий фрагмент имеет менее чем 10% мутированных аминокислотных остатков в сравнении с исходным антигенсвязывающим фрагментом.
С учетом идей, представленных настоящим изобретением, для экспрессии антител в соответствии с настоящим изобретением специалист в данной области техники будет способен получить гибридому или применить альтернативные технологии, такие как экспрессионные библиотеки и экспрессионные системы, с последующим отбором антител, имеющих структуру таких антител, секретируемых гибридомой, и имеющие их свойства, в частности, их свойствами связывания и нейтрализации. Библиотеки кДНК можно соответствующим образом получить из РНК, экспрессируемой в гибридоме в соответствии с настоящим изобретением, и соответствующие последовательности можно подвергнуть отбору и осуществлять их экспрессию. В качестве альтернативы, кДНК, кодирующую антитела в соответствии с настоящим изобретением или их фрагменты, получают посредством синтеза.
«Клетки гибридомы» в соответствии с настоящим изобретением представляют собой клетки, образованные в результате слияния антителопродуцирующих клеток (В-лимфоцитов) из животного, которое ранее иммунизировали выбранным иммуногеном, и партнера по слиянию, который представляет собой клетки миеломы, обеспечивающие возможность иммортализации полученной в результате слияния клетки. Клетки миеломы и антителопродуцирующие клетки (В-клетки, такие как спленоциты) могут иметь одинаковое происхождение и представляют собой эукариотические клетки, в частности, клетки млекопитающего из одного и того же животного. В качестве альтернативы, они могут иметь разное происхождение, таким образом приводя к образованию гетерогибридомы. Клетки миеломы, какие как клетки линии LOU, линии несекретирующих и устойчивых к азагуанину Т-клеток крысиной иммуноцитомы IR983F, выбирают из числа клеток, которые неспособны продуцировать иммуноглобулины, для того, чтобы обеспечить возможность секреции гибридомой только моноклональных антител с желаемой специфичностью. Вместо крысиной иммуноцитомы можно применять другие клетки, подходящие для стимуляции ADCC, такие как описанные на следующих страницах для получения антител посредством экспрессии в рекомбинантных клетках. Такие клетки преимущественно представляют собой клетки, которые характеризуются низкой способностью к фукозилированию, или у которых отсутствует способность к фукозилированию.
Получение гибридомы, подходящей для осуществления настоящего изобретения, выполняют в соответствии с традиционными методиками. В разделе Примеры в настоящей заявке подробно описаны варианты осуществления, конкретные раскрытые признаки которых можно адаптировать к другим клеткам, используемым в качестве партнеров по слиянию.
Антигенсвязывающие фрагменты антитела можно получить, исходя из антитела, в особенности, при использовании ферментативного расщепления в соответствии с хорошо известными методиками, в том числе расщепления папаином или пепсином, или с помощью любой подходящей методики расщепления. В качестве альтернативы, они могут экспрессироваться в клетках-хозяевах, модифицированных посредством рекомбинации с использованием последовательностей нуклеиновой кислоты, кодирующих аминокислотную последовательность указанных фрагментов, или их можно синтезировать, в особенности, химически синтезировать. Соответственно, антитела в соответствии с настоящим изобретением, в том числе модифицированные антитела и антигенсвязывающие фрагменты антител, также можно получить с помощью классических методик генной инженерии, таких как описанные Sambrook et al. (Deininger, 1990) и обновленные версии). Настоящее изобретение, соответственно, относится к вариантам полипептидов VH и VL, которые включают или не включают в себя сигнальный пептид. Сигнальный пептид может быть необходим в ходе получения полипептидов в клетках.
Рассчитывая на применение антител в соответствии с настоящим изобретением или их функциональных фрагментов для введения пациенту-человеку, может быть выгодным получение гуманизированных моноклональных антител, или химерных моноклональных антител, и/или деиммунизированных антител из антител в соответствии с настоящим изобретением, которые будут представлять собой антитела животного, не относящегося к приматам, такие как иллюстрируемые в разделе Примеры, в особенности, для снижения иммунной реакции в отношении указанных антител у получающего их хозяина или пациента. Функциональные фрагменты этих вариантов антител можно получить также, как и гуманизированные, химерные или деиммунизированные варианты.
Антитело или его антигенсвязывающий фрагмент, которые представляют собой гуманизированное антитело, также можно получить посредством замены аминокислотного остатка(остатков), присутствующего(присутствующих) в константном участке(участках) вариабельных цепей (VH и/или VL) антитела в соответствии с настоящим изобретением, которое не является человеческим антителом, на человеческий аминокислотный остаток(остатки) с соответствующим расположением в человеческих антителах в соответствии со стандартным определением и нумерацией, причем уровень замены составляет от 1% до 20%, в частности, от 1% до 18% остатков в указанных каркасных участках. Указанные константные участки включают в себя таковые из каркасных участков (FwR), определенных в четырехцепочечных антителах, идентифицированных, в частности, в соответствии с нумерацией по Kabat.
Конкретные примеры модифицированных антител в соответствии с настоящим изобретением охватывают химерные антитела, гуманизированные антитела и/или деиммунизированные антитела.
Конкретное модифицированное антитело имеет модифицированные аминокислотные остатки в CDR участках, причем указанная модификация приводит в результате к деиммунизации за счет потери Т-клеточных эпитопов в вариабельном домене антитела, не являющегося человеческим. Деиммунизацию можно провести после определения Т-клеточных эпитопов в вариабельном домене антитела, в особенности, посредством in silico прогнозирования, с последующим введением точечной мутации в последовательность вариабельных цепей антитела, которая ликвидирует функциональные Т-клеточные эпитопы. В соответствии с предпочтительным вариантом осуществления настоящего изобретения модификация CDR участка(участков), в особенности, CDR3 участка ограничивается степенью, необходимой для деиммунизации с расчетом на введение в человеческий организм, например, для снижения аффинности связывания Т-клеточных рецепторов в отношении комплексов HLA-класса II/пептид. В соответствии с конкретным вариантом осуществления CDR3 участок(участки) VH и/или VL не является(не являются) модифицированным(модифицированными). В соответствии с еще одним вариантом осуществления FR участки и/или СН участки также являются модифицированными, в особенности, гуманизированными.
Антитела в рамках настоящего изобретения охватывают, соответственно, антитело, характеризующееся определенными выше признаками, которое представляет собой гуманизированное антитело, в особенности, антитело, полученное посредством замены аминокислотного остатка(остатков), присутствующего(присутствующих) в каркасном участке(участках) антитела в соответствии с настоящим изобретением, на человеческий аминокислотный остаток(остатки) с соответствующим расположением в человеческих антителах в соответствии со стандартным определением и нумерацией. Уровень замены аминокислотных остатков в каркасных участках и/или в CDR для гуманизации, включая деиммунизацию, составляет от 1% до 20% в частности, от 1% до 18% остатков в указанных каркасных участках и/или CDR участках. Как упомянуто выше, мишенью гуманизации преимущественно являются каркасные участки исходных антитела. В некоторых случаях гуманизация, в качестве альтернативы или в дополнение, может затрагивать CDR участок(участки), в особенности, CDR1 и/или CDR2 участок(участки), и более конкретно называется деиммунизацией. В соответствии с конкретными вариантами осуществления в каждом CDR участке модифицируют не более чем одну аминокислоту. Примеры гуманизированных и/или деиммунизированных антител, происходящих из крысиного антитела N13B2, раскрыты в данном документе.
Гуманизацию, следовательно, можно осуществлять, рассматривая человеческие каркасные области легкой цепи или тяжелой цепи зародышевой линии, которые проявляют наиболее высокую идентичность последовательности с последовательностью антитела или фрагмента, не являющихся человеческими, и выбирая аминокислотные остатки, в особенности, остатки, проявляющиеся на поверхности в антителе, подлежащие замене в указанных антителе или его фрагменте, не являющихся человеческими, для того, чтобы обеспечить соответствие с соответствующим человеческим остатком(остатками). В соответствии с конкретным вариантом осуществления некоторые или все FRL и/или некоторые или все FRH участки являются полностью человеческими, т.е. являются характерными для человеческих каркасных последовательностей. В соответствии с другим вариантом осуществления замененными являются выбранные остатки в некоторых или всех FR участках.
Способы гуманизации антител также хорошо известны в уровне техники и описаны, например, Routledege et al. (Edward G. Routledge, 1993). Эти способы также можно применять к антигенсвязывающим фрагментам, таким как scFv. В качестве примера, способ, известный как «рекомбинация поверхностных остатков», заключается в замене ряда поверхностных остатков в каркасных участках вариабельного участка антитела, не являющегося человеческим, на ряд человеческих поверхностных остатков, в то время как способ, известный как CDR-прививка, состоит из переноса CDR из антитела, не являющегося человеческим, в каркасные участки человеческого антитела. CDR-прививку обычно дополняют оптимизацией каркасных участков, заключающейся в замене некоторых остатков в человеческих каркасных участках с целью оптимизации аффинности связывания. Стадию оптимизации каркасных участков недавно упростили путем применения комбинаторных библиотек (Rosok et al., 1996) (Baca et al., 1997).
Настоящее изобретение относится, в частности, к гуманизированным антителам, полученным с помощью CDR-прививки из крысиного антитела N13B2. Из базы данных выбирали человеческие последовательности VH и VL, имеющие последовательности с сильной гомологией с последовательностями VH и VL, соответственно, из крысиного N13B2. Последовательности CDR из N13B2 прививали на эти человеческие последовательности. Некоторые остатки за пределами последовательностей CDR могут оказывать значительное воздействие на распознавание антигена или аффинность к нему, в частности, остатки, находящиеся в непосредственной близости от CDR, и остатки, известные как остатки зоны Vernier. Как подробно описано ниже, а также в разделе Примеры, в частности, в примере 12 исследовали несколько вариантов гуманизированных антител: наиболее консервативные, в которых сохранялись все крысиные последовательности для CDR и вышеупомянутых важных в плане структуры остатков, варианты, в которых человеческие последовательности подвергали отбору в отношении важных в плане структуры остатков, и вариант, наиболее близкий к человеческим последовательностям, в котором, в дополнение к важным в плане структуры остаткам за пределами CDR, несколько остатков внутри CDR модифицировали из исходной крысиной последовательности, в частности, с целью предотвращения посттрансляционных модификаций, таких как окисление или дезамидирование.
В другой современной стратегии, доступной для гуманизации антитела, сохраняют только исходные, не являющиеся человеческими, последовательности CDR3 легкой и тяжелой цепей, тогда как остальную последовательность выбирают из библиотек человеческих V-генов, ранее не подвергавшихся воздействию (Rader et al., 1998).
Химерные, гуманизированные и/или деиммунизированные антитела в соответствии с настоящим изобретением могут относиться к любому классу иммуноглобулинов, как и немодифицированные антитела. Предпочтительно, они относятся к подклассу класса IgG, как например, IgG1, IgG2, IgG3 или IgG4.
Способы получения рекомбинантных антигенсвязывающих фрагментов или химерных антител посредством объединения вариабельных участков антитела с использованием подходящих линкеров или с использованием константных участков из другого антитела известны в уровне техники.
Как указано, антитела в соответствии с настоящим изобретением представляют собой моноклональные антитела, это означает, что строение этих антител является однородным, в особенности, идентичным, в плане специфичности связывания с антигеном и, соответственно, в плане строения вариабельного участка. Следовательно, антитела можно классифицировать как моноклональные, даже если их получают с помощью методик, альтернативных методикам с использованием гибридомы.
В соответствии с другим вариантом осуществления настоящее изобретение также относится к химерной молекуле, которая содержит антитело в соответствии с определением, представленным в данном документе, или его антигенсвязывающий фрагмент, причем указанное антитело или его функциональный фрагмент связаны с функционально отличающейся молекулой. Химерная молекула в соответствии с настоящим изобретением может представлять собой либо слитый химерный белок, либо конъюгат, полученный в результате любого подходящего вида прикрепления, в том числе ковалентного прикрепления, прививки, химического связывания с химической или биологической группой или с молекулой, такой как полимер PEG или другая защитная группа или молекула, подходящая для защиты от расщепления протеазами in vivo, для улучшения стабильности и/или периода полувыведения антитела или функционального фрагмента. С использованием аналогичных методик, в особенности, посредством химического присоединения или прививки, можно получить химерную молекулу с биологически активной молекулой, причем указанная активная молекула выбрана, например, из числа токсинов, в частности, экзотоксина A Pseudomonas (Risberg et al., 2011), А-цепи растительного токсина рицина (van Oosterhout et al., 2001) или токсина сапорина (Flavell et al., 2006), в особенности, терапевтического активного ингредиента, вектора (в том числе, в особенности, вектора для белка), подходящего для целенаправленного воздействия антитела или функционального фрагмента на конкретные клетки или ткани человеческого организма, или она может быть связана с меткой или с линкером, в особенности, в случае, когда используются фрагменты антитела.
Пегилирование антител или их функциональных фрагментов является вариантом осуществления, представляющим особенный интерес, поскольку оно улучшает условия доставки активного вещества к хозяину, в особенности, для терапевтического применения. Пегилирование может быть сайт-специфичным для предотвращения созданию помех сайтам распознавания в антителах или функциональных фрагментах, и его можно осуществлять с использованием PEG с высоким молекулярным весом. Пегилирование можно осуществлять по свободным цистеиновым остаткам, присутствующим в последовательности антитела или функционального фрагмента, или по добавленным свободным цистеиновым остаткам в аминокислотной последовательности антитела или функционального фрагмента.
Настоящее изобретение также относится к композиции, содержащей антитела или их функциональные фрагменты, как определено в данном документе, причем антитела или их функциональные фрагменты представляют собой однородную популяцию антител или их функциональных фрагментов или представляют собой моноклональные антитела или их функциональные фрагменты.
В некоторых случаях возможно применение композиции из продуктов для получения желаемого эффекта в случае, когда каждый из продуктов в композиции создает по меньшей мере один желаемый эффект. В данном случае, например, представляется возможным объединение молекул, характеризующихся ингибирующим эффектом в отношении взаимодействия IL-7 - IL-7R, и молекул, характеризующихся цитотоксическим эффектом в отношении CD127-положительных клеток. Такие комбинации включены в настоящее изобретение. Важно, что в соответствии с настоящим изобретением композиция из продуктов не должна проявлять синергизм с TSLP в отношении созревания дендритных клеток. Обычно подразумевается объединение в комбинацию продуктов, ни один из которых отдельно не проявляет синергию с TSLP в отношении созревания дендритных клеток.
В соответствии с конкретным вариантом осуществления настоящее изобретение относится к композиции или совокупности соединений, содержащих антитела, фрагменты или химерные молекулы, которые описаны в данном документе, причем указанная композиция содержит (i) популяцию антител или их антигенсвязывающих фрагментов или химерных молекул, характеризующихся цитотоксической активностью в отношении CD127-положительных клеток, в особенности CD127+-Т-клеток, и (ii) популяцию антитела или их функциональных фрагментов или химерных молекул, характеризующихся антагонистическими свойствами в отношении человеческого IL-7, эти популяции антител либо объединяют в смеси, либо разделяют и, в этом последнем варианте, составляют для комбинированного или последовательного введения. Антитела, и/или функциональные фрагменты, и/или химерные молекулы не проявляют синергизм с TSLP в отношении созревания дендритных клеток.
Определения, представленные в данном документе, в особенности, по отношению к антителам в соответствии с настоящим изобретением, аналогично, применимы к их антигенсвязывающим фрагментам, за исключением тех случаев, когда очевидно, что с технической точки зрения это неуместно. Эти определения также применимы к макромолекулам (в частности, химерным антителам или химерным молекулам) или композициям, содержащим эти антитела или их антигенсвязывающие фрагменты или полученным из этих антител, которые раскрыты в настоящей заявке. Дополнительно определяется, что с точки зрения идеи или создания антигенсвязывающие фрагменты антител в соответствии с настоящим изобретением получены из антител, но их можно получать посредством различных методик, к которым прибегают для получения продуктов, не обязательно представляющих собой антитела.
Настоящее изобретение также относится к молекуле нуклеиновой кислоты, кодирующей макромолекулу в соответствии с любым из определений, представленных в данном документе. В соответствии с конкретными вариантами осуществления нуклеиновая кислота согласно настоящему изобретению кодирует аминокислоту, выбранную из группы, состоящей из SEQ ID No: 2; SEQ ID No: 4; SEQ ID No: 6; SEQ ID No: 8; SEQ ID No: 10; SEQ ID No: 12; SEQ ID No: 14; SEQ ID No: 16; SEQ ID No: 18; SEQ ID No: 20; SEQ ID No: 22, SEQ ID No: 24, SEQ ID No: 36, SEQ ID No: 38, SEQ ID No: 40, SEQ ID No: 42, SEQ ID No: 44, SEQ ID No: 46, SEQ ID No: 48, SEQ ID No: 50, SEQ ID No: 52, SEQ ID No: 54, SEQ ID No: 56, SEQ ID No: 110, SEQ ID No: 111, SEQ ID No: 86, SEQ ID No: 115, SEQ ID No: 116 и SEQ ID No: 117. В соответствии с конкретными вариантами осуществления нуклеиновая кислота согласно настоящему изобретению содержит или состоит из последовательности SEQ ID No: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53 или 55.
Такая нуклеиновая кислота, подходящая для получения макромолекул в соответствии с настоящим изобретением, выбрана, в частности, из группы следующих:
i. полинуклеотид, кодирующий VH-участок и имеющий последовательность SEQ ID No 1, или SEQ ID No: 5, или SEQ ID No: 54, или вариабельный участок VH-участка и имеющий последовательность SEQ ID No: 21, или SEQ ID No: 35, или SEQ ID No: 37, или SEQ ID No: 39;
ii. полинуклеотид, кодирующий VL-участок, имеющий последовательность SEQ ID No 3, или SEQ ID No: 7, или SEQ ID No: 56, или вариабельный участок VL-участка и имеющий последовательность SEQ ID No: 23, или SEQ ID No: 41, или SEQ ID No: 43, или SEQ ID No: 45;
iii. полинуклеотид, кодирующий VHCDR1 участок, имеющий последовательность SEQ ID No: 9,
iv. полинуклеотид, кодирующий VHCDR2 участок, имеющий последовательность SEQ ID No: 11,
v. полинуклеотид, кодирующий VHCDR3 участок, имеющий последовательность SEQ ID No: 13 или SEQ ID No: 47,
vi. полинуклеотид, кодирующий VLCDR1 участок, имеющий последовательность SEQ ID No 15 или SEQ ID No: 49,
vii. полинуклеотид, кодирующий VLCDR2 участок, имеющий последовательность SEQ ID No 17 или SEQ ID No: 51,
viii. полинуклеотид, кодирующий VLCDR3 участок, имеющий последовательность SEQ ID No 19.
Настоящее изобретение также относится к полинуклеотиду, имеющему модифицированные нуклеотиды по отношению к последовательности SEQ ID No 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53 или 55, и который:
(a) кодирует полипептид, имеющий аминокислотную последовательность, соответственно, SEQ ID No 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54 или 56, и/или
(b) характеризуется по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 98% или по меньшей мере 99% идентичностью по всей своей длине с одним из полинуклеотидов, имеющих последовательность, соответственно, SEQ ID No 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53 или 55, и/или
(c) представляет собой фрагмент полинуклеотида, имеющего последовательность из последовательности SEQ ID No: 1, 3, 5, 7, 21, 23, 35, 37, 39, 41, 43, 45, 53 или 55, и кодирует полипептид, содержащий антигенсвязывающий фрагмент или состоящий из него.
Полинуклеотиды в соответствии с настоящим изобретением также могут представлять собой оптимизированные последовательности, в особенности, для экспрессии в клетках-хозяевах. Методики оптимизации в этой области представляют собой традиционные методики.
Фрагменты полинуклеотида в соответствии с настоящим изобретением преимущественно имеют последовательность по меньшей мере из 9 нуклеотидов, в частности, по меньшей мере из 18 нуклеотидов, и являются более короткими, чем последовательность, из которой они происходят, в особенности, более короткими, чем проиллюстрированные полноразмерные последовательности VH или VL, соответственно.
В соответствии с конкретным вариантом осуществления полинуклеотиды согласно настоящему изобретению преимущественно могут содержать, помимо последовательности, кодирующей макромолекулу в соответствии с настоящим изобретением, выше последовательности, кодирующей цепи антитела, последовательность, кодирующую сигнальный пептид, обеспечивающий возможность секреции указанного белка при экспрессии в продуцирующей клетке. Они также могут содержать одну или несколько последовательностей, кодирующих один или несколько маркерных пептидов для выявления и/или облегчения очистки указанного белка.
Настоящее изобретение также относится к вектору для клонирования и/или для экспрессии полинуклеотида, раскрытого в данном документе. В соответствии с конкретным вариантом осуществления вектор согласно настоящему изобретению представляет собой плазмиду, подходящую для клонирования и/или экспрессии в клетках млекопитающего, которая содержит регуляторные последовательности для транскрипции и экспрессии.
Настоящее изобретение дополнительно относится к клетками или клеточным линиям, в которую был встроен посредством рекомбинации полинуклеотид в соответствии с настоящим изобретением, в особенности, клетки или клеточные линии млекопитающих или птиц. Например, клетки яичника китайского хомячка, генетически модифицированные для снижения общего фукозилирования. В действительности, антитела, у которых отсутствует фукозилирование коровой части, проявляют значительно усиленную антителозависимую клеточно-опосредованную цитотоксичность (ADCC) (von Horsten et al., 2010). Другим примером является клеточная линия ЕВ66, которая по своей природе характеризуется свойствами слабого фукозилирования (Olivier et al., 2010).
Таким образом, настоящее изобретение также относится к способу получения антитела или его антигенсвязывающего фрагмента, который предусматривает:
(a) получение гибридомы после иммунизации животного, в особенности, млекопитающего человеческой альфа-цепью человеческого рецептора IL-7, предпочтительно ее антигеном, содержащим последовательности человеческого CD127 с последовательностями SEQ ID No: 115 (и/или SEQ ID No: 110), и/или SEQ ID No: 117 (и/или SEQ ID No: 111), и/или SEQ ID No: 116 (и/или SEQ ID No: 86), причем указанный антиген содержит другие последовательности человеческого CD127 или не содержит их, как раскрыто выше, и в случае, когда это необходимо, бустер-иммунизации указанного животного тем же иммуногеном, выделения клеток селезенки или лимфатических узлов из животного, отвечающего на иммунизацию, и слияния указанных клеток с клетками миеломы с выделением моноклональных антител, и/или
(b) экспрессию полинуклеотидов, кодирующих такие антитела, как например, полинуклеотидов, раскрытых в данном документе, причем их нуклеотидная последовательность присутствует в рекомбинантной форме в клетках в условиях, обеспечивающих возможность выделения антител, и
(c) выделение антител, распознающих эпитоп, который определен в данном документе, в частности, содержащий последовательности из сайта 2b в CD127 и, в частности, содержащий такие последовательности, а также дополнительно последовательности из домена D1 в CD127, в частности, антител, характеризующихся желаемой аффинностью связывания в отношении альфа-цепи человеческого рецептора IL-7.
В соответствии с конкретным вариантом осуществления настоящего изобретения антитела или их фрагмент получают в клетках, у которых проявляются свойства слабого фукозилирования, такие как ЕВ66 клетки птиц.
Настоящее изобретение также относится к способу отбора антител, предусматривающему стадии получения, возможно, посредством одного из способов, описанных в данном документе, антител или их фрагментов, которые специфично связываются с CD127, в частности, с его антигеном, который раскрыт выше, и осуществления отбора из числа этих антител таковых, которые не повышают индуцируемое TSLP созревание иммунных клеток, в частности, дендритных клеток, которые не индуцируют интернализацию CD127, и/или которые ингибируют индуцируемую IL-7 интернализацию CD127, и/или которые ингибируют in vitro и/или in vivo экспрессию α4-, β7- и/или α4/β7-интегринов. Отбор можно осуществлять с использованием любой из процедур, описанных в разделе Примеры, для анализа в отношении повышения или снижения индуцируемой TSLP экспрессии маркеров клеточной поверхности CD40 и/или CD80, или для анализа эффектов в отношении интернализации CD127, или для анализа эффектов в отношении экспрессии α4-, β7- и α4/β7-интегринов. Такие анализы можно подходящим образом осуществлять, например, в 96-луночных планшетах для обеспечения возможности быстрого и эффективного скрининга большого количества антител-кандидатов и считывание результатов можно осуществлять посредством классического иммуноокрашивания и проточно-цитометрического анализа. Таким образом, настоящее изобретение относится к способу отбора антител, их антигенсвязывающих фрагментов или других макромолекул, который предусматривает или состоит из по меньшей мере одной из следующих стадий:
a. исследование (например, как описано в примере 1, примере 2, примере 6 и/или примере 7) макромолекулы со связывающей способностью макромолекулы в отношении CD127, в частности, в отношении его антигена, который раскрыт в данном документе;
b. исследование (например, как описано на фиг. 16 и/или в примере 5) интернализации CD127 в экспрессирующих CD127 клетках, индуцируемой присутствием макромолекулы;
c. исследование (например, как описано на фиг. 16 и/или в примере 5) ингибирования макромолекулой индуцируемой IL-7 интернализации CD127 в экспрессирующих CD127 клетках;
d. исследование (например, как на фиг. 5, фиг. 6 и/или в примере 9) повышения созревания DC, индуцируемое TSLP в присутствии макромолекулы;
и необязательно предусматривающий по меньшей мере одну из следующих стадий:
e. исследование (например, как на фиг. 1, фиг. 2 и/или в примере 3) ингибирования макромолекулой индуцируемой IL-7 передачи сигнала, в частности, фосфорилирования STAT5;
f. исследование (например, как в примере 9, на фиг. 5 и/или на фиг. 6) ингибирования макромолекулой индуцируемой TSLP продукции TARC;
g. исследование (например, как в примере 16, на фиг. 19 и/или на фиг. 20) ингибирования макромолекулой экспрессии α4-, β7- и/или α4/β7-интегринов, в частности, экспрессии на клеточной поверхности на Т-лимфоцитах;
h. исследование (например, как в примере 21, на фиг. 28) нарушения антителом связывания CD127 с γc-цепью, в частности, в присутствии IL-7.
За каждой из этих стадий исследования следует отбор одной или нескольких макромолекул с желаемыми функциональными признаками, которые раскрыты в данном документе.
Как упоминается выше, в случае, если желательно, чтобы антитело распознавало эпитоп, содержащий последовательности, которые не являются смежными в последовательности CD127, возможно последовательно анализировать распознавание фрагментов эпитопа (или связывание с ними), состоящего (или, по сути, состоящего) из одной смежной последовательности CD127. Например, если желательным является получение антитела, распознающего эпитоп, содержащий последовательности SEQ ID No: 115, SEQ ID No: 116 и SEQ ID No: 117, возможно, во-первых, провести отбор антител, распознающих эпитоп, состоящий, по сути, из SEQ ID No: 116, а затем, во-вторых, отобрать из числа отобранных в первом отборе антител антитела, распознающие эпитоп, состоящий, по сути, из SEQ ID No: 115, а затем отобрать из числа отобранных во втором отборе антител антитела, распознающие эпитоп, состоящий, по сути, из SEQ ID No: 117. Очевидно, что порядок проведения отбора можно модифицировать по отношению к данному порядку, приведенному исключительно в качестве примера.
Другой целью настоящего изобретения является фармацевтическая композиция, содержащая макромолекулу в соответствии с настоящим изобретением с фармацевтической средой, причем указанная фармацевтическая композиция необязательно дополнительно содержит отличающийся активный ингредиент.
Настоящее изобретение также относится к композиции, содержащей в качестве активного ингредиента макромолекулу в соответствии с настоящим изобретением или фармацевтическую композицию, которая определена выше, в составе, подходящем для контроля выживания или размножения положительных по человеческому CD127 клеток, в частности, положительных по человеческому CD127 эффекторных клеток, в особенности, выживания или размножения CD127+ Т-клеток памяти, в особенности, Т-клеток памяти, которые являются и CD127+-, и CD8+-, или которые являются и CD127+-, и CD4+-клеток, при введении пациенту-человеку. В соответствии с конкретным вариантом осуществления композиция, содержащая макромолекулу в соответствии с настоящим изобретением в качестве активного ингредиента, присутствует в составе, подходящем для контроля дифференцировки и/или созревания дендритных клеток при введении пациенту.
Композиция в соответствии с настоящим изобретением может дополнительно содержать дополнительное соединение, характеризующееся терапевтическим иммуномодулирующим эффектом, в частности, в отношении клеток, вовлеченных в аллергию или аутоиммунную реакцию. С целью иллюстрации, представляющие интерес иллюстративные иммуномодуляторы представляют собой другие моноклональные антитела, целенаправленно воздействующие на Т-клетки, такие как антитела к CD3, антитела к ICOS или антитела к CD28, или рекомбинантные белки или антитела, целенаправленно воздействующие на акцессорные клетки, такие как антитела к CTLA4Ig или антитела к CD40.
Настоящее изобретение также относится к антителу или его антигенсвязывающему фрагменту или химерной молекуле, которые определены или проиллюстрированы в данном документе, для применения в качестве активного ингредиента в комбинации или в составе схемы дополнительной терапии у пациента, нуждающегося в этом. Также предполагается применение макромолекулы, нуклеиновой кислоты, клетки или клеточной линии в соответствии с настоящим изобретением в качестве терапевтически активного ингредиента в комбинации или в составе схемы дополнительной терапии у пациента, нуждающегося в этом.
Макромолекула в соответствии с настоящим изобретением, нуклеиновая кислота, вектор, клетка, клеточная линия, фармацевтическая композиция или композиция, которые определены в данном документе, предполагаются, в частности, для применения у пациента-человека для лечения патологических состояний, на которые оказывают влияния иммунные реакции, в особенности, реакции с участием Т-клеток памяти. Соответственно, авторы настоящего изобретения предполагают, что антитело или его антигенсвязывающий фрагмент, химерная молекула в соответствии с настоящим изобретением, фармацевтическая композиция или композиция, которые определены в данном документе, можно применять для лечения аутоиммунных или аллергических заболеваний, в частности, кожных аллергических расстройств, кишечных расстройств, или при отторжении трансплантата, или для лечения лейкоза, такого как острый лимфобластный лейкоз (например, T-ALL), или лимфомы, такой как лимфома Ходжкина, или лечения злокачественного заболевания, такого как злокачественная опухоль молочной железы, ассоциированная с CD127+-клетками, злокачественная опухоль почки, злокачественная опухоль мочевого пузыря, злокачественная опухоль легкого, злокачественная опухоль поджелудочной железы, или для лечения кожной Т-клеточной лимфомы, такой как лимфома при синдроме Сезари, или для лечения острого лимфобластоидного лейкоза с мутацией с приобретением функции в рамках пути с участием IL-7-R/TSLP.
В соответствии с различными вариантами осуществления настоящее изобретение относится к применению макромолекул, которые определены в данном документе, с целью сокращения количества CD127-положительных клеток при сохранении CD127-отрицательных клеток.
В соответствии с вариантами осуществления настоящее изобретение относится к применению макромолекул, которые определены в данном документе, с целью предотвращения дифференцировки, и/или размножения, и/или созревания CD127-положительных клеток, в частности, дифференцировки, размножения или созревания, индуцируемых IL-7 и/или TSLP, при этом оказывая незначительный эффект или не оказывая эффект в отношении CD127-отрицательных клеток.
В соответствии с конкретным вариантом осуществления настоящее изобретение относится к применению макромолекул, определенных в данном документе, с целью ликвидации/нейтрализации наивных Т-клеток и Т-клеток памяти путем создания препятствий индуцируемой IL-7 передаче сигнала при сохранении Treg клеток.
В соответствии с конкретным вариантом осуществления настоящее изобретение также относится к применению макромолекул, определенных в данном документе, с целью сокращения субпопуляций лимфоцитов или других клеточных популяций, экспрессирующих CD127 (в том числе нормальных или патологических Т- и В-лимфоцитов, NK-клеток, дендритных клеток и других типов клеток, в том числе эпителиальных клеток), в результате цитотоксического действия антител, возможно, но не исключительно, посредством ADCC (антителозависимой клеточной цитотоксичности) и, необязательно, посредством CDC (комплементзависимой цитотоксичности).
В соответствии с вышеизложенными вариантами осуществления предполагаемые применения также применимы к нуклеиновым кислотам, векторам, клеткам, клеточным линиям и композициям в соответствии с настоящим изобретением.
Под термином «лечение» или «терапевтическое лечение» подразумевается, что осуществляемые стадии введения приводят в результате к улучшению клинического состояния животного или пациента-человека, нуждающегося в этом, который страдает от нарушения(нарушений), связанных с путем IL-7, т.е. включающих активацию или пролиферацию CD127-положительных клеток. Такое лечение имеет своей целью улучшение клинического статуса животного или пациента-человека посредством устранения или ослабления симптомов, ассоциированных с нарушением (нарушениями), связанными с путем с участием IL-7, т.е. включающими активацию или пролиферацию CD127-положительных клеток. В соответствии с предпочтительным вариантом осуществления лечение согласно настоящему изобретению обеспечивает возможность восстановления здоровья. В соответствии с предпочтительным вариантом осуществления указанное лечение не оказывает нежелательных отрицательных эффектов, обусловленных повышенным созреванием иммунных клеток, в частности, дендритных клеток.
Настоящее изобретение включает в себя применение макромолекул в лечении патологических состояний, включающих изменение иммунной реакции у пациента-человека, приводящее к доминантному толерогенному состоянию или, напротив, к недостатку толерантности, в случае, когда будет необходим контроль уровня иммунной реакции, а также для разрушения злокачественных CD127-положительных клеток.
Настоящим изобретением предполагаются средства, подходящие для применения при патологиях, таких как патологии, вызываемые отторжением трансплантата, аутоиммунными заболеваниями, аллергическими заболеваниями, респираторными заболеваниями, хроническими вирусными инфекциями, лимфомой, лейкозом или другими злокачественными заболеваниями, в том числе заболевания, являющегося результатом солидных опухолей (например, злокачественная опухоль молочной железы), в случае, когда эти патологии ассоциированы с CD127-положительными клетками, а также с путем передачи сигнала с участием IL-7, и когда нужно избегать повышения созревания дендритных клеток.
В соответствии с конкретным вариантом осуществления настоящее изобретение относится к применению макромолекулы, нуклеиновой кислоты, клетки, клеточной линии или композиции в соответствии с настоящим изобретением у пациента-человека для лечения аутоиммунного заболевания или аллергического заболевания, или для лечения лейкоза, такого как острый лимфобластный лейкоз, или для лечения лимфомы, или для лечения злокачественного заболевания, или для лечения хронической вирусной инфекции, или для лечения воспалительных заболеваний, или для лечения респираторных заболеваний, или для лечения симптомов, связанных с трансплантацией.
В соответствии с конкретным вариантом осуществления настоящее изобретение относится к способу лечения, предусматривающему введение макромолекулы, нуклеиновой кислоты, клетки, клеточной линии или композиции в соответствии с настоящим изобретением у пациента-человека для лечения аутоиммунного заболевания или аллергического заболевания, или для лечения лейкоза, такого как острый лимфобластный лейкоз, или для лечения лимфомы, или для лечения злокачественного заболевания, или для лечения хронической вирусной инфекции, или для лечения воспалительных заболеваний, или для лечения респираторных заболеваний, или для лечения симптомов, связанных с трансплантацией.
Дополнительные признаки и свойства в соответствии с настоящим изобретением будут понятны из следующих примеров и описания фигур.
Краткое описание чертежей
Фиг. 1. Ингибирование передачи сигнала с участием IL-7R. Ингибирование индуцируемых IL-7 pSTAT5+ Т-лимфоцитов в зависимости от дозы моноклональных антител к человеческому IL-7Rα. N13B2 (квадрат), N13E5 (круг) и N13K12 (треугольник). pSTAT5 (%): доля (%) клеток, положительных в отношении фосфо-STAT5, которая измерена с помощью метода FACS. Дозозависимое ингибирование фосфорилирования STAT5 является подобным для трех клонов, причем все три ингибируют фосфорилирование эффективно в концентрации 50 нг/мл (примерно 50% ингибирование) и полностью в концентрации 100-500 нг/мл (>95% ингибирование).
Фиг. 2. Ингибирование передачи сигнала с участием IL-7R mAb N13B2. Оси соответствуют фиг. 1. (А) Ингибирование индуцируемых IL-7 pSTAT5+ Т-лимфоцитов в зависимости от дозы mAb N13B2 (квадраты) по сравнению с mAb MD707-3 (кружки), причем оба из них в формате антитела грызуна. (В) Тот же эксперимент, что и в (А), с химерными формами N13B2 в форме человеческого IgG1 (квадрат) и человеческого IgG4 (круг) в присутствии 0,1 (незакрашенные символы) или 5 нг/мл (закрашенные символы) рекомбинантного человеческого IL-7. N13B2 является более эффективным в ингибировании STAT5, чем MD707-13 (~50% ингибирование в концентрации 100 нг/мл для N13B2 по сравнению с 1000 нг/мл для MD707-13), тогда как у разных изотипов IgG N13B2 проявляется сравнимая эффективность ингибирования.
Фиг. 3. (А) Исследования связывания крысиного антитела N13B2 к CD127. Антитело N13B2 или MD707-1 впрыскивали на иммобилизированный антиген CD127 в разной концентрации. Отлич. отв.: отличие ответа. Время: время в секундах (общая длительность: 20 мин.). Холост.: холостая проба (без антитела). Кривые ассоциации и диссоциации анализировали с использованием модели «Бивалентный аналит» в программном обеспечении BIAeval 4. Результаты представлены в таблице 1 ниже.


Фиг. 4. Активность в отношении CD127 нового антитела N13B2 измеряли с помощью анализа методом ELISA с использованием рекомбинантного антигена hCD127. OD 450 нм: оптическая плотность при 450 нм. А. Активность связывания N13B2 (закрашенный круг) с CD127 сравнивали с предыдущим поколением антител (MD707-1 (незакрашенный ромб), 3 (незакрашенный треугольник) и 6 (закрашенный квадрат)). Оказывается, что N13B2 наиболее эффективно связывается в анализе. В. Сравнивали активность CD127 у разных форматов N13B2 (крыса, IgG1 (круг) или IgG4 (квадрат)). Не наблюдали значимого различия в активности связывания.
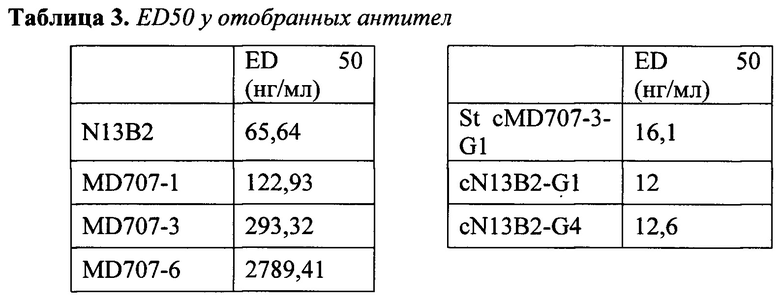
Фиг. 5. Индуцируемая TSLP продукция TARC (регулирующий активацию хемокин тимуса, CCL17) и экспрессия маркера клеточной поверхности CD80 миелоидными дендритными клетками. Отсутствует: без стимуляции. LPS: стимуляция липополисахаридом. TSLP: стимуляция TSLP. А) Количественное определение продукции TARC в супернатанте с помощью метода ELISA; и В) экспрессии CD80 на клеточной поверхности с помощью проточной цитометрии человеческих CD1C+-дендритных клеток крови, культивируемых в течение 24 часов только со средой, с 1 мкг/мл LPS или 15 нг/мл TSLP. Данные представляют собой среднее значение ± стандартная ошибка или средняя квадратичная ошибка (SEM) для концентрации из 3 независимых экспериментов.
Фиг. 6. Ингибирование индуцируемой TSLP продукции TARC антителами к человеческому й CD127. Количественное определение методом ELISA продукции TARC в супернатанте человеческих CD1C+-дендритных клеток крови, культивируемых в течение 24 часов с 15 нг/мл TSLP и разными концентрациями антител к человеческому CD127: антитело N13B2 (круг), MD707-6 (треугольник) и антитело к TSLP в качестве контроля (X). Данные являются репрезентативными для трех независимых доноров крови. N13B2 лишь очень умеренно ингибирует индукцию секреции TARC (~20% ингибирование в концентрации 6 мкг/мл), тогда как MD707-13 и антитело к TSLPR являются более эффективными ингибиторами (соотв., ~50% и ~70% ингибирование).
Фиг. 7. Эффект антител к CD127 в отношении индуцируемой TSLP экспрессии маркеров созревания дендритных клеток CD80 и CD40. Клетки активировали TSLP в концентрации 15 нг/мл в течение 24 часов. Антитела к CD127 N13B2, MD707-3 и MD707-6 добавляли к супернатанту в концентрации 6 мкг/мл. Экспрессию CD80 (А) и CD40 (В) на клеточной поверхности анализировали с помощью метода FACS. Данные являются репрезентативными для 3 независимых экспериментов и выражены в % от уровня экспрессии в контрольных клетках (среда = без антитела, с TSLP). Из анализируемых антител только N13B2 не повышает экспрессию CD40 и CD80 на клеточной поверхности у обработанных TSLP клеток.
Фиг. 8. Антителозависимая клеточная цитотоксичность (ADCC) химерного (IgG1 или IgG4) N13B2 антитела к человеческому CD127. Человеческие NK-клетки, используемые в качестве эффекторных (Е), инкубировали в течение 4 часов с линией клеток BAF/3, трансфицированных человеческим CD127, в качестве клеток-мишеней (соотношение клеток: 10 эффекторных на 1 мишень) и с разными концентрациями химерного N13B2 IgG1 (закрашенный квадрат), N13B-IgG4 (незакрашенный квадрат) или химерного MD707-3 (X). Процентное значение специфичной цитотоксичности определяли по высвобождению 51Cr.
Фиг. 9. Эффективность крысиных mAb N13B2 к CD127 в плане ослабления химически индуцируемого колита у гуманизированных иммунодефицитных мышей. Выживаемость (А) и изменение веса (В) отслеживали ежедневно со Дня 0, начала химической обработки 2,4,6-тринитробензолсульфоновой кислотой (TNBS), которая индуцирует тяжелое воспаление толстого кишечника при интраректальном введении, после инъекции PBS (сплошная линия/закрашенный треугольник) или антитело N13B2 к IL-7Rα (пунктирная линия, незакрашенный треугольник). На секции (В) каждая точка представляет данные среднего веса (+/- SEM); n=6 для группы Hu-TNBS + PBS и n=6 для группы TNBS + антитело к IL-7Rα. В обработанной группе выживаемость повышена, а потеря веса снижена.
Фиг. 10. Нуклеотидная и аминокислотная последовательность VH- и VL-цепей химеры N13B2_G1M. Fc-цепи напечатаны строчными буквами, три CDR в каждой последовательности подчеркнуты. Звездочкой (*) обозначен стоп-кодон в аминокислотной последовательности.
Фиг. 11. Нуклеотидная и аминокислотная последовательность химеры N13B2G4M. Fc-цепи напечатаны строчными буквами, три CDR в каждой последовательности подчеркнуты. Звездочкой (*) обозначено расположение стоп-кодона в аминокислотной последовательности.
Фиг. 12. Аминокислотная последовательность трех альтернативных человеческих Fc-цепей (IgG1, IgG2 и IgG4) и Fc-цепи крысиного антитела (IgG1) N13B2.
Фиг. 13. Анализ связывания с CD127 с помощью метода ELISA: нанесение в виде покрытия человеческого CD127-Fc и выявление антитела к человеческой каппа-цепи. Активность в отношении CD127 нового антитела N13B2 измеряли с помощью анализа методом ELISA с использованием рекомбинантного антигена hCD127. Сравнивали активность в отношении CD127 у разных форматов антитела N13B2 (антитело wt (X), h1 (закрашенный квадрат), h2 (незакрашенный круг) или h3 (закрашенный треугольник) гуманизированное антитело IgG4). OD: оптическая плотность.

Фиг. 14. Ингибирование P-STAT5 антителами к CD127. А. Ингибирование индуцируемого IL-7 P-STAT5 гуманизированными mAb N13B2 на Т-лимфоцитах (N13B2 h1 (черный квадрат), h2 (незакрашенный круг) и h3 (черный треугольник) в зависимости от дозы и в сравнении с крысиным антителом N13B2 wt (X) в присутствии 0,1 нг/мл рекомбинантного человеческого IL-7. В. Разные антитела к CD127 из предыдущих поколений антител сравнивали в отношении их способности к ингибированию IL-7-зависисмого P-STAT5: MD707 3 (круг), MD707 4 (треугольник) и MD707 13 (квадрат).

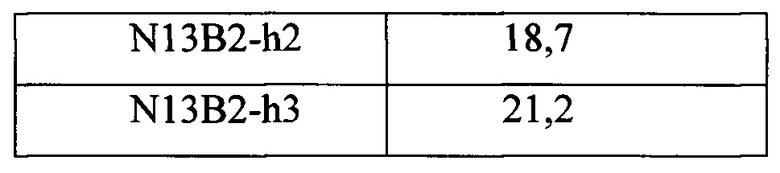
Фиг. 15. Анализ стабильности гуманизированных антител к CD127 в сравнении с крысиным антителом к CD127. Концентрации антител измеряли с помощью метода ELISA после 7 суток при 37°С (крысиное N13B2wt (+) или гуманизированное N13B2 h3 (квадрат)) и при -80°С (крысиное N13B2wt (X) или гуманизированное N13B2 h3 (треугольник)) и после четырех действий по замораживанию/размораживанию (ромбики).

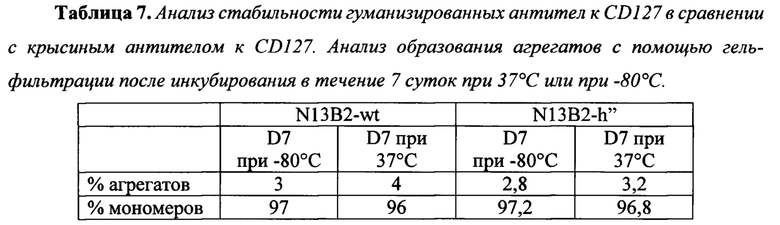
Фиг. 16. Анализы конкуренции и интернализации с помощью циптометрии. Человеческие мононуклеарные клетки периферической крови инкубировали с несколькими mAb к CD127 в течение 30 мин. либо при 4°С (заштрихованный столбец) или 37°С (черный столбец) или при 37°С в течение 30 мин. без IL-7, а затем в течение 15 мин. с 5 нг/мл рекомбинантного человеческого IL-7 (серый столбец): (А) 10 мкг клонов MD707-5, MD707-12 или MD707-13 или химерного N13B2-G4; (В) 50 нг N13B2, HAL клона H3L4 или 1A11 или среда в качестве контроля. Клетки затем окрашивали при 4°С с использованием коммерчески доступных mAb к человеческому CD127 для оценки уровня экспрессии альфа-цепи рецептора IL-7 на клеточной мембране.
Антитела MD707-5, MD707-12 и MD707-13 индуцировали интернализацию рецептора при 37°С с или без IL-7, тогда как химерное N13B2-G4 не индуцировало. Антитело HAL индуцировало снижение экспрессии CD127 на клеточной поверхности в любых условиях. Результаты при 4°С показывают, что антитело 1А11 незначительно конкурирует с антителом, используемым для мечения, тогда как HAL проявляет сильную конкуренцию, a N13B2 не проявляет конкуренцию. При 37°С не наблюдали окрашивания клеточной поверхности в присутствии HAL, тогда как 1A11 само по себе индуцировало сильное снижение экспрессии CD127 на клеточной поверхности, а в сочетании с IL-7 экспрессия на клеточной поверхности снижалась на ~90%. В отличие от этого, N13B2 не снижало экспрессию CD127 на клеточной поверхности при 4°С, а также не индуцировало снижение экспрессии CD127 на клеточной поверхности при использовании отдельно, и оно ингибировало снижение, наблюдаемое в присутствии IL-7.
Фиг. 17. (А) Изучение фармакокинетических и фармакодинамических характеристик введения mAb N13B2 и MD707-13 приматам, отличным от человека. Павианов (Papio anubis) обрабатывали внутривенно 10 мг/кг N13B2-IgG1 (n=3, закрашенный квадрат), N13B2-IgG4 (n=3, закрашенный круг) или MD707-13-IgG4 (n=3, незакрашенный круг). Концентрацию mAb к CD127 в сыворотке отслеживали с помощью метода ELISA. (В) Параллельно экспрессию CD127 на поверхности Т-лимфоцитов в крови отслеживали с помощью проточной цитометрии и нормализовали к уровню, измеренному перед инъекцией mAb (показан пунктирной линией). * p<0,05. Общие уровни в плазме сравнимы со временем для всех трех антител. Экспрессия CD127 на клеточной поверхности снижается после ~8 суток обработки MD707-13, в то время как такое снижение не наблюдается с любым из исследуемых клонов N13B2.
Фиг. 18. Павианов (Papio anubis) обрабатывали внутривенно 10 мг/кг N13B2-IgG1 (n=3, закрашенный квадрат), N13B2-IgG4 (n=3, закрашенный круг) или MD707-13-IgG4 (n=3, незакрашенный круг). Частоту обнаружения регуляторных Т-лимфоцитов (CD3+ CD4+ CD25high Foxp3+) в крови и лимфатических узлах (выраженную в % CD4-положительных Т-клеток), а также рассчитанное абсолютное количество регуляторных Т-лимфоцитов (выраженное в количестве клеток/мл) отслеживали в День 0 и через 2 недели после введения mAb. ** р<0,01, *** р<0,001. Все три антитела повышают общее количество регуляторных Т-клеток в крови и долю регуляторных Т-клеток как в крови, так и в лимфатических узлах.
Фиг. 19. In vitro ингибирование экспрессии α4-, β7- и α4/β7-интегринов. А. Процент α4-положительных и α4/β7-положительных человеческих Т-лимфоцитов после 9 суток культивирования с 5 нг/мл человеческого IL-7 или без него анализировали с помощью метода FACS. В. То же, что и выше, причем указанные концентрации mAb N13B2 добавляли к культуре в День 0. Пунктирными линиями указан фоновый уровень в контрольных условиях (без IL-7 и mAb N13B2). Индуцируемое IL-7 повышение экспрессии α4-, β7- и α4/β7-интегринов предотвращается гуманизированным mAb N13B2 in vitro (она полностью ингибируется при концентрации антитела ~2 мкг/мл).
Фиг. 20. In vivo ингибирование экспрессии α4-, β7- и α4/β7-интегринов. 40×106 человеческих мононуклеарных клеток периферической крови вводили инъекцией внутрибрюшинно подвергшимся облучению иммунодефицитным мышам (NOD/SCID/нокаутным по гамма-цепи рецептора IL-2 мышам). Процент β7-положительных Т-лимфоцитов в крови (слева) и приживление β7-положительных человеческих Т-лимфоцитов (справа) после двух недель обработки контрольным буфером (n=5) или mAb N13B2 (5 мг/кг, n=5) оценивали с помощью метода FACS. ** р<0,01. N13B2 значительно снижает долю β7-положительных Т-клеток и приживление β7-положительных Т-клеток.
Фиг. 21. Эффект антитела N13B2 в модели DTH, in vivo модели псориаза. Вакцинированных BCG (бацилла Кальмета-Герена) павианов (Papio anubis) сенсибилизировали посредством интрадермальной инъекции 2000 (А) или 1000 (В) единиц очищенного туберкулина для индукции реакции гиперчувствительности замедленного типа и диаметры области эритемы записывали каждый день (звездочка; пунктирная линия). Месяц спустя животных обрабатывали внутривенно 10 мг/кг N13B2-IgG1 (n=3, закрашенный квадрат), N13B2-IgG4 (n=3, закрашенный круг) или MD707-13-IgG4 (n=3, незакрашенный круг). Через четыре недели после введения mAb животных снова сенсибилизировали посредством интрадермальной инъекции 2000 (А) или 1000 (В) единиц очищенного туберкулина для индукции реакции гиперчувствительности замедленного типа и диаметры области эритемы записывали каждый день (сплошные линии). Антитело N13B2, но не MD707-13 ингибирует реакцию лимфоцитов памяти, что измеряли по диаметру области эритемы после второй сенсибилизации.
Фиг. 22. Павианов (Papio anubis) обрабатывали внутривенно 10 мг/кг N13B2-IgG1 (n=3, закрашенный квадрат), N13B2-IgG4 (n=3, закрашенный круг), или MD707-13-IgG4 (n=3, незакрашенный круг), или контрольным буфером (n=3, пунктирная линия). Спустя четыре часа животные получали внутривенную инъекцию 1,5 мл бараньих эритроцитов (SRBC) в концентрации 10%. Титры специфичных антител IgG к SRBC отслеживали спустя 1 неделю и 2 недели после введения SRBC и нормализовали к их титрам в День 0. * p<0,05. N13B2, но не MD707-13 ингибирует гуморальный иммунный ответ, что измеряли по титру специфичного IgG.
Фиг. 23. Последовательность белка гуманизированного N13B2 VH IgG4 S228P_h3: в последовательности серым цветом выделены CDR, выделенные подчеркиванием и жирным шрифтом аминокислоты являются мутированными (V42I, A54S, D82N, M108L), подчеркнутая последовательность является мутированной последовательностью IgG4 (S228P).
Фиг. 24. Последовательность белка гуманизированного N13B2 VL Ckappa_h3: в последовательности серым цветом выделены CDR, выделенные подчеркиванием и жирным шрифтом аминокислоты являются мутированными (V54I, Y77F, F93Y+ N31Q, S59T), подчеркнутая последовательность является мутированной последовательностью IgG4 (S228P).
Фиг. 25. N13B2 защищает от гибели в модели воспаления у мышей: у гуманизированных мышей индуцировали реакцию «трансплантат против хозяина» (см. пример 13). Процент выживших NSG мышей, которым вводили инъекцией 50 миллионов человеческих РВМС в День 0 и не подвергавшихся обработке (белый квадрат, n=14) или обрабатываемых три раза в неделю посредством внутрибрюшинной инъекции 5 мг/кг химерного N13B2 (черный круг, n=19).
Фиг. 26. N13B2 специфично предотвращает воспаление толстого кишечника в модели воспаления у мышей (см. пример 13). На момент умерщвления (т.е. при 25% потере веса или через 100 суток после инъекции) инфильтрацию воспалительных клеток в каждую ткань NSG мышей, которым вводили инъекцией 50 миллионов человеческих РВМС в День 0 и обрабатывали (показано черным) три раза в неделю 5 мг/кг N13B2 или не обрабатывали (показано белым), анализировали с помощью гистологического анализа 10 мкм срезов, окрашенных гематоксилином и эозином. Результаты представлены следующим образом: А. толстый кишечник, В. тонкий кишечник, С. печень и D. легкое. Данные представляют собой среднее значение +/- SEM от по меньшей мере n=8 на группу.
Фиг. 27. Эпитопные домены на белке CD127 (Uniprot PI6871), которые распознаются антителом N13B2. Аминокислоты, выделенные жирным шрифтом, соответствуют последовательностям, образующим конформационный эпитоп, распознаваемый N13B2; аминокислоты на сером фоне являются важными для взаимодействия с IL-7; аминокислоты, которые являются зачеркнутыми, составляют сигнальный пептид CD127.
Фиг. 28. Исследование совместного иммуноосаждения комплекса CD127/IL-7/CD132 с антителами к hCD127 (пример 21). Полосы: 1 - только PBL, 2 - PBL+IL-7, 3 - PBL+IL-7+N13B2, 4 - PBL+IL-7+MD707-13, 5 - CD132-FC (72 кДа) или CD-127-Fc (80 кДа). Совместное иммуноосаждение образцов на колонке с антителом hCD127 (MD707-9). Элюаты анализировали с помощью вестерн-блоттинга (А) с использованием кроличьего антитела к человеческому CD132, выявляемого с использованием меченого пероксидазой козьего антитела к кроличьему антителу, или (В) с использованием крысиного антитела к человеческому CD127, выявляемого с использованием меченого пероксидазой ослиного антитела к крысиному антителу.
Примеры
Пример 1
Получение и отбор новых Mab к человеческому CD127
Клетки иммунизировали рекомбинантным hCD127-Ig (hCD127, слитым с константным фрагментом иммуноглобулина, - Sino Biologicals, Пекин, Китай; код 10975-H03H) и моноклональные антитела получали в соответствии с традиционными методиками. Используемый протокол иммунизации был следующим: рекомбинантную химеру CD127-Fc (10975-H03H Sino Biological, Пекин, Китай) использовали для иммунизации крыс линии LOU/C Igk1a. Пятьдесят микрограмм белков суспендировали в полном адъюванте Фрейнда и вводили подкожно. После 20 суток осуществляли вторичную инъекцию белка, суспендированного в неполном адъюванте Фрейнда. Другую подобную вторичную инъекцию осуществляли в День 60 и бустер-инъекцию осуществляли в День 90 с использованием 100 микрограмм белков за 4 суток до сбора клеток селезенки.
Гибридому получали посредством слияния мононуклеарных клеток селезенки с клетками линии LOU, линии несекретирующих и устойчивых к азагуанину Т-клеток крысиной иммуноцитомы IR983F, в соответствии с ранее описанной процедурой (Chassoux et al, 1988). Гибридому вначале подвергали скринингу по признаку способности секретируемых моноклональных антител к связыванию с рекомбинантной молекулой CD127 (химера CD127-Fc; 10975-H03H, Sino Biological, Пекин, Китай).
После отбора гибридому культивировали в полной среде DMEM. Супернатант концентрировали с помощью ультрафильтрации (Centramate, Pall) и очищали с помощью аффинной хроматографии на белке G (HiTrap, GeHealthcare). Элюирование осуществляли с использованием 0,1 М глицинового буфера для элюирования с pH 2,8. Полученные в результате очищенные иммуноглобулины оценивали в плане активности в анализе ELISA в отношении человеческого CD127.
Из числа первых отобранных клонов, отобранных, исходя из распознавания секретируемыми антителами рекомбинантного CD127, 2 подвергали дополнительному отбору с помощью проточной цитометрии в отношении распознавания CD127, экспрессируемого человеческими Т-клетками и в отношении их антагонистических свойств по отношению к TSLP.
Антитела получали и их изотип, также как и значения их аффинности, характеризовали с помощью измерения поверхностного плазмонного резонанса с использованием технологии BIAcore.
Пример 2
Распознавание rCP127 Mab к h-CD127, оцениваемое с помощью ELISA
Рекомбинантный hCD127 (Sino Biologicals, Пекин, Китай; код 10975-Н08Н) иммобилизировали на пластике и возрастающие дозы Mab добавляли для измерения связывания. После инкубирования и промывки добавляли меченое пероксидазой мышиное антитело к крысиной каппа-цепи (AbdSerotec) и выявляли его с помощью традиционных методов. Связывание подтверждали для каждого антитела.
Пример 3
Ингибирование передачи сигнала с участием IL-7 (pSTAT5)
Человеческие моноцитарные клетки периферической крови (РВМС), собранные в градиенте плотности фиколла от здоровых добровольцев, инкубировали в бессывороточной среде с разными концентрациями антител, представляющих интерес, в течение 15 минут при комнатной температуре перед инкубированием с 0,1 или 5 нг/мл рекомбинантного человеческого IL-7 (rhIL-7; AbD Serotec, код РНР046) в течение 15 минут при 37°С. РВМС, не обработанные rhIL-7, анализировали в качестве фонового сигнала, в то время как обработанные IL-7 клетки без антитела использовали в качестве отрицательного контроля. РВМС затем быстро охлаждали и промывали FACS буфером для остановки реакции. Клетки затем инкубировали в течение 15 минут с холодным раствором Cytofix/Cytoperm (BD Bioscience, код 554722), промывали дважды буфером Perm/Wash (Bd Bioscience) и окрашивали меченым FITC антителом к человеческому CD3 (Bd Bioscience, код 557694) в течение 30 минут на льду. РВМС затем дважды промывали буфером Perm/Wash и пермеабилизировали в буфере BD Perm Buffer III (Bd Bioscience, код 558050) в течение 30 минут. Клетки затем дважды промывали в FACS буфере (и/или PBS с 1% BSA и 0,1% азида) и инкубировали в течение 30 минут при комнатной температуре с меченым Alexa 647 антителом к человеческому pSTAT5 (BD Bioscience, код 612599). Образцы анализировали на FACS-инструменте BD CANTO II. Как показано на фиг. 1 и фиг. 2, N13B2 и химерные антитела, полученные из него (N13B2-G1 и N13B2-G4), являлись сильными ингибиторами фосфорилирования STAT5; с более чем 50% ингибированием при концентрациях до 50 нг/мл и более чем 80% (для 0,1 нг/мл IL-7) или более чем 90% (для 5 нг/мл IL-7) ингибированием при концентрациях антитела до 100 нг/мл.
Пример 4
Значения полумаксимальной ингибирующей концентрации (IC50) для разных моноклональных антител к человеческому IL-7Rα представлены в таблице 1.
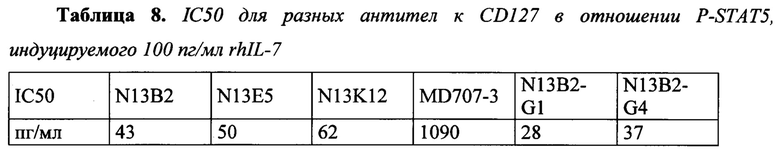
Пример 5
Анализ интернализации IL-7R с использованием цитофлуориметрии
Анализ интернализации можно осуществлять с использованием конфокального микроскопа, как подробно описано в разделе «Материалы и методы» в Henriques et al (2010); и Luo et al. (2011). Для наблюдения интернализации CD127 в отсутствие IL-7 антитела hN13B2, клон H3L4 HAL (патент США №863727) или 1А11 (международная патентная заявка WO 2011094259) в конечной концентрации 50 нг/мл (или антитела MD707-5, MD707-12, MD707-13 или N13B2-G4 в конечной концентрации 10 мкг/мл) инкубировали с человеческими РВМС (100000 клеток/лунка) в бессывороточной среде (TexMACS, Miltenyi Biotec) в течение 30 мин. при 4°С или 37°С. Для наблюдения интернализации CD127 в отсутствие IL-7 использовались те же условия предварительного инкубирования при 37°C с антителами и клетки затем стимулировали рекомбинантным IL-7 (AbD Serotec, код РНР046) в концентрации 0,1 нг/мл в течение 15 мин. при 37°С. Реакцию останавливали при 4°С и клетки промывали 3 раза PBS-1%BSA-0,1% азида перед окрашиванием меченым РЕ антителом к CD127 (клон hIL-7R-М21, BD Bioscience, код 557938), разведенным в соотношении 1/10 в PBS-1%BSA-0,1% азида, и инкубировали 15 мин. при 4°С. После промывания клетки анализировали с использованием цитофлуориметрии на цитометре CantoII (BD Biosciences). Результаты, представленные на фиг. 16, являются репрезентативными для трех независимых экспериментов.
Этот способ можно легко адаптировать к 96-луночным планшетам с целью осуществления скрининга и проведения отбора антител, которые блокируют зависимую или независимую от IL-7 интернализацию CD127.
Пример 6
Изучение аффинности антитела к CD127
Аффинность антитела к hCD127 измеряли с помощью поверхностного плазмонного резонанса на Biacore 3000 (GE Healthcare)
Чип СМ5 (GE healthcare) активировали впрыскиванием смеси NHS/EDC в течение 7 мин. CD-127Fc (500 мкг/мл) разводили в 5 мМ малеатном буфере с pH 6,2 и остатки сукцинимидного сложного эфира впрыскивали до улавливания сигнала в 300 RU (относительные единицы). Свободные реакционноспособные остатки инактивировали посредством инъекции 1 М этаноламина с pH 8,5. Антитела впрыскивали на иммобилизированный CD127 в диапазоне концентраций, определенном в разделе Результаты. Скорость инъекции устанавливали на 40 мкл/мин., ассоциацию измеряли в течение 3 мин., а диссоциацию - в течение 10 мин. Между каждым циклом анализа чип регенерировали инъекцией раствора 5 М MgCl2 в течение 60 с.
Полученные сенсограммы анализировали с использованием модели «Бивалентный аналит» в программном обеспечении BIAeval 4.
Как показано на фиг. 3 и в таблице 2 в данном документе, N13B2 из крысы и химеризованное антитело проявляли высокую аффинность в отношении CD127, причем KD находилась в диапазоне 4,9Е-11 М - 8,Е-11 М (N13B2 от крысы), 3,77.Е-10 (N13B2-G1) и 1,70.Е-10 (N13B2-G4). Антитело MD707-1 из крысы проявляло более низкую аффинность в отношении CD127, чем N13B2 из крысы.
Пример 7
Активность связывания антитела к CD127
Для осуществления сэндвич-ELISA, ослиное антитело к человеческому IgG (Fc-специфичное) наносили в виде покрытия в концентрации 1,2 мкг/мл на Р96-планшет и очищенные антитела добавляли для измерения концентрации в зависимости от стандартного диапазона. После инкубирования и промывания добавляли мышиное специфичное в отношении каппа-цепи антитело к человеческой легкой цепи (Abcam, код ab79115, или Effimune, клон NaM76-5F3) и меченое пероксидазой ослиное антитело к мышиному антителу (Jackson Immunoresearch, код 715-036-151) и выявляли их с помощью традиционных методов.
Активность связывания антитела к hCD127 оценивали с помощью ELISA (твердофазный иммуноферментный анализ). В случае ELISA анализа рекомбинантный hCD127 (Sino Biologicals, Пекин, Китай; код 10975-Н08Н) иммобилизировали на пластике в концентрации 1 мкг/мл и очищенное антитело добавляли для измерения связывания. После инкубирования и промывки добавляли меченое пероксидазой мышиное антитело к крысиной каппа-цепи (AbdSerotec) и выявляли его с помощью традиционных методов.
Как показано на фиг. 4 и в таблице 3, измеренная с помощью ELISA активность связывания антитела N13B2 является высокой, причем ED50=65,6 нг/мл (ED50<75 нг/мл и ED50<100 нг/мл) для крысиного N13B2 антитела к hCD127, и ED50 составляла 12,0 нг/мл и 12,6 нг/мл (ED50<15 нг/мл) для двух химерных антител, полученных из N13B2 (cN13B2-G1 и cN13B2-G4).
Пример 8
Анализ стабильности
Гуманизированные и химерные очищенные N13B2-G1 инкубировали при 37°С или при -80°С в течение 7 суток. Два анализа использовали для измерения стабильности антитела: анализ связывания антитела с CD127 с помощью ELISA и образование агрегатов с помощью гель-фильтрации. В случае ELISA анализа активности рекомбинантный hCD127 (Sino Biologicals, Пекин, Китай; код 10975-Н08Н) иммобилизировали на пластике в концентрации 1 мкг/мл и разведенные образцы супернатанта добавляли для измерения связывания. После инкубирования и промывки добавляли мышиное антитело к человеческой легкой цепи (специфичное в отношении каппа-цепи) и меченое пероксидазой ослиное антитело к мышиному антителу и выявляли их с помощью традиционных методов. В случае анализа образования агрегатов образец анализировали на колонке для гель-фильтрационной хроматографии (Superdex 200, 10/300GL, GeHealthcare) для разделения и оценки агрегата и мономера из образцов.
Пример 9
Индуцируемая TSLP продукция TARC и экспрессия маркеров зрелых дендритных клеток CD80 и CD40.
Миелоидные дендритные клетки (DC) выделяли с использованием набора для выделения CD1c (BDCA-1)+-дендритных клеток (Miltenyi Biotec, Бергиш-Гладбах, Германия) из крови здоровых добровольцев (Etablissement Francais du Sang, Нант, Франция). Миелоидные дендритные клетки культивировали в среде RPMI, содержащей 10% фетальной телячьей сыворотки, 1% пирувата, 1% Hepes, 1% L-глутамина и 1% пенициллина-стрептомицина. Клетки высевали в количестве 5.104 клетки/лунку в плоскодонные 96-луночные планшеты в присутствии TSLP (15 нг/мл), LPS (1 мкг/мл) или только среды культивирования и при добавлении крысиных антител к человеческому CD127 в разных концентрациях. Через 24 часа культивирования клетки анализировали с помощью проточной цитометрии в отношении маркера созревания CD80 на клеточной поверхности (антитело к CD80-V450 (BD#560442) и супернатанты собирали и анализировали в отношении продукции TARC с помощью ELISA анализа (R&D sytems, Миннеаполис, США).
Ингибирование индуцируемой TSLP продукции TARC оценивали путем измерения указанной продукции, как описано выше, в отсутствие антитела или в присутствии N13B2, или MD707-6, или коммерческого антитела к TSLPR (R&Dsystems, код AF981) в концентрации 1 мкг/мл или 6 мкг/мл. Как показано на фиг. 6, N13B2 ингибировало индуцируемую TSLP продукцию TARC более чем на 25% в концентрациях до 1 мкг/мл, т.е. также эффективно, как и MD707-6 в этой концентрации.
Ингибирование индуцируемой TSLP экспрессии маркеров клеточной поверхности CD40 и CD80 оценивали посредством измерения указанной экспрессии, как описано выше (в случае CD40 использовали антитело (антитело к CD40-FITC от Beckton Dickinson, код 555588) в условиях, подобным описанным выше для CD80), в отсутствие антитела (в этом случае экспрессию нормализуют к 100%) или в присутствии антител N13B2, MD707-3 или MD707-6 в концентрации 6 мкг/мл. Как показано на фиг. 7, как MD707-3, так и MD707-6 индуцировали повышение экспрессии CD40 и CD80, тогда как MD707-3 являлось хорошим ингибитором активации STAT5 и хорошо связывалось с CD127 (фиг. 2 и фиг. 4), и MD707-6 являлось сильным ингибитором индуцируемой TSLP продукции TARC (фиг. 6). Повышение составляло по меньшей мере 20% для CD80 и 50% для CD40. В отличие от этого, антитело в соответствии с настоящим изобретением, N13B2, не повышало индуцируемую TSLP экспрессию CD40 или CD80. Вместе с тем, указанные уровни экспрессии были ниже в присутствии TSLP и антитела, чем в присутствии только TSLP.
Пример 10
Антителозависимая клеточная цитотоксичность (ADCC) Mab к человеческому CD127
ADCC называется связывание антитела с эпитопом, экспрессируемым на клетках-мишенях, и последующее Fc-зависимое привлечение эффекторных иммунных клеток, экспрессирующих Fc-рецепторы (в основном NK-клеток и активированных лимфоцитов), приводя в результате к цитолизу клеток-мишеней преимущественно посредством механизмов на основе гранзима/перфорина.
Эффекторные клетки представляли собой свежие первичные человеческие NK-клетки, выделенные из мононуклеарных клеток периферической крови посредством отрицательного отбора с использованием магнитных гранул (набор для выделения NK-клеток, Miltenyi Biotec, Бергиш-Гладбах, Германия) и инструмента для клеточного сортинга AutoMACS. NK-клетки инкубировали в течение ночи при 37°С с 5% CO2 в среде RPMI 1640 (Life Technologies, Карлсбад, Калифорния), дополненной 10% FBS (Life Technologies), 100 МУ/мл пенициллина (Life Technologies), 0,1 мг/мл стрептомицина (Life Technologies), 2 мМ L-глутамин (Life Technologies) и 150 МУ/мл человеческого IL-2 (Roche, Базель, Швейцария). Клетки-мишени (клеточная линия BAF/3, трансфицированная человеческим CD127 (Park et al., 2000)) метили 100 мкКи (3,7 МБк) 51Cr (PerkinElmer) в течение 1 часа при 37°С и промывали пять раз средой культивирования. Клетки-мишени инкубировали с разбавленными антителами или с вспомогательным средством (средой культивирования) в течение 15 мин. при комнатной температуре и 10000 клеток помещали в 96-луночный планшет с U-образным дном. Эффекторные Т-клетки добавляли при соотношении клеток 10:1 (конечный объем: 200 мкл) в течение 4 часового периода инкубирования при 37°С. Затем собирали в общей сложности 25 мкл супернатанта и производили подсчет на счетчике гамма-частиц (Packard Instrument).
Как Mab MD707-3 крысиного происхождения, так и химерное Mab N13B2-G1 (имеющее, следовательно, Fc-домен типа IgG1) проявляли ADCC. Химерное N13B2-G4 (имеющее Fc-домен типа IgG4) не проявляло никакой активности ADCC и использовалось в качестве отрицательного контроля. Интересно, что не существовало прямой корреляции между аффинностью, свойствами связывания и ADCC, указывая на то, что свойства ADCC нельзя спрогнозировать, исходя из анализов связывания.
Пример 11
Нуклеотидные и аминокислотные последовательности Mab к человеческому CD127
VH- и VL-участки клона N13B2 секвенировали с использованием технологии ПЦР с быстрой амплификацией концов кДНК (RACE PCR). Вкратце, общую РНК экстрагировали, подвергали обратной транскрипции и полученную в результате кДНК подвергали полиаденилированию по 3'-концу молекул с использованием dATP и фермента терминальной трансферазы. Первые 35 циклов реакции ПЦР проводили с использованием якорного праймера олиго(dT) и фермента геркулазы (Stratagene). Вторые 35 циклов ПЦР проводили с использованием якорных праймеров для гнездовой ПЦР. Полученный в результате ПЦР-продукт затем подвергали ТА-клонированию в Е. Coli и после отбора на ампициллине полученные в результате колонии подвергали скринингу посредством анализа профиля фрагментов с использованием рестрикционных ферментов и встроившуюся кДНК секвенировали.
Пример 12
Гуманизация
Гуманизацию крысиного моноклонального антитела N13B2 выполняли с использованием стандартной технологии CDR-прививки. Принцип этого метода заключается в структурной перестройке человеческого антитела таким образом, чтобы оно содержало только определяющие комплементарность участки (CDR) из крысиного моноклонального антитела для того, чтобы не только снизить иммуногенность антитела у людей, но также улучшить биофизические свойства молекулы с привитыми CDR.
Гуманизация посредством CDR-прививки требует того, чтобы антигенсвязывающие остатки из исходного крысиного антитела сохранялись у гуманизированного варианта. Было обнаружено, что остатки, смежные с CDR, называемые остатками «из зоны Vernier», оказывают воздействие на конформации CDR и на точную регулировку распознавания антигена. Chothia and Lesk, (1987), выделяли конформации CDR в соответствии с «каноническими» остатками, некоторые из которых сами располагаются в пределах CDR, а другие - в каркасных участках. Таким образом, идентификация этих остатков «из зоны Vernier» и «канонических» остатков является критически важной стадией. Используемый протокол основывается на подходе, впервые предложенном Грегом Винтером и коллегами (Paus and Winter, 2006) в Совете по исследованиям в области медицины, Кембридж, Великобритания, и в котором используются остатки CDR, определенные по Kabat.
Отбор акцепторных человеческих каркасных участков, на которые прививают CDR участки крысиного N13B2, выполняли посредством IMGT поиска в базах данных V-генов для крысы и человека с использованием IgBLAST - инструмента, разработанного в NCBI для облегчения анализа последовательностей вариабельных участков иммуноглобулинов (http://www.ncbi.nlm.nih.gov/igblast; Ye et al., 2013), причем в качестве вводимых данных использовали последовательности VH и VL крысиного N13B2. Помимо этого, в применяемой в данном случае стратегии используются человеческие последовательности зародышевой линии, которые представляют собой природные человеческие последовательности, не содержащие соматические сверхмутации, обнаруживаемые в белке и полученных из кДНК последовательностях. Обычно отбирали гены зародышевой линии, наиболее подобные крысиным последовательностям VL и VH. Акцепторные человеческие каркасные VH- и VL-участки зародышевой линии идентифицировали посредством выравнивания последовательностей VH и VL исходного антитела N13B2 и на основе следующих критериев: 1. идентичность последовательности по каркасной области и CDR, как определено Kabat, 2. идентичные и совместимые остатки на поверхности взаимодействия между цепями, 3. поддерживающие петли с исходными каноническими конформациями CDR и остатками из зоны Vernier.
Несколько разных последовательностей, полученных в результате гуманизации, исследовали в отношении N13B2 для выбора лучшей, которая сохраняет связывание и биологическую активность. Для гуманизированных вариантов N13B2 вариабельную последовательность гуманизированной тяжелой цепи (VH) антитела N13B2 клонировали с помощью EcoRV в экспрессионную плазмиду pFuseCHIg-hG1e4 (Invivogen, Тулуза), содержащую СН1-СН2-СН3 домены hIgG1, в которые была введена мутация E333A для повышения ADCC. Вариабельную последовательность гуманизированной легкой цепи (VL) антитела N13B2 клонировали с помощью BsiWI в экспрессионную плазмиду pFuse2CLIg-hk (Invivogen, Тулуза), содержащую человеческий CLkappa.
В COS-клетках, которые авторы настоящего изобретения подвергли совместной трасфекции с помощью метода с использованием липофектамина, присутствовали плазмида, содержащая VH-hFcG1, с плазмидой, содержащей VL-CLk. После 48-72-часового инкубирования супернатант выделяли и очищали с помощью аффинной хроматографии на белке G (HiTrap, GeHealthcare) с 0,1 М глициновым буфером для элюирования с pH 2,8. Очищенное антитело подвергали диализу в PBS и концентрировали. Их количественное определение осуществляли с помощью сэндвич-ELISA и исследовали в анализе активности в отношении антигена CD127.
Пример 13
Исследование воздействия антител к IL-7Rα в отношении IL-7 в разных in vivo моделях воспалительного заболевания
С целью оценки эффекта антагонистического антитела в индукции колита у гуманизированных NSG мышей авторы настоящего изобретения провели ряд экспериментов в модели с TNBS, которые показали измеримый эффект. Применение гаптенов, таких как TNBS (2,4,6-тринитробензолсульфоновая кислота), позволяет обеспечить имитацию иммунологической модели (Nancey et al., 2008). Колит индуцируется у мышей путем интраректального введения TNBS (Sigma Chemical, L'Isle d'Abeau Chesne, Франция), разведенного в этаноле, в День 0 четырем гуманизированным мышам. Первоначально, мышей подвергали анестезии посредством ингаляции газовой смесью. В День 7 животных умерщвляли под анестезией посредством интоксикации CO2 для нескольких исследований (данные не показаны). Некоторых животных умерщвляли до Дня 7 вследствие их плохой клинической оценки.
Таким образом, две новых группы мышей обрабатывали либо PBS, либо инъекциями 210 мкл антитела к IL-7Rα N13B2 в концентрации 0,7 мг/мл каждые 2 суток, начиная с дня перед обработкой TNBS. Осуществляли анализы, подобные выполняемым при разработке модели.
Затем авторы настоящего изобретения исследовали эффективность антитела N13B2 в модели реакции «трансплантат против хозяина» (GVHD) с использованием гуманизированных мышей. Эта модель имитирует общего воспалительного заболевания. Некоторых NOD/scid/IL-2Rγ-/- (NSG) мышей (Charles River, Л'Арбрель, Франция) возрастом 7-12 недель облучали (3Gy) и вводили инфузией внутрибрюшинно (i.p.) 50 миллионов человеческих РВМС от здоровых доноров, как ранее описано Poirier et al., 2012. Животных затем содержали в асептических условиях и подвергали мониторингу три раза в неделю в отношении изменения веса и клинической оценки. Контрольную группу оставляли необработанной после инфузии клеток, а обрабатываемая группа получала, начиная со Дня 0 и три раза в неделю, i.p. инъекции 5 мг/кг химерного mAb N13B2. Диагноз GVHD ставили мыши после 20% потери веса. Животных, у которых была обнаружена более чем 25% потеря веса, и животных, выживших после 100 суток с Дня 0, умерщвляли. После умерщвления ткани толстого кишечника, тонкого кишечника, печени и легких замораживали в жидком азоте и реактиве Tissu-tek для гистологического анализа. Замороженные срезы (10 мкм) из этих тканей сушили на воздухе при комнатной температуре в течение 1 часа до фиксации в ацетоне в течение 10 мин. при комнатной температуре, а затем окрашивали раствором гематоксилина и эозина. Результаты представлены на фиг. 25 и фиг. 26.
Пример 14
Анализ различных клинических параметров
Выживание (фиг. 9А): авторы настоящего изобретения оценивали выживаемость в связи с химической обработкой и применением антител к IL-7Rα. Проявлялась тенденция, что процент выживших оказывался более значительным для группы Hu-TNBS + IL-7Rα, чем для группы Hu-TNBS + PBS (фиг. 9A). Действительно, авторы настоящего изобретения наблюдали, что 100% из мышей группы Hu-TNBS + IL-7Rα выживали до 5 суток, тогда как в группе Hu-TNBS + PBS три животных пришлось умертвить до J5.
Вес (фиг. 9В): в обработанных TNBS группах, начиная с интраректальной инъекции 5% TNBS/50% этанола со Дня 0, авторы настоящего изобретения наблюдали снижение веса до 20% для обеих групп. Тем не менее, в группе Hu-TNBS + IL-7Rα животные набирали вес с J3, тогда как в группе Hu-TNBS + PBS потеря веса продолжалась (фиг. 9В). Важно отметить, что мыши должны были быть умерщвлены для сбора биологических данных, и более долгосрочный протокол подтвердил бы повторный набор веса.
Выживаемость (фиг. 25): авторы настоящего изобретения оценивали выживаемость в связи с инъекцией человеческих РВМС (развитие GvHD) и применением антитела к IL-7Rα N13B2. Выживаемость животных была на 30% лучше, когда животных обрабатывали антителом, чем у контрольных животных (100% смертность контрольных животных после 60 суток). Эти результаты показывают, что антитело N13B2 защищает от GvHD и смерти.
Инфильтрат в тканях (фиг. 26): толстый кишечник, тонкий кишечник, печень и легкие из умерших и выживших (но умерщвленных) животных, обработанных или не обработанных, подвергали гистологическому анализу в отношении показателя инфильтрации воспалительных клеток в них (определяли гистологическую оценку). Авторы настоящего изобретения наблюдали, что толстый кишечник животного, обработанного N13B2, содержал меньшее количество клеточного инфильтрата, чем контроль. Не наблюдали различия в тонком кишечнике, печени и легком между обоими состояниями.
У животных, обработанных N13B2, проявлялась 30% выживаемость по сравнению с контролем. Клеточный инфильтрат, характеризующий воспаление, не модифицировался при обработке в тканях тонкого кишечника, печени и легкого, это показывало, что в этой модели воспаления N13B2 не защищает от воспаления в этих тканях. Тем не менее, N13B2 индуцировало 50% снижение количества клеточного инфильтрата в толстом кишечнике. Можно увидеть корреляцию этого эффекта с активностью антитела N13B2 в отношении экспрессии α4β7-интегрина, что представлено на фиг. 19 и фиг. 20. Действительно, α4β7-интегрин, как известно, играет важную роль в хоуминге активированных лимфоцитов в кишечник. Таким образом, снижение экспрессии интегрина, индуцируемое антителом N13B2, может быть ответственно за снижение количества клеточного инфильтрата, наблюдаемого в толстом кишечнике (фиг. 26). Следует подчеркнуть, что явное отсутствие защиты в других тканях может быть специфичным для модели, используемой в данном случае, и это не должно приводить к выводу, что защитный эффект антитела ограничивается толстым кишечником. В частности, гораздо более высокая выживаемость обработанных животных показывает, что защитный эффект антитела оказывает сильное положительное воздействие на общее состояние животных.
Пример 15
In vivo эффективность антитела в отношении неинтернализованного CD127
Животные
Павианы (Papio anubis, из Центра приматологии CNRS, Руссе, Франция) были отрицательными в отношении всех карантинных анализов, в том числе по туберкулиновой кожной пробе. Животных содержали в большом виварии при лаборатории, следуя этическим нормативам Institutional Ethical Guidelines института Institut National de la  Et de la Recherche
Et de la Recherche  , Франция. Все эксперименты выполняли под общей анестезией с использованием золетила (Virbac, Карро, Франция). Фармакокинетические и фармакодинамические исследования осуществляли в ходе экспериментов с DTH на пяти павианах, получающих i.v. болюсную инъекцию 10 мг/кг любого из N13B2-IgG1, или N13B2-IgG4, или MD707-13-IgG4.
, Франция. Все эксперименты выполняли под общей анестезией с использованием золетила (Virbac, Карро, Франция). Фармакокинетические и фармакодинамические исследования осуществляли в ходе экспериментов с DTH на пяти павианах, получающих i.v. болюсную инъекцию 10 мг/кг любого из N13B2-IgG1, или N13B2-IgG4, или MD707-13-IgG4.
BCG вакцинация и DTH анализ
В соответствии с Poirier и соавт. (Poirier et al., 2011) павианов иммунизировали интрадермально (i.d.) дважды вакциной на основе бациллы Кальмета-Герена (BCG) (0⋅1 мл; 2-8  105 UFS; Sanofi Pasteur MSD, Лион, Франция) в верхнюю область нижней конечности за 4 и 2 недели до анализа кожной DTH. Для изучения антигенспецифичного Т-клеточного иммунитета перед анализом кожной DTH успешную иммунизацию подтверждали с помощью иммуноферментного спот-анализа (ELISPOT) интерферона (IFN)-g (набор для ELISPOT-анализа IFN-g примата, отличного от человека; R&D Systems, Миннеаполис, Миннесота, США) на свежевыделенных РВМС в соответствии с инструкциями производителя. Интрадермальные реакции (IDR) проводили с использованием дублирующих интрадермальных инъекций двух доз (1000 МУ или 2000 МУ) очищенного белкового продукта туберкулина (PPD; Symbiotics Corporation, Сан-Диего, Калифорния, США) в 0,1 мл в кожу на правой части спины животных. Солевой раствор (0,1 мл) использовали в качестве отрицательного контроля. Кожные реакции в местах инъекции измеряли с использованием штангенциркуля. Диаметр каждой уплотненной области эритемы измерялся двумя наблюдателями, начиная с Дней 3-8, и результат считался положительным, когда диаметр области составлял >4 мм. Записывали среднее значение показаний. Образцы биопсии кожи из места DTH или места введения контроля (солевого раствора) забирали в День 4 на месте одной дублирующей инъекции и помещали в реактив Tissue Tek для обеспечения оптимальной температуры получения срезов (OCT) (Sakura Finetek, Вильнев-д'Аск, Франция) для иммуногистохимического анализа. Вторую IDR проводили после 3-недельного «отмывочного периода», и животные получали одну i.v. инъекцию 10 мг/кг любого из химерных антител к CD127 (N13B2-IgG1, или N13B2-IgG4, или MD707-13-IgG4) за 1 сутки до этой второй сенсибилизации PPD. Третью IDR проводили после дополнительного 3-6-недельного «отмывочного периода» и животных оставляли необработанными. В некоторых случаях проводили четвертую IDR после еще одного 3-месячного «отмывочного периода» и животных также оставляли необработанными.
105 UFS; Sanofi Pasteur MSD, Лион, Франция) в верхнюю область нижней конечности за 4 и 2 недели до анализа кожной DTH. Для изучения антигенспецифичного Т-клеточного иммунитета перед анализом кожной DTH успешную иммунизацию подтверждали с помощью иммуноферментного спот-анализа (ELISPOT) интерферона (IFN)-g (набор для ELISPOT-анализа IFN-g примата, отличного от человека; R&D Systems, Миннеаполис, Миннесота, США) на свежевыделенных РВМС в соответствии с инструкциями производителя. Интрадермальные реакции (IDR) проводили с использованием дублирующих интрадермальных инъекций двух доз (1000 МУ или 2000 МУ) очищенного белкового продукта туберкулина (PPD; Symbiotics Corporation, Сан-Диего, Калифорния, США) в 0,1 мл в кожу на правой части спины животных. Солевой раствор (0,1 мл) использовали в качестве отрицательного контроля. Кожные реакции в местах инъекции измеряли с использованием штангенциркуля. Диаметр каждой уплотненной области эритемы измерялся двумя наблюдателями, начиная с Дней 3-8, и результат считался положительным, когда диаметр области составлял >4 мм. Записывали среднее значение показаний. Образцы биопсии кожи из места DTH или места введения контроля (солевого раствора) забирали в День 4 на месте одной дублирующей инъекции и помещали в реактив Tissue Tek для обеспечения оптимальной температуры получения срезов (OCT) (Sakura Finetek, Вильнев-д'Аск, Франция) для иммуногистохимического анализа. Вторую IDR проводили после 3-недельного «отмывочного периода», и животные получали одну i.v. инъекцию 10 мг/кг любого из химерных антител к CD127 (N13B2-IgG1, или N13B2-IgG4, или MD707-13-IgG4) за 1 сутки до этой второй сенсибилизации PPD. Третью IDR проводили после дополнительного 3-6-недельного «отмывочного периода» и животных оставляли необработанными. В некоторых случаях проводили четвертую IDR после еще одного 3-месячного «отмывочного периода» и животных также оставляли необработанными.
Пример 16
Экспрессия α4β7 на поверхности Т-клеток in vitro и in vivo в мышиной модели
Для измерения индуцируемой IL-7 экспрессии а407 на поверхности Т-клеток человеческие Т-лимфоциты стимулировали в течение 9 суток при 37°С с использованием IL-7 (AbD Serotec, код РНР046) в концентрации 5 нг/мл. Реакцию останавливали при 4°С и промывали перед окрашиванием меченым PerCP/Cy5 антителом к α4 (BD Bioscience, 563644, клон 9F10) и меченым РЕ антителом к β7 (BD Bioscience, клон FIB504). Положительные в отношении α4-интегрина клетки, а затем β7-положительные клетки подвергали измерению с помощью проточной цитометрии. Гуманизированное антитело N13B2 добавляли в День 0 в культуру клеток в разных концентрациях, составляющих от 0,01 до 20 мкг/мл.
In vivo, 40×106 человеческих мононуклеарных клеток периферической крови вводили инъекцией внутрибрюшинно подвергшимся облучению иммунодефицитным мышам (NOD/SCID/нокаутным по гамма-цепи рецептора IL-2 мышам). Через две недели после обработки контрольным буфером (n=5) или mAb N13B2 (5 мг/кг, n=5) процент β7-положительных Т-лимфоцитов в крови измеряли с помощью проточной цитометрии и приживление β7-положительных человеческих Т-лимфоцитов измеряли с помощью проточной цитометрии. Это приживление измеряли с помощью проточной цитометрии посредством отделения человеческих CD45-положительных клеток от мышиных CD45-положительных клеток с использованием специфичных антител (PECy7 антитело к человеческому CD45 от BD, код 57748, и PerCPCy5.5 антитело к мышиному CD45 от BD, код 550994), затем анализировали человеческие β7-положительные клетки (BD Bioscience, клон FIB504).
Пример 17
Определение антигенного профиля антител с использованием микроматриц с пептидами
Микроматрицы с пептидами PepStarTM от Peptide Technologies содержат очищенные синтетические пептиды, полученные из антигенов или других источников, которые хемоселективно и ковалентно иммобилизированы на стеклянной поверхности. Оптимизированный гидрофильный линкерный фрагмент вводили между стеклянной поверхностью и полученной из антигена пептидной последовательностью во избежание получения ложноотрицательных результатов, вызванных стерйческим несоответствием. По техническим причинам все пептиды содержали С-концевой глицин. Эксперименты по определению антигенного профиля образцов выполняли на пептидной библиотеке, состоящей из 52 пептидов. Полный перечень пептидов приведен ниже.
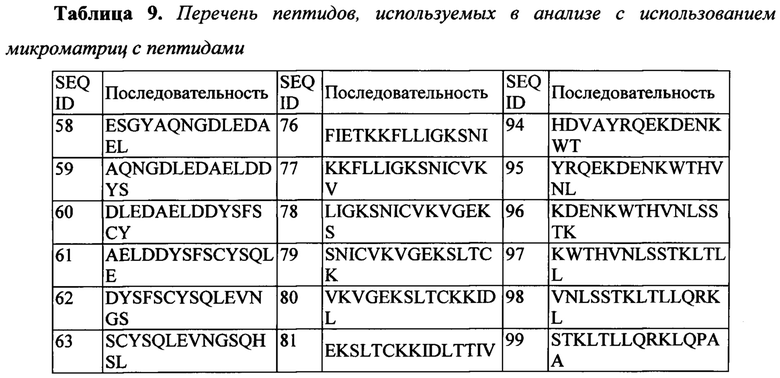
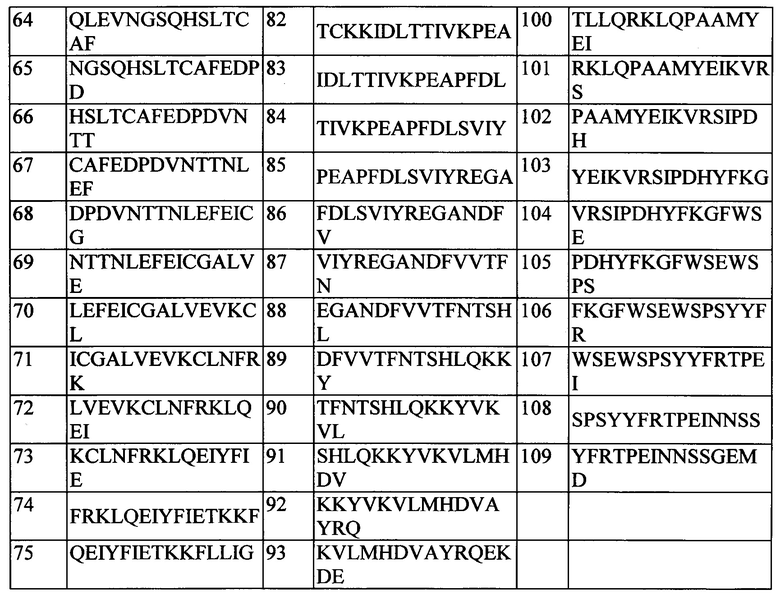
В сумме 9 образцов инкубировали на стеклах с микроматрицами с использованием многолуночного формата. Для антитела N13B2 и других образцов применяли 4 разные концентрации (10, 1, 0,1 и 0,01 мкг/мл). Инкубирование одного отрицательного контроля (только вторичное антитело) осуществляли параллельно. Белки человеческого и мышиного IgG подвергали совместной иммобилизации наряду с каждым набором пептидов, чтобы они служили в качестве контролей при анализе. Все процедуры инкубирования осуществляли параллельно с использованием двух стекол. Две пептидные мини-матрицы на каждом стекле использовали в качестве контроля инкубирования, внося на них только содержащее флуоресцентную метку выявляющее антитело для оценки ложноположительного связывания с пептидами. После промывания и высушивания стекол их сканировали с использованием лазерного сканера с высокой разрешающей способностью при длине волны 635 нм с получением изображений данных интенсивностей флуоресценции. Изображения подвергали количественной оценки для получения среднего значения интенсивности пикселя для каждого пептида. Вторичное антитело к крысиному IgG (JIR 212-175-082), меченое Cy5 в концентрации 1 мкг/мл. Буферы и растворы Используемый буфер представлял собой TBS-буфер, включающий в себя 0,05% Tween20 (JPT), и Т20 буфер для анализа (Pierce, SuperBlock TBS Т20, #37536). Сбор и анализ осуществляли с использованием микроматриц с пептидами (JPT Peptide Technologies GmbH, Берлин, Германия; партия №2668), многолуночной инкубационной камеры, сканера Axon Genepix Scanner 4200AL, программного обеспечения для распознавания пятен GenePix и Microsoft Excel, R.
Пример 18
Картирование эпитопов с помощью масс-спектрометрического анализа
Масс-спектрометрию использовали для идентификации конформационного эпитопа. Определение последовательности эпитопа выполняли с использованием масс-спектрометра с MALDI. Этот инструмент обеспечивает возможность анализа пептидной последовательности весом от 800 до 4000 Да. Расщепление белка, представляющего интерес, позволяет разрезать белок на небольшие фрагменты (потенциальные эпитопы). В идеале, расщепляющий фермент должен осуществлять разрезание как можно ближе к границам эпитопа. Выбор расщепляющего фермента следует выполнять с учетом частоты разрезания ферментом в последовательности рекомбинантного белка. Второе расщепление предусматривается для уменьшения размера эпитопов, полученных в конце первого расщепления. В зависимости от выбранного фермента профили значительно отличаются. Ферментом, характеризующимся наилучшим распределением расщепленных фрагментов по последовательности, является химотрипсин. Вторым ферментом с подходящей частотой разрезания и хорошим распределением расщепленных фрагментов по последовательности, представляющей интерес, является Glu C.
Поскольку эпитоп является конформационным, предпочтение отдают расщеплению комплекса в ходе аффинной хроматографии. Идентификация последовательности, представляющей интерес, основывается на защите эпитопа от ферментативного расщепления посредством образования комплекса антиген-антитело. После прохождения аффинной хроматографии и расщепления фрагменты эпитопа элюируют и определяют последовательность при помощи масс-спектрометрии (MALDI-TOF-TOF Bruker). 3D-структура белка, представляющего интерес, является доступной, и ее сравнивают с полученными результатами.
Последовательность в базе данных Uniprot под номером доступа Р16871 [21-239] (Seq ID No: 114): соответствует топологическому домену альфа-субъединицы рецептора интерлейкина 7 Homo Sapiens:
ESGYAQNGDLEDAELDDYSFSCYSQLEVNGSQHSLTCAFEDPDVNTTNLEFEICGALVEVKCLNFRKLQEIYFIETKKFLLIGKSNICVKVGEKSLTCKKIDLTTIVKPEAPFDLSVIYREGANDFVVTFNTSHLQKKYVKVLMHDVAYRQEKDENKWTHVNLSSTKLTLLQRKLQPAAMYEIKVRSIPDHYFKGFWSEWSPSYYFRTPEINNSSGEMD
Определенные in silico возможные варианты выбора фермента, расщепляющего CD127, (см. подчеркнутые аминокислоты выше в последовательности, соответствующей Seq ID No: 114): Химотрипсин выбрали в качестве расщепляющего фермента. Сайты разрезания (жирные линии), количество пептидов, частота разрезания являются подходящими. Фермент Glu-C выбирали в качестве второго расщепляющего фермента. Количество полученных пептидов с весом, составляющим от 800 до 4000 Да, является подходящим. Частота разрезания Glu-C и расположение сайтов разрезания (тонкая линия) являются подходящими. Используемая процедура является традиционной и хорошо известна специалисту в данной области техники, также она описана в Suckau et al., 1990, и Рарас et al., 1994.
Материалы и реактивы: масс-спектрометр MALDI-TOF/TOF II de Bruker; Hi-trap NHS колонки (код: 17-0716-01 - GE healthcare); химотрипсин (код: 11418467001 - Roche); Glu С (код: 11420399001 - Roche); Zip/TIP C18 (код: ZTC18S096 - Millipore); бикарбонат аммония (код: 09830 - Sigma); глицин (код: G7126 - Sigma); NaCl (код: 27800.360-VWR).
Фаза 1. Расщепление несвязанного белка и антитела в растворе. Расщепление в растворе несвязанного антигена и антитела химотрипсином или Glu С в течение 1 часа, 2 часов, 3 часов, 4 часов, 5 часов и в течение ночи при комнатной температуре или при 37°С. Анализ расщепленных пептидов осуществляли посредством масс-спектрометрии (MS) расщепленных пептидов. Эти эксперименты позволяют установить подходящие условия для ферментативного расщепления (время и температура). Цель заключается в том, чтобы иметь достаточное расщепление антигена при минимальном воздействии на структуру антитела, насколько это возможно. Определенными оптимальными условиями были следующие: Расщепление химотрипсином: 1 час при комнатной температуре; расщепление Glu-C: в течение ночи при 37°С. Каждый расщепленный фрагмент антигена и антитела анализируют с помощью масс-спектрометрии MALDI-TOF/TOF.
Фаза 2. Полное расщепление комплекса из целого связанного Ас + целого антигена. Связывание моноклонального антитела N13B2-G1 к CD127 (партия 210415) осуществляли на Hi-Trap NHS колонке, следуя стандартной процедуре. Захват антигена антителом на колонке осуществляли в течение 1 часа, что обеспечивало возможность образования комплекса антиген-антитело. Эффективность связывания антитела N13B2-G1 на четырех колонках Hi-Trap NHS была следующей: 84%, 84%, 83% и 83%. Получали соответствующие и идентичные продукты связывания.
Расщепление комплекс осуществляли при соотношении 1/50, или 1 мг фермента на 50 мг антитела, при температуре и в течение периода, определенных с помощью вышеупомянутых контрольных экспериментов. Колонку затем промывали промывочным буфером (25 мМ бикарбонат аммония) для удаления и выделения несвязанных пептидов антигена. Стадию промывания в буферном солевом растворе (PBS-2M NaCl) также осуществляли для удаления неспецифичных пептидов. После промывания осуществляли элюирование с использованием растворителя для элюирования (50 мМ глицин с pH 2), чтобы специфично экстрагировать и выделить специфично связавшиеся пептиды (которые по прогнозу соответствуют эпитопу).
MALDI анализ: фракции, полученные в результате промывания и элюирования, концентрировали с помощью гидрофобной хроматографии на С18 матрице. Затем их анализировали с помощью масс-спектрометрии MALDI-TOF/TOF. В MS-анализе можно точно измерить массу пептидов, и сравнение полученных в эксперименте масс с теоретическими массами у пептидов, полученных в результате расщепления in silico несвязанного антигена, обеспечивает возможность идентификации пептидов; MS/MS анализ можно осуществлять для подтверждения последовательности пептида, если это необходимо.
Спектр элюата после расщепления химотрипсином выявил присутствие пептидов с массой, составляющей: 912,49; 1086,47; 1843,03; 2104,16; 1944,97; 1564,73; 1835,97; 2022,05; 2424,22 и 2858,42 Да, которые могут соответствовать пептидам антигена в таблице 10 ниже.


Спектр элюата после расщепления Glu-C выявлял присутствие расщепленных пептидов из белка, представляющего интерес, с массой, составляющей 1200,43; 1309,68; 2108,97; 2191,04; 2699,43; 3170,68 и 3264,70 Да, которые могут соответствовать пептидам антиген в таблице 11 ниже.

Два расщепления позволили авторам настоящего изобретения идентифицировать три сайта (Таблица 12 ниже), вовлеченные во взаимодействие между hN13B2 и антигеном CD127. Пептиды, полученные на этапе промывки солевым буферным раствором, исключали для ограничения последовательностей, представляющих.

Картирование эпитопов для антитела N13B2 на антигене CD127 показало 3 разные последовательности, важные для активности антитела в отношении пути с участием IL-7/CD127 (фиг. 27). По результатам 3D-кристаллографического анализа взаимодействия IL-7/CD127 (McElroy et al, Structure 2009, PDB:3DI2) две из последовательностей (Seq ID  115 и ID
115 и ID  117) являются близкими в плане структуры и располагаются в участке, вовлеченном в связывание IL-7 с CD127. Третья идентифицированная последовательность (seq ID
117) являются близкими в плане структуры и располагаются в участке, вовлеченном в связывание IL-7 с CD127. Третья идентифицированная последовательность (seq ID  116) располагается в сайте 2b в домене D2 рецептора, домене, который согласно прогнозу взаимодействует с CD132, гамма-цепью рецептора (Walsh et al, 2012). N13B2 распознает конформационный эпитоп на CD127, расположенный в 2 частях белка, который ингибирует взаимодействие IL-7-CD127 и образование гетеродимера CD127-CD132. Связывание N13B2 должно дестабилизировать образование «тройного комплекса IL-7Ra/IL-7/g-цепь», как предсказывалось Walsh ST, что блокирует интернализацию комплекса.
116) располагается в сайте 2b в домене D2 рецептора, домене, который согласно прогнозу взаимодействует с CD132, гамма-цепью рецептора (Walsh et al, 2012). N13B2 распознает конформационный эпитоп на CD127, расположенный в 2 частях белка, который ингибирует взаимодействие IL-7-CD127 и образование гетеродимера CD127-CD132. Связывание N13B2 должно дестабилизировать образование «тройного комплекса IL-7Ra/IL-7/g-цепь», как предсказывалось Walsh ST, что блокирует интернализацию комплекса.
Пример 19
Результаты
Как описано ранее (Henriques et al., 2010), IL-7 сам по себе индуцирует быструю интернализацию (30-40%) альфа-цепи (CD127) рецептора IL-7 на поверхности Т-лимфоцитов, что необходимо для опосредованной IL-7 передачи сигнала. В данном документе авторы настоящего изобретения описывали, что mAb N13B2 предотвращает индуцируемую IL-7 интернализацию CD127 и само не индуцирует эту интернализацию (фиг. 16). В отличие от этого, авторы настоящего изобретения описывали, что клон 1A11 антитела к человеческому CD127 от GSK (патентная заявка WO 2011094259) резко снижает экспрессию CD127 на поверхности Т-лимфоцитов пери применении его отдельно или в комбинации с IL-7 при 37°С (фиг. 16). Этот эффект наблюдали с использованием дифференциального окрашивания несколькими коммерческими антителами к IL-7R (eBioRDR5 и МВ15-18С9, данные не показаны). После внутривенного введения химерного mAb N13B2 (в формате с Fc-доменом человеческого IgG1 или IgG4) в концентрации 10 мг/кг приматам, отличным от человека, авторы настоящего изобретения в ходе измерений не наблюдали снижения экспрессии CD127 на поверхности Т-лимфоцитов в течение 2-недельного периода последующего наблюдения (фиг. 17В). В отличие от этого, у других приматов, отличных от человека, параллельно обработанных внутривенно 10 мг/кг клона MD707-13 антитела к человеческому CD127 (в формате с Fc-доменом человеческого IgG4; WO 2013/056984), авторы настоящего изобретения наблюдали значительное снижение (60%) CD127 на поверхности Т-лимфоцитов (фиг. 17В). Информация об этой интернализации CD127 после связывания mAb к человеческому CD127 на Т-лимфоцитах, также ранее публиковалась группой Pfizer, где было описано, что их mAb к человеческому CD127 (клон HAL-H3L4, патент США №8637273) значительно индуцирует интернализацию CD127 ex vivo на человеческих клетках крови и клетках крови примата, отличного от человека, а также in vivo после внутривенного введения приматам, отличным от человека, (Kern et al., 2013).
В недавней публикации за авторством Kern et al. (Kern et al., 2015) исследовали занятость CD127 и проводили конкурентные анализы. Клон HIL-7R-M21 антитела к CD127 от BD biosciences, как было показано, конкурировал с антителом HAL/Ab1 (от группы Pfizer) за связывание с CD127. Как показано на фиг. 16 в соответствии с настоящим изобретением, антитело HAL (клон H3L4, патент США №8637273) сравнивали с N13B2 и 1А11 с точки зрения экспрессии и интернализации CD127. Эти результаты показали конкуренцию между антителом HAL и HIL-7R-M21, подтверждая данные Kern et al., 2015. Тем не менее N13B2 не конкурирует с HIL-7R-M21. Kern и соавт. также показали, что HAL/Ab1 сам по себе индуцирует in vivo понижающую регуляцию экспрессии CD127 на клеточной поверхности спустя 4-8 часов после инъекции. Эти результаты являются сравнимыми с результатами, представленными на фиг. 17В в соответствии с настоящим изобретением с клоном MD707-13. На фиг. 17В показана понижающая регуляции экспрессии на клеточной поверхности спустя 4-10 суток после инъекции антитела. Также наблюдали, что этот in vivo эффект может коррелировать с МD707-13-зависимой интернализацией CD127 в клетку in vitro.
В исследовании эпитопов с помощью микроматриц с пептидами и масс-спектрометрии идентифицировали конформационный эпитоп, распознаваемый N13B2 на CD127. Этот эпитоп располагается в доменах D1 и D2, в отличие от антител из уровня техники, которые распознают эпитоп, расположенный только в D1 (пример 17). Более того, на фиг. 16 показано, что антитела из уровня техники индуцируют интернализацию CD127, тогда как N13B2 не индуцирует. Таким образом, авторы настоящего изобретения сделали вывод, что свойство N13B2 заключается в том, что оно не индуцирует интернализацию CD127, коррелирует с его свойством, заключающемся в распознавании эпитопа, расположенного в обоих доменах D1 и D2.
В общем, эти, а также ранее описанные результаты показали, что mAb к человеческому CD127 (клон 1A11, клоны HAL/Ab1 и H3L4 и клон MD707-13), которые, как описано, блокируют связывание IL-7 на рецепторе IL-7, также индуцируют интернализацию альфа-цепи рецептора IL-7, которая находилась в ассоциации с рецептором IL-7 и требовалась для передачи сигнала с его участием. Неожиданно и в отличие от этого, mAb N13B2 имеет уникальное свойство, заключающееся в том, что оно не индуцирует интернализацию CD127 и предотвращает такую интернализацию, индуцируемую IL-7. Эти результаты должны коррелировать с наблюдением, что mAb-индуктор интернализации CD127 (например, клон MD707-13), которые являются эффективными in vitro для предотвращения передачи сигнала с участием рецептора IL-7 (например, фосфорилирование STAT5, фиг. 14В), не способны предотвращать иммунные реакции клеток памяти (фиг. 21) или гуморальные иммунные реакции (фиг. 22) in vivo. В отличие от этого, авторы настоящего изобретения описали, что mAb N13B2, которое эффективно блокирует передачу сигнала с участием рецептора IL-7 (фосфорилирование STAT5), но не индуцирует интернализацию CD127 ex vivo на человеческих Т-лимфоцитах и in vivo у приматов, отличных от человека, предотвращает реакции гиперчувствительности замедленного типа с участием клеток памяти (фиг. 21), а также иммунизацию в ответ на ксеногенные бараньи эритроциты (фиг. 22). Хотя не наблюдалось различия между изотипом N13B2 в отношении контроля гуморальной реакции клеток памяти, авторы настоящего изобретения заметили, что N13B2 в формате IgG4 было более эффективным в предотвращении реакций с участием клеток памяти по сравнению с IgG1. Не наблюдали различий в плане воздействия mAb и их концентраций в сыворотке между животными, обработанными MD707-13 и обработанными N13B2. Аналогично, авторы настоящего изобретения также наблюдали значительное повышение количества регуляторных Т-лимфоцитов у животных, обработанных любым из mAb N13B2 или MD707-13 (фиг. 22).
Человеческий IL-7 индуцировал сильную экспрессию α4- и β7-интегринов in vitro на человеческих Т-лимфоцитах и резко повышал частоту обнаружения человеческих Т-лимфоцитов, экспрессирующих α4-, β7- и α4/β7-интегрины (фиг. 19А), которые требуются для хоуминга Т-лимфоцитов и их удержания в тканях, не относящихся к лимфоидным, таких как ткани кишечника, головного мозга и кожи (Gorfu et al., 2009, DeNucci et al., 2009). Соответственно, авторы настоящего изобретения наблюдали, что mAb N13B2 дозозависимо ингибирует in vitro экспрессию и α4, и β7, а также снижает частоту обнаружения α4-положительных и α4/β7-положительных человеческих Т-лимфоцитов (фиг. 19В). Аналогично, после переноса человеческих мононуклеарных клеток периферической крови в иммунодефицитных мышей, авторы настоящего изобретения наблюдали, что антитело N13B2 значительно и быстро снижает процент β7-положительных Т-лимфоцитов, а также количество (i.d. приживление) этих клеток после одной (данные не показаны) и двух недель обработки (фиг. 20). Результаты, полученные в двух разных моделях воспаления, показывают, что антитело N13B2 к IL-7Rα может являться эффективным лечебным средством против воспалительных заболеваний и, в частности, при колите.
Пример 20
Создание конформационного эпитопа
Пептиды CLIPS можно использовать для соответствующей имитации нативной вторичной и третичной структуры антигена с целью преобразования этих пептидов CLIPS в активные и сильнодействующие иммуногены, которые индуцируют желаемые антитела (Boshuizen et al, 2014). Технология CLIPS включает циклизацию (многократную) линейных пептидов посредством реакции с небольшой жесткой молекулой (химический остов), которая несет 2, 3 или 4 якорные точки. Якорные группы реагируют исключительно с одним типом функциональных групп пептида (т.е. тиолами) и прикрепляются к пептиду посредством многих ковалентных связей. Пептид сворачивается вокруг остова и теряет гибкость, при этом медленно принимая четко определенную трехмерную структуру с молекулой остова в центре, подобную «пауку в паутине».
В технологии используются полностью синтетические специально разработанные остовы. Остовы CLIPS варьируют преимущественно по размеру, полярности, жесткости, растворимости, функциональным группам и расстоянию «разделяющему SS-связи». Эти остовы используются для прикрепления свободных концов пептида. При надлежащем расположении внутри пептидной последовательности, полученный в результате пептид CLIPS, вероятно, имеет намного большее сходство с 3D-структурой соответствующего участка на интактном белке по сравнению с линейной последовательностью. CLIPS-циклизации можно осуществлять на нативных остатках L-цистеина, но также на искусственно введенных D- и L-(гомо)цистеинах в практически любом желательном положении в последовательности. Следовательно, структуру и размеры скрепленных с помощью CLIPS пептидов можно изменять, как угодно. Реакция циклизации длится не более 30 мин., проходит при комнатной температуре и не требует какого-либо вида катализатора. Более того, ее можно осуществлять полностью в водных условиях и при нейтральном pH (7,5-8,0), и, следовательно, она является совместимой с высокочувствительными биологическими системами, подобными бактериофагам. Наконец, реакции можно проводить в условиях сильного разведения (10-100 мкМ), что способствует высоким выходам циклических продуктов и избегает полимеризации. Эта технология является очень универсальной, и она уникальна в плане простоты ее применения.
Стремясь реконструировать как линейные, так и прерывающиеся эпитопы для антитела к рецептору, линейные перекрывающиеся пептиды из множества мономерных звеньев синтезируют непосредственно на полипропиленовых планшетах размером с кредитную карту, причем их С-конец ковалентно присоединен к дну каждой лунки с объемом 3 мкл (455 лунок на планшет), и каждая лунка содержит разный пептид. В каждом из однодоменных пептидов циклизованный дицистеиновый мостик образовывали для встраивания ограничивающей петли в прикрепленный к планшету пептид. В Teeling et al, 2006, объясняется, как создавать циклизованные пептиды с пептидами, представляющими интерес, с целью воссоздания прерывающегося эпитопа, распознаваемого антителом, представляющим интерес. Вкратце, вначале синтезировали связанные с планшетом дицистеин-содержащие пептиды, у которых цистеины были разделены 4-13 аминокислотами в пептиде, например, СХХХХС-планшет, ХХХСХХХХСХХХХХХ-планшет или СХХХХС-планшет и т.д. Пептиды затем циклизировали посредством обработки а,а-дибромксилолом в водном растворе с получением цистеиновых петель, содержащих разные количества аминокислот. Эта химическая модификация обеспечивает более стабильные петли, чем дисульфидные мостики. (Niederfellner et al, 2011)
Пример 21
Совместное иммуноосаждение CD127 и γc
Для исследования эффекта антитела N13B2 и антител из уровня техники в отношении связывания CD127 с γc-цепью эксперимент по совместному иммуноосаждению осуществляли в клетках, стимулируемых IL-7 и инкубируемых в отсутствие антител или в присутствии антител MD707-13 или N13B2. В отсутствие антител было показано, что CD127 и γc подвергаются совместному иммуноосаждению. Инкубирование клеток с MD707-13 не предотвращало это совместное иммуноосаждение, тогда как инкубирование с N13B2 приводило к отсутствию такого совместного иммуноосаждения. Разработанное авторами настоящего изобретения антитело, таким образом, способно нарушать связывание CD127 с γс-цепью, тогда как антитела из уровня техники не характеризуются таким признаком.
Для совместного иммуноосаждения комплекса CD127-CD132-IL-7 в присутствии антитела к CD127, человеческие PBL инкубировали с крысиным антителом к hCD127 (крысиное N13B2 или MD707-13 в концентрации 10 мкг/мл) в течение 30 мин. при 37°С перед стимуляцией IL-7 (AbD Serotec, код РНР046) в концентрации 5 нг/мл в течение 15 мин при 37°С. Реакцию останавливали при 4°С и промывали два раза холодным PBS перед добавлением лизирующего буфера из набора для совместного иммуноосаждения (набор Pierce Direct IP kit, код 26148).
Колонку для очистки с использованием антитела к человеческому CD127 готовили с использованием набора для совместного иммуноосаждения (набор Pierce Direct IP kit, код 26148). С колонкой связывали 75 мкг неконкурирующего крысиного антитела к человеческому CD127 (Effimune, MD707-9), следуя процедуре, рекомендованной производителем. Лизат подвергали предварительной очистке на несвязанной колонке с целью удаления молекул, приводящих к неспецифическому связыванию. Затем лизат добавляли в колонку с антителом к CD127 и инкубировали 2 часа при 4°С при перемешивании на роликовой мешалке. Колонку промывали дважды промывочным буфером, а затем элюировали буфером для элюирования. Выделенные образцы анализировали с помощью метода вестерн-блоттинга.
В случае вестерн-блоттинга готовили SDS-Page гель (10% для разделяющего, 4% для концентрирующего геля толщиной 1,5 мм) и 50 мкл денатурированного элюата (для денатурации: DTT 0,1 М и 10 мин. при 95°С) добавляли в каждую лунку. Рекомбинантный белок CD127Fc (Sino Biologicals, Пекин, Китай; код 10975-Н08Н) и CD132Fc (Sino Biologicals, Пекин, Китай; код 10555-Н02Н) добавляли (5 мкг/лунку) в качестве контроля для выявления с помощью метода вестерн-блоттинга. После миграции в течение 1 часа 30 минут при 200 В, и переноса на нитроцеллюлозную мембрану в течение 35 мин. при 20 В выполняли насыщение в течение 2 часов при комнатной температуре в 5% молоке.
Для начала выявления кроличье антитело к человеческому CD132 (anticorps-en-ligne, Франция, код ABIN741840) добавляют в соотношении 1/50 в течение ночи при 4°С, а затем выявляют с использованием меченого пероксидазой козьего антитела к антителу кролика (Jackson Immunoresearch, код 111-035-144) в соотношении 1/2000 в течение 1 часа при комнатной температуре. После дегибридизации мембрану инкубировали с крысиным антителом к человеческому CD127 (Effimune, MD707-9) в соотношении 1/200 в течение ночи при 4°С и выявляли с использованием меченого пероксидазой ослиного антитела к крысиному антителу (Jackson Immunoresearch, код 712-035-153) в соотношении 1/1000 в течение 1 часа при комнатной температуре. В случае каждого выявления ECL (Thermo Scientific, код 34080) использовали для выявления пероксидазы посредством хемолюминисценции и результаты считывали с использованием камеры Fuji 4000.
На фиг. 28 показаны результаты совместного иммуноосаждения комплекса CD127/IL-7/CD132. Авторы наблюдали, что цепь CD132 (60 кДа) подвергается совместному иммуноосаждению с CD127 в любых условиях, за исключением тех, когда клетки инкубировали с антителом N13B2 (28А). Тем не менее, в каждом наборе условий CD127 (70 кДа) хорошо подвергается иммуноосаждению антителом MD707-9, что показано на фиг. 28В, это указывает на то, что N13B2 и MD707-13 не конкурирует с MD707-9 за распознавание CD127. Антитело N13B2 ингибирует образование комплекса CD127/CD132 в присутствии IL-7. Эти результаты согласуются с картированием эпитопов для антитела N13B2 на CD127, показывающим, что N13B2 связывается с аминокислотной последовательностью в пределах сайта 2b в домене D2 альфа-цепи IL-7R (Walsh et al, Immunol rev. 2012).
Вместе эти результаты показали, что антитело N13B2 является антагонистом взаимодействия IL-7/CD127, а также является антагонистом взаимодействия CD127/CD132 в сайте 2b в присутствии IL-7, что может объяснять ингибирующую активность антитела в отношении интернализации CD127, наблюдаемой с IL-7 и/или антителами к CD127 из уровня техники.
Следующие пронумерованные варианты осуществления составляют предпочтительные варианты осуществления настоящего изобретения.
1. Антитело, или антигенсвязывающий фрагмент антитела, или антигенсвязывающий миметик антитела, которые специфично связываются с CD127, и не индуцируют интернализацию CD127.
2. Антитело или его антигенсвязывающий фрагмент или миметик, в частности, в соответствии с вариантом осуществления 1, которые ингибируют индуцируемую IL-7 интернализацию CD127.
3. Антитело или его антигенсвязывающий фрагмент или миметик в соответствии с вариантом осуществления 1 или 0, причем экспрессия CD127 на клеточной поверхности у обработанный IL-7 клеток в присутствии антитела или фрагмента составляет по меньшей мере 80%, предпочтительно по меньшей мере 90% от ее уровня у клеток, инкубируемых в отсутствие антитела.
4. Антитело или его антигенсвязывающий фрагмент, которые специфично связываются с CD127 и тем самым нарушают связывание CD127 с общей γс-цепью цитокиновых рецепторов.
5. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-0, которые нарушают связывание CD127 с общей γс-цепью цитокиновых рецепторов при связывании с CD127.
6. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 0 или 0, в присутствии которого количество γс, связавшееся с CD127, составляет менее чем 80%, предпочтительно менее чем 50%, еще более предпочтительно менее чем 25% или 10% от указанного количества, измеренного в отсутствие антител в идентичных в других отношениях условиях, в частности, когда указанное измерение осуществляют на клеточных лизатах, содержащих молекулярные комплексы, содержащие CD127, из интактных клеток, экспрессирующих рецептор IL-7 на клеточной поверхности, инкубируемых в присутствии или в отсутствие указанных антител.
7. Антитело или его антигенсвязывающий фрагмент или миметик в соответствии с любым из вышеуказанных вариантов осуществления, которые являются антагонистами передачи сигнала с участием IL-7R, индуцируемой IL-7.
8. Антитело или его антигенсвязывающий фрагмент или миметик, в частности, в соответствии с любым из вышеуказанных вариантов осуществления, которые специфично связываются с антигеном в соответствии с любым из вариантов осуществления 53-67 или эпитопом в указанном антигене.
9. Антитело или его антигенсвязывающий фрагмент или миметик, которые специфично связываются с CD127, в частности, в соответствии с любым из вышеуказанных вариантов осуществления, что не повышает созревание дендритных клеток, индуцируемое TSLP.
10. Антитело или его антигенсвязывающий фрагмент или миметик в соответствии с любым из вышеуказанных вариантов осуществления, которые ингибируют экспрессию α4-, β7- и/или α4/β7-интегринов.
11. Антитело или его антигенсвязывающий фрагмент или миметик в соответствии с вариантом осуществления, 10 которые ингибирует экспрессию α4-, β7- и/или α4/β7-интегринов in vivo, в частности, в человеческих Т-клетках, вводимых инъекцией иммунодефицитной мыши.
12. Антитело или его антигенсвязывающий фрагмент или миметик, которые специфично связываются с CD127, в частности, в соответствии с любым из вышеуказанных вариантов осуществления, содержащие VH-цепь, которая содержит по меньшей мере одну из следующих аминокислотных последовательностей:
- VHCDR1 SEQ ID No: 10;
- VHCDR2 SEQ ID No: 12;
- VHCDR3 SEQ ID No: 14 или SEQ ID No: 48; или
- VH SEQ ID No: 22;
и/или VL-цепь, содержащую по меньшей мере одну из следующих аминокислотных последовательностей:
- VLCDR1 SEQ ID No: 16 или SEQ ID No: 50;
- VLCDR2 SEQ ID No: 18 или SEQ ID No: 52;
- VLCDR3 SEQ ID No: 20; или
- VL SEQ ID No: 24.
13. Антитело или его фрагмент или миметик в соответствии с вариантом осуществления 12, которые содержат по меньшей мере две, три, четыре или пять последовательностей CDR, выбранных из группы, состоящей из VHCDR1 SEQ ID No: 10, VHCDR2 SEQ ID No: 12, VHCDR3 SEQ ID No: 14 или SEQ ID No: 48, VLCDR1 SEQ ID No: 16 или SEQ ID No: 50, VLCDR2 SEQ ID No: 18 или SEQ ID No: 52 и VLCDR3 SEQ ID No: 20.
14. Антитело или его фрагмент или миметик в соответствии с вариантом осуществления 13, которые содержат все шесть последовательностей CDR VHCDR1 SEQ ID No: 10, VHCDR2 SEQ ID No: 12, VHCDR3 SEQ ID No: 14 или SEQ ID No: 48, VLCDR1 SEQ ID No: 16 или SEQ ID No: 50, VLCDR2 SEQ ID No: 18 или SEQ ID No: 52 и VLCDR3 SEQ ID No: 20.
15. Антитело в соответствии с вариантом осуществления 14, в котором
- VH-цепь состоит из VH-цепи с последовательностью SEQ ID No: 2, или SEQ ID No: 6, или SEQ ID No: 54 или содержит последовательность SEQ ID No: 22 или SEQ ID No: 36 или SEQ ID No: 38 или SEQ ID No: 40; и
- VL-цепь состоит из VL-цепи с последовательностью SEQ ID No: 4 или SEQ ID No: 56 или содержит последовательность SEQ ID No: 24, или SEQ ID No: 42, или SEQ ID No: 44, или SEQ ID No: 46.
16. Антитело в соответствии с любым из вышеуказанных вариантов осуществления, которое представляет собой химерное антитело, или гуманизированное антитело, или деиммунизированное антитело.
17. Антитело в соответствии с вариантом осуществления 13, которое представляет собой гуманизированное и деиммунизированное антитело, в котором тяжелая цепь имеет последовательность SEQ ID No: 52, и легкая цепь имеет последовательность SEQ ID No: 54.
18. Макромолекула, которая представляет собой химерную молекулу, содержащую антитело или его антигенсвязывающий фрагмент или миметик в соответствии с любым из вышеуказанных вариантов осуществления, причем указанное антитело связано с функционально отличающейся молекулой, при этом указанная химерная молекула является либо слитым химерным белком, либо конъюгатом, полученным в результате ковалентного прикрепления химической группы или молекулы, такой как полимер PEG или меченое антитело.
19. Макромолекула в соответствии с любым из вышеуказанных вариантов осуществления, которая представляет собой аффитин или антикалин.
20. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вышеуказанных вариантов осуществления, которая связывается с CD127 с Kd, которая ниже чем 5Е-10 М, в особенности, ниже чем 1Е-10 М, в особенности, ниже чем 5Е-11 М.
21. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вышеуказанных вариантов осуществления, которая проявляет цитотоксическую активность в отношении CD127-положительных клеток.
22. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вышеуказанных вариантов осуществления, которая не повышает созревание дендритных клеток, индуцируемое TSLP, причем повышение созревания дендритных клеток, индуцируемое TSLP, оценивают посредством определения повышенной экспрессии маркера клеточной поверхности CD40 и/или CD80 в положительных по рецептору TSLP клетках, обработанных TSLP и указанной макромолекулой, по сравнению с клетками, обработанными только TSLP.
23. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с вариантом осуществления 22, причем экспрессия CD80 повышается не более чем на 25%, предпочтительно не более чем на 10% в положительных по рецептору TSLP клетках, обработанных TSLP и указанной макромолекулой, по сравнению с клетками, обработанными только TSLP.
24. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с вариантом осуществления 23, причем экспрессия CD80 не повышается или снижается в положительных по рецептору TSLP клетках, обработанных TSLP и указанной макромолекулой, по сравнению с клетками, обработанными только TSLP.
25. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик в соответствии с вариантом осуществления 22, причем экспрессия CD40 повышается не более чем на 50%, предпочтительно не более чем на 25% в положительных по рецептору TSLP клетках, обработанных TSLP и указанной макромолекулой, по сравнению с клетками, обработанными только TSLP.
26. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с вариантом осуществления 25, причем экспрессия CD40 не повышается или снижается в положительных по рецептору TSLP клетках, обработанных TSLP и указанной макромолекулой, по сравнению с клетками, обработанными только TSLP.
27. Молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент или макромолекулу в соответствии с любым из вышеуказанных вариантов осуществления.
28. Молекула нуклеиновой кислоты в соответствии с вариантом осуществления 27, которая кодирует аминокислоту, выбранную из группы, состоящей из SEQ ID No: 2; SEQ ID No: 4; SEQ ID No: 6; SEQ ID No: 8; SEQ ID No: 10; SEQ ID No: 12; SEQ ID No: 14; SEQ ID No: 16; SEQ ID No: 18; SEQ ID No: 20; SEQ ID No: 22; SEQ ID No: 24; SEQ ID No: 36; SEQ ID No: 38; SEQ ID No: 40; SEQ ID No: 42; SEQ ID No: 44; SEQ ID No: 46; SEQ ID No: 48; SEQ ID No: 50; SEQ ID No: 52; SEQ ID No: 54 и SEQ ID No: 56.
29. Молекула нуклеиновой кислоты в соответствии с вариантом осуществления 28, которая выбрана из группы, состоящей из SEQ ID No: 1; SEQ ID No: 3; SEQ ID No: 5; SEQ ID No: 7; SEQ ID No: 9; SEQ ID No: 11; SEQ ID No: 13; SEQ ID No: 15; SEQ ID No: 17; SEQ ID No: 19; SEQ ID No: 21; SEQ ID No: 23; SEQ ID No: 35; SEQ ID No: 37; SEQ ID No: 39; SEQ ID No: 41; SEQ ID No: 43; SEQ ID No: 45; SEQ ID No: 47; SEQ ID No: 49; SEQ ID No: 51; SEQ ID No: 53 и SEQ ID No: 55.
30. Вектор для клонирования и/или для экспрессии полинуклеотида в соответствии с любым из вариантов осуществления 27-29, в особенности, плазмида, подходящий для клонирования и/или экспрессии в клетках млекопитающего.
31. Клетка или клеточная линия, в которую был встроен посредством рекомбинации полинуклеотид в соответствии с любым из вариантов осуществления 27-30, в особенности, клетка или клеточная линия млекопитающего.
32. Фармацевтическая композиция, содержащая макромолекулу, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вариантов осуществления 1-26 с фармацевтическим носителем, причем указанная фармацевтическая композиция необязательно содержит дополнительный отличающийся активный ингредиент.
33. Фармацевтическая композиция, содержащая в качестве терапевтически активного ингредиента макромолекулу, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вариантов осуществления 1-26, или фармацевтическая композиция в соответствии с вариантом осуществления 32 в составе, подходящем для контроля дифференцировки/созревания дендритных клеток при введении пациенту-человеку.
34. Фармацевтическая композиция в соответствии вариантами осуществления 32 или 33, которая дополнительно содержит дополнительное соединение, характеризующееся терапевтическим иммуномодулирующим эффектом, в частности, в отношении клеток, вовлеченных в аутоиммунное заболевание или аллергическое заболевание, лейкоз, такой как острый лимфобластный лейкоз, лимфому, злокачественное заболевание, хроническую вирусную инфекцию, воспалительные заболевания, трансплантацию, респираторные заболевания или аутоиммунную реакцию.
35. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вариантов осуществления 1-26, или нуклеиновая кислота в соответствии с любым из вариантов осуществления 27-30, или клетка или клеточная линия в соответствии с вариантом осуществления 31 для применения в качестве терапевтически активного ингредиента в комбинации или в составе схемы дополнительной терапии у пациента, нуждающегося в этом.
36. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вариантов осуществления 1-26, или нуклеиновая кислота в соответствии с любым из вариантов осуществления 27-30, или клетка или клеточная линия в соответствии с вариантом осуществления 31, или фармацевтическая композиция в соответствии с любым из вариантов осуществления 32-34 для применения в лечении пациента, в частности, пациента-человека, с заболеванием.
37. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вариантов осуществления 1-26, или нуклеиновая кислота в соответствии с любым из вариантов осуществления 27-30, или клетка или клеточная линия в соответствии с вариантом осуществления 31, или фармацевтическая композиция в соответствии с любым из вариантов осуществления 32-34 для применения в лечении пациента, в частности, пациента-человека, с риском заболевания.
38. Макромолекула, нуклеиновая кислота, клетка, клеточные линии или фармацевтическая композиция для применения в соответствии с вариантом осуществления 36 и/или вариантом осуществления 37, причем заболевание представляет собой аутоиммунное заболевание, в частности, ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит и волчанку.
39. Макромолекула, нуклеиновая кислота, клетка, клеточные линии или фармацевтическая композиция для применения в соответствии с вариантом осуществления 36 и/или вариантом осуществления 37, причем заболевание представляет собой воспалительное заболевание, в частности, IBD и энцефаломиелит.
40. Макромолекула, нуклеиновая кислота, клетка, клеточные линии или фармацевтическая композиция для применения в соответствии с вариантом осуществления 36 и/или вариантом осуществления 37, причем заболевание представляет собой аллергическое заболевание.
41. Макромолекула, нуклеиновая кислота, клетка, клеточные линии или фармацевтическая композиция для применения в соответствии с вариантом осуществления 36 и/или вариантом осуществления 37, причем заболевание представляет собой злокачественное заболевание.
42. Макромолекула, нуклеиновая кислота, клетка, клеточные линии или фармацевтическая композиция для применения в соответствии с вариантом осуществления 36 и/или вариантом осуществления 37, причем заболевание представляет собой респираторные заболевания.
43. Макромолекула, нуклеиновая кислота, клетка, клеточные линии или фармацевтическая композиция для применения в соответствии с вариантом осуществления 36 и/или вариантом осуществления 37, причем заболевание связано с трансплантацией, в частности, является ее последствием.
44. Способ лечения, предусматривающий введение макромолекулы, в частности, антитела или его антигенсвязывающего фрагмента или миметика в соответствии с любым из вариантов осуществления 1-26, или нуклеиновой кислоты в соответствии с любым из вариантов осуществления 27-30, или клетки или клеточной линии в соответствии с вариантом осуществления 31, или фармацевтической композиции в соответствии вариантами осуществления 32-34 пациенту с заболеванием или с риском заболевания.
45. Способ лечения в соответствии с вариантом осуществления 44, причем заболевание представляет собой аутоиммунное заболевание, в частности, ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит и волчанку.
46. Способ лечения в соответствии с вариантом осуществления 44, причем заболевание представляет собой воспалительное заболевание, в частности, IBD и энцефаломиелит.
47. Способ лечения в соответствии с вариантом осуществления 44, причем заболевание представляет собой аллергическое заболевание.
48. Способ лечения в соответствии с вариантом осуществления 44, причем заболевание представляет собой злокачественное заболевание.
49. Способ лечения в соответствии с вариантом осуществления 44, причем заболевание представляет собой респираторные заболевания.
50. Способ лечения в соответствии с вариантом осуществления 44, причем заболевание связано с трансплантацией, в частности, является ее последствием.
51. Макромолекула, в частности, антитело или его антигенсвязывающий фрагмент или миметик, в соответствии с любым из вариантов осуществления 1-26, или нуклеиновая кислота в соответствии с любым из вариантов осуществления 27-30, или клетка или клеточная линия в соответствии с вариантом осуществления 31, или фармацевтическая композиция в соответствии с любым из вариантов осуществления 32-34 для применения в лечении пациента, в частности, пациента-человека, который нуждается в трансплантации, и/или которому вскоре предстоит трансплантация, и/или пациента, который перенес трансплантацию.
52. Способ лечения, предусматривающий введение макромолекулы, в частности, антитела или его антигенсвязывающего фрагмента или миметика в соответствии с любым из вариантов осуществления 1-26, или нуклеиновой кислоты в соответствии с любым из вариантов осуществления 27-30, или клетки или клеточной линии в соответствии с вариантом осуществления 31, или фармацевтической композиции в соответствии вариантами осуществления 32-34 пациенту, который нуждается в трансплантации, и/или которому вскоре предстоит трансплантация, и/или пациенту, который перенес трансплантацию.
53. Антиген, в котором эпитоп содержит или состоит из последовательностей из сайта 2b в CD127, в частности, содержащих по меньшей мере 3, 4, 5, 6 или 7 последовательных аминокислот из сайта 2b в CD127.
54. Антиген в соответствии с вариантом осуществления 53, в котором эпитоп содержит или состоит из последовательностей из сайта, состоящего из аминокислот 109-127 в SEQ ID No: 114, в частности, из сайта, состоящего из аминокислот 110-125, 112-125, 112-120, в частности, содержащих по меньшей мере 3, 4, 5, 6 или 7 последовательных аминокислот из указанного сайта.
55. Антиген в соответствии с любым из вариантов осуществления 53 или 54, в котором эпитоп содержит по меньшей мере 3, 4, 5, 6 или 7 последовательных аминокислот из CD127, при этом указанные последовательные аминокислоты содержат Р112 и/или L115.
56. Антиген в соответствии с любым из вариантов осуществления 53-55, в котором эпитоп состоит из или содержит последовательность SEQ ID No: 116, в частности, содержит последовательность SEQ ID No: 86.
57. Антиген в соответствии с любым из вариантов осуществления 53-56, в котором эпитоп также содержит последовательности, в частности, по меньшей мере 3, 4, 5, 6 или 7 последовательных аминокислот, из домена D1 в CD127, в частности, из аминокислот 1-98 в SEQ ID No: 114.
58. Антиген в соответствии с вариантом осуществления 57, в котором эпитоп содержит последовательность человеческого CD127, содержащую или состоящую из последовательности SEQ ID No: 115, в частности, содержащую или состоящую из SEQ ID No: 110.
59. Антиген в соответствии с любым из вариантов осуществления 53-58, в котором эпитоп также содержит последовательности, в частности, по меньшей мере 3, 4, 5, 6 или 7 последовательных аминокислот, из аминокислот 180-220 в SEQ ID No: 114, в частности, при этом указанные последовательности из аминокислот 180-220 в SEQ ID No: 114 состоят из или содержат последовательность SEQ ID No: 117, в частности, содержат или состоят из SEQ ID No: 111.
60. Антиген в соответствии с любым из вариантов осуществления 53-59, в котором эпитоп состоит из или содержит последовательности человеческого CD127, состоящие из:
последовательности SEQ ID No: 110 или последовательности SEQ ID No: 115;
последовательности SEQ ID No: 111 или последовательности SEQ ID No: 117; и
последовательности SEQ ID No: 86 или последовательности SEQ ID No: 116.
61. Антиген в соответствии с любым из вариантов осуществления 53-60, в котором эпитоп не содержит более чем 3, 4 или 5 последовательных аминокислот из последовательности аминокислот 99-108 в SEQ ID No: 114, и/или не содержит более чем 3, 4 или 5 последовательных аминокислот из последовательности аминокислот 128-179 в SEQ ID No: 114, и/или не содержит более чем 3, 4 или 5 последовательных аминокислот из последовательности аминокислот 220-239 в SEQ ID No: 114, в частности, не содержит более чем 3, 4 или 5 последовательных аминокислот из любой из указанных аминокислотных последовательностей в SEQ ID No: 114.
62. Антиген в соответствии с любым из вариантов осуществления 53 или 60, в котором последовательность эпитопа человеческого CD127, содержащая SEQ ID No: 111, не продолжается так, чтобы она содержала аминокислоты, смежные с указанной последовательностью в последовательности человеческого CD127 более чем на 1 аминокислоту с N-конца или более чем на 7 аминокислот с С-конца.
63. Антиген в соответствии с вариантом осуществления 61, в котором последовательность эпитопа человеческого CD127, содержащая SEQ ID No: 110, не продолжается так, чтобы она содержала любую из N-концевых и/или С-концевых аминокислот, смежных с указанной последовательностью в последовательности человеческого CD127.
64. Антиген в соответствии с любым из вариантов осуществления 53-63, в котором последовательность эпитопа человеческого CD127, содержащая SEQ ID No: 111, не продолжается так, чтобы она содержала аминокислоты, смежные с указанной последовательностью в последовательности человеческого CD127 более чем на 30 аминокислот с N-конца или более чем на 30 аминокислот с С-конца.
65. Антиген в соответствии с вариантом осуществления 64, в котором последовательность эпитопа человеческого CD127, содержащая SEQ ID No: 111, не продолжается так, чтобы она содержала любую из N-концевых и/или С-концевых аминокислот, смежных с указанной последовательностью в последовательности человеческого CD127.
66. Антиген в соответствии с любым из вариантов осуществления 53-65, в котором эпитоп представляет собой конформационный эпитоп, в частности, в котором пептиды из CD127, содержащиеся в указанном эпитопе, присутствуют в конформации, которая имитирует конформацию соответствующих пептидов в нативном CD127 или его внеклеточном домене, в частности, в CD127 в его мономерной форме без лиганда, в его форме, связанной с ус, и/или в его форме, связанной с IL-7.
67. Антиген в соответствии с вариантом осуществления 66, в котором эпитоп представляет собой конформационный эпитоп, в котором пептиды из CD127 связаны с жестким молекулярным остовом, который поддерживает их в желаемой конформации, в частности, такой антиген, полученный с использованием технологии CLIPS.
68. Эпитоп, который определен в любом из вариантов осуществления 53-67.
69. Нуклеиновая кислота, кодирующая антиген, который определен любым из вариантов осуществления 53-67.
70. Способ получения антитела, предусматривающий иммунизацию животного, отличного от человека, антигеном, который определен в любом из вариантов осуществления 53-67.
71. Способ отбора антитела, фрагмента антитела или миметика антитела, в частности, антитела, полученного, как описано в варианте осуществления 70, его фрагмента или миметика, предусматривающий стадию анализа связывающей способности указанного антитела в отношении по меньшей мере одного антигена, который определен в любом из вариантов осуществления 53-67, в частности, при этом указанный способ предусматривает несколько таких последовательных стадий, причем на каждой стадии анализируют связывающую способность в отношении отдельного пептида, состоящего из одной смежной последовательности в CD127.
72. Способ отбора макромолекулы, в частности, антитела, в частности, антитела, полученного, как описано в варианте осуществления 70, или антигенсвязывающего фрагмента или миметика такого антитела, предусматривающий или состоящий из стадии исследования связывающей способности макромолекулы в отношении CD127, в частности, в отношении его антигена, который определен в любом из вариантов осуществления 53-67, и необязательно проведения отбора макромолекул в соответствии с вариантом осуществления 20.
73. Способ отбора макромолекулы в соответствии с любым из вариантов осуществления 71 или 72, причем антиген содержит несколько несмежных пептидов в CD127, и при этом способ предусматривает несколько стадий, причем каждая из указанных стадий состоит из исследования связывающей способности макромолекулы в отношении одного из указанных пептидов CD127.
74. Способ, в частности, в соответствии с любым из вариантов осуществления 71-73, отбора макромолекулы, в частности, антитела, в частности, антитела, полученного, как описано в варианте осуществления 70, или антигенсвязывающего фрагмента или миметика такого антитела, предусматривающей или состоящий из стадии исследования интернализации CD127 в экспрессирующие CD127 клетки, индуцируемой присутствием макромолекулы.
75. Способ, в частности, в соответствии с любым из вариантов осуществления 71-74, отбора макромолекулы, в частности, антитела, в частности, антитела, полученного, как описано в варианте осуществления 70, или антигенсвязывающего фрагмента или миметика такого антитела, предусматривающей или состоящий из стадии исследования ингибирования макромолекулой индуцируемой IL-7 интернализации CD127 в экспрессирующие CD127 клетки и, необязательно, проведения отбора макромолекул в соответствии с вариантом осуществления 3.
76. Способ, в частности, в соответствии с любым из вариантов осуществления 71-75, отбора макромолекулы, в частности, антитела, в частности, антитела, полученного, как описано в варианте осуществления 70, или антигенсвязывающего фрагмента или миметика такого антитела, предусматривающей или состоящий из стадии анализа способности указанной макромолекулы к нарушению, посредством своего связывания с CD127, связывания CD127 с γc-цепью.
77. Способ, в частности, в соответствии с любым из вариантов осуществления 71-76, отбора макромолекулы, в частности, антитела, в частности, антитела, полученного, как описано в варианте осуществления 70, или антигенсвязывающего фрагмента или миметика такого антитела, предусматривающей или состоящий из стадии исследования повышения созревания DC, индуцируемого TSLP в присутствии макромолекулы, и, необязательно, проведения отбора макромолекул в соответствии с любым из вариантов осуществления 22-26.
78. Способ в соответствии с любым из вариантов осуществления 71-77, дополнительно предусматривающий одну или несколько из следующих стадий:
a. исследование ингибирования макромолекулой индуцируемой IL-7 передачи сигнала, в частности, фосфорилирования STAT5;
b. исследование ингибирования макромолекулой индуцируемой TSLP продукции TARC;
c. исследование ингибирования макромолекулой экспрессии α4-, β7- и/или α4/β7-интегринов, в частности, экспрессии на клеточной поверхности на Т-лимфоцитах.
Список литературы
Adams, А.В., Pearson, Т.С., and Larsen, С.Р. (2003). Heterologous immunity: an overlooked barrier to tolerance. Immunol. Rev. 196, 147-160.
Albuquerque, A.S., Cortesao, C.S., Foxall, R.B., Soares, R.S., Victorino, R.M.M., and Sousa, A.E. (2007). Rate of increase in circulating IL-7 and loss of IL-7Ralpha expression differ in HIV-1 and HIV-2 infections: two lymphopenic diseases with similar hyperimmune activation but distinct outcomes. J. Immunol. Baltim. Md 1950 178, 3252-3259.
Baca, M., Presta, L.G., O'Connor, S.J., and Wells, J.A. (1997). Antibody humanization using monovalent phage display. J. Biol. Chem. 272, 10678-10684.
Van Bodegom, D., Zhong, J., Kopp, N., Dutta, C., Kim, M.-S., Bird, L., Weigert, O., Tyner, J., Pandey, A., Yoda, A., et al. (2012). Differences in signaling through the B-cell leukemia oncoprotein CRLF2 in response to TSLP and through mutant JAK2. Blood 120, 2853-2863.
Boshuizen, R.S., Marsden, C, Turkstra, J., Rossant, C.J., Slootstra, J., Copley, C, and Schwamborn, K. (2014). A combination of in vitro techniques for efficient discovery of functional monoclonal antibodies against human CXC chemokine receptor-2 (CXCR2). mAbs 6, 1415-1424.
Bour-Jordan, H., Esensten, J.H., Martinez-Llordella, M., Penaranda, C., Stumpf, M., and Bluestone, J.A. (2011). Intrinsic and extrinsic control of peripheral T-cell tolerance by costimulatory molecules of the CD28/B7 family. Immunol. Rev. 241, 180-205.
Broux, В., Hellings, N., Venken, K., Rummens, J.-L., Hensen, K., Van Wijmeersch, В., and Stinissen, P. (2010). Haplotype 4 of the multiple sclerosis-associated interleukin-7 receptor alpha gene influences the frequency of recent thymic emigrants. Genes Immun. 11, 326-333.
Chassoux, D.M., Linares-Cruz, L.G., Bazin, H., and Stanislawski, M. (1988). K-cell-mediated cytotoxicity induced with rat monoclonal antibodies. I. Antibodies of various isotypes differ in their ability to induce cytotoxicity mediated by rat and human effectors. Immunology 65, 623-628.
Chothia, C., and Lesk, A.M. (1987). Canonical structures for the hypervariable regions of immunoglobulins. J. Mol. Biol. 196, 901-917.
Deininger, P. (1990). Molecular cloning: A laboratory manual: 2nd ed. Edited by J. Sambrook, E.F. Fritsch, and T. Maniatis. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989 (in 3 volumes). Anal. Biochem. 186, 182-183.
Delves, P.J., Martin, S.J., Burton, D.R., and Roitt, I.M. (2011). Roitt's Essential Immunology (John Wiley & Sons).
Denucci, C.C., Mitchell, J.S., and Shimizu, Y. (2009). Integrin function in T-cell homing to lymphoid and nonlymphoid sites: getting there and staying there. Crit. Rev. Immunol. 29, 87-109.
Dustin, M.L., and Shaw, A.S. (1999). Costimulation: building an immunological synapse. Science 283, 649-650.
Edward G. Routledge, S.D.G. (1993). Reshaping antibodies for therapy. 13-44.
Flavell, D.J., Warnes, S.L., Bryson, C.J., Field, S.A., Noss, A.L., Packham, G., and Flavell, S.U. (2006). The anti-CD20 antibody rituximab augments the immunospecific therapeutic effectiveness of an anti-CD19 immunotoxin directed against human B-cell lymphoma. Br. J. Haematol. 134, 157-170.
Gaseitsiwe, S., Valentini, D., Mahdavifar, S., Reilly, M., Ehrnst, A., and Maeurer, M. (2010). Peptide microarray-based identification of Mycobacterium tuberculosis epitope binding to HLA-DRB1*0101, DRB1*1501, and DRB1*0401. Clin. Vaccine Immunol. CVI 17, 168-175.
Gorfu, G., Rivera-Nieves, J., and Ley, K. (2009). Role of beta7 integrins in intestinal lymphocyte homing and retention. Curr. Mol. Med. 9, 836-850.
Grakoui, A., Bromley, S.K., Sumen, C., Davis, M.M., Shaw, A.S., Allen, P.M., and Dustin, M.L. (1999). The immunological synapse: a molecular machine controlling T cell activation. Science 285, 221-227.
Haas, J., Korporal, M., Schwarz, A., Balint, В., and Wildemann, B. (2011). The interleukin-7 receptor α chain contributes to altered homeostasis of regulatory T cells in multiple sclerosis. Eur. J. Immunol. 41, 845-853.
Haudebourg, Т., Poirier, N., and Vanhove, B. (2009). Depleting T-cell subpopulations in organ transplantation. Transpl. Int. Off. J. Eur. Soc. Organ Transplant. 22, 509-518.
He, R., and Geha, R.S. (2010). Thymic stromal lymphopoietin. Ann. N.Y. Acad. Sci. 1183, 13-24.
Henriques, С.М., Rino, J., Nibbs, R.J., Graham, G.J., and Barata, J.T. (2010). IL-7 induces rapid clathrin-mediated internalization and JAK3-dependent degradation of IL-7Ralpha in T cells. Blood 115, 3269-3277.
Von Horsten, H.H., Ogorek, C., Blanchard, V., Demmler, C., Giese, C., Winkler, K., Kaup, M., Berger, M., Jordan, I., and Sandig, V. (2010). Production of non-fucosylated antibodies by co-expression of heterologous GDP-6-deoxy-D-lyxo-4-hexulose reductase. Glycobiology 20, 1607-1618.
Inaba, K., Inaba, M., Witmer-Pack, M., Hatchcock, K., Hodes, R., and Steinman, R.M. (1995). Expression of B7 costimulator molecules on mouse dendritic cells. Adv. Exp. Med. Biol. 378, 65-70.
Jariwala, S.P., Abrams, E., Benson, A., Fodeman, J., and Zheng, T. (2011). The role of thymic stromal lymphopoietin in the immunopathogenesis of atopic dermatitis. Clin. Exp. Allergy J. Br. Soc. Allergy Clin. Immunol. 41, 1515-1520.
Kabat, E.A., Wu, T.T., Reid-Miller, M., Perry, H.M. and Gottesman, K.S. (1992) Sequences of Proteins of Immunological Interest (DIANE publishing, 1992).
Kern, В., Kraynov, E., Lee, L.-F., Ray, R. (2013). Receptor occupancy and internalization of an anti-IL-7 receptor antibody. Cytokine 63, 276-277.
Kern, В., Li, W., Bono, C., Lee, L.-F., and Kraynov, E. (2015). Receptor occupancy and blocking of STAT5 signaling by an anti-IL-7 receptor α antibody in cynomolgus monkeys. Cytometry В Clin. Cytom.
Krehenbrink, M., Chami, M., Guilvout, I., Alzari, P.M.,  F., Pugsley A.P. (2008). Artificial binding proteins (Affitins) as probes for conformational changes in secretin PulD. J Mol Biol. 2008 Nov 28.
F., Pugsley A.P. (2008). Artificial binding proteins (Affitins) as probes for conformational changes in secretin PulD. J Mol Biol. 2008 Nov 28.
Lefranc, M.-P., Giudicelli, V., Ginestoux, C., Bodmer, J.,  , W., Bontrop, R., Lemaitre, M., Malik, A.,
, W., Bontrop, R., Lemaitre, M., Malik, A.,  , V., and Chaume, D. (1999). IMGT, the international ImMunoGeneTics database. Nucleic Acids Res. 27, 209-212.
, V., and Chaume, D. (1999). IMGT, the international ImMunoGeneTics database. Nucleic Acids Res. 27, 209-212.
Lei, L., Zhang, Y., Yao, W., Kaplan, M.H., and Zhou, B. (2011). Thymic Stromal Lymphopoietin Interferes with Airway Tolerance by Suppressing the Generation of Antigen-Specific Regulatory T Cells. J. Immunol. 186, 2254-2261.
Luo, H., Wu, Z., Qi, S., Jin, W., Han, В., Wu, J. (2011). Ephrinbl and Ephrinb2 are associated with interleukin-7 receptor α and retard its internalization from the cell surface. J Biol Chem. 2011 Dec 30; 286(52):44976-87.
Martin, A.C.R. (2001). Protein Sequence and Structure Analysis of Antibody Variable Domains. In Antibody Engineering, D.R. Kontermann, and D.S.  , eds. (Springer Berlin Heidelberg), pp. 422-439.
, eds. (Springer Berlin Heidelberg), pp. 422-439.
Mazzucchelli, R., Hixon, J.A., Spolski, R., Chen, X., Li, W.Q., Hall, V.L., Willette-Brown, J., Hurwitz, A.A., Leonard, W.J., and Durum, S.K. (2008). Development of regulatory T cells requires IL-7Ralpha stimulation by IL-7 or TSLP. Blood 112, 3283-3292.
McElroy, C.A., Dohm, J.A., and Walsh, S.T.R. (2009). Structural and biophysical studies of the human IL-7/IL-7Ralpha complex. Struct. Lond. Engl. 1993 17, 54-65.
McElroy, C.A., Holland, P.J., Zhao, P., Lim, J.-M., Wells, L., Eisenstein, E., and Walsh, S.T.R. (2012). Structural reorganization of the interleukin-7 signaling complex. Proc. Natl. Acad. Sci. U.S.A. 109, 2503-2508
Michel, L., Berthelot, L.,  , S., Wiertlewski, S.,
, S., Wiertlewski, S.,  , F., Braudeau, C., Brouard, S., Soulillou, J.-P., and Laplaud, D.-A. (2008). Patients with relapsing-remitting multiple sclerosis have normal Treg function when cells expressing IL-7 receptor alpha-chain are excluded from the analysis. J. Clin. Invest. 118, 3411-3419.
, F., Braudeau, C., Brouard, S., Soulillou, J.-P., and Laplaud, D.-A. (2008). Patients with relapsing-remitting multiple sclerosis have normal Treg function when cells expressing IL-7 receptor alpha-chain are excluded from the analysis. J. Clin. Invest. 118, 3411-3419.
Nancey, S., Hamzaoui, N., Moussata, D., Graber, I., Bienvenu, J., and Flourie, B. (2008). Serum interleukin-6, soluble interleukin-6 receptor and Crohn's disease activity. Dig. Dis. Sci. 53, 242-247.
Niederfellner, G., Lammens, A., Mundigl, O., Georges, G.J., Schaefer, W., Schwaiger, M., Franke, A., Wiechmann, K., Jenewein, S., Slootstra, J.W., et al. (2011). Epitope characterization and crystal structure of GA101 provide insights into the molecular basis for type I/II distinction of CD20 antibodies. Blood 118, 358-367.
Olivier, S., Jacoby, M., Brillon, C., Bouletreau, S., Mollet, Т., Nerriere, O., Angel, A., Danet, S., Souttou, В., Guehenneux, F., et al. (2010). EB66 cell line, a duck embryonic stem cell-derived substrate for the industrial production of therapeutic monoclonal antibodies with enhanced ADCC activity. mAbs 2, 405-415.
Olkhanud, P.B., Rochman, Y., Bodogai, M., Malchinkhuu, E., Wejksza, K., Xu, M., Gress, R.E., Hesdorffer, C., Leonard, W.J., and Biragyn, A. (2011). Thymic stromal lymphopoietin is a key mediator of breast cancer progression. J. Immunol. Baltim. Md 1950 186, 5656-5662.
Van Oosterhout, Y.V., van Ernst, J.L., Bakker, H.H., Preijers, F.W., Schattenberg, A.V., Ruiter, D.J., Evers, S., Koopman, J.P., and de Witte, T. (2001). Production of anti-CD3 and anti-CD7 ricin A-immunotoxins for a clinical pilot study. Int. J. Pharm. 221, 175-186.
Papac, D.I., Hoyes, J., and Tomer, K.B. (1994). Epitope mapping of the gastrin-releasing peptide/anti-bombesin monoclonal antibody complex by proteolysis followed by matrix-assisted laser desorption ionization mass spectrometry. Protein Sci. 3, 1485-1492.
Park, L.S., Martin, U., Garka, K., Gliniak, В., Di Santo, J.P., Muller, W., Largaespada, D.A., Copeland, N.G., Jenkins, N.A., Farr, A.G., et al. (2000). Cloning of the murine thymic stromal lymphopoietin (TSLP) receptor: Formation of a functional heteromeric complex requires interleukin 7 receptor. J. Exp. Med. 192, 659-670.
Paus, D., and Winter, G. (2006). Mapping epitopes and antigenicity by site-directed masking. Proc. Natl. Acad. Sci. U.S.A. 103, 9172-9177.
Poirier, N., Haudebourg, Т., Brignone, C., Dilek, N., Hervouet, J., Minault, D., Coulon, F., de Silly, R.V., Triebel, F., Blancho, G., et al. (2011). Antibody-mediated depletion of lymphocyte-activation gene-3 (LAG-3(+))-activated T lymphocytes prevents delayed-type hypersensitivity in non-human primates. Clin. Exp. Immunol. 164, 265-274.
 , M., Vanhove, В., Soulillou, J.-P., and Brouard, S. (2009). Interleukin 7 receptor alpha as a potential therapeutic target in transplantation. Arch. Immunol. Ther. Exp. (Warsz.) 57, 253-261.
, M., Vanhove, В., Soulillou, J.-P., and Brouard, S. (2009). Interleukin 7 receptor alpha as a potential therapeutic target in transplantation. Arch. Immunol. Ther. Exp. (Warsz.) 57, 253-261.
Rader, C., Cheresh, D.A., and Barbas, C.F. (1998). A phage display approach for rapid antibody humanization: designed combinatorial V gene libraries. Proc. Natl. Acad. Sci. U.S.A. 95, 8910-8915.
Reche, P.A., Soumelis, V., Gorman, D.M., Clifford, Т., Liu Mr, null, Travis, M., Zurawski, S.M., Johnston, J., Liu, Y.J., Spits, H., et al. (2001). Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J. Immunol. Baltim. Md 1950 167, 336-343.
Risberg, K., Fodstad,  ., and Andersson, Y. (2011). Synergistic anticancer effects of the 9.2.27PE immunotoxin and ABT-737 in melanoma. PloS One 6, e24012.
., and Andersson, Y. (2011). Synergistic anticancer effects of the 9.2.27PE immunotoxin and ABT-737 in melanoma. PloS One 6, e24012.
Roan, F., Bell, B.D., Stoklasek, T.A., Kitajima, M., Han, H., and Ziegler, S.F. (2012). The multiple facets of thymic stromal lymphopoietin (TSLP) during allergic inflammation and beyond. J. Leukoc. Biol. 91, 877-886.
Rochman, Y., Kashyap, M., Robinson, G.W., Sakamoto, K., Gomez-Rodriguez, J., Wagner, K.-U., and Leonard, W.J. (2010). Thymic stromal lymphopoietin-mediated STAT5 phosphorylation via kinases JAK1 and JAK2 reveals a key difference from IL-7-induced signaling. Proc. Natl. Acad. Sci. U.S.A. 107, 19455-19460.
Rosok, M.J., Yelton, D.E., Harris, L.J., Bajorath, J.,  , K.E.,
, K.E.,  , I., Cruz, G.A., Kristensson, K., Lin, H., Huse, W.D., et al. (1996). A combinatorial library strategy for the rapid humanization of anticarcinoma BR96 Fab. J. Biol. Chem. 271, 22611-22618.
, I., Cruz, G.A., Kristensson, K., Lin, H., Huse, W.D., et al. (1996). A combinatorial library strategy for the rapid humanization of anticarcinoma BR96 Fab. J. Biol. Chem. 271, 22611-22618.
Schlehuber, S., Skerra, A. (2002). Tuning ligand affinity, specificity, and folding stability of an engineered lipocalin variant -- a so-called 'anticalin' -- using a molecular random approach. Biophys Chem. 2002 May 2; 96(2-3):213-28
Shaw, A.S., and Dustin, M.L. (1997). Making the T cell receptor go the distance: a topological view of T cell activation. Immunity 6, 361-369.
Shinohara, Т., Nemoto, Y., Kanai, Т., Kameyama, K., Okamoto, R., Tsuchiya, K., Nakamura, Т., Totsuka, Т., Ikuta, K., and Watanabe, M. (2011). Upregulated IL-7 receptor α expression on colitogenic memory CD4+ T cells may participate in the development and persistence of chronic colitis. J. Immunol. Baltim. Md 1950 186, 2623-2632.
Shochat, C., Tal, N., Bandapalli, O.R., Palmi, C, Ganmore, I., te Kronnie, G., Cario, G., Cazzaniga, G., Kulozik, A.E., Stanulla, M., et al. (2011). Gain-of-function mutations in interleukin-7 receptor-α (IL7R) in childhood acute lymphoblastic leukemias. J. Exp. Med. 208, 901-908.
Skerra, A. (2008). Alternative binding proteins: anticalins - harnessing the structural plasticity of the lipocalin ligand pocket to engineer novel binding activities. FEBS J. 2008 Jun; 275(11):2677-83. doi: 10.1111/j.1742-4658.2008.06439.x. Epub 2008 Apr 24.
Suckau, D.,  , J., Karwath, G., Schneider, K., Casaretto, M., Bitter-Suermann, D., and Przybylski, M. (1990). Molecular epitope identification by limited proteolysis of an immobilized antigen-antibody complex and mass spectrometric peptide mapping. Proc. Natl. Acad. Sci. U.S.A. 87, 9848-9852
, J., Karwath, G., Schneider, K., Casaretto, M., Bitter-Suermann, D., and Przybylski, M. (1990). Molecular epitope identification by limited proteolysis of an immobilized antigen-antibody complex and mass spectrometric peptide mapping. Proc. Natl. Acad. Sci. U.S.A. 87, 9848-9852
Taylor, B.C., Zaph, C., Troy, A.E., Du, Y., Guild, K.J., Comeau, M.R., and Artis, D. (2009). TSLP regulates intestinal immunity and inflammation in mouse models of helminth infection and colitis. J. Exp. Med. 206, 655-667.
Teeling, J.L., Mackus, W.J.M., Wiegman, L.J.J.M., van den Brakel, J.H.N., Beers, S.A., French, R.R., van Meerten, Т., Ebeling, S., Vink, Т., Slootstra, J.W., et al. (2006). The biological activity of human CD20 monoclonal antibodies is linked to unique epitopes on CD20. J. Immunol. Baltim. Md 1950 177, 362-371.
Timmerman, P., Puijk, W.C., and Meloen, R.H. (2007). Functional reconstruction and synthetic mimicry of a conformational epitope using CLIPS technology. J. Mol. Recognit. JMR 20, 283-299.
Walsh, S.T.R. (2012). Structural insights into the common γ-chain family of cytokines and receptors from the interleukin-7 pathway. Immunol. Rev. 250, 303-316.
Watanabe, N., Wang, Y.-H., Lee, H.K., Ito, Т., Wang, Y.-H., Cao, W., and Liu, Y.-J. (2005a). Hassall's corpuscles instruct dendritic cells to induce CD4+CD25+ regulatory T cells in human thymus. Nature 436, 1181-1185.
Watanabe, N., Hanabuchi, S., Marloie-Provost, M.-A., Antonenko, S., Liu, Y.-J., and Soumelis, V. (2005b). Human TSLP promotes CD40 ligand-induced IL-12 production by myeloid dendritic cells but maintains their Th2 priming potential. Blood 105, 4749-4751.
Ye, J., Ma, N., Madden, T.L., and Ostell, J.M. (2013). IgBLAST: an immunoglobulin variable domain sequence analysis tool. Nucleic Acids Res. 41, W34-W40.
Ying, S., O'Connor, В., Ratoff, J., Meng, Q., Fang, C., Cousins, D., Zhang, G., Gu, S., Gao, Z., Shamji, В., et al. (2008). Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease. J. Immunol. Baltim. Md 1950 181, 2790-2798.
Zhi, K., Li, M., Zhang, X., Gao, Z., Bai, J., Wu, Y., Zhou, S., Li, M., and Qu, L. (2014). α4β7 Integrin (LPAM-1) is upregulated at atherosclerotic lesions and is involved in atherosclerosis progression. Cell. Physiol. Biochem. Int. J. Exp. Cell. Physiol. Biochem. Pharmacol. 33, 1876-1887.
Zhong, J., Sharma, J., Raju, R., Palapetta, S.M., Prasad, T.S.K., Huang, T.-C, Yoda, A., Tyner, J.W., van Bodegom, D., Weinstock, D.M., et al. (2014). TSLP signaling pathway map: a platform for analysis of TSLP-mediated signaling. Database J. Biol. Databases Curation 2014, bau007.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>ОСЕ ИММУНОТЕРАПЕУТИКС
<120>АНТИТЕЛА, НАПРАВЛЕННЫЕ НА CD127
<130> B10744B
<150> US 62/010117
<151> 2014-06-10
<150> EP 15305078.6
<151> 2015-01-23
<160> 132
<170> PatentIn version 3.5
<210> 1
<211> 1359
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 1
gcggtgcagc tggtggagtc tgggggaggc ctagtgcagc ctggagggtc cctgaaactc 60
tcctgtgcag tctcaggatt cactctcagt gactattaca tggcctgggt ccgccaggct 120
ccaaagaagg gtctggaatg ggtcgcaacc attagtgcca gtgggctcag aacttactat 180
ccagactccg tgaagggccg cttcactatc tccagagatg atgcaaaaag gagcctcttc 240
ctgcaaatga ccagtctgaa gtctgaggac acggccactt attactgtgc aagaccgatg 300
tctgcacact atggttttaa ctactttgat tactggggcc aaggagtcat ggtcacagtc 360
tcctcagcta gcaccaaggg cccatcggtc ttccccctgg caccctcctc caagagcacc 420
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 480
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 540
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 600
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 660
gagcccaaat cttgtgacaa aactcacaca tgcccaccgt gcccagcacc tgaactcctg 720
gggggaccgt cagtcttcct cttcccccca aaacccaagg acaccctcat gatctcccgg 780
acccctgagg tcacatgcgt ggtggtggac gtgagccacg aagaccctga ggtcaagttc 840
aactggtacg tggacggcgt ggaggtgcat aatgccaaga caaagccgcg ggaggagcag 900
tacaacagca cgtaccgtgt ggtcagcgtc ctcaccgtcc tgcaccagga ctggctgaat 960
ggcaaggagt acaagtgcaa ggtctccaac aaagccctcc cagcccccat cgcgaaaacc 1020
atctccaaag ccaaagggca gccccgagaa ccacaggtgt acaccctgcc cccatcccgg 1080
gaggagatga ccaagaacca ggtcagcctg acctgcctgg tcaaaggctt ctatcccagc 1140
gacatcgccg tggagtggga gagcaatggg cagccggaga acaactacaa gaccacgcct 1200
cccgtgctgg actccgacgg ctccttcttc ctctacagca agctcaccgt ggacaagagc 1260
aggtggcagc aggggaacgt cttctcatgc tccgtgatgc atgaggctct gcacaaccac 1320
tacacgcaga agagcctctc cctgtctccg ggtaaatga 1359
<210> 2
<211> 452
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 2
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Ala Pro Lys Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ala Ser Gly Leu Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Lys Arg Ser Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Lys Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Pro Met Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Ala Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly Lys
450
<210> 3
<211> 645
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 3
gacatccaga tgacacagtc tccagcttcc ctgtctgcat ctctgggaga aactgtcacc 60
atcgaatgtc gaacaagtga ggacatttac aatggtttag catggtatca gcagaagcca 120
gggaaatctc ctcagctcct ggtctatagt gcaaatagct tacatattgg ggtcccatca 180
cggttcagtg gcagtggatc tggtacacag tattctctca agataaacag cctgcaattt 240
gaagatgtcg caagttattt ctgtcaacag tattacgatt atccgctcgc gttcggttct 300
gggaccaagc tggagatcaa acggacggtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttag 645
<210> 4
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Thr Val Thr Ile Glu Cys Arg Thr Ser Glu Asp Ile Tyr Asn Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Ser Ala Asn Ser Leu His Ile Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Phe
65 70 75 80
Glu Asp Val Ala Ser Tyr Phe Cys Gln Gln Tyr Tyr Asp Tyr Pro Leu
85 90 95
Ala Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 5
<211> 1350
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 5
gcggtgcagc tggtggagtc tgggggaggc ctagtgcagc ctggagggtc cctgaaactc 60
tcctgtgcag tctcaggatt cactctcagt gactattaca tggcctgggt ccgccaggct 120
ccaaagaagg gtctggaatg ggtcgcaacc attagtgcca gtgggctcag aacttactat 180
ccagactccg tgaagggccg cttcactatc tccagagatg atgcaaaaag gagcctcttc 240
ctgcaaatga ccagtctgaa gtctgaggac acggccactt attactgtgc aagaccgatg 300
tctgcacact atggttttaa ctactttgat tactggggcc aaggagtcat ggtcacagtc 360
tcctcagcta gcaccaaggg cccatcggtc ttccccctgg cgccctgctc caggagcacc 420
tccgagagca cagccgccct gggctgcctg gtcaaggact acttccccga accggtgacg 480
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 540
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacg 600
aagacctaca cctgcaacgt agatcacaag cccagcaaca ccaaggtgga caagagagtt 660
gagtccaaat atggtccccc atgcccacca tgcccagcac ctgagttcct ggggggacca 720
tcagtcttcc tgttcccccc aaaacccaag gacactctca tgatctcccg gacccctgag 780
gtcacgtgcg tggtggtgga cgtgagccag gaagaccccg aggtccagtt caactggtac 840
gtggatggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gttcaacagc 900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa cggcaaggag 960
tacaagtgca aggtctccaa caaaggcctc ccgtcctcca tcgagaaaac catctccaaa 1020
gccaaagggc agccccgaga gccacaggtg tacaccctgc ccccatccca ggaggagatg 1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctaccccag cgacatcgcc 1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1200
gactccgacg gctccttctt cctctacagc aggctaaccg tggacaagag caggtggcag 1260
gaggggaatg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacacag 1320
aagagcctct ccctgtctcc gggtaaatga 1350
<210> 6
<211> 449
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 6
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Ala Pro Lys Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ala Ser Gly Leu Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Lys Arg Ser Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Lys Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Pro Met Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 7
<211> 645
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 7
gacatccaga tgacacagtc tccagcttcc ctgtctgcat ctctgggaga aactgtcacc 60
atcgaatgtc gaacaagtga ggacatttac aatggtttag catggtatca gcagaagcca 120
gggaaatctc ctcagctcct ggtctatagt gcaaatagct tacatattgg ggtcccatca 180
cggttcagtg gcagtggatc tggtacacag tattctctca agataaacag cctgcaattt 240
gaagatgtcg caagttattt ctgtcaacag tattacgatt atccgctcgc gttcggttct 300
gggaccaagc tggagatcaa acggacggtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttag 645
<210> 8
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Thr Val Thr Ile Glu Cys Arg Thr Ser Glu Asp Ile Tyr Asn Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Ser Ala Asn Ser Leu His Ile Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Phe
65 70 75 80
Glu Asp Val Ala Ser Tyr Phe Cys Gln Gln Tyr Tyr Asp Tyr Pro Leu
85 90 95
Ala Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 9
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 9
ttcactctca gtgactatta catggcc 27
<210> 10
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 10
Phe Thr Leu Ser Asp Tyr Tyr Met Ala
1 5
<210> 11
<211> 51
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 11
accattagtg ccagtgggct cagaacttac tatccagact ccgtgaaggg c 51
<210> 12
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 12
Thr Ile Ser Ala Ser Gly Leu Arg Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 13
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 13
ccgatgtctg cacactatgg ttttaactac tttgattac 39
<210> 14
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 14
Pro Met Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr
1 5 10
<210> 15
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 15
cgaacaagtg aggacattta caatggttta gca 33
<210> 16
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 16
Arg Thr Ser Glu Asp Ile Tyr Asn Gly Leu Ala
1 5 10
<210> 17
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 17
agtgcaaata gcttacatat t 21
<210> 18
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 18
Ser Ala Asn Ser Leu His Ile
1 5
<210> 19
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 19
caacagtatt acgattatcc gctcgcg 27
<210> 20
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 20
Gln Gln Tyr Tyr Asp Tyr Pro Leu Ala
1 5
<210> 21
<211> 366
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 21
gcggtgcagc tggtggagtc tgggggaggc ctagtgcagc ctggagggtc cctgaaactc 60
tcctgtgcag tctcaggatt cactctcagt gactattaca tggcctgggt ccgccaggct 120
ccaaagaagg gtctggaatg ggtcgcaacc attagtgcca gtgggctcag aacttactat 180
ccagactccg tgaagggccg cttcactatc tccagagatg atgcaaaaag gagcctcttc 240
ctgcaaatga ccagtctgaa gtctgaggac acggccactt attactgtgc aagaccgatg 300
tctgcacact atggttttaa ctactttgat tactggggcc aaggagtcat ggtcacagtc 360
tcctca 366
<210> 22
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 22
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Ala Pro Lys Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ala Ser Gly Leu Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Lys Arg Ser Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Lys Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Pro Met Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Val Met Val Thr Val Ser Ser
115 120
<210> 23
<211> 324
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 23
gacatccaga tgacacagtc tccagcttcc ctgtctgcat ctctgggaga aactgtcacc 60
atcgaatgtc gaacaagtga ggacatttac aatggtttag catggtatca gcagaagcca 120
gggaaatctc ctcagctcct ggtctatagt gcaaatagct tacatattgg ggtcccatca 180
cggttcagtg gcagtggatc tggtacacag tattctctca agataaacag cctgcaattt 240
gaagatgtcg caagttattt ctgtcaacag tattacgatt atccgctcgc gttcggttct 300
gggaccaagc tggagatcaa acgg 324
<210> 24
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Thr Val Thr Ile Glu Cys Arg Thr Ser Glu Asp Ile Tyr Asn Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Ser Ala Asn Ser Leu His Ile Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Phe
65 70 75 80
Glu Asp Val Ala Ser Tyr Phe Cys Gln Gln Tyr Tyr Asp Tyr Pro Leu
85 90 95
Ala Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 25
<211> 993
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 25
gctagcacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 60
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 240
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc 300
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaact cctgggggga 360
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 420
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 480
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 540
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 600
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgcgaa aaccatctcc 660
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggaggag 720
atgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 780
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 840
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 900
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 960
cagaagagcc tctccctgtc tccgggtaaa tga 993
<210> 26
<211> 330
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 26
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Ala Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 27
<211> 984
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 27
gctagcacca agggcccatc ggtcttcccc ctggcgccct gctccaggag cacctccgag 60
agcacagccg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacgaagacc 240
tacacctgca acgtagatca caagcccagc aacaccaagg tggacaagag agttgagtcc 300
aaatatggtc ccccatgccc accatgccca gcacctgagt tcctgggggg accatcagtc 360
ttcctgttcc ccccaaaacc caaggacact ctcatgatct cccggacccc tgaggtcacg 420
tgcgtggtgg tggacgtgag ccaggaagac cccgaggtcc agttcaactg gtacgtggat 480
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagttcaa cagcacgtac 540
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaacggcaa ggagtacaag 600
tgcaaggtct ccaacaaagg cctcccgtcc tccatcgaga aaaccatctc caaagccaaa 660
gggcagcccc gagagccaca ggtgtacacc ctgcccccat cccaggagga gatgaccaag 720
aaccaggtca gcctgacctg cctggtcaaa ggcttctacc ccagcgacat cgccgtggag 780
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 840
gacggctcct tcttcctcta cagcaggcta accgtggaca agagcaggtg gcaggagggg 900
aatgtcttct catgctccgt gatgcatgag gctctgcaca accactacac acagaagagc 960
ctctccctgt ctccgggtaa atga 984
<210> 28
<211> 327
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 28
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys
325
<210> 29
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 29
acggtggctg caccatctgt cttcatcttc ccgccatctg atgagcagtt gaaatctgga 60
actgcctctg ttgtgtgcct gctgaataac ttctatccca gagaggccaa agtacagtgg 120
aaggtggata acgccctcca atcgggtaac tcccaggaga gtgtcacaga gcaggacagc 180
aaggacagca cctacagcct cagcagcacc ctgacgctga gcaaagcaga ctacgagaaa 240
cacaaagtct acgcctgcga agtcacccat cagggcctga gctcgcccgt cacaaagagc 300
ttcaacaggg gagagtgtta g 321
<210> 30
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 30
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
1 5 10 15
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
20 25 30
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
35 40 45
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
50 55 60
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
65 70 75 80
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
85 90 95
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 31
<211> 330
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 31
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 32
<211> 326
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 32
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 33
<211> 327
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 33
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 34
<211> 326
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 34
Ala Glu Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Gly Thr Ala
1 5 10 15
Leu Lys Ser Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ala Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Gly Leu Tyr Thr Leu
50 55 60
Thr Ser Ser Val Thr Val Pro Ser Ser Thr Trp Pro Ser Gln Thr Val
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile Val Pro Arg Asn Cys Gly Gly Asp Cys Lys Pro Cys Ile Cys Thr
100 105 110
Gly Ser Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp
115 120 125
Val Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp
130 135 140
Ile Ser Gln Asp Asp Pro Glu Val His Phe Ser Trp Phe Val Asp Asp
145 150 155 160
Val Glu Val His Thr Ala Gln Thr Arg Pro Pro Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Leu His Gln Asp Trp
180 185 190
Leu Asn Gly Arg Thr Phe Arg Cys Lys Val Thr Ser Ala Ala Phe Pro
195 200 205
Ser Pro Ile Glu Lys Thr Ile Ser Lys Pro Glu Gly Arg Thr Gln Val
210 215 220
Pro His Val Tyr Thr Met Ser Pro Thr Lys Glu Glu Met Thr Gln Asn
225 230 235 240
Glu Val Ser Ile Thr Cys Met Val Lys Gly Phe Tyr Pro Pro Asp Ile
245 250 255
Tyr Val Glu Trp Gln Met Asn Gly Gln Pro Gln Glu Asn Tyr Lys Asn
260 265 270
Thr Pro Pro Thr Met Asp Thr Asp Gly Ser Tyr Phe Leu Tyr Ser Lys
275 280 285
Leu Asn Val Lys Lys Glu Lys Trp Gln Gln Gly Asn Thr Phe Thr Cys
290 295 300
Ser Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu
305 310 315 320
Ser His Ser Pro Gly Lys
325
<210> 35
<211> 366
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 35
caggtgcagc tggtcgaatc tggagggggt ctggtcaagc ccggagggtc actgcgtctg 60
tcatgcgccg tctcagggtt cacactgtct gactactata tggcttgggt gcgacaggca 120
ccaggcaagg gactggagtg ggtcgccact atctctgcta gtggcctgag gacctactat 180
cctgatagtg tgaagggaag gttcacaatt tcacgggacg atgcaaaaaa ctccctgtac 240
ctgcagatga atagcctgag agcagaagac accgccgtct actattgcgc ccgcccaatg 300
agcgctcact atggcttcaa ctactttgat tattgggggc agggtaccct ggtgacagtc 360
tccagc 366
<210> 36
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 36
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ala Ser Gly Leu Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Met Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 37
<211> 366
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 37
caggtgcagc tggtcgaatc tgggggggga ctggtcaaac ccggaggctc actgcgtctg 60
tcatgtgccg tctcaggctt tacactgagc gactactata tggcatggat ccgacaggca 120
ccaggcaagg gactggagtg ggtgtctact atttctgcca gtggcctgag gacctactat 180
cctgacagtg tcaagggaag gttcacaatc tcacgggata acgctaaaaa ttccctgtac 240
ctgcagatga acagcctgag agccgaagac accgctgtgt actattgcgc tcgcccaatg 300
tccgcacact atggcttcaa ttactttgat tattgggggc agggtaccct ggtgacagtc 360
tccagc 366
<210> 38
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 38
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Ala Ser Gly Leu Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Met Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 39
<211> 366
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 39
caggtgcagc tggtcgaatc agggggggga ctggtcaaac ccgggggctc actgcgtctg 60
tcatgtgccg tctcaggctt cacactgagc gactactata tggcatggat ccgacaggca 120
ccaggcaagg gactggagtg ggtgtctact atttctgcca gtggcctgag gacctactat 180
cctgacagtg tcaagggaag gttcacaatc tcacgggata acgctaaaaa ttccctgtac 240
ctgcagatga acagcctgag agccgaagac accgctgtgt actattgcgc tcgcccactg 300
tccgcacact atggcttcaa ttactttgat tattgggggc agggtaccct ggtgacagtc 360
tccagc 366
<210> 40
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 40
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Ala Ser Gly Leu Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Leu Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 41
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 41
gaaattgtga tgactcagtc tcccgctacc ctgtcagtct ctcccggcga acgtgctacc 60
ctgtcctgcc gaacctcaga agatatctac aacgggctgg cttggtatca gcagaagccc 120
ggacaggccc ctaggctgct ggtgtactcc gctaattctc tgcacatcgg cattccagca 180
cggttctctg gtagtggctc aggaactgag tataccctga caatctccag cctgcagagc 240
gaagacttcg cagtgtactt ttgccagcag tactatgatt atcccctggc ctttggcgga 300
gggaccaagg tcgagatcaa g 321
<210> 42
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 42
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Thr Ser Glu Asp Ile Tyr Asn Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Val
35 40 45
Tyr Ser Ala Asn Ser Leu His Ile Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Tyr Asp Tyr Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 43
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 43
gaaatcgtga tgactcagtc tcctgctact ctgtccgtgt cccctggtga acgtgctact 60
ctgtcctgtc gtacctccga agatatttac aacgggctgg cttggtatca gcagaagccc 120
ggacaggccc ctaggctgct gatctactcc gctaattctc tgcacatcgg cattccagca 180
cggttctctg gtagtggctc aggaactgag tttaccctga caatttccag cctgcagagc 240
gaagacttcg cagtgtacta ttgccagcag tactatgatt atcccctggc ctttggcgga 300
gggaccaagg tcgagatcaa a 321
<210> 44
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 44
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Thr Ser Glu Asp Ile Tyr Asn Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Asn Ser Leu His Ile Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Tyr Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 45
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 45
gaaattgtga tgactcagag ccctgctaca ctgtccgtca gccctggaga acgtgctaca 60
ctgtcctgtc gcacctcaga agatatttac caggggctgg cttggtatca gcagaagccc 120
ggacaggccc ctaggctgct gatctactcc gctaacactc tgcacatcgg cattccagca 180
cggttctctg gtagtggctc aggaaccgag tttaccctga caatttccag cctgcagtct 240
gaagacttcg cagtgtacta ttgccagcag tactatgatt atcccctggc ctttggcgga 300
gggacaaagg tcgagatcaa a 321
<210> 46
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 46
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Thr Ser Glu Asp Ile Tyr Gln Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Asn Thr Leu His Ile Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Tyr Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 47
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 47
ccactgtccg cacactatgg cttcaattac tttgattat 39
<210> 48
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 48
Pro Leu Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr
1 5 10
<210> 49
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 49
tgtcgcacct cagaagatat ttaccagggg ctggct 36
<210> 50
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 50
Cys Arg Thr Ser Glu Asp Ile Tyr Gln Gly Leu Ala
1 5 10
<210> 51
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 51
tccgctaaca ctctgcacat c 21
<210> 52
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 52
Ser Ala Asn Thr Leu His Ile
1 5
<210> 53
<211> 1350
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 53
caggtgcagc tggtcgaatc agggggggga ctggtcaaac ccgggggctc actgcgtctg 60
tcatgtgccg tctcaggctt cacactgagc gactactata tggcatggat ccgacaggca 120
ccaggcaagg gactggagtg ggtgtctact atttctgcca gtggcctgag gacctactat 180
cctgacagtg tcaagggaag gttcacaatc tcacgggata acgctaaaaa ttccctgtac 240
ctgcagatga acagcctgag agccgaagac accgctgtgt actattgcgc tcgcccactg 300
tccgcacact atggcttcaa ttactttgat tattgggggc agggtaccct ggtgacagtc 360
tccagcgcta gcaccaaggg cccatcggtc ttccccctgg cgccctgctc caggagcacc 420
tccgagagca cagccgccct gggctgcctg gtcaaggact acttccccga accggtgacg 480
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 540
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacg 600
aagacctaca cctgcaacgt agatcacaag cccagcaaca ccaaggtgga caagagagtt 660
gagtccaaat atggtccccc atgcccacca tgcccagcac ctgagttcct ggggggacca 720
tcagtcttcc tgttcccccc aaaacccaag gacactctca tgatctcccg gacccctgag 780
gtcacgtgcg tggtggtgga cgtgagccag gaagaccccg aggtccagtt caactggtac 840
gtggatggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gttcaacagc 900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa cggcaaggag 960
tacaagtgca aggtctccaa caaaggcctc ccgtcctcca tcgagaaaac catctccaaa 1020
gccaaagggc agccccgaga gccacaggtg tacaccctgc ccccatccca ggaggagatg 1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctaccccag cgacatcgcc 1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1200
gactccgacg gctccttctt cctctacagc aggctaaccg tggacaagag caggtggcag 1260
gaggggaatg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacacag 1320
aagagcctct ccctgtctcc gggtaaatga 1350
<210> 54
<211> 449
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 54
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Leu Ser Asp Tyr
20 25 30
Tyr Met Ala Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Ala Ser Gly Leu Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Leu Ser Ala His Tyr Gly Phe Asn Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr
210 215 220
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
260 265 270
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 55
<211> 642
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 55
gaaattgtga tgactcagag ccctgctaca ctgtccgtca gccctggaga acgtgctaca 60
ctgtcctgtc gcacctcaga agatatttac caggggctgg cttggtatca gcagaagccc 120
ggacaggccc ctaggctgct gatctactcc gctaacactc tgcacatcgg cattccagca 180
cggttctctg gtagtggctc aggaaccgag tttaccctga caatttccag cctgcagtct 240
gaagacttcg cagtgtacta ttgccagcag tactatgatt atcccctggc ctttggcgga 300
gggacaaagg tcgagatcaa aacggtggct gcaccatctg tcttcatctt cccgccatct 360
gatgagcagt tgaaatctgg aactgcctct gttgtgtgcc tgctgaataa cttctatccc 420
agagaggcca aagtacagtg gaaggtggat aacgccctcc aatcgggtaa ctcccaggag 480
agtgtcacag agcaggacag caaggacagc acctacagcc tcagcagcac cctgacgctg 540
agcaaagcag actacgagaa acacaaagtc tacgcctgcg aagtcaccca tcagggcctg 600
agctcgcccg tcacaaagag cttcaacagg ggagagtgtt ag 642
<210> 56
<211> 213
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 56
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Thr Ser Glu Asp Ile Tyr Gln Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Asn Thr Leu His Ile Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Asp Tyr Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 57
<211> 439
<212> PRT
<213> Homo Sapiens
<400> 57
Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp Ala Glu Leu Asp
1 5 10 15
Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val Asn Gly Ser Gln
20 25 30
His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val Asn Thr Thr Asn
35 40 45
Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val Lys Cys Leu Asn
50 55 60
Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys Phe Leu
65 70 75 80
Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly Glu Lys Ser Leu
85 90 95
Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys Pro Glu Ala Pro
100 105 110
Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn Asp Phe Val Val
115 120 125
Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val Lys Val Leu Met
130 135 140
His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn Lys Trp Thr His
145 150 155 160
Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln Arg Lys Leu Gln
165 170 175
Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr
180 185 190
Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe Arg Thr
195 200 205
Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro Ile Leu Leu Thr
210 215 220
Ile Ser Ile Leu Ser Phe Phe Ser Val Ala Leu Leu Val Ile Leu Ala
225 230 235 240
Cys Val Leu Trp Lys Lys Arg Ile Lys Pro Ile Val Trp Pro Ser Leu
245 250 255
Pro Asp His Lys Lys Thr Leu Glu His Leu Cys Lys Lys Pro Arg Lys
260 265 270
Asn Leu Asn Val Ser Phe Asn Pro Glu Ser Phe Leu Asp Cys Gln Ile
275 280 285
His Arg Val Asp Asp Ile Gln Ala Arg Asp Glu Val Glu Gly Phe Leu
290 295 300
Gln Asp Thr Phe Pro Gln Gln Leu Glu Glu Ser Glu Lys Gln Arg Leu
305 310 315 320
Gly Gly Asp Val Gln Ser Pro Asn Cys Pro Ser Glu Asp Val Val Ile
325 330 335
Thr Pro Glu Ser Phe Gly Arg Asp Ser Ser Leu Thr Cys Leu Ala Gly
340 345 350
Asn Val Ser Ala Cys Asp Ala Pro Ile Leu Ser Ser Ser Arg Ser Leu
355 360 365
Asp Cys Arg Glu Ser Gly Lys Asn Gly Pro His Val Tyr Gln Asp Leu
370 375 380
Leu Leu Ser Leu Gly Thr Thr Asn Ser Thr Leu Pro Pro Pro Phe Ser
385 390 395 400
Leu Gln Ser Gly Ile Leu Thr Leu Asn Pro Val Ala Gln Gly Gln Pro
405 410 415
Ile Leu Thr Ser Leu Gly Ser Asn Gln Glu Glu Ala Tyr Val Thr Met
420 425 430
Ser Ser Phe Tyr Gln Asn Gln
435
<210> 58
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 58
Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp Ala Glu Leu
1 5 10 15
<210> 59
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 59
Ala Gln Asn Gly Asp Leu Glu Asp Ala Glu Leu Asp Asp Tyr Ser
1 5 10 15
<210> 60
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 60
Asp Leu Glu Asp Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr
1 5 10 15
<210> 61
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 61
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu
1 5 10 15
<210> 62
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 62
Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val Asn Gly Ser
1 5 10 15
<210> 63
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 63
Ser Cys Tyr Ser Gln Leu Glu Val Asn Gly Ser Gln His Ser Leu
1 5 10 15
<210> 64
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 64
Gln Leu Glu Val Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe
1 5 10 15
<210> 65
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 65
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp
1 5 10 15
<210> 66
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 66
His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val Asn Thr Thr
1 5 10 15
<210> 67
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 67
Cys Ala Phe Glu Asp Pro Asp Val Asn Thr Thr Asn Leu Glu Phe
1 5 10 15
<210> 68
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 68
Asp Pro Asp Val Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly
1 5 10 15
<210> 69
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 69
Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu
1 5 10 15
<210> 70
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 70
Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val Lys Cys Leu
1 5 10 15
<210> 71
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 71
Ile Cys Gly Ala Leu Val Glu Val Lys Cys Leu Asn Phe Arg Lys
1 5 10 15
<210> 72
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 72
Leu Val Glu Val Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile
1 5 10 15
<210> 73
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 73
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu
1 5 10 15
<210> 74
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 74
Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys Phe
1 5 10 15
<210> 75
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 75
Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys Phe Leu Leu Ile Gly
1 5 10 15
<210> 76
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 76
Phe Ile Glu Thr Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile
1 5 10 15
<210> 77
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 77
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val
1 5 10 15
<210> 78
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 78
Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly Glu Lys Ser
1 5 10 15
<210> 79
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 79
Ser Asn Ile Cys Val Lys Val Gly Glu Lys Ser Leu Thr Cys Lys
1 5 10 15
<210> 80
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 80
Val Lys Val Gly Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu
1 5 10 15
<210> 81
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 81
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val
1 5 10 15
<210> 82
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 82
Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys Pro Glu Ala
1 5 10 15
<210> 83
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 83
Ile Asp Leu Thr Thr Ile Val Lys Pro Glu Ala Pro Phe Asp Leu
1 5 10 15
<210> 84
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 84
Thr Ile Val Lys Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr
1 5 10 15
<210> 85
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 85
Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala
1 5 10 15
<210> 86
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 86
Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn Asp Phe Val
1 5 10 15
<210> 87
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 87
Val Ile Tyr Arg Glu Gly Ala Asn Asp Phe Val Val Thr Phe Asn
1 5 10 15
<210> 88
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 88
Glu Gly Ala Asn Asp Phe Val Val Thr Phe Asn Thr Ser His Leu
1 5 10 15
<210> 89
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 89
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr
1 5 10 15
<210> 90
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 90
Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val Lys Val Leu
1 5 10 15
<210> 91
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 91
Ser His Leu Gln Lys Lys Tyr Val Lys Val Leu Met His Asp Val
1 5 10 15
<210> 92
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 92
Lys Lys Tyr Val Lys Val Leu Met His Asp Val Ala Tyr Arg Gln
1 5 10 15
<210> 93
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 93
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu
1 5 10 15
<210> 94
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 94
His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn Lys Trp Thr
1 5 10 15
<210> 95
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 95
Tyr Arg Gln Glu Lys Asp Glu Asn Lys Trp Thr His Val Asn Leu
1 5 10 15
<210> 96
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 96
Lys Asp Glu Asn Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys
1 5 10 15
<210> 97
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 97
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu
1 5 10 15
<210> 98
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 98
Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln Arg Lys Leu
1 5 10 15
<210> 99
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 99
Ser Thr Lys Leu Thr Leu Leu Gln Arg Lys Leu Gln Pro Ala Ala
1 5 10 15
<210> 100
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 100
Thr Leu Leu Gln Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile
1 5 10 15
<210> 101
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 101
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser
1 5 10 15
<210> 102
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 102
Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp His
1 5 10 15
<210> 103
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 103
Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly
1 5 10 15
<210> 104
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 104
Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu
1 5 10 15
<210> 105
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 105
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser
1 5 10 15
<210> 106
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 106
Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe Arg
1 5 10 15
<210> 107
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 107
Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe Arg Thr Pro Glu Ile
1 5 10 15
<210> 108
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 108
Ser Pro Ser Tyr Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser
1 5 10 15
<210> 109
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 109
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp
1 5 10 15
<210> 110
<211> 31
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 110
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
1 5 10 15
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val
20 25 30
<210> 111
<211> 31
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 111
Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe
1 5 10 15
Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe Arg Thr Pro Glu Ile
20 25 30
<210> 112
<211> 327
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 112
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys
325
<210> 113
<211> 459
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 113
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp
20 25 30
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val
35 40 45
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val
50 55 60
Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val
65 70 75 80
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
85 90 95
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly
100 105 110
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys
115 120 125
Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn
130 135 140
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val
145 150 155 160
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn
165 170 175
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln
180 185 190
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile
195 200 205
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr
210 215 220
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro
225 230 235 240
Ile Leu Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser Val Ala Leu Leu
245 250 255
Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile Lys Pro Ile Val
260 265 270
Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu His Leu Cys Lys
275 280 285
Lys Pro Arg Lys Asn Leu Asn Val Ser Phe Asn Pro Glu Ser Phe Leu
290 295 300
Asp Cys Gln Ile His Arg Val Asp Asp Ile Gln Ala Arg Asp Glu Val
305 310 315 320
Glu Gly Phe Leu Gln Asp Thr Phe Pro Gln Gln Leu Glu Glu Ser Glu
325 330 335
Lys Gln Arg Leu Gly Gly Asp Val Gln Ser Pro Asn Cys Pro Ser Glu
340 345 350
Asp Val Val Ile Thr Pro Glu Ser Phe Gly Arg Asp Ser Ser Leu Thr
355 360 365
Cys Leu Ala Gly Asn Val Ser Ala Cys Asp Ala Pro Ile Leu Ser Ser
370 375 380
Ser Arg Ser Leu Asp Cys Arg Glu Ser Gly Lys Asn Gly Pro His Val
385 390 395 400
Tyr Gln Asp Leu Leu Leu Ser Leu Gly Thr Thr Asn Ser Thr Leu Pro
405 410 415
Pro Pro Phe Ser Leu Gln Ser Gly Ile Leu Thr Leu Asn Pro Val Ala
420 425 430
Gln Gly Gln Pro Ile Leu Thr Ser Leu Gly Ser Asn Gln Glu Glu Ala
435 440 445
Tyr Val Thr Met Ser Ser Phe Tyr Gln Asn Gln
450 455
<210> 114
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 114
Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp Ala Glu Leu Asp
1 5 10 15
Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val Asn Gly Ser Gln
20 25 30
His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val Asn Thr Thr Asn
35 40 45
Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val Lys Cys Leu Asn
50 55 60
Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys Phe Leu
65 70 75 80
Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly Glu Lys Ser Leu
85 90 95
Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys Pro Glu Ala Pro
100 105 110
Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn Asp Phe Val Val
115 120 125
Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val Lys Val Leu Met
130 135 140
His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn Lys Trp Thr His
145 150 155 160
Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln Arg Lys Leu Gln
165 170 175
Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr
180 185 190
Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe Arg Thr
195 200 205
Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp
210 215
<210> 115
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 115
Phe Ile Glu Thr Lys Lys Phe
1 5
<210> 116
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 116
Asp Leu Ser Val Ile Tyr
1 5
<210> 117
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 117
Phe Lys Gly Phe
1
<210> 118
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 118
Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys Phe
1 5 10
<210> 119
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 119
Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys Phe
1 5 10 15
<210> 120
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 120
Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn Asp Phe Val Val Thr
1 5 10 15
Phe
<210> 121
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 121
Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr
1 5 10
<210> 122
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 122
Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe
1 5 10 15
<210> 123
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 123
Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe Trp
1 5 10 15
<210> 124
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 124
Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe Trp
1 5 10 15
Ser Glu Trp
<210> 125
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 125
Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe Trp
1 5 10 15
Ser Glu Trp Ser Pro Ser Tyr
20
<210> 126
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 126
Phe Lys Gly Phe Trp Ser Glu Trp
1 5
<210> 127
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 127
Ile Tyr Phe Ile Glu Thr Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn
1 5 10 15
Ile Cys Val Lys Val Gly Glu
20
<210> 128
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 128
Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys Pro
1 5 10 15
Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu
20 25
<210> 129
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 129
Leu Thr Thr Ile Val Lys Pro Glu Ala Pro Phe Asp Leu Ser Val Ile
1 5 10 15
Tyr Arg Glu
<210> 130
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 130
Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu
1 5 10
<210> 131
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 131
Asn Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu
1 5 10 15
Gln Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu
20 25
<210> 132
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic sequence
<400> 132
Ile Lys Val Arg Ser Ile Pro Asp His Tyr Phe Lys Gly Phe Trp Ser
1 5 10 15
Glu
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Антитела к TSLP человека и их применение | 2021 |
|
RU2825460C1 |
| АНТИТЕЛА И ПОЛИПЕПТИДЫ, НАПРАВЛЕННЫЕ ПРОТИВ CD127 | 2017 |
|
RU2769352C2 |
| АНТИТЕЛО, СПОСОБНОЕ СВЯЗЫВАТЬСЯ С ТИМИЧЕСКИМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2825304C2 |
| IL-12 ГЕТЕРОДИМЕРНЫЕ СЛИТЫЕ БЕЛКИ FC | 2019 |
|
RU2819097C2 |
| ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ОДИНОЧНЫЕ ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ИММУНОГЛОБУЛИНОВ, НАЦЕЛИВАЮЩИЕСЯ НА IL-13 И TSLP | 2020 |
|
RU2836310C1 |
| АНТИ-TSLP АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2834227C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ СВЯЗАННЫХ С IL-8 ЗАБОЛЕВАНИЙ | 2017 |
|
RU2766112C2 |
| КОМПОЗИЦИЯ ДЛЯ КУЛЬТИВИРОВАНИЯ РЕГУЛЯТОРНЫХ Т-КЛЕТОК И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807802C1 |
| ПОЛИПЕПТИД, ВКЛЮЧАЮЩИЙ АНТИГЕНСВЯЗЫВАЮЩИЙ ДОМЕН И ТРАНСПОРТИРУЮЩИЙ СЕГМЕНТ | 2018 |
|
RU2815452C2 |
| ЛИГАНДСВЯЗЫВАЮЩАЯ МОЛЕКУЛА С РЕГУЛИРУЕМОЙ ЛИГАНДСВЯЗЫВАЮЩЕЙ АКТИВНОСТЬЮ | 2017 |
|
RU2803067C2 |
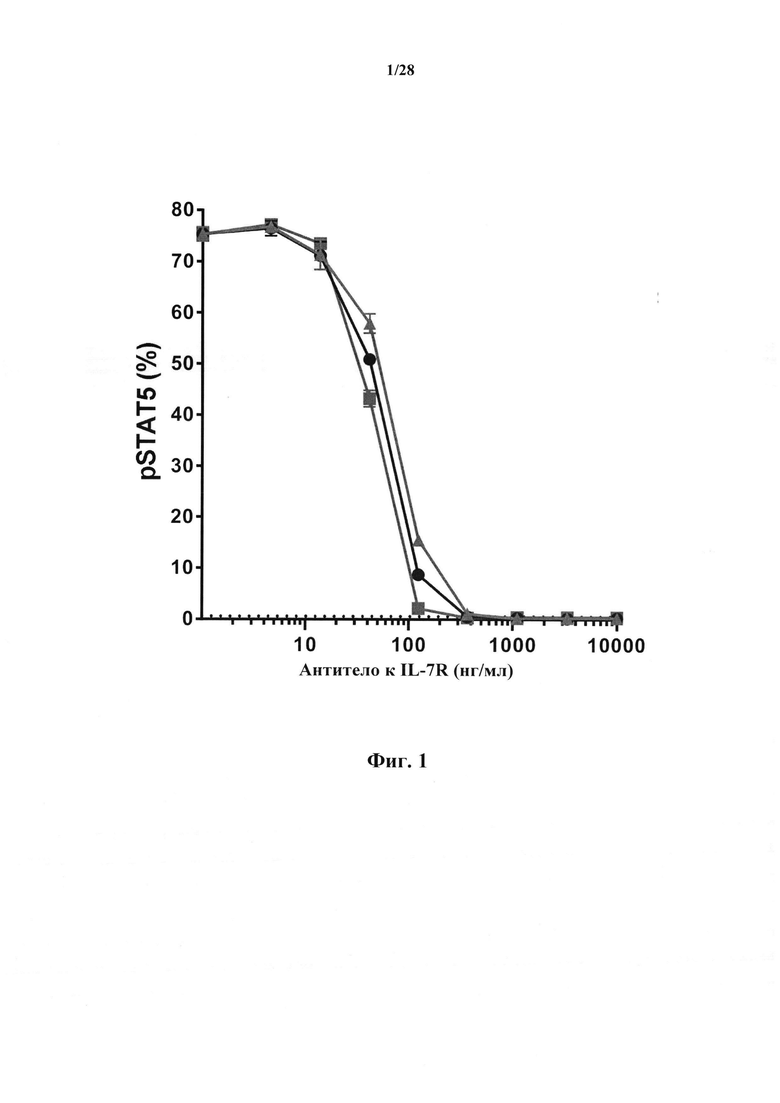
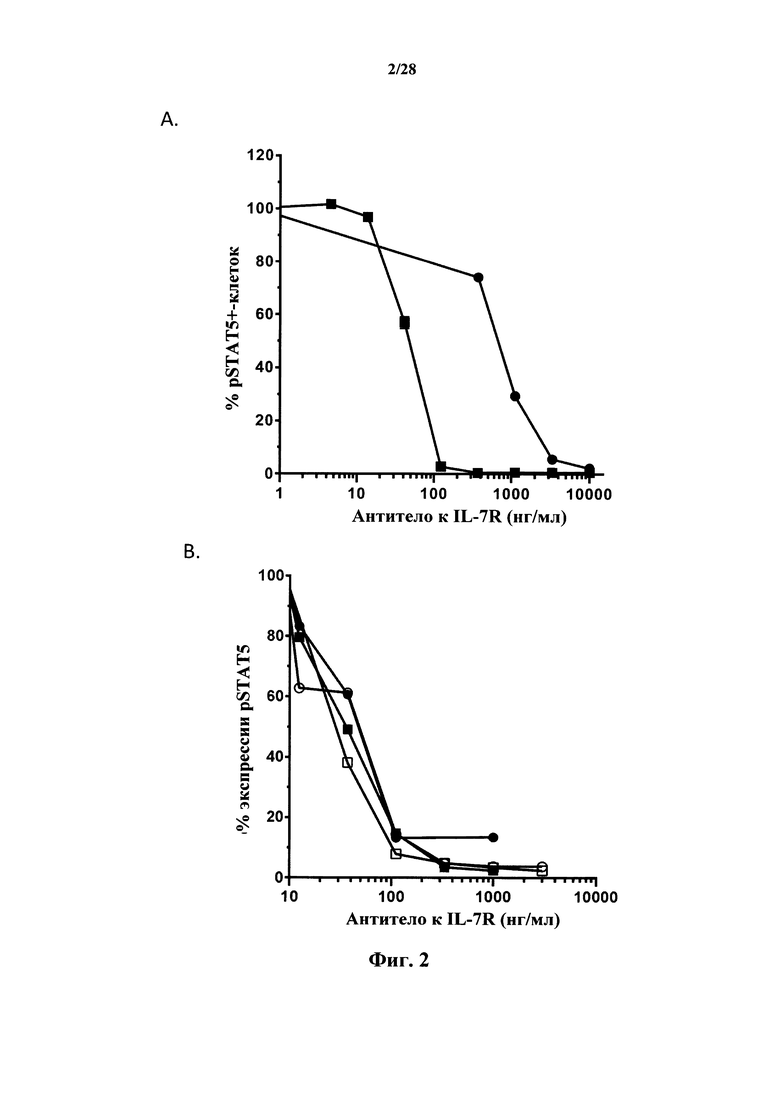
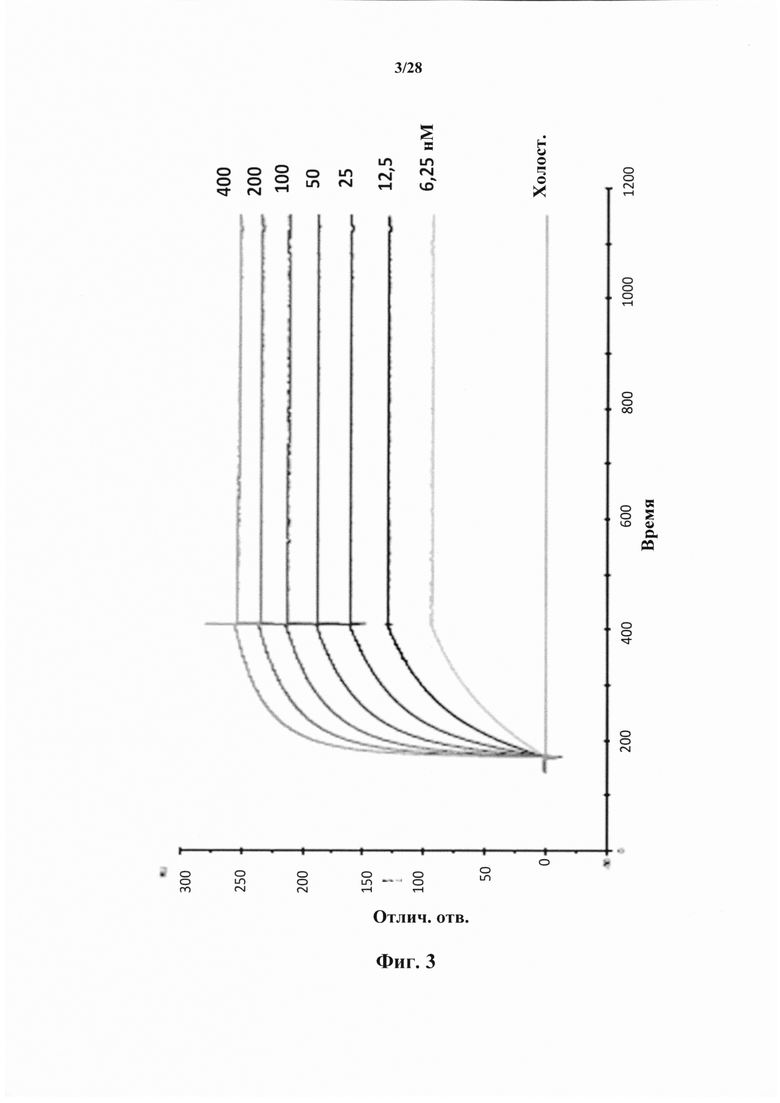
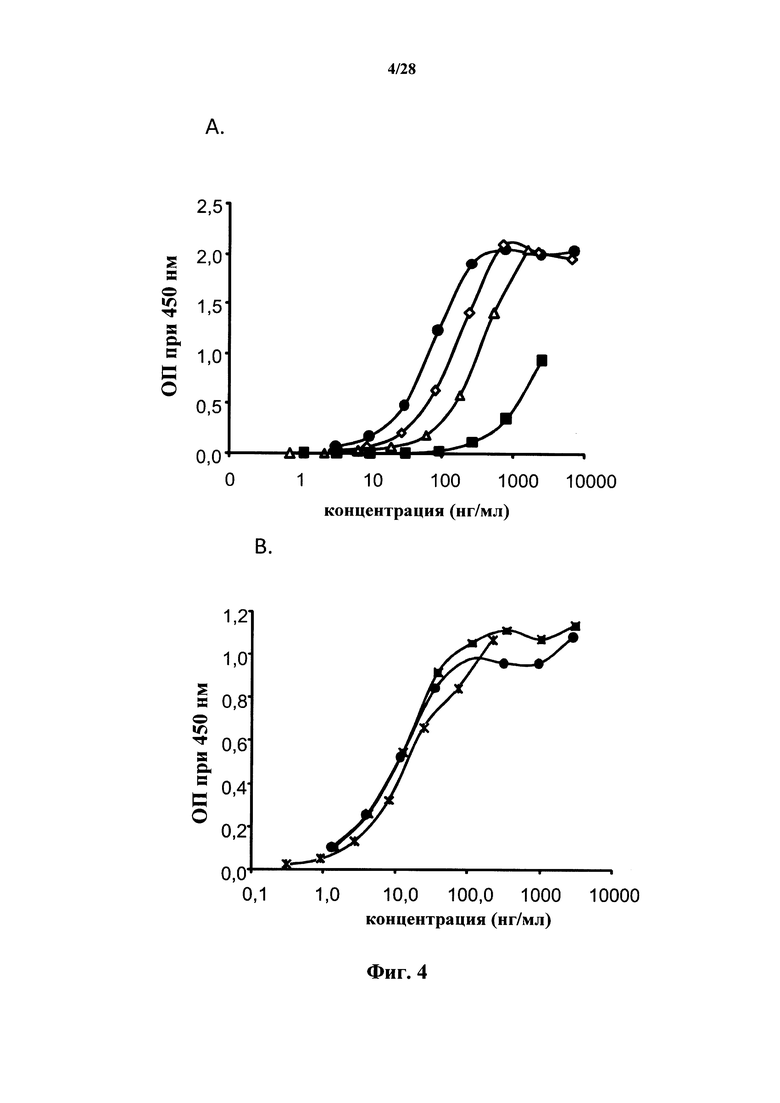
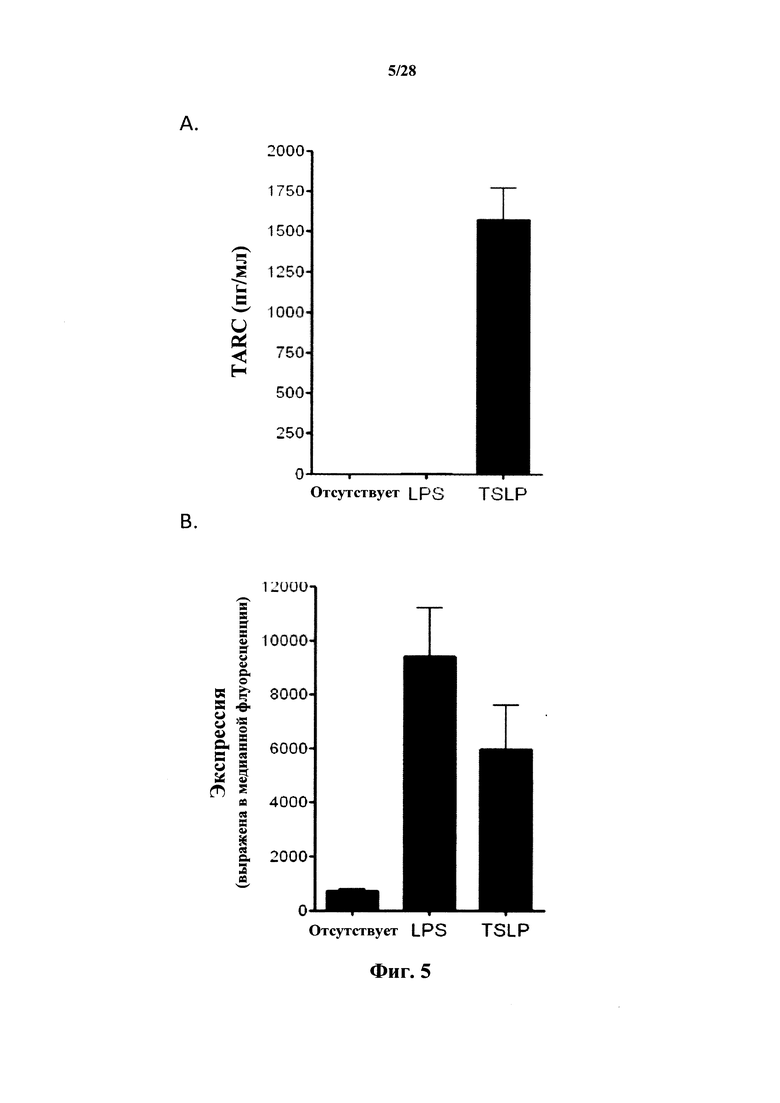
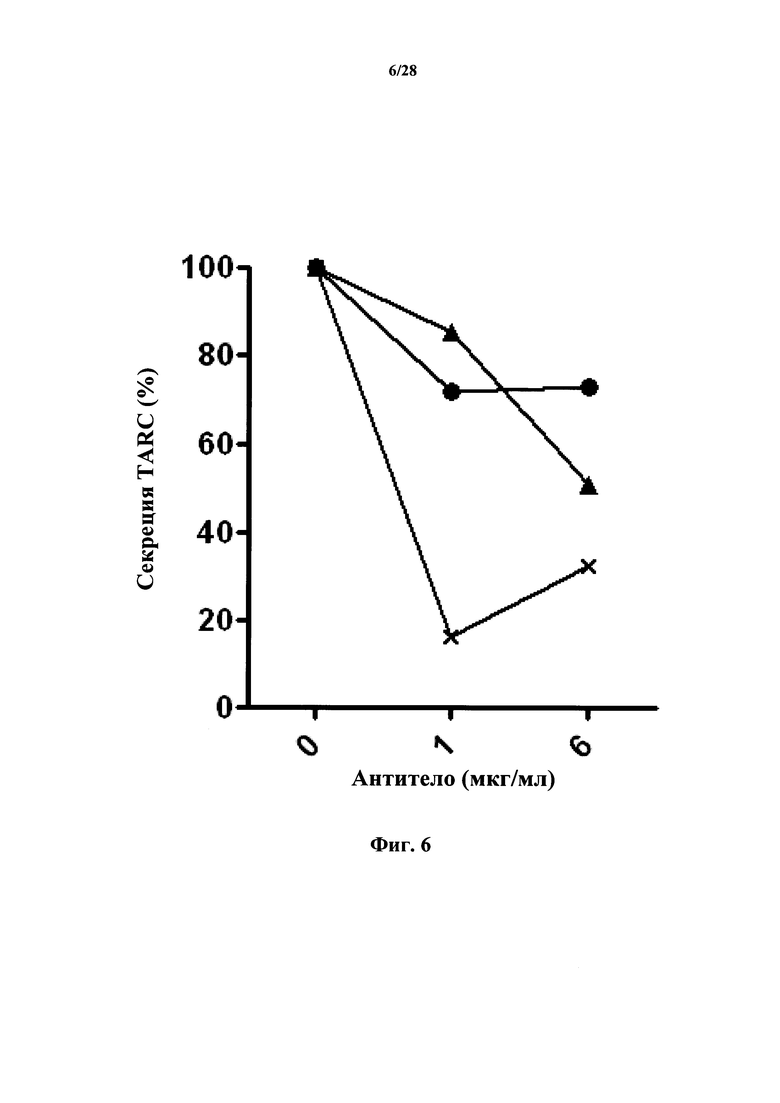
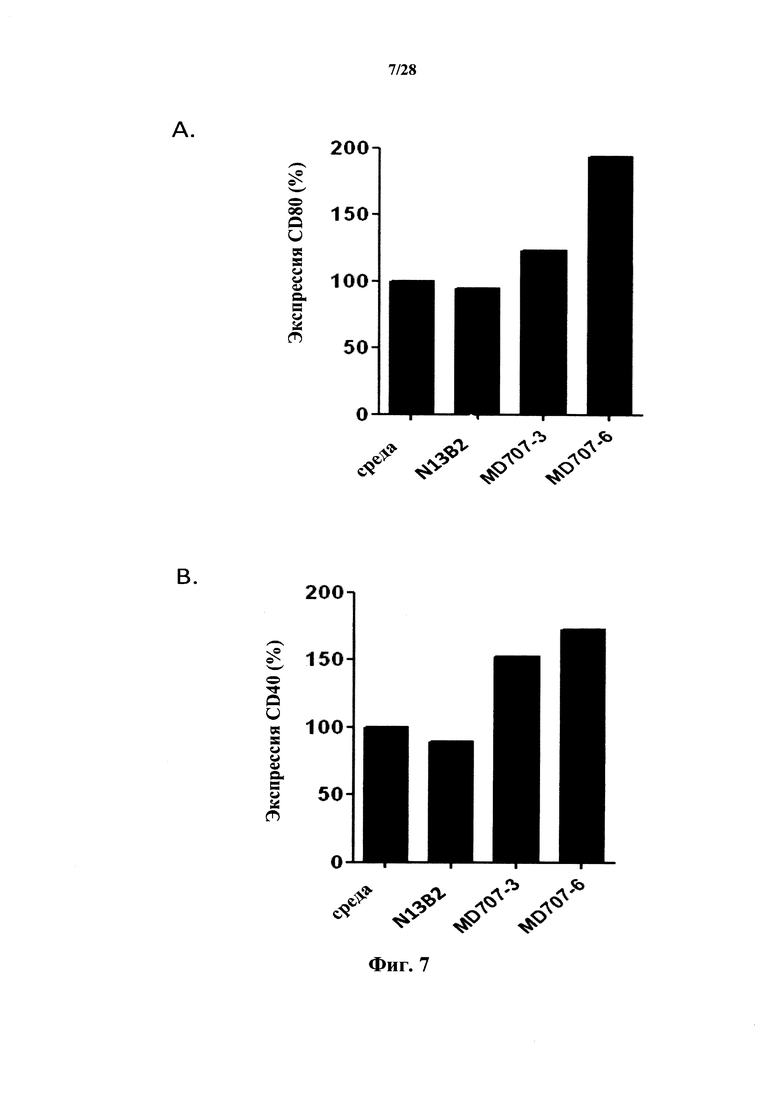
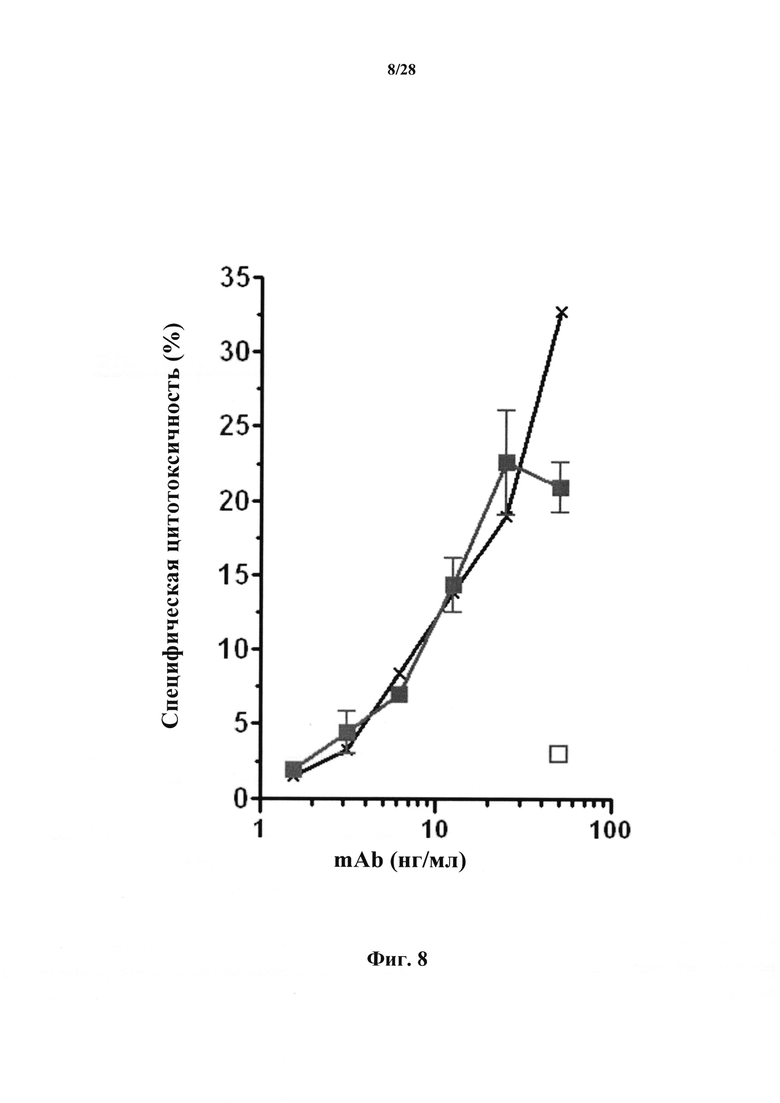
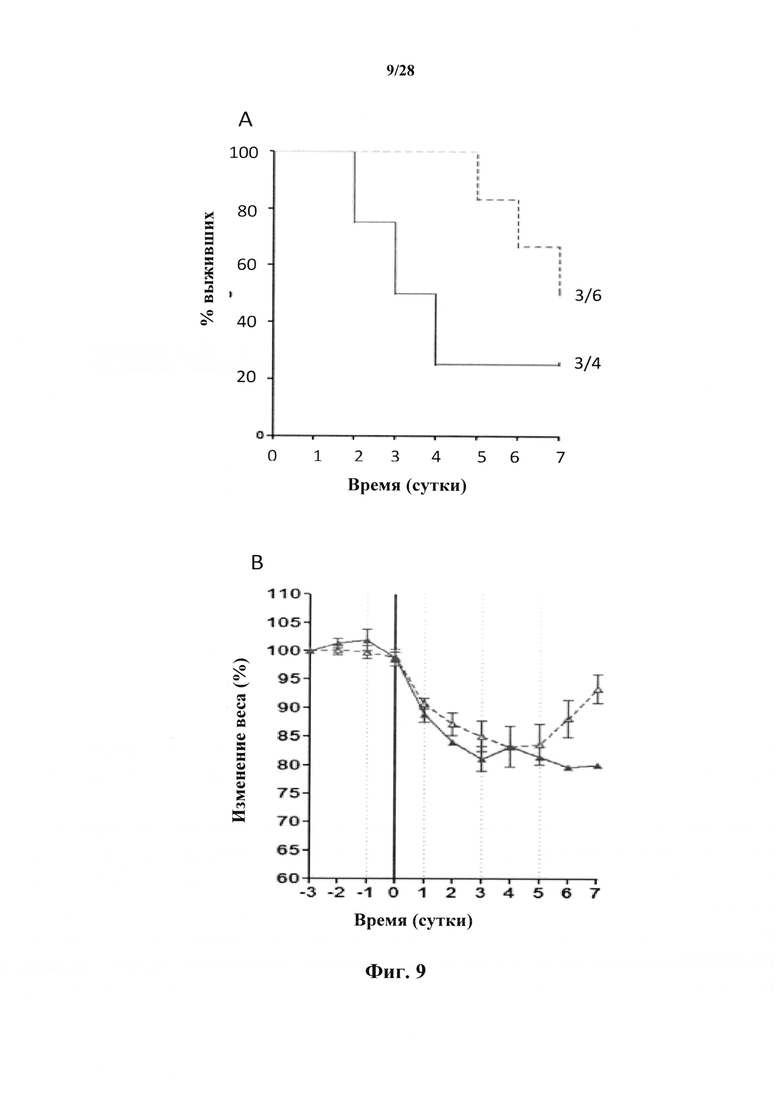



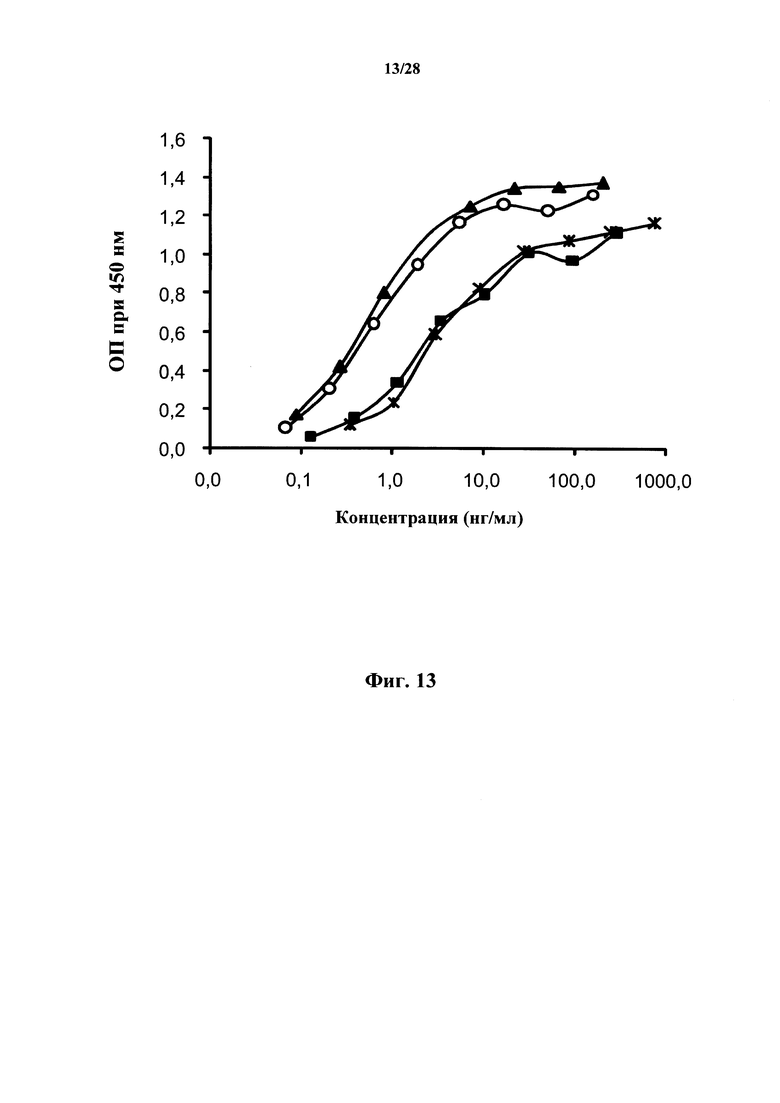
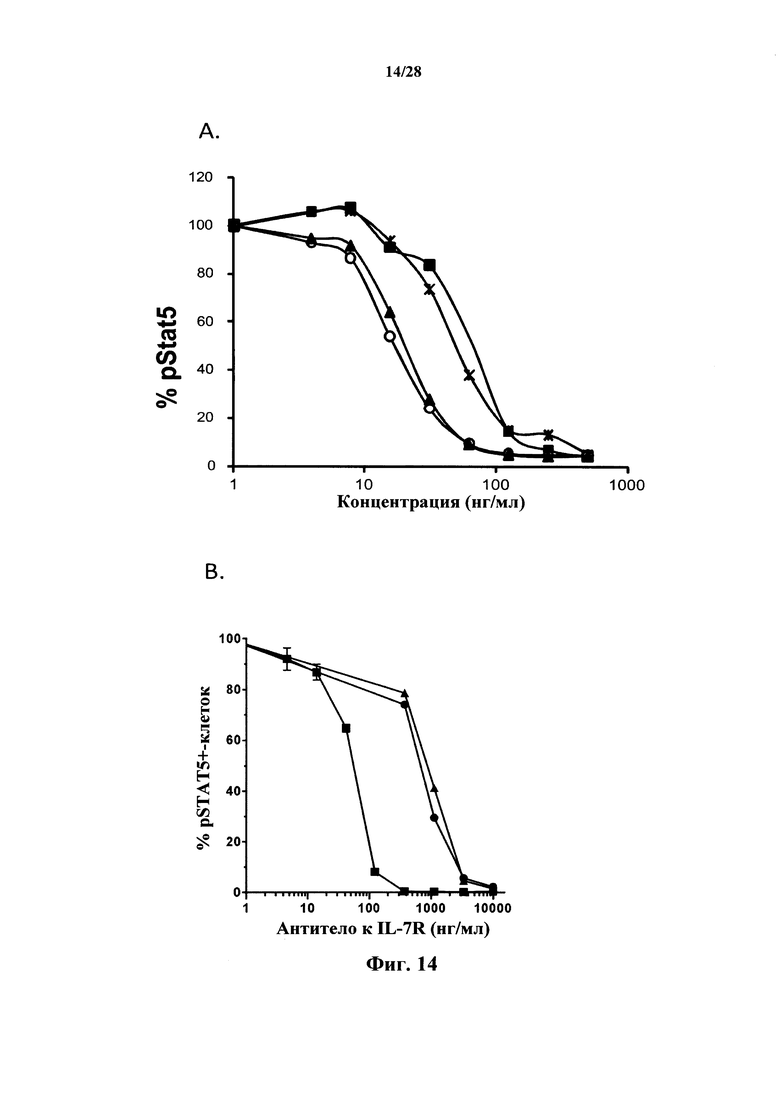
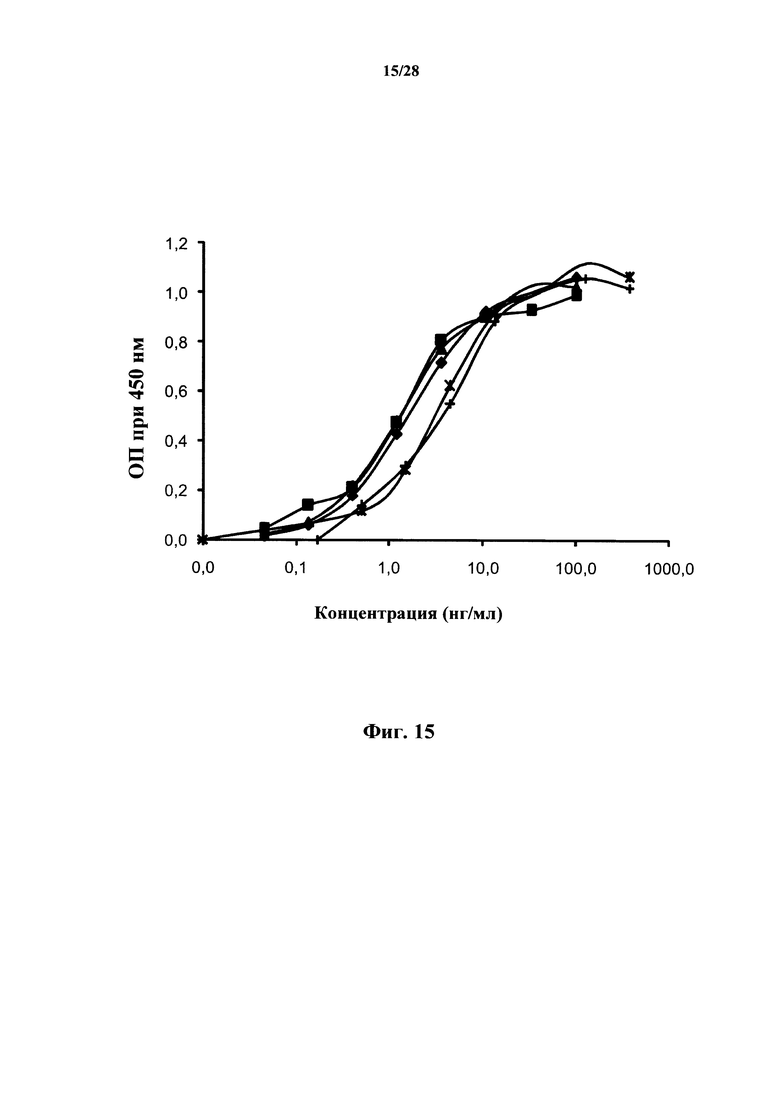
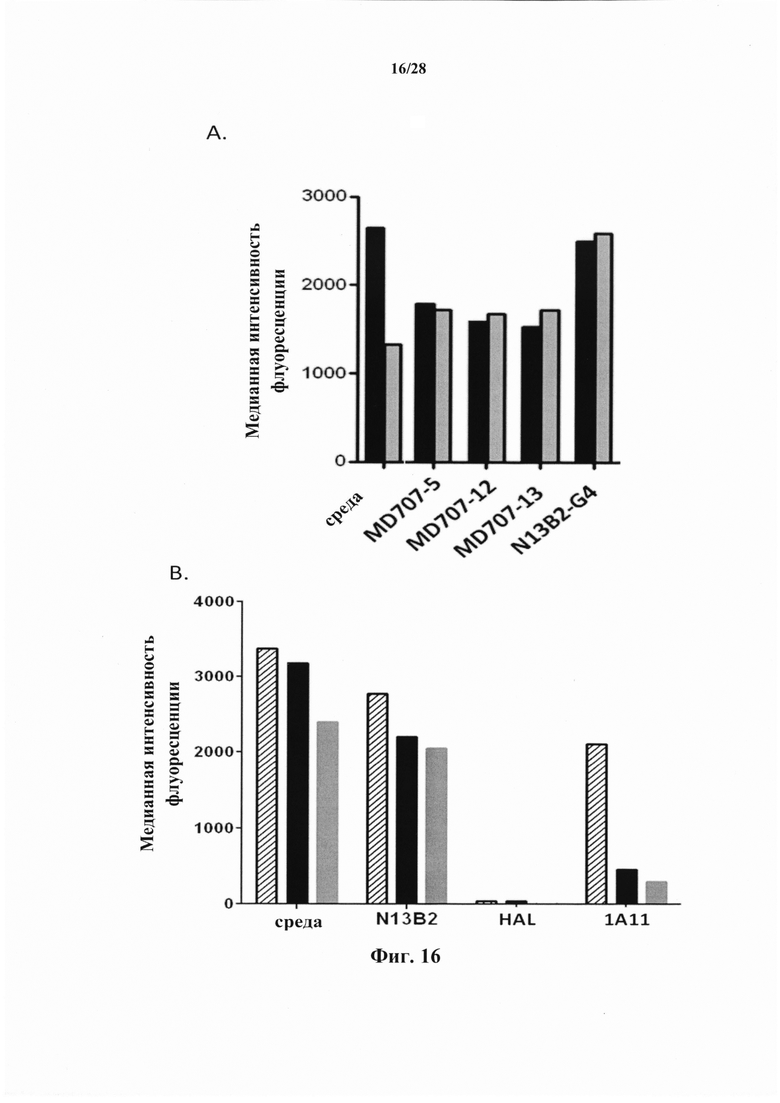
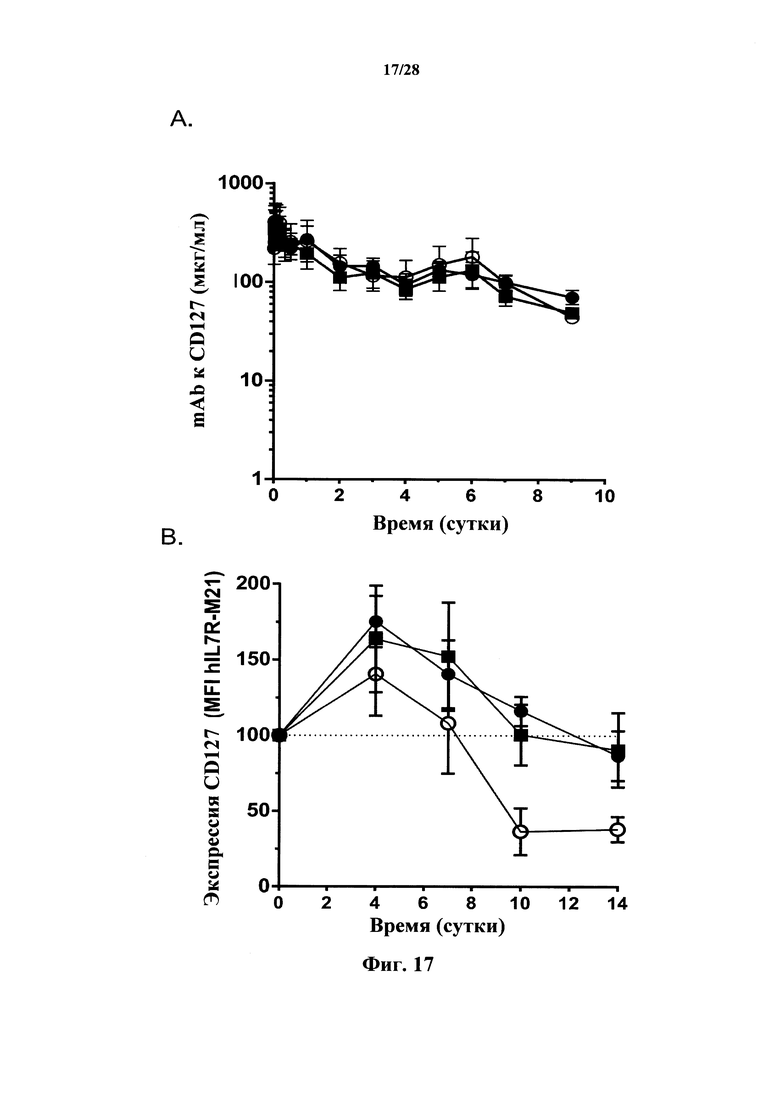
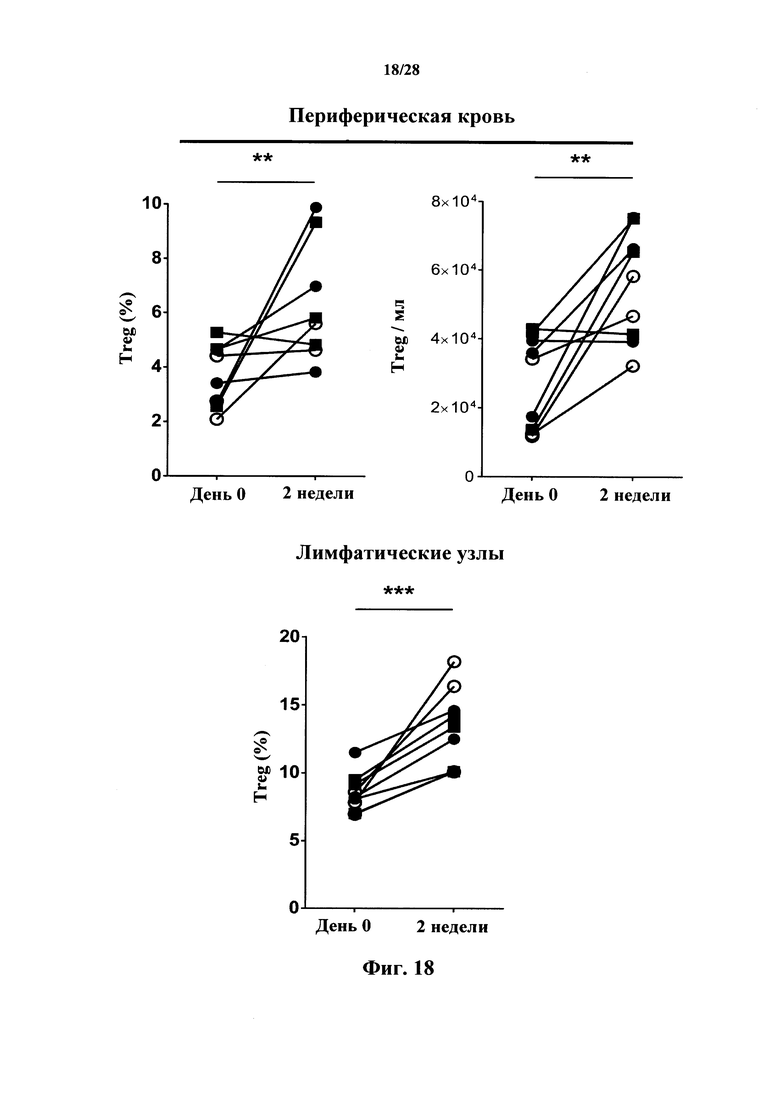
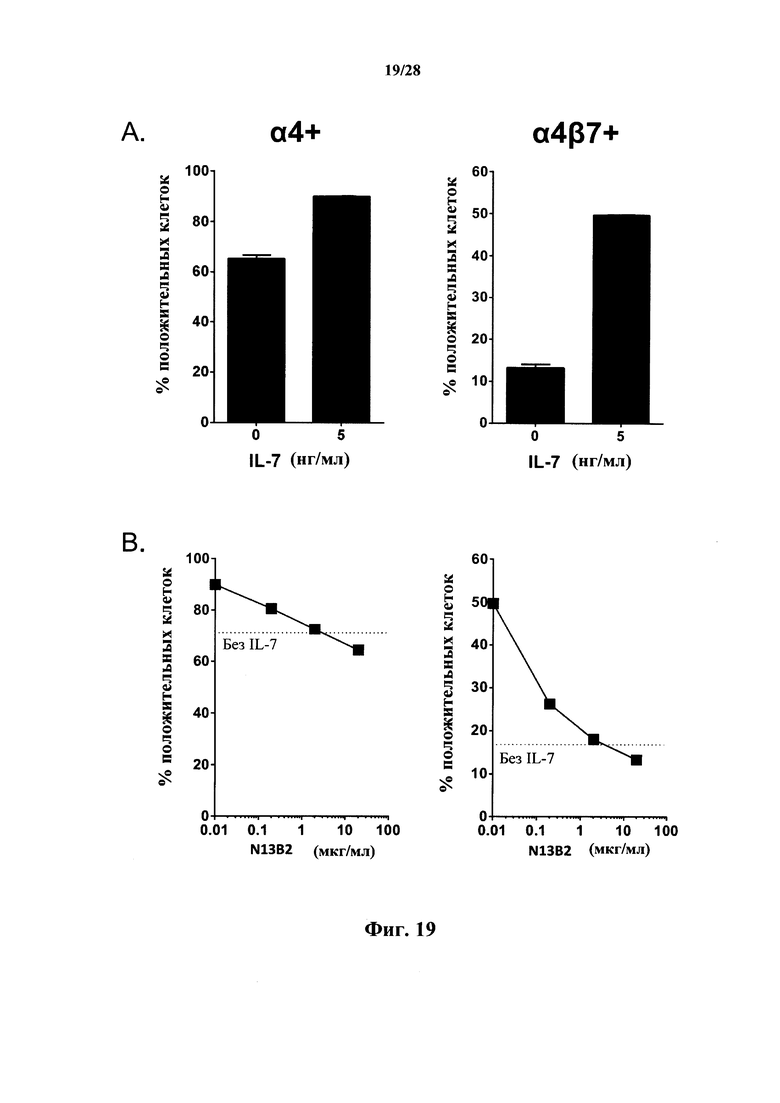
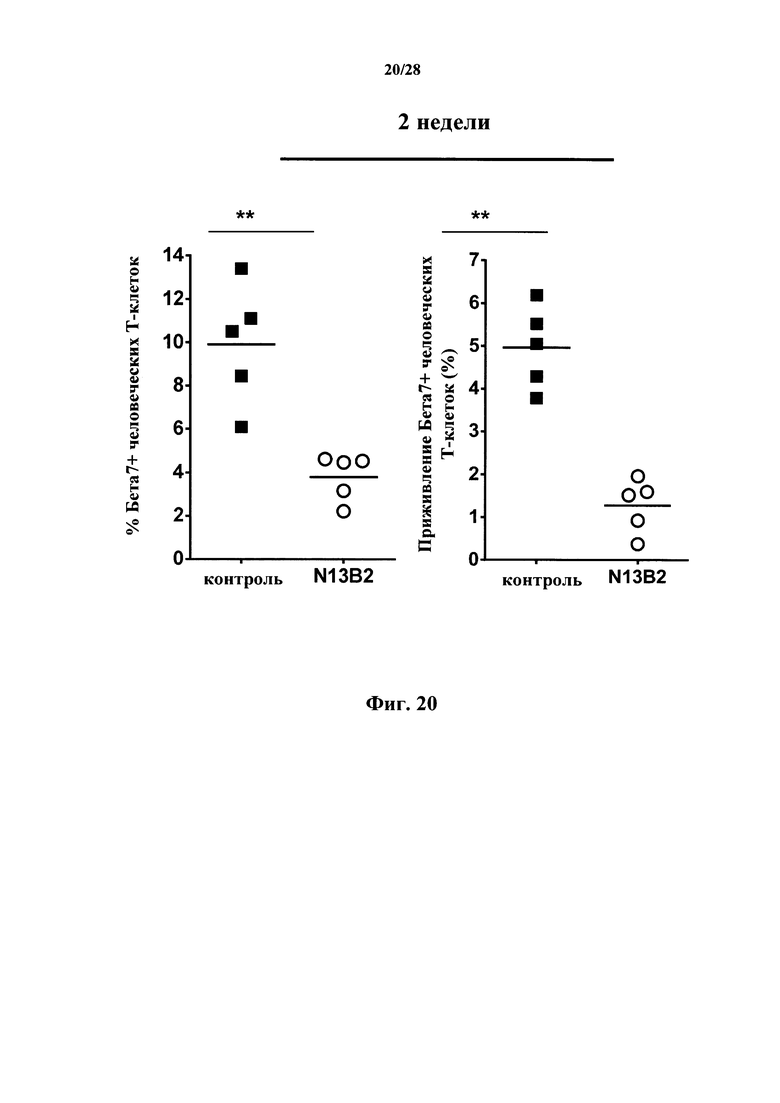
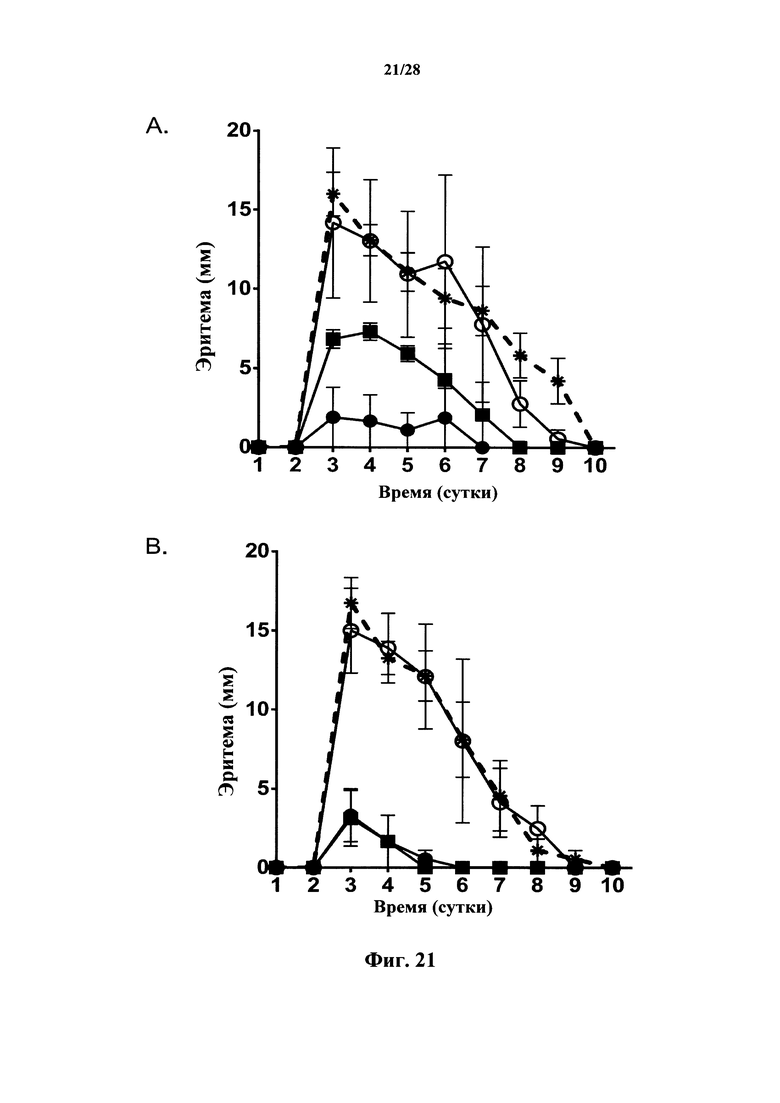
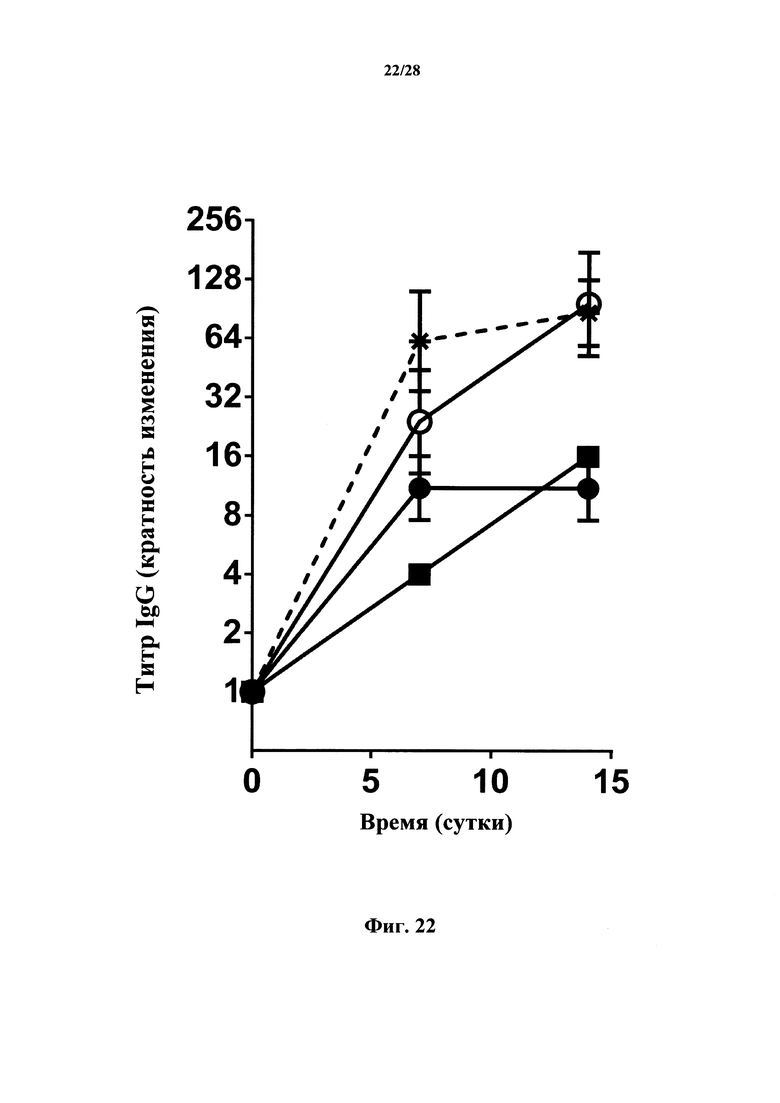


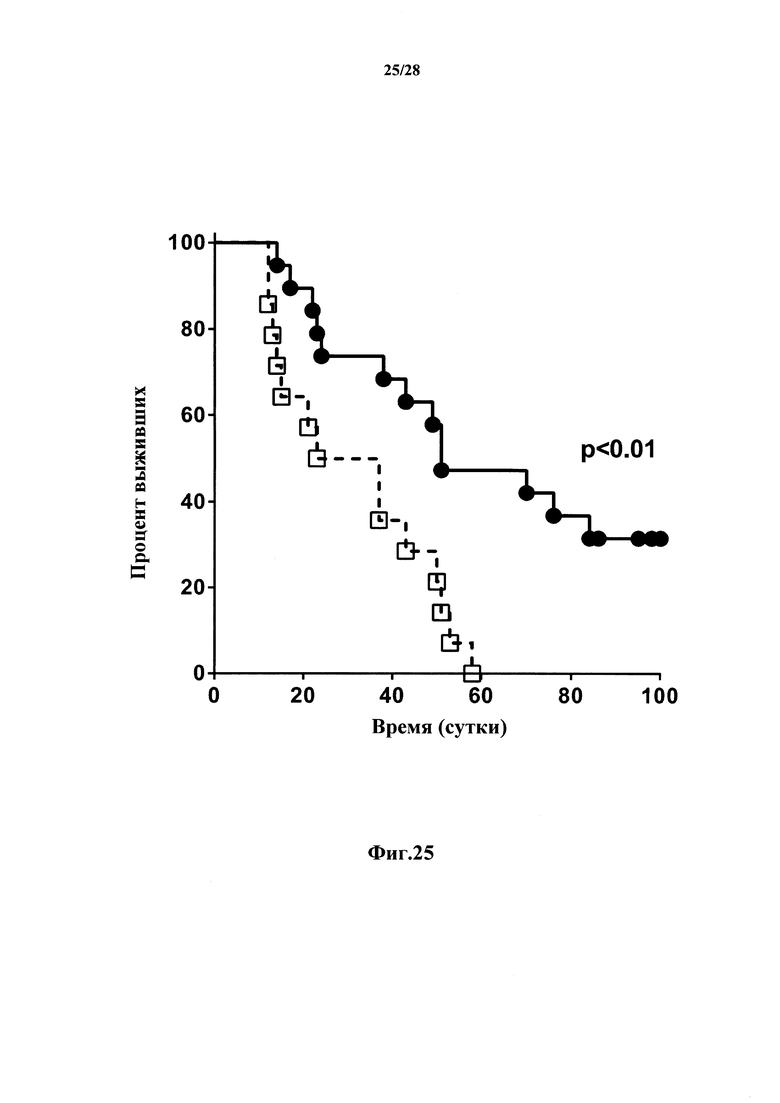
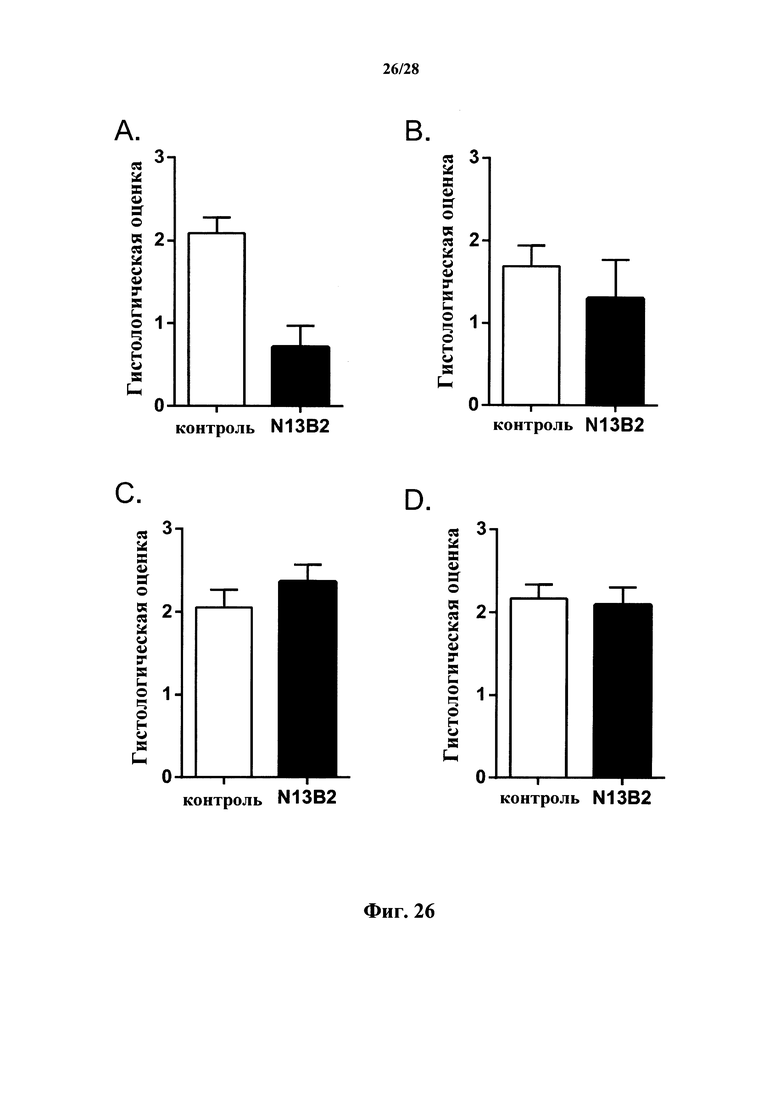

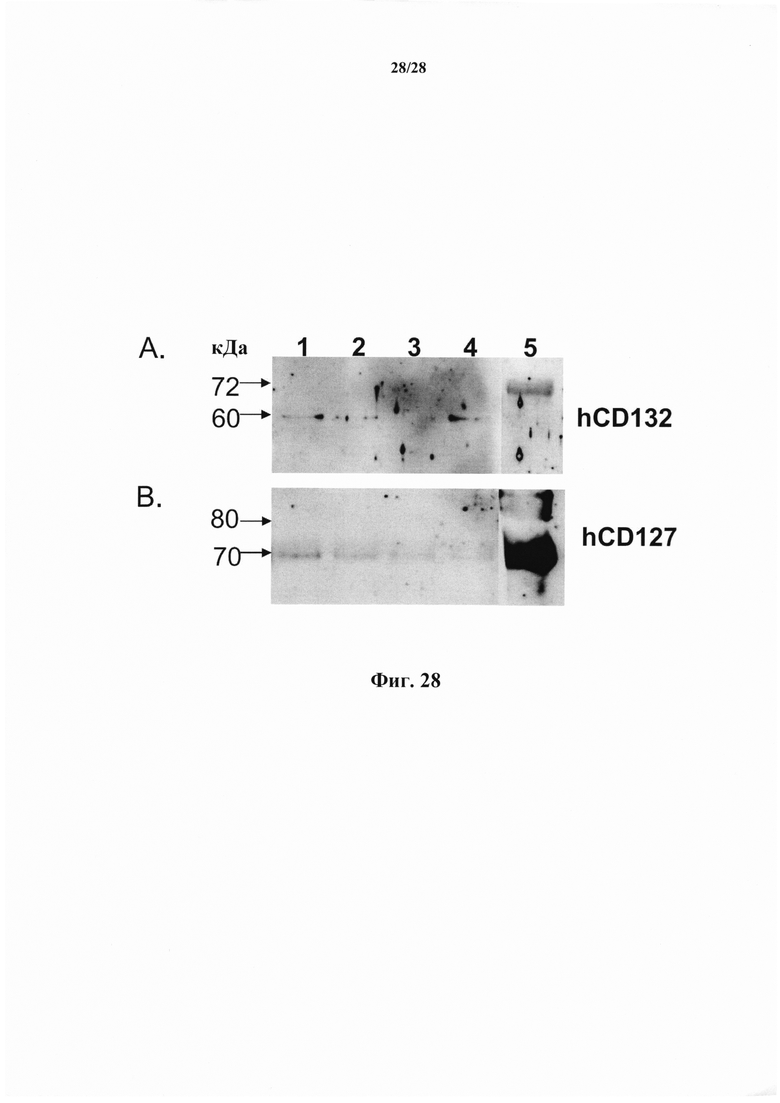
Группа изобретений относится к антителу или его антигенсвязывающему фрагменту, которые специфично связываются с CD127 и применению указанного антитела или его антигенсвязывающего фрагмента. Антитело или его антигенсвязывающий фрагмент содержат VH-цепь, содержащую следующие аминокислотные последовательности VHCDR1 SEQ ID No: 10, VHCDR2 SEQ ID No: 12, VHCDR3 SEQ ID No: 14 или SEQ ID No: 48; и VL-цепь, содержащую следующие аминокислотные последовательности VLCDR1 SEQ ID No: 16 или SEQ ID No: 50; VLCDR2 SEQ ID No: 18 или SEQ ID No: 52; VLCDR3 SEQ ID No: 20. Предложены также макромолекула, представляющая собой конъюгат и содержащая указанное антитело или его антигенсвязывающий фрагмент; молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент. Предложена также фармацевтическая композиция, содержащая указанное антитело или его антигенсвязывающий фрагмент, или указанную макромолекулу, или указанную молекулу нуклеиновой кислоты. Данные антитело или его антигенсвязывающий фрагмент, макромолекула, молекула нуклеиновой кислоты, фармацевтическая композиция могут применяться для лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7. Предложены также способ лечения, способ получения антитела и способ отбора антитела. Предложенное антитело или его антигенсвязывающий фрагмент характеризуются высокой эффективностью. 19 н. и 16 з.п. ф-лы, 12 табл., 21 пр., 28 ил.
1. Антитело или его антигенсвязывающий фрагмент, которые специфично связываются с CD127, и
содержат VH-цепь, содержащую следующие аминокислотные последовательности:
• VHCDR1 SEQ ID No: 10;
• VHCDR2 SEQ ID No: 12;
• VHCDR3 SEQ ID No: 14 или SEQ ID No: 48;
и VL-цепь, содержащую следующие аминокислотные последовательности:
VLCDR1 SEQ ID No: 16 или SEQ ID No: 50;
VLCDR2 SEQ ID No: 18 или SEQ ID No: 52;
VLCDR3 SEQ ID No: 20.
2. Антитело, или его антигенсвязывающий фрагмент по п. 1, которые специфично связываются с CD127, и не индуцируют интернализацию CD127.
3. Антитело, или его антигенсвязывающий фрагмент по п. 1 или 2, которые специфично связываются с CD127 и ингибируют индуцируемую IL-7 интернализацию CD127.
4. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-3, которые специфично связываются с CD127 и тем самым нарушают связывание CD127 с общей γс-цепью цитокиновых рецепторов.
5. Антитело, или его антигенсвязывающий фрагмент, по любому из пп. 1-4, которые являются антагонистами индуцируемой IL-7 передачи сигнала с участием IL-7R.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-5, которые специфично связываются с CD127 и не повышают созревание дендритных клеток, индуцируемое TSLP.
7. Антитело или его антигенсвязывающий фрагмент по пп. 1-6, которое содержит:
- тяжелую цепь с последовательностью SEQ ID No: 2, или SEQ ID No: 6, или SEQ ID No: 54 или содержит последовательность SEQ ID No: 22, или SEQ ID No: 36, или SEQ ID No: 38, или SEQ ID No: 40; и
- легкую цепь с последовательностью SEQ ID No: 4 или SEQ ID No: 56 или содержит последовательность SEQ ID No: 24, или SEQ ID No: 42, или SEQ ID No: 44, или SEQ ID No: 46.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7, которое представляет собой химерное антитело, или гуманизированное антитело, или деиммунизированное антитело.
9. Макромолекула, которая представляет собой конъюгат, специфично связывающийся с CD127, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8, связанные с функционально отличающейся молекулой.
10. Молекула нуклеиновой кислоты, кодирующая антитело, его антигенсвязывающий фрагмент по любому из пп. 1-8, и содержащие в частности, аминокислоту, выбранную из группы, состоящей из SEQ ID No: 2; SEQ ID No: 4; SEQ ID No: 6; SEQ ID No: 8; SEQ ID No: 10; SEQ ID No: 12; SEQ ID No: 14; SEQ ID No: 16; SEQ ID No: 18; SEQ ID No: 20; SEQ ID No: 22; SEQ ID No: 24; SEQ ID No: 36; SEQ ID No: 38; SEQ ID No: 40; SEQ ID No: 42; SEQ ID No: 44; SEQ ID No: 46; SEQ ID No: 48; SEQ ID No: 50; SEQ ID No: 52; SEQ ID No: 54 и SEQ ID No: 56, в частности, содержащая молекула нуклеиновой кислоты, которая выбрана из группы, состоящей из SEQ ID No: 1; SEQ ID No: 3; SEQ ID No: 5; SEQ ID No: 7; SEQ ID No: 9; SEQ ID No: 11; SEQ ID No: 13; SEQ ID No: 15; SEQ ID No: 17; SEQ ID No: 19; SEQ ID No: 21; SEQ ID No: 23;; SEQ ID No: 35; SEQ ID No: 37; SEQ ID No: 39; SEQ ID No: 41; SEQ ID No: 43; SEQ ID No: 45; SEQ ID No: 47; SEQ ID No: 49; SEQ ID No: 51; SEQ ID No: 53 и SEQ ID No: 55.
11. Фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-8, или макромолекулу по п. 9, или молекулу нуклеиновой кислоты по п. 10, с фармацевтическим носителем для лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7, причем указанная фармацевтическая композиция необязательно содержит дополнительный отличающийся активный ингредиент, в частности, дополнительное соединение, характеризующееся терапевтическим иммуномодулирующим эффектом, в частности, в отношении клеток, вовлеченных в аутоиммунное заболевание или аллергическое заболевание, лейкоз, такой как острый лимфобластный лейкоз, лимфому, злокачественное заболевание, хроническую вирусную инфекцию, воспалительные заболевания, трансплантацию, респираторные заболевания или аутоиммунную реакцию.
12. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8, в качестве терапевтически активного ингредиента для изготовления лекарственного средства, для использования в комбинации или в составе схемы дополнительной терапии у пациента для лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7.
13. Применение макромолекулы по п. 9 в качестве терапевтически активного ингредиента в комбинации или в составе схемы дополнительной терапии у пациента для лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7.
14. Применение молекулы нуклеиновой кислоты по п. 10 в качестве терапевтически активного ингредиента для изготовления лекарственного средства в комбинации или в составе схемы дополнительной терапии у пациента для лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7.
15. Применение фармацевтической композиции по п. 11 в качестве терапевтически активного ингредиента для изготовления лекарственного средства в комбинации или в составе схемы дополнительной терапии у пациента для лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7.
16. Применение антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8 для изготовления лекарственного средства для лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7.
17. Применение по п. 16 для изготовления лекарственного средства для лечения пациента с заболеванием или с риском заболевания, выбранного из аутоиммунного заболевания, такого как ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит или волчанка, или воспалительного заболевания, такого как воспалительное заболевание кишечника (IBD) и энцефаломиелит, или аллергического заболевания, или злокачественного заболевания, или респираторного заболевания, или заболевания, связанного с трансплантацией.
18. Применение макромолекулы по п. 9 для изготовления лекарственного средства для лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7.
19. Применение по п. 18, для изготовления лекарственного средства для лечения пациента с заболеванием или с риском заболевания, выбранного из аутоиммунного заболевания, такого как ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит или волчанка, или воспалительного заболевания, такого как воспалительное заболевание кишечника (IBD) и энцефаломиелит, или аллергического заболевания, или злокачественного заболевания, или респираторного заболевания, или заболевания, связанного с трансплантацией.
20. Применение молекулы нуклеиновой кислоты по п. 10 для изготовления лекарственного средства лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7.
21. Применение по п. 20 для изготовления лекарственного средства для лечения пациента с заболеванием или с риском заболевания, выбранного из аутоиммунного заболевания, такого как ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит или волчанка, или воспалительного заболевания, такого как воспалительное заболевание кишечника (IBD) и энцефаломиелит, или аллергического заболевания, или злокачественного заболевания, или респираторного заболевания, или заболевания, связанного с трансплантацией.
22. Применение фармацевтической композиции по п. 11 для изготовления лекарственного средства лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7.
23. Применение по п. 22 для изготовления лекарственного средства для лечения пациента с заболеванием или с риском заболевания, выбранного из аутоиммунного заболевания, такого как ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит или волчанка, или воспалительного заболевания, такого как воспалительное заболевание кишечника (IBD) и энцефаломиелит, или аллергического заболевания, или злокачественного заболевания, или респираторного заболевания, или заболевания, связанного с трансплантацией.
24. Способ лечения пациента, в частности пациента-человека, лечения состояния, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7, где способ включает введение пациенту антитела или его антигенсвязывающего фрагмента по любому из пп. 1-8.
25. Способ лечения по п. 24, где пациент, в частности пациент-человек, имеет заболевание или риск заболевания, выбранного из аутоиммунного заболевания, такого как ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит или волчанка, или воспалительного заболевания, такого как воспалительное заболевание кишечника (IBD) и энцефаломиелит, или аллергического заболевания, или злокачественного заболевания, или респираторного заболевания, или заболевания, связанного с трансплантацией.
26. Способ лечения пациента, в частности пациента-человека, с риском заболевания, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7, причем указанный способ включает введение пациенту макромолекулы по п. 9.
27. Способ лечения по п. 26, где пациент, в частности пациент-человек, имеет риск заболевания, выбранного из аутоиммунного заболевания, такого как ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит или волчанка, или воспалительного заболевания, такого как воспалительное заболевание кишечника (IBD) и энцефаломиелит, или аллергического заболевания, или злокачественного заболевания, или респираторного заболевания, или заболевания, связанного с трансплантацией.
28. Способ лечения пациента, в частности пациента-человека, с риском заболевания, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7, причем указанный способ включает введение пациенту молекулы нуклеиновой кислоты по п. 10.
29. Способ лечения по п. 28, где пациент, в частности пациент-человек, имеет риск заболевания, выбранного из аутоиммунного заболевания, такого как ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит или волчанка, или воспалительного заболевания, такого как воспалительное заболевание кишечника (IBD) и энцефаломиелит, или аллергического заболевания, или злокачественного заболевания, или респираторного заболевания, или заболевания, связанного с трансплантацией.
30. Способ лечения пациента, в частности пациента-человека, с риском заболевания, которое можно улучшить или предотвратить путем антагонизации сигнального пути IL7-R, индуцированного IL7, причем указанный способ включает введение пациенту фармацевтической композиции по п. 11.
31. Способ лечения по п. 30, где пациент, в частности пациент-человек, имеет риск заболевания, выбранного из аутоиммунного заболевания, такого как ревматоидный артрит, рассеянный склероз, диабет I типа, аутоиммунный тиреоидит или волчанка, или воспалительного заболевания, такого как воспалительное заболевание кишечника (IBD) и энцефаломиелит, или аллергического заболевания, или злокачественного заболевания, или респираторного заболевания, или заболевания, связанного с трансплантацией.
32. Способ получения антитела по любому из пп. 1-7, предусматривающий иммунизацию животного, отличного от человека антигеном, состоящим из последовательности(ей) эпитопа в человеческом CD127, содержащей или состоящей из последовательности SEQ ID No: 86, SEQ ID No: 110 и SEQ ID No: 111,
(i) причем последовательность эпитопа в человеческом CD127, содержащая SEQ ID No: 110, не продолжается так, чтобы она содержала аминокислоты, смежные с указанной последовательностью в последовательности человеческого CD127 более чем на 1 аминокислоту с N-конца или более чем на 7 аминокислот с С-конца; и/или
(ii) причем последовательность эпитопа в человеческом CD127, содержащая SEQ ID No: 111, не продолжается так, чтобы она содержала аминокислоты, смежные с указанной последовательностью в последовательности человеческого CD127 более чем на 30 аминокислот с N-конца или более чем на 30 аминокислот с С-конца.
33. Способ по п. 32, в котором последовательности эпитопа содержат или состоят из последовательности SEQ ID №115, SEQ ID №116 и SEQ ID №117.
34. Способ получения антитела по любому из пп. 1-8, где способ предусматривает
- экспрессирование полинуклеотида, содержащего или состоящего из нуклеотидной последовательности, которая выбрана из группы, состоящей из SEQ ID No: 1; SEQ ID No: 3; SEQ ID No: 5; SEQ ID No: 7; SEQ ID No: 21; SEQ ID No: 23; SEQ ID No: 35; SEQ ID No: 37; SEQ ID No: 39; SEQ ID No: 41; SEQ ID No: 43; SEQ ID No: 45; SEQ ID No: 53 and SEQ ID No: 55; в частности, в клетках, которые характеризуются свойствами слабого фукозилирования, в условиях, обеспечивающих возможность выделения антител; и
- выделение антител, которые являются антагонистами индуцируемой IL-7 передачи сигнала с участием IL-7R.
35. Способ отбора антитела, полученного в соответствии с п. 32 или 34, или его антигенсвязывающего фрагмента, предусматривающий или состоящий из по меньшей мере одной из следующих стадий:
a. исследование связывающей способности антитела или антиген-связывающего фрагмента в отношении CD127, в частности, в отношении его антигена по п. 33 или 34;
b. исследование интернализации CD127 в экспрессирующих CD127 клетках, индуцируемой присутствием антитела или антиген-связывающего фрагмента;
c. исследование ингибирования макромолекулой индуцируемой IL-7 интернализации CD127 в экспрессирующих CD127 клетках;
d. исследование повышения созревания DC, индуцируемого TSLP в присутствии антитела или антиген-связывающего фрагмента;
и необязательно дополнительно предусматривает одну или несколько из следующих стадий:
e. исследование ингибирования антителом или антиген-связывающим фрагментом индуцируемой IL-7 передачи сигнала, в частности, фосфорилирования STAT5;
f. исследование ингибирования макромолекулой индуцируемой TSLP продукции TARC;
g. исследование ингибирования макромолекулой экспрессии α4-, β7- и/или α4/β7-интегринов, в частности, экспрессии на клеточной поверхности на Т-лимфоцитах, за каждой из этих стадий исследования следует отбор одного или нескольких антител или их антиген-связывающих фрагментов с желаемым указанным функциональным признаком, подлежащим исследованию.
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| CHUNG B | |||
| et al | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| BLOOD | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Прибор, автоматически записывающий пройденный путь | 1920 |
|
SU110A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРРОВОЛЬФРАМА | 1925 |
|
SU2803A1 |
| MCALLISTER F | |||
| et al | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
Авторы
Даты
2020-10-12—Публикация
2015-06-10—Подача