Область техники, к которой относится изобретение
Настоящее изобретение относится к вакцинной композиции, а также к ее применению для иммунизации и защиты млекопитающих, в частности свиней и людей, от Streptococcus suis.
Предпосылки создания изобретения
Streptococcus suis (S. suis) колонизирует дыхательный, пищеварительный и генитальный тракт свиней. S. suis также является одним из наиболее важных свиных патогенов, вызывающих различные патологии, такие как менингит, сепсис, артрит и эндокардит.
Инфекции, вызванные S. suis, являются причиной высоких производственных потерь в свиноводстве во всем мире. Для лечения инфекций, вызванных S. Suis, обычно используют антибиотики. Но рецидивирующие инфекции, которые часто возникают, а также продолжающиеся дискуссии по сокращению использования антибиотиков говорят о необходимости альтернативных мер контроля. В Европе нет в наличии лицензированных вакцин и обычно используются аутологические бактерины. Главным недостатком является тот факт, что эти вакцины защищают только от гомологичного серотипа. Но S. suis - это очень многообразный организм и за заболеваемость поросят отвечают разные серотипы. Особенно штаммы серотипа 2 играют важную роль в появлении заболеваний у поросят во всем мире.
Серотип 2 S. suis был идентифицирован как вызывающий менингит у взрослых в Азии, но до сих пор не было обнаружено ни одного случая передачи S. suis от человека человеку.
Как правило, инфекции вызывают ответ раннего антиген-специфического иммуноглобулина М (IgM), что приводит к аффинному созреванию и переключению изотопа. Кроме того, антитела IgM, присутствующие до инфицирования, которые встречаются в природе, важны для связывания врожденного и адаптивного иммунитета.
У свиней IgM особенно важен в качестве мономерного мембранного IgM (mIgM), поскольку он является единственным встречающимся В-клеточным рецептором, так как IgD у свиней отсутствует. Кроме того, синтез IgM у новорожденных поросят начинается гораздо раньше, чем синтез IgG и IgA. IgM в молозиве имеет решающее значение для защиты от патогенных микроорганизмов, которая осуществляется с помощью комплемент-опосредованного лизиса. Следовательно, антитела IgM играют важную роль в защите от различных патогенных микроорганизмов.
Были идентифицированы различные факторы вирулентности или вирулентность-ассоциированные факторы серотипа 2 S. suis, наряду с капсулой, которая до сих пор является единственным известным весьма важным фактором вирулентности, защищающим патоген от фагоцитоза. Ряд поверхностно-ассоциированных и секретируемых белков серотипа 2 S. suis показывают те же или очень похожие функции, как гомологичные факторы других патогенных стрептококков. Многие человеческие или животные патогены, такие как Streptococcus pyogenes, Streptococcus equi подвида equi и Streptococcus equi подвида zooepidemicus, экспрессируют специфические IgG-эндопептидазы, которые являются гомологами друг к другу.
Поверхностно-ассоциированный или секретируемый фактор с функцией, уникальной для S. Suis, был впервые описан автором Seele и соавторами в публикации ("Identification of a Novel Host-specific IgM Protease in Streptococcus suis." 2013, Journal of Bacteriology, 195: 930-940). Авторы Seele et al. показали, что эта IgM-протеаза, обозначенная IdeSsuis, не действует как IgG- эндопептидаза. IgM-протеаза разрушает опсонизирующий IgM на бактериальной поверхности и, следовательно, способствует выживанию S. suis в крови примированных бактерином поросят.IdeSsuis является высокоспецифичным по отношению к IgM и не расщепляет IgG или IgA. В публикации Seele и соавторов, однако, ничего не говорят о функции IdeSsuis, rIdeSsuis и их аналогов и фрагментов в качестве эффективной вакцины против инфекций, вызванных S. suis. Всего лишь выдвигается гипотеза, что нейтрализация активности IdeSsuis IgM-протеазы может существенно повысить защитную эффективность бактеринов или других будущих вакцин, индуцирующих опсонизирующие антитела. Однако не показано, что IdeSsuis и родственные белки могут использоваться в качестве единственного иммунизирующего агента в вакцине против инфекций, вызванных S. suis.
Авторы Baums и соавторы описывают в публикации Surface-associated and secreted factors of Streptococcus suis in epidemiology, pathogenesis and vaccine development, Animal Health Research Reviews, Volume 10, Issue 01, June 2009, pp 65-83 бактериальные факторы, как поверхностно-ассоциированные, так и секретируемые, которые считаются способствующими взаимодействию (-ям) S. suis с хозяйскими факторами и клетками. Факторы представлены по (i) их идентификации и характеристикам, (ii) их распределению среди S. suis и (iii) их значению для вирулентности, иммунного ответа и вакцинации. В этом обзоре особый акцент сделан на ряд сложных вопросов, на которые еще предстоит ответить в будущем.
Проблема, которая должна быть решена в соответствии с настоящим изобретением, состоит в решении проблем, описанных в данной области, и предоставлении новой вакцинной композиции для иммунизации и защиты млекопитающих, в частности свиней и людей, против инфекций, вызванных S. suis.
Сущность изобретения
Эта проблема решается, в соответствии с настоящим изобретением, предоставлением вакцинной композиции, которая содержит эффективное количество по меньшей мере одного полипептида или по меньшей мере одного вектора, выбранного из группы
(a) белок, обозначенный IdeSsuis, его аналог или фрагмент,
(b) белок, обозначенный rIdeSsuis, его аналог или фрагмент,
(c) вектор с полинуклеотидом, вставленным в него, кодирующий белок IdeSsuis, его аналог или фрагмент,
(d) вектор с полинуклеотидом, вставленным в него, кодирующий белок rIdeSsuis, его аналог или фрагмент и
по меньшей мере фармацевтический носитель, разбавитель или адъювант.
Подробное описание изобретения
Вакцинная композиция, используемая в настоящем изобретении, содержит по меньшей мере один одиночный полипептид в соответствии с определением в (а) или (b) совместно с фармацевтическим носителем или разбавителем или адъювантом, или их смесью. Кроме того, вакцина может также содержать по меньшей мере один одиночный вектор в соответствии с определением в (с) или (d), с фармацевтическим носителем, разбавителем или адъювантом, или их смесью.
Предпочтительной является вакцинная композиция в соответствии с настоящим изобретением, отличающаяся тем, что IdeSsuis согласно (а) содержит
(а.а) аминокислотную последовательность SEQ ID NO: 1;
(a.b) фрагмент или аналог аминокислотной последовательности SEQ ID NO: 1;
или
(а.с) фрагмент либо (а.а), либо (a.b), обладающий активностью IgM-протеазы.
Кроме того, предпочтительной является вакцинная композиция в соответствии с настоящим изобретением, отличающаяся тем, что rIdeSsuis согласно (b) содержит или состоит из следующего:
(b.а) аминокислотная последовательность SEQ ID NO: 2, 6 или 7;
(b.b) фрагмент или аналог аминокислотной последовательности SEQ ID NO: 2, 6 или 7;
(b.c) аминокислотная последовательность, в которой отсутствуют аминокислоты от позиции 1 до 34 аминокислотной последовательности SEQ ID NO: 1;
(b.d) аминокислотная последовательность, которая по меньшей мере на 60% гомологична, предпочтительно на 70% гомологична и наиболее предпочтительно на 85% гомологична к аминокислотной последовательности белка IdeSsuis SEQ ID NO: 1; (b.e) фрагмент либо (b.a), либо (b.b), либо (b.c), либо (b.d), обладающий активностью IgM - протеазы; или
(b.f) фрагмент либо (b.а), либо (b.b), либо (b.c), либо (b.d), содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 5 или аминокислотной последовательности, которая является по меньшей мере на 95% гомологична ей.
Аминокислотная последовательность SEQ ID NO: 2 представляет собой последовательность SEQ ID NO: 1, однако в ней отсутствуют аминокислоты 1-34 (сигнальный пептид), но добавлена HIS-метка. Следует отметить, что SEQ ID NO: 1 была извлечена из штамма серотипа 2 S. suis.
Аминокислотная последовательность SEQ ID NO: 6 представляет собой N-концевую последовательность SEQ ID NO: 2.
SEQ ID NO: 7 (также называемая антиген rIdeSsuisB2) содержит полную аминокислотную последовательность зрелого белка IdeSsuis штамма серотипа 7 S. suis, но с добавлением N-концевой HIS-метки. Белок IdeSsuis штамма серотипа 7 S. suis отличается С-концевой половиной белка, так как в нем отсутствует последовательность 114 аминокислот по сравнению с SEQ ID NO: 1. Аминокислоты 80-414 последовательности SEQ ID NO: 7 (высококонсервативная часть так называемого домена Мас-1) соответствует на 97,9% последовательности SEQ ID NO: 5. Полная идентичность между SEQ ID NO: 7 и 1 составляет 96,4% (без учета N-концевой HIS-метки и пробела из 114 аминокислот).
Термин «фрагмент или аналог», используемый в данном контексте, определяется следующим образом:
«Аналог» может рассматриваться как аминокислотная последовательность по аналогии с аминокислотными последовательностями, описанными выше и показывающие уровень гомологии по меньшей мере 60%, предпочтительно 70% и наиболее предпочтительно 85% к исходной аминокислотной последовательности (например, SEQ ID NO: 1, 2, 6 или 7). Также в настоящем документе рассматриваются более высокие степени гомологии, как например 95%. Гомология, используемая в данном контексте, означает идентичность. По существу, последовательности могут отличаться друг от друга на основании замены, делеции или вставки.
Степень идентичности может определяться с помощью программы blast для белка с использованием алгоритма медленного сравнения с целью поиска всех сходных последовательностей, с использованием стандартных параметров, например, Ожидаемое пороговое значение: 10, Размер слова: 3, Матрица: BLOMSUM62, Цена делеции: Наличие: 11 Расширение: 1 и Композиционные корректировки: Условная композиционная оценочная корректировка матрицы (BLAST является зарегистрированным товарным знакомНациональной медицинской библиотеки). Программа может быть использована в базе данных белков для поиска белка по запросу. Параметр «идентичность» сообщает о точных соответствиях между выровненными запрашиваемыми последовательностями и последовательностями из базы данных.
Предпочтительно, аминокислотные «замещения» являются результатом замены одной аминокислоты на другую аминокислоту, имеющую аналогичные структурные и/или химические свойства, т.е. консервативные аминокислотные замены. Аминокислотные замещения могут выполняться на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы вовлеченных остатков. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серии, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (базовые) аминокислоты включают аргинин, лизин и гистидин; а отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту.
«Вставки» или «делеции», как правило, находятся в диапазоне примерно 1, 2 или 3 аминокислот.Допускаемая вариация может быть определена экспериментально путем систематического выполнения вставок или делеций аминокислот в белке с использованием методов рекомбинантной ДНК и путем тестирования полученных рекомбинантных вариантов на активность. От квалифицированного персонала для этого требуется проведение всего лишь рутинных экспериментов.
«Аналог» может быть альтернативно или дополнительно определен как аминокислотная последовательность, аналогичная последовательностям, описанным выше, и содержащая высококонсервативную часть домена Мас-1 (SEQ ID NO: 5), или аминокислотная последовательность, которая является по меньшей мере на 95% гомологична указанной. Авторы настоящего изобретения, как ни удивительно, обнаружили, что этот домен в основном отвечает за неожиданную иммуногенную активность белков IdeSsuis и, для себя, является достаточным для обеспечения иммунной защиты вакцинированному животному. Существуют различные серотипы S. suis, которые частично демонстрируют большие вариации в своей аминокислотной последовательности, приводя, таким образом, к уровню гомологии вплоть до примерно 60%. Однако высококонсервативный домен Мас-1 демонстрирует только небольшие вариации между различными серотипами, например, 97,9% между штаммами серотипов 2 и 7.
Следовательно, допускается, что аминокислоты по настоящему изобретению (а также нуклеиновые кислоты, кодирующие их) демонстрируют более высокий уровень вариаций вне домена Мас-1, чем в его пределах.
Термин «фрагмент» может быть определен аналогичным образом (смотри выше). Он описывает более короткую аминокислотную последовательность, чем аналог (меньше, чем примерно 400 аминокислот). Он содержит или состоит из высококонсервативной части домена Мас-1 (SEQ ID NO: 5) или аминокислотной последовательности, которая по меньшей мере на 95% гомологична указанному. По желанию, фрагмент может быть определен как обладающий активностью IgM-протеазы, хотя это требование не является обязательным. Эти фрагменты могут использоваться в качестве единственного активного ингредиента в вакцине в соответствии с настоящим изобретением.
Таким образом, вакцинная композиция по настоящему изобретению в предпочтительном варианте осуществления содержит, по существу состоит из или состоит из белка, содержащего или состоящего из аминокислотной последовательности SEQ ID NO: 5 или аминокислотной последовательности, которая по меньшей мере на 95% гомологична ей. В еще более предпочтительном варианте осуществления белок (или вектор, кодирующий его) является единственным активным или иммуногенным ингредиентом.
Термин «содержащий», используемый в данном документе, в контексте вакцинной композиции означает, что могут присутствовать дополнительные активные или иммуногенные компоненты. Термин «состоит из» означает, что никаких дополнительных компонентов нет, а «по существу состоящий из» означает, что могут присутствовать специфические дополнительные компоненты, а именно компоненты, которые не существенно влияют на основные характеристики вакцины (т.е. неактивные или не иммуногенные ингредиенты).
В предпочтительном варианте осуществления настоящего изобретения предлагается вакцинная композиция, по существу состоящая из белка rIdeSsuis, который по меньшей мере на 60%, 70%, 85% или 95% гомологичен аминокислотной последовательности белка IdeSsuis SEQ ID NO: 1 и/или содержит или состоит из аминокислотной последовательности SEQ ID NO: 5 или аминокислотной последовательности, которая по меньшей мере на 95% гомологична ей.
Приведенные выше определения с соответствующими поправками применимы также к нуклеиновокислотным последовательностям по настоящему изобретению, кодирующим эти белки. Определения гомологии такие же, но длина фрагмента будет меньше, чем примерно 1200 нуклеиновых кислот.
Кроме того, предпочтительной является вакцинная композиция в соответствии с настоящим изобретением, отличающаяся тем, что фрагмент эффективного количества указанного полипептида (а) или (b) является частью слитого белка по меньшей мере с одним другим белком.
Предпочтительной является вакцинная композиция в соответствии с настоящим изобретением, отличающаяся тем, что полинуклеотид согласно (с) содержит последовательность, кодирующую белок, определенный как IdeSsuis, а именно
(а.а) аминокислотную последовательность SEQ ID NO: 1;
(a.b) фрагмент или аналог аминокислотной последовательности SEQ ID NO: 1; или
(а.с) фрагмент либо (а.а), либо (a.b), обладающий активностью IgM-протеазы.
Особенно предпочтительной является вакцинная композиция в соответствии с настоящим изобретением, которая характеризуется тем, что полинуклеотид содержит (с.а) последовательность SEQ ID NO: 3 или комплементарную ей последовательность;
(c.b) фрагмент последовательности согласно (с.а) или
(с.с) фрагмент последовательности согласно (с.а), которая кодирует белок, обладающий активностью IgM-протеазы.
Кроме того, предпочтительной является вакцинная композиция в соответствии с настоящим изобретением, отличающаяся тем, что полинуклеотид согласно (d) содержит последовательность, кодирующую белок, определенный как rIdeSsuis, а именно
(b.а) аминокислотную последовательность SEQ ID NO: 2;
(b.b) фрагмент или аналог аминокислотной последовательности SEQ ID NO: 2;
(b.c) аминокислотную последовательность, в которой отсутствуют аминокислоты от позиции 1 до 34 аминокислотной последовательности SEQ ID NO: 1;
(b.d) аминокислотную последовательность, которая по меньшей мере на 60% гомологична, предпочтительно на 70% гомологична и наиболее предпочтительно на 85%о гомологична аминокислотной последовательности белка IdeSsuis SEQ ID NO:; или
(b.e) фрагмент либо (b.а), либо (b.b), либо (b.c), либо (b.d), обладающий активностью IgM-протеазы и/или
(b.f) фрагмент либо (b.а), либо (b.b), либо (b.c), либо (b.d), содержащий или состоящий из аминокислотной последовательности SEQ ID NO: 5 или аминокислотной последовательности, которая является по меньшей мере на 95% гомологична ей.
Особенно предпочтительной является вакцинная композиция в соответствии с настоящим изобретением, которая характеризуется тем, что полинуклеотид содержит
(d.a) последовательность SEQ ID NO: 4, 8 или 9, или комплементарную ей последовательность;
(d.b) фрагмент последовательности согласно (d.a) или
(d.c) фрагмент последовательности согласно (d.a), который кодирует белок, обладающий активностью IgM-протеазы.
Предпочтительной является вакцинная композиция в соответствии с настоящим изобретением, отличающаяся тем, что полинуклеотид представляет собой кДНК, ДНК или кРНК, РНК. Термин «нуклеиновокислотная последовательность» относится к гетерополимеру нуклеотидов или последовательности этих нуклеотидов. Термины «нуклеиновая кислота» и «полинуклеотид» используются в данном контексте взаимозаменяемо для ссылки на гетерополимер нуклеотидов.
Кроме того, предпочтительным является то, что вакцинная композиция в соответствии с настоящим изобретением дополнительно характеризуется полинуклеотидом, встроенным в вектор, причем полинуклеотид функционально связан с областью контроля экспрессии вектора.
Этот вектор экспрессии предпочтительно содержит один или несколько регуляторных последовательностей. Термин «вектор экспрессии», как правило, относится к плазмиде или фагу или вирусу или вектору, для экспрессии полипептида из последовательности ДНК (РНК). Вектор экспрессии может содержать транскрипционную единицу, содержащую сборку (1) генетического элемента или элементов, играющих регуляторную роль в экспрессии генов, например, промоторы или энхансеры, (2) структурную или кодирующую последовательность, которая транскрибируется в мРНК и преобразуется в белок, и (3) соответствующие последовательности инициации и терминации транскрипции. Структурные единицы, предназначенные для использования в дрожжевых или эукариотических системах экспрессии, предпочтительно включают лидерную последовательность, обеспечивающую возможность внеклеточной секреции транслируемого белка клеткой-хозяином. В качестве альтернативы, когда рекомбинантный белок экспрессируется без лидерной или транспортной последовательности, он может включать остаток N-концевого метионина. Этот остаток может впоследствии отщепляться или может не отщепляться от экспрессированного рекомбинантного белка с получением конечного продукта. Также предпочтительным является то, что вакцинная композиция в соответствии с настоящим изобретением предлагается в физиологически вводимой форме и пригодна для внутримышечной, внутривенной, подкожной или кожной инъекции или мукозального введения. Следует отметить, что менее предпочтительно внутривенное введение.
В еще одном аспекте настоящее изобретение направлено на фрагмент IdeSsuis, имеющий аминокислотную последовательность SEQ ID NO: 5 или аминокислотную последовательность, которая является по меньшей мере на 95% гомологична ей. SEQ ID NO: 5 соответствует высококонсервативной части домена Мас-1. Хотя этот домен демонстрирует активность IgM- протеазы, иммуногенный эффект не обязательно связан с этой активностью. Например, в пределах объема настоящего изобретения имеются аналоги SEQ ID NO: 5, где активный центр протеазы инактивирован путем мутагенеза Cys-остатка. Кроме того, в этом случае аналог будет эффективным в качестве вакцины для индукции иммунного ответа.
Кроме того, оказалось, что аминокислотные последовательности могут быть эффективными в качестве вакцины против инфекций, вызванных S. suis, если они сохраняют гомологию по меньшей мере на 95% к SEQ ID NO: 5. Это включает замещение, вставку или делецию одиночных аминокислот.Оказалось, что встречающиеся в природе домены Мас-1, хотя и демонстрируют некоторые вариации, отличаются не более чем на 5%, или другими словами, имеют общую идентичность 95% или более в этом домене. Иллюстративные последовательности Streptococcus suis были получены из штаммов, выделенных в различных географических регионах (Америка, Азия, Европа) и были извлечены из различных организмов-хозяев (людей, свиней). Эти штаммы принадлежат к различным серотипам (1-4, 7-9, 14 и 16 или которые были нетипируемыми). Эти данные обобщены в прилагаемой таблице 1:
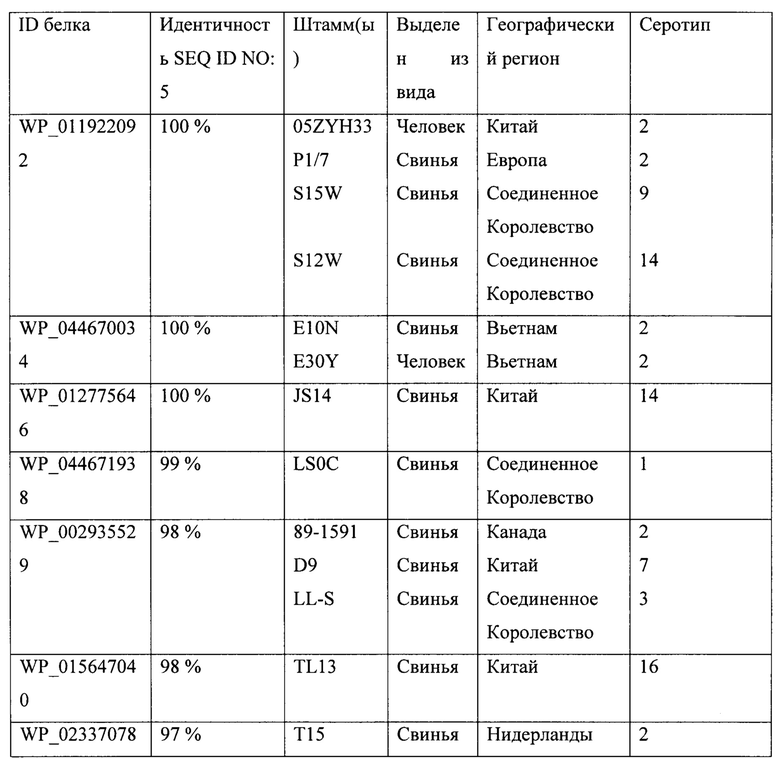
Информация о последовательности домена Мас-1 белков WP_044671938, WP_002935529, WP_015647040, WP_023370787 и WP_044678723 представлена в последовательностях SEQ ID NO: 10 - SEQ ID NO: 14. Так как их гомология с SEQ ID NO: 5 выше 95%, они попадают под определение фрагмента или гомолога по настоящему изобретению.
Еще один аспект представляет собой белок rIdeSsuis, содержащий аминокислотную последовательность SEQ ID NO: 6 или 7 или аминокислотную последовательность, которая по меньшей мере на 60%, предпочтительно на 70%, 85% или 95% гомологична аминокислотной последовательности белка IdeSsuis SEQ ID NO: 6 или 7.
Другим объектом настоящего изобретения является клетка-хозяин, которая трансфицирована вектором.
Еще одним объектом настоящего изобретения является способ получения белка, определенного как rIdeSsuis, в качестве антигена-гостя в векторе или другом организме, соответственно клетки-хозяина, трансфицированной в условиях, подходящих для экспрессии указанного рекомбинантного белка.
Еще один аспект настоящего изобретения представляет собой антитело, которое распознает белок IdeSsuis или rIdeSsuis, аналог или фрагмент, определенные выше. Антитело предпочтительно выбирают из группы, состоящей из поликлональных антител, моноклональных антител, гуманизированных антител, химерных антител и синтетических антител.
Термин «антитело» используется в данном контексте для интактных антител, а также фрагментов антител, которые обладают определенной способностью селективно связываться с эпитопом. Такие фрагменты включают, без ограничений, фрагменты антител Fab, F(ab') и Fv. Термин «эпитоп» означает любой антигенный детерминант антигена, с которым может связываться паратоп антитела. Детерминанты эпитопа обычно состоят из химически активных поверхностных групп молекул (например, остатки аминокислоты или сахара), и, как правило, отображают трехмерную структуру, а также специфические физические свойства.
Антитела согласно настоящему изобретению могут быть получены в соответствии с любой известной методикой. Например, чистый полный белок IdeSsuis или rIdeSsuis согласно настоящему изобретению или его фрагмент/аналог может быть получен и использован в качестве иммуногена для иммунизации животного и для получения специфических антител.
Технология получения поликлональных антител общеизвестна. Подробные протоколы можно найти, например, в публикации автора Green и соавторы Production of Polyclonal Antisera, Immunochemical Protocols (Manson, editor), pp.1-5 (Humana Press 1992) и в публикации автора Coligan и соавторы Production of Polyclonal Antisera in Rabbits, Rats, Mice and Hamsters, Current Protocols In Immunology, section 2.4.1 (1992). Кроме того, специалистам известны несколько методов по очистке и концентрированию поликлональных антител, а также моноклональных антител (Coligan et al, Unit 9, Current Protocols in Immunology, Wiley Interscience, 1994).
Технология получения моноклональных антител также общеизвестна. Примеры включают метод гибридом (Kohler and Milstein, 1975, Nature, 256:495-497, Coligan et al., section 2.5.1 - 2.6.7; и Harlow et al., Antibodies: A Laboratory Manual, page 726 (Cold Spring Harbor Pub. 1988).), метод триом, метод человеческой В-клеточной гибридомы (Kozbor et al., 1983, Immunology Today 4:72), и метод EBV-гибридомы для получения человеческих моноклональных антител (Cole, et al., 1985, in Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96).
Вкратце, моноклональные антитела можно получить путем введения смеси, содержащей белок в соответствии с изобретением, мышам. Продуцирование антител у мышей проверяют с помощью сывороточного зонда. В случае достаточного титра антител мышь умерщвляют и извлекают селезенку, чтобы выделить В-клетки. В-клетки объединяют с миеломными клетками, что приводит к образованию гибридом. Гибридомы клонируют и клоны анализируют. Положительные клоны, которые содержат моноклональные антитела против белка, отбирают и антитела выделяют из гибридомных культур. Существует много установившихся методов выделения и очистки моноклональных антител. Такие методы включают аффинную хроматографии с белком А-сефароза, гель-хроматографию и ионообменную хроматографию. Также смотри, например, Coligan и соавторы, раздел 2.7.1 - 2.7.12 и раздел «Иммуноглобулин G (IgG)» [ʺImmunglobulin G (IgG)ʺ], в Methods In Molecular Biology, том 10, страницы 79-104 (Humana Press 1992).
Предпочтительно, в настоящем изобретении предлагаются гуманизированные специфические антитела мыши IdeSsuis или rIdeSsuis.
Вышеуказанные антитела могут формировать часть парентеральной композиции для терапевтического лечения пациента, человека или животного (свинья), страдающего от инфекции, вызванной S. suis. Однако они могут также использоваться и в профилактических целях.
В еще одном аспекте настоящее изобретение направлено на применение предлагаемых выше белков для получения описанных выше антител.
Другим объектом настоящего изобретения является применение вакцинной или парентеральной композиции в соответствии с настоящим изобретением для осуществления профилактического или метафилактического или терапевтического лечения инфекции, вызванной Streptococcus suis, у свиней. Далее в данном документе предполагается использовать вакцину или парентеральную композицию в соответствии с настоящим изобретением для профилактического или метафилактического или терапевтического лечения инфекции, вызванной S. Suis, у пациента-человека.
Особенно предпочтительным является применение вакцинной композиции в соответствии с настоящим изобретением, отличающееся тем, что лечение вызывает иммунный ответ у свиней, тогда как иммунный ответ представляет собой активацию гуморального и клеточного ответа против белка IdeSsuis, продуцированного бактериями Streptococcus suis.
Лечение (вакцинация) предусматривает по меньшей мере одну или две иммунизации. Общая доза, вводимая одной свинье/одному человеку, составляет примерно 0,05-2,0 мг белка.
Приготовление вакцинной композиции в соответствии с изобретением известно в данной области и описано в справочниках, известных специалисту в данной области. Для получения вакцинной композиции в соответствии с настоящим изобретением могут использоваться фармацевтически приемлемые носители, разбавители или адъюванты, которые содержат, но не ограничиваются этим, следующее: адьюванты минеральных солей (например, на основе алюминия, кальция, железа, циркония), тензоактивные адъюванты (например, Quil A, QS-21, другие сапонины), адъюванты, извлеченные из бактерий (например, N-ацетил-мурамил-L-аланил-D-изоглутамин (MDP), липополисахариды (LPS), монофосфориллипид А, димиколат трегалозы (TDM), ДНК, CpGs, бактериальные токсины), адъювантные эмульсии (например, FIA, Монтанид, Адьювант 65, Липовант), липосомные адъюванты, полимерные адъюванты и носители, цитокины (например, гранулоцитарно-макрофагальный колониестимулирующий фактор), углеводные адъюванты, живые системы доставки антигена (например, бактерии, вирусы). Кроме того, носители могут также содержать сухие препараты, такие как пластыри с покрытием, изготовленные из титана или полимера. Методы составления и введения вакцин в соответствии с настоящей заявкой также можно найти в «Remington, The Science and Practice of Pharmacy», 22-е издание.
Таким образом, настоящее изобретение направлено на вакцинную композицию, содержащую белок, обозначенный как IdeSsuis или rIdeSsuis, или фрагмент любого из них; или полинуклеотид, экспрессирующий либо белок IdeSsuis, либо rIdeSsuis, либо фрагмент любого из них, который встроен в вектор экспрессии, тогда как рекомбинантный белок является предпочтительным.
Авторами данного изобретения обнаружено следующее:
(a) индукция опсонизирующих антител имеет решающее значение для защитной эффективности S. suis бактерина.
(b) IdeSsuis способствует выживанию S. suis в крови вакцинированных поросят.
Кроме того, авторы изобретения показали, что вакцинация свиней с использованием только белка rIdeSsuis в качестве единственного антигена обеспечивает защиту свиней, инфицированных S. suis. В соответствии с изобретением вакцинация белком rIdeSsuis предотвращает расщепление IgMs с помощью IdeSsuis IgM-протеазы S. suis путем индукции нейтрализующих антител.
В соответствии с настоящим изобретением вакцинация свиней с помощью рекомбинантного белка rIdeSsuis или его фрагмента привело к высоким титрам IdeSsuis-специфических антител IgG с нейтрализующей активностью в отличие от реконвалесцентных или иммунизированных S. S. Suis-бактерином поросят.Кроме того, в соответствии с Примером 1, было показано, что rIdeSsuis обеспечивает более высокий иммунитет против вызванных S. suis инфекций, чем бактерин-вакцины известного уровня техники.
Кроме того, авторы настоящего изобретения продемонстрировали, что вакцинация свиней рекомбинантным белком rIdeSsuis или его аналогом или фрагментом снижает выживаемость S. suis в крови.
Один важный аспект настоящего изобретения - как уже отмечалось выше - заключается в неожиданном понимании того, что белки, нуклеиновые кислоты и их аналоги и фрагменты, согласно определению выше, могут использоваться в качестве единственного иммуногенного агента для обеспечения защиты от инфекций, вызванных S. suis. Никакие другие активные ингредиенты не требуются, как например бактерины и т.д., используемые в известном уровне техники. Это подтверждается экспериментальным свидетельством, представленным в Примере 2. Показано, что вакцины в соответствии с настоящим изобретением обладают существенно более высокой эффективностью по сравнению с плацебо/контрольными вакцинами, см. данные бактериального анализа испытаний 1 и 2 из Примера 2 (Фиг. 3 и 4). Выводы, которые можно сделать из результатов эксперимента, заключаются в следующем:
rIdeSsuis (SEQ ID NO: 2) обеспечивает иммунную защиту по различным серотипам S. Suis,
Белок, по меньшей мере содержащий высококонсервативный домен Мас-1 (SEQ ID NO: 5), является достаточным для обеспечения иммунной защиты,
Кроме того, белки IdeSsuis других серотипов, по меньшей мере содержащие высококонсервативный домен Мас-1 (SEQ ID NO: 5), индуцируют защиту, даже если их общая последовательность вне этого домена отличается от последовательности штаммов серотипа 2 (даже если определенные сегменты последовательности полностью отсутствуют).
В соответствии с настоящим изобретением белки IdeSsuis или rIdeSsuis или их аналоги/фрагменты могут также использоваться в слитых белках. Слитые белки создаются путем соединения двух или более генов, которые изначально закодированы на отдельные белки. Трансляция этого слитого гена дает в результате одиночный или множественный полипептид с функциями, каждая из которых происходит из первоначальных белков. На современном уровне развития слитые белки часто используют для упрощения специфических применений, таких как детекция, интеграция или транспорт белка, представляющего интерес. Основным элементом для детекции методом флуоресцентной микроскопии является зеленый флуоресцентный белок (GFP), слитый с белком, представляющим интерес.
Другие белки, которые могут быть слиты с IdeSsuis для улучшения доставки и иммуногенности антигена, представляют собой FC-фрагмент иммуноглобулина, нетоксичную СТА субъединицу холерного токсина, мутированные термолабильные токсины, белок оболочки спор сенной палочки или бактериальные флагеллины. Кроме того, слитые белки с белками вирусов или фагов (например, модифицированный вирус коровьей оспы Анкара (MVA), вирус гепатита В, фаг лямбда или нитевидные фаги типа fd, M13 или fI) могут использоваться для экспрессии IdeSsuis на поверхности вирусной частицы или вирусоподобной частицы.
Другая возможность обнаружить слитые белки заключается в использовании так называемых белковых меток, которые часто используются в процессе получения слитых белков, соответственно, их очистки и детекции посредством выполнения аффинной хроматографии, вестерн-блоттинга, иммуногистохимии или флуоресцентной микроскопии. Белковые метки обычно представляют собой короткие аминокислотные последовательности, например His-метка, myc-метка, НА-метка, Step-метка, GST-метка, связывающий мальтозу белок-метка или тиоредоксин-метка.
Способ получения рекомбинантных белков, таких как rIdeSsuis, их фрагментов или аналогов в соответствии с настоящим изобретением известен специалистам в данной области, а также описан в справочниках, известных специалистам в данной области. Как правило, для получения рекомбинантного белка используются клетки-хозяева для трансфицирования с вектором, кодирующим белок, представляющий интерес. В общем, эти клетки-хозяева могут представлять собой бактерии (например, штаммы Е. coli, Bacillus или Lactococcus), человеческие (например, 293-Т, НЕК-293), мышиные клеточные линии, клеточные линии насекомых, клетки дрожжей или системы на основе растений.
Для трансфекции векторов экспрессии клеток-хозяев, таких как плазмиды (например, рЕТ, pQE), могут использоваться вирусы и бактериофаги (например, бакуловирус, фаг лямбда или нитевидные бактериофаги).
Обычно вакцинные или парентеральные композиции готовят в виде инъецируемых препаратов, либо в виде жидких растворов, либо в виде суспензий.
Предметом настоящего изобретения также является вакцинная или парентеральная композиция для подкожного, внутривенного, внутримышечного, кожного или мукозального введения.
Представленные вакцины используются для выполнения профилактического или метафилактического или терапевтического лечения инфекции, вызванной Streptococcus suis, у свиней или людей. Лечение предусматривает по меньшей мере одну, предпочтительно две иммунизации. Хотя на практике предпочтительной является одна иммунизация, стандартная иммунизация обычно включает в себя «прайм-буст» режим (prime-boost regimen), то есть 2 отдельные вакцинации. Буст-вакцинация обычно выполняется в сроки 1-3 недели, предпочтительно примерно 2 недели после прайм-вакцинации. Дозировка отдельных вакцинации может быть одинаковой или разной, хотя предпочтительно, чтобы доза вакцины была одинаковой для обеих вакцинаций. Общая доза, которая должна быть введена пациенту, животному или человеку, составляет примерно 0,05-2,0 мг белка IdeSsuis или rIdeSsuis, аналогов или фрагментов, как определено выше. Предпочтительные дозы включают 0,1-1,0, более предпочтительно примерно 0,5 мг.Эта доза вводится в виде одной дозы, при условии, что достаточной является одна вакцинации. Если применяется не одна вакцинация, общая доза разделяется на несколько равных субдоз, например, при использовании двух вакцинаций индивидуальная доза вакцины составляет примерно 0,025-1,0 мг белка.
Настоящее изобретение далее описано со ссылкой на следующие фигуры, где
На Фиг. 1 показана таблица времени, представляющая провокационные эксперименты по вакцинации с использованием S. suis у свиней,
На Фиг. 2 показан график, представляющий результаты, полученные в провокационных экспериментах вакцинации согласно Фиг. 1,
На Фиг. 3 показана схема испытания 1 по оценке эффективности вакцины с применением бактерицидного анализа,
На Фиг. 4 показана схема, представляющая результаты бактерицидного анализа при привлечении вакцинации с использованием плацебо против rIdeSsuis согласно Фиг. 3,
На Фиг. 5 показана схема испытания 2 по оценке эффективности вакцины с применением бактерицидного анализа,
На Фиг. 6 изображена схема, представляющая результаты бактерицидного анализа при привлечении вакцинации с использованием аналогов rIdeSsuis или rIdeSsuis против контрольной группы согласно Фиг. 5.
Кроме того, к этому описанию прилагается перечень последовательностей.
SEQ ID NO: 1 представляет аминокислотную последовательность белка IdeSsuis;
SEQ ID NO: 2 представляет аминокислотную последовательность рекомбинантного белка rIdeSsuis без сигнального пептида;
SEQ ID NO: 3 представляет нуклеотидная последовательность, кодирующую IdeSsuis и
SEQ ID NO: 4 представляет нуклеотидную последовательность, кодирующую rIdeSsuis.
SEQ ID NO: 5 представляет аминокислотную последовательность высококонсервативной части домена Мас-1 IdeSsuis.
SEQ ID NO: 6 представляет аминокислотную последовательность аналога rIdeSsuis rIdeSsuis_homologue.
SEQ ID NO: 7 представляет аминокислотную последовательность аналога rIdeSsuis rIdeSsuisB2.
SEQ ID NO: 8 представляет нуклеотидную последовательность, кодирующую аналог rIdeSsuis rIdeSsuis_homologue.
SEQ ID NO: 9 представляет нуклеотидную последовательность, кодирующую аналог rIdeSsuis rIdeSsuisB2.
SEQ ID NO: 10 представляет аминокислотного последовательность аминокислот 91 - 425 белка WP_044671938.
SEQ ID NO: 11 представляет аминокислотного последовательность аминокислот 91 - 425 белка WP_002935529.
SEQ ID NO: 12 представляет аминокислотную последовательность аминокислот 92 - 426 белка WP_015647040.
SEQ ID NO: 13 представляет аминокислотную последовательность аминокислот 92 - 426 белка WP_023370787.
SEQ ID NO: 14 представляет аминокислотную последовательность аминокислот 92 - 426 белка WP_044678723.
Следующие примеры объясняют настоящее изобретение. Примеры следует понимать только в качестве одного предпочтительного варианта осуществления настоящего изобретения. Настоящее изобретение не ограничивается объемом приведенных примеров.
Пример 1
В следующем примере представлены экспериментальные данные после проведения провокационных экспериментов по вакцинации поросят, инфицированных S. suis.
Организация провокационных экспериментов по вакцинации поросят в отношении различных серотипов S. suis (серотип 2 и 9) и пути инфицирования (внутривенный и интраназальный).
Вкратце, как показано на Фиг. 1, поросята в возрасте пяти недель были прайм-вакцинированы rIdeSsuis-вакциной. В возрасте 7 недель эти поросята были бустер-вакцинированы с помощью rIdeSsuis и в одной группе также были прайм-вакцинированы бактерином путем внутримышечной инъекции (показано в таблице на Фиг. 1). Одна группа поросят была только прайм-вакцинирована бактерином в возрасте 7 недель, а последнюю группу животных вакцинировали дважды с помощью плацебо, состоящего из буфера и адъюванта. Поросят инфицировали через две недели после второй иммунизации интраназально. Мониторинг животных далее проводился каждые восемь часов. Из соображений благополучия животных, животных подвергали эвтаназии в каждом случае, когда у поросенка появлялась высокая температура в сочетании с апатией и анорексией, а также в случае клинических признаков острого полиартрита или тяжелого менингита.
Все оставшиеся в живых поросят были умерщвлены через 14 дней после инфицирования.
Эксперимент выявил, что иммунизация поросят с использованием только рекомбинантного белка rIdeSsuis является достаточной для защиты поросят от инфекций, вызванных серотипом 2 S. suis (Фиг. 2).
Пример 2
8 этом примере для оценки эффективности данной вакцины применяли бактерицидный анализ. Этот тест предусматривает определение выживаемости бактерий S. suis определенного серотипа после добавления в кровь подопытного животного. Если в крови этого подопытного животного присутствуют протективные антитела против определенного серотипа, бактерии будут эффективно уничтожены во время инкубации в течение 2-х часов. Степень защиты обозначается как «фактор выживания» (SF) и представляет собой отношение количества колоний через 120 мин. и количества колоний непосредственно после добавления бактерий в кровь подопытного животного. Низкий фактор выживаемости означает эффективное уничтожение бактерий в крови и, следовательно, эффективную защиту подопытного животного.
Экспрессию и очистку рекомбинантного IdeSsuis (SEQ ID NO: 2), рекомбинантного IdeSsuisB2 (SEQ ID NO: 7) и рекомбинантного IdeSsuis_homologue (SEQ ID NO: 6) осуществляли путем выращивания соответствующих штаммов в LB бульоне плюс ампициллин. Экспрессию белка индуцировали добавлением IPTG. Очистку рекомбинантных белков с помощью аффинной хроматографии с Ni2+-нитрилотриуксусной кислотой в нативных условиях проводили, как рекомендовано производителем (Macherey-Nagel).
Иммунизация поросят: Поросята были прайм- и бустер-вакцинированы с использованием 1,5 мл вакцины, содержащей 0,25 мг rIdeSsuis или 0,25 мг rIdeSsuisB2 или 0,5 мг rIdeSsuis_homologue с содержанием 20% [об/об] Emulsigen в качестве адьюванта.
Испытание 1.
Два или четыре однопометных поросенка случайным образом были распределены в две испытательные группы (n=9/группу), группа 1 контрольная (плацебо), группа 2, иммунизированная rIdeSsuis (SEQ ID NO: 2). Животные были иммунизированы и протестированы в соответствии со следующей схемой испытания на Фиг. 3.
Полученные результаты приведены на Фиг. 4.
Контрольная группа (плацебо) показала гораздо более высокий фактор выживаемости, чем вакцинированная группа. Рекомбинантный антиген rIdeSsuis (вакцинированная группа), содержащий полную последовательность белков IdeSsuis штамма серотипа 2 (SEQ ID NO: 2), индуцирует антитела, вызывающие эффективное уничтожение бактерий S. suis штамма 2, также, как и штамма 9.
Испытание 2.
Четыре однопометных поросенка случайным образом были распределены в четыре испытательные группы (n=6/группа, за исключением группы 4, где n=5): группа 1 контрольная (не иммунизированная); группа 2, иммунизированная rIdeSsuis_homologue (SEQ ID NO: 6); группа 3, иммунизированная IdeSsuis, полученным из штамма серотипа 7 (rIdeSsuisB2; SEQ ID NO: 7); группа 4, иммунизированная SEQ ID NO: 2. Животные были иммунизированы и протестированы в соответствии со следующей схемой испытания на Фиг. 5.
Полученные результаты приведены на Фиг. 6.
Результаты демонстрируют значительно более высокий фактор выживаемости в контрольной группе (группа 1), чем в трех вакцинированных группах. Рекомбинантный антиген rIdeSsuis_homologue (группа 2), содержащий только N-концевой фрагмент, включающий высоко консервативный домен Мас-1 (IGM-протеаза-домен), индуцировал антитела, которые дают в результате гораздо лучшее уничтожение бактерий по сравнению с контрольной группой. Результат по 2-й группе можно сравнить с результатами, полученными по группе 4. Кроме того, антиген rIdeSsuis, содержащий полную аминокислотную последовательность зрелого белка IdeSsuis штамма серотипа 2 S. Suis, индуцирует антитела, которые значительно снижают выживаемость штамма серотип 9 S. suis в крови. Выживаемость штамма серотипа 9 даже еще в большей степени снижается под влиянием антител, которые были индуцированы антигеном rIdeSsuisB2 (группа 3).
rIdeSsuisB2 (SEQ ID NO: 7) содержит полную аминокислотную последовательность зрелого белка IdeSsuis штамма серотипа 7 S. suis и отличается С-концевой половиной белка, так как в ней отсутствует последовательность 114 аа по сравнению с SEQ ID NO: 1. От аа 80 до 414 в SEQ ID NO: 7 (высококонсервативная часть так называемого домена Мас-1) соответствуют на 97,9% последовательности SEQ ID NO: 5. Идентичность между оставшейся С-концевой частью последовательности SEQ ID NO: 7 и 1 составляет 96,4%.
Выводы, которые можно сделать из результатов эксперимента, заключаются в следующем:
rIdeSsuis (SEQ ID NO: 2) обеспечивает иммунную защиту по различным серотипам S. suis,
Аминокислота, по меньшей мере содержащая высококонсервативный домен Мас-1, является достаточной для обеспечения иммунной защиты,
Кроме того, белки IdeSsuis других серотипов, по меньшей мере содержащие высококонсервативный домен Мас-1, индуцируют защиту, даже если их общая последовательность вне этого домена отличается от последовательности штамма серотипа 2 (даже если некоторые сегменты последовательности полностью отсутствуют).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ИДТ Биологика ГмбХ
<120> Вакцинная композиция против инфекции, вызванной Streptococcus suis
<130> P37819-WO
<150> EP14170637.4
<151> 2014-05-30
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 1141
<212> PRT
<213> Streptococcus suis
<400> 1
Met Asn Ile Gln Glu Arg Phe Ser Leu Arg Lys Ser Ala Val Gly Leu
1 5 10 15
Val Ser Val Ser Leu Leu Cys Ala Ile Tyr Thr Ser Thr Val Ala Ala
20 25 30
Asp Thr Val Val Thr Gly Val Asn Glu Ile Ile Glu Glu Ser Gln Val
35 40 45
Lys Asp Glu Val Ser Ile Glu Ser Glu Lys Asn Glu Ser Leu Asp Gly
50 55 60
Ser Asn Ile Glu Ile Val Glu Glu Ile Ala Asp Asn Ile Pro Ser Pro
65 70 75 80
Val Ile Ala Glu Gly Glu Val Ala Val Glu Met Lys Val Asp Arg Gly
85 90 95
Thr Glu Asn Val Val Ser Arg Asn Asp Thr Glu Val Thr Thr Ser Glu
100 105 110
Gln Asn Gln Ile Glu Val Thr Glu Thr Lys Glu Ile Leu Asn Gln Thr
115 120 125
Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg Gln Ile Ile Trp Ala His
130 135 140
Gly Ile Thr Pro Pro Ala Met Glu Gln Ser Gly Gly Phe Val Lys Glu
145 150 155 160
Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala Pro Phe Glu Ala Gly Lys
165 170 175
Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn Ala Ser Phe Ile Asp Leu
180 185 190
Asn Leu Cys Phe Ala Ala Val Ser Ser Asn Met Val His Trp Trp Leu
195 200 205
Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr Leu Lys Glu Lys Lys Gly
210 215 220
Thr Val Asn Val Glu Glu Asn Tyr Ala Ile Thr Asp Leu Arg Arg Tyr
225 230 235 240
Ile Asn Ser Phe Gln Asn Gln Gln Asn Ser Arg Val Phe Asp Met Phe
245 250 255
Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly Phe Val Ser Asp Ala Leu
260 265 270
Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro Lys Ala Gln Gly Gly Val
275 280 285
Asn Leu Glu Asp Ser Gln Leu Val Pro Asp Ser Arg Gly Gly Phe Phe
290 295 300
Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr Asn Arg Ile Phe Ser Gly
305 310 315 320
Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg Thr Val Leu Glu Ser Lys
325 330 335
Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu Gly Tyr Ala Thr His Ile
340 345 350
Val Thr Val Trp Gly Ala Glu Tyr Asp Asn Gln Gly Lys Ile Lys Ala
355 360 365
Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln Glu Gln Ile Gly Leu Lys
370 375 380
Arg Met Gly Ile Thr Arg Asp Ala Ser Gly Asn Pro Arg Leu Asn Asn
385 390 395 400
His Met Lys Asn Asn Ser Ala Gly Ala Leu Leu Asp Tyr Val His Thr
405 410 415
Ile Arg Leu Gly Gln Asp Leu Trp Glu Glu Tyr Phe Asn Pro Leu Ala
420 425 430
Lys Ala Lys Glu Thr Ala Ser Gln Thr Leu Ala Asp Thr Lys Lys Ala
435 440 445
Leu Asp Leu Ser Ile Gln Gly Gln Ser Glu Leu Pro Glu Ser Met Arg
450 455 460
Leu Ile Tyr Leu Glu Lys Leu Asn Asn Leu Tyr Asn Gln Gly Ile Leu
465 470 475 480
Ser Ile Gln Lys Ala Glu Ser Ser Glu Met Leu Ser Gly Ala Leu Glu
485 490 495
Asn Gly Leu Asn Ser Leu Lys Ser Leu Asp Phe Pro Ile Ser Glu Val
500 505 510
Gly Asn Ala Leu Ala Pro Asp Leu Pro Val Gly Asp Arg Ser Thr Val
515 520 525
Ser Asp Val Asp Ser Leu Ser Ser Gln Glu Thr Ser Ser Thr Asn Leu
530 535 540
Glu Ala Asp Thr Glu Asn Ala Gly Ile Ile Ala Asp Gly Thr Asn Gln
545 550 555 560
Leu His Phe Pro Val Glu Ala Gln Thr Thr Ser Ser Val Glu Ala Glu
565 570 575
Gly Asp Asn Val Phe Glu Gln Glu Ala Asp Thr Leu Pro Ile Ile Ile
580 585 590
Glu Asn Lys Asp Glu Phe Gly Ser Glu Leu Ser Arg Asn Met Gln Thr
595 600 605
Ser Glu Thr Asp Ser Leu Val Val Ala Val Glu Glu Asp Val Lys Asn
610 615 620
Asp Glu Val Ala Gln Val Glu Glu Leu Leu Glu Ser Glu Lys Val Glu
625 630 635 640
Asn Gln Ser Ser Glu Leu Leu Ser Asp Thr Leu Ile Val Glu Ser Ala
645 650 655
Asn Asp Lys Glu Glu Asp Arg Val Glu Ala Val Val Ser Glu Gln Pro
660 665 670
Asp Ser Ile Pro His Gln Asn Val Glu Ile Ser Leu Val Glu Pro Thr
675 680 685
Asn Val Glu Thr Glu Thr Val Val Thr Pro Ile Asn Asp Ala Ala Thr
690 695 700
Pro His Gly Ser Pro Thr Tyr Ile Asp Asn Ser Val Thr Glu Ser Val
705 710 715 720
Ala Thr Pro Leu Glu Lys Asp Ser Ile Gln Ala Gly Glu Thr Glu Ile
725 730 735
Ala Glu Pro Thr Ser Ser Glu Ser Thr Asn Val Glu Thr Glu Thr Val
740 745 750
Val Thr Pro Val Asn Asp Val Ala Thr Pro His Gly Ser Pro Thr Tyr
755 760 765
Ile Asp Asn Ser Val Thr Glu Ser Val Ala Thr Pro Leu Glu Lys Asp
770 775 780
Ser Ile Gln Ala Gly Glu Thr Glu Ile Ala Glu Pro Thr Ser Ser Glu
785 790 795 800
Ser Thr Asn Val Glu Thr Glu Thr Val Val Thr Pro Val Asn Asp Val
805 810 815
Ala Thr Pro His Gly Ser Pro Thr Tyr Ile Asp Asn Ser Val Thr Glu
820 825 830
Ser Val Ala Thr Pro Leu Glu Lys Asp Ser Ile Gln Ala Gly Glu Thr
835 840 845
Glu Ile Ala Glu Pro Thr Ser Ser Glu Ser Thr Ser Val Glu Ala Glu
850 855 860
Leu Val Asp Asn Ser Glu Ile His Ala Ala Thr Ser Ser Val Thr Pro
865 870 875 880
Cys Gly Ser Ser Ala Tyr Ala Asp Gly Ser Thr Thr Glu Ser Val Ala
885 890 895
Thr Pro Leu Glu Lys Asp Ser Ile Gln Thr Gly Asn Thr Glu Ile Ala
900 905 910
Glu Pro Thr Ser Ser Lys Ser Thr Asn Val Glu Ala Ala Ser Val Asp
915 920 925
Asn Ser Glu Ile His Ala Asp Ala Ser Leu Thr Ala Val Ser Ser Val
930 935 940
Asn Leu Asp Asn Pro Val Ile Glu Pro Val Ala Ile Ser Leu Ile Gly
945 950 955 960
Ser Lys Arg Asp Thr Asn Ala Glu Val Glu Val Ser Ser Leu Ser Lys
965 970 975
Arg Glu Val Arg Lys Thr Asn Thr Asp Gly Leu Ile Ser Val Gln Ser
980 985 990
Lys Val Ile Lys Lys Glu Leu Leu Glu Ser Ser Leu Ala Glu Ala Gly
995 1000 1005
Ser Pro Leu Leu Glu Ala Thr Ile Ala Gln Ser Ser Asn Ser Asn
1010 1015 1020
Ser Thr Glu Ile Gly Met Ser Tyr Gln Asn Thr Val Leu Leu Glu
1025 1030 1035
Ser Asn Asn Thr Glu Arg Gln Val Ser Lys Ala Glu Ile Val Met
1040 1045 1050
Glu His Lys Glu Thr Glu Leu Val Glu Thr Val Ser Ser Ala Ser
1055 1060 1065
Glu Pro Val Val Leu Val Glu Asn Ile Ser Gln Thr Ser Asn Asn
1070 1075 1080
Thr Ile Glu Ser Gly Lys Asn Met Gly Val Gln Ser Gln Ala Gly
1085 1090 1095
Ala Lys Gln Ile Leu Gly Val Glu Gln Ser Ser Lys Val Ser Thr
1100 1105 1110
Pro Thr Ser Arg Gln Ile Met Gly Val Gly Leu Leu Thr Leu Val
1115 1120 1125
Leu Gly Ser Ala Leu Gly Leu Leu Lys Lys Arg Arg Lys
1130 1135 1140
<210> 2
<211> 1130
<212> PRT
<213> Искусственная
<220>
<223> rIdeSsuis
<400> 2
Met Ala His His His His His His Val Gly Thr Gly Ser Asn Asp Asp
1 5 10 15
Asp Asp Lys Ser Pro Asp Pro Val Val Thr Gly Val Asn Glu Ile Ile
20 25 30
Glu Glu Ser Gln Val Lys Asp Glu Val Ser Ile Glu Ser Glu Lys Asn
35 40 45
Glu Ser Leu Asp Gly Ser Asn Ile Glu Ile Val Glu Glu Ile Ala Asp
50 55 60
Asn Ile Pro Ser Pro Val Ile Ala Glu Gly Glu Val Ala Val Glu Met
65 70 75 80
Lys Val Asp Arg Gly Thr Glu Asn Val Val Ser Arg Asn Asp Thr Glu
85 90 95
Val Thr Thr Ser Glu Gln Asn Gln Ile Glu Val Thr Glu Thr Lys Glu
100 105 110
Ile Leu Asn Gln Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg Gln
115 120 125
Ile Ile Trp Ala His Gly Ile Thr Pro Pro Ala Met Glu Gln Ser Gly
130 135 140
Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala Pro
145 150 155 160
Phe Glu Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn Ala
165 170 175
Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn Met
180 185 190
Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr Leu
195 200 205
Lys Glu Lys Lys Gly Thr Val Asn Val Glu Glu Asn Tyr Ala Ile Thr
210 215 220
Asp Leu Arg Arg Tyr Ile Asn Ser Phe Gln Asn Gln Gln Asn Ser Arg
225 230 235 240
Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly Phe
245 250 255
Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro Lys
260 265 270
Ala Gln Gly Gly Val Asn Leu Glu Asp Ser Gln Leu Val Pro Asp Ser
275 280 285
Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr Asn
290 295 300
Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg Thr
305 310 315 320
Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu Gly
325 330 335
Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn Gln
340 345 350
Gly Lys Ile Lys Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln Glu
355 360 365
Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly Asn
370 375 380
Pro Arg Leu Asn Asn His Met Lys Asn Asn Ser Ala Gly Ala Leu Leu
385 390 395 400
Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu Glu Tyr
405 410 415
Phe Asn Pro Leu Ala Lys Ala Lys Glu Thr Ala Ser Gln Thr Leu Ala
420 425 430
Asp Thr Lys Lys Ala Leu Asp Leu Ser Ile Gln Gly Gln Ser Glu Leu
435 440 445
Pro Glu Ser Met Arg Leu Ile Tyr Leu Glu Lys Leu Asn Asn Leu Tyr
450 455 460
Asn Gln Gly Ile Leu Ser Ile Gln Lys Ala Glu Ser Ser Glu Met Leu
465 470 475 480
Ser Gly Ala Leu Glu Asn Gly Leu Asn Ser Leu Lys Ser Leu Asp Phe
485 490 495
Pro Ile Ser Glu Val Gly Asn Ala Leu Ala Pro Asp Leu Pro Val Gly
500 505 510
Asp Arg Ser Thr Val Ser Asp Val Asp Ser Leu Ser Ser Gln Glu Thr
515 520 525
Ser Ser Thr Asn Leu Glu Ala Asp Thr Glu Asn Ala Gly Ile Ile Ala
530 535 540
Asp Gly Thr Asn Gln Leu His Phe Pro Val Glu Ala Gln Thr Thr Ser
545 550 555 560
Ser Val Glu Ala Glu Gly Asp Asn Val Phe Glu Gln Glu Ala Asp Thr
565 570 575
Leu Pro Ile Ile Ile Glu Asn Lys Asp Glu Phe Gly Ser Glu Leu Ser
580 585 590
Arg Asn Met Gln Thr Ser Glu Thr Asp Ser Leu Val Val Ala Val Glu
595 600 605
Glu Asp Val Lys Asn Asp Glu Val Ala Gln Val Glu Glu Leu Leu Glu
610 615 620
Ser Glu Lys Val Glu Asn Gln Ser Ser Glu Leu Leu Ser Asp Thr Leu
625 630 635 640
Ile Val Glu Ser Ala Asn Asp Lys Glu Glu Asp Arg Val Glu Ala Val
645 650 655
Val Ser Glu Gln Pro Asp Ser Ile Pro His Gln Asn Val Glu Ile Ser
660 665 670
Leu Val Glu Pro Thr Asn Val Glu Thr Glu Thr Val Val Thr Pro Ile
675 680 685
Asn Asp Ala Ala Thr Pro His Gly Ser Pro Thr Tyr Ile Asp Asn Ser
690 695 700
Val Thr Glu Ser Val Ala Thr Pro Leu Glu Lys Asp Ser Ile Gln Ala
705 710 715 720
Gly Glu Thr Glu Ile Ala Glu Pro Thr Ser Ser Glu Ser Thr Asn Val
725 730 735
Glu Thr Glu Thr Val Val Thr Pro Val Asn Asp Val Ala Thr Pro His
740 745 750
Gly Ser Pro Thr Tyr Ile Asp Asn Ser Val Thr Glu Ser Val Ala Thr
755 760 765
Pro Leu Glu Lys Asp Ser Ile Gln Ala Gly Glu Thr Glu Ile Ala Glu
770 775 780
Pro Thr Ser Ser Glu Ser Thr Asn Val Glu Thr Glu Thr Val Val Thr
785 790 795 800
Pro Val Asn Asp Val Ala Thr Pro His Gly Ser Pro Thr Tyr Ile Asp
805 810 815
Asn Ser Val Thr Glu Ser Val Ala Thr Pro Leu Glu Lys Asp Ser Ile
820 825 830
Gln Ala Gly Glu Thr Glu Ile Ala Glu Pro Thr Ser Ser Glu Ser Thr
835 840 845
Ser Val Glu Ala Glu Leu Val Asp Asn Ser Glu Ile His Ala Ala Thr
850 855 860
Ser Ser Val Thr Pro Cys Gly Ser Ser Ala Tyr Ala Asp Gly Ser Thr
865 870 875 880
Thr Glu Ser Val Ala Thr Pro Leu Glu Lys Asp Ser Ile Gln Thr Gly
885 890 895
Asn Thr Glu Ile Ala Glu Pro Thr Ser Ser Lys Ser Thr Asn Val Glu
900 905 910
Ala Ala Ser Val Asp Asn Ser Glu Ile His Ala Asp Ala Ser Leu Thr
915 920 925
Ala Val Ser Ser Val Asn Leu Asp Asn Pro Val Ile Glu Pro Val Ala
930 935 940
Ile Ser Leu Ile Gly Ser Lys Arg Asp Thr Asn Ala Glu Val Glu Val
945 950 955 960
Ser Ser Leu Ser Lys Arg Glu Val Arg Lys Thr Asn Thr Asp Gly Leu
965 970 975
Ile Ser Val Gln Ser Lys Val Ile Lys Lys Glu Leu Leu Glu Ser Ser
980 985 990
Leu Ala Glu Ala Gly Ser Pro Leu Leu Glu Ala Thr Ile Ala Gln Ser
995 1000 1005
Ser Asn Ser Asn Ser Thr Glu Ile Gly Met Ser Tyr Gln Asn Thr
1010 1015 1020
Val Leu Leu Glu Ser Asn Asn Thr Glu Arg Gln Val Ser Lys Ala
1025 1030 1035
Glu Ile Val Met Glu His Lys Glu Thr Glu Leu Val Glu Thr Val
1040 1045 1050
Ser Ser Ala Ser Glu Pro Val Val Leu Val Glu Asn Ile Ser Gln
1055 1060 1065
Thr Ser Asn Asn Thr Ile Glu Ser Gly Lys Asn Met Gly Val Gln
1070 1075 1080
Ser Gln Ala Gly Ala Lys Gln Ile Leu Gly Val Glu Gln Ser Ser
1085 1090 1095
Lys Val Ser Thr Pro Thr Ser Arg Gln Ile Met Gly Val Gly Leu
1100 1105 1110
Leu Thr Leu Val Leu Gly Ser Ala Leu Gly Leu Leu Lys Lys Arg
1115 1120 1125
Arg Lys
1130
<210> 3
<211> 3426
<212> ДНК
<213> Streptococcus suis
<400> 3
atgaacattc aagaacgatt ttctttgaga aaatccgcgg ttggcttggt ctcagtctct 60
ttgctatgtg ctatttatac atccactgtt gctgccgata cagttgttac aggagtgaat 120
gaaataattg aagaatcaca agtcaaggat gaggtatcta ttgaatcaga aaaaaatgaa 180
tccctagatg gttctaatat tgaaattgta gaggaaatag cagacaacat cccatcacct 240
gttatcgctg aaggggaagt agcggtagag atgaaagttg acagagggac cgagaatgta 300
gtttctagaa atgatacaga agttacgacg agcgagcaaa atcagataga ggttactgag 360
acaaaagaaa ttttgaatca gaccagttat caaacggaga gtggcgagca acgacaaatt 420
atatgggccc atggaattac tcctcctgca atggaacaaa gcggtggttt tgtaaaggaa 480
aagtatggag actatttaaa ctatacagcg ccatttgagg ctggaaaagg ctactatgat 540
accaataaga gtctgaatgc ttcatttatt gaccttaatc tttgttttgc agctgtgtct 600
tcaaacatgg tacattggtg gttggaacag aatagttcct atgttgagcg atatctcaaa 660
gaaaaaaagg gtacagtaaa tgttgaagaa aactacgcaa taacggactt acggcgctat 720
attaattcat tccaaaatca acaaaatagt cgagtttttg atatgttcaa aacttactat 780
ggttatcgta caaatggttt tgtatcagat gccttggttg acttgtttat taacggatat 840
aaacctaagg cacagggcgg tgtcaatctg gaagatagcc agttagtacc agatagtagg 900
ggtggctttt tctacgacgt tttcaaagag aaaaaactga caaatcgaat ttttagtggt 960
agttatgagc ggtttggtga ggatgttcga actgttttgg aaagcaaagg attactcggc 1020
ttaacttata gaacattagg ttatgcaacg catattgtga cggtatgggg tgctgagtac 1080
gacaatcaag gtaagattaa ggctgtctat atcacagatt ctgatgatca acaagaacaa 1140
attggtttga agcgtatggg aatcactcgt gatgcttccg gaaatccacg tttgaataat 1200
catatgaaaa ataattcagc tggagcgctt ttggattatg tccatacaat ccgtctgggt 1260
caagacttat gggaagaata tttcaatccg cttgcaaaag ccaaagaaac agctagtcag 1320
acattagccg atacaaagaa ggcgttggat ttgtctattc aaggacaatc tgaattgcca 1380
gaatcaatgc gactgattta tcttgaaaaa ctaaataatc tctataatca aggaattcta 1440
tctattcaaa aggcagaaag ttctgagatg ctaagtggtg cattggaaaa tggtttaaat 1500
agtttaaaga gtttagattt tcctatttca gaagttggaa atgctttggc accagattta 1560
ccagtaggtg atcgctcaac ggtttcagat gttgattctc tatcatctca agaaacaagt 1620
tccacaaatt tggaagcaga cacagagaat gcaggtatta ttgcagatgg taccaatcaa 1680
ttgcattttc cagtggaggc ccaaacgaca tcttcagtag aggctgaggg agataatgtt 1740
tttgaacaag aggcagatac attaccaata attattgaaa acaaggatga atttggttca 1800
gaactatcaa gaaacatgca aacgtcagaa acggattcgc tagtagtagc tgttgaagaa 1860
gatgtgaaaa atgatgaggt agcccaagtt gaagagcttc ttgaatcaga aaaagttgaa 1920
aatcagagtt cggaacttct gtcagacacc ctaatcgtag agagtgcaaa tgacaaagaa 1980
gaagatagag tggaggcggt tgtttctgaa caaccagact caataccaca tcaaaatgta 2040
gaaatctctc ttgtagaacc aacgaatgtc gaaactgaaa ctgtggtcac tcctattaat 2100
gatgcagcta ctcctcatgg ttccccgacg tatatagata attccgtaac tgaatctgta 2160
gctactccac ttgaaaaaga ctccattcaa gccggggaga cagagattgc agaaccaacc 2220
tcgagcgaat caacgaatgt cgaaactgaa actgtggtca ctcctgttaa tgatgtagct 2280
actcctcatg gttccccgac gtatatagat aattccgtaa ctgaatctgt agctactcca 2340
cttgaaaaag actccattca agccggagag acagaaattg cagaaccaac ctcgagcgaa 2400
tcaacgaatg tcgaaactga aactgtggtc actcctgtta atgatgtagc tactcctcat 2460
ggttccccga cgtatataga taattccgta actgaatctg tagctactcc acttgaaaaa 2520
gactccattc aagccgggga gacagagatt gcagaaccaa cctcgagcga atcaactagt 2580
gttgaagctg aacttgtcga caattctgaa attcatgcag ctacctcttc agttactccc 2640
tgtggctcct cggcatatgc agatggttcc acaactgaat ctgtagccac tccgcttgaa 2700
aaagactcca ttcagactgg aaatacagaa attgcagaac caacctcgag caaatcaact 2760
aatgtagaag ctgcatctgt cgacaattct gaaattcatg cagatgcctc tctaactgct 2820
gtttcatcag ttaatctgga taatccagtg attgaaccag tagctatctc ccttatcggt 2880
tctaagaggg acacgaatgc agaagtagaa gtttcttcat tatcgaaaag agaggttaga 2940
aaaacaaata ctgacgggct aatctctgtt caatcaaaag ttattaagaa agaattgcta 3000
gaatcaagct tagcagaagc agggtctcca ttgctagaag ccaccattgc tcagtcttca 3060
aactcaaata gtactgagat aggtatgagc tatcagaata ctgtgttatt agagtctaat 3120
aatacagagc gtcaggtgtc taaagcagaa attgttatgg aacacaagga gacagagtta 3180
gttgaaacgg tttcatctgc ttctgagcct gtagtgctcg tagaaaatat ctcacaaacc 3240
tcaaataata ctattgaatc tggtaagaat atgggagttc aatctcaagc aggtgcaaaa 3300
caaattttag gcgtagaaca atcttcgaaa gtaagtacac ctacttcaag acagattatg 3360
ggagtcggtc tattgactct tgttcttggt agtgctttag gtttgttaaa gaaaagacgt 3420
aagtaa 3426
<210> 4
<211> 3393
<212> ДНК
<213> Искусственная
<220>
<223> Нуклеотидная последовательность кодирующая rIdeSsuis
<400> 4
atggcacatc accaccacca tcacgtgggt accggttcga atgatgacga cgacaagagt 60
ccggatccag ttgttacagg agtgaatgaa ataattgaag aatcacaagt caaggatgag 120
gtatctattg aatcagaaaa aaatgaatcc ctagatggtt ctaatattga aattgtagag 180
gaaatagcag acaacatccc atcacctgtt atcgctgaag gggaagtagc ggtagagatg 240
aaagttgaca gagggaccga gaatgtagtt tctagaaatg atacagaagt tacgacgagc 300
gagcaaaatc agatagaggt tactgagaca aaagaaattt tgaatcagac cagttatcaa 360
acggagagtg gcgagcaacg acaaattata tgggcccatg gaattactcc tcctgcaatg 420
gaacaaagcg gtggttttgt aaaggaaaag tatggagact atttaaacta tacagcgcca 480
tttgaggctg gaaaaggcta ctatgatacc aataagagtc tgaatgcttc atttattgac 540
cttaatcttt gttttgcagc tgtgtcttca aacatggtac attggtggtt ggaacagaat 600
agttcctatg ttgagcgata tctcaaagaa aaaaagggta cagtaaatgt tgaagaaaac 660
tacgcaataa cggacttacg gcgctatatt aattcattcc aaaatcaaca aaatagtcga 720
gtttttgata tgttcaaaac ttactatggt tatcgtacaa atggttttgt atcagatgcc 780
ttggttgact tgtttattaa cggatataaa cctaaggcac agggcggtgt caatctggaa 840
gatagccagt tagtaccaga tagtaggggt ggctttttct acgacgtttt caaagagaaa 900
aaactgacaa atcgaatttt tagtggtagt tatgagcggt ttggtgagga tgttcgaact 960
gttttggaaa gcaaaggatt actcggctta acttatagaa cattaggtta tgcaacgcat 1020
attgtgacgg tatggggtgc tgagtacgac aatcaaggta agattaaggc tgtctatatc 1080
acagattctg atgatcaaca agaacaaatt ggtttgaagc gtatgggaat cactcgtgat 1140
gcttccggaa atccacgttt gaataatcat atgaaaaata attcagctgg agcgcttttg 1200
gattatgtcc atacaatccg tctgggtcaa gacttatggg aagaatattt caatccgctt 1260
gcaaaagcca aagaaacagc tagtcagaca ttagccgata caaagaaggc gttggatttg 1320
tctattcaag gacaatctga attgccagaa tcaatgcgac tgatttatct tgaaaaacta 1380
aataatctct ataatcaagg aattctatct attcaaaagg cagaaagttc tgagatgcta 1440
agtggtgcat tggaaaatgg tttaaatagt ttaaagagtt tagattttcc tatttcagaa 1500
gttggaaatg ctttggcacc agatttacca gtaggtgatc gctcaacggt ttcagatgtt 1560
gattctctat catctcaaga aacaagttcc acaaatttgg aagcagacac agagaatgca 1620
ggtattattg cagatggtac caatcaattg cattttccag tggaggccca aacgacatct 1680
tcagtagagg ctgagggaga taatgttttt gaacaagagg cagatacatt accaataatt 1740
attgaaaaca aggatgaatt tggttcagaa ctatcaagaa acatgcaaac gtcagaaacg 1800
gattcgctag tagtagctgt tgaagaagat gtgaaaaatg atgaggtagc ccaagttgaa 1860
gagcttcttg aatcagaaaa agttgaaaat cagagttcgg aacttctgtc agacacccta 1920
atcgtagaga gtgcaaatga caaagaagaa gatagagtgg aggcggttgt ttctgaacaa 1980
ccagactcaa taccacatca aaatgtagaa atctctcttg tagaaccaac gaatgtcgaa 2040
actgaaactg tggtcactcc tattaatgat gcagctactc ctcatggttc cccgacgtat 2100
atagataatt ccgtaactga atctgtagct actccacttg aaaaagactc cattcaagcc 2160
ggggagacag agattgcaga accaacctcg agcgaatcaa cgaatgtcga aactgaaact 2220
gtggtcactc ctgttaatga tgtagctact cctcatggtt ccccgacgta tatagataat 2280
tccgtaactg aatctgtagc tactccactt gaaaaagact ccattcaagc cggagagaca 2340
gaaattgcag aaccaacctc gagcgaatca acgaatgtcg aaactgaaac tgtggtcact 2400
cctgttaatg atgtagctac tcctcatggt tccccgacgt atatagataa ttccgtaact 2460
gaatctgtag ctactccact tgaaaaagac tccattcaag ccggggagac agagattgca 2520
gaaccaacct cgagcgaatc aactagtgtt gaagctgaac ttgtcgacaa ttctgaaatt 2580
catgcagcta cctcttcagt tactccctgt ggctcctcgg catatgcaga tggttccaca 2640
actgaatctg tagccactcc gcttgaaaaa gactccattc agactggaaa tacagaaatt 2700
gcagaaccaa cctcgagcaa atcaactaat gtagaagctg catctgtcga caattctgaa 2760
attcatgcag atgcctctct aactgctgtt tcatcagtta atctggataa tccagtgatt 2820
gaaccagtag ctatctccct tatcggttct aagagggaca cgaatgcaga agtagaagtt 2880
tcttcattat cgaaaagaga ggttagaaaa acaaatactg acgggctaat ctctgttcaa 2940
tcaaaagtta ttaagaaaga attgctagaa tcaagcttag cagaagcagg gtctccattg 3000
ctagaagcca ccattgctca gtcttcaaac tcaaatagta ctgagatagg tatgagctat 3060
cagaatactg tgttattaga gtctaataat acagagcgtc aggtgtctaa agcagaaatt 3120
gttatggaac acaaggagac agagttagtt gaaacggttt catctgcttc tgagcctgta 3180
gtgctcgtag aaaatatctc acaaacctca aataatacta ttgaatctgg taagaatatg 3240
ggagttcaat ctcaagcagg tgcaaaacaa attttaggcg tagaacaatc ttcgaaagta 3300
agtacaccta cttcaagaca gattatggga gtcggtctat tgactcttgt tcttggtagt 3360
gctttaggtt tgttaaagaa aagacgtaag taa 3393
<210> 5
<211> 335
<212> PRT
<213> Искусственная
<220>
<223> Частичная последовательность домена Mac-1
<400> 5
Met Lys Val Asp Arg Gly Thr Glu Asn Val Val Ser Arg Asn Asp Thr
1 5 10 15
Glu Val Thr Thr Ser Glu Gln Asn Gln Ile Glu Val Thr Glu Thr Lys
20 25 30
Glu Ile Leu Asn Gln Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg
35 40 45
Gln Ile Ile Trp Ala His Gly Ile Thr Pro Pro Ala Met Glu Gln Ser
50 55 60
Gly Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala
65 70 75 80
Pro Phe Glu Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn
85 90 95
Ala Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn
100 105 110
Met Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr
115 120 125
Leu Lys Glu Lys Lys Gly Thr Val Asn Val Glu Glu Asn Tyr Ala Ile
130 135 140
Thr Asp Leu Arg Arg Tyr Ile Asn Ser Phe Gln Asn Gln Gln Asn Ser
145 150 155 160
Arg Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly
165 170 175
Phe Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro
180 185 190
Lys Ala Gln Gly Gly Val Asn Leu Glu Asp Ser Gln Leu Val Pro Asp
195 200 205
Ser Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr
210 215 220
Asn Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg
225 230 235 240
Thr Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu
245 250 255
Gly Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn
260 265 270
Gln Gly Lys Ile Lys Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln
275 280 285
Glu Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly
290 295 300
Asn Pro Arg Leu Asn Asn His Met Lys Asn Asn Ser Ala Gly Ala Leu
305 310 315 320
Leu Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu
325 330 335
<210> 6
<211> 457
<212> PRT
<213> Искусственная
<220>
<223> rIdeSsuis_гомолог
<400> 6
Met Ala His His His His His His Val Gly Thr Gly Ser Asn Asp Asp
1 5 10 15
Asp Asp Lys Ser Pro Asp Pro Val Val Thr Gly Val Asn Glu Ile Ile
20 25 30
Glu Glu Ser Gln Val Lys Asp Glu Val Ser Ile Glu Ser Glu Lys Asn
35 40 45
Glu Ser Leu Asp Gly Ser Asn Ile Glu Ile Val Glu Glu Ile Ala Asp
50 55 60
Asn Ile Pro Ser Pro Val Ile Ala Glu Gly Glu Val Ala Val Glu Met
65 70 75 80
Lys Val Asp Arg Gly Thr Glu Asn Val Val Ser Arg Asn Asp Thr Glu
85 90 95
Val Thr Thr Ser Glu Gln Asn Gln Ile Glu Val Thr Glu Thr Lys Glu
100 105 110
Ile Leu Asn Gln Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg Gln
115 120 125
Ile Ile Trp Ala His Gly Ile Thr Pro Pro Ala Met Glu Gln Ser Gly
130 135 140
Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala Pro
145 150 155 160
Phe Glu Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn Ala
165 170 175
Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn Met
180 185 190
Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr Leu
195 200 205
Lys Glu Lys Lys Gly Thr Val Asn Val Glu Glu Asn Tyr Ala Ile Thr
210 215 220
Asp Leu Arg Arg Tyr Ile Asn Ser Phe Gln Asn Gln Gln Asn Ser Arg
225 230 235 240
Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly Phe
245 250 255
Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro Lys
260 265 270
Ala Gln Gly Gly Val Asn Leu Glu Asp Ser Gln Leu Val Pro Asp Ser
275 280 285
Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr Asn
290 295 300
Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg Thr
305 310 315 320
Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu Gly
325 330 335
Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn Gln
340 345 350
Gly Lys Ile Lys Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln Glu
355 360 365
Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly Asn
370 375 380
Pro Arg Leu Asn Asn His Met Lys Asn Asn Ser Ala Gly Ala Leu Leu
385 390 395 400
Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu Glu Tyr
405 410 415
Phe Asn Pro Leu Ala Lys Ala Cys Arg Ser Thr Ser Leu Arg Pro His
420 425 430
Ser Ser Leu Val Lys Lys Pro Leu Leu Arg Asn Leu Asn Ala Ser Thr
435 440 445
Trp Thr Arg Leu Leu Ala Gln Leu Asn
450 455
<210> 7
<211> 1016
<212> PRT
<213> Искусственная
<220>
<223> rIdeSsuisB2
<400> 7
Met Ala His His His His His His Val Gly Thr Gly Ser Asn Asp Asp
1 5 10 15
Asp Asp Lys Ser Pro Asp Pro Val Val Thr Gly Val Asn Glu Ile Ile
20 25 30
Glu Glu Ser Gln Val Lys Asp Glu Val Ser Ile Glu Ser Glu Lys Asn
35 40 45
Glu Ser Leu Asp Gly Ser Asn Ile Glu Ile Val Glu Glu Ile Ala Asp
50 55 60
Asn Ile Pro Ser Pro Val Ile Ala Glu Gly Glu Val Ala Val Glu Met
65 70 75 80
Lys Val Asp Arg Gly Thr Glu Asn Val Val Ser Arg Asn Asp Thr Glu
85 90 95
Val Thr Thr Ser Glu Gln Asn Gln Ile Glu Val Thr Glu Thr Lys Glu
100 105 110
Ile Leu Asn Gln Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg Gln
115 120 125
Ile Ile Trp Ala His Gly Ile Thr Pro Pro Ala Met Glu Gln Ser Gly
130 135 140
Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala Pro
145 150 155 160
Phe Lys Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn Ala
165 170 175
Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn Met
180 185 190
Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr Leu
195 200 205
Lys Glu Lys Lys Gly Thr Val Asn Val Gly Glu Asn Tyr Ala Ile Thr
210 215 220
Asp Leu Arg Arg Tyr Ile Asp Ser Phe Gln Asp Gln Gln Asn Ser Arg
225 230 235 240
Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly Phe
245 250 255
Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro Lys
260 265 270
Val Gln Gly Gly Val Asn Leu Glu Asp Ser Gln Leu Val Pro Asp Ser
275 280 285
Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr Asn
290 295 300
Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg Thr
305 310 315 320
Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu Gly
325 330 335
Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn Gln
340 345 350
Gly Lys Ile Arg Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln Glu
355 360 365
Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly Asn
370 375 380
Pro Arg Leu Asn Asn His Val Lys Asn Asn Ser Ala Gly Ala Leu Leu
385 390 395 400
Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu Glu Tyr
405 410 415
Phe Asn Pro Phe Ala Lys Ala Lys Glu Ile Ala Ser Gln Ile Leu Ala
420 425 430
Asp Arg Lys Lys Ala Leu Val Leu Ser Ile Gln Gly Gln Ser Glu Leu
435 440 445
Pro Glu Ser Met Arg Leu Ile Tyr Leu Glu Lys Leu Asn Asn Leu Tyr
450 455 460
Asn Gln Gly Ile Leu Ser Ile Gln Lys Thr Glu Ser Ser Glu Met Leu
465 470 475 480
Ser Gly Ala Leu Glu Asn Gly Leu Asn Ser Leu Lys Ser Leu Asp Phe
485 490 495
Pro Ile Ser Glu Val Gly Asn Ala Leu Ala Pro Asp Leu Ser Val Gly
500 505 510
Asp Arg Ser Thr Val Ser Asp Val Asp Ser Leu Ser Ser Gln Glu Thr
515 520 525
Ser Ser Thr Asn Leu Glu Ala Asp Thr Glu Asn Ala Gly Ile Ile Ala
530 535 540
Asp Gly Thr Asn Gln Leu His Phe Pro Val Glu Ala Gln Thr Thr Ser
545 550 555 560
Ser Val Glu Ala Glu Gly Asp Asn Val Phe Glu Gln Glu Ala Asp Thr
565 570 575
Leu Pro Ile Ile Ile Glu Asn Lys Asp Glu Phe Gly Ser Glu Leu Ser
580 585 590
Gly Asn Met Gln Thr Ser Glu Thr Asp Ser Leu Val Val Ala Val Glu
595 600 605
Glu Asp Val Lys Asn Asp Glu Val Asp Gln Val Glu Lys Leu Leu Glu
610 615 620
Ser Glu Lys Val Glu Asn Gln Ser Ser Glu Leu Leu Ser Asp Thr Leu
625 630 635 640
Ile Val Glu Gly Ala Asn Asp Lys Glu Glu Asp Arg Val Glu Ala Val
645 650 655
Val Ser Glu Gln Pro Asp Ser Ile Pro His Gln Asn Val Glu Ile Ser
660 665 670
Pro Val Glu Pro Met Asn Val Glu Thr Glu Ser Val Val Thr Pro Ile
675 680 685
Asn Asp Ala Ala Thr Pro His Gly Phe Pro Met Tyr Ile Asp Asn Ser
690 695 700
Val Thr Glu Ser Val Ala Thr Pro Leu Glu Lys Asp Ser Ile Gln Ala
705 710 715 720
Gly Glu Thr Glu Ile Ala Glu Pro Thr Ser Ser Glu Ser Thr Ser Val
725 730 735
Glu Ala Glu Leu Val Asp Asn Ser Glu Ile His Ser Ala Thr Ser Ser
740 745 750
Val Thr Pro Arg Gly Ser Ser Ala Tyr Ala Asp Ser Ser Thr Thr Glu
755 760 765
Ser Val Ala Thr Leu Leu Glu Lys Asp Ser Ile Gln Ala Gly Glu Thr
770 775 780
Glu Ile Ala Glu Pro Thr Ser Ser Lys Ser Thr Asn Val Glu Ala Ala
785 790 795 800
Ser Val Asp Asn Ser Glu Ile His Ala Asp Thr Ser Leu Thr Ala Val
805 810 815
Ser Ser Val Asn Leu Asp Asn Pro Val Ile Glu Pro Val Ala Ile Pro
820 825 830
Leu Ile Gly Ser Lys Arg Asp Thr Asn Ala Glu Val Glu Val Ser Ser
835 840 845
Leu Ser Lys Arg Glu Val Arg Lys Pro Asn Thr Glu Gly Leu Ile Ser
850 855 860
Val Gln Ser Lys Val Ile Lys Lys Glu Leu Leu Glu Ser Ser Leu Val
865 870 875 880
Glu Ala Gly Ser Pro Leu Leu Glu Ala Thr Ile Ala Gln Ser Ser Asn
885 890 895
Ser Asn Ser Thr Glu Ile Gly Met Ser Tyr Gln Asn Thr Val Leu Leu
900 905 910
Glu Ser Asn Asn Thr Glu Arg Gln Val Ser Lys Ala Glu Ile Val Ile
915 920 925
Glu His Lys Glu Thr Glu Leu Val Glu Thr Val Ser Ser Ala Ser Glu
930 935 940
Pro Val Val Leu Val Glu Asn Ile Ser Gln Thr Ser Asn Asn Thr Ile
945 950 955 960
Glu Ser Gly Lys Asn Met Gly Val Gln Ser Gln Ala Gly Ala Lys Gln
965 970 975
Ile Leu Gly Ile Glu Gln Ser Ser Lys Val Ser Thr Pro Thr Ser Arg
980 985 990
Gln Ile Met Gly Val Gly Leu Leu Thr Leu Val Leu Gly Ser Ala Leu
995 1000 1005
Gly Leu Leu Lys Lys Arg Arg Lys
1010 1015
<210> 8
<211> 1374
<212> ДНК
<213> Искусственная
<220>
<223> Нуклеотидная последовательность кодирующая rIdeSsuis_гомолог
<400> 8
atggcacatc accaccacca tcacgtgggt accggttcga atgatgacga cgacaagagt 60
ccggatccag ttgttacagg agtgaatgaa ataattgaag aatcacaagt caaggatgag 120
gtatctattg aatcagaaaa aaatgaatcc ctagatggtt ctaatattga aattgtagag 180
gaaatagcag acaacatccc atcacctgtt atcgctgaag gggaagtagc ggtagagatg 240
aaagttgaca gagggaccga gaatgtagtt tctagaaatg atacagaagt tacgacgagc 300
gagcaaaatc agatagaggt tactgagaca aaagaaattt tgaatcagac cagttatcaa 360
acggagagtg gcgagcaacg acaaattata tgggcccatg gaattactcc tcctgcaatg 420
gaacaaagcg gtggttttgt aaaggaaaag tatggagact atttaaacta tacagcgcca 480
tttgaggctg gaaaaggcta ctatgatacc aataagagtc tgaatgcttc atttattgac 540
cttaatcttt gttttgcagc tgtgtcttca aacatggtac attggtggtt ggaacagaat 600
agttcctatg ttgagcgata tctcaaagaa aaaaagggta cagtaaatgt tgaagaaaac 660
tacgcaataa cggacttacg gcgctatatt aattcattcc aaaatcaaca aaatagtcga 720
gtttttgata tgttcaaaac ttactatggt tatcgtacaa atggttttgt atcagatgcc 780
ttggttgact tgtttattaa cggatataaa cctaaggcac agggcggtgt caatctggaa 840
gatagccagt tagtaccaga tagtaggggt ggctttttct acgacgtttt caaagagaaa 900
aaactgacaa atcgaatttt tagtggtagt tatgagcggt ttggtgagga tgttcgaact 960
gttttggaaa gcaaaggatt actcggctta acttatagaa cattaggtta tgcaacgcat 1020
attgtgacgg tatggggtgc tgagtacgac aatcaaggta agattaaggc tgtctatatc 1080
acagattctg atgatcaaca agaacaaatt ggtttgaagc gtatgggaat cactcgtgat 1140
gcttccggaa atccacgttt gaataatcat atgaaaaata attcagctgg agcgcttttg 1200
gattatgtcc atacaatccg tctgggtcaa gacttatggg aagaatattt caatccgctt 1260
gcaaaagcct gcaggtcgac aagcttgcgg ccgcactcga gtctggtaaa gaaaccgctg 1320
ctgcgaaatt tgaacgccag cacatggact cgtctactag cgcagcttaa ttaa 1374
<210> 9
<211> 3051
<212> ДНК
<213> Искусственная
<220>
<223> Нуклеотидная последовательность колирующая rIdeSsuisB2
<400> 9
atggcacatc accaccacca tcacgtgggt accggttcga atgatgacga cgacaagagt 60
ccggatccag ttgttacagg agtgaatgaa ataattgaag aatcacaagt caaggatgag 120
gtatctattg aatcagaaaa aaatgaatcc ctagatggtt ctaatattga aattgtagag 180
gaaatagcag acaacatccc atcacctgtt atcgctgaag gggaagtagc ggtagagatg 240
aaagttgaca gagggaccga gaatgtagtt tctagaaatg atacagaagt tacgacgagc 300
gagcaaaatc agatagaggt tactgagaca aaagaaattt tgaatcagac cagttatcaa 360
acggagagtg gcgagcaacg acaaattata tgggcccatg gaattactcc tcctgcaatg 420
gaacaaagcg gtggttttgt aaaggaaaag tatggagact atttaaacta tacagcgcca 480
tttaaggcag gaaaaggcta ttatgatacc aataaaagtc tcaatgcttc atttattgac 540
cttaacctat gttttgcagc cgtgtcttcc aacatggtac attggtggtt ggaacagaat 600
agttcctatg ttgagcgata tctcaaagaa aaaaagggta cagtaaatgt tggggaaaac 660
tatgcaataa cggacctacg tcgctatatt gattcgttcc aggatcagca aaatagtcga 720
gtctttgata tgttcaaaac ttactacggt tatcgtacaa atggttttgt gtcagatgcc 780
ctagttgact tgtttattaa tggatataaa cctaaggtac agggtggtgt caatctggaa 840
gatagccagt tagtaccaga tagtaggggt ggctttttct acgacgtttt caaagagaaa 900
aaactgacaa atcgtatttt tagtggtagc tatgagcgtt ttggtgagga tgttcgaact 960
gttttggaga gcaaaggatt actcggtcta acttatagaa cattaggcta tgcaacgcat 1020
attgtgacgg tatggggtgc tgagtacgat aatcaaggta agattagggc tgtctatatc 1080
actgattccg atgatcaaca agaacaaatt ggtttgaagc gtatgggaat cactcgtgat 1140
gcttctggaa atccgcgttt gaataatcat gtgaaaaata attcagctgg ggcgcttttg 1200
gattatgtcc atacaatccg tcttggtcaa gacttatggg aagaatattt caatccgttc 1260
gcaaaagcca aagaaatagc tagtcagata ctagctgata gaaagaaggc gttggttctg 1320
tctattcaag gacaatctga attgccagaa tcaatgcggc tgatttatct tgaaaaacta 1380
aataatctct ataatcaagg gattctatct attcaaaaga cagaaagttc tgagatgcta 1440
agtggtgcat tggaaaatgg tttaaatagt ttaaagagtt tagattttcc tatttcagaa 1500
gttggaaatg ctttggcacc agatttatca gtaggtgatc gctcaacggt ttcagatgtt 1560
gattctctat catctcaaga aacaagttcc acaaatttgg aagcagacac agagaatgca 1620
ggtattattg cagatggtac caatcaattg cattttccag tggaggccca aacgacatct 1680
tcagtagagg ctgagggaga taatgttttt gaacaagagg cagatacatt accaataatt 1740
attgaaaaca aggatgaatt tggttcagaa ctatcaggaa acatgcaaac gtcagaaacg 1800
gattcgctag tagtagctgt tgaagaagat gtgaaaaatg atgaggtaga ccaagttgaa 1860
aagcttcttg aatcagaaaa agttgaaaat cagagttcgg aacttctgtc agacacccta 1920
atcgtagagg gtgcaaatga caaagaagaa gatagagtgg aggcggttgt ttctgaacaa 1980
ccagactcaa taccacatca aaatgtagaa atctctcctg tagaaccaat gaatgtcgaa 2040
actgaatctg tggtcactcc tattaatgat gcagctactc ctcatggttt cccgatgtat 2100
atagataatt ccgtaactga atctgtagct actccacttg aaaaagactc cattcaagcc 2160
ggagagacag aaattgcaga accaacctcg agcgaatcaa ctagtgttga agctgaactt 2220
gtcgacaatt ctgaaatcca ttcagctacc tcttcagtta ctccccgtgg ttcctcggca 2280
tatgcagata gttccacaac tgaatctgta gctactctgc ttgaaaaaga ctccattcag 2340
gctggagaga cagaaattgc agaaccaacc tcgagcaaat caactaatgt cgaagctgca 2400
tctgtcgaca attctgaaat tcatgcagat acctctctaa ctgctgtttc atcagtcaat 2460
ctggataatc cagtgattga accagtagct atccccctta tcggttctaa gagggacacg 2520
aatgcagaag tggaagtttc ttcattatcg aaaagagagg ttagaaaacc aaatactgaa 2580
gggctaatct ctgttcaatc aaaagttatt aagaaagaat tgctagaatc aagcttagta 2640
gaagcagggt ctccattgct agaagccacc attgctcagt cttcaaactc aaatagtact 2700
gagataggta tgagctatca gaatactgtg ttattagagt ctaataatac agagcgtcag 2760
gtgtctaaag cagaaattgt tatagaacac aaggagacag agttagttga aacggtttca 2820
tctgcttctg agcctgtagt gctcgtagaa aatatctcac aaacctcaaa taatactatt 2880
gaatctggta agaatatggg agttcaatct caagcaggtg caaaacaaat tttaggcata 2940
gaacaatctt cgaaagtaag tacacctact tcaagacaga ttatgggagt cggtctattg 3000
actcttgttc ttggtagtgc tttaggtttg ttaaagaaaa gacgtaagta a 3051
<210> 10
<211> 335
<212> PRT
<213> Искусственная
<220>
<223> аминокислоты WP_044671938 с 91 по 425
<400> 10
Met Lys Val Asp Arg Gly Thr Glu Asn Val Val Ser Arg Asn Asp Thr
1 5 10 15
Glu Val Thr Thr Ser Glu Gln Asn Gln Ile Glu Val Thr Glu Thr Lys
20 25 30
Glu Ile Leu Asn Gln Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg
35 40 45
Gln Ile Ile Trp Ala His Gly Ile Thr Pro Pro Ala Met Glu Gln Ser
50 55 60
Gly Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala
65 70 75 80
Pro Phe Lys Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn
85 90 95
Ala Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn
100 105 110
Met Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr
115 120 125
Leu Lys Glu Lys Lys Gly Thr Val Asn Val Gly Glu Asn Tyr Ala Ile
130 135 140
Thr Asp Leu Arg Arg Tyr Ile Asp Ser Phe Gln Asp Gln Gln Asn Ser
145 150 155 160
Arg Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly
165 170 175
Phe Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro
180 185 190
Lys Val Gln Gly Gly Val Asn Leu Glu Asp Ser Gln Leu Val Pro Asp
195 200 205
Ser Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr
210 215 220
Asn Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg
225 230 235 240
Thr Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu
245 250 255
Gly Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn
260 265 270
Gln Gly Lys Ile Lys Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln
275 280 285
Glu Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly
290 295 300
Asn Pro Arg Leu Asn Asn His Met Lys Asn Asn Ser Ala Gly Ala Leu
305 310 315 320
Leu Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu
325 330 335
<210> 11
<211> 335
<212> PRT
<213> Искусственная
<220>
<223> аминокислоты WP_002935529 с 91 по 425
<400> 11
Met Lys Val Asp Arg Gly Thr Glu Asn Val Val Ser Arg Asn Asp Thr
1 5 10 15
Glu Val Thr Thr Ser Glu Gln Asn Gln Ile Glu Val Thr Glu Thr Lys
20 25 30
Glu Ile Leu Asn Gln Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg
35 40 45
Gln Ile Ile Trp Ala His Gly Ile Thr Pro Pro Ala Met Glu Gln Ser
50 55 60
Gly Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala
65 70 75 80
Pro Phe Lys Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn
85 90 95
Ala Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn
100 105 110
Met Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr
115 120 125
Leu Lys Glu Lys Lys Gly Thr Val Asn Val Gly Glu Asn Tyr Ala Ile
130 135 140
Thr Asp Leu Arg Arg Tyr Ile Asp Ser Phe Gln Asp Gln Gln Asn Ser
145 150 155 160
Arg Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly
165 170 175
Phe Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro
180 185 190
Lys Val Gln Gly Gly Val Asn Leu Glu Asp Ser Gln Leu Val Pro Asp
195 200 205
Ser Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr
210 215 220
Asn Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg
225 230 235 240
Thr Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu
245 250 255
Gly Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn
260 265 270
Gln Gly Lys Ile Arg Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln
275 280 285
Glu Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly
290 295 300
Asn Pro Arg Leu Asn Asn His Val Lys Asn Asn Ser Ala Gly Ala Leu
305 310 315 320
Leu Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu
325 330 335
<210> 12
<211> 335
<212> PRT
<213> Искусственная
<220>
<223> аминокислоты WP_015647040 с 92 по 426
<400> 12
Met Lys Val Asp Arg Gly Thr Glu Asn Val Val Ser Arg Asn Asp Lys
1 5 10 15
Glu Val Thr Thr Ser Glu Lys Asn Gln Ile Glu Val Thr Glu Thr Lys
20 25 30
Glu Ile Leu Asn Gln Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg
35 40 45
Gln Ile Ile Trp Ala His Gly Ile Thr Pro Pro Ala Met Glu Gln Ser
50 55 60
Gly Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala
65 70 75 80
Pro Phe Glu Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn
85 90 95
Ala Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn
100 105 110
Met Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr
115 120 125
Leu Lys Glu Lys Asn Ser Thr Val Asn Val Gly Glu Asn Tyr Ala Ile
130 135 140
Thr Asp Leu Arg Arg Tyr Ile Asn Ser Phe Gln Asn Gln Gln Asn Ser
145 150 155 160
Arg Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly
165 170 175
Phe Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro
180 185 190
Lys Ala Gln Gly Gly Val Asn Leu Glu Asp Ser Gln Leu Val Pro Asp
195 200 205
Ser Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr
210 215 220
Asn Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg
225 230 235 240
Thr Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu
245 250 255
Gly Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn
260 265 270
Gln Gly Lys Ile Lys Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln
275 280 285
Glu Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly
290 295 300
Asn Pro Arg Leu Asn Asn His Val Lys Asn Asn Ser Ala Gly Ala Leu
305 310 315 320
Leu Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu
325 330 335
<210> 13
<211> 335
<212> PRT
<213> Искусственная
<220>
<223> аминокислоты WP_023370787 с 92 по 426
<400> 13
Met Lys Ser Asp Asn Gly Asp Glu Asn Ala Val Ser Arg Asp Asp Ser
1 5 10 15
Glu Val Thr Thr Asn Glu Gln Asn Gln Ile Glu Val Thr Glu Thr Lys
20 25 30
Glu Ile Leu Asn Gln Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg
35 40 45
Gln Ile Ile Trp Ala His Gly Ile Thr Pro Pro Ala Met Glu Gln Ser
50 55 60
Gly Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala
65 70 75 80
Pro Phe Glu Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn
85 90 95
Ala Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn
100 105 110
Met Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr
115 120 125
Leu Lys Glu Lys Lys Gly Thr Val Asn Val Glu Glu Asn Tyr Ala Ile
130 135 140
Thr Asp Ile Arg Arg Tyr Ile Asn Ser Phe Gln Asn Gln Gln Asn Ser
145 150 155 160
Arg Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly
165 170 175
Phe Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro
180 185 190
Lys Ser Gln Gly Gly Val Asn Leu Glu Asp Ser His Leu Val Pro Asp
195 200 205
Ser Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr
210 215 220
Asn Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg
225 230 235 240
Thr Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu
245 250 255
Gly Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn
260 265 270
Gln Gly Lys Ile Lys Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln
275 280 285
Glu Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly
290 295 300
Asn Pro Arg Leu Asn Asn His Met Lys Asn Asn Ser Ala Gly Ala Leu
305 310 315 320
Leu Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu
325 330 335
<210> 14
<211> 335
<212> PRT
<213> Искусственная
<220>
<223> аминокислоты WP_044678723 с 92 по 426
<400> 14
Met Asn Ser Asp Asn Gly Asp Glu Asn Val Val Ser Arg Asp Asp Ser
1 5 10 15
Glu Val Thr Thr Asn Glu Gln Asn Gln Ile Glu Val Thr Glu Thr Lys
20 25 30
Glu Ile Leu Asn Tyr Thr Ser Tyr Gln Thr Glu Ser Gly Glu Gln Arg
35 40 45
Gln Ile Val Trp Ala Tyr Gly Ile Thr Pro Pro Val Met Glu Gln Lys
50 55 60
Gly Gly Phe Val Lys Glu Lys Tyr Gly Asp Tyr Leu Asn Tyr Thr Ala
65 70 75 80
Pro Phe Glu Ala Gly Lys Gly Tyr Tyr Asp Thr Asn Lys Ser Leu Asn
85 90 95
Ala Ser Phe Ile Asp Leu Asn Leu Cys Phe Ala Ala Val Ser Ser Asn
100 105 110
Met Val His Trp Trp Leu Glu Gln Asn Ser Ser Tyr Val Glu Arg Tyr
115 120 125
Leu Lys Glu Lys Lys Gly Thr Val Asn Val Glu Glu Asn Tyr Ala Ile
130 135 140
Thr Asp Leu Arg Arg Tyr Ile Asn Ser Phe Gln Asn Gln Gln Asn Ser
145 150 155 160
Arg Val Phe Asp Met Phe Lys Thr Tyr Tyr Gly Tyr Arg Thr Asn Gly
165 170 175
Phe Val Ser Asp Ala Leu Val Asp Leu Phe Ile Asn Gly Tyr Lys Pro
180 185 190
Lys Ala Gln Gly Gly Val Asn Leu Glu Asp Ser Gln Leu Val Pro Asp
195 200 205
Ser Arg Gly Gly Phe Phe Tyr Asp Val Phe Lys Glu Lys Lys Leu Thr
210 215 220
Asn Arg Ile Phe Ser Gly Ser Tyr Glu Arg Phe Gly Glu Asp Val Arg
225 230 235 240
Thr Val Leu Glu Ser Lys Gly Leu Leu Gly Leu Thr Tyr Arg Thr Leu
245 250 255
Gly Tyr Ala Thr His Ile Val Thr Val Trp Gly Ala Glu Tyr Asp Asn
260 265 270
Gln Gly Lys Ile Lys Ala Val Tyr Ile Thr Asp Ser Asp Asp Gln Gln
275 280 285
Glu Gln Ile Gly Leu Lys Arg Met Gly Ile Thr Arg Asp Ala Ser Gly
290 295 300
Asn Pro Arg Leu Asn Asn His Met Lys Asn Asn Ser Ala Gly Ala Leu
305 310 315 320
Leu Asp Tyr Val His Thr Ile Arg Leu Gly Gln Asp Leu Trp Glu
325 330 335
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| T-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, РАСПОЗНАЮЩИЕ МУТАЦИЮ R175H ИЛИ Y220C В P53 | 2020 |
|
RU2830061C2 |
| АНТАГОНИСТЫ NGF ДЛЯ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ | 2020 |
|
RU2829812C2 |
| КОМПОЗИЦИИ И СПОСОБЫ РЕДАКТИРОВАНИЯ ГЕНОВ | 2019 |
|
RU2804665C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| Мутантная нитрилгидратаза, нуклеиновая кислота, кодирующая указанную мутантную нитрилгидратазу, вектор экспрессии и трансформант, содержащие указанную нуклеиновую кислоту, способ получения указанной мутантной нитрилгидратазы и способ получения амидного соединения | 2017 |
|
RU2736086C1 |
| Слитые молекулы, происходящие от Cholix-токсина, для пероральной доставки биологически активных нагрузок | 2015 |
|
RU2723178C2 |
| ВАРИАНТЫ IgG-FC ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2814952C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| ВАРИАНТ Fc И ЕГО ПОЛУЧЕНИЕ | 2021 |
|
RU2828852C1 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
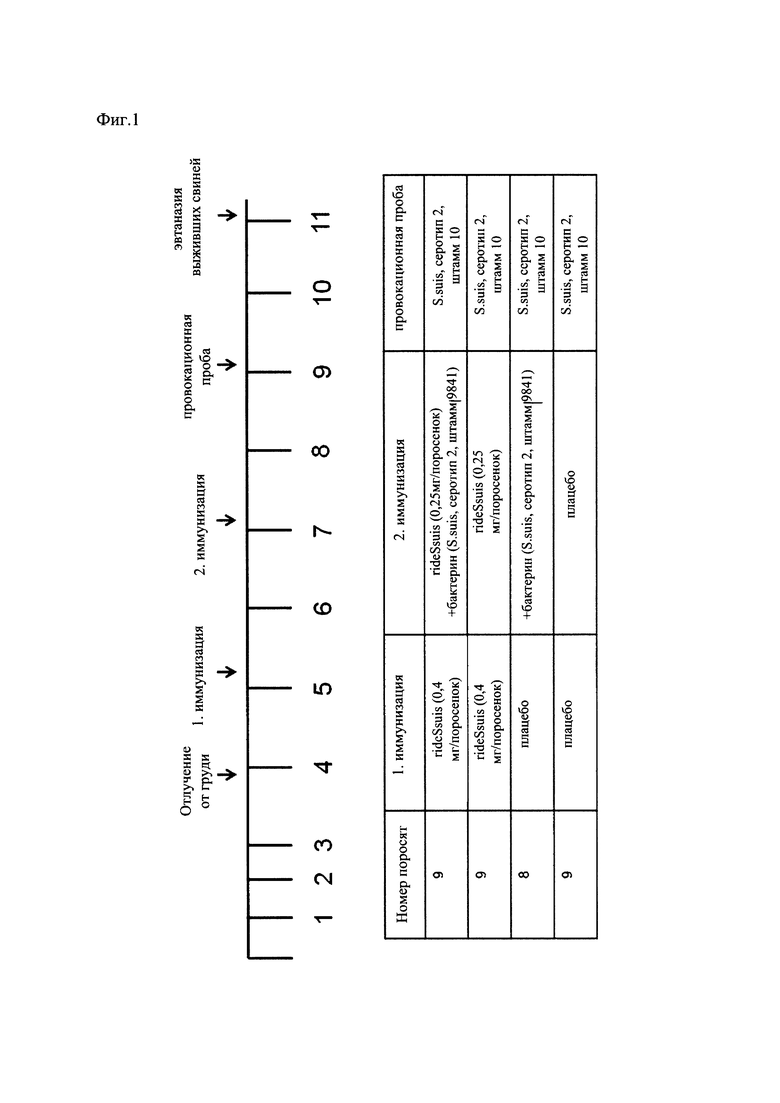
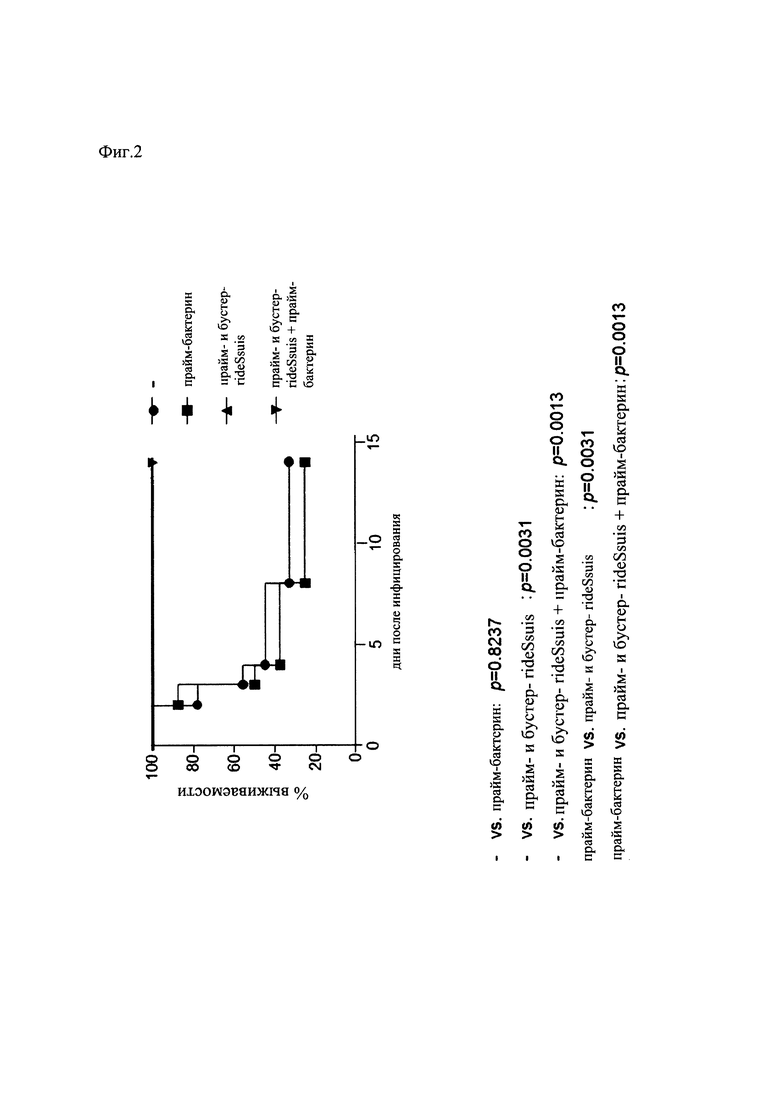
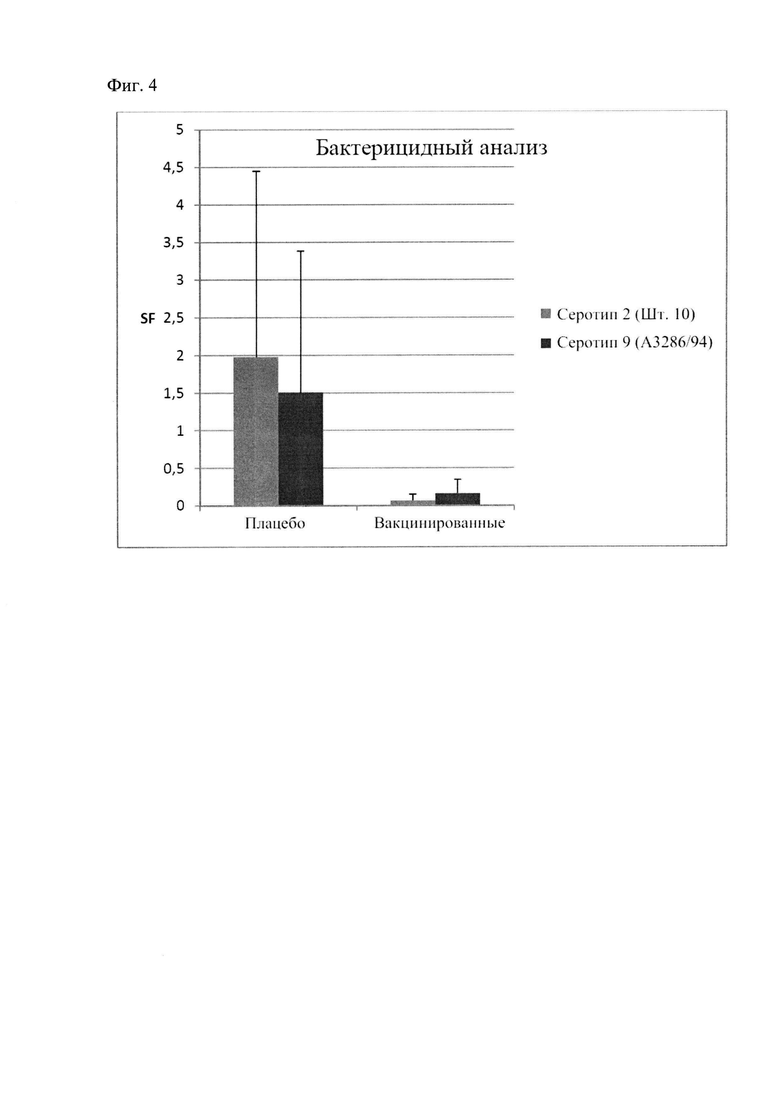

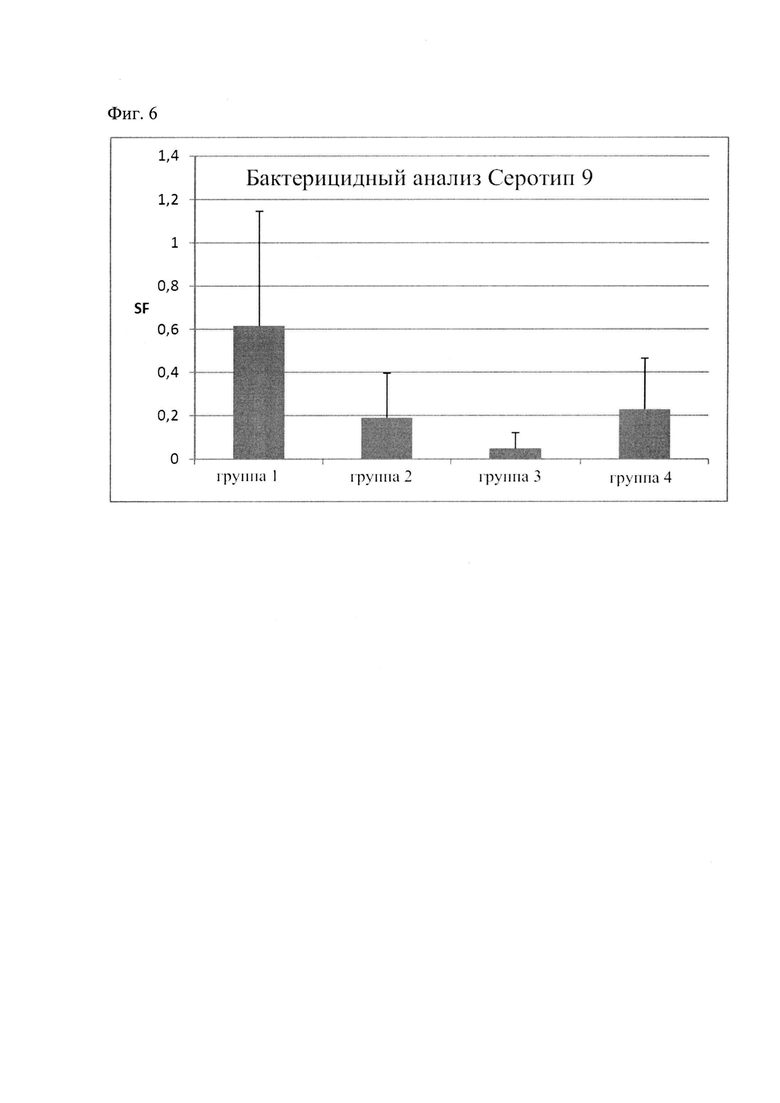
Изобретение относится к биотехнологии. К рассмотрению представлена вакцинная композиция, используемая для выполнения профилактического, метафилактического или терапевтического лечения инфекции, вызываемой Streptococcus suis, у свиней и у людей, содержащая эффективное количество по меньшей мере одного белка или по меньшей мере одного вектора, и по меньшей мере фармацевтический носитель, разбавитель или адъювант. Эта вакцинная композиция применяется в профилактическом, метафилактическом или терапевтическом лечении инфекций, вызванных Streptococcus suis, у свиней или людей. 4 н. и 12 з.п. ф-лы, 6 ил., 1 табл., 2 пр.
1. Вакцинная композиция, используемая для выполнения профилактического, метафилактического или терапевтического лечения инфекции, вызываемой Streptococcus suis, у свиней и у людей, содержащая эффективное количество по меньшей мере одного белка или по меньшей мере одного вектора, выбранного из группы:
(a) белок, имеющий аминокислотную последовательность SEQ ID NO: 1, или его иммуногенный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 5 или аминокислотную последовательность, которая по меньшей мере на 95% гомологична ей и обладает иммуногенной активностью,
(b) белок, имеющий аминокислотную последовательность SEQ ID NO: 2, 6 или 7, или его иммуногенный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 5 или аминокислотную последовательность, которая по меньшей мере на 95% гомологична ей и обладает иммуногенной активностью,
(c) вектор с полинуклеотидом, вставленным в него, кодирующим белок, имеющий аминокислотную последовательность SEQ ID NO: 1, или его иммуногенный фрагмент, как определено в а),
(d) вектор с полинуклеотидом, вставленным в него, кодирующим белок, имеющий аминокислотную последовательность SEQ ID NO: 2, 6 или 7, или его иммуногенный фрагмент, как определено в b),
и
по меньшей мере фармацевтический носитель, разбавитель или адъювант.
2. Вакцинная композиция по п. 1, характеризующаяся тем, что белок, имеющий аминокислотную последовательность SEQ ID NO: 1, содержит фрагмент, обладающий активностью IgM-протеазы.
3. Вакцинная композиция по п. 1, характеризующаяся тем, что белок, имеющий аминокислотную последовательность SEQ ID NO: 2, 6 или 7, содержит аминокислотную последовательность, в которой отсутствуют аминокислоты от позиции 1 до 34 аминокислотной последовательности SEQ ID NO: 1, или фрагмент, обладающий активностью IgM-протеазы.
4. Вакцинная композиция по одному или нескольким из пп. 1-3, отличающаяся тем, что белок или вектор является единственным активным или иммуногенным ингредиентом.
5. Вакцинная композиция по меньшей мере по одному из пп. 1-4, характеризующаяся тем, что фрагмент эффективного количества указанного белка согласно (а) или (b) является частью слитого белка по меньшей мере с одним другим белком.
6. Вакцинная композиция по меньшей мере по одному из пп. 1-5, содержащая общее количество белка примерно 0,05-2 мг.
7. Вакцинная композиция по п. 1, характеризующаяся тем, что указанный полинуклеотид содержит последовательность SEQ ID NO: 3 или комплементарную ей последовательность;
фрагмент его последовательности, кодирующий аминокислотную последовательность SEQ ID NO: 5 или аминокислотную последовательность, которая по меньшей мере на 95% гомологична ей и обладает иммуногенной активностью, предпочтительно, обладающий активностью IgM-протеазы.
8. Вакцинная композиция по п. 1, характеризующаяся тем, что указанный полинуклеотид содержит последовательность SEQ ID NO: 4, 8 или 9 или комплементарную ей последовательность;
фрагмент его последовательности или кодирующий аминокислотную последовательность SEQ ID NO: 5 или аминокислотную последовательность, которая по меньшей мере на 95% гомологична ей и обладает иммуногенной активностью, предпочтительно, обладающий активностью IgM-протеазы.
9. Вакцинная композиция по меньшей мере по одному из пп. 7 или 8, характеризующаяся тем, что указанный полинуклеотид представляет собой ДНК или РНК, отличающийся тем, что указанный полинуклеотид предпочтительно встроен в вектор, и полинуклеотид функционально связан с областью контроля экспрессией вектора, и вектор представляет собой вектор экспрессии, который является плазмидой или вирусным вектором.
10. Вакцинная композиция по любому из предыдущих пунктов, характеризующаяся тем, что она представлена в физиологически вводимой форме и пригодна для внутримышечной, внутривенной, подкожной или дермальной инъекции или мукозального введения.
11. Вакцинная композиция по любому из пп. 1-10 для применения в профилактическом, метафилактическом или терапевтическом лечении инфекции, вызванной Streptococcus suis, у свиней или людей.
12. Вакцинная композиция по п. 11 для применения в профилактическом, метафилактическом или терапевтическом лечении инфекции, вызванной Streptococcus suis, у свиней или людей, отличающаяся тем, что лечение предусматривает по меньшей мере одну, предпочтительно две иммунизации.
13. Вакцинная композиция по п. 12 для применения в профилактическом, метафилактическом или терапевтическом лечении инфекции, вызванной Streptococcus suis, у свиней или людей, отличающаяся тем, что общая доза белка, имеющего аминокислотную последовательность SEQ ID NO: 1, 2, 6 или 7, вводимая одной свинье/одному человеку, составляет 0,05-2,0 мг.
14. Аналог белка последовательности SEQ ID NO: 1 для профилактического, метафилактического или терапевтического лечения инфекции, вызванной Streptococcus suis, и обладающий иммуногенной активностью, где указанный аналог содержит аминокислотную последовательность SEQ ID NO: 5 или состоит из аминокислотной последовательности SEQ ID NO: 5, или содержит аминокислотную последовательность, которая по меньшей мере на 95% гомологична аминокислотной последовательности SEQ ID NO: 5 и обладает иммуногенной активностью, или состоит из аминокислотной последовательности, которая по меньшей мере на 95% гомологична аминокислотной последовательности SEQ ID NO: 5.
15. Белок для профилактического, метафилактического или терапевтического лечения инфекции, вызванной Streptococcus suis, обладающий иммуногенной активностью, содержащий аминокислотную последовательность SEQ ID NO: 6 или 7, или состоящий из аминокислотной последовательности SEQ ID NO: 6 или 7, или содержащий аминокислотную последовательность, которая по меньшей мере на 60%, предпочтительно на 70% и наиболее предпочтительно на 85% гомологична аминокислотной последовательности SEQ ID NO: 6 или 7, или состоящий из аминокислотной последовательности, которая по меньшей мере на 60%, предпочтительно на 70% и наиболее предпочтительно на 85% гомологична аминокислотной последовательности SEQ ID NO: 6 или 7, или его иммуногенный фрагмент, содержащий аминокислотную последовательность SEQ ID NO: 5 или аминокислотную последовательность, которая по меньшей мере на 95% гомологична ей.
16. Применение аналога белка по п. 14 или белка по п. 15 для получения антитела, которое распознает белок, имеющий аминокислотную последовательность SEQ ID NO: 1, 2, 6 или 7.
| BAUMS C.G | |||
| et al., Surface-associated and secreted factors of Streptococcus suis in epidemiology, pathogenesis and vaccine development, animal health research rev., 2009, v.10, p.p.65-83, реферат, стр | |||
| Разборное приспособление для накатки на рельсы сошедших с них колес подвижного состава | 1920 |
|
SU65A1 |
| SEELE J | |||
| et al., Identification of a novel host-specific IgM protease in Streptococcus suis, J | |||
| Bacteriology, 2012, v.195, p.p.930-940, | |||
Авторы
Даты
2020-10-28—Публикация
2015-05-29—Подача