Область изобретения
Настоящее изобретение относится к области слитых белков и, более конкретно, к слитому белку человеческого фактора свертывания IX (FIX), к способу его получения и к его применению, особенно к его применению в лечении различных заболеваний, связанных со свертыванием.
Предшествующий уровень техники
Гемофилия В является Х-связанным рецессивным наследственным заболеванием, в основе патогенеза которого лежит мутация в гене фактора свертывания IX человека (FIX), расположенном на X хромосоме, что приводит к значительному снижению содержания или активности фактора свертывания в плазме, и таким образом препятствует внутренней системе свертывания и вызывает расстройства свертывания. По оценкам, общее количество больных гемофилией В в Китае примерно 20000 человек, что составляет 15%-20% гемофилии. Гемофилия В поражает одного из 30000 мужчин, в то время как редко встречается среди женщин. Наиболее распространенным лечением в настоящее время является FIX-заместительная терапия, включающая использование обогащенного FIX из плазмы или FIX, экспрессируемого рекомбинантной клеткой.
Человеческий фактор свертывания IX (FIX) представляет собой зимоген сериновой протеазы, содержащий 461 аминокислоту, и является важным компонентом каскада внутреннего свертывания. Он, главным образом, синтезируется в печени и секретируется в плазму. FIX состоит из ряда отдельных функциональных доменов, включающих сигнальный пептид, пропептидную область, домен Gla, два домена эпидермального фактора роста (EGF), активирующий пептид и каталитический домен триптазы (домен сериновой протеазы). Зимоген затем процессируется в активную форму путем связывания его легких и тяжелых цепей посредством дисульфидных связей, с образованием гетеродимера. FIX играет важную роль во внутренней системе свертывания. Только активированный FIXa активирует FX вместе с активированным FVIII (FVIIIa), фосфолипидами и Са2+ в FXa с инициированием общей системы свертывания и осуществлением эффекта свертывания. В настоящем исследовании зафиксировано более 100 мутаций в FIX. Некоторые из них не вызывают никаких клинических симптомов, но другие приводят к значительным нарушениям свертываемости крови. При отсутствии лечения гемофилия В может вызвать неконтролируемые кровотечения в мышцах, суставах и полостях тела после травмы и может привести к смерти. В прошлом это заболевание лечили, главным образом, введением FIX, полученным из плазмы человека. Однако, с одной стороны, это лечение влечет за собой риск заражения гемоконтактными вирусами, включая вирус иммунодефицита человека (ВИЧ) и вирус гепатита С (HCV). С другой стороны. нативный FIX имеет короткий период полувыведения у людей, составляющий примерно от 18 до 24 часов. Пациентам необходимы многократные переливания крови или продуктов, получаемых из крови, что не только дорого, но также может вызвать тяжелую реакцию на переливание крови. Следовое количество активированных факторов в комплексе зимогена тромбина может также активировать каскад свертывания, вызывая тромбоз и эмболию. В настоящее время период полувыведения имеющегося в продаже рекомбинантного FIX является относительно коротким, только 18 часов, так что пациентам с гемофилией необходимо получать частое внутривенное введение при вынужденном лечении по необходимости после кровотечения или для профилактики до кровотечения. Пациентам с гемофилией В рекомендуют получать инъекцию FIX в дозе 40~100 МЕ/кг 2 или 3 раза в неделю для предотвращения кровотечений. Следовательно, разработка длительно действующих рекомбинантных препаратов FIX с увеличенным периодом полувыведения в плазме может не только сократить число введений, но также снизить физическую и душевную нагрузку на пациентов и значительно улучшить соблюдение больным режима и схемы лечения.
В предшествующем уровне техники для увеличения функционального периода полувыведения FIX in vivo, увеличивающие период полувыведения группировки, такие как PEG (полиэтиленгликоль), человеческий сывороточный альбумин (HSA), XTEN, СТР (карбокси-концевой пептид) или Fc IgG соединяли с FIX. Например, N9-GP (пегилированный) от Novo Nordisk, FIX-FP (слитый с HSA белок) от CSL Behring и длительно действующий FIX-CTP (слитый с СТР белок) от OPKO/Prolor включены в клинические испытания. Клинические испытания N9-GP показали, что период полувыведения FIX увеличивался в 5 раз (со средним периодом полувыведения 110 ч) после в общей сложности 3 введений. Однако в этом испытании наблюдали одного пациента с тяжелой реакцией гиперчувствительности и трех пациентов с развитием не ингибирующих антител. Иммуногенность N9-GP остается предметом дальнейшего изучения (Collins PW et al, Blood, 2014, 124(26): 3880-3886). Клинические испытания FIX-FP показали, что период полувыведения FIX-FP составлял 89-96 часов, и у пациентов не было специфического иммунного ответа. Исследования FIX-CTP в модели гемофилии В у мышей показали, что период полувыведения FIX увеличивался в 4 раза, а частота и продолжительность кровотечений были уменьшены, но активность FIX также была снижена (Hart Get. al., Haemophilia, 2012, 18: 32). Первый слитый белок FIX с Fc (FIX-Fc) был одобрен FDA США в марте 2014 года под торговым названием Alprolix (Biogen Idec) и в настоящее время является единственным одобренным рекомбинантным препаратом FIX длительного действия. Alprolix представляет собой слитый белок, образованный путем ковалентного связывания одной молекулы FIX с N-концом двухцепочечного Fc-фрагмента человеческого IgG1, и рекомбинантно экспрессируется клетками HEK-293Н. Клинические исследования показали, что Alprolix имеет период полувыведения 57-86 часов и частота его введения может составлять один раз в 7 или 10 суток при использовании его для профилактики. В настоящее время, Alprolix был одобрен для регистрации в нескольких странах мира. Однако слияние Fc неизбежно вызывает снижение специфической активности. Определение активности in vitro подтвердило, что молярная специфическая активность FIX-Fc (МЕ/нмоль) составляла только 50% активности FIX (BeneFIX®) (Peters RTet. al., Blood, 2010, 115(10): 2057-64).
СТР представляет собой короткий пептид, происходящий из карбоксильного конца р-субъединицы хорионического гонадотропина человека (hCG). Было показано, что он обладает способностью продлевать периоды полувыведения in vivo. В китайских патентах CN 103539860 A и CN 103539861 A раскрыт слитый белок, в котором СТР использован в качестве линкера для связывания β-субъединицы и α-субъединицы FSH (фолликулостимулирующего гормона) для увеличения периода полувыведения слитого белка in vivo. В патенте WO 2013121416 раскрыт фактор свертывания IX пролонгированного действия, содержащий по меньшей мере один СТР, связанный с карбоксильным концом фактора свертывания IX. FIX-(CTP)3, который содержит три последовательно расположенных СТР, обладает улучшенными фармакокинетическими свойствами по сравнению с rhFIX, FIX-CTP или FIX-CTP-CTP; FIX-CTP обладает in vitro активностью и периодом полувыведения, сопоставимыми с rhFIX; и период полувыведения FIX-CTP-CTP в 3 раза больше, чем период полувыведения rhFIX, а период полувыведения FIX-(CTP)3 в 2,5-4 раза больше, чем период полувыведения rhFIX у крыс и у FIX-дефицитных мышей. Однако FIX-(CTP)3 показывает пониженную активность свертывания в анализе свертывания in vivo. Кроме того, по сравнению с BeneFIX, активность свертывания FIX-(CTP)3 задерживается на 1 час, что может быть связано с тем, что добавление трех последовательно расположенных СТР может маскировать сайт активации FIX, тем самым задерживая каскад.
Авторы настоящего изобретения не используют СТР в качестве линкера или в качестве группировки, увеличивающей период полувыведения, как предложено в предшествующем уровне техники, а вместо этого соединяют его с гибким пептидным линкером (например (GGGGS)n) с образованием гибридного линкерного пептида, состоящего из гибкого пептидного линкера, содержащего GS, и жесткого СТР-пептидного линкера, содержащего множество гликозильных боковых цепей. Гибридный пептидный линкер расположен между FIX и группировкой, увеличивающей период полувыведения (например Fc-фрагментом иммуноглобулина, который не содержит СТР, как предложено в предшествующем уровне техники) с образованием нового слитого белка FIX, не только с пролонгированным периодом полувыведения, но также со сниженной иммуногенностью, улучшенной биологической доступностью, значительным снижением эффекта стерического препятствия для слитого лиганда Fc на FIX, и поддержанием хорошей биологической активности и функциональности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложен высокогликозилированный, гомодимерный слитый с Fc белок фактора свертывания IX (FIX). Слитый белок имеет пролонгированный активный период полувыведения in vivo, низкую иммуногенность и биологическую активность, аналогичную рекомбинантному FIX. Кроме того, в настоящем изобретении предложен способ эффективной и стабильной экспрессии слитого белка. Слитый белок, экспрессируемый этим способом, обладает преимуществом высокого выхода, хорошей стабильности при получении и хранении, и биологической активностью, аналогичной рекомбинантному FIX на рынке.
В одном аспекте настоящего изобретения предложен высокогликозилированный слитый белок FIX, который содержит, по порядку от N-конца к С-концу, человеческий фактор свертывания IX (hFIX), гибкий пептидный линкер (линкер, L), по меньшей мере один жесткий фрагмент, содержащий карбоксильный концевой пептид β-субъединицы хорионического гонадотропина человека (СТР) и группировку, увеличивающую период полувыведения (например Fc-фрагмент иммуноглобулина, альбумин, трансферрин или PEG, предпочтительно вариант человеческого Fc IgG (обозначенный как vFc)). В некоторых предпочтительных воплощениях настоящего изобретения слитый белок обозначен как hFIX-L-CTP-vFc.
hFIX представляет hFIX дикого типа или его мутант. Кроме того, hFIX дикого типа имеет аминокислотную последовательность, показанную в SEQ ID NO: 1. Предпочтительно, мутант hFIX по меньшей мере на 85% гомологичен аминокислотной последовательности, показанной в SEQ ID NO: 1. Более предпочтительно, мутант hFIX по меньшей мере на 90% гомологичен аминокислотной последовательности, показанной в SEQ ID NO: 1. Наиболее предпочтительно, мутант hFIX по меньшей мере на 95% гомологичен аминокислотной последовательности, показанной в SEQ ID NO: 1.
Гибкий пептидный линкер предпочтительно является неиммуногенным и может создавать достаточное пространственное расстояние между hFIX и Fc, чтобы минимизировать их стерическое влияние друг на друга. Предпочтительно используют гибкий пептидный линкер, состоящий из двух или более аминокислотных остатков, выбранных из группы, состоящей из Gly (G), Ser (S), Ala (А) и Thr (T). Предпочтительно гибкий пептидный линкер содержит остатки G и S. Длина линкерного пептида играет очень важную роль в активности слитого белка. Для целей настоящего изобретения пептидный линкер может предпочтительно содержать общую формулу аминокислотной последовательности, образованную путем комбинирования повторяющихся единиц (GS)a(GGS)b(GGGS)c(GGGGS)d, где каждый а, b, с и d представляет собой целое число, которое равно или больше, чем 0, и a+b+c+d≥1.
В частности, в некоторых воплощениях настоящего изобретения пептидный линкер может предпочтительно содержать следующие последовательности:
(1) L1: GSGGGSGGGGSGGGGS;
(2) L2: GSGGGGSGGGGSGGGGSGGGGSGGGGS;
(3) L3: GGGGSGGGGSGGGGSGGGGS;
(4) L4: GSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGS;
(5) L5: GGGSGGGSGGGSGGGSGGGS;
Жесткий фрагмент СТР выбран из полноразмерной последовательности, состоящей из 113-145 аминокислот карбоксильного конца β-субъединицы хорионического гонадотропина человека или его фрагмента. В частности, жесткий фрагмент СТР содержит аминокислотную последовательность, показанную в SEQ ID NO: 2, или ее усеченную последовательность. Во-первых, пептид СТР, который встречается естественным образом в организме человека, является неиммуногенным. Во-вторых, по сравнению со случайной спиралью гибкого пептидного линкера, жесткий СТР-пептидный линкер, содержащий множество сайтов гликозилирования, может образовывать стабильную стерическую конформацию, которая облегчает независимое складывание FIX и Fc-сегмента в правильные трехмерные конформации без влияния на индивидуальные биологические активности каждого. Кроме того, гликозильные боковые цепи СТР обладают защитным эффектом, который может снизить чувствительность пептидного линкера к протеазам.
Предпочтительно, жесткий фрагмент СТР содержит по меньшей мере 2 сайта гликозилирования. Например, в предпочтительном воплощении настоящего изобретения жесткий фрагмент СТР содержит 2 сайта гликозилирования. Для иллюстрации, жесткий фрагмент СТР содержит N-концевые 10 аминокислот из SEQ ID NO: 2, то есть SSSS*KAPPPS*; в качестве альтернативы жесткий фрагмент СТР содержит С-концевые 14 аминокислот из SEQ ID NO: 2, то есть S*RLPGPS*DTPILPQ. В качестве другого примера, в другом воплощении жесткий фрагмент СТР содержит 3 сайта гликозилирования. Например, жесткий фрагмент СТР содержит N-концевые 16 аминокислот из SEQ ID NO: 2, то есть SSSS*KAPPPS*LPSPS*R. В качестве другого примера, в других воплощениях жесткий фрагмент СТР содержит 4 сайта гликозилирования. Например, жесткий фрагмент СТР содержит 28, 29, 30, 31, 32 или 33 аминокислоты, начиная с положения 113, 114, 115, 116, 117 или 118, и заканчивая положением 145 β-субъединицы хорионического гонадотропина человека. В частности, жесткий фрагмент СТР содержит N-концевые 28 аминокислот из SEQ ID NO: 2, то есть SSSS*KAPPPS*LPSPS*RLPGPS*DTPILPQ. Здесь * обозначает сайт гликозилирования. Каждая возможность представляет собой отдельное воплощение настоящего изобретения.
В других воплощениях жесткий фрагмент СТР, предложенный в настоящем изобретении, по меньшей мере на 70% гомологичен аминокислотной последовательности нативного СТР. В других воплощениях жесткий фрагмент СТР, предложенный в настоящем изобретении, по меньшей мере на 80% гомологичен аминокислотной последовательности нативного СТР. В других воплощениях жесткий фрагмент СТР, предложенный в настоящем изобретении, по меньшей мере на 90% гомологичен аминокислотной последовательности нативного СТР. В других воплощениях жесткий фрагмент СТР, предложенный в настоящем изобретении, по меньшей мере на 95% гомологичен аминокислотной последовательности нативного СТР.
В конкретных воплощениях настоящего изобретения жесткий фрагмент СТР предпочтительно может содержать следующие последовательности:
(1) СТР1: PRFQDSSSSKAPPPSLPSPSRLPGPSDTPILPQ;
(2) СТР2: SSSSKAPPPSLPSPSRLPGPSDTPILPQ;
(3) СТР3: SSSSKAPPPS;
(4) СТР4: SRLPGPSDTPILPQ.
В некоторых воплощениях настоящего изобретения слитый белок содержит один жесткий фрагмент СТР, как описано выше. В других воплощениях настоящего изобретения слитый белок может содержать 2 или более, предпочтительно 2, 3, 4 или 5 жестких фрагментов СТР, как описано выше. Например, в одном воплощении настоящего изобретения слитый белок содержит 2 жестких фрагмента СТР3: SSSSKAPPPSSSSSKAPPPS (СТР3-СТР3 или экспрессируется, как (СТР3)2).
Группировку, увеличивающую период полувыведения, предпочтительно выбирают из группы, состоящей из Fc-фрагментов иммуноглобулина IgG, IgM и IgA, более предпочтительно из группы, состоящей из Fc-фрагментов человеческих IgG1, IgG2, IgG3 и IgG4 и их вариантов. Кроме того, вариант Fc иммуноглобулина IgG человека содержит по меньшей мере одну аминокислотную модификацию в Fc человеческого иммуноглобулина IgG дикого типа и имеет сниженную эффекторную функцию (ADCC и/или CDC эффекты) и/или повышенную аффинность связывания с неонатальным Fc-рецептором (FcRn). Кроме того, человеческий вариант Fc иммуноглобулина IgG может быть выбран из группы, состоящей из:
(1) vFcγ1: шарнирный участок, области СН2 и СР3 человеческого IgG1 с мутациями Leu234Val, Leu235Ala и Pro331Ser (аминокислотная последовательность, показанная в SEQ ID NO: 3);
(2) vFcγ2-1: шарнирный участок, области СН2 и СР3 человеческого IgG2 с мутацией Pro331Ser (аминокислотная последовательность, показанная в SEQ ID NO: 4);
(3) vFcγ2-2: шарнирный участок, области СН2 и СР3 человеческого IgG2 с мутациями Thr250Gln и Met428Leu (аминокислотная последовательность, показанная в SEQ ID NO: 5);
(4) vFcγ2-3: шарнирный участок, области СН2 и СР3 человеческого IgG2 с мутациями Pro331Ser, Thr250Gln и Met428Leu (аминокислотная последовательность, показанная в SEQ ID NO: 6).
(5) vFcγ4: шарнирный участок, области СН2 и СН3 человеческого IgG4 с мутациями Ser228Pro и Leu235Ala (аминокислотная последовательность, показанная в SEQ ID NO: 7).
Вариант Fc (vFc) в слитом белке по настоящему изобретению содержит шарнирный участок, области СН2 и СН3 человеческого IgG, например человеческого IgG1, IgG2 и IgG4. Область СН2 содержит аминокислотные мутации в положениях 228, 234, 235 и 331 (d соответствии с системой нумерации ЕС). Считается, что эти аминокислотные мутации снижают эффекторные функции Fc. Fc человеческого IgG2 не связывается с FcγR, но демонстрирует крайне слабую активность в отношении системы комплемента. Вариант Fcγ2 с мутацией Pro331Ser должен иметь меньшую активность в отношении комплемента, чем нативный Fcγ2, при этом также не связываясь с FcγR. Fc IgG4 имеет недостаточную активацию каскада комплемента, и его аффинность связывания с FcγR на порядок ниже, чем у IgG1. Вариант Fcγ4 с мутацией Leu235Ala должен проявлять минимальные эффекторные функции по сравнению с нативным Fcγ4. Вариант Fcγl с мутациями Leu234Val, Leu235Ala и Pro331Ser также должен проявлять пониженные эффекторные функции, чем нативный Fcγ1. Эти варианты Fc являются более подходящими для получения слитых FIX-белков, чем нативные человеческие варианты Fc IgG. Аминокислотные мутации в положениях 250 и 428, в соответствии с системой нумерации ЕС, повышают аффинность связывания области Fc с неонатальным рецептором FcRn, тем самым дополнительно пролонгируя период полувыведения (Paul R et al., J Biol Chem, 2004, 279: 6213-6216). Указанные выше два типа функциональных вариантов комбинируют или добавляют друг к другу с образованием новых вариантов комбинаций с целью уменьшения эффекторных функций при пролонгации периода полувыведения. Варианты Fc по настоящему изобретению содержат мутации в вышеуказанных сайтах, без ограничения ими. Замены могут быть введены в другие сайтах, так чтобы Fc имели сниженные эффекторные функции и/или улучшенную аффинность связывания с FcRn. Такие замены не должны приводить к снижению функции/активности или нежелательным конформационным изменениям вариантов Fc. Известные сайты мутаций можно найти в Shields RL et al., J Biol Chem, 2001, 276(9): 6591-604.
В предпочтительном воплощении настоящего изобретения слитый белок имеет аминокислотную последовательность, показанную в SEQ ID NO: 8.
Согласно другому аспекту настоящего изобретения предложена ДНК, кодирующая вышеописанный слитый белок.
В предпочтительном воплощении настоящего изобретения слитый белок имеет последовательность ДНК, показанную в SEQ ID NO: 9.
Согласно другому аспекту настоящего изобретения предложен вектор, который содержит вышеописанную ДНК.
Согласно другому аспекту настоящего изобретения предложена клетка-хозяин, которая содержит или которая трансфицирована вышеописанным вектором.
В конкретном воплощении настоящего изобретения клетка-хозяин представляет собой клеточную линию DXB-11, производную от СНО (клети яичника китайского хомячка).
Согласно пятому аспекту настоящего изобретения предложена фармацевтическая композиция. Фармацевтическая композиция содержит фармацевтически приемлемый носитель, эксципиент или разбавитель и эффективное количество вышеописанного слитого белка.
Согласно другому аспекту настоящего изобретения предложен способ получения или продуцирования слитого белка из клеточной линии млекопитающего, такой как производная от СНО клеточная линия, включающий стадии:
(а) введение ДНК, кодирующей вышеописанный слитый белок, в клетку СНО с получением производной от СНО клеточной линии;
(б) скрининг высокопродуктивной клеточной линии со стадии (а), которая экспрессирует более 1 мг/106 клеток за 24 часа в свою ростовую среду;
(в) выращивание клеточной линии, полученной на стадии (б), для экспрессии слитого белка;
(г) сбор ферментативного бульона, полученного на стадии (с), и выделение и очистка слитого белка.
Кроме того, клеточная линия, производная от клеточной линии СНО на стадии (а), представляет собой DXB-11.
Кроме того, культивирование клеток на стадии (в) может быть выполнено с использованием метода периодической подпитки культуры, перфузионной культуры или культуры с подпиткой.
Кроме того, на стадии (г) слитый белок очищают методом четырехстадийной хроматографии, то есть аффинной хроматографии, гидрофобной хроматографии, анионообменной хроматографии и хроматографии на молекулярных ситах. В настоящем изобретении, кроме того, предлагаются предпочтительные условия очистки в Примере 5.
В предпочтительном воплощении настоящего изобретения слитый белок, полученный посредством вышеупомянутого способа, имеет активность >200 МЕ/мг.
В соответствии в шестым аспектом настоящего изобретения, предложено применение слитого белка в изготовлении лекарственного средства для предупреждения или лечения геморрагического заболевания или события, вызванного недостатком или функциональным дефектом FIX, включающим его применение в изготовлении лекарственного средства для предупреждения или лечения геморрагического заболевания у пациента с наследственным или приобретенным дефицитом FIX, и его применение в изготовлении лекарственного средства для предупреждения или лечения спонтанного или хирургического кровотечения у пациента с гемофилией В.
Авторы настоящего изобретения обнаружили, что слитые белки и способы их получения, описанные и/или раскрытые в настоящем изобретении, имеют следующие преимущества:
1. Вариант Fc человеческого IgG, который используют в слитом белке в качестве лиганда слияния, является нелитическим и уменьшает эффекторную функцию, инициируемую связыванием с FcγRs и Clq.
2. Можно ожидать, что, по сравнению с рекомбинантными FIX, слитый белок по настоящему изобретению имеет пониженную иммуногенность, что приводит к пониженному продуцированию нейтрализующих антител у пациентов.
3. Слитый белок по настоящему изобретению обладает хорошей стабильностью во время ферментации, очистки и хранения.
4. Слитый белок по настоящему изобретению содержит жесткий пептид СТР, содержащий множество гликозильных боковых цепей. Жесткий пептид СТР может образовывать стабильную стерическую конформацию по сравнению со случайной спиралью гибких линкеров, таких как (GGGGS)n. Этот "блокирующий" эффект заставляет FIX и Fc-фрагмент независимо складываться в правильные трехмерные конформации, не оказывая влияния на биологические активности каждого из них. Высокосиалилированные, отрицательно заряженные СТР, которые содержат гликозильные группы, могут противостоять клиренсу почками, тем самым увеличивая период полувыведения слитого белка. Кроме того, защитный эффект гликозильных боковых цепей СТР снижает чувствительность пептидного линкера к протеазам, так что слитый белок менее подвержен деградации в области связывания.
5. Способ получения слитого белка по настоящему изобретению имеет высокий выход. После культивирования в 300 мл встряхиваемой колбе в течение 14 суток суммарный выход может достигать по меньшей мере 200 мг/л. Способ может быть масштабирован для крупномасштабного промышленного производства.
6. По сравнению с мономерно-димерным гетерозиготным (Мономерным) слитым белком FIX, сконструированным Biogen, экспрессия и очистка слитого белка по настоящему изобретению является более эффективной и удобной, значительно снижая себестоимость получения. Biogen сконструировал бинарный экспрессионный вектор rFIXFc и Fc, где молекула Fc помечена меткой Flag, (публикация европейского патента ЕР 1624891 В1). Ожидалось, что ферментативный бульон экспрессированного слитого белка содержит три формы продуктов, гомодимерный (Димерный) слитый белок (FIX-Fc:FIX-Fc), мономер-димерный гетерозиготный (Мономерный) слитый белок (FIX-Fc:FLAG-Fc) и димер (FLAG-Fc:FLAG-Fc). С одной стороны, во время экспрессии слитого белка, поскольку клетки-хозяева должны одновременно экспрессировать одноцепочечные молекулы и FIX-Fc, и Fc, а затем эти молекулы должны связываться друг с другом с образованием трех описанных выше продуктов, то эффективность конечной экспрессии целевого продукта значительно снижена. Кроме того, во время очистки побочные примеси в двух других формах должны быть удалены, что делает очистку более сложной, а эффективность производства более низкой и значительно увеличивает стоимость производства. По сравнению с Мономерным слитым белком rFIXFc, полученным Biogen, способ получения по настоящему изобретению имеет определенные технические и ценовые преимущества. Экспрессия и очистка по настоящему изобретению проще и более эффективна, а стоимость производства ниже.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Карбоксильный концевой пептид hCG-β (СТР)
СТР представляет собой короткий пептид карбоксильного конца β-субъединицы хорионического гонадотропина (hCG) человека. Четыре вида репродуктивных полипептидных гормонов, фолликулостимулирующий гормон (FSH), лютеинизирующий гормон (LH), тиреостимулирующий гормон (TSH) и человеческий хорионический гонадотропин (hCG), содержат одинаковую α-субъединицу и свои соответствующие специфические β-субъединицы. По сравнению с другими тремя гормонами, hCG имеет существенно пролонгированный период полувыведения in vivo, что главным образом связано с конкретным карбокси-концевым пептидом (СТР) на β-субъединице hCG (Fares FA et al., Proc Natl Acad Sci USA, 1992, 89(10): 4304-4308). Нативный СТР содержит 37 аминокислотных остатков, включающих четыре О-сайта гликозилирования, и остатки сиаловой кислоты на конце. Высокосиалилированные, отрицательно заряженные СТР могут противостоять клиренсу почками, тем самым увеличивая период полувыведения белка in vivo. (Fares F Aet. al., Proc Natl Acad Sci USA, 1992, 89(10): 4304-4308). Авторы настоящего изобретения креативно соединили по меньшей мере один пептид СТР с гибким пептидным линкером, имеющим подходящую длину, с образованием нового пептидного линкера для связывания FIX с группировкой, увеличивающей период полувыведения, например Fc-фрагментом иммуноглобулина.
Авторы настоящего изобретения обнаружили, что добавление пептида СТР между FIX и Fc-вариантом эквивалентно добавлению жесткого пептидного линкера. С одной стороны, добавление пептида СТР гарантирует, что слитый по N-концу FIX не влияет на сайт связывания в варианте Fc в отношении FcRn, и таким образом не оказывает влияния на период полувыведения. Кроме того, сайт связывания белка А в Fc важен для стадий очистки. Добавление СТР гарантирует, что слитый по N-концу FIX не будет "покрывать" его сайт связывания белка А. Таким образом, слитый белок может быть очищен с помощью более дешевого и более подходящего наполнителя, что снижает стоимость очистки. С другой стороны, добавление жесткого фрагмента СТР предотвращает негативное вмешательство Fc-фрагмента размером примерно 25 кДа в правильное складывание слитого по N-концу FIX, таким образом, это не приводит к потере или снижению биологической активности/функции FIX. Жесткий пептид СТР, содержащий множество гликозильных боковых цепей, может образовывать стабильную стерическую конформацию в отличие от случайной спирали гибких линкеров, таких как (GGGGS)n. Этот "блокирующий" эффект заставляет FIX и Fc-фрагмент независимо складываться в правильные трехмерные конформации, не влияния на биологические активности каждого из них. Кроме того, защитный эффект гликозильных боковых цепей СТР снижает чувствительность пептидного линкера к протеазам, так что слитый белок является менее чувствительным к деградации в области связывания.
Варианты IgG Fc
Нелитические варианты Fc
Элемент Fc происходит из константной области (Fc-фрагмент) иммуноглобулина IgG и играет важную роль в уничтожении патогенов в иммунной защите. Fc-опосредованные эффекторные функции IgG реализует посредством двух следующих механизмов. (1) После связывания с Fc-рецепторами (FcγR) на клеточной поверхности патогены разрушаются посредством фагоцитоза, или лизиса, или клеток-киллеров через путь антителозависимой клеточной цитотоксичности (ADCC). (2) Альтернативно, после связывания с C1q первого компонента комплемента С1, инициируется путь комплемент-зависимой цитотоксичности (CDC) и, таким образом, патоген лизируется. Среди четырех субтипов человеческого иммуноглобулина IgG, IgG1 и IgG3 способны связываться с FcγRs эффективно, a IgG4 имеет более низкую аффинность связывания с FcγR. Связывание IgG2 с FcγR является слишком низким для измерения, поэтому человеческий IgG2 имеет незначительные ADCC-эффекты. Кроме того, человеческие IgG1 и IgG3 могут также эффективно связываться с C1q с активацией каскада комплемента. Человеческий IgG2 слабо связывается с C1q, и IgG4 не связывается с C1q (Jefferis R et al., Immunol Rev, 1998, 163: 59-76), таким образом CDC-эффект человеческого IgG2 также является слабым. Очевидно, что ни один из нативных субтипов IgG не является подходящим для конструирования слитых белков FIX-Fc. Для того чтобы получить нелитические варианты Fc без эффекторных функций, наиболее эффективным способом является мутация комплемент- и рецептор-связывающих областей сегмента Fc и подбор аффинности связывания Fc с соответствующими рецепторами для уменьшения или устранения ADCC и CDC эффектов, но сохранения только биологической активности функционального белка и продолжительного периода полувыведения in vivo Fc-сегмента без формирования цитотоксичности. Большее количество мутантных сайтов, содержащихся в нелитических вариантах Fc можно найти в Shields RL et al., J Biol Chem, 2001, 276(9): 6591-604 или китайском патенте CN 2012800311372.
Варианты Fc с высокой аффинностью к неонатальному рецептору FcRn
Период полувыведения IgG в плазме зависит от его связывания с FcRn. Как правило, IgG связывается с FcRn при рН 6,0 и диссоциирует от FcRn при рН 7,4 (рН плазмы). Посредством исследования сайтов связывания при этих двух значениях, сайты IgG, которые связываются с FcRn, модифицируют для увеличения аффинности связывания при рН 6,0. Доказано, что мутации некоторых остатков в домене человеческого Fcγ, которые важны для связывания с FcRn, могут увеличивать период полувыведения из сыворотки. Сообщалось, что мутации в остатках Т250, М252, S254, Т256, V308, Е380, М428 и N434 увеличивают или уменьшают аффинность связывания с FcRn (Roopenian et al., Nat.Review Immunology7:715-725, 2007). Варианты трастузумаба (Герцептин, Genentech), раскрытые в корейском патенте KR 10-1027427, показали повышенную аффинность связывания с FcRn, и эти варианты содержат одну или более аминокислотных модификаций, выбранных из группы, состоящей из 257С, 257М, 257L, 257N, 257Y, 279Q, 279Y, 308F и 308Y. Варианты бевацизумаба (Авастин, Genentech), представленные в корейском патенте KR 2010-0099179, показали пролонгированный период полувыведения in vivo и эти варианты содержат аминокислотные модификации N434S, M252Y/M428L, M252Y/N434S и M428L/N434S. Кроме того, Hinton et al. также обнаружили, что два варианта T250Q и M428L увеличили аффинность связывания с FcRn в 3 и 7 раз соответственно. Когда два сайта были мутированы одновременно, аффинность связывания возросла в 28 раз. У макаки-резус варианты M428L или T250Q/M428L показывают 2-кратное увеличение периода полувыведения в плазме (Paul R. Hinton et al., J Immunol, 2006, 176: 346-356). Большее количество сайтов мутаций, содержащихся в вариантах Fc с увеличенной аффинностью связывания с FcRn, можно найти в китайском патенте CN 201280066663.2. Кроме того, исследования показывают, что мутации T250Q/M428L в Fc-участках пяти гуманизированных антител улучшают взаимодействие между Fc-доменом и FcRn. Кроме того, в последующих фармакокинетических тестах in vivo, по сравнению с антителами дикого типа, мутантные по Fc антитела показывают улучшенные фармакокинетические параметры, такие как увеличенная экспозиция in vivo, пониженный клиренс и увеличенная подкожная биодоступность, при введении посредством подкожной инъекции (Datta-Mannan A et al., MAbs. Taylor & Francis, 2012, 4(2): 267-273).
Слитый белок и способ его получения
Ген слитого белка по настоящему изобретению искусственно синтезируют после оптимизации кодона. На основе нуклеотидной последовательности по настоящему изобретению специалист в данной области техники может легко получить нуклеиновую кислоту по настоящему изобретению различными известными методами, такими как, но без ограничения ими, искусственный синтез или традиционное субклонирование. Конкретные методы смотрите в J. Sambrook, Molecular Cloning: A Laboratory Manual. В качестве одного воплощения настоящего изобретения нуклеиновокислотную последовательность по настоящему изобретению можно сконструировать посредством сегментного синтеза нуклеотидных последовательностей с последующим субклонированием.
В настоящем изобретении также предложен экспрессионный вектор для клеток млекопитающих, содержащий последовательность, кодирующую слитый белок по настоящему изобретению и последовательность, регулирующую экспрессию, функционально связанную с ней. Термины "функциональная связь" или "функционально связанные" означают состояние, в котором некоторые участки линейной ДНК-последовательности способны регулировать или контролировать активность других участков той же линейной ДНК-последовательности. Например, промотор функционально связан с кодирующей последовательностью, если промотор контролирует транскрипцию этой последовательности.
Экспрессионный вектор для клеток млекопитающих может быть коммерчески доступным вектором, таким как, но без ограничения ими, pcDNA3, pIRES, pDR, pBK, pSPORT и тому подобные, которые можно использовать в системе экспрессии на основе эукариотических клеток. Специалист в данной области техники может выбрать подходящий экспрессионный вектор на основе клетки-хозяина.
Кодирующая последовательность слитого белка по настоящему изобретению может быть введена в подходящие сайты рестрикции специалистом в данной области путем расщепления рестрикционным ферментом и сплайсинга в соответствии с обычным методом на основе карты рестрикционных ферментов известного пустого экспрессионного вектора с получением рекомбинантного экспрессионного вектора по настоящему изобретению.
В настоящем изобретении также предлагается клетка-хозяин, экспрессирующая слитый белок по настоящему изобретению, содержащая кодирующую последовательность слитого белка по настоящему изобретению. Клетка-хозяин предпочтительно представляет собой эукариотическую клетку, такую как, но без ограничения ими, клетки СНО, клетки COS, клетки 293, клетки RSF и подобные. В предпочтительном воплощении настоящего изобретения клетка представляет собой клетку СНО, которая может лучше экспрессировать слитый белок по настоящему изобретению с получением слитого белка, имеющего хорошую активность и хорошую стабильность.
В настоящем изобретении также предлагается способ получения слитого белка по настоящему изобретению путем использования технологии рекомбинантной ДНК, включающей стадии:
1) предоставления нуклеиновокислотной последовательности, кодирующей слитый белок;
2) встраивания нуклеиновокислотной последовательности (1) в подходящий экспрессионный вектор с получением рекомбинантного экспрессионного вектора;
3) введения рекомбинантного экспрессионного вектора (2) в подходящую клетку-хозяина;
4) выращивание трансфицированной клетки-хозяина в условиях, подходящих для экспрессии;
5) сбор супернатанта и очистка продукта в виде слитого белка.
Кодирующая последовательность может быть введена в клетку-хозяина различными способами, известными в данной области, такими как, но без ограничения ими, осаждение фосфатом кальция, липофекция, электропорация, микро инъекция, вирусная инфекция и метод с использованием ионов щелочных металлов.
Культивирование и экспрессию в клетках-хозяевах смотрите в Olander RM et. al., Dev Biol Stand, 1996, 86:338. Клетки и дебрис в суспензии могут быть удалены центрифугированием, а супернатант собирают.
Слитый белок, полученный, как описано выше, может быть очищен до по существу однородных свойств, например, быть представлен одной полоской или конкретными полосками при SDS-PAGE (в полиакриламидном геле с додецилсульфатом натрия) электрофорезе. Супернатант сначала концентрируют. Концентрированный супернатант может быть дополнительно очищен с помощью гель-хроматографии или ионообменной хроматографии, такой как анионообменная хроматография или катионообменная хроматография. Гелевая матрица может быть матрицей, обычно используемой для очистки белков, такой как агароза, декстран, полиамид и т.п. Группа Q или SP является предпочтительной ионообменной группой. Наконец, очищенный продукт может быть дополнительно высококачественно очищен такими методами, как адсорбционная хроматография на гидроксиапатите, металл-хелатная хроматография, хроматография с гидрофобным взаимодействием и высокоэффективная жидкостная хроматография на обращенной фазе и т.п. Все вышеупомянутые стадии очистки можно использовать в разных комбинациях, чтобы в конечном счете получить белки с по существу однородной чистотой. Экспрессированный слитый белок может быть очищен с использованием аффинной хроматографической колонки, содержащей антитело, рецептор или лиганд, специфичный к слитому белку. В зависимости от природы используемой аффинной колонки, слитый полипептид, связанный с аффинной колонкой, можно элюировать, используя обычные способы, такие как высокосолевой буфер, изменение рН и т.п.
Фармацевтическая композиция
В настоящем изобретении также предлагается фармацевтическая композиция, содержащая эффективную дозу слитого белка по настоящему изобретению и фармацевтически приемлемый носитель. В общем случае, эффективное количество слитого белка по настоящему изобретению может быть приготовлено в виде препарата в нетоксичном, инертном и фармацевтически приемлемом водном носителе, где рН обычно составляет примерно 5-8, предпочтительно примерно 6-8. Термин "эффективное количество" или "эффективная доза" относится к количеству, которое оказывает функциональные или активные воздействия на людей и/или животных и приемлемо для людей и/или животных. "Фармацевтически приемлемыми" ингредиентами являются такие, которые пригодны для использования у человека и/или млекопитающих без чрезмерных побочных эффектов (например токсичности, раздражения и аллергий), т.е. вещества с разумным соотношением польза/риск. Термин "фармацевтически приемлемый носитель" относится к носителю для доставки терапевтического агента и носитель включает различные эксципиенты и разбавители.
Фармацевтически приемлемые носители включают, без ограничения ими, физиологический раствор, буфер, глюкозу, воду, глицерин, этанол и их комбинации. В общем случае, фармацевтическая композиция должна быть совместима со способом введения. Фармацевтические композиции по настоящему изобретению могут быть приготовлены в форме инъекций, например получены обычными способами с использованием физиологического раствора или водных растворов, содержащих глюкозу и другие вспомогательные вещества. Фармацевтические композиции, описанные выше, предпочтительно изготавливают в асептических условиях. Количество вводимого активного ингредиента представляет собой терапевтически эффективное количество. Фармацевтическая композиция по настоящему изобретению также может быть приготовлена в форме с пролонгированным высвобождением.
Эффективное количество слитого белка по настоящему изобретению может варьироваться в зависимости от пути введения и тяжести заболевания, подлежащего лечению. Предпочтительное эффективное количество может быть определено специалистом в данной области на основании различных факторов, например, в клинических испытаниях. Факторы включают, без ограничения ими, фармакокинетические параметры слитого белка, такие как биодоступность, метаболизм, период полувыведения и т.д., тяжесть заболевания, подлежащего лечению у пациента, массу пациента, иммунный статус пациента, путь введения и т.д.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показана нуклеотидная последовательность и предсказаннная аминокислотная последовательность слитого белка, встроенная в фрагмент Spe I-EcoR I экспрессионного вектора pF9-5B. Зрелый слитый белок содержит hFIX, а гибкий пептидный линкер (подчеркнутый  ), жесткий фрагмент СТР (подчеркнутый
), жесткий фрагмент СТР (подчеркнутый  ) и вариант vFcγ2-3.
) и вариант vFcγ2-3.
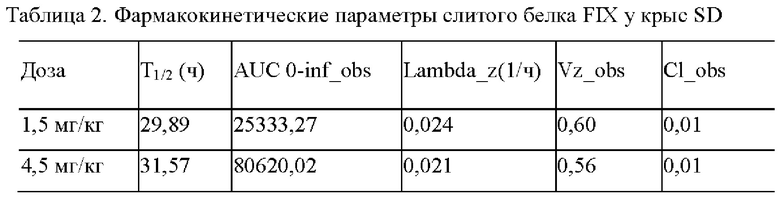
На Фиг. 2 показана хроматограмма SEC-HPLC очищенного слитого белка F9-5B.
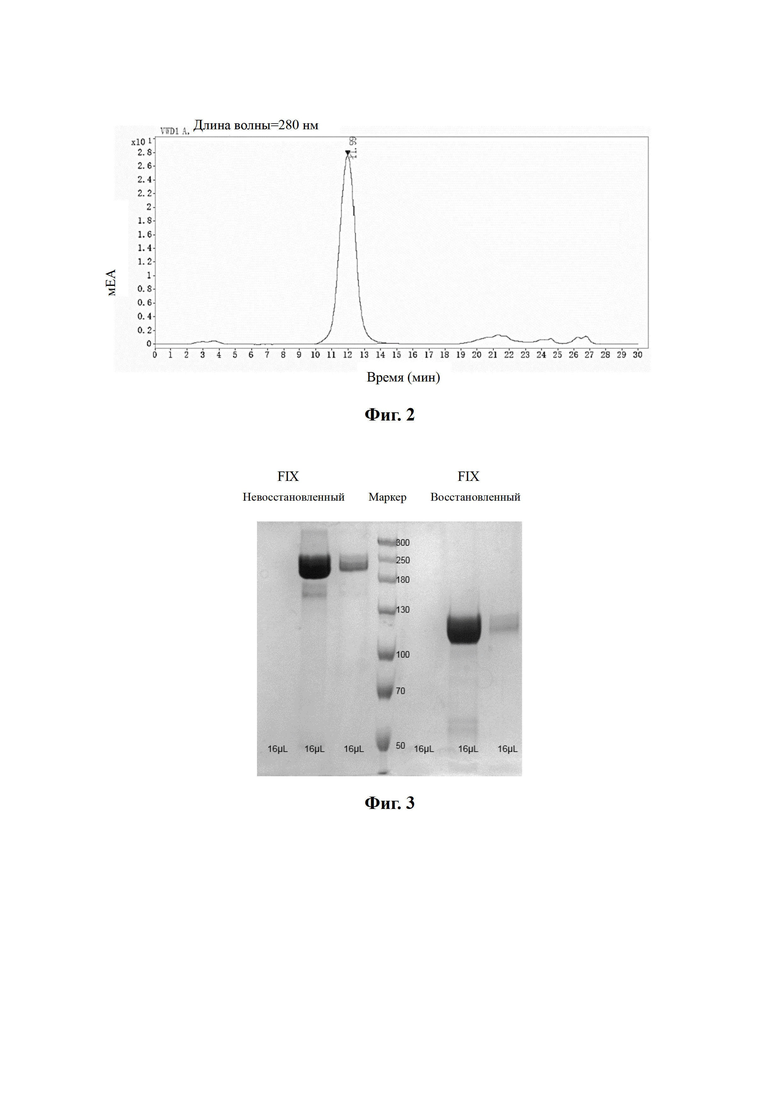
На Фиг. 3 показана электрофореграмма SDS-PAGE очищенного слитого белка F9-5В.
Примеры
Пример 1. Конструирование экспрессирующей плазмиды, кодирующей слитый белок FIX
Последовательность гена, кодирующая полноразмерный FIX, и последовательности генов, кодирующие гибкие пептидные линкеры разной длины, жесткие пептиды СТР с разной длиной и разные варианты IgG Fc были искусственно оптимизированными, СНО клеточно-смещенными кодонами и могли быть получены химическим синтезом. Сайт рестрикции SpeI или EcoRI соответственно, присутствовал на каждом из 5'-конца и 3'-конца синтезированного фрагмента для облегчения встраивания целевого фрагмента в конкретный сайт экспрессионного вектора. Верифицированный слитый ген переваривали с помощью SpeI и EcoRI и затем встраивали между соответствующими сайтами рестрикциями в экспрессионную плазмиду PXY1A1, которую получали путем модификации PCDNA3.1 в качестве матрицы, с получения экспрессионной плазмиды pF9-5 слитого гена. Плазмида PXY1A1 содержит, без ограничения ими, следующие важные экспрессионные элементы: 1) ранний промотор цитомегаловируса человека и энхансер, необходимый для высокой экзогенной экспрессии в клетках млекопитающих; 2) двойной селективный маркер, который может придавать устойчивость к канамицину бактериям и устойчивость к G418 клеткам млекопитающих; 3) экспрессионная кассета гена дигидрофолатредуктазы (DHFR) мыши, которая позволяет совместно амплифицировать слитый ген и ген DHFR в присутствии метотрексата (МТХ) в дефицитных по гену DHFR клетках-хозяевах (см. патент US 4399216). Затем экспрессионную плазмиду слитого белка трансфицировали в линию клеток-хозяев млекопитающего. Дефицитные по ферменту DHFR клетки СНО являются предпочтительной линией клеток-хозяев для стабильной экспрессии на высоких уровнях (см. патент US 4818679).
Как показано в Таблице 1, в настоящем изобретении конструировали ряд слитых белков hFIX, содержащих гибкие пептидные линкеры разной длины, жесткие фрагменты СТР разного состава и несколько разных подтипов IgG Fc (vFc) вариантов. Нуклеотидная последовательность F9-5B и ее транслированная аминокислотная последовательность показаны на Фиг. 1.
Пример 2. Временная экспрессия различных слитых белков и определение их активности in vitro
Ряд экспрессионных плазмид, полученный в Примере 1, соответственно трансфицировали в 3×107 клеток СНО-K1 в 30 мл встряхиваемой колбе с использованием DNAFect LT Reagent™ (ATGCell), и трансфицированные клетки культивировали в бессывороточной ростовой среде, содержащей 1000 нг/мл витамина K1 в течение 5 суток. Измеряли концентрацию слитого белка в супернатанте, и определяли его активность методом, описанным в Примере 6. Результаты ELISA показали, что уровни временной экспрессии этих плазмид были в этих условиях похожими, но коагуляционные активности этих слитых белков демонстрировали большие различия. Активности F9-5B, F9-5C, F9-5D и F9-5E составляли 119,5%, 104,2%, 83,9% и 94,7% соответственно от активности F9-5A, молярная специфическая активность которого была определена как 100%. Активность F9-5F составляла только примерно 30% активности F9-5B, вероятно потому, что жесткий фрагмент СТР, который был помещен на N-конец Fc, образовывал фиксированную пространственную конформацию для эффективного разделения разных функциональных участков слитого белка, что облегчало для FIX и части Fc независимый фолдинг в правильную трехмерную конформацию, тем самым сохраняя высокую активность. Слитый белок в супернатанте клеточной культуры F9-5G главным образом существует в форме неактивных полимеров. Это может быть связано с тем, что пептидный линкер большой длины не может повысить активность слитого белка, а вместо этого приведет к неправильному фолдингу белка и его существованию в виде неактивных полимеров.
Пример 3. Экспрессия слитых белков в трансфицированных клеточных линиях
Вышеописанные экспрессионные плазмиды слитых белков трансфицировали в линии клеток-хозяев млекопитающих для экспрессии слитых белков FIX. DHFR-дефицитные клетки СНО являются предпочтительной линией клеток-хозяев для стабильной экспрессии на высоком уровне (см. патент US 4818679). Предпочтительным методом трансфекции была электропорация, но могут быть использованы другие способы, включающие кальций фосфатное соосаждение, липосомную трансфекцию и микроинъекцию. При электропорации использовали Gene Pulser Electroporator (Bio-Rad Laboratories) при напряжении 300 В и емкости 1050 мкФд, и 50 мкг PvuI-линеаризованной экспрессионной плазмиды добавляли к 3×107 клеток, помещенных в кювету. Электропорированные клетки переносили во встряхиваемую колбу, содержащую 30 мл ростовой среды. Через двое суток после трансфекции среду заменяли ростовой средой, содержащей 0,6 мг/мл G418. Клетки высевали в 96-луночные планшеты в определенной концентрации и культивировали в течение 12-15 суток до появления крупных дискретных клеточных клонов. Трансфектанты, устойчивые к выбранному лекарственному средству, скринировали посредством анализа ELISA (ферментный иммуносорбентный анализ) против человеческого IgG Fc. Количественное определение экспрессии слитого белка также может быть выполнено с использованием анализа ELISA против FIX. Лунки, продуцирующие высокие уровни слитого белка Fc, субклонировали посредством серийных разведений.
Для достижения более высоких уровней экспрессии слитого белка, предпочтительной является совместная амплификация с использованием гена DHFR, который можно ингибировать лекарственным средством МТХ. Трансфицированный ген слитого белка амплифицировали совместно с геном DHFR в ростовой среде, содержащей увеличивающиеся концентрации МТХ. Субклоны с положительной экспрессией DHFR подвергали серийному разведению, и трансфектанты, способные расти в среде, содержащей вплоть до 6 мкМ МТХ, подвергали скринингу посредством постепенного увеличения селекционного давления. У трансфектантов измеряли уровень секреции, и подвергали скринингу клеточные линии с высоким уровнем экзогенного белка. Клеточные линии со скоростью секреции более чем примерно 1, предпочтительно примерно 2 мг/106 [т.е. миллион] клеток/24 ч, адаптировали к суспензионной культуре с использованием бессывороточных ростовых сред. Кондиционированную среду затем использовали для очистки слитого белка.
Пример 4. Получение слитых белков
Во-первых, высокопродуктивные клеточные линии, полученные в Примере 3, подвергали адаптационному бессывороточному культивированию в чашке Петри и затем переносили во встряхиваемую колбу для адаптационного культивирования в суспензии. После того, как клетки адаптировались к условиям культивирования, их культивировали с периодической подпиткой в 300 мл встряхиваемой колбе или имитировали перфузионную культуру путем ежесуточной замены среды. Происходящую от СНО клеточную линию, экспрессирующую слитый белок F9-5B, полученный в Примере 3, культивировали с периодической подпиткой в 300 мл встряхиваемой колбе в течение 14 суток. Суммарный выход экспрессированного рекомбинантного слитого белка достигал 200 мг/л, а плотность жизнеспособных клеток достигала 18×106 клеток/мл. 1000 мл встряхиваемые колбы можно использовать для получения большего количества слитых белков. В другом способе культивирования вышеописанную происходящую от СНО клеточную линию культивировали в 100 мл встряхиваемой колбе с ежесуточной сменой среды. Экспрессированный рекомбинантный слитый белок достигал суммарного выхода примерно 30 мг/л в сутки. Плотность жизнеспособных клеток во встряхиваемой колбе достигала вплоть до 35×10б клеток/мл. Биологические активности рекомбинантных слитых белков, полученных указанными выше двумя способами, были эквивалентными.
Пример 5. Очистка и характеристика слитых белков
Аффинную хроматографию главным образом использовали в настоящем изобретении для очистки FIX-слитого белка F9-5B. Инструментом, используемым для очистки белка в этом примере, является AKTA Explorer 100 (GE Healthcare, USA). Все реагенты, используемые в этом примере, имели аналитическую степень чистоты и были приобретены в Sinopharm Chemical Reagent Co., Ltd.
Стадия 1: аффинная хроматография. Отбор проб, концентрирование и удаление части загрязнений производили с использованием Mabselect Sure, имеющегося у GE, или других имеющихся в продаже сред для аффинной хроматографии с использованием рекомбинантного белка А, таких как Mabselect, Mabselect Sure LX, имеющиеся у GE, антищелочной Protein A Diamond от Bestchrom, Toyopearl AF-rProteinA-650F, имеющийся у TOSOH, rProtein A Bead от Smart-Lifesciences, MabPurix, имеющийся у Sepax Technologies, KANEKA KanCapA, имеющийся у Pall, и Eshumono А, имеющийся у Merck. Прежде всего, колонку уравновешивали 3-5 объемами колонки уравновешивающего буфера (20 мМ РВ, 140 мМ NaCl, рН 6,8-7,4) при линейной скорости потока 50-100 см/ч; очищенный ферментативный бульон загружали при линейной скорости потока 50-100 см/ч; после загрузки колонку уравновешивали 3-5 объемами колонки уравновешивающего буфера (20 мМ РВ, 140 мМ NaCl, рН 6,8-7,4) при линейной скорости потока 50-100 см/ч для удаления несвязанных компонентов; колонку промывали 3-5 объемами колонки буфера для деконтаминации 1 (20 мМ лимонная кислота-цитрат, 0,5 М NaCl, рН 4,8-5,2) при линейной скорости потока 50-100 см/ч для удаления части загрязняющих веществ; колонку уравновешивали 3-5 объемами колонки буфера для деконтаминации 2 (20 мМ лимонная кислота-цитрат, рН 4,8-5,2) при линейной скорости потока 50-100 см/ч; затем целевой продукт элюировали элюирующим буфером (50 мМ NaAc-HAc, 1,0 М мочевина, рН 3,0-4,0) при линейной скорости потока не более 60 см/ч. Собирали продукты, соответствующие целевому пику, и нейтрализовали до рН от нейтрального до кислого (рН 4,8-5,2) с помощью 1М Tris, рН 9,0.
Стадия 2: анионообменная хроматография. Промежуточную очистку проводили с помощью Q Sepharase FF, имеющейся у GE, или с помощью других имеющихся в продаже сред для анионообменной хроматографии, таких как DEAE Sepharose FF, Q Sepharose HP, Capto Q, Capto DEAE, имеющихся у GE, Toyopearl GigaCap Q-650, имеющейся у TOSOH, DEAE Beads 6FF, имеющейся у Smart-Lifesciences, Generik MC-Q, имеющейся у Sepax Technologies, Fractogel EMD TMAE, имеющейся у Merck, и Q Ceramic HyperD F, имеющейся у Pall, для уменьшения количества НСР, остаточной ДНК и отделившегося белка А. Элюент, полученный на стадии 1, все еще содержал некоторую часть НСР, остаточной ДНК, эндотоксина и других загрязняющих веществ, то есть было необходимо удалить эти загрязнения. Сначала колонку уравновешивали 3-5 объемами колонки (CV) уравновешивающего буфера (40 мМ Na2PO4-лимонная кислота, 0,1 М NaCl, рН 4,8-5,2) при линейной скорости потока 50-100 см/ч; образец, захваченный посредством аффинной хроматографии, разбавляли однократно уравновешивающим буфером и затем загружали. Целевой белок проходи насквозь при этих условиях. Пропущенные образцы собирали, когда А280 достигала 100 мЕА. После загрузки колонку промывали уравновешивающим буфером (40 мМ Na2PO4-лимонная кислота, 0,1 М NaCl, рН 4,8-5,2) при линейной скорости потока 50-100 см/час, и пропущенные образцы собирали, когда А280 уменьшалась до 100 мЕА, в этот момент сбор останавливали; затем колонку промывали 3-5 объемами колонки регенерационного буфера (1 М NaCl, 1 М NaOH) при линейной скорости потока 50-100 см/ч для регенерации колонки. В собранных образцах определяли НСР, ДНК, белок А и выполняли SEC-HPLC (эксклюзионная ВЭЖХ).
Стадия 3, аффинная хроматография. Окончательную очистку выполняли с использованием Cellufine Sulfate, имеющегося у JNC, или других имеющихся в продаже сред для аффинной хроматографии, таких как Heparin FF и Heparin HP, имеющегося у GE, для удаления агрегатов и дополнительного удаления загрязнений, таких как НСР и ДНК. Сначала колонку промывали 3-5 объемами колонки уравновешивающего буфера (20 мМ РВ, 100 мМ NaCl, рН 7,0-7,4) при линейной скорости потока 50-100 см/ч; целевой белок, полученный после анионной хроматографии на стадии 2, разбавляли однократно уравновешивающим буфером для снижения концентрации органических веществ и затем загружали; после загрузки колонку промывали 3-5 объемами колонки уравновешивающего буфера (20 мМ РВ, 100 мМ NaCl, рН 7,0-7,4) при линейной скорости потока 50-100 см/ч; затем с колонки элюировали линейным градиентом концентраций солей, элюирующим буфером: 20 мМ РВ, 1 М NaCl, рН 7,0-7,4, элюирующим буфером 0-100%, 15 объемов колонки, линейная скорость потока не более 50 см/ч. Элюированные фракции собирали в несколько этапов, и в собранных образцах определяли содержание белка, выполняли SEC-HPLC, определяли активность и содержание НСР соответственно. Удельная активность белка была рассчитана, как равная примерно 200 МЕ/мг, по концентрации белка и активности белка.
Результаты хроматографии SEC-HPLC и электрофореза SDS-PAGE образца показаны на Фиг. 2 и 3 соответственно. Результаты SEC-HPLC показали, что чистота основного пика очищенного слитого белка была более 90%, и картина полос при электрофорезе SDS-PAGE соответствовала ожиданиям. Невосстанавливающий электрофорез содержал слитый белок, и после восстановления был получен четкая одноцепочечная полоса.
Пример 6. Определение активности слитого белка in vitro посредством анализа с хромогенным субстратом
Активность слитого белка FIX-Fc можно определить посредством анализа с хромогенным субстратом. В этом примере набор BIOPHEN фактора IX (HYPHEN BioMed, Ref. А221802) использовали для определения на основе следующего принципа. Фактор XIa, поставляемый в наборе, активирует фактор IX, имеющийся в тестируемом образце, в FIXa, который образует тромбиновый комплекс с тромбин-активируемым FVIILC, фосфолипидами (PLP) и ионами кальция (Са2+) в присутствии тромбина, PLP и Са2+. Ферментный комплекс активирует Фактор X в системе определения в активированную форму Ха. Активность активации тромбинового комплекса к Фактору X положительно коррелирует с содержанием Факторв IX в тестируемом образце. Активность активированного Фактора Ха можно измерить по специфическому расщеплению хромогенного субстрата (SXa-11), то есть путем измерения поглощения его продукта расщепления, pNA, при 405 нм. Поглощение pNA прямо пропорционально активности FIXa.
Удельная активность очищенного FIX слитого белка F9-5B достигла более 200 МЕ/мг, при определении настоящим методом.
Пример 7. Фармакокинетическое определение слитого белка
Самцов крыс SD (класс SPF, приобретенных у Bikai Experimental Animal Co., Ltd., Shanghai) предварительно кормили в течение 1 недели и затем случайным образом делили на 2 группы (по 2 крысы в каждой группе). Крысам внутривенно вводили однократную дозу 4,5 мг/кг (группа с высокой дозой) и 1,5 мг/кг (группа с низкой дозой) слитого белка F9-5B соответственно, и исследовали взаимосвязь между концентрацией лекарственного средства в крови и временем. 0,3 мл крови собирали из глазных орбит через 0, 1, 3, 6, 24, 48, 72, 96, 120, 144 и 168 часов после введения в контрольную группу и группу с введением. Кровь оставляли стоять при комнатной температуре в течение 30 мин и центрифугировали при 5000 об/мин в течение 10 мин с выделением сыворотки, которую затем хранили при -20°С. Количество слитого белка в сыворотке в каждый момент времени определяли с помощью анализа ELISA, специфичного к FIX. Основные фармакокинетические параметры рассчитывали для каждой группы с помощью программного обеспечения PKSOLVER. Результаты представлены в Таблице 2.
Согласно фармакокинетическим данным период полувыведения слитого белка F9-5В in vivo с высокой и низкой дозой составлял 31 и 30 часов соответственно, то есть был увеличен в 8 раз по сравнению со значением Т1/2 β rhFIX (китайский патент CN 104427994). Слитый белок F9-5B продемонстрировал улучшенный период полувыведения по сравнению с rhFIX, показывая, что добавление линкерного пептида и Fc-варианта на С-конец FIX не оказывает негативного влияния на активность слитого белка, а напротив, оказывает неожиданный эффект на активность и период полувыведения слитого белка FIX. Предполагается, что жесткий пептид СТР, который связывает FIX с вариантом Fc вместе с гибким пептидным линкером, может не только дополнительно пролонгировать период полувыведения FIX in vivo, но также увеличивает пространственное расстояние между молекулами в слитом белке посредством блокирующего эффекта, возникающего благодаря множеству гликозилированных боковых цепей, которые содействуют независимому фолдингу FIX и сегмента Fc в правильные трехмерные конформации без влияния на биологические активность каждого из них. Можно видеть, что F9-5B обладает превосходными характеристиками с точки зрения биодоступности и фармакокинетики по сравнению с rhFIX.
Хотя предпочтительные воплощения настоящего изобретения были проиллюстрированы и описаны, следует понимать, что специалисты в данной области техники могут внести различные изменения в свете приведенных здесь идей, не выходя за рамки объема изобретения.
Все документы, упомянутые в настоящем изобретении, включены в данное описание изобретения посредством ссылки, как если бы каждый из этих документов был отдельно описан для ссылки. Следует понимать, что специалисты в данной области техники могут вносить различные модификации и изменения при ознакомлении с вышеизложенными идеями настоящего изобретения, которые также входят в объем прилагаемой формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> AMPSOURCE BIOPHARMA INC
PHARMAB, INC.
<120> HUMAN COAGULATION FACTOR IX (FIX) FUSION PROTEIN,
PREPARATION METHOD THEREFOR, AND USE THEREOF
<130> 2017
<160> 9
<170> PatentIn version 3.5
<210> 1
<211> 415
<212> PRT
<213> Amino acid sequence of FIX
<400> 1
Tyr Asn Ser Gly Lys Leu Glu Glu Phe Val Gln Gly Asn Leu Glu Arg
1 5 10 15
Glu Cys Met Glu Glu Lys Cys Ser Phe Glu Glu Ala Arg Glu Val Phe
20 25 30
Glu Asn Thr Glu Arg Thr Thr Glu Phe Trp Lys Gln Tyr Val Asp Gly
35 40 45
Asp Gln Cys Glu Ser Asn Pro Cys Leu Asn Gly Gly Ser Cys Lys Asp
50 55 60
Asp Ile Asn Ser Tyr Glu Cys Trp Cys Pro Phe Gly Phe Glu Gly Lys
65 70 75 80
Asn Cys Glu Leu Asp Val Thr Cys Asn Ile Lys Asn Gly Arg Cys Glu
85 90 95
Gln Phe Cys Lys Asn Ser Ala Asp Asn Lys Val Val Cys Ser Cys Thr
100 105 110
Glu Gly Tyr Arg Leu Ala Glu Asn Gln Lys Ser Cys Glu Pro Ala Val
115 120 125
Pro Phe Pro Cys Gly Arg Val Ser Val Ser Gln Thr Ser Lys Leu Thr
130 135 140
Arg Ala Glu Thr Val Phe Pro Asp Val Asp Tyr Val Asn Ser Thr Glu
145 150 155 160
Ala Glu Thr Ile Leu Asp Asn Ile Thr Gln Ser Thr Gln Ser Phe Asn
165 170 175
Asp Phe Thr Arg Val Val Gly Gly Glu Asp Ala Lys Pro Gly Gln Phe
180 185 190
Pro Trp Gln Val Val Leu Asn Gly Lys Val Asp Ala Phe Cys Gly Gly
195 200 205
Ser Ile Val Asn Glu Lys Trp Ile Val Thr Ala Ala His Cys Val Glu
210 215 220
Thr Gly Val Lys Ile Thr Val Val Ala Gly Glu His Asn Ile Glu Glu
225 230 235 240
Thr Glu His Thr Glu Gln Lys Arg Asn Val Ile Arg Ile Ile Pro His
245 250 255
His Asn Tyr Asn Ala Ala Ile Asn Lys Tyr Asn His Asp Ile Ala Leu
260 265 270
Leu Glu Leu Asp Glu Pro Leu Val Leu Asn Ser Tyr Val Thr Pro Ile
275 280 285
Cys Ile Ala Asp Lys Glu Tyr Thr Asn Ile Phe Leu Lys Phe Gly Ser
290 295 300
Gly Tyr Val Ser Gly Trp Gly Arg Val Phe His Lys Gly Arg Ser Ala
305 310 315 320
Leu Val Leu Gln Tyr Leu Arg Val Pro Leu Val Asp Arg Ala Thr Cys
325 330 335
Leu Arg Ser Thr Lys Phe Thr Ile Tyr Asn Asn Met Phe Cys Ala Gly
340 345 350
Phe His Glu Gly Gly Arg Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro
355 360 365
His Val Thr Glu Val Glu Gly Thr Ser Phe Leu Thr Gly Ile Ile Ser
370 375 380
Trp Gly Glu Glu Cys Ala Met Lys Gly Lys Tyr Gly Ile Tyr Thr Lys
385 390 395 400
Val Ser Arg Tyr Val Asn Trp Ile Lys Glu Lys Thr Lys Leu Thr
405 410 415
<210> 2
<211> 33
<212> PRT
<213> Full-length amino acid sequence of hCG¦Â CTP
<400> 2
Pro Arg Phe Gln Asp Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu
1 5 10 15
Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro
20 25 30
Gln
<210> 3
<211> 227
<212> PRT
<213> Amino acid sequence of vFc¦Ã1
<400> 3
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Val Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Ser Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys
225
<210> 4
<211> 223
<212> PRT
<213> Amino acid sequence of vFc¦Ã2-1
<400> 4
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
1 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 5
<211> 223
<212> PRT
<213> Amino acid sequence of vFc¦Ã2-2
<400> 5
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
1 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
100 105 110
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 6
<211> 223
<212> PRT
<213> Amino acid sequence of vFc¦Ã2-3
<400> 6
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
1 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 7
<211> 229
<212> PRT
<213> Amino acid sequence of vFc¦Ã4
<400> 7
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 8
<211> 739
<212> PRT
<213> Amino acid sequence of FIX fusion protein
<400> 8
Met Gln Arg Val Asn Met Ile Met Ala Glu Ser Pro Gly Leu Ile Thr
1 5 10 15
Ile Cys Leu Leu Gly Tyr Leu Leu Ser Ala Glu Cys Thr Val Phe Leu
20 25 30
Asp His Glu Asn Ala Asn Lys Ile Leu Asn Arg Pro Lys Arg Tyr Asn
35 40 45
Ser Gly Lys Leu Glu Glu Phe Val Gln Gly Asn Leu Glu Arg Glu Cys
50 55 60
Met Glu Glu Lys Cys Ser Phe Glu Glu Ala Arg Glu Val Phe Glu Asn
65 70 75 80
Thr Glu Arg Thr Thr Glu Phe Trp Lys Gln Tyr Val Asp Gly Asp Gln
85 90 95
Cys Glu Ser Asn Pro Cys Leu Asn Gly Gly Ser Cys Lys Asp Asp Ile
100 105 110
Asn Ser Tyr Glu Cys Trp Cys Pro Phe Gly Phe Glu Gly Lys Asn Cys
115 120 125
Glu Leu Asp Val Thr Cys Asn Ile Lys Asn Gly Arg Cys Glu Gln Phe
130 135 140
Cys Lys Asn Ser Ala Asp Asn Lys Val Val Cys Ser Cys Thr Glu Gly
145 150 155 160
Tyr Arg Leu Ala Glu Asn Gln Lys Ser Cys Glu Pro Ala Val Pro Phe
165 170 175
Pro Cys Gly Arg Val Ser Val Ser Gln Thr Ser Lys Leu Thr Arg Ala
180 185 190
Glu Thr Val Phe Pro Asp Val Asp Tyr Val Asn Ser Thr Glu Ala Glu
195 200 205
Thr Ile Leu Asp Asn Ile Thr Gln Ser Thr Gln Ser Phe Asn Asp Phe
210 215 220
Thr Arg Val Val Gly Gly Glu Asp Ala Lys Pro Gly Gln Phe Pro Trp
225 230 235 240
Gln Val Val Leu Asn Gly Lys Val Asp Ala Phe Cys Gly Gly Ser Ile
245 250 255
Val Asn Glu Lys Trp Ile Val Thr Ala Ala His Cys Val Glu Thr Gly
260 265 270
Val Lys Ile Thr Val Val Ala Gly Glu His Asn Ile Glu Glu Thr Glu
275 280 285
His Thr Glu Gln Lys Arg Asn Val Ile Arg Ile Ile Pro His His Asn
290 295 300
Tyr Asn Ala Ala Ile Asn Lys Tyr Asn His Asp Ile Ala Leu Leu Glu
305 310 315 320
Leu Asp Glu Pro Leu Val Leu Asn Ser Tyr Val Thr Pro Ile Cys Ile
325 330 335
Ala Asp Lys Glu Tyr Thr Asn Ile Phe Leu Lys Phe Gly Ser Gly Tyr
340 345 350
Val Ser Gly Trp Gly Arg Val Phe His Lys Gly Arg Ser Ala Leu Val
355 360 365
Leu Gln Tyr Leu Arg Val Pro Leu Val Asp Arg Ala Thr Cys Leu Arg
370 375 380
Ser Thr Lys Phe Thr Ile Tyr Asn Asn Met Phe Cys Ala Gly Phe His
385 390 395 400
Glu Gly Gly Arg Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro His Val
405 410 415
Thr Glu Val Glu Gly Thr Ser Phe Leu Thr Gly Ile Ile Ser Trp Gly
420 425 430
Glu Glu Cys Ala Met Lys Gly Lys Tyr Gly Ile Tyr Thr Lys Val Ser
435 440 445
Arg Tyr Val Asn Trp Ile Lys Glu Lys Thr Lys Leu Thr Gly Ser Gly
450 455 460
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
465 470 475 480
Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Ser Ser Lys Ala Pro Pro
485 490 495
Pro Ser Leu Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro
500 505 510
Ile Leu Pro Gln Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala
515 520 525
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met
530 535 540
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
545 550 555 560
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val
565 570 575
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
580 585 590
Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly
595 600 605
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Ser Ile
610 615 620
Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val
625 630 635 640
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
645 650 655
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
660 665 670
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
675 680 685
Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
690 695 700
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu
705 710 715 720
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
725 730 735
Pro Gly Lys
<210> 9
<211> 2220
<212> DNA
<213> Nucleotide sequence of FIX fusion protein
<400> 9
atgcagcgcg tgaacatgat catggcagaa tcaccaggcc tcatcaccat ctgcctttta 60
ggatatctac tcagtgctga atgtacagtt tttcttgatc atgaaaacgc caacaaaatt 120
ctgaatcggc caaagaggta taattcaggt aaattggaag agtttgttca agggaatcta 180
gagagagaat gtatggaaga aaagtgtagt tttgaagaag cacgagaagt ttttgaaaac 240
actgaaagaa caactgaatt ttggaagcag tatgttgatg gagatcagtg tgagtccaat 300
ccatgtttaa atggcggcag ttgcaaggat gacattaatt cctatgaatg ttggtgtccc 360
tttggatttg aaggaaagaa ctgtgaatta gatgtaacat gtaacattaa gaatggcaga 420
tgcgagcagt tttgtaaaaa tagtgctgat aacaaggtgg tttgctcctg tactgaggga 480
tatcgacttg cagaaaacca gaagtcctgt gaaccagcag tgccatttcc atgtggaaga 540
gtttctgttt cacaaacttc taagctcacc cgtgctgaga ctgtttttcc tgatgtggac 600
tatgtaaatt ctactgaagc tgaaaccatt ttggataaca tcactcaaag cacccaatca 660
tttaatgact tcactcgggt tgttggtgga gaagatgcca aaccaggtca attcccttgg 720
caggttgttt tgaatggtaa agttgatgca ttctgtggag gctctatcgt taatgaaaaa 780
tggattgtaa ctgctgccca ctgtgttgaa actggtgtta aaattacagt tgtcgcaggt 840
gaacataata ttgaggagac agaacataca gagcaaaagc gaaatgtgat tcgaattatt 900
cctcaccaca actacaatgc agctattaat aagtacaacc atgacattgc ccttctggaa 960
ctggacgaac ccttagtgct aaacagctac gttacaccta tttgcattgc tgacaaggaa 1020
tacacgaaca tcttcctcaa atttggatct ggctatgtaa gtggctgggg aagagtcttc 1080
cacaaaggga gatcagcttt agttcttcag taccttagag ttccacttgt tgaccgagcc 1140
acatgtcttc gatctacaaa gttcaccatc tataacaaca tgttctgtgc tggcttccat 1200
gaaggaggta gagattcatg tcaaggagat agtgggggac cccatgttac tgaagtggaa 1260
gggaccagtt tcttaactgg aattattagc tggggtgaag agtgtgcaat gaaaggcaaa 1320
tatggaatat ataccaaggt gtcccggtat gtcaactgga ttaaggaaaa aacaaagctc 1380
actggatccg gtggcggtgg ctccggtgga ggcggaagcg gcggtggagg atcaggcggt 1440
ggaggtagcg gcggaggcgg tagctccagc tctagtaaag ctccccctcc ttccctgccc 1500
tcaccctcaa gactgcctgg accttccgac actcccatcc tgccacaggt ggagtgccct 1560
ccatgtccag caccccctgt cgcaggtcca tctgtgttcc tgtttccacc caagcctaaa 1620
gaccagctga tgatctcccg caccccagaa gtcacctgtg tggtcgtgga tgtgagccat 1680
gaagaccccg aggtccagtt caattggtac gtggatggcg tcgaggtgca caacgctaag 1740
acaaaaccta gagaagagca gttcaactct acctttcgcg tcgtgagtgt gctgacagtc 1800
gtgcaccagg actggctgaa tggcaaggag tataagtgca aagtgagcaa caaaggactg 1860
cctgcctcaa tcgaaaagac tatttccaag accaaaggac agccaagaga gccccaggtg 1920
tacaccctgc ctccaagccg cgaagagatg actaaaaatc aggtctctct gacctgtctg 1980
gtgaaggggt tttatcctag tgatatcgcc gtggaatggg agtcaaacgg tcagccagag 2040
aacaattaca agaccacacc ccctatgctg gacagcgatg ggtctttctt tctgtatagc 2100
aaactgacag tggacaagtc tcggtggcag cagggtaacg tcttctcttg cagtgtgctg 2160
cacgaagcac tgcacaatca ttacacccag aagtcactgt cactgagccc aggaaaatga 2220
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЙ СЛИТЫЙ БЕЛОК ФАКТОРА IX И ЕГО КОНЪЮГАТ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2794350C1 |
| Новые варианты интерлейкина-2 для лечения рака | 2020 |
|
RU2833537C2 |
| СЛИТЫЙ БЕЛОК FGF21 FC, СЛИТЫЙ БЕЛОК GLP-1 FC И КОМБИНИРОВАННЫЙ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, ВКЛЮЧАЮЩИЙ ИХ, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2804335C2 |
| ВЫСОКОГЛИКОЗИЛИРОВАННЫЙ СЛИТЫЙ БЕЛОК НА ОСНОВЕ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ ЧЕЛОВЕКА VIII, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2722374C1 |
| ВАРИАНТЫ IgG-FC ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2814952C2 |
| КОМПОЗИЦИЯ ДЛЯ КУЛЬТИВИРОВАНИЯ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ И СПОСОБ ПОЛУЧЕНИЯ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2020 |
|
RU2824216C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРОТИВОРАКОВОГО ЛЕЧЕНИЯ, СОДЕРЖАЩАЯ NK-КЛЕТКИ И СЛИТЫЙ БЕЛОК, КОТОРЫЙ СОДЕРЖИТ БЕЛОК IL-2 И БЕЛОК CD80 | 2020 |
|
RU2832136C1 |
| Способы лечения кальцификации тканей | 2015 |
|
RU2770698C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |


Изобретение относится к области биотехнологии, конкретно к получению слитого белка гипергликозилированного рекомбинантного человеческого фактора свертывания IX (FIX), и может быть использовано в медицине в терапии геморрагической болезни. Слитый белок состоит из последовательно от N-конца к С-концу, человеческого фактора коагуляции IX, гибкого пептидного линкера, по меньшей мере одного жесткого фрагмента, содержащего карбоксильный концевой пептид бета-субъединицы человеческого хорионического гонадотропина и Fc-сегмента иммуноглобулина. Изобретение позволяет получить слитый FIX, обладающий высокой биологической активностью, увеличенным периодом полувыведения in vivo и уменьшенной иммуногенностью. 7 н. и 9 з.п. ф-лы, 2 табл., 7 пр., 3 ил.
1. Слитый белок человеческого фактора коагуляции IX (FIX), обладающий высокой биологической активностью FIX, состоящий из последовательно от N-конца к С-концу, человеческого фактора коагуляции IX, гибкого пептидного линкера, по меньшей мере одного жесткого фрагмента, содержащего карбоксильный концевой пептид β-субъединицы человеческого хорионического гонадотропина и Fc-сегмента иммуноглобулина,
где человеческий фактор коагуляции IX содержит аминокислотную последовательность, показанную в SEQ ID NO: 1, или аминокислотная последовательность человеческого фактора коагуляции IX имеет по меньшей мере 85%, 90% или 95% идентичность аминокислотной последовательности, показанной в SEQ ID NO: 1;
где пептидный линкер включает общую формулу аминокислотной последовательности, образованную путем комбинирования повторяющихся единиц (GS)a(GGS)b(GGGS)c(GGGGS)d, где каждый а, b, с и d представляет собой целое число, которое равно или больше, чем 0, и a+b+c+d≥1;
где слитый белок содержит 1, 2, 3, 4 или 5 жестких фрагментов, содержащих карбоксильный концевой пептид β-субъединицы человеческого хорионического гонадотропина;
где жесткий фрагмент, содержащий карбоксильный концевой пептид β-субъединицы человеческого хорионического гонадотропина, содержит следующие аминокислотные последовательности:
(1) PRFQDSSSSKAPPPSLPSPSRLPGPSDTPILPQ;
(2) SSSSKAPPPSLPSPSRLPGPSDTPILPQ;
(3) SSSSKAPPPS;
(4) SRLPGPSDTPILPQ;
или
жесткий фрагмент, содержащий карбоксильный концевой пептид β-субъединицы человеческого хорионического гонадотропина, имеет по меньшей мере 70%, 80%, 90% или 95% идентичность аминокислотной последовательности СТР (карбокси-концевой пептид), содержащей следующие аминокислотные последовательности:
(1) PRFQDSSSSKAPPPSLPSPSRLPGPSDTPILPQ;
(2) SSSSKAPPPSLPSPSRLPGPSDTPILPQ;
(3) SSSSKAPPPS;
(4) SRLPGPSDTPILPQ;
и
где Fc-вариант выбран из группы, состоящей из:
(1) шарнирного участка, областей СН2 и СН3 человеческого IgG1, содержащего мутации Leu234Val, Leu235Ala и Pro331Ser;
(2) шарнирного участка, областей СН2 и СН3 человеческого IgG2, содержащего мутацию Pro331Ser;
(3) шарнирного участка, областей СН2 и СН3 человеческого IgG2, содержащего мутации Thr250Gln и Met428Leu;
(4) шарнирного участка, областей СН2 и СН3 человеческого IgG2, содержащего мутации Pro331Ser, Thr250Gln и Met428Leu;
(5) шарнирного участка, областей СН2 и СН3 человеческого IgG4, содержащего мутации Ser228Pro и Leu235Ala.
2. Слитый белок по п. 1, который гликозилирован.
3. Слитый белок по п. 2, где слитый белок гликозилирован посредством его экспрессии в клетках млекопитающих.
4. Слитый белок по п. 3, где слитый белок гликозилирован посредством его экспрессии в клетках яичника китайского хомячка.
5. Слитый белок по п. 1, где гибкий пептидный линкер выбран из группы, состоящей из:
(1) GSGGGSGGGGSGGGGS;
(2) GSGGGGSGGGGSGGGGSGGGGSGGGGS;
(3) GGGGSGGGGSGGGGSGGGGS;
(4) GSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGSGGGGS;
(5) GGGSGGGSGGGSGGGSGGGS.
6. Слитый белок по п. 1, который имеет аминокислотную последовательность, показанную в SEQ ID NO: 8.
7. Слитый белок по любому из пп. 1-6, который имеет активность более 200 МЕ/мг.
8. Молекула ДНК, кодирующая слитый белок по любому из пп. 1-7.
9. Молекула ДНК по п. 8, которая содержит последовательность, показанную в SEQ ID NO: 9.
10. Вектор для экспрессии слитого белка по п. 1, содержащий молекулу ДНК по п. 8 или 9.
11. Клетка-хозяин СНО для экспрессии слитого белка по п. 1, содержащая вектор по п. 10 или трансфицированная им.
12. Фармацевтическая композиция для предупреждения или лечения геморрагической болезни у пациентов с дефицитом FIX, содержащая фармацевтически приемлемый носитель, эксципиент или разбавитель и эффективное количество слитого белка по любому из пп. 1-7.
13. Способ получения слитого белка по любому из пп. 1-7, включающий:
(а) введение последовательности ДНК, кодирующей слитый белок по п. 8 или 9, в клетку СНО в виде части экспрессионного вектора с получением происходящей от СНО клетки;
(б) скрининг высокопродуктивной клетки СНО со стадии (а), которая экспрессирует более 1 мг/106 (миллион) клеток в течение 24 часов в своей ростовой среде;
(в) выращивание клетки СНО, полученной на стадии (б), для экспрессии слитого белка;
(г) сбор ферментативного бульона, полученного на стадии (в), и выделение и очистка слитого белка.
14. Способ по п. 13, где происходящая от СНО клетка на стадии (а) представляет собой DXB-11.
15. Способ по п. 13, где очистка слитого белка на стадии (г) включает аффинную хроматографию и анионообменную хроматографию.
16. Применение слитого белка по любому из пп. 1-7 в изготовлении лекарственного средства для предупреждения или лечения геморрагической болезни, включающее применение в изготовлении лекарственного средства для предупреждения или лечения геморрагического заболевания у пациента с врожденным или приобретенным дефицитом FIX и применение в изготовлении лекарственного средства для предупреждения или лечения спонтанного или хирургического кровотечения у пациента с гемофилией В.
| EA 201291480 A1, 30.09.2013 | |||
| WO 2013096386 A1, 27.06.2013 | |||
| ORLANDO M | |||
| Modification of proteins and low molecular weight substances with hydroxyethyl starch (HES), Inauguraldissertation, Giesen, 2003, p.166 | |||
| CHEN X | |||
| et al | |||
| Fusion protein linkers: property, design and functionality, Advanced drug delivery reviews, 2013, v | |||
| Разборное приспособление для накатки на рельсы сошедших с них колес подвижного состава | 1920 |
|
SU65A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2020-11-16—Публикация
2017-04-10—Подача