Область техники
Настоящее изобретение относится к новым гетероарил-тетрагидротиофен-3,4-диоловым, тетрагидрофуран-3,4-диоловым или циклопентан-1,2-диоловым соединениям, которые являются эффективными в качестве антагониста А3-аденозинового рецептора, и медицинскому применению этих соединений. Настоящее изобретение также относится к способам синтеза этих соединений.
Уровень техники
Группа рецепторов, сопряженных с G-белком (GPCR) является самым большим семейством рецепторов клеточной поверхности, которая играет решающую роль во внутриклеточной сигнальной трансдукции. Аденозиновые рецепторы являются частью группы GPCR, которая относится к классу А или родопсин-подобному подсемейству GPCR. Аденозин представляет собой природный нуклеозид, который проявляет свои биологические эффекты, взаимодействуя с семейством аденозиновых рецепторов, известных как A1, A2a, A2b и A3, которые участвуют в многочисленных физиологических и патофизиологических процессах (см. Fredholm et al., Pharmacol. Rev. 2001, 53, 527-552).
Агонисты рецепторов аденозина А1 и А2, большинство из которых были получены из аденозина, интенсивно изучались для применения в качестве гипотензивных средств, терапевтических средств для психических заболеваний и аритмии, препарата для подавления липидного обмена (терапевтические средства для лечения диабета) и нейропротекторов. С другой стороны, их антагонисты, полученные из ксантина или в виде двух или более конденсированных гетероциклических соединений, разрабатывают как антиастматические средства, антидепрессанты, антиаритмические средства, средства для защиты почек, лекарственные средства против болезни Паркинсона и средства для усиления познавательной функции (см. Патент США No 9018371).
Функция А3-аденозинового рецептора была определена совсем недавно, в отличие от рецепторов А1 и А2. Рецептор А3 ингибирует аденилатциклазу, фермент, который продуцирует цАМФ из АТФ. Также, при активации агонистами рецептор A3, как было доказано, опосредует активацию гуанозинтрифосфат-зависимой фосфолипазы C, фермента, который катализирует расщепление фосфатидилинозитола на инозитолтрифосфат и диацилглицерин (ДАГ) в головном мозге (см. Ramkumar, V. et al., J. Biol. Chem., 1993, 268, 168871-168890; Abbracchio, M. P. et al., Mol. Pharmacol., 1995, 48, 1038-1045). С другой стороны, инактивация А3-аденозинового рецептора вызывает высвобождение факторов воспаления, таких как гистамин, из тучных клеток, бронхоконстрикцию, и апоптоз иммунных клеток. Таким образом, агонисты А3-аденозинового рецептора рассматривают при лечении сердечной и церебральной ишемии и рака, в то время как антагонисты А3-аденозиновых рецепторов были предложены для применения в качестве потенциального лечения глаукомы, воспаления и астмы (см. Патент США No 6066642 и 6528516 и WO 2008/055711).
Глаукома остается одной из основных причин необратимой слепоты во всем мире, от которой страдает около 70 миллионов человек. Повышенное внутриглазное давление (ВГД) было продемонстрировано в качестве основного фактора риска для развития и прогрессирования глаукомы в ходе ряда хорошо проведенных, проспективных рандомизированных клинических испытаний, которые дали убедительные доказательства того, что понижение ВГД эффективно замедляет темпы развития или прогрессирование потери зрения, вызванной глаукомой. Однако доступные фармакологические и хирургические методы лечения имеют ограниченную эффективность и значительные побочные эффекты (см. Medeiros, F. A. et al., Drugs Today 2002, 38, 563-570). Большинство побочных эффектов, связанных с лекарственными средствами, понижающими ВГД, носят мягкий и глазной характер; однако некоторые из них связаны с системными рисками, а также с серьезными глазными побочными эффектами, особенно после длительного применения (см. Schuman, J. S. et al., Expert Opin. Drug Saf. 2002, 1, 181-194).
Было обнаружено, что уровни аденозина повышаются в водянистой влаге глаза у пациентов, имеющих повышенное артериальное давление, и A3AR в значительной степени повышаются на непигментированных клетках ресничного эпителия (NPE) у пациентов с псевдоэксфолиативным синдромом. A3AR имеет перспективы при глаукоме, поскольку нокаут A3AR снижает ВГД у живых мышей и, как было показано, антагонисты A3AR снижают ВГД у грызунов, кроликов и как у нормальных обезьян, так и обезьян с глаукомой (см. Avila et al., Investig. Ophthalmol. Vis. Sci., 2002, 43, 3021-3026). Антагонисты A3AR физиологически уменьшают приток внутриглазной жидкости путем ингибирования Cl-каналов NPE на водной поверхности. Также было обнаружено, что антагонисты A3AR являются нейропротективными для ткани гиппокампа, лишенной кислорода и глюкозы. A3AR присутствуют на ганглионарных клетках сетчатки, и антагонисты A3AR обладают потенциалом нейропротекции у пациентов с глаукомой.
В настоящее время ни один из существующих медицинских или хирургических методов лечения не защищает сетчатку от дегенерации при глаукоме.
Раскрытие изобретения
Техническая задача
Таким образом, один аспект настоящего изобретения предоставляет соединения, которые являются эффективными в качестве антагониста аденозинового рецептора А3, полезного для профилактики, облегчения тяжести или лечения глаукомы, связанных с глаукомой глазных нарушений или воспалительных заболеваний.
Другой аспект настоящего изобретения предоставляет способ получения таких соединений.
Еще одним объектом настоящего изобретения является фармацевтическая композиция для профилактики, улучшения или лечения глаукомы, связанных с глаукомой глазных нарушений и воспалительных заболеваний, содержащая по меньшей мере одно из таких соединений, являющихся антагонистами А3-аденозинового рецептора, в качестве активного ингредиента. Еще одним объектом настоящего изобретения является способ профилактики, облегчения тяжести или лечения глаукомы, связанных с глаукомой глазных нарушений и воспалительных заболеваний, включающий введение терапевтически эффективного количества по меньшей мере одного из соединений по настоящему изобретению.
Решение задачи
Сущность изобретения
В одном варианте осуществления предоставляется новое гетероарил-тетрагидротиофен-3,4-диольное, тетрагидрофуран-3,4-диольное или циклопентан-1,2-диольное соединение формулы (I) ниже или его фармацевтически приемлемая соль, которое является эффективным в качестве антагониста аденозинового рецептора А3, полезного для профилактики, облегчения тяжести или лечения глаукомы, связанных с глаукомой глазных нарушений и воспалительных заболеваний.
[Формула I]
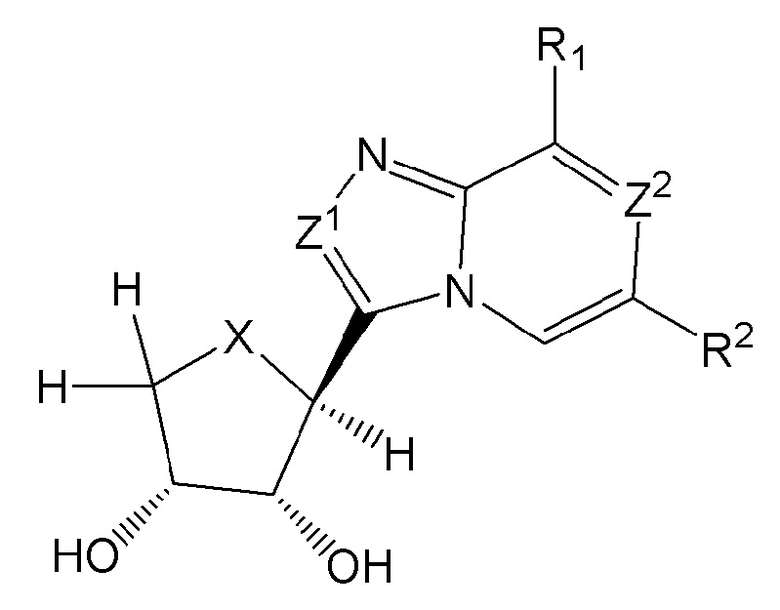
X представляет собой серу, кислород или CH2;
Z1 и Z2 являются одинаковыми или различными и каждый независимо представляет собой азот или CH;
R1 представляет собой галоген, NR3R4, NR3NR3R4, CR3R4R5, OR3 или SR3, где указанный R3, R4 и R5 каждый независимо представляет собой H, C1-6 алкил, замещенный C1-6 алкил, C3-7 циклоалкил, замещенный C3-7 циклоалкил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, гетероциклоалкил, замещенный гетероциклоалкил, C2-6 алкинил, необязательно замещенный арилом или гетероарилом, -C(=O)-C1-6 алкил, -S(O)n-C1-6 алкил, замещенный -C(=O)-C1-6 алкил или замещенный -S(O)n-C1-6 алкил, и указанный n равен 0, 1 или 2 и
R2 представляет собой Н или галоген.
В другом варианте осуществления предоставляется фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, эксципиент или разбавитель. В различных вариантах осуществления фармацевтическая композиция дополнительно содержит одно или более дополнительных фармацевтически активных соединений.
В еще одном варианте осуществления предлагается способ профилактики, облегчения тяжести или лечения заболевания, включающий введение субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, где заболевание, подлежащее лечению, включает, но не ограничивается этим, глаукому или связанные с глаукомой глазные нарушения. В различных вариантах осуществления способ включает введение комбинации соединения формулы I или его фармацевтически приемлемой соли и по меньшей мере одного дополнительного фармацевтически активного соединения.
В еще одном варианте осуществления предлагается способ получения соединения формулы I или его фармацевтически приемлемой соли.
Соединения и вышеуказанные композиции более подробно описаны в подробном описании, которое следует далее.
Подробное описание
Нижеследующее описание является исключительно иллюстративным по своей природе и не предназначено для ограничения настоящего раскрытия, применения или использования.
Определения
Использование общих терминов в описании соединений в настоящем документе определено для ясности.
В этом описании используются термины «заместитель», «радикал», «группа», «компонент» и «фрагмент» взаимозаменяемо.
Как используется в настоящем описании формы единственного числа включают ссылку на множественное число, если контекст явно не диктует иное.
Число атомов углерода в углеводородном заместителе может быть указано префиксом «CX-Y», где X представляет собой минимальное и Y представляет собой максимальное число атомов углерода в заместителе.
Как используется в настоящем описании, термин «алкил», или отдельно или в других терминах, таких как «галогеналкил» и «алкиларил», относится к насыщенному углеводородному радикалу с прямой или разветвленной цепью. Примеры «алкила», как используется в настоящем описании, включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил и гексил.
Как используется в настоящем описании, термин «галогеналкил» относится к алкильному фрагменту, замещенному одной или несколькими галогеновыми группами. Примеры галогеналкильных групп включают -CF3 и -CHF2.
Если заместитель описывается как «необязательно замещенный», заместитель может быть (1) незамещенным или (2) замещенным. Если замещаемое положение является незамещенным, по умолчанию заместитель представляет собой гидридорадикал.
Как используется в настоящем описании, термин «замещенный алкил» относится к насыщенному углеводородному радикалу с прямой или разветвленной цепью, который необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из C1-3 алкила, необязательно имеющего от одного до трех фторзаместителей, C2-3 алкенила, C2-3 алкинил, C1-2 алкокси, необязательно имеющего от одного до трех фторзаместителей, сульфанила, сульфинила, сульфонила, оксо, гидрокси, меркапто, амино, гуанидино, карбокси, аминокарбонила, арила, арилокси, гетероарила, гетероарилокси, гетероциклила, аминосульфонила, сульфониламино, карбоксиамида, уреидо, нитро, циано и галогена.
Как используется в настоящем описании, термин «алкенил» относится к углеводородному радикалу с прямой или разветвленной цепью, имеющему по меньшей мере одну углерод-углеродную двойную связь. Примеры "алкенила", как используется в настоящем описании, включают, но не ограничиваются ими, этенил и пропенил.
Как используется в настоящем описании, термин «замещенный алкенил» относится к углеводородному радикалу с прямой или разветвленной цепью, имеющему по меньшей мере одну углерод-углеродную двойную связь, который имеет необязательные заместители, выбранные из группы, состоящей из C1-3 алкила, необязательно имеющего от одного до трех фторзаместителей, амино, арила, циано и галогена.
Как используется в настоящем описании, термин «алкинил» относится к углеводородному радикалу с прямой или разветвленной цепью, имеющему по меньшей мере одну углерод-углеродную тройную связь. Примеры "алкинила", как используется в настоящем описании, включают, но не ограничиваются ими, ацетиленил и 1-пропинил.
Как используется в настоящем описании, термин «замещенный алкинил» относится к углеводородному радикалу с прямой или разветвленной цепью, имеющему по меньшей мере одну углерод-углеродную тройную связь, необязательно имеющему один или более заместителей, выбранных из группы, состоящей из C1-3 алкила, необязательно имеющего от одного до трех фторзаместителей, амино, арила и галогена.
Как используется в настоящем описании, термин «галоген» относится к фтору (F), хлору (Cl), брому (Br) или иоду (I).
Как используется в настоящем описании, термин «карбоцикл» или «циклоалкил» относится к неароматическому циклическому углеводородному радикалу, содержащему от трех до семи атомов углерода. Пяти-семи-членные кольца могут содержать двойную связь в кольцевой структуре. В вариантах осуществления «карбоциклические» или «циклоалкильные» группы включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогептил.
Как используется в настоящем описании, термин «замещенный карбоцикл» или «замещенный циклоалкил» относится к неароматическому циклическому углеводородному радикалу, состоящему из трех-семи атомов углерода, который необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из C1-3 алкила, необязательно имеющего от одного до трех фторзаместителей, С2-3 алкенила, С2-3 алкинила, С1-2 алкокси, необязательно имеющего от одного до трех фторзаместителей, сульфанила, сульфинила, сульфонила, оксо, гидрокси, меркапто, амино, гуанидино, карбокси, аминокарбонила, арила, арилокси, гетероарила, гетероциклила, аминосульфонила, сульфониламино, карбоксиамида, нитро, уреидо, циано и галогена.
Как используется в настоящем описании, термин «арил» относится к необязательно замещенному бензольному кольцу или относится к кольцевой системе, которая может быть результатом конденсирования одного или нескольких необязательных заместителей. В вариантах осуществления необязательные заместители включают замещенный С1-3 алкил, замещенный С2-3 алкенил, замещенный С2-3 алкинил, гетероарил, гетероциклический, арил, алкокси, необязательно имеющий от одного до трех фторзаместителей, арилокси, аралкокси, ацил, ароил, гетероароил, ацилокси, ароилокси, гетероароилокси, сульфанил, сульфинил, сульфонил, аминосульфонил, сульфониламино, карбоксиамид, аминокарбонил, карбокси, оксо, гидрокси, меркапто, амино, нитро, циано, галоген или уреидо. Такое кольцо или кольцевая система могут быть необязательно конденсированы с арильными кольцами (включая бензольные кольца), необязательно содержащими один или более заместителей, карбоциклическими кольцами или циклическими кольцами. Примеры "арильных" групп включают, но не ограничиваются ими, фенил, нафтил, тетрагидронафтил, бифенил, инданил, антрацил и фенантрил, а также их замещенные производные.
Как используется в настоящем описании, термин «гетероарил» относится к необязательно замещенному моноциклическому пяти-шестичленному ароматическому кольцу, содержащему один или более гетероатомных заместителей, выбранных из S, SO, SO2, O, N или N-оксида, или относится к такому ароматическому кольцу, конденсированному с одним или несколькими кольцами, такими как гетероарильные кольца, арильные кольца, гетероциклические кольца или карбоциклические кольца (например, бициклическая или трициклическая кольцевая система), каждое из которых имеет необязательные заместители. Примеры необязательных заместителей выбраны из группы, состоящей из замещенного C1-3 алкила, замещенного С2-3 алкенила, замещенного С2-3 алкинила, гетероарила, гетероциклила, арила, С1-3 алкокси, необязательно имеющего от одного до трех фторзаместителей, арилокси, аралкокси, ацила, ароила, гетероароила, ацилокси, ароилокси, гетероароилокси, сульфанила, сульфинила, сульфонила, аминосульфонила, сульфониламино, карбоксиамида, аминокарбонила, карбокси, оксо, гидрокси, меркапто, амино, нитро, циано, галогена или уреидо. Примеры "гетероарильных" групп, используемых в настящем описании, включают, но не ограничиваются ими, бензоимидазолил, бензотиазолил, бензоизотиазолил, бензотиофенил, бензопиразинил, бензотриазолил, бензо[1,4]диоксанил, бензофуранил, 9Н-а-карболинил, циннолинил, фуранил, фуро[2,3-b]пиридинил, имидазолил, имидазолидинил, имидазопиридинил, изоксазолил, изотиазолил, изохинолинил, индолил, индазолил, индолизинил, нафтиридинил, оксазолил, оксотиадиазолил, оксадиазолил, фталазинил, пиридил, пирролил, пуринил, птеридинил, феназинил, пиразолил, пиридил, пиразолопиримидинил, пирролизинил, пиридазил, пиразинил, пиримидил, 4-оксо-1,2-дигидро-4Н-пирроло[3,2,1-ij]-хинолин-4-ил, хиноксалинил, хиназолинил, хинолинил, хинолизинил, тиофенил, триазолил, триазинил, тетразолопиримидинил, триазолопиримидинил, тетразолил, тиазолил, тиазолидинил и их замещенные варианты.
Как используется в настоящем описании, термин «гетероцикл (гетероциклический)» относится к трех-семи-членному кольцу, содержащему один или более гетероатомных фрагментов, выбранных из S, SO, SO2, O, N или N-оксида, необязательно замещенных одним или несколькими заместителями, выбранными из группы, которая включает замещенный С1-3 алкил, замещенный С2-3 алкенил, замещенный С2-3 алкинил, гетероарил, гетероциклилический, арил, С1-3 алкокси, необязательно содержащий от одного до трех фторзаместителей, арилокси, аралкокси, ацил, ароил, гетероароил, ацилокси, ароилокси, гетероароилокси, сульфанил, сульфинил, сульфонил, аминосульфонил, сульфониламино, карбоксиамид, аминокарбонил, карбокси, оксо, гидрокси, меркапто, амино, нитро, циано, галоген и уреидо. Такое кольцо может быть насыщенным или иметь одну или более степеней ненасыщенности. Такое кольцо может быть необязательно конденсировано с одним или более «гетероциклическим» кольцом(кольцами), арильным кольцом(кольцами), гетероарильным кольцом(кольцами) или карбоциклическим кольцом(кольцами), каждый из которых имеет необязательные заместители. Примеры «гетероциклических» фрагментов включают, но не ограничиваются ими, 1,4-диоксанил, 1,3-диоксанил, пирролидинил, пирролидин-2-онил, пиперидинил, имидазолидин-2,4-дионепиперидинил, пиперазинил, пиперазин-2,5-дионил, морфолинил, дигидропиранил, дигидроциннолинил, 2,3-дигидробензо[1,4]диоксинил, 3,4-дигидро-2Н-бензо[b][1,4]-диоксепинил, тетрагидропиранил, 2,3-дигидрофуранил, 2,3-дигидробензофуранил, дигидроизоксазолил, тетрагидробензодиазепинил, тетрагидрохинолинил, тетрагидрофуранил, тетрагидронафтиридинил, тетрагидропуринил, тетрагидропиранил, тетрагидротиофенил, тетрагидрохиноксалинил, тетрагидропиридинил, тетрагидрокарболинил, 4Н-бензо[1,3]-диоксинил, бензо[1,3]диоксонил, 2,2-дифторбензо[1,3]-диоксонил, 2,3-дигидрофталазин-1,4-дионил и изоиндол-1,3-дионил.
Как используется в настоящем описании, термин «алкокси» относится к группе -ORa, где Ra обозначает алкил, имеющий вышеуказанные значения. В вариантах осуществления алкоксигруппы, используемые в вариантах осуществления настоящего изобретения, включают, но не ограничиваются ими, метокси, дифторметокси, трифторметокси, этокси, н-пропокси, изопропокси, н-бутокси и трет-бутокси.
Как используется в настоящем описании, термин «алкенилокси» относится к группе -ORb, где Rb обозначает алкенил, имеющий вышеуказанные значения.
Как используется в настоящем описании, термин «алкинилокси» относится к группе -ORc, где Rc обозначает алкинил, имеющий вышеуказанные значения.
Как используется в настоящем описании, термин «аралкокси» относится к группе -ORaRd, где Ra обозначает алкил, и Rd обозначает арил, имеющие вышеуказанные значения.
Как используется в настоящем описании, термин «арилокси» относится к группе -ORd, где Rd обозначает арил, имеющий вышеуказанные значения.
Как используется в настоящем описании, термин «гетероарилокси» относится к группе -ORe, где Re обозначает гетероарил, имеющий вышеуказанные значения.
Как используется в настоящем описании, термин «меркапто» относится к группе -SH.
Как используется в настоящем описании, термин «тио» относится к группе -SRf, где Rf обозначает замещенный алкил, замещенный карбоцикл, арил, гетероарил или гетероцикл, имеющие вышеуказанные значения.
Как используется в настоящем описании, термин «сульфинил» относится к группе -S-(O)Rf, где Rf обозначает замещенный алкил, замещенный карбоцикл, арил, гетероарил или гетероцикл, имеющий вышеуказанные значения.
Как используется в настоящем описании, термин «сульфонил» относится к группе -S(O)2Rf, где Rf обозначает замещенный алкил, замещенный карбоцикл, арил, гетероарил или гетероцикл, имеющие вышеуказанные значения.
Как используется в настоящем описании, термин «оксо» относится к группе =O.
Как используется в настоящем описании, термин «гидроксил» относится к группе -OH.
Как используется в настоящем описании, термин «амино» относится к группе -NH2. Аминогруппа необязательно замещена замещенным алкилом, замещенным карбоциклом, арилом, гетероарилом или гетероциклом, имеющими вышеуказанные значения.
Как используется в настоящем описании, термин «циано» относится к группе -CN.
Как используется в настоящем описании, термин «аминосульфонил» относится к группе -S(O)2NH2. Аминосульфонилгруппа необязательно замещена замещенным алкилом, замещенным карбоциклом, арилом, гетероарилом или гетероциклом, имеющие вышеуказанные значения.
Как используется в настоящем описании, термин «сульфониламино» относится к группе -NHS(O)2Rf, где Rf обозначает замещенный алкил, замещенный карбоцикл, арил, гетероарил или гетероцикл, имеющими вышеуказанные значения.
Как используется в настоящем описании, термин «карбоксиамид» относится к группе -NHC(O)Rf, где Rf обозначает замещенный алкил, замещенный карбоцикл, арил, гетероарил или гетероцикл, имеющие вышеуказанные значения.
Как используется в настоящем описании, термин «карбокси» относится к группе -C(O)OH. Карбоксигруппа необязательно замещена замещенным алкилом, замещенным карбоциклом, арилом, гетероарилом или гетероциклом, имеющими вышеуказанные значения.
Как используется в настоящем описании, термин «аминокарбонил» относится к группе -C(O)NH2. Аминокарбонилгруппа необязательно замещена замещенным алкилом, замещенным карбоциклом, арилом, гетероарилом или гетероциклом, имеющими вышеуказанные значения.
Как используется в настоящем описании, термин «уреидо» относится к группе -NHC(O)NHRg, где Rg обозначает водород, алкил, карбоцикл или арил, имеющие вышеуказанные значения.
Как используется в настоящем описании, термин «гуанидин» относится к группе -NHC(=NH)NH2.
Как используется в настоящем описании, термин «ацил» относится к группе -C(O)Rh, где Rh обозначает алкил, карбоцикл или гетероцикл, имеющие вышеуказанные значения.
Как используется в настоящем описании, термин «ароил» относится к группе -C(O)Rd, где Rd обозначает арил, имеющий вышеуказанные значения.
Как используется в настоящем описании, термин «гетероароил» относится к группе -C(O)Re, где Re обозначает гетероарил, имеющий вышеуказанные значения.
Как используется в настоящем описании, термин «ацилокси» относится к группе -OC(O)Rh, где Rh обозначает алкил, карбоцикл или гетероцикл, имеющие вышеуказанные значения.
Как используется в настоящем описании, термин «ароилокси» относится к группе -OC(O)Rd, где Rd обозначает арил, имеющий вышеуказанные значения.
Как используется в настоящем описании, термин «гетероароилокси» относится к группе -OC(O)Re, где Re обозначает гетероарил, имеющий вышеуказанные значения.
Термин «фармацевтически приемлемый» означает подходящий для применения в фармацевтических препаратах, обычно считающийся безопасным для такого применения, официально утвержденный регулирующим органом национального или государственного управления для такого применения или внесенный в Фармакопею США или другие общепризнанные фармакопеи для применения у животных и, более конкретно, у людей.
Термин «терапевтически эффективное количество» относится к количеству соединения, которое при введении субъекту для лечения заболевания является достаточным для лечения этого заболевания. «Терапевтически эффективное количество» может варьироваться в зависимости от соединения, заболевания и его тяжести, возраста, массы и т.п. субъекта, подлежащего лечению.
Как используется в настоящем описании, термин «очищенный» означает, что при выделении изолят имеет более чем 90%-ную чистоту, в одном варианте осуществления более чем 95%-ную чистоту, в другом варианте осуществления более чем 99%-ную чистоту, и в другом варианте осуществления более чем 99,9%-ную чистоту.
Соединения
Один аспект настоящего изобретения предоставляет соединение формулы (I):

или его фармацевтически приемлемую соль, где:
X представляет собой серу, кислород или CH2;
Z1 и Z2 являются одинаковыми или различными и каждый независимо представляет собой азот или CH;
R1 представляет собой галоген, NR3R4, NR3NR3R4, CR3R4R5, OR3 или SR3, где указанный R3, R4 и R5 каждый независимо представляет собой H, C1-6 алкил, замещенный C1-6 алкил, C3-7 циклоалкил, замещенный C3-7 циклоалкил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, гетероциклоалкил, замещенный гетероциклоалкил, C2-6 алкинил, необязательно замещенный арилом или гетероарилом, -C(=O)-C1-6 алкил, -S(O)n-C1-6 алкил, замещенный -C(=O)-C1-6 алкил или замещенный -S(O)n-C1-6 алкил, и указанный n равен 0, 1 или 2, и
R2 представляет собой Н или галоген.
В некоторых вариантах осуществления в формуле I выше,
X представляет собой серу, кислород или CH2;
Z1 и Z2 являются одинаковыми или различными и каждый независимо представляет собой азот или CH;
R1 представляет собой NHR3R4, NR3R4, CCR3R4, NH((SO2)R3R4, NH2, N(CH3)R3R4, OH, NH(NH)R3R4, R3R4, SR3R4, OR3R4, NHCOR3R4 или NH(SO2)R3R4, где R3 представляет собой (CRR')n, где R и R' являются одинаковыми или различными и каждый независимо представляет H или C1-C6 алкил, и n равен 0, 1, 2 или 3; R4 представляет собой замещенный или незамещенный фенил, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C3-C7 циклоалкил, замещенный или незамещенный гетероарил, выбранный из группы, включающей бензоимидазолил, фуранил, имидазопиридинил, индолил, морфолинил, пиперидинил, пиразинил, пиридинил, пиримидинил, тиазолил, тиофенил, тетразолил, тиадиазолил, оксадиазолил и оксазолил, где замещенное соединение замещено по меньшей мере одним, выбранным из группы, содержащей галоген, фенил, фенокси, циано, C1-C6 алкил, C1-C6 галогеналкил, C1-C6 алкокси, C1-C6 галогеналкоксил, C3-C7 циклоалкил, пиперазинил, морфолинил, тетразолил, метилпиперазинил и NRaRb, где Ra и Rb являются одинаковыми или различными и каждый независимо представляет собой водород или C1-C6 алкил, COORc, где Rc представляет собой водород или C1-C6 алкил, и CONRdRe, где Rd и Re являются одинаковыми или различными и каждый независимо представляет собой водород или C1-C6 алкил; R3R4 может представлять собой 2-R''-замещенный-циклопроп-1-ил или 1-R''-замещенный-фенилциклопроп-1-ил, где R'' представляет собой фенил, галогенфенил или дигалогенфенил; когда R1 представляет собой NR3R4, R3 и R4 могут образовывать кольцо с N в NR3R4;
R2 представляет собой Н или галоген.
В одном варианте осуществления настоящего изобретения представлено соединение формулы (I-a):
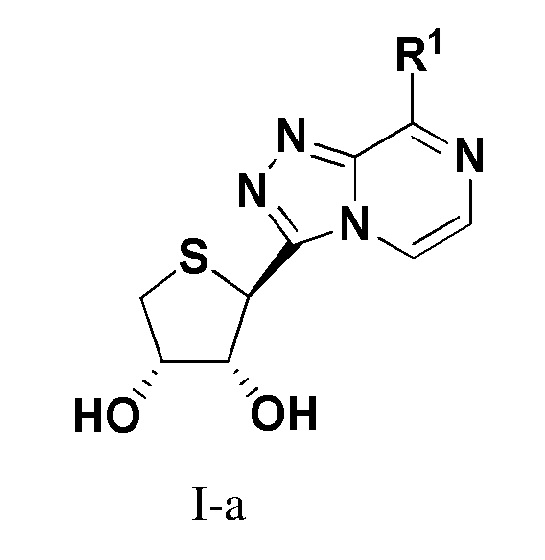
или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В другом варианте осуществления настоящего изобретения представлено соединение формулы (I-b):
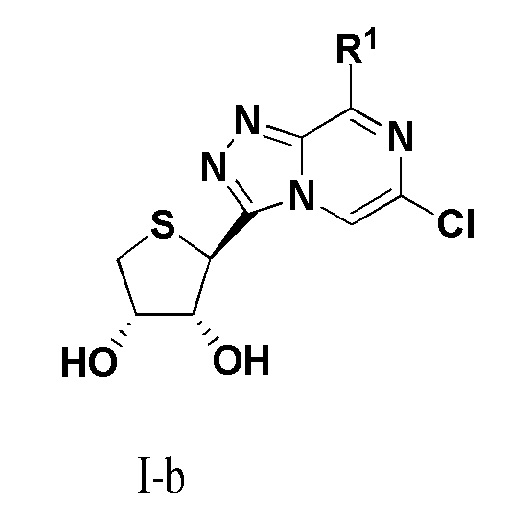
или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В другом варианте осуществления настоящего изобретения представлено соединение формулы (I-c):

или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В еще одном варианте осуществления настоящего изобретения представлено соединение формулы (I-d):

или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В еще одном варианте осуществления настоящего изобретения представлено соединение формулы (I-e):

или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В варианте осуществления настоящего изобретения также представлено соединение формулы (II-a):
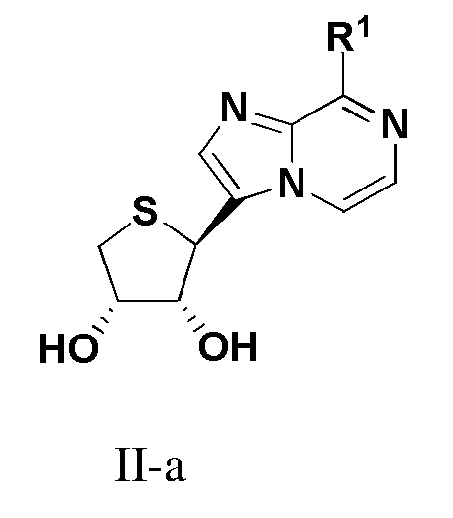
или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В еще одном варианте осуществления настоящего изобретения представлено соединение формулы (II-b):
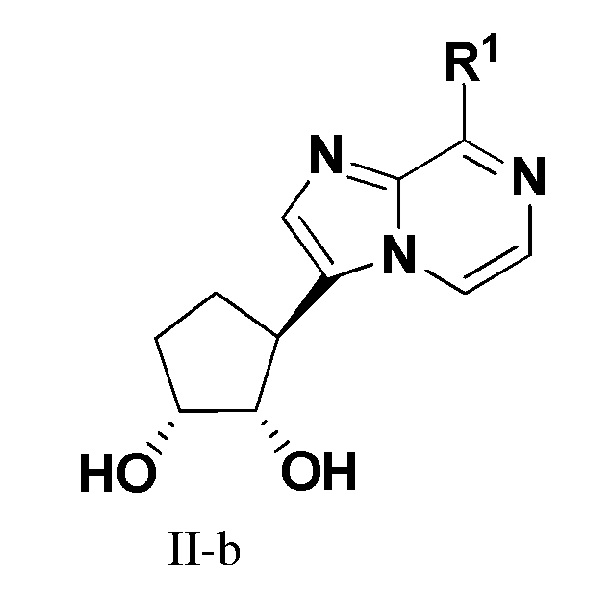
или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В еще одном варианте осуществления настоящего изобретения представлено соединение формулы (II-c):

или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В еще одном варианте осуществления настоящего изобретения представлено соединение формулы (II-d):
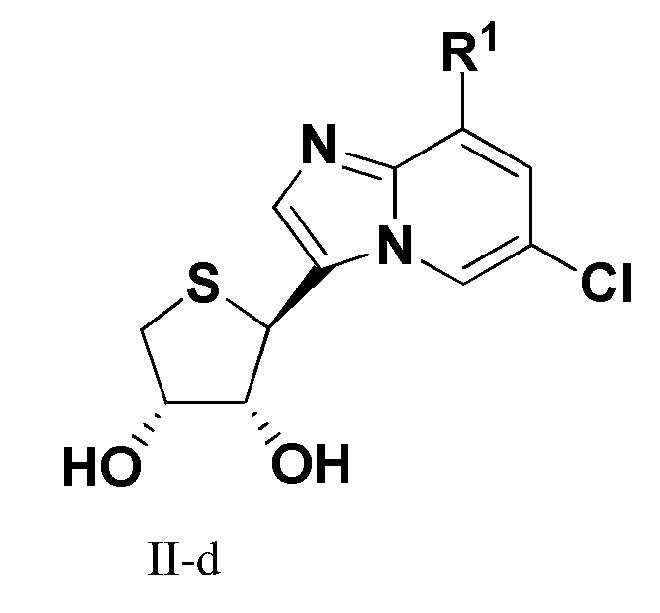
или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В еще одном варианте осуществления настоящего изобретения представлено соединение формулы (II-e):
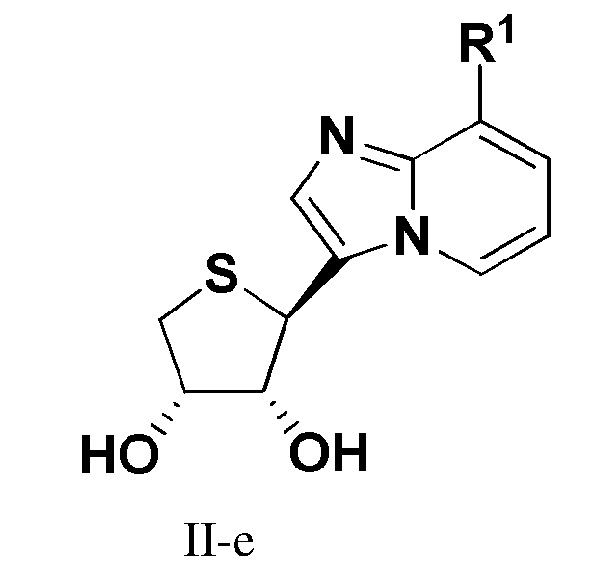
или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
В еще одном варианте осуществления настоящего изобретения представлено соединение формулы (III-a):

или его фармацевтически приемлемая соль, где R1 имеет те же значения, как определено в формуле I.
Предпочтительно, предоставляются соединения формулы (I), где X представляет собой серу, кислород или CH2; Z1 и Z2 являются одинаковыми или различными и каждый независимо представляет собой азот или CH; R1 представляет собой NR3R4 или CR3R4R5, где указанный R3, R4 и R5 каждый независимо представляет собой H, C1-6 алкил, замещенный C1-6 алкил, C3-7 циклоалкил, замещенный C3-7 циклоалкил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл, замещенный гетероцикл, гетероциклоалкил, замещенный гетероциклоалкил или C2-6 алкинил, необязательно замещенный арилом или гетероарилом; и R2 представляет собой Н или галоген.
Соединения настоящего изобретения обладают высокой активностью антагониста А3-аденозинового рецептора и являются высокоселективными для А3-аденозиновых рецепторов и менее селективными по отношению к другим подтипам, например, A1 и A2a. Кроме того, соединения по настоящему изобретению являются высокорастворимыми в воде и, таким образом, могут быть хорошим активным ингредиентом для лекарственных средств для контроля внутриглазного давления. Положение и количество атома N в гетероарил-подобных соединениях настоящего изобретения, влияют на активность и селективность антагонизма А3-аденозинового рецептора.
Предпочтительно соединения по настоящему изобретению имеют формулу I или II, как указано выше. Более предпочтительно в формулах (Ia) и (II-a) R1 имеет мостик -NH- вместо других мостиков, таких как -N-, -CH-, -S- и -O-, и такие соединения имеют более высокую активность антагонизма А3-аденозинового рецептора.
Предпочтительно в формулах (I) и (II) R3 представляет собой галоген-замещенный бензил или фенетил, когда R1 представляет собой -NHR3. Когда R3 представляет собой бензил, предпочтительно, заместитель представляет собой небольшой заместитель, такой как галоген или метил, расположенный в пара-положении.
Неограничивающие примеры соединений формулы I включают следующие соединения и их фармацевтически приемлемые соли:
Соединения формулы I могут иметь один или более центров асимметрии (также называемых хиральным центром) и поэтому могут существовать в виде индивидуальных энантиомеров, диастереомеров или других стереоизомерных форм, или в виде их смесей. Хиральные центры, такие как хиральные атомы углерода, также могут присутствовать в заместителе, таком как алкильная группа. Если стереохимия хирального центра, присутствующего в формуле I, или в любой химической структуре, проиллюстрированной в настоящем описании, не указана, структура охватывает все отдельные стереоизомеры и все их смеси. Таким образом, соединения формулы I, содержащие один или более хиральных центров, могут быть использованы в виде рацемических смесей, диастереомерных смесей, энантиомерно обогащенных смесей, диастереомерно обогащенных смесей или в виде энантиомерно и диастереомерно чистых индивидуальных стереоизомеров.
Индивидуальные стереоизомеры соединения формулы I, которые содержат один или более асимметричных центров, могут быть разделены способами, известными специалистам в данной области. Например, такое разделение может быть осуществлено (1) посредством образования диастереоизомерных солей, комплексов или других производных; (2) посредством селективного взаимодействия со стереоизомерно-специфическим реагентом, например, путем ферментативного окисления или восстановления; или (3) посредством газо-жидкостной или жидкостной хроматографии в хиральной среде, например, на хиральной подложке, такой как диоксид кремния с связанным хиральным лигандом или в присутствии хирального растворителя. Специалисту в данной области техники будет понятно, что, когда желаемый стереоизомер превращают в диастереомерную соль, комплекс или производное, требуется дополнительная стадия для высвобождения желаемой формы. Альтернативно специфические стереоизомеры могут быть синтезированы посредством асмметричного синтеза, используя оптически активные реагенты, субстраты, катализаторы или растворители, или посредством превращения одного энантиомера в другой путем асимметричной трансформации.
Соединения формулы I могут также содержать двойные связи или другие центры геометрической асимметрии. В тех случаях, когда стереохимия центра геометрической асимметрии, присутствующего в формуле I, или в любой химической структуре, проиллюстрированной в настоящем описании, не указывается, структура предназначена для охвата транс (Е) геометрического изомера, цис (Z) геометрического изомера и всех их смесей. Аналогично, все таутомерные формы также включены в формулу I, независимо от того, существуют ли таутомеры в равновесии или преимущественно в одной форме.
В некоторых вариантах осуществления соединения согласно формуле I могут содержать кислотную функциональную группу. В некоторых других вариантах соединения согласно формуле I могут содержать основную функциональную группу. Таким образом, специалист в данной области поймет, что могут быть получены соли соединений формулы I. Действительно, в вариантах осуществления изобретения соли соединений согласно формуле I могут быть предпочтительными относительно соответствующих свободного основания или свободной кислоты, поскольку, например, такие соли придают большую стабильность или растворимость молекуле, тем самым облегчая их приготовление в виде лекарственной формы. Соответственно, варианты осуществления изобретения дополнительно представляют собой фармацевтически приемлемые соли соединений формулы I. Для обзора подходящих солей см. Berge et al, J. Pharm. Sci., 1977, 66, 1-19.
Кислые соли: подходящие аддитивные соли получают из кислот, которые образуют нетоксичные соли, и примерами являются гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, нитрат, фосфат, гидрофосфат, ацетат, малеат, малат, фумарат, малонат, лактат, тартрат, цитрат, формиат, глюконат, сукцинат, пируват, оксалат, оксалоацетат, трифторацетат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, соль метансульфоновой кислоты, соль этансульфоновой кислоты, соль п-толуолсульфоновой кислоты и изетионат.
Основные соли: Фармацевтически приемлемые основные соли включают соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, и соли с органическими основаниями, включая соли первичных, вторичных и третичных аминов, такие как изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин и N-метил-D-глюкамин.
Как используется в настоящем описании, термин «фармацевтически приемлемые соли» относится к солям, которые сохраняют желаемую биологическую активность настоящего соединения и проявляют минимальные нежелательные токсикологические эффекты. Эти фармацевтически приемлемые соли могут быть получены in situ во время окончательного выделения и очистки соединения или путем отдельного введения в реакцию очищенного соединения в форме его свободной кислоты или свободного основания с подходящим основанием или кислотой, соответственно.
Как используется в настоящем описании, термин «соединения согласно вариантам осуществления изобретения» означает как соединения формулы I, так и их соли, включая фармацевтически приемлемые соли. Термин «соединение согласно вариантам осуществления изобретения» также представлен в настоящем описании и относится как к соединению формулы I, так и к его солям, включая фармацевтически приемлемые соли.
Соединения согласно вариантам осуществления изобретения могут существовать в твердой или жидкой форме. В твердом состоянии соединения согласно вариантам осуществления изобретения могут существовать в кристаллической или некристаллической форме или в виде их смеси. Для соединений согласно вариантам осуществления изобретения, которые находятся в кристаллической форме, специалисту в данной области понятно, что могут быть получены фармацевтически приемлемые сольваты, где молекулы растворителя включены в кристаллическую решетку в результате кристаллизации. Сольваты могут включать неводные растворители, такие как этанол, изопропанол, ДМСО, уксусная кислота, этаноламин и этилацетат, или они могут включать воду в качестве растворителя, которая включена в кристаллическую решетку. Сольваты, в которых вода является растворителем, которая включена в кристаллическую решетку, обычно называют «гидратами». Гидраты включают стехиометрические гидраты, а также композиции, содержащие различные количества воды. Варианты осуществления изобретения включают все такие сольваты.
Специалистам в данной области также должно быть понятно, что некоторые соединения согласно вариантам осуществления изобретения, которые существуют в кристаллической форме, включая их различные сольваты, могут проявлять полиморфизм (то есть способность к существованию в различных кристаллических структурах). Эти различные кристаллические формы обычно известны как «полиморфы». Варианты осуществления изобретения включают все такие полиморфы. Полиморфы имеют один и тот же химический состав, но различаются по упаковке, геометрическому расположению и другим описательным свойствам кристаллического твердого состояния. Поэтому, полиморфы могут иметь разные физические свойства, такие как форма, плотность, твердость, деформируемость, стабильность и свойства растворения. Полиморфы обычно проявляют разные точки плавления, ИК-спектры и порошковый рентгеновские дифрактограммы, которые можно применять для идентификации. Специалисту в данной области техники будет понятно, что различные полиморфы могут быть получены, например, путем изменения или регулирования условий реакции или реагентов, используемых при получении соединения, или с использованием различных способов выделения или очистки. Например, изменения в температуре, давлении или растворителе могут привести к получению полиморфов. Кроме того, один полиморф может самопроизвольно превращаться в другой полиморф при определенных условиях.
Соединения согласно вариантам осуществления изобретения могут существовать в форме пролекарства. Как используется в настоящем описании и, если специально не указано иное, термин «пролекарство» означает производное, которое может гидролизоваться, окисляться или иным образом вступать в реакцию в биологических условиях (in vitro или in vivo), давая активное соединение по настоящему изобретению. Примеры пролекарств включают, но не ограничиваются ими, производные и метаболиты соединений согласно настоящему изобретению, которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Предпочтительно пролекарствами соединений с карбоксильными функциональными группами являются низшие алкиловые эфиры карбоновой кислоты. Сложные эфиры карбоновой кислоты обычно образуются путем эстерификации любой из групп карбоновой кислоты, присутствующей в молекуле. Пролекарства могут быть, обычно, получены с использованием хорошо известных методов, таких как описанные Burger's Medicinal Chemistiy and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley) и Design and Application of Prodrugs (H. Bundgaard ed., 1985, Harwood Academic Publishers Gmfh).
В другом варианте осуществления представлена композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль. В еще одном варианте осуществления представлена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель, эксципиент или разбавитель.
Общие схемы синтеза
Другим аспектом настоящего изобретения является способ получения соединений формулы I или их фармацевтически приемлемой соли.
Соединения настоящего изобретения могут быть получены с использованием способов, проиллюстрированных на общих схемах синтеза и экспериментальных процедурах, подробно описанных ниже. Эти общие схемы синтеза и экспериментальные процедуры представлены в целях иллюстрации и не предназначены для ограничения. Исходные материалы, используемые для получения соединений настоящего изобретения, являются коммерчески доступными или могут быть получены с использованием обычных методов, известных в данной области.
Промежуточное соединение диола 6, используемое при получении соединения формулы (I), может быть синтезировано из коммерчески доступной D-маннозы, описанной в J. Med. Chem. 2003, 46, 3775-3777 и патенте США No 9018371. Для получения соединения формулы I-a, I-b и I-e окислительное расщепление диола 6 перйодатом натрия на влажном диоксиде кремния при комнатной температуре в течение 3 часов дало альдегид 7, как показано на схеме 1.
Схема 1:
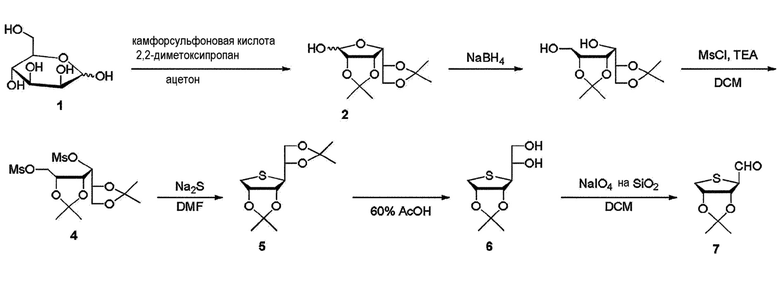
Схема 2:
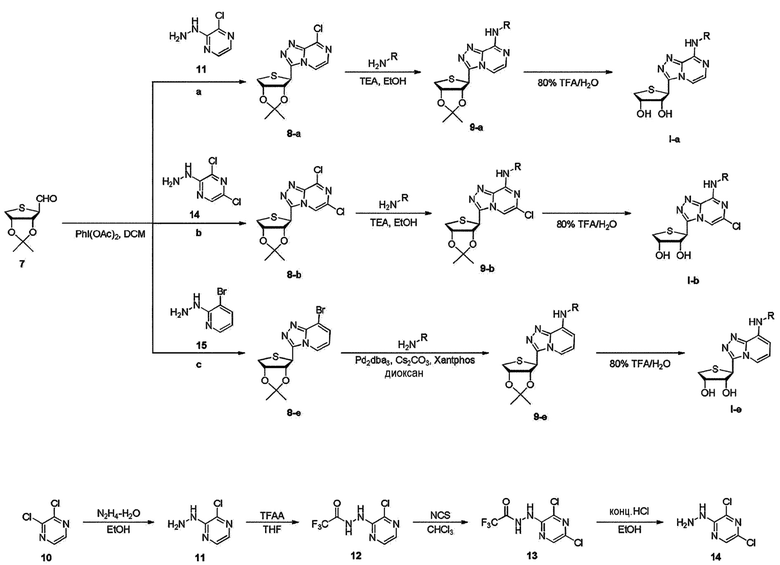
Как показано на схеме 2, циклизация полученного альдегида 7 с использованием гидразина 11, 14 и 15, с последующим добавлением PhI(OAC)2 дает ключевые промежуточные соединения 8-a, 8-b и 8-e. В случае, когда гидразин представляет собой 11 и 14; гетероциклический триазопиразин 8-а и 8-b можно обработать производным амина в присутствии триэтиламина при 85°С с получением соединения 9-а и 9-b, которое затем подвергают гидролизу производных ацетонида с использованием 80% водной уксусной кислоты до конечных нуклеозидов I-a и I-b, соответственно. В случае, когда гидразин представляет собой 15; гетероциклический триазопиридин 8-e может быть обработан производным амина в присутствии Pd2dba3, Xantphos и Cs2CO3 при 110°C с получением соединения 9-e, которое затем подвергают гидролизу производного ацетонида с использованием 80% водной трифторуксусной кислоты до конечного нуклеозида I-e, соответственно.
Схема 3:

Альдегидное промежуточное соединение 20, используемое при получении соединения формулы I-c, может быть синтезировано из коммерчески доступного промежуточного соединения диола 15 (см. Tetrahedron Letters, 2004, 45, 1789-1791; Carbohydrate Research, 1994, 264, 33-44; Chem. Eur. J., 2010, 16, 8545-8556), как показано на схеме 3. Соединение формулы I-c может быть получено взаимодействием промежуточного соединения диола 15 с 2,2-диметоксипропаном в присутствии кислоты в качестве катализатора с получением диацетонида 16. У соединения диацетонида 16 может происходить раскрытие цикла в присутствии боргидрида натрия с получением диола 17. Диол 17 может быть мезилирован в димезильное соединение, которое затем может быть циклизовано в диацетонид 18. Диацетонид 18 может быть селективно гидролизован уксусной кислотой в диол 19. Альдегид 20 может быть получен окислением диола 19 перйодатом натрия на влажном диоксиде кремния. Конечные нуклеозиды I-c могут быть получены путем взаимодействия альдегида 20 по пути а или b на схеме 2.
Схема 4:

Промежуточное соединение циклопентилового спирта 28, используемое при получении соединения формулы I-d и II-c, может быть описано в J. Org. Chem., 2005, 70(17), 6884-6890, J. Org. Chem., 2004, 69(7), 2634-2636, Tetrahedron Asymmetry 13 (2002) 1189-1193. Защищенный циклопентиловый спирт 28 может быть ацилирован метилхлорформиатом с получением карбоната 29. Карбонат 29 можно подвергнуть взаимодействию с винилмагнийбромидом в присутствии цианида меди(I) с получением винилпроизводного 30. Региоселективное эпоксидирование концевой винильной группы может быть достигнуто с использованием mCPBA при низкой температуре с получением эпоксида 31.
Схема 5:

Эпоксид 31 может подвергаться региоселективному взаимодействию с H2O при температурных условиях с получением ненасыщенного циклопентилдиола 32. Ненасыщенный циклопентилдиол 32 может быть подвергнут взаимодействию с 10% палладием в присутствии газообразного водорода с получением насыщенного циклопентилдиола 33. Альдегид 34 может быть получен путем окисления насыщенного циклопентилдиола 33 перйодатом натрия на влажном диоксиде кремния. Конечные нуклеозиды I-d могут быть получены путем взаимодействия альдегида 20 по пути а или b на схеме 2.
Схема 6:
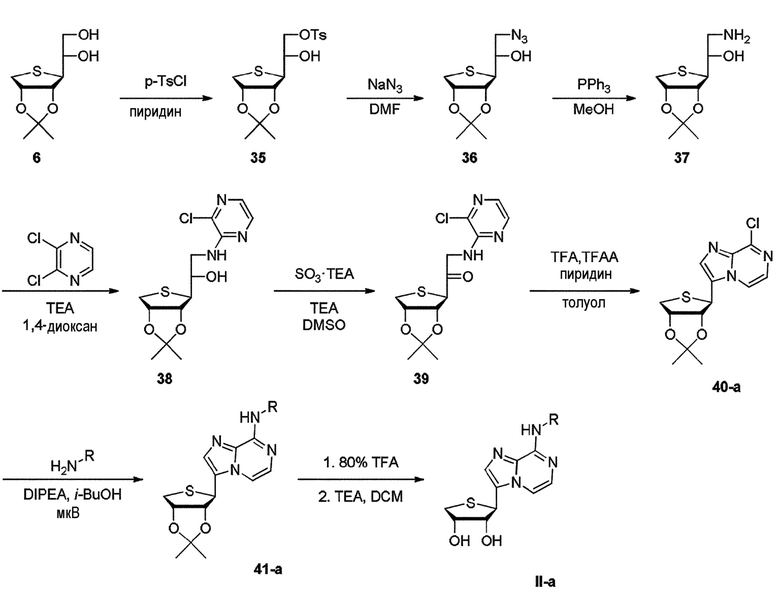
Как показано на схеме 6, соединение формулы II-a может быть получено путем тозилирования промежуточного соединения диола 6 в присутствии пиридина с получением тозилированного соединения 35. Обработка тозилированного соединения 35 азидом натрия при 120°C дает азидное промежуточное соединение 36. Восстановление азидного промежуточного соединения 36 может быть осуществлено с использованием трифенилфосфина при 85°C. Аминоспирты 37 могут быть соединены с 2,3-дихлорпиразином при 110°С с получением аминопиразинов 38. Окисление комплексом триоксид серы пиридин вторичного спирта в пиразины 38 дает кетон 39, который затем может быть циклизован в присутствии трифторуксусной кислоты и трифторуксусного ангидрида, забуференного присутствием пиридина. Эти условия обеспечивают гетероциклический имидазопиразин 40-а. (см. Carbohydrate Research, 2010, 345, 1617-1621; EP0480713) Гетероциклический имидазопиразин 40-а может быть обработан производным амина в присутствии DIPEA с микроволновым облучением с получением соединения 41-а, которое затем подвергают гидролизу производных ацетонида с использованием 80% водной трифторуксусной кислоты до конечных нуклеозидов II-a, соответственно.
Схема 7:

Как показано на схеме 7, эпоксид 31 может быть затем подвергнут региоселективной реакции с аммиаком при температурных условиях с получением ненасыщенного циклопентилового аминоспирта 42. Ненасыщенный циклопентиловый аминоспирт 42 может быть подвергнут взаимодействию с 10% палладием в присутствии газообразного водорода с получением насыщенного циклопентилового аминоспирта 43. Аминоспирт 43 может быть связан с 2,3-дихлорпиразином с получением аминопиразина 44. Окисление Сверна-Моффата вторичного спирта в пиразин дает кетон 45, который затем циклизуют в присутствии трифторуксусной кислоты и трифторуксусного ангидрида, забуференного присутствием пиридина. Эти условия обеспечивают гетероциклический имидазопиразин 40-b (см. WO 2009/108546). Гетероциклический имидазопиразин 40-b может быть обработан производным амина в присутствии DIPEA при нагревании с получением соединения 41-b, которое затем подвергают гидролизу ацетонидных производных с использованием 80% водной трифторуксусной кислоты до конечных нуклеозидов II-b, соответственно.
Схема 8:
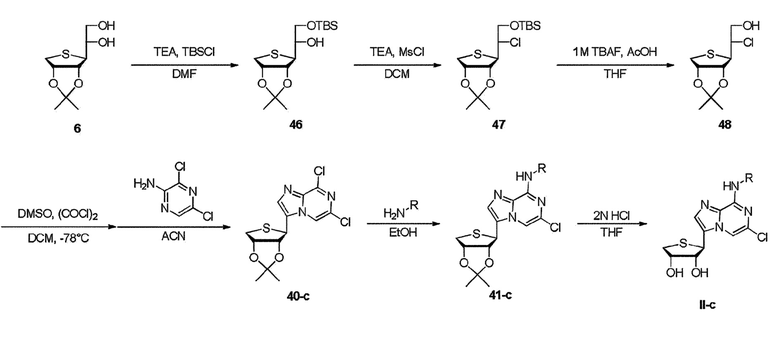
Как показано на схеме 8, соединение формулы II-c может быть получено путем добавления трет-бутилдиметилсилилхлорида к промежуточному соединению диола 6 в присутствии триэтиламина с получением защищенного соединения 46. Обработка защищенного соединения 46 метансульфонилхлоридом в присутствии триэтиламина дает промежуточное соединение хлорида 47. Окисление Сверна-Моффата вторичного спирта 48 дает кетоновое промежуточное соединение, которое затем может быть циклизовано в присутствии 2,3-дихлорпиразина. Эти условия обеспечивают гетероциклический имидазопиразин 40-c. гетероциклический триазопиразин 40-c может быть обработан производным амина с получением соединения 41-c, которое затем подвергают гидролизу ацетонидных производных с использованием 2 н HCl до конечных нуклеозидов II-c, соответственно.
Схема 9:

Как показано на схеме 9, аминоспирты 43 могут быть соединены с производным 3-нитропиридина при 110°С с получением аминопиридинов 49. Окисление Десс-Мартина вторичного спирта в пиридинах 49 дает кетон 50, который затем может быть циклизован в присутствии трифторуксусной кислоты и трифторуксусного ангидрида, забуференного присутствием пиридина. Эти условия обеспечивают гетероциклический имидазопиридин 51. Восстановление имидазопиридина 51 может быть осуществлено с использованием Fe в присутствии хлорида аммония при 85°C (см. Org. Lett., 2011, 13, 42-45). Имидазопиридин 52-d или 52-e может быть обработан цианоборгидридом натрия в присутствии производного альдегида и хлорида цинка при 85°С с получением соединения 53-d или 53-e (см. WO 2004/026867)., которое затем подвергают гидролизу ацетонидных производных с использованием 2 н хлористоводородной кислоты до конечных нуклеозидов II-d или II-e, соответственно.
Схема 10:
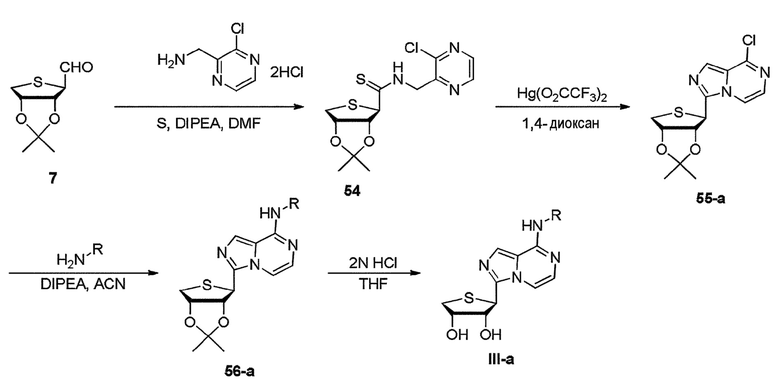
Как показано на схеме 10, альдегид 7 может быть связан с (3-хлорпиразин-2-ил)метанамин 2HCl, DIPEA и серой с получением промежуточного соединения 54. Циклизация промежуточного соединения 54 с использованием Hg(O2CCF3)2 обеспечивает ключевое промежуточное соединение 55-a (см. WO 2010/104027; Патент США No 8426411). Гетероциклический имидазопиразин 55-а может быть обработан производным амина в присутствии DIPEA при 70°C с получением соединения 56-a, которое затем подвергают гидролизу ацетонидных производных с использованием 2 н HCl до конечных нуклеозидов III-a, соответственно.
Схема 11:

Когда заместитель R1 представляет собой OR, схему 11 берут для синтеза конечных нуклеозидов I-a-1 или II-a-1. Как видно на схеме 11, синтез конечных нуклеозидов осуществляют взаимодействием соединения 8-a или 40-a с агентом кросс-сочетания Бухвальда-Хартвига с получением соединения 9-a-1 или 41-a-1 и взаимодействием соединения 9-a-1 или 41-a-1 с 80% трифторуксусной кислотой с получением конечных нуклеозидов I-a-1 или II-a-1, соответственно.
Схема 12:
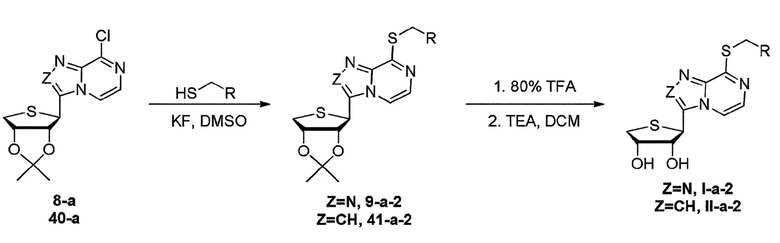
Когда заместитель R1 представляет собой SR, схему 12 берут для синтеза конечных нуклеозидов I-a-2 или II-a-2. Как видно на схеме 12, синтез конечных нуклеозидов осуществляют взаимодействием соединения 8-a или 40-a с KF с получением соединения 9-a-2 или 41-a-2 и взаимодействием соединения 9-a-2 или 41-a-2 с 80% трифторуксусной кислотой и затем добавлением TEA к раствору с получением конечных нуклеозидов I-a-2 или II-a-2, соответственно.
Схема 13:

Когда заместитель R1 представляет собой CH2R, схему 13 берут для синтеза конечных нуклеозидов I-a-3 или II-a-3. Как видно на схеме 13, синтез конечных нуклеозидов осуществляют взаимодействием соединения 8-a или 40-a с реактивом Гриньяра с получением соединения 9-a-3 или 41-a-3 и взаимодействием соединения 9-a-3 или 41-a-3 с 80% трифторуксусной кислотой и затем добавлением TEA к раствору с получением конечных нуклеозидов I-a-3 или II-a-3, соответственно.
Схема 14:
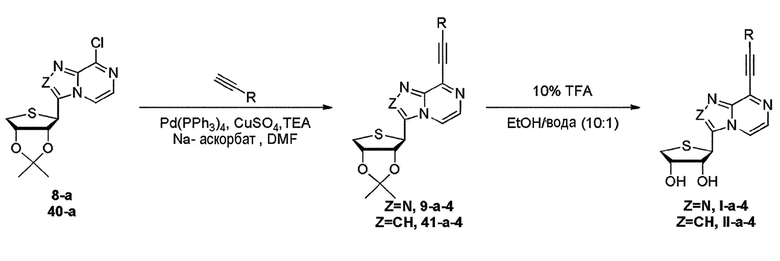
Когда заместитель R1 представляет собой алкинил R, схему 14 берут для синтеза конечных нуклеозидов I-a-4 или II-a-4. Как видно на схеме 14, синтез конечных нуклеозидов осуществляют взаимодействием соединения 8-a или 40-a с реагентом кросс-сочетания Соногашира с получением соединения 9-a-4 или 41-a-4 и взаимодействием соединения 9-a-4 или 41-a-4 с 10% трифторуксусной кислотой с получением конечных нуклеозидов I-a-4 или II-a-4, соответственно.
Схема 15:
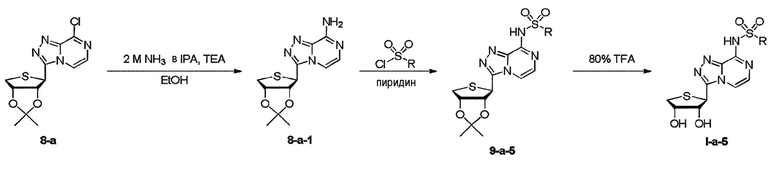
Когда заместитель R1 представляет собой сульфонил R, схему 15 берут для синтеза конечных нуклеозидов I-a-5. Как видно на схеме 15, синтез конечных нуклеозидов осуществляют взаимодействием соединения 8-a с 2M NH3 в IPA с получением соединения 8-a-1, которое может быть связано с сульфонилхлоридом и взаимодействием соединения 9-a-5 с 80% трифторуксусной кислотой с получением конечных нуклеозидов I-a-5, соответственно.
Схема 16:

Когда заместитель R1 представляет собой сульфонил R3, схему 16 берут для синтеза конечных нуклеозидов II-a-5. Как видно на схеме 16, синтез конечных нуклеозидов осуществляют взаимодействием соединения 40-a с сульфонамидом с получением соединения 41-a-5 и взаимодействием соединения 41-a-5 с 80% трифторуксусной кислотой и затем добавлением TEA к раствору с получением конечных нуклеозидов II-a-5, соответственно.
Схема 17:
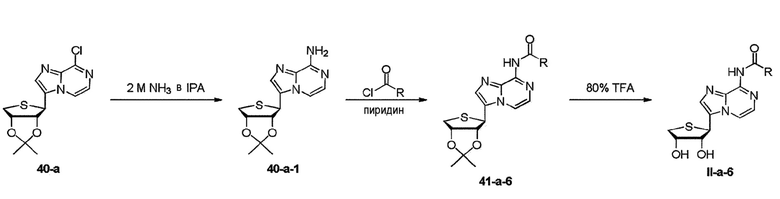
Когда заместитель R1 представляет собой карбонил R, схему 17 берут для синтеза конечных нуклеозидов II-a-6. Как видно на схеме 17, синтез конечных нуклеозидов осуществляют взаимодействием соединения 40-a с 2M NH3 в IPA с получением соединения 40-a-1, которое может быть связано с карбонилхлоридом и взаимодействием соединения 41-a-6 с 80% трифторуксусной кислотой с получением конечных нуклеозидов II-a-6, соответственно.
Медицинское применение и методы лечения
Настоящее изобретение дополнительно предоставляет способы лечения состояния у субъекта, имеющего или восприимчивого к такому состоянию, путем введения субъекту терапевтически эффективного количества одного или более соединений, как описано выше. В одном варианте осуществления лечение является профилактическим лечением. В другом варианте осуществления лечение является паллиативным лечением. В другом варианте осуществления лечение является восстановительным лечением.
1. Состояния
В некоторых вариантах осуществления состояния, которые можно лечить в соответствии с настоящим изобретением, включают, но не ограничиваются ими, глаукому и связанные с глаукомой глазные нарушения. А именно, в другом варианте осуществления предоставляется способ профилактики, облегчения тяжести или лечения состояния, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, где состояние выбрано из группа, состоящая из глаукомы или связанных с глаукомой глазных нарушений. В другом варианте осуществления субъектом является человек. В другом варианте осуществления состояние представляет собой глаукому.
В некоторых вариантах осуществления предлагается способ антагонизации А3-аденозинового рецептора, включающий приведение в контакт клеток с эффективным количеством по меньшей мере одного соединения по настоящему изобретению. В других вариантах осуществления контактирование происходит in vivo.
2. Субъекты
Подходящие субъекты, подлежащие лечению в соответствии с настоящим изобретением, включают млекопитающих. Млекопитающие в соответствии с настоящим изобретением включают, но не ограничиваются ими, человека, собак, кошек, быков, козлов, лошадей, овец, свиней, грызунов, зайцеобразных, приматов и т.п. и охватывают млекопитающих в утробе.
3. Введение и дозы
Соединения по настоящему изобретению обычно вводят в терапевтически эффективном количестве.
Соединения настоящего изобретения можно вводить любым подходящим путем в форме фармацевтической композиции, адаптированной к такому пути, и в дозе, эффективной для предполагаемого лечения. Эффективная доза обычно находится в диапазоне от примерно 0,0001 до примерно 100 мг на кг массы тела в день, предпочтительно от примерно 0,01 до примерно 30 мг/кг/день, в одноразовой или раздельных дозах. В зависимости от возраста, вида и состояния, подлежащего лечению, могут быть подходящими уровни дозы ниже нижнего предела этого диапазона. В других случаях, еще большие дозы могут использоваться без вредных побочных эффектов. Большие дозы также можно разделить на несколько меньших доз для введения в течение дня. Как правило, соответствующее дозирование будет определяться с использованием методов, известных специалисту в данной области (см., например, Remington: The Science and Practice of Pharmacy, Mack Publishing Co., 20th ed., 2000).
В некоторых вариантах осуществления настоящего изобретения предоставляются способы лечения или профилактики глаукомы и/или связанных с глаукомой глазных нарушений у субъекта, включающие введение указанному субъекту терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению, антагониста А3-аденозинового рецептора. В более конкретных вариантах осуществления предоставляются способы лечения глаукомы и/или связанных с глаукомой глазных нарушений у субъекта, включающие введение указанному субъекту эффективного количества указанного соединения(соединений), где соединение(я) вводят путем интравитреальной инъекции. В некоторых вариантах осуществления предоставляются способы лечения глаукомы и/или связанных с глаукомой глазных нарушений у субъекта, включающие введение указанному субъекту эффективного количества соединения, где соединение(я) вводят в жидкой форме при концентрациях примерно 0,001 мг/мл до примерно 0,01 мг/мл, или примерно 0,005 мг/мл до примерно 0,05 мг/мл, или примерно 0,01 мг/мл до примерно 0,1 мг/мл, или примерно 0,05 мг/мл до примерно 0,5 мг/мл, или примерно 0,1 мг/мл до примерно 1,0 мг/мл, или примерно 0,5 мг/мл до примерно 5 мг/мл, или примерно 1,0 мг до примерно 10 мг/мл, или примерно 2 мг/мл до примерно 10 мг/мл, или примерно 5,0 мг/мл до примерно 10 мг/мл, или от примерно 5,0 мг/мл до примерно 15 мг/мл, или примерно 10 мг/мл до примерно 20 мг/мл. В некоторых конкретных вариантах осуществления по меньшей мере одно соединение по настоящему изобретению вводят местно.
Фармацевтические композиции
Для лечения описанных выше состояний соединения, описанные в настоящем документе, могут быть введены следующим образом:
Пероральное введение
Соединения по настоящему изобретению могут вводиться перорально, в том числе путем глотания, так что соединение поступает в желудочно-кишечный тракт или всасываются в кровь непосредственно из полости рта (например, буккальное или сублингвальное введение).
Подходящие композиции для перорального введения включают твердые композиции, такие как таблетки, пастилка для рассасывания и капсулы, которые могут содержать жидкости, гели или порошки.
Композиции для перорального введения могут быть приготовлены в виде композиций с немедленным или модифицированным высвобождением, включая отсроченное или замедленное высвобождение, необязательно с энтеросолюбильным покрытием.
Жидкие составы могут включать растворы, сиропы и суспензии, которые могут быть использованы в мягких или твердых капсулах. Такие составы могут включать фармацевтически приемлемый носитель, например, воду, этанол, полиэтиленгликоль, целлюлозу или масло. Состав может также включать один или более эмульгаторов и/или суспендирующих средств.
В лекарственной форме таблетки количество присутствующего лекарственного средства может составлять от примерно 0,05% до примерно 95% мас., более типично от примерно 2% до примерно 50% мас. лекарственной формы. Кроме того, таблетки могут содержать разрыхлитель, содержащий от примерно 0,5% до примерно 35% мас., более типично от примерно 2% до примерно 25% лекарственной формы. Неограничивающие примеры разрыхлителей включают натрия или кальция карбоксиметилцеллюлозу, натрий кроскармеллозу, поливинилпирролидон, гидроксипропилцеллюлозу, крахмал и тому подобное.
Подходящие лубриканты для применения в таблетке могут присутствовать в количествах от примерно 0,1% до примерно 5% мас. и включают стеариновую кислоту, SiO2, стеарат кальция, цинка или магния, натрий стеарилфумарат и тому подобное.
Подходящие связующие вещества для применения в таблетке включают желатин, полиэтиленгликоль, сахара, камеди, крахмал, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон и тому подобное.
Подходящие разбавители для применения в таблетке включают маннит, ксилит, лактозу, декстрозу, сахарозу, сорбит, микрокристаллическую целлюлозу и крахмал.
Подходящие поверхностно-активные вещества и скользящие вещества для применения в таблетке могут присутствовать в количествах от примерно 0,1% до примерно 3% мас. и включают полисорбат 80, додецилсульфат натрия, тальк и диоксид кремния.
Парентеральное введение
Соединения настоящего изобретения могут вводиться непосредственно в кровоток, мышцы или внутренние органы. Подходящие пути для парентерального введения включают внутривенный, внутримышечный, подкожный внутриартериальный, внутрибрюшинный, интратекальный, внутричерепной и тому подобное. Подходящие устройства для парентерального введения включают инъекторы (включая игольный и безыгольный инъектор) и инфузионный методы.
Композиции для парентерального введения могут быть сформулированы в виде композиций с немедленным или модифицированным высвобождением, включая отсроченное или замедленное высвобождение.
Большинство парентеральных составов представляют собой водные растворы, содержащие эксципиенты, включая соли, буферные агенты и углеводы.
Парентеральные составы также могут быть получены в дегидратированной форме (например, путем лиофилизации) или в виде стерильных неводных растворов. Эти составы можно использовать с подходящим носителем, таким как стерильная вода. Усилители растворимости, также могут быть использованы для получения парентеральных растворов.
Местное глазное введение
В настоящем описании раскрыты составы, содержащие раскрытые соединения в качестве местных офтальмологических растворов (глазных капель), которые обычно доступны в виде стерильного изотонического (то есть значение рН от примерно 3 до примерно 8, от примерно 4 до примерно 8, от примерно 7 до примерно 8 или примерно 7,4) раствора, необязательно дополнительно содержащего консервант. Термин «глазные капли», как используется в настоящем описании, относится к фармацевтической жидкой лекарственной форме, которая вводится в виде капель на наружную поверхность глаза и оказывает местное воздействие на задний сегмент глаза, включая сосудистую оболочку глаза, пигментный эпителий сетчатки, сетчатку, макулу, фовеолярную зону, глазной нерв и стекловидное тело. Соответственно, в некоторых вариантах осуществления соединение, раскрытое в настоящем описании, может быть объединено с очищенной водой и доведено для физиологического рН и изотоничности.
Примерами буферных агентов для поддержания или корректировки рН являются, но не ограничиваются ими, ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы. Примерами регуляторов тоничности являются хлорид натрия, маннит и глицерин.
Затем состав в виде глазных капель необязательно аликвотируют либо в виде множества дискретных стерильных одноразовых картриджей, каждый из которых подходит для одноразового дозирования, или один картридж для единичного дозирования. Таким единичным одноразовым картриджом может быть, например, конический или цилиндрический специальный объемный дозатор с контейнером, имеющим боковые стенки, сжимаемые в радиальном направлении к продольной оси для того, чтобы распределять содержимое контейнера оттуда на одном конце контейнера. Такие одноразовые контейнеры в настоящее время используются для дозирования глазных капель при 0,3-0,4 мл на единицу дозирования и идеально подходят для доставки глазных капель.
Офтальмологические растворы в виде глазных капель также могут быть упакованы в многодозовую форму, например, в виде пластикового флакона с капельницей. В таких составах консерванты необязательно добавляют для предотвращения микробного загрязнения после открытия контейнера. Подходящие консерванты включают, но не ограничиваются ими: бензалкония хлорид, тимеросал, хлорбутанол, метилпарабен, пропилпарабен, фенилэтиловый спирт, динатрия эдетат, сорбиновую кислоту, поликватерниум-1 или другие средства, известные специалистам в данной области, и все из которых предназначены для использования в настоящем изобретении. Содержащие консервант составы могут содержать от примерно 0,001 до примерно 1,0% мас./объем консерванта.
В некоторых вариантах осуществления полимеры могут быть добавлены в офтальмические растворы для увеличения вязкости носителя, тем самым продлевая контакт раствора с роговицей и увеличивая биодоступность. В некоторых вариантах осуществления такие полимеры выбирают из производных целлюлозы (например, метилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы или карбоксиметилцеллюлозы), декстрана 70, желатина, полиолов, глицерина, полиэтиленгликоля 300, полиэтиленгликоля 400, полисорбата 80, пропиленгликоля, поливинилового спирта и повидона, или их комбинации.
В некоторых вариантах осуществления офтальмологические растворы, описанные в настоящем документе, могут дополнительно содержать стабилизатор/солюбилизатор, такой как циклодекстрин. В некоторых таких вариантах осуществления циклодекстрин выбран из α-циклодекстрина, β-циклодекстрина, γ-циклодекстрина, гидроксипропил-β-циклодекстрина, гидроксипропил-γ-циклодекстрина, диметил-β-циклодекстрина и диметил-γ-циклодекстрина.
В некоторых вариантах осуществления соединение, описанное в настоящем документе, можно вводить в лекарственной форме офтальмологического раствора с замедленным высвобождением.
В некоторых вариантах осуществления соединение, раскрытое в настоящем документе, можно вводить посредством системы доставки глазных лекарственных средств, такой как, но не ограничиваясь этим, коллоидные лекарственные формы, такие как наночастицы, наномицеллы, липосомы, микроэмульсии, биоадгезивные гели и основанные на фибринновом клее подходы к поддержанию уровня лекарственного средства на целевом участке. Другие системы доставки глазных лекарственных средств включают контактные линзы с покрытием лекарственным средством, опосредованную ультразвуком доставку лекарственного средства, глазной ионтофорез и микроиглы с лекарственным покрытием.
В некоторых вариантах осуществления частота введения может сильно варьироваться в зависимости от потребностей каждого субъекта и тяжести заболевания, подлежащего лечению, такое введение может составлять от одного раза в неделю до десяти раз в день, например, от примерно трех раз в неделю до трех раз в день или один или два раза в день.
Комбинации и комбинированная терапия
Соединения настоящего изобретения могут использоваться отдельно или в комбинации с другими фармацевтически активными соединениями для лечения таких состояний, как ранее описанные выше. Соединение(я) настоящего изобретения и другое фармацевтически активное соединение(я) можно вводить одновременно (либо в той же лекарственной форме, либо в отдельных лекарственных формах) или последовательно. Соответственно, в одном варианте осуществления настоящее изобретение включает способы лечения состояния путем введения субъекту терапевтически эффективного количества одного или нескольких соединений настоящего изобретения и одного или нескольких дополнительных фармацевтически активных соединений.
В другом варианте осуществления предложена фармацевтическая композиция, содержащая одно или более соединений настоящего изобретения, одно или более дополнительных фармацевтически активных соединений и фармацевтически приемлемый носитель, эксципиент или разбавитель.
В другом варианте осуществления одно или более дополнительных фармацевтически активных соединений выбраны из группы, состоящей из аналога простагландина, антагониста бета-адренергического рецептора, альфа-2-адренергического агониста, ингибитора карбоангидразы, миотического средства, моноклонального антитела, кортикостероида, глюкокортикоида, ингибитора киназы, мидриатика и антиметаболита, или их комбинации.
В некоторых вариантах осуществления другим лекарственным средством является лазерная терапия.
Терапевтически эффективные дозы варьируют, когда лекарственные средства используют в комбинациях лечениях. Методы экспериментального определения терапевтически эффективных доз лекарственных средств и других средств для применения в режимах комбинированного лечения являются документально подтвержденными методологиями. Комбинированное лечение дополнительно включает периодические терапии, которые начинаются и останавливаются в разное время, чтобы помочь в клиническом лечении пациента. В любом случае множественные терапевтические средства (одно из которых представляет собой антагонист А3-аденозиновый рецептор, как описано в настоящем документе) вводят в любом порядке или даже одновременно. Если одновременно, несколько терапевтических средств необязательно предоставляются в единичной единой форме или в нескольких формах (только в качестве примера, либо в виде одной таблетки, либо в виде двух отдельных таблеток).
В некоторых вариантах осуществления одно из терапевтических средств вводят в нескольких дозах или оба назначают в виде нескольких доз. Если не одновременно, выбор времени между несколькими дозами может варьироваться от более чем ноль недель до менее двенадцати недель.
Кроме того, комбинированные методы, композиции и составы не должны ограничиваться применением только двух средств, также предусматривается применение нескольких терапевтических комбинаций. Понятно, что режим дозировки для лечения, предотвращения или улучшения состояния(ий), для которого требуется облегчение, необязательно модифицируется в соответствии с различными факторами. Эти факторы включают заболевание, от которого страдает субъект, а также возраст, массу, пол, питание и состояние здоровья субъекта. Таким образом, фактически применяемый режим дозирования широко варьируется в некоторых вариантах и поэтому отклоняется от режимов дозирования, изложенных в настоящем документе.
Фармацевтические средства, которые составляют комбинированную терапию, описанную в настоящем документе, являются необязательно комбинированной лекарственной формой или отдельными лекарственными формами, предназначенными для одновременного применения. Фармацевтические средства, которые составляют комбинированную терапию, необязательно также вводят последовательно, причем любое средство вводится режимом, требующим двухэтапное введение. Двухэтапный режим введения необязательно требует последовательного введения активных средств или разнесенного введения отдельных активных средств. Период времени между несколькими стадиями введения составляет от нескольких минут до нескольких часов в зависимости от свойств каждого фармацевтического средства, такого как удельная активность, растворимость, биодоступность, период полувыведения из плазмы и кинетический профиль фармацевтического средства. Для определения оптимального интервала дозы необязательно используется суточная вариация концентрации целевой молекулы.
Таким образом, предоставляется фармацевтическая композиция для применения при профилактике, облегчении тяжести или лечении глаукомы или связанных с глаукомой глазных нарушений, содержащая (а) соединение(ия) по настоящему изобретению и (b) терапевтически эффективное количество активного фармацевтического ингредиента, как указано выше. Кроме того, предложен способ профилактики, облегчения тяжести или лечения глаукомы или связанных с глаукомой глазных нарушений, включающий введение субъекту, нуждающемуся в этом, (а) терапевтически эффективного количества соединения по настоящему изобретению и (b) введение субъекту, нуждающемуся в этом, терапевтически эффективного количества активного фармацевтического ингредиента, как указано выше.
Полезные эффекты изобретения
В одном аспекте предлагаются соединения, которые являются эффективными в качестве антагониста А3-аденозинового рецептора, пригодного для профилактики, облегчения тяжести или лечения глаукомы, связанных с глаукомой глазных нарушений или воспалительных заболеваний. В другом аспекте предложен способ получения соединения(ий) по настоящему изобретению. В еще одном аспекте предложена фармацевтическая композиция для профилактики, облегчения тяжести или лечения глаукомы, связанных с глаукомой глазных нарушений и воспалительных заболеваний, содержащая по меньшей мере одно из таких соединений, являющихся антагонистами А3-аденозинового рецептора, по настоящему изобретению в качестве активного ингредиента. В еще одном аспекте предложен способ профилактики, облегчения тяжести или лечения глаукомы, связанных с глаукомой глазных нарушений или воспалительных заболеваний, включающий введение терапевтически эффективного количества соединения(ий) по настоящему изобретению. В еще одном аспекте предложен способ антагонизации А3-аденозинового рецептора соединением(ями) в соответствии с настоящим изобретением.
Способ осуществления изобретения
Далее будут подробно описаны предпочтительные варианты осуществления настоящего изобретения. До описания, следует понимать, что термины, используемые в описании и прилагаемой формуле изобретения, не должны толковаться как ограниченные общим и словарным значениями, а должны толковаться на основе значений и понятий, соответствующих техническим аспектам настоящего изобретения, исходя из принципа, согласно которому изобретателю разрешено определять условия надлежащим образом для лучшего объяснения. Следовательно, описание, предлагаемое в настоящем документе, является лишь предпочтительным примером для целей иллюстраций, не предназначенным для ограничения объема изобретения, поэтому следует понимать, что в него могут быть внесены другие эквиваленты и изменения, не выходящие за рамки раскрытия.
Примеры синтеза
Некоторые варианты осуществления настоящего изобретения синтезировали следующим образом:
Пример 1: Синтез (2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
СТАДИЯ 1 Получение соединения (3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-карбальдегида
К суспензии силикагеля (20 г) в DCM (100 мл) добавляли суспензию NaIO4 (4,4 г, 20,4 ммоль) в H2O (5 мл) с постоянным перемешиванием при комнатной температуре. Смесь охлаждали на ледяной бане и обрабатывали суспензией (S)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этан-1,2-диола (3 г, 13,6 ммоль) в DCM и ход реакции контролировали с помощью ТСХ до исчезновения исходного материала (4 ч). Смесь фильтровали через слой целита, отфильтрованный осадок промывали DCM и концентрировали в вакууме. Остаток очищали с помощью ЖХСД на SiO2 (Гексан:EtOAc=9:1-3:1) с получением (3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-карбальдегида (1,6 г, 62%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 9,38 (с, 1H), 7,28 (с, 1H), 5,13 (д, J=5,5 Гц, 1H), 4,96-4,92 (м, 1H), 3,95 (с, 1H), 2,93-2,87 (м, 1H), 2,65 (дд, J=13,3, 4,1 Гц, 1H), 1,54 (с, 3H), 1,35 (с, 3H).
СТАДИЯ 2 Получение соединения 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина
К раствору (3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-карбальдегида (1,75 г, 9,3 ммоль) в DCM (55 мл) добавляли 2-хлор-3-гидразинилпиразин (1,34 г, 9,3 ммоль) (красная суспензия). Смесь перемешивали при комнатной температуре и контролировали с помощью ТСХ до исчезновения исходного материала (3 ч). После охлаждения на ледяной бане смесь обрабатывали PhI(OAc)2 (4,49 г, 13,94 ммоль) и перемешивали в течение 4 ч при комнатной температуре. Реакционную смесь промывали насыщ. водн. раствором NaHCO3 и насыщенным солевым раствором, сушили над Na2SO4 и фильтровали. Органический слой концентрировали в вакууме до очищения с помощью ЖХСД на SiO2 (Гексан:EtOAc=9:1-1:1) с получением 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина (28,6 г, 89%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 7,85 (д, J=4,4 Гц, 1H), 7,75 (д, J=4,8 Гц, 1H), 6,55 (ушир.с, 1H), 5,67 (д, J= 5,6 Гц, 1H), 5,28 (м, 1H), 4,82 (т, J=4,4 Гц, 1H), 4,56 (с, 1H), 2,98 (д, J=2,8 Гц, 2H), 1,59 (с, 3H), 1,41 (с, 3H).
СТАДИЯ 3 Получение соединения N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-амина
Раствор 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина (500 мг, 1,60 ммоль), (3-хлорфенил)метанамина (0,39 мл, 3,2 ммоль) и TEA (0,68 мл, 4,8 ммоль) в EtOH (8,0 мл) перемешивали при 80°C в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли DCM и промывали водой и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью ЖХСД на SiO2 (2~5% MeOH в DCM) с получением N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-амина (2,40 г, 90%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 7,41 (м, 2H), 7,27 (м, 3H), 7,24 (д, J=4,8 Гц, 1H), 5,75 (д, J= 5,2 Гц, 1H), 5,31 (т, J=4,0 Гц, 1H), 4,62 (с, 1H), 2,95 (м, 2H), 1,59 (с, 3H), 1,42 (с, 3H).
СТАДИЯ 4 Получение соединения (2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
Раствор N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (2,40 г, 5,76 ммоль) в 80% водн. TFA (46 мл) перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали в вакууме. Остаток разбавляли DCM, и затем TEA добавляли к раствору до значения pH 7. Смесь перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (EtOAc:MeOH=10:1) с получением (2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (1,95 г, 90%) в виде белого твердого вещества.
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,66 (д, J= 5,2 Гц, 1H), 7,42-7,23 (м, 5H), 4,78 (с, 2H), 4,74 (дд, J=3,6, 8,0 Гц, 1H), 4,54 (дд, J=3,6, 7,6 Гц, 1H), 3,37 (дд, J=4,4, 11,2 Гц, 1H), 2,97 (дд, J=3,2, 11,2 Гц, 1H).
LC-MS MS(EI) для C16H16ClN5O2S [M+H]+, (Рассч.: 377,85) Найдено: 378,2.
Пример 2: Синтез (2S,3R,4S)-2-(8-(метиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,14 (кв, J=4,7 Гц, 1H), 7,66 (д, J=4,8 Гц, 1H), 7,30 (д, J=4,8 Гц, 1H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,4 Гц, 1H), 4,76 (д, J=7,1 Гц, 1H), 4,66-4,60 (м, 1H), 4,44-4,38 (м, 1H), 3,25 (дт, J=10,6, 5,4 Гц, 1H), 2,95 (д, J=4,7 Гц, 3H), 2,82 (дд, J=10,7, 3,8 Гц, 1H).
LC-MS MS(EI) для C10H13N5O2S [M+H]+, (Рассч.: 267,08) Найдено: 268,1.
Пример 3: Синтез (2S,3R,4S)-2-(8-(пиперидин-1-ил)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,70 (д, J=4,7 Гц, 1H), 7,34 (д, J=4,6 Гц, 1H), 5,37 (д, J=44,9 Гц, 2H), 4,77 (д, J=6,9 Гц, 1H), 4,66 (дд, J=6,8, 3,0 Гц, 1H), 4,42 (д, J=3,5 Гц, 1H), 4,22 (с, 4H), 3,23 (дд, J=10,6, 4,7 Гц, 1H), 2,83 (дд, J=10,6, 4,0 Гц, 1H), 1,68 (д, J=4,7 Гц, 2H), 1,60 (д, J=3,8 Гц, 4H).
LC-MS MS(EI) для C14H19N5O2S [M+H]+, (Рассч.: 321,13) Найдено: 322,1.
Пример 4: Синтез (2S,3R,4S)-2-(8-морфолино-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,80 (д, J=4,7 Гц, 1H), 7,38 (д, J=4,7 Гц, 1H), 5,43 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,3 Гц, 1H), 4,79 (д, J=7,0 Гц, 1H), 4,65 (тд, J=6,3, 3,4 Гц, 1H), 4,45-4,36 (м, 1H), 4,22 (с, 4H), 3,80-3,66 (м, 4H), 3,24 (дд, J=10,7, 4,7 Гц, 1H), 2,83 (дд, J=10,6, 3,9 Гц, 1H).
LC-MS MS(EI) для C13H17N5O3S [M+H]+, (Рассч.: 323,11) Найдено: 324,1.
Пример 5: Синтез (2S,3R,4S)-2-(8-(бензиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,76 (с, 1H), 7,68 (д, J=4,8 Гц, 1H), 7,41-7,17 (м, 6H), 5,42 (д, J=5,9 Гц, 1H), 5,31 (д, J=3,5 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,68 (д, J=6,0 Гц, 2H), 4,65-4,58 (м, 1H), 4,46-4,37 (м, 1H), 3,25 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,6 Гц, 1H).
LC-MS MS(EI) для C16H17N5O2S [M+H]+, (Рассч.: 343,11) Найдено: 344,1.
Пример 6: Синтез (2S,3R,4S)-2-(8-((3-иодбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,80 (т, J=6,1 Гц, 1H), 7,73 (с, 1H), 7,70 (д, J=4,8 Гц, 1H), 7,58 (д, J=7,8 Гц, 1H), 7,36 (д, J=7,7 Гц, 1H), 7,26 (д, J=4,8 Гц, 1H), 7,11 (т, J=7,8 Гц, 1H), 5,43 (д, J=5,9 Гц, 1H), 5,31 (д, J=4,3 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,63 (д, J=6,5 Гц, 3H), 4,44-4,38 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H16IN5O2S [M+H]+, (Рассч.: 469,01) Найдено: 470,0.
Пример 7: Синтез (2S,3R,4S)-2-(8-((циклопропилметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,23 (т, J=4,7 Гц, 1H), 7,65 (д, J=4,8 Гц, 1H), 7,27 (д, J=4,8 Гц, 1H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,4 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,63 (ддд, J=9,6, 6,7, 3,3 Гц, 1H), 4,44-4,37 (м, 1H), 3,25 (дд, J=10,7, 4,5 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 1,27-1,12 (м, 2H), 0,47-0,38 (м, 2H), 0,31-0,23 (м, 2H).
LC-MS MS(EI) для C13H17N5O2S [M+H]+, (Рассч.: 307,11) Найдено: 308,1.
Пример 8: Синтез (2S,3R,4S)-2-(8-(циклобутиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,40 (д, J=7,5 Гц, 2H), 7,65 (д, J=4,8 Гц, 2H), 7,26 (д, J=4,8 Гц, 2H), 5,41 (д, J=6,1 Гц, 2H), 5,30 (д, J=4,4 Гц, 2H), 4,76 (д, J=7,2 Гц, 2H), 4,69-4,54 (м, 4H), 4,45-4,36 (м, 2H), 3,25 (дд, J=10,6, 4,5 Гц, 2H), 2,81 (дд, J=10,6, 3,7 Гц, 2H), 2,23 (дд, J=13,2, 5,3 Гц, 5H), 2,20-2,08 (м, 4H), 1,75-1,60 (м, 4H).
LC-MS MS(EI) для C13H17N5O2S [M+H]+, (Рассч.: 307,11) Найдено: 308,1.
Пример 9: Синтез (2S,3R,4S)-2-(8-((3-(трифторметил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,87 (т, J=6,2 Гц, 1H), 7,76-7,69 (м, 2H), 7,66 (д, J=7,5 Гц, 1H), 7,56 (дт, J=15,3, 7,8 Гц, 2H), 7,26 (д, J=4,8 Гц, 1H), 5,42 (д, J=5,8 Гц, 1H), 5,31 (д, J=3,8 Гц, 1H), 4,77 (т, J=7,1 Гц, 3H), 4,63 (дд, J=9,0, 6,6 Гц, 1H), 4,44-4,38 (м, 1H), 3,25 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C17H16F3N5O2S [M+H]+, (Рассч.: 411,10) Найдено: 412,1.
Пример 10: Синтез (2S,3R,4S)-2-(8-((тиофен-3-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,65 (т, J=6,3 Гц, 1H), 7,68 (д, J=4,7 Гц, 1H), 7,49-7,39 (м, 1H), 7,34-7,25 (м, 2H), 7,11 (д, J=4,2 Гц, 1H), 5,42 (д, J=5,6 Гц, 1H), 5,30 (д, J=3,3 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,72-4,57 (м, 3H), 4,40 (с, 1H), 3,25 (дд, J=10,6, 4,4 Гц, 1H), 2,84-2,77 (м, 1H).
LC-MS MS(EI) для C14H15N5O2S2 [M+H]+, (Рассч.: 349,07) Найдено: 350,1.
Пример 11: Синтез (2S,3R,4S)-2-(8-(фенетиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,22 (т, J=5,8 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,34-7,22 (м, 5H), 7,22-7,16 (м, 1H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,4 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,66-4,59 (м, 1H), 4,44-4,37 (м, 1H), 3,70 (дд, J=13,6, 6,5 Гц, 2H), 3,25 (дд, J=10,7, 4,6 Гц, 1H), 2,94 (т, J=7,5 Гц, 2H), 2,82 (дд, J=10,6, 3,7 Гц, 1H).
LC-MS MS(EI) для C17H19N5O2S [M+H]+, (Рассч.: 357,13) Найдено: 358,1.
Пример 12: Синтез (2S,3R,4S)-2-(8-((3-метилбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,72 (т, J=6,2 Гц, 1H), 7,68 (д, J=4,8 Гц, 1H), 7,26 (д, J=4,8 Гц, 1H), 7,15 (м, 3H), 7,02 (д, J=7,2 Гц, 1H), 5,43 (д, J=6,1 Гц, 1H), 5,32 (д, J=4,3 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,69-4,60 (м, 3H), 4,44-4,38 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 2,26 (с, 3H).
LC-MS MS(EI) для C17H19N5O2S [M+H]+, (Рассч.: 357,13) Найдено: 358,1.
Пример 13: Синтез (2S,3R,4S)-2-(8-((3-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,77 (т, J=6,4 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,30 (м, 1H), 7,22 (д, J=4,8 Гц, 1H), 7,18-7,09 (м, 2H), 7,00 (м, 1H), 5,40 (д, J=4,9 Гц, 1H), 5,28 (д, J=3,1 Гц, 1H), 4,74 (д, J=7,1 Гц, 1H), 4,65 (д, J=6,1 Гц, 2H), 4,59 (с, 1H), 4,37 (с, 1H), 3,22 (дд, J=10,7, 4,5 Гц, 1H), 2,78 (дд, J=10,6, 3,5 Гц, 1H).
LC-MS MS(EI) для C16H16FN5O2S [M+H]+, (Рассч.: 361,10) Найдено: 362,1.
Пример 14: Синтез (2S,3R,4S)-2-(8-((3-(трифторметокси)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,84 (т, J=6,0 Гц, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,47-7,32 (м, 3H), 7,26 (д, J=4,8 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 5,43 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,4 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,72 (д, J=6,2 Гц, 2H), 4,66-4,59 (м, 1H), 4,46-4,37 (м, 1H), 3,26 (дд, J=10,6, 4,5 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C17H16F3N5O3S [M+H]+, (Рассч.: 427,09) Найдено: 428,1.
Пример 15: Синтез (2S,3R,4S)-2-(8-((3-метоксибензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,72 (т, J=6,2 Гц, 1H), 7,68 (д, J=4,8 Гц, 1H), 7,26 (д, J=4,8 Гц, 1H), 7,20 (т, J=7,8 Гц, 1H), 6,95-6,89 (м, 2H), 6,81-6,75 (м, 1H), 5,42 (с, 1H), 5,31 (с, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,69-4,59 (м, 3H), 4,41 (с, 1H), 3,71 (с, 3H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,6, 3,5 Гц, 1H).
LC-MS MS(EI) для C17H19N5O3S [M+H]+, (Рассч.: 373,12) Найдено: 374,1.
Пример 16: Синтез 3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)бензонитрила
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,83 (т, J=6,1 Гц, 1H), 7,79 (с, 1H), 7,70 (т, J=6,9 Гц, 3H), 7,52 (т, J=7,7 Гц, 1H), 7,26 (д, J=4,8 Гц, 1H), 5,42 (с, 1H), 5,32 (с, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,72 (д, J=6,0 Гц, 2H), 4,63 (с, 1H), 4,41 (с, 1H), 3,26 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C17H16N6O2S [M+H]+, (Рассч.: 368,11) Найдено: 369,1.
Пример 17: Синтез (2S,3R,4S)-2-(8-((3-бромбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,82 (т, J=6,1 Гц, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,54 (с, 1H), 7,41 (д, J=7,9 Гц, 1H), 7,35 (д, J=7,9 Гц, 1H), 7,30-7,23 (м, 2H), 5,44 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,4 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,67 (д, J=6,1 Гц, 2H), 4,65-4,59 (м, 1H), 4,44-4,38 (м, 1H), 3,26 (дд, J=10,7, 4,5 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H16BrN5O2S [M+H]+, (Рассч.: 421,02) Найдено: 422,0.
Пример 18: Синтез (2S,3R,4S)-2-(8-((циклогексилметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,18 (т, J=6,0 Гц, 1H), 7,63 (д, J=4,8 Гц, 1H), 7,27 (д, J=4,8 Гц, 1H), 5,43 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,3 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,67-4,59 (м, 1H), 4,45-4,37 (м, 1H), 3,25 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 1,75-1,57 (м, 6H), 1,21-1,09 (м, 3H), 1,00-0,86 (м, 2H).
LC-MS MS(EI) для C16H23N5O2S [M+H]+, (Рассч.: 349,16) Найдено: 350,1.
Пример 19: Синтез (2S,3R,4S)-2-(8-(циклопентиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,04 (д, J=7,4 Гц, 1H), 7,64 (д, J=4,8 Гц, 1H), 7,28 (д, J=4,8 Гц, 1H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,3 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,68-4,54 (м, 1H), 4,50-4,33 (м, 2H), 3,25 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 2,01-1,85 (м, 2H), 1,76-1,59 (м, 4H), 1,59-1,48 (м, 2H).
LC-MS MS(EI) для C14H19N5O2S [M+H]+, (Рассч.: 321,13) Найдено: 322,1.
Пример 20: Синтез (2S,3R,4S)-2-(8-(циклогексиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,90 (д, J=8,2 Гц, 1H), 7,64 (д, J=4,8 Гц, 1H), 7,27 (д, J=4,8 Гц, 1H), 5,42 (д, J=6,0 Гц, 1H), 5,31 (д, J=4,3 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,66-4,59 (м, 1H), 4,44-4,38 (м, 1H), 4,04 (с, 1H), 3,29-3,22 (м, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 1,88 (д, J=12,2 Гц, 2H), 1,74 (д, J=13,1 Гц, 2H), 1,62 (д, J=12,4 Гц, 1H), 1,49-1,07 (м, 6H).
LC-MS MS(EI) для C15H21N5O2S [M+H]+, (Рассч.: 335,14) Найдено: 336,1.
Пример 21: Синтез (2S,3R,4S)-2-(8-((пиридин-3-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диол 2,2,2-трифторуксусной кислоты
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,83 (т, J=6,2 Гц, 1H), 8,58 (д, J=1,7 Гц, 1H), 8,42 (дд, J=4,8, 1,5 Гц, 1H), 7,75 (д, J=7,9 Гц, 1H), 7,70 (д, J=4,8 Гц, 1H), 7,32 (дд, J=7,8, 4,7 Гц, 1H), 7,27 (д, J=4,8 Гц, 1H), 5,43 (д, J=6,1 Гц, 1H), 5,32 (д, J=4,3 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,69 (д, J=6,2 Гц, 2H), 4,65-4,58 (м, 1H), 4,43-4,38 (м, 1H), 3,30-3,22 (м, 1H), 2,81 (дд, J=10,6, 3,6 Гц, 1H).
LC-MS MS(EI) для C15H16N6O2S [M+H]+, (Рассч.: 344,11) Найдено: 345,1.
Пример 22: Синтез (2S,3R,4S)-2-(8-((пиридин-4-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диол 2,2,2-трифторуксусной кислоты
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,86 (т, J=6,3 Гц, 1H), 8,46 (дд, J=4,4, 1,6 Гц, 2H), 7,72 (д, J=4,8 Гц, 1H), 7,31 (д, J=5,9 Гц, 2H), 7,23 (д, J=4,8 Гц, 1H), 5,44 (д, J=6,1 Гц, 1H), 5,33 (д, J=4,3 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,69 (д, J=6,0 Гц, 2H), 4,67-4,59 (м, 1H), 4,45-4,38 (м, 1H), 3,30-3,23 (м, 1H), 2,82 (дд, J=10,6, 3,6 Гц, 1H).
LC-MS MS(EI) для C15H16N6O2S [M+H]+, (Рассч.: 344,11) Найдено: 345,1.
Пример 23: Синтез (2S,3R,4S)-2-(8-((фуран-3-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,49 (т, J=6,6 Гц, 1H), 7,67 (д, J=4,7 Гц, 1H), 7,55 (д, J=6,7 Гц, 2H), 7,29 (д, J=4,7 Гц, 1H), 6,48 (с, 1H), 5,40 (д, J=6,1 Гц, 1H), 5,29 (д, J=4,4 Гц, 1H), 4,76 (д, J=7,1 Гц, 1H), 4,65-4,58 (м, 1H), 4,49 (д, J=5,7 Гц, 2H), 4,43-4,36 (м, 1H), 3,24 (дд, J=10,6, 4,6 Гц, 1H), 2,81 (дд, J=10,3, 3,3 Гц, 1H).
LC-MS MS(EI) для C14H15N5O3S [M+H]+, (Рассч.: 333,09) Найдено: 334,1.
Пример 24: Синтез (2S,3R,4S)-2-(8-((3-хлорфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,26 (т, J=5,7 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,34 (дд, J=5,0, 3,4 Гц, 1H), 7,32-7,28 (м, 2H), 7,28-7,19 (м, 2H), 5,43 (д, J=6,1 Гц, 1H), 5,32 (д, J=4,4 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,66-4,59 (м, 1H), 4,43-4,37 (м, 1H), 3,71 (дд, J=12,6, 6,5 Гц, 2H), 3,25 (дд, J=10,6, 4,6 Гц, 1H), 2,96 (т, J=7,2 Гц, 2H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C17H18ClN5O2S [M+H]+, (Рассч.: 391,09) Найдено: 392,1.
Пример 25: Синтез (2S,3R,4S)-2-(8-((3-бромфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,26 (т, J=5,2 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,48 (с, 1H), 7,40-7,35 (м, 1H), 7,30 (д, J=4,8 Гц, 1H), 7,24 (д, J=6,2 Гц, 2H), 5,43 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,4 Гц, 1H), 4,76 (д, J=7,1 Гц, 1H), 4,65-4,59 (м, 1H), 4,45-4,36 (м, 1H), 3,70 (дд, J=12,9, 5,1 Гц, 2H), 3,25 (дд, J=10,6, 4,6 Гц, 1H), 2,95 (т, J=7,2 Гц, 2H), 2,81 (дд, J=10,6, 3,8 Гц, 1H).
LC-MS MS(EI) для C17H18BrN5O2S [M+H]+, (Рассч.: 435,04) Найдено: 436,0.
Пример 26: Синтез (2S,3R,4S)-2-(8-((3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,24 (т, J=5,6 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,36-7,27 (м, 2H), 7,10 (т, J=7,7 Гц, 2H), 7,06-6,97 (м, 1H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,4 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,66-4,59 (м, 1H), 4,44-4,38 (м, 1H), 3,72 (дд, J=13,2, 6,7 Гц, 2H), 3,29-3,22 (м, 1H), 2,97 (т, J=7,2 Гц, 2H), 2,82 (дд, J=10,7, 3,8 Гц, 1H).
LC-MS MS(EI) для C17H18FN5O2S [M+H]+, (Рассч.: 375,12) Найдено: 376,1.
Пример 27: Синтез (2S,3R,4S)-2-(8-((2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,61 (с, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,27 (дд, J=12,1, 6,0 Гц, 2H), 7,16 (д, J=6,6 Гц, 2H), 5,37 (с, 2H), 4,76 (д, J=7,2 Гц, 1H), 4,61 (дд, J=7,0, 3,0 Гц, 1H), 4,39 (дд, J=7,3, 3,8 Гц, 1H), 3,25 (дд, J=10,7, 4,6 Гц, 1H), 3,20-3,12 (м, 1H), 2,81 (дд, J=10,7, 3,7 Гц, 1H), 2,16-2,08 (м, 1H), 1,50 (дт, J=13,9, 4,7 Гц, 1H), 1,25 (дт, J=10,3, 5,0 Гц, 1H).
LC-MS MS(EI) для C18H19N5O2S [M+H]+, (Рассч.: 369,13) Найдено: 370,1.
Пример 28: Синтез (2S,3R,4S)-2-(8-((2-(3-хлорфенил)пропан-2-ил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,99 (с, 1H), 7,64 (д, J=4,8 Гц, 1H), 7,42 (т, J=1,7 Гц, 1H), 7,38-7,34 (м, 1H), 7,28 (т, J=7,8 Гц, 1H), 7,24-7,20 (м, 1H), 7,08 (д, J=4,8 Гц, 1H), 5,51-5,30 (м, 2H), 4,77 (д, J=7,3 Гц, 1H), 4,61 (дд, J=7,2, 3,3 Гц, 1H), 4,42-4,37 (м, 1H), 3,26 (дд, J=10,8, 4,6 Гц, 1H), 2,81 (дд, J=10,7, 3,5 Гц, 1H), 1,78 (с, 6H).
LC-MS MS(EI) для C18H20ClN5O2S [M+H]+, (Рассч.: 405,10) Найдено: 406,1.
Пример 29: Синтез (2S,3R,4S)-2-(8-((1-(3-хлорфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 9,05 (с, 1H), 7,73 (д, J=4,8 Гц, 1H), 7,30-7,12 (м, 5H), 5,45 (д, J=5,0 Гц, 1H), 5,34 (д, J=3,8 Гц, 1H), 4,79 (д, J=7,3 Гц, 1H), 4,63 (с, 1H), 4,41 (с, 1H), 3,27 (дд, J=10,6, 4,4 Гц, 1H), 2,82 (дд, J=10,7, 3,6 Гц, 1H), 1,36 (с, 4H).
LC-MS MS(EI) для C18H18ClN5O2S [M+H]+, (Рассч.: 403,09) Найдено: 404,1.
Пример 30: Синтез (2S,3R,4S)-2-(8-((3-хлорфенил)этинил)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,99-7,93 (м, 2H), 7,67-7,54 (м, 3H), 7,18 (д, J=5,2 Гц, 1H), 6,89 (с, 1H), 5,49 (д, J=6,0 Гц, 1H), 5,36 (д, J=4,4 Гц, 1H), 4,74 (д, J=7,2 Гц, 1H), 4,63-4,55 (м, 1H), 4,45-4,38 (м, 1H), 3,28-3,22 (м, 1H), 2,83 (дд, J=10,8, 3,5 Гц, 1H).
LC-MS MS(EI) для C17H13ClN4O2S [M+H]+, (Рассч.: 372,04) Найдено: 373,0.
Пример 31: Синтез (2S,3R,4S)-2-(8-(циклопропиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,33 (д, J=4,0 Гц, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,33 (д, J=4,8 Гц, 1H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,4 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,63 (ддд, J=7,2, 6,2, 3,2 Гц, 1H), 4,40 (дт, J=8,1, 4,0 Гц, 1H), 3,25 (дд, J=10,6, 4,5 Гц, 1H), 2,98-2,90 (м, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 0,72 (д, J=7,3 Гц, 2H), 0,66 (д, J=3,8 Гц, 2H).
LC-MS MS(EI) для C12H15N5O2S [M+H]+, (Рассч.: 293,09) Найдено: 294,1.
Пример 32: Синтез (2S,3R,4S)-2-(8-(изопентиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,13 (т, J=5,8 Гц, 1H), 7,63 (д, J=4,8 Гц, 1H), 7,28 (д, J=4,8 Гц, 1H), 5,43 (д, J=5,9 Гц, 1H), 5,32 (д, J=4,0 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,63 (тд, J=6,6, 3,3 Гц, 1H), 4,45-4,37 (м, 1H), 3,48 (дд, J=13,5, 6,2 Гц, 2H), 3,25 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 1,62 (тд, J=13,2, 6,6 Гц, 1H), 1,51 (дд, J=14,3, 7,0 Гц, 2H), 0,91 (д, J=6,6 Гц, 6H).
LC-MS MS(EI) для C14H21N5O2S [M+H]+, (Рассч.: 323,14) Найдено: 324,1.
Пример 33: Синтез (2S,3R,4S)-2-(8-((2-морфолиноэтил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,95 (т, J=5,7 Гц, 2H), 7,67 (д, J=4,8 Гц, 2H), 7,29 (д, J=4,8 Гц, 2H), 5,44 (д, J=5,9 Гц, 2H), 5,33 (д, J=4,2 Гц, 2H), 4,77 (д, J=7,2 Гц, 2H), 4,63 (тд, J=7,1, 3,4 Гц, 2H), 4,44-4,38 (м, 2H), 3,58 (дт, J=9,1, 5,5 Гц, 12H), 3,25 (дд, J=10,6, 4,6 Гц, 2H), 2,82 (дд, J=10,7, 3,7 Гц, 2H), 2,56 (т, J=6,7 Гц, 5H), 2,43 (д, J=3,8 Гц, 8H).
LC-MS MS(EI) для C15H22N6O3S [M+H]+, (Рассч.: 366,15) Найдено: 367,1.
Пример 34: Синтез 3-хлор-N-(3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)бензолсульфонамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 11,78 (с, 1H), 8,00 (т, J=1,7 Гц, 1H), 7,92 (д, J=7,9 Гц, 1H), 7,79 (д, J=5,2 Гц, 1H), 7,73 (д, J=7,7 Гц, 1H), 7,62 (т, J=7,8 Гц, 1H), 7,07 (д, J=5,0 Гц, 1H), 5,45 (д, J=5,8 Гц, 1H), 5,33 (д, J=4,0 Гц, 1H), 4,73 (д, J=7,0 Гц, 1H), 4,54 (тд, J=6,5, 3,5 Гц, 1H), 4,40 (дд, J=7,2, 3,6 Гц, 1H), 3,23 (дд, J=10,6, 4,6 Гц, 1H), 2,81 (дд, J=10,7, 3,8 Гц, 1H).
LC-MS MS(EI) для C15H14ClN5O4S2 [M+H]+, (Рассч.: 427,02) Найдено: 428,0.
Пример 35: Синтез (2S,3R,4R)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидрофуран-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,70 (т, J=6,4 Гц, 1H), 7,72 (д, J=4,9 Гц, 1H), 7,40 (с, 1H), 7,37-7,25 (м, 3H), 7,18 (д, J=4,9 Гц, 1H), 5,49 (д, J=4,3 Гц, 1H), 5,31 (д, J=4,0 Гц, 1H), 5,20 (д, J=6,2 Гц, 1H), 4,70-4,63 (м, 2H), 4,46-4,36 (м, 1H), 4,29 (дд, J=8,7, 4,5 Гц, 1H), 3,95 (дд, J=8,2, 6,7 Гц, 1H), 3,87-3,80 (м, 1H).
LC-MS MS(EI) для C16H16ClN5O3 [M+H]+, (Рассч.: 361,09) Найдено: 362,1.
Пример 36: Синтез (2S,3R,4S)-2-(8-((имидазо[1,2-a]пиридин-2-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,63-8,56 (м, 1H), 8,44 (дт, J=6,7, 1,0 Гц, 1H), 7,74-7,69 (м, 2H), 7,47 (дд, J=9,0, 0,7 Гц, 1H), 7,28 (д, J=4,8 Гц, 1H), 7,18 (ддд, J=9,1, 6,7, 1,3 Гц, 1H), 6,82 (тд, J=6,8, 1,2 Гц, 1H), 5,54-5,47 (м, 1H), 5,38 (дд, J=3,7, 1,9 Гц, 1H), 4,83-4,77 (м, 3H), 4,68-4,60 (м, 1H), 4,46-4,39 (м, 1H), 3,27 (дд, J=10,0, 3,9 Гц, 1H), 2,83 (дд, J=10,6, 3,7 Гц, 1H).
LC-MS MS(EI) для C17H17N7O2S [M+H]+, (Рассч.: 383,12) Найдено: 384,1.
Пример 37: Синтез (2S,3R,4S)-2-(8-амино-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,66 (д, J=4,8 Гц, 2H), 7,52 (с, 2H), 7,23 (д, J=4,8 Гц, 2H), 7,06 (дд, J=6,8, 2,9 Гц, 3H), 5,35 (д, J=6,4 Гц, 2H), 5,25 (д, J=3,3 Гц, 2H), 4,63 (д, J=7,6 Гц, 2H), 4,25 (дд, J=8,0, 3,9 Гц, 4H), 3,24 (д, J=10,8 Гц, 2H), 2,76 (дд, J=11,0, 2,5 Гц, 2H).
LC-MS MS(EI) для C9H11N5O2S [M+H]+, (Рассч.: 253,06) Найдено: 254,1.
Пример 38: Синтез (2S,3R,4R)-2-(8-((3-иодбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидрофуран-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,68 (т, J=6,3 Гц, 1H), 7,75-7,69 (м, 2H), 7,58 (д, J=7,9 Гц, 1H), 7,37 (д, J=8,1 Гц, 1H), 7,18 (д, J=4,8 Гц, 1H), 7,11 (т, J=7,8 Гц, 1H), 5,49 (д, J=4,2 Гц, 1H), 5,28 (д, J=4,4 Гц, 1H), 5,17 (д, J=6,2 Гц, 1H), 4,68-4,60 (м, 2H), 4,41 (дд, J=11,9, 5,6 Гц, 1H), 4,29 (кв, J=4,4 Гц, 1H), 3,95 (дд, J=8,1, 6,7 Гц, 1H), 3,88-3,80 (м, 1H).
LC-MS MS(EI) для C16H16IN5O3 [M+H]+, (Рассч.: 453,03) Найдено: 454,0.
Пример 39: Синтез (2S,3R,4R)-2-(8-((3-хлорфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидрофуран-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,11 (т, J=5,7 Гц, 1H), 7,69 (д, J=4,9 Гц, 1H), 7,35 (т, J=1,7 Гц, 1H), 7,34-7,28 (м, 1H), 7,28-7,19 (м, 3H), 5,48 (д, J=4,2 Гц, 1H), 5,29 (д, J=4,4 Гц, 1H), 5,19 (д, J=6,3 Гц, 1H), 4,46-4,37 (м, 1H), 4,28 (кв, J=4,4 Гц, 1H), 3,95 (дд, J=8,2, 6,7 Гц, 1H), 3,87-3,80 (м, 1H), 3,70 (дд, J=13,2, 7,0 Гц, 2H), 2,96 (т, J=7,2 Гц, 2H).
LC-MS MS(EI) для C17H18ClN5O3 [M+H]+, (Рассч.: 375,11) Найдено: 376,1.
Пример 40: Синтез 4-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)-2-фтор-N-метилбензамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,83 (т, J=6,1 Гц, 1H), 8,15 (с, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,55 (т, J=7,8 Гц, 1H), 7,32-7,15 (м, 3H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,4 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,70 (д, J=6,1 Гц, 2H), 4,67-4,59 (м, 1H), 4,46-4,37 (м, 1H), 3,26 (дд, J=10,7, 4,5 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 2,74 (д, J=4,6 Гц, 3H).
LC-MS MS(EI) для C18H19FN6O3S [M+H]+, (Рассч.: 418,12) Найдено: 419,1.
Пример 41: Синтез (2S,3R,4S)-2-(8-((4-метилпиперазин-1-ил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 9,14 (с, 1H), 7,72 (д, J=4,8 Гц, 1H), 7,31 (д, J=4,8 Гц, 1H), 5,44 (д, J=5,8 Гц, 1H), 5,33 (д, J=4,0 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,65-4,60 (м, 1H), 4,44-4,37 (м, 1H), 3,26 (дд, J=10,6, 4,6 Гц, 1H), 2,91 (т, J=4,9 Гц, 4H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 2,43 (с, 4H), 2,18 (с, 3H).
LC-MS MS(EI) для C14H21N7O2S [M+H]+, (Рассч.: 351,15) Найдено: 352,1.
Пример 42: Синтез (2S,3R,4S)-2-(8-(морфолиноамино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 9,26 (с, 1H), 7,74 (д, J=4,8 Гц, 1H), 7,32 (д, J=4,8 Гц, 1H), 5,45 (д, J=5,8 Гц, 1H), 5,34 (д, J=4,0 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,66-4,58 (м, 1H), 4,45-4,37 (м, 1H), 3,73-3,64 (м, 4H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,96-2,88 (м, 4H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C13H18N6O3S [M+H]+, (Рассч.: 338,12) Найдено: 339,1.
Пример 43: Синтез (2S,3R,4S)-2-(8-(((1S,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,58 (д, J=4,4 Гц, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,35-7,23 (м, 3H), 7,21-7,13 (м, 3H), 5,43 (д, J=6,1 Гц, 1H), 5,32 (д, J=4,3 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,62 (тд, J=7,0, 3,2 Гц, 1H), 4,44-4,38 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 3,22-3,14 (м, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 2,17-2,08 (м, 1H), 1,57-1,48 (м, 1H), 1,31-1,21 (м, 1H).
LC-MS MS(EI) для C18H19N5O2S [M+H]+, (Рассч.: 369,13) Найдено: 370,1.
Пример 44: Синтез 2-хлор-4-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)-N-метилбензамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,85 (т, J=6,0 Гц, 1H), 8,29 (кв, J=4,6 Гц, 1H), 7,71 (д, J=4,9 Гц, 1H), 7,44 (с, 1H), 7,37-7,30 (м, 2H), 7,26 (д, J=4,8 Гц, 1H), 5,46 (с, 1H), 5,35 (с, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,68 (д, J=6,2 Гц, 2H), 4,66-4,59 (м, 1H), 4,41 (с, 1H), 3,26 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 2,72 (д, J=4,6 Гц, 3H).
LC-MS MS(EI) для C18H19ClN6O3S [M+H]+, (Рассч.: 434,09) Найдено: 435,1.
Пример 45: Синтез (2S,3R,4S)-2-(8-(((S)-1-(3-хлорфенил)этил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,70 (д, J=8,2 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,53 (т, J=1,8 Гц, 1H), 7,43-7,37 (м, 1H), 7,32 (т, J=7,7 Гц, 1H), 7,28-7,21 (м, 2H), 5,45-5,36 (м, 2H), 5,31 (д, J=4,3 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,65-4,58 (м, 1H), 4,44-4,37 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 1,55 (д, J=7,1 Гц, 3H).
LC-MS MS(EI) для C17H18ClN5O2S [M+H]+, (Рассч.: 391,09) Найдено: 392,1.
Пример 46: Синтез (2S,3R,4S)-2-(8-(((R)-1-(3-хлорфенил)этил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,71 (д, J=8,2 Гц, 1H), 7,68 (д, J=4,8 Гц, 1H), 7,53 (с, 1H), 7,40 (д, J=7,6 Гц, 1H), 7,32 (т, J=7,8 Гц, 1H), 7,29-7,24 (м, 1H), 7,23 (д, J=4,8 Гц, 1H), 5,48-5,35 (м, 2H), 5,32 (д, J=4,3 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,66-4,57 (м, 1H), 4,45-4,36 (м, 1H), 3,25 (дд, J=10,6, 4,5 Гц, 1H), 2,81 (дд, J=10,6, 3,6 Гц, 1H), 1,55 (д, J=7,1 Гц, 3H).
LC-MS MS(EI) для C17H18ClN5O2S [M+H]+, (Рассч.: 391,09) Найдено: 392,1.
Пример 47: Синтез (2S,3R,4S)-2-(8-((2-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,76 (т, J=6,1 Гц, 1H), 7,73 (д, J=4,8 Гц, 1H), 7,48-7,42 (м, 1H), 7,32-7,22 (м, 4H), 5,43 (д, J=6,1 Гц, 1H), 5,32 (д, J=4,4 Гц, 1H), 4,80 (д, J=7,2 Гц, 1H), 4,74 (д, J=6,1 Гц, 2H), 4,68-4,61 (м, 1H), 4,45-4,39 (м, 1H), 3,27 (дд, J=10,6, 4,6 Гц, 1H), 2,83 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H16ClN5O2S [M+H]+, (Рассч.: 377,07) Найдено: 378,1.
Пример 48: Синтез (2S,3R,4S)-2-(8-((4-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,79 (т, J=6,2 Гц, 1H), 7,69 (д, J=4,8 Гц, 1H), 7,42-7,31 (м, 4H), 7,25 (д, J=4,8 Гц, 1H), 5,42 (д, J=6,0 Гц, 1H), 5,31 (д, J=4,2 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,71-4,58 (м, 3H), 4,45-4,38 (м, 1H), 3,26 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H16ClN5O2S [M+H]+, (Рассч.: 377,07) Найдено: 378,1.
Пример 49: Синтез (2S,3R,4S)-2-(8-((4-иодбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,78 (т, J=6,3 Гц, 1H), 7,69 (д, J=4,8 Гц, 1H), 7,68-7,61 (м, 2H), 7,25 (д, J=4,8 Гц, 1H), 7,16 (д, J=8,4 Гц, 2H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,3 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,68-4,56 (м, 3H), 4,46-4,37 (м, 1H), 3,26 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H16IN5O2S [M+H]+, (Рассч.: 469,01) Найдено: 470,0.
Пример 50: Синтез (2S,3R,4S)-2-(8-((2-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,25 (т, J=5,7 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,31 (дд, J=11,0, 6,6 Гц, 2H), 7,28-7,22 (м, 1H), 7,19-7,07 (м, 2H), 5,44 (д, J=6,2 Гц, 1H), 5,33 (д, J=4,1 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,66-4,59 (м, 1H), 4,45-4,38 (м, 1H), 4,10 (кв, J=5,2 Гц, 2H), 3,72 (дт, J=12,5, 6,2 Гц, 2H), 3,25 (дд, J=10,8, 4,5 Гц, 1H), 2,99 (т, J=7,1 Гц, 2H), 2,82 (дд, J=10,6, 3,6 Гц, 1H).
LC-MS MS(EI) для C17H18FN5O2S [M+H]+, (Рассч.: 375,12) Найдено: 376,1.
Пример 51: Синтез (2S,3R,4S)-2-(8-((2-(пиперидин-1-ил)этил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,87 (т, J=5,6 Гц, 1H), 7,66 (д, J=4,8 Гц, 1H), 7,29 (д, J=4,8 Гц, 1H), 5,45 (д, J=5,8 Гц, 1H), 5,33 (д, J=4,0 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,63 (м, 1H), 4,41 (м, 1H), 3,57 (м, 2H), 3,25 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,6, 3,7 Гц, 1H), 2,38 (м, 5H), 1,54-1,32 (м, 7H).
LC-MS MS(EI) для C16H24N6O2S [M+H]+, (Рассч.: 364,17) Найдено: 365,2.
Пример 52: Синтез (2S,3R,4S)-2-(8-((2-(диметиламино)этил)(метил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,66 (д, J=4,7 Гц, 1H), 7,33 (д, J=4,7 Гц, 1H), 5,47 (д, J=5,7 Гц, 1H), 5,35 (д, J=4,0 Гц, 1H), 4,76 (д, J=6,9 Гц, 1H), 4,70-4,64 (м, 1H), 4,46-4,39 (м, 1H), 4,25 (с, 2H), 3,41 (с, 3H), 3,23 (дд, J=10,6, 4,7 Гц, 1H), 2,83 (дд, J=10,6, 4,0 Гц, 1H), 2,18 (с, 6H).
LC-MS MS(EI) для C14H22N6O2S [M+H]+, (Рассч.: 338,15) Найдено: 339,1.
Пример 53: Синтез (2S,3R,4S)-2-(8-гидрокси-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 11,46 (с, 1H), 7,44 (д, J=5,8 Гц, 1H), 6,90 (д, J=5,8 Гц, 1H), 5,46 (с, 1H), 5,32 (с, 1H), 4,71 (д, J=7,0 Гц, 1H), 4,62-4,54 (м, 1H), 4,45-4,37 (м, 1H), 3,23 (дд, J=10,6, 4,7 Гц, 1H), 2,82 (дд, J=10,6, 3,9 Гц, 1H).
LC-MS MS(EI) для C9H10N4O3S [M+H]+, (Рассч.: 254,05) Найдено: 255,0.
Пример 54: Синтез (2S,3R,4S)-2-(8-(2-(3-хлорфенил)гидразинил)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 10,01 (с, 1H), 8,74 (с, 1H), 7,93 (с, 1H), 7,79 (с, 1H), 7,70 (д, J=7,6 Гц, 1H), 7,26 (с, 1H), 6,79-6,64 (м, 1H), 5,47 (д, J=5,1 Гц, 1H), 5,33 (с, 1H), 4,81 (с, 1H), 4,66 (с, 1H), 4,42 (с, 1H), 3,31-3,24 (м, 1H), 2,83 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C15H15ClN6O2S [M+H]+, (Рассч.: 378,07) Найдено: 380,0.
Пример 55: Синтез (2S,3R,4S)-2-(8-((3,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,83 (т, J=6,1 Гц, 1H), 7,73 (д, J=4,8 Гц, 1H), 7,47 (т, J=1,9 Гц, 1H), 7,40 (д, J=1,9 Гц, 2H), 7,27 (д, J=4,8 Гц, 1H), 5,42 (д, J=6,0 Гц, 1H), 5,31 (д, J=4,4 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,67 (д, J=6,1 Гц, 2H), 4,65-4,60 (м, 1H), 4,44-4,38 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H15Cl2N5O2S [M+H]+, (Рассч.: 411,03) Найдено: 412,0.
Пример 56: Синтез (2S,3R,4S)-2-(8-((2,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,80 (т, J=6,0 Гц, 1H), 7,75 (д, J=4,8 Гц, 1H), 7,51 (д, J=8,5 Гц, 1H), 7,36 (дд, J=8,5, 2,6 Гц, 1H), 7,32 (д, J=2,6 Гц, 1H), 7,26 (д, J=4,8 Гц, 1H), 5,44 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,3 Гц, 1H), 4,80 (д, J=7,2 Гц, 1H), 4,72 (д, J=6,0 Гц, 2H), 4,68-4,60 (м, 1H), 4,46-4,40 (м, 1H), 3,27 (дд, J=10,7, 4,6 Гц, 1H), 2,83 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H15Cl2N5O2S [M+H]+, (Рассч.: 411,03) Найдено: 412,0.
Пример 57: Синтез (2S,3R,4S)-2-(8-((тиофен-2-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,79 (т, J=6,1 Гц, 1H), 7,72 (д, J=4,8 Гц, 1H), 7,36-7,31 (м, 2H), 7,04 (дд, J=3,4, 1,2 Гц, 1H), 6,94 (дд, J=5,1, 3,4 Гц, 1H), 5,44 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,3 Гц, 1H), 4,83 (д, J=6,4 Гц, 2H), 4,78 (д, J=7,2 Гц, 1H), 4,66-4,59 (м, 1H), 4,45-4,38 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C14H15N5O2S2 [M+H]+, (Рассч.: 349,07) Найдено: 350,1.
Пример 58: Синтез (2S,3R,4S)-2-(8-((2,3-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,82 (т, J=5,6 Гц, 1H), 7,72 (д, J=4,8 Гц, 1H), 7,57-7,49 (м, 1H), 7,32-7,20 (м, 3H), 5,45 (д, J=5,8 Гц, 1H), 5,33 (д, J=4,0 Гц, 1H), 4,78 (д, J=7,1 Гц, 1H), 4,73 (д, J=5,6 Гц, 2H), 4,66-4,58 (м, 1H), 4,44-4,37 (м, 1H), 3,25 (дд, J=10,7, 4,7 Гц, 1H), 2,81 (дд, J=10,8, 3,5 Гц, 1H).
LC-MS MS(EI) для C16H15Cl2N5O2S [M+H]+, (Рассч.: 411,03) Найдено: 412,0.
Пример 59: Синтез (2S,3R,4S)-2-(8-((3,4-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,82 (т, J=6,0 Гц, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,60 (с, 1H), 7,56 (д, J=8,3 Гц, 1H), 7,34 (д, J=8,3 Гц, 1H), 7,26 (д, J=4,8 Гц, 1H), 5,45 (д, J=5,8 Гц, 1H), 5,33 (д, J=3,8 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,70-4,59 (м, 3H), 4,45-4,38 (м, 1H), 3,26 (дд, J=10,7, 4,5 Гц, 1H), 2,82 (дд, J=10,7, 3,5 Гц, 1H).
LC-MS MS(EI) для C16H15Cl2N5O2S [M+H]+, (Рассч.: 411,03) Найдено: 412,0.
Пример 60: Синтез (2S,3R,4S)-2-(8-((2,4-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,78 (т, J=5,9 Гц, 1H), 7,72 (д, J=4,8 Гц, 1H), 7,60 (д, J=1,9 Гц, 1H), 7,33 (дд, J=8,3, 1,9 Гц, 1H), 7,29 (д, J=8,3 Гц, 1H), 7,23 (д, J=4,8 Гц, 1H), 5,44 (д, J=6,3 Гц, 1H), 5,33 (д, J=3,8 Гц, 1H), 4,78 (д, J=7,3 Гц, 1H), 4,68 (д, J=5,9 Гц, 2H), 4,66-4,59 (м, 1H), 4,43-4,37 (м, 1H), 3,25 (дд, J=10,5, 4,5 Гц, 1H), 2,81 (дд, J=10,5, 3,5 Гц, 1H).
LC-MS MS(EI) для C16H15Cl2N5O2S [M+H]+, (Рассч.: 411,03) Найдено: 412,0.
Пример 61: Синтез метил-2-хлор-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)бензоата
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,86 (т, J=6,4 Гц, 1H), 7,81 (д, J=1,9 Гц, 1H), 7,71 (д, J=4,9 Гц, 1H), 7,53 (дт, J=14,3, 5,2 Гц, 2H), 7,26 (д, J=4,8 Гц, 1H), 5,44 (д, J=5,9 Гц, 1H), 5,33 (д, J=4,1 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,69 (д, J=6,1 Гц, 2H), 4,62 (тд, J=6,5, 3,3 Гц, 1H), 4,45-4,38 (м, 1H), 3,26 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,6, 3,7 Гц, 1H).
LC-MS MS(EI) для C18H18ClN5O4S [M+H]+, (Рассч.: 435,08) Найдено: 436,1.
Пример 62: Синтез (2S,3R,4S)-2-(8-((2-иодбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,77 (т, J=6,0 Гц, 1H), 7,87 (дд, J=7,8, 1,1 Гц, 1H), 7,73 (д, J=4,8 Гц, 1H), 7,35-7,28 (м, 1H), 7,25 (д, J=4,8 Гц, 1H), 7,20 (д, J=6,3 Гц, 1H), 7,01 (тд, J=7,7, 1,6 Гц, 1H), 5,44 (д, J=6,1 Гц, 1H), 5,32 (д, J=4,4 Гц, 1H), 4,80 (д, J=7,2 Гц, 1H), 4,69-4,61 (м, 1H), 4,58 (д, J=6,0 Гц, 2H), 4,47-4,38 (м, 1H), 3,27 (дд, J=10,6, 4,5 Гц, 1H), 2,83 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H16IN5O2S [M+H]+, (Рассч.: 469,01) Найдено: 470,0.
Пример 63: Синтез (2S,3R,4S)-2-(8-((3-хлор-4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,23 (д, J=5,7 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,49 (дд, J=7,3, 2,1 Гц, 1H), 7,34-7,28 (м, 2H), 7,28-7,22 (м, 1H), 5,43 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,4 Гц, 1H), 4,76 (д, J=7,2 Гц, 1H), 4,63 (дд, J=11,2, 5,0 Гц, 1H), 4,44-4,38 (м, 1H), 3,71 (дд, J=13,1, 6,8 Гц, 2H), 3,25 (дд, J=10,7, 4,6 Гц, 1H), 2,95 (т, J=6,9 Гц, 2H), 2,82 (дд, J=10,7, 3,8 Гц, 1H).
LC-MS MS(EI) для C17H17ClFN5O2S [M+H]+, (Рассч.: 409,08) Найдено: 410,1.
Пример 64: Синтез (2S,3R,4S)-2-(8-((4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,21 (т, J=5,6 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,32-7,25 (м, 3H), 7,16-7,05 (м, 2H), 5,43 (д, J=6,0 Гц, 1H), 5,32 (д, J=4,3 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,68-4,59 (м, 1H), 4,46-4,38 (м, 1H), 3,69 (м, 2H), 3,25 (дд, J=10,6, 4,6 Гц, 1H), 2,94 (т, J=7,3 Гц, 2H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C17H18FN5O2S [M+H]+, (Рассч.: 375,12) Найдено: 376,1.
Пример 65: Синтез (2S,3R,4S)-2-(8-((3-хлор-4-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,80 (т, J=6,3 Гц, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,56 (дд, J=7,2, 1,6 Гц, 1H), 7,40-7,30 (м, 2H), 7,27 (д, J=4,8 Гц, 1H), 5,42 (д, J=6,1 Гц, 1H), 5,31 (д, J=4,3 Гц, 1H), 4,78 (д, J=7,2 Гц, 1H), 4,69-4,60 (м, 3H), 4,44-4,38 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H15ClFN5O2S [M+H]+, (Рассч.: 395,06) Найдено: 396,1.
Пример 66: Синтез (2S,3R,4S)-2-(8-((2,6-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,42 (т, J=4,5 Гц, 1H), 7,73 (д, J=4,8 Гц, 1H), 7,54-7,45 (м, 2H), 7,42-7,33 (м, 2H), 5,44 (с, 1H), 5,32 (с, 1H), 4,88 (д, J=4,5 Гц, 2H), 4,78 (д, J=7,2 Гц, 1H), 4,63 (с, 1H), 4,41 (с, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C16H15Cl2N5O2S [M+H]+, (Рассч.: 411,03) Найдено: 412,1.
Пример 67: Синтез (2S,3R,4S)-2-(8-((3-(4-метилпиперазин-1-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,65 (т, J=6,2 Гц, 1H), 7,68 (д, J=4,8 Гц, 1H), 7,27 (д, J=4,8 Гц, 1H), 7,15-7,08 (м, 1H), 6,98 (с, 1H), 6,82-6,73 (м, 2H), 5,42 (д, J=6,1 Гц, 1H), 5,30 (д, J=4,4 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,68-4,58 (м, 3H), 4,46-4,37 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 3,15-3,05 (м, 4H), 2,82 (дд, J=10,7, 3,7 Гц, 1H), 2,47-2,39 (м, 4H), 2,21 (с, 3H).
LC-MS MS(EI) для C21H27N7O2S [M+H]+, (Рассч.: 441,19) Найдено: 442,2.
Пример 68: Синтез (2S,3R,4S)-2-(8-((3-(диметиламино)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,64 (т, J=6,2 Гц, 1H), 7,67 (д, J=4,8 Гц, 1H), 7,27 (д, J=4,8 Гц, 1H), 7,13-7,04 (м, 1H), 6,77 (с, 1H), 6,64 (д, J=7,7 Гц, 1H), 6,58 (дд, J=8,0, 2,2 Гц, 1H), 5,43 (д, J=6,0 Гц, 1H), 5,31 (д, J=4,3 Гц, 1H), 4,77 (д, J=7,2 Гц, 1H), 4,70-4,56 (м, 3H), 4,47-4,37 (м, 1H), 3,26 (дд, J=10,7, 4,6 Гц, 1H), 2,85 (с, 6H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C18H22N6O2S [M+H]+, (Рассч.: 386,15) Найдено: 387,1.
Пример 69: Синтез (2S,3R,4S)-2-(8-((3-(1H-тетразол-5-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,87 (т, J=6,2 Гц, 1H), 8,10-8,01 (м, 1H), 7,88 (дт, J=6,9, 1,8 Гц, 1H), 7,71 (д, J=4,8 Гц, 1H), 7,58-7,48 (м, 2H), 7,27 (д, J=4,8 Гц, 1H), 5,43 (д, J=4,5 Гц, 1H), 5,31 (с, 1H), 4,88-4,72 (м, 3H), 4,69-4,58 (м, 1H), 4,47-4,35 (м, 1H), 3,26 (дд, J=10,6, 4,6 Гц, 1H), 2,82 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C17H17N9O2S [M+H]+, (Рассч.: 411,12) Найдено: 412,1.
Пример 70: Синтез (2S,3R,4S)-2-(8-((2-(3-фторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,56 (д, J=4,3 Гц, 1H), 7,68 (д, J=4,8 Гц, 1H), 7,39-7,21 (м, 2H), 7,03-6,89 (м, 3H), 5,38 (д, J=6,0 Гц, 1H), 5,27 (д, J=4,2 Гц, 1H), 4,74 (д, J=7,2 Гц, 1H), 4,66-4,52 (м, 1H), 4,45-4,32 (м, 1H), 3,22 (дд, J=10,7, 4,5 Гц, 1H), 3,19-3,08 (м, 1H), 2,78 (дд, J=10,7, 3,7 Гц, 1H), 2,16-2,05 (м, 1H), 1,60-1,47 (м, 1H), 1,34-1,24 (м, 1H).
LC-MS MS(EI) для C18H18FN5O2S [M+H]+, (Рассч.: 387,12) Найдено: 388,1.
Пример 71: Синтез (2S,3R,4S)-2-(8-((2-(3-хлорфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,56 (д, J=4,2 Гц, 1H), 7,68 (д, J=4,8 Гц, 1H), 7,30-7,23 (м, 2H), 7,23-7,16 (м, 2H), 7,10 (д, J=7,6 Гц, 1H), 5,38 (д, J=6,0 Гц, 1H), 5,27 (д, J=4,0 Гц, 1H), 4,74 (д, J=7,2 Гц, 1H), 4,64-4,55 (м, 1H), 4,41-4,33 (м, 1H), 3,22 (дд, J=10,7, 4,5 Гц, 1H), 3,18-3,09 (м, 1H), 2,78 (дд, J=10,7, 3,6 Гц, 1H), 2,13-2,05 (м, 1H), 1,58-1,49 (м, 1H), 1,33-1,25 (м, 1H).
LC-MS MS(EI) для C18H18ClN5O2S [M+H]+, (Рассч.: 403,09) Найдено: 404,1.
Пример 72: Синтез (2S,3R,4S)-2-(8-(((1R,2S)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,57 (д, J=4,4 Гц, 3H), 7,71 (д, J=4,8 Гц, 3H), 7,33-7,24 (м, 9H), 7,21-7,13 (м, 9H), 5,42 (д, J=6,1 Гц, 3H), 5,31 (д, J=4,3 Гц, 3H), 4,78 (д, J=7,2 Гц, 3H), 4,68-4,60 (м, 3H), 4,45-4,38 (м, 3H), 3,26 (дд, J=10,7, 4,6 Гц, 3H), 3,22-3,13 (м, 3H), 2,82 (дд, J=10,7, 3,6 Гц, 3H), 2,17-2,08 (м, 3H), 1,57-1,48 (м, 3H), 1,31-1,21 (м, 4H).
LC-MS MS(EI) для C18H19N5O2S [M+H]+, (Рассч.: 369,13) Найдено: 370,1.
Пример 73: Синтез (2S,3R,4S)-2-(8-((2,3-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,30-8,26 (1H, м), 7,67 (1H, д, J=4,8 Гц), 7,30 (1H, д, J=4,0 Гц), 7,27-7,25 (1H, м), 7,12-7,11 (2H, м), 5,42 (1H, д, J=6,0 Гц), 5,30 (1H, д, J=4,4 Гц), 4,77 (1H, д, J=7,2 Гц), 4,63 (1H, с), 4,41 (1H, с), 3,75-3,73 (2H, м), 3,25 (1H, дд, J=10,4, 4,4 Гц), 3,04 (2H, т, J=6,6 Гц), 2,82 (1H, дд, J=11,6, 4,0 Гц).
LC-MS MS(EI) для C17H17F2N5O2S [M+H]+, (Рассч.: 393,11) Найдено: 394,3.
Пример 74: Синтез (2S,3R,4S)-2-(8-((2,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,26-8,22 (1H, м), 7,66 (1H, д, J=4,8 Гц), 7,35 (1H, кв, J=8,0 Гц), 7,29 (1H, д, J=4,8 Гц), 7,19-7,14 (1H, м), 7,02-6,98 (1H, м), 5,41 (1H, д, J=6,0 Гц), 5,30 (1H, д, J=4,4 Гц), 4,76 (1H, д, J=6,8 Гц), 4,65-4,61 (1H, м), 4,41 (1H, с), 3,71-3,69 (2H, м), 3,25 (1H, дд, J=11,8, 5,4 Гц), 2,96 (2H, т, J=7,0 Гц), 2,82 (1H, дд, J=10,8, 3,6 Гц).
LC-MS MS(EI) для C17H17F2N5O2S [M+H]+, (Рассч.: 393,11) Найдено: 394,3.
Пример 75: Синтез (2S,3R,4S)-2-(8-(((1R,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,30-8,24 (1H, м), 7,60 (1H, т, J=4,4 Гц), 7,24-7,21 (3H, м), 7,11-7,10 (2H, м), 7,04-6,98 (1H, м), 5,41-5,39 (1H, м), 5,29 (1H, д, J=3,6 Гц), 4,70 (1H, д, J=7,2 Гц), 4,59 (1H, с), 4,37 (1H, с), 3,22 (1H, д, J=10,8 Гц), 2,79 (1H, д, J=12,4 Гц), 2,32-2,28 (1H, м), 1,58-1,56 (1H, м), 1,37-1,35 (1H, м). *Протон будет перекрываться с пиком H2O при 3,40 м.д.
LC-MS MS(EI) для C18H19N5O2S [M+H]+, (Рассч.: 369,13) Найдено: 370,2.
Пример 76: Синтез (2S,3R,4S)-2-(8-((2,5-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,26-8,22 (1H, м), 7,63 (1H, д, J=4,4 Гц), 7,26 (1H, д, J=4,8 Гц), 7,18-7,12 (2H, м), 7,06-7,02 (1H, м), 5,38 (1H, д, J=5,6 Гц), 5,26 (1H, с), 4,73 (1H, д, J=7,2 Гц), 4,62-4,58 (1H, м), 4,37 (1H, ушир.с), 3,70-3,68 (2H, м), 3,21 (1H, дд, J=10,8, 4,4 Гц), 2,95 (2H, т, J=7,0 Гц), 2,78 (1H, дд, J=10,6, 3,4 Гц).
LC-MS MS(EI) для C17H17F2N5O2S [M+H]+, (Рассч.: 393,11) Найдено: 394,3.
Пример 77: Синтез (2S,3R,4S)-2-(8-(3-хлорфенетил)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,45 (1H, д, J=4,8 Гц), 7,84 (1H, д, J=5,2 Гц), 7,38 (1H, с), 7,33-7,29 (1H, м), 7,26-7,24 (2H, м), 5,45 (1H, д, J=6,0 Гц), 5,34 (1H, д, J=4,0 Гц), 4,90 (1H, д, J=6,8 Гц), 4,64 (1H, ушир.с), 4,24 (1H, ушир.с), 3,52 (2H, т, J=7,6 Гц), 3,30-3,27 (1H, м), 3,22 (2H, т, J=7,8 Гц), 2,84 (1H, дд, J=10,8, 3,2 Гц).
LC-MS MS(EI) для C17H17ClN4O2S [M+H]+, (Рассч.: 376,08) Найдено: 377,3.
Пример 78: Синтез (2S,3R,4S)-2-(8-((4-хлор-3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,19 (с, 1H), 7,63 (д, J=3,8 Гц, 1H), 7,43 (т, J=8,0 Гц, 1H), 7,28 (дд, J=12,8, 7,7 Гц, 2H), 7,08 (д, J=7,7 Гц, 1H), 5,41 (д, J=4,4 Гц, 1H), 5,29 (д, J=4,3 Гц, 1H), 4,72 (д, J=7,0 Гц, 1H), 4,62-4,55 (м, 1H), 4,41-4,34 (м, 1H), 3,68 (дд, J=13,0, 6,9 Гц, 2H), 3,24-3,18 (м, 1H), 2,93 (т, J=6,8 Гц, 2H), 2,78 (дд, J=9,9, 3,6 Гц, 1H).
LC-MS MS(EI) для C17H17ClFN5O2S [M+H]+, (Рассч.: 409,08) Найдено: 410,1.
Пример 79: Синтез метил-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)-2-фторбензоата
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,85-8,77 (м, 1H), 7,86 (д, J=5,3 Гц, 1H), 7,66 (д, J=4,3 Гц, 1H), 7,64-7,58 (м, 1H), 7,28-7,20 (м, 1H), 5,41 (д, J=6,1 Гц, 1H), 5,29 (д, J=4,9 Гц, 1H), 4,74 (д, J=6,9 Гц, 1H), 4,65 (с, 1H), 4,59 (д, J=4,9 Гц, 1H), 4,37 (с, 1H), 3,79 (с, 2H), 3,22 (дд, J=11,5, 4,3 Гц, 1H), 2,78 (дд, J=11,0, 3,8 Гц, 1H).
LC-MS MS(EI) для C18H18FN5O4S [M+H]+, (Рассч.: 419,11) Найдено: 420,1.
Пример 80: Синтез (2S,3R,4S)-2-(8-((3-(пиперазин-1-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,64 (т, J=6,3 Гц, 1H), 8,58-8,31 (м, 2H), 7,65 (д, J=4,8 Гц, 1H), 7,22 (д, J=4,8 Гц, 1H), 7,13 (т, J=7,8 Гц, 1H), 6,97 (с, 1H), 6,81 (д, J=7,9 Гц, 2H), 5,38 (д, J=6,1 Гц, 1H), 5,28 (д, J=4,3 Гц, 1H), 4,73 (д, J=7,1 Гц, 1H), 4,59 (т, J=7,7 Гц, 3H), 4,44-4,34 (м, 2H), 4,06 (дд, J=11,2, 5,2 Гц, 1H), 3,26-3,18 (м, 5H), 3,14 (дд, J=12,4, 4,8 Гц, 5H), 2,79 (дд, J=10,7, 3,7 Гц, 1H).
LC-MS MS(EI) для C20H25N7O2S [M+H]+, (Рассч.: 427,18) Найдено: 428,2.
Пример 81: Синтез (2S,3R,4S)-2-(8-((2,6-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,31-8,30 (1H, м), 7,66 (1H, д, J=4,8 Гц), 7,34-7,28 (2H, м), 7,03 (2H, т, J=5,2 Гц), 5,42 (1H, д, J=5,6 Гц), 5,30 (1H, д, J=4,4 Гц), 4,76 (1H, д, J=6,8 Гц), 4,66-4,62 (1H, м), 4,41 (1H, ушир.с), 3,70-3,68 (2H, м), 3,25 (1H, дд, J=10,8, 4,8 Гц), 3,02 (2H, т, J=6,6 Гц), 2,83 (1H, дд, J=11,0, 3,4 Гц).
LC-MS MS(EI) для C17H17F2N5O2S [M+H]+, (Рассч.: 393,11) Найдено: 394,3.
Пример 82: Синтез (2S,3R,4S)-2-(8-((3,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,24-8,22 (1H, м), 7,67 (1H, д, J=4,8 Гц), 7,36-7,29 (3H, м), 7,09 (1H, ушир.с), 5,42 (1H, д, J=6,4 Гц), 5,30 (1H, д, J=4,4 Гц), 4,76 (1H, д, J=6,8 Гц), 4,63 (1H, ушир.с), 4,41 (1H, ушир.с), 3,72-3,70 (2H, м), 3,25 (1H, дд, J=11,0, 4,6 Гц), 2,95 (2H, т, J=7,0 Гц), 2,84-2,81 (1H, м).
LC-MS MS(EI) для C17H17F2N5O2S [M+H]+, (Рассч.: 393,11) Найдено: 394,3.
Пример 83: Синтез (2S,3R,4S)-2-(8-((3,5-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,26-8,22 (1H, м), 7,67 (1H, д, J=4,8 Гц), 7,36-7,29 (1H, д, J=4,4 Гц), 7,06-7,00 (3H, м), 5,42 (1H, д, J=6,4 Гц), 5,30 (1H, д, J=4,0 Гц), 4,76 (1H, д, J=7,2 Гц), 4,63 (1H, ушир.с), 4,41 (1H, ушир.с), 3,74-3,73 (2H, м), 3,25 (1H, дд, J=10,4, 4,4 Гц), 2,99 (2H, т, J=6,8 Гц), 2,84-2,81 (1H, дд, J=10,6, 3,4 Гц).
LC-MS MS(EI) для C17H17F2N5O2S [M+H]+, (Рассч.: 393,11) Найдено: 394,3.
Пример 84: Синтез (2S,3R,4S)-2-(8-(((1S,2R)-2-(3,4-дифторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,59 (1H, д, J=4,0 Гц), 7,72 (1H, д, J=4,8 Гц), 7,36-7,24 (3H, м), 7,07 (1H, ушир.с), 5,42 (1H, д, J=5,6 Гц), 5,31 (1H, д, J=4,4 Гц), 4,78 (1H, д, J=7,6 Гц), 4,61 (1H, ушир.с), 4,42-4,41 (1H, м), 3,26 (1H, дд, J=10,6, 4,2 Гц), 3,14-3,13 (1H, м), 2,82 (1H, дд, J=10,6, 3,4 Гц), 2,14 (1H, ушир.с), 1,56-1,51 (1H, м), 1,33-1,29 (1H, м).
LC-MS MS(EI) для C18H17F2N5O2S [M+H]+, (Рассч.: 405,11) Найдено: 406,3.
Пример 85: Синтез (2S,3R,4S)-2-(8-((5-хлор-2-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,77 (1H, т, J=5,8 Гц), 7,74 (1H, д, J=4,4 Гц), 7,39-7,34 (2H, м), 7,29-7,23 (2H, м), 5,30 (1H, д, J=5,6 Гц), 5,31 (1H, д, J=4,4 Гц), 4,79 (1H, д, J=7,2 Гц), 4,72 (2H, д, J=6,0 Гц), 4,66-4,64 (1H, м), 4,42 (1H, ушир.с), 3,27 (1H, дд, J=10,8, 4,8 Гц), 2,83 (1H, дд, J=10,8, 3,6 Гц).
LC-MS MS(EI) для C16H15ClFN5O2S [M+H]+, (Рассч.: 395,06) Найдено: 396,2.
Пример 86: Синтез (2S,3R,4S)-2-(8-((3-хлор-5-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,82 (1H, т, J=5,8 Гц), 7,72 (1H, д, J=5,2 Гц), 7,28-7,26 (3H, м), 7,18 (1H, д, J=9,2 Гц), 5,42 (1H, д, J=6,0 Гц), 5,30 (1H, д, J=4,4 Гц), 4,78 (1H, д, J=7,2 Гц), 4,69 (2H, д, J=5,6 Гц), 4,65-4,63 (1H, м), 4,42 (1H, ушир.с), 3,26 (1H, дд, J=10,6, 4,6 Гц), 2,82 (1H, дд, J=10,6, 3,4 Гц).
LC-MS MS(EI) для C16H15ClFN5O2S [M+H]+, (Рассч.: 395,06) Найдено: 396,2.
Пример 87: Синтез (2S,3R,4S)-2-(8-((3-циклопропилбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,71-8,66 (1H, м), 7,68 (1H, д, J=4,8 Гц), 7,26 (1H, д, J=4,8 Гц), 7,17-7,10 (3H, м), 6,90 (1H, д, J=7,2 Гц), 5,41 (1H, д, J=5,6 Гц), 5,30 (1H, д, J=3,6 Гц), 4,77 (1H, д, J=7,2 Гц), 4,64-4,63 (3H, м), 4,41 (1H, ушир.с), 3,26 (1H, дд, J=11,2, 4,4 Гц), 2,84-2,81 (1H, м), 1,86-1,85 (1H, м), 0,91 (2H, д, J=8,4 Гц), 0,62-0,61 (2H, м).
LC-MS MS(EI) для C19H21N5O2S [M+H]+, (Рассч.: 383,14) Найдено: 384,3.
Пример 88: Синтез (2S,3R,4S)-2-(8-(([1,1'-бифенил]-3-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,80 (1H, т, J=6,2 Гц), 7,69-7,70 (2H, м), 7,62 (2H, д, J=7,6 Гц), 7,52-7,37 (6H, м), 7,29 (1H, д, J=4,8 Гц), 5,42 (1H, д, J=5,6 Гц), 5,31 (1H, д, J=4,0 Гц), 4,79-4,77 (3H, м), 4,64 (1H, ушир.с), 4,42 (1H, ушир.с), 3,26 (1H, дд, J=10,4, 4,4 Гц), 2,83 (1H, дд, J=10,8, 3,2 Гц).
LC-MS MS(EI) для C22H21N5O2S [M+H]+, (Рассч.: 419,50) Найдено: 420,3.
Пример 89: Синтез (2S,3R,4S)-2-(8-((3-феноксибензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,75 (1H, т, J=5,8 Гц), 7,69 (1H, д, J=4,4 Гц), 7,37-7,29 (3H, м), 7,25 (1H, д, J=4,4 Гц), 7,13-7,09 (2H, м), 7,00-6,96 (3H, м), 6,85 (1H, д, J=8,0 Гц), 5,43 (1H, д, J=5,6 Гц), 5,31 (1H, д, J=4,4 Гц), 4,78 (1H, д, J=7,2 Гц), 4,67-4,65 (3H, м), 4,42-4,40 (1H, м), 3,26 (1H, дд, J=10,6, 4,6 Гц), 2,83 (1H, дд, J=10,8, 3,2 Гц).
LC-MS MS(EI) для C22H21N5O3S [M+H]+, (Рассч.: 435,50) Найдено: 436,3.
Пример 90: Синтез метил-3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)бензоата
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,90-8,84 (1H, м), 7,98 (1H, с), 7,82 (1H, д, J=7,6 Гц), 7,70 (1H, д, J=4,8 Гц), 7,64 (1H, д, J=8,0 Гц), 7,46 (1H, т, J=7,6 Гц), 7,26 (1H, д, J=4,4 Гц), 5,42 (1H, д, J=6,0 Гц), 5,30 (1H, д, J=4,4 Гц), 4,78 (1H, д, J=6,8 Гц), 4,74 (1H, д, J=6,4 Гц), 4,63 (1H, ушир.с), 4,41 (1H, ушир.с), 3,83 (3H, с), 3,26 (1H, дд, J=10,8, 4,4 Гц), 2,82 (1H, дд, J=10,8, 3,6 Гц).
LC-MS MS(EI) для C18H19N5O4S [M+H]+, (Рассч.: 401,12) Найдено: 402,3.
Пример 91: Синтез (2S,3R,4S)-2-(8-((3-морфолинобензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,66 (1H, т, J=6,6 Гц), 7,68 (1H, д, J=4,8 Гц), 7,27 (1H, д, J=4,8 Гц), 7,14 (1H, т, J=8,0 Гц), 6,98 (1H, с), 6,79 (2H, д, J=7,6 Гц), 5,42 (1H, д, J=5,6 Гц), 5,30 (1H, д, J=4,4 Гц), 4,77 (1H, д, J=7,2 Гц), 4,63 (1H, д, J=4,4 Гц), 4,42-4,40 (3H, м), 3,72 (4H, т, J=4,4 Гц), 3,26 (1H, дд, J=10,6, 4,2 Гц), 3,06 (4H, т, J=4,4 Гц), 2,83 (1H, дд, J=11,2, 3,2 Гц).
LC-MS MS(EI) для C20H24N6O3S [M+H]+, (Рассч.: 428,51) Найдено: 429,3.
Пример 92: Синтез (2S,3R,4S)-2-(8-((3-хлорбензил)тио)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,35 (1H, д, J=4,8 Гц), 7,81 (1H, д, J=4,8 Гц), 7,56 (1H, с), 7,45 (1H, д, J=6,8 Гц), 7,38-7,32 (2H, м), 5,44 (1H, д, J=6,0 Гц), 5,34 (1H, д, J=3,2 Гц), 4,87 (1H, д, J=7,2 Гц), 4,61 (3H, с), 4,41 (1H, с), 3,28-3,27 (1H, м), 2,83 (1H, дд, J=10,8, 2,8 Гц).
LC-MS MS(EI) для C16H15ClN4O2S2 [M+H]+, (Рассч.: 394,03) Найдено: 395,2.
Пример 93: Синтез (2S,3R,4S)-2-(8-((3-фтор-4-(5-метилоксазол-2-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,85 (1H, т, J=6,6 Гц), 7,89 (1H, т, J=8,0 Гц), 7,72 (1H, д, J=4,4 Гц), 7,34-7,26 (3H, м), 7,02 (1H, с), 5,42 (1H, д, J=6,0 Гц), 5,31 (1H, д, J=4,4 Гц), 4,79 (1H, д, J=7,2 Гц), 4,74 (2H, д, J=5,2 Гц), 4,69-4,63 (1H, м), 4,49-4,41 (1H, м), 3,26 (1H, дд, J=10,6, 3,8 Гц), 2,83 (1H, дд, J=11,0, 3,4 Гц), 2,37 (3H, с).
LC-MS MS(EI) для C20H19FN6O3S [M+H]+, (Рассч.: 442,12) Найдено: 443,2.
Пример 94: Синтез (2S,3R,4S)-2-(8-((3-фтор-4-(5-метилтиазол-2-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,85 (1H, т, J=6,8 Гц), 8,09 (1H, т, J=8,0 Гц), 7,72 (1H, д, J=4,8 Гц), 7,67 (1H, с), 7,36-7,31 (2H, м), 7,27 (1H, д, J=4,8 Гц), 5,42 (1H, д, J=5,6 Гц), 5,31 (1H, д, J=4,4 Гц), 4,78 (1H, д, J=7,6 Гц), 4,73 (2H, д, J=5,6 Гц), 4,66-4,63 (1H, м), 4,42-4,41 (1H, м), 3,26 (1H, дд, J=10,6, 4,2 Гц), 2,82 (1H, дд, J=10,8, 3,6 Гц).
* Протоны из CH3 перекрываются пиком DMSO при 2,5 м.д.
LC-MS MS(EI) для C20H19FN6O2S2 [M+H]+, (Рассч.: 458,10) Найдено: 459,2.
Пример 95: Синтез (2S,3R,4S)-2-(8-((3-фтор-4-(5-метил-1,3,4-оксадиазол-2-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,92-8,85 (1H, м), 7,93 (1H, т, J=7,8 Гц), 7,73 (1H, д, J=4,4 Гц), 7,43-7,37 (2H, м), 7,26 (1H, д, J=5,2 Гц), 5,43 (1H, д, J=5,6 Гц), 5,32 (1H, д, J=3,6 Гц), 4,80-4,76 (3H, м), 4,63 (1H, ушир.с), 4,42 (1H, ушир.с), 3,28 (1H, дд, J=11,0, 4,2 Гц), 2,84-2,81 (1H, м), 2,58 (3H, с).
LC-MS MS(EI) для C19H18FN7O3S [M+H]+, (Рассч.: 443,12) Найдено: 444,2.
Пример 96: Синтез (2S,3R,4S)-2-(8-((3-(2-метил-2H-тетразол-5-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,91 (1H, т, J=7,0 Гц), 8,08 (1H, с), 7,91 (1H, д, J=7,2 Гц), 7,70 (1H, д, J=4,8 Гц), 7,52-7,47 (2H, м), 7,27 (1H, д, J=4,8 Гц), 5,43 (1H, д, J=5,6 Гц), 5,31 (1H, д, J=4,4 Гц), 4,79-4,77 (3H, м), 4,65-4,62 (1H, м), 4,41 (4H, с), 3,26 (1H, дд, J=10,6, 4,2 Гц), 2,82 (1H, дд, J=10,4, 2,4 Гц).
LC-MS MS(EI) для C18H19N9O2S [M+H]+, (Рассч.: 425,14) Найдено: 426,2.
Пример 97: Синтез (2S,3R,4S)-2-(8-((3-фтор-4-(5-метил-1,3,4-тиадиазол-2-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,88-8,84 (1H, м), 8,16 (1H, т, J=7,6 Гц), 7,72 (1H, д, J=4,8 Гц), 7,43-7,37 (2H, м), 7,26 (1H, д, J=5,2 Гц), 5,42 (1H, д, J=5,2 Гц), 5,31 (1H, с), 4,80-4,75 (3H, м), 4,63 (1H, ушир.с), 4,42 (1H, ушир.с), 3,28-3,24 (1H, м), 2,83 (1H, дд, J=11,0, 3,4 Гц), 2,79 (3H, с).
LC-MS MS(EI) для C19H18FN7O2S2 [M+H]+, (Рассч.: 459,09) Найдено: 460,2.
Пример 98: Синтез (2S,3R,4S)-2-(8-(((1S,2R)-2-(3-фторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,60 (1H, д, J=4,0 Гц), 7,25 (1H, д, J=4,8 Гц), 7,34-7,28 (2H, м), 7,04-6,97 (3H, м), 5,43 (1H, д, J=6,0 Гц), 5,32 (1H, д, J=4,4 Гц), 4,78 (1H, д, J=7,2 Гц), 4,64-4,62 (1H, м), 4,41 (1H, ушир.с), 3,26 (1H, дд, J=10,8, 4,4 Гц), 3,17-3,16 (1H, м), 2,82 (1H, дд, J=10,4, 3,2 Гц), 2,14 (1H, ушир.с), 1,59-1,54 (1H, м), 1,35-1,30 (1H, м).
LC-MS MS(EI) для C18H18FN5O2S [M+H]+, (Рассч.: 387,12) Найдено: 388,2.
Пример 99: Синтез (2S,3R,4S)-2-(8-(((1S,2R)-2-(3-хлорфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,61 (1H, д, J=3,6 Гц), 7,73 (1H, д, J=4,8 Гц), 7,32-7,30 (2H, м), 7,29-7,22 (2H, м), 7,15 (1H, д, J=7,6 Гц), 5,43 (1H, д, J=6,0 Гц), 5,32 (1H, д, J=4,0 Гц), 4,78 (1H, д, J=7,2 Гц), 4,63 (1H, ушир.с), 4,41 (1H, ушир.с), 3,26 (1H, дд, J=10,6, 4,6 Гц), 3,09 (1H, ушир.с), 2,82 (1H, дд, J=11,0, 3,4 Гц), 2,13 (1H, ушир.с), 1,58-1,56 (1H, м), 1,36-1,32 (1H, м).
LC-MS MS(EI) для C18H18ClN5O2S [M+H]+, (Рассч.: 403,09) Найдено: 404,2.
Пример 100: Синтез (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
СТАДИЯ 1 Получение 2-хлор-3-гидразинилпиразина
К раствору 2,3-дихлорпиразина (10,0 г, 67,1 ммоль) в EtOH (224 мл) добавляли гидразин гидрат (6,72 г, 134 ммоль) при комнатной температуре. Реакционную смесь кипятили с обратным холодильником в течение 3 часов. Осажденное твердое вещество собирали фильтрованием, промывали EtOH и сушили в вакууме с получением 2-хлор-3-гидразинилпиразина (7,80 г, 80%) в виде оранжевого твердого вещества.
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,30 (1H, ушир.с), 8,07 (1H, д, J=2,4 Гц), 7,57 (1H, д, J=2,8 Гц), 4,34 (2H, ушир.с).
СТАДИЯ 2 Получение N'-(3-хлорпиразин-2-ил)-2,2,2-трифторацетогидразида
К раствору 2-хлор-3-гидразинилпиразина (4,50 г, 31,1 ммоль) в THF (104 мл) добавляли по каплям TFAA (5,72 мл, 40,5 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и гасили водой. Смесь экстрагировали DCM, промывали водой, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением N'-(3-хлорпиразин-2-ил)-2,2,2-трифторацетогидразида (2,76 г, 37%) в виде желтого твердого вещества, который использовали на следующей реакции без дополнительной очистки.
1H-ЯМР (DMSO-d6, 400 МГц): δ 11,6 (1H, с), 9,47 (1H, с), 8,18 (1H, д, J=2,8 Гц), 7,88 (1H, д, J=2,4 Гц).
СТАДИЯ 3 Получение N'-(3,5-дихлорпиразин-2-ил)-2,2,2-трифторацетогидразида
К раствору N'-(3-хлорпиразин-2-ил)-2,2,2-трифторацетогидразида (2,76 г, 11,5 ммоль) в CHCl3 (38 мл) добавляли NCS (2,30 г, 17,2 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, разбавляли водой и экстрагировали DCM. Отделенный органический слой промывали водой, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=5:1) с получением N'-(3,5-дихлорпиразин-2-ил)-2,2,2-трифторацетогидразида (1,50 г, 48%) в виде желтого твердого вещества.
1H-ЯМР (DMSO-d6, 400 МГц): δ 11,7 (1H, с), 9,67 (1H, с), 8,35 (1H, с).
СТАДИЯ 4 Получение 3,5-дихлор-2-гидразинилпиразина
К раствору N'-(3,5-дихлорпиразин-2-ил)-2,2,2-трифторацетогидразида (1,50 г, 5,45 ммоль) в EtOH (27 мл) добавляли конц. HCl (3,31 мл, 109 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 80°C в течение 4 часов. После нейтрализации насыщенным водн. Na2CO3, смесь экстрагировали EtOAc. Отделенный органический слой промывали водой, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (Гексан:EtOAc=5:1) с получением 3,5-дихлор-2-гидразинилпиразина (900 мг, 92%) в виде желтого твердого вещества.
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,54 (1H, ушир.с), 8,20 (1H, с), 4,40 (2H, ушир.с).
СТАДИЯ 4 Получение 6,8-дихлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина
Смесь (3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-карбальдегида (850 мг, 4,52 ммоль) и 3,5-дихлор-2-гидразинилпиразина (889 мг, 4,97 ммоль) в DCM (45 мл) перемешивали при комнатной температуре в течение 1 часа и охлаждали до 0°C. После добавления PhI(OAc)2 (2,18 г, 6,77 ммоль) при 0°C, реакционную смесь перемешивали при комнатной температуре в течение 3 часов, и затем промывали насыщенным водн. NaHCO3 и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=3:1) с получением 6,8-дихлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина (493 мг, 31%) в виде желтого твердого вещества
1H-ЯМР (CDCl3, 400 МГц): δ 7,95 (1H, с), 5,73 (1H, д, J=4,4 Гц), 5,30 (1H, с), 4,60 (1H, с), 3,02 (1H, д, J=13,2 Гц), 2,92 (1H, дд, J=13,2, 3,6 Гц), 1,59 (3H, с), 1,42 (3H, с).
СТАДИЯ 5 Получение 6-хлор-N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-амина
Смесь 6,8-дихлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина (50,0 мг, 0,144 ммоль), (3-хлорфенил)метанамина (24,0 мг, 0,173 ммоль) и DIPEA (30,0 мкл, 0,173 ммоль) в EtOH (2,0 мл) перемешивали при комнатной температуре в течение 18 часов. После концентрации в вакууме, остаток разбавляли EtOAc и промывали водой и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (Гексан:EtOAc=1:1) с получением 6-хлор-N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-амина (50,0 мг, 77%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 7,40 (1H, ушир.с), 7,30-7,29 (4H, м), 6,85 (1H, ушир.с), 5,64 (1H, д, J=5,2 Гц), 5,25 (1H, ушир.с), 4,90-4,80 (2H, м), 4,51 (1H, с), 3,00-2,97 (2H, м), 1,56 (3H, с), 1,40 (3H, с).
СТАДИЯ 6 Получение (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
Раствор 6-хлор-N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-амина (50,0 мг, 0,111 ммоль) в 80% TFA (0,111 мл, 0,111 ммоль) перемешивали при комнатной температуре в течение 30 мин. После концентрации в вакууме, остаток разбавляли DCM, и затем TEA добавляли к раствору до значения pH 7. Смесь перемешивали при комнатной температуре в течение 20 мин и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (EtOAc:MeOH= 10:1) с получением (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (30,0 мг, 65%) в виде белого твердого вещества.
1H-ЯМР (DMSO-d6, 400 МГц): δ 9,34-9,28 (1H, м), 7,92 (1H, с), 7,43 (1H, с), 7,38-7,32 (3H, м), 5,42 (1H, д, J=5,2 Гц), 5,30 (1H, д, J=4,0 Гц), 4,78 (1H, д, J=7,2 Гц), 4,65 (2H, д, J=4,8 Гц), 4,55 (1H, ушир.с), 4,40 (1H, ушир.с), 3,27 (1H, дд, J=10,6, 4,2 Гц), 2,82-2,80 (1H, м).
LC-MS MS(EI) для C16H15Cl2N5O2S [M+H]+, (Рассч.: 411,03) Найдено: 412,1
Пример 101: Синтез (2S,3R,4S)-2-(6-хлор-8-((2,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 9,29 (1H, с), 7,96 (1H, с), 7,52 (1H, д, J=8,4 Гц), 7,43-7,38 (2H, м), 5,43 (1H, д, J=5,6 Гц), 5,30 (1H, д, J=4,8 Гц), 4,79 (1H, д, J=7,2 Гц), 4,71-4,69 (2H, м), 4,58-4,55 (1H, м), 4,43-4,40 (1H, м), 3,27 (1H, дд, J=10,6, 4,6 Гц), 2,82 (1H, дд, J=10,6, 3,4 Гц).
LC-MS MS(EI) для C16H14Cl3N5O2S [M+H]+, (Рассч.: 444,99) Найдено: 448,1
Пример 102: Синтез (2S,3R,4S)-2-(6-хлор-8-((3,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 9,30 (1H, т, J=3,4 Гц), 7,95 (1H, с), 7,50 (1H, с), 7,43 (2H, с), 5,42 (1H, д, J=5,2 Гц), 5,30 (1H, д, J=2,8 Гц), 4,78 (1H, д, J=7,2 Гц), 4,65 (2H, д, J=4,8 Гц), 4,56-4,54 (1H, м), 4,41-4,39 (1H, м), 3,27 (1H, дд, J=10,8, 4,4 Гц), 2,82 (1H, дд, J=10,4, 3,6 Гц).
LC-MS MS(EI) для C16H14Cl3N5O2S [M+H]+, (Рассч.: 444,99) Найдено: 448,0
Пример 103: Синтез (2S,3R,4S)-2-(6-хлор-8-((5-хлор-2-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 9,29 (1H, ушир.с), 7,95 (1H, с), 7,46-7,45 (1H, м), 7,39-7,37 (1H, м), 7,27 (1H, т, J=9,2 Гц), 5,42 (1H, д, J=5,6 Гц), 5,30 (1H, д, J=4,4 Гц), 4,79 (1H, д, J=7,2 Гц), 4,68-4,67 (2H, м), 4,56 (1H, ушир.с), 4,41 (1H, ушир.с), 3,27 (1H, дд, J=10,6, 4,6 Гц), 2,81 (1H, дд, J=10,2, 3,8 Гц).
LC-MS MS(EI) для C16H14Cl2FN5O2S [M+H]+, (Рассч.: 429,02) Найдено: 430,1
Пример 104: Синтез (2S,3R,4S)-2-(6-хлор-8-((4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,81 (1H, т, J=4,8 Гц), 7,88 (1H, с), 7,31-7,28 (2H, м), 7,11 (2H, т, J=9,0 Гц), 5,42 (1H, д, J=5,6 Гц), 5,30 (1H, д, J=4,0 Гц), 4,77 (1H, д, J=6,8 Гц), 4,58-4,54 (1H, м), 4,42-4,37 (1H, м), 3,68-3,62 (2H, м), 3,26 (1H, дд, J=10,5, 4,1 Гц), 2,94 (2H, т, J=6,8 Гц), 2,81 (1H, дд, J=10,3, 4,2 Гц).
LC-MS MS(EI) для C17H17ClFN5O2S [M+H]+, (Рассч.: 409,08) Найдено: 410,2
Пример 105: Синтез (2S,3R,4S)-2-(6-хлор-8-((3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,83-8,80 (1H, м), 7,88 (1H, с), 7,35-7,30 (1H, м), 7,14-7,09 (2H, м), 7,02 (1H, т, J=8,6 Гц), 5,43 (1H, д, J=5,6 Гц), 5,30 (1H, д, J=4,4 Гц), 4,77 (1H, д, J=6,4 Гц), 4,55 (1H, ушир.с), 4,40 (1H, ушир.с), 3,70-3,68 (2H, м), 3,25 (1H, дд, J=10,6, 4,6 Гц), 2,98 (2H, т, J=7,0 Гц), 2,81 (1H, дд, J=10,4, 4,0 Гц).
LC-MS MS(EI) для C17H17ClFN5O2S [M+H]+, (Рассч.: 409,08) Найдено: 410,2
Пример 106: Синтез (2S,3R,4S)-2-(6-хлор-8-((3,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,88 (1H, с), 7,94 (1H, с), 7,45-7,35 (2H, м), 7,18-7,13 (1H, м), 5,48 (1H, д, J=6,4 Гц), 5,37 (1H, д, J=4,4 Гц), 4,83 (1H, д, J=6,8 Гц), 4,62-4,61 (1H, м), 4,47-4,46 (1H, м), 3,75-3,73 (2H, м), 3,32 (1H, дд, J=13,2, 4,4 Гц), 3,01 (2H, т, J=4,8 Гц), ), 2,87 (1H, д, J=8,0 Гц).
LC-MS MS(EI) для C17H16ClF2N5O2S [M+H]+, (Рассч.: 427,07) Найдено: 428,1
Пример 107: Синтез (2S,3R,4S)-2-(6-хлор-8-((4-хлор-3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,82-8,76 (1H, м), 7,84 (1H, с), 7,44 (1H, д, J=8,0 Гц), 7,32 (1H, д, J=10,8 Гц), 7,09 (1H, д, J=8,0 Гц), 5,39 (1H, д, J=6,0 Гц), 5,26 (1H, д, J=4,4 Гц), 4,73 (1H, д, J=6,8 Гц), 4,54-4,50 (1H, м), 4,37-4,36 (1H, м), 3,66-3,65 (2H, м), 3,22 (1H, дд, J=10,4, 4,4 Гц), 2,93 (2H, т, J=6,8 Гц), 2,78 (1H, дд, J=10,4, 3,6 Гц).
LC-MS MS(EI) для C17H16Cl2FN5O2S [M+H]+, (Рассч.: 443,04) Найдено: 444,1
Пример 108: Синтез (2S,3R,4S)-2-(6-хлор-8-(((1S,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 9,13 (1H, с), 7,93 (1H, с), 7,31-7,18 (4H, м), 5,43 (1H, д, J=5,6 Гц), 5,30 (1H, д, J=4,0 Гц), 4,79 (1H, д, J=7,2 Гц), 4,58-4,53 (1H, м), 4,42-4,38 (1H, м), 3,26 (1H, дд, J=12,8, 6,0 Гц), 3,12-3,06 (1H, м), 2,81 (1H, дд, J=11,2, 3,2 Гц), 2,23-2,17 (1H, м), 1,49-1,46 (1H, м), 1,34-1,32 (1H, м). * Протон не наблюдался.
LC-MS MS(EI) для C18H18ClN5O2S [M+H]+, (Рассч.: 403,09) Найдено: 404,1
Пример 109: Синтез (2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
СТАДИЯ 1 Получение (S)-2-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-2-гидроксиэтил-4-метилбензолсульфоната
К раствору (S)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этан-1,2-диола (19,0 г, 86,0 ммоль) в пиридине (108 мл) добавляли по каплям раствор p-TsCl (21,38 г, 112 ммоль) в пиридине (50 мл) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и выливали на ледяную воду. Смесь экстрагировали DCM дважды. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=7:1-3:1) с получением (S)-2-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-2-гидроксиэтил-4-метилбензолсульфоната (28,6 г, 89%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 7,80 (д, J=8,8 Гц, 2H), 7,37 (д, J=8,4 Гц, 2H), 4,90 (дд, J=5,2, 4,0 Гц, 1H), 4,78 (дд, J=5,6, 1,2 Гц, 1H), 4,14-4,08 (м, 2H), 3,99 (дд, J=14,4, 8,0 Гц, 1H), 3,32 (ушир.с, 1H), 3,18 (дд, J=12,4, 4,8 Гц, 1H), 2,84 (д, J=12,4 Гц, 1H), 2,48-2,44 (м, 4H), 1,50 (с, 3H), 1,31 (с, 3H).
СТАДИЯ 2 Получение (S)-2-азидо-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола
К раствору (S)-2-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-2-гидроксиэтил-4-метилбензолсульфоната (28,6 г, 76,0 ммоль) в DMF (219 мл) добавляли азид натрия (24,9 г, 382 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 120°C в течение 3 ч, охлаждали до комнатной температуры и разделяли между EtOAc и водой. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=5:1-2:1) с получением (S)-2-азидо-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (17,8 г, 95%) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц): δ 4,93 (тд, J=5,5, 1,7 Гц, 1H), 4,74 (дд, J=5,8, 1,8 Гц, 1H), 3,84-3,89 (м, 1H), 3,49-3,37 (м, 3H), 3,17 (дд, J=12,6, 5,0 Гц, 1H), 2,91 (дд, J=12,4, 2,0 Гц, 1H), 2,37 (д, J=5,6 Гц, 1H), 1,53 (с, 3H), 1,33 (с, 3H).
СТАДИЯ 3 Получение (S)-2-амино-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола
К раствору (S)-2-азидо-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (17,8 г, 72,6 ммоль) в MeOH (363 мл) добавляли трифенилфосфин (28,5 г, 109 ммоль) при комнатной температуре. Реакционную смесь кипятили с обратным холодильником в течение 2 ч и затем концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (только EtOAc до EtOAc:MeOH=10:1), и затем полученное твердое вещество перекристаллизовывали из петролейного эфира и EtOAc, и собирали фильтрованием. Отфильтрованное твердое вещество промывали петролейным эфиром и сушили в вакууме с получением (S)-2-амино-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (8,63 г, 54%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 4,94 (т, J=4,4 Гц, 1H), 4,79 (д, J=7,2 Гц, 1H), 3,69-3,65 (м, 1H), 3,31 (д, J=3,2 Гц, 1H), 3,21 (дд, J=12,4, 5,2 Гц, 1H), 2,89-2,85 (м, 2H), 2,76 (дд, J=12,8, 8,0 Гц, 1H), 1,87 (ушир.с, 2H), 1,53 (с, 3H), 1,33 (с, 3H).
СТАДИЯ 4 Получение (S)-2-((3-хлорпиразин-2-ил)амино)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола
К раствору (S)-2-амино-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (8,63 г, 39,4 ммоль) в 1,4-диоксане (131 мл) добавляли 2,3-дихлорпиразин (17,6 г, 118 ммоль) и TEA (27,4 мл, 197 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 110°C в течение 24 ч и концентрировали в вакууме. Остаток растворяли в DCM и промывали водой. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=3:1) с получением (S)-2-((3-хлорпиразин-2-ил)амино)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (11,0 г, 84%) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц): δ 7,91 (д, J=2,8 Гц, 1H), 7,63 (д, J=2,8 Гц, 1H), 5,65 (т, J=6,0 Гц, 1H), 4,95 (тд, J=5,6, 1,9 Гц, 1H), 4,77 (дд, J=5,6, 2,4 Гц, 1H), 3,97-3,93 (м, 1H) 3,73 (ддд, J=14,4, 6,8, 3,2 Гц, 1H), 3,63-3,57 (м, 1H), 3,55 (д, J=4,8 Гц, 1H), 3,41 (дд, J=5,2, 2,0 Гц, 1H), 3,21 (дд, J=12,4, 5,6 Гц, 1H), 2,92 (дд, J=12,8, 1,6 Гц, 1H), 1,54 (с, 3H), 1,34 (с, 3H).
СТАДИЯ 5 Получение 2-((3-хлорпиразин-2-ил)амино)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанона
К раствору (S)-2-((3-хлорпиразин-2-ил)амино)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (11,0 г, 33,2 ммоль) и TEA (38,9 мл, 279 ммоль) в DMSO (39 мл) добавляли комплекс триэтиламин-триоксид серы (9,01 г, 49,7 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем разделяли между EtOAc и водой. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=5:1-3:1) с получением 2-((3-хлорпиразин-2-ил)амино)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанона (7,03 г, 64%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,94 (д, J=2,8 Гц, 1H), 7,69 (д, J=2,8 Гц, 1H), 5,97 (ушир.с, 1H), 5,05-5,00 (м, 2H), 4,73 (дд, J=19,2, 5,2 Гц, 1H), 4,33 (дд, J=19,4, 5,0 Гц, 1H), 4,01 (с, 1H), 2,95-2,86 (м, 2H), 1,52 (с, 3H), 1,34 (с, 3H).
СТАДИЯ 6 Получение 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина
К раствору 2-((3-хлорпиразин-2-ил)амино)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанона (7,03 г, 21,3 ммоль) в толуоле (142 мл) добавляли пиридин (20,7 мл, 256 ммоль), затем TFA (11,5 мл, 149 ммоль) при 0°C. После перемешивания в течение 30 мин при комнатной температуре смесь охлаждали до 0°C, и затем к ней добавляли TFAA (21,1 мл, 149 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 3 ч. После концентрации в вакууме, остаток растворяли в DCM, промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=3:1-1:1), и затем полученное твердое вещество перекристаллизовывали из петролейного эфира и EtOAc и собирали фильтрованием. Отфильтрованное твердое вещество промывали петролейным эфиром и сушили в вакууме с получением 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина (5,25 г, 79%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 8,01 (д, J=4,4 Гц, 1H), 7,79 (д, J=4,8 Гц, 1H), 7,63 (с, 1H), 5,15-5,09 (м, 2H), 4,59 (с, 1H), 3,11-3,00 (м, 2H), 1,61 (с, 3H), 1,40 (с, 3H).
СТАДИЯ 7 Получение N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина
Смесь 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина (500 мг, 1,60 ммоль), (3-хлорфенил)метанамина (0,236 мл, 1,92 ммоль) и DIPEA (0,700 мл, 4,01 ммоль) в i-BuOH (8,0 мл) подвергали микроволновому облучению при 170°C в течение 4 ч. (Реакцию повторяли 4 раза в том же масштабе). Объединенную реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc и промывали водой и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (Гексан:EtOAc=1:1) с получением N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (2,40 г, 90%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 7,44 (д, J=4,8 Гц, 1H), 7,39-7,40 (м, 2H), 7,26-7,25 (м, 4H), 6,32-6,24 (м, 1H), 5,10-5,05 (м, 2H), 4,78 (д, J=6,4 Гц, 2H), 4,55 (с, 1H), 3,05-3,04 (м, 2H), 1,60 (с, 3H), 1,38 (с, 3H).
СТАДИЯ 8 Получение (2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
Раствор N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (2,40 г, 5,76 ммоль) в 80% водн. TFA (46 мл) перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали в вакууме. Остаток разбавляли DCM, и затем TEA добавляли к раствору до значения pH 7. Смесь перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (EtOAc:MeOH=10:1) с получением (2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (1,95 г, 90%) в виде белого твердого вещества.
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,14 (т, J=6,4 Гц, 1H), 7,66 (д, J=4,8 Гц, 1H), 7,52 (с, 1H), 7,38 (с, 1H), 7,32-7,26 (м, 4H), 5,32 (д, J=6,4 Гц, 1H), 5,23 (д, J=4,0 Гц, 1H), 4,66-4,63 (м, 3H), 4,28-4,22 (м, 2H), 3,24 (дд, J=10,8, 4,0 Гц, 1H), 2,77 (дд, J=8,6, 4,6 Гц, 1H).
LC-MS MS(EI) для C17H17ClN4O2S [M+H]+, (Рассч.: 376,86) Найдено: 377,2.
Пример 110: Синтез (2S,3R,4S)-2-(8-аминоимидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,70 (д, J=4,9 Гц, 1H), 7,57 (с, 1H), 7,39 (с, 2H), 7,24 (д, J=4,9 Гц, 1H), 5,36 (д, J=5,5 Гц, 1H), 5,26 (с, 1H), 4,65 (д, J=7,8 Гц, 1H), 4,25 (д, J=11,5 Гц, 2H), 3,24 (дд, J=10,9, 4,3 Гц, 2H), 2,76 (дд, J=11,0, 2,4 Гц, 1H).
LC-MS MS(EI) для C10H12N4O2S [M+H]+, (Рассч.: 252,07) Найдено: 253,1.
Пример 111: Синтез (2S,3R,4S)-2-(8-(метиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,61 (д, J=4,8 Гц, 1H), 7,49-7,42 (м, 2H), 7,30 (д, J=4,7 Гц, 1H), 5,34 (д, J=6,3 Гц, 1H), 5,25 (д, J=3,7 Гц, 1H), 4,63 (д, J=7,7 Гц, 1H), 4,25 (дд, J=11,2, 3,9 Гц, 2H), 3,23 (дд, J=10,9, 4,3 Гц, 1H), 2,92 (д, J=4,8 Гц, 3H), 2,76 (дд, J=10,9, 2,5 Гц, 1H).
LC-MS MS(EI) для C11H14N4O2S [M+H]+, (Рассч.: 266,08) Найдено: 267,1.
Пример 112: Синтез (2S,3R,4S)-2-(8-((циклопропилметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,61 (д, J=4,7 Гц, 1H), 7,51-7,41 (м, 2H), 7,28 (д, J=4,7 Гц, 1H), 5,29 (д, J=37,6 Гц, 2H), 4,63 (д, J=7,7 Гц, 1H), 4,26 (с, 2H), 3,31 (д, J=6,4 Гц, 2H), 3,23 (дд, J=10,9, 4,4 Гц, 1H), 2,76 (дд, J=10,9, 2,5 Гц, 1H), 1,22-1,11 (м, 1H), 0,45-0,37 (м, 2H), 0,31-0,22 (м, 2H).
LC-MS MS(EI) для C14H18N4O2S [M+H]+, (Рассч.: 306,12) Найдено: 307,1.
Пример 113: Синтез (2S,3R,4S)-2-(8-(циклобутиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,64-7,58 (м, 2H), 7,48 (с, 1H), 7,27 (д, J=4,7 Гц, 1H), 5,30 (д, J=32,7 Гц, 2H), 4,61 (дд, J=15,0, 7,9 Гц, 2H), 4,25 (д, J=6,7 Гц, 2H), 3,23 (дд, J=10,9, 4,4 Гц, 1H), 2,75 (дд, J=10,9, 2,6 Гц, 1H), 2,29-2,19 (м, 2H), 2,19-2,06 (м, 2H), 1,72-1,56 (м, 2H).
LC-MS MS(EI) для C14H18N4O2S [M+H]+, (Рассч.: 306,12) Найдено: 307,1.
Пример 114: Синтез (2S,3R,4S)-2-(8-(циклопропиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,66 (д, J=4,7 Гц, 1H), 7,57 (д, J=3,8 Гц, 1H), 7,46 (с, 1H), 7,34 (д, J=4,7 Гц, 1H), 5,34 (д, J=6,1 Гц, 1H), 5,25 (д, J=3,3 Гц, 1H), 4,63 (д, J=7,7 Гц, 1H), 4,24 (дд, J=10,7, 3,8 Гц, 2H), 3,23 (дд, J=10,9, 4,2 Гц, 1H), 2,89 (тд, J=7,1, 3,6 Гц, 1H), 2,76 (дд, J=10,9, 2,4 Гц, 1H), 0,74-0,65 (м, 2H), 0,65-0,58 (м, 2H).
LC-MS MS(EI) для C13H16N4O2S [M+H]+, (Рассч.: 292,10) Найдено: 293,1.
Пример 115: Синтез (2S,3R,4S)-2-(8-(изопентиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,59 (д, J=4,8 Гц, 1H), 7,46 (с, 1H), 7,37 (т, J=5,9 Гц, 1H), 7,28 (д, J=4,7 Гц, 1H), 5,36 (д, J=5,0 Гц, 1H), 5,29 (д, J=11,3 Гц, 1H), 4,62 (д, J=7,6 Гц, 1H), 4,29-4,21 (м, 2H), 3,46 (дд, J=14,2, 6,2 Гц, 2H), 3,23 (дд, J=10,8, 4,4 Гц, 1H), 2,75 (дд, J=10,9, 2,6 Гц, 1H), 1,62 (дт, J=13,2, 6,6 Гц, 1H), 1,50 (дд, J=14,3, 7,0 Гц, 2H), 0,90 (д, J=6,6 Гц, 6H).
LC-MS MS(EI) для C15H22N4O2S [M+H]+, (Рассч.: 322,15) Найдено: 323,1.
Пример 116: Синтез (2S,3R,4S)-2-(8-морфолиноимидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,78 (д, J=4,6 Гц, 1H), 7,56 (с, 1H), 7,40 (д, J=4,6 Гц, 1H), 5,38 (д, J=5,6 Гц, 1H), 5,27 (д, J=3,5 Гц, 1H), 4,65 (д, J=7,5 Гц, 1H), 4,27 (д, J=4,5 Гц, 2H), 4,18-4,12 (м, 4H), 3,76-3,69 (м, 4H), 3,23 (дд, J=10,8, 4,4 Гц, 1H), 2,77 (дд, J=10,8, 2,6 Гц, 1H).
LC-MS MS(EI) для C14H18N4O3S [M+H]+, (Рассч.: 322,11) Найдено: 323,1.
Пример 117: Синтез (2S,3R,4S)-2-(8-(пиперидин-1-ил)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,68 (д, J=4,6 Гц, 1H), 7,53 (с, 1H), 7,36 (д, J=4,5 Гц, 1H), 5,30 (т, J=20,3 Гц, 2H), 4,63 (д, J=7,6 Гц, 1H), 4,26 (д, J=5,8 Гц, 2H), 4,22-4,06 (м, 4H), 3,22 (дд, J=10,8, 4,4 Гц, 1H), 2,77 (дд, J=10,8, 2,6 Гц, 1H), 1,73-1,62 (м, 2H), 1,58 (д, J=4,0 Гц, 4H).
LC-MS MS(EI) для C15H20N4O2S [M+H]+, (Рассч.: 320,13) Найдено: 321,1.
Пример 118: Синтез (2S,3R,4S)-2-(8-(4-бензилпиперидин-1-ил)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,69 (д, J=4,6 Гц, 2H), 7,52 (с, 2H), 7,36 (д, J=4,5 Гц, 2H), 7,31-7,24 (м, 4H), 7,19 (дд, J=7,3, 2,9 Гц, 6H), 5,43-5,30 (м, 6H), 5,25 (д, J=1,9 Гц, 2H), 4,63 (д, J=7,6 Гц, 2H), 4,26 (с, 4H), 3,22 (дд, J=10,9, 4,5 Гц, 2H), 2,95 (т, J=11,7 Гц, 4H), 2,76 (дд, J=10,8, 2,6 Гц, 2H), 1,85 (с, 2H), 1,65 (д, J=11,2 Гц, 4H), 1,29-1,14 (м, 5H).
LC-MS MS(EI) для C22H26N4O2S [M+H]+, (Рассч.: 410,18) Найдено: 411,2.
Пример 119: Синтез (2S,3R,4S)-2-(8-(4-(4-фторбензил)пиперазин-1-ил)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,74 (д, J=4,6 Гц, 1H), 7,54 (с, 1H), 7,37 (дд, J=7,8, 5,2 Гц, 3H), 7,16 (т, J=8,9 Гц, 2H), 5,31 (д, J=42,1 Гц, 2H), 4,64 (д, J=7,6 Гц, 1H), 4,26 (с, 2H), 4,18 (с, 4H), 3,50 (с, 2H), 3,22 (дд, J=10,8, 4,4 Гц, 1H), 2,76 (дд, J=10,8, 2,6 Гц, 1H).
LC-MS MS(EI) для C21H24FN5O2S [M+H]+, (Рассч.: 429,16) Найдено: 430,2.
Пример 120: Синтез (2S,3R,4S)-2-(8-(бензиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,04 (т, J=6,3 Гц, 3H), 7,64 (д, J=4,8 Гц, 4H), 7,50 (с, 4H), 7,36-7,31 (м, 8H), 7,31-7,24 (м, 12H), 7,23-7,16 (м, 4H), 5,30 (д, J=38,9 Гц, 6H), 4,65 (т, J=8,1 Гц, 12H), 4,26 (с, 8H), 3,24 (дд, J=10,9, 4,4 Гц, 4H), 2,76 (дд, J=10,9, 2,4 Гц, 4H).
LC-MS MS(EI) для C17H18N4O2S [M+H]+, (Рассч.: 342,12) Найдено: 343,1.
Пример 121: Синтез (2S,3R,4S)-2-(8-((3-метилбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,99 (т, J=6,3 Гц, 1H), 7,63 (д, J=4,8 Гц, 1H), 7,50 (с, 1H), 7,26 (д, J=4,7 Гц, 1H), 7,14 (п, J=7,5 Гц, 3H), 7,01 (д, J=7,2 Гц, 1H), 5,33 (д, J=5,7 Гц, 1H), 5,24 (с, 1H), 4,67-4,60 (м, 3H), 4,26 (с, 2H), 3,24 (дд, J=10,9, 4,4 Гц, 1H), 2,76 (дд, J=10,9, 2,4 Гц, 1H), 2,26 (с, 3H).
LC-MS MS(EI) для C18H20N4O2S [M+H]+, (Рассч.: 356,13) Найдено: 357,1.
Пример 122: Синтез (2S,3R,4S)-2-(8-((3-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,13 (т, J=6,4 Гц, 1H), 7,65 (д, J=4,8 Гц, 1H), 7,52 (с, 1H), 7,33 (тд, J=7,9, 6,2 Гц, 1H), 7,26 (д, J=4,7 Гц, 1H), 7,15 (дд, J=16,8, 9,0 Гц, 2H), 7,02 (тд, J=8,3, 1,9 Гц, 1H), 5,34 (д, J=6,0 Гц, 1H), 5,24 (с, 1H), 4,71-4,62 (м, 3H), 4,26 (т, J=5,4 Гц, 2H), 3,24 (дд, J=10,8, 4,4 Гц, 1H), 2,76 (дд, J=10,9, 2,5 Гц, 1H).
LC-MS MS(EI) для C17H17FN4O2S [M+H]+, (Рассч.: 360,11) Найдено: 361,1.
Пример 123: Синтез (2S,3R,4S)-2-(8-((3-(трифторметил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,22 (т, J=6,3 Гц, 1H), 7,71 (с, 1H), 7,65 (т, J=5,9 Гц, 2H), 7,61-7,49 (м, 3H), 7,26 (д, J=4,7 Гц, 1H), 5,33 (д, J=6,4 Гц, 1H), 5,24 (д, J=3,7 Гц, 1H), 4,73 (д, J=6,3 Гц, 2H), 4,64 (д, J=7,7 Гц, 1H), 4,25 (дд, J=10,9, 4,3 Гц, 2H), 3,24 (дд, J=10,9, 4,3 Гц, 1H), 2,76 (дд, J=10,9, 2,5 Гц, 1H).
LC-MS MS(EI) для C18H17F3N4O2S [M+H]+, (Рассч.: 410,10) Найдено: 411,1.
Пример 124: Синтез (2S,3R,4S)-2-(8-((3-иодбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,13 (т, J=6,2 Гц, 1H), 7,72 (с, 1H), 7,65 (д, J=4,8 Гц, 1H), 7,57 (д, J=7,2 Гц, 1H), 7,52 (с, 1H), 7,35 (д, J=7,2 Гц, 1H), 7,26 (д, J=4,4 Гц, 1H), 7,10 (т, J=7,6 Гц, 1H), 5,33 (д, J=6,4 Гц, 1H), 5,24 (д, J=3,2 Гц, 1H), 4,65-4,61 (м, 3H), 4,27-4,24 (м, 2H), 3,24 (дд, J=10,6, 4,6 Гц, 1H), 2,76 (дд, J=10,8, 2,0 Гц, 1H).
LC-MS MS(EI) для C17H17IN4O2S [M+H]+, (Рассч.: 468,01) Найдено: 469,0.
Пример 125: Синтез 4-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-2-фтор-N-метилбензамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,15 (дт, J=8,7, 4,7 Гц, 2H), 7,66 (д, J=4,8 Гц, 1H), 7,57-7,51 (м, 2H), 7,25 (д, J=4,7 Гц, 1H), 7,20 (дд, J=13,6, 6,2 Гц, 2H), 5,33 (д, J=6,3 Гц, 1H), 5,24 (д, J=3,1 Гц, 1H), 4,66 (дд, J=13,3, 6,9 Гц, 3H), 4,29-4,22 (м, 2H), 3,25 (д, J=11,0 Гц, 1H), 2,80-2,71 (м, 4H).
LC-MS MS(EI) для C19H20FN5O3S [M+H]+, (Рассч.: 417,13) Найдено: 418,1.
Пример 126: Синтез 2-хлор-4-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-N-метилбензамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,28-8,24 (м, 1H), 8,19 (т, J=6,2 Гц, 1H), 7,65 (д, J=4,8 Гц, 1H), 7,52 (с, 1H), 7,42 (с, 1H), 7,34-7,30 (м, 2H), 7,25 (д, J=4,4 Гц, 1H), 5,33 (д, J=6,4 Гц, 1H), 5,24 (д, J=4,0 Гц, 1H), 4,65-4,63 (м, 3H), 4,27-4,24 (м, 2H), 3,24 (д, J=10,8, 4,0 Гц, 1H), 2,78 (дд, J=13,2, 2,4 Гц, 1H), 2,72 (д, J=4,8 Гц, 3H).
LC-MS MS(EI) для C19H20ClN5O3S [M+H]+, (Рассч.: 433,10) Найдено: 434,1.
Пример 127: Синтез (2S,3R,4S)-2-(8-((3-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,63 (т, J=4,8 Гц, 1H), 7,50-7,47 (м, 2H), 7,35-7,29 (м, 2H), 7,10-7,08 (м, 2H), 7,02 (т, J=8,4 Гц, 1H), 5,33 (д, J=6,0 Гц, 1H), 5,24 (д, J=3,2 Гц, 1H), 4,63 (д, J=7,6 Гц, 1H), 4,27-4,22 (м, 2H), 3,69 (кв, J=6,6 Гц, 2H), 3,24 (дд, J=11,2, 4,4 Гц, 1H), 2,96 (т, J=7,4 Гц, 2H), 2,76 (дд, J=11,0, 2,2 Гц, 1H).
LC-MS MS(EI) для C18H19FN4O2S [M+H]+, (Рассч.: 374,12) Найдено: 375,1.
Пример 128: Синтез (2S,3R,4S)-2-(8-(фенетиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,62 (д, J=4,8 Гц, 1H), 7,48-7,41 (м, 2H), 7,33-7,29 (м, 2H), 7,29-7,23 (м, 3H), 7,22-7,16 (м, 1H), 5,34 (д, J=6,4 Гц, 1H), 5,25 (д, J=3,8 Гц, 1H), 4,63 (д, J=7,7 Гц, 1H), 4,26 (д, J=4,5 Гц, 2H), 3,72-3,64 (м, 2H), 3,23 (дд, J=10,8, 4,3 Гц, 1H), 2,93 (т, J=7,4 Гц, 2H), 2,76 (дд, J=10,9, 2,5 Гц, 1H).
LC-MS MS(EI) для C18H20N4O2S [M+H]+, (Рассч.: 356,13) Найдено: 357,1.
Пример 129: Синтез (2S,3R,4S)-2-(8-((2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,86 (д, J=3,6 Гц, 1H), 7,66 (д, J=5,2 Гц, 1H), 7,49 (с, 1H), 7,30-7,25 (м, 3H), 7,18-7,16 (м, 3H), 5,33 (д, J=6,0 Гц, 1H), 5,23 (д, J=2,8 Гц, 1H), 4,64 (д, J=6,8 Гц, 1H), 4,29-4,21 (м, 2H), 3,24 (дд, J=7,6, 1,6 Гц, 1H), 3,16-3,13 (м, 1H), 2,76 (дд, J=11,2, 4,0 Гц, 1H), 2,10-2,04 (м, 1H), 1,52-1,46 (м, 1H), 1,29-1,20 (м, 1H).
LC-MS MS(EI) для C19H20N4O2S [M+H]+, (Рассч.: 368,13) Найдено: 369,1.
Пример 130: Синтез (2S,3R,4S)-2-(8-((тиофен-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,75 (1H, дд, J=11,6, 2,4 Гц), 3,24 (1H, дд, J=10,8, 4,0 Гц), 4,24-4,27 (2H, м), 4,64 (3H, д, J=5,6 Гц), 5,24 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=6,4 Гц), 7,11 (1H, д, J=5,2 Гц), 7,26-7,28 (1H, м), 7,29 (1H, д, J=4,4 Гц), 7,43 (1H, дд, J=4,6, 3,0 Гц), 7,49 (1H, с), 7,64 (1H, д, J=4,8 Гц), 7,92 (1H, т, J=6,4 Гц).
LC-MS MS(EI) для C15H16N4O2S2 [M+H]+, (Рассч.: 348,07) Найдено: 349,1.
Пример 131: Синтез (2S,3R,4S)-2-(8-((фуран-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=11,0, 2,2 Гц), 3,23 (1H, дд, J=11,0, 3,8 Гц), 4,23-4,27 (2H, м), 4,48 (2H, д, J=6,4 Гц), 4,64 (1H, д, J=7,2 Гц), 5,24 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=6,4 Гц), 6,49 (1H, с), 7,31 (1H, д, J=4,8 Гц), 7,48 (1H, с), 7,55 (2H, с), 7,64 (1H, д, J=4,4 Гц), 7,75 (1H, т, J=6,2 Гц).
LC-MS MS(EI) для C15H16N4O3S [M+H]+, (Рассч.: 332,09) Найдено: 333,2.
Пример 132: Синтез (2S,3R,4S)-2-(8-((3-бромбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=10,8, 2,0 Гц), 3,24 (1H, дд, J=10,4, 4,4 Гц), 4,24-4,26 (2H, м), 4,65 (3H, д, J=6,0 Гц), 5,24 (1H, д, J=3,6 Гц), 5,34 (1H, д, J=6,0 Гц), 7,23-7,27 (2H, м), 7,34 (1H, д, J=7,6 Гц), 7,40 (1H, д, J=8,0 Гц), 7,52-7,53 (2H, м), 7,66 (1H, д, J=4,8 Гц), 8,15 (1H, т, J=6,4 Гц).
LC-MS MS(EI) для C17H17BrN4O2S [M+H]+, (Рассч.: 420,03) Найдено: 423,2.
Пример 133: Синтез (2S,3R,4S)-2-(8-(циклопентиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,53-1,64 (4H, м), 1,69-1,72 (2H, м), 1,92-1,98 (2H, м), 2,76 (1H, дд, J=10,8, 2,4 Гц), 3,23 (1H, дд, J=10,8, 4,0 Гц), 4,22-4,26 (2H, м), 4,37-4,44 (1H, м), 4,63 (1H, д, J=7,6 Гц), 5,23 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=6,4 Гц), 7,16 (1H, д, J=7,2 Гц), 7,29 (1H, д, J=4,4 Гц), 7,47 (1H, с), 7,61 (1H, д, J=4,4 Гц).
LC-MS MS(EI) для C15H20N4O2S [M+H]+, (Рассч.: 320,13) Найдено: 321,2.
Пример 134: Синтез (2S,3R,4S)-2-(8-((пиридин-2-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,74 (1H, д, J=11,2 Гц), 3,23 (1H, дд, J=10,6, 4,2 Гц), 4,25 (2H, с), 4,64 (1H, д, J=8,0 Гц), 4,73 (2H, д, J=6,0 Гц), 5,24 (1H, д, J=2,8 Гц), 5,34 (1H, д, J=5,6 Гц), 7,21-7,28 (3H, м), 7,52 (1H, с), 7,64-7,71 (2H, м), 8,00 (1H, дт, J=6,0 Гц), 8,49 (1H, д, J=4,4 Гц).
LC-MS MS(EI) для C16H17N5O2S [M+H]+, (Рассч.: 343,11) Найдено: 344,3.
Пример 135: Синтез (2S,3R,4S)-2-(8-((пиридин-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,75 (1H, дд, J=10,8, 2,4 Гц), 3,23 (1H, дд, J=11,0, 4,2 Гц), 4,24-4,26 (2H, м), 4,63-4,68 (3H, м), 5,23 (1H, д, J=4,0 Гц), 5,32 (1H, д, J=6,4 Гц), 7,27 (1H, д, J=4,8 Гц), 7,30 (1H, дд, J=8,2, 5,0 Гц), 7,51 (1H, с), 7,66 (1H, д, J=4,8 Гц), 7,72-7,74 (1H, м), 8,16 (1H, т, J=6,0 Гц), 8,41 (1H, дд, J=5,0, 1,8 Гц), 8,57 (1H, д, J=1,6 Гц).
LC-MS MS(EI) для C16H17N5O2S [M+H]+, (Рассч.: 343,11) Найдено: 344,2.
Пример 136: Синтез (2S,3R,4S)-2-(8-((пиридин-4-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=10,2, 3,0 Гц), 3,24 (1H, дд, J=10,6, 4,2 Гц), 4,25-4,28 (2H, м), 4,64-4,68 (3H, м), 5,24 (1H, д, J=4,0 Гц), 5,34 (1H, д, J=6,4 Гц), 7,24 (1H, д, J=4,8 Гц), 7,29 (2H, д, J=5,6 Гц), 7,54 (1H, с), 7,67 (1H, д, J=4,8 Гц), 8,19 (1H, т, J=6,0 Гц), 8,44-8,46 (2H, м).
LC-MS MS(EI) для C16H17N5O2S [M+H]+, (Рассч.: 343,11) Найдено: 344,3.
Пример 137: Синтез (2S,3R,4S)-2-(8-((3-метоксибензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,72-2,75 (1H, д, J=10,8 Гц), 3,22 (1H, дд, J=10,8, 4,0 Гц), 3,68 (3H, с), 4,22-4,25 (2H, м), 4,60-4,63 (3H, м), 5,22 (1H, д, J=3,2 Гц), 5,31 (1H, д, J=6,4 Гц), 6,75 (1H, д, J=7,2 Гц), 6,88 (1H, д, J=7,2 Гц), 6,89 (1H, с), 7,17 (1H, т, J=7,6 Гц), 7,24 (1H, д, J=4,8 Гц), 7,49 (1H, с), 7,62 (1H, д, J=4,4 Гц), 7,99 (1H, т, J=10,0 Гц).
LC-MS MS(EI) для C18H20N4O3S [M+H]+, (Рассч.: 372,13) Найдено: 373,2.
Пример 138: Синтез (2S,3R,4S)-2-(8-(циклогексиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,14-1,20 (1H, м), 1,25-1,39 (4H, м), 1,57-1,61 (1H, м), 1,70-1,73 (2H, м), 1,86-1,90 (2H,м), 2,74 (1H, д, J=11,6 Гц), 3,21 (1H, дд, J=11,2, 4,0 Гц), 3,81-4,00 (1H, м), 4,23-4,24 (2H, м), 4,61 (1H, д, J=7,2 Гц), 5,21 (1H, д, J=4,0 Гц), 5,30 (1H, д, J=6,8 Гц), 7,01 (1H, д, J=8,4 Гц), 7,26 (1H, д, J=4,4 Гц), 7,44 (1H, с), 7,58 (1H, д, J=4,4 Гц).
LC-MS MS(EI) для C16H22N4O2S [M+H]+, (Рассч.: 334,15) Найдено: 335,2.
Пример 139: Синтез (2S,3R,4S)-2-(8-((циклогексилметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 0,89-0,92 (2H, м), 1,12-1,65 (3H, м), 1,59-1,70 (6H, м), 2,74 (1H, д, J=11,2 Гц), 3,21 (1H, дд, J=11,0, 3,8 Гц), 3,26-3,28 (2H, м), 4,23-4,24 (2H, м), 4,60 (1H, д, J=7,6 Гц), 5,31 (1H, с), 5,32 (1H, д, J=6,4 Гц), 7,25 (1H, д, J=4,4 Гц), 7,38 (1H, т, J=6,2 Гц), 7,44 (1H, с), 7,56 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C17H24N4O2S [M+H]+, (Рассч.: 348,16) Найдено: 349,3
Пример 140: Синтез (2S,3R,4S)-2-(8-((3-(трифторметокси)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=10,6, 2,2 Гц), 3,24 (1H, дд, J=10,8, 4,0 Гц), 4,24-4,27 (2H, м), 4,65 (1H, д, J=7,6 Гц), 4,69 (2H, д, J=6,0 Гц), 5,24 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=6,0 Гц), 7,20 (1H, д, J=8,0 Гц), 7,26 (1H, д, J=4,8 Гц), 7,32 (1H, с), 7,37 (1H, д, J=8,0 Гц), 7,42 (1H, т, J=8,0 Гц), 7,52 (1H, с), 7,66 (1H, д, J=5,2 Гц), 8,18 (1H, т, J=6,2 Гц).
LC-MS MS(EI) для C18H17F3N4O3S [M+H]+, (Рассч.: 426,10) Найдено: 427,2.
Пример 141: Синтез 3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензонитрила
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=11,0, 1,8 Гц), 3,24 (1H, дд, J=10,6, 3,8 Гц), 4,23-4,27 (2H, м), 4,64 (1H, д, J=7,2 Гц), 4,70 (2H, д, J=6,4 Гц), 5,24 (1H, д, J=3,6 Гц), 5,33 (1H, д, J=6,4 Гц), 7,26 (1H, д, J=4,8 Гц), 7,49-7,53 (2H, м), 7,66-7,69 (3H, м), 7,77 (1H, с), 8,19 (1H, т, J=6,4 Гц).
LC-MS MS(EI) для C18H17N5O2S [M+H]+, (Рассч.: 367,11) Найдено: 368,2.
Пример 142: Синтез (2S,3R,4S)-2-(8-((пиримидин-5-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,75 (1H, дд, J=10,4, 2,0 Гц), 3,24 (1H, дд, J=10,8, 3,6 Гц), 4,24-4,28 (2H, м), 4,63-4,67 (3H, м), 5,23 (1H, д, J=3,6 Гц), 5,33 (1H, д, J=6,4 Гц), 7,29 (1H, д, J=5,2 Гц), 7,52 (1H, с), 7,68 (1H, д, J=4,8 Гц), 8,22 (1H, т, J=6,0 Гц), 8,79 (2H, с), 9,04 (1H, с).
LC-MS MS(EI) для C15H16N6O2S [M+H]+, (Рассч.: 344,11) Найдено: 345,2.
Пример 143: Синтез (2S,3R,4S)-2-(8-((пиразин-2-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=10,8, 2,4 Гц), 3,25 (1H, дд, J=10,6, 4,2 Гц), 4,25-4,28 (2H, м), 4,65 (1H, д, J=8,0 Гц), 4,81 (2H, д, J=6,4 Гц), 5,24 (1H, д, J=3,2 Гц), 5,34 (1H, д, J=6,0 Гц), 7,25 (1H, д, J=4,4 Гц), 7,54 (1H, с), 7,68 (1H, д, J=4,4 Гц), 8,12 (1H, т, J=6,0 Гц), 8,50 (1H, д, J=2,4 Гц), 8,57 (1H, д, J=2,4 Гц), 8,58 (1H, с).
LC-MS MS(EI) для C15H16N6O2S [M+H]+, (Рассч.: 344,11) Найдено: 345,2.
Пример 144: Синтез (2S,3R,4S)-2-(8-((пиримидин-2-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=10,8 Гц), 3,25 (1H, дд, J=11,2, 4,0 Гц), 4,23-4,30 (2H, м), 4,66 (1H, д, J=8,0 Гц), 4,84 (2H, д, J=6,0 Гц), 5,25 (1H, д, J=3,6 Гц), 5,35 (1H, д, J=6,8 Гц), 7,23 (1H, д, J=4,8 Гц), 7,38 (1H, т, J=5,0 Гц), 7,53 (1H, с), 7,66 (1H, д, J=5,2 Гц), 7,77 (1H, т, J=4,8 Гц), 8,76 (2H, д, J=4,8 Гц).
LC-MS MS(EI) для C15H16N6O2S [M+H]+, (Рассч.: 344,11) Найдено: 345,3.
Пример 145: Синтез (2S,3R,4S)-2-(8-((пиримидин-4-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=11,4, 1,0 Гц), 3,25 (1H, дд, J=11,8, 4,6 Гц), 4,25-4,29 (2H, м), 4,66 (1H, д, J=8,0 Гц), 4,72 (2H, д, J=5,6 Гц), 5,26 (1H, д, J=3,6 Гц), 5,35 (1H, д, J=6,4 Гц), 7,23 (1H, д, J=4,8 Гц), 7,36 (1H, д, J=5,2 Гц), 7,56 (1H,s), 7,69 (1H, д, J=4,8 Гц), 8,15 (1H, т, J=4,4 Гц), 8,66 (1H, д, J=5,2 Гц), 9,09 (1H, с).
LC-MS MS(EI) для C15H16N6O2S [M+H]+, (Рассч.: 344,11) Найдено: 345,2.
Пример 146: Синтез (2S,3R,4S)-2-(8-((3-хлорфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=14,8, 6,0 Гц), 2,95 (2H, т, J=7,0 Гц), 3,23 (1H, дд, J=11,0, 3,8 Гц), 3,69 (2H, кв, J=6,8 Гц), 4,25-4,26 (2H, м), 4,63 (1H, д, J=7,6 Гц), 5,23 (1H, д, J=3,6 Гц), 5,33 (1H, д, J=6,8 Гц), 7,21-7,24 (1H, м), 7,26 (1H, с), 7,29-7,34 (3H, м), 7,47 (1H, с), 7,48-7,51 (1H, м), 7,63 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C18H19ClN4O2S [M+H]+, (Рассч.: 390,09) Найдено: 391,3.
Пример 147: Синтез (2S,3R,4S)-2-(8-((тиазол-4-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,74 (1H, д, J=11,2 Гц), 3,22 (1H, дд, J=10,6, 3,8 Гц), 4,25-4,26 (2H, м), 4,63 (1H, д, J=7,6 Гц), 4,79 (2H, д, J=6,0 Гц), 5,23 (1H, д, J=3,6 Гц), 5,32 (1H, д, J=6,4 Гц), 7,26 (1H, д, J=4,4 Гц), 7,34 (1H, с), 7,50 (1H, с), 7,65 (1H, д, J=4,8 Гц), 7,90 (1H, т, J=6,0 Гц), 9,02 (1H, с).
LC-MS MS(EI) для C14H15N5O2S2 [M+H]+, (Рассч.: 349,07) Найдено: 350,2.
Пример 148: Синтез (2S,3R,4S)-2-(8-((тиазол-2-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=10,6, 2,2 Гц), 3,25 (1H, дд, J=10,2, 3,8 Гц), 4,25-4,28 (2H, м), 4,66 (1H, д, J=8,0 Гц), 4,92 (2H, д, J=6,4 Гц), 5,24 (1H, д, J=3,6 Гц), 5,35 (1H, д, J=6,4 Гц), 7,31 (1H, д, J=4,8 Гц), 7,54 (1H, д, J=3,6 Гц), 7,55 (1H, с), 7,71 (1H, д, J=3,2 Гц), 7,72 (1H, д, J=5,2 Гц), 8,35 (1H, т, J=5,8 Гц).
LC-MS MS(EI) для C14H15N5O2S2 [M+H]+, (Рассч.: 349,07) Найдено: 350,2.
Пример 149: Синтез (2S,3R,4S)-2-(8-((3-бромфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,75 (1H, д, J=9,2, 3,2 Гц), 2,94 (2H, т, J=7,0 Гц), 3,23 (1H, дд, J=11,6, 5,2 Гц), 3,65-3,71 (2H, м), 4,23-4,27 (2H, м), 4,63 (1H, д, J=7,6 Гц), 5,23 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=5,6 Гц), 7,24-7,26 (2H, м), 7,31 (1H, д, J=4,8 Гц), 7,38-7,39 (1H, м), 7,47-7,49 (3H,м), 7,63 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C18H19BrN4O2S [M+H]+, (Рассч.: 434,04) Найдено: 435,1.
Пример 150: Синтез (2S,3R,4S)-2-(8-((2-морфолиноэтил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,42 (4H, ушир.с), 2,50-2,56 (2H, м), 2,75 (1H, дд, J=8,6, 4,6 Гц), 3,23 (1H, дд, J=11,0, 5,0 Гц), 3,54-3,58 (6H, м), 4,23-4,26 (2H, м), 4,63 (1H, д, J=7,6 Гц), 5,23 (1H, д, J=4,0 Гц), 5,32 (1H, д, J=6,4 Гц), 7,18-7,30 (1H, м), 7,29 (1H, д, J=5,2 Гц), 7,47 (1H, с), 7,62 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C16H23N5O3S [M+H]+, (Рассч.: 365,15) Найдено: 366,2.
Пример 151: Синтез (2S,3R,4S)-2-(8-((1-(3-хлорфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,36 (4H, с), 2,75 (1H, дд, J=10,8, 2,0 Гц), 3,24 (1H, дд, J=11,2, 4,0 Гц), 4,24-4,27 (2H, м), 4,65 (1H, д, J=7,2 Гц), 5,23 (1H, д, J=3,6 Гц), 5,33 (1H, д, J=6,0 Гц), 7,13-7,27 (5H, м), 7,53 (1H, с), 7,68 (1H, д, J=5,2 Гц), 8,37 (1H, с).
LC-MS MS(EI) для C19H19ClN4O2S [M+H]+, (Рассч.: 402,09) Найдено: 403,3.
Пример 152: Синтез (2S,3R,4S)-2-(8-((2-(3-хлорфенил)пропан-2-ил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,74 (6H, с), 2,72 (1H, д, J=12,0 Гц), 3,20 (1H, дд, J=11,2, 3,6 Гц), 4,19-4,22 (2H, м), 4,60 (1H, д, J=7,6 Гц), 5,20 (1H, д, J=3,6 Гц), 5,30 (1H, д, J=6,4 Гц), 7,06 (1H, д, J=4,4 Гц), 7,13 (1H, с), 7,17 (1H, д, J=7,6 Гц), 7,24 (1H, т, J=7,6 Гц), 7,32 (1H, д, J=7,6 Гц), 7,38 (1H, с), 7,49 (1H, с), 7,58 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C19H21ClN4O2S [M+H]+, (Рассч.: 404,11) Найдено: 405,1.
Пример 153: Синтез (2S,3R,4S)-2-(8-(((1H-бензо[d]имидазол-2-ил)метил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диол гидрохлорида
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,78 (1H, дд, J=9,2, 2,0 Гц), 3,26 (1H, дд, J=11,6, 4,4 Гц), 4,26-4,28 (4H, м), 4,70 (2H, д, J=8,0 Гц), 5,13 (2H, с), 7,26 (1H, д, J=4,8 Гц), 7,52 (2H, дд, J=5,8, 3,0 Гц), 7,66 (1H, с), 7,74 (2H, дд, J=6,0, 3,2 Гц), 7,82 (1H, д, J=4,8 Гц), 8,55 (1H, ушир.с).
LC-MS MS(EI) для C18H19ClN6O2S [M+H]+, (Рассч.: 382,12) Найдено: 383,2.
Пример 154: Синтез (2S,3R,4S)-2-(8-((2-(пиперидин-1-ил)этил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,18-1,40 (2H, м), 1,48-1,49 (4H, м), 2,38 (4H, с), 2,50-2,52 (2H, м), 2,76 (1H, дд, J=10,6, 2,2 Гц), 3,23 (1H, дд, J=11,2, 4,0 Гц), 3,53 (2H, кв, J=6,3 Гц), 4,25-4,26 (2H, м), 4,63 (1H, д, J=7,6 Гц), 5,23 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=6,4 Гц), 7,12 (1H, т, J=5,4 Гц), 7,29 (1H, д, J=4,8 Гц), 7,47 (1H, с), 7,62 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C17H25N5O2S [M+H]+, (Рассч.: 363,17) Найдено: 364,2.
Пример 155: Синтез (2S,3R,4S)-2-(8-((3-хлорбензил)окси)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,77 (1H, дд, J=10,8, 2,0 Гц), 3,27 (1H, дд, J=11,2, 4,4 Гц), 4,25-4,28 (2H, м), 4,72 (1H, д, J=10,0 Гц), 5,27 (1H, д, J=3,6 Гц), 5,37 (1H, д, J=6,4 Гц), 5,55 (2H, с), 7,43-7,46 (4H, м), 7,58 (1H, с), 7,65 (1H, с), 8,14 (1H, д, J=5,2 Гц).
LC-MS MS(EI) для C17H16ClN3O3S [M+H]+, (Рассч.: 377,06) Найдено: 378,2.
Пример 156: Синтез (2S,3R,4S)-2-(8-((2-(диметиламино)этил)(метил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,18 (6H, с), 2,76 (1H, дд, J=10,4, 2,4 Гц), 3,22 (1H, дд, J=11,0, 3,8 Гц), 3,38 (3H, с), 4,26-4,29 (4H, м), 4,62 (1H, д, J=7,6 Гц), 5,24 (1H, д, J=4,0 Гц), 5,34 (1H, д, J=6,0 Гц), 7,34 (1H, д, J=4,0 Гц), 7,52 (1H, с), 7,62 (1H, д, J=4,8 Гц). * Two protons were overlapped with DMSO peak at 2,5 ppm.
LC-MS MS(EI) для C15H23N5O2S [M+H]+, (Рассч.: 337,16) Найдено: 338,2.
Пример 157: Синтез (2S,3R,4S)-2-(8-((тиазол-5-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=11,4, 3,0 Гц), 3,24 (1H, дд, J=10,8, 4,0 Гц), 4,24-4,26 (2H, м), 4,64 (1H, д, J=7,6 Гц), 4,84 (2H, д, J=6,4 Гц), 5,23 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=6,4 Гц), 7,35 (1H, д, J=4,8 Гц), 7,50 (1H, с), 7,69 (1H, д, J=4,4 Гц), 7,80 (1H, с), 8,15 (1H, т, J=6,4 Гц), 8,89 (1H, с).
LC-MS MS(EI) для C14H15N5O2S2 [M+H]+, (Рассч.: 349,07) Найдено: 350,1.
Пример 158: Синтез 3-хлор-N-(3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)бензамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,77 (1H, дд, J=11,2, 2,0 Гц), 3,29-3,32 (1H, м), 4,25-4,35 (2H, м), 4,80 (1H, д, J=8,80 Гц), 5,30 (1H, д, J=3,6 Гц), 5,43 (1H, д, J=6,0 Гц), 7,60 (1H, т, J=5,2 Гц), 7,72 (1H, д, J=8,4 Гц), 7,76 (2H, с), 7,98 (1H, ушир.с), 8,08 (1H, с), 8,42 (1H, ушир.с), 11,04 (1H, ушир.с).
LC-MS MS(EI) для C17H15ClN4O3S [M+H]+, (Рассч.: 390,06) Найдено: 391,2.
Пример 159: Синтез (2S,3R,4S)-2-(8-((3-хлорфенил)этинил)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,79 (1H, д, J=11,2, Гц), 3,30-3,32 (1H, м), 4,26-4,32 (2H,м), 4,83 (1H, д, J=8,0 Гц), 5,31 (1H, д, J=4,0 Гц), 5,41 (1H, д, J=6,8 Гц), 7,54 (1H, т, J=7,8 Гц), 7,62 (1H, д, J=8,4 Гц), 7,67 (1H, д, J=8,0 Гц), 7,76 (1H, с), 7,90 (1H, с), 7,98 (1H, д, J=4,4 Гц), 8,60 (1H, д, J=4,4 Гц).
LC-MS MS(EI) для C18H14ClN3O2S [M+H]+, (Рассч.: 371,05) Найдено: 372,2.
Пример 160: Синтез (2S,3R,4S)-2-(8-(((R)-1-(3-хлорфенил)этил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,54 (3H, д, J=7,2 Гц), 2,75 (1H, дд, J=11,8, 2,6 Гц), 3,23 (1H, дд, J=10,8, 4,0 Гц), 4,24-4,27 (2H, м), 4,63 (1H, д, J=7,2 Гц), 5,22 (1H, д, J=4,0 Гц), 5,32 (1H, д, J=6,4 Гц), 5,37 (1H, т, J=7,2 Гц), 7,23 (1H, д, J=4,8 Гц), 7,25 (1H, с), 7,31 (1H, т, J=7,6 Гц), 7,39 (1H, д, J=7,6 Гц), 7,52 (2H, с), 7,63 (1H, д, J=4,8 Гц), 7,93 (1H, т, J=8,4 Гц).
LC-MS MS(EI) для C18H19ClN4O2S [M+H]+, (Рассч.: 390,09) Найдено: 432,1.
Пример 161: Синтез (2S,3R,4S)-2-(8-(((S)-1-(3-хлорфенил)этил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,54 (3H, д, J=7,2 Гц), 2,75 (1H, дд, J=10,8, 2,0 Гц), 3,23 (1H, дд, J=11,0, 4,2 Гц), 4,22-4,26 (2H, м), 4,63 (1H, д, J=8,0 Гц), 5,22 (1H, д, J=4,0 Гц), 5,32 (1H, д, J=6,8 Гц), 5,37 (1H, т, J=7,2 Гц), 7,23 (1H, д, J=4,4 Гц), 7,24 (1H, д, J=7,6 Гц), 7,31 (1H, т, J=7,8 Гц), 7,39 (1H, д, J=7,6 Гц), 7,52 (2H, с), 7,62 (1H, д, J=4,8 Гц), 7,94 (1H, т, J=8,4 Гц).
LC-MS MS(EI) для C18H19ClN4O2S [M+H]+, (Рассч.: 390,09) Найдено: 391,1.
Пример 162: Синтез (2S,3R,4S)-2-(8-(((1S,2R)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,23 (1H, кв, J=6,4 Гц), 1,46-1,50 (1H, м), 2,01-2,10 (1H, м), 2,76 (1H, дд, J=13,4, 2,6 Гц), 3,12-3,13 (1H, м), 3,24 (1H, дд, J=11,4, 3,4 Гц), 4,22-4,28 (2H, м), 4,64 (1H, д, J=7,2 Гц), 5,23 (1H, д, J=3,6 Гц), 5,32 (1H, д, J=6,8 Гц), 7,12-7,18 (3H, м), 7,25-7,30 (3H, м), 7,49 (1H, с), 7,67 (1H, д, J=4,8 Гц), 7,85 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C19H20N4O2S [M+H]+, (Рассч.: 368,13) Найдено: 369,3.
Пример 163: Синтез (2S,3R,4S)-2-(8-((2-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=11,6 Гц), 3,25 (1H, дд, J =11,2, 4,4 Гц), 4,27 (2H, ушир.с), 4,66 (1H, д, J=8,0 Гц), 4,72 (2H, д, J=6,4 Гц), 5,25 (1H, д, J=3,6 Гц), 5,34 (1H, д, J=6,4 Гц), 7,24-7,26 (4H, м), 7,44 (1H, т, J=3,6 Гц), 7,55 (1H, с), 7,67 (1H, д, J=4,8 Гц), 8,04 (1H, т, J=5,2 Гц).
LC-MS MS(EI) для C17H17ClN4O2S [M+H]+, (Рассч.: 376,08) Найдено: 377,2.
Пример 164: Синтез (2S,3R,4S)-2-(8-((4-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=11,0, 2,2 Гц), 3,24 (1H, дд, J=10,6, 4,2 Гц), 4,22-4,28 (2H, м), 4,64 (3H, J=6,4 Гц), 5,24 (1H, д, J=3,2 Гц), 5,33 (1H, д, J=6,0 Гц), 7,25 (1H, д, J=4,4 Гц), 7,32-7,36 (4H, м), 7,51 (1H, с), 7,64 (1H, д, J=4,8 Гц), 8,11 (1H, д, J=6,2 Гц).
LC-MS MS(EI) для C17H17ClN4O2S [M+H]+, (Рассч.: 376,08) Найдено: 377,2.
Пример 165: Синтез (2S,3R,4S)-2-(8-((4-иодбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,75 (1H, дд, J=11,2, 2,4 Гц), 3,24 (1H, дд, J=10,2, 4,6 Гц), 4,24-4,25 (2H, м), 4,60 (2H, д, J=6,4 Гц), 4,64 (1H, д, J=8,0 Гц), 5,23 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=6,8 Гц), 7,14 (2H, д, J=8,4 Гц), 7,25 (1H, д, J=4,8 Гц), 7,51 (1H, с), 7,64 (2H, д, J=8,4 Гц), 7,64 (1H, д, J=4,8 Гц), 8,10 (1H, т, J=6,4 Гц).
LC-MS MS(EI) для C17H17IN4O2S [M+H]+, (Рассч.: 468,01) Найдено: 469,1.
Пример 166: Синтез (2S,3R,4S)-2-(8-(((1H-индол-5-ил)метил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,7 (1H, дд, J=9,8, 3,0 Гц), 3,23 (1H, дд, J=10,8, 4,4 Гц), 4,22-4,28 (2H, м), 4,63 (1H, д, J=6,4 Гц), 4,72 (2H, д, J=6,0 Гц), 5,23 (1H, с), 5,33 (1H, д, J=6,4 Гц), 6,35 (1H, с), 7,12 (1H, д, J=6,8 Гц), 7,27-7,31 (3H, м), 7,48 (2H, с), 7,62 (1H, д, J=4,8 Гц), 7,85 (1H, т, J=6,6 Гц), 10,97 (1H, с).
LC-MS MS(EI) для C19H19N5O2S [M+H]+, (Рассч.: 381,13) Найдено: 382,2.
Пример 167: Синтез 3-хлор-N-(3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)бензолсульфонамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,75 (1H, дд, J=10,2 2,6 Гц), 3,24 (1H, дд, J=10,6, 4,2 Гц), 4,19 (1H, д, J=6,8 Гц), 4,25 (1H, с), 4,63 (1H, д, J=8,0 Гц), 5,28-5,37 (2H, м), 7,16 (1H, д, J=8,4 Гц), 7,59 (1H, т, J=8,4 Гц), 7,65 (1H, с), 7,68 (1H, д, J=7,6 Гц), 7,80 (1H, д, J=5,2 Гц), 7,90 (1H, д, J=8,0 Гц), 7,97 (1H, с), 11,8 (1H, ушир.с).
LC-MS MS(EI) для C16H15ClN4O4S2 [M+H]+, (Рассч.: 426,02) Найдено: 427,2.
Пример 168: Синтез (2S,3R,4S)-2-(8-((2-иодбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=10,0 Гц), 3,26 (1H, д, J=11,2 Гц), 4,27 (2H, ушир.с), 4,56 (2H, д, J=6,4 Гц), 4,66 (1H, д, J=7,6 Гц), 5,25 (1H, с), 5,34 (1H, д, J=5,2 Гц), 7,00 (1H, т, J=7,0 Гц), 7,17 (1H, д, J=8,4 Гц), 7,24 (1H, д, J=4,8 Гц), 7,30 (1H, т, J=7,6 Гц), 7,55 (1H, с), 7,68 (1H, д, J=4,4 Гц), 7,86 (1H, д, J=7,2 Гц), 8,06-8,10 (1H, м).
LC-MS MS(EI) для C17H17IN4O2S [M+H]+, (Рассч.: 468,01) Найдено: 469,2.
Пример 169: Синтез (2S,3R,4S)-2-(8-((2-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,72 (1H, дд, J=11,8, 4,2 Гц), 2,94 (2H, т, J=7,0 Гц), 3,20 (1H, дд, J=10,4, 3,6 Гц), 3,65 (2H, кв, J=7,3 Гц), 4,21-4,22 (2H, м), 4,60 (1H, д, J=7,6 Гц), 5,20 (1H, д, J=4,0 Гц), 5,29 (1H, д, J=6,4 Гц), 7,06-7,13 (2H, м), 7,19-7,23 (1H, м), 7,27-7,31 (2H, м), 7,43 (1H, с), 7,47-7,48 (1H, м), 7,58 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C18H19FN4O2S [M+H]+, (Рассч.: 374,12) Найдено: 375,3.
Пример 170: Синтез (2S,3R,4S)-2-(8-((4-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=11,2, 1,6 Гц), 2,92 (2H, д, J=7,6 Гц), 3,23 (1H, дд, J=10,8, 4,0 Гц), 3,66 (2H, кв, J=7,1 Гц), 4,23-4,26 (2H, м), 4,63 (1H, д, J=8,0 Гц), 5,23 (1H, д, J=4,0 Гц), 5,32 (1H, д, J=6,8 Гц), 7,10 (2H, т, J=8,8 Гц), 7,26-7,32 (3H, м), 7,44-7,47 (2H, м), 7,62 (1H, д, J=4,8 Гц).
LC-MS MS(EI) для C18H19FN4O2S [M+H]+, (Рассч.: 374,12) Найдено: 375,3.
Пример 171: Синтез метил-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-2-фторбензоата
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=6,8, 5,6 Гц), 3,23 (1H, дд, J=11,0, 3,8 Гц), 3,83 (3H, с), 4,24-4,25 (2H, м), 4,63-4,67 (3H, м), 5,23 (1H, д, J=3,6 Гц), 5,32 (1H, д, J=6,4 Гц), 7,25-7,29 (2H, м), 7,52 (1H, с), 7,62-7,66 (1H, м), 7,65 (1H, д, J=4,4 Гц), 7,89 (1H, дд, J=7,4, 2,2 Гц), 8,20 (1H, т, J=7,2 Гц).
LC-MS MS(EI) для C19H19FN4O4S [M+H]+, (Рассч.: 418,11) Найдено: 419,2.
Пример 172: Синтез (2S,3R,4S)-2-(8-((3-хлор-4-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, дд, J=10,8, 2,0 Гц), 2,94 (1H, т, J=7,0 Гц), 3,23 (1H, дд, J=11,0, 3,8 Гц), 3,68 (2H, кв, J=6,5 Гц), 4,24-4,26 (2H, м), 4,63 (1H, д, J=7,2 Гц), 5,23 (1H, д, J=3,6 Гц), 5,32 (1H, д, J=6,8 Гц), 7,25-7,33 (3H, м), 7,47 (1H, с), 7,49-7,50 (2H, м), 7,62 (1H, д, J=4,8 Гц). * Протон не наблюдался.
LC-MS MS(EI) для C18H18ClFN4O2S [M+H]+, (Рассч.: 408,08) Найдено: 409,3.
Пример 173: Синтез (2S,3R,4S)-2-(8-((3-(диметиламино)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=10,8 Гц), 2,85 (6H, с), 3,23 (1H, дд, J=10,4, 3,2 Гц), 4,26 (2H, ушир.с), 4,59 (2H, д, J=6,0 Гц), 4,63 (1H, д, J=7,2 Гц), 5,22 (1H, д, J=3,2 Гц), 5,32 (1H, д, J=6,4 Гц), 6,57 (1H, д, J=8,4 Гц), 6,63 (1H, д, J=7,2 Гц), 6,77 (1H, с), 7,07 (1H, т, J=7,8 Гц), 7,27 (1H, д, J=4,8 Гц), 7,49 (1H, с), 7,62 (1H, д, J=4,8 Гц), 7,87 (1H, т, J=6,0 Гц).
LC-MS MS(EI) для C19H23N5O2S [M+H]+, (Рассч.: 385,16) Найдено: 386,2
Пример 174: Синтез (2S,3R,4S)-2-(8-((3-(4-метилпиперазин-1-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,20 (3H, с), 2,41-2,43 (4H, м), 2,76 (1H, дд, J=11,2, 2,0 Гц), 3,07-3,10 (4H, м), 3,23 (1H, дд, J=11,2, 3,6 Гц), 4,25-4,27 (2H, м), 4,60 (2H, д, J=5,6 Гц), 4,63 (1H, д, J=7,6 Гц), 5,23 (1H, д, J=3,2 Гц), 5,32 (1H, д, J=6,4 Гц), 6,76 (2H, т, J=7,0 Гц), 6,97 (1H, с), 7,10 (1H, т, J=7,8 Гц), 7,27 (1H, д, J=4,4 Гц), 7,50 (1H, с), 7,63 (1H, д, J=4,8 Гц), 7,91 (1H, т, J=7,8 Гц).
LC-MS MS(EI) для C22H28N6O2S [M+H]+, (Рассч.: 440,20) Найдено: 441,3.
Пример 175: Синтез (2S,3R,4S)-2-(8-((2,3-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=10,0 Гц), 3,26 (1H, д, J=10,0 Гц), 4,27 (2H, ушир.с), 4,66 (1H, д, J=7,2 Гц), 4,73 (2H, д, J=5,6 Гц), 5,25 (1H, д, J=3,2 Гц), 5,34 (1H, д, J=5,6 Гц), 7,24-7,30 (3H, м), 7,52 (1H, д, J=8,0 Гц), 7,56 (1H, с), 7,69 (1H, д, J=4,0 Гц), 8,17 (1H, т, J=6,0 Гц).
LC-MS MS(EI) для C17H16Cl2N4O2S [M+H]+, (Рассч.: 410,04) Найдено: 411,3.
Пример 176: Синтез (2S,3R,4S)-2-(8-((2,4-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=10,4 Гц), 3,25 (1H, д, J=10,8 Гц), 4,28 (2H, ушир.с), 4,67 (3H, ушир.с), 5,24 (1H, с), 5,34 (1H, с), 7,25-7,27 (2H, м), 7,32-7,36 (1H, м), 7,55 (1H, с), 7,60 (1H, с), 7,68 (1H, с), 8,12 (1H, ушир.с).
LC-MS MS(EI) для C17H16Cl2N4O2S [M+H]+, (Рассч.: 410,04) Найдено: 411,2.
Пример 177: Синтез (2S,3R,4S)-2-(8-((2,5-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,77 (1H, дд, J=10,8, 2,0 Гц), 3,25 (1H, д, J=10,8, 4,4 Гц), 4,28 (2H, ушир.с), 4,67 (1H, д, J=8,0 Гц), 4,70 (2H, д, J=6,4 Гц), 5,26 (1H, д, J=4,0 Гц), 5,35 (1H, д, J=6,0 Гц), 7,26 (2H, д, J=3,6 Гц), 7,35 (1H, дд, J=8,4, 2,4 Гц), 7,50 (1H, д, J=8,8 Гц), 7,56 (1H, с), 7,71 (1H, д, J=4,8 Гц), 8,16 (1H, т, J=6,2 Гц).
LC-MS MS(EI) для C17H16Cl2N4O2S [M+H]+, (Рассч.: 410,04) Найдено: 411,3.
Пример 178: Синтез (2S,3R,4S)-2-(8-((тиофен-2-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=11,6 Гц), 3,24 (1H, дд, J=11,0, 3,4 Гц), 4,26 (2H, ушир.с), 4,64 (1H, д, J=7,6 Гц), 4,81 (2H, д, J=6,0 Гц), 5,23 (1H, д, J=2,8 Гц), 5,33 (1H, д, J=5,6 Гц), 6,93 (1H, т, J=4,0 Гц), 7,01 (1H, с), 7,30-7,33 (2H, м), 7,50 (1H, с), 7,67 (1H, д, J=4,8 Гц), 8,06 (1H, т, J=6,0 Гц).
LC-MS MS(EI) для C15H16N4O2S2 [M+H]+, (Рассч.: 348,07) Найдено: 349,2.
Пример 179: Синтез (2S,3R,4S)-2-(8-((2-(3-фторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,27-1,32 (1H, м), 1,51-1,56 (1H, м), 2,07-2,12 (1H, м), 1,76 (1H, д, J=10,4 Гц), 3,12-3,16 (1H, м), 3,24 (1H, дд, J=11,0, 2,2 Гц), 4,25 (2H, ушир.с), 4,64 (1H, д, J=7,2 Гц), 5,24 (1H, с), 5,33 (1H, д, J=4,8 Гц), 6,96-7,03 (3H, м), 7,27-7,33 (2H, м), 7,50 (1H, с), 7,67 (1H, д, J=4,8 Гц), 7,89 (1H, д, J=4,0 Гц).
LC-MS MS(EI) для C19H19FN4O2S [M+H]+, (Рассч.: 386,12) Найдено: 387,3.
Пример 180: Синтез (2S,3R,4S)-2-(8-((2-(3-хлорфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 1,25-1,33 (1H, м), 1,52-1,57 (1H, м), 2,06-2,11 (1H, м), 2,76 (1H, д, J=10,8 Гц), 3,11-3,16 (1H, м), 3,25 (1H, дд, J=10,0, 3,6 Гц), 4,25 (2H, ушир.с), 4,64 (1H, д, J=7,6 Гц), 5,25 (1H, с), 5,34 (1H, д, J=5,6 Гц), 7,14 (1H, д, J=8,0 Гц), 7,21-7,25 (2H, м), 7,28-7,31 (2H, м), 7,50 (1H, с), 7,68 (1H, д, J=4,8 Гц), 7,90 (1H, д, J=4,4 Гц).
LC-MS MS(EI) для C19H19ClN4O2S [M+H]+, (Рассч.: 402,09) Найдено: 403,3.
Пример 181: Синтез (2S,3R,4S)-2-(8-((3-(пиперазин-1-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,74-2,80 (5H, м), 2,98-3,00 (4H, м), 3,24 (1H, дд, J=11,2, 4,0 Гц), 4,26 (2H, с), 4,60 (2H, д, J=6,4 Гц), 4,64 (1H, д, J=7,2 Гц), 5,24 (1H, с), 5,34 (1H, д, J=4,8 Гц), 6,74 (2H, д, J=8,0 Гц), 6,95 (1H, с), 7,10 (1H, т, J=7,4 Гц), 7,27 (1H, д, J=4,8 Гц), 7,50 (1H, с), 7,63 (1H, д, J=4,8 Гц), 7,92 (1H, т, J=5,8 Гц).
LC-MS MS(EI) для C21H26N6O2S [M+H]+, (Рассч.: 426,18) Найдено: 427,3.
Пример 182: Синтез метил-2-хлор-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензоата
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=9,6 Гц), 3,24 (1H, дд, J=11,0, 4,2 Гц), 3,83 (3H, с), 4,25 (2H, ушир.с), 4,63-4,67 (3H, м), 5,24 (1H, с), 5,33 (1H, д, J=5,6 Гц), 7,25 (1H, д, J=4,4 Гц), 7,48-7,54 (3H, м), 7,66 (1H, д, J=4,8 Гц), 7,79 (1H, с), 8,20 (1H, т, J=6,0 Гц).
LC-MS MS(EI) для C19H19ClN4O4S [M+H]+, (Рассч.: 434,08) Найдено: 435,2.
Пример 183: Синтез (2S,3R,4S)-2-(8-((3-хлор-4-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=10,8 Гц), 3,24 (1H, дд, J=10,8, 4,0 Гц), 4,25-4,26 (2H, м), 4,62-4,65 (3H, м), 5,23 (1H, д, J=3,6 Гц), 5,33 (1H, д, J=6,4 Гц), 7,27 (1H, д, J=4,8 Гц), 7,30-7,34 (2H, м), 7,52-7,54 (2H, м), 7,66 (1H, д, J=4,4 Гц), 8,15 (1H, т, J=6,4 Гц).
LC-MS MS(EI) для C17H16ClFN4O2S [M+H]+, (Рассч.: 394,07) Найдено: 395,2.
Пример 184: Синтез (2S,3R,4S)-2-(8-((3,5-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=10,0 Гц), 3,24 (1H, дд, J=11,2, 4,0 Гц), 4,24-4,28 (2H, м), 4,64 (3H, д, J=6,4 Гц), 5,24 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=5,6 Гц), 7,27 (1H, д, J=4,8 Гц), 7,38 (2H, с), 7,44 (1H, с), 7,53 (1H, с), 7,68 (1H, д, J=4,4 Гц), 8,19 (1H, т, J=6,4 Гц).
LC-MS MS(EI) для C17H16Cl2N4O2S [M+H]+, (Рассч.: 410,04) Найдено: 411,3.
Пример 185: Синтез (2S,3R,4S)-2-(8-((3,4-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,76 (1H, д, J=10,8 Гц), 3,24 (1H, дд, J=11,2, 4,8 Гц), 4,24-4,27 (2H, м), 4,64 (3H, д, J=5,2 Гц), 5,24 (1H, д, J=4,4 Гц), 5,33 (1H, д, J=5,2 Гц), 7,26 (1H, д, J=4,4 Гц), 7,32 (1H, д, J=8,4 Гц), 7,52 (1H, с), 7,55 (1H, д, J=8,4 Гц), 7,58 (1H, с), 7,66 (1H, д, J=4,8 Гц), 8,18 (1H, т, J=7,2 Гц).
LC-MS MS(EI) для C17H16Cl2N4O2S [M+H]+, (Рассч.: 410,04) Найдено: 411,2.
Пример 186: Синтез (2S,3R,4S)-2-(8-((2,6-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,73 (1H, дд, J=10,8, 2,4 Гц), 3,24 (1H, дд, J=12,0, 4,8 Гц), 4,23-4,26 (2H, м), 4,64 (1H, д, J=7,2 Гц), 4,88 (2H, д, J=4,8 Гц), 5,23 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=6,0 Гц), 7,34-7,37 (2H, м), 7,41 (1H, т, J=5,0 Гц), 7,47-7,49 (3H, м), 7,69 (1H, д, J=4,4 Гц).
LC-MS MS(EI) для C17H16Cl2N4O2S [M+H]+, (Рассч.: 410,04) Найдено: 411,3.
Пример 187: Синтез 5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-2-фторбензойная кислота 2,2,2-трифторуксусной кислоты
1H-ЯМР (DMSO-d6, 400 МГц): 2,76 (1H, д, J=12,0 Гц), 3,24 (1H, д, J=7,6 Гц), 3,42 (2H, ушир.с), 4,26 (2H, с), 4,67 (2H, с), 5,34 (1H, с), 7,24-7,27 (2H, м), 7,56-7,60 (2H, м), 7,69 (1H, с), 7,88 (1H, с), 7,39 (1H, ушир.с), 13,2 (1H, с).
LC-MS MS(EI) для C20H18F4N4O5S [M+H]+, (Рассч.: 404,42) Найдено: 405,3.
Пример 188: Синтез 5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-2-фтор-N,N-диметилбензамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,75 (1H, д, J=11,6 Гц), 2,81 (3H, с), 2,97 (3H, с), 3,24 (1H, дд, J=10,2, 4,2 Гц), 4,25-4,26 (2H, м), 4,63-4,66 (3H, м), 5,23 (1H, с), 5,33 (1H, д, J=6,0 Гц), 7,20 (1H, т, J=9,0 Гц), 7,27 (1H, д, J=5,2 Гц), 7,32 (1H, д, J=6,8 Гц), 7,42-7,46 (1H, м), 7,51 (1H, с), 7,65 (1H, д, J=4,8 Гц), 8,13 (1H, т, J=6,0 Гц).
LC-MS MS(EI) для C20H22FN5O3S [M+H]+, (Рассч.: 431,14) Найдено: 432,2.
Пример 189: Синтез 2-хлор-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензойная кислота 2,2,2-трифторуксусной кислоты
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,77 (1H, д, J=10,8, Гц), 3,26 (H, дд, J=9,4, 2,6 Гц), 4,24-4,27 (3H, м), 4,67-4,71 (3H, м), 7,29 (1H, д, J=4,8 Гц), 7,49 (2H, с), 7,66 (1H, с), 7,80 (2H, с), 9,01 (1H, ушир.с), 13,46 (1H, ушир.с). Протон не наблюдался.
LC-MS MS(EI) для C20H18ClF3N4O5S [M+H]+, (Рассч.: 420,07) Найдено: 421,3.
Пример 190: Синтез 2-хлор-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-N,N-диметилбензамида
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,70 (3H, с), 2,71 (1H, д, J=7,2 Гц), 2,93 (3H, с), 3,20 (1H, д, J=11,6 Гц), 4,21 (2H, ушир.с), 4,59-4,62 (3H, м), 5,19 (1H, ушир.с), 5,29 (1H, д, J=7,2 Гц), 7,21-7,23 (2H, м), 7,32-7,39 (2H, м), 7,47 (1H, с), 7,61 (1H, д, J=4,8 Гц), 8,08-8,12 (1H, м).
LC-MS MS(EI) для C20H22ClN5O3S [M+H]+, (Рассч.: 447,11) Найдено: 448,2.
Пример 191: Синтез (2S,3R,4S)-2-(8-((3-(1H-тетразол-5-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диол 2,2,2-трифторуксусной кислоты
1H-ЯМР (DMSO-d6, 400 МГц): δ 2,73 (1H, д, J=10,4 Гц), 3,22 (1H, дд, J=9,0, 2,2 Гц), 4,20-4,23 (3H, м), 4,65 (2H, д, J=8,0 Гц), 4,79 (3H, с), 7,26 (1H, д, J=5,2 Гц), 7,52-7,54 (2H, м), 7,64 (1H, с), 7,48-7,76 (1H, м), 7,87 (1H, д, J=6,4 Гц), 8,02 (1H, с). * Протон не наблюдался.
LC-MS MS(EI) для C20H19F3N8O3S [M+H]+, (Рассч.: 410,45) Найдено: 411,2.
Пример 192: Синтез (2S,3R,4S)-2-(8-((2,3-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,63 (1H, д, J=4,8 Гц), 7,57 (1H, т, J=5,6 Гц), 7,47 (1H, с), 7,30 (1H, д, J=4,8 Гц), 7,28-7,22 (1H, м), 7,13-7,11 (2H, м), 5,34 (1H, д, J=4,4 Гц), 5,25 (1H, с), 4,63 (1H, д, J=7,6 Гц), 4,26 (2H, с), 3,71 (2H, кв, J=6,4 Гц), 3,23 (1H, дд, J=11,0, 3,8 Гц), 3,02 (2H, т, J=6,8 Гц), 2,76 (1H, д, J=11,2 Гц).
LC-MS MS(EI) для C18H18F2N4O2S [M+H]+, (Рассч.: 392,11) Найдено: 393,3.
Пример 193: Синтез (2S,3R,4S)-2-(8-((2,4-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,62 (1H, д, J=4,5 Гц), 7,54 (1H, т, J=3,0 Гц), 7,47 (1H, с), 7,38-7,34 (1H, м), 7,30 (1H, д, J=4,4 Гц), 7,17 (1H, т, J=9,0 Гц), 7,00 (1H, т, J=8,2 Гц), 5,33 (1H, д, J=5,6 Гц), 5,24 (1H, с), 4,63 (1H, д, J=7,6 Гц), 4,25 (2H, с), 3,30 (2H, кв, J=6,3 Гц), 3,23 (1H, дд, J=11,6, 3,2 Гц), 2,95 (2H, т, J=6,6 Гц), 2,75 (1H, д, J=10,8 Гц).
LC-MS MS(EI) для C18H18F2N4O2S [M+H]+, (Рассч.: 392,11) Найдено: 393,3.
Пример 194: Синтез (2S,3R,4S)-2-(8-((2,5-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,62 (1H, д, J=4,8 Гц), 7,55 (1H, т, J=5,8 Гц), 7,47 (1H, с), 7,30 (1H, д, J=4,4 Гц), 7,20-7,16 (2H, м), 7,09-7,05 (1H, м), 5,33 (1H, д, J=6,4 Гц), 5,24 (1H, с), 4,63 (1H, д, J=8,0 Гц), 4,26-4,25 (2H, м), 3,71 (2H, кв, J=6,5 Гц), 3,23 (1H, дд, J=10,4, 3,6 Гц), 2,97 (2H, т, J=7,0 Гц), 2,76 (1H, д, J=10,8 Гц).
LC-MS MS(EI) для C18H18F2N4O2S [M+H]+, (Рассч.: 392,11) Найдено: 393,3.
Пример 195: Синтез (2S,3R,4S)-2-(8-((2,6-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,61 (1H, д, J=4,8 Гц), 7,58 (1H, т, J=6,2 Гц), 7,46 (1H, с), 7,32-7,28 (2H, м), 7,03 (2H, т, J=7,6 Гц), 5,33 (1H, д, J=5,6 Гц), 5,23 (1H, с), 4,63 (1H, д, J=7,6 Гц), 4,26 (2H, с), 3,66 (2H, кв, J=6,4 Гц), 3,23 (1H, дд, J=11,4, 3,8 Гц), 3,00 (2H, т, J=6,6 Гц), 2,76 (1H, д, J=12,0 Гц).
LC-MS MS(EI) для C18H18F2N4O2S [M+H]+, (Рассч.: 392,11) Найдено: 393,3.
Пример 196: Синтез (2S,3R,4S)-2-(8-((3,5-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,63 (1H, д, J=4,8 Гц), 7,52 (1H, т, J=5,2 Гц), 7,47 (1H, с), 7,31 (1H, д, J=4,8 Гц), 7,05-6,99 (3H, м), 5,33 (1H, д, J=6,0 Гц), 5,23 (1H, с), 4,63 (1H, д, J=7,2 Гц), 4,25 (2H, с), 3,70 (2H, кв, J=6,3 Гц), 3,23 (1H, дд, J=4,6, 11,4 Гц), 3,98 (2H, т, J=6,8 Гц), 2,76 (1H, д, J=10,4 Гц).
LC-MS MS(EI) для C18H18F2N4O2S [M+H]+, (Рассч.: 392,11) Найдено: 393,3.
Пример 197: Синтез (2S,3R,4S)-2-(8-((3,4-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,62 (1H, д, J=4,8 Гц), 7,50-7,47 (2H, м), 7,35-7,28 (3H, м), 7,08 (1H, ушир.с), 5,33 (1H, д, J=5,6 Гц), 5,24 (1H, с), 4,63 (1H, д, J=8,0 Гц), 4,26-4,25 (2H, м), 3,68 (2H, кв, J=6,5 Гц), 3,23 (1H, дд, J=10,6, 3,8 Гц), 2,94 (2H, т, J=7,0 Гц), 2,76 (1H, д, J=10,0 Гц).
LC-MS MS(EI) для C18H18F2N4O2S [M+H]+, (Рассч.: 392,11) Найдено: 393,3.
Пример 198: Синтез (2S,3R,4S)-2-(8-((4-хлор-3-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,62 (1H, д, J=4,8 Гц), 7,50-7,45 (3H, м), 7,33-7,31 (2H, м), 7,11 (1H, д, J=8,4 Гц), 5,32 (1H, д, J=6,4 Гц), 5,23 (1H, д, J=3,6 Гц), 4,63 (1H, д, J=8,0 Гц), 4,61-4,25 (2H, м), 3,69 (2H, кв, J=6,4 Гц), 3,23 (1H, дд, J=11,6, 4,4 Гц), 3,96 (2H, т, J=7,2 Гц), 2,76 (1H, д, J=10,4 Гц).
LC-MS MS(EI) для C18H18ClFN4O2S [M+H]+, (Рассч.: 408,08) Найдено: 409,3.
Пример 199: Синтез (2S,3R,4S)-2-(8-((3-хлорбензил)тио)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,30 (1H, д, J=4,4 Гц), 7,81 (1H, д, J=4,4 Гц), 7,70 (1H, с), 7,53 (1H, с), 7,43 (1H, д, J=6,4 Гц), 7,36-7,30 (2H, м), 5,36 (1H, д, J=6,8 Гц), 5,27 (1H, д, J=3,6 Гц), 4,76 (1H, д, J=8,0 Гц), 4,56 (2H, с), 4,27-4,24 (2H, м), 2,98 (1H, дд, J=10,6, 3,8 Гц), 2,77 (1H, д, J=11,2 Гц).
LC-MS MS(EI) для C17H16ClN3O2S2 [M+H]+, (Рассч.: 393,04) Найдено: 394,3.
Пример 200: Синтез (2S,3R,4S)-2-(8-(((1R,2S)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,86 (1H, д, J=3,6 Гц), 7,67 (1H, д, J=4,8 Гц), 7,50 (1H, с), 7,29-7,25 (3H, м), 7,17 (3H, д, J=6,4 Гц), 5,32 (1H, с), 5,23 (1H, с), 4,64 (1H, д, J=7,8 Гц), 4,26 (2H, с), 3,24 (1H, д, J=9,6 Гц), 3,16-3,11 (1H, м), 2,76 (1H, д, J=10,0 Гц), 2,10-2,06 (1H, м), 1,51-1,46 (1H, м), 1,26-1,21 (1H, м).
LC-MS MS(EI) для C19H20N4O2S [M+H]+, (Рассч.: 368,13) Найдено: 369,3.
Пример 201: Синтез (2S,3R,4S)-2-(8-((3-хлор-5-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,19 (1H, т, J=6,6 Гц), 7,68 (1H, д, J=4,8 Гц), 7,53 (1H, с), 7,28-7,25 (3H, м), 7,15 (1H, д, J=10,0 Гц), 5,33 (1H, д, J=6,4 Гц), 5,23 (1H, д, J=3,6 Гц), 4,67-4,65 (3H, м), 4,26 (2H, с), 3,24 (1H, дд, J=10,6, 4,2 Гц), 2,75 (1H, д, J=11,2 Гц).
LC-MS MS(EI) для C17H16ClFN4O2S [M+H]+, (Рассч.: 394,07) Найдено: 395,3.
Пример 202: Синтез (2S,3R,4S)-2-(8-((3-циклопропилбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,97 (1H, т, J=6,2 Гц), 7,63 (1H, д, J=4,4 Гц), 7,50 (1H, с), 7,26 (1H, д, J=4,8 Гц), 7,16-7,09 (3H, м), 6,88 (1H, д, J=7,6 Гц), 5,33 (1H, д, J=5,6 Гц), 5,23 (1H, с), 4,65-4,60 (3H, м), 4,26 (2H, с), 3,24 (1H, дд, J=10,6, 3,4 Гц), 2,76 (1H, д, J=10,4 Гц), 1,88-1,82 (1H, м), 0,91 (2H, д, J=8,4 Гц), 0,61 (2H, д, J=4,4 Гц).
LC-MS MS(EI) для C20H22N4O2S [M+H]+, (Рассч.: 382,15) Найдено: 383,3.
Пример 203: Синтез (2S,3R,4S)-2-(8-(([1,1'-бифенил]-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,10 (1H, т, J=6,4 Гц), 7,66-7,60 (4H, м), 7,51-7,44 (4H, м), 7,40-7,33 (3H, м), 7,28 (1H, д, J=4,8 Гц), 5,32 (1H, д, J=6,4 Гц), 5,22 (1H, д, J=3,2 Гц), 4,74 (2H, д, J=6,4 Гц), 4,64 (1H, д, J=7,2 Гц), 4,27-4,23 (2H, м), 3,24 (1H, дд, J=11,0, 4,6 Гц), 2,75 (1H, д, J=11,6 Гц).
LC-MS MS(EI) для C23H22N4O2S [M+H]+, (Рассч.: 418,15) Найдено: 419,3.
Пример 204: Синтез (2S,3R,4S)-2-(8-((3-феноксибензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,06 (1H, т, J=6,2 Гц), 7,64 (1H, д, J=4,0 Гц), 7,50 (1H, с), 7,37-7,25 (4H, м), 7,12-7,11 (2H, м), 7,00-6,95 (3H, м), 6,82 (1H, д, J=7,2 Гц), 5,32 (1H, д, J=6,0 Гц), 5,22 (1H, с), 4,64 (3H, д, J=5,6 Гц), 4,26 (2H, с), 3,24 (1H, дд, J=9,8, 2,6 Гц), 2,76 (1H, д, J=9,6 Гц).
LC-MS MS(EI) для C23H22N4O3S [M+H]+, (Рассч.: 434,14) Найдено: 435,3.
Пример 205: Синтез метил-3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензоата
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,20 (1H, т, J=6,0 Гц), 7,97 (1H, с), 7,80 (1H, д, J=7,2 Гц), 7,65-7,62 (2H, м), 7,52 (1H, с), 7,45 (1H, т, J=7,4 Гц), 7,26 (1H, д, J=4,0 Гц), 5,33 (1H, д, J=5,6 Гц), 5,23 (1H, с), 4,71 (2H, д, J=6,0 Гц), 4,64 (1H, д, J=7,2 Гц), 4,26 (2H, с), 3,82 (3H, с), 2,24 (1H, дд, J=10,4, 4,0 Гц), 2,76 (1H, д, J=10,8 Гц).
LC-MS MS(EI) для C19H20N4O4S [M+H]+, (Рассч.: 400,12) Найдено: 401,3.
Пример 206: Синтез (2S,3R,4S)-2-(8-(3-хлорфенетил)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,37 (1H, д, J=4,8 Гц), 7,82 (1H, д, J=4,0 Гц), 7,67 (1H, с), 7,35 (1H, с), 7,32-7,28 (1H, м), 7,25-7,23 (2H, м), 5,37 (1H, д, J=6,0 Гц), 5,28 (1H, д, J=3,2 Гц), 4,77 (1H, д, J=7,6 Гц), 4,29-4,27 (2H, м), 3,44 (2H, т, J=7,8 Гц), 3,28 (1H, дд, J=10,4, 3,2 Гц), 3,18 (2H, т, J=8,0 Гц), 2,78 (1H, д, J=10,0 Гц).
LC-MS MS(EI) для C18H18ClN3O2S [M+H]+, (Рассч.: 375,08) Найдено: 376,3.
Пример 207: Синтез (2S,3R,4S)-2-(8-(((1R,2R)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,73-7,70 (1H, м), 7,60 (1H, с), 7,23-7,21 (3H, м), 7,13 (2H, т, J=7,4 Гц), 7,05-7,01 (1H, м), 5,32 (2H, ушир.с), 4,61 (1H, д, J=8,4 Гц), 4,24-4,16 (2H, м), 3,24-3,20 (2H, м), 2,75 (1H, д, J=11,2 Гц), 2,42-2,41 (1H, м), 1,65 (1H, с), 1,48-1,46 (1H, м).
* Протон не наблюдался.
LC-MS MS(EI) для C18H19N5O2S [M+H]+, (Рассч.: 368,13) Найдено: 369,3.
Пример 208: Синтез (2S,3R,4S)-2-(8-((5-хлор-2-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,11 (1H, т, J=6,0 Гц), 7,68 (1H, д, J=4,4 Гц), 7,54 (1H, с), 7,33-7,28 (2H, м), 7,27-7,22 (2H, м), 5,34 (1H, д, J=5,6 Гц), 5,24 (1H, д, J=3,2 Гц), 4,68 (2H, д, J=6,0 Гц), 4,65 (1H, д, J=8,0 Гц), 4,26 (2H, ушир.с), 3,25 (1H, дд, J=11,4, 4,2 Гц), 2,76 (1H, д, J=11,2 Гц).
LC-MS MS(EI) для C17H16ClFN4O2S [M+H]+, (Рассч.: 394,85) Найдено: 395,3.
Пример 209: Синтез (2S,3R,4S)-2-(8-(((1S,2R)-2-(3,4-дифторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,89 (1H, д, J=4,0 Гц), 7,68 (1H, д, J=4,4 Гц), 7,50 (1H, с), 7,35-7,27 (3H, м), 7,07-7,03 (1H, м), 5,32 (1H, д, J=6,0 Гц), 5,23 (1H, д, J=3,2 Гц), 4,64 (1H, д, J=7,6 Гц), 4,27-4,25 (2H, м), 3,23 (1H, дд, J=10,6, 3,8 Гц), 3,10-3,07 (1H, м), 2,77 (1H, д, J=10,8 Гц), 2,11-2,05 (1H, м), 1,52-1,50 (1H, м), 1,30-1,27 (1H, м).
LC-MS MS(EI) для C19H18F2N4O2S [M+H]+, (Рассч.: 404,11) Найдено: 405,3.
Пример 210: Синтез (2S,3R,4S)-2-(8-((3-морфолинобензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,92 (1H, т, J=6,4 Гц), 7,63 (1H, д, J=4,8 Гц), 7,47 (1H, с), 7,26 (1H, д, J=4,8 Гц), 7,12 (1H, т, J=7,8 Гц), 6,97 (1H, с), 6,78 (2H, д, J=7,6 Гц), 5,36 (1H, д, J=6,8 Гц), 5,23 (1H, д, J=3,6 Гц), 4,64-4,60 (3H, м), 4,27-4,24 (2H, м), 3,71 (4H, т, J=4,4 Гц), 3,23 (1H, дд, J=12,8, 2,8 Гц), 3,05 (4H, т, J=4,6 Гц), 2,75 (1H, д, J=11,6 Гц).
LC-MS MS(EI) для C21H25N5O3S [M+H]+, (Рассч.: 427,17) Найдено: 428,3.
Пример 211: Синтез (2S,3R,4S)-2-(8-((3-фтор-4-(5-метилоксазол-2-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,20 (1H, т, J=6,2 Гц), 7,88 (1H, т, J=7,8 Гц), 7,67 (1H, д, J=4,8 Гц), 7,54 (1H, с), 7,31-7,27 (3H, м), 7,02 (1H, с), 5,34 (1H, д, J=5,6 Гц), 5,24 (1H, д, J=2,8 Гц), 4,72 (2H, д, J=6,4 Гц), 4,65 (1H, д, J=7,6 Гц), 4,27-4,26 (2H, м), 3,25 (1H, дд, J=11,2, 4,4 Гц), 2,76 (1H, д, J=12,0 Гц), 2,37 (3H, с).
LC-MS MS(EI) для C21H20FN5O3S [M+H]+, (Рассч.: 441,13) Найдено: 442,2.
Пример 212: Синтез (2S,3R,4S)-2-(8-((3-фтор-4-(5-метилтиазол-2-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,20 (1H, т, J=6,0 Гц), 8,08 (1H, т, J=8,0 Гц), 7,68-7,66 (2H, м), 7,53 (1H, с), 7,33-7,26 (3H, м), 5,34 (1H, д, J=6,0 Гц), 5,24 (1H, д, J=3,6 Гц), 4,71 (2H, д, J=6,4 Гц), 4,65 (1H, д, J=8,0 Гц), 4,28-4,25 (2H, м), 3,24 (1H, дд, J=10,8, 4,0 Гц), 2,76 (1H, д, J=12,4 Гц).
* Протоны из CH3 перекрываются пиком DMSO при 2,5 м.д.
LC-MS MS(EI) для C21H20FN5O2S2 [M+H]+, (Рассч.: 457,10) Найдено: 458,2.
Пример 213: Синтез (2S,3R,4S)-2-(8-((3-фтор-4-(5-метил-1,3,4-оксадиазол-2-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,26-8,22 (1H, м), 7,92 (1H, т, J=7,8 Гц), 7,68 (1H, д, J=4,8 Гц), 7,54 (1H, с), 7,39-7,35 (2H, м), 7,26 (1H, д, J=4,0 Гц), 5,34 (1H, д, J=6,4 Гц), 5,25 (1H, с), 4,74 (2H, д, J=6,4 Гц), 4,65 (1H, д, J=8,0 Гц), 4,26-4,24 (2H, м), 3,26-3,24 (1H, м), 2,78-2,75 (1H, м), 2,58 (3H, с).
LC-MS MS(EI) для C20H19FN6O3S [M+H]+, (Рассч.: 442,12) Найдено: 443,3.
Пример 214: Синтез (2S,3R,4S)-2-(8-((3-(2-метил-2H-тетразол-5-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,23 (1H, т, J=6,0 Гц), 8,06 (1H, с), 7,90 (1H, д, J=7,2 Гц), 7,65 (1H, д, J=4,4 Гц), 7,53-7,46 (3H, м), 7,26 (1H, д, J=4,8 Гц), 5,34 (1H, д, J=6,0 Гц), 5,24 (1H, д, J=3,6 Гц), 4,75 (2H, д, J=6,4 Гц), 4,65 (1H, д, J=7,2 Гц), 4,40 (3H, с), 4,26-4,25 (2H, м), 3,24 (1H, дд, J=10,6, 4,2 Гц), 2,75 (1H, д, J=10,8 Гц).
LC-MS MS(EI) для C19H20N8O2S [M+H]+, (Рассч.: 424,14) Найдено: 425,2.
Пример 215: Синтез (2S,3R,4S)-2-(8-(((1S,2R)-2-(3-фторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,90 (1H, д, J=4,4 Гц), 7,68 (1H, д, J=4,8 Гц), 7,50 (1H, с), 7,33-7,28 (2H, м), 7,03-6,96 (3H, м), 5,34 (1H, д, J=6,0 Гц), 5,25 (1H, с), 4,64 (1H, д, J=8,0 Гц), 4,27-4,23 (2H, м), 3,24 (1H, дд, J=11,2, 3,6 Гц), 3,16-3,12 (1H, м), 2,75 (1H, д, J=8,8 Гц), 2,11-2,07 (1H, м), 1,56-,1,51 (1H, м), 1,35-1,27 (1H, м).
LC-MS MS(EI) для C19H19FN4O2S [M+H]+, (Рассч.: 386,12) Найдено: 387,2.
Пример 216: Синтез (2S,3R,4S)-2-(8-(((1S,2R)-2-(3-хлорфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,92 (1H, д, J=4,0 Гц), 7,68 (1H, д, J=4,4 Гц), 7,50 (1H, с), 7,32-7,28 (2H, м), 7,25-7,21 (2H, м), 7,15-7,13 (1H, м), 5,35 (1H, д, J=6,0 Гц), 5,26 (1H, с), 4,64 (1H, д, J=7,6 Гц), 4,30-4,20 (2H, м), 3,25-3,23 (1H, м), 3,14 (1H, ушир.с), 2,76 (1H, д, J=8,8 Гц), 2,08 (1H, ушир.с), 1,56-1,53 (1H, м), 1,33-1,29 (1H, м).
LC-MS MS(EI) для C19H19ClN4O2S [M+H]+, (Рассч.: 402,09) Найдено: 403,2.
Пример 217: Синтез (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
СТАДИЯ 1 Получение (S)-2-((трет-бутилдиметилсилил)окси)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола
К раствору (S)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этан-1,2-диола (2,0 г, 9,08 ммоль) в DMF (60 мл) добавляли по каплям TBSCl (1,51 г, 9,99 ммоль) и TEA (1,9 мл, 13,62 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 15 часов, разбавляли EtOAc и промывали водой и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=4:1) с получением (S)-2-((трет-бутилдиметилсилил)окси)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (2,8 г, 93%) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц): δ 4,91-4,89 (м, 1H), 4,83 (дд, 1H, J=6,0, 2,0 Гц), 3,86-3,83 (м, 1H), 3,67 (дд, 1H, J=10,4, 6,4 Гц), 3,57 (дд, 1H, J=10,0, 4,8 Гц), 3,39 (дд, 1H, J=3,6, 2,0 Гц), 3,19 (дд, 1H, J=12,4, 5,2 Гц), 2,85 (дд, 1H, J=12,0, 2,0 Гц), 2,46 (д, 1H, J=4,8 Гц), 1,52 (с, 3H), 1,33 (с, 3H), 0,90(с, 9H), 0,08 (с, 6H).
СТАДИЯ 2 Получение трет-бутил((S)-2-хлор-2-((3aR,4R,6aS)-2,2-диметилтетрагидролтиено[3,4-d][1,3]диоксол-4-ил)этокси)диметилсилана
К раствору (S)-2-((трет-бутилдиметилсилил)окси)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (2,7 г, 8,07 ммоль) в DCM (30 мл) добавляли MsCl (1,11 г, 9,68 ммоль) и TEA (1,69 мл, 12,11 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, разбавляли DCM и промывали водой и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=9:1) с получением трет-бутил((S)-2-хлор-2-((3aR,4R,6aS)-2,2-диметилтетрагидрол тиено[3,4-d][1,3]диоксол-4-ил)этокси)диметилсилана (2,2 г, 84%) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц): δ 5,00-4,97(м, 1H), 4,4,92-4,91 (м, 1H), 4,21-4,19 (м, 1H), 3,91 (дд, 1H, J=10,4, 4,8 Гц), 3,84-3,74 (м, 2H), 3,33 (дд, 1H, J=12,4, 5,2 Гц), 2,90 (д, 1H, J=12,4 Гц), 1,53 (с, 3H), 1,33 (с, 3H), 0,90 (с, 9H), 0,08 (с, 6H).
СТАДИЯ 3 Получение (S)-2-хлор-2-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола
К раствору (трет-бутил((S)-2-хлор-2-((3aR,4R,6aS)-2,2-диметилтетрагидролтиено[3,4-d][1,3]диоксол-4-ил)этокси)диметилсилана (2,4 г, 6,80 ммоль) в THF (30 мл) добавляли по каплям AcOH (0,82 г, 13,6 ммоль) и 1M TBAF (8,84 мл, 8,84 ммоль) при 0°C. Реакционную смесь перемешивали в течение 3 часов и выливали в воду. Смесь экстрагировали EtOAc дважды. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=9:1-3:1) с получением (S)-2-хлор-2-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (1,18 г, 73%) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц): δ 4,99 (дт, 1H, J=2,0, 5,6 Гц), 4,86 (дд, 1H, J=5,6, 2,4 Гц), 4,25 (кв, 1H, J=5,2 Гц), 3,95-3,81 (м, 2H), 3,72 (дд, 1H, J=1,4, 4,4 Гц), 3,29 (дд, 1H, J=5,6, 12,8 Гц), 2,95 (дд, 1H, J=2,0, 12,8 Гц), 2,19 (т, 1H, J=7,2), 1,52(с, 3H), 1,33 (с, 3H).
СТАДИЯ 4 Получение 6,8-дихлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина
COCl2 (2,13 мл, 4,27 ммоль) добавляли по каплям в течение 15 мин к раствору диметилсульфоксида (0,39 г, 4,98 ммоль) в DCM (30 мл), охлажденному на бане сухой лед с ацетоном. К этому раствору добавляли раствор (S)-2-хлор-2-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (0,85 г, 3,56 ммоль) в течение 5 мин. Смесь дополнительно перемешивали при -78°C в течение 45 мин. TEA (0,26 мл, 1,89 ммоль) добавляли к раствору, перемешивали -40°C в течение 30 мин и давали нагреться до комнатной температуры. Органическую фазу промывали насыщ. раствором NH4Cl и насыщенным солевым раствором, сушили над Na2SO4 и фильтровали. После удаления растворителя полученный остаток (760 мг) растворяли в CH3CN. К этому раствору добавляли 3,5-дихлорпиразин-2-амина (584 мг, 3,56 ммоль), перемешивали при 85°C в течение 16 ч и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc:DCM=2:1:1) с получением 6,8-дихлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина (36 мг, 3%) в виде белого липкого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 8,08 (с, 1H), 7,65 (с, 1H), 5,13-5,05 (м, 2H), 4,54 (д, 1H, J=2,4 Гц), 3,13-3,01 (м, 2H), 1,61 (с, 3H), 1,39 (с, 3H),
СТАДИЯ 5 Получение 6-хлор-N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина
Раствор 6,8-дихлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина (44 мг, 0,17 ммоль) и (3-хлорфенил)метанамина (27 мг, 0,19 ммоль) в EtOH (6,4 мл) перемешивали при комнатной температуре в течение 24 ч и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (MeOH:DCM=1:40) с получением 6-хлор-N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (25 мг, 44%) в виде белого липкого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 7,46 (с, 1H), 7,38(с, 1H), 7,27-7,26 (м, 4H), 6,42 (т, 1H, J=6,0 Гц), 5,08-5,01 (м, 2H), 4,78 (д, 1H, J=6,0 Гц), 4,48 (д, 1H, J=2,0 Гц), 3,05 (м, 1H), 1,60 (с, 3H), 1,38(с, 3H).
СТАДИЯ 6 Получение (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
Раствор 6-хлор-N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (25 мг, 0,055 ммоль) и 2н раствора HCl (0,5 мл) в THF (2 мл) перемешивали при комнатной температуре в течение 15 ч. Реакционную смесь концентрировали в вакууме. Остаток разбавляли EtOAc, и затем к раствору добавляли 1н NaOH (1 мл) до pH 7. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=4:1 с 0,5% TEA) с получением (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (12 мг, 53%) в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,81 (с, 1H), 7,59 (с, 1H), 7,45 (с, 1H), 7,35-7,28 (м, 3H), 4,76-4,73 (м, 3H), 4,43-4,40 (м, 1H), 4,34-4,31 (м, 1H), 3,50-3,32 (м, 1H), 2,93-2,90 (м, 1H).
LC-MS MS(EI) для C17H16Cl2N4O2S [M+H]+, (Рассч.: 410,04) Найдено: 411,1.
Пример 218: Синтез (2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиридин-3-ил)тетрагидротиофен-3,4-диола
СТАДИЯ 1 Получение 8-бром-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиридина
К раствору (3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-карбальдегида (0,3 г, 1,59 ммоль) в безводном DCM (17 мл) в атмосфере N2 добавляли 3-бром-2-гидразинопиридин (0,3 г, 1,59 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, и исчезновение (3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-карбальдегида проверяли с помощью ТСХ. Когда около 95% исходного материала исчезло, к реакционной смеси добавиляли PhI(OAc)2 (0,77 г, 2,34 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 3,3 ч. Органическую фазу промывали насыщ. раствором NaHCO3 и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=2:1) с получением 8-бром-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиридина (383 мг, 54%) в виде светло-оранжевого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,91 (д, J=7,2 Гц, 1H), 7,55 (д, J=7,6 Гц, 1H), 6,80 (т, J=7,2 Гц, 1H), 5,77 (д, J=5,2 Гц, 1H), 5,32-5,30 (м, 1H), 4,60 (с, 1H), 2,96-2,95 (м, 2H), 1,60 (с, 3H), 1,42 (с, 1H).
СТАДИЯ 2 Получение N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиридин-8-амина
К раствору 8-бром-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиридина (150 мг, 0,42 ммоль), Pd2dba3 (19 мг, 0,021 ммоль), Xantphos (13 мг, 0,023 ммоль) и Cs2CO3 (410 мг, 1,26 ммоль) в безводном диоксане (8 мл) в атмосфере N2 добавляли по каплям 3-хлорбензиламин (0,06 мл, 0,50 ммоль). Реакционную смесь перемешивали при 110°С в течение 18 ч и разбавляли DCM. Органический раствор фильтровали через целит и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=1:1) с получением N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиридин-8-амина (56 мг, 32%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,52(с, 1H), 7,38-7,28(м, 4H), 6,70 (т, J=7,6 Гц, 1H), 6,00 (д, J=7,6 Гц, 1H), 5,86-5,83 (м, 1H), 5,72 (д, J=5,2 Гц, 1H), 5,32-5,30 (м, 1H), 4,59(с, 1H), 4,52 (д, J=6,0 Гц, 2H), 3,02-2,93 (м, 2H), 1,69-1,53 (м, 10H), 1,42 (с, 3H).
СТАДИЯ 3 Получение (2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиридин-3-ил)тетрагидротиофен-3,4-диола
Раствор N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиридин-8-амина (57 мг, 0,14 ммоль) в 80% AcOH (32 мл) нагревали с обратным холодильником в течение 2,5 ч и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (MeOH: DCM=1:20) с получением (2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиридин-3-ил)тетрагидротиофен-3,4-диола (40 мг, 78%) в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,41 (д, J=6,4 Гц, 1H), 7,37 (с, 1H), 6,64 (т, J=7,2 Гц, 1H), 5,98 (д, J=7,6 Гц, 1H), 5,94 (т, J=5,8 Гц, 1H), 5,34 (br, 1H), 5,13 (дд, J=3,2, 8,0 Гц, 1H), 4,87 (д, J=8,4 Гц, 1H), 4,50-5,71 (м, 1H), 4,50 (д, J=5,6 Гц, 1H), 3,64 (br, 1H), 3,29 (дд, J 4,4, 11,6 Гц, 1H), 3,08 (дд, J=2,4, 11,6 Гц, 1H).
LC-MS MS(EI) для C17H17ClN4O2S [M+H]+, (Рассч.: 376,08) Найдено: 377,1.
Пример 219: Синтез (2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,5-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
СТАДИЯ 1 Получение (3aR,4R,6aS)-N-((3-хлорпиразин-2-ил)метил)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-карботиоамида
К раствору (3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-карбальдегида (791 мг, 4,2 ммоль) в DMF (5 мл) добавляли (3-хлорпиразин-2-ил)метанамин 2HCl (1 г, 4,6 ммоль), DIPEA (2,2 мл, 12,6 ммоль) и серу. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, разбавляли DCM и промывали водой со льдом и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc:DCM=1:3:1) с получением 2-(3-хлорпиразин-2-ил)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этантиона (672 г, 46%) в виде коричневого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 9,98 (шир.с, 1H), 8,50 (д, J=2,4 Гц, 1H), 8,39 (д, J=2,4 Гц, 1H), 5,63 (д, J=5,6 Гц, 1H), 5,03-4,98 (м, 3H), 4,33 (с, 1H), 3,22-3,18 (м, 1H), 3,10-2,98 (м, 1H), 1,55 (с, 3H), 1,35 (с, 3H).
СТАДИЯ 2 Получение 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,5-a]пиразина
Раствор 2-(3-хлорпиразин-2-ил)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этантиона (672 мг, 1,94 ммоль) и Hg(O2CCF3)2 (837 мг, 1,96 ммоль) в 1,4-диоксане (20 мл) перемешивали при комнатной температуре в течение 2 ч и разбавляли DCM. Органический раствор фильтровали через целит и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc= 5:1) с получением 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,5-a]пиразина (292 мг, 48%) в виде светло-желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,73 (с, 1H), 7,61 (д, J=4,4 Гц, 1H), 7,41 (д, J=5,2 Гц, 1H), 5,57 (д, J=5,6 Гц, 1H), 5,28-5,26 (м, 1H), 4,58 (с, 1H), 2,99-2,97 (м, 2H), 1,59 (с, 3H), 1,40 (с, 3H).
СТАДИЯ 3 Получение N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиридин-8-амина
Раствор 8-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,5-a]пиразина (40 мг, 0,1 ммоль) и (3-хлорфенил)метанамина (55 мг, 0,4 ммоль) и DIPEA (0,08 мл, 0,4 ммоль) в CH3CN (1 мл) перемешивали при 70°С в течение 18 ч, разбавляли DCM и промывали насыщ. раствором NH4Cl и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=1:1) с получением 2-(3-хлорпиразин-2-ил)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этантиона (672 г, 46%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,41 (с, 1H), 7,37 (с, 1H), 7,27-7,26 (м, 2H), 7,21-7,17 (м, 2H), 5,53 (д, J=5,6 Гц, 1H), 5,27-5,25 (м, 1H), 5,23-5,19 (м, 1H), 4,78-4,76 (м, 2H), 4,57 (с, 1H), 3,07-3,06 (м, 1H), 2,96-2,93 (м, 1H), 1,59 (с, 3H), 1,39 (с, 3H).
СТАДИЯ 4 Получение (2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,5-a]пиразин-3-ил)тетрагидротиофен-3,4-диола
Раствор 2-(3-хлорпиразин-2-ил)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этантиона (26 мг, 0,06 ммоль) и 2н раствора HCl (0,09 мл) в THF (0,5 мл) перемешивали при комнатной температуре в течение 28 ч. Реакционную смесь концентрировали в вакууме. Остаток разбавляли EtOAc, и затем 1 н NaOH (1 мл) добавляли к раствору до значения pH 7. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (MeOH:DCM=1:15) с получением (2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,5-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (14 мг, 62%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,41 (д, J=6,4 Гц, 1H), 7,37 (с, 1H), 6,64 (т, J=7,2 Гц, 1H), 5,98 (д, J=7,6 Гц, 1H), 5,94 (т, J=5,8 Гц, 1H), 5,34 (br, 1H), 5,13 (дд, J=3,2, 8,0 Гц, 1H), 4,87 (д, J=8,4 Гц, 1H), 4,50-5,71 (м, 1H), 4,50 (д, J=5,6 Гц, 1H), 3,64 (br, 1H), 3,29 (дд, J 4,4, 11,6 Гц, 1H), 3,08 (дд, J=2,4, 11,6 Гц, 1H).
LC-MS MS(EI) для C17H17ClN4O2S [M+H]+, (Рассч.: 376,08) Найдено: 377,1.
Пример 220: Синтез (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)имидазо[1,2-a]пиридин-3-ил)тетрагидротиофен-3,4-диола
СТАДИЯ 1 Получение (S)-2-((5-хлор-3-нитропиридин-2-ил)амино)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола
К раствору (S)-2-амино-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (556 мг, 2,54 ммоль) в 1,4-диоксане (5 мл) добавляли 2,5-дихлор-3-нитропиридин (978,64 мг, 5,07 ммоль) и TEA (769,65 мг, 7,61 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 110°C в течение 18 часов и концентрировали в вакууме. Остаток растворяли в DCM и промывали 1 н HCl и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=3:1) с получением (S)-2-((5-хлор-3-нитропиридин-2-ил)амино)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (747 мг, 78%) в виде оранжевого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 8,43 (д, J= 2,4 Гц, 2H), 8,33 (д, J= 2,4 Гц, 1H), 4,93 (м, 1H), 4,80 (м, 1H), 3,94 (м, 1H), 3,88 (м, 1H), 3,73 (м, 1H), 3,42 (дд, 1H, J=2,4, 5,2 Гц), 3,17 (м, 1H), 2,91 (дд, J=2,0, 12,8 Гц), 1,53 (с, 3H), 1,33 (с, 3H).
СТАДИЯ 2 Получение 2-((5-хлор-3-нитропиридин-2-ил)амино)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанона
К раствору (S)-2-((5-хлор-3-нитропиридин-2-ил)амино)-1-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанола (724 мг, 1,93 ммоль) в DCM (13 мл) добавляли реагент Десса-Мартина (980,48 мг, 2,31 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, разбавляли DCM и промывали 1 н NaOH и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=5:1) с получением 2-((5-хлор-3-нитропиридин-2-ил)амино)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанона (586 мг, 81%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 8,50 (шир.с, 1H), 8,44 (д, J= 2,0 Гц, 1H), 8,34 (д, J= 2,0 Гц, 1H), 4,99 (м, 2H), 4,80 (дд, J= 5,2 Гц, 19,2 Гц, 1H), 4,45 (дд, J= 4,8 Гц, 12,8 Гц, 1H), 4,00 (с, 1H), 2,90 (м, 3H), 1,51 (с, 3H), 1,33 (с, 3H).
СТАДИЯ 3 Получение 6-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-8-нитроимидазо[1,2-a]пиридина
К раствору 2-((5-хлор-3-нитропиридин-2-ил)амино)-1-((3aR,4R,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)этанона (586 мг, 1,57 ммоль) в толуоле (10 мл) добавляли пиридин (1,49 г, 18,81 ммоль), затем TFA (1,25 г, 10,97 ммоль) при 0°C. После перемешивания в течение 30 мин при комнатной температуре смесь охлаждали до 0°C, и затем к ней добавляли TFAA (2,3 г, 10,97 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 3 часов. После концентрации в вакууме, остаток растворяли в DCM, промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=2:1) с получением 6-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-8-нитроимидазо[1,2-a]пиридина (280 мг, 60%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 8,41 (д, J= 1,6 Гц, 1H), 8,34 (д, J= 1,6 Гц, 1H), 7,64 (с, 1H), 5,13 (м, 2H), 4,57 (с, 1H), 4,12 (кв, J= 7,2 Гц, 1H), 3,10~2,98 (м, 2H), 1,61 (с, 3H), 1,41 (с, 3H).
СТАДИЯ 4 Получение 6-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиридин-8-амина
К раствору 6-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)-8-нитроимидазо[1,2-a]пиридина (170 мг, 0,48 ммоль) в MeOH (5 мл) добавляли NH4Cl (217,28 мг, 4,06 ммоль) и Fe (133,42 мг, 2,39 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 3 часов и охлаждали до комнатной температуры. Органический раствор фильтровали через целит и концентрировали в вакууме с получением 6-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиридин-8-амина (145 мг, 93%) в виде темно-коричневого твердого вещества, которое использовали на следующей стадии без очистки.
1H-ЯМР (CDCl3, 400 МГц): δ 7,57 (д, J= 1,6 Гц, 1H), 7,31 (с, 1H), 6,44 (с, 1H), 5,10 (м, 2H), 4,78 (шир.с, 2H), 4,53 (с, 1H), 3,06 (д, J= 2,8H, 2H), 1,62 (с, 3H), 1,41 (с, 3H).
СТАДИЯ 5 Получение N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина
К раствору 6-хлор-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиридин-8-амина (62 мг, 0,19 ммоль) в MeOH (3 мл) добавляли 3-хлорбензальдегид (33,44 мг, 0,24 ммоль) и ZnCl2 (45,39 мг, 0,33 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, после чего добавляли одной порцией NaBH3CN (14,95 мг, 0,24 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 15 ч, охлаждали до комнатной температуры и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=1:1) с получением N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (30 мг, 35%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 8,20 (д, J= 3,2 Гц, 1H), 8,07 (с, 4H), 7,46 (д, J= 1,6 Гц, 1H), 7,34 (с, 1H), 6,04 (с, 1H), 5,07 (д, J= 1,2 Гц, 2H), 3,85 (м, 1H), 3,01 (д, J= 2,4H, 2H), 1,58 (с, 3H), 1,37 (с, 3H).
СТАДИЯ 6 Получение (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)имидазо[1,2-a]пиридин-3-ил)тетрагидротиофен-3,4-диол
Раствор N-(3-хлорбензил)-3-((3aR,4S,6aS)-2,2-диметилтетрагидротиено[3,4-d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (30 мг, 0,067 ммоль) и 2 н раствора HCl (0,09 мл) в THF (1,3 мл) перемешивали при 50°C в течение 18 ч. Реакционную смесь концентрировали в вакууме. Остаток разбавляли EtOAc, и затем 1 н NaOH (1 мл) добавляли к раствору до значения pH 7. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (MeOH:DCM=1:20) с получением (2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)имидазо[1,2-a]пиридин-3-ил)тетрагидротиофен-3,4-диола (12 мг, 44%) в виде белого твердого вещества.
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,76 (с, 1H) 7,48 (с, 1H), 7,44 (с, 1H), 7,35 (м, 4H), 6,00 (с, 1H), 5,35 (д, J= 6,4 Гц, 1H), 5,19 (д, J= 4,0 Гц, 1H), 4,64 (д, J= 7,6 Гц, 1H), 4,50 (д, J= 6,4 Гц, 2H), 4,23 (м, 2H), 3,20 (дд, J= 4,8 Гц, 10,8 Гц, 1H), 2,76 (дд, J= 3,2 Гц, 10,0 Гц, 1H).
LC-MS MS(EI) для C18H17Cl2N3O2S [M+H]+, (Рассч.: 409,04) Найдено: 410,1.
Пример 221: Синтез (2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиридин-3-ил)тетрагидротиофен-3,4-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,59 (д, J=6,8 Гц, 1 H), 7,47 (с, 2H), 7,34-7,33(м, 2H), 7,28-7,27(м, 1H), 6,88-6,86(м, 1H), 6,68-6,64(м, 1H), 5,97(д, J=7,6 Гц, 1H), 5,30(д, J=6,4 Гц, 1H), 5,21(д, J=4,0 Гц, 1H), 4,64(д, J=7,6 Гц, 1H), 4,48(д, J=6,4 Гц, 2H), 4,28-4,27(м, 2H), 3,22-3,18(м, 1 H), 2,78-2,75(м, 1H).
LC-MS MS(EI) для C18H18ClN3O2S [M+H]+, (Рассч.: 375,08) Найдено: 376,1.
Пример 222: Синтез (1R,2S,3S)-3-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
СТАДИЯ 1 Получение (3aR,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-илметилкарбоната
К раствору (3aS,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-ола (8,86 г, 56,7 ммоль) в DCM (189 мл) добавляли пиридин (6,87 мл, 85 ммоль) при 0°C. Смесь перемешивали при 0°C в течение 1 часа. После добавления DMAP (2,77 г, 22,7 ммоль) и метилхлорформиата (17,6 мл, 227 ммоль), реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 3 часов. Реакционную смесь промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=4:1) с получением (3aR,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-илметилкарбоната (10,3 г, 85%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 6,10 (1H, д, J=5,6 Гц), 5,91 (1H, д, J=4,8 Гц), 5,30 (1H, д, J=5,2 Гц), 5,03 (1H, д, J=5,2 Гц), 4,92 (1H, т, J=5,8 Гц), 3,83 (3H, с), 1,40 (3H, с), 1,38 (3H, с).
СТАДИЯ 2 Получение (3aS,4R,6aR)-2,2-диметил-4-винил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксола
К раствору (3aR,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-илметилкарбоната (8,00 г, 37,3 ммоль) в сухом THF (187 мл) добавляли CuCN (1,00 г, 11,2 ммоль), затем винилмагнийбромид (1 M в THF, 93,0 мл, 93,0 ммоль) при -10°C. Реакционную смесь перемешивали в течение 10 мин при этой температуре, гасили насыщенным водн. NH4Cl и экстрагировали эфиром. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=8:1) с получением (3aS,4R,6aR)-2,2-диметил-4-винил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксола (3,86 г, 62%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 5,87-5,75 (3H, м), 5,17 (1H, д, J=5,2 Гц), 5,08-5,04 (2H, м), 4,45 (1H, д, J=5,6 Гц), 3,45 (1H, д, J=7,2 Гц), 1,43 (3H, с), 1,35 (3H, с).
СТАДИЯ 3 Получение (3aS,4S,6aR)-2,2-диметил-4-(оксиран-2-ил)-4,6a-дигидро-3aH-циклопента[d][1,3]диоксола
К раствору (3aS,4R,6aR)-2,2-диметил-4-винил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксола (3,86 г, 23,2 ммоль) в DCM (232 мл) добавляли mCPBA (50% масс., 8,82 г, 25,5 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 24 часов и промывали 1 н водн. NaOH. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=4:1) с получением (3aS,4S,6aR)-2,2-диметил-4-(оксиран-2-ил)-4,6a-дигидро-3aH-циклопента[d][1,3]диоксола (3,08 г, 72%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 5,93-5,91 (1H, м), 5,75-5,74 (1H, м), 5,17 (1H, д, J=5,2 Гц), 4,65 (0,6H, д, J=6,0 Гц), 4,60 (0,4H, д, J=5,6 Гц), 2,97-2,88 (2H, м), 2,76 (1H, т, J=4,0 Гц), 2,57-2,55 (1H, м), 1,42 (3H, с), 1,36 (3H, с).
СТАДИЯ 4 Получение (R)-2-амино-1-((3aS,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола
Смесь (3aS,4S,6aR)-2,2-диметил-4-(оксиран-2-ил)-4,6a-дигидро-3aH-циклопента[d][1,3]диоксола (3,08 г, 16,9 ммоль) и NH4 OH (26,3 мл, 169 ммоль) в EtOH (169 мл) перемешивали при 60°C в течение 24 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме с получением (R)-2-амино-1-((3aS,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола (2,40 г, 71%) в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки.
1H-ЯМР (CDCl3, 400 МГц): δ 5,96-5,92 (1H, м), 5,81 (0,6H, д, J=3,2 Гц), 5,75 (0,4H, д, J=4,4 Гц), 5,14 (1H, ушир.с), 4,71 (0,4H, д, J=6,0 Гц), 4,59 (0,6H, д, J=6,0 Гц), 3,61-3,59 (1H, м), 3,44-3,43 (1H, м), 2,96-2,85 (2H, м), 2,74-2,69 (0,4H, м), 2,63-2,57 (0,6H, м), 1,42 (3H, с), 1,35 (3H, с). *Пик протона NH2 не наблюдался.
СТАДИЯ 5 Получение (R)-2-амино-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола
Суспензию (R)-2-амино-1-((3aS,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола (3,30 г, 16,56 ммоль) и Pd/C (5% масс., 1,76 г, 16,6 ммоль) в MeOH (166 мл) перемешивали при комнатной температуре в течение 2 часов в атмосфере H2 (баллон). Реакционную смесь фильтровали через слой целита, и фильтрат концентрировали в вакууме с получением (R)-2-амино-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола (2,60 г, 78%) в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки.
1H-ЯМР (CDCl3, 400 МГц): δ 4,65 (1H, с), 4,36 (1H, ушир.с), 3,95-3,82 (1H, м), 3,27-3,18 (1H, м), 3,05-2,99 (1H, м), 2,08-1,90 (3H, м), 1,80 (1H, ушир.с), 1,67 (1H, ушир.с), 1,46 (3H, с), 1,29 (3H, с). *Пики протона NH2 и OH не наблюдали.
СТАДИЯ 6 Получение (R)-2-((3-хлорпиразин-2-ил)амино)-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола
Смесь (R)-2-амино-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола (2,6 г, 12,9 ммоль), 2,3-дихлорпиразина (4,03 мл, 38,8 ммоль) и TEA (0,517 мл, 3,73 ммоль) в диоксане (43 мл) перемешивали при 100°C в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток растворяли в DCM и промывали водой и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=1:1) с получением (R)-2-((3-хлорпиразин-2-ил)амино)-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола (1,03 г, 25%) в виде желтого масла.
1H-ЯМР (CDCl3, 400 МГц): δ 8,02-8,00 (1H, м), 5,56 (1H, д, J=2,4 Гц), 6,81-6,78 (0,6H, м), 6,72-6,68 (0,4H, м), 5,01 (0,4H, д, J=6,4 Гц), 4,95 (0,6H, д, J=4,8 Гц), 4,62-4,55 (1H, м), 4,39-4,38 (1H, м), 3,53-3,49 (1H, м), 3,28-3,21 (2H, м), 1,91 (1H, ушир.с), 1,91-1,76 (2H, м), 1,66-1,60 (2H, м), 1,33 (3H, с), 1,20 (3H, с).
СТАДИЯ 7 Получение 2-((3-хлорпиразин-2-ил)амино)-1-((3aS,4R,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанона
К раствору (R)-2-((3-хлорпиразин-2-ил)амино)-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанола (360 мг, 1,147 ммоль) и TEA (792 мл, 5,71 ммоль) в сухом DMSO (11 мл) добавляли SO3.TEA (312 мг, 1,72 ммоль) при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, гасили водой и экстрагировали EtOAc. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=3:1) с получением 2-((3-хлорпиразин-2-ил)амино)-1-((3aS,4R,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанона (270 мг, 75%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,92 (1H, д, J=2,4 Гц), 7,64 (1H, д, J=2,4 Гц), 5,92 (1H, ушир.с), 4,81-4,79 (1H, м), 4,75-4,72 (1H, м), 4,47 (1H, дд, J=19,8, 5,0 Гц), 4,31 (1H, дд, J=19,8, 4,6 Гц), 3,17 (1H, д, J=7,6 Гц), 2,26-2,16 (1H, м), 1,90-1,82 (2H, м), 1,77-1,69 (1H, м), 1,47 (3H, с), 1,32 (3H, с).
СТАДИЯ 8 Получение 8-хлор-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина
К раствору 2-((3-хлорпиразин-2-ил)амино)-1-((3aS,4R,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этанона (270 мг, 0,866 ммоль) в толуоле (5,8 мл) добавляли пиридин (0,839 мл, 10,4 ммоль) и TFA (0,467 мл, 6,06 ммоль) при 0°C. Смесь перемешивали в течение 30 мин при комнатной температуре. После добавления TFAA (0,855 мл, 6,06 ммоль) при 0°C, реакционную смесь перемешивали при комнатной температуре в течение 3 часов и концентрировали в вакууме. Остаток разбавляли DCM, промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=1:1) с получением 8-хлор-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина (90,0 мг, 35%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 8,12 (1H, д, J=4,0 Гц), 7,76 (1H, д, J=4,8 Гц), 7,56 (1H, с), 4,81 (1H, с), 4,59 (1H, д, J=4,0 Гц), 3,47 (1H, ушир.с), 2,48-2,42 (1H, м), 2,10-2,00 (3H, м), 1,58 (3H, с), 1,34 (3H, с).
СТАДИЯ 9 Получение N-(3-хлорбензил)-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина
Смесь 8-хлор-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразина (35,0 мг, 0,119 ммоль), (3-хлорфенил)метанамина (20,0 мг, 0,143 ммоль) и DIPEA (52,0 мкл, 0,298 ммоль) в i-BuOH (1,2 мл) подвергали микроволновому облучению при 170°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток разбавляли EtOAc и промывали водой и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (Гексан:EtOAc=1:1) с получением N-(3-хлорбензил)-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (40,0 мг, 84%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,45 (1H, д, J=5,2 Гц), 7,41 (1H, д, J=4,8 Гц), 7,34 (1H, с), 7,33 (1H, с), 7,28-7,21 (2H, м), 7,17 (1H, с), 6,24 (1H, ушир.с), 4,78 (3H, д, J=6,4 Гц), 4,65 (1H, д, J=6,0 Гц), 3,86 (1H, с), 3,44 (1H, д, J=6,8 Гц), 2,38 (1H, ушир.с), 2,0-1,80 (2H, м), 1,55 (3H, с), 1,34 (3H, с).
СТАДИЯ 10 Получение (1R,2S,3S)-3-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
Раствор N-(3-хлорбензил)-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)имидазо[1,2-a]пиразин-8-амина (40,0 мг, 0,100 ммоль) в 80% TFA (1,00 мл, 0,100 ммоль) перемешивали при комнатной температуре в течение 30 мин. После концентрации в вакууме, остаток разбавляли DCM, и затем TEA добавляли к раствору до значения pH 7. Смесь перемешивали при комнатной температуре в течение 20 мин и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (EtOAc:MeOH=10:1) с получением (1R,2S,3S)-3-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола (11,0 мг, 30%) в виде белого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 8,06 (1H, т, J=6,6 Гц), 7,69 (1H, д, J=4,4 Гц), 7,40-7,38 (2H, м), 7,34-7,30 (3H,м), 7,21 (1H, д, J=4,4 Гц), 4,85 (1H, д, J=6,4 Гц), 4,65 (2H, д, J=6,8 Гц), 4,60 (1H, д, J=3,6 Гц), 3,94 (1H, ушир.с), 3,90-3,80 (1H, м), 2,25-2,15 (1H, м), 2,00-1,90 (1H, м), 1,70-1,60 (2H, м). *Пик протона OH будет перекрываться с пиком H2O при 3,33 м.д.
LC-MS MS(EI) для C18H19ClN4O2 [M+H]+, (Рассч.: 358,12) Найдено: 359,2.
Пример 223: Синтез (1R,2S,3S)-3-(8-((3,5-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,12 (1H, т, J=7,6 Гц), 7,71 (1H, д, J=4,8 Гц), 7,44-7,37 (4H, м), 7,21 (1H, д, J=4,0 Гц), 4,85 (1H, д, J=6,8 Гц), 4,64 (2H, д, J=6,0 Гц), 4,59 (1H, д, J=4,0 Гц), 4,04-4,02 (1H, м), 3,94-3,84 (1H, м), 3,33-3,31 (1H, м), 2,21-2,20 (1H, м), 1,99-1,98 (1H, м), 1,65-1,61 (2H, м).
LC-MS MS(EI) для C18H18Cl2N4O2 [M+H]+, (Рассч.: 392,08) Найдено: 393,2.
Пример 224: Синтез (1R,2S,3S)-3-(8-((2,5-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,08 (1H, т, J=7,6 Гц), 7,74 (1H, д, J=4,4 Гц), 7,50 (1H, д, J=8,8 Гц), 7,44 (1H, с), 7,35 (1H, д, J=6,0 Гц), 7,26 (1H, с), 7,21 (1H, д, J=4,4 Гц), 4,86 (1H, д, J=6,0 Гц), 4,69 (2H, д, J=5,6 Гц), 4,60 (1H, д, J=2,8 Гц), 3,95-3,94 (1H, м), 3,91-3,88 (1H, м), 3,35-3,33 (1H, м), 2,21-2,20 (1H, м), 1,99-1,98 (1H, м), 1,65-1,61 (2H, м).
LC-MS MS(EI) для C18H18Cl2N4O2 [M+H]+, (Рассч.: 392,08) Найдено: 393,2.
Пример 225: Синтез (1R,2S,3S)-3-(8-((5-хлор-2-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,03 (1H, т, J=6,8 Гц), 7,72 (1H, д, J=4,8 Гц), 7,42 (1H, с), 7,33-7,31 (2H, м), 7,26-7,21 (2H, м), 4,85 (1H, д, J=6,4 Гц), 4,68 (2H, д, J=6,0 Гц), 4,59 (1H, д, J=3,6 Гц), 3,95-3,94 (1H, м), 3,89-3,86 (1H, м), 2,22-2,20 (1H, м), 1,99-1,98 (1H, м), 1,66-1,63 (2H, м). * Протон будет перекрываться с пиком H2O при 3,33 м.д.
LC-MS MS(EI) для C18H18ClFN4O2 [M+H]+, (Рассч.: 376,11) Найдено: 377,2.
Пример 226: Синтез (1R,2S,3S)-3-(8-((4-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,65 (1H, д, J=4,8 Гц), 7,37-7,34 (2H, м), 7,30-7,25 (3H, м), 7,10 (2H, т, J=9,0 Гц), 4,83 (1H, д, J=6,8 Гц), 4,59 (1H, д, J=3,6 Гц), 3,94-3,92 (1H, м), 3,88-3,83 (1H, м), 3,66 (2H, кв, J=6,6 Гц), 3,33-3,27 (1H, м), 2,92 (2H, т, J=7,4 Гц), 2,25-2,16 (1H, м), 1,97-1,91 (1H, м), 1,68-1,59 (2H, м).
LC-MS MS(EI) для C19H21FN4O2 [M+H]+, (Рассч.: 356,16) Найдено: 357,3.
Пример 227: Синтез (1R,2S,3S)-3-(8-((3-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,66 (1H, д, J=4,8 Гц), 7,38-7,29 (3H, м), 7,26 (1H, д, J=4,8 Гц), 7,10-7,08 (2H, м), 7,01 (1H, т, J=8,4 Гц), 4,83 (1H, д, J=6,8 Гц), 4,59 (1H, д, J=4,0 Гц), 3,94-3,93 (1H, м), 3,88-3,83 (1H, м), 3,69 (2H, кв, J=6,4 Гц), 3,33-3,27 (1H, м), 2,96 (2H, т, J=7,0 Гц), 2,20-2,16 (1H, м), 2,03-1,91 (1H, м), 1,67-1,58 (2H, м).
LC-MS MS(EI) для C19H21FN4O2 [M+H]+, (Рассч.: 356,16) Найдено: 357,3.
Пример 228: Синтез (1R,2S,3S)-3-(8-((3,4-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,66 (1H, д, J=4,8 Гц), 7,39 (1H, т, J=5,4 Гц), 7,34-7,29 (3H, м), 7,25 (1H, д, J=4,4 Гц), 7,11-7,05 (1H, м), 4,83 (1H, д, J=6,8 Гц), 4,59 (1H, д, J=4,0 Гц), 3,94-3,93 (1H, м), 3,88-3,83 (1H, м), 3,65 (2H, кв, J=6,8 Гц), 3,33-3,27 (1H, м), 2,93 (2H, т, J=7,0 Гц), 2,21-2,16 (1H, м), 1,97-1,90 (1H, м), 1,66-1,55 (2H, м).
LC-MS MS(EI) для C19H20F2N4O2 [M+H]+, (Рассч.: 374,16) Найдено: 375,2.
Пример 229: Синтез (1R,2S,3S)-3-(8-((3-хлор-4-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,66 (1H, д, J=4,8 Гц), 7,48 (1H, д, J=6,4 Гц), 7,40 (1H, т, J=5,8 Гц), 7,34 (1H, с), 7,30 (2H, т, J=9,0 Гц), 7,25-7,24 (1H, м), 4,82 (1H, д, J=6,0 Гц), 4,58 (1H, д, J=4,0 Гц), 3,94-3,93 (1H, м), 3,88-3,85 (1H, м), 3,68 (2H, кв, J=7,0 Гц), 2,33-2,27 (1H, м), 2,93 (2H, д, J=6,8 Гц), 2,21-2,16 (1H, м), 2,00-1,91 (1H, м), 1,67-1,63 (2H, м).
LC-MS MS(EI) для C19H20ClFN4O2 [M+H]+, (Рассч.: 390,13) Найдено: 391,2.
Пример 230: Синтез (1R,2S,3S)-3-(8-(((1S,2R)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,76 (1H, д, J=3,2 Гц), 7,70 (1H, д, J=4,0 Гц), 7,37 (1H, с), 7,29-7,23 (3H, м), 7,17 (3H, д, J=6,8 Гц), 4,84 (1H, д, J=7,6 Гц), 4,59 (1H, с), 3,94 (1H, с), 3,86-3,84 (1H, м), 3,33-3,30 (1H, м), 3,12-3,11 (1H, м), 2,23-2,16 (1H, м), 2,09-2,02 (1H, м), 2,00-1,93 (1H, м), 1,68-1,60 (2H, м), 1,49-1,47 (1H, м), 1,24-1,21 (1H, м).
LC-MS MS(EI) для C20H22N4O2 [M+H]+, (Рассч.: 350,17) Найдено: 351,3
Пример 231: Синтез (1R,2S,3S)-3-(8-((4-хлор-3-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ δ 7,66 (1H, д, J=5,4 Гц), 7,45 (1H, т, J=8,0 Гц), 7,41 (1H, т, J=6,6 Гц), 7,34-7,31 (2H, м), 7,25 (1H, д, J=4,8 Гц), 7,11 (1H, д, J=7,2 Гц), 4,83 (1H, д, J=7,2 Гц), 4,58 (1H, д, J=4,0 Гц), 3,94-3,93 (1H, м), 3,88-3,85 (1H, м), 3,68 (2H, кв, J=7,0 Гц), 2,33-2,27 (1H, м), 2,96 (2H, д, J=7,0 Гц), 2,23-1,18 (1H, м), 2,00-1,81 (1H, м), 1,69-1,52 (2H, м).
LC-MS MS(EI) для C19H20ClFN4O2 [M+H]+, (Рассч.: 390,13) Найдено: 391,3.
Пример 232: Синтез (1R,2S,3S)-3-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
СТАДИЯ 1 Получение (R)-1-((3aS,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-ил)этан-1,2-диола
Смесь (3aS,4S,6aR)-2,2-диметил-4-(оксиран-2-ил)-4,6a-дигидро-3aH-циклопента[d][1,3]диоксола (4,41 г, 24,2 ммоль), воды (0,87 мл) и DMF (0,94 мл) нагревали при 110°C в течение 18 часов. После концентрации в вакууме, остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=1:3 до только EtOAc) с получением (R)-1-((3aS,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-ил)этан-1,2-диола (3,86 г, 80%) в виде бесцветного масла.
1H-ЯМР (CDCl3, 400 МГц): δ 5,98 (0,6H, д, J=5,6 Гц), 5,93 (0,4H, д, J=5,6 Гц), 5,81 (0,6H, д, J=3,6 Гц), 5,74 (0,4H, д, J=4,0 Гц), 5,15 (1H, д, J=5,6 Гц), 4,72 (0,4H, д, J=6,0 Гц), 4,60 (0,6H, д, J=5,2 Гц), 3,84-3,54 (3H, м), 2,98 (0,6H, с), 2,90 (0,4H, с), 2,30 (0,4H, с), 2,07-2,05 (1H, м), 1,98 (0,6H, с), 1,42 (3H, с), 1,36 (3H, с).
СТАДИЯ 2 Получение (R)-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этан-1,2-диола
Суспензию (R)-1-((3aS,4S,6aR)-2,2-диметил-4,6a-дигидро-3aH-циклопента[d][1,3]диоксол-4-ил)этан-1,2-диола (3,86 г, 19,3 ммоль) и Pd/C (10% масс., 2,05 г, 1,93 ммоль) в MeOH (193 мл) перемешивали при комнатной температуре в течение 2 часов в атмосфере H2 (баллон). Реакционную смесь фильтровали через слой целита, и фильтрат концентрировали в вакууме с получением (R)-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этан-1,2-диола (3,48 г, 89%) в виде бесцветного масла, которое использовали на следующей стадии без дополнительной очистки.
1H-ЯМР (CDCl3, 400 МГц): δ 4,65-4,60 (1,5H, м), 4,37-4,34 (0,5H, м), 3,77-3,72 (1H, м), 3,63-3,56 (2H, м), 2,21-1,90 (5H, м), 1,89-1,77 (1H, м), 1,65-1,63 (1H, м), 1,48 (3H, с), 1,32 и 1,30 (3H, с+с).
СТАДИЯ 3 Получение (3aS,4R,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида
Суспензию периодата натрия (5,52 г, 25,8 ммоль) и SiO2 (ca 10 г) в DCM (167 мл) и воде (5,5 мл) перемешивали при комнатной температуре в течение 30 мин и охлаждали до 0°C. После добавления раствора (R)-1-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)этан-1,2-диола (3,48 г, 17,2 ммоль) в DCM (5,0 мл) при 0°C, реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Нерастворимое твердое вещество отфильтровывали через слой целита. Фильтрат концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на SiO2 (Гексан:EtOAc=5:1) с получением (3aS,4R,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида (1,81 г, 62%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 9,69 (1H, с), 4,94 (1H, д, J=5,2 Гц), 4,70 (1H, д, J=5,4 Гц), 2,98 (1H, д, J=8,0 Гц), 2,13-2,03 (1H, м), 1,97 (1H, дд, J=12,8, 6,8 Гц), 1,88 (1H, дд, J=14,0, 6,0 Гц), 1,49-1,39 (4H, м), 1,32 (3H, с).
СТАДИЯ 4 Получение 8-хлор-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина
Смесь (3aS,4R,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-карбальдегида (1,81 г, 10,6 ммоль) и 2-хлор-3-гидразинилпиразина (1,85 г, 12,8 ммоль) в DCM (106 мл) перемешивали при комнатной температуре в течение 1 часа и охлаждали до 0°C. После добавления PhI(OAc)2 (5,14 г, 15,9 ммоль) при 0°C, реакционную смесь перемешивали при комнатной температуре в течение 3 часов и затем промывали насыщенным водн. NaHCO3 и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (Гексан:EtOAc=3:1) с получением 8-хлор-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина (1,36 г, 43%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,97 (1H, д, J=4,4 Гц), 7,72 (1H, д, J=4,4 Гц), 4,98-4,93 (2H, м), 3,59 (1H, д, J=6,0 Гц), 2,51-2,41 (1H, м), 2,14-1,99 (3H, м), 1,56 (3H, с), 1,36 (3H, с).
СТАДИЯ 5 Получение N-(3-хлорбензил)-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-амина
Смесь 8-хлор-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразина (50,0 мг, 0,170 ммоль), (3-хлорфенил)метанамина (36,0 мг, 0,254 ммоль) и DIPEA (89,0 мкл, 0,506 ммоль) в i-BuOH (1,5 мл) подвергали микроволновому облучению при 170°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc и промывали водой и насыщенным солевым раствором. Отделенный органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии на NH-SiO2 (Гексан:EtOAc=3:1) с получением N-(3-хлорбензил)-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-амина (45,0 мг, 66%) в виде желтого твердого вещества.
1H-ЯМР (CDCl3, 400 МГц): δ 7,39 (1H, с), 7,36 (1H, д, J=5,6 Гц), 7,32 (1H, д, J=4,8 Гц), 7,26-7,20 (3H, м), 6,68 (1H, ушир.с), 5,03 (1H, д, J=5,2 Гц), 4,92-4,91 (1H, м), 4,82 (1H, д, J=5,6 Гц), 3,86 (1H, с), 3,54 (1H, д, J=6,4 Гц), 2,42-2,38 (1H, м), 2,05-1,97 (3H, м), 1,54 (3H, с), 1,36 (3H, с).
СТАДИЯ 6 Получение (1R,2S,3S)-3-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
Раствор N-(3-хлорбензил)-3-((3aS,4S,6aR)-2,2-диметилтетрагидро-3aH-циклопента[d][1,3]диоксол-4-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-амина (45,0 мг, 0,113 ммоль) в 80% TFA (1,00 мл, 1,00 ммоль) перемешивали при комнатной температуре в течение 20 мин. После концентрации в вакууме, остаток очищали с помощью колоночной хроматографии на NH-SiO2 (EtOAc:MeOH=10:1) с получением (1R,2S,3S)-3-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола (28,0 мг, 69%) в виде белого твердого вещества.
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,71 (1H, т, J=6,2 Гц), 7,72 (1H, д, J=5,2 Гц), 7,40 (1H, с), 7,35-7,27 (3H, м), 7,21 (1H, д, J=4,5 Гц), 4,95 (1H, д, J=6,4 Гц), 4,68-4,66 (3H, м), 4,06-3,98 (2H, м), 3,52 (1H, кв, J=8,5 Гц), 2,21-2,20 (1H, м), 2,08-1,98 (2H, м), 1,71-1,68 (1H, м).
LC-MS MS(EI) для C17H18ClN5O2 [M+H]+, (Рассч.: 359,11) Найдено: 360,3.
Пример 233: Синтез (1R,2S,3S)-3-(8-((3,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,78-8,70 (1H, м), 7,74 (1H, д, J=4,4 Гц), 7,46 (1H, с), 7,40 (2H, с), 7,22 (1H, д, J=4,8 Гц), 4,95 (1H, д, J=6,4 Гц), 4,70-4,60 (3H, м), 4,03-3,99 (2H, м), 3,56-3,50 (1H, м), 2,25-2,15 (1H, м), 2,08-1,99 (2H, м), 1,69 (1H, ушир.с).
LC-MS MS(EI) для C17H17Cl2N5O2 [M+H]+, (Рассч.: 393,08) Найдено: 394,2.
Пример 234: Синтез (1R,2S,3S)-3-(8-((2,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 7,70 (1H, т, J=7,6 Гц), 7,76 (1H, д, J=5,2 Гц), 7,51 (1H, д, J=8,8 Гц), 7,36 (1H, д, J=8,4 Гц), 7,31 (1H, с), 7,22 (1H, д, J=4,8 Гц), 4,97 (1H, д, J=6,8 Гц), 4,70 (3H, дд, J=15,8, 4,6 Гц), 4,05-4,00 (2H, м), 3,54 (1H, кв, J=8,8 Гц), 2,28-2,21 (1H, м), 2,12-1,96 (2H, м), 1,70-1,65 (1H, м).
LC-MS MS(EI) для C17H17Cl2N5O2 [M+H]+, (Рассч.: 393,08) Найдено: 394,2.
Пример 235: Синтез (1R,2S,3S)-3-(8-((5-хлор-2-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,68 (1H, т, J=7,2 Гц), 7,74 (1H, д, J=4,8 Гц), 7,37-7,35 (2H, м), 7,27-7,22 (2H, м), 4,96 (1H, д, J=6,8 Гц), 4,69 (3H, дд, J=15,8, 4,6 Гц), 4,04-4,00 (2H, м), 3,53 (1H, кв, J=8,1 Гц), 2,22-2,20 (1H, м), 2,09-1,99 (2H, м), 1,70-1,66 (1H, м).
LC-MS MS(EI) для C17H17ClFN5O2 [M+H]+, (Рассч.: 377,11) Найдено: 378,2.
Пример 236: Синтез (1R,2S,3S)-3-(8-((4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,08-8,02 (1H, м), 7,64 (1H, д, J=4,4 Гц), 7,26-7,21 (3H, м), 7,06 (2H, т, J=8,6 Гц), 4,91 (1H, д, J=7,2 Гц), 4,62 (1H, д, J=6,4 Гц), 4,00-3,90 (2H, м), 3,70-3,60 (2H, м), 3,48-3,43 (1H, м), 2,89 (2H, т, J=7,2 Гц), 2,20-2,10 (1H, м), 2,00-1,90 (2H, м), 1,70-1,60 (1H, м).
LC-MS MS(EI) для C18H20FN5O2 [M+H]+, (Рассч.: 357,16) Найдено: 358,3.
Пример 237: Синтез (1R,2S,3S)-3-(8-((3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,12 (1H, т, J=6,0 Гц), 7,69 (1H, д, J=4,4 Гц), 7,34-7,29 (1H, м), 7,25 (1H, д, J=4,4 Гц), 7,12-7,08 (2H, м), 7,01 (1H, т, J=8,0 Гц), 4,94 (1H, д, J=6,0 Гц), 4,66 (1H, д, J=3,6 Гц), 4,08-3,98 (2H, м), 3,72-3,70 (2H, м), 3,51 (1H, кв, J=8,4 Гц), 2,98 (2H, т, J=6,8 Гц), 2,22-2,18 (1H, м), 2,08-1,98 (2H, м), 1,69-1,66 (1H, м).
LC-MS MS(EI) для C18H20FN5O2 [M+H]+, (Рассч.: 357,16) Найдено: 358,3.
Пример 238: Синтез (1R,2S,3S)-3-(8-((3,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,14,-8,08 (1H, м), 7,69 (1H, д, J=4,8 Гц), 7,26-7,28 (2H, м), 7,25 (1H, д, J=4,8 Гц), 7,10-7,06 (1H, м), 4,94 (1H, д, J=6,4 Гц), 4,66 (1H, д, J=3,2 Гц), 4,03-3,98 (2H, м), 3,75-3,65 (2H, м), 3,52-3,48 (1H, м), 2,95 (2H, т, J=7,2 Гц), 2,25-2,15 (1H, м), 2,10-1,95 (2H, м), 1,70-1,60 (1H, м).
LC-MS MS(EI) для C18H19F2N5O2 [M+H]+, (Рассч.: 375,15) Найдено: 376,3.
Пример 239: Синтез (1R,2S,3S)-3-(8-((3-хлор-4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,12 (1H, т, J=5,8 Гц), 7,69 (1H, д, J=4,4 Гц), 7,49 (1H, д, J=6,0 Гц), 7,33-7,24 (3H, м), 4,94 (1H, д, J=6,4 Гц), 4,66 (1H, д, J=3,6 Гц), 4,03-3,98 (2H, м), 3,71-3,70 (2H, м), 3,51 (1H, кв, J=6,9 Гц), 2,95 (2H, т, J=7,0 Гц), 2,19-2,17 (1H, м), 2,01-1,98 (2H, м), 1,69-1,65 (1H, м).
LC-MS MS(EI) для C18H19ClFN5O2 [M+H]+, (Рассч.: 391,12) Найдено: 392,3.
Пример 240: Синтез (1R,2S,3S)-3-(8-(((1S,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,47 (1H, д, J=4,0 Гц), 7,73 (1H, д, J=4,4 Гц), 7,30-7,24 (3H, м), 7,18 (3H, д, J=6,8 Гц), 4,95 (1H, д, J=6,4 Гц), 4,68 (1H, с), 4,04-3,98 (2H, м), 3,52 (1H, кв, J=8,5 Гц), 3,17-3,16 (1H, м), 2,22-2,20 (1H, м), 2,13-2,12 (1H, м), 2,04-1,99 (2H, м), 1,69-1,66 (1H, м), 1,52-1,51 (1H, м), 1,26 (1H, кв, J=3,3 Гц).
LC-MS MS(EI) для C19H21N5O2 [M+H]+, (Рассч.: 351,17) Найдено: 352,3.
Пример 241: Синтез (1R,2S,3S)-3-(8-((4-хлор-3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)циклопентан-1,2-диола
1H-ЯМР (DMSO-d6, 400 МГц): δ 8,13 (1H, т, J=6,0 Гц), 7,69 (1H, д, J=4,4 Гц), 7,47 (1H, т, J=8,0 Гц), 7,33 (1H, д, J=10,8 Гц), 7,25 (1H, д, J=4,4 Гц), 7,12 (1H, д, J=8,4 Гц), 4,94 (1H, д, J=6,4 Гц), 4,66 (1H, д, J=3,6 Гц), 4,06-3,98 (2H, м), 3,73-3,71 (2H, м), 3,51 (1H, кв, J=8,6 Гц), 2,97 (2H, т, J=6,8 Гц), 2,24-2,15 (1H, м), 2,05-1,97 (2H, м), 1,68-1,66 (1H, м).
LC-MS MS(EI) для C18H19ClFN5O2 [M+H]+, (Рассч.: 391,12) Найдено: 392,3.
Примеры оценки
Пример оценки 1: Анализ аффинности связывания для аденозиновых рецепторов
Производные аденозина в соответствии с вариантами осуществления настоящего изобретения анализировали на аффинность связывания для аденозиновых рецепторов человека A1, A2a и A3 следующим образом:
Гомогенаты клеточной мембраны CHO (40 мкг белка), в которых экспрессировали А1-аденозиновые рецепторы, инкубировали в течение 60 мин при 22°С с 1 нМ [3H]CCPA в отсутствие или в присутствии тестируемого соединения в буфере, содержащем 50 мМ Tris-HCl (pH 7,4), 5 мМ MgCl2, 1 мМ EDTA, 2 Ед/мл ADA, 1 г/мл лейпептина, 1 М пепстатина и 10 мкг/мл ингибитора трипсина. Неспецифическое связывание определяли в присутствии 10 мкМ CPA. После инкубации производные в соответствии с вариантами осуществления настоящего изобретения быстро фильтровали в вакууме через фильтры из стекловолокна (GF/B, Packard), предварительно промытые 0,3% PEI, и несколько раз промывали ледяной 50 мМ Tris-HCl, используя 96-кюветный харвестер клеток (Unifilter, Packard). Фильтры сушили, затем подсчитывали радиоактивность в сцинтилляционном счетчике (Topcount, Packard) с использованием сцинтилляционного коктейля (Microscint 0, Packard). Результаты выражали в виде процента ингибирования специфического связывания радиолиганда в контроле. Стандартным эталонным соединением является CPA, которое тестируют в каждом эксперименте в нескольких концентрациях для получения кривой конкурентного связывания, из которой рассчитывают его IC50.
Гомогенаты клеточной мембраны HEK-293 (40 мкг белка), в которых экспрессировали А2а-аденозиновые рецепторы, инкубировали в течение 120 мин при 22°C с 6 нM [3H]CGS 21680 в отсутствие или в присутствии тестируемого соединения в буфере, содержащем 50 мМ Tris-HCl (pH 7,4), 10 мМ MgCl2 и 2 Ед/мл ADA. Неспецифическое связывание определяли в присутствии 10 мкM NECA. После инкубации, образцы быстро фильтровали в вакууме через фильтры из стекловолокна (GF/B, Packard), предварительно промытые 0,3% PEI, и несколько раз промывали ледяной 50 мМ Tris-HCl, используя 96-кюветный харвестер клеток (Unifilter, Packard). Фильтры сушили, затем подсчитывали радиоактивность в сцинтилляционном счетчике (Topcount, Packard) с использованием сцинтилляционного коктейля (Microscint 0, Packard). Результаты выражали в виде процента ингибирования специфического связывания радиолиганда в контроле. Стандартным эталонным соединением является NECA, которое тестируют в каждом эксперименте в нескольких концентрациях для получения кривой конкурентного связывания, из которой рассчитывают его IC50.
Гомогенаты клеточной мембраны HEK-293 (32 мкг белка), в которых экспрессировали А3-аденозиновые рецепторы, инкубировали в течение 120 мин при 22°C с 0,15 нM [125I]AB-MECA в отсутствие или в присутствии тестируемого соединения в буфере, содержащем 50 мМ Tris-HCl (pH 7,4), 5 мМ MgCl2, 1 мМ EDTA и 2 Ед/мл ADA. Неспецифическое связывание определяли в присутствии 1 мкM IB-MECA. После инкубации, образцы быстро фильтровали в вакууме через фильтры из стекловолокна (GF/B, Packard), предварительно промытые 0,3% PEI, и несколько раз промывали ледяной 50 мМ Tris-HCl, используя 96-кюветный харвестер клеток (Unifilter, Packard). Фильтры сушили, затем подсчитывали радиоактивность в сцинтилляционном счетчике (Topcount, Packard) с использованием сцинтилляционного коктейля (Microscint 0, Packard). Результаты выражали в виде процента ингибирования специфического связывания радиолиганда в контроле. Стандартным эталонным соединением является IB-MECA, которое тестируют в каждом эксперименте в нескольких концентрациях для получения кривой конкурентного связывания, из которой рассчитывают его IC50.
Стандарт для каждого значения показан в таблице 1 ниже.
Таблица 1
Номера примеров соединений, синтезированных в примерах, и значения Ki для аффинности связывания приведены в таблице 2 ниже.
Таблица 2
Пример оценки 2: Анализ потоков кальция для рецепторов аденозина
FLIPR (флюориметрический планшет-ридер) анализы проводили для профилирования соединений в соответствии с вариантами осуществления настоящего изобретения на агонистическую и антагонистическую активность в отношении рецептора A3.
Связывание A3AR с Gq приводит к стимуляции мобилизации внутриклеточного кальция. Мобилизацию кальция контролировали с помощью анализа FLIPR, функциональный отклик можно было измерять с использованием кальций-чувствительных красителей и флуоресцентного планшет-ридера.
Тестируемое соединения растворяли в диметилсульфоксиде (DMSO) и в конечном итоге получали в аналитическом буфере GPCR Profiler® (Eurofins Discovery services) в концентрациях, которые были в три раза выше конечной концентрации анализа. Аналогичным образом, контроли носителем и положительные контроли были подготовлены для обеспечения надлежащего контроля всех анализов. И конечная концентрация диметилсульфоксида была ниже требуемых 0,5%.
Все лунки были приготовлены с использованием аналитического буфера GPCRProfiler® Assay Buffer. Аналитический буфер GPCRProfiler® модифицировали сбалансированным солевым раствором Хэнкса (HBSS), где HBSS дополняли до содержания 20 мМ HEPES и 2,5 мМ пробенецида при pH 7,4.
Анализ FLIPR проводили с использованием стабильной клеточной линии ChemiScreen A3 Adenosine Receptor (Eurofins, номер по каталогу HTS052C), которая клонировала клетки ChemiScreen, экспрессирующие человеческий рецептор A3, сконструированной путем стабильной трансфекции клеток Chem-3 с A3.
Культивирование клеток проводили с использованием 384-луночного черного планшета с прозрачным дном и инкубации в увлажненной атмосфере, содержащей 5% CO2 инкубатор при 37°С. В день анализа клетки загружали аналитическим буфером GPCRProfiler® Assay Buffer.
Кривые концентрация-эффект были получены для анализа A3AR эталонного агониста (NECA) и эталонного антагониста (VUF5574), чтобы можно было определить концентрации EC50 и EC80.
Анализ агониста проводили на приборе FLIPRTETRA, где тестируемые соединения, контроли носителем и эталонный агонист (NECA) добавляли в аналитический планшет после установления базовой линии флуоресценции/люминесценции. Анализ агониста составлял в общей сложности 180 секунд и использовался для оценки способности каждого соединения активировать каждый анализируемый GPCR.
Анализ антагониста проводили с использованием значений EC80 эффективности, определенных во время анализа агониста, во все лунки, содержащие предварительно инкубированное тестируемое соединение, вводили концентрации EC80 эталонного агониста (NECA) после установления базовой линии флуоресценции/люминесценции. Анализ антагониста проводили с использованием того же аналитического планшета, который использовали для анализа агониста. Анализ антагониста проводили на приборе FLIPRTETRA, где контроли носителем и EC80 концентрацию эталонного агониста (NECA) добавляли в соответствующие лунки. Анализ антагониста составлял в общей сложности 180 секунд и использовался для оценки способности каждого соединения ингибировать каждый анализируемый GPCR.
Соединения в соответствии с вариантами осуществления настоящего изобретения высевали в двух экземплярах для каждой анализируемой концентрации.
Стандарт для каждого значения показан в таблице 3 ниже.
Таблица 3
Номера примеров соединений, синтезированных в примерах, и значения IC50 показаны в таблице 4 ниже.
Таблица 4
Как показано в таблицах 2 и 4, соединения в соответствии с настоящим изобретением были эффективны в качестве антагониста А3-аденозинового рецептора. В частности, соединения настоящего изобретения не связывают или мало связывают А1 и А2-рецептор, что означает, что соединения являются очень селективными при связывании или ингибировании А3-аденозинового рецептора.
Пример оценки 3: Оценка с кроликами
Новозеландских белых кроликов содержали в условиях 12-часового цикла освещения свет-темнота и имели неограниченный доступ к пище и воде. Все процедуры соответствовали The Catholic Institute for Visual Science College of Medicine. Кроликов анестезировали золетилом 50 (VIRBAC, Франция) и ксилазином (Rompun®, Bayer AG, Германия) для измерений ВГД.
ВГД контролировали с помощью TonoVet®, высоконадежным электрофизиологическим методом, который был широко проверен и использован в предыдущих исследованиях. Сообщенные данные получали от одного глаза каждого исследованного кролика. Средние значения ВГД рассчитывали путем усреднения 3-5 мин данных, полученных при 3 Гц до и после применения лекарственного средства. Таким образом, каждое среднее значение было получено от ~ 540 до 900 измерений.
Тестируемые соединения наносили местно по 10 мкл капель с помощью пипетки Эппендорфа при 250 мкМ. Средства сначала растворяли в кремофоре RH40, а затем добавляли к раствору NaOH, содержащему бензалконий хлорид, для усиления проницаемости роговицы. Конечный раствор капель содержал лекарственные средства в указанных концентрациях вместе с 3% кремофора RH40 и 0,005% бензалконий хлорида при осмолярности 270-280 мОсм. Контрольный раствор NaOH (0,1% NaCl) содержал бензалконий.
Результаты показаны в таблице 5 ниже.
Таблица 5
Как показано в таблице 5 выше, соединения настоящего изобретения эффективны при снижении внутриглазного давления (ВГД). Таким образом, соединения являются полезными для облегчения тяжести, профилактики или лечения глаукомы или глазных заболеваний, связанных с глаукомой.
Все упомянутые документы включены посредством ссылки, как если бы были описаны в настоящем документе. Термины "содержащий", "включающий" и "имеющий" являются включительными и означают, что могут быть дополнительные элементы помимо перечисленных элементов. Хотя настоящее изобретение было описано в отношении конкретных вариантов осуществления, детали этих вариантов осуществления не должны толковаться как ограничения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Имидазопирролопиразиновые производные, полезные для лечения заболеваний, вызванных аномальной активностью протеинкиназ Jak1, Jak3 или Syk | 2010 |
|
RU2711869C2 |
| ИМИДАЗОПИРРОЛОПИРАЗИНОВЫЕ ПРОИЗВОДНЫЕ, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ АНОМАЛЬНОЙ АКТИВНОСТЬЮ ПРОТЕИНКИНАЗ Jak1, Jak3 ИЛИ Syk | 2010 |
|
RU2570416C2 |
| СОЕДИНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТА АДЕНОЗИНОВОГО РЕЦЕПТОРА A2a И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2022 |
|
RU2840068C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ И ОНКОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2009 |
|
RU2545023C9 |
| ПРОИЗВОДНЫЕ АМИНОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2826628C1 |
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2833354C1 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТИХ СОЕДИНЕНИЙ | 2007 |
|
RU2478635C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PRMT5 | 2018 |
|
RU2797822C2 |
| СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2809763C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АЛЛОСТЕРИЧЕСКИХ ИНГИБИТОРОВ SHP2 | 2018 |
|
RU2776846C2 |
Изобретение относится к соединению формулы I или его фармацевтически приемлемой соли. В формуле I X представляет собой серу или кислород; Z1 и Z2 являются одинаковыми или различными и каждый независимо представляет собой азот или CH; R1 представляет собой NR3R4, где указанный R3 и R4 каждый независимо представляет собой H, C1-6 алкил, замещенный C1-6 алкил, C3-7 циклоалкил, замещенный C3-7 циклоалкил или гетероцикл, R2 представляет собой Н или галоген; при этом замещенный C1-6 алкил представляет собой C1-6 алкил, замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-3 алкила, необязательно имеющего от одного до трех фторзаместителей, амино, арила, гетероарила, гетероцикла и галогена; замещенный C3-7 циклоалкил представляет собой C3-7 циклоалкил, замещенный одним заместителем, выбранным из арила; арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из замещенного C1-3 алкила, необязательно имеющего от одного до трех фторзаместителей, гетероарила, гетероцикла, арила, C1-3 алкокси, необязательно имеющего от одного до трех фторзаместителей, арилокси, ацилокси, карбокси, амино, циано и галогена; гетероарил представляет собой бензоимидазолил, фуранил, имидазопиридинил, индолил, оксазолил, оксадиазолил, пиридил, пиразинил, пиримидил, тиофенил, тетразолил или тиазолил, необязательно замещенные одним или несколькими заместителями, выбранными из C1-3 алкила; и гетероцикл представляет собой пиперидинил, пиперазинил или морфолинил; или соединение, выбранное из группы, указанной в формуле изобретения. Изобретение также относится к фармацевтической композиции, к способу профилактики, облегчения тяжести или лечения состояния, к способу антагонизации А3-аденозинового рецептора. Технический результат: получены новые соединения формулы I, которые обладают свойствами антагониста А3-аденозинового рецептора и полезны при лечении глаукомы. 4 н. и 6 з.п. ф-лы, 5 табл., 244 пр.
 I
I
1. Соединение формулы I:
 I
I
или его фармацевтически приемлемая соль, где:
X представляет собой серу или кислород;
Z1 и Z2 являются одинаковыми или различными и каждый независимо представляет собой азот или CH;
R1 представляет собой NR3R4, где указанный R3 и R4 каждый независимо представляет собой H, C1-6 алкил, замещенный C1-6 алкил, C3-7 циклоалкил, замещенный C3-7 циклоалкил или гетероцикл, и
R2 представляет собой Н или галоген,
где
замещенный C1-6 алкил представляет собой C1-6 алкил, замещенный одним или несколькими заместителями, выбранными из группы, состоящей из C1-3 алкила, необязательно имеющего от одного до трех фторзаместителей, амино, арила, гетероарила, гетероцикла и галогена;
замещенный C3-7 циклоалкил представляет собой C3-7 циклоалкил, замещенный одним заместителем, выбранным из арила;
арил представляет собой фенил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из замещенного C1-3 алкила, необязательно имеющего от одного до трех фторзаместителей, гетероарила, гетероцикла, арила, C1-3 алкокси, необязательно имеющего от одного до трех фторзаместителей, арилокси, ацилокси, карбокси, амино, циано и галогена;
гетероарил представляет собой бензоимидазолил, фуранил, имидазопиридинил, индолил, оксазолил, оксадиазолил, пиридил, пиразинил, пиримидил, тиофенил, тетразолил или тиазолил, необязательно замещенные одним или несколькими заместителями, выбранными из C1-3 алкила; и
гетероцикл представляет собой пиперидинил, пиперазинил или морфолинил;
или соединение, выбранное из группы, состоящей из
(2S,3R,4S)-2-(8-((циклопропилметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 7),
(2S,3R,4S)-2-(8-((3-хлорфенил)этинил)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 30),
4-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)-2-фтор-N-метилбензамида (Соединение 40),
2-хлор-4-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)-N-метилбензамида (Соединение 44),
4-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-2-фтор-N-метилбензамида (Соединение 125),
2-хлор-4-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-N-метилбензамида (Соединение 126),
(2S,3R,4S)-2-(8-((3-хлорфенил)этинил)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 159),
(2S,3R,4S)-2-(8-((3-(4-метилпиперазин-1-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 174),
(2S,3R,4S)-2-(8-((3-циклопропилбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 202) и
(2S,3R,4S)-2-(8-((3-фтор-4-(5-метилоксазол-2-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 211),
и их фармацевтически приемлемой соли.
2. Соединение по п. 1, где соединение представляет собой любое соединение, выбранное из группы, состоящей из
(2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 1),
(2S,3R,4S)-2-(8-(метиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 2),
(2S,3R,4S)-2-(8-(бензиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 5),
(2S,3R,4S)-2-(8-((3-иодбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 6),
(2S,3R,4S)-2-(8-(циклобутиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 8),
(2S,3R,4S)-2-(8-((3-(трифторметил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 9),
(2S,3R,4S)-2-(8-((тиофен-3-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 10),
(2S,3R,4S)-2-(8-(фенетиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 11),
(2S,3R,4S)-2-(8-((3-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 13),
(2S,3R,4S)-2-(8-((3-(трифторметокси)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 14),
(2S,3R,4S)-2-(8-((3-метоксибензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 15),
3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)бензонитрила (Соединение 16),
(2S,3R,4S)-2-(8-((3-бромбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 17),
(2S,3R,4S)-2-(8-((3-хлорфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 24),
(2S,3R,4S)-2-(8-((3-бромфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 25),
(2S,3R,4S)-2-(8-((3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 26),
(2S,3R,4S)-2-(8-((2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 27),
(2S,3R,4S)-2-(8-((1-(3-хлорфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 29),
(2S,3R,4S)-2-(8-(циклопропиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 31),
(2S,3R,4S)-2-(8-(изопентиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 32),
(2S,3R,4S)-2-(8-((имидазо[1,2-a]пиридин-2-илметил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 36),
(2S,3R,4R)-2-(8-((3-хлорфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидрофуран-3,4-диола (Соединение 39),
(2S,3R,4S)-2-(8-(((1S,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 43),
(2S,3R,4S)-2-(8-(((S)-1-(3-хлорфенил)этил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 45),
(2S,3R,4S)-2-(8-(((R)-1-(3-хлорфенил)этил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 46),
(2S,3R,4S)-2-(8-((2-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 47),
(2S,3R,4S)-2-(8-((2-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 50),
(2S,3R,4S)-2-(8-((3,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 55),
(2S,3R,4S)-2-(8-((2,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 56),
(2S,3R,4S)-2-(8-((2,3-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 58),
(2S,3R,4S)-2-(8-((3,4-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 59),
метил-2-хлор-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидро тиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)бензоата (Соединение 61),
(2S,3R,4S)-2-(8-((2-иодбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 62),
(2S,3R,4S)-2-(8-((3-хлор-4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 63),
(2S,3R,4S)-2-(8-((4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 64),
(2S,3R,4S)-2-(8-((3-хлор-4-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 65),
(2S,3R,4S)-2-(8-((3-(1H-тетразол-5-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 69),
(2S,3R,4S)-2-(8-((2-(3-фторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 70),
(2S,3R,4S)-2-(8-((2-(3-хлорфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 71),
(2S,3R,4S)-2-(8-((2,3-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 73),
(2S,3R,4S)-2-(8-((2,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 74),
(2S,3R,4S)-2-(8-(((1R,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 75),
(2S,3R,4S)-2-(8-((2,5-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 76),
(2S,3R,4S)-2-(8-((4-хлор-3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 78),
(2S,3R,4S)-2-(8-((3-(пиперазин-1-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 80),
(2S,3R,4S)-2-(8-((2,6-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 81),
(2S,3R,4S)-2-(8-((3,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 82),
(2S,3R,4S)-2-(8-((3,5-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 83),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3,4-дифторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 84),
(2S,3R,4S)-2-(8-((5-хлор-2-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 85),
(2S,3R,4S)-2-(8-((3-хлор-5-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 86),
метил-3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)-[1,2,4]триазоло[4,3-a]пиразин-8-ил)амино)метил)бензоата (Соединение 90),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3-фторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 98),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3-хлорфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 99),
(2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 100),
(2S,3R,4S)-2-(6-хлор-8-((2,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 101),
(2S,3R,4S)-2-(6-хлор-8-((3,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 102),
(2S,3R,4S)-2-(6-хлор-8-((5-хлор-2-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 103),
(2S,3R,4S)-2-(6-хлор-8-((4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 104),
(2S,3R,4S)-2-(6-хлор-8-((3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 105),
(2S,3R,4S)-2-(6-хлор-8-((3,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 106),
(2S,3R,4S)-2-(6-хлор-8-((4-хлор-3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 107),
(2S,3R,4S)-2-(6-хлор-8-(((1S,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 108),
(2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 109),
(2S,3R,4S)-2-(8-(метиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 111),
(2S,3R,4S)-2-(8-(циклобутиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 113),
(2S,3R,4S)-2-(8-(циклопропиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 114),
(2S,3R,4S)-2-(8-(изопентиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 115),
(2S,3R,4S)-2-(8-(бензиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 120),
(2S,3R,4S)-2-(8-((3-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 122),
(2S,3R,4S)-2-(8-((3-(трифторметил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 123),
(2S,3R,4S)-2-(8-((3-иодбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 124),
(2S,3R,4S)-2-(8-((3-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 127),
(2S,3R,4S)-2-(8-(фенетиламино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 128),
(2S,3R,4S)-2-(8-((2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 129),
(2S,3R,4S)-2-(8-((тиофен-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 130),
(2S,3R,4S)-2-(8-((фуран-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 131),
(2S,3R,4S)-2-(8-((3-бромбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 132),
(2S,3R,4S)-2-(8-((пиридин-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 135),
(2S,3R,4S)-2-(8-((пиридин-4-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 136),
(2S,3R,4S)-2-(8-((3-метоксибензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 137),
(2S,3R,4S)-2-(8-((3-(трифторметокси)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 140),
3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензонитрила (Соединение 141),
(2S,3R,4S)-2-(8-((пиримидин-4-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 145),
(2S,3R,4S)-2-(8-((3-хлорфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 146),
(2S,3R,4S)-2-(8-((тиазол-4-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 147),
(2S,3R,4S)-2-(8-((тиазол-2-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 148),
(2S,3R,4S)-2-(8-((3-бромфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 149),
(2S,3R,4S)-2-(8-((1-(3-хлорфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 151),
(2S,3R,4S)-2-(8-((2-(3-хлорфенил)пропан-2-ил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 152),
(2S,3R,4S)-2-(8-(((1H-бензо[d]имидазол-2-ил)метил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диол гидрохлорида (Соединение 153),
(2S,3R,4S)-2-(8-((2-(пиперидин-1-ил)этил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 154),
(2S,3R,4S)-2-(8-((тиазол-5-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 157),
(2S,3R,4S)-2-(8-(((R)-1-(3-хлорфенил)этил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 160),
(2S,3R,4S)-2-(8-(((S)-1-(3-хлорфенил)этил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 161),
(2S,3R,4S)-2-(8-(((1S,2R)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 162),
(2S,3R,4S)-2-(8-((2-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 163),
(2S,3R,4S)-2-(8-((4-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 164),
(2S,3R,4S)-2-(8-((4-иодбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 165),
(2S,3R,4S)-2-(8-(((1H-индол-5-ил)метил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 166),
(2S,3R,4S)-2-(8-((2-иодбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 168),
(2S,3R,4S)-2-(8-((2-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 169),
(2S,3R,4S)-2-(8-((4-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 170),
метил-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-2-фторбензоата (Соединение 171),
(2S,3R,4S)-2-(8-((3-хлор-4-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 172),
(2S,3R,4S)-2-(8-((2,3-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 175),
(2S,3R,4S)-2-(8-((2,4-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 176),
(2S,3R,4S)-2-(8-((2,5-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 177),
(2S,3R,4S)-2-(8-((тиофен-2-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 178),
(2S,3R,4S)-2-(8-((2-(3-фторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 179),
(2S,3R,4S)-2-(8-((2-(3-хлорфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 180),
(2S,3R,4S)-2-(8-((3-(пиперазин-1-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 181),
метил-2-хлор-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензоата (Соединение 182),
(2S,3R,4S)-2-(8-((3-хлор-4-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 183),
(2S,3R,4S)-2-(8-((3,5-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 184),
(2S,3R,4S)-2-(8-((3,4-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 185),
(2S,3R,4S)-2-(8-((2,6-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 186),
(2S,3R,4S)-2-(8-((3-(1H-тетразол-5-ил)бензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диол 2,2,2-трифторуксусной кислоты (Соединение 191),
(2S,3R,4S)-2-(8-((2,3-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 192),
(2S,3R,4S)-2-(8-((2,4-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 193),
(2S,3R,4S)-2-(8-((2,5-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 194),
(2S,3R,4S)-2-(8-((2,6-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 195),
(2S,3R,4S)-2-(8-((3,5-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 196),
(2S,3R,4S)-2-(8-((3,4-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 197),
(2S,3R,4S)-2-(8-((4-хлор-3-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 198),
(2S,3R,4S)-2-(8-(((1R,2S)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 200),
(2S,3R,4S)-2-(8-((3-хлор-5-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 201),
(2S,3R,4S)-2-(8-(([1,1'-бифенил]-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 203),
(2S,3R,4S)-2-(8-((3-феноксибензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 204),
метил-3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензоата (Соединение 205),
(2S,3R,4S)-2-(8-(((1R,2R)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 207),
(2S,3R,4S)-2-(8-((5-хлор-2-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 208),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3,4-дифторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 209),
(2S,3R,4S)-2-(8-((3-морфолинобензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 210),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3-фторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 215),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3-хлорфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 216),
(2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 217),
(2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиридин-3-ил)тетрагидротиофен-3,4-диола (Соединение 218),
и их фармацевтически приемлемой соли.
3. Соединение по п. 2, где соединение представляет собой любое соединение, выбранное из группы, состоящей из
(2S,3R,4S)-2-(8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 1),
(2S,3R,4S)-2-(8-((3-иодбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 6),
(2S,3R,4S)-2-(8-((3-(трифторметил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 9),
(2S,3R,4S)-2-(8-(фенетиламино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 11),
(2S,3R,4S)-2-(8-(((1S,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 43),
(2S,3R,4S)-2-(8-((2-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 50),
(2S,3R,4S)-2-(8-((3,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 55),
(2S,3R,4S)-2-(8-((2,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 56),
(2S,3R,4S)-2-(8-((2,3-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 58),
(2S,3R,4S)-2-(8-((3,4-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 59),
(2S,3R,4S)-2-(8-((2-иодбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 62),
(2S,3R,4S)-2-(8-((3-хлор-4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 63),
(2S,3R,4S)-2-(8-((4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 64),
(2S,3R,4S)-2-(8-((3-хлор-4-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 65),
(2S,3R,4S)-2-(8-((3-(1H-тетразол-5-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 69),
(2S,3R,4S)-2-(8-((2-(3-фторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 70),
(2S,3R,4S)-2-(8-((2-(3-хлорфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 71),
(2S,3R,4S)-2-(8-((2,3-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 73),
(2S,3R,4S)-2-(8-((2,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 74),
(2S,3R,4S)-2-(8-(((1R,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 75),
(2S,3R,4S)-2-(8-((2,5-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 76),
(2S,3R,4S)-2-(8-((4-хлор-3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 78),
(2S,3R,4S)-2-(8-((3-(пиперазин-1-ил)бензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 80),
(2S,3R,4S)-2-(8-((2,6-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 81),
(2S,3R,4S)-2-(8-((3,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 82),
(2S,3R,4S)-2-(8-((3,5-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 83),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3,4-дифторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 84),
(2S,3R,4S)-2-(8-((5-хлор-2-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 85),
(2S,3R,4S)-2-(8-((3-хлор-5-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 86),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3-фторфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 98),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3-хлорфенил)циклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 99),
(2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 100),
(2S,3R,4S)-2-(6-хлор-8-((2,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 101),
(2S,3R,4S)-2-(6-хлор-8-((3,5-дихлорбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 102),
(2S,3R,4S)-2-(6-хлор-8-((5-хлор-2-фторбензил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 103),
(2S,3R,4S)-2-(6-хлор-8-((4-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 104),
(2S,3R,4S)-2-(6-хлор-8-((3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 105),
(2S,3R,4S)-2-(6-хлор-8-((3,4-дифторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 106),
(2S,3R,4S)-2-(6-хлор-8-((4-хлор-3-фторфенетил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 107),
(2S,3R,4S)-2-(6-хлор-8-(((1S,2R)-2-фенилциклопропил)амино)-[1,2,4]триазоло[4,3-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 108),
(2S,3R,4S)-2-(8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 109),
(2S,3R,4S)-2-(8-((3-иодбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 124),
(2S,3R,4S)-2-(8-((3-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 127),
(2S,3R,4S)-2-(8-((2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 129),
(2S,3R,4S)-2-(8-((3-бромбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 132),
(2S,3R,4S)-2-(8-((3-бромфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 149),
(2S,3R,4S)-2-(8-(((R)-1-(3-хлорфенил)этил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 160),
(2S,3R,4S)-2-(8-(((1S,2R)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 162),
(2S,3R,4S)-2-(8-((2-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 163),
(2S,3R,4S)-2-(8-(((1H-индол-5-ил)метил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 166),
(2S,3R,4S)-2-(8-((2-иодбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 168),
(2S,3R,4S)-2-(8-((2-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 169),
(2S,3R,4S)-2-(8-((4-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 170),
метил-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)-2-фторбензоата (Соединение 171),
(2S,3R,4S)-2-(8-((3-хлор-4-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 172),
(2S,3R,4S)-2-(8-((2,3-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 175),
(2S,3R,4S)-2-(8-((2,4-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 176),
(2S,3R,4S)-2-(8-((2,5-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 177),
(2S,3R,4S)-2-(8-((тиофен-2-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 178),
(2S,3R,4S)-2-(8-((2-(3-фторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 179),
(2S,3R,4S)-2-(8-((2-(3-хлорфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 180),
метил-2-хлор-5-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензоата (Соединение 182),
(2S,3R,4S)-2-(8-((3-хлор-4-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 183),
(2S,3R,4S)-2-(8-((3,5-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 184),
(2S,3R,4S)-2-(8-((3,4-дихлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 185),
(2S,3R,4S)-2-(8-((2,3-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 192),
(2S,3R,4S)-2-(8-((2,4-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 193),
(2S,3R,4S)-2-(8-((2,5-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 194),
(2S,3R,4S)-2-(8-((2,6-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 195),
(2S,3R,4S)-2-(8-((3,5-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 196),
(2S,3R,4S)-2-(8-((3,4-дифторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 197),
(2S,3R,4S)-2-(8-((4-хлор-3-фторфенетил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 198),
(2S,3R,4S)-2-(8-(((1R,2S)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 200),
(2S,3R,4S)-2-(8-((3-хлор-5-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 201),
(2S,3R,4S)-2-(8-(([1,1'-бифенил]-3-илметил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 203),
(2S,3R,4S)-2-(8-((3-феноксибензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 204),
метил-3-(((3-((2S,3R,4S)-3,4-дигидрокситетрагидротиофен-2-ил)имидазо[1,2-a]пиразин-8-ил)амино)метил)бензоата (Соединение 205),
(2S,3R,4S)-2-(8-(((1R,2R)-2-фенилциклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 207),
(2S,3R,4S)-2-(8-((5-хлор-2-фторбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 208),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3,4-дифторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 209),
(2S,3R,4S)-2-(8-((3-морфолинобензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 210),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3-фторфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 215),
(2S,3R,4S)-2-(8-(((1S,2R)-2-(3-хлорфенил)циклопропил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 216),
(2S,3R,4S)-2-(6-хлор-8-((3-хлорбензил)амино)имидазо[1,2-a]пиразин-3-ил)тетрагидротиофен-3,4-диола (Соединение 217),
и их фармацевтически приемлемой соли.
4. Фармацевтическая композиция, обладающая свойствами антагониста А3-аденозинового рецептора, содержащая терапевтически эффективное количество соединения по любому из пп.1-3 и фармацевтически приемлемый носитель, эксципиент или разбавитель.
5. Фармацевтическая композиция по п.4 для применения при профилактике, облегчении тяжести или лечении глаукомы.
6. Соединение по любому из пп.1-3 для применения при профилактике, облегчении тяжести или лечении глаукомы.
7. Соединение по любому из пп.1-3, где соединение предназначено для применения в антагонизации А3-аденозинового рецептора.
8. Способ профилактики, облегчения тяжести или лечения состояния, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-3, в котором состояние представляет собой глаукому.
9. Способ по п.8, где субъект представляет собой человека.
10. Способ антагонизации А3-аденозинового рецептора, включающий приведение в контакт клеток с эффективным количеством соединения по любому из пп.1-3.
| WO 2009108546 A1, 03.09.2009 | |||
| A | |||
| Converso et al | |||
| "Adenosine analogue inhibitors of S-adenosylhomocysteine hydrolase" Bioorganic & Medicinal Chemistry Letters, 2014 | |||
| S | |||
| Pal et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2020-11-25—Публикация
2017-01-13—Подача