Изобретение относится к медицине, а именно к онкологии, может быть использовано для хирургического лечения больных местно-распространенными нейроэндокринными опухолями тонкой кишки с вовлечением в опухолевый процесс проксимальных отделов верхних брыжеечных сосудов в качестве самостоятельного метода либо составляющей части комплексного лечения больных.
Нейроэндокринные опухоли (НЭО) тонкой кишки считаются относительно редкими новообразованиями, заболеваемость которыми составляет 1,05 случаев на 100 тыс.населения в год [1, 2]. Вместе с тем, за последние два десятилетия частота встречаемости данных опухолей увеличилась в 3 раза [3]. Кардинальные изменения в выявлении НЭО тонкой кишки связаны с внедрением в повседневную клиническую практику высокоинформативных методов эндоскопической и лучевой диагностики, а также значительным прогрессом в морфологической верификации НЭО благодаря применению иммуногистохимического исследования [4]. На сегодняшний день НЭО вышли на первое место и составляют 37,5-40,0% в структуре злокачественных опухолей, опережая такие морфологические формы новообразований тонкой кишки как аденокарцинома, лимфома, гастроинтестинальностромальные опухоли [5]. Несмотря на существенное увеличение числа случаев НЭО тонкой кишки, по-прежнему их ранняя диагностика представляет значительные сложности, что обусловлено длительным бессимптомным течением заболевания, а также труднодоступностью данного отдела желудочно-кишечного тракта для инструментального обследования [6, 7]. Как правило, от возникновения опухоли в тонкой кишке до ее выявления проходит в среднем не менее 3-5 лет, ввиду чего заболевание в 80-90% случаев диагностируется на стадии местно-распространенного либо генерализованного онкологического процесса [8]. Отличительной особенностью НЭО тонкой кишки является их индолентное течение, в связи с чем, регионарные и отдаленные метастазы характеризуются более интенсивным ростом по сравнению с первичной опухолью, размер которой в 90% случаев не превышает 2 см [9]. У таких пациентов в 80-90% наблюдений развивается метастатическое поражение брыжейки тонкой кишки, представленное конгломератом измененных лимфатических узлов, располагающихся вдоль ветвей или непосредственно стволов верхних брыжеечных сосудов [10]. Избыточная продукция опухолевыми клетками серотонина приводит к развитию выраженных фиброзных изменений клетчатки вокруг метастатически пораженных лимфатических узлов и значительной деформации брыжейки тонкой кишки с формированием опухолевого конгломерата, вовлекающего различное число петель кишки и верхние брыжеечные сосуды [11]. Развивающиеся изменения в брюшной полости нередко приводят к возникновению местных осложнений опухолевого процесса (острая кишечная непроходимость, тромбоз либо опухолевый стеноз верхних брыжеечных сосудов, прогрессирующий абдоминальный болевой синдром вследствие ишемии кишки), существенно ухудшающих качество и представляющих непосредственную угрозу для жизни пациентов [12, 13]. Зачастую больные НЭО тонкой кишки с местно-распространенным опухолевым процессом признаются нерезектабельными и получают системную лекарственную терапию, а в случае развития острой кишечной непроходимости им проводиться паллиативное хирургическое лечение в объеме формирования дренирующих межкишечных анастомозов [14]. Существующие на сегодняшний день малоинвазивные эндоваскулярные методы лечения осложнений, связанных с вовлечением в опухолевый конгломерат верхних брыжеечных сосудов, не всегда позволяют эффективно устранить сосудистые нарушения и остаются малодоступными для большинства лечебных учреждений [15]. Установлено, что удаление первичного очага у больных местно-распространенными НЭО тонкой кишки позволяет профилактировать местные осложнения и прогрессирование опухолевого процесса, тогда как у пациентов генерализованными опухолями - увеличить канцер-специфическую выживаемость и качество жизни благодаря уменьшению опухолевой массы и повышению эффективности системного медикаментозного лечения отдаленных метастазов [16, 17]. Следовательно, несмотря на имеющиеся достижении в лекарственной и локо-регионарной терапии, по-прежнему хирургическому методу отводиться ведущее место в лечении больных местно-распространенными и генерализованными НЭО тонкой кишки [18]. Вместе с тем, ввиду сложности топографо-анатомических взаимоотношений оперативное вмешательство у таких пациентов представляет значительные технические трудности и таит риск возникновения фатальных интраоперационных осложнений, связанных с массивным кровотечением из проксимальных отделов верхних брыжеечных сосудов в ходе выделения опухолевого конгломерата брыжейки тонкой кишки [11, 13]. Кроме того, в случае необоснованного расширения объема резекции существует высокая вероятность развития в послеоперационном периоде синдрома короткой тонкой кишки, значительно ухудшающего качество жизни больных и трудно поддающегося лекарственной терапии [18].
В зарубежной и отечественной научной медицинской литературе вопросам хирургического лечения больных НЭО тонкой кишки посвящены немногочисленные публикации. Вместе с тем, наиболее сложные и представляющие непосредственный практический интерес технические особенности резекции тонкой кишки у больных местно-распространенными НЭО с вовлечением в опухолевый процесс верхних брыжеечных сосудов нашли отражение в отдельных работах.
Ohrvall U. и соавт. предложен способ резекции НЭО тонкой кишки с метастатическим поражением брыжейки [19]. Выполняется латеральная мобилизация правой половины ободочной кишки и дистального отдела тонкой кишки с диссекцией корня брыжейки от забрюшинной клетчатки до уровня нижней горизонтальной ветви двенадцатиперстной кишки, где визуализируются верхние брыжеечные сосуды и определяется степень их вовлечения в опухоль. В случае выявления циркулярной инвазии верхних брыжеечных сосудов на уровне нижнего края поджелудочной железы опухолевый процесс признается нерезектабельным. Недостатком предложенного способа резекции НЭО является значительная травматичность в связи с широкой мобилизацией тонкой и толстой кишки, а также риск диссеминации опухолевых клеток вследствие манипуляции с опухолевым конгломератом брыжейки до перевязки питающих его сосудов.
Другой способ резекции местно-распространенных НЭО тонкой кишки был разработан Pasquer А. и соавт. [20]. Особенность его заключается в первоначальной мобилизации печеночного изгиба и проксимальной трети поперечной ободочной кишки, а также двенадцатиперстной кишки по Кохеру с целью визуализации проксимальных отделов верхних брыжеечных сосудов и определения уровня их инвазии опухолью. Исследователи считают резектабельным опухолевый процесс в том случае, когда пересечение верхней брыжеечной артерии представляется возможным дистальнее первых 3-4 отходящих от ее левой полуокружности тощекишечных артерий, которые необходимы для сохранения полноценного кровоснабжения остающейся части тонкой кишки. Преимуществом представленного способа резекции НЭО тонкой кишки по сравнению со способом Ohrvall U. и соавт. является первичный контроль над питающими опухоль сосудами, что повышает онкологическую радикальность оперативного вмешательства. Вместе с тем, его недостатком является техническая сложность выделения верхних брыжеечных сосудов в верхнем этаже брюшной полости, что не позволяет рекомендовать предложенный способ резекции тонкой кишки для широкого практического применения.
В связи с ограниченным опытом лечения больных НЭО большинством лечебных учреждений в отечественной научной медицинской литературе отсутствуют разработанные технические способы, позволяющие безопасно и эффективно с онкологических и функциональных позиций выполнить резекцию тонкой кишки при местно-распространенном опухолевом процессе с инвазией верхних брыжеечных сосудов.
Предлагаемая техника резекции тонкой кишки предназначена для лечения больных местно-распространенными нейроэндокринными опухолями с вовлечением в опухолевый процесс верхних брыжеечных сосудов. Реализация разработанного способа резекции тонкой кишки позволяет эффективно увеличить общую выживаемость пациентов с местно-распространенными нейроэндокринными опухолями благодаря профилактике развития жизнеугрожающих местных осложнений опухолевого процесса, связанных с окклюзией либо тромбозом верхних брыжеечных сосудов, а также позволяет улучшить качество жизни вследствие устранения у данных пациентов стойкого абдоминального болевого синдрома. Применение разработанного способа оперативного вмешательства позволяет проводить изолированное хирургическое лечение местно-распространенных НЭО тонкой кишки с инвазией верхних брыжеечных сосудов в качестве самостоятельного метода либо составляющего элемента комплексного лечения пациентов, когда другие методы лечение не позволяют предотвратить либо устранить развитие местных осложнений опухолевого процесса.
Решение поставленной задачи обеспечивается тем, что в способе резекции тонкой кишки при местно-распространенных нейроэндокринных опухолях с вовлечением в опухолевый процесс верхних брыжеечных сосудов, включающем выполнение срединной лапаротомии и ревизии брюшной полости для оценки распространенности опухолевого процесса отличающийся тем, что поперечную ободочную кишку с мезоколон приподнимают и перемещают в краниальном направлении; проводят визуальную и бимануальную ревизию тонкой кишки на всем протяжении от дуоденоеюнального до илеоцекального перехода, определяют протяженность и локализацию сегмента тонкой кишки, вовлеченного в опухолевый конгломерат брыжейки; осуществляют визуальную и пальпаторную оценку размеров опухолевого конгломерата брыжейки, степень его распространения в краниальном направлении корня брыжейки, предполагаемый уровень вовлечения в опухолевый процесс верхних брыжеечных сосудов; локализацию верхних брыжеечных сосудов в корне брыжейки тонкой кишки определяют на основании установления пульсации верхней брыжеечной артерии непосредственно у основания мезоколон, а также по расположению в основании мезоколон средней ободочной артерии; резектабельным расценивают опухолевый конгломерат корня брыжейки тонкой кишки, не распространяющийся на мезоколон; визуализируют забрюшинную часть нисходящей и нижней горизонтальной ветви двенадцатиперстной кишки, стенка которой прослеживается через задний листок париетальной брюшины; с помощью биполярного пинцета либо гармонического скальпеля задний листок париетальной брюшины рассекают от нижнего изгиба двенадцатиперстной кишки в медиальном направлении по краю ее нижней горизонтальной ветви до уровня дуоденоеюнального перехода обнажая переднюю поверхность верхних брыжеечных сосудов; вторым разрезом рассекают заднюю париетальную брюшину от нижнего изгиба двенадцатиперстной кишки в нижне-латеральном направлении кнаружи от определяемого опухолевого конгломерата корня брыжейки на протяжении 8-10 см; в области нижнего изгиба двенадцатиперстной кишки выполняют диссекцию клетчатки брыжейки тонкой кишки до уровня фасции Тольда; последующую диссекцию корня брыжейки тонкой кишки по намеченным линиям рассечения заднего листка париетальной брюшины проводят в межфасциальном клетчаточном пространстве Тольда; под основание опухолевого конгломерата корня брыжейки тонкой кишки и верхние брыжеечные сосуды подводят левую кисть и пальпаторно оценивают истинные размеры опухолевого конгломерата, а также осуществляют гемостаз при выделении брыжеечных сосудов путем пальцевой компрессии тканей; ствол верхней брыжеечной вены и верхней брыжеечной артерии выделяют раздельно диссектором с тупоконечными браншами на расстоянии 0,5-1,0 см от пальпируемого верхнего края опухолевого конгломерата; сосуды берут на турникеты; осуществляют диссекцию тканей вдоль передней поверхности брыжеечных сосудов в дистальном направлении, определяя характер и уровень их вовлечения в опухолевый конгломерат; сосудистые турникеты перенакладывают в дистальном направлении на расстоянии 0,5-1,0 см от уровня инвазии верхних брыжеечных сосудов; затягивают сосудистые турникеты на брыжеечных сосудах с экспозицией в течение 5 минут и определяют объем резецируемого сегмента тонкой кишки и необходимость выполнения правосторонней гемиколэктомии по наметившимся зонам демаркации стенкикишки; на верхнюю брыжеечную артерию и вену проксимальнее сосудистых турникетов накладывают зажимы, сосуды пересекают с прошиванием и дважды перевязывают; диссекцию брыжейки с опухолевым конгломератом завершают в соответствии с наметившимися зонами демаркации стенки кишки; выполняют резекцию тонкой кишки; сформировавшийся после диссекции дефект брыжейки тонкой кишки ушивают отдельными узловыми швами; оперативное вмешательство завершают дренированием брюшной полости.
Для уточнения распространения опухолевого конгломерата брыжейки в краниальном направлении, вскрывают желудочно-ободочную связка в бессосудистой зоне и осуществляют оценку размеров конгломерата с определением степени вовлечения мезоколон путем пальпации со стороны сальниковой сумки и нижнего этажа брюшной полости. при обнаружении в ходе диссекции тканей истинной инвазии верхних брыжеечных сосудов опухолевым конгломератом дальнейшее разделения тканей прекращают. В способе также выполняют правостороннюю гемиколэктомию.
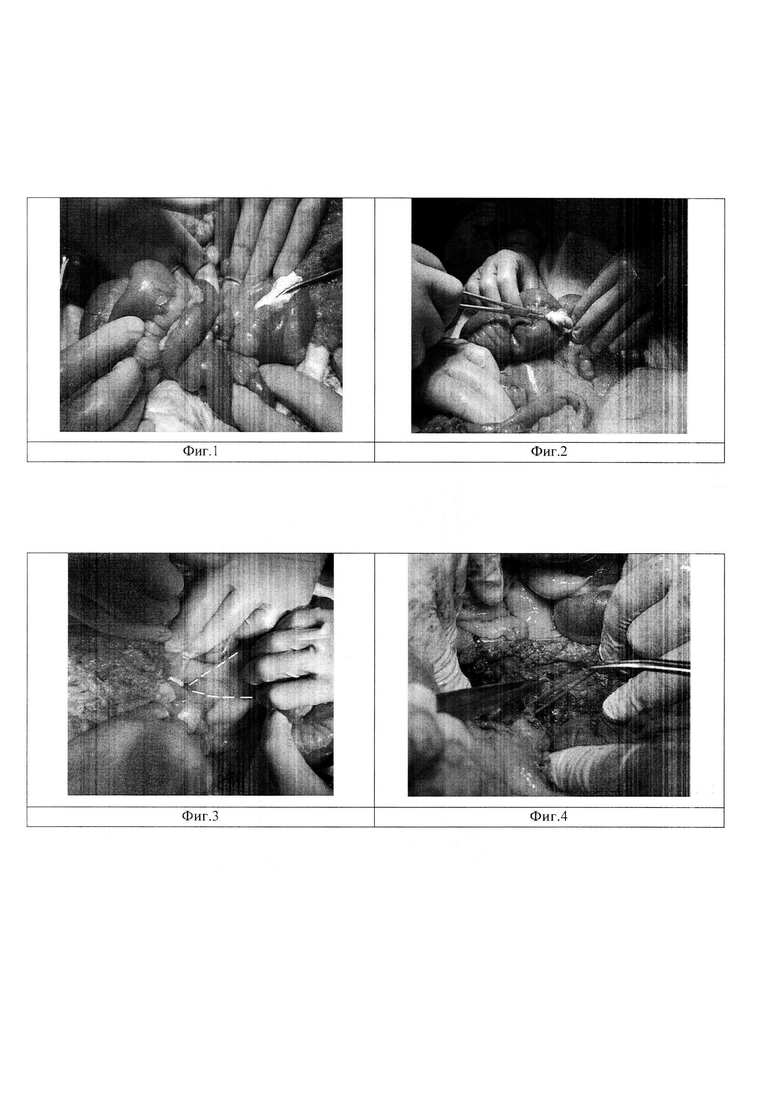
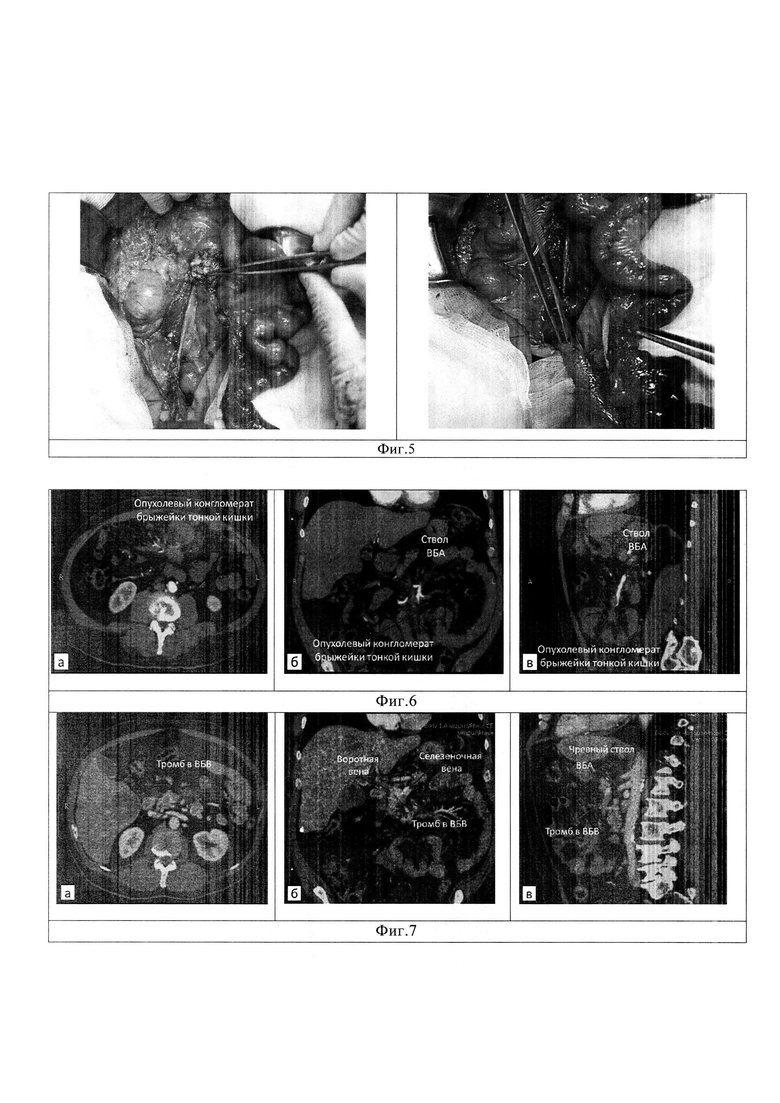
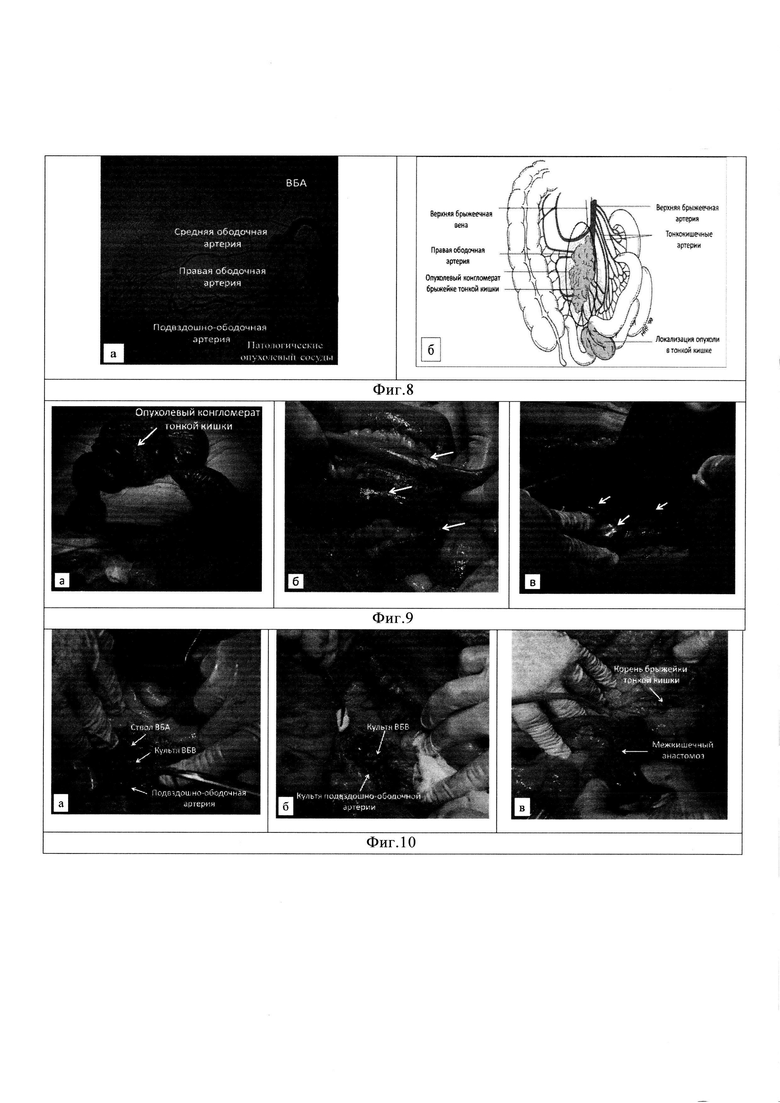
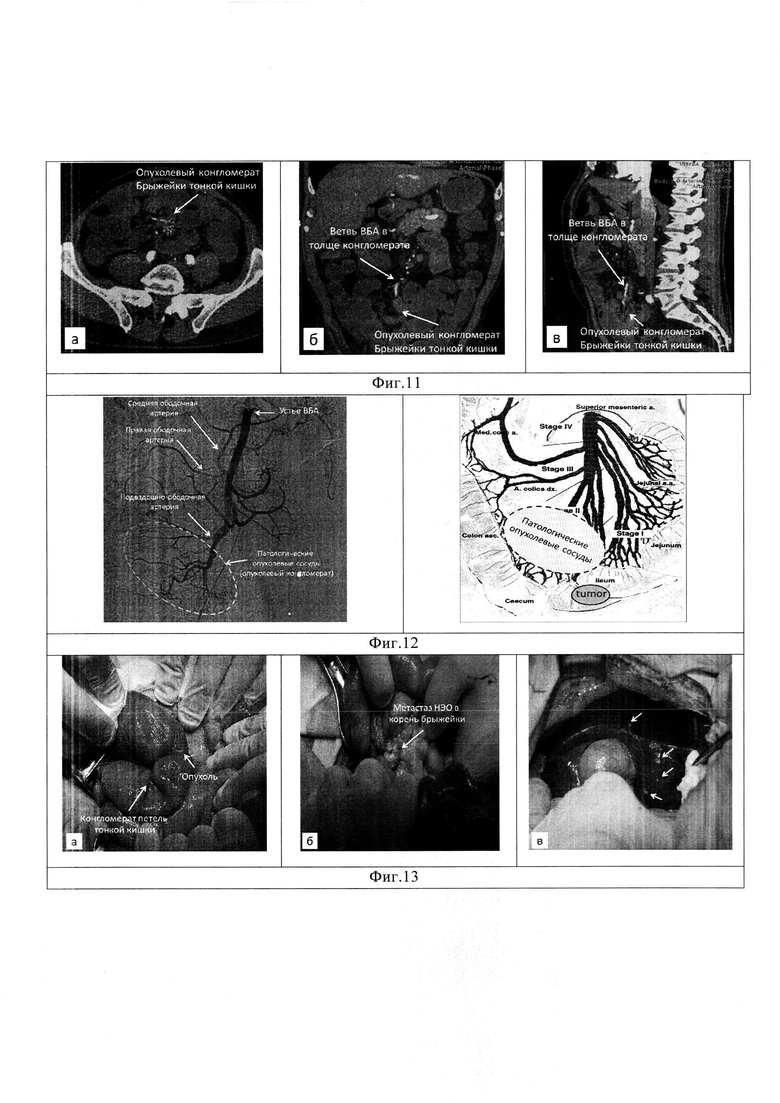
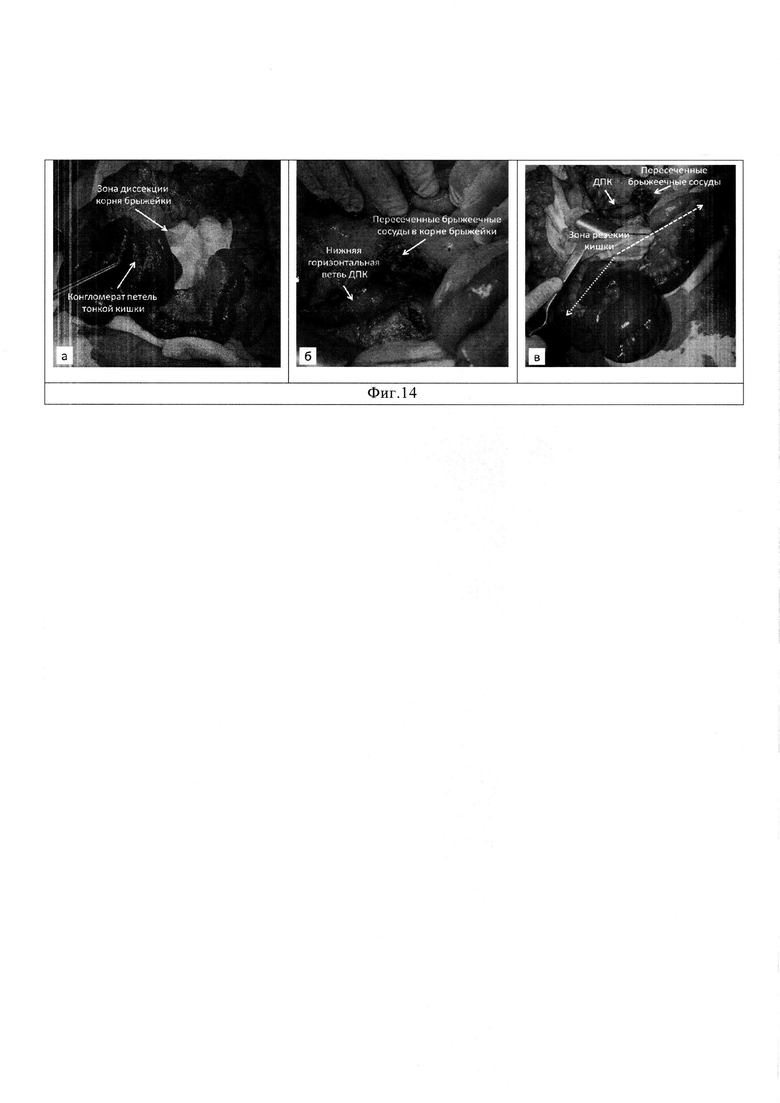
Изобретение поясняет фиг. 1, на котором показана нейроэндокринная опухоль тонкой кишки; фиг. 2 - представлен опухолевый конгломерат брыжейки тонкой кишки; фиг. 3 - пунктиром намечены линии рассечения заднего листка париетальной брюшины для вскрытия забрюшинного пространства; фиг. 4 - этап выделения и пересечения верхних брыжеечных сосудов над верхним краем опухолевого конгломерата брыжейки тонкой кишки; фиг. 5 - представлен внешний вид операционной раны после пересечения верхних брыжеечных сосудов с сохранением достаточной длины проксимального и дистального сегментов тонкой кишки для формирования энтеро-энтероанастомоза. На фиг. 6 показано СКТ опухолевого конгломерата брыжейки тонкой кишки с вовлечением ствола верхней брыжеечной артерии (ВБА) у пациента С. в различных томографических проекциях: а - аксиальной, б - коронарной, в - сагиттальной. На фиг. 7 приведено СКТ тромбированного ствола верхней брыжеечной вены (ВБВ) у пациента С. в различных томографических проекциях: а - аксиальной, б - коронарной, в - сагиттальной. На фиг. 8 показано вовлечение в опухолевый конгломерат брыжейки тонкой кишки верхней брыжеечной артерии у больного С: а - прямая ангиограмма; б - схематическое изображение. На фиг. 9 показаны результаты ревизии брюшной полости у больного С: а - опухолевый конгломерат корня брыжейки тонкой кишки; б - множественные (3) НЭО подвздошной кишки; в - множественные метастазы в печени. На фиг. 10 показаны этапы резекции тонкой кишки с опухолевым конгломератом у больного С: а - выделение верхних брыжеечных сосудов в корне брыжейки тонкой кишки; б - вид корня брыжейки после пересечения брыжеечных сосудов; в - сформированный межкишечный анастомоз. На фиг. 11 показано СКТ опухолевого конгломерата брыжейки тонкой кишки с вовлечением верхней брыжеечной артерии (ВБА) у пациента Р. в различных томографических проекциях: а - аксиальной, б - коронарной, в - сагиттальной. На фиг. 12 показано вовлечение в опухолевый конгломерат брыжейки тонкой кишки верхней брыжеечной артерии у больного Р.: а - прямая ангиограмма; б - схематическое изображение. На фиг. 13 приведены результаты ревизии брюшной полости у больного Р.: а - НЭО опухоль тонкой кишки; б - опухолевый конгломерат с метастазом в корень брыжейки тонкой кишки; в - метастазы в печени (указаны стрелками). На фиг. 14 приведены этапы оперативного вмешательства у больного Р.: а - диссекция корня брыжейки тонкой кишки с выделением опухолевого конгломерата; б - пересечение брыжеечные сосудов в корне брыжейки; в - резекция кишки в соответствии с наметившимися зонами демаркации.
Изобретение осуществляется следующим образом: выполняется срединная лапаротомия, осуществляется ревизия брюшной полости для оценки распространенности опухолевого процесса; поперечная ободочная кишка с мезоколон приподнимается и перемещается в краниальном направлении, что обеспечивает максимальный доступ к тонкой кишке, корню брыжейки и забрюшинному пространству нижнего этажа брюшной полости; проводится визуальная и тщательная бимануальная ревизия тонкой кишки на всем протяжении от дуоденоеюнального до илеоцекального перехода с целью установления локализации и количества нейроэндокринных опухолей (фиг. 1), определяется протяженность и локализация сегмента тонкой кишки, вовлеченного в опухолевый конгломерат брыжейки; осуществляется визуальная и пальпаторная оценка размеров опухолевого конгломерата брыжейки, степень его распространения в краниальном направлении корня брыжейки, предполагаемый уровень вовлечения в опухолевый процесс верхних брыжеечных сосудов (фиг. 2); локализация верхних брыжеечных сосудов в корне брыжейки тонкой кишки определяется на основании установления пульсации верхней брыжеечной артерии непосредственно у основания мезоколон, а также по расположению в основании мезоколон средней ободочной артерии, которая является постоянной ветвью верхней брыжеечной артерии; резектабельным расценивается опухолевый конгломерат корня брыжейки тонкой кишки не распространяющийся на мезоколон, что позволяет выполнить безопасное пересечение верхних брыжеечных сосудов с сохранением достаточного кровоснабжения и длины остающейся части тонкой кишки; в сомнительных случаях для уточнения распространения опухолевого конгломерата брыжейки в краниальном направлении вскрывается желудочно-ободочная связка в бессосудистой зоне и осуществляется оценка его размеров с определением степени вовлечения мезоколон путем пальпации со стороны сальниковой сумки и нижнего этажа брюшной полости; визуализируется забрюшинная часть нисходящей и нижней горизонтальной ветви двенадцатиперстной кишки, стенка которой отчетливо прослеживается через задний листок париетальной брюшины; с помощью биполярного пинцета либо гармонического скальпеля задний листок париетальный брюшины рассекается от нижнего изгиба двенадцатиперстной кишки в медиальном направлении по краю ее нижней горизонтальной ветви до уровня дуоденоеюнального перехода с целью обнажения передней поверхности верхних брыжеечных сосудов; вторым разрезом рассекается задняя париетальная брюшина от нижнего изгиба двенадцатиперстной кишки в нижне-латеральном направлении кнаружи от определяемого опухолевого конгломерата корня брыжейки на протяжении 8-10 см (фиг. 3); в области нижнего изгиба двенадцатиперстной кишки выполняется диссекция клетчатки брыжейки тонкой кишки до уровня фасции Тольда; последующая диссекция корня брыжейки тонкой кишки по намеченным линиям рассечения заднего листка париетальной брюшины проводится в межфасциальном клетчаточном пространстве Тольда что позволяет с минимальной кровопотерей отделить опухолевый конгломерат брыжейки вместе с верхними брыжеечными сосудами и их ветвями от клетчатки забрюшинного пространства; под основание опухолевого конгломерата корня брыжейки тонкой кишки и верхние брыжеечные сосуды подводиться левая кисть, что дает возможность пальпаторно окончательно оценить истинные размеры опухолевого конгломерата, а также эффективно осуществлять гемостаз при выделении брыжеечных сосудов путем пальцевой компрессии тканей; ствол верхней брыжеечной вены и верхней брыжеечной артерии выделяются раздельно диссектором с тупоконечными браншами на расстоянии 0,5-1,0 см от пальпируемого верхнего края опухолевого конгломерата; сосуды берутся на турникеты; осуществляется диссекция тканей вдоль передней поверхности брыжеечных сосудов в дистальном направлении с целью определения характера и уровня их вовлечения в опухолевый конгломерат; в случае выявлении истинной инвазии верхних брыжеечных сосудов опухолевым конгломератом попытки дальнейшего разделения тканей прекращаются; сосудистые турникеты перенакладываются в диастальном направлении на расстоянии 0,5-1,0 см от уровня инвазии верхних брыжеечных сосудов; после затягивания сосудистых турникетов на брыжеечных сосудах с экспозицией в течение 5 минут определяется объем резецируемого сегмента тонкой кишки и необходимость выполнения правосторонней гемиколэктомии по наметившимся зонам демаркации жизнеспособности стенки кишки; на верхнюю брыжеечную артерию и вену проксимальнее сосудистых турникетов накладываются зажимы, сосуды пересекаются с прошиванием и дважды перевязываются (фиг. 4); диссекция брыжейки с опухолевым конгломератом завершается в соответствии с наметившимися зонами демаркации стенки кишки, что позволяет сохранить максимальную длину остающейся части кишки без ущерба для онкологической радикальности оперативного вмешательства (фиг. 5); резекцию тонкой кишки, которая в случае необходимости дополняется правосторонней гемиколэктомией, завершается в соответствии с общеизвестными правилами; сформировавшийся после диссекции дефект брыжейки тонкой кишки ушивается отдельными узловыми швами; оперативное вмешательство оканчивается дренированием брюшной полости.
С целью подтверждения эффективности предлагаемого нами способа резекции тонкой кишки у больных местно-распространенными НЭО с вовлечением в опухолевый процесс верхних брыжеечных сосудов представляем клинические наблюдения.
Клиническое наблюдение №1. Пациент С., 63 лет, поступил в клинику в октябре 2017 года для обследования и определения тактики лечения с диагнозом: НЭО без выявленного первичного очага cTxN1M1 (печень, кости), IV стадия, Grade-2 (Ki-67 - 5%). Карциноидный синдром. Комплексное лечение: 1) биотерапия: «октреотид-депо» 40 мг внутримышечно 1 раз в месяц в сочетании с «альтевир» 3 млн ЕД подкожно 3 раза в неделю; 2) Химиоэмболизация печеночной артерии - проведено 3 цикла подолевой эмболизации печени с доксорубицином и липиодолом. В ходе сбора анамнеза заболевания установлено, что метастазы НЭО в печени выявлены при плановом обследовании в 2015 году по данным УЗИ, морфологическая структура опухоли была верифицирована при гистологическом и иммуногистохимическомм исследовании биоптатов печеночных очагов. В течение последних 6 месяцев пациента стали беспокоить нарастающие по интенсивности боли в животе после приема пищи, жидкий стул 3-4 раза в день, периодически возникающие приливы. По данным лабораторных методов обследования установлено повышение уровня серотонина крови в 7 раз выше нормы, 5-ГИУК - в 4 раза соответственно, что подтверждало клинические признаки карциноидного синдрома. При выполнении СКТ в режиме ангиографии в брыжейке тонкой кишки выявлено гиподенсное образование с нечеткими бугристыми контурами неоднородной структуры за счет множественных обызвествлений, накапливающее контрастный препарат до +61..+82 HU, размерами 2,7×4,4×4,3 см с тракционной деформации петель тонкой кишки и прилежащих сосудов. Установлено, что образование брыжейки тонкой кишки кровоснабжается основным стволом верхней брыжеечной артерии (ВБА), проходящей через образование, часть ветвей которой тромбированы (фиг. 6).
В основном стволе ВБВ визуализируются тромботические массы, накапливающие контраст. Печень увеличена, во всех сегментах печени визуализируются разнокалиберные метастатические очаги (фиг. 7).
С целью уточнения уровня и степени инвазии опухолевым конгломератом брыжейки тонкой кишки верхних брыжеечных сосудов пациенту выполнена прямая ангиография верхней брыжеечной артерии. На ангиограммах установлено вовлечение в опухолевый конгломерат брыжейки тонкой кишки ствола ВБА дистальнее уровня отхождения правой ободочной артерии с инвазией опухолью подвздошно-ободочной артерии. Полученные данные свидетельствовали о резектабельности опухолевого процесса брюшной полости (фиг. 8).
Клинико-лабораторные признаки карциноидного синдрома, а также наличие по данным СКТ и прямой ангиографии опухолевого конгломерата брыжейки тонкой кишки свидетельствовали о локализации первичной НЭО в тонкой кишке. В связи с развитием осложнений местно-распространенного опухолевого процесса в виде тромбоза ствола ВБВ и стеноза ВБА с тромбозом части ветвей определены показания к циторедуктивной резекции тонкой кишки с опухолевым конгломератом брыжейки. В ходе оперативного вмешательства при ревизии брюшной полости в корне брыжейки тонкой кишки выявлен малоподвижный плотной консистенции опухолевый конгломерат размерами 5,0×6,0 см (метастаз в корень брыжейки тонкой кишки), вовлекающий и деформирующий прилежащие петли средней трети кишки (фиг. 9а). Петли тонкой кишки в средней трети с признаками венозного застоя, обусловленного вовлечением их брыжейки в опухолевый конгломерат. В ходе ревизии тонкой кишки на расстоянии 180 см от дуоденоеюнального перехода по противобрыжеечному краю стенки подвздошной кишки выявлена плотной консистенции опухоль размерами 1,0×1,0 см, не прорастающая серозную оболочку; в 6,0 см от выявленной опухоли в стенке подвздошной кишки также по противобрыжеечному краю установлена плотная опухоль белесого цвета, прорастающая серозную оболочку размерами 1,0×1,2 см; при дальнейшей ревизии в 40 см от второй опухоли по противобрыжеечному краю стенки подвздошной кишки выявлена третья опухоль плотной консистенции размерами 1,0×1,3 см, прорастающая серозную оболочку (фиг. 9б). При визуальной и пальпаторной оценке в печени определены множественные билобарно расположенные метастатические очаги диаметром от 0,5 см до 6-7 см (фиг. 9в). Результаты ревизии органов живота подтвердили наличие у пациента НЭО подвздошной кишки с мультифокальным типом роста, метастатического поражения корня брыжейки тонкой кишки и билобарного очагового поражения печени 3-го типа по A. Frilling.
По разработанной методике выполнено рассечение заднего листка париетальной брюшины в области нижнего изгиба двенадцатиперстной кишки в медиальном и нижне-латеральном направлении вдоль верхнего и латерального края опухолевого конгломерата. В ходе диссекции забрюшинной клетчатки в межфасциальном клетчаточном пространстве Тольда у основания мезоколон выделены стволы ВБА и ВБВ. При последующем выделении брыжеечных сосудов в дистальном направлении установлено, что ВБВ на уровне верхнего края опухолевого конгломерата тромбирована и вовлечена в опухолевый процесс, подвздошно-ободочная артерия расположена в толще конгломерата брыжейки. Брыжеечные сосуды на уровне верхнего края опухолевого конгломерата прошиты и пересечены. Учитывая наличие множественных НЭО, признаков венозного застоя в петлях кишки, установлено, что резекции подлежит сегмент подвздошной кишки протяженностью 160 см, начинающийся в 230 см от дуоденоеюнального перехода и заканчивающийся в 70 см от илеоцекального перехода. Произведена дальнейшая мобилизация брыжейки подвздошной кишки с опухолевым конгломератом до стенки кишки в намеченных границах резекции. По линии демаркации тонкая кишки пересечена в проксимальном и дистальном отделах с удалением 160 см подвздошной кишки с 3-мя опухолями и метастазом корня брыжейки. При осмотре установлено, что оставшиеся 310 см тонкой кишки нормального цвета, активно перистальтируют. Сформирован двухрядный межкишечный анастомоз между приводящей и отводящей петлями оставшейся тонкой кишки по типу «бок в бок» (фиг. 10).
С целью уменьшения опухолевой массы и выраженности карциноидного синдрома выполнена радиочастотная термоаблация метастатических очагов печени наибольшего размера. Послеоперационный период протекал без осложнений, пациент выписан из клиники на 12 сутки после операции в удовлетворительном состоянии.
Клиническое наблюдение №2. Пациент Р., 70 лет, поступил в клинику в ноябре 2017 года с жалобами на боли в мезогастральной области живота, возникающие после еды, периодическое вздутие живота, учащенный до 4 раз в день стул. С целью исключения онкологической патологии органов ЖКТ пациенту проведено эндоскопическое исследование верхних и нижних отделов пищеварительного тракта - патологии не установлено. По данным СКТ в ангиографическом режиме в корне брыжейки тонкой кишки с распространением вдоль подвздошно-ободочной артерии инвазией выявлено мягкотканное образование неправильной формы с нечеткими, неровными контурами размерами 28×26×55 мм с выраженной ретракцией петель подвздошной кишки. В правой (S5, S7, S8) и левой (S2) долях печени выявлены гиперваскулярные очаговые образования, накапливающие контрастный препарат в артериальную фазу исследования (фиг. 11).
Клинические проявления заболевания (боли в животе, диарея - проявления карциноидного синдрома), данные СКТ (опухолевый конгломерат брыжейки тонкой кишки) позволили заподозрить у пациента НЭО тонкой кишки с местным распространения опухолевого процесса на корень брыжейки и метастатическим поражением печени. Исследование уровня серотонина (повышен в 14,8 раза) и 5-ГИУК (повышен в 2,2 раза), а также результаты ПЭТ-КТ с 68Ga-DOTATE (гиперметаболизм радиоизотопного препарата в опухолевом конгломерате брыжейки тонкой кишки и очагах печени) подтвердили нейроэндокринный характер опухолевого поражения брюшной полости с проявлениями карциноидного синдрома. Для уточнения степени вовлечения в опухолевый процесс верхней брыжеечной артерии выполнена прямая ангиография. Выявлены патологические опухолевые сосуды (локализация опухолевого конгломерата брыжейки тонкой кишки) в проекции подвздошно-ободочной артерии и конечной ветви ВБА, наличие общего ствола средней и правой ободочной артерии с отсутствием анастомозирования последней с подвздошно-ободочной артерией. В связи с отсутствием вовлечения в конгломерат корня брыжейки основного ствола ВБА опухолевый процесс признан резектабельным (фиг. 12).
Учитывая высокий риск развития местных осложнений опухолевого процесса брюшной полости (кишечная непроходимость, ишемия тонкой кишки), установлены показания к циторедуктивной резекции тонкой кишки с удалением конгломерата корня брыжейки.
В ходе ревизии брюшной полости в корне брыжейки тонкой кишки выявлен опухолевый конгломерат с метастатическим очагом в его центе размерами 2,5×3,0 см, к конгломерату подтянуты петли подвздошной кишки общей протяженностью около 1,0 м, которые отечны с признаками формирующегося венозного полнокровия вследствие вовлечения в опухолевый процесс брыжеечных сосудов. При ревизии петель подвздошной кишки, вовлеченных в конгломерат, выявлена опухоль плотной консистенции 1,0×1,0 см, прорастающая серозную оболочку стенки кишки. В обеих долях печени выявлены множественные, субкапсулярно расположенные метастатические очаги диаметром до 1,0 см (фиг. 13).
По предложенной методике выполнено рассечение заднего париетального листка брюшины, покрывающего корень брыжейки тонкой кишки, на уровне нижнего изгиба двенадцатиперстной кишки в медиальном и нижне-латеральном направлении с диссекцией забрюшинной клетчатки до межфасциального клетчаточного пространства Тольда. Верхние брыжеечные сосуды идентифицированы и выделены у основания мезоколон. Произведена диссекция брыжеечных сосудов в дистальном направлении до верхнего края конгломерат корня брыжейки. Установлена опухолевая инвазия подвздошно-ободочной артерии и терминальной ветви ВБА, которые у верхнего края опухолевого конгломерата корня брыжейки перевязаны и пересечены. По наметившейся демаркации тканей установлено, что резекции подлежит дистальный отдел подвздошной кишки длиной 1,0 м и правая половина ободочной кишки, что согласуется с особенностям ангиоархитектоники ВБА по данным прямой ангиографии. Выполнена резекция подвздошной кишки с правосторонней гемиколэктомией и удалением опухолевого конгломерата корня брыжейки. Сформирован илеотрансверзоанастомоз по стандартной методике «бок в бок», дефект брыжейки ушит узловыми швами. Выполнена радиочастотная термодеструкция видимых метастатических очагов печени (фиг. 14).
Послеоперационный период протекал без осложнений, пациент был выписан на 10-е сутки после операции для продолжения лекарственной терапии.
СПИСОК ЛИТЕРАТУРЫ
1. Mocellin S., Nitti D. Gastrointestinal carcinoid: epidemiological and survival evidence from a large population-based study (n=25 531) // Ann. Oncol. - 2013. - Vol. 24(12). - P. 3040-3044. doi: 10.1093/annonc/mdt377.
2. Dasari A., Shen C, Halperin D., Zhao В., Zhou S., Xu Y., Shih Т., Yao J.C. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States // JAMA Oncol. - 2017. - Vol. 3(10). - P 1335-1342. doi: 10.1001/jamaoncol.2017.0589.
3. Huguet I., Grossman A.B., O'Toole D. Changes in the Epidemiology of Neuroendocrine Tumours // Neuroendocrinology. - 2017. - Vol. 104(2). - P. 105-111. doi: 10.1159/000441897.
4.  K. The Genesis of the Neuroendocrine Tumors Concept: From Oberndorfer to 2018 // Endocrinol. Metab. Clin. North. Am. - 2018. - Vol. 47(3). - P. 711-731. doi: 10.1016/j.ecl.2018.05.003.
K. The Genesis of the Neuroendocrine Tumors Concept: From Oberndorfer to 2018 // Endocrinol. Metab. Clin. North. Am. - 2018. - Vol. 47(3). - P. 711-731. doi: 10.1016/j.ecl.2018.05.003.
5. Barsouk A., Rawla P., Barsouk A., Thandra K.C. Epidemiology of Cancers of the Small Intestine: Trends, Risk Factors, and Prevention // Med. Sci. (Basel). - 2019. - Vol 7(3). - P. E46. doi: 10.3390/medsci7030046.
6. Basuroy R., Bouvier C., Ramage J.K., Sissons M., Kent A., Srirajaskanthan R. Presenting Symptoms and Delay in Diagnosis of Gastrointestinal and Pancreatic Neuroendocrine Tumours // Neuroendocrinology. - 2018. - Vol. 107(1). - P. 42-49. doi: 10.1159/000488510.
7. Sundin A., Arnold R., Baudin E., Cwikla J.B., Eriksson В., Fanti S., Fazio N., Giammarile F., Hicks R.J., Kjaer A., Krenning E., Kwekkeboom D., Lombard-Bohas C., O'Connor J.M., O'Toole D., Rockall A., Wiedenmann В., Valle J.W., Vullierme M. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Radiological, Nuclear Medicine & Hybrid Imaging // Neuroendocrinology. - 2017. - Vol. 105(3). - P. 212-244. doi: 10.1159/000471879.
8. Hallet J., Law C.H., Cukier M., Saskin R., Liu N., Singh S. Exploring the rising incidence of neuroendocrine tumors: a population-based analysis of epidemiology, metastatic presentation, and outcomes // Cancer. - 2015. - Vol. 121(4). - P. 589-597. doi: 10.1002/cncr.29099.
9. Watzka F.M., Fottner C., Miederer M., Weber M.M., Schad A., Lang H., Musholt T.J. Surgical Treatment of NEN of Small Bowel: A Retrospective Analysis // World J. Surg. - 2016. - Vol. 40(3). - P. 749-758. doi: 10.1007/s00268-016-3432-2.
10. Fata C.R., Gonzalez R.S., Liu E., Cates J.M., Shi C. Mesenteric Tumor Deposits in Midgut Small Intestinal Neuroendocrine Tumors Are a Stronger Indicator Than Lymph Node Metastasis for Liver Metastasis and Poor Prognosis // Am. J. Surg. Pathol. - 2017. -Vol. 41(1). - P. 128-133. doi: 10.1097/PAS.0000000000000751.
11.  S., de Mestier L.,
S., de Mestier L.,  F., Vullierme M.P., Zappa M., Hoeffel C, Noaves M., Brixi H., Hentic O., Ruszniewski P., Cadiot G., Panis Y., Kianmanesh R. Toward a Preoperative Classification of Lymph Node Metastases in Patients with Small Intestinal Neuroendocrine Tumors in the Era of Intestinal-Sparing Surgery // Neuroendocrinology. - 2016. - Vol. 103(5). - P. 552-559. doi: 10.1159/000441423.
F., Vullierme M.P., Zappa M., Hoeffel C, Noaves M., Brixi H., Hentic O., Ruszniewski P., Cadiot G., Panis Y., Kianmanesh R. Toward a Preoperative Classification of Lymph Node Metastases in Patients with Small Intestinal Neuroendocrine Tumors in the Era of Intestinal-Sparing Surgery // Neuroendocrinology. - 2016. - Vol. 103(5). - P. 552-559. doi: 10.1159/000441423.
12.  A., Hofland J., Hofland L.J., Feelders R.A., de Herder W.W. Small intestinal neuroendocrine tumours and fibrosis: an entangled conundrum // Endocr. Relat. Cancer. - 2018. - Vol. 25(3). - P. 115-130. doi: 10.1530/ERC-17-0380.
A., Hofland J., Hofland L.J., Feelders R.A., de Herder W.W. Small intestinal neuroendocrine tumours and fibrosis: an entangled conundrum // Endocr. Relat. Cancer. - 2018. - Vol. 25(3). - P. 115-130. doi: 10.1530/ERC-17-0380.
13. Mantzoros I., Sawala N.A., Ioannidis O., Parpoudi S., Loutzidou L., Kyriakidou D., Cheva A., Intzos V., Tsalis K. Midgut neuroendocrine tumor presenting with acute intestinal ischemia // World J. Gastroenterol. - 2017. - Vol. 23(45). - P. 8090-8096. doi: 10.3748/wjg.v23.i45.8090.
14. Moris D., Ntanasis-Stathopoulos I., Tsilimigras D.I., Vagios S., Karamitros A., Karaolanis G., Griniatsos J., Papalampros A., Papaconstantinou I., Glantzounis G.K., Spartalis E., Blazer D.G., Felekouras E. Update on Surgical Management of Small Bowel Neuroendocrine Tumors // Anticancer Res. - 2018. - Vol. 38(3). - P. 1267-1278. doi: 10.21873/anticanres. 12349.
15. Daskalakis K., Karakatsanis A.,  P.,
P., 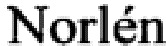 O., Hellman P. Clinical signs of fibrosis in small intestinal neuroendocrine tumours // Br. J. Surg. - 2017. - Vol. 104(1). - P. 69-75. doi: 10.1002/bjs.10333.
O., Hellman P. Clinical signs of fibrosis in small intestinal neuroendocrine tumours // Br. J. Surg. - 2017. - Vol. 104(1). - P. 69-75. doi: 10.1002/bjs.10333.
16. Citterio D., Pusceddu S., Facciorusso A., Coppa J., Milione M., Buzzoni R., Bongini M., deBraud F., Mazzaferro V. Primary tumour resection may improve survival in functional well-differentiated neuroendocrine tumours metastatic to the liver // Eur. J. Surg. Oncol. - 2017. - Vol. 43(2). - P. 380-387. doi: 10.1016/j.ejso.2016.10.031.
17. Strosberg J.R., Halfdanarson T.R. Bellizzi A.M., Chan J.A., Dillon J.S., Heaney A.P., Kunz P.L., O'Dorisio T.M., Salem R., Segelov E., Howe J.R., Pommier R.F., Brendtro K., Bashir M.A., Singh S., Soulen M.C., Tang L., Zacks J.S., Yao J.C., Bergsland E.K. The North American Neuroendocrine Tumor Society Consensus Guidelines for Surveillance and Medical Management of Midgut Neuroendocrine Tumors // Pancreas. - 2017. - Vol. 46(6). - P. 707-714. doi: 10.1097/MPA.0000000000000850.
18. Farley H.A., Pommier R.F. Surgical Treatment of Small Bowel Neuroendocrine Tumors // Hematol. Oncol. Clin. North. Am. - 2016. - Vol.30(1). - P. 49-61. doi: 10.1016/j.hoc.2015.09.001.
19. Ohrvall U., Eriksson В., Juhlin C, Karacagil S., Rastad J., Hellman P., Akerstrom G. Method for dissection of mesenteric metastases in mid-gut carcinoid tumors // World J. Surg. - 2000. - Vol. 24(11). - P. 1402-1408. doi: 10.1007/s002680010232.
20. Pasquer A., Walter Т., Hervieu V., Forestier J., Scoazec J.Y., Lombard-Bohas C, Poncet G. Surgical Management of Small Bowel Neuroendocrine Tumors: Specific Requirements and Their Impact on Staging and Prognosis // Ann. Surg. Oncol. - 2015. - Suppl 3. - P. 742-749. doi: 10.1245/s10434-015-4620-2.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лапароскопической радикальной левосторонней нефрэктомии с тромбэктомией из нижней полой вены | 2023 |
|
RU2803686C1 |
| Способ малоинвазивного, органосохраняющего хирургического лечения рака слепой кишки с расширенной лимфодиссекцией первично-забрюшинным доступом | 2024 |
|
RU2841563C1 |
| Способ хирургического лечения рака ободочной кишки с расширенной сосудосохраняющей лимфодиссекцией первично-забрюшинным доступом | 2023 |
|
RU2827373C1 |
| СПОСОБ ОПЕРАТИВНОГО ЛЕЧЕНИЯ БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ ЛЕВОГО ФЛАНГА ОБОДОЧНОЙ КИШКИ, ОСЛОЖНЕННЫМИ ОСТРОЙ ОБТУРАЦИОННОЙ КИШЕЧНОЙ НЕПРОХОДИМОСТЬЮ | 2011 |
|
RU2474390C1 |
| Способ лапароскопической мобилизации правой половины ободочной кишки при правосторонней гемиколэктомии | 2022 |
|
RU2781122C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПАТОЛОГИЧЕСКИХ ОБЪЕМНЫХ ОБРАЗОВАНИЙ В КОРНЕ БРЫЖЕЙКИ ТОНКОЙ КИШКИ И/ИЛИ В БОЛЬШОМ САЛЬНИКЕ | 2007 |
|
RU2344762C1 |
| СПОСОБЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ ДУОДЕНАЛЬНОЙ НЕПРОХОДИМОСТИ (ВАРИАНТЫ) | 2004 |
|
RU2302823C2 |
| Способ хирургического лечения локализованных форм рака слепой кишки | 2023 |
|
RU2811964C1 |
| Способ повышения радикальности хирургического лечения детей с местнораспространенной формой нейробластомы | 2022 |
|
RU2797690C1 |
| Способ хирургического лечения пациентов с стриктурирующей формой болезни Крона | 2023 |
|
RU2806298C1 |
Изобретение относится к медицине, а именно к онкологии. Выполняют срединную лапаротомию и ревизию брюшной полости для оценки распространенности опухолевого процесса. Резектабельным расценивают опухолевый конгломерат корня брыжейки тонкой кишки, не распространяющийся на мезоколон. С помощью биполярного пинцета либо гармонического скальпеля задний листок париетальной брюшины рассекают от нижнего изгиба двенадцатиперстной кишки в медиальном направлении по краю ее нижней горизонтальной ветви до уровня дуоденоеюнального перехода. Вторым разрезом рассекают заднюю париетальную брюшину от нижнего изгиба двенадцатиперстной кишки в нижне-латеральном направлении кнаружи от определяемого опухолевого конгломерата корня брыжейки на протяжении 8-10 см. В области нижнего изгиба двенадцатиперстной кишки выполняют диссекцию клетчатки брыжейки тонкой кишки до уровня фасции Тольда; последующую диссекцию корня брыжейки тонкой кишки по намеченным линиям рассечения заднего листка париетальной брюшины проводят в межфасциальном клетчаточном пространстве Тольда. Ствол верхней брыжеечной вены и верхней брыжеечной артерии выделяют раздельно диссектором с тупоконечными браншами на расстоянии 0,5-1,0 см от пальпируемого верхнего края опухолевого конгломерата. Сосуды берут на турникеты. Осуществляют диссекцию тканей вдоль передней поверхности брыжеечных сосудов в дистальном направлении. Сосудистые турникеты перенакладывают в дистальном направлении на расстоянии 0,5-1,0 см от уровня инвазии верхних брыжеечных сосудов. Затягивают сосудистые турникеты на брыжеечных сосудах с экспозицией в течение 5 минут и определяют объем резецируемого сегмента тонкой кишки и необходимость выполнения правосторонней гемиколэктомии по наметившимся зонам демаркации стенки кишки. На верхнюю брыжеечную артерию и вену проксимальнее сосудистых турникетов накладывают зажимы, сосуды пересекают с прошиванием и дважды перевязывают. Диссекцию брыжейки с опухолевым конгломератом завершают в соответствии с наметившимися зонами демаркации стенки кишки; выполняют резекцию тонкой кишки. Сформировавшийся после диссекции дефект брыжейки тонкой кишки ушивают отдельными узловыми швами. Дренируют брюшную полость. Способ позволяет эффективно увеличивать общую выживаемость больных, улучшать качество жизни пациентов вследствие предупреждения развития либо устранения жизнеугрожающих местных осложнений опухолевого процесса, позволяет проводить изолированное агрессивное либо комплексное лечение больных местно-распространенными нейроэндокринными опухолями тонкой кишки, когда другие методы являются малоэффективными. 3 з.п. ф-лы, 14 ил., 2 пр.
1. Способ резекции тонкой кишки при местно-распространенных нейроэндокринных опухолях с вовлечением в опухолевый процесс верхних брыжеечных сосудов, включающий выполнение срединной лапаротомии и ревизии брюшной полости для оценки распространенности опухолевого процесса, отличающийся тем, что поперечную ободочную кишку с мезоколон приподнимают и перемещают в краниальном направлении; проводят визуальную и бимануальную ревизию тонкой кишки на всем протяжении от дуоденоеюнального до илеоцекального перехода, определяют протяженность и локализацию сегмента тонкой кишки, вовлеченного в опухолевый конгломерат брыжейки; осуществляют визуальную и пальпаторную оценку размеров опухолевого конгломерата брыжейки, степень его распространения в краниальном направлении корня брыжейки, предполагаемый уровень вовлечения в опухолевый процесс верхних брыжеечных сосудов; локализацию верхних брыжеечных сосудов в корне брыжейки тонкой кишки определяют на основании установления пульсации верхней брыжеечной артерии непосредственно у основания мезоколон, а также по расположению в основании мезоколон средней ободочной артерии; резектабельным расценивают опухолевый конгломерат корня брыжейки тонкой кишки, не распространяющийся на мезоколон; визуализируют забрюшинную часть нисходящей и нижней горизонтальной ветви двенадцатиперстной кишки, стенка которой прослеживается через задний листок париетальной брюшины; с помощью биполярного пинцета либо гармонического скальпеля задний листок париетальной брюшины рассекают от нижнего изгиба двенадцатиперстной кишки в медиальном направлении по краю ее нижней горизонтальной ветви до уровня дуоденоеюнального перехода, обнажая переднюю поверхность верхних брыжеечных сосудов; вторым разрезом рассекают заднюю париетальную брюшину от нижнего изгиба двенадцатиперстной кишки в нижне-латеральном направлении кнаружи от определяемого опухолевого конгломерата корня брыжейки на протяжении 8-10 см; в области нижнего изгиба двенадцатиперстной кишки выполняют диссекцию клетчатки брыжейки тонкой кишки до уровня фасции Тольда; последующую диссекцию корня брыжейки тонкой кишки по намеченным линиям рассечения заднего листка париетальной брюшины проводят в межфасциальном клетчаточном пространстве Тольда; под основание опухолевого конгломерата корня брыжейки тонкой кишки и верхние брыжеечные сосуды подводят левую кисть и пальпаторно оценивают истинные размеры опухолевого конгломерата, а также осуществляют гемостаз при выделении брыжеечных сосудов путем пальцевой компрессии тканей; ствол верхней брыжеечной вены и верхней брыжеечной артерии выделяют раздельно диссектором с тупоконечными браншами на расстоянии 0,5-1,0 см от пальпируемого верхнего края опухолевого конгломерата; сосуды берут на турникеты; осуществляют диссекцию тканей вдоль передней поверхности брыжеечных сосудов в дистальном направлении, определяя характер и уровень их вовлечения в опухолевый конгломерат; сосудистые турникеты перенакладывают в дистальном направлении на расстоянии 0,5-1,0 см от уровня инвазии верхних брыжеечных сосудов; затягивают сосудистые турникеты на брыжеечных сосудах с экспозицией в течение 5 минут и определяют объем резецируемого сегмента тонкой кишки и необходимость выполнения правосторонней гемиколэктомии по наметившимся зонам демаркации стенки кишки; на верхнюю брыжеечную артерию и вену проксимальнее сосудистых турникетов накладывают зажимы, сосуды пересекают с прошиванием и дважды перевязывают; диссекцию брыжейки с опухолевым конгломератом завершают в соответствии с наметившимися зонами демаркации стенки кишки; выполняют резекцию тонкой кишки; сформировавшийся после диссекции дефект брыжейки тонкой кишки ушивают отдельными узловыми швами; оперативное вмешательство завершают дренированием брюшной полости.
2. Способ по п.1, отличающийся тем, что для уточнения распространения опухолевого конгломерата брыжейки в краниальном направлении вскрывают желудочно-ободочную связку в бессосудистой зоне и осуществляют оценку размеров конгломерата с определением степени вовлечения мезоколон путем пальпации со стороны сальниковой сумки и нижнего этажа брюшной полости.
3. Способ по п. 1, отличающийся тем, что при обнаружении в ходе диссекции тканей истинной инвазии верхних брыжеечных сосудов опухолевым конгломератом дальнейшее разделения тканей прекращают.
4. Способ по п.1, отличающийся тем, что выполняют правостороннюю гемиколэктомию.
| СПОСОБ РЕИННЕРВАЦИИ ТОНКОЙ КИШКИ ПРИ РАСШИРЕННОЙ ЛИМФАДЕНЭКТОМИИ И НЕЙРОДИССЕКЦИИ КОРНЯ БРЫЖЕЙКИ ТОНКОЙ КИШКИ | 2016 |
|
RU2615277C1 |
| Способ получения металлического бария | 1932 |
|
SU37849A1 |
| МАЙСТРЕНКО Н.А | |||
| и др | |||
| Диагностика и хирургическое лечение нейроэндокринных опухолей поджелудочной железы и желудочно-кишечного тракта, Анналы хирургической гепатологии, 2016, т | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| с | |||
| Насос | 1917 |
|
SU13A1 |
| БЕЛЬЦЕВИЧ Д.Г | |||
| и др | |||
| Ведение больных с дифференцированными нейроэндокринными опухолями илеоеюнальной | |||
Авторы
Даты
2021-02-10—Публикация
2019-11-06—Подача