Изобретение относится к биотехнологии и медицине, а именно к мониторингу носительства модифицированного вакцинного штамма (nOPV2) типа 2 вируса полиомиелита у здоровых лиц, диагностике лиц с подозрением на полиомиелит и больных полиомиелитом.
Полиомиелит относится к острым инфекционным заболеваниям вирусной этиологии и характеризуется разнообразием клинических форм - от абортивных до паралитических. Паралитические формы возникают при поражении вирусом полиомиелита клеток передних рогов спинного мозга и двигательных ядер черепных нервов, и проявляются развитием вялых парезов/параличей конечностей, реже мимической мускулатуры или мышц туловища.
Основной механизм передачи возбудителя - фекально-оральный, пути передачи - водный, пищевой, контактно-бытовой. Эпидемиологическое значение имеет также аспирационный механизм передачи возбудителя с воздушно-капельным и воздушно-пылевым путями передачи.
Человек начинает выделять полиовирус через 2-4 дня с момента заражения. В носоглотке он сохраняется в течение 1-2 недель. Полиовирус может долго присутствовать в кишечном тракте и выделяться в окружающую среду от нескольких недель до месяцев.
Попадая в наш организм через рот, вирус проникает в слизистую оболочку верхних дыхательных путей и желудочно-кишечного тракта и начинает активно размножаться в носоглотке (в аденоидах и миндалинах) и тонком кишечнике (в лимфатических узлах - пейеровых бляшках). Инкубационный период болезни составляет от 3 до 35 дней.
Около 72% людей, заразившихся вирусом, не чувствуют никаких симптомов, полиомиелит для них проходит незаметно. У 24% по завершении инкубационного периода в течение нескольких дней поднимается температура, появляется расстройство пищеварения, боль в горле, тошнота, головная боль и усталость.
Примерно у 4% заразившихся, из-за полиовируса возникает асептический менингит - воспаление оболочек головного мозга. Он тяжело переносится, сопровождаясь лихорадкой, сильными головными болями и рвотой, но, как правило, заканчивается выздоровлением.
Наконец, примерно у каждого двухсотого заболевшего вирус с лимфой и кровью перемещается к нервным волокнам и попадает в двигательные нейроны в спинном мозге, стволе головного мозга или в моторной коре. Это приводит к разрушению нейронов и последующему вялому параличу мышц: человек больше не может ими управлять, и мышцы со временем атрофируются.
Паралич, вызванный полиомиелитом, может привести к смерти, если повреждены нервы, важные для обеспечения жизненно необходимых функций. Каждые 2-20 человек из 100 с проявившимся параличом умирают. Чаще всего причиной смерти служит отказ мышц диафрагмы.
Кроме параличей, острый полиомиелит грозит разного рода осложнениями, включая пневмонию, нарушение расправления легких (ателектазы), воспаление сердечной мышцы (миокардит), а при бульбарной форме - острое расширение желудка, желудочно-кишечные расстройства, язвы и непроходимость кишечника. Пострадавшие от полиомиелита многие годы могут страдать из-за повреждений опорно-двигательной системы: сколиоза, защемлений нервов и патологий сухожилий в области спины. Даже после полного выздоровления, через 15-40 лет перенесенная инфекция может спровоцировать новые осложнения: повышенную усталость, боли, проблемы с дыханием, ослабление мышц и потерю их функциональности. Постполиомиелитный синдром встречается у 25% людей, переболевших паралитической формой болезни.
Так же является важной проблема вспышек циркулирующего вакцино-родственного полиовируса (цВРПВ), возникающих в редких случаях, когда ослабленный штамм полиовируса, содержащийся в оральной полиомиелитной вакцине (ОПВ), претерпевает генетические изменения и преобразуется в форму, которая может вызывать паралич. Это может наблюдаться, когда ОПВ штамм циркулирует среди недопривитого населения в течение долгого времени, при этом наибольший риск перерождения имеет ослабленный штамм, содержащий в ОПВ2.
Новая вакцина хорошо переносится взрослыми, детьми младшего возраста и младенцами, при этом ее применение не несет с собой увеличение риска с точки зрения безопасности, по сравнению с моновалетной оральной полиомиелитной вакциной типа 2 (мОПВ2). Страны, желающие использовать нОПВ2 в рамках EUL, могут внедрить вакцину в соответствии с установленными критериями, которые включают процесс мониторинга ее безопасности, обеспечивающий быстрое выявление и реагирование на сигналы безопасности в случае их возникновения.
Диагностируют полиомиелит по наличию в мазке из горла или кале вирусной РНК методом ПЦР (Chezzi С.Rapid diagnosis of poliovirus infection by PCR amplification. J Clin Microbiol. 1996 Jul;34(7): 1722-5. PMID: 8784577). Метод диагностики предусматривает экстракцию РНК из биологических образцов, с последующим проведением двухстадийной реакции обратной транскрипции и полимеразной цепной реакции для целевых фрагментов РНК nOPV2, с использованием праймеров и зондов, комплементарных высококонсервативным фрагментам РНК вируса,
Однако, большинство диагностических тест-систем не позволяют отличить вакцинный штамм от дикого. Если полиовирус выделен у пациента с параличом, врачи дополнительно выясняют, является ли этот вирус диким или вакцинным. Определить источник вируса важно, потому что на каждый зарегистрированный случай паралитического полиомиелита, вызванного диким полиовирусом, приходится до нескольких тысяч бессимптомных носителей. Каждый случай заражения диким вирусом - это угроза эпидемии.
Целью создания настоящего изобретения является расширение арсенала средств эпиднадзора для мониторинга носительства модифицированного вакцинного штамма (nOPV2) типа 2 вируса полиомиелита у здоровых лиц и диагностики лиц с подозрением на полиомиелит и больных полиомиелитом.
Технической задачей изобретения является разработка высокочувствительного способа идентификации РНК модифицированного вакцинного полиовируса типа 2 (nOPV2) в биологических образцах и других вируссодержащих пробах (культуральная вируссодержащая жидкость, и т.д.).
Поставленная задача решалась путем: конструирования диагностических праймеров и флуоресцентно-меченного зонда на специфические для nOPV2 кДНК фрагменты, полученные с РНК матрицы; конструирования рекомбинантной плазмидной ДНК и MS2-фага, несущих специфический участок ДНК- и РНК-матрицы; оптимизации концентраций компонентов реакционной смеси и условий проведения ПЦР.
Авторами предложен способ выявления nOPV2, согласно которому выделенную из биологических образцов и сточных вод РНК анализируют в одной пробирке при помощи реакции обратной транскрипции, и дальнейшей полимеразной цепной реакции полученных кДНК, при помощи олигонуклеот идных праймеров и соответствующего флуоресцентно меченного зонда.
Анализ результатов проводят с помощью программного обеспечения используемого прибора для проведения ПЦР с гибридизационно-флуоресцентной детекцией в режиме «реального времени». Результаты интерпретируют на основании наличия или отсутствия пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что соответствует наличию или отсутствию значения порогового цикла Ct, причем результат считают положительным в случае, если кривая накопления флуоресценции для соответствующего образца имеет характерную «сигмовидную» форму и пересекает пороговую линию.
На начальном этапе были подобраны и синтезированы пара специфических олигонуклеотидных праймеров и зонд для гибридизационно-флуоресцентной детекции продуктов ПЦР. Для этого в базе данных NCBI Mega BLAST (http://www.ncbi.nlm.nih. gov/) был выбран наиболее консервативный участок генома модифицированного вакцинного полиовируса типа 2 (nOPV2). Были проанализированы все имеющиеся в базе данных последовательности. Также были подобраны праймеры и флуоресцентный зонд для ВКО в качестве внутреннего контроля ПЦР. Последовательности олигонуклеотидных праймеров и флуоресцентного зонда представлены в Таблице 1 и Таблице 2.


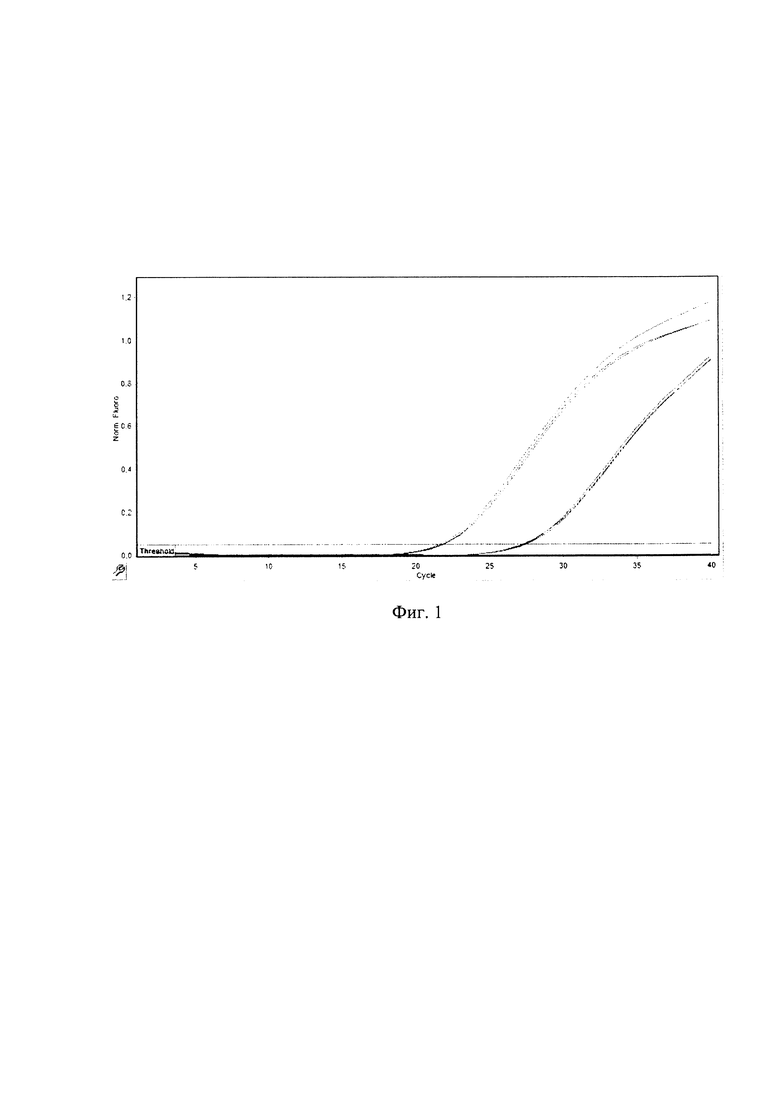
Сущность изобретения поясняется чертежом, где на Фиг. 1 представлены кривые флуоресценции, отражающие динамику образования продукта реакции при анализе контрольных образцов. Каждая кривая выше пороговой линии отображает положительный результат на выявление в образце РНК nOPV2 вируса, каждая кривая ниже пороговой линии отображает отрицательные контроли, не содержащие РНК nOPV2.
Подбор и анализ свойств олигонуклеотидных праймеров и флуоресцентного зонда проводился с использованием программного обеспечения Oligonucleotide Properties Calculator и MFold.
Для контроля качества прохождения этапов обратной транскрипции и ПЦР в состав методики были введены рекомбинантные положительные контрольные образцы К+ и ПКО и внутренний контрольный образец (ВКО). Матрицу для создания рекомбинантных положительных контрольных образцов получали синтетическим методом на основе ампликона, включающего в себя диагностическую область-мишень и фланкирующие последовательности нуклеотидов. Ампликон получали методом ПЦР в один шаг. Конечный ПЦР-продукт лигировали в плазмидный вектор pGEM-T («Promega», USA) под контролем промотора Т7 РНК полимеразы и трансформировали им Escherichia coli (штамм XLl-Blue). Рекомбинантные плазмиды из индивидуальных клонов проверяли на правильность ориентации целевой последовательности и отсутствие мутаций в области посадки праймеров и зонда. Проверку осуществляли методом секвенирования по Сэнгеру с помощью прибора для автоматического капиллярного секвенирования ABI PRISM 3500x1 («Applied Biosystems», США).
Соответствующие заданным критериям рекомбинантные плазмиды использовали для приготовления положительного контрольного образца этапа ПЦР (К+). Для этого определяли концентрацию ДНК в растворе рекомбинантной плазмиды и разводили стерильной водой до рабочей концентрации 1*107 копий/мл. Также плазмиды использовались для получения рекомбинантного РНК-содержащего положительного контрольного образца с защитной белковой оболочкой MS2-фага (ПКО). Для полученного продукта производили определение концентрации, затем разводили РНК-буфером (ФБУН ЦНИИ Эпидемиологии, Россия) до рабочей концентрации 1*106 копий/мл, которую использовали в качестве ПКО.
Оценку аналитической чувствительности метода производили на разведениях РНК-содержащего рекомбинантного положительного контрольного образца (ПКО), из которых экстрагировали РНК с помощью набора для выделения нуклеиновых кислот «Рибо-Преп» (ФБУН ЦНИИ Эпидемиологии, Россия), а затем с помощью специфических праймеров и флуоресцентных зондов определяли минимальное разведение, детектируемое как положительное в 100% случаев. Определенная таким образом аналитическая чувствительность метода составила 1*10 копий/мл.
Свойство изобретения специфически определять РНК модифицированного вакцинного вируса полиомиелита типа 2 достигнуто путем подбора праймеров и зондов к высококонсервативным фрагментам РНК вируса, что минимизирует возможность перекрестных реакций с НК человека, близкородственных микроорганизмов, других инфекционных возбудителей.
Аналитическую специфичность оценивали при помощи тестирования образцов НК человека и следующих микроорганизмов: дикие штаммы полиовируса PV-1, PV-2, PV-3, вакцинные штаммы полиовируса Sabin 1, Sabin 2, Sabin 3, вирус Коксаки А. Неспецифические реакции отсутствуют.
Таким образом, в результате проведенных исследований был разработан и апробирован способ выявления РНК модифицированного вакцинного полиовируса типа 2 (nOPV2) в различных видах биологического материала. Технический результат достигается путем определения РНК nOPV2, включающим выделение РНК исследуемой пробы, проведение обратной транскрипции и ПЦР с учетом результатов в режиме реального времени, согласно изобретению.
Диагностика проводится следующим образом: Подготовку проб проводят согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности». Материалом для исследования могут служить: клинические и биологические образцы.
Экстракция производится из 100 мкл полученной суспензии образца с лизирующим буфером на основе 6 моль гуанидинизотиоцианата в объеме, указанном в инструкции к набору для выделения РНК, и последующим инкубированием 5 минут при температуре (65±1)°С. Выделение РНК осуществляют с помощью наборов «Рибо-преп» и «Рибо-Сорб» (ФБУН ЦНИИ Эпидемиологии, Россия) в соответствии с инструкциями к наборам. Во все пробирки, включая контроль выделения, до этапа прогревания в лизирующем буфере добавляют 10 мкл внутреннего контрольного образца (ВКО). После выделения РНК приступают к постановке ОТ-ПЦР.
Для упрощения подготовки и стандартизации выполнения анализа в тест-систему входят 8 реактивов:
1) Amp 1RT - представляет из себя буферный раствор, содержащий 50 мМ Трис-HCl, рН 8.0 (при 25±С), 100 мМ NaCl, 1 мМ ЭДТА, 5 мМ дитиотреитол, 50% (v/v) глицерин и 0.1% (v/v) NP-40, ингибитор РНКаз, M-MuLV-RH-ревертаза и HS-Taq ДНК-полимераза;
2) Amp 1В - представляет из себя буферный раствор, содержащий 100 мМ Трис-HCl, рН 8.3 (при 25°С), 150 мМ KCl, 0,6 мМ каждого дезоксинуклеозидтрифосфата, 10 мМ MgC12, 8 мМ ДТТ, стабилизаторы и усилители ферментов;
3) Amp 2 - содержит олигонуклеотидные праймеры и флуоресцентно-меченые олигонуклеотидные зонды к РНК модифицированного вакцинного полиовируса типа 2 (nOPV2) и к ВКО;
4) К+ - представляет собой смесь двух плазмидных ДНК:
a) плазмида содержащая фрагмент nOPV2;
b) плазмида содержащая фрагмент ВКО;
с которых, при помощи реактива Amp 2, амплифицируются специфические фрагменты;
5) К- - представляет собой дистиллированную стерильную воду;
6) ПКО - представляет собой псевдовирусные частицы на основе MS2-фага, содержащие РНК с фрагментом РНК nOPV2, которые после выделения и обратной траснскрипции в кДНК, амплифицируются при помощи реактива Amp 2;
7) ОКО - дистиллированная стерильная вода;
8) ВКО - представляет собой псевдовирусные частицы на основе MS2-фага, содержащие РНК с фрагментом РНК VKO, которые после выделения и обратной траснскрипции в кДНК, амплифицируются при помощи реактива Amp 2.
Все реактивы, кроме ПКО и ВКО, хранятся при температуре -20°С. ПКО и ВКО хранятся при температуре +4°С.
Для постановки реакции ОТ-ПЦР в реальном времени нужно взять необходимое количество микропробирок объемом 0,2 мл, соответствующее числу исследуемых проб; плюс четыре пробирки для положительных и отрицательных контролей. Подготовить ПЦР-смесь из рассчета на одну реакцию: 1 мкл реактив Amp1RT, 12,5 мкл реактив Amp1B, 1,5 мкл реактив Amp2. По 15 мкл полученной смеси вносят в пробирки, затем добавляют в каждую по 10 мкл РНК-пробы, экстрагированной из исследуемого материала. Готовят 4 контрольные реакции. Для этого в пробирку для положительного контроля ПЦР вносят 10 мкл К+, в пробирку для положительного контроля обратной транскрипции вносят 10 мкл образца, экстрагированного из ПКО. В пробирку для отрицательного контроля ПЦР вносят 10 мкл К-, в пробирку для отрицательного контроля экстракции вносят 10 мкл пробы, экстрагированной из ОКО. Конечный объем реакционной смеси составляет 25 мкл. Микропробирки переносят в программируемый амплификатор с функцией детекции флуоресценции в режиме «реального времени» по каналам (FAM/SybrGreen/Green и JOE/ HEX). Режим амплификации представлен в таблице 3.


Детекцию флуоресцентного сигнала производят при 57°С по каналам Green (FAM) и Yellow (JOE/HEX). Учет и анализ результатов проводят с помощью программного обеспечения прибора на основании отсутствия или наличия сигнала флуоресценции в исследуемых пробах по детектируемым каналам. Результаты интерпретируют на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что соответствует наличию (или отсутствию) значения порогового цикла Ct в соответствующей графе в таблице результатов. Результат считают положительным в случае, если кривая накопления флуоресценции для соответствующего образца имеет характерную «сигмовидную» форму и пересекает пороговую линию. Накопление флуоресцентного сигнала по каналу HEX свидетельствует о наличии в исследуемом материале РНК модифицированного вакцинного полиовируса типа 2 (nOPV2). При этом результат считается валидным, если параллельно в пробе по каналу FAM регистрируется накопление флуоресцентного сигнала ВКО, а в образцах К+ и ПКО - по каналу HEX. Сигнал по каналу HEX в образцах К- и ОКО должен отсутствовать.
Таким образом, заявляемый способ выявления позволяет достоверно выявлять РНК модифицированного вакцинного полиовируса типа 2 (nOPV2) в клинических пробах и образцах сточных вод.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления РНК вируса геморрагической лихорадки Крым-Конго методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2834908C1 |
| Способ выявления РНК вируса Хунин методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822164C1 |
| Способ выявления вируса Nipah методом ОТ-ПЦР в реальном времени | 2022 |
|
RU2816270C2 |
| Способ выявления РНК вируса Хендра вида Hendra henipavirus методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822161C1 |
| Способ выявления РНК вируса Mammarenavirus guanaritoense методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2839982C1 |
| Способ выявления РНК вируса Bandavirus dabieense (SFTSV) методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2831410C1 |
| Способ выявления вируса кори методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822430C1 |
| Набор для выявления вируса SARS-CoV методом ОТ-ПЦР в реальном времени | 2020 |
|
RU2744198C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ВИРУСА ОБЕЗЬЯНЬЕЙ ОСПЫ ВИДА MONKEYPOX МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ (MPX AMP PS) | 2023 |
|
RU2803898C1 |
| Способ выявления вируса клещевого энцефалита методом ОТ-ПЦР в реальном времени | 2019 |
|
RU2744187C1 |

Изобретение относится к биотехнологии и медицине, а именно к мониторингу носительства модифицированного вакцинного штамма (nOPV2) типа 2 вируса полиомиелита у здоровых лиц, диагностике лиц с подозрением на полиомиелит и больных полиомиелитом. Диагностику проводят с использованием РНК, выделенной из биологических образцов и сточных вод, с целью постановки диагноза и/или эпидемиологического мониторинга, а также для решения научно-исследовательских задач по изучению свойств модифицированного вакцинного полиовируса типа 2 (nOPV2). Изобретение представляет собой способ выявления РНК nOPV2 методом ОТ-ПЦР в реальном времени, представляет из себя оригинальные олигонуклеотидные праймеры и олигонуклеотид, меченный флуоресцентной меткой (флуоресцентный зонд). 1 ил., 3 табл., 1 пр.
Способ выявления РНК модифицированного вакцинного полиовируса типа 2 (nOPV2) методом ПЦР с обратной транскрипцией в реальном времени, предусматривающий экстракцию РНК из биологических образцов, с последующим проведением двухстадийной реакции обратной транскрипции и полимеразной цепной реакции для целевых фрагментов РНК nOPV2, с использованием праймеров и зондов, комплементарных высококонсервативным фрагментам РНК вируса, отличающийся тем, что в качестве праймеров используются последовательности
nPV2-f (SEQ ID NO: 1) aac tta gaa gca cga aac cat taa с,
nPV2-r (SEQ ID NO: 2) tga gca gtc tat gca atg tca c,
а в качестве зонда
nPV2-prb (SEQ ID NO: 3) R6G - tta ggt аса gct cta gag caa аса cct - BHQ1.
| Manukyan H | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| - Т | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| - No | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| - С | |||
| Колосниковая решетка с охлажденными водой колосниками | 1925 |
|
SU688A1 |
| Deshpande J | |||
| M., Nadkarni S | |||
| S., Siddiqui Z | |||
| A | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-05-11—Публикация
2022-09-08—Подача