Изобретение относится к области биотехнологии, средствам молекулярной диагностики и производству антирабических вакцин, а именно к способу опосредованного определения полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР) с последующим электрофорезом ампликонов в агарозном геле.
Бешенство (Rabies) занимает первоочередное место в ряду вирусных болезней человека и животных, является одним из высоко опасных зоонозов, вызывая поражение центральной нервной системы, энцефаломиелиты, параличи с неизбежным летальным исходом. Данное заболевание представляет собой мировую проблему, которой уделяют особое внимание международные организации (ВОЗ, МЭБ, ФАО, GARC) и ветеринарные службы многих стран мира [1, 2, 3].
Вирус бешенства относится к порядку Mononegavirales, семейству Rhabdoviridae, роду Lyssavirus, виду Rabies lyssavirus [4]. Вирионы вируса бешенства имеют пулевидную форму, длиной около 180 нм, диаметром около 75 нм. На наружной поверхности вирусной частицы имеются выступы в виде шипов длиной 10-12 нм, которые прикреплены к двуслойной липидной оболочке [1]. Геном вируса бешенства представлен несегментированной одноцепочечной негативной спиральной РНК длиной около 12 000 н.о., который кодирует 5 основных белков: нуклеопротеин (N-белок), фосфопротеин (Р-белок), матриксный белок (М-белок), гликопротеин (G-белок), РНК-зависимую РНК-полимеразу (L-белок). Между G- и L-цистронами располагается псевдоген (ψ-фрагмент) [5]. Средние размеры N-, Р-, М-, G-, ψ- и L-генов в среднем составляют 1420, 990, 610, 1675, 525, 6475 н.о., соответственно [1].
Бешенство приводит к значительным экономическим потерям, которые связаны с гибелью животных, ликвидацией последствий вспышек заболевания, проведением профилактических и карантинных мероприятий, регулированием численности диких плотоядных животных, отловом бродячих кошек и собак и осуществлением лабораторных исследований по постановке диагноза [6, 7]. По оценкам экспертов, ежегодный экономический ущерб от бешенства составляет более 8,6 млрд. долларов США [8].
Система мер для борьбы с бешенством и его профилактики предусматривает иммунизацию домашних, сельскохозяйственных и диких плотоядных, а также контроль уровня напряженности поствакцинального иммунитета [2].
В процессе производства антирабических инактивированных сорбированных и эмульсионных вакцин для плотоядных домашних и сельскохозяйственных животных после инактивации антигена вируса бешенства требуется проводить оценку отсутствия неинактивированного вируса бешенства для подтверждения безопасности вакцинного препарата.
Инактивация вируса бешенства может достигаться за счет влияния различных физических и химических факторов. Так, при температуре плюс 18°С полная инактивация происходит через 30 суток, при 37°С - через 5 суток, при 50°С - через 1,5 часа, при 60°С - через 5-10 минут, при 70°С - через 1-2 минуты. Воздействие ультрафиолетовых лучей инактивирует вирус бешенства через 5-10 минут. Солнечный свет при температуре 5-6°С обезвреживает вирус через 5-7 дней, при 16-18°С - через 3-4 дня, при 37°С - через 40 часов [1].
Вирус инактивируют различными химическими агентами: 0,5-1,0% раствор фенола при температуре 4°С через 8 недель, при 18-20°С - через 14 дней, при 37°С - через 3 суток; 2% раствор формалина при 4°С - через 2 часа; 45-70% раствор этилового спирта при 4°С - через 2 ч, 1% раствор перманганата калия - через 20 минут; 3-5% раствор соляной кислоты - через 5 минут [1].
В настоящее время в соответствии с требованиями МЭБ (OIE) [2] при изготовлении антирабических вакцин для получения инактивированного антигена вируса бешенства используют инактиванты первого порядка, а именно β-пропиолактон (оксетан-2-он, БПЛ) (0,02-0,03%) и 1,2-аминоэтилэтиленимин (АЭЭИ) (0,025-0,050%) [9, 10, 11, 18].
β-пропиолактон - бесцветная жидкость с резким запахом, внутренний циклический эфир β-оксипропионовой кислоты. В силу напряженности четырехчленного цикла β-пропиолактон является высокореакционным соединением, для которого характерны реакции с раскрытием цикла. БПЛ - электрофил, который взаимодействует с нуклеиновой кислотой вируса бешенства по оксиметиленовому углероду [21], что приводит к разрывам нуклеотидной цепи в вирусном геноме и определяет отсутствие вирулентности возбудителя. При этом структура сформированной частицы вируса бешенства сохраняется, что обуславливает ее антигенные свойства.
1,2-аминоэтилэтиленимин - азотсодержащее гетероциклическое соединение, которое относится к циклическим аминам. АЭЭИ вступает в реакцию замещения водорода в N-H-связи вирусной РНК с сохранением цикла инактиванта [20]. Данный процесс приводит к деградации генома вируса бешенства, в результате этого утрачивается вирулентность возбудителя, но при этом сохраняется структура сформированной вирусной частицы и ее антигенные свойства.
Другие инактиванты, такие как формалин и карболовая кислота (водный раствор фенола) при изготовлении антирабических вакцин использоваться не должны. Процесс инактивации необходимо должным образом документировать с тем, чтобы демонстрировать кинетику инактивации и того анализа, с помощью которого детектируется результат [2].
В результате воздействия β-пропиолактона и 1,2-аминоэтилэтиленимина вирус бешенства теряет свою инфекционную активность за счет многочисленных делеций и повреждений вирусной РНК, разрушения вирусного генома до низкомолекулярных фрагментов [14], что не позволяет осуществлять процессы обратной транскрипции, трансляции и процессинга белковых составляющих вируса, тем самым, репродукция вирусной частицы в клеточных системах in vivo и in vitro становится невозможной [1]. Повреждения в N-, Р-, М-, G-генах приводят к прекращению процесса синтеза нуклеопротеина, фосфопротеина, матриксного белка и гликопротеина вируса бешенства, соответственно. Разрушения РНК в L-гене делает невозможным синтез РНК-зависимой-ДНК-полимеразы, следовательно, и формирование перечисленных выше структурных белков возбудителя бешенства. Иными словами, при одном из указанных повреждений антиген вируса бешенства становится авирулентным. Данный факт можно обнаружить с помощью проведения молекулярно-биологического исследования с оригинальными системами праймеров и подобранными условиями проведения анализа.
В соответствии с требованиями МЭБ (OIE) полноту инактивации верифицируют с использованием теста на остаточное содержание вирулентного вируса бешенства. С этой целью суспензию антигена инактивированного вируса инокулируют в такой же тип клеточной культуры, которая используется в производстве антирабической вакцины или клеточную линию, обладающую не меньшей чувствительностью. При изготовлении антирабических вакцин наиболее часто применяют клеточную линию из почки новорожденного сирийского хомячка (ВНК-21/2-17). Количество исследуемой суспензии инактивированного вируса должно быть эквивалентно не менее 25 дозам вакцины. После четырех дневной инкубации с применением трипсинизированных клеток линии ВНК-21/2-17 готовят субкультуру, и после инкубации в течение последующих четырех суток ежедневно клеточный монослой исследуют на остаточное количество живого вируса бешенства посредством реакции иммунофлуоресценции (РИФ). Суспензия инактивированного антигена считается соответствующего качества, если вирулентный вирус в ней не обнаружен. Данный анализ проводят на протяжении 3 последовательных пассажей в чувствительной клеточной линии ВНК-21/2-17 [2, 3].
Существенными недостатками данного метода являются: 1) длительная процедура анализа, связанная с развитием цитопатического действия (не менее 4 суток для каждого из трех пассажей), 2) определенная степень субъективности при оценке результатов анализа, 3) высокая стоимость клеточной линии как тест-системы и затраты на ее поддержание. В связи с этим целесообразно провести поиск способа оценки полноты инактивации антигена вируса бешенства с применением более быстрого и менее затратного метода исследования, который отличается при этом высокой степенью достоверности и объективности получаемых результатов.
Проблемой является отсутствие чувствительного и специфичного способа опосредованного определения полноты инактивации антигена вируса бешенства с целью устранения вышеуказанных недостатков.
Данная проблема была решена благодаря разработке нового способа опосредованного определения полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции, предполагающей применение 5 систем праймеров, детектирующих протяженные участки в N-, Р-, М-, G-, L-генах вируса с размерами 1010, 1214, 2050, 792, 1890 н.о., соответственно, с последующим электрофорезом ампликонов в агарозном геле, с помощью которого возможно выявлять неповрежденный геном вируса бешенства до процесса инактивации и определять отсутствие вирулентного вируса бешенства после воздействия инактивантами. Данная возможность позволит предварительно определять полноту инактивации антигена вируса бешенства, который используется для изготовления антирабических инактивированных вакцин для домашних и сельскохозяйственных животных.
Сущность изобретения заключается в новом подходе по опосредованному определению полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции с последующим электрофорезом ампликонов в агарозном геле. Заявляемый способ основан на проведении выделения РНК вируса бешенства до и после процесса инактивации с помощью карболовой кислоты, гуанидинизотиоцианата (ГТЦ), хладона-20, пропанола-2 и этилового спирта, оценке степени чистоты полученного элюата вирусной РНК спектральным методом, синтезе комплементарной ДНК (кДНК) и реакции амплификации, предполагающей использование 5 систем оригинальных праймеров, детектирующих протяженные участки в N-, Р-, М-, G-, L-генах вируса с размерами 1010, 1214, 2050, 792, 1890 н.о., соответственно, с последующей детекцией ампликонов методом горизонтального электрофореза в 1,5%-ном агарозном геле с добавлением 0,0005% бромистого этидия. По итогам анализа оценивают наличие или отсутствие продуктов полимеразной цепной реакции в виде светящихся полос в потоке ультрафиолетового света при длине волны 312 нм. На основании полученных треков ампликонов делают заключение о целостности участков генома вируса бешенства и, как следствие, о полноте инактивации антигена.
В настоящее время метод ОТ-ПЦР с последующим нуклеотидным секвенированием применяют для проведения диагностики бешенства, типирования, молекулярно-эпидемиологических исследований, а также для дифференциации штаммов с применением штаммоспецифических праймеров (Tordo et al., 1995, 1996; David et al., 2002; Rimhanen-Finne et al., 2010; Dacheux et al., 2010; Цыбанов с соавт., 2002) [12, 13].
Для оценки полноты инактивации антигена вируса бешенства для вакцины используют перевиваемую монослойную клеточную линию ВНК-21/2-17 с проведением РИФ, предполагающей использование антирабического иммуноглобулина G, меченого флуоресцеинизотиоцианата (ФИТЦ) (прототип). По сравнению с прототипом метод ОТ-ПЦР с последующей детекцией ампликонов методом горизонтального электрофореза в агарозном геле с добавлением бромистого этидия отличается высокой чувствительностью и специфичностью, является более экономичным, позволяет одновременно исследовать несколько десятков проб инактивированного вируссодержащего материала для вакцины, а время проведения анализа сократить до 4-5 часов [12, 13]. Исходя из этого, актуально применять метод ОТ-ПЦР с последующим электрофорезом ампликонов в агарозном геле для опосредованного определения полноты инактивации антигена вируса бешенства при изготовлении антирабических инактивированных сорбированных и эмульсионных вакцин.
Ключевым элементом заявляемого способа является проведение ОТ-ПЦР с использованием 5 оригинальных систем праймеров, позволяющих амплифицировать 5 участков генома с размерами 1010, 1214, 2050, 792, 1890 н.о., детектирование полученных ампликонов с помощью горизонтального электрофореза в 1,5% агарозном геле с добавлением 0,0005% бромистого этидия и установление зависимости между разрушением генома вируса бешенства и авируленостью антигена вируса бешенства после воздействия применяемых инактивантов.
Сопоставительный анализ с прототипом позволяет сделать вывод, что новизна и изобретательский уровень заявляемого изобретения заключается в применении способа выделения РНК вируса бешенства, оценки степени чистоты полученного элюата, получения кДНК и проведении реакции амплификации с использованием 5 оригинальных пар праймеров с последующим электрофорезом ампликонов в 1,5%-ном агарозном геле с 0,0005% бромистым этидием для предварительной оценки полноты инактивации антигена вируса бешенства, применяемого для изготовления антирабических вакцин.
Сведений об аналогах предлагаемого способа опосредованного определения полноты инактивации антигена вируса бешенства в сырье для антирабической вакцины авторами не обнаружено. Возможность применения метода ОТ-ПЦР с проведением горизонтального электрофореза в иной модификации и с другими праймерами описана для оценки полноты инактивации вируса классической чумы свиней [19].
Сущность изобретения отражена на графических изображениях:
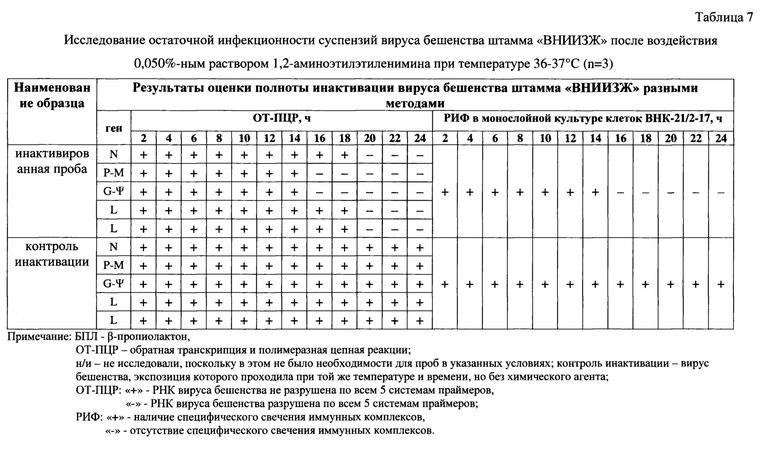
Фиг. 1 - Электрофореграммы контрольных образцов при опосредованном определении полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции с последующим электрофорезом ампликонов в агарозном геле: 1 - положительный контрольный образец на этапе выделения РНК (ПКОвыд-е рнк), 2 - положительный контрольный образец на этапе ПНР (ПКОпцр), 3 - внутренний контрольный образец на этапе выделения РНК (ВКОвыд-е рнк), 4 - внутренний контрольный образец на этапе ПЦР (ВКОпцр), 5 - отрицательный контрольный образец, контроль фона (ОКО), 6 - отрицательный инактивированный контрольный образец на этапе выделения РНК (ОИКОвыд-е рнк), 7 - отрицательный инактивированный контрольный образец на этапе ПЦР (ОИКОпцр). Примечание: А - тест-система с парой праймеров Shift_Oligo-R1069, Б - F1807-R3020, В - F3471-R5520, Г - F5499-R6290, Д - F8085-R9954, М - маркер фрагментов ДНК с длинами 2900, 2500, 2000, 1700, 780 н.о.
Фиг. 2 - Электрофореграмма ампликонов вируса бешенства, подвергнутого инактивации β-пропиолактоном:
1 - 0,025%, экспозиция при температуре 37°С через 2 ч,
2 - 0,025%; экспозиция при температуре 37°С через 4 ч;
3 - 0,050%, экспозиция при температуре 37°С через 2 ч;
4 - 0,050%, экспозиция при температуре 37°С через 4 ч;
5 - 0,050%, экспозиция в течение 0,5 ч при температуре 37°С и 23,5 ч при температуре 4°С, через 2 ч;
6 - 0,050%, экспозиция в течение 0,5 ч при температуре 37°С и 23,5 ч при температуре 4°С, через 4 ч;
7 - 0,050%, экспозиция в течение 0,5 ч при температуре 37°С и 23,5 ч при температуре 4°С, через 8 ч;
8 - 0,050%, экспозиция в течение 0,5 ч при температуре 37°С и 23,5 ч при температуре 4°С, через 12 ч;
9 - 0,050%, экспозиция в течение 0,5 ч при температуре 37°С и 23,5 ч при температуре 4°С, через 16 ч;
10 - 0,050%, экспозиция в течение 0,5 ч при температуре 37°С и 23,5 ч при температуре 4°С, через 20 ч;
11 - 0,050%, экспозиция в течение 0,5 ч при температуре 37°С и 23,5 ч при температуре 4°С, через 24 ч;
12 - контроль инактивации (вирус бешенства, не подвергнутый инактивации, экспозиция при температуре 37°С) через 4 ч;
13 - контроль инактивации (вирус бешенства, не подвергнутый инактивации, экспозиция в течение 0,5 ч при температуре 37°С и 23,5 ч при температуре 4°С) через 24 ч. Примечание: А - тест-система с парой праймеров Shift_Oligo-R1069, Б - F1807-R3020, В - F3471-R5520, Г - F5499-R6290, Д - F8085-R9954, М - маркер фрагментов ДНК с длинами 2900, 2500, 2000, 1700, 780 н.о.
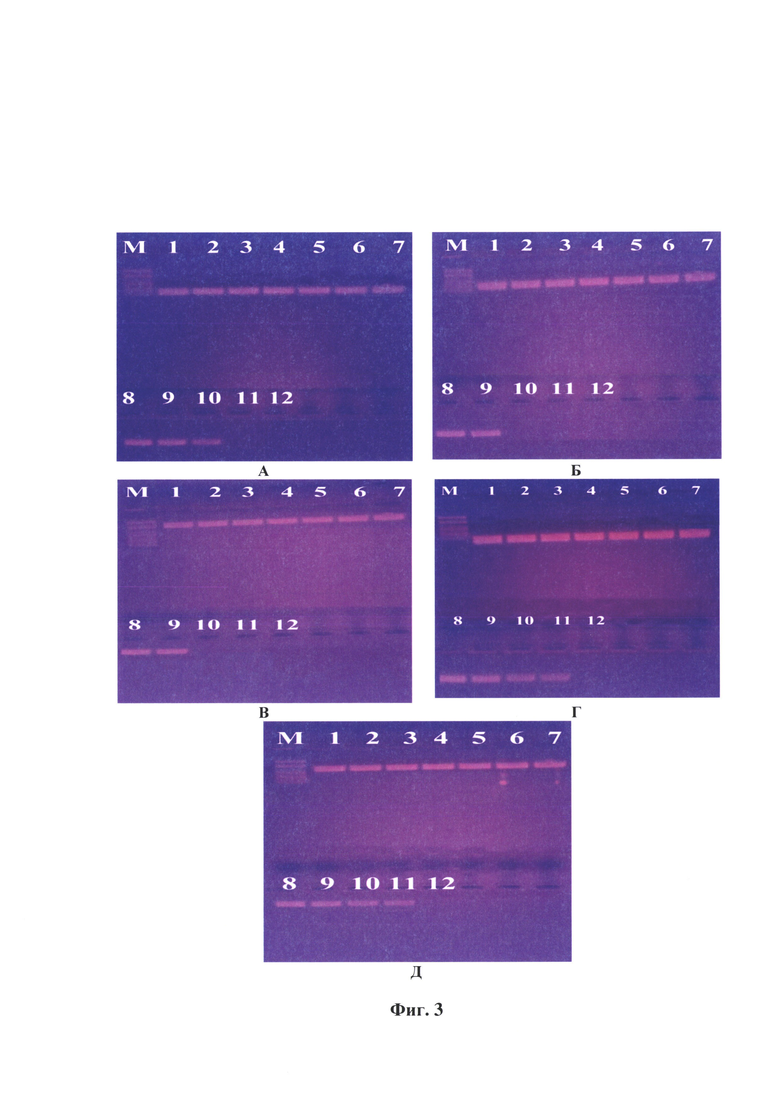
Фиг. 3 - Электрофореграмма ампликонов вируса бешенства, подвергнутого инактивации 1,2-аминоэтилэтиленимином с концентрацией 0,025%, экспозиция при температуре 37°С через 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 ч (номера треков 1-12, соответственно). Примечание: А - тест-система с парой праймеров Shift_Oligo-R1069, Б - F1807-R3020, В - F3471-R5520, Г - F5499-R6290, Д - F8085-R9954, М - маркер фрагментов ДНК с длинами 2900, 2500, 2000, 1700, 780 н.о.
Фиг. 4 - Электрофореграмма ампликонов вируса бешенства, подвергнутого инактивации 1,2-аминоэтилэтиленимином с концентрацией 0,050%, экспозиция при температуре 37°С через 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 ч (номера треков 1-12, соответственно). Примечание: А - тест-система с парой праймеров Shift_Oligo-R1069, Б - F1807-R3020, В - F3471-R5520, Г - F5499-R6290, Д - F8085-R9954, М - маркер фрагментов ДНК с длинами 2900, 2500, 2000, 1700, 780 н.о.
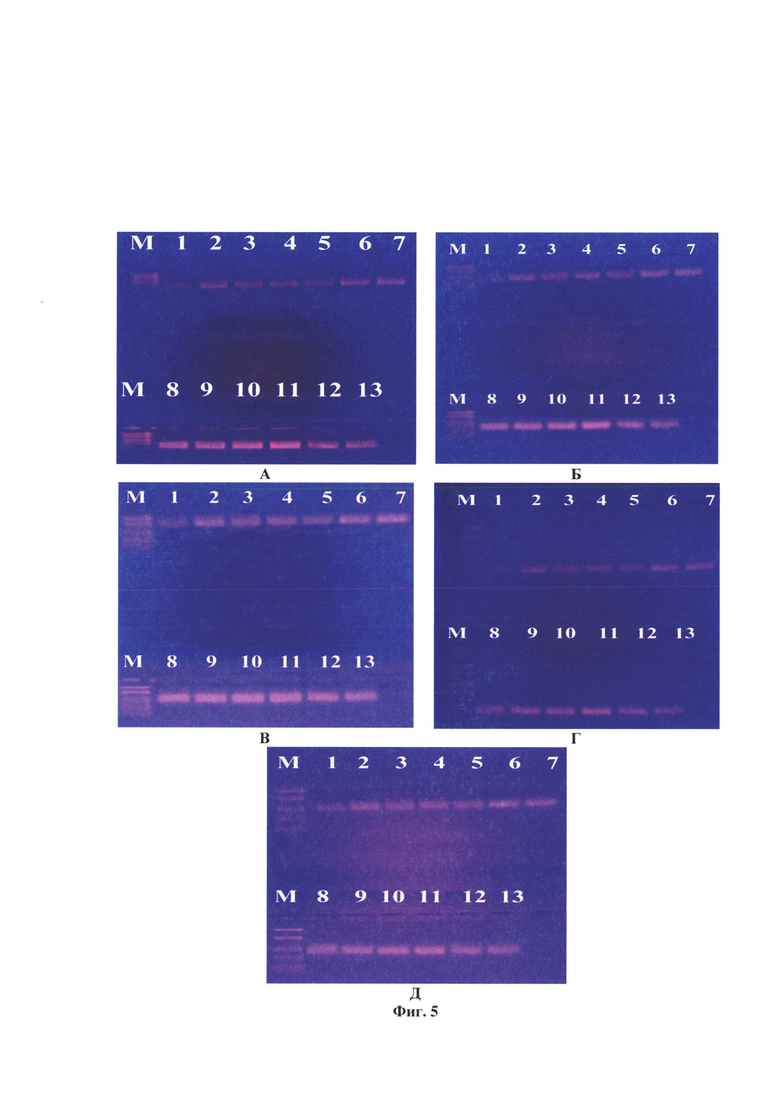
Фиг. 5 - Электрофореграмма контроля инактивации (вирус бешенства, не подвергнутый воздействию 1,2-аминоэтилэтиленимина), экспозиция при температуре 37°С через 1, 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 ч (номера треков 1-13, соответственно). Примечание: А - тест-система с парой праймеров Shift_Oligo-R1069, Б - F1807-R3020, В - F3471-R5520, Г - F5499-R6290, Д - F8085-R9954, М - маркер фрагментов ДНК с длинами 2900, 2500, 2000, 1700, 780 н.о.
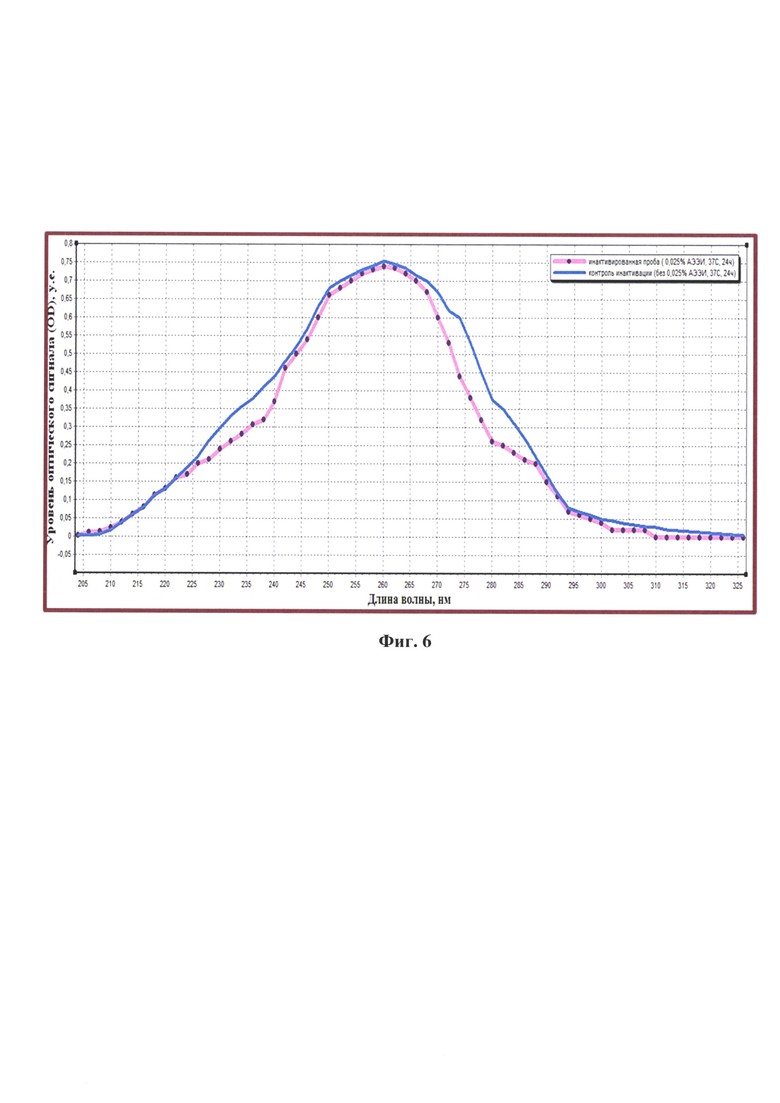
Фиг. 6 - Спектр поглощения экстрактов РНК вируса бешенства штамма ВНИИЗЖ до и после инактивации 0,025% 1,2-аминоэтилэтиленимином для оценки степени их чистоты (максимальные оптические сигналы для РНК вируса бешенства зарегистрированы при длине волны 260 нм).
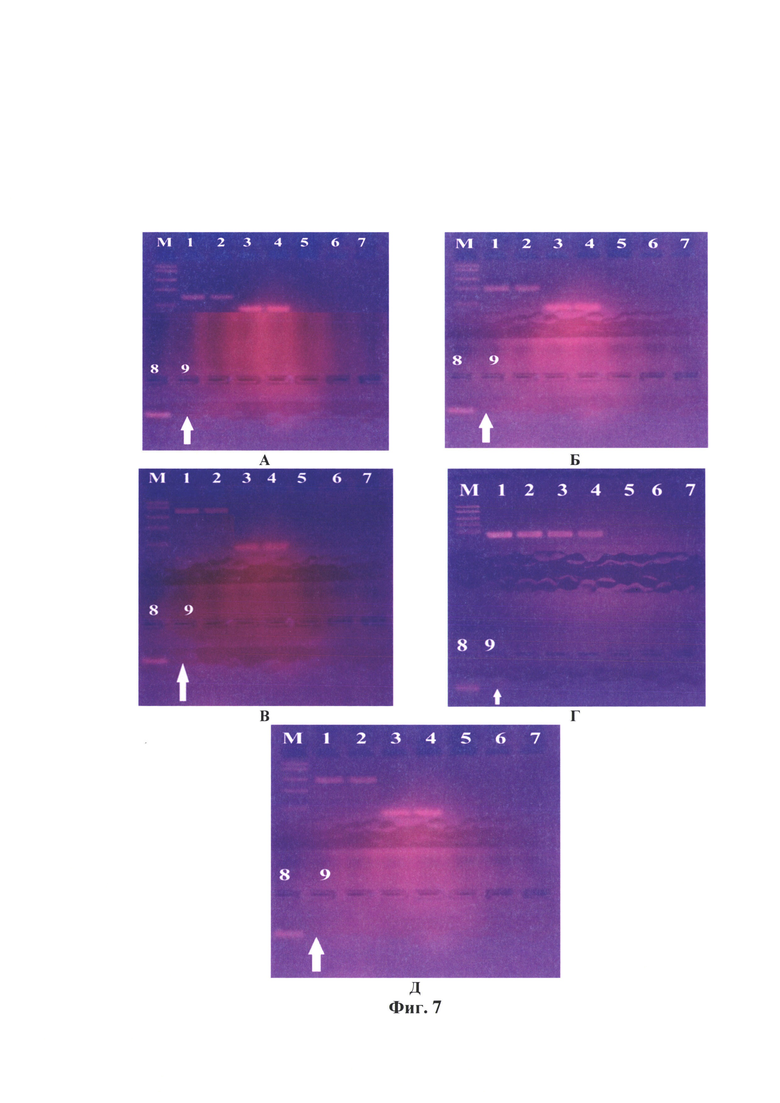
Фиг. 7 - Электрофореграмма ампликонов вируса бешенства при оценке полноты инактивации (номера треков: 1 - положительный контрольный образец на этапе выделения РНК (ПКОвыд-е рнк), 2 - положительный контрольный образец на этапе ПЦР (ПКОпцр), 3 - внутренний контрольный образец на этапе выделения РНК (ВКОвыд-е рнк), 4 - внутренний контрольный образец на этапе ПЦР (ВКОпцр), 5 - отрицательный контрольный образец, контроль фона (ОКО), 6 - отрицательный инактивированный контрольный образец на этапе выделения РНК (ОИКОвыд-е рнк), 7 - отрицательный инактивированный контрольный образец на этапе ПЦР (ОИКОпцр), 8 - контроль инактивации (неинактивированная проба вируса бешенства после инкубации при температуре 36-37°С в течение 24 ч), 9 - проба вируса бешенства, подвергнутого инактивации 1,2-аминоэтилэтиленимином с концентрацией 0,025%, экспозиция при температуре 37°С через 24 ч) (обозначена стрелкой). Примечание: А - тест-система с парой праймеров Shift_Oligo-R1069, Б - F1807-R3020, В - F3471-R5520, Г - F5499-R6290, Д - F8085-R9954, М - маркер фрагментов ДНК с длинами 2900, 2500, 2000, 1700, 780 н.о.
При проведении оценки полноты инактивации антигена вируса бешенства используют следующие контроли:
1) ПКОвыд-е рнк - положительный контрольный образец на этапе выделения РНК (исходный не инактивированный вирус бешенства);
2) ПКОпцр - положительный контрольный образец на этапе ПЦР (проверенная кДНК не инактивированного вируса бешенства);
3) ВКОвыд-е рнк - внутренний контрольный образец на этапе выделения РНК (исходный не инактивированный вирус ящура);
4) ВКОпцр - внутренний контрольный образец на этапе ПЦР (проверенная к ДНК не инактивированного вируса ящура);
5) ОКО - отрицательный контрольный образец, контроль фона (деионизированная вода);
6) ОИКОвыд-е рнк - отрицательный инактивированный контрольный образец на этапе выделения РНК (инактивированная суспензия вируса бешенства);
7) ОИКОпцр - отрицательный инактивированный контрольный образец на этапе ПЦР (проверенная кДНК вируса бешенства, выделенная из инактивированной суспензии).
Из суспензии исследуемого образца, а также из ПКОвыд-е рнк, ВКОвыд-е рнк, ОКО и ОИКОвыд-е рнк выделяют вирусную РНК в процессе лизиса белков и липопротеинов, очистки нуклеиновой кислоты от примесей и ее концентрирования. Данный метод выделения РНК позволяет достичь высокой стандартизации в процедуре экстракции и получить из образцов высокоочищенные препараты нуклеиновой кислоты. Представленная ниже модифицированная методика адаптирована к процессу получения высокоочищенного элюата РНК вируса ящура и имеет отличия по количеству используемых компонентов от прописи Chomczynski Р. [15]. Лизис проводят с применением 0,8 см3 раствора, содержащего 50% карболовой кислоты (рН<7,0) и 50% 4М ГТЦ, который смешивают с 0,1 см3 исследуемой суспензии. Смесь инкубируют при температуре 22-25°С в течение 15-17 минут для полного диссоциирования полипептидных и нуклеопротеидных комплексов. При этом суммарная вирусная РНК сохраняет свою целостность благодаря высокой ингибирующей активности карболовой кислоты и ГТЦ в отношении РНКаз. Полученный лизат очищают от конгломератов с помощью центрифугирования при 14000 об/мин в течение 8 минут. Супернатант переносят в центрифужную пробирку с 0,2 см3 хладона-20 и инкубируют содержимое в течение 5 минут с перемешиванием на вортексе. Общий объем составляет 1,09±0,02 см3 Смесь после инкубирования фракционируют при 14000 об/мин в течение 10 минут при температуре 4-8°С. В результате центрифугирования происходит разделение содержимого пробирки на три фракции: 1) нижняя фракция, содержащая комплекс карболовой кислоты и хладона-20 со связанными липопротеинами и денатурированными полипептидами; 2) средняя фракция, включающая в свой состав белки и клеточную ДНК; 3) верхняя фракция, представляющая собой элюат РНК [13]. Верхнюю фракцию полностью отбирают, не затрагивая остальные, и переносят элюат в новую центрифужную пробирку с 0,4 см3 100%-ого пропанола-2 для преципитации одноатомным спиртом с целью концентрирования вирусной РНК. Смесь инкубируют в течение 10 минут при температуре 22-25°С, затем центрифугируют при 14000 об/мин в течение 7 минут при температуре 22-25°С. Супернатант удаляют, оставляя осадок РНК вируса, к которому добавляют 0,2 см3 80%-ого этилового спирта. Содержимое перемешивают, инкубируют 3 минуты и осаждают при 14000 об/мин в течение 7 минут при температуре 22-25°С. Надосадок удаляют, осадок РНК высушивают в потоке воздуха комнатной температуры в течение 5 минут. К высушенному осадку добавляют 0,1 см3 буфера ТЕ (10 мМ трис(оксиметил)аминометан, 1 мМ этилендиамин-тетраацетат, рН 7,0-7,3), свободного от РНКаз и ионов Mg2+, прогревают содержимое пробирки при температуре 60±2°С в течение 3-5 минут для получения элюата вирусной РНК. Таким образом, получают по 0,1 см3 экстрактов вирусной РНК.
Элюаты РНК исследуют в спектральном анализе, определяя поглощение аналитом монохроматического ультрафиолетового света, что позволяет оценить степень чистоты экстракта, который в последующем используют в ОТ-ПЦР. Измерения спектральной поглощающей способности образцов проводят при длинах волны в диапазоне 205-325 нм и температуре 22-25°С. В выделенных элюатах оценивают содержание остатков фосфолипидов, полисахаридов и ГТЦ, карболовой кислоты, полипептидов и крупных взвешенных частиц, определяя значения оптической плотности (OD, optical density) при 205, 235, 270, 280 и 320 нм, соответственно [16]. Элюат РНК считают свободным от примесей белка и карболовой кислоты, если OD260/OD280 (коэффициент экстинкции R1) находится в пределах 1,8-2,2 и оптимально составляет примерно 2,0. Более низкие значения R1 указывают на наличие ДНК, белковых составляющих и остатков карболовой кислоты в элюате. Более высокие значения коэффициента R1 свидетельствуют о деградации РНК и наличии свободных рибонуклеотидов. Экстракт нуклеиновой кислоты вируса ящура считают незагрязненным полисахаридами, если OD260/OD235 (коэффициент экстинкции R2) приближен к значению 2,000 [17]. При замещении 1% РНК на полисахаридные составляющие R2 снижается на 0,002. Значения коэффициента R2 большие 2,000 могут указывать на деградацию молекул РНК. Отсутствие взвеси крупных частиц в элюате подтверждается, если OD320 приближено к нулевому значению [16, 17]. При несоответствии требованиям чистоты повторно проводят этап выделения РНК из исходного материала.
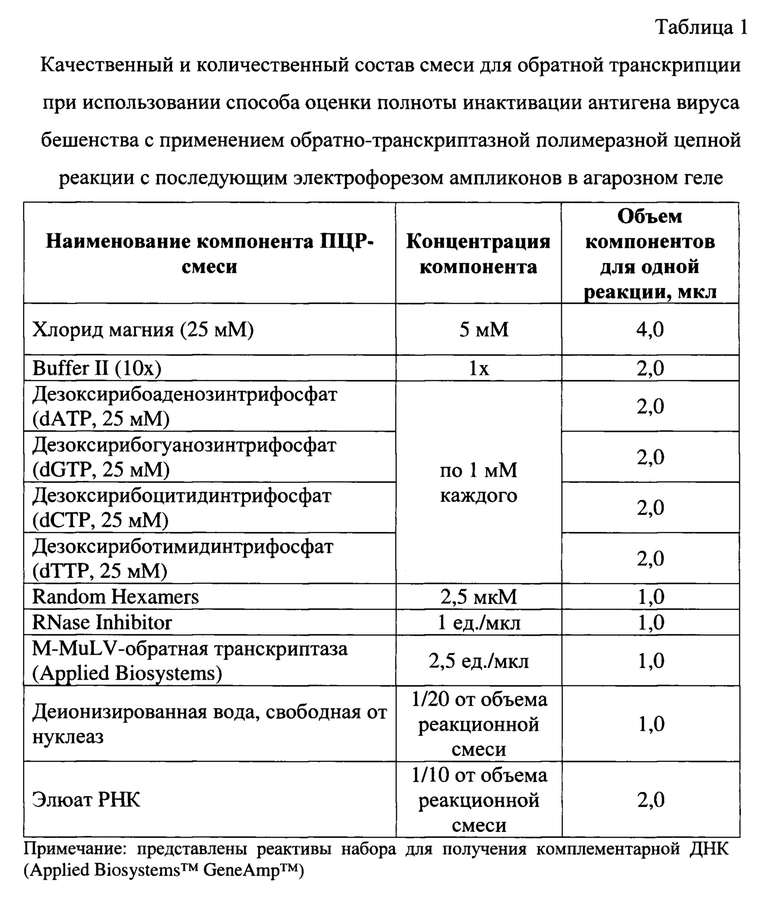
На следующем этапе исследования полученные экстракты вирусной РНК исследуют в реакции обратной транскрипции (ОТ) с ранее введенными контролями. Для постановки реакции готовят ОТ-смесь с использованием набора реагентов для обратной транскрипции с гексамерами Applied Biosystems™ GeneAmp™. Рецептура приготовления смеси для обратной транскрипции представлена в таблице 1.
Для проведения обратной транскрипции РНК вирусов бешенства и внутреннего контрольного образца (вируса ящура) применяют хлорид магния с концентрацией 5 мМ на реакцию. В качестве буферного раствора используют Buffer II в количестве 1х на реакцию. Для формирования нуклеотидных цепей продуктов реакции применяют дезоксирибонуклеозидтрифосфаты с концентрацией каждого в ОТ-смеси по 1,0 мМ. В качестве универсальных праймеров применяют Random Hexamers с концентрацией 2,5 мкМ. В качестве катализатора обратной транскрипции используют M-MuLV-обратную транскриптазу (2,5 ед./мкл). Для защиты ферментативного процесса от РНКаз применяют RNase Inhibitor с активностью 1 ед. на мкл реакционной смеси. Содержание деионизированной воды составляет 1/20 от объема реакционной смеси. Количества элюата РНК составляет 1/10 от объема смеси. Объем реакционной ОТ-смеси компонентов для проведения одной реакции вместе с элюатом вирусной РНК составляет 20 мкл. Обратную транскрипцию проводят при температуре 42°С в течение 60 мин за 1 цикл (таблица 2).
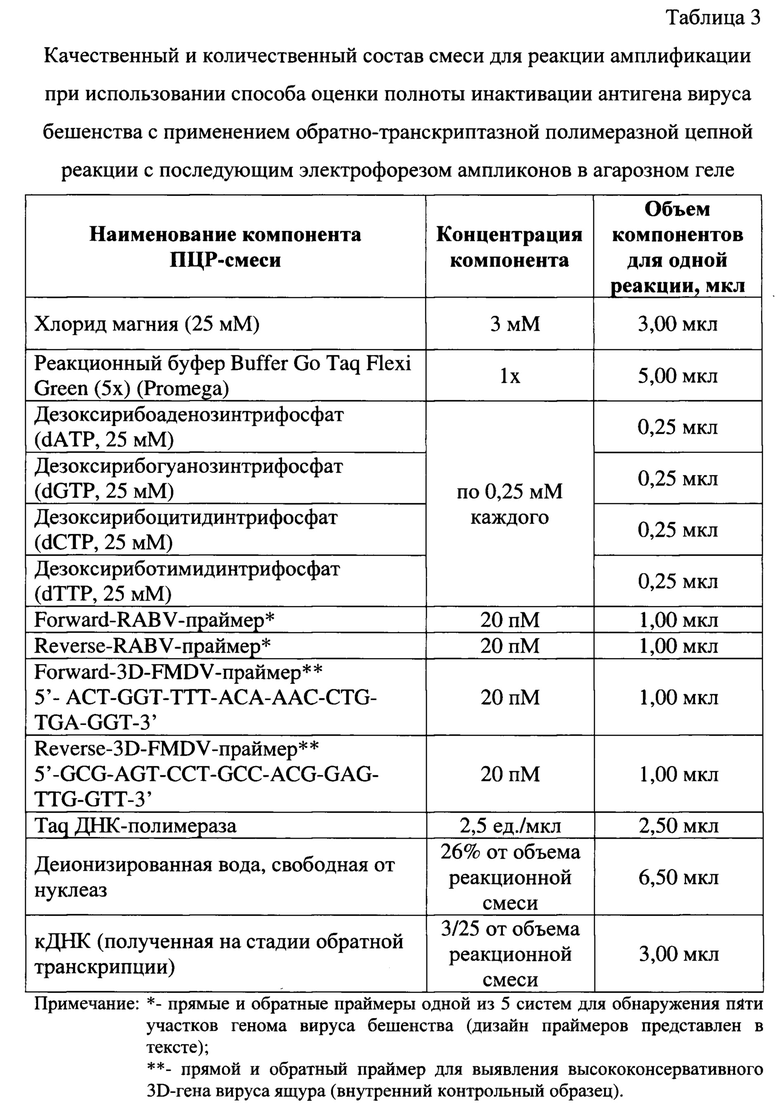
Полученную кДНК исследуют в реакции амплификации. На данном этапе в дополнение к контролям, которые применяются на стадиях выделения РНК из исследуемой суспензии и обратной транскрипции, используют дополнительные контроли: ПКОпцр, ВКОпцр, ОИКОпцр. Рецептура приготовления ПЦР-смеси представлена в таблице 3.
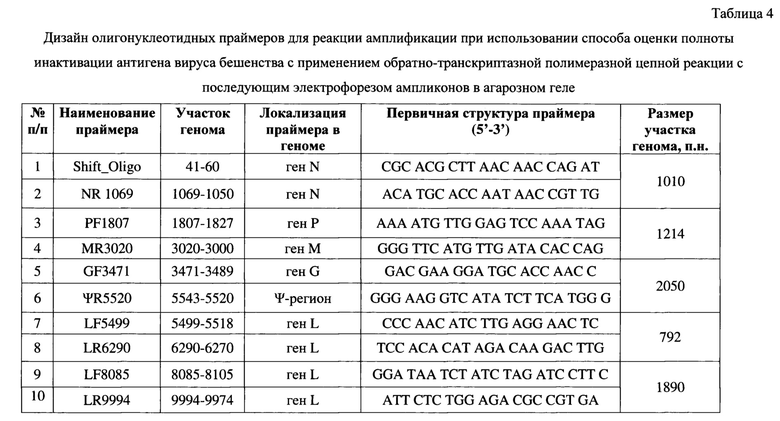
Для амплификации 5 участков генома вируса бешенства используют 5 систем оригинальных праймеров, дизайн которых представлен в таблице 4. Для анализа применяют следующие олигонуклеотиды:
1) Shift_Oligo-NR1069 (для участка высококонсервативного гена N вируса бешенства, кодирующего нуклеопротеин);
2) PF1807-MR3020 (для участка, захватывающего гены Р и М вируса бешенства, несущие информацию о фосфопротеине и матриксном белке);
3) GF3471-ΨR5520 (для участка вариабельного фрагмента гена G, ответственного за синтез гликопротеина, и Ψ-региона вируса бешенства);
4) LF5499-LR6290 (для участка гена L вируса бешенства, кодирующего информацию об РНК-зависимой ДНК-полимеразе);
5) LF8085-LR9954 (для участка L-гена вируса бешенства, несущего информацию о РНК-зависимой ДНК-полимеразе). Указанные системы праймеров позволяют амплифицировать ПЦР-продукты вируса бешенства с размерами 1010, 1214, 2050, 792, 1890, соответственно. В качестве гомологичных 3D-гену вируса ящура олигонуклеотидов используют forward-3D-FMDV- (5'- ACT-GGT-TTT-ACA-AAC-CTG-TGA-GGT-3'), reverse-3D-FMDV-праймеры (5'-GCG-AGT-CCT-GCC-ACG-GAG-TTG-GTT-3') в концентрации 20 пМ на реакцию с внесением в ПЦР-смесь по 1,0 мкл. Для формирования нуклеотидных цепей продуктов реакции применяют дезоксирибонуклеозидтрифосфаты с концентрацией каждого в ПЦР-смеси по 0,25 мМ. В качестве основы используют реакционный буфер (5х), содержание которого составляет 20% от общего объема реакционной смеси, а также добавляют хлорид магния до конечной концентрации 3 мМ. Содержание деионизированной воды составляет 26% от объема смеси. В качестве катализатора реакции амплификации применяют Thermus aquaticus DNA-полимеразу (2,5 ед.). Количество кДНК составляет 3/25 от объема реакционной смеси. Объем ПЦР-смеси компонентов вместе с кДНК для проведения одной реакции составляет 25 мкл.
Постановку реакции осуществляют при температурных и временных параметрах, сведения о которых представлены в таблице 2. Активацию Taq ДНК-полимеразы проводят при температуре 94°С за 180 с в течение 1 цикла. Реакцию амплификации осуществляют в течение 35 циклов, каждый из которых складывается из 3 подэтапов: «денатурация», проводимая при температуре 94°С в течение 60 с, «отжиг праймеров» - при температуре 58°С в течение 60 с, «элонгация» - при температуре 72°С в течение 90 с. Финишная денатурация осуществляется при температуре 72°С в течение 180 с.
На завершающем этапе исследования проводят детекцию ампликонов ДНК с помощью горизонтального электрофореза в 1,5%-ном агарозном геле, содержащем 0,0005% бромистого этидия. Учитывая, что в нашем случае размер ПЦР-продуктов для 5 систем праймеров на геном вируса бешенства не менее 300 и не более 3000 н.о. (1010, 1214, 2050, 792, 1890, соответственно) оптимально использовать гель, содержащий 1,5% агарозы Е low ЕЕО. В расплавленный гель агарозы добавляют 0,0005% бромистого этидия. Полученные после реакции образцы в соотношении 5:1 подкрашивают смесью ксиленового голубого и бромфенолового синего с добавлением 15% глицерина для визуализации процесса электрофореза. Разделение молекул ампликонов под влиянием градиента напряжения применяют стандартный ТАЕ-буфер, содержащий ЭДТА, трис(оксиметиламинометан) и ледяную уксусную кислоту. Электрофорез проводят при силе тока 90А в течение 15-20 минут. Движение ПЦР-продуктов осуществляется от отрицательно заряженного катода к положительному аноду. Бромистый этидий интеркалирует между азотистыми основаниями ампликона и в трансиллюминаторе в потоке ультрафиолетового света при длине волны 312 нм флуоресцирует, что обеспечивает детекцию результатов анализа в виде наличия или отсутствия светящихся полос. Результаты электрофореза документируют с помощью видеосистемы «Взгляд» в цветном исполнении.
Проводят интерпретацию полученных данных. Важным условием качественно проведенных исследований являются результаты испытания контрольных образцов. Если положительный контрольный образец на этапе выделения РНК (исходный не инактивированный вирус бешенства) (ПКОвыд-е рнк); положительный контрольный образец на этапе ПЦР (проверенная кДНК не инактивированного вируса бешенства) (ПКОпцр); внутренний контрольный образец на этапе выделения РНК (исходный не инактивированный вирус ящура) (ВКОвыд-е рнк); внутренний контрольный образец на этапе ПЦР (проверенная кДНК не инактивированного вируса ящура) (ВКОпцр) после всех стадий исследования в горизонтальном электрофорезе дают положительный результат (свечение ампликонов), отрицательный контрольный образец (деионизированная вода) (ОКО); отрицательный инактивированный контрольный образец на этапе выделения РНК (инактивированная суспензия вируса бешенства) (ОИКОвыд-е рнк); отрицательный инактивированный контрольный образец на этапе ПЦР (проверенная кДНК вируса бешенства, выделенная из инактивированной суспензии) (ОИКОпцр) характеризуются в качестве отрицательных образцов (свечение ампликонов отсутствует), то в таком случае стадии выделения РНК, получения кДНК и реакции амплификации проведены правильно, и можно учитывать результаты исследуемых проб.
Если один из контрольных образцов показал неадекватные, неожидаемые результаты, то интерпретировать данные анализа проб не возможно и требуется провести повторно тот (те) этап (ы) реакции, в которых результат ложный.
Если во всех треках исследуемой пробы обнаружены светящиеся продукты ПЦР, то анализируемый участок нуклеиновой кислоты вируса бешенства не поврежден, следовательно, данный образец считается вирулентным. Если во всех треках свечение ампликона отсутствует, то данный участок генома вируса бешенства поврежден, тем самым, репликация вируса бешенства не возможна и антиген считается авирулентным. Иными словами, на основании отсутствия ПЦР-продуктов исследуемой пробы по сравнению с положительными контролями позволяет сделать заключение о разрушении РНК вируса бешенства в инактивированных суспензиях и, как следствие, об отсутствии вирулентного вируса. В том случае, если получены ампликоны не для всех 5 систем праймеров, то инактивация вируса прошла, но в мягких условиях.
В том случае, если обнаружены несоответствия в результатах анализа контролей, требуется повторно провести исследование именно того этапа (выделение РНК, обратная транскрипция, реакция амплификации), на котором выявлено отклонение от нормы.
Пример 1. Исследование процесса инактивации вируса бешенства штамма «ВНИИЗЖ» в течение 24 ч с помощью β-пропиолактона методом ОТ-ПЦР с последующим горизонтальным электрофорезом
Суспензию вируса бешенства штамма «ВНИИЗЖ» с титром инфекционной активности 7,25 lg ККИД50/см3, по данным титрования в перевиваемой монослойной клеточной линии ВНК-21/2-17, сразу после репродукции в суспензионной культуре клеток ВНК-21/2-17 разделяли в 3 стерильные емкости и подвергали процессу инактивации с применением β-пропиолактона (БПЛ) (рН 8,2-8,6):
1 флакон - концентрация БПЛ 0,025%, температура инактивации плюс 36-37°С, экспозиция -4 ч;
2 флакон - концентрация БПЛ 0,050%, температура инактивации плюс 36-37°С, экспозиция -4 ч;
3 флакон - концентрация БПЛ 0,050%, температура инактивации плюс 36-37°С, экспозиция - 0,5 ч, далее температура - плюс 4°С, экспозиция - 23,5 ч.
Водородный показатель вирусной суспензии поддерживали в диапазоне 7,2-7,6. Суспензии подвергали тщательному перемешиванию в течение 3-5 минут через каждый час. Условия инактивации подбирали в соответствии с требованиями МЭБ (OIE) в зависимости от химической природы агента, а также от действительных условий и оборудования, используемого во время промышленного производства [2].
Параллельно исследовали вирус бешенства штамма «ВНИИЗЖ», не подвергнутый инактивации, экспозиция которого проводилась при той же температуре и в тот период времени.
Для определения времени полной инактивации после добавления химического агента через 2 и 4 ч в стерильных условиях производили отбор проб из флаконов. Из третьего флакона также анализировали пробы через 4, 8, 12, 16, 20 и 24 ч, поскольку условия инактивации были более мягкими.
Полученные образцы исследовали на наличие инфекционной активности вируса бешенства в РИФ с помощью перевиваемой монослойной культуры клеток ВНК-21/2-17 с последующим окрашиванием монослоя антирабическим иммуноглобулином G, меченым ФИТЦ, а также разработанным способом опосредованного определения полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции в пяти оригинальных тест-системах с последующим электрофорезом ампликонов в агарозном геле. Исследование образцов в культуре клеток проводили в соответствии с международными требованиями [2]. Качественный и количественный состав смеси для проведения ОТ-ПЦР, а также параметры термоциклирования отражены в таблицах 1-4.
Электрофореграммы контрольных образцов представлены на фиг. 1, из которой следует, что положительный контрольный образец на этапе выделения РНК (ПКОвыд-е рнк); положительный контрольный образец на этапе ПЦР (ПКОпцр); внутренний контрольный образец на этапе выделения РНК (ВКОвыд-е рнк); внутренний контрольный образец на этапе ПЦР (ВКОпцр) после всех стадий исследования в горизонтальном электрофорезе дают положительный результат (свечение ампликонов), отрицательный контрольный образец (ОКО); отрицательный инактивированный контрольный образец на этапе выделения РНК (ОИКОвыд-е рнк); отрицательный инактивированный контрольный образец на этапе ПЦР (ОИКОпцр) дают отрицательный результат (свечение продуктов ПЦР отсутствует). Иными словами, стадии выделения РНК, получения кДНК и реакции амплификации проведены правильно, и можно учитывать результаты исследуемых суспензий вируса бешенства, подвергнутых влиянию (3-пропиолактона.
Результаты исследования отобранных суспензий вируса бешенства после экспозиции с β-пропиолактоном в РИФ и ОТ-ПЦР отражены в таблице 5 и на фиг. 2. Из данных, представленных в таблице 5 видно, контроль инактивации (вирус бешенства, не подвергнутый инактивации, экспозиция при температуре 36-37°С через 4 ч, а также при экспозиции в течение 0,5 ч при температуре 36-37°С и 23,5 ч при температуре 4°С через 24 ч) сохранил вирусную РНК без повреждений по всем системам праймеров.
Из таблицы 5 следует, что полная инактивация вируса бешенства штамма «ВНИИЗЖ» β-пропиолактоном в концентрации 0,025% при температуре 36-37°С достигается через 4 ч, в концентрации 0,050% при температуре 36-37°С достигается через 4 ч, в концентрации 0,050% при температуре 36-37°С в течение 2 ч и при температуре 4°С в течение 23,5 ч достигается через 20 ч.
Из данных фиг. 2 следует, что в инактивированных материалах вируса бешенства штамма «ВНИИЗЖ» полностью отсутствовали продукты ПЦР, комплементарные участкам N-гена (41-1069 п. о.), Р-М-генов (1807-3020 п. о.), G-гена-Ψ-региона (3471-5543 п. о.), L-гена (5499-6290 и 8085-9994 п. о.), что свидетельствовало о прохождении полной инактивации вируса бешенства. Полученные результаты были подтверждены в РИФ с применением монослойной клеточной линии ВНК-21/2-17 и антирабического иммуноглобулина G, меченного ФИТЦ.
Таким образом, определение полноты инактивации вирусного сырья с помощью ОТ-ПЦР не уступает по своей эффективности традиционному биологическому методу и позволяет значительно сократить время проведения исследования.
Пример 2. Исследование процесса инактивации вируса бешенства штамма «ВНИИЗЖ» в течение 24 ч с помощью 0,025% 1,2-аминоэтилэтиленимина методом ОТ-ПЦР с последующим горизонтальным электрофорезом
Суспензию вируса бешенства штамма «ВНИИЗЖ» с титром инфекционной активности 7,25 lg ККИД50/см3, по данным титрования в перевиваемой монослойной клеточной линии из почки новорожденного сирийского хомячка ВНК-21/2-17, сразу после репродукции в суспензионной культуре клеток ВНК-21/2-17 подвергали процессу инактивации с применением 1,2-аминоэтилэтиленимина (АЭЭИ) (рН 8,2-8,6) с концентрацией 0,025% при температуре 36-37°С в течение 24 ч. Водородный показатель вирусной суспензии поддерживали в диапазоне 7,2-7,6. Суспензию подвергали тщательному перемешиванию в течение 3-5 минут через каждый час. Параллельно исследовали вирус бешенства штамма «ВНИИЗЖ», не подвергнутый инактивации, экспозиция которого проводилась при той же температуре и в тот период времени.
Для определения времени полной инактивации после добавления химического агента через каждые 2 ч в стерильных условиях производили отбор проб. Полученные образцы исследовали на наличие инфекционной активности вируса бешенства в РИФ с помощью перевиваемой монослойной культуры клеток ВНК-21/2-17 с последующим окрашиванием монослоя антирабическим иммуноглобулином G, меченым ФИТЦ, а также разработанным способом оценки полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции в пяти оригинальных тест-системах с последующим электрофорезом ампликонов в агарозном геле. Исследование образцов в культуре клеток проводили в соответствии с международными требованиями [2]. Качественный и количественный состав смеси для проведения ОТ-ПЦР, а также параметры термоциклирования отражены в таблицах 1-4.
Электрофореграммы контрольных образцов отражены на фиг. 1. Их интерпретация представлена в примере 1, и из нее следует, что стадии выделения РНК, получения кДНК и реакции амплификации проведены правильно, и можно учитывать результаты исследуемых суспензий вируса бешенства, подвергнутых влиянию АЭЭИ.
Результаты исследования в РИФ и ОТ-ПЦР отобранных суспензий вируса бешенства после экспозиции с АЭЭИ отражены в таблице 6 и на фиг. 3.
Из данных, представленных в таблице 6 и на фиг. 3 видно, что контроль инактивации (вирус бешенства, не подвергнутый инактивации, экспозиция при температуре 36-37°С через 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 ч) сохранил вирусную РНК без повреждений по всем системам праймеров.
Из таблицы 6 следует, что полная инактивация вируса бешенства штамма «ВНИИЗЖ» 1,2-аминоэтилэтиленимином в концентрации 0,025% при температуре 37°С достигается через 20 ч.
Как следует из данных фиг. 3, под влиянием 0,025% АЭЭИ отмечаются разрушения в N-, Р-, М- G- и L-участках генома вируса бешенства штамма «ВНИИЗЖ». Продукты ПЦР, комплементарные участкам N-гена (41-1069 п. о.) отсутствовали через 22 ч, Р-М-генов (1807-3020 п. о.) - через 20 ч, G-гена-Ψ-региона (3471-5543 п. о.) - через 20 ч, L-гена (5499-6290 и 8085-9994 п. о.) - через 24 ч. Иными словами, спустя 24 ч продукты ПЦР в указанных тест-системах полностью отсутствовали, что свидетельствовало о прохождении полной инактивации вируса бешенства. Полученные результаты были подтверждены в РИФ с применением монослойной клеточной линии ВНК-21/2-17 и антирабического иммуноглобулина G, меченного ФИТЦ.
Таким образом, определение полноты инактивации вирусного сырья с помощью ОТ-ПЦР не уступает по своей эффективности традиционному биологическому методу и позволяет значительно сократить время проведения исследования.
Пример 3. Исследование процесса инактивации вируса бешенства штамма «ВНИИЗЖ» в течение 24 ч с помощью 0,050% 1,2-аминоэтилэтиленимина методом ОТ-ПЦР с последующим горизонтальным электрофорезом
Суспензию вируса бешенства штамма «ВНИИЗЖ» с титром инфекционной активности 7,25 lg ККИД50/см3, по данным титрования в перевиваемой монослойной клеточной линии из почки новорожденного сирийского хомячка ВНК-21/2-17, сразу после репродукции в суспензионной культуре клеток ВНК-21/2-17 подвергали процессу инактивации с применением 1,2-аминоэтилэтиленимина (АЭЭИ) (рН 8,2-8,6) с концентрацией 0,050% при температуре 36-37°С в течение 24 ч. Водородный показатель вирусной суспензии поддерживали в диапазоне 7,2-7,6. Суспензию подвергали тщательному перемешиванию в течение 3-5 минут через каждый час. Параллельно исследовали вирус бешенства штамма «ВНИИЗЖ», не подвергнутый инактивации, экспозиция которого проводилась при той же температуре и в тот период времени.
Для определения времени полной инактивации после добавления химического агента через каждые 2 ч в стерильных условиях производили отбор проб. Полученные образцы исследовали на наличие инфекционной активности вируса бешенства в РИФ с помощью перевиваемой монослойной культуры клеток ВНК-21/2-17 с последующим окрашиванием монослоя антирабическим иммуноглобулином G, меченым ФИТЦ, а также разработанным способом оценки полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции в пяти тест-системах с последующим электрофорезом ампликонов в агарозном геле. Исследование образцов в культуре клеток проводили в соответствии с международными требованиями [2]. Качественный и количественный состав смеси для проведения ОТ-ПЦР, а также параметры термоциклирования отражены в таблицах 1-4.
Электрофореграммы контрольных образцов отражены на фиг. 1. Их интерпретация представлена в примере 1 и из нее следует, что стадии выделения РНК, получения кДНК и реакции амплификации проведены правильно, и можно учитывать результаты исследуемых суспензий вируса бешенства, подвергнутых влиянию АЭЭИ.
Результаты исследования в РИФ и ОТ-ПЦР отобранных суспензий вируса бешенства после экспозиции с АЭЭИ отражены в таблице 7 и на фиг. 4.
Из данных, представленных в таблице 7 и на фиг. 4 видно, что контроль инактивации (вирус бешенства, не подвергнутый инактивации 0,050% АЭЭИ, экспозиция при температуре 36-37°С через 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 ч) сохранил вирусную РНК без повреждений по итогам анализа во всех 5 представленных системах праймеров.
Из таблицы 7 следует, что полная инактивация вируса бешенства штамма «ВНИИЗЖ» 1,2-аминоэтилэтиленимином в концентрации 0,050% при температуре 37°С достигается через 16 ч.
Как следует из данных фиг. 4, под влиянием 0,050% АЭЭИ отмечаются разрушения в N-, Р-, М- G- и L-участках генома вируса бешенства штамма «ВНИИЗЖ». Продукты ПЦР, комплементарные участкам N-гена (41-1069 п. о.) отсутствовали через 20 ч, Р-М-генов (1807-3020 п. о.) - через 16 ч, G-гена-Ψ-региона (3471-5543 п. о.) - через 16 ч, L-гена (5499-6290 и 8085-9994 п. о.) - через 20 ч. Иными словами, спустя 20 ч продукты ПЦР в указанных тест-системах полностью отсутствовали, что свидетельствовало о прохождении полной инактивации вируса бешенства. Полученные результаты были подтверждены в РИФ с применением монослойной клеточной линии ВНК-21/2-17 и антирабического иммуноглобулина G, меченного ФИТЦ.
Таким образом, определение полноты инактивации вирусного сырья с помощью ОТ-ПЦР не уступает по своей эффективности традиционному биологическому методу и позволяет значительно сократить время проведения исследования.
Пример 4. Определение полноты инактивации антигена вируса бешенства штамма «ВНИИЗЖ» с применением ОТ-ПЦР с последующим электрофорезом ампликонов в агарозном геле в сравнении с данными реакции иммунофлуоресценции (РИФ)
Суспензию вируса бешенства штамма «ВНИИЗЖ» с титром инфекционной активности 7,50 lg ККИД50/см3, по данным титрования в перевиваемой монослойной клеточной линии из почки новорожденного сирийского хомячка ВНК-21/2-17, сразу после репродукции в суспензионной культуре клеток ВНК-21/2-17 подвергали процессу инактивации с применением 1,2-аминоэтилэтиленимина (АЭЭИ) (рН 8,2-8,6) с концентрацией 0,025% при температуре 36-37°С в течение 24 ч. Водородный показатель вирусной суспензии поддерживали в диапазоне 7,2-7,6. Суспензию подвергали тщательному перемешиванию в течение 3-5 минут через каждый час. Параллельно исследовали вирус бешенства штамма «ВНИИЗЖ», не подвергнутый инактивации, экспозиция которого проводилась при той же температуре и в тот период времени. Через 24 ч в стерильных условиях производили отбор проб. Полученные образцы исследовали на наличие инфекционной активности вируса бешенства в РИФ с помощью перевиваемой монослойной культуры клеток ВНК-21/2-17 с последующим окрашиванием монослоя антирабическим иммуноглобулином G, меченым ФИТЦ, а также разработанным способом оценки полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции в пяти тест-системах с последующим электрофорезом ампликонов в агарозном геле.
Исследование образцов в культуре клеток методом РИФ проводили в соответствии с международными требованиями [2].
Из суспензии исследуемого образца, а также из ПКОвыд-е рнк» ВКОвыд-е рнк, ОКО и ОИКОвыд-е рнк выделяли вирусный геном в процессе лизиса белков и липопротеинов, очистки нуклеиновой кислоты от примесей и ее концентрирования. Лизис проводили с применением 0,8 см3 раствора, содержащего 50% карболовой кислоты (рН<7,0) и 50% 4М ГТЦ, который смешивали с 0,1 см3 исследуемой суспензии. Смесь инкубировали при температуре 22-25°С в течение 15-17 минут для полного диссоциирования полипептидных и нуклеопротеидных комплексов. Полученный лизат очищали от конгломератов с помощью центрифугирования при 14000 об/мин в течение 8 минут. Супернатант переносили в центрифужную пробирку с 0,2 см3 хладона-20 и инкубировали содержимое в течение 5 минут с перемешиванием на вортексе. Смесь после инкубирования фракционировали при 14000 об/мин в течение 10 минут при температуре 4-8°С. В результате центрифугирования происходило разделение содержимого пробирки на три фракции: нижнюю, среднюю и верхнюю. Верхнюю фракцию полностью отбирали, не затрагивая остальные, и переносили элюат в новую центрифужную пробирку с 0,4 см3 100%-ого пропанола-2. Смесь инкубировали в течение 10 минут при температуре 22-25°С, затем центрифугировали при 14000 об/мин в течение 7 минут при температуре 22-25°С. Супернатант удаляли, оставляя осадок РНК вируса, к которому добавляли 0,2 см3 80%-ого этилового спирта. Содержимое перемешивали, инкубировали 3 минуты и осаждали при 14000 об/мин в течение 7 минут при температуре 22-25°С. Надосадок удаляли, осадок РНК высушивали в потоке воздуха комнатной температуры в течение 5 минут. К высушенному осадку добавляли 0,1 см3 буфера ТЕ (10 мМ трис(оксиметил)аминометан, 1 мМ этилендиамин-тетраацетат, рН 7,0-7,3), свободного от РНКаз и ионов Mg2+. Прогревали содержимое пробирки при температуре 60±2°С в течение 3-5 минут для получения 0,1 см3 элюата вирусной РНК от каждого образца.
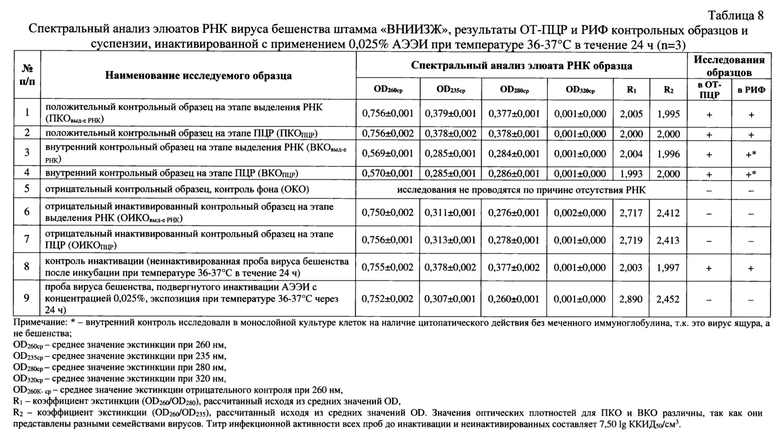
Полученные экстракты РНК исследовали в спектральном анализе, определяя поглощение аналитом монохроматического ультрафиолетового света при длинах волны в диапазоне 205-325 нм и температуре 22-25°С. В выделенных экстрактах оценивали содержание остатков фосфолипидов, полисахаридов и ГТЦ, карболовой кислоты, полипептидов и крупных взвешенных частиц, определяя значения оптической плотности (OD, optical density) при 205, 235, 270, 280 и 320 нм, соответственно [16]. Результаты исследования отражены в таблице 8. Элюаты РНК вируса бешенства, не подвергнутого инактивации с помощью 0,050% АЭЭИ, были свободным от примесей белка и карболовой кислоты, ДНК и свободных рибонуклеотидов поскольку коэффициент экстинкии R1 (OD260/OD280) находился в пределах 1,8-2,2 и составлял 1,993-2,005. Для контроля инактивации R1 был равен 2,003, что соответствует требованиями [16, 17]. Элюат РНК вируса бешенства, подвергнутый воздействию 0,025% АЭЭИ в течение 24 ч, имел завышение значения коэффициента R1 и составлял 2,890. Иными словами, данный материал содержал короткие фрагменты РНК и отдельные рибонуклеотиды. Экстракты неинактивированной вирусной РНК не содержали полисахаридов, а также не имели признаков деградации нуклеиновой кислоты, так как коэффициент экстинкции R2 (OD260/OD235) был приближен к нормальному значению 2,000 [17] и составлял 1,995-2,000, что означало замещение не более 2,5% РНК на полисахаридные составляющие. Для элюата инактивированной РНК вируса бешенства значение коэффициента R2 составляло 2,452, что косвенно подтверждало деградацию нуклеиновой кислоты до коротких фрагментов и отдельных рибонуклеотидов. Отмечалось отсутствие взвеси крупных частиц во всех элюатах, поскольку OD320 было приближено к нормальному нулевому значению [16, 17] и составило 0,001-0,002. Учитывая, что элюаты, не подвергнутые инактивации, по значениям коэффициентов R1 и R2 и данным OD320 соответствовали требованиям чистых препаратов [16, 17] данные материалы использовали на дальнейших этапах анализа. Элюаты, отобранные от инактивированных суспензий вируса бешенства, также анализировали в последующих исследованиях, поскольку значение OD320 соответствовало требованиям, а значения коэффициентов R1 и R2 ожидаемо были завышены из-за воздействия химического инактиванта.
На следующем этапе исследования полученные экстракты вирусной РНК исследовали в реакции обратной транскрипции и полимеразной цепной реакции. Рецептуры приготовления смесей для данных реакций представлены в таблицах 1,3. Параметры режимов термоциклирования для проведения ОТ-ПЦР при использовании способа опосредованного определения полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции с последующим электрофорезом ампликонов в агарозном геле отражены в таблице 2. Для амплификации 5 участков генома вируса бешенства использовали 5 систем оригинальных праймеров, дизайн которых представлен в таблице 4.
На завершающем этапе исследования проводили детекцию ампликонов ДНК с помощью горизонтального электрофореза в 1,5%-ном агарозном геле, содержащем 0,0005% бромистого этидия. В расплавленный гель агарозы добавляли 0,0005% бромистого этидия. Полученные после реакции образцы в соотношении 5:1 подкрашивали смесью ксиленового голубого и бромфенолового синего с добавлением 15% глицерина для визуализации процесса электрофореза. Разделение молекул ампликонов под влиянием градиента напряжения применяли стандартный ТАЕ-буфер, содержащий ЭДТА, трис(оксиметиламинометан) и ледяную уксусную кислоту. Электрофорез проводят при силе тока 90А в течение 15-20 минут. Наличие продуктов реакции амплификации определяли с помощью трансиллюминатора в потоке ультрафиолетового света при длине волны 312 нм. Результаты электрофореза документировали с помощью видеосистемы «Взгляд» в цветном исполнении.
Проводили интерпретацию полученных данных для контролей и исследуемого образца после инактивации 0,025% АЭЭИ при температуре 36-37°С в течение 24 ч. Электрофореграммы контрольных образцов представлены на фиг. 7, из которой следует, что положительный контрольный образец на этапе выделения РНК (ПКОвыд-е рнк); положительный контрольный образец на этапе ПЦР (ПКОпцр); внутренний контрольный образец на этапе выделения РНК (ВКОвыд-е рнк); внутренний контрольный образец на этапе ПЦР (ВКОпцр) и контроль инактивации (проба вируса бешенства, инкубация которой проводилась без АЭЭИ при температуре 36-37°С в течение 24 ч) после всех стадий исследования в горизонтальном электрофорезе дали положительный результат (свечение ампликонов), отрицательный контрольный образец (ОКО); отрицательный инактивированный контрольный образец на этапе выделения РНК (ОИКОвыд-е рнк); отрицательный инактивированный контрольный образец на этапе ПЦР (ОИКОпцр) дали отрицательный результат (свечение продуктов ПЦР отсутствует). Иными словами, стадии выделения РНК, получения к ДНК и реакции амплификации проведены правильно, и можно учитывать результаты исследуемых суспензий вируса бешенства.
Результаты исследования образцов в РИФ и ОТ-ПЦР отражены в таблице 8 и на фиг. 7, из которых видно, что через 24 ч экспозиции с 0,025% АЭЭИ отмечались разрушения в N-, Р-, М- G- и L-участках генома вируса бешенства штамма «ВНИИЗЖ». Продукты ПЦР, комплементарные участкам N-гена (41-1069 п. о.), Р-М-генов (1807-3020 п. о.), G-гена-Ψ-региона (3471-5543 п. о.), L-гена (5499-6290 и 8085-9994 п. о.) отсутствовали. Полученные данные означали, что положительные контроли и контроль инактивации были вирулентными, а отрицательные контроли и проба, подвергнутая воздействию 0,025% АЭЭИ, были полностью инактивированными. Результаты были подтверждены в РИФ.
Таким образом, определение полноты инактивации вирусного сырья с помощью ОТ-ПЦР не уступает по своей эффективности традиционному биологическому методу и позволяет значительно сократить время проведения исследования.
Основным преимуществом предлагаемого изобретения является возможность одновременного исследования большого количества проб для определения полноты инактивации антигена вируса бешенства в сырье для антирабической инактивированой вакцины в течение 4-5 часов. В предлагаемом изобретении предлагается применение оптимизированной обратно-транскриптазной полимеразной цепной реакции с использованием 5 систем оригинальных праймеров, детектирующих протяженные участки в N-, Р-, М-, G-, L-генах вируса с размерами 1010, 1214, 2050, 792, 1890 н.о., соответственно, с последующим электрофорезом ампликонов в агарозном геле, с помощью которого возможно выявлять неповрежденный геном вируса бешенства до процесса инактивации и определять отсутствие вирулентного вируса бешенства после воздействия инактивантами.
Предлагаемое изобретение позволяет быстро и с высокой степенью достоверности определять полноту инактивации антигена вируса бешенства для антирабической вакцины на основе ОТ-ПЦР с последующей детекцией результатов исследования в 1,5%-ном агарозном геле.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Способ оценки полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции с последующим электрофорезом ампликонов в агарозном геле»
1. Груздев К.Н., Метлин А.Е. Бешенство животных. - Владимир: ФГБУ «ВНИИЗЖ», 2019. - 394 с.
2. OIE. Manual of diagnostic tests and vaccines for terrestrial animals. - Paris, 2018. - Chapter 3.1.17. - P. 578-612.
3. WHO Rabies vaccines: WHO position paper-recommendations. Vaccine. - 2010. - Vol. 28. - P. 7140-7142.
4. Метлин A.E. Современные аспекты классификации лиссавирусов // Ветеринария сегодня. - 2017. - №3 (22). - С. 52-57.
5. A single aminoacide change in rabies virus glycoprotein increasesvirus spread and enhances virus pathogenicity / M. Faber, M.L. Faber, A. Papanery [et al.] // J. Virology. - 2005. - Vol. 79 (22). - P. 14141-14148.
6. Недосеков В.В. Современные вакцины против бешенства животных // Ветеринария. - 2003. - С. 23-25.
7. Barrat, J. Rabies diagnosis / J. Barrat, E. Picard-Meyer, F. Cliquet // Developments in Biologicals. - 2006. - Vol. 125. - P. 71-77.
8. Nucleoprotein gene analysis of fixed and street rabies virus variants using RT-PCR / Y.T. Arai, K. Yamada, Y. Kameoka [et al.] // Arch. Virol. - 1997. - Vol. 142. - P. 1787-1796.
9. Патент 2366457 Российская Федерация, МПК A61K 39/205 (2006.01). Вакцина антирабическая для животных (УНИРЭВ) / Иванов B.C., Иванов И.В., Самуйленко А.Я. [и др.] - №2008107039/13; заявл. 27.02.2008; опубл. 10.09.2009, Бюл. №25.
10. Патент 2402348 Российская Федерация, МПК A61K 39/205 (2006.01). Вакцина антирабическая сухая для крупного и мелкого рогатого скота / Иванов B.C., Иванов И.В., Самуйленко А. Я [и др.]. - №2009117725/13; заявл. 13.05.2009; опубл. 27.10.2010, Бюл. №30.
11. Вакцина антирабическая инактивированная культуральная жидкая (ВНИИЗЖ) [Электронный ресурс]. - Режим доступа: http://www.arriah.ru/main/production/price-vaccines/113/vakcina-antirabicheskaya-inaktivirovannaya-kulturalnaya-zhidkaya (Дата обращения: 13 декабря 2019 г. ).
12. Курашова С.С. Сравнительная характеристика инактивирующих агентов для создания вакцин против геморрагичексой лифхорадки с печечным синдромом / С.С. Курашова, А.А. Ишмухаметов, М.С. Егорова [и др.] // Эпидемиология и вакцинопрофилактика. - 2018. - №17(4). - С. 26-29.
13. Beta-Propiolactone - URL: http://www.cdc.gov/niosh/npg/npgd0528.html (дата обращения: 5 декабря 2019 г.).
14. Ethyleneimine - URL: http://www.cdc.gov/niosh/npg/npgd0274.html (дата обращения: 6 декабря 2019 г.).
15. Метлин А.Е. Комплекс средств и методов диагностики и борьбы с бешенством: дис…. докт. Вет. наук: 06.02.02: защищена 28.02.19 / Метлин Артем Евгеньевич. - Казань, 2018. - 446 с.
16. Цыбанов, Я.С. Дифференциация вирусов арктического и классического бешенства методом полимеразной цепной реакции / Я.С. Цыбанов, В.В. Недосеков, И.А. Сливко // Актуальные пробл. патологии свиней, крупного и мелкого рогатого скота - Владимир, 2002. - С. 133-137.
17. Tordo, N. The polymerase chain reaction (PCR) technique for diagnosis, typing and epidemiological studies of rabies / N. Tordo, D. Sacramento, H. Bourhy // Laboratory Techniques in Rabies / ed. F.-X. Meslin, M.M. Kaplan, H. Koprowski - Geneva, 1996. - P. 157-170.
18. Федоров Д.Г. 1999. Усовершенствование технологии изготовления и контроля инактивированной вакцины против классической чумы свиней // Автореферат…. канд-та ветер. Наук. Покров. 24 с.
19. Chomczynski P., Sacchi N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nat Protoc. 1 (2). - 2006. - P. 581-585.
20. The Analysis of DNA or RNA using Its Wavelengths: 230 nm, 260 nm, 280 nm. Bioteachnology.com (дата обращения 13.11.2019). http://bioteachnology.com/dna/analysis-dna-rna-wavelengths-230-260-280-nm.





Изобретение относится к области биотехнологии. Описан способ опосредованного определения полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР) с последующим электрофорезом ампликонов в агарозном геле. Полноту инактивации антигена вируса бешенства определяют методом ОТ-ПЦР с использованием 5 систем оригинальных праймеров (Shift_Oligo-NR1069 (для участка высококонсервативного гена N вируса бешенства); PF1807-MR3020 (для участка, захватывающего гены Р и М вируса бешенства); GF3471-ΨR5520 (для участка вариабельного фрагмента гена G и Ψ-региона вируса бешенства); LF5499-LR6290 и LF8085-LR9954 (для участков L-гена вируса бешенства, несущего информацию о РНК-зависимой ДНК-полимеразе)). Детекцию результатов полноты инактивации вируса бешенства осуществляют в потоке ультрафиолетового света при длине волны 312 нм после проведения горизонтального электрофореза в 1,5%-ном агарозном геле с добавлением 0,0005% бромистого этидия. При наличии флуоресцирующих ампликонов, полученных в ПЦР с использованием 5 систем оригинальных праймеров, образец вирулентен, при отсутствии светящихся продуктов ПЦР во всех 5 системах праймеров образец инактивирован. Предлагаемое изобретение позволяет быстро и с высокой степенью достоверности оценивать полнота инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции с последующим электрофорезом ампликонов в агарозном геле. 7 з.п. ф-лы, 8 табл., 4 пр., 7 ил.
1. Способ опосредованного определения полноты инактивации антигена вируса бешенства с применением обратно-транскриптазной полимеразной цепной реакции (ОТ-ПЦР) с последующим электрофорезом ампликонов в агарозном геле, включающий следующие стадии:
- подготавливают контрольную панель образцов: положительный контроль на этапе выделения РНК, положительный контроль на этапе ПЦР, внутренний контроль на этапе выделения РНК, внутренний контроль на этапе ПЦР, отрицательный контрольный образец, отрицательный инактивированный контрольный образец на этапе выделения РНК, отрицательный инактивированный контрольный образец на этапе ПЦР, контроль инактивации (неинактивированная проба вируса бешенства после инкубации при температуре 36-37°С в течение 24 ч);
- выделяют РНК вируса бешенства из контрольных и исследуемых инактивированных образцов с помощью карболовой кислоты, гуанидинизотиоцианата, хладона-20, пропанола-2, этилового спирта и буфера ТЕ;
- проводят оценку степени чистоты полученных элюатов РНК вируса бешенства спектральным методом при длинах волны 205-325 нм;
- осуществляют синтез комплементарной ДНК в процессе обратной транскрипции и получение ампликонов в реакции амплификации, предполагающей использование 5 систем праймеров, детектирующих протяженные участки в N-, Р-, М-, G-, L-генах вируса с размерами 1010, 1214, 2050, 792, 1890 н.о., соответственно, что составляет 58% от всего генома вируса бешенства во всех генах;
- проводят детекцию ампликонов вируса бешенства контрольных и исследуемых образцов методом горизонтального электрофореза в агарозном геле с добавлением бромистого этидия;
- оценивают наличие и отсутствие продуктов полимеразной цепной реакции в виде светящихся полос в потоке ультрафиолетового света при длине волны 312 нм;
- делают заключение о целостности участков генома вируса бешенства и, как следствие, о полноте инактивации антигена.
2. Способ по п. 1, отличающийся тем, что на этапе выделения РНК вируса бешенства соотношения объемов образца, 100% карболовой кислоты, 4 М гуанидинизотиоцианата, хладона-20, 100% пропанола-2, 80% этилового спирта и буфера ТЕ составляют 1:4:4:2:4:2:1.
3. Способ по п. 1, отличающийся тем, что в выделенных экстрактах РНК вируса бешенства оценивают содержание остатков фосфолипидов, полисахаридов и ГТЦ, карболовой кислоты, полипептидов и крупных взвешенных частиц, определяя значения оптической плотности при длинах волны 205, 235, 270, 280 и 320 нм, соответственно.
4. Способ по п. 1, отличающийся тем, что смесь компонентов для проведения обратной транскрипции включает в свой состав следующие компоненты: хлорид магния - 5 мМ, буферный раствор Buffer II (Applied Biosystems™ GeneAmp™) - 1x, дезоксирибонуклеозидтрифосфаты - по 1,0 мМ каждого, универсальные праймеры Random Hexamers - 2,5 мкМ, M-MuLV-обратная транскриптаза - 2,5 ед./мкл, ингибитор РНКаз RNase Inhibitor - 1 ед./мкл реакционной смеси. Содержание деионизированной воды составляет 1/20, а элюата РНК - 1/10 от объема смеси.
5. Способ по п. 1, отличающийся тем, что смесь компонентов для проведения полимеразной цепной реакции включает в свой состав следующие компоненты: хлорид магния - 3 мМ, Реакционный буфер Buffer Go Taq Flexi Green (Promega) - 1x, дезоксирибонуклеозидтрифосфаты - по 0,25 мМ, оригинальные forward-RABV- и reverse-RABV-праймеры - по 20 пМ, универсальные forward-3D-FMDV- и reverse-3D-FMDV-праймеры (OIE) - по 20 пМ, Taq ДНК-полимераза - 2,5 ед./мкл реакционной смеси. Содержание деионизированной воды составляет 26%, а комплементарной ДНК вируса бешенства - 3/25 от объема смеси.
6. Способ по п. 1, отличающийся тем, что для оценки полноты инактивации антигена вируса бешенства при проведении ПЦР используют следующие системы оригинальных праймеров для вируса бешенства: 1) Shift_Oligo-NR1069 (для участка высококонсервативного гена N); 2) PF1807-MR3020 (для участка, захватывающего гены Р и М); 3) GF3471-ΨR5520 (для участка вариабельного фрагмента гена G и Ψ-региона); 4) LF5499-LR6290 и 5) LF8085-LR9954 (для участков L-гена, несущего информацию о РНК-зависимой ДНК-полимеразе). Указанные системы праймеров позволяют амплифицировать ПЦР-продукты вируса бешенства с размерами 1010, 1214, 2050, 792, 1890, соответственно.
7. Способ по п. 1, отличающийся тем, что ОТ-ПЦР проводят с соблюдением следующих режимов:
- обратная транскрипция: 42°С в течение 60 мин;
- активация Taq ДНК-полимеразы: 94°С в течение 180 с;
- полимеразная цепная реакция (35 циклов):
• денатурация: 94°С в течение 60 с,
• отжиг праймеров: 58°С в течение 60 с,
• элонгация: 72°С в течение 90 с.
- финишная денатурация: 72°С в течение 180 с.
8. Способ по п. 1, отличающийся тем, что с помощью результатов электрофореза в 1,5%-ном агарозном геле и добавлением 0,0005% бромистого этидия оценивают полноту инактивации вируса бешенства: при наличии флуоресцирующих ампликонов, полученных в ПЦР при использовании 5 систем оригинальных праймеров, образец вирулентен, при отсутствии светящихся продуктов ПЦР во всех 5 системах праймеров образец инактивирован.
| РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli TG1(pRVMoscow3253G-L) ДЛЯ ПОЛУЧЕНИЯ НАБОРА ПЦР-СТАНДАРТОВ И НАБОР ПЦР-СТАНДАРТОВ ДЛЯ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ШТАММА ВИРУСА БЕШЕНСТВА "Москва 3253" В РАБИЧЕСКОМ АНТИГЕНЕ | 2012 |
|
RU2511029C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФИКСИРОВАННОГО ВИРУСА БЕШЕНСТВА ШТАММА "МОСКВА 3253" | 2012 |
|
RU2511440C2 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ ДЛЯ ВЫЯВЛЕНИЯ РНК ВИРУСА БЕШЕНСТВА И СПОСОБ ВЫЯВЛЕНИЯ РНК ВИРУСА БЕШЕНСТВА С ПОМОЩЬЮ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ОБРАТНОЙ ТРАНСКРИПЦИЕЙ (ОТ-ПЦР) | 2014 |
|
RU2575088C1 |
| CN 103353526 B, 21.10.2015 | |||
| CN 108342368 A, 31.07.2018. | |||
Авторы
Даты
2021-04-16—Публикация
2020-11-02—Подача