УРОВЕНЬ ТЕХНИКИ
У людей присутствует три изоформы TGF-beta: TGF-beta 1, TGF-beta 2 и TGF-beta 3. Изоформы гомологичны и имеют идентичность последовательности ~70%. Все они синтезируются и секретируются в виде латентного комплекса, в котором TGF-beta образует комплекс с двумя другими полипептидами, латентным TGF-beta-связывающим белком (LTBP) и латентно-ассоциированным пептидом (LAP) (белок, полученный из N-концевой области продукта гена TGF-beta). Сывороточные протеиназы, такие как плазмин, катализируют высвобождение активного зрелого TGF-beta из комплекса.
В своих активных формах изоформы TGF-beta существуют в виде гомодимерного белка ~25 кДа. Все 3 изоформы передают сигнал через одинаковые трансмембранные рецепторы, TbetaRI и TbetaRII. Сначала TGF-beta связывается с TbetaRII, который затем образует гетеротетрамерный комплекс с TbetaRI, что приводит к фосфорилированию TbetaRI и активации последующих сигнальных путей (см. Derynck & Miyazono (eds), 2008, The TGF-beta Family, Cold Spring Harbor Press). Несмотря на сигнализацию через один и тот же рецепторный комплекс, у трех изоформ были отмечены различные неперекрывающиеся функции, которые можно проиллюстрировать на примере мышей, содержащих генетические делеции индивидуальных изоформ, каждая из которых имеет отличный фенотип (Shull et al., 1992, Nature 359: 693-699, Sanford et al., 1997, Development 124: 2659-2670; Proetzel et al., 1995, Nature Genet., 11: 409-414).
TGF-beta представляет собой плеотропную молекулу, участвующую в ряде биологических процессов. TGF-beta ингибирует пролиферацию многих типов клеток, включая эпителиальные, эндотелиальные, гематопоэтические и иммунные клетки. Эффекторные функции иммунных клеток также реактивны в отношении TGF-beta, и TGF-beta подавляет дифференцировку клеток Th1 и Th2, стимулируя клетки Treg, поэтому TGF-beta обладает преимущественно иммуносупрессивной функцией (Li et al., 2006, Ann Rev Immunol., 24: 99-146, Rubtsov & Rudensky, 2007, Nat Rev Immunol., 7: 443-453). Экспрессия TGF-beta подвержена сильной регуляции и участвует в поддержании тканевого гомеостаза. Однако хроническая сверхэкспрессия TGF-beta связана с управлением прогрессии заболевания в таких болезненных состояниях, как злокачественное новообразование и фиброз.
Благодаря роли человеческого TGF-beta во множестве человеческих расстройств были разработаны терапевтические стратегии для ингибирования или противодействия активности TGF-beta. В частности, искали антитела, которые связываются и нейтрализуют TGF-beta, в качестве средства для ингибирования активности TGF-beta. В данной области известны антитела против TGF-beta. Системно введенное антитело против TGF-beta1 (CAT-192) оценивали в фазе I/II клинических испытаний у пациентов с системным склерозом без каких-либо доказательств эффективности с дозами до 10 мг/кг (Denton et al., 2007, Arthritis Rheum, 56: 323-333). Гуманизированное антитело (TbetaM1), оптимизированное для активности против TGF-beta1, оценивали в Фазе 1 клинических испытаний у пациентов с метастатическим злокачественным новообразованием, но при этом не было отмечено никакого противоопухолевого эффекта (Cohn et al., 2014, Int J Oncol., 45: 2221- 2231). Человеческое антитело против TGF-beta2 (CAT-152) оценивали для профилактики рубцевания после трабекулэктомии, но различия между плацебо не отмечались (CAT-152 0102 Trabeculectomy Study Group, 2007, Ophthalmology, 114: 1822-1830). Для лечения некоторых видов злокачественного новообразования и фиброзного заболевания было исследовано системное введенное полноразмерного IgG, специфичного к TGF-beta1, 2 и 3 (Fresolimumab, GC1008). Однако сообщалось о побочных эффектах, включающих поражения кожи, которые, по-видимому, связаны с системной доставкой антитела (Lacouture et al., 2015, Cancer Immunol Immunother., 64: 437-446).
Фиброз является аберрантным ответом на заживление ран, при котором в органе или ткани образуется избыточная фиброзная соединительная ткань. На стадии ремоделирования при нормальном заживлении ран синтез нового коллагена превышает скорость его деградации, что приводит к образованию рубцов. Конечным процессом нормального заживления ран является рассасывание рубца, которое происходит за счет сочетания уменьшения синтеза коллагена и повышенной деградации коллагена, процесса, контролируемого матриксными металлопротеиназами (ММР) и тканевыми ингибиторами металлопротеиназ (TIMPS), которые продуцируются гранулоцитами, макрофагами, эпидермальными клетками и миофибробластами. Таким образом, заживление ран включает в себя сдвиг метаболического равновесия от стимулирования депонирования с последующим разрушением. Любое нарушение этого равновесия может привести к чрезмерному депонированию матриксных компонентов, что приводит к отверждению и рубцеванию тканей и к разрушению нормальной тканевой архитектуры, и к нарушению тканевой функции; это нарушение называют фиброзом.
Аномальные эпителиально-мезенхимальные взаимодействия, измененные фенотипы фибробластов, увеличенная пролиферация фибробластов и чрезмерное депонирование коллагена и внеклеточного матрикса представляют собой все ключевые процессы, которые способствуют фиброзному заболеванию. Ключевым типом клеток в этом процессе являются миофибробласты. Активация миофибробластов приводит к повышенной секреции ими коллагена I, III и IV типов, фибронектина, ламинина и протеогликанов. Другие типы клеток, которые, как считается, играют важную роль в фиброзе, включают эпителиальные клетки и макрофаги. TGF-beta считается основным регулятором фиброза и способствует фиброзному процессу посредством действий на нескольких типах клеток, включающих макрофаги и фибробласты (Leask & Abraham, 2004, FASEB J., 18: 816-827). Ключевые профиброзные активности включают стимулирование миграции фибробластов и трансформацию фибробластов в миофибробласты, стимулирование чрезмерного депонирования ECM. TGF-beta также участвует в миграции макрофагов и стимулирует продуцирование макрофагами мезенхимальных факторов роста, таких как PDGF, а также ингибирует деградацию ECM за счет повышенной экспрессии ингибиторов протеаз, таких как TIMP3.
Фиброзные заболевания являются основной причиной заболеваемости и смертности и могут влиять на многие системы тканей и органов. В эту группу заболеваний включены интерстициальные заболевания легких. Идиопатический легочный фиброз (IPF) является наиболее распространенной формой интерстициальных заболеваний легких и относится к одной из семи отдельных групп идиопатических интерстициальных пневмоний (IIP). Интерстиций представляет собой микроскопическое пространство между базальными мембранами альвеолярного эпителия и капиллярного эндотелия и образует часть альвеолярно-капиллярного барьера. IIP характеризуются расширением интерстициального компартмента воспалительными клетками, с ассоциированным фиброзом, особенно отмеченным для IPF.
У пациентов с IPF проявляется прогрессирующая напряженная одышка и кашель с прогрессирующим легочным паренхимным фиброзом, что приводит к легочной рестрикции и гипоксемии. Диагноз IPF устанавливается с использованием комбинации клинических, рентгенологических и патологических критериев и связан с характерной патологической картиной, называемой обычной интерстициальной пневмонией (UIP).
IPF можно диагностировать в любом возрасте, но наиболее распространен у лиц старше 50 лет, а распространенность среди мужчин выше, чем у женщин. При IPF уровень смертности выше, чем при многих неопластических заболеваниях, при этом коэффициент выживаемости в течение 3 лет составляет 50%, а выживаемость в течение 5 лет составляет всего 20%. Причина IPF неизвестна, но предполагается, что существует несколько эпизодов активации эпителиальных клеток от еще неидентифицированных экзогенных и эндогенных стимулов, которые, если их не подвергать лечению, приводят к прогрессирующим повреждениям легких и в конечном счете к фиброзу. Нарушение альвеолярного эпителия вызывает миграцию, пролиферацию и активацию мезенхимальных клеток, что приводит к образованию фибробластных/миофибробластных очагов с чрезмерным накоплением ECM.
Экспрессия TGF-beta увеличивается в фиброзных легких пациентов с IPF (Broekelmann et al., 1991, PNAS, 88: 6642-6646, Khalil et al., 1991, Am J Respir Cell Mol Biol, 5: 155-162) и наряду с хорошо известной ролью TGF-beta в управлении фиброзных механизмов, ингибирование TGF-beta следует рассматривать как эффективный механизм лечения пациентов с IPF.
Для пациентов с IPF не существует эффективной терапии. Противовоспалительные агенты, включающие кортикостероиды, циклофосфамид и азотиаприн, оказались мало полезными для пациентов и имели связанные побочные эффекты. Недавно были одобрены два низкомолекулярных лекарственных средства, пирфенидон и нинтеданиб для лечения IPF. Было показано, что оба лекарственных средства замедляют прогрессирование заболевания, но не излечивают заболевание, и у многих пациентов продолжается ухудшение. Кроме того, очевидны побочные явления, связанные с лечением, такие как желудочно-кишечные расстройства, сыпь и светочувствительность (Cottin and Maher, 2015, Eur Respir Rev, 24: 58-64, Mazzei et al., 2015, Ther Adv Respir Dis.) На сегодняшний момент для фиброзных проявлений нет никаких направленных терапий и нет терапий антителами.
Кроме того, TGF-beta также ассоциирован с легочной гипертензией, такой как легочная артериальная гипертензия (PAH). Повышенная экспрессия TGF-beta у пациентов с легочной гипертензией была продемонстрирована иммуногистохимией (Botney et al., 1994, Am J Pathol, 144: 286-295), а также была отмечена в гомогенатах крови и легких пациентов с легочной гипертензией (Selimovic et al.., 2009, Eur Respir J, 34: 662-668, Gore et al., PLOS One (2014) 9 (6): e100310). Также было показано, что киназный ингибитор TbetaRI ингибирует модель легочной гипертензии, индуцированную монокроталином (Zaiman et al., 2008, Am J Respir Crit Care Med, 177: 896-905). Легочная гипертензия является хорошо изученным осложнением IPF, и эти данные подтверждают гипотезу о том, что пациенты IPF, симптомы которых обусловлены как интерстициальным фиброзом, так и легочной гипертензией, могут относиться к подгруппе пациентов, для которых терапия против TGF-beta может быть потенциально еще более эффективной.
Следовательно, существует потребность в подходящих и/или улучшенных антителах, способных связывать и ингибировать все три изоформы TGF-beta, подходящих для терапевтических применений. Такие антитела также могут быть более эффективными для лечения легочных симптомов и/или иметь меньше побочных эффектов при их доставке путем ингаляции.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым TGF-beta-специфичным антителам и их связывающим фрагментам, в частности к антагонистическим антителам и фрагментам.
В одном аспекте предложено антагонистическое антитело, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее тяжелую цепь, где вариабельный домен тяжелой цепи содержит по меньшей мере одну из CDR, имеющую последовательность, приведенную в SEQ ID NO: 4 для CDR-H1, CDR, имеющую последовательность, приведенную в SEQ ID NO: 5 для CDR-H2, и CDR, имеющую последовательность, приведенную в SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: ID NO: 8 или SEQ ID NO: 9 для CDR-H3.
В одном аспекте предложено антагонистическое антитело, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее легкую цепь, где вариабельный домен легкой цепи содержит по меньшей мере одну из CDR, имеющую последовательность, приведенную в SEQ ID NO: 1 для CDR-L1, CDR, имеющую последовательность, приведенную в SEQ ID NO: 2 для CDR-L2, и CDR, имеющую последовательность, приведенную в SEQ ID NO: 3 для CDR-L3.
Раскрытие также распространяется на полинуклеотид, такой как ДНК, кодирующий антитело или фрагмент, как описано в настоящем документе.
Также предложена клетка-хозяин, содержащая указанный полинуклеотид.
В настоящем описании предложены способы экспрессии антитела или его связывающего фрагмента.
Настоящее раскрытие также относится к фармацевтическим композициям, содержащим указанные антитела или их связывающие фрагменты.
В одном варианте осуществления предложен способ лечения, включающий введение терапевтически эффективного количества антитела, фрагмента или композиции, как описано в настоящем документе.
Настоящее раскрытие также распространяется на антитело, связывающий фрагмент или композицию в соответствии с настоящим изобретением для применения при лечении, конкретно, при лечении злокачественного новообразования и/или фиброзного заболевания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигурах 1 A-I представлены определенные аминокислотные и полинуклеотидные последовательности антитела по изобретению.
На Фигуре 1А представлены последовательности CDR из антитела 4856 (SEQ ID NO: 1-9).
На Фигуре 1В представлены кроличьи последовательности для антитела 4856 (SEQ ID NO: 10-25).
На Фигуре 1С представлены муринизированные последовательности для антитела 4856 (SEQ ID NO: 26-33), а также мышиные акцепторные последовательности (SEQ ID NO: 34-37).
На Фигуре 1D представлена легкая цепь (SEQ ID NO: 45-51) и последовательности вариабельных областей (SEQ ID NO: 38-44) для антитела 4856 gL3.
На Фигуре 1Е представлена тяжелая цепь Fab (SEQ ID NO: 59-65) и последовательности вариабельных областей (SEQ ID NO: 52-58) для антитела 4856 gH13.
На Фигуре 1F представлена тяжелая цепь Fab (SEQ ID NO: 73-79) и последовательности вариабельных областей (SEQ ID NO: 66-72) для антитела 4856 gH20.
На Фигуре 1G представлена тяжелая цепь Fab (SEQ ID NO: 87-93) и последовательности вариабельных областей (SEQ ID NO: 80-86) для антитела 4856 gH23.
На Фигуре 1H представлены тяжелые цепи Fab (SEQ ID NO: 101-107) и последовательности вариабельных областей (SEQ ID NO: 94-100) для антитела 4856 gH29.
На Фигуре 1I представлены человеческие акцепторные каркасные последовательности (SEQ ID NO: 108-111).
На Фигуре 2 представлены выравнивания аминокислотных последовательностей различных легкой цепи (Фигура 2А) и тяжелой цепи (Фигура 2В) антитела 4856 и акцепторных последовательностей.
На Фигуре 3А представлена аминокислотная последовательность человеческого латентно-ассоциированного пептида и TGF-beta 1.
На Фигуре 3В представлена аминокислотная последовательность зрелого человеческого TGF-beta 1.
На Фигуре 3С представлена аминокислотная последовательность человеческого латентно-ассоциированного пептида и TGF-beta 2.
На Фигуре 3D представлена аминокислотная последовательность зрелого человеческого TGF-beta 2.
На Фигуре 3Е представлена аминокислотная последовательность человеческого латентно-ассоциированного пептида и TGF-beta 3.
На Фигуре 3F представлена аминокислотная последовательность зрелого человеческого TGF-beta 3.
На Фигурах 4А, В и С показан эффект кроличьего антитела 4856 Fab в анализе репортерного гена HEK-Blue-TGF-beta для (A) TGF-beta1, (B) TGF-beta2 и (C) TGF-beta3.
На Фигуре 5 показан эффект кроличьего Fab 4856 в анализе репортерного гена в совместной культуре BxPC3-HEK-Blue с эндогенным TGF-beta.
На Фигуре 6 показаны изображения депонирования ECM клетками HRMC в ответ на 10 нМ адриамицин и в присутствии возрастающих концентраций 4856 Fab-трансплантатов gL3gH13, gL3gH20, gL3gH23 и gL3gH29 или контрольного Fab.
На Фигурах 7A, B и C показано влияние 4856 Fab-трансплантатов gL3gH13, gL3gH20, gL3gH23 и gL3gH29 на депонирование (A) фибронектина, (B) коллагена I и III и (C) коллагена IV из HRMC, обработанных адриамицином.
На Фигуре 8 показаны изображения депонирования ECM с помощью совместных культур SAEpC и фибробластов IPF в присутствии возрастающих концентраций 4856 Fab-трансплантата gL3gH13 и контрольного Fab.
На Фигурах 9А, В и С показано влияние 4856 Fab-трансплантата gL3gH13 и контрольного Fab на депонирование (A) фибронектина, (B) коллагена I и III и (C) коллагена IV из совместных культур SAEpC и фибробластов IPF.
На Фигурах 10А, В и С показано влияние 4856 Fab-трансплантата gL3gH13 на ингибирование депонирования фибронектина из монокультуры человеческих почечных проксимальных трубчатых эпителиальных клеток, индуцированное (A) TGF-beta 1, (B) TGF-beta 2 и (C) TGF-beta 3.
На Фигуре 10D показано влияние 4856 Fab-трансплантата gL3gH13 на ингибирование депонирования фибронектина из совместной культуры человеческих почечных проксимальных трубчатых эпителиальных клеток и фибробластов почек человека.
На Фигуре 11А и В показано влияние 4856 Fab-трансплантата gL3gH13 на ингибирование депонирования TGF-beta 1-индуцированного (A) коллагена I и III, (B) коллагена V из монокультуры человеческих почечных проксимальных трубчатых эпителиальных клеток.
Фигура 12 Сравнение эффекта интраназального введения указанных 4856 Fab на экспрессию PAI-1 у мышей на 7-й день после введения блеомицина.
Фигура 13 Сравнение дозы интраназально введенного 4856 Fab gL3gH13 в отношении экспрессии PAI-1 у мышей на 7-й день после введения блеомицина.
Фигуры 14A-B Эффект интраназально введенного 4856 Fab gL3gH13 с 1 по 28 день на A) индуцированное блеомицином депонирование коллагена (окрашивание PSR) и (B) содержание гидроксипролина в легком.
Фигура 15A-B. Эффект интраназально введенного 4856 Fab gL3gH13 с 13 по 28 день на A) индуцированное блеомицином депонирование коллагена (окрашивание PSR) и B) содержание гидроксипролина в легком.
Фигуры 16A-B. Эффект интраназально введенного 4856 Fab gL3gH13, A) с 1 по 28 день или B) с 13 по 28 день на индуцированную блеомицином дифференцировку миофибробластов в легких.
Фигуры 17A-B. Эффект интраназально введенного 4856 Fab gL3gH13 A) с 1 по 28 день или B) с 13 по 28 день на индуцированную блеомицином экспрессию pSmad2/3 в клетках, экспрессирующих коллаген типа 1.
На Фигуре 18А показана последовательность зрелого человеческого TGF-beta 1 (SEQ ID NO: 114) с остатками, участвующими во взаимодействии с 4856 Fab gL3gH13 (подчеркнуто), и остатками, критичными для взаимодействия с TbetaRI и TbetaRII (полужирный шрифт) с использованием кристаллографических данных с разрешением 4Å.
На Фигуре18В показана последовательность зрелого человеческого TGF-beta 1 (SEQ ID NO: 114) с остатками, участвующими во взаимодействии с 4856 Fab gL3gH13 (подчеркнуто), и остатками, критичными для взаимодействия с TbetaRI и TbetaRII (жирный шрифт) с использованием кристаллографических данных с разрешением 5Å.
На Фигуре 18С показана последовательность зрелого человеческого TGF-beta 2 (SEQ ID NO: 116).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Антитела по настоящему изобретению связываются с TGF-beta 1, TGF-beta 2 и TGF-beta 3. В одном варианте осуществления антитела по настоящему изобретению связывают все три изоформы зрелого TGF-beta, зрелого TGF-beta 1 (SEQ ID NO: 114), зрелого TGF-beta 2 (SEQ ID NO: 115) и зрелого TGF-beta 3 (SEQ ID NO: 118). В одном варианте осуществления антитела по настоящему изобретению связываются с гомодимером каждой из трех изоформ зрелого TGF-beta, гомодимером зрелого TGF-beta 1 (SEQ ID NO: 114), гомодимером зрелого TGF-beta 2 (SEQ ID NO: 115) и гомодимером зрелого TGF-beta 3 (SEQ ID NO: 118). В одном варианте осуществления антитела по настоящему изобретению не связываются с латентными формами TGF-beta 1, TGF-beta 2 и TGF-beta 3, содержащими латентно-ассоциированный пептид (LAP), как показано в SEQ ID NO: 113, SEQ ID NO: ID NO: 115 и SEQ ID NO: 117.
В одном варианте осуществления антитела, описанные в настоящем документе, являются антагонистическими. Используемый в настоящем описании термин «антагонистическое антитело» описывает антитело, которое способно ингибировать и/или нейтрализовывать биологическую сигнальную активность TGF-beta 1, TGF-beta 2 и TGF-beta 3, например, путем блокирования связывания или, по существу, путем уменьшения связывания TGF-beta 1, TGF-beta 2 и TGF-beta 3 с TbetaRI и/или TbetaRII и, таким образом, путем ингибирования образования и активации рецепторного комплекса TGF-beta.
Анализы, подходящие для определения способности антитела ингибировать и/или нейтрализовать биологическую сигнальную активность TGF-beta 1, TGF-beta 2 и TGF-beta 3, представлены в примерах настоящего описания, например, анализ репортерного гена HEK-Blue TGF-beta с использованием рекомбинантного TGF-beta 1, 2 и/или 3, описанный в Примере 1 и Примере 2, или анализ репортерного гена в совместной культуре BxPC3 и HEK-Blue TGF-beta, обусловленный продуцированием TGF-beta клетками BvPC3, описанный в Примере 3.
В одном варианте осуществления молекулы антител по настоящему изобретению обладают ингибирующей активностью в анализе репортерного гена HEK-Blue TGF-beta с рекомбинантным TGF-beta 1, TGF-beta 2 или TGF-beta 3, где антитело ингибирует активность человеческого TGF-beta 1 с IC50 0,5 нМ или лучше, ингибирует активность человеческого TGF-beta2 с IC50 0,05 нМ или лучше и ингибирует активность человеческого TGF-beta 3 с IC50 2 нМ или лучше. В одном варианте осуществления антитело ингибирует TGF-beta в анализе репортерного гена HER-Blue TGF-beta с эндогенным TGF-beta с IC50 10 нм или лучше.
Молекулы антител по настоящему изобретению соответственно имеют высокую аффинность связывания. Аффинность может быть измерена с использованием любого подходящего способа, известного в данной области, включая такие методы, как поверхностный плазмонный резонанс, например BIAcore, как описано в примерах в настоящем документе, с использованием выделенных природных или рекомбинантных TGF-beta 1, TGF-beta 2 и TGF-beta 3 или подходящего слитого белка/полипептида. В одном варианте осуществления молекулы антитела по настоящему изобретению имеют следующий порядок аффинности связывания, с наиболее высоким значением для человеческого TGF-beta 1, за которым следует человеческий TGF-beta 2, и с наименьшей аффинностью связывания для человеческого TGF-beta 3. В одном варианте осуществления молекулы антитела по настоящему изобретению имеют аффинность связывания для человеческого TGF-beta 1, которая составляет в 10-30 раз выше, например в 15-25 раз выше, чем аффинность связывания для человеческого TGF-beta 3. В одном варианте осуществления молекулы антител по настоящему изобретению имеют аффинность связывания для человеческого TGF-beta 2, которая в 2-20 раз выше, например в 5-15 раз выше, чем аффинность связывания для человеческого TGF-beta 3.
Соответственно молекулы антител по настоящему изобретению имеют аффинность связывания для выделенных TGF-beta 1, TGF-beta 2 и TGF-beta 3 примерно 2000 пМ или менее чем 2000 пМ. В одном варианте осуществления молекула антитела по настоящему изобретению имеет аффинность связывания для человеческого TGF-beta 1 500 пМ или менее, например 200 пМ или менее, или 100 пМ или менее. В одном варианте осуществления молекула антитела по настоящему изобретению имеет аффинность связывания для человеческого TGF-beta 2 500 пМ или менее, например 300 пМ или менее, 200 пМ или менее. В одном варианте осуществления молекула антитела по настоящему изобретению имеет аффинность связывания для человеческого TGF-beta 3 3000 пМ или менее, например 2500 пМ или менее, 2000 пМ или менее.
В одном варианте осуществления антитело по настоящему изобретению имеет аффинность связывания для человеческого TGF-beta 1 100 мкМ или менее, аффинностью связывания для человеческого TGF-beta 2 200 пМ или менее и аффинность связывания для человеческого TGF-beta 3 2000 пМ или лучше.
Чем ниже числовое значение аффинности, тем выше аффинность антитела или фрагмента для изоформы TGF-beta.
Авторами настоящего изобретения предложены новые антитела против TGF-beta, включая гуманизированные антитела. Антитела были получены в результате иммунизации кроликов зрелым TGF-beta 1 и зрелым TGF-beta 2.
Остатки в вариабельных доменах антитела обычно нумеруются в соответствии с системой, разработанной Kabat et al., 1987. Эта система изложена в Kabat et al., 1987, in Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, NIH, USA (далее «Kabat et al. (выше)»). Эта система нумерации используется в настоящей спецификации, если не указано иное.
Обозначения остатков по Kabat не всегда прямо соответствуют линейной нумерации аминокислотных остатков. Фактическая линейная аминокислотная последовательность может содержать меньше или дополнительные аминокислоты, чем в строгой нумерации Kabat, соответствуя укорочению или вставке в структурный компонент, будь то каркасная область или область определения комплементарности (CDR) основной структуры вариабельного домена. Правильная нумерация остатков по Kabat может быть определена для данного антитела путем выравнивания остатков гомологии в последовательности антитела в соответствии со «стандартной» нумерацией по Kabat.
CDR вариабельного домена тяжелой цепи расположены в остатках 31-35 (CDR-H1), остатках 50-65 (CDR-H2) и остатках 95-102 (CDR-H3) в соответствии с системой нумерации Kabat. Однако, согласно Chothia (Chothia, C. and Lesk, AM, J. Mol. Biol., 196, 901-917 (1987)), петля, эквивалентная CDR-H1, простирается от остатка 26 до остатка 32. Таким образом, если не указано иное, «CDR-H1», используемый в настоящем описании, предназначен для обозначения остатков 26-35, как описано комбинацией системы нумерации Kabat и определения топологической петли Chothia.
CDR вариабельного домена легкой цепи расположены в остатках 24-34 (CDR-L1), остатках 50-56 (CDR-L2) и остатках 89-97 (CDR-L3) в соответствии с системой нумерации Kabat.
Антитела для использования в настоящем раскрытии могут быть получены с использованием любого подходящего способа, известного в данной области. Полипептид/белок TGF-beta, включая слитые белки, клетки, экспрессирующие (рекомбинантно или естественно) полипептид, могут быть использованы для получения антител, которые специфически распознают TGF-beta. Полипептид может быть «зрелым» полипептидом TGF-beta 1, TGF-beta 2 и TGF-beta 3, как показано в SEQ ID NO: 113, 115 и 117, или может быть его биологически активным фрагментом или его производным. Полипептиды, используемые для иммунизации хозяина, могут быть получены способами, хорошо известными в данной области, из генетически сконструированных клеток-хозяев, содержащих экспрессирующие системы, или они могут быть выделены из природных биологических источников. В настоящей заявке термин «полипептиды» включает пептиды, полипептиды и белки. Они используются взаимозаменяемо, если не указано иное. Полипептид TGF-beta в некоторых случаях может быть частью более крупного белка, такого как слитый белок, например, слитый с аффинным маркером, лидерной последовательностью или другой последовательностью.
Антитела, сгенерированные против полипептида TGF-beta, могут быть получены в случае, где необходима иммунизация животного, путем введения полипептидов животному, предпочтительно животному, отличному от человека, с использованием хорошо известных и обычных протоколов, см., например, Handbook of Experimental Immunology, D. M. Weir (ed.), Vol 4, Blackwell Scientific Publishers, Oxford, England, 1986). Могут быть иммунизированы многие теплокровные животные, такие как кролики, мыши, крысы, овцы, коровы, верблюды или свиньи. Однако наиболее приемлемыми являются мыши, кролики, свиньи и крысы.
Моноклональные антитела могут быть получены любым способом, известным в данной области, таким как метод гибридом (Kohler & Milstein, 1975, Nature, 256: 495-497), метод триом, метод гибридом B-клеток человека (Kozbor et al., 1983, Immunology Today, 4:72) и метод EBV-гибридом (Cole et al., 1985, Monoclonal Antibodies and Cancer Therapy, pp77-96, Alan R Liss, Inc.).
Антитела также могут быть получены с использованием метода антитела из одиночного лимфоцита путем клонирования и экспрессии кДНК вариабельной области иммуноглобулина, полученной из одиночных лимфоцитов, отобранных для получения конкретных антител, например, способами, описанными Babcook, J. et al., 1996, Proc. Natl. Acad. Sci. USA 93: 7843-7848; WO92/02551; WO04/051268 и в международной патентной заявке WO 04/106377.
Скрининг на антитела может быть проведен с использованием анализов для измерения связывания с человеческим TGF-beta и/или анализов для измерения способности блокировать связывание лиганда с рецептором. Примеры подходящих анализов описаны в примерах, приведенных в настоящем документе.
Используемый в настоящем описании термин «специфичный» относится к антителу, которое распознает только антиген, к которому он специфичен, или антитело, которое имеет значительно более высокую аффинность связывания с антигеном, к которому оно специфично, по сравнению со связыванием с антигенами, к которым оно не специфично, например, по меньшей мере в 5, 6, 7, 8, 9, 10 раз более высокую аффинность связывания.
Аминокислотные последовательности и полинуклеотидные последовательности некоторых антител в соответствии с настоящим изобретением представлены на Фигурах 1 и 2.
В одном аспекте изобретения антитело представляет собой антагонистическое антитело, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее тяжелую цепь, где вариабельный домен тяжелой цепи содержит по меньшей мере одну из CDR, имеющую последовательность, приведенную в SEQ ID NO: 4 для CDR-H1, CDR, имеющую последовательность, приведенную в SEQ ID NO: 5 для CDR-H2 и CDR, имеющую последовательность, приведенную в SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9 для CDR-H3. Предпочтительно, вариабельный домен тяжелой цепи содержит последовательность, приведенную в SEQ ID NO: 4 для CDR-H1, последовательность, приведенную в SEQ ID NO: 5 для CDR-H2, и последовательность, приведенную в SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9 для CDR-H3.
Во втором аспекте изобретения антитело представляет собой антагонистическое антитело, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее легкую цепь, где вариабельный домен легкой цепи содержит по меньшей мере одну CDR, имеющую последовательность, приведенную в SEQ ID NO: 1 для CDR-L1, CDR, имеющую последовательность, приведенную в SEQ ID NO: 2 для CDR-L2, и CDR, имеющую последовательность, приведенную в SEQ ID NO: 3 для CDR- L3. Предпочтительно, вариабельный домен легкой цепи содержит последовательность, приведенную в SEQ ID NO: 1 для CDR-L1, последовательность, приведенную в SEQ ID NO: 2 для CDR-L2, и последовательность, приведенную в SEQ ID NO: 3 для CDR-L3,
Молекулы антител по настоящему изобретению соответственно содержат комплементарную легкую цепь или комплементарную тяжелую цепь, соответственно.
В одном варианте осуществления антитело по изобретению представляет собой антагонистическое антитело, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее тяжелую цепь, как определено выше, и дополнительно содержит легкую цепь, где вариабельный домен легкой цепь содержит по меньшей мере одну из CDR, имеющую последовательность, приведенную в SEQ ID NO: 1 для CDR-L1, CDR, имеющую последовательность, приведенную в SEQ ID NO: 2 для CDR-L2, и CDR, имеющую последовательность, приведенную в SEQ ID NO: 3 для CDR-L3. Вариабельный домен легкой цепи предпочтительно включает последовательность, приведенную в SEQ ID NO: 1 для CDR-L1, последовательность, приведенную в SEQ ID NO: 2 для CDR-L2, и последовательность, приведенную в SEQ ID NO: 3 для CDR-L3.
В одном варианте осуществления антитело по изобретению представляет собой антагонистическое антитело, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее тяжелую цепь и легкую цепь, где вариабельный домен тяжелой цепи содержит последовательность, приведенную в SEQ ID NO: 4 для CDR-H1, последовательность, приведенную в SEQ ID NO: 5 для CDR-H2, и последовательность, приведенную в SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9 для CDR-H3; и где вариабельный домен легкой цепи содержит последовательность, приведенную в SEQ ID NO: 1 для CDR-L1, последовательность, приведенную в SEQ ID NO: 2 для CDR-L2, и последовательность, приведенную в SEQ ID NO: 3 для CDR- L3.
Понятно, что одна или более аминокислотных замен, вставок и/или делеций могут быть сделаны в CDR, предоставленных настоящим изобретением, без значительного изменения способности антитела связываться с TGF-beta 1, TGF-beta 2 и TGF-beta 3 и нейтрализовать активность TGF-beta 1, TGF-beta 2 и TGF-beta 3. Эффект любых аминокислотных замен, вставок и/или делеций может быть легко протестирован специалистом в данной области, например, с использованием описанных в настоящем документе способов, особенно тех, которые приведены в примерах, для определения связывания TGF-beta 1, TGF-beta 2 и TGF-beta 3 и ингибирования взаимодействия TGF-beta 1, TGF-beta 2 и TGF-beta 3 и рецептора. В одном варианте осуществления по меньшей мере одна аминокислота заменена консервативной заменой в одной или более CDR, выбранных из группы, независимо состоящей из:
любой из CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2, CDR-L3;
любой из комбинаций CDR-H1 и H2, CDR-H1 и H3, CDR-H1 и L1, CDR-H1 и L2, CDR-H1 и L3, CDR-H2 и H3, CDR-H2 и L1, CDR-H2 и L2, CDR-H2 и L3, CDR-H3 и L1, CDR-H3 и L2, CDR-H3 и L3, CDR-L1 и L2, CDR-L1 и L3, CDR-L2 и L3;
CDR-H1, H2 и H3, CDR-H1, H2 и L1, CDR-H1, H2 и L2, CDR-H1, H2 и L3, CDR-H2, H3 и L1, CDR-H2, H3 и L2, CDR- H2, H3 и L3, CDR-H3, L1 и L2, CDR-H3, L1 и L3, CDR-L1, L2, L3;
любой из комбинаций CDR-H1, H2, H3 и L1, CDR-H1, H2, H3 и L2, CDR-H1, H2, H3 и L3, CDR-H2, H3, L1 и L2, CDR-H2, H3, L2 и L3, CDR-H3, L1, L2 и L3, CDR-L1, L2, L3 и H1, CDR-L1, L2, L3 и H2, CDR-L1, L2, L3 и H3, CDR-L2, L3, H1 и H2,
CDR-H1, H2, H3, L1 и L2, CDR-H1, H2, H3, L1 и L3, CDR-H1, H2, H3, L2 и L3, CDR-L1, L2, L3, H1 и H2, CDR- L1, L2, L3, H1 и H3, CDR-L1, L2, L3, H2 и H3; и
комбинации CDR-H1, H2, H3, L1, L2 и L3.
Соответственно, настоящее изобретение относится к антагонистическому антителу, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащему одну или более CDR, выбранных из CDRH-1 (SEQ ID NO: 4), CDRH-2 ( SEQ ID NO: 5), CDRH-3 (SEQ ID NO: 6 или SEQ ID NO: 7 или SEQ ID NO: 8 или SEQ ID NO: 9), CDRL-1 (SEQ ID NO: 1), CDRL-2 (SEQ ID NO: 2) и CDRL-3 (SEQ ID NO: 3), в которых одна или более аминокислот в одной или более CDR были заменены другой аминокислотой, например сходной аминокислотой, как определено в настоящем описании ниже.
В одном варианте осуществления настоящее изобретение относится к антагонистическому антителу, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащему CDRH-1 (SEQ ID NO: 4), CDRH-2 (SEQ ID NO: 5), CDRH-3 (SEQ ID NO: 6 или SEQ ID NO: 7 или SEQ ID NO: 8 или SEQ ID NO: 9), CDRL-1 (SEQ ID NO: 1), CDRL-2 (SEQ ID NO: 2) и CDRL-3 (SEQ ID NO: 3), например, где одна или более аминокислот в одной или более CDR были заменены другой аминокислотой, такой как сходная аминокислота, как определено в настоящем описании ниже.
В одном варианте осуществления домен тяжелой цепи, описанный в настоящем документе, включает в себя последовательность с 1, 2, 3 или 4 консервативными аминокислотными заменами, например, в каркасе.
В одном варианте осуществления каркас вариабельной области тяжелой цепи содержит 1, 2, 3 или 4 аминокислоты, которые были вставлены, удалены, заменены, или их комбинацию. В одном варианте осуществления заменяющая аминокислота представляет собой соответствующую аминокислоту из донорного антитела.
В одном варианте осуществления раскрытая в настоящем описании вариабельная область легкой цепи включает в себя последовательность с 1, 2, 3 или 4 консервативными аминокислотными заменами, например, в каркасе.
В одном варианте осуществления каркас вариабельной области легкой цепи содержит 1, 2, 3 или 4 аминокислоты, которые были вставлены, удалены, заменены, или их комбинацию. В одном варианте осуществления заменяющая аминокислота представляет собой соответствующую аминокислоту, образующую донорное антитело.
В одном аспекте настоящего изобретения предложено антитело против TGF-beta или его связывающий фрагмент, где вариабельный домен тяжелой цепи содержит три CDR, а последовательность CDR-H1 имеет по меньшей мере 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более идентичности или сходства с последовательностью, приведенной в SEQ ID NO: 4, последовательность CDR-H2 имеет по меньшей мере 60%, 70%, 80%, 90% или 95% идентичности или сходства с последовательностью, приведенной в SEQ ID NO: 5, и последовательность CDR-H3 имеет по меньшей мере 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более идентичности или сходства с последовательностью, приведенной в SEQ ID NO: 6 или SEQ ID NO: 7 или SEQ ID NO: 8 или SEQ ID NO: 9. Предпочтительно антитело против TGF-beta или его связывающий фрагмент дополнительно содержит легкую цепь, где вариабельный домен легкой цепи содержит три CDR, а последовательность CDR-L1 имеет по меньшей мере 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более идентичности или сходства с последовательностью, приведенной в SEQ ID NO: 1, последовательность CDR-L2 имеет по меньшей мере 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более идентичности или сходства с последовательностью, приведенной в SEQ ID NO: 2, и последовательность CDR-L3 имеет по меньшей мере 60% идентичности или сходства с последовательностью, приведенной в SEQ ID NO: 3.
В одном варианте осуществления вариабельная область имеет по меньшей мере 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более идентичности или сходства с раскрытой в настоящем описании вариабельной областью.
В одном варианте осуществления настоящее изобретение относится к антагонистическому антителу, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, которое контактирует с последовательностью, которая по меньшей мере на 90% идентична аминокислотам 24-35 SEQ ID NO: 114 и необязательно по меньшей мере одной из аминокислот 90-95 SEQ ID NO: 114. В следующем варианте осуществления антитело контактирует с последовательностью, которая по меньшей мере на 95%, 96%, 97%, 98%, 99% или 100% идентична SEQ ID NO: 114. В одном варианте осуществления антитело дополнительно контактирует по меньшей мере с одной из аминокислот 60, 97 и 101 SEQ ID NO: 114. Еще в одном варианте осуществления антитело также контактирует с аминокислотами вне аминокислот, представленных в настоящем описании. Под терминами «контактирует» или «контактирование» подразумевается, что взаимодействие может быть обнаружено с использованием стандартных методов рентгеноструктурной кристаллографии при подходящем разрешении, таком как 5Å или 4 Å.
В другом варианте осуществления предложено антитело против TGF-beta, которое конкурирует связыванием антитела или фрагмента по изобретению за связывание с TbetaRI и/или TbetaRII.
В одном варианте осуществления предложено антитело против TGF-beta, которое перекрестно блокирует связывание антитела, содержащего 6 CDR, приведенных в последовательности SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3, SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2 и SEQ ID NO: 6 или SEQ ID NO: 7 или SEQ ID NO: 8 или SEQ ID NO: 9 для CDR-H3, в частности, где перекрестное блокирование является аллостерическим.
В одном варианте осуществления предложено антитело против TGF-beta, которое перекрестно блокирует связывание антитела, содержащего 6 CDR, приведенных в последовательности SEQ ID NO: 1 для CDR-L1, SEQ ID NO: 2 для CDR-L2, SEQ ID NO: 3 для CDR-L3, SEQ ID NO: 4 для CDR-H1, SEQ ID NO: 5 для CDR-H2 и SEQ ID NO: 6 или SEQ ID NO: 7 или SEQ ID NO: 8 или SEQ ID NO: 9 для CDR-H3, в частности, где антитело перекрестно блокирует связывание путем связывания того же эпитопа, что и антитело, которое оно блокирует.
В одном варианте осуществления антитело или связывающий фрагмент взяты из мыши, крысы, кролика, верблюда или других видов млекопитающих. Например, антитело или связывающий фрагмент могут быть кроличьими. Примеры вариабельных областей для таких антител представлены в SEQ ID NO: 10-17.
В одном варианте осуществления антитело или связывающие фрагменты являются химерными. Как правило, химерные антитела или связывающие фрагменты содержат элементы из двух или более видов, сохраняя при этом определенные характеристики этого вида. Например, химерное антитело или связывающий фрагмент может иметь вариабельную область от одного вида, такого как мышь, крыса, кролик или другие виды млекопитающих, и всю или часть константной области от другого вида, такого как человек.
В одном варианте осуществления антитело или связывающие фрагменты согласно изобретению гуманизированы.
Используемый в настоящем описании термин «гуманизированное антитело» относится к антителу или к молекуле антитела, где тяжелая и/или легкая цепь содержит одну или более CDR (включая, если целесообразно, одну или более модифицированных CDR) из донорного антитела (например, мышиного моноклонального антитела), трансплантированных в каркас вариабельной области тяжелой и/или легкой цепи акцепторного антитела (например, человеческого антитела) (см., например, US 5585089, WO 91/09967). Обзор см. Vaughan et al., Nature Biotechnology, 16, 535-539, 1998. В одном варианте осуществления скорее происходит перенос всей CDR, а не только одного или более остатков, определяющих специфичность, из любой из CDR, описанных выше, в каркас человеческих антител (см., например, Kashmiri et al., 2005, Methods, 36: 25-34). В одном варианте осуществления только остатки, определяющие специфичность, из одной или более CDR, описанных выше, переносятся в каркас человеческих антител. В другом варианте осуществления только остатки, определяющие специфичность, из каждой из CDR, описанных выше, переносятся в каркас человеческих антител. Когда трансплантируют CDR или остатки, определяющие специфичность, то может использоваться любая подходящая каркасная последовательность акцепторной вариабельной области с учетом класса/типа донорного антитела, из которого получены CDR, включая каркасные области мыши, примата и человека.
Соответственно, гуманизированное антитело в соответствии с настоящим изобретением содержит вариабельный домен, содержащий человеческие акцепторные каркасные области, а также одну или более CDR, конкретно представленных в настоящем описании. Таким образом, в одном варианте осуществления предложено гуманизированное антитело, которое связывается с человеческими TGF-beta 1, TGF-beta 2 и TGF-beta 3, где вариабельный домен содержит человеческие акцепторные каркасные области и донорные CDR, не относящиеся к человеку.
Примерами человеческих каркасов, которые могут быть использованы в настоящем изобретении, являются KOL, NEWM, REI, EU, TUR, TEI, LAY и POM (Kabat et al., выше). Например, KOL и NEWM могут использоваться для тяжелой цепи, REI может использоваться для легкой цепи, а EU, LAY и POM могут использоваться как для тяжелой цепи, так и для легкой цепи. Альтернативно, могут использоваться последовательности человеческой зародышевой линии; они доступны по адресу: www2.mrc-lmb.cam.ac.uk/vbase или по адресу www.imgt.org, каждый из которых в последний раз был доступен 07 января 2016 года.
В гуманизированном антителе по настоящему изобретению акцепторные тяжелые и легкие цепи необязательно должны быть получены из одного и того же антитела и могут, если целесообразно, содержать композитные цепи, имеющие каркасные области, полученные из разных цепей.
В одном варианте осуществления человеческий каркас включает в себя 1, 2, 3 или 4 аминокислотных замены, вставки или делеции, например 1, 2, 3 или 4 консервативные замены или замены донорных остатков.
В одном варианте осуществления последовательность, используемая в качестве человеческого каркаса, на 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более имеет сходство или идентична последовательности, описанной в настоящем документе.
Подходящая каркасная область для тяжелой цепи гуманизированного антитела по настоящему изобретению получена из последовательности IGHV3-21 подгруппы VH3 человека вместе с JH5 (SEQ ID NO: 111).
Подходящая каркасная область для легкой цепи гуманизированного антитела по настоящему изобретению получена из последовательности IGKV1-5 подгруппы VK1 человека вместе с JK4 (SEQ ID NO: 109).
Соответственно, в одном примере предложено гуманизированное антитело, содержащее последовательность, приведенную в SEQ ID NO: 4 для CDR-H1, последовательность, приведенную в SEQ ID NO: 5 для CDR-H2, и последовательность, приведенную в SEQ ID NO: 6 или SEQ ID NO: 7 или SEQ ID NO: 8 или SEQ ID NO: 9 для CDR-H3, где каркасная область тяжелой цепи получена из последовательности IGHV3-21 подгруппы VH3 человека вместе с JH5 (SEQ ID NO: 111).
В одном примере вариабельный домен тяжелой цепи антитела содержит последовательность, приведенную в SEQ ID NO: 52, SEQ ID NO: 66, SEQ ID NO: 80 или SEQ ID NO: 94.
Подходящая каркасная область для легкой цепи гуманизированного антитела по настоящему изобретению получена из последовательности IGKV1-5 подгруппы VK1 человеческой зародышевой линии вместе с JK4 (SEQ ID NO: 109).
Соответственно, в одном примере предложено гуманизированное антитело, содержащее последовательность, приведенную в SEQ ID NO: 1 для CDR-L1, последовательность, приведенную в SEQ ID NO: 2 для CDR-L2, и последовательность, приведенную в SEQ ID NO: 3 для CDR-L3, где каркасная область легкой цепи получена из последовательности IGKV1-5 подгруппы VK1 человека вместе с JK4 (SEQ ID NO: 109).
В одном примере вариабельный домен легкой цепи антитела содержит последовательность, приведенную в SEQ ID NO: 38.
В гуманизированном антителе по настоящему изобретению каркасные области не обязательно должны иметь точно такую же последовательность, как в случае акцепторного антитела. Например, необычные остатки могут быть изменены на более часто встречающиеся остатки для этого класса или типа акцепторной цепи. Альтернативно, выбранные остатки в акцепторных каркасных областях могут быть изменены так, чтобы они соответствовали остатку, имеющемуся в том же положении в донорском антителе (см. Reichmann et al., 1998, Nature, 332: 323-324). Такие изменения должны быть сведены к минимуму, необходимому для восстановления аффинности донорного антитела. Протокол для отбора остатков в акцепторных каркасных областях, который может потребоваться изменить, изложен в WO 91/08967.
Донорный остаток, используемый в настоящем описании, относится к остатку из антитела, отличного от человеческого (например, мышиного или кроличьего антитела), которое предоставило CDR.
В одном варианте осуществления предложено гуманизированное антитело, где вариабельный домен тяжелой цепи не содержит каких-либо донорных остатков.
Аналогичным образом, в одном варианте осуществления предложено антитело или связывающий фрагмент, который «муринизирован». Такое антитело или связывающий фрагмент может иметь кроличий донор и мышиный акцептор. Примеры таких антител приведены в SEQ ID NO: 26-33. Примеры мышиных акцепторных последовательностей приведены в SEQ ID NO: 34-37.
В конкретном варианте осуществления настоящее изобретение относится к антагонистическому антителу, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, имеющим тяжелую цепь, содержащую последовательность вариабельной области тяжелой цепи, приведенную в SEQ ID NO: 52, SEQ ID NO: 66, SEQ ID NO: 80 или SEQ ID NO: 94, и легкую цепь, содержащую последовательность вариабельной области легкой цепи, приведенную в SEQ ID NO: 38.
В одном варианте осуществления раскрытие представляет собой последовательность антитела, которая на 80% имеет сходство или идентична описанной в настоящем документе последовательности, например на 85%, 90%, 91%, 92%, 93%, 94%, 95% 96%, 97% 98% или 99% или более в части или по всей соответствующей последовательности. В одном варианте осуществления соответствующая последовательность представляет собой SEQ ID NO: 52, SEQ ID NO: 66, SEQ ID NO: 80 или SEQ ID NO: 94. В одном варианте осуществления соответствующая последовательность представляет собой SEQ ID NO: 38.
Используемый в настоящем описании термин «идентичность» указывает, что в любом конкретном положении в выровненных последовательностях аминокислотный остаток идентичен между последовательностями. Используемый в настоящем описании термин «сходство» указывает, что в любом конкретном положении в выровненных последовательностях аминокислотный остаток имеет сходный тип между последовательностями. Например, лейцин может быть заменен изолейцином или валином. Другие аминокислоты, которые часто могут быть заменены друг другом, включают, но не ограничиваются ими, следующие:
- фенилаланин, тирозин и триптофан (аминокислоты, имеющие ароматические боковые цепи);
- лизин, аргинин и гистидин (аминокислоты, имеющие основные боковые цепи);
- аспартат и глутамат (аминокислоты, имеющие кислотные боковые цепи);
- аспарагин и глутамин (аминокислоты, имеющие амидные боковые цепи); и
- цистеин и метионин (аминокислоты, имеющие серосодержащие боковые цепи). Степени идентичности и сходства можно легко вычислить (Computational Molecular Biology, Lesk, AM, ed., Oxford University Press, New York, 1988; Biocomputing. Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987, Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991, программный пакет BLAST™ от NCBI (Altschul, S.F. et al., 1990, J. Mol. Biol. 215: 403-410; Gish, W. & States, DJ 1993, Nature Genet. 3:266-272. Madden, TL et al., 1996, Meth. Enzymol. 266: 131-141; Altschul, SF et al., 1997, Nucleic Acids Res. 25: 3389-3402; Zhang, J. & Madden, TL 1997, Genome Res. 7: 649-656).
Молекулы антител по настоящему изобретению могут содержать полную молекулу антитела, имеющую полноразмерные тяжелые и легкие цепи или их связывающий фрагмент, и могут представлять собой, но не ограничены ими, Fab, модифицированный Fab, Fab', модифицированный Fab', F(ab')2, Fv, однодоменные антитела (например, VH или VL или VHH), scFv, би-, три- или тетравалентные антитела, Bis-scFv, диатела, триатела, тетратела и эпитоп-связывающие фрагменты любого из вышеуказанных (см. например Holliger and Hudson, 2005, Nature Biotech. 23(9):1126-1136; Adair and Lawson, 2005, Drug Design Reviews - Online 2(3), 209-217). Способы создания и изготовления этих фрагментов антител хорошо известны в данной области (см., например, Verma et al., 1998, Journal of Immunological Methods, 216: 165-181). Другие фрагменты антител для использования в настоящем изобретении включают фрагменты Fab и Fab', описанные в международных патентных заявках WO 05/003169, WO05/003170 и WO05/003171. Поливалентные антитела могут содержать множественные специфичности, например, могут быть биспецифичными или моноспецифичными (см., например, WO92/22853, WO05/113605, WO2009/040562 и WO2010/035012).
Связывающий фрагмент антитела, используемый в настоящем описании, относится к фрагменту, способному связываться с антигеном с аффинностью, так что фрагмент характеризуется как специфичный для антигена.
В одном варианте осуществления антитело в соответствии с настоящим изобретением предложено в виде слитого белка TGF-beta-связывающего антитела, который содержит иммуноглобулиновый компонент, например фрагмент Fab или Fab', и одно или два однодоменных антитела (dAb), которые прямо или косвенно связаны с ним, например, как описано в WO2009/040562, WO2010/035012, WO2011/030107, WO2011/061492 и WO2011/086091, которые включены в настоящее описание в качестве ссылки.
В одном варианте осуществления слитый белок содержит два доменных антитела, например, в виде пары вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), необязательно связанных дисульфидной связью.
В одном варианте осуществления Fab- или Fab'-элемент слитого белка имеет такую же или сходную специфичность для однодоменного антитела или антител. В одном варианте осуществления Fab или Fab' имеют различную специфичность к однодоменному антителу или антителам, то есть слитый белок является поливалентным. В одном варианте осуществления поливалентный слитый белок в соответствии с настоящим изобретением содержит сайт связывания альбумина, например пара VH/VL в нем обеспечивает сайт связывания альбумина.
Домены константной области молекулы антитела по настоящему изобретению, если они имеются, могут быть выбраны с учетом предлагаемой функции молекулы антитела и, в частности, эффекторных функций, которые могут потребоваться. Например, домены константной области могут быть доменами IgA, IgD, IgE, IgG или IgM человека. В частности, могут быть использованы домены константной области человеческого IgG, особенно изотипов IgG1 и IgG3, когда молекула антитела предназначена для терапевтических целей, и необходимы эффекторные функции антитела. Альтернативно, изотипы IgG2 и IgG4 могут быть использованы, когда молекула антитела предназначена для терапевтических целей, а эффекторные функции антител не требуются, например, просто для блокирования активности TGF-beta.
Понятно, что также могут быть использованы варианты последовательности этих доменов константной области. Например, могут использоваться молекулы IgG4, в которых серин в положении 241 был заменен на пролин, как описано в Angal et al., 1993, Molecular Immunology, 1993, 30: 105-108. Соответственно, в варианте осуществления, где антитело представляет собой антитело IgG4, оно может включать мутацию S241P.
Специалисту в данной области должно быть понятно, что антитела могут подвергаться разнообразным посттрансляционным модификациям. Тип и степень этих модификаций часто зависят от линии клеток-хозяев, используемых для экспрессии антитела, а также условий культивирования. Такие модификации могут включать изменения в гликозилировании, окислении метионина, образовании дикетопиперазина, изомеризации аспартата и дезаминировании аспарагина. Частой модификацией является потеря карбоксиконцевого основного остатка (такого как лизин или аргинин) из-за действия карбоксипептидаз (как описано в Harris, RJ. Journal of Chromatography 705: 129-134, 1995). Однако С-концевой лизин отсутствует как на тяжелой, так и на легкой цепи варианта осуществления изобретения для Ab4856.
В одном примере одна или более CDR, представленных в настоящем описании, могут быть модифицированы для удаления нежелательных остатков или сайтов, таких как остатки цистеина или сайты изомеризации аспарагиновой кислоты (D) или сайты дезамидирования аспарагина (N).
Например, один или более остатков цистеина в любой из CDR могут быть заменены другой аминокислотой, такой как серин.
В одном примере сайт дезамидирования аспарагина может быть удален из одной или более CDR путем мутации аспарагинового остатка (N) и/или соседнего остатка на любую другую подходящую аминокислоту. В одном примере сайт дезамидирования аспарагина, такой как NG или NS, может быть мутирован, например, до NA или NT.
В одном примере сайт изомеризации аспарагиновой кислоты можно удалить из одной или более CDR путем мутации остатка аспарагиновой кислоты (D) и/или соседнего остатка до любой другой подходящей аминокислоты. В одном примере сайт изомеризации аспарагиновой кислоты, такой как DG или DS, может быть мутирован, например, до EG, DA или DT.
В одном примере сайт N-гликозилирования, такой как NLS, может быть удален путем мутации аспарагинового остатка (N) до любой другой подходящей аминокислоты, например, до SLS или QLS. В одном примере сайт N-гликозилирования, такой как NLS, может быть удален путем мутации остатка серина (S) до любого другого остатка, за исключением треонина (T).
В одном варианте осуществления тяжелая цепь антитела содержит домен CH1, домен CH2 и домен CH3, а легкая цепь антитела содержит домен CL, либо каппа, либо лямбда.
В одном варианте осуществления тяжелая цепь антитела содержит домен CH1, а легкая цепь антитела содержит домен CL, либо каппа, либо лямбда.
В одном варианте осуществления антитело, предложенное настоящим изобретением, представляет собой антагонистическое антитело, имеющее специфичность к человеческому TGF-beta, в котором константная область тяжелой цепи содержит модифицированную шарнирную область. Соответственно, настоящее изобретение относится к антителу, в котором тяжелая цепь содержит или состоит из последовательности, приведенной в SEQ ID NO: 59, SEQ ID NO: 73, SEQ ID NO: 87 или SEQ ID NO: 101.
Настоящее изобретение также относится к антителу, в котором легкая цепь содержит или состоит из последовательности, приведенной в SEQ ID NO: 45.
Антитело, предложенное настоящим изобретением, имеет тяжелую цепь, содержащую последовательность, приведенную в SEQ ID NO: 59, SEQ ID NO: 73, SEQ ID NO: 87 или SEQ ID NO: 101, и легкую цепь, содержащую последовательность, приведенную в SEQ ID НЕТ: 45.
Также предложено антитело против TGF-beta или его связывающий фрагмент, в котором тяжелая и легкая цепи по меньшей мере на 80% (предпочтительно 85%, 90%, 95%, 96%, 97%, 98%, 99% или более) идентичны или имеют сходство с тяжелой цепью, содержащей последовательность, приведенную в SEQ ID NO: 59, SEQ ID NO: 73, SEQ ID NO: 87 или SEQ ID NO: 101, и легкой цепью, содержащей последовательность, приведенную в SEQ ID NO: 45. В одном варианте осуществления легкая цепь содержит или состоит из последовательности, приведенной в SEQ ID NO: 45, и тяжелая цепь содержит или состоит из последовательности, приведенной в SEQ ID NO: 59, SEQ ID NO: 73, SEQ ID NO: 87 или SEQ ID NO: 101. В другом варианте осуществления легкая цепь содержит или состоит из последовательности SEQ ID NO: 45, и тяжелая цепь содержит или состоит из последовательности SEQ ID NO: 59.
Кроме того, настоящее изобретение относится к специфической области или эпитопу человеческого TGF-beta 1, 2 или 3, который связывается антителом, предложенным настоящим изобретением, в частности, антителом 4856, содержащим последовательность тяжелой цепи gH13 (SEQ ID NO: 59) и/или последовательность легкой цепи gL3 (SEQ ID NO: 45).
Эта специфическая область или эпитоп полипептида человеческого TGF-beta 1, 2 или 3 может быть идентифицирована с помощью любого подходящего метода картирования эпитопов, известного в данной области, в сочетании с любым из антител, предложенных настоящим изобретением. Примеры таких способов включают скрининговые пептиды различной длины, полученные из TGF-beta, для связывания с антителом по настоящему изобретению с наименьшим фрагментом, который может специфично связываться с антителом, содержащим последовательность эпитопа, распознаваемого антителом (например, пептидом в области примерно от 5 до 20, предпочтительно примерно 7 аминокислот в длину). Пептиды TGF-beta могут быть получены синтетически или путем протеолитического гидролиза полипептида TGF-beta. Пептиды, которые связываются с антителом, можно идентифицировать, например, масс-спектрометрическим анализом. В другом примере ЯМР-спектроскопия или рентгеновская кристаллография могут быть использованы для идентификации эпитопа, связанного с антителом по настоящему изобретению. После идентификации эпитопный фрагмент, который связывается с антителом по настоящему изобретению, может быть использован, если потребуется, в качестве иммуногена для получения дополнительных антител, которые связываются с одним и тем же эпитопом.
Антитела, которые перекрестно блокируют связывание антитела в соответствии с настоящим изобретением, в частности, антитело, содержащее последовательность тяжелой цепи (SEQ ID NO: 59) и последовательность легкой цепи (SEQ ID NO: 45), могут быть одинаково полезны в антагонизме TGF-beta 1, 2 и 3. Соответственно, настоящее изобретение также относится к антагонистическому антителу, имеющему специфичность для человеческого TGF-beta 1, 2 и 3, которое перекрестно блокирует связывание любого из описанных выше антител с человеческим TGF-beta 1, 2 и/или 3 и/или перекрестно блокируется от связывания TGF-beta 1, 2 и/или 3 с любым из этих антител. В одном варианте осуществления такое антитело связывается с тем же эпитопом, что и антитело, описанное выше. В другом варианте осуществления перекрестно блокирующее нейтрализующее антитело связывается с эпитопом, который граничит и/или перекрывается с эпитопом, связанным с антителом, описанным выше. В другом варианте осуществления перекрестно блокирующее нейтрализующее антитело данного аспекта изобретения не связывается с тем же эпитопом, что и антитело по настоящему изобретению, или эпитопом, который граничит и/или перекрывается с указанным эпитопом.
Перекрестно блокирующие антитела могут быть идентифицированы с использованием любого подходящего метода в данной области, например, с использованием конкурентных анализов ИФА или BIAcore, где связывание перекрестно блокирующего антитела с человеческим TGF-beta 1, 2 и/или 3 предотвращает связывание антитела по настоящему изобретению или наоборот.
В одном варианте осуществления предложено антагонистическое антитело, имеющее специфичность для человеческого TGF-beta 1, 2 и 3, которое перекрестно блокирует связывание антитела, чья тяжелая цепь содержит последовательность, приведенную в SEQ ID NO: 59, и легкая цепь которой содержит последовательность, приведенную в SEQ ID NO: 45, для человеческого TGF-beta 1, 2 и 3. В одном варианте осуществления перекрестно блокирующие антитела, предложенные настоящим изобретением, ингибируют связывание антитела, содержащего последовательность тяжелой цепи, приведенную в SEQ ID NO: 59, и последовательность легкой цепи, приведенную в SEQ ID NO: 45 более чем на 80%, например, более чем на 85%, например более чем на 90%, в частности более чем на 95%, 96%, 97%, 98%, 99% или более.
Альтернативно или дополнительно антагонистические антитела в соответствии с этим аспектом изобретения могут быть перекрестно заблокированы от связывания с человеческим TGF-beta 1, 2 и 3 с помощью антитела, содержащего последовательность тяжелой цепи, приведенную в SEQ ID NO: 59, и последовательность легкой цепи, приведенную в SEQ ID NO: 45. Также предложена антагонистическая молекула антитела, обладающая специфичностью для человеческого TGF-beta 1, 2 и 3, которая перекрестно блокируется от связывания человеческого TGF-beta 1, 2 и 3 с помощью антитела, содержащего последовательность тяжелой цепи, приведенную в SEQ ID NO: 59, и последовательность легкой цепи, приведенную в SEQ ID NO: 45. В одном варианте осуществления антагонистические антитела, предусмотренные этим аспектом изобретения, ингибируются от связывания с человеческим TGF-beta 1, 2 и 3 с помощью антитела, содержащего последовательность тяжелой цепи, приведенную в SEQ ID NO: 59, и последовательность легкой цепи, приведенную в SEQ ID NO: 45, более чем на 80%, например, более чем на 85%, например более чем на 90%, в частности более 95%, 96%, 97%, 98%, 99% или более.
В одном варианте осуществления перекрестно блокирующие антитела, предложенные настоящим изобретением, являются полностью человеческими. В одном варианте осуществления перекрестно блокирующие антитела, предложенные настоящим изобретением, являются гуманизированными. В одном варианте осуществления антитела по настоящему изобретению пригодны для ингаляционной доставки, например, путем распыления. В одном примере физические свойства антител по настоящему изобретению, например, аффинность и активность связывания, существенно не изменяются при распылении. В одном примере антитела по настоящему изобретению являются высокостабильными. Одной из мер стабильности антител является температура плавления (Тпл). Температура плавления может быть определена любым подходящим способом, известным в данной области, например, с использованием Thermofluor (Ericsson et al., Analytical Biochemistry 357 (2006) 289-298) или DSC (дифференциальная сканирующая калориметрия). Предпочтительно антитела, предложенные настоящим изобретением, имеют высокую температуру плавления (Тпл), как правило, по меньшей мере 75°C. В одном примере антитело по настоящему изобретению имеет Тпл по меньшей мере 75°C. В одном примере антитело по настоящему изобретению имеет Тпл по меньшей мере 77°C. В одном примере антитело по настоящему изобретению имеет Тпл по меньшей мере 79°C.
Биологические молекулы, такие как антитела или фрагменты, содержат кислотные и/или основные функциональные группы, тем самым придавая молекуле чистый положительный или отрицательный заряд. Количество общего «наблюдаемого» заряда будет зависеть от абсолютной аминокислотной последовательности сущности, локальной среды заряженных групп в трехмерной структуре и условий окружающей среды молекулы. Изоэлектрическая точка (pI) представляет собой pH, при котором конкретная молекула или поверхность, доступная растворителю, не несет никакого суммарного электрического заряда. В одном примере антитело и фрагменты TGF-beta по изобретению могут быть сконструированы так, чтобы иметь соответствующую изоэлектрическую точку. Это может привести к образованию антител и/или фрагментов с более прочными свойствами, в частности, с подходящими профилями растворимости и/или стабильности, и/или с улучшенными характеристиками очистки.
Таким образом, в одном аспекте изобретение относится к гуманизированному антителу TGF-beta, сконструированному с тем, чтобы иметь изоэлектрическую точку, отличную от изоэлектрической точки первоначально идентифицированного антитела. Антитело может, например, быть сконструировано путем замены аминокислотного остатка, такой как замена кислотного аминокислотного остатка одним или более основным аминокислотным остатком. Альтернативно, могут быть введены основные аминокислотные остатки или удалены кислотные аминокислотные остатки. Альтернативно, если молекула имеет неприемлемо высокую величину pI, кислотные остатки могут быть введены для снижения pI, если требуется. Важно, чтобы при манипулировании pI необходимо было соблюдать осторожность, чтобы сохранить целевую активность антитела или фрагмента. Таким образом, в одном варианте осуществления сконструированное антитело или фрагмент имеет такую же или по существу такую же активность, что и «немодифицированное» антитело или фрагмент.
Для прогнозирования изоэлектрической точки антитела или фрагмента можно использовать такие программы, как **ExPASY www.expasy.ch/tools/pi_tool.html (доступ к 21 декабря 2015 года).
В одном варианте осуществления перекрестно блокирующее антитело имеет изоэлектрическую точку по меньшей мере 7, например, по меньшей мере 8, как например, 8,5, 8,6, 8,7, 8,8 или 8,9 или по меньшей мере 9, такие как 9, 9,1, 9,2, 9,3 или 9,4.
Понятно, что аффинность антител, предложенных настоящим изобретением, может быть изменена с использованием любого подходящего способа, известного в данной области. Следовательно, настоящее изобретение также относится к вариантам молекул антител по настоящему изобретению, которые имеют улучшенную аффинность к TGF-beta. Такие варианты могут быть получены с помощью ряда протоколов созревания аффинности, включая мутацию CDR (Yang et al., 1995, J. Mol. Biol., 254: 392-403), перетасовка цепи (Marks et al., 1992, Bio/Technology, 10: 779-783), использование штаммов-мутаторов E. coli (Low et al., 1996, J. Mol. Biol., 250: 359-368), перетасовка ДНК (Patten et al., 1997, Curr. Opin. Biotechnol., 8: 724-733), фаговый дисплей (Thompson et al., J. Mol. Biol., 256, 77-88, 1996) и «sexual PCR» (Crameri et al., 1998, Nature, 391: 288-291). Vaughan et al. (выше) обсуждают эти методы созревания аффинности.
Если целесообразно, антитело для применения в настоящем изобретении может быть конъюгировано с одной или более эффекторными молекулами. Понятно, что эффекторная молекула может содержать одну эффекторную молекулу или две или более таких молекул, которые связаны так, чтобы образовывать единый фрагмент, который может быть присоединен к антителам по настоящему изобретению. Когда целесообразно получить фрагмент антитела, связанный с эффекторной молекулой, он может быть получен стандартными методами химической или рекомбинантной ДНК, в которых фрагмент антитела связан либо непосредственно, либо через связующий агент с эффекторной молекулой. Методы конъюгирования таких эффекторных молекул с антителами хорошо известны в данной области (см. Hellstrom et al., Controlled Drug Delivery, 2nd Ed., Robinson et al., Eds., 1987, pp. 623-53, Thorpe et al., 1982, Immunol. Rev., 62: 119-58 и Dubowchik et al., 1999, Pharmacology and Therapeutics, 83, 67-123). Конкретные химические процедуры включают, например, те, которые описаны в WO 93/06231, WO 92/2 22583, WO 89/00195, WO 89/01476 и WO 03/31581. Альтернативно, когда эффекторная молекула представляет собой белок или полипептид, связь может быть достигнута с использованием процедур рекомбинантной ДНК, например, как описано в WO86/01533 и EP0392745.
Используемый в настоящем описании термин эффекторная молекула включает, например, противоопухолевые агенты, лекарственные средства, токсины, биологически активные белки, например ферменты, другие антитела или фрагменты антител, синтетические или природные полимеры, нуклеиновые кислоты и их фрагменты, например ДНК, РНК и их фрагменты, радионуклиды, в частности, радиоактивный йодид, радиоизотопы, хелатированные металлы, наночастицы и репортерные группы, такие как флуоресцентные соединения или соединения, которые могут быть обнаружены с помощью ЯМР или ЭПР спектроскопии.
Примеры эффекторных молекул могут включать цитотоксины или цитотоксические агенты, включая любой агент, который вреден для клеток (например, убивает их). Примеры включают комбрестатины, доластатины, эпотилоны, стауроспорин, майтансиноиды, спонгистатины, ризоксин, галихондрины, роридины, гемиастерлины, таксол, цитохалазин В, грамицидин D, этидий бромид, эметин, митомицин, этопосид, тенопосид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин, а также их аналоги или гомологи.
Эффекторные молекулы также включают, но не ограничиваются ими, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацилдекарбазин), алкилирующие агенты (например, мехлорэтамин, тиоэпа хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнит, стрептозотоцин, митомицин C и цис-дихлордиамин платины (II) (DDP цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин, антрамицин (AMC), калихеамицины или дуокармицины) и антимитотические агенты (например, винкристин и винбластин).
Другие эффекторные молекулы могут включать хелатированные радионуклиды, такие как 111In и 90Y, Lu177, Висмут213, Калифорний252, Иридий192 и Вольфрам188/Рений188; или лекарственные средства, такие как, но не ограничиваясь ими, алкилфосфохолины, ингибиторы топоизомеразы I, таксоиды и сурамин.
Другие эффекторные молекулы включают белки, пептиды и ферменты. Интересующие ферменты включают, но не ограничиваются ими, протеолитические ферменты, гидролазы, лиазы, изомеразы, трансферазы. Интересующие белки, полипептиды и пептиды включают, но не ограничиваются ими, иммуноглобулины, токсины, такие как абрин, рицин A, экзотоксин синегнойной палочки или дифтерийный токсин, белок, такой как инсулин, фактор некроза опухоли, α-интерферон, бета-интерферон, фактор роста нервов, фактор роста тромбоцитов или активатор тканевого плазминогена, тромботический агент или антиангиогенный агент, например ангиостатин или эндостатин, или модификатор биологического ответа, такой как лимфокин, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), фактор роста нервов (NGF) или другой фактор роста и иммуноглобулины.
Другие эффекторные молекулы могут включать детектируемые вещества, полезные, например, при диагностике. Примеры детектируемых веществ включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, биолюминесцентные материалы, радиоактивные нуклиды, позитрон-излучающие металлы (для использования в позитронно-эмиссионной томографии) и нерадиоактивные парамагнитные ионы металлов. См., в основном, патент США №4741900 для ионов металлов, которые могут быть конъюгированы с антителами для использования в качестве диагностики. Подходящие ферменты включают пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразу; подходящие простетические группы включают стрептавидин, авидин и биотин; подходящие флуоресцентные материалы включают умбелиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазиниламина флуоресцеин, дансилхлорид и фикоэритрин; подходящие люминесцентные материалы включают люминол; подходящие биолюминесцентные материалы включают люциферазу, люциферин и аэкворин; и подходящие радиоактивные нуклиды включают 125I, 131I, 111In и 99Tc.
В другом примере эффекторная молекула может увеличивать период полужизни антитела in vivo и/или уменьшать иммуногенность антитела, и/или усиливать доставку антитела через эпителиальный барьер к иммунной системе. Примеры подходящих эффекторных молекул этого типа включают полимеры, альбумин, альбуминсвязывающие белки или альбуминсвязывающие соединения, такие как описанные в WO 05/17984.
В одном варианте осуществления предпочтительным является период полужизни, обеспечиваемый эффекторной молекулой, которая не зависит от TGF-beta.
Если эффекторная молекула является полимером, она может, вообще говоря, быть синтетическим или природным полимером, например, необязательно замещенным полиалкиленовым, полиалкениленовым или полиоксиалкиленовым полимером с прямой или разветвленной цепью или разветвленным или неразветвленным полисахаридом, например гомо- или гетерополисахаридом.
Конкретные необязательные заместители, которые могут присутствовать на вышеуказанных синтетических полимерах, включают одну или более гидроксильных, метильных или метоксигрупп.
Конкретные примеры синтетических полимеров включают необязательно замещенный прямой или с разветвленной цепью поли(этиленгликоль), (поли(пропиленгликоль), поли(виниловый спирт) или его производные, особенно необязательно замещенный поли(этиленгликоль), такой как метоксиполи(этиленгликоль) или его производные.
Конкретные природные полимеры включают лактозу, амилозу, декстран, гликоген или их производные.
В одном варианте осуществления полимер представляет собой альбумин или его фрагмент, такой как человеческий сывороточный альбумин или его фрагмент.
Подразумевается, что «производные», используемые в настоящем описании, включают реакционноспособные производные, например, тиоселективные реакционноспособные группы, такие как малеимиды и тому подобное. Реакционноспособная группа может быть связана непосредственно или через линкерный сегмент с полимером. Понятно, что остаток такой группы в некоторых случаях будет частью продукта в качестве связующей группы между фрагментом антитела и полимером.
Размер полимера можно варьировать по желанию, но обычно он будет находиться в среднем диапазоне молекулярных масс от 500 до 50000 Да, например, от 5000 до 40000 Да, например от 20000 до 40000 Да. Размер полимера, в частности, может быть выбран на основе предполагаемого использования продукта, например способности локализоваться в определенных тканях, таких как опухоли, или продлевать период полужизни (обзор см. В Chapman, 2002, Advanced Drug Delivery Reviews, 54, 531-545). Так, например, когда продукт предназначен для того, чтобы из кровотока проникнуть в ткань, например, для использования при лечении опухоли, может быть выгодным использовать полимер с малой молекулярной массой, например, с молекулярной массой около 5000 Да. Для применений, где продукт остается в кровотоке, может быть выгодным использовать полимер с более высокой молекулярной массой, например имеющий молекулярную массу в диапазоне от 20000 Да до 40000 Да.
Подходящие полимеры включают полиалкиленовый полимер, такой как поли(этиленгликоль) или, особенно, метоксиполи(этиленгликоль) или его производное, и особенно с молекулярной массой в диапазоне примерно от 15000 Да примерно до 40000 Да.
В одном примере антитела для использования в настоящем изобретении присоединены к поли(этиленгликолю) (ПЭГ). В одном конкретном примере антитело представляет собой фрагмент антитела, и молекулы ПЭГ могут быть присоединены через любую доступную аминокислотную функциональную группу боковой цепи или концевой аминокислоты, расположенную во фрагменте антитела, например, через любую свободную амино-, имино-, тиольную, гидроксильную или карбоксильную группу. Такие аминокислоты могут встречаться естественным образом во фрагменте антитела или могут быть сконструированы во фрагменте с использованием способов рекомбинантной ДНК (см., например, US 5219996, US 5667425, WO 98/2971, WO2008/038024). В одном примере молекула антитела по настоящему изобретению представляет собой модифицированный Fab-фрагмент, в котором модификация представляет собой добавление к С-концу его тяжелой цепи одной или более аминокислот, чтобы обеспечить присоединение эффекторной молекулы. Соответственно, дополнительные аминокислоты образуют модифицированную область шарнира, содержащую один или более цистеиновых остатков, к которым может быть присоединена эффекторная молекула. Несколько сайтов могут использоваться для присоединения двух или более молекул ПЭГ.
Подходящие молекулы ПЭГ ковалентно связаны через тиольную группу по меньшей мере одного остатка цистеина, расположенного во фрагменте антитела. Каждая молекула полимера, присоединенная к фрагменту модифицированного антитела, может быть ковалентно связана с атомом серы остатка цистеина, расположенного во фрагменте. Ковалентная связь обычно будет представлять собой дисульфидную связь или, в частности, серо-углеродную связь. Если тиольная группа используется в качестве точки присоединения соответственно активированных эффекторных молекул, например, могут быть использованы тиольные селективные производные, такие как малеимиды и производные цистеина. Активированный полимер можно использовать в качестве исходного материала для получения фрагментов антител, модифицированных полимером, как описано выше. Активированным полимером может быть любой полимер, содержащий реакционноспособную тиольную группу, такую как α-галогенкарбоновая кислота или сложный эфир, например иодацетамид, имид, например, малеимид, винилсульфон или дисульфид. Такие исходные вещества могут быть получены коммерчески (например, из Nektar, ранее Shearwater Polymers Inc., Huntsville, AL, USA) или могут быть получены из коммерчески доступных исходных материалов с использованием обычных химических процедур. Конкретные молекулы ПЭГ включают 20K метокси-ПЭГ-амин (получаемый от Nektar, ранее Shearwater, Rapp Polymere и SunBio) и M-PEG-SPA (можно получить от Nektar, ранее Shearwater).
В одном варианте осуществления антитело представляет собой модифицированный Fab-фрагмент, Fab'-фрагмент или diFab, который является ПЭГилированным, т.е. имеет ПЭГ (поли(этиленгликоль)), ковалентно присоединенный к нему, например, согласно способу, описанному в ЕР 0948544 или ЕР1090037 [см. также «Poly(ethyleneglycol) Chemistry, Biotechnical and Biomedical Applications», 1992, J. Milton Harris (ed), Plenum Press, New York, «Poly(ethyleneglycol) Chemistry and Biological Applications», 1997, J. Milton Harris and S. Zalipsky (eds), American Chemical Society, Washington DC and «Bioconjugation Protein Coupling Techniques for the Biomedical Sciences», 1998, M. Aslam and A. Dent, Grove Publishers, New York; Chapman, A. 2002, Advanced Drug Delivery Reviews 2002, 54:531-545]. В одном примере ПЭГ прикрепляется к цистеину в шарнирной области. В одном примере модифицированный ПЭГ Fab-фрагмент содержит малеимидную группу, ковалентно связанную с одной тиольной группой в модифицированной шарнирной области. Лизиновый остаток может быть ковалентно связан с малеимидной группой, и к каждой из аминогрупп по остатку лизина может быть присоединен полимер метоксиполи(этиленгликоля), имеющий молекулярную массу приблизительно 20000 Да. Таким образом, общая молекулярная масса ПЭГ, присоединенного к Fab-фрагменту, может составлять приблизительно 40000 Да.
Конкретные молекулы ПЭГ включают 2-[3-(N-малеимидо)пропионамидо]этиламид N,N'-бис(метоксиполи(этиленгликоля) MW 20000) модифицированного лизина, также известный как PEG2MAL40K (полученный от Nektar, ранее Shearwater).
Альтернативные источники ПЭГ-линкеров включают NOF, которые поставляют GL2-400MA3 (где m в структуре ниже равно 5) и GL2-400MA (где m равно 2), а n составляет приблизительно 450:
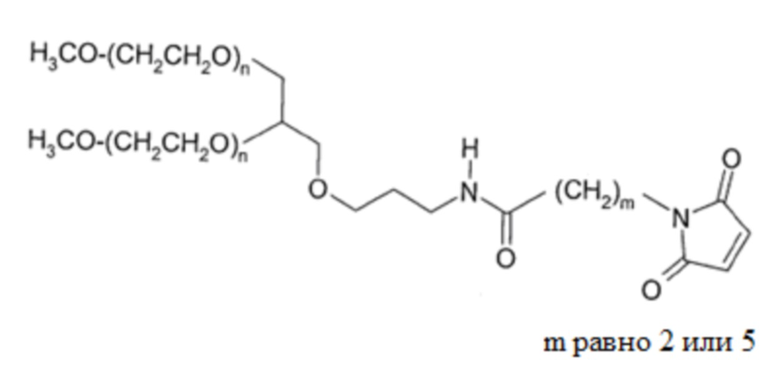
То есть каждый ПЭГ составляет примерно 20000 Да.
Таким образом, в одном из вариантов осуществления ПЭГ представляет собой 2,3-бис(метилполиоксиэтилен-окси)-1-{[3-(6-малеимидо-1-оксогексил)амино]пропилокси}гексан (содержащий 2 рукава разветвленный ПЭГ, -CH2)3NHCO(CH2)5-MAL, Mw 40000, известен как SUNBRIGHT GL2-400MA3.
Дополнительные альтернативные ПЭГ-эффекторные молекулы относятся к следующему типу:
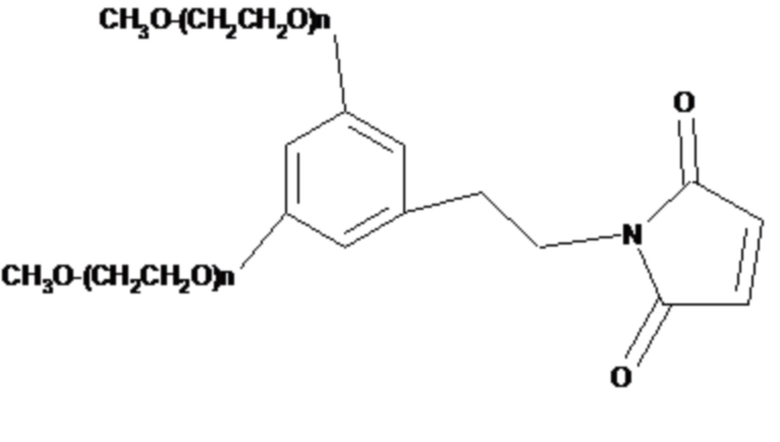
В одном варианте осуществления предложено антитело, такое как полноразмерное антитело, которое является ПЭГилированным (например, с ПЭГ, описанным в настоящем документе), присоединенным через аминокислотный остаток цистеина по аминокислоте 226 или около нее в цепи, например по аминокислоте 226 тяжелой цепи (при последовательной нумерации). В одном варианте осуществления ПЭГ присоединен к Cys226 SEQ ID NO: 101.
В одном варианте осуществления в настоящем раскрытии предложена молекула Fab-ПЭГ, содержащая один или более полимеров ПЭГ, например 1 или 2 полимера, таких как полимер или полимеры 40 кДа.
Молекулы Fab-ПЭГ в соответствии с настоящим изобретением могут быть особенно выгодными тем, что они имеют период полужизни, не зависящий от Fc-фрагмента.
В одном варианте осуществления предложен scFv, конъюгированный с полимером, таким как молекула ПЭГ, молекула крахмала или молекула альбумина.
В одном варианте осуществления антитело или фрагмент конъюгируют с молекулой крахмала, например, для увеличения периода полужизни. Методы конъюгирования начинают с белка, как описано в US 8017739, включенном в настоящее описании путем ссылки.
Репортерная молекула, используемая в настоящем описании, представляет собой молекулу, которая может быть детектирована, например, флуоресцентный краситель, радиоактивная метка или другая детектируемая сущность.
Настоящее изобретение также относится к выделенной последовательности ДНК, кодирующей тяжелую и/или легкую цепь (цепи) молекулы антитела по настоящему изобретению. Соответственно, последовательность ДНК кодирует тяжелую или легкую цепь молекулы антитела по настоящему изобретению. ДНК-последовательность по настоящему изобретению может содержать синтетическую ДНК, например, полученную путем химической обработки, кДНК, геномную ДНК или любую их комбинацию.
Последовательности ДНК, которые кодируют молекулу антитела по настоящему изобретению, могут быть получены способами, хорошо известными специалистам в данной области. Например, последовательности ДНК, кодирующие часть или все тяжелые и легкие цепи антитела, могут быть синтезированы по желанию из определенных последовательностей ДНК или на основе соответствующих аминокислотных последовательностей.
ДНК, кодирующая акцепторные каркасные последовательности, широко доступна специалистам в данной области и может быть легко синтезирована на основе их известных аминокислотных последовательностей.
Стандартные методы молекулярной биологии могут быть использованы для получения последовательностей ДНК, кодирующих молекулу антитела по настоящему изобретению. Целевые последовательности ДНК могут быть синтезированы полностью или частично с использованием методов синтеза олигонуклеотидов. При необходимости можно использовать методы сайт-направленного мутагенеза и полимеразной цепной реакции (ПЦР).
Примеры подходящих последовательностей ДНК представлены на Фигуре 1.
Настоящее изобретение также относится к клонирующему или экспрессирующему вектору, содержащему одну или более последовательностей ДНК по настоящему изобретению. Соответственно, предложен клонирующий или экспрессирующий вектор, содержащий одну или более последовательностей ДНК, кодирующих антитело по настоящему изобретению. В одном варианте осуществления вектор содержит последовательности ДНК легкой цепи, приведенные в SEQ ID NO: 46 или SEQ ID NO: 47, и/или последовательность ДНК тяжелой цепи, приведенную в SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 102 или SEQ ID NO: 103. Соответственно, клонирующий или экспрессирующий вектор содержит две последовательности ДНК, кодирующие легкую цепь и тяжелую цепь молекулы антитела по настоящему изобретению, предпочтительно SEQ ID NO: 47 и SEQ ID NO: 61, соответственно, и подходящие сигнальные последовательности. В одном примере вектор содержит межгенную последовательность между тяжелой и легкой цепями (см. WO03/048208).
Специалистам в данной области хорошо известны общие методы, с помощью которых могут быть сконструированы векторы, способы трансфекции и методы культивирования. В этом отношении есть ссылка на «Current Protocols in Molecular Biology», 1999, FM Ausubel (ed), Wiley Interscience, New York и Maniatis Manual produced by Cold Spring Harbor Publishing.
Также предложена клетка-хозяин, содержащая один или более клонирующих или экспрессирующих векторов, содержащих одну или более последовательностей ДНК, кодирующих антитело по настоящему изобретению. Любая подходящая система клетки-хозяева/вектор может быть использована для экспрессии последовательностей ДНК, кодирующих молекулу антитела по настоящему изобретению. Также могут использоваться бактериальные экспрессирующие системы клеток-хозяев, например, E. coli и другие микробные системы, или эукариотические, например клетки млекопитающих. Подходящие клетки-хозяева млекопитающих включают клетки HEK, CHO, миеломные или гибридомные клетки.
Настоящее изобретение также относится к способу получения молекулы антитела в соответствии с настоящим изобретением, включающему культивирование клетки-хозяина, содержащей вектор по настоящему изобретению, в условиях, подходящих для экспрессии белка из ДНК, кодирующей молекулу антитела по настоящему изобретению, и выделение молекулы антитела.
Молекула антитела может содержать только полипептид тяжелой или легкой цепи, и в этом случае для трансфекции клеток-хозяев необходимо использовать только кодирующую последовательность полипептида тяжелой цепи или легкой цепи. Для получения продуктов, содержащих как тяжелые, так и легкие цепи, клеточная линия может трансфецироваться двумя векторами: первым вектором, кодирующим полипептид легкой цепи, и вторым вектором, кодирующим полипептид тяжелой цепи. Альтернативно, может быть использован один вектор, включающий в себя последовательности, кодирующие полипептиды легкой цепи и тяжелой цепи.
Антитела и фрагменты в соответствии с настоящим изобретением экспрессируются клетками-хозяевами на хорошем уровне. Таким образом, свойства антител и/или связывающих фрагментов пригодны для экспрессии в промышленном масштабе.
Таким образом, существует способ культивирования клетки-хозяина и экспрессии антитела или его фрагмента, выделения последнего и необязательно его очистки с получением выделенного антитела или фрагмента. В одном варианте осуществления способ дополнительно включает стадию конъюгации эффекторной молекулы с выделенным антителом или фрагментом, например, конъюгацию с ПЭГ-полимером, в частности, как описано в настоящем документе.
В одном варианте осуществления предложен способ очистки антитела (в частности, антитела или фрагмента согласно изобретению), включающий проведение анионообменной хроматографии в несвязывающем режиме, так что примеси сохраняются на колонке, а антитело элюируются.
В одном варианте осуществления при очистке используется аффинный захват на колонке TGF-beta.
В одном варианте осуществления при очистке используют сибакроновый синий или ему подобный для очистки слитого альбумина или конъюгатных молекул.
Подходящие ионообменные смолы для использования в этом процессе включают смолу Q.FF (поставляемую компанией GE-Healthcare). Стадию можно, например, проводить при рН примерно 8.
Способ может дополнительно содержать начальную стадию захвата с использованием катионообменной хроматографии, например, при рН от 4 до 5, например 4,5. Катионообменная хроматография может, например, использовать смолу, такую как смола CaptoS или SP сефароза FF (поставляемая компанией GE-Healthcare). Затем антитело или фрагмент можно элюировать из смолы с использованием раствора ионной соли, такого как хлорид натрия, например, в концентрации 200 мМ.
Таким образом, стадия или стадии хроматографии могут включать одну или более стадий промывки, если это необходимо.
Процесс очистки может также содержать одну или более стадий фильтрации, таких как стадия диафильтрации.
Таким образом, в одном варианте осуществления предложено очищенное антитело против TGF-beta или фрагмент, например гуманизированное антитело или фрагмент, в частности, антитело или фрагмент в соответствии с изобретением, по существу очищенный, в частности, свободный или по существу свободный от эндотоксина и/или белка клетки-хозяина или ДНК.
Очищенная форма, используемая выше, предназначена для обозначения чистоты по меньшей мере на 90% масс./масс., такой как 91, 92, 93, 94, 95, 96, 97, 98, 99% масс./масс. или более.
Подразумевается, что по существу свободен от эндотоксина, как правило, обозначает содержание эндотоксина 1 ЕЭ на мг продукта-антитела или менее, например 0,5 или 0,1 ЕЭ на мг продукта.
Подразумевается, что по существу, свободный от белка клетки-хозяина или ДНК, как правило, обозначает содержание белка клетки-хозяина и/или ДНК, составляющее 400 мкг на 1 мг продукта-антитела или менее, как например, 100 мкг на 1 мг или менее, в частности, 20 мкг на 1 мг, если это необходимо.
Настоящее изобретение также относится к антагонистическому антителу, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3 (или к фармацевтическим композициям, содержащие его) в соответствии с раскрытием для применения в качестве лекарственного средства. Настоящее изобретение также относится к антагонистическому антителу, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3 (или к фармацевтическим композициям, содержащим его) в соответствии с раскрытием для применения при лечении или профилактике патологического расстройства, которое опосредуется TGF-beta 1, 2 и/или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 и/или 3.
Настоящее изобретение также относится к применению антагонистического антитела, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3 согласно раскрытию изобретения при изготовлении лекарственного средства для лечения или профилактики патологического расстройства, которое опосредуется TGF-beta 1, 2 и/или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 и/или 3.
Настоящее изобретение также относится к способу лечения пациента, страдающего или подверженного риску патологического расстройства, опосредованного TGF-beta 1, 2 или 3 или связанного с повышенным уровнем TGF-beta 1, 2 или 3, причем способ включает введение пациенту эффективного количества антитела согласно раскрытию изобретения. В настоящей заявке патологическое расстройство, которое опосредуется TGF-beta 1, 2 и/или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 и/или 3, может быть любым подходящим расстройством. В одном варианте патологическое расстройство выбирают из группы, состоящей из: фиброза легких, такого как идиопатический фиброз легких, легочной гипертензии, такой как легочная артериальная гипертензия.
Антитело в соответствии с раскрытием изобретения может быть использовано для лечения заболеваний легких, включающих легочную артериальную гипертензию.
Антитело в соответствии с раскрытием изобретения может быть использовано для лечения пациентов, страдающих идиопатическим легочным фиброзом и легочной артериальной гипертензией.
Настоящее изобретение также относится к антагонистическому антителу Fab или Fab'-фрагменту, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, для применения путем ингаляционного введения в лечении или профилактике патологического расстройства, которое опосредовано TGF-бета 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3.
Настоящее изобретение также относится к антагонистическому антителу Fab или Fab'-фрагменту, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, в изготовлении лекарственного средства для лечения или профилактики патологического расстройства, которое опосредовано TGF -бета 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3, путем ингаляционного введения.
Настоящее изобретение также относится к способу лечения пациента, страдающего или подверженного риску патологического расстройства, опосредованного TGF-beta 1, 2 или 3 или связанного с повышенным уровнем TGF-beta 1, 2 или 3, причем способ включает введение пациенту путем ингаляции эффективного количества антагонистического антитела Fab или Fab'-фрагмента, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3.
Патологическим расстройством, подходящим для лечения путем ингаляционного введения, может быть любое легочное заболевание, которое опосредуется TGF-beta 1, 2 и/или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 и/или 3, например заболевание, выбранное из группы, состоящей из: фиброза легких, такого как идиопатический фиброз легких (IPF), например легкий, умеренный и/или тяжелый IPF, а также кистозный фиброз и легочная гипертензия, такая как легочная артериальная гипертензия (PAH). В другом варианте осуществления антитело может быть использовано для лечения легкого IPF, такого как легкий IPF, связанный с легочной гипертензией, в частности, PAH или диспропорциональной легочной гипертензии. В одном варианте осуществления антитело может использоваться для лечения пациента, страдающего IPF и легочной гипертензией, такими как IPF и PAH. В другом варианте осуществления антитело можно использовать для лечения системного склероза. В следующем варианте осуществления антитело может быть использовано для лечения системного склероза, связанного по меньшей мере с одним из следующих: фиброз легких (SSc-ILD); легочная гипертензия, например, легочная гипертензия, связанная с заболеванием соединительной ткани; или и с тем и с другим: IPF и легочной гипертензией.
Использование ингаляционного антитела, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, может снизить риск побочных эффектов при местном введении в легкие по сравнению с системным введением антитела.
Антитела и фрагменты согласно раскрытию настоящего изобретения могут быть использованы в лечении или профилактике.
Молекула антитела по настоящему изобретению также может быть использована при диагностике, например, при диагностике in vivo и визуализации состояний заболевания, в которое вовлечен TGF-beta.
Поскольку антитела по настоящему изобретению полезны при лечении и/или профилактике патологического состояния, настоящее изобретение также относится к фармацевтической или диагностической композиции, содержащей молекулу антитела по настоящему изобретению в сочетании с одним или более фармацевтически приемлемыми вспомогательными веществами, разбавителями или носителями. Соответственно, предусмотрено применение антитела по изобретению для изготовления лекарственного средства. Композиция обычно будет поставляться в виде части стерильной фармацевтической композиции, которая обычно включает фармацевтически приемлемый носитель. Фармацевтическая композиция по настоящему изобретению может дополнительно содержать фармацевтически приемлемый адъювант.
Настоящее изобретение также относится к способу получения фармацевтической или диагностической композиции, включающему добавление и смешивание молекулы антитела по настоящему изобретению вместе с одним или более фармацевтически приемлемыми вспомогательными веществами, разбавителями или носителями.
Молекула антитела может быть единственным активным ингредиентом в фармацевтической или диагностической композиции. Альтернативно, антитело можно вводить в комбинации, например, одновременно, последовательно или отдельно с другим одним или более терапевтически активными ингредиентами. Соответственно, молекула антитела в фармацевтической или диагностической композиции может быть дополнена другими активными ингредиентами, включая ингредиенты в виде других антител, например, антитела против семейства рецепторов эпидермального фактора роста (EGFR, HER-2), антитела против рецепторов фактора роста эндотелия сосудов (VEGFR), антитела против рецептора фактора роста тромбоцитов (PDGFR), или отличные от антител ингредиенты, такие как иматиниб, дазатиниб, ниолтиниб, базутиниб, гефитиниб, эрлотиниб, темсиролимус, вандетаниб, вемурафениб, кризотиниб, вориностат, ромидепсин, бортезомиб, сорафениб, сунитиниб, пазопаниб, регорафениб, кабозантиниб, перфенидон, нинтеданиб, стероиды или другие лекарственные молекулы, в частности, чей период полужизни не зависит от связывания TGF-beta. В конкретном варианте осуществления антитело вводят с помощью нинтеданиб, например, для лечения IPF.
Активный ингредиент, используемый в настоящем описании, относится к ингредиенту с фармакологическим эффектом, таким как терапевтический эффект, в соответствующей дозе.
Фармацевтические композиции соответственно включают терапевтически эффективное количество антитела по изобретению. Используемый в настоящем описании термин «терапевтически эффективное количество» относится к количеству терапевтического агента, необходимого для лечения, улучшения или предотвращения целевого заболевания или состояния, или для проявления детектируемого терапевтического, фармакологического или профилактического эффекта. Для любого антитела терапевтически эффективное количество может быть оценено первоначально либо в анализах клеточной культуры, либо на животных моделях, как правило, на грызунах, кроликах, собаках, свиньях или приматах. Животная модель может также использоваться для определения соответствующего диапазона концентраций и пути введения. Такая информация затем может быть использована для определения полезных доз и путей введения человеку.
Точное терапевтически эффективное количество для пациента будет зависеть от тяжести заболевания, общего состояния здоровья пациента, возраста, веса и пола пациента, диеты, времени и частоты введения, комбинации лекарственных средств, чувствительности реакции и толерантности/ответа на терапию. Это все может быть определено путем рутинного экспериментирования и находится в пределах оценки врача. Как правило, терапевтически эффективное количество будет составлять от 0,01 мг/кг до 500 мг/кг, например от 0,1 мг/кг до 200 мг/кг, например 100 мг/кг. В частности, терапевтически эффективное количество будет составлять от 0,001 до 100 мг/кг.
Фармацевтические композиции могут быть удобно представлены в виде единых лекарственных форм, содержащих заранее определенное количество активного агента по изобретению на дозу.
Терапевтические дозы антител в соответствии с раскрытием настоящего изобретения не демонстрируют явных или ограниченных токсикологических эффектов in vivo.
Композиции могут вводиться пациенту индивидуально или в комбинации (например, одновременно, последовательно или отдельно) с другими агентами, лекарственными средствами или гормонами.
Антитела, которые будут использоваться для лечения различных воспалительных заболеваний, могут использоваться отдельно или в комбинации с различными другими противовоспалительными агентами.
Антитела, которые будут использоваться для лечения различных фиброзных заболеваний, могут использоваться отдельно или в комбинации с другими противофиброзными агентами. Примерами таких агентов являются пирфенидон и/или нинтеданиб.
Доза, при которой вводится молекула антитела по настоящему изобретению, зависит от характера состояния, подлежащего лечению, тяжести присутствующего состояния и от того, используется ли молекула антитела профилактически или для лечения существующего состояния.
Частота дозы будет зависеть от периода полужизни молекулы антитела и продолжительности ее действия. Если молекула антитела имеет короткий период полужизни (например, от 2 до 10 часов), то может потребоваться дать одну или более доз в день. Альтернативно, если молекула антитела имеет длительный период полужизни (например, от 2 до 15 дней) и/или длительный профиль фармакодинамики (PD), может потребоваться только однократное введение дозы один раз в день, один раз в неделю или даже один раз в 1 или 2 месяца.
Период полужизни, используемый в настоящем описании, предназначен для обозначения продолжительности присутствия молекулы в кровотоке, например, в сыворотке/плазме.
Используемая в настоящем описании фармакодинамика относится к профилю и, в частности, к продолжительности биологического действия молекулы в соответствии с настоящим изобретением.
Фармацевтически приемлемый носитель не должен сам индуцировать образование антител, вредных для индивидуума, получающего композицию, и не должен быть токсичным. Подходящими носителями могут быть крупные, медленно метаболизируемые макромолекулы, такие как белки, полипептиды, липосомы, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы.
Можно использовать фармацевтически приемлемые соли, например соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты или соли органических кислот, такие как ацетаты, пропионаты, малонаты и бензоаты.
Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, такие как воду, физиологический раствор, глицерин и этанол. Кроме того, в таких композициях могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты или буферные вещества с рН. Такие носители позволяют составлять фармацевтические композиции в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей и суспензий для приема пациентом внутрь.
Подходящие формы для введения включают формы, подходящие для парентерального введения, например, путем инъекции или инфузии, например, путем болюсной инъекции или непрерывной инфузии. Если продукт предназначен для инъекций или инфузий, он может принимать форму суспензии, раствора или эмульсии в маслянистом или водном носителе и может содержать составные агенты, такие как суспендирующие, консервирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, молекула антитела может быть представлена в сухой форме для восстановления перед использованием с помощью соответствующей стерильной жидкости.
После приготовления композиции по изобретению можно вводить непосредственно пациенту. Объектами, подлежащими лечению, могут быть животные. Однако в одном или более вариантах осуществления композиции адаптированы для введения людям.
Подходящим образом в композициях в соответствии с настоящим изобретением рН конечного состава отличается от значения изоэлектрической точки антитела или фрагмента, например, если рН композиции составляет 7, тогда может быть уместным pI от 8 до 9 или выше. Безотносительно к теории считается, что это может в конечном итоге обеспечить получение конечного состава с улучшенной стабильностью, например, антитело или фрагмент остаются в растворе.
В одном примере фармацевтическая композиция при рН в диапазоне 4-7 содержит 1-200 мг/мл антитела в соответствии с настоящим изобретением, 1-100 мМ буфера, 0,001-1% поверхностно-активного вещества, а)10-500 мМ стабилизатора, b) 10-500 мМ стабилизатора и 5-500 мМ агена тоничности или c) 5-500 мМ агента тоничности.
Фармацевтические композиции по настоящему изобретению могут вводиться любым количеством путей, включая, но не ограничиваясь ими, пероральный, внутривенный, внутримышечный, внутриартериальный, интрамедуллярный, интратекальный, внутрижелудочковый, трансдермальный, чрескожный (например, см. WO98/20734), подкожный, внутрибрюшинный, интраназальный, энтеральный, местный, сублингвальный, интравагинальный или ректальный. Гипоспреи могут также использоваться для введения фармацевтических композиций по изобретению. Как правило, терапевтические композиции могут быть приготовлены в виде инъекций либо в виде жидких растворов, либо суспензий. Также могут быть получены твердые формы, пригодные для растворения или суспензии в жидких носителях перед инъекцией. Предпочтительно молекулы антител по настоящему изобретению вводят подкожно, путем ингаляции или местно. Например, антитело можно вводить интраназально или перорально, например, путем ингаляции.
Прямую доставку композиций обычно осуществляют путем инъекции, подкожно, внутрибрюшинно, внутривенно или внутримышечно или доставляют в интерстициальное пространство ткани. Композиции также можно вводить в пораженный участок. Дозированное лечение может представлять собой схему с однократным введением или схему с многократным введением.
Понятно, что активный ингредиент в композиции будет представлять собой молекулу антитела. Таким образом, оно будет подвержено деградации в желудочно-кишечном тракте. Таким образом, если композицию следует вводить по пути с использованием желудочно-кишечного тракта, композиция должна содержать агенты, которые защищают антитело от деградации, но которые высвобождают антитело после его абсорбции из желудочно-кишечного тракта.
Подробное обсуждение фармацевтически приемлемых носителей доступно в Remington's Pharmaceutical Sciences (Mack Publishing Company, NJ 1991).
В одном варианте осуществления композиция предложена в виде композиции для местного введения, включая ингаляцию.
Подходящие ингаляционные препараты включают ингаляционные порошки, дозирующие аэрозоли, содержащие газы-пропелленты или ингаляционные растворы, свободные от газов-пропеллентов (таких как распыляемые растворы или суспензии). Ингаляционные порошки согласно раскрытию изобретения, содержащие активное вещество, могут состоять исключительно из вышеуказанных активных веществ или смесей вышеуказанных активных веществ с физиологически приемлемым вспомогательным веществом.
Эти ингаляционные порошки могут включать моносахариды (например, глюкозу или арабинозу), дисахариды (например, лактозу, сахарозу, мальтозу), олиго- и полисахариды (например, декстраны), полиспирты (например, сорбит, маннит, ксилит), соли (например, хлорид натрия, карбонат кальция ) или их смеси друг с другом. Целесообразно использовать моно- или дисахариды, использование лактозы или глюкозы предпочтительно, но не исключительно в форме их гидратов.
Частицы для осаждения в легких требуют размера частиц менее 10 микрон, например 1-9 мкм, например, от 0,1 до 5 мкм, в частности от 1 до 5 мкм. Размер частиц активного ингредиента (такого как антитело или фрагмент) имеет первостепенное значение, поскольку считается, что он коррелирует с осаждением в областях легкого, пригодных для лечения антителом или связывающим фрагментом по изобретению. Например, частицы размером 10 мкм или менее, например от 0,1 до 5 мкм, в частности от 1 до 5 мкм, с большей вероятностью будут осаждаться в альвеолярных структурах легкого.
Газы-пропелленты, которые могут быть использованы для приготовления ингаляционных аэрозолей, известны в данной области техники. Подходящие газы-пропелленты выбирают из углеводородов, таких как н-пропан, н-бутан или изобутан и галогенуглеводородов, таких как хлорированные и/или фторированные производные метана, этана, пропана, бутана, циклопропана или циклобутана. Вышеуказанные газы-пропелленты могут использоваться сами по себе или в их смесях.
Особенно подходящими газами-пропеллентами являются галогенированные производные алканов, выбранные из TG 11, TG 12, TG 134a и TG227. Из вышеупомянутых галогенированных углеводородов особенно пригодны TG134a (1,1,1,2-тетрафторэтан) и TG227 (1,1,1,2,3,3,3-гептафторпропан) и их смеси.
Ингаляционные аэрозоли, содержащие газ-пропеллент, могут также содержать другие ингредиенты, такие как сорастворители, стабилизаторы, поверхностно-активные вещества (ПАВ), антиоксиданты, смазывающие вещества и средства для регуляции рН. Все эти ингредиенты известны в данной области.
Ингаляционные аэрозоли, содержащие газ-пропеллент, согласно изобретению могут содержать до 5 мас. % активного вещества. Аэрозоли согласно изобретению содержат, например, 0,002-5 мас. %, 0,01-3 мас. %, 0,015-2 мас. %, 0,1-2 мас. %, 0,5-2 мас. % или 0,5-1 мас. % активного ингредиента.
Альтернативно, местное введение в легкие также может быть осуществлено путем введения жидкого раствора или суспензионного состава, например, с использованием устройства, такого как небулайзер, например, небулайзер, подключенный к компрессору.
В одном варианте осуществления композиция предложена в виде дискретных ампул, содержащих единичную дозу для доставки путем распыления.
В одном варианте осуществления антитело поставляется в лиофилизированной форме, для восстановления или, альтернативно, в виде суспензионной композиции.
Антитело по изобретению может быть доставлено диспергированным в растворителе, например, в виде раствора или суспензии. Его можно суспендировать в соответствующем физиологическом растворе, например физиологическом растворе или другом фармакологически приемлемом растворителе или в буферном растворе. Буферные растворы, известные в данной области, могут содержать 0,05мг -0,15 мг динатрия эдетата, 8 мг - 9 мг NaCl, 0,15 мг - 0,25 мг полисорбата, 0,25 мг - 0,30 мг безводной лимонной кислоты и 0,45 мг - 0,55 мг цитрата натрия на 1 мл воды для достижения рН примерно 4-5. В суспензии, например, можно использовать лиофилизированное антитело.
Терапевтические суспензии или растворы могут также содержать одно или более вспомогательных веществ. Вспомогательные вещества хорошо известны в данной области и включают в себя буферы (например, цитратный буфер, фосфатный буфер, ацетатный буфер и бикарбонатный буфер), аминокислоты, мочевину, спирты, аскорбиновую кислоту, фосфолипиды, белки (например, сывороточный альбумин), ЭДТА, хлорид натрия, липосомы, маннит, сорбит и глицерин. Растворы или суспензии могут быть инкапсулированы в липосомы или биоразлагаемые микросферы. Состав обычно предоставляется по существу в стерильной форме с использованием стерильных процессов производства.
Это может включать в себя производство и стерилизацию путем фильтрации буферного растворителя/ раствора, используемого для композиции, асептической суспензии антитела в стерильном буферном растворе растворителя, и путем выдачи препарата в стерильные сосуды способами, известными специалистам в данной области.
Распыляемый состав в соответствии с раскрытием настоящего изобретения может быть предоставлен, например, в виде однодозовых лекарственных форм (например, герметичные пластиковые контейнеры или флаконы), упакованные в конверты из фольги. Каждый флакон содержит единичную дозу в объеме, например, 2 мл буфера растворителя/раствора.
Раскрытые в настоящем описании антитела считаются подходящими для доставки посредством распыления.
Также предполагается, что антитело по настоящему изобретению можно вводить с использованием генной терапии. Для этого ДНК-последовательности, кодирующие тяжелую и легкую цепи молекулы антитела под контролем соответствующих компонентов ДНК, вводят пациенту таким образом, что цепи антитела экспрессируются из последовательностей ДНК и собираются in situ.
В одном варианте осуществления настоящее раскрытие включает использование антител или их фрагментов в качестве реагента диагностики, например, конъюгированного с репортерной молекулой. Таким образом, предложено антитело или фрагмент согласно раскрытию, которое является меченым. В одном аспекте предложена колонка, содержащая антитело или фрагмент согласно раскрытию.
Таким образом, предложено антитело или фрагмент антитела против TGF-beta для применения в качестве реагента для таких целей, как:
1) очистка белка TGF-beta (или его связывающего фрагмента), который конъюгируют с матрицей и используют в качестве аффинной колонки или (в виде модифицированной формы антитела против TGF-beta) в качестве осаждающего агента (например, в виде формы, модифицированной доменом, распознаваемым другой молекулой, которая может быть модифицирована), который необязательно осаждается анти-Fc-реагентом);
2) детектирование и/или количественное определение TGF-beta на клетках или в клетках, живых или фиксированных (клетки in vitro или в тканях или срезах клеток). Использование для этого может включать количественную оценку TGF-beta в качестве биомаркера для отслеживания эффекта обработки антителом против TGF-beta. Для этих целей кандидат может использоваться в модифицированной форме (например, путем добавления другого фрагмента в качестве генетического гибридного белка или химического конъюгата, как например, путем добавления репортерной молекулы, например флуоресцентной метки, используемой для детектирования);
3) очистка или сортировка TGF-beta-несущих клеток, меченных связыванием с кандидатом, модифицированным способами, проиллюстрированными в (1) и (2).
«Содержащий» в контексте настоящей спецификации предназначено для обозначения «включающий».
Если технически целесообразно, варианты осуществления изобретения могут быть объединены.
Варианты осуществления описаны в настоящем документе как содержащие определенные признаки/элементы. Раскрытие изобретения также распространяется на отдельные варианты осуществления, состоящие или в основном состоящие из указанных признаков/элементов.
Технические ссылки, такие как патенты и заявки, включены в настоящее описание путем ссылки.
Любые варианты осуществления, конкретно и явно изложенные в настоящем описании, могут составлять основу отказа от ответственности либо отдельно, либо в сочетании с одним или более дополнительными вариантами осуществления.
Настоящее изобретение далее описано исключительно в качестве иллюстрации в следующих примерах.
ПРИМЕРЫ
В следующих примерах использование терминов TGF-beta 1, TGF-beta 2 и TGF-beta 3 относится к зрелым последовательностям TGF-beta 1, TGF-beta 2 и TGF-beta 3, как показано на Фигурах 3b, 3d и 3f, соответственно.
Пример 1. Иммунизация и первичный и вторичный скрининг супернатантов клеточной культуры B-клеток
4-х самцов кроликов Half-Lop (> 2 кг) иммунизировали подкожно человеческим белком TGF-beta1 (Фигура 3b) 250 мкг, смешанным с человеческим белком TGF-beta2 250 мкг (Фигура 3d), с получением общей дозы 500 мкг на кролика, эмульгированной в равном объеме полного адъюванта Фрейнда (CFA) путем энергичного смешивания шприцем. Кроликам вводили бустерные инъекции с интервалом 21 день с использованием неполного адъюванта Фрейнда (IFA) с забором крови из уха через 14 дней после иммунизации. Вводили 3 дозы смеси изоформ 1/2 перед конечной дозой только человеческого белка TGF-beta2 (500 мкг). Завершение введения происходило через 14 дней после конечного бустерного введения суспензий одиночных клеток селезенки, костного мозга и мононуклеаров периферической крови, полученных и замороженных в 10% DMSO/ FCS при -80°C.
Полученные иммунные ответы определяли с помощью ИФА. На 96-луночные планшеты Nunc-Immuno™ 1 Maxisorp™ наносили покрытие либо в виде человеческого белка TGF-beta1 (Peprotech, # 100-21C) при 2 мкг/мкл в PBS, человеческого белка TGF-beta2 (R & D systems, 302-B2-010/CF) или человеческого белка TGF-beta-3 (R & D-системы, 243-B3-010/CF) при 0,5 мкг/мл в PBS и инкубировали в течение ночи при 4°C. Планшеты промывали после каждого слоя (автоматизированно, 4×200 мл промывок PBS+0,05% Tween). Лунки блокировали 1% (мас./об.) казеином (VWR Chemicals, 440203H) в PBS путем инкубации при комнатной температуре (RT) в течение 1 часа. Сыворотки, log-разведения от 1/100 в 1% казеине добавляли и инкубировали в течение 1½ часов при комнатной температуре. В каждую лунку добавляли 100 мкл конъюгата козьего антикроличьего Fc-специфического антитела IgG и пероксидазы хрена (Jackson, 111-036-046) при разведении 1/3000 в 1% (мас./об.) казеине в PBS и инкубировали в течение 1 часа при комнатной температуре. Добавляли субстрат, 100 мкл TMB (3,3',5,5' Тетраметилбензидин, растворимый) и реакцию останавливали 50 мкл 2,5% раствора фторида натрия в dH2O. Оптические плотности (OD) определяли при 610 нм с использованием ИФА-ридера.
Культуры B-клеток получали с использованием метода, аналогичного описанному Zubler et al. (1985). Вкратце, В-клетки, полученные из мононуклеаров периферической крови (PBMC) из иммунизированных кроликов, культивировали с плотностью приблизительно 5000 клеток на лунку в 96-луночных планшетах для культивирования в 96-луночном планшете со средой RPMI 1640 с концентрацией 200 мкл/л (Gibco BRL), дополненной 10% FCS (Sigma Aldrich), 2% HEPES (Sigma Aldrich), 2% L-глутамином (Gibco BRL), 1% раствором пенициллина/стрептомицина (Gibco BRL), 0,1% бета-меркаптоэтанолом (Gibco BRL) 0,2% Нормоцином (Invivogen), 1% супернатант активированных человеческих мононуклеаров периферической крови (РВМС) и гамма-облученные мутантные клетки EL4 мышиной тимомы (5×104/лунку) в течение семи дней при температуре 37°C с в атмосфере 5% СО2.
Первичный скрининг на связывание TGF-beta:
Присутствие антител, специфичных к белку TGF-beta, в супернатантах культуры B-клеток определяли с использованием гомогенного анализа на основе флуоресценции с использованием гранул Superavidin™ (Bangs Laboratories), покрытых биотинилированным TGF-beta1 (Peprotech). Белок TGF-beta1 биотинилировали с использованием набора для биотинилирования Lightning-Link® (Innova Biosciences) в соответствии с инструкциями производителя.
10 мкл супернатанта культуры В-клеток переносили из 96-луночных культуральных планшетов со штрихкодом в 384-луночные аналитические планшеты со штрихкодом с черной стенкой, содержащие TGF-β1, иммобилизованный на гранулах (10 мкл/лунку), с использованием автоматизированного жидкостного манипулятора Bravo (Agilent). Связывание детектировали с помощью козьего антикроличьего IgG Fcγ-специфического конъюгата FITC (Jackson ImmunoResearch). Планшеты считывали в системе детектирования TTV Labtech mirrorball®.
После первичного скрининга супернатанты, положительные по связыванию TGF-beta, объединяли на 96-луночных планшетах со штрихкодом с использованием робота-захвата Beckman и B-клеток в планшетах для культивирования клеток, замороженных при -800°C.
Вторичный скрининг на связывание с TGF-beta 1, 2 и 3:
Для определения способности антител связываться с различными изоформами TGF-beta, супернатант B-клеток в этих основных планшетах подвергали скринингу в ИФА-анализе с 3 различными изоформами TGF-beta. Анализ ИФА включал нанесение покрытий в виде различных изоформ TGF-beta 1, 2, 3 (Peprotech) на 384-луночные планшеты Maxisorp™ (ThermoScientific/Nunc) с концентрацией 2 мкг/мл в PBS. Планшеты блокировали 1% BSA в PBS и затем инкубировали с 10 мкл/лунку супернатанта культуры В-клеток. Вторичное HRP-конъюгированное козье антитело против кроличьего fc IgG (Jackson ImmunoResearch) добавляли к планшетам с последующей визуализацией связывания с субстратом TMB (3,3',5,5'-тетраметилбензидином из EMD Millipore, 10 мкл/лунку). Оптическую плотность измеряли при 630 нм с использованием микропланшетного ридера BioTek Synergy 2.
Результаты первичного скрининга и вторичного скрининга
79 мышей, крыс и кроликов иммунизировали только человеческим TGF-beta1 (SEQ ID NO: 114; фиг. 3b) и скринировали на связывание TGF-beta 1 с различными уровнями положительных для TGF-beta 1 агентов связывания. Из этих 79 различных иммунизированных крыс, мышей и кроликов идентифицировали 2656 агентов связывания для антител против человеческого TGF-beta 1. Однако только 831 из этих лунок продемонстрировали связывание со всеми тремя изоформами на вторичном скрининге.
Как описано выше, 4 кролика иммунизировали как человеческим TGF-beta 1, так и человеческим TGF-beta 2. Всю сыворотку этих 4 кроликов анализировали на первичном скрининге и продемонстрировали 1367 положительных лунок для связывания TGF-beta 1 и затем подвергали вторичному скринингу на связывание со всеми тремя изоформами TGF-beta 1, 2 и 3, что привело к идентификации 1026 лунок со связыванием со всеми тремя изоформами TGF-beta.
После первичного и вторичного скрининга B-клетки, демонстрирующие связывание со всеми тремя изоформами, затем анализировали на блокирующую активность.
Анализ репортерного гена в клетках HEK-Blue TGF-beta с использованием рекомбинантного TGF-beta 1
Анализ репортерного гена был разработан с использованием клеток HEK-Blue TGF-beta (клеточная линия HEK-Blue TGF-beta, Invivogen). Клеточная линия HEK-Blue TGF-beta реагирует на присутствие TGF-beta путем экспрессии SEAP, который детектируется с помощью реагента колориметрического детектирования. Антитела, способные нейтрализовать TGF-beta, приведут к уменьшению сигнала, генерируемого в репортерной клеточной линии. Оценивали способность тестирующих агентов нейтрализовать TGF-beta 1.
Антитела титровали 3-кратно или добавляли в одной концентрации и инкубировали с изоформами человеческого TGF-beta 1, 2 или 3 (50 пг/мл TGF-beta-изоформы) в аналитической среде (DMEM, 4,5 г/л глюкозы, 10% об./об.) фетальной бычьей сыворотки, 50 ед/мл пенициллина, 50 мкг/мл стрептомицина, 100 мкг/мл Normoci, 2 мМ L-глутамина) в течение 30 минут до добавления 50000 клеток HEK-Blue TGF-beta и инкубировали в течение 16 часов при 37°С. SEAP, продуцируемый клетками в ответ на активацию TGF-beta, детектировали добавлением реагента Quanti Blue (Invivogen) в течение 1 часа при 37°С и путем детектирования с помощью поглощения при 630 нм. Максимальный сигнал генерировали лунки, содержащие HEK-Blue TGF-beta-клетки и TGF-beta, и минимальный сигнал генерировали с использованием избытка TGF-beta-нейтрализующего антитела.
Супернатант культуры B-клеток, содержащий BSN.4856, анализировали в одноточечном анализе репортерного гена TGF-beta1 (мастер-планшет 3142, из лунки D012). Антитело проявляло 80% ингибирования TGF-beta1. Процент ингибирования из анализов концентрационных кривых рассчитывали на основе максимального и минимального сигналов в аналитическом планшете.
Пример 2. Клонирование генов вариабельной области из В-клеток и экспрессия и характеристика активности рекомбинантного Fab в анализах in vitro
Данные связывания ИФА и анализов блокирования репортерных генов в Примере 1 позволили выбрать лунки для извлечения вариабельной области. Чтобы извлечь гены вариабельной области антитела из интересующих лунок, необходимо провести стадию деконволюции, чтобы обеспечить идентификацию антигенспецифических В-клеток в данной лунке, поскольку присутствует гетерогенная популяция В-клеток. Это было достигнуто с использованием метода флуоресценции фокусов (Clargo et al., MAb, Vol. 6, Iss. 1, 2014). Вкратце, иммуноглобулин-секретирующие В-клетки из положительных лунок смешивали со стрептавидиновыми гранулами (New England Biolabs) с покрытием биотинилированным TGF-beta1 и 1:1200 конечного разведения козьего антикроличьего Fcγ-специфичного FITC конъюгата (Jackson ImmunoResearch). После статической инкубации при 37°С в течение 1 часа, антиген-специфические В-клетки могут быть идентифицированы по наличию флуоресцентного ореола, окружающего эти B-клетки. Эти индивидуальные В-клетки, идентифицированные с помощью микроскопа Olympus, затем собирали микроманипулятором Eppendorf и осаждали в пробирку для ПЦР.
Гены вариабельной области антитела выделяли из одиночных клеток с помощью обратной транскрипции (ОТ)-ПЦР с использованием праймеров на вариабельную область тяжелой и легкой цепей. Проводили два раунда ПЦР с вложенной ПЦР для введения сайтов рестрикции на концах 3' и 5', что позволило клонировать вариабельную область в экспрессирующий вектор млекопитающего, содержащий кроличий Fab без шарнира (VH) или кроличью цепь каппа (VL). Конструкции тяжелых и легких цепей ко-трансфецировали в клетки Expi-293 с использованием ExpiFectamine™ 293 (Invitrogen) и рекомбинантного антитела, экспрессируемого в 48-луночном планшете с глубокими лунками в объеме 1 мл или в конической колбе на 30 мл. После 7-дневной экспрессии неочищенные транзиторные супернатанты собирали и тестировали снова на связывание с помощью ИФА и на блокирование в анализе репортерного гена, как описано в Примере 1. Связывание со всеми тремя изоформами было подтверждено с использованием рекомбинантного кроличьего Fab 4856 в ИФА. Последовательности представлены на Фигуре 1B.
Экспрессированную кроличью молекулу 4856 Fab очищали с помощью аффинного захвата с использованием мелкомасштабной системы очистки на основе вакуума. Вкратце, супернатант из 30 мл клеточной культуры стерильно фильтровали на 0,22 мкм фильтре перед добавлением 1 мл гранул GammaBind Plus™ (GE Healthcare). Смесь супернатанта/гранул затем переворачивали в течение часа, прежде чем надосадочную жидкость удаляли, применяя вакуум. Гранулы промывали PBS перед элюированием 0,1 М глицином с рН 2,7. Элюированные фракции нейтрализовали и буфер заменяли на PBS перед тем, как стерильно фильтровать через 0,22 мкм. Конечный анализ состоял из определения концентрации с помощью A280; очистки с помощью SEC-UPLC (колонка BEH200, Waters); и определения эндотоксина с помощью системы с картриджем PTS-Endosafe™ (Charles River).
Пример 3. Характеристика активности рекомбинантного кроличьего Fab в анализах in vitro
Анализ репортерного гена в клетках HEK-SEAP-SBE с использованием рекомбинантных TGF-beta 1, 2 и 3:
Затем очищенный кроличий Fab тестировали (n=2) в анализе TGF-beta с использованием репортерного гена, как описано в Примере 1, в 10-точечном дозовом ответа против TGF-beta 1, 2 и 3. Изоформы TGF-beta 1, 2 и 3 добавляли в концентрации 50 пг/мл и оценивали способность антитела нейтрализовать TGF-beta 1, 2 и 3.
Данные приводили в соответствие с использованием 4-параметрической логистической модели (Фигура 4a, 4b и 4c). IC50 рассчитывали на основе точки перегиба кривой (Таблица 1).
(n=2, из 5 отдельных образцов)
(0,01 нМ)
ТАБЛИЦА 1. Значения IC50 для очищенного кроличьего Fab 4856 в анализе репортерного гена в клетках HEK-Blue TGF-beta (Invivogen).
Очищенный кроличий Fab 4856 ингибировал TGF-beta1, TGF-beta2 и TGF-beta3-управляемый анализ репортерного гена в клетках HEK-Blue TGF-beta с IC50 0,04, 0,01 и 0,54 нМ, соответственно.
Анализ репортерного гена в совместной культуре BxPC3 и HEK-Blue TGF-beta с эндогенным TGF-beta:
Была разработана система совместного культивирования, состоящая из клеток Bx-PC3 (ATCC) и клеточной линии HEK-Blue TGF-beta (Invivogen). Клетки BXPC-3 конститутивно продуцируют и активируют TGF-beta. Клеточная линия HEK-Blue TGF-beta реагирует на присутствие активного TGF-beta экспрессией SEAP, которая детектируется с помощью реагента колориметрического детектирования. Антитела, способные нейтрализовать TGF-beta, приведут к уменьшению сигнала, генерируемого в репортерной клеточной линии.
Клетки HEK-Blue TGF-beta высевали в количестве 100000 клеток на лунку в DMEM с 10% FCS и инкубировали в течение 90 минут при 37°C. Тестируемые агенты титровали 3-кратно в бессывороточной DMEM, содержащей 0,2% (мас./об.) BSA и добавляли к клеткам HEK-Blue TGF-beta. Клетки BxPC3 добавляли в бессывороточную DMEM, содержащую 0,2% (мас./об.) BSA, в количестве 50000 клеток на лунку и инкубировали в течение 18 часов при 37°C. Максимальный сигнал генерировался из лунок, содержащих как клетки BX-PC3, так и HEK-Blue TGF-beta, и минимальный сигнал генерировался с использованием избытка TGF-beta-нейтрализующего антитела. SEAP определяли путем добавления реагента QuantiBlue в течение 1 часа при 37°C и измерения поглощения при 630 нм.
Очищенный кроличий Fab 4856 анализировали в анализе репортерного гена при совместном культивировании BxPC3-HEK-Blue TGF-beta (n=3). Процент ингибирования из анализов концентрационных кривых рассчитывали на основе максимального и минимального сигналов в анализе, и данные приводили в соответствие с использованием 4-х параметрической логистической модели (Фигура 5). IC50 рассчитывали на основе точки перегиба кривой (Таблица 2).
ТАБЛИЦА 2. Результаты эффективности кроличьего Fab 4856 в анализе репортерного гена в совместной культуре клеток BxPC3-HEK-Blue TGF-beta. Пять различных образцов кроличьего Fab 4856 тестировали в трех независимых экспериментах.
BSN.4856.rbFab ингибирует анализ репортерного гена в совместной культуре BxPC3-HEK-Blue TGF-beta с IC50 3,7 нМ.
Аффинность кроличьего Fab 4856
Аффинность кроличьего Fab 4856 к изоформам TGF-β 1, 2 и 3 определяли с помощью поверхностного плазмонного резонанса с использованием Biacore™ T200 (GE Healthcare).
Изоформы TGF-β 1, 2 и 3 (Peprotech) иммобилизовали на чипе CM5 Series S посредством химической аминоконденсации на Flowcell 2, 3 и 4 (соответственно) до уровня приблизительно 150RU. Буфер HBS-EP (10 мМ HEPES pH 7,4, 0,15 М NaCl, 3 мМ EDTA, 0,05% поверхностно-активного вещества P20, GE Healthcare) использовали в качестве рабочего буфера. Кроличий Fab 4856 титровали по всем трем изоформам при различных концентрациях (200-1200 нм) при скорости потока 30 мкл/мин. Поверхность регенерировали с помощью инъекции 2×10 мкл 10 мМ HCl при скорости потока 10 мкл/мин.
Кривые связывания с вычитанием фона анализировали с использованием программного обеспечения для оценки Biacore™ T200 (версия 1.0) в соответствии со стандартными процедурами. Кинетические параметры для кроличьего Fab 4856 определяли с использованием алгоритма «подбора с гетерогенным лигандном» с RI=0. Кинетические параметры приведены в Таблице 3.
Считается, что иммобилизация каждой изоформы TGFβ на сенсорном чипе Biacore™ с помощью лизиновых остатков мешает связыванию антитела с одним связывающим доменом и приводит к вторичному слабому взаимодействию (KD1). Данные были приведены в соответствие с гетерогенной моделью для учета двух независимых событий связывания. Считается, что более высокоаффинный компонент (KD2) представляет незакрытое взаимодействие и, следовательно, наиболее представительное измерение аффинности тестируемого антитела.
Таблица 3. Аффинность кроличьего Fab 4856 определяли с использованием анализа аффинности Biacore, n=5 для каждой группы.
Пример 4. Генерация химерных и гуманизированных трансплантатов антитела 4856
Антитело Fab 4856 было выбрано для дальнейшей оптимизации на основе его превосходной ингибирующей активности как в анализе репортерного гена HEK-Blue™-SBE, так и в анализе репортерного гена при совместном культивировании BxPC3-HEK-Blue™-SBE в сочетании с его способностью связываться со всеми тремя изоформами TGF-beta с высокой аффинностью.
Химерное антитело 4856
Вариабельные области антитела 4856 клонировали в отдельные экспрессирующие векторы тяжелых и легких цепей и экспрессировали в виде фрагмента человеческого Fab (без шарнира).
Ген VH (SEQ ID NO: 17) клонировали в вектор pMhFab-HIS6, который содержит ДНК, кодирующую человеческую константную область CH1 гамма-1 (аллотип G1m17) с усеченным шарниром и C-концевым маркером из шести гистидиновых остатков. Ген VL (каппа) (SEQ ID NO: 13) клонировали в вектор pMhCK, который содержит ДНК, кодирующую человеческую константную область каппа (аллотип K1m3).
Антитела экспрессировали с помощью транзиторной котрансфекции векторов тяжелой и легкой цепей в клетки Expi293F™.
Гуманизированное антитело 4856
Антитело 4856 гуманизировали путем трансплантации CDR из V-области кроличьего антитела на каркасы V-области человеческого зародышевого антитела.
Чтобы восстановить активность антитела, в гуманизированной последовательности также сохраняли ряд каркасных остатков из V-области кролика. Эти остатки выбирали с использованием протокола, описанного Adair et al. (1991) (Humanised antibodies. WO91/09967). Выравнивание последовательностей V-области кроличьего антитела (донора) с последовательностями V-области человеческой зародышевой линии (акцептора) показано на Фигурах 2a и 2b вместе с разработанными гуманизированными последовательностями.
CDR, трансплантированные от донорной на акцепторную последовательность, были такими, как определено Kabat et al. (см. выше), за исключением CDRH1, где используется комбинированное определение Chothia/Kabat (см. Adair et al., выше).
Гены, кодирующие ряд вариабельных последовательностей V-области тяжелой и легкой цепей, были разработаны и сконструированы методом автоматического синтеза ДНК2.0. Другие варианты V-областей тяжелой и легкой цепей были созданы путем модификации генов VH и VK посредством олигонуклеотид-направленного мутагенеза, включая, в некоторых случаях, мутации в CDR для модификации потенциальных сайтов изомеризации аспарагиновой кислоты.
Эти гены клонировали в ряд векторов, чтобы обеспечить экспрессию гуманизированного антитела 4856 Fab в клетках E.coli и млекопитающих. Цепи вариантов и их комбинации оценивали по их активности относительно исходного антитела, их биофизическим свойствам и пригодности для последующей обработки, что привело к выбору трансплантата легкой цепи gL3 и трансплантата тяжелой цепи gH13.
Человеческая V-область IGKV1-5 плюс JK4 J-область (Фигура 1I, также доступная от IMGT®, www.imgt.org, последний доступ к которому был получен до 5 января 2016 г.) были выбраны в качестве акцептора для CDR легкой цепи 4856. Остатки каркаса легкой цепи в трансплантате gL3 все взяты из гена человеческой зародышевой линии, за исключением остатков 1, 2, 3 и 71 (нумерация Kabat), где сохранялись донорные остатки аланин (А1), тирозин (Y2), аспарагиновая кислота (D3) и тирозин (Y71), соответственно. Сохранение остатков A1, Y2, D3 и Y71 было необходимо для полной эффективности гуманизированного антитела.
Человеческая V-область IGHV3-21 плюс JH5 J-область (Фигура 1I, также доступны от IMGT®, www.imgt.org, последний доступ к 05 января 2016 г.) были выбраны в качестве акцептора для CDR тяжелой цепи антитела 4856. Как и у многих кроличьих антител, ген VH антитела 4856 короче, чем выбранный человеческий акцептор. При выравнивании с человеческой акцепторной последовательностью каркас 1 области VH антитела 4856 не имеет N-концевого остатка, который сохраняется в гуманизированном антителе (Фигура 2b). Каркас 3 VH-области кроличьего 4856 также не содержит двух остатков (75 и 76) в петле между цепями D и E бета-листа: в трансплантате gH13 пропуск заполняется соответствующими остатками (лизин 75, K75, аспарагин 76, N76) из выбранной человеческой акцепторной последовательности (Фигура 2b). Остатки каркаса тяжелой цепи в трансплантатах gH13, gH23 и gH29 все взяты из гена человеческой зародышевой линии, за исключением остатков 48, 49, 73 и 78 (нумерация Kabat), где сохраняются донорные остатки изолейцин (I48), глицин (G49), серин (S73) и валин (V78), соответственно. Сохранение остатков E1, V2, Q3, I48, G49, S73 и V78 было необходимо для полной эффективности гуманизированного антитела.
В трансплантате gH20 каркасные остатки все взяты из гена зародышевой линии человека, за исключением остатков 48, 69, 71, 73 и 78 (нумерация Kabat), где сохранены донорные остатки изолейцин (I48), метионин (M69), лизин (K71), серин (S73) и валин (V78), соответственно.
Остаток 98 в CDRH3 трансплантатов gH13, gH20, gH23 и gH29 подвергали мутации из остатка глицина (G98) до остатка аланина (A98), таким образом удаляя потенциальный сайт изомеризации аспарагиновой кислоты из последовательностей gH13, gH20, gH23 и gH29.
Потенциальный сайт дезаминирования аспарагина в остатках N100e и G100f (Фигура 2b) удаляли из трансплантата gH23 путем мутации G100f до A100f и удаляли из трансплантате gH29 путем мутации N100e до D100e.
Экспрессия гуманизированного 4856 Fab
Исходные фрагменты Fab 4856 были сконструированы и протестированы в виде экспрессирующих векторов млекопитающих. Для достижения наивысшего выхода использование кодонов трансплантатов было изменено в соответствии с периплазматической экспрессией E.coli. Трансплантаты выравнивали с предыдущими гуманизированными Fab, которые исторически давали стабильно высокий выход, и соответствующие кодоны изменяли соответственно с каркасными последовательностями.
Для экспрессии гуманизированного Fab 4856 в E.coli гуманизированный ген V-области тяжелой цепи (SEQ ID NO: 54, SEQ ID NO: 68, SEQ ID NO: 82 или SEQ ID NO: 96) и ген V-области легкой цепи (SEQ ID NO: 40) клонировали в экспрессирующий вектор UCB pTTOD, который содержит ДНК, кодирующую константную область C-каппа (K1m3 аллотип) и человеческую CH1-область гамма-1 (аллотип G1m17). Гены fkpA и dsbC E.coli также вводили в экспрессирующую плазмиду, поскольку было обнаружено, что совместная экспрессия этих шапероновых белков улучшает выход гуманизированного Fab в штамме MXE016 E.coli во время ферментации с периодической подачей, используя IPTG для индукции экспрессии Fab. Легкие и тяжелые цепи Fab 4856 и полипептиды FkpA и DsbC экспрессировались из одного мультицистрона под контролем индуцируемого IPTG промотора tac.
Экспрессию Fab тестировали в продуцирующем штамме E.coli MXE016 с использованием 5 мл метода автоматической индукции. Комбинация шаперонов FkpA и DsbC значительно увеличила выход Fab.
Для экспрессии гуманизированного Fab 4856 в клетках млекопитающих ген V-области гуманизированной легкой цепи соединяли с последовательностью ДНК, кодирующей человеческую константную область C-каппа (аллотип K1m3), для создания непрерывного гена легкой цепи (SEQ ID NO: 41). Ген V-области гуманизированной тяжелой цепи соединяли с последовательностью ДНК, кодирующей человеческую CH1-область гамма-1 (аллотип G1m17), для создания непрерывного гена тяжелой цепи (SEQ ID NO: 55, SEQ ID NO: 69, SEQ ID NO: 83 или SEQ ID NO: 97). Гены тяжелой и легкой цепей клонировали в экспрессирующий вектор млекопитающих pMXE692 Cellca vector DGV 4856 gL3 gH13 VL VH.
Определение аффинности выделенного из E.coli Fab 4856 gL3gH13 с помощью Biacore
Антитело 4856 gL3gH13, продуцируемое в E.coli в соответствии с описанным выше способом, тестировали на аффинность к изоформам TGF-β 1, 2 и 3, которую определяли с помощью поверхностного плазмонного резонанса с использованием Biacore T200 (GE Healthcare). Изоформы человеческого TGF-β 1, 2 и 3 (Peprotech) иммобилизовали на чипе CM5 Series S с помощью химической реакции аминоконденсации на Flowcell 2, 3 и 4 (соответственно) до уровня приблизительно 20RU. Буфер HBS-EP (10 мМ HEPES pH 7,4, 0,15 М NaCl, 3 мМ EDTA, 0,05% Surfactant P20, GE Healthcare) использовали в качестве рабочего буфера. Антитело 4856 гL3gH13Fab титровали по всем трем изоформам при различных концентрациях (200-1,56 нм) при скорости потока 30 мкл/мин. Поверхность регенерировали с помощью инъекции 2×10 мкл 10 мМ HCl при скорости потока 10 мкл/мин.
Кривые связывания с вычитанием фона анализировали с использованием программного обеспечения T200 для оценки (версия 1.0, GE Healthcare) в соответствии со стандартными процедурами. Кинетические параметры определяли с использованием алгоритма гетерогенной подгонки с RI=0), как описано в Примере 3, и значения приведены в Таблице 4. Как и раньше, с кроличьей версией Fab в Таблице 3, KD2 Таблицы 4, как полагают, представляет собой значение незакрытого связывания для антитела 4856 gL3gH13Fab.
Таблица 4: Аффинность для гуманизированного Fab 4856, определенная с использованием анализа аффинности Biacore, n=4 для каждой группы.
Аналитическую гель-фильтрацию проводили для определения того, связывается ли трансплантат антитела 4856 gL3gH13 с полноразмерной последовательностью TGF-beta 1, включая латентно-ассоциированный пептид. Данные продемонстрировали, что антитело 4856 gL3gH13 не связывается с полноразмерным TGF-beta 1, включая латентно-ассоциированный пептид (данные не показаны).
Пример 5. in vitro ингибирующая активность гуманизированных трансплантатов
Ингибирующая активность в анализе репортерного гена HER-Blue TGF-beta с использованием рекомбинантных TGF-beta 1, 2 и 3:
Ингибирующую активность 4856 гуманизированных трансплантатов gL3gH13, gL3gH20, gL3gH23 и gL3gH29 анализировали в анализе репортерного гена HEK-Blue TGF-beta с использованием рекомбинантных TGF-beta 1, 2 и 3, как описано в Примере 1, в 10-точечном ответе дозы против TGF-beta 1, 2 и 3. Изоформы TGF-beta-1, 2 и 3 добавляли в концентрации 50 пг/мл и оценивали способность антитела нейтрализовать TGF-beta 1, 2 и 3. Данные приводили в соответствие с использованием 4-х параметрической логистической модели. IC50 рассчитывали на основании точки перегиба кривой (Таблица 5). Из Таблицы 5 видно, что гуманизированные трансплантаты, особенно gL3gH13 и gL3gH20, эффективны для нейтрализации активности TGF-beta 1, 2 и 3.
Таблица 5: Ингибирование экзогенных изоформ TGF-beta 1, 2 и 3.
Ингибирующая активность в анализе репортерного гена при совместном культивировании BxPC3 и HEK-Blue TGF-beta с эндогенным TGF-beta:
Ингибирующую активность гуманизированных трансплантатов gL3gH13, gL3gH20, gL3gH23 и gL3gH29 4856 анализировали с помощью анализа репортерного гена при совместном культивировании BxPC3 и HEK-Blue TGF-beta, как описано в Примере 3. Процент ингибирования от анализов концентрационных кривых рассчитывали на основе максимального и минимального сигналов в анализе, и данные приводили в соответствие с использованием 4-х параметрической логистической модели. IC50 рассчитывали на основе точки перегиба кривой, и результаты показаны в Таблице 6. Из Таблицы 6 можно заметить, что гуманизированные трансплантаты, особенно gL3gH13, gL3gH20 и gL3gH29, эффективны для нейтрализации TGF-beta, экспрессируемого и активированного клетками в этом анализе.
Таблица 6: Ингибирование TGF-beta, экспрессируемого клетками BxPC3, в анализе с совместным культивированием с клетками HEK-Blue TGF-beta.
Пример 6. Ингибирующая активность гуманизированных трансплантатов 4856 в индуцированной адриамицином in vitro модели фиброза почки
Адриамицин-индуцированная нефропатия является хорошо охарактеризованной моделью приобретенного фиброза почек у грызунов с патологическими особенностями, сходными с гломерулосклерозом человека и тубулоинтерстициальным фиброзом. Мезангиальные клетки являются одним из основных типов клеток, участвующих в фиброзном фенотипе в ответ на адриамицин. Была создана человеческая in vitro модель для фиброзного ответа на обработку адриамицином, и проводили оценку способности TGF-beta-нейтрализующих трансплантатов gL3gH13, gL3gH20, gL3gH23 и gL3gH29 антитела 4856 Fab модулировать депонирование компонентов внеклеточного матрикса (ECM) в этой системе.
Первичные человеческие почечные мезангиальные клетки (HRMC, Innoprot) высевали в количестве 1,6×104 клеток/см2 в присутствии 10 нМ адриамицина и тестируемых трансплантатов 4856 Fab gL3gH13, gL3gH20, gL3gH23 и gL3gH29 и контрольного Fab (3-кратные последовательные разведения в диапазоне от 0,2 до 6000 нМ). Клетки инкубировали в течение 6 дней при 37°С, 5% СО2, затем лизировали в 0,25 М NH4OH/25 мМ Tris (30 мин при 37°С) и депонированный ECM фиксировали в ледяном метаноле (30 мин при -20°С). Депонирование отдельных компонентов ECM детектировали путем визуализации с высоким содержания после иммуноокрашивания для фибронектина (AlexaFluor488-конъюгированный Ebioscience 53-9869-82), Коллагенов I и III (поликлональные кроличьи антитела Millipore AB745 и AB747) и Коллагена типа IV (конъюгированного с Efluor660) Ebioscience 50-9871-80). Получали изображения и интенсивность флуоресценции детектировали с помощью Cellomics Arrayscan. Максимальный сигнал получали из лунок, содержащих обработанные адриамицином клетки, в отсутствие Fab, и минимальный сигнал получали в лунках, где клетки не подвергались воздействию адриамицина.
Процент ингибирования из анализов концентрационных кривых рассчитывали на основе максимальной и минимальной интенсивности флуоресценции в анализе, и данные приводили в соответствие с использованием 4-параметрической логистической модели. Изображения и показанные графики представляют собой три повторных эксперимента.
На Фигуре 6 показаны типичные изображения депонирования ECM в HRMC в ответ на 10 нМ адриамицин и в присутствии указанных концентраций TGF-beta-нейтрализующих 4856 Fab-трансплантатов gL3gH13, gL3gH20, gL3gH23 и gL3gH29 или контрольного Fab.
На Фигуре 7 показаны типичные концентрационные кривые для 4856 Fab-трансплантатов gL3gH13, gL3gH20, gL3gH23 и gL3gH29 в in vitro-анализе с адриамицином.
Четыре протестированных TGF-beta-нейтрализующих Fab-трансплантата ингибировали индуцированное адриамицином депонирование ECM в HRMC (Таблица 7).
Таблица 7: Ингибирование депонирования ECM с помощью 4856 Fab-трансплантатов gL3gH13, gL3gH20, gL3gH23 и gL3gH29 в индуцированной адриамицином модели фиброза почек (среднее геометрическое значение из 3 повторных экспериментов).
n=3
n=3
n=3
Следует отметить, что верхняя и нижняя асимптоты некоторых кривых фиксировались с минимальными или максимальными значениями.
Пример 7. Ингибирующая активность гуманизированного трансплантата 4856 в in vitro модели интерстициального фиброза легкого человека
Эпителиальное повреждение и активация фибробластов являются важными событиями, приводящими к депонированию ECM во время фиброзного процесса. Чтобы создать in vitro модель интерстициального фиброза легкого, был разработан анализ с использованием первичных человеческих эпителиальных клеток легкого (SAEpC, ATCC) и фибробластов легкого (АТСС), выделенных от пациента IPF. Совместная культура этих двух типов клеток в среде эпителиальных клеток индуцирует значительное депонирование ECM даже в отсутствие дополнительного стимула, что позволяет изучать антифиброзные агенты.
1,8×104 первичных человеческих эпителиальных клеток малых дыхательных путей (SAEpC) и равное количество фибробластов легких IPF высевали на см2 (всего 3,6×104 клеток/см2) и совместно культивировали в течение 7 дней при 37°С, 5% СО2. 4856 Fab-трансплантат gL3gH13 и контрольный Fab подвергали 3-кратному титрованию в диапазоне от 0,03 до 1000 нм. Через 7 дней совместного культивирования жизнеспособность клеток оценивали с помощью Presto Blue, затем клетки лизировали в 0,25 М NH4OH/25 мМ Tris (30 мин при 37°С) и депонированный ECM фиксировали в ледяном метаноле (30 мин при - 20°С). Депонирование отдельных компонентов ECM детектировали путем визуализации с высоким содержанием после иммуноокрашивания для фибронектина и коллагена типа I, III, IV и V. Были получены изображения и интенсивность флуоресценции, детектированные с помощью Cellomics Arrayscan. Максимальный сигнал генерировался в необработанной совместной культуре, а минимальный сигнал генерировался при использовании избытка Fab.
Процент ингибирования после анализов концентрационных кривых рассчитывали на основе максимального и минимального сигналов в анализе, и данные приводили в соответствие с использованием 4-параметрической логистической модели. IC50 рассчитывали на основе точки перегиба кривой. Изображения и показанные графики представляют собой три повторных эксперимента.
На Фигуре 8 показаны изображения депонирования ECM с помощью SAEpC и совместных культур IPF фибробластов в присутствии указанных концентраций 4856 Fab-трансплантата gL3gH13 и контрольного Fab.
На Фигуре 9 показаны концентрационные кривые 4856 Fab-трансплантата gL3gH13 и контрольного Fab в анализе совместной культуры клеток легких человека.
В Таблице 7 показаны результаты эффективности для ингибирования депонирования ECM с помощью 4856 Fab-трансплантата gL3gH13 в анализе совместного культивирования клеток легких (среднее геометрическое из 3 повторных экспериментов)
Депонирование ECM в совместных культурах SAEpC и фибробластов IPF ингибировалось с помощью 4856 Fab-трансплантата gL3gH13.
Пример 8. Ингибирующая активность гуманизированного трансплантата 4856 в in vitro модели фиброза почки человека
Способность 4856 Fab gL3gH13 ингибировать депонирование фибронектина и коллагена в первичных клетках почки человека оценивали с использованием тестов накопления внеклеточного матрикса (ECM) на монокультуре человеческих почечных проксимальных трубчатых эпителиальных клетках (RPTEC), стимулированных TGF-beta 1, 2 или 3, и на совместной культуре почечных проксимальных трубчатых эпителиальных клеток (RPTEC) с человеческими почечными фибробластами (HRF) (без стимуляции).
Человеческие почечные проксимальные трубчатые эпителиальные клетки (RPTEC, Innoprot) и человеческие почечные фибробласты (HRF, InnoProt) высевали в количестве 2000 клеток на лунку (соотношение 1:1 в совместной культуре) на 384-луночный черный планшет с прозрачным дном (Corning) в присутствии 0,1-100 мкг/мл (0,2-2000 нМ) антитела против TGF-beta (gL3gH13 Fab) или контрольного Fab и 10 нг/мл TGF-beta1 (Peprotech), TGF-beta2 (R & D) или TGF-beta3 (R & D) для монокультуры RPTEC или без экзогенного TGF-beta (без стимуляции) для совместной культуры RPTEC и HRF в конечном объеме 50 мкл в Базальной среде для почечных эпителиальных клеток+0,5% Fcs и добавки (ATCC).
Через 7 дней инкубации при 37°С 5% СО2 клетки промывали в PBS и лизировали 20 мкл 0,25 М NH4OH/25 мМ Tris в течение 15 мин при 37°С. Матрицу промывали 3 раза в PBS, фиксировали в 40 мкл 100% метанола в течение 30 мин при -20°С и промывали 3 раза в PBS перед окрашиванием с использованием антител против фибронектина (eBiosciences), коллагена I (Millipore), коллагена III (Millipore), коллагена IV (eBios ciences) и антитела против коллагена V (Abcam). Планшеты сканировали на ридере Cellomics Arrayscan HC, используя 3-канальный протокол в рамках биоприложения профилирования «Cellomics CellHealth» и 10-кратный объектив (новая камера X1) с 2×2-битнированием (1104×1104 пикселей/поле).
Хотя были получены данные считывания для коллагена IV, результаты были исключены из-за неприемлемых окон анализа и изменчивости.
Результаты представлены в Таблице 9 и на Фигурах 10a, b, c и d и на Фигурах 11a и b, которые демонстрируют, что gL3gH13 Fab способен ингибировать индуцированное TGF-beta1, 2 и 3 накопление фибронектина и коллагена I, III и V в системе монокультуры RPTEC и в системе совместной культуры RPTEC и HRF с эндогенно продуцируемым TGF-beta.
Таблица 9: IC50 и среднее геометрическое IC50 (nM) (N=3) для gL3gH13:
Пример 9. in vivo модель фиброза легкого мыши
i) 7-дневное стимулирование
Острая вызванная блеомицином модель повреждения легких включает местное введение гликопептидного блеомицина непосредственно в легкие мышей. Это индуцирует воспалительный ответ, связанный с увеличением ингибитора активации плазминогена-1 (PAI-1), и, в конечном итоге, приводит к легочному фиброзу. PAI-1 транскрипционно регулируется TGF-beta и может выступать в роли мощного фиброгенного медиатора, индуцирующего рекрутирование воспалительных клеток и депонирование внеклеточного матрикса (ECM) (Ghosh and Vaughan, 2012, J Cell Physiol, 227: 493-507),
Любой эффект на тестируемые антител Fab против TGF-beta для ограничения фиброгенеза, такой как ингибирование PAI-1, свидетельствует о том, что пан-специфическое TGF-beta блокирующее Fab, доставляемое непосредственно в легкие, является жизнеспособным терапевтическим средством против легочного фиброза у людей.
4856 Fab-трансплантаты (гуманизированные) вводили местно непосредственно в легкие мышей через интраназальный путь (i.n). Мышам C57/BL6 вводили 4856gL3gH13 или 4856gL3gH29 (по 200 мкг/мышь) за 1 час до стимулирования блеомицином (o.p 0,05Ед/мышь) и через 6 часов после. Мыши впоследствии получали 4856gL3gH13 или 4856gL3gH29 ((i.n) 200 мкг/мышь) каждые 12 часов, пока не прекратили прием на 7-й день. Сразу же после прекращения приема собирали бронхоальвеолярную лаважную жидкость (BAL) и определяли общие концентрации PAI-1 с помощью ИФА. Статистический анализ проводили с помощью одностороннего ANOVA против контрольной группы, обработанной блеомицином.
Результаты этого введения двух 4856Fab (4856gL3gH13 и 4856gL3gH29) показаны на Фигуре 12. На Фигуре 12 показано, что у мышей, стимулированных блеомицином, значительно повышался уровень PAI-1 в BAL по сравнению с контрольными мышами, стимулированными солевым раствором, и что гуманизированные Fab, 4856gL3gH13 и 4856gL3gH29 способны ингибировать индуцированный блеомицином PAI-1 на 49% и 64%, соответственно, при доставке непосредственно в легкие.
Во втором исследовании мышам C57/BL6 вводили гуманизированные 4856gL3gH13 (по 20, 60, 200 мкг/мышь) за 1 час до стимулирования блеомицином (o.p 0,05Ед/мышь) и через 6 часов. Мыши впоследствии получали 4856gL3gH13 каждые 12 часов, пока прием не прекращали на 7-й день. Сразу же после прекращения приема BAL собирали, и общие концентрации PAI-1 определяли с помощью ИФА. Статистический анализ проводили односторонним ANOVA против контрольной группы, обработанной блеомицином. *p≤0,05, **p≤0,005, ***p≤0,0005, ****p≤0,00005.
Чтобы продемонстрировать превосходную эффективность 4856gL3gH13 в этой системе, на Фигуре 13 показано влияние 4856gL3gH13 на блеомицин-индуцированный PAI-1 в разных дозах. Как было показано ранее, блеомицин вызывает увеличение уровня BAL PAI-1, который может быть значительно ингибироваться до 76% с использованием 200 мкг/мышь 4856gL3gH13 и до 45% с использованием 60 мкг/мышь 4856gL3gH13.
Это демонстрирует, что доставленный местно (i.n) 4856gL3gH13 значительно ингибирует острый блеомицин-индуцированный PAI-1? и что можно местно ингибировать TGF-beta в легком, потенциально избегая нежелательных системных событий.
ii) 28-дневное стимулирование
Более длительные эффекты стимулирования блеомицином вызывали легочный фиброз, поэтому аналогичное исследование проводили на мышах в течение 28 дней с муринизированным 4856gL3gH13 (далее 4856), которое дозировали профилактически с 1-го дня, а также с 13-го дня стимулирования блеомицином. Это более позднее введение 4856 позволяет фиброзу как можно сильнее развиться в легком до начала обработки.
Влияние 4856 на блеомицин-индуцированный легочный фиброз оценивали путем ослабления депонирования ECM и дифференцировки миофибробластов в легких. Депонирование ECM определяли гистологически в ткани, погруженной в парафин, путем окрашивания на коллаген с использованием Picro Sirius Red (PSR). Это подтверждается более количественным анализом уровня гидроксипролина в расщепленной легочной ткани. Гидроксипролин является основным компонентом коллагена и может использоваться для оценки количества коллагена в тканях. Кроме того, количество миофибробластов; это преобладающий тип клеток, которые, как считается, ответственны за депонирование коллагена в легком, определяли с использованием иммуногистохимического (IHC) окрашивания для α-Гладкомышечного актина (α-SMA). Более того, ингибирование фосфорилированного гомолога белка «Mothers against decapentaplegic» 2 и 3 (p-Smad2/3) также определяли с помощью IHC, чтобы продемонстрировать специфическое ингибирование с помощью 4856 сигнального пути TGF. Все статистические данные определяли с использованием непарного t-теста против назначенной контрольной группы, стимулированной блеомицином. *Р=0,05; **р=0,01; ***р=0,001; ****р=0,0001.
a) 4856 улучшает вызванное блеомицином депонирование коллагена в легких
Обработка 4856 с 1 по 28 день. Мышей (самцы c57BL/6, n=8/группа) обрабатывали физиологическим раствором (i.t, 50 мкл) или блеомицином (i.t, 50 мкл, 0,5 мг/мл) в течение 28 дней. Кроме того, мышей обрабатывали либо носителем (i.n, 25 мкл), либо 4856 (i.n, 25 мкл, 400 мкг/мышь) два раза с 1 по 28 день.
Обработка 4856 с 13 по 28 день. Мышей (самцы c57BL/6, n=8/группа) обрабатывали физиологическим раствором (i.t, 50 мкл) или блеомицином (i.t, 50 мкл, 0,5 мг/мл) в течение 12 или 28 дней. Кроме того, мышей обрабатывали либо носителем (в, 25 мкл), либо 4856 (в, 25 мкл, 400 мкг/мышь) два раза в день с 13 по 28 день.
Анализ. Всю левую долю фиксировали в 4% формалине в течение 6 ч и погружали в парафин. 5 мкм срезы разрезали и окрашивали PSR. Изображения визуализировали с использованием микроскопа Nikon Eclipse 80i (Nikon, Badhoevedorp, Netherlands), а фиброзную область, как минимум, из четырех полей на мышь, анализировали с использованием ImageJ (V. 1.42q, National Institutes of Health, USA). Количество белка коллагена в трех нижних долях правого легкого (азигулярная доля, сердечная доля и диафрагмальная доля) определяли с помощью анализа гидроксипролина. После гидролиза в 6 М HCl в течение трех часов при 120°С. рН образцов доводили до 6 с помощью 6 М NaOH. Затем к каждому образцу добавляли 0,06 М хлорамина Т и инкубировали в течение 20 мин при комнатной температуре. Затем добавляли 3,15 М хлорной кислоты и 20% п-диметиламинобензальдегида, и образцы инкубировали в течение дополнительных 20 мин при 60°С. Поглощение определяли при 557 нм с помощью спектрофотометра для микропланшетов Spectra MAX 190.
Результаты. Интратрахеальная (i.t) инстилляция блеомицина с использованием микрораспылителя (50 мкл, 0,5 мг/мл) индуцировала выраженный легочный фиброз по сравнению с контрольными мышами, которых обрабатывали инстилляцией физиологического раствора (0,9% NaCl, растворитель блеомицина). Это продемонстрировано усилением окрашивания PSR и повышенным содержанием гидроксипролина в легких (Фигуры 14 и 15). Кроме того, эти фиброзные изменения были более выраженными через 28 дней, чем через 12 дней (Фигура 15), что указывает на то, что тяжесть фиброза прогрессировала с течением времени.
Обработка с использованием 4856 с 1 по 28 день (25 μ L i.n; 400 мкг/мышь, два раза в день) приводила к значительному снижению как PSR (Фигура 14А), так и содержания гидроксипролина в легких (Фигура 14В). Это предполагает, что 4856 может предотвратить блеомицин-индуцированный легочный фиброз. Кроме того, введение 4856 мышам, стимулированным блеомицином с 13 по 28 день, значительно ограничивало прогрессирующее увеличение PSR (Фигура 15A) и гидроксипролина (Фигура 15B), наблюдаемое на 28-й день, по сравнению с мышами, обработанными носителем. Это предполагает, что 4856 способен ограничивать прогрессирование заболевания, при его введении того, как фиброз уже проявляется.
b) 4856 улучшает дифференцировку блеомицин-индуцированных миофибробластов в легких
Мышей (самцы c57BL/6; n=8/группа) обрабатывали физиологическим раствором (i.t 50 мкл) или блеомицином (i.t, 50 мкл, 0,5 мг/мл) в течение 12 или 28 дней. Кроме того, мышей обрабатывали либо носителем (i.n 25 мкл) или 4856 (i.n 25 мкл; 400 мкг/мышь) два раза в день с дня 1 по 28 или с дня 13 по 28 день. Миофибробласты характеризуются экспрессией α-гладкомышечного актина (α-SMA). Фибробласты, положительные для α-SMA, были обнаружены путем инкубации с моноклональными антителами против αSMA (клон 1A4, Sigma-Aldrich, Ste inheim, Germany). Экспрессию визуализировали вторичными антителами, мечеными пероксидазой хрена, и 3,3-диаминобензидин тетрагидрохлоридом (DAB) (Sigma-Aldrich). Моноклональные мышиные IgG-антитела (Calbiochem, San Diego, CA, USA) использовали для изотипических контролей. Для каждой мыши оценивали четыре разных поля.
Введение блеомицина также приводило к увеличению дифференцировки миофибробластов в легких, характеризующейся экспрессией α-SMA IHC (Фигура 16). На Фигуре 16А показано, что дифференцировка миофибробластов, индуцированная блеомицином в легком, ингибировалась при введении 4856 с 1 по 28 день. Кроме того, хотя не наблюдалось значительного увеличения экспрессии α-SMA между 12 и 28 днями обработки блеомицином, введение 4856 с 13 по 28 день также вызывало значительное ослабление дифференцировки миофибробластов. Кроме того, она снижалась до нижнего уровня экспрессии α-SMA, наблюдаемой после обработки блеомицином в течение 12 дней, предполагая возможное изменение фиброзных процессов в этот момент времени (Фигура 16B).
c) 4856 ингибирует индуцированную блеомицином сигнализацию TGF-β в легких.
Мышей (самцы c57BL/6; n=8/группа) обрабатывали физиологическим раствором (i.t 50 мкл) или блеомицином (i.t, 50 мкл, 0,5 мг/мл) в течение 12 или 28 дней. Кроме того, мышей обрабатывали либо носителем (i.n 25 мкл) или 4856 (i.n 25 мкл; 400 мкг/мышь) два раза в день с 1 по 28 день или с 13 по 28 день. Срезы легких окрашивали козьими антителами против pSmad2/3 (Santa Cruz Biotechnology, Heidelberg, Germany) и антителами против коллагена I типа (Abcam, Cambridge, UK). В качестве вторичных антител использовались HRP-конъюгированные антитела или Alexa Fluor (Life Technologies, Дармштадт, Германия). Посторонние антитела соответствующего изотипа служили в качестве контроля. Ядра окрашивали с использованием DAPI (Santa Cruz Biotechnology). Окрашивание визуализировалось с помощью микроскопа Nikon Eclipse 80i (Nikon, Badhoevedorp, Netherlands). Экспрессию pSmad2/3 в клетках, положительных по коллагену 1-го типа, оценивали в трех разных полях на мышь.
Блеомицин-индуцированный фиброз легких ассоциировался с увеличением экспрессии pSmad2/3 в клетках, положительных по коллагену 1-го типа, как на 12-й день, так и в большей степени на 28-й день по сравнению с контрольной группой, обработанной физиологическим раствором (Фигура 17B). Обработка с помощью 4856 с 1 по 28 день (Фигура 17А) и с 13 по 28 день (Фигура 17В) значительно ингибировала экспрессию pSmad2/3 ниже, чем у контрольных мышей, получавших физиологический раствор, предполагая, что TGFβ-зависимое Smad2/3 фосфорилирование полностью блокировалось с помощью 4856. Кроме того, 4856, которое вводили с 13 по 13 день, может отменить индуцированное блеомицином увеличение экспрессии pSmad2/3, наблюдаемое после 12 дней стимулирования блеомицином вместе с носителем, что коррелирует с эффектом, наблюдаемым при дифференцировке миофибробластов.
d) Вывод
4856 оказывало мощные антифиброзные эффекты в мышиной модели индуцированного блеомицином фиброза легкого и улучшал гистологические изменения в депонировании коллагена (PSR окрашивание), накапливания коллагена (анализ гидроксипролина), влияло на дифференцировку миофибробластов (α-SMA экспрессия), а также на активацию канонической сигнализации TGF-β (экспрессия pSmad2/3). Кроме того, 4856 доказал свою эффективность при введении либо профилактически с 1 по 28 день, либо в качестве воздействия с 13 по 28 день после того, как фиброзные изменения уже были очевидны. Это подтверждает гипотезу о возможности местного ингибирования TGFβ в легких, потенциально избегая нежелательных системных событий.
Пример 10. Биофизический анализ гуманизированных трансплантатов 4856 Fab
Гуманизированные трансплантаты антитела 4856: gL3gH13, gL3gH20, gL3gH23, gL3gH29 подвергали серии биохимических и биофизических анализов для скрининга и отбора наиболее надежной молекулы для разработки и стабильности введения. Анализы включали сравнение таких характеристик, как Tпл (температура плавления в середине процесса разворачивания белка); экспериментальная pI и стабильность агрегации в интерфейсе воздух-жидкость (имитация напряжения сдвига при изготовлении и стабильность распыления); и склонность к дезамидированию.
Измерение термостабильности (Tпл)
Проводили анализ теплового сдвига на основе флуоресценции (также называемый анализом «thermofluor») с получением Tпл (температура в середине процесса разворачивания белка) для оценки термостабильности очищенных молекул. Реакционная смесь содержала 5 мкл 30-кратного SYPRO® Orange (Invitrogen), разбавленного PBS из исходного раствора 5000X и 45 мкл образца при 0,12 мг/мл (в PBS pH 7,4). 10 мкл смеси распределяли по четыре повтора в 384-луночный прозрачный ПЦР-планшет, и реакцию осуществляли на системе 7900HT Fast Real-Time (Applied Biosystems) для ПЦР в реальном времени. Устройство нагрева системы ПЦР было установлено на уровне от 20 до 99°C при скорости нарастания 1,1°C мин-1. Устройство с зарядовой связью контролировало изменения флуоресценции в лунках. Увеличение интенсивности наносили на график, точку перегиба наклона (слоев) использовали для генерации Tпл.
Tпл (температура в середине процесса разворачивания белка) определяли с помощью анализа «thermofluor». В этом методе SYPRO оранжевый (флуоресцентный краситель) используется для контроля процесса разворачивания путем связывания с гидрофобными областями, которые становятся экспонированными во время теплового расширения. Более высокое значение Tпл приравнивается к большей молекулярной стабильности и устойчивости к развитию напряжения распыления.
Один домен разворачивания, как и ожидалось, наблюдали для всех молекул, что эквивалентно домену разворачивания Fab. Результаты суммированы в Таблице 10.
Можно было ранжировать молекулы на основе их температуры плавления: gL3gH13, как было показано, имеет самую высокую температуру плавления, замена N109G на D109G в HC CDR3 (gL3gH29) привела к снижению температуры плавления на 2°C, и оба, gL3gH23 и gL3gH20 продемонстрировали дальнейшее снижение температуры плавления на 2°C. gL3gH13 имел самую высокую температуру плавления 79°C, что делает его отличным кандидатом для использования при местной доставке в легкие с помощью распыления, где Fab должен сохранять достаточную биологическую активность после распыления.
Таблица 10: Анализ Tпл: «Thermofluor» анализ: gL3gH13> gL3gH29> gL3gH20=gL3gH23
Экспериментальная pI и анализ вариантов заряда
Очищенные образцы анализировали с использованием системы cIEF ICE3 с цельной капиллярной системой визуализации (ProteinSimple). Образцы готовили путем смешивания следующего: 30 мкл образца (из 1 мг/мл материала в воде класса ВЭЖХ), 35 мкл 1% раствора метилцеллюлозы (Protein Simple), 4 мкл pH3-10 амфолитов (Pharmalyte), 0,5 мкл 4,65 и 0,5 мкл 9,77 синтетических pI-маркеров (ProteinSimple), 12,5 мкл 8M раствора мочевины (Sigma-Aldrich). Для получения конечного объема до 100 мкл использовали воду класса ВЭЖХ. Смесь быстро встряхивали, чтобы обеспечить полное перемешивание и центрифугирование при 10000 об/мин в течение 3 минут для удаления пузырьков воздуха перед анализом. Образцы фокусировали в течение 1 мин при 1,5 кВ, затем 5 мин при 3 кВ, а изображения капилляра А280 были получены с использованием программного обеспечения ProteinSimple. Полученные электроферограммы сначала анализировали с использованием программного обеспечения iCE3 и оценивали значения pI (линейная зависимость между pI-маркерами). Затем калибровочные электроферограммы интегрировали с использованием программного обеспечения Empower (Waters).
pI всех ведущих кандидатов была высокой (см. Таблицу 11), так что маловероятно, что молекулы будут иметь приблизительно нулевой общий молекулярный заряд (при увеличении риска агрегации) при ожидаемом рН состава. Было установлено, что экспериментальная pI была одинаковой для всех молекул, и поэтому нельзя было их различить.
Таблица 11: Экспериментальная pI

Склонность к агрегации на границе воздух-жидкость
Очищенные образцы (3×250 мкл аликвоты) в PBS, рН 7,4 при 1 мг/мл встряхивали при 1400 об/мин при 25°С в 1,5 мл пробирках eppendorf с использованием Eppendorf Mixmate. Образцы анализировали на образование мутности в различные моменты времени после встряхивания, получая поглощение при 595 нм с использованием спектрофотометра (Varian). Данные наносили на график в зависимости от времени.
Все ведущие кандидаты подвергали стрессу путем встряхивания для получения информацию об агрегационной стабильности на границе воздух-жидкость. Это служило для имитации усилий сдвига во время производства, а также потенциальной стабильности при распылении. Агрегационную стабильность контролировали измерением мутности при 595 нм до 144 часов. Скорость агрегации была медленной (низкие значения поглощения), и между трансплантатами не наблюдалось различий.
Анализ состояния дезамидирования Asn (N) 109 (CDR3 тяжелой цепи)
В CDR3 тяжелой цепи для gL3gH13, gL3gH20 (как N109G) и для gL3gH23 (N109A) присутствует мотив дезамидирования. Химическая нестабильность на этом сайте может привести к гетерогенности продукта и иммуногенности. Трансплантат gL3gH29 имеет D109G в этом сайте (дезамидированный продукт) для тестирования пригодности в качестве кандидата при одновременной минимизации риска дезамидирования.
Базовое процентное дезамидирование на N109 в CDR3 тяжелой цепи для gL3gH13, gL3gH20 и gL3gH23 сразу после очистки определяли путем (i) трипсинового расщепления/пептидного картирования/масс-спектрометрии и (ii) капиллярного визуализированного изоэлектрического фокусирования (ICE3). Скорость/склонность сайта N109 к созданию дезамидата (потеря аммиака, образование кислотных компонентов) определяли, подвергая три молекулы воздействию ускоренных стрессовых условий, которые, как известно, способствуют дезамидированию (рН 8, 37°С).
(i) Масс-спектрометрия
Аликвоты (50 мкг) восстанавливали с помощью DTT, алкилировали иодацетамидом, затем расщепляли трипсином (1:20 об/об) в течение ночи при комнатной температуре. Гидролиз (~ 2 мкг) анализировали путем инъекции на колонку С18 (1×150 мм BEH-300), уравновешенную 0,2% муравьиной кислотой/водой. Полученные пептиды элюировали со скоростью 20 мкл/мин в градиенте ацетонитрила в масс-спектрометр Thermo Fusion, работающий в режиме +ve-ion. Комплектование в зависимости от данных (DDA) состояло из полного сканирования orbitrap (разрешение 120000) с последующей фрагментацией HCD и измерением с использованием ионной ловушки наиболее интенсивных предшественников. Данные MS анализировали с использованием Thermo Pepfinder для соответствия полученным спектрам с ожидаемой последовательностью антитела.
Процент базального уровня дезамидирования (потери аммиака) в сайте N109G (CDR3 тяжелой цепи) в gL3gH13 и gL3gH20 был сходным (~4%), тогда как при N109A для gL3gH23 не было отмечено дезамидирования.
После ускоренного стресса (рН 8 в течение 2 недель при 4°С и 37°С) не было изменений уровня дезамидирования для любого трансплантата Fab (Таблица 12).
В целом, замена N109G на N109A приводила к тому, что gL3gH23 имел потенциально более низкий риск дезамидирования. Однако, поскольку базальный уровень был низким для всех, и не было повышенной склонности после ускоренного стресса, все молекулы имели уровень дезамидирования, который был бы подходящим для терапевтического кандидата.
Таблица 12: Процент дезаминирования до и после ускоренного стресса (pH 8).
(ii) Визуализированное капиллярное изоэлектрическое фокусирование (ICE3)
ICE3 осуществляли, как описано выше для измерения pI, и результаты не выявили существенных различий между трансплантатами gL3gH13, gL3gH20, gL3gH23 и gL3gH29 в % заряженных компонентов до и после ускоренного стресса (pH 8).
Пример 11. Исследование распыления гуманизированного 4856 Fab-трансплантата gL3gH13
Агрегационную стабильность к сдвиговым усилиям, возникающим при распылении трансплантата Fab 4856 gL3gH13 (далее 4886), определяли с использованием исследуемого небулайзера PARI eFlow® (PARI Pharma GmBh, Grafeling, Германия). E.coli экспрессировали Fab 4856 при ~100 мг/мл в буфере с pH 6, разбавленном до номинальных концентраций 20 мг/мл, 50 мг/мл и 80 мг/мл, и в буфере с pH 7,4, разбавленном до номинальных концентраций 20 мг/мл и 50 мг/мл.
Предварительно отфильтрованные/стерильные образцы 4856 (~1 мл) при различных концентрациях и буферах распыляли с помощью небулайзера eFlow®.
(i) Влияние распыления на концентрацию
Разведенные образцы (<1AU при 280 нм) измеряли с использованием спектрофотометра Varian Cary 50-Bio UV/Vis. Концентрацию рассчитывали с использованием коэффициента поглощения 1,72 АU (280 нм, 1 мг/мл и длины пути 1 см).
Никакой разницы в концентрации (мг/мл) не наблюдали между образцами до и после распыления.
(ii) Эксклюзионная ВЭЖХ (SEC HPLC)
Этот анализ контролировал образование растворимых агрегатов и фрагментированного материала.
Образцы разбавляли до 1 мг/мл (объем инъекции 25 мкл) или 5 мг/мл (объем инъекции 20 мкл). Анализ осуществляли с использованием колонки TSK G3000SW (7,7 мм I.Dx30 см), соединенный с системой Agilent 1100, элюировали изократически с использованием 0,2 М фосфата натрия, рН 7 при 1,0 мл/мин в течение 17 минут, 30°C. Пики контролировали при 280 нм.
Не было обнаружено различий в процентах образцов с высокой молекулярной массой (HMW), присутствующих в материале до и после распыления. Следовательно, распыление не приводило к образованию растворимого агрегата. Не было никаких доказательств присутствия материала с низкой молекулярной массой, следовательно, не было обнаружено фрагментации вследствие распыления.
(iii) Динамическое рассеяние света (DLS)
Этот анализ контролировал генерацию высокомолекулярных соединений (нерастворимый материал в виде частиц, который был бы отфильтрован колонкой SEC HPLC). Fab 4856 в буфере, содержащем гистидин и хлорид натрия, при рН 6 тестировали с помощью динамического рассеяния света с использованием прибора Malvern Nano ZS.
Не было обнаружено различий в интенсивности основного пика (%) от профиля распределения размера интенсивности (SDP) для 4856 до 50 мг/мл в образцах до и после распыления. Что касается процента полидисперсности (% PD), распределение интенсивности сильно сдвинуто к материалу с более крупной молекулярной массой (рассеяние пропорционально квадрату молекулярной массы), и когда оно преобразуется в объемное распределение, описывающее относительную долю нескольких присутствующих видов, то наблюдаются минимальные незначительные изменения до 50 мг/мл.
(iv) SDS PAGE (невосстанавливающие и восстанавливающие условия)
Этот анализ контролировал генерацию агрегации/фрагментации в буфере, включающем гистидин и NaCl, при рН 6.
Для невосстанавливающих условий 10 мкл образца при 1 мг/мл смешивали с 10 мкл буфера для образцов Tris/Глицин SDS (2x, Invitrogen) и 2 мкл 100 мМ N-этилмалеимида; нагревали при 100°С в течение 2 минут.
Для восстанавливающих условий 10 мкл образца при 1 мг/мл смешивали с 10 мкл буфера для оразцов Tris/Глицин SDS (2x, Invitrogen) и 2 мкл DTT (10x Invitrogen); нагревали при 100°С в течение 3 минут.
После центрифугирования 10 мкл (4,5 мкг) каждого образца загружали в гель Novex Tris/Glycine (4-20%) (Invitrogen) и подвергали электрофорезу при 125 мВ (постоянное напряжение) в течение 100 минут. Полосы визуализировали Кумасси синим.
Не наблюдалось различий между образцами до и после распыления до 20 мг/мл.
(vi) Функциональный in vitro анализ.
Этот анализ осуществляли в гистидине, pH 6, NaCl, при 20, 50 и 80 мг/мл.
Анализ репортерного гена в клетках HER-Blue TGF-beta с использованием рекомбинантного TGF-beta 1 проводили, как описано в Примере 3.
Никаких существенных различий в IC50 не наблюдалось между образцами до и после распыления при любой концентрации.
(v) Аэрозольная характеристика распыляемого антитела при моделировании дыхания
Этот анализ контролировал размер капель, а также дозу и время распыления Fab 4856 при концентрации 50 мг/мл (pH 6) с использованием небулайзера PARI eFlow®. Вкратце, небулайзер подключали к синусному насосу, а аэрозольные капли, содержащие распыляемый материал, собирали на дыхательном фильтре. Использовали профиль дыхания взрослого с объемом дыхания 500 мл при 15 вдохах в минуту и отношением ингаляция:выдох 50:50. После завершения, фильтр для сбора промывали для экстракции распыленного материала, который анализировали с помощью ВЭЖХ (Таблица 13).
Таблица 13. Данные экспериментов по симуляции дыхания с использованием двух разных головок небулайзера.
(n=6)
(n=6)
После обратного потока: 5,75
Доставленную дозу (DD) определяли с помощью экспериментов по симуляции дыхания. DD [%] составила 68% (2,9 мкм MMD) и 64% (3,7 мкм MMD), что считается типичным хорошим результатом, так как значения DD редко превышают 70%. Остаток составил 14% (2,9 мкм MMD) и 21,9% (3,7 мкм MMD), что также находится в типичном диапазоне. Вдыхаемые дозы <5 мкм (RD <5 мкм) составили 63% (2,9 мкм MMD) против 50% (3,7 мкм MMD). Размер частиц влияет на доставку в разные области дыхательного пути, а RD <5 мкм соответствует альвеолярной доставке.
Эти данные подтверждают пригодность 4856 Fab для доставки путем распыления.
Пример 12 - Структура, определенная с помощью рентгеновской кристаллографии
Антитело 4856 кристаллизовали с TGF-beta1 для определения аминокислотных остатков, с которыми оно контактирует.
i) Подготовка образца
2 мл зрелого TGF-beta 1 при 2,25 мг/мл в 5 мМ HCl доводили до рН 7 путем добавления 30 мкл 2 М Tris pH8. После инкубации при комнатной температуре в течение 1 часа осадок удаляли центрифугированием, оставляя 2 мл при 2,1 мг/мл. К этому добавляли 0,46 мл Fab4856gL3gH13 при 32 мг/мл (14,7 мг) с приблизительным молярным соотношением 1:1,1 TGF-beta1:Fab. Оставляли при комнатной температуре в течение 1 часа, затем загружали на колонку S200 16/160, предварительно уравновешенную 50 мМ NaCl, 25 мМ Tris, 5% глицерином, pH 7,5.Пиковые фракции комплекса объединяли и концентрировали до 10 мг/мл для кристаллографии.
ii) Кристаллизация
Скрининг проводили с использованием различных условий, которые были доступны от Qiagen (приблизительно 2000 условий). Инкубацию и визуализацию проводили с помощью Formulatrix RockImager 1000 (для полного инкубационного периода 21 день).
iii) Сбор данных и уточнение структуры
Остатки TGF-beta 1, взаимодействующие с 4856gL3gH13 Fab, приведены на Фигурах 18A и 18B. 4856gL3gH13 Fab связывается в области, которая накладывается на область рецепторного связывания, предполагая, что будет конкуренция рецепторной блокады с помощью 4856gL3gH13 Fab, причем антитело против TGF-beta 1 эффективно благодаря превосходной аффинности. Был также протестирован вариант 4856gL3H13, содержащий замену аспарагина треонином в легкой цепи (положение 5 SEQ ID NO: 45) и было обнаружено, что он не вызывает изменений в структуре.
Аналогично, одноцепочечный формат антитела 4856 (scFv 4856, SEQ ID NO: 108) кристаллизовали с TGF-beta 2 (SEQ ID NO: 116) для определения аминокислотных остатков, с которыми контактирует антитело. Остатки TGF-beta 2, взаимодействующие с scFv 4856, приведены на Фигуре 18C, показывающие связывание в той же области, что показано для связывания Fab с TGF-beta 1.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> UCB Biopharma sprl
<120> Антитела
<130> PF0037-WO
<150> GB1610044.8
<151> 2016-06-08
<160> 118
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL1
<400> 1
Gln Ala Ser Glu Ser Ile Tyr Ser Gly Leu Ala
1 5 10
<210> 2
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2
<400> 2
Ala Ala Ser Asp Leu Ala Ser
1 5
<210> 3
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL3
<400> 3
Gln Gln Thr Trp Thr Asp Gly Gly Ile Asp Asn Pro
1 5 10
<210> 4
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1
<400> 4
Gly Phe Ser Leu Ser Ser Tyr Asp Met Ser
1 5 10
<210> 5
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2
<400> 5
Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala Lys
1 5 10 15
Gly
<210> 6
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3
<400> 6
Gly Arg Asp Gly Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser Leu
1 5 10 15
<210> 7
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 var1
<400> 7
Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser Leu
1 5 10 15
<210> 8
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 var 2
<400> 8
Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Ala Tyr Ser Leu
1 5 10 15
<210> 9
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 var3
<400> 9
Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asp Gly Tyr Ser Leu
1 5 10 15
<210> 10
<211> 110
<212> Белок
<213> Искусственная последовательность
<220>
<223> VL кроличьего 4856
<400> 10
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Glu Ser Ile Tyr Ser Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Thr Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Gly Val Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Thr Trp Thr Asp Gly Gly
85 90 95
Ile Asp Asn Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 11
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> VL кроличьего 4856
<400> 11
gcctatgata tgacccagac tccagcctct gtggaggtag ctgtgggagg cacagtcacc 60
atcaagtgcc aggccagtga gagcatttac agtggtttgg cctggtatca gcagacacca 120
gggcagcgtc ccaagctcct gatctatgct gcatccgatc tggcatctgg ggtcccatcg 180
cgattcaaag gcagtggatc tgggacagag tacactctca ccatcagcgg cgtggagtgt 240
gccgatgctg ccacttacta ctgtcaacag acttggactg atggtggtat tgataatcct 300
ttcggcggag ggaccgaggt ggtggtcaaa 330
<210> 12
<211> 132
<212> Белок
<213> Искусственная последовательность
<220>
<223> VL-область кроличьего 4856 с сигнальной последовательностью
<400> 12
Met Asn Met Arg Ala Pro Thr Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Pro Gly Ala Arg Cys Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser
20 25 30
Val Glu Val Ala Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala Ser
35 40 45
Glu Ser Ile Tyr Ser Gly Leu Ala Trp Tyr Gln Gln Thr Pro Gly Gln
50 55 60
Arg Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Lys Gly Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr
85 90 95
Ile Ser Gly Val Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Thr Trp Thr Asp Gly Gly Ile Asp Asn Pro Phe Gly Gly Gly Thr Glu
115 120 125
Val Val Val Lys
130
<210> 13
<211> 396
<212> ДНК
<213> Искусственная последовательность
<220>
<223> VL кроличьего 4856 с сигнальной последовательностью
<400> 13
atgaacatga gggcccccac tcagctgctg gggctcctgc tgctctggct cccaggtgcc 60
agatgtgcct atgatatgac ccagactcca gcctctgtgg aggtagctgt gggaggcaca 120
gtcaccatca agtgccaggc cagtgagagc atttacagtg gtttggcctg gtatcagcag 180
acaccagggc agcgtcccaa gctcctgatc tatgctgcat ccgatctggc atctggggtc 240
ccatcgcgat tcaaaggcag tggatctggg acagagtaca ctctcaccat cagcggcgtg 300
gagtgtgccg atgctgccac ttactactgt caacagactt ggactgatgg tggtattgat 360
aatcctttcg gcggagggac cgaggtggtg gtcaaa 396
<210> 14
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> VH кроличьего 4856
<400> 14
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr Asp
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala Lys
50 55 60
Gly Arg Phe Thr Met Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Ile
65 70 75 80
Thr Ser Pro Thr Thr Glu Asp Met Ala Thr Tyr Phe Cys Ala Arg Gly
85 90 95
Arg Asp Gly Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser Leu Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 15
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> VH кроличьего 4856
<400> 15
cagtcgctgg aggagtccgg gggtcgcctg gtcacgcctg ggacacccct gacactcacc 60
tgcacagcct ctggattctc cctcagcagc tacgacatga gctgggtccg ccaggctcca 120
gggaaggggc tggaatggat cggaatcatt tatggtggta gtggtagcac atggtacgcg 180
agctgggcga aaggccgatt caccatgtcc aaaacgtcga ccacggtgga tctgaaaatc 240
accagtccga cgaccgagga catggccacc tatttctgtg ccagaggacg ggatggtggt 300
gctggtggtt ctcgtaatgg ctattccttg tggggccaag gcaccctggt caccgtctcg 360
agt 363
<210> 16
<211> 140
<212> Белок
<213> Искусственная последовательность
<220>
<223> VH кроличьего 4856 с сигнальной последовательностью
<400> 16
Met Glu Thr Gly Leu Arg Trp Leu Leu Leu Val Ala Val Leu Lys Gly
1 5 10 15
Val Gln Cys Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Met Ser Lys Thr Ser Thr Thr Val Asp
85 90 95
Leu Lys Ile Thr Ser Pro Thr Thr Glu Asp Met Ala Thr Tyr Phe Cys
100 105 110
Ala Arg Gly Arg Asp Gly Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser
115 120 125
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
<210> 17
<211> 420
<212> ДНК
<213> Искусственная последовательность
<220>
<223> VH кроличьего 4856 с сигнальной последовательностью
<400> 17
atggagactg ggctgcgctg gcttctcctg gtcgctgtgc tcaaaggtgt ccagtgtcag 60
tcgctggagg agtccggggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
acagcctctg gattctccct cagcagctac gacatgagct gggtccgcca ggctccaggg 180
aaggggctgg aatggatcgg aatcatttat ggtggtagtg gtagcacatg gtacgcgagc 240
tgggcgaaag gccgattcac catgtccaaa acgtcgacca cggtggatct gaaaatcacc 300
agtccgacga ccgaggacat ggccacctat ttctgtgcca gaggacggga tggtggtgct 360
ggtggttctc gtaatggcta ttccttgtgg ggccaaggca ccctggtcac cgtctcgagt 420
<210> 18
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь кроличьего 4856
<400> 18
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Glu Ser Ile Tyr Ser Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Thr Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Gly Val Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Thr Trp Thr Asp Gly Gly
85 90 95
Ile Asp Asn Pro Phe Gly Gly Gly Thr Glu Val Val Val Lys Arg Thr
100 105 110
Pro Val Ala Pro Thr Val Leu Ile Phe Pro Pro Ala Ala Asp Gln Val
115 120 125
Ala Thr Gly Thr Val Thr Ile Val Cys Val Ala Asn Lys Tyr Phe Pro
130 135 140
Asp Val Thr Val Thr Trp Glu Val Asp Gly Thr Thr Gln Thr Thr Gly
145 150 155 160
Ile Glu Asn Ser Lys Thr Pro Gln Asn Ser Ala Asp Cys Thr Tyr Asn
165 170 175
Leu Ser Ser Thr Leu Thr Leu Thr Ser Thr Gln Tyr Asn Ser His Lys
180 185 190
Glu Tyr Thr Cys Lys Val Thr Gln Gly Thr Thr Ser Val Val Gln Ser
195 200 205
Phe Asn Arg Gly Asp Cys
210
<210> 19
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> легкая цепь кроличьего 4856
<400> 19
gcctatgata tgacccagac tccagcctct gtggaggtag ctgtgggagg cacagtcacc 60
atcaagtgcc aggccagtga gagcatttac agtggtttgg cctggtatca gcagacacca 120
gggcagcgtc ccaagctcct gatctatgct gcatccgatc tggcatctgg ggtcccatcg 180
cgattcaaag gcagtggatc tgggacagag tacactctca ccatcagcgg cgtggagtgt 240
gccgatgctg ccacttacta ctgtcaacag acttggactg atggtggtat tgataatcct 300
ttcggcggag ggaccgaggt ggtggtcaaa cgtacgccag ttgcacctac tgtcctcatc 360
ttcccaccag ctgctgatca ggtggcaact ggaacagtca ccatcgtgtg tgtggcgaat 420
aaatactttc ccgatgtcac cgtcacctgg gaggtggatg gcaccaccca aacaactggc 480
atcgagaaca gtaaaacacc gcagaattct gcagattgta cctacaacct cagcagcact 540
ctgacactga ccagcacaca gtacaacagc cacaaagagt acacctgcaa ggtgacccag 600
ggcacgacct cagtcgtcca gagcttcaat aggggtgact gt 642
<210> 20
<211> 236
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь кроличьего 4856 с сигнальной последовательностью
<400> 20
Met Asn Met Arg Ala Pro Thr Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Pro Gly Ala Arg Cys Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser
20 25 30
Val Glu Val Ala Val Gly Gly Thr Val Thr Ile Lys Cys Gln Ala Ser
35 40 45
Glu Ser Ile Tyr Ser Gly Leu Ala Trp Tyr Gln Gln Thr Pro Gly Gln
50 55 60
Arg Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Lys Gly Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr
85 90 95
Ile Ser Gly Val Glu Cys Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Thr Trp Thr Asp Gly Gly Ile Asp Asn Pro Phe Gly Gly Gly Thr Glu
115 120 125
Val Val Val Lys Arg Thr Pro Val Ala Pro Thr Val Leu Ile Phe Pro
130 135 140
Pro Ala Ala Asp Gln Val Ala Thr Gly Thr Val Thr Ile Val Cys Val
145 150 155 160
Ala Asn Lys Tyr Phe Pro Asp Val Thr Val Thr Trp Glu Val Asp Gly
165 170 175
Thr Thr Gln Thr Thr Gly Ile Glu Asn Ser Lys Thr Pro Gln Asn Ser
180 185 190
Ala Asp Cys Thr Tyr Asn Leu Ser Ser Thr Leu Thr Leu Thr Ser Thr
195 200 205
Gln Tyr Asn Ser His Lys Glu Tyr Thr Cys Lys Val Thr Gln Gly Thr
210 215 220
Thr Ser Val Val Gln Ser Phe Asn Arg Gly Asp Cys
225 230 235
<210> 21
<211> 708
<212> ДНК
<213> Искусственная последовательность
<220>
<223> легкая цепь кроличьего 4856 с подчеркнутой сигнальной последовательностью
<400> 21
atgaacatga gggcccccac tcagctgctg gggctcctgc tgctctggct cccaggtgcc 60
agatgtgcct atgatatgac ccagactcca gcctctgtgg aggtagctgt gggaggcaca 120
gtcaccatca agtgccaggc cagtgagagc atttacagtg gtttggcctg gtatcagcag 180
acaccagggc agcgtcccaa gctcctgatc tatgctgcat ccgatctggc atctggggtc 240
ccatcgcgat tcaaaggcag tggatctggg acagagtaca ctctcaccat cagcggcgtg 300
gagtgtgccg atgctgccac ttactactgt caacagactt ggactgatgg tggtattgat 360
aatcctttcg gcggagggac cgaggtggtg gtcaaacgta cgccagttgc acctactgtc 420
ctcatcttcc caccagctgc tgatcaggtg gcaactggaa cagtcaccat cgtgtgtgtg 480
gcgaataaat actttcccga tgtcaccgtc acctgggagg tggatggcac cacccaaaca 540
actggcatcg agaacagtaa aacaccgcag aattctgcag attgtaccta caacctcagc 600
agcactctga cactgaccag cacacagtac aacagccaca aagagtacac ctgcaaggtg 660
acccagggca cgacctcagt cgtccagagc ttcaataggg gtgactgt 708
<210> 22
<211> 216
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь кроличьего 4856 Fab
<400> 22
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr Asp
20 25 30
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala Lys
50 55 60
Gly Arg Phe Thr Met Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Ile
65 70 75 80
Thr Ser Pro Thr Thr Glu Asp Met Ala Thr Tyr Phe Cys Ala Arg Gly
85 90 95
Arg Asp Gly Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser Leu Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gln Pro Lys Ala Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Cys Cys Gly Asp Thr Pro Ser Ser Thr Val
130 135 140
Thr Leu Gly Cys Leu Val Lys Gly Tyr Leu Pro Glu Pro Val Thr Val
145 150 155 160
Thr Trp Asn Ser Gly Thr Leu Thr Asn Gly Val Arg Thr Phe Pro Ser
165 170 175
Val Arg Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Ser Val
180 185 190
Thr Ser Ser Ser Gln Pro Val Thr Cys Asn Val Ala His Pro Ala Thr
195 200 205
Asn Thr Lys Val Asp Lys Thr Val
210 215
<210> 23
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь кроличьего 4856 Fab
<400> 23
cagtcgctgg aggagtccgg gggtcgcctg gtcacgcctg ggacacccct gacactcacc 60
tgcacagcct ctggattctc cctcagcagc tacgacatga gctgggtccg ccaggctcca 120
gggaaggggc tggaatggat cggaatcatt tatggtggta gtggtagcac atggtacgcg 180
agctgggcga aaggccgatt caccatgtcc aaaacgtcga ccacggtgga tctgaaaatc 240
accagtccga cgaccgagga catggccacc tatttctgtg ccagaggacg ggatggtggt 300
gctggtggtt ctcgtaatgg ctattccttg tggggccaag gcaccctggt caccgtctcg 360
agtgggcaac ctaaggctcc atcagtcttc ccactggccc cctgctgcgg ggacacaccc 420
agctccacgg tgaccctggg ctgcctggtc aaaggctacc tcccggagcc agtgaccgtg 480
acctggaact cgggcaccct caccaatggg gtacgcacct tcccgtccgt ccggcagtcc 540
tcaggcctct actcgctgag cagcgtggtg agcgtgacct caagcagcca gcccgtcacc 600
tgcaacgtgg cccacccagc caccaacacc aaagtggaca agaccgtt 648
<210> 24
<211> 235
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь кроличьего 4856 Fab с подчеркнутой сигнальной последовательностью
<400> 24
Met Glu Thr Gly Leu Arg Trp Leu Leu Leu Val Ala Val Leu Lys Gly
1 5 10 15
Val Gln Cys Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Thr Pro
20 25 30
Gly Thr Pro Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Met Ser Lys Thr Ser Thr Thr Val Asp
85 90 95
Leu Lys Ile Thr Ser Pro Thr Thr Glu Asp Met Ala Thr Tyr Phe Cys
100 105 110
Ala Arg Gly Arg Asp Gly Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser
115 120 125
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gln Pro Lys
130 135 140
Ala Pro Ser Val Phe Pro Leu Ala Pro Cys Cys Gly Asp Thr Pro Ser
145 150 155 160
Ser Thr Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Leu Pro Glu Pro
165 170 175
Val Thr Val Thr Trp Asn Ser Gly Thr Leu Thr Asn Gly Val Arg Thr
180 185 190
Phe Pro Ser Val Arg Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
195 200 205
Val Ser Val Thr Ser Ser Ser Gln Pro Val Thr Cys Asn Val Ala His
210 215 220
Pro Ala Thr Asn Thr Lys Val Asp Lys Thr Val
225 230 235
<210> 25
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь кроличьего 4856 Fab с сигнальной последовательностью
<400> 25
atggagactg ggctgcgctg gcttctcctg gtcgctgtgc tcaaaggtgt ccagtgtcag 60
tcgctggagg agtccggggg tcgcctggtc acgcctggga cacccctgac actcacctgc 120
acagcctctg gattctccct cagcagctac gacatgagct gggtccgcca ggctccaggg 180
aaggggctgg aatggatcgg aatcatttat ggtggtagtg gtagcacatg gtacgcgagc 240
tgggcgaaag gccgattcac catgtccaaa acgtcgacca cggtggatct gaaaatcacc 300
agtccgacga ccgaggacat ggccacctat ttctgtgcca gaggacggga tggtggtgct 360
ggtggttctc gtaatggcta ttccttgtgg ggccaaggca ccctggtcac cgtctcgagt 420
gggcaaccta aggctccatc agtcttccca ctggccccct gctgcgggga cacacccagc 480
tccacggtga ccctgggctg cctggtcaaa ggctacctcc cggagccagt gaccgtgacc 540
tggaactcgg gcaccctcac caatggggta cgcaccttcc cgtccgtccg gcagtcctca 600
ggcctctact cgctgagcag cgtggtgagc gtgacctcaa gcagccagcc cgtcacctgc 660
aacgtggccc acccagccac caacaccaaa gtggacaaga ccgtt 705
<210> 26
<211> 110
<212> Белок
<213> Искусственная последовательность
<220>
<223> V-область муринизированного 4856 mL1.1
<400> 26
Ala Tyr Asp Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys Gln Ala Ser Glu Ser Ile Tyr Ser Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Thr Trp Thr Asp Gly Gly
85 90 95
Ile Asp Asn Pro Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 27
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> V-область муринизированного 4856 mL1.1
<400> 27
gcctacgaca tgaaccagtc gccatcaagc ctgagcgcct cccttggcga caccatcacc 60
attacttgcc aagcctccga aagcatctac tccggactcg cctggtatca gcagaaaccg 120
gggaacattc ccaagctcct gatctacgcc gcttccgact tggcatcggg agtgccgtca 180
cggttcaagg ggtccggatc gggaaccgag tacaccctga ctatctcctc cctgcaaccc 240
gaggatattg cgacctacta ctgtcagcag acttggacgg atggtggaat cgacaaccct 300
ttcggtggcg gcaccaagct ggaaatcaag 330
<210> 28
<211> 130
<212> Белок
<213> Искусственная последовательность
<220>
<223> V-область муринизированного 4856 mL1.1 с сигнальной последовательностью
<400> 28
Met Ser Val Pro Thr Gln Val Leu Gly Leu Leu Leu Leu Trp Leu Thr
1 5 10 15
Asp Ala Arg Cys Ala Tyr Asp Met Asn Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Leu Gly Asp Thr Ile Thr Ile Thr Cys Gln Ala Ser Glu Ser
35 40 45
Ile Tyr Ser Gly Leu Ala Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro
50 55 60
Lys Leu Leu Ile Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Lys Gly Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Thr Trp
100 105 110
Thr Asp Gly Gly Ile Asp Asn Pro Phe Gly Gly Gly Thr Lys Leu Glu
115 120 125
Ile Lys
130
<210> 29
<211> 390
<212> ДНК
<213> Искусственная последовательность
<220>
<223> V-область муринизированного 4856 mL1.1 с сигнальной последовательностью
<400> 29
atgtctgtcc ccacccaagt cctcggactc ctgctactct ggcttacaga tgccagatgc 60
gcctacgaca tgaaccagtc gccatcaagc ctgagcgcct cccttggcga caccatcacc 120
attacttgcc aagcctccga aagcatctac tccggactcg cctggtatca gcagaaaccg 180
gggaacattc ccaagctcct gatctacgcc gcttccgact tggcatcggg agtgccgtca 240
cggttcaagg ggtccggatc gggaaccgag tacaccctga ctatctcctc cctgcaaccc 300
gaggatattg cgacctacta ctgtcagcag acttggacgg atggtggaat cgacaaccct 360
ttcggtggcg gcaccaagct ggaaatcaag 390
<210> 30
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> V-область муринизированного 4856 mH2.1
<400> 30
Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Lys Phe Ile Met Ser Lys Asp Ser Ala Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Ser Lys Val Arg Ser Glu Asp Met Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Gly Arg Asp Gly Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 31
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> V-область муринизированного 4856 mH2.1
<400> 31
gaggtcaagc tgctggaatc ggggggaggt ctggtgcagc cgggcggatc tctgaagctg 60
tcatgcaccg catccgggtt tagcctttcg tcctacgaca tgtcctgggt gcgccaggcc 120
cccggaaagg gattggaatg gatcggcatt atctacgggg gctccggttc cacttggtac 180
gcgagctggg ccaaggggaa gttcatcatg tcgaaggact ccgctaagaa caccgtgtac 240
ctccaaatga gcaaagtccg gagcgaggat atggccacct atttctgcgc ccggggaagg 300
gacggaggag ccggcggttc cagaaacggc tactcactgt ggggacaggg caccctcgtg 360
actgtctcga gt 372
<210> 32
<211> 143
<212> Белок
<213> Искусственная последовательность
<220>
<223> V-область муринизированного 4856 mH2.1 с сигнальной последовательностью
<400> 32
Met Glu Trp Ser Trp Val Phe Leu Phe Phe Leu Ser Val Thr Thr Gly
1 5 10 15
Val His Ser Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Lys Leu Ser Cys Thr Ala Ser Gly Phe Ser Leu
35 40 45
Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala
65 70 75 80
Ser Trp Ala Lys Gly Lys Phe Ile Met Ser Lys Asp Ser Ala Lys Asn
85 90 95
Thr Val Tyr Leu Gln Met Ser Lys Val Arg Ser Glu Asp Met Ala Thr
100 105 110
Tyr Phe Cys Ala Arg Gly Arg Asp Gly Gly Ala Gly Gly Ser Arg Asn
115 120 125
Gly Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
<210> 33
<211> 429
<212> ДНК
<213> Искусственная последовательность
<220>
<223> V-область муринизированного 4856 mH2.1 с сигнальной последовательностью
<400> 33
atggaatgga gctgggtctt tctcttcttc ctgtcagtaa ctacaggagt ccattctgag 60
gtcaagctgc tggaatcggg gggaggtctg gtgcagccgg gcggatctct gaagctgtca 120
tgcaccgcat ccgggtttag cctttcgtcc tacgacatgt cctgggtgcg ccaggccccc 180
ggaaagggat tggaatggat cggcattatc tacgggggct ccggttccac ttggtacgcg 240
agctgggcca aggggaagtt catcatgtcg aaggactccg ctaagaacac cgtgtacctc 300
caaatgagca aagtccggag cgaggatatg gccacctatt tctgcgcccg gggaagggac 360
ggaggagccg gcggttccag aaacggctac tcactgtggg gacagggcac cctcgtgact 420
gtctcgagt 429
<210> 34
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мышиный IGKV15-103 JK1 акцепторный каркас
<400> 34
Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 35
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышиный IGKV15-103 JK1 акцепторный каркас
<400> 35
gacatccaga tgaaccagtc tccatccagt ctgtctgcat cccttggaga cacaattacc 60
atcacttgcc atgccagtca gaacattaat gtttggttaa gctggtacca gcagaaacca 120
ggaaatattc ctaaactatt gatctataag gcttccaact tgcacacagg cgtcccatca 180
aggtttagtg gcagtggatc tggaacaggt ttcacattaa ccatcagcag cctgcagcct 240
gaagacattg ccacttacta ctgtcaacag ggtcaaagtt atccttggac gttcggtgga 300
ggcaccaagc tggaaatcaa a 321
<210> 36
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мышиный IGHV4-S1 JH3 акцепторный каркас
<400> 36
Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Asp Phe Ser Arg Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ala
<210> 37
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышиный IGHV4-S1 JH3 акцепторный каркас
<400> 37
gaggtgaagc ttctcgagtc tggaggtggc ctggtgcagc ctggaggatc cctgaaactc 60
tcctgtgcag cctcaggatt cgattttagt agatactgga tgagttgggt ccggcaggct 120
ccagggaaag ggctagaatg gattggagaa attaatccag atagcagtac gataaactat 180
acgccatctc taaaggataa attcatcatc tccagagaca acgccaaaaa tacgctgtac 240
ctgcaaatga gcaaagtgag atctgaggac acagcccttt attactgtgc aagatggttt 300
gcttactggg gccaagggac tctggtcact gtctctgca 339
<210> 38
<211> 110
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gL3 V-область
<400> 38
Ala Tyr Asp Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Ser Ile Tyr Ser Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Trp Thr Asp Gly Gly
85 90 95
Ile Asp Asn Pro Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 39
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gL3 V-область (экспрессия в млекопитающих)
<400> 39
gcctacgaca tgacccagtc cccctcaacc ctctccgctt ccgtgggaga tcgcgtgacc 60
atcacttgcc aagcctccga atcgatctac tcgggtctgg cctggtatca gcagaagcca 120
gggaaggcac ctaagctgtt gatctacgcg gcctcagacc tggccagcgg agtgcccagc 180
cggttctccg gctccggaag cggcactgag tacaccctga ccatttcctc gcttcaaccg 240
gatgacttcg cgacctacta ctgtcagcag acttggacgg acgggggcat cgacaacccg 300
tttggtggag gcaccaaagt cgagattaag 330
<210> 40
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gL3 V-область (экспрессия в E. coli)
<400> 40
gcgtatgata tgacccagag tccaagcacc ctctccgcca gcgtaggcga tcgtgtgact 60
attacctgtc aggccagtga aagcatctat agcggcctgg cgtggtatca gcaaaaaccg 120
ggcaaagccc cgaagctgct catctatgcg gcgtccgatc tggcgagcgg tgtgccaagc 180
cgtttcagtg gcagcggcag cggcaccgaa tataccctca caatttcgtc tctccagccg 240
gatgatttcg ccacttacta ttgtcagcaa acctggaccg atggcggcat tgataacccg 300
ttcggtggcg gcactaaagt agaaatcaaa 330
<210> 41
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gL3 V-область с сигнальной последовательностью
<400> 41
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Ala Tyr Asp Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser
20 25 30
Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Ser Ile Tyr
35 40 45
Ser Gly Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
50 55 60
Leu Ile Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe
65 70 75 80
Ser Gly Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu
85 90 95
Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Trp Thr Asp
100 105 110
Gly Gly Ile Asp Asn Pro Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
<210> 42
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gL3 V-область с сигнальной последовательностью
<400> 42
atgaagtggg tcaccttcat ctccctgctg tttctgttct cctccgccta ctccgcctac 60
gacatgaccc agtccccctc aaccctctcc gcttccgtgg gagatcgcgt gaccatcact 120
tgccaagcct ccgaatcgat ctactcgggt ctggcctggt atcagcagaa gccagggaag 180
gcacctaagc tgttgatcta cgcggcctca gacctggcca gcggagtgcc cagccggttc 240
tccggctccg gaagcggcac tgagtacacc ctgaccattt cctcgcttca accggatgac 300
ttcgcgacct actactgtca gcagacttgg acggacgggg gcatcgacaa cccgtttggt 360
ggaggcacca aagtcgagat taag 384
<210> 43
<211> 131
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gL3 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 43
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Ala Tyr Asp Met Thr Gln Ser Pro Ser Thr Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu
35 40 45
Ser Ile Tyr Ser Gly Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr
100 105 110
Trp Thr Asp Gly Gly Ile Asp Asn Pro Phe Gly Gly Gly Thr Lys Val
115 120 125
Glu Ile Lys
130
<210> 44
<211> 393
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gL3 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 44
atgaaaaaga cagctatcgc aattgcagtg gccttggctg gtttcgctac cgtagcgcaa 60
gctgcgtatg atatgaccca gagtccaagc accctctccg ccagcgtagg cgatcgtgtg 120
actattacct gtcaggccag tgaaagcatc tatagcggcc tggcgtggta tcagcaaaaa 180
ccgggcaaag ccccgaagct gctcatctat gcggcgtccg atctggcgag cggtgtgcca 240
agccgtttca gtggcagcgg cagcggcacc gaatataccc tcacaatttc gtctctccag 300
ccggatgatt tcgccactta ctattgtcag caaacctgga ccgatggcgg cattgataac 360
ccgttcggtg gcggcactaa agtagaaatc aaa 393
<210> 45
<211> 217
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gL3 легкая цепь
<400> 45
Ala Tyr Asp Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Ser Ile Tyr Ser Gly
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Trp Thr Asp Gly Gly
85 90 95
Ile Asp Asn Pro Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 46
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gL3 легкая цепь (экспрессия в млекопитающих)
<400> 46
gcctacgaca tgacccagtc cccctcaacc ctctccgctt ccgtgggaga tcgcgtgacc 60
atcacttgcc aagcctccga atcgatctac tcgggtctgg cctggtatca gcagaagcca 120
gggaaggcac ctaagctgtt gatctacgcg gcctcagacc tggccagcgg agtgcccagc 180
cggttctccg gctccggaag cggcactgag tacaccctga ccatttcctc gcttcaaccg 240
gatgacttcg cgacctacta ctgtcagcag acttggacgg acgggggcat cgacaacccg 300
tttggtggag gcaccaaagt cgagattaag cgtacggtag cggccccatc tgtcttcatc 360
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 420
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 480
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 540
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 600
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg t 651
<210> 47
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gL3 легкая цепь (экспрессия в E.coli)
<400> 47
gcgtatgata tgacccagag tccaagcacc ctctccgcca gcgtaggcga tcgtgtgact 60
attacctgtc aggccagtga aagcatctat agcggcctgg cgtggtatca gcaaaaaccg 120
ggcaaagccc cgaagctgct catctatgcg gcgtccgatc tggcgagcgg tgtgccaagc 180
cgtttcagtg gcagcggcag cggcaccgaa tataccctca caatttcgtc tctccagccg 240
gatgatttcg ccacttacta ttgtcagcaa acctggaccg atggcggcat tgataacccg 300
ttcggtggcg gcactaaagt agaaatcaaa cgtacggtag cggccccatc tgtcttcatc 360
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 420
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 480
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 540
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 600
catcagggcc tgagctcacc agtaacaaaa agttttaata gaggggagtg t 651
<210> 48
<211> 235
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gL3 легкая цепь с сигнальной последовательностью
<400> 48
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Ala Tyr Asp Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser
20 25 30
Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Ser Ile Tyr
35 40 45
Ser Gly Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
50 55 60
Leu Ile Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe
65 70 75 80
Ser Gly Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu
85 90 95
Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Trp Thr Asp
100 105 110
Gly Gly Ile Asp Asn Pro Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
130 135 140
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
145 150 155 160
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
165 170 175
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
180 185 190
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
195 200 205
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
210 215 220
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 49
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gL3 легкая цепь с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 49
atgaagtggg tcaccttcat ctccctgctg tttctgttct cctccgccta ctccgcctac 60
gacatgaccc agtccccctc aaccctctcc gcttccgtgg gagatcgcgt gaccatcact 120
tgccaagcct ccgaatcgat ctactcgggt ctggcctggt atcagcagaa gccagggaag 180
gcacctaagc tgttgatcta cgcggcctca gacctggcca gcggagtgcc cagccggttc 240
tccggctccg gaagcggcac tgagtacacc ctgaccattt cctcgcttca accggatgac 300
ttcgcgacct actactgtca gcagacttgg acggacgggg gcatcgacaa cccgtttggt 360
ggaggcacca aagtcgagat taagcgtacg gtagcggccc catctgtctt catcttcccg 420
ccatctgatg agcagttgaa atctggaact gcctctgttg tgtgcctgct gaataacttc 480
tatcccagag aggccaaagt acagtggaag gtggataacg ccctccaatc gggtaactcc 540
caggagagtg tcacagagca ggacagcaag gacagcacct acagcctcag cagcaccctg 600
acgctgagca aagcagacta cgagaaacac aaagtctacg cctgcgaagt cacccatcag 660
ggcctgagct cgcccgtcac aaagagcttc aacaggggag agtgt 705
<210> 50
<211> 238
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gL3 легкая цепь с сигнальной последовательностью (экспрессия в E. coli)
<400> 50
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Ala Tyr Asp Met Thr Gln Ser Pro Ser Thr Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu
35 40 45
Ser Ile Tyr Ser Gly Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr
100 105 110
Trp Thr Asp Gly Gly Ile Asp Asn Pro Phe Gly Gly Gly Thr Lys Val
115 120 125
Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
130 135 140
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
145 150 155 160
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
165 170 175
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
180 185 190
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
195 200 205
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
210 215 220
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235
<210> 51
<211> 714
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gL3 легкая цепь с сигнальной последовательностью (экспрессия в E. coli)
<400> 51
atgaaaaaga cagctatcgc aattgcagtg gccttggctg gtttcgctac cgtagcgcaa 60
gctgcgtatg atatgaccca gagtccaagc accctctccg ccagcgtagg cgatcgtgtg 120
actattacct gtcaggccag tgaaagcatc tatagcggcc tggcgtggta tcagcaaaaa 180
ccgggcaaag ccccgaagct gctcatctat gcggcgtccg atctggcgag cggtgtgcca 240
agccgtttca gtggcagcgg cagcggcacc gaatataccc tcacaatttc gtctctccag 300
ccggatgatt tcgccactta ctattgtcag caaacctgga ccgatggcgg cattgataac 360
ccgttcggtg gcggcactaa agtagaaatc aaacgtacgg tagcggcccc atctgtcttc 420
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 480
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 540
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 600
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 660
acccatcagg gcctgagctc accagtaaca aaaagtttta atagagggga gtgt 714
<210> 52
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH13 V-область
<400> 52
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 53
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH13 V-область (экспрессия в млекопитающих)
<400> 53
gaagtgcaac tggtggaaag cggaggaggt ttggtgaaac cgggagggtc actgcggctc 60
tcctgtgccg cctccggatt cagcctctcg tcctacgaca tgagctgggt cagacaggcc 120
cccgggaagg gcctggagtg gattggtatc atctacggcg gctccggctc gacttggtac 180
gcttcgtggg ccaagggacg gttcaccatc tcccgcgatt ccgcgaagaa cagcgtgtat 240
ctgcagatga actctctgcg ggccgaggac accgcagtgt actactgcgc gagggggcgc 300
gacgccggcg ccgggggatc acgcaacggt tactcccttt ggggacaggg aaccctggtc 360
actgtctcca gc 372
<210> 54
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH13 V-область (экспрессия в E. coli)
<400> 54
gaggttcagc tggtcgagtc tggaggcggg cttgtcaaac ctggagggag cctgcgtctc 60
tcttgtgcag caagcggctt cagcctgtcc tcttacgata tgtcctgggt gcgccaggca 120
cctgggaagg gcctggagtg gattggcatt atttatggcg gcagcggcag cacatggtac 180
gcgagctggg cgaagggccg tttcaccatc tcccgggaca gcgcaaagaa tagcgtgtac 240
ctccagatga actctctccg cgcagaggac acagcagtct attactgtgc gcggggccgc 300
gatgcaggcg cgggcggcag ccgcaacggc tatagcctgt ggggacaggg gacccttgtg 360
acagtctcga gc 372
<210> 55
<211> 142
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH13 V-область с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 55
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro
20 25 30
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser
85 90 95
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly
115 120 125
Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
<210> 56
<211> 426
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH13 V-область с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 56
atgaagtggg tcaccttcat ctccctgctg tttctgttct ccagcgccta ctccgaagtg 60
caactggtgg aaagcggagg aggtttggtg aaaccgggag ggtcactgcg gctctcctgt 120
gccgcctccg gattcagcct ctcgtcctac gacatgagct gggtcagaca ggcccccggg 180
aagggcctgg agtggattgg tatcatctac ggcggctccg gctcgacttg gtacgcttcg 240
tgggccaagg gacggttcac catctcccgc gattccgcga agaacagcgt gtatctgcag 300
atgaactctc tgcgggccga ggacaccgca gtgtactact gcgcgagggg gcgcgacgcc 360
ggcgccgggg gatcacgcaa cggttactcc ctttggggac agggaaccct ggtcactgtc 420
tccagc 426
<210> 57
<211> 145
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH13 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 57
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Leu Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp
65 70 75 80
Tyr Ala Ser Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala
85 90 95
Lys Asn Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser
115 120 125
Arg Asn Gly Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser
145
<210> 58
<211> 435
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH13 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 58
atgaagaaga ctgctatagc aattgcagtg gcgctagctg gtttcgccac cgtggcgcaa 60
gctgaggttc agctggtcga gtctggaggc gggcttgtca aacctggagg gagcctgcgt 120
ctctcttgtg cagcaagcgg cttcagcctg tcctcttacg atatgtcctg ggtgcgccag 180
gcacctggga agggcctgga gtggattggc attatttatg gcggcagcgg cagcacatgg 240
tacgcgagct gggcgaaggg ccgtttcacc atctcccggg acagcgcaaa gaatagcgtg 300
tacctccaga tgaactctct ccgcgcagag gacacagcag tctattactg tgcgcggggc 360
cgcgatgcag gcgcgggcgg cagccgcaac ggctatagcc tgtggggaca ggggaccctt 420
gtgacagtct cgagc 435
<210> 59
<211> 227
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4856 gH13 Fab
<400> 59
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys
225
<210> 60
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4856 gH13 Fab (экспрессия в млекопитающих)
<400> 60
gaagtgcaac tggtggaaag cggaggaggt ttggtgaaac cgggagggtc actgcggctc 60
tcctgtgccg cctccggatt cagcctctcg tcctacgaca tgagctgggt cagacaggcc 120
cccgggaagg gcctggagtg gattggtatc atctacggcg gctccggctc gacttggtac 180
gcttcgtggg ccaagggacg gttcaccatc tcccgcgatt ccgcgaagaa cagcgtgtat 240
ctgcagatga actctctgcg ggccgaggac accgcagtgt actactgcgc gagggggcgc 300
gacgccggcg ccgggggatc acgcaacggt tactcccttt ggggacaggg aaccctggtc 360
actgtctcca gcgcttctac aaagggccca tcggtcttcc ccctggcacc ctcctccaag 420
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 480
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 540
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 600
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtggacaag 660
aaagttgagc ccaaatcttg t 681
<210> 61
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4856 gH13 Fab (экспрессия в E. coli)
<400> 61
gaggttcagc tggtcgagtc tggaggcggg cttgtcaaac ctggagggag cctgcgtctc 60
tcttgtgcag caagcggctt cagcctgtcc tcttacgata tgtcctgggt gcgccaggca 120
cctgggaagg gcctggagtg gattggcatt atttatggcg gcagcggcag cacatggtac 180
gcgagctggg cgaagggccg tttcaccatc tcccgggaca gcgcaaagaa tagcgtgtac 240
ctccagatga actctctccg cgcagaggac acagcagtct attactgtgc gcggggccgc 300
gatgcaggcg cgggcggcag ccgcaacggc tatagcctgt ggggacaggg gacccttgtg 360
acagtctcga gcgcttctac aaagggccca tcggtcttcc ccctggcacc ctcctccaag 420
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 480
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 540
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 600
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtcgacaag 660
aaagttgagc ccaaatcttg t 681
<210> 62
<211> 245
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4856 gH13 Fab с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 62
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro
20 25 30
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser
85 90 95
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly
115 120 125
Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys
245
<210> 63
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4856 gH13 Fab с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 63
atgaagtggg tcaccttcat ctccctgctg tttctgttct ccagcgccta ctccgaagtg 60
caactggtgg aaagcggagg aggtttggtg aaaccgggag ggtcactgcg gctctcctgt 120
gccgcctccg gattcagcct ctcgtcctac gacatgagct gggtcagaca ggcccccggg 180
aagggcctgg agtggattgg tatcatctac ggcggctccg gctcgacttg gtacgcttcg 240
tgggccaagg gacggttcac catctcccgc gattccgcga agaacagcgt gtatctgcag 300
atgaactctc tgcgggccga ggacaccgca gtgtactact gcgcgagggg gcgcgacgcc 360
ggcgccgggg gatcacgcaa cggttactcc ctttggggac agggaaccct ggtcactgtc 420
tccagcgctt ctacaaaggg cccatcggtc ttccccctgg caccctcctc caagagcacc 480
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 540
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 600
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 660
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 720
gagcccaaat cttgt 735
<210> 64
<211> 248
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4856 gH13 Fab с сигнальной последовательностью (экспрессия в E. coli)
<400> 64
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Leu Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp
65 70 75 80
Tyr Ala Ser Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala
85 90 95
Lys Asn Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser
115 120 125
Arg Asn Gly Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
145 150 155 160
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
165 170 175
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
180 185 190
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
195 200 205
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
210 215 220
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
225 230 235 240
Lys Lys Val Glu Pro Lys Ser Cys
245
<210> 65
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь 4856 gH13 Fab с сигнальной последовательностью (экспрессия в E. coli)
<400> 65
atgaagaaga ctgctatagc aattgcagtg gcgctagctg gtttcgccac cgtggcgcaa 60
gctgaggttc agctggtcga gtctggaggc gggcttgtca aacctggagg gagcctgcgt 120
ctctcttgtg cagcaagcgg cttcagcctg tcctcttacg atatgtcctg ggtgcgccag 180
gcacctggga agggcctgga gtggattggc attatttatg gcggcagcgg cagcacatgg 240
tacgcgagct gggcgaaggg ccgtttcacc atctcccggg acagcgcaaa gaatagcgtg 300
tacctccaga tgaactctct ccgcgcagag gacacagcag tctattactg tgcgcggggc 360
cgcgatgcag gcgcgggcgg cagccgcaac ggctatagcc tgtggggaca ggggaccctt 420
gtgacagtct cgagcgcttc tacaaagggc ccatcggtct tccccctggc accctcctcc 480
aagagcacct ctgggggcac agcggccctg ggctgcctgg tcaaggacta cttccccgaa 540
ccggtgacgg tgtcgtggaa ctcaggcgcc ctgaccagcg gcgtgcacac cttcccggct 600
gtcctacagt cctcaggact ctactccctc agcagcgtgg tgaccgtgcc ctccagcagc 660
ttgggcaccc agacctacat ctgcaacgtg aatcacaagc ccagcaacac caaggtcgac 720
aagaaagttg agcccaaatc ttgt 744
<210> 66
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH20 V-область
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Met Ser Lys Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 67
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH20 V-область
<400> 67
gaagtgcaac tggtggaaag cggaggaggt ttggtgaaac cgggagggtc actgcggctc 60
tcctgtgccg cctccggatt cagcctctcg tcctacgaca tgagctgggt cagacaggcc 120
cccgggaagg gcctggagtg gatttccatc atctacggcg gctccggctc gacttggtac 180
gcttcgtggg ccaagggacg gttcaccatg tccaaggatt ccgcgaagaa cagcgtgtat 240
ctgcagatga actctctgcg ggccgaggac accgcagtgt actactgcgc gagggggcgc 300
gacgccggcg ccgggggatc acgcaacggt tactcccttt ggggacaggg aaccctggtc 360
actgtctcca gc 372
<210> 68
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH20 V-область (экспрессия в E. coli)
<400> 68
gaggttcagc tggtcgagtc tggaggcggg cttgtcaaac ctggagggag cctgcgtctc 60
tcttgtgcag caagcggctt cagcctgtcc tcttacgata tgtcctgggt gcgccaggca 120
cctgggaagg gcctggagtg gatttctatt atttatggcg gcagcggcag cacatggtac 180
gcgagctggg cgaagggccg tttcaccatg tccaaagaca gcgcaaagaa tagcgtgtac 240
ctccagatga actctctccg cgcagaggac acagcagtct attactgtgc gcggggccgc 300
gatgcaggcg cgggcggcag ccgcaatggg tatagcctgt ggggacaggg gacccttgtg 360
acagtctcga gc 372
<210> 69
<211> 142
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH20 V-область с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 69
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro
20 25 30
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Ser Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Met Ser Lys Asp Ser Ala Lys Asn Ser
85 90 95
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly
115 120 125
Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
<210> 70
<211> 426
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH20 V-область с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 70
atgaagtggg tcaccttcat ctccctgctg tttctgttct ccagcgccta ctccgaagtg 60
caactggtgg aaagcggagg aggtttggtg aaaccgggag ggtcactgcg gctctcctgt 120
gccgcctccg gattcagcct ctcgtcctac gacatgagct gggtcagaca ggcccccggg 180
aagggcctgg agtggatttc catcatctac ggcggctccg gctcgacttg gtacgcttcg 240
tgggccaagg gacggttcac catgtccaag gattccgcga agaacagcgt gtatctgcag 300
atgaactctc tgcgggccga ggacaccgca gtgtactact gcgcgagggg gcgcgacgcc 360
ggcgccgggg gatcacgcaa cggttactcc ctttggggac agggaaccct ggtcactgtc 420
tccagc 426
<210> 71
<211> 145
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH20 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 71
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Leu Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Ser Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp
65 70 75 80
Tyr Ala Ser Trp Ala Lys Gly Arg Phe Thr Met Ser Lys Asp Ser Ala
85 90 95
Lys Asn Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser
115 120 125
Arg Asn Gly Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser
145
<210> 72
<211> 435
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH20 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 72
atgaagaaga ctgctatagc aattgcagtg gcgctagctg gtttcgccac cgtggcgcaa 60
gctgaggttc agctggtcga gtctggaggc gggcttgtca aacctggagg gagcctgcgt 120
ctctcttgtg cagcaagcgg cttcagcctg tcctcttacg atatgtcctg ggtgcgccag 180
gcacctggga agggcctgga gtggatttct attatttatg gcggcagcgg cagcacatgg 240
tacgcgagct gggcgaaggg ccgtttcacc atgtccaaag acagcgcaaa gaatagcgtg 300
tacctccaga tgaactctct ccgcgcagag gacacagcag tctattactg tgcgcggggc 360
cgcgatgcag gcgcgggcgg cagccgcaat gggtatagcc tgtggggaca ggggaccctt 420
gtgacagtct cgagc 435
<210> 73
<211> 227
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH20 Fab тяжелая цепь
<400> 73
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Met Ser Lys Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys
225
<210> 74
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH20 Fab тяжелая цепь (V + человеческая гамма1 CH1) (экспрессия в млекопитающих)
<400> 74
gaagtgcaac tggtggaaag cggaggaggt ttggtgaaac cgggagggtc actgcggctc 60
tcctgtgccg cctccggatt cagcctctcg tcctacgaca tgagctgggt cagacaggcc 120
cccgggaagg gcctggagtg gatttccatc atctacggcg gctccggctc gacttggtac 180
gcttcgtggg ccaagggacg gttcaccatg tccaaggatt ccgcgaagaa cagcgtgtat 240
ctgcagatga actctctgcg ggccgaggac accgcagtgt actactgcgc gagggggcgc 300
gacgccggcg ccgggggatc acgcaacggt tactcccttt ggggacaggg aaccctggtc 360
actgtctcca gcgcttctac aaagggccca tcggtcttcc ccctggcacc ctcctccaag 420
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 480
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 540
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 600
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtggacaag 660
aaagttgagc ccaaatcttg t 681
<210> 75
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH20 Fab тяжелая цепь (V + человеческая гамма-1 CH1) (экспрессия в E. coli)
<400> 75
gaggttcagc tggtcgagtc tggaggcggg cttgtcaaac ctggagggag cctgcgtctc 60
tcttgtgcag caagcggctt cagcctgtcc tcttacgata tgtcctgggt gcgccaggca 120
cctgggaagg gcctggagtg gatttctatt atttatggcg gcagcggcag cacatggtac 180
gcgagctggg cgaagggccg tttcaccatg tccaaagaca gcgcaaagaa tagcgtgtac 240
ctccagatga actctctccg cgcagaggac acagcagtct attactgtgc gcggggccgc 300
gatgcaggcg cgggcggcag ccgcaatggg tatagcctgt ggggacaggg gacccttgtg 360
acagtctcga gcgcttctac aaagggccca tcggtcttcc ccctggcacc ctcctccaag 420
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 480
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 540
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 600
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtcgacaag 660
aaagttgagc ccaaatcttg t 681
<210> 76
<211> 245
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH20 Fab тяжелая цепь с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 76
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro
20 25 30
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Ser Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Met Ser Lys Asp Ser Ala Lys Asn Ser
85 90 95
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly
115 120 125
Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys
245
<210> 77
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH20 Fab тяжелая цепь с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 77
atgaagtggg tcaccttcat ctccctgctg tttctgttct ccagcgccta ctccgaagtg 60
caactggtgg aaagcggagg aggtttggtg aaaccgggag ggtcactgcg gctctcctgt 120
gccgcctccg gattcagcct ctcgtcctac gacatgagct gggtcagaca ggcccccggg 180
aagggcctgg agtggatttc catcatctac ggcggctccg gctcgacttg gtacgcttcg 240
tgggccaagg gacggttcac catgtccaag gattccgcga agaacagcgt gtatctgcag 300
atgaactctc tgcgggccga ggacaccgca gtgtactact gcgcgagggg gcgcgacgcc 360
ggcgccgggg gatcacgcaa cggttactcc ctttggggac agggaaccct ggtcactgtc 420
tccagcgctt ctacaaaggg cccatcggtc ttccccctgg caccctcctc caagagcacc 480
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 540
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 600
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 660
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 720
gagcccaaat cttgt 735
<210> 78
<211> 248
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH20 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в E. coli)
<400> 78
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Leu Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Ser Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp
65 70 75 80
Tyr Ala Ser Trp Ala Lys Gly Arg Phe Thr Met Ser Lys Asp Ser Ala
85 90 95
Lys Asn Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser
115 120 125
Arg Asn Gly Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
145 150 155 160
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
165 170 175
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
180 185 190
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
195 200 205
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
210 215 220
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
225 230 235 240
Lys Lys Val Glu Pro Lys Ser Cys
245
<210> 79
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH20 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в E. coli)
<400> 79
atgaagaaga ctgctatagc aattgcagtg gcgctagctg gtttcgccac cgtggcgcaa 60
gctgaggttc agctggtcga gtctggaggc gggcttgtca aacctggagg gagcctgcgt 120
ctctcttgtg cagcaagcgg cttcagcctg tcctcttacg atatgtcctg ggtgcgccag 180
gcacctggga agggcctgga gtggatttct attatttatg gcggcagcgg cagcacatgg 240
tacgcgagct gggcgaaggg ccgtttcacc atgtccaaag acagcgcaaa gaatagcgtg 300
tacctccaga tgaactctct ccgcgcagag gacacagcag tctattactg tgcgcggggc 360
cgcgatgcag gcgcgggcgg cagccgcaat gggtatagcc tgtggggaca ggggaccctt 420
gtgacagtct cgagcgcttc tacaaagggc ccatcggtct tccccctggc accctcctcc 480
aagagcacct ctgggggcac agcggccctg ggctgcctgg tcaaggacta cttccccgaa 540
ccggtgacgg tgtcgtggaa ctcaggcgcc ctgaccagcg gcgtgcacac cttcccggct 600
gtcctacagt cctcaggact ctactccctc agcagcgtgg tgaccgtgcc ctccagcagc 660
ttgggcaccc agacctacat ctgcaacgtg aatcacaagc ccagcaacac caaggtcgac 720
aagaaagttg agcccaaatc ttgt 744
<210> 80
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH23 V-область
<400> 80
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Ala Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 81
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH23 V-область
<400> 81
gaagtgcaac tggtggaaag cggaggaggt ttggtgaaac cgggagggtc actgcggctc 60
tcctgtgccg cctccggatt cagcctctcg tcctacgaca tgagctgggt cagacaggcc 120
cccgggaagg gcctggagtg gattggtatc atctacggcg gctccggctc gacttggtac 180
gcttcgtggg ccaagggacg gttcaccatc tcccgcgatt ccgcgaagaa cagcgtgtat 240
ctgcagatga actctctgcg ggccgaggac accgcagtgt actactgcgc gagggggcgc 300
gacgccggcg ccgggggatc acgcaacgcc tactcccttt ggggacaggg aaccctggtc 360
actgtctcca gc 372
<210> 82
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH23 V-область (экспрессия в E. coli)
<400> 82
gaggttcagc tggtcgagtc tggaggcggg cttgtcaaac ctggagggag cctgcgtctc 60
tcttgtgcag caagcggctt cagcctgtcc tcttacgata tgtcctgggt gcgccaggca 120
cctgggaagg gcctggagtg gattggcatt atttatggcg gcagcggcag cacatggtac 180
gcgagctggg cgaagggccg tttcaccatc tcccgggaca gcgcaaagaa tagcgtgtac 240
ctccagatga actctctccg cgcagaggac acagcagtct attactgtgc gcggggccgc 300
gatgcaggcg cgggcggcag ccgcaacgcg tatagcctgt ggggacaggg gacccttgtg 360
acagtctcga gc 372
<210> 83
<211> 142
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH23 V-область с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 83
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro
20 25 30
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser
85 90 95
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Ala
115 120 125
Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
<210> 84
<211> 426
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH23 V-область с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 84
atgaagtggg tcaccttcat ctccctgctg tttctgttct ccagcgccta ctccgaagtg 60
caactggtgg aaagcggagg aggtttggtg aaaccgggag ggtcactgcg gctctcctgt 120
gccgcctccg gattcagcct ctcgtcctac gacatgagct gggtcagaca ggcccccggg 180
aagggcctgg agtggattgg tatcatctac ggcggctccg gctcgacttg gtacgcttcg 240
tgggccaagg gacggttcac catctcccgc gattccgcga agaacagcgt gtatctgcag 300
atgaactctc tgcgggccga ggacaccgca gtgtactact gcgcgagggg gcgcgacgcc 360
ggcgccgggg gatcacgcaa cgcctactcc ctttggggac agggaaccct ggtcactgtc 420
tccagc 426
<210> 85
<211> 145
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH23 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 85
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Leu Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp
65 70 75 80
Tyr Ala Ser Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala
85 90 95
Lys Asn Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser
115 120 125
Arg Asn Ala Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser
145
<210> 86
<211> 435
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH23 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 86
atgaagaaga ctgctatagc aattgcagtg gcgctagctg gtttcgccac cgtggcgcaa 60
gctgaggttc agctggtcga gtctggaggc gggcttgtca aacctggagg gagcctgcgt 120
ctctcttgtg cagcaagcgg cttcagcctg tcctcttacg atatgtcctg ggtgcgccag 180
gcacctggga agggcctgga gtggattggc attatttatg gcggcagcgg cagcacatgg 240
tacgcgagct gggcgaaggg ccgtttcacc atctcccggg acagcgcaaa gaatagcgtg 300
tacctccaga tgaactctct ccgcgcagag gacacagcag tctattactg tgcgcggggc 360
cgcgatgcag gcgcgggcgg cagccgcaac gcgtatagcc tgtggggaca ggggaccctt 420
gtgacagtct cgagc 435
<210> 87
<211> 227
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH23 Fab тяжелая цепь (V + человеческая гамма-1 CH1)
<400> 87
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Ala Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys
225
<210> 88
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH23 Fab тяжелая цепь (V + человеческая гамма-1 CH1) (экспреесия в млекопитающих)
<400> 88
gaagtgcaac tggtggaaag cggaggaggt ttggtgaaac cgggagggtc actgcggctc 60
tcctgtgccg cctccggatt cagcctctcg tcctacgaca tgagctgggt cagacaggcc 120
cccgggaagg gcctggagtg gattggtatc atctacggcg gctccggctc gacttggtac 180
gcttcgtggg ccaagggacg gttcaccatc tcccgcgatt ccgcgaagaa cagcgtgtat 240
ctgcagatga actctctgcg ggccgaggac accgcagtgt actactgcgc gagggggcgc 300
gacgccggcg ccgggggatc acgcaacgcc tactcccttt ggggacaggg aaccctggtc 360
actgtctcca gcgcttctac aaagggccca tcggtcttcc ccctggcacc ctcctccaag 420
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 480
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 540
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 600
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtggacaag 660
aaagttgagc ccaaatcttg t 681
<210> 89
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH23 Fab тяжелая цепь (V + человеческая гамма-1 CH1) (экспреесия в E. coli)
<400> 89
gaggttcagc tggtcgagtc tggaggcggg cttgtcaaac ctggagggag cctgcgtctc 60
tcttgtgcag caagcggctt cagcctgtcc tcttacgata tgtcctgggt gcgccaggca 120
cctgggaagg gcctggagtg gattggcatt atttatggcg gcagcggcag cacatggtac 180
gcgagctggg cgaagggccg tttcaccatc tcccgggaca gcgcaaagaa tagcgtgtac 240
ctccagatga actctctccg cgcagaggac acagcagtct attactgtgc gcggggccgc 300
gatgcaggcg cgggcggcag ccgcaacgcg tatagcctgt ggggacaggg gacccttgtg 360
acagtctcga gcgcttctac aaagggccca tcggtcttcc ccctggcacc ctcctccaag 420
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 480
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 540
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 600
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtcgacaag 660
aaagttgagc ccaaatcttg t 681
<210> 90
<211> 245
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH23 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в млекопитающих)
<400> 90
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro
20 25 30
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser
85 90 95
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Ala
115 120 125
Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys
245
<210> 91
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH23 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в млекопитающих)
<400> 91
atgaagtggg tcaccttcat ctccctgctg tttctgttct ccagcgccta ctccgaagtg 60
caactggtgg aaagcggagg aggtttggtg aaaccgggag ggtcactgcg gctctcctgt 120
gccgcctccg gattcagcct ctcgtcctac gacatgagct gggtcagaca ggcccccggg 180
aagggcctgg agtggattgg tatcatctac ggcggctccg gctcgacttg gtacgcttcg 240
tgggccaagg gacggttcac catctcccgc gattccgcga agaacagcgt gtatctgcag 300
atgaactctc tgcgggccga ggacaccgca gtgtactact gcgcgagggg gcgcgacgcc 360
ggcgccgggg gatcacgcaa cgcctactcc ctttggggac agggaaccct ggtcactgtc 420
tccagcgctt ctacaaaggg cccatcggtc ttccccctgg caccctcctc caagagcacc 480
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 540
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 600
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 660
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 720
gagcccaaat cttgt 735
<210> 92
<211> 248
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH23 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в E. coli)
<400> 92
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Leu Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp
65 70 75 80
Tyr Ala Ser Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala
85 90 95
Lys Asn Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser
115 120 125
Arg Asn Ala Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
145 150 155 160
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
165 170 175
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
180 185 190
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
195 200 205
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
210 215 220
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
225 230 235 240
Lys Lys Val Glu Pro Lys Ser Cys
245
<210> 93
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH23 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в E. coli)
<400> 93
atgaagaaga ctgctatagc aattgcagtg gcgctagctg gtttcgccac cgtggcgcaa 60
gctgaggttc agctggtcga gtctggaggc gggcttgtca aacctggagg gagcctgcgt 120
ctctcttgtg cagcaagcgg cttcagcctg tcctcttacg atatgtcctg ggtgcgccag 180
gcacctggga agggcctgga gtggattggc attatttatg gcggcagcgg cagcacatgg 240
tacgcgagct gggcgaaggg ccgtttcacc atctcccggg acagcgcaaa gaatagcgtg 300
tacctccaga tgaactctct ccgcgcagag gacacagcag tctattactg tgcgcggggc 360
cgcgatgcag gcgcgggcgg cagccgcaac gcgtatagcc tgtggggaca ggggaccctt 420
gtgacagtct cgagcgcttc tacaaagggc ccatcggtct tccccctggc accctcctcc 480
aagagcacct ctgggggcac agcggccctg ggctgcctgg tcaaggacta cttccccgaa 540
ccggtgacgg tgtcgtggaa ctcaggcgcc ctgaccagcg gcgtgcacac cttcccggct 600
gtcctacagt cctcaggact ctactccctc agcagcgtgg tgaccgtgcc ctccagcagc 660
ttgggcaccc agacctacat ctgcaacgtg aatcacaagc ccagcaacac caaggtcgac 720
aagaaagttg agcccaaatc ttgt 744
<210> 94
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH29 V-область
<400> 94
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asp Gly Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 95
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH29 V-область (экспрессия в млекопитающих)
<400> 95
gaagtgcaac tggtggaaag cggaggaggt ttggtgaaac cgggagggtc actgcggctc 60
tcctgtgccg cctccggatt cagcctctcg tcctacgaca tgagctgggt cagacaggcc 120
cccgggaagg gcctggagtg gattggtatc atctacggcg gctccggctc gacttggtac 180
gcttcgtggg ccaagggacg gttcaccatc tcccgcgatt ccgcgaagaa cagcgtgtat 240
ctgcagatga actctctgcg ggccgaggac accgcagtgt actactgcgc gagggggcgc 300
gacgccggcg ccgggggatc acgcgacggt tactcccttt ggggacaggg aaccctggtc 360
actgtctcca gc 372
<210> 96
<211> 372
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH29 V-область (экспрессия в E. coli)
<400> 96
gaggttcagc tggtcgagtc tggaggcggg cttgtcaaac ctggagggag cctgcgtctc 60
tcttgtgcag caagcggctt cagcctgtcc tcttacgata tgtcctgggt gcgccaggca 120
cctgggaagg gcctggagtg gattggcatt atttatggcg gcagcggcag cacatggtac 180
gcgagctggg cgaagggccg tttcaccatc tcccgggaca gcgcaaagaa tagcgtgtac 240
ctccagatga actctctccg cgcagaggac acagcagtct attactgtgc gcggggccgc 300
gatgcaggcg cgggcggcag ccgcgatggg tatagcctgt ggggacaggg gacccttgtg 360
acagtctcga gc 372
<210> 97
<211> 142
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH29 V-область с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 97
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro
20 25 30
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser
85 90 95
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asp Gly
115 120 125
Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
130 135 140
<210> 98
<211> 426
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH29 V-область с сигнальной последовательностью (экспрессия в млекопитающих)
<400> 98
atgaagtggg tcaccttcat ctccctgctg tttctgttct ccagcgccta ctccgaagtg 60
caactggtgg aaagcggagg aggtttggtg aaaccgggag ggtcactgcg gctctcctgt 120
gccgcctccg gattcagcct ctcgtcctac gacatgagct gggtcagaca ggcccccggg 180
aagggcctgg agtggattgg tatcatctac ggcggctccg gctcgacttg gtacgcttcg 240
tgggccaagg gacggttcac catctcccgc gattccgcga agaacagcgt gtatctgcag 300
atgaactctc tgcgggccga ggacaccgca gtgtactact gcgcgagggg gcgcgacgcc 360
ggcgccgggg gatcacgcga cggttactcc ctttggggac agggaaccct ggtcactgtc 420
tccagc 426
<210> 99
<211> 145
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856gH29 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 99
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Leu Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp
65 70 75 80
Tyr Ala Ser Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala
85 90 95
Lys Asn Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser
115 120 125
Arg Asp Gly Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser
145
<210> 100
<211> 435
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856gH29 V-область с сигнальной последовательностью (экспрессия в E. coli)
<400> 100
atgaagaaga ctgctatagc aattgcagtg gcgctagctg gtttcgccac cgtggcgcaa 60
gctgaggttc agctggtcga gtctggaggc gggcttgtca aacctggagg gagcctgcgt 120
ctctcttgtg cagcaagcgg cttcagcctg tcctcttacg atatgtcctg ggtgcgccag 180
gcacctggga agggcctgga gtggattggc attatttatg gcggcagcgg cagcacatgg 240
tacgcgagct gggcgaaggg ccgtttcacc atctcccggg acagcgcaaa gaatagcgtg 300
tacctccaga tgaactctct ccgcgcagag gacacagcag tctattactg tgcgcggggc 360
cgcgatgcag gcgcgggcgg cagccgcgat gggtatagcc tgtggggaca ggggaccctt 420
gtgacagtct cgagc 435
<210> 101
<211> 227
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH29 Fab тяжелая цепь (V + человеческая гамма-1 CH1)
<400> 101
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asp Gly Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
210 215 220
Lys Ser Cys
225
<210> 102
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH29 Fab тяжелая цепь (V + человеческая гамма-1 CH1) (экспреесия в млекопитающих)
<400> 102
gaagtgcaac tggtggaaag cggaggaggt ttggtgaaac cgggagggtc actgcggctc 60
tcctgtgccg cctccggatt cagcctctcg tcctacgaca tgagctgggt cagacaggcc 120
cccgggaagg gcctggagtg gattggtatc atctacggcg gctccggctc gacttggtac 180
gcttcgtggg ccaagggacg gttcaccatc tcccgcgatt ccgcgaagaa cagcgtgtat 240
ctgcagatga actctctgcg ggccgaggac accgcagtgt actactgcgc gagggggcgc 300
gacgccggcg ccgggggatc acgcgacggt tactcccttt ggggacaggg aaccctggtc 360
actgtctcca gcgcttctac aaagggccca tcggtcttcc ccctggcacc ctcctccaag 420
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 480
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 540
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 600
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtggacaag 660
aaagttgagc ccaaatcttg t 681
<210> 103
<211> 681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH29 Fab тяжелая цепь (V + человеческая гамма-1 CH1) (экспреесия в E. coli)
<400> 103
gaggttcagc tggtcgagtc tggaggcggg cttgtcaaac ctggagggag cctgcgtctc 60
tcttgtgcag caagcggctt cagcctgtcc tcttacgata tgtcctgggt gcgccaggca 120
cctgggaagg gcctggagtg gattggcatt atttatggcg gcagcggcag cacatggtac 180
gcgagctggg cgaagggccg tttcaccatc tcccgggaca gcgcaaagaa tagcgtgtac 240
ctccagatga actctctccg cgcagaggac acagcagtct attactgtgc gcggggccgc 300
gatgcaggcg cgggcggcag ccgcgatggg tatagcctgt ggggacaggg gacccttgtg 360
acagtctcga gcgcttctac aaagggccca tcggtcttcc ccctggcacc ctcctccaag 420
agcacctctg ggggcacagc ggccctgggc tgcctggtca aggactactt ccccgaaccg 480
gtgacggtgt cgtggaactc aggcgccctg accagcggcg tgcacacctt cccggctgtc 540
ctacagtcct caggactcta ctccctcagc agcgtggtga ccgtgccctc cagcagcttg 600
ggcacccaga cctacatctg caacgtgaat cacaagccca gcaacaccaa ggtcgacaag 660
aaagttgagc ccaaatcttg t 681
<210> 104
<211> 245
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH29 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в млекопитающих)
<400> 104
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro
20 25 30
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser
35 40 45
Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
50 55 60
Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser
65 70 75 80
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser
85 90 95
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
100 105 110
Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asp Gly
115 120 125
Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser
130 135 140
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
145 150 155 160
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
165 170 175
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
180 185 190
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
195 200 205
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
210 215 220
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
225 230 235 240
Glu Pro Lys Ser Cys
245
<210> 105
<211> 735
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH29 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в млекопитающих)
<400> 105
atgaagtggg tcaccttcat ctccctgctg tttctgttct ccagcgccta ctccgaagtg 60
caactggtgg aaagcggagg aggtttggtg aaaccgggag ggtcactgcg gctctcctgt 120
gccgcctccg gattcagcct ctcgtcctac gacatgagct gggtcagaca ggcccccggg 180
aagggcctgg agtggattgg tatcatctac ggcggctccg gctcgacttg gtacgcttcg 240
tgggccaagg gacggttcac catctcccgc gattccgcga agaacagcgt gtatctgcag 300
atgaactctc tgcgggccga ggacaccgca gtgtactact gcgcgagggg gcgcgacgcc 360
ggcgccgggg gatcacgcga cggttactcc ctttggggac agggaaccct ggtcactgtc 420
tccagcgctt ctacaaaggg cccatcggtc ttccccctgg caccctcctc caagagcacc 480
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 540
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 600
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 660
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 720
gagcccaaat cttgt 735
<210> 106
<211> 248
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 gH29 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в E. coli)
<400> 106
Met Lys Lys Thr Ala Ile Ala Ile Ala Val Ala Leu Ala Gly Phe Ala
1 5 10 15
Thr Val Ala Gln Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Ser Leu Ser Ser Tyr Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Glu Trp Ile Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp
65 70 75 80
Tyr Ala Ser Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala
85 90 95
Lys Asn Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser
115 120 125
Arg Asp Gly Tyr Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser
130 135 140
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
145 150 155 160
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
165 170 175
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
180 185 190
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
195 200 205
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
210 215 220
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
225 230 235 240
Lys Lys Val Glu Pro Lys Ser Cys
245
<210> 107
<211> 744
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4856 gH29 Fab тяжелая цепь с сигнальной последовательностью (экспреесия в E. coli)
<400> 107
atgaagaaga ctgctatagc aattgcagtg gcgctagctg gtttcgccac cgtggcgcaa 60
gctgaggttc agctggtcga gtctggaggc gggcttgtca aacctggagg gagcctgcgt 120
ctctcttgtg cagcaagcgg cttcagcctg tcctcttacg atatgtcctg ggtgcgccag 180
gcacctggga agggcctgga gtggattggc attatttatg gcggcagcgg cagcacatgg 240
tacgcgagct gggcgaaggg ccgtttcacc atctcccggg acagcgcaaa gaatagcgtg 300
tacctccaga tgaactctct ccgcgcagag gacacagcag tctattactg tgcgcggggc 360
cgcgatgcag gcgcgggcgg cagccgcgat gggtatagcc tgtggggaca ggggaccctt 420
gtgacagtct cgagcgcttc tacaaagggc ccatcggtct tccccctggc accctcctcc 480
aagagcacct ctgggggcac agcggccctg ggctgcctgg tcaaggacta cttccccgaa 540
ccggtgacgg tgtcgtggaa ctcaggcgcc ctgaccagcg gcgtgcacac cttcccggct 600
gtcctacagt cctcaggact ctactccctc agcagcgtgg tgaccgtgcc ctccagcagc 660
ttgggcaccc agacctacat ctgcaacgtg aatcacaagc ccagcaacac caaggtcgac 720
aagaaagttg agcccaaatc ttgt 744
<210> 108
<211> 262
<212> Белок
<213> Искусственная последовательность
<220>
<223> 4856 scFv
<400> 108
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Cys Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Gly Gly Ser Gly Ser Thr Trp Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Asp Ala Gly Ala Gly Gly Ser Arg Asn Gly Tyr Ser
100 105 110
Leu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Ala Tyr Asp Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
145 150 155 160
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Ser Ile Tyr Ser Gly
165 170 175
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
180 185 190
Tyr Ala Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
210 215 220
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Trp Thr Asp Gly Gly
225 230 235 240
Ile Asp Asn Pro Phe Gly Cys Gly Thr Lys Val Glu Ile Lys Arg Thr
245 250 255
Glu Asn Leu Tyr Phe Gln
260
<210> 109
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Человеческий IGKV1-5 JK4 акцепторный каркас
<400> 109
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Ser Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 110
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Человеческий IGKV1-5 JK4 акцепторный каркас
<400> 110
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gagtattagt agctggttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgat gcctccagtt tggaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag tataatagtt attctctcac tttcggcgga 300
gggaccaagg tggagatcaa a 321
<210> 111
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Человеческий IGHV3-21 JH5 акцепторный каркас
<400> 111
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Trp Phe Asp Ser Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 112
<211> 342
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Человеческий IGHV3-21 JH5 акцепторный каркас
<400> 112
gaggtgcagc tggtggagtc tgggggaggc ctggtcaagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatagca tgaactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcatcc attagtagta gtagtagtta catatactac 180
gcagactcag tgaagggccg attcaccatc tccagagaca acgccaagaa ctcactgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagaaactgg 300
ttcgactcct ggggccaagg aaccctggtc accgtctcct ca 342
<210> 113
<211> 361
<212> Белок
<213> Искусственная последовательность
<220>
<223> Человеческий LAP и TGFb1
<400> 113
Leu Ser Thr Cys Lys Thr Ile Asp Met Glu Leu Val Lys Arg Lys Arg
1 5 10 15
Ile Glu Ala Ile Arg Gly Gln Ile Leu Ser Lys Leu Arg Leu Ala Ser
20 25 30
Pro Pro Ser Gln Gly Glu Val Pro Pro Gly Pro Leu Pro Glu Ala Val
35 40 45
Leu Ala Leu Tyr Asn Ser Thr Arg Asp Arg Val Ala Gly Glu Ser Ala
50 55 60
Glu Pro Glu Pro Glu Pro Glu Ala Asp Tyr Tyr Ala Lys Glu Val Thr
65 70 75 80
Arg Val Leu Met Val Glu Thr His Asn Glu Ile Tyr Asp Lys Phe Lys
85 90 95
Gln Ser Thr His Ser Ile Tyr Met Phe Phe Asn Thr Ser Glu Leu Arg
100 105 110
Glu Ala Val Pro Glu Pro Val Leu Leu Ser Arg Ala Glu Leu Arg Leu
115 120 125
Leu Arg Leu Lys Leu Lys Val Glu Gln His Val Glu Leu Tyr Gln Lys
130 135 140
Tyr Ser Asn Asn Ser Trp Arg Tyr Leu Ser Asn Arg Leu Leu Ala Pro
145 150 155 160
Ser Asp Ser Pro Glu Trp Leu Ser Phe Asp Val Thr Gly Val Val Arg
165 170 175
Gln Trp Leu Ser Arg Gly Gly Glu Ile Glu Gly Phe Arg Leu Ser Ala
180 185 190
His Cys Ser Cys Asp Ser Arg Asp Asn Thr Leu Gln Val Asp Ile Asn
195 200 205
Gly Phe Thr Thr Gly Arg Arg Gly Asp Leu Ala Thr Ile His Gly Met
210 215 220
Asn Arg Pro Phe Leu Leu Leu Met Ala Thr Pro Leu Glu Arg Ala Gln
225 230 235 240
His Leu Gln Ser Ser Arg His Arg Arg Ala Leu Asp Thr Asn Tyr Cys
245 250 255
Phe Ser Ser Thr Glu Lys Asn Cys Cys Val Arg Gln Leu Tyr Ile Asp
260 265 270
Phe Arg Lys Asp Leu Gly Trp Lys Trp Ile His Glu Pro Lys Gly Tyr
275 280 285
His Ala Asn Phe Cys Leu Gly Pro Cys Pro Tyr Ile Trp Ser Leu Asp
290 295 300
Thr Gln Tyr Ser Lys Val Leu Ala Leu Tyr Asn Gln His Asn Pro Gly
305 310 315 320
Ala Ser Ala Ala Pro Cys Cys Val Pro Gln Ala Leu Glu Pro Leu Pro
325 330 335
Ile Val Tyr Tyr Val Gly Arg Lys Pro Lys Val Glu Gln Leu Ser Asn
340 345 350
Met Ile Val Arg Ser Cys Lys Cys Ser
355 360
<210> 114
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> зрелый человеческий TGFb1
<400> 114
Ala Leu Asp Thr Asn Tyr Cys Phe Ser Ser Thr Glu Lys Asn Cys Cys
1 5 10 15
Val Arg Gln Leu Tyr Ile Asp Phe Arg Lys Asp Leu Gly Trp Lys Trp
20 25 30
Ile His Glu Pro Lys Gly Tyr His Ala Asn Phe Cys Leu Gly Pro Cys
35 40 45
Pro Tyr Ile Trp Ser Leu Asp Thr Gln Tyr Ser Lys Val Leu Ala Leu
50 55 60
Tyr Asn Gln His Asn Pro Gly Ala Ser Ala Ala Pro Cys Cys Val Pro
65 70 75 80
Gln Ala Leu Glu Pro Leu Pro Ile Val Tyr Tyr Val Gly Arg Lys Pro
85 90 95
Lys Val Glu Gln Leu Ser Asn Met Ile Val Arg Ser Cys Lys Cys Ser
100 105 110
<210> 115
<211> 394
<212> Белок
<213> Искусственная последовательность
<220>
<223> Человеческий LAP и TGFb2
<400> 115
Leu Ser Thr Cys Ser Thr Leu Asp Met Asp Gln Phe Met Arg Lys Arg
1 5 10 15
Ile Glu Ala Ile Arg Gly Gln Ile Leu Ser Lys Leu Lys Leu Thr Ser
20 25 30
Pro Pro Glu Asp Tyr Pro Glu Pro Glu Glu Val Pro Pro Glu Val Ile
35 40 45
Ser Ile Tyr Asn Ser Thr Arg Asp Leu Leu Gln Glu Lys Ala Ser Arg
50 55 60
Arg Ala Ala Ala Cys Glu Arg Glu Arg Ser Asp Glu Glu Tyr Tyr Ala
65 70 75 80
Lys Glu Val Tyr Lys Ile Asp Met Pro Pro Phe Phe Pro Ser Glu Asn
85 90 95
Ala Ile Pro Pro Thr Phe Tyr Arg Pro Tyr Phe Arg Ile Val Arg Phe
100 105 110
Asp Val Ser Ala Met Glu Lys Asn Ala Ser Asn Leu Val Lys Ala Glu
115 120 125
Phe Arg Val Phe Arg Leu Gln Asn Pro Lys Ala Arg Val Pro Glu Gln
130 135 140
Arg Ile Glu Leu Tyr Gln Ile Leu Lys Ser Lys Asp Leu Thr Ser Pro
145 150 155 160
Thr Gln Arg Tyr Ile Asp Ser Lys Val Val Lys Thr Arg Ala Glu Gly
165 170 175
Glu Trp Leu Ser Phe Asp Val Thr Asp Ala Val His Glu Trp Leu His
180 185 190
His Lys Asp Arg Asn Leu Gly Phe Lys Ile Ser Leu His Cys Pro Cys
195 200 205
Cys Thr Phe Val Pro Ser Asn Asn Tyr Ile Ile Pro Asn Lys Ser Glu
210 215 220
Glu Leu Glu Ala Arg Phe Ala Gly Ile Asp Gly Thr Ser Thr Tyr Thr
225 230 235 240
Ser Gly Asp Gln Lys Thr Ile Lys Ser Thr Arg Lys Lys Asn Ser Gly
245 250 255
Lys Thr Pro His Leu Leu Leu Met Leu Leu Pro Ser Tyr Arg Leu Glu
260 265 270
Ser Gln Gln Thr Asn Arg Arg Lys Lys Arg Ala Leu Asp Ala Ala Tyr
275 280 285
Cys Phe Arg Asn Val Gln Asp Asn Cys Cys Leu Arg Pro Leu Tyr Ile
290 295 300
Asp Phe Lys Arg Asp Leu Gly Trp Lys Trp Ile His Glu Pro Lys Gly
305 310 315 320
Tyr Asn Ala Asn Phe Cys Ala Gly Ala Cys Pro Tyr Leu Trp Ser Ser
325 330 335
Asp Thr Gln His Ser Arg Val Leu Ser Leu Tyr Asn Thr Ile Asn Pro
340 345 350
Glu Ala Ser Ala Ser Pro Cys Cys Val Ser Gln Asp Leu Glu Pro Leu
355 360 365
Thr Ile Leu Tyr Tyr Ile Gly Lys Thr Pro Lys Ile Glu Gln Leu Ser
370 375 380
Asn Met Ile Val Lys Ser Cys Lys Cys Ser
385 390
<210> 116
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> зрелый человеческий TGFb2
<400> 116
Ala Leu Asp Ala Ala Tyr Cys Phe Arg Asn Val Gln Asp Asn Cys Cys
1 5 10 15
Leu Arg Pro Leu Tyr Ile Asp Phe Lys Arg Asp Leu Gly Trp Lys Trp
20 25 30
Ile His Glu Pro Lys Gly Tyr Asn Ala Asn Phe Cys Ala Gly Ala Cys
35 40 45
Pro Tyr Leu Trp Ser Ser Asp Thr Gln His Ser Arg Val Leu Ser Leu
50 55 60
Tyr Asn Thr Ile Asn Pro Glu Ala Ser Ala Ser Pro Cys Cys Val Ser
65 70 75 80
Gln Asp Leu Glu Pro Leu Thr Ile Leu Tyr Tyr Ile Gly Lys Thr Pro
85 90 95
Lys Ile Glu Gln Leu Ser Asn Met Ile Val Lys Ser Cys Lys Cys Ser
100 105 110
<210> 117
<211> 389
<212> Белок
<213> Искусственная последовательность
<220>
<223> Человеческий LAP и TGFb3
<400> 117
Leu Ser Thr Cys Thr Thr Leu Asp Phe Gly His Ile Lys Lys Lys Arg
1 5 10 15
Val Glu Ala Ile Arg Gly Gln Ile Leu Ser Lys Leu Arg Leu Thr Ser
20 25 30
Pro Pro Glu Pro Thr Val Met Thr His Val Pro Tyr Gln Val Leu Ala
35 40 45
Leu Tyr Asn Ser Thr Arg Glu Leu Leu Glu Glu Met His Gly Glu Arg
50 55 60
Glu Glu Gly Cys Thr Gln Glu Asn Thr Glu Ser Glu Tyr Tyr Ala Lys
65 70 75 80
Glu Ile His Lys Phe Asp Met Ile Gln Gly Leu Ala Glu His Asn Glu
85 90 95
Leu Ala Val Cys Pro Lys Gly Ile Thr Ser Lys Val Phe Arg Phe Asn
100 105 110
Val Ser Ser Val Glu Lys Asn Arg Thr Asn Leu Phe Arg Ala Glu Phe
115 120 125
Arg Val Leu Arg Val Pro Asn Pro Ser Ser Lys Arg Asn Glu Gln Arg
130 135 140
Ile Glu Leu Phe Gln Ile Leu Arg Pro Asp Glu His Ile Ala Lys Gln
145 150 155 160
Arg Tyr Ile Gly Gly Lys Asn Leu Pro Thr Arg Gly Thr Ala Glu Trp
165 170 175
Leu Ser Phe Asp Val Thr Asp Thr Val Arg Glu Trp Leu Leu Arg Arg
180 185 190
Glu Ser Asn Leu Gly Leu Glu Ile Ser Ile His Cys Pro Cys His Thr
195 200 205
Phe Gln Pro Asn Gly Asp Ile Leu Glu Asn Ile His Glu Val Met Glu
210 215 220
Ile Lys Phe Lys Gly Val Asp Asn Glu Asp Asp His Gly Arg Gly Asp
225 230 235 240
Leu Gly Arg Leu Lys Lys Gln Lys Asp His His Asn Pro His Leu Ile
245 250 255
Leu Met Met Ile Pro Pro His Arg Leu Asp Asn Pro Gly Gln Gly Gly
260 265 270
Gln Arg Lys Lys Arg Ala Leu Asp Thr Asn Tyr Cys Phe Arg Asn Leu
275 280 285
Glu Glu Asn Cys Cys Val Arg Pro Leu Tyr Ile Asp Phe Arg Gln Asp
290 295 300
Leu Gly Trp Lys Trp Val His Glu Pro Lys Gly Tyr Tyr Ala Asn Phe
305 310 315 320
Cys Ser Gly Pro Cys Pro Tyr Leu Arg Ser Ala Asp Thr Thr His Ser
325 330 335
Thr Val Leu Gly Leu Tyr Asn Thr Leu Asn Pro Glu Ala Ser Ala Ser
340 345 350
Pro Cys Cys Val Pro Gln Asp Leu Glu Pro Leu Thr Ile Leu Tyr Tyr
355 360 365
Val Gly Arg Thr Pro Lys Val Glu Gln Leu Ser Asn Met Val Val Lys
370 375 380
Ser Cys Lys Cys Ser
385
<210> 118
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> зрелый человеческий TGFb3
<400> 118
Ala Leu Asp Thr Asn Tyr Cys Phe Arg Asn Leu Glu Glu Asn Cys Cys
1 5 10 15
Val Arg Pro Leu Tyr Ile Asp Phe Arg Gln Asp Leu Gly Trp Lys Trp
20 25 30
Val His Glu Pro Lys Gly Tyr Tyr Ala Asn Phe Cys Ser Gly Pro Cys
35 40 45
Pro Tyr Leu Arg Ser Ala Asp Thr Thr His Ser Thr Val Leu Gly Leu
50 55 60
Tyr Asn Thr Leu Asn Pro Glu Ala Ser Ala Ser Pro Cys Cys Val Pro
65 70 75 80
Gln Asp Leu Glu Pro Leu Thr Ile Leu Tyr Tyr Val Gly Arg Thr Pro
85 90 95
Lys Val Glu Gln Leu Ser Asn Met Val Val Lys Ser Cys Lys Cys Ser
100 105 110
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕЖВИДОВЫЕ АНТИТЕЛА К ЛАТЕНТНОМУ TGF-БЕТА 1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2837609C2 |
| СЛИТЫЕ МОЛЕКУЛЫ ЭКТОДОМЕНА РЕЦЕПТОРА TGF-БЕТА И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2797464C2 |
| СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ PD-L1 и LAG-3 | 2017 |
|
RU2784388C2 |
| БИСПЕЦИФИЧНЫЙ СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2801528C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ РАКА, НАЦЕЛИВАЮЩИЕСЯ НА CD38 И TGF-БЕТА | 2019 |
|
RU2808632C2 |
| СЛИТЫЙ БЕЛОК НА ОСНОВЕ АНТИТЕЛА К ЕТА И TGF-β TRAP, СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2832190C2 |
| СЛИТЫЙ БЕЛОК, СОДЕРЖАЩИЙ РЕЦЕПТОР TGF-БЕТА, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2776204C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ СЛИТОГО БЕЛКА РЕЦЕПТОРА ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА БЕТА И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2791683C2 |
| МОЛЕКУЛЫ АНТИТЕЛ К CD73 И ПУТИ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2791192C2 |
| ПОЛИФУНКЦИОНАЛЬНЫЕ БЕЛКОВЫЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ ДЕКОРИН, И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2823357C2 |































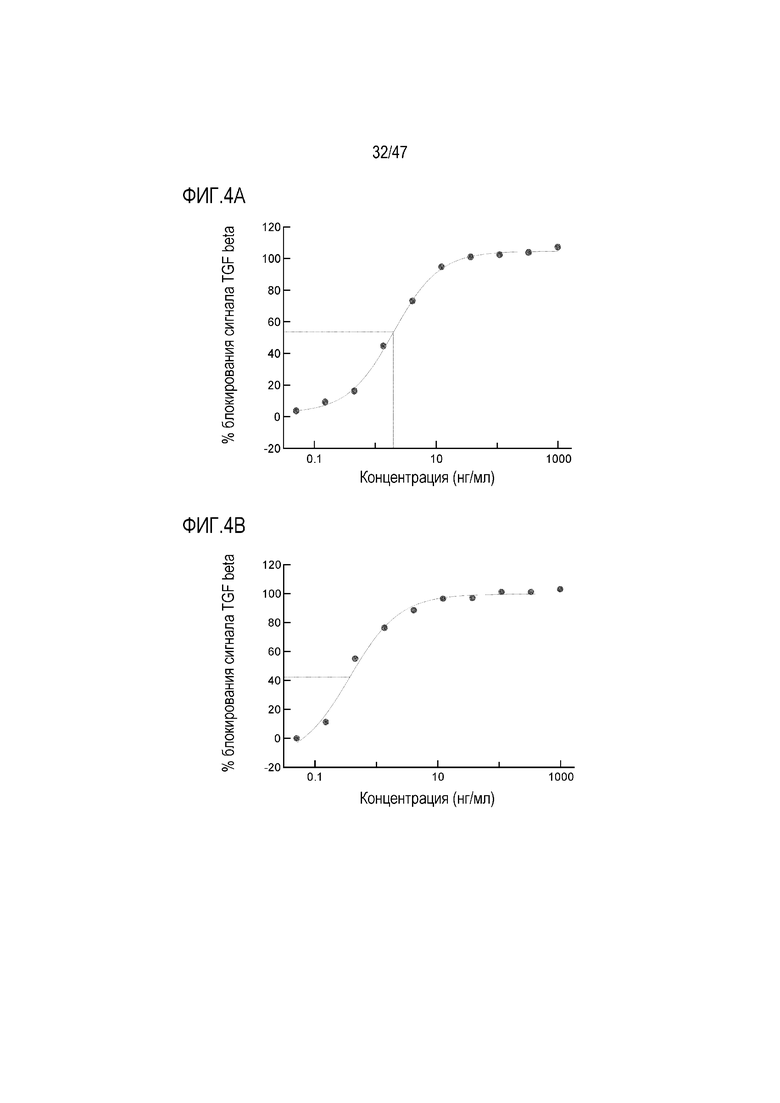
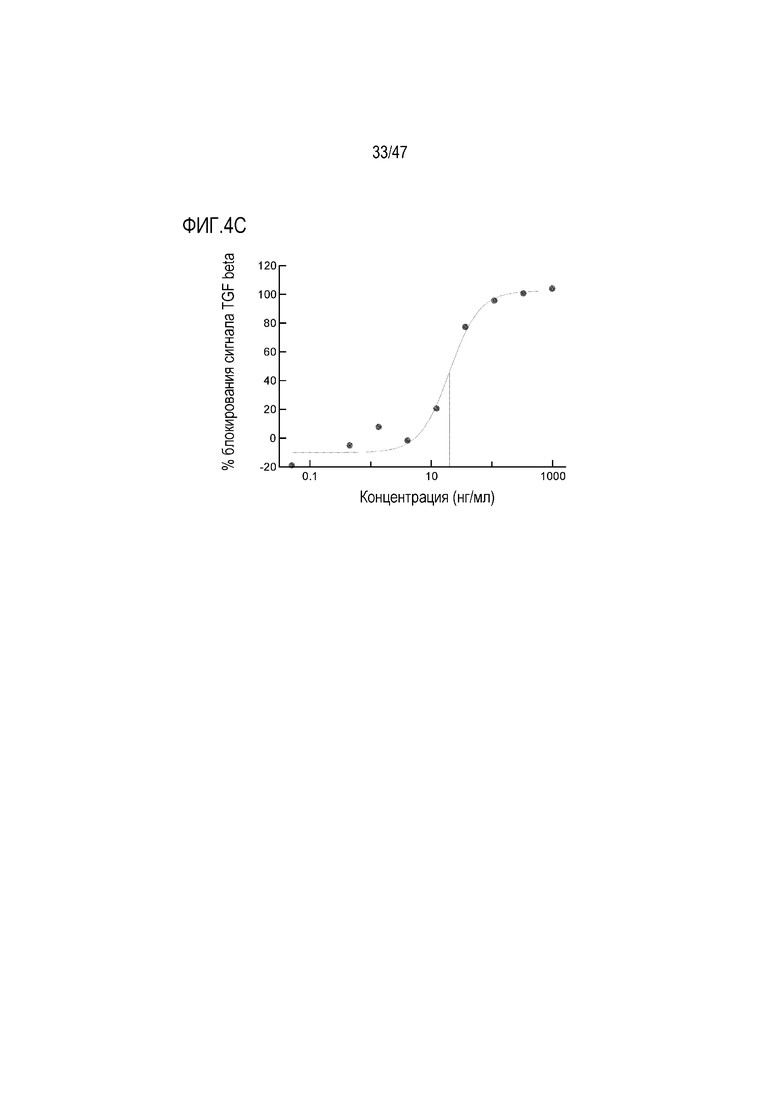
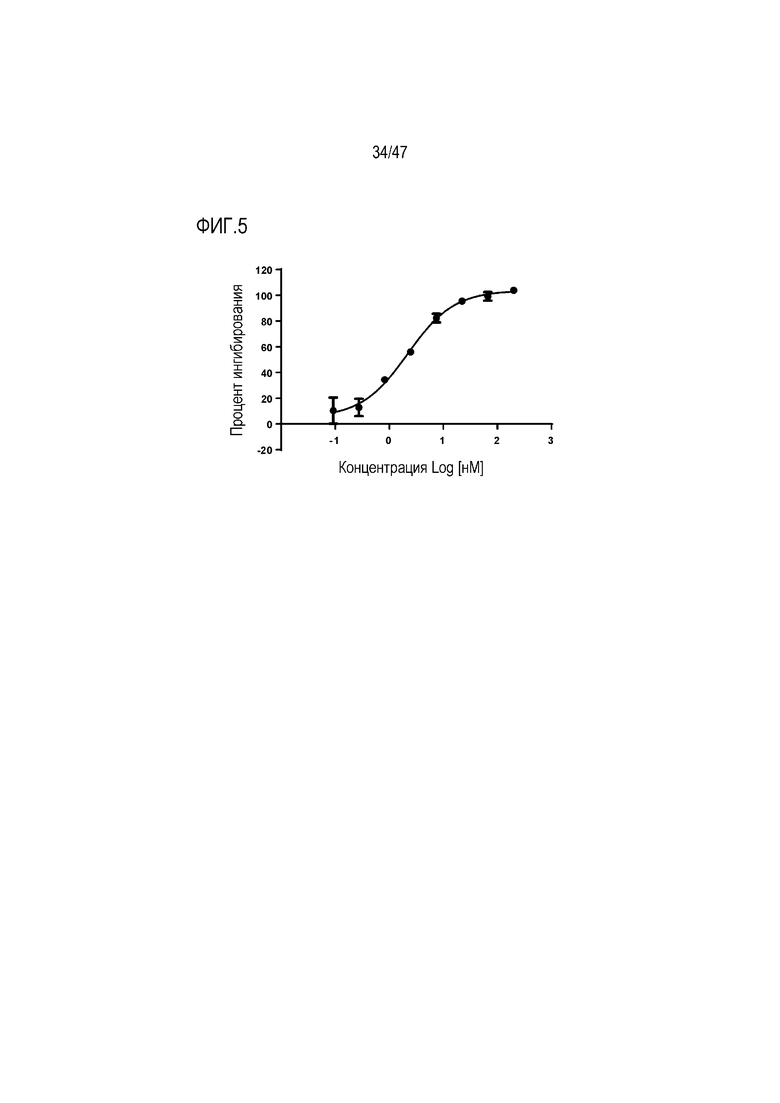



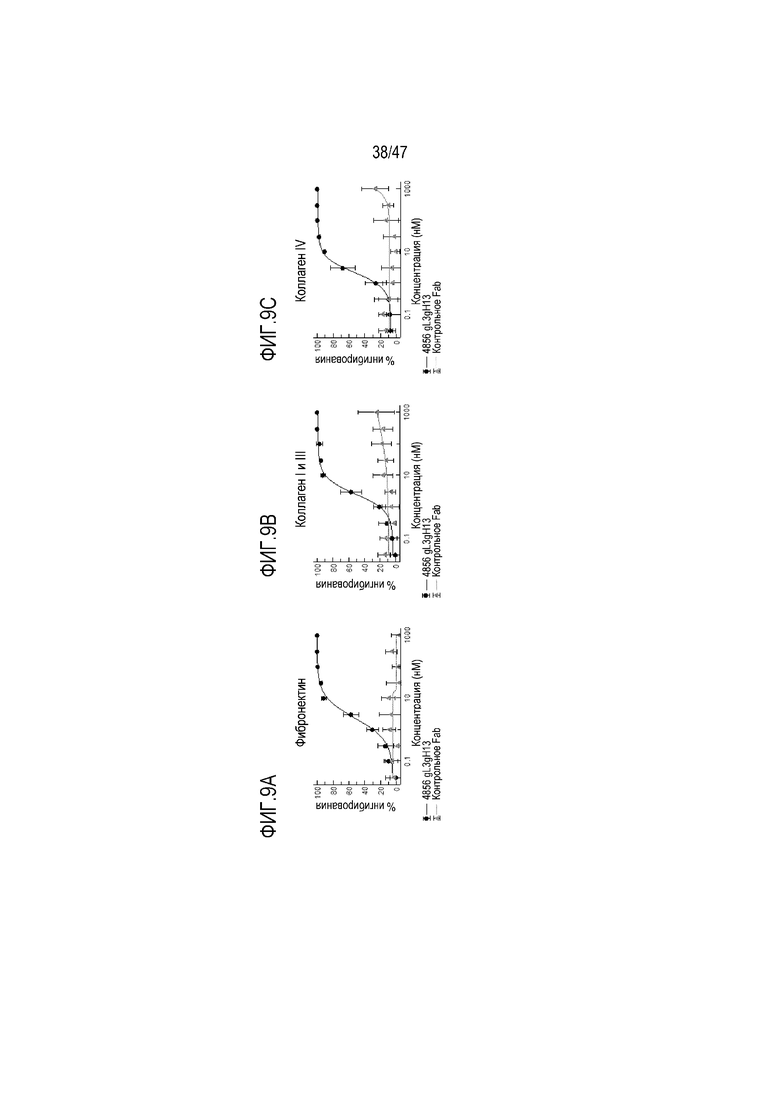
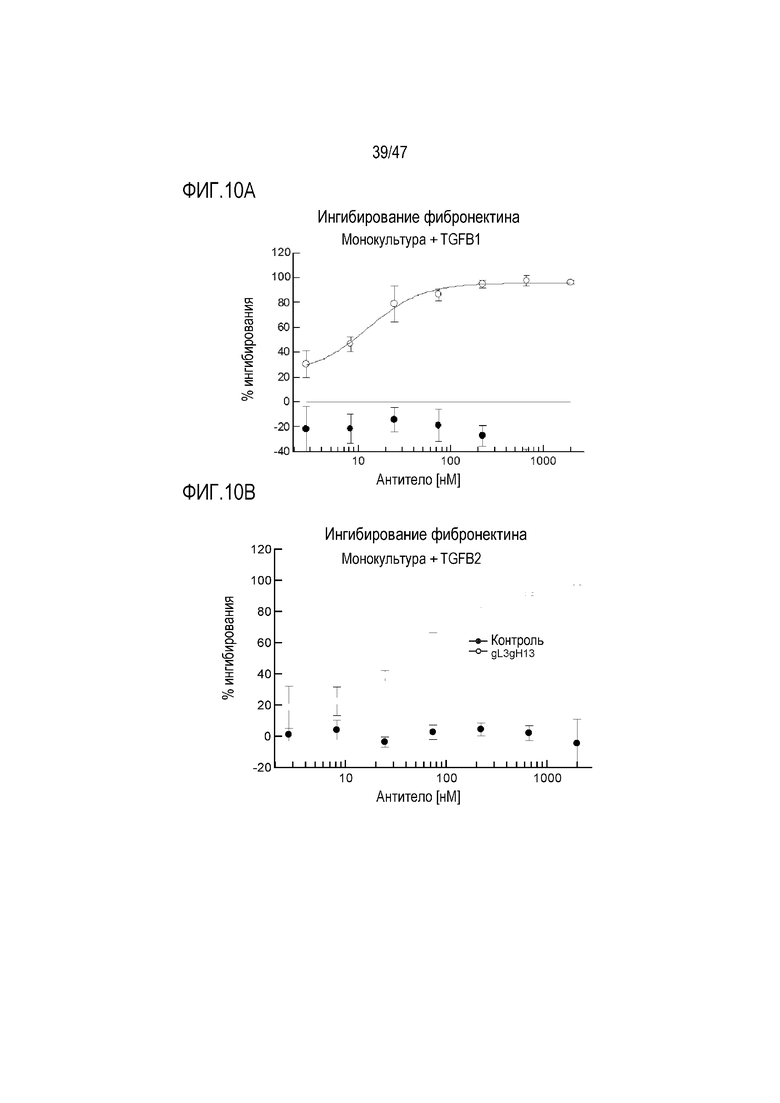
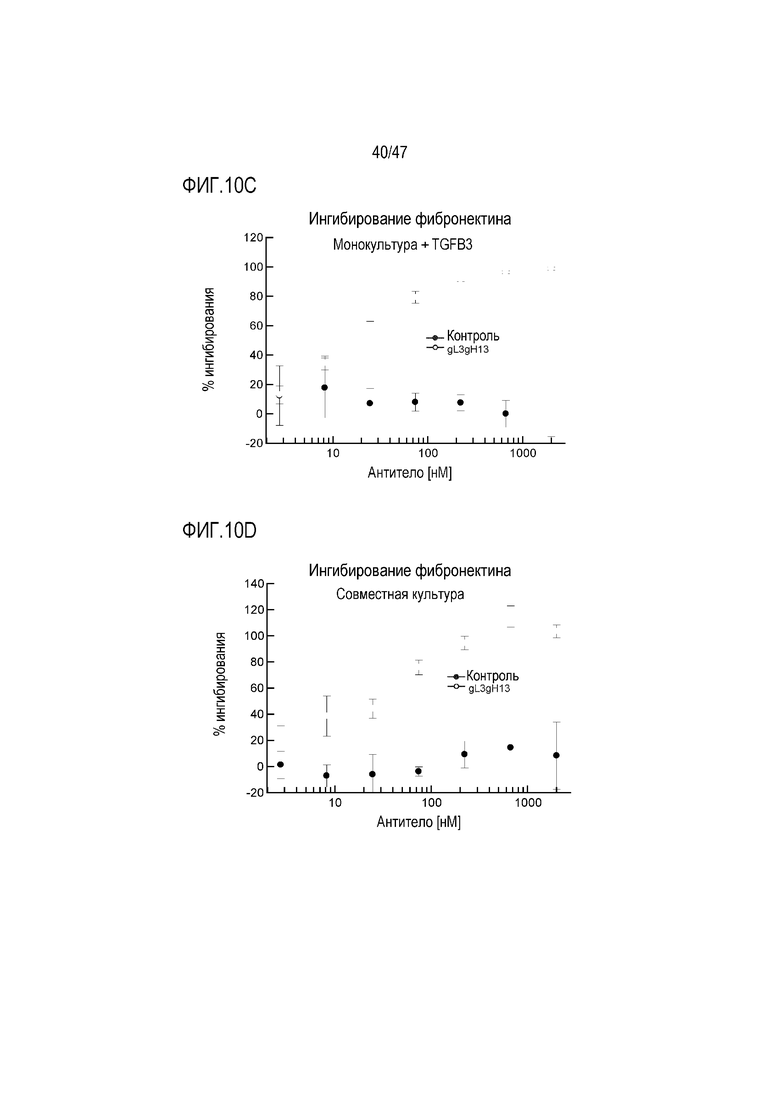
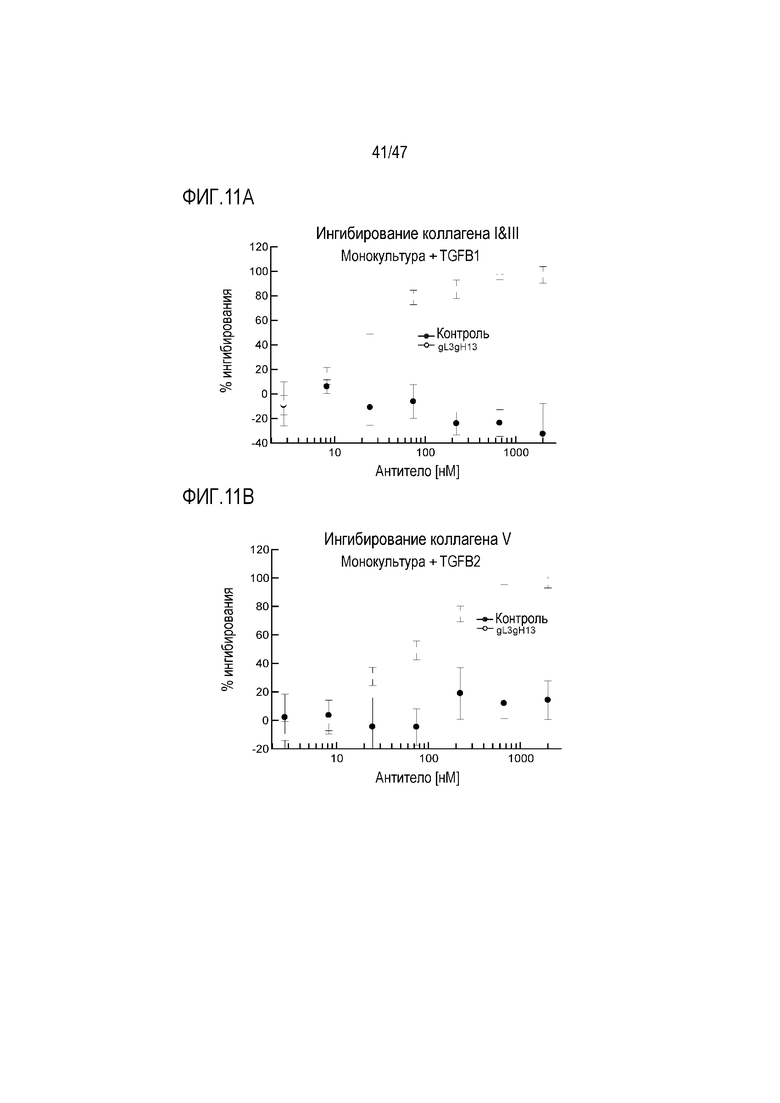
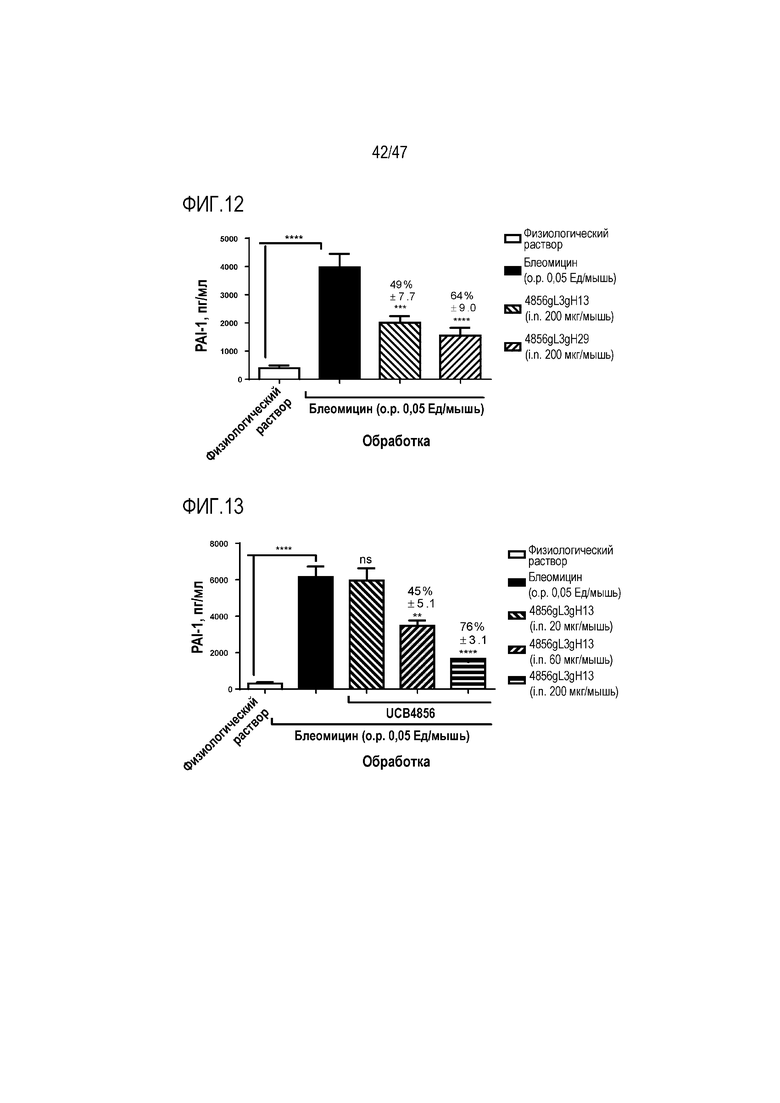
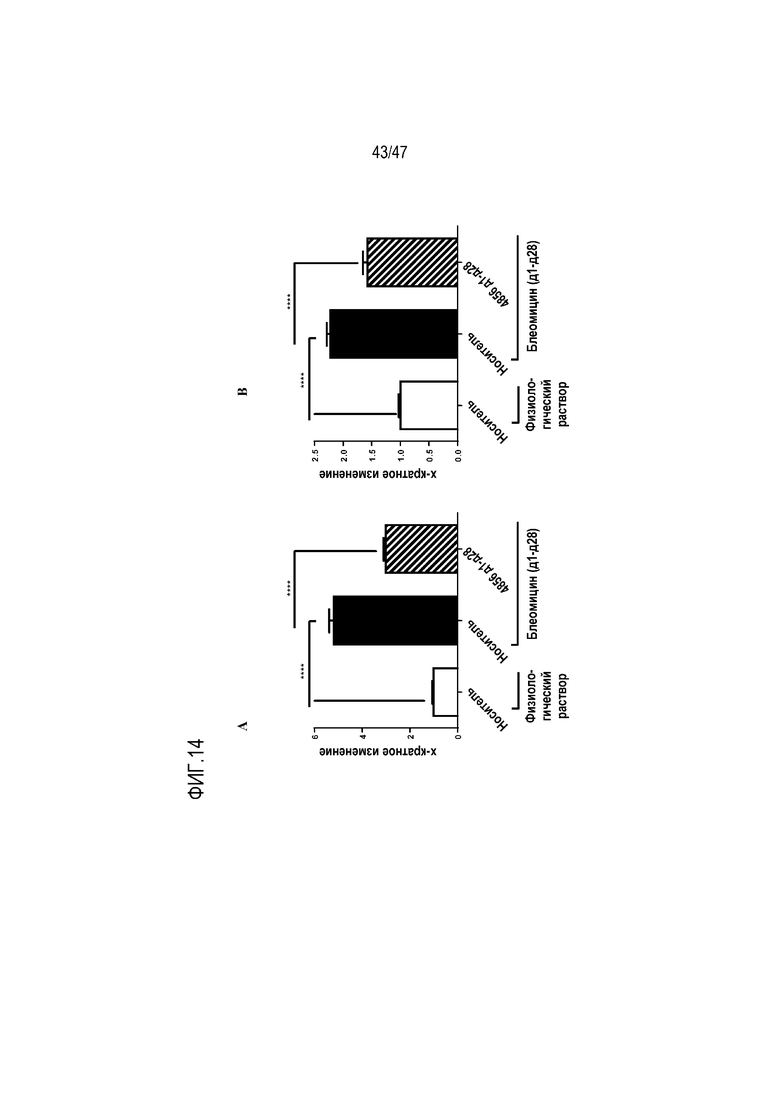
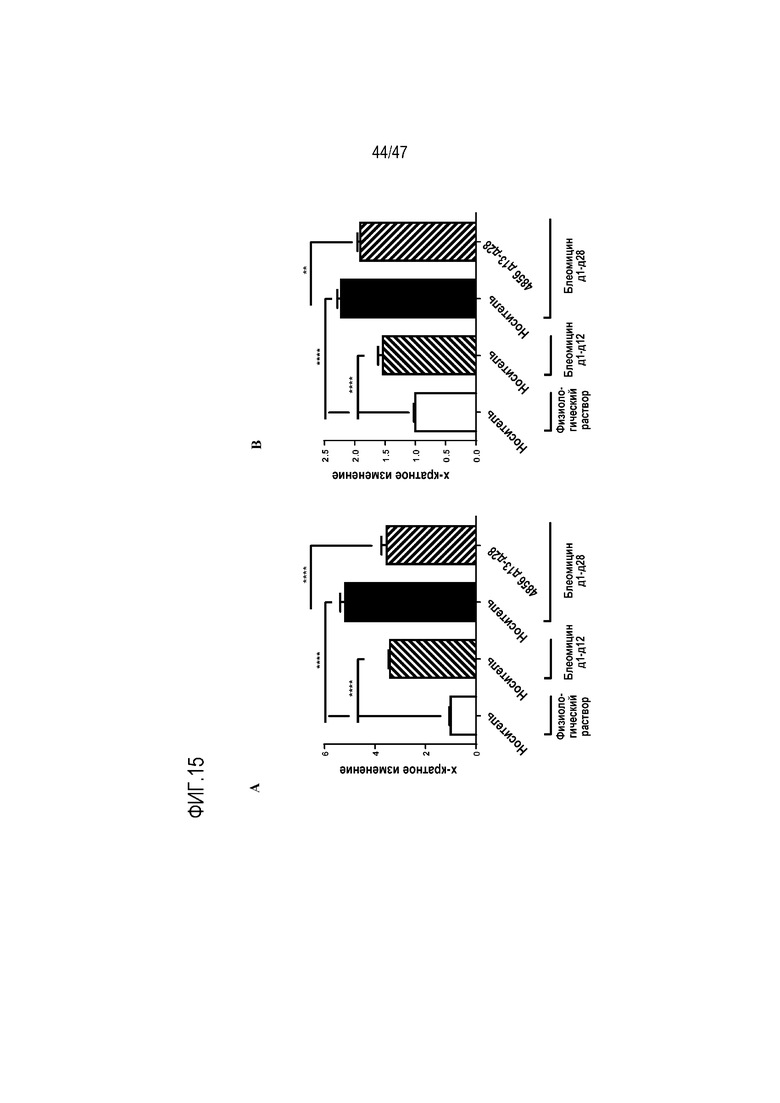
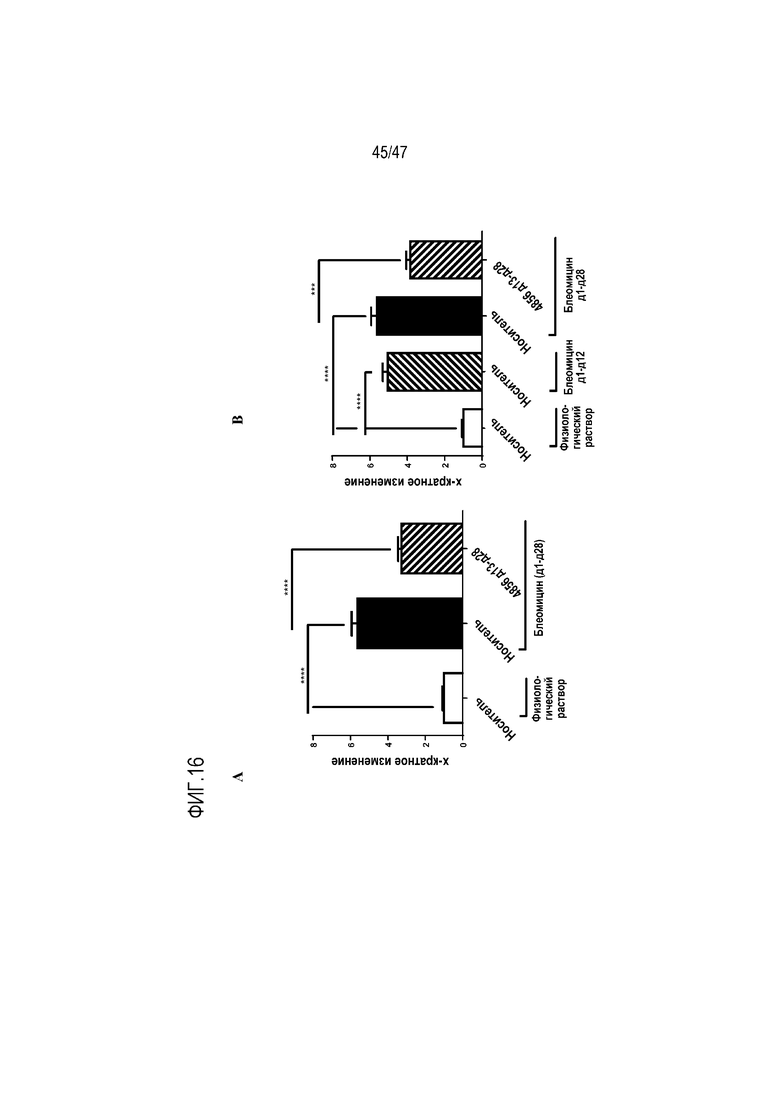
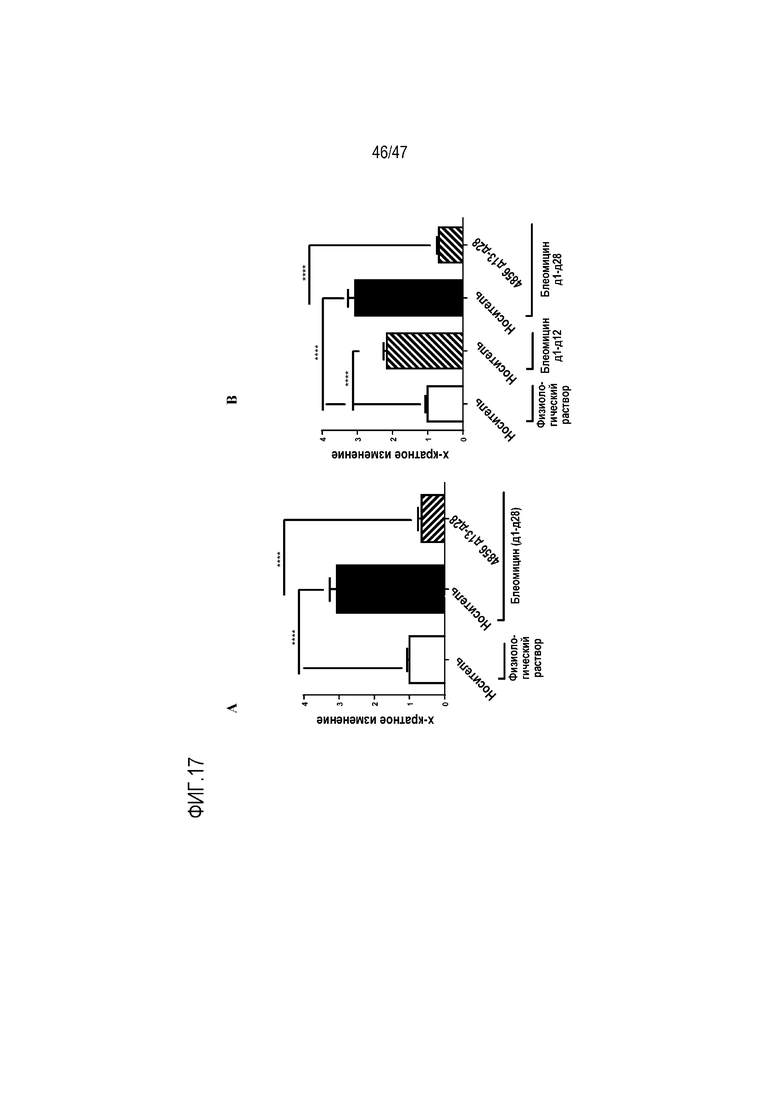

Изобретение относится к области биохимии, в частности к антагонистическому антителу или его связывающему фрагменту, специфично связывающемуся с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, к способу его получения, а также к выделенной последовательности ДНК, кодирующей его легкую и тяжелую цепь, и содержащей его композиции. Также раскрыты вектор, клетка-хозяин, содержащие вышеуказанную последовательность ДНК. Изобретение также относится к применению вышеуказанного антитела или его фрагмента при изготовлении лекарственного средства для лечения или профилактики патологического расстройства, которое опосредовано TGF-beta 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3, а также в изготовлении лекарственного средства для лечения или профилактики легочного расстройства, которое опосредовано TGF-бета 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3. Изобретение позволяет эффективно осуществлять лечение пациента, страдающего или подверженного риску патологического расстройства, опосредованного TGF-beta 1, 2 или 3 или связанного с повышенным уровнем TGF-beta 1, 2 или 3. 13 н. и 15 з.п. ф-лы, 13 табл., 12 пр., 18 ил.
1. Антагонистическое антитело или его связывающий фрагмент, который специфично связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее тяжелую цепь, где вариабельный домен тяжелой цепи содержит последовательность, приведенную в SEQ ID NO: 4 для CDR-H1, последовательность, приведенную в SEQ ID NO: 5 для CDR-H2, и последовательность, приведенную в SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8 или SEQ ID NO: 9 для CDR-H3, и содержащее легкую цепь, где вариабельный домен легкой цепи содержит последовательность, приведенную в SEQ ID NO: 1 для CDR-L1, последовательность, приведенную в SEQ ID NO: 2 для CDR-L2, и последовательность, приведенную в SEQ ID NO: 3 для CDR-L3.
2. Антагонистическое антитело или его связывающий фрагмент по п.1, где антагонистическое антитело содержит тяжелую цепь, содержащую последовательность, приведенную в SEQ ID NO: 52, SEQ ID NO: 66, SEQ ID NO: 80 или SEQ ID NO: 94.
3. Антагонистическое антитело или его связывающий фрагмент по любому из пп.1, 2, где антагонистическое антитело содержит легкую цепь, содержащую последовательность, приведенную в SEQ ID NO: 38.
4. Антагонистическое антитело или его связывающий фрагмент по любому из пп.1-3, где молекула антагонистического антитела или его связывающий фрагмент выбраны из группы, состоящей из: полной молекулы антитела, имеющей полноразмерные тяжелую и легкую цепи или их фрагменты, например, выбранные из группы, содержащей Fab, модифицированный Fab', Fab', F(ab')2, Fv и scFv-фрагмент.
5. Антагонистическое антитело, которое специфично связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее тяжелую цепь, имеющую последовательность, приведенную в SEQ ID NO: 52, SEQ ID NO: 66, SEQ ID NO: 80 или SEQ ID NO: 94, и легкую цепь, имеющую последовательность, приведенную в SEQ ID NO: 38.
6. Антагонистическое антитело, которое специфично связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, содержащее тяжелую цепь, имеющую последовательность, приведенную в SEQ ID NO: 59, SEQ ID NO: 73, SEQ ID NO: 87 или SEQ ID NO: ID NO: 101, и легкую цепь, имеющую последовательность, приведенную в SEQ ID NO: 45.
7. Антагонистическое антитело или его связывающий фрагмент по любому из пп.1-6, обладающее аффинностью связывания с человеческим TGF-beta 1 200 пМ или лучше, аффинностью связывания с человеческим TGF-beta 2 300 пМ или лучше и аффинностью связывания с человеческим TGF-beta 3 2500 пМ или лучше.
8. Антагонистическое антитело или его связывающий фрагмент по п.7, обладающее аффинностью связывания с человеческим TGF-beta 1 100 пM или лучше, аффинностьюю связывания с человеческим TGF-beta 2 200 пМ или лучше и аффинностью связывания с человеческим TGF-beta 3 2000 пМ или лучше.
9. Антагонистическое антитело или его связывающий фрагмент по любому из пп.1-8, отличающееся тем, что в анализе репортерного гена в клетках HEK-SEAP-SBE с рекомбинантным TGF-beta 1, TGF-beta 2 или TGF-beta 3 антитело ингибирует активность человеческого TGF-beta 1 с IC50 0,5 нМ или лучше, ингибирует активность человеческого TGF-beta2 с IC50 0,05 нМ или лучше и ингибирует активность человеческого TGF-beta 3 с IC50 2 нМ или лучше.
10. Антагонистическое антитело по любому из пп.1-9, где в анализе репортерного гена в клетках HEK-SEAP-SBE с эндогенным TGF-beta антитело ингибирует человеческий TGF-beta с IC50 10 нМ или лучше.
11. Антагонистическое антитело по любому из предыдущих пунктов, где указанное антагонистическое антитело представляет собой моноклональное гуманизированное антитело.
12. Выделенная последовательность ДНК, кодирующая тяжелую и легкую цепь антитела по любому из пп.1-11.
13. Выделенная последовательность ДНК по п.12, отличающаяся тем, что выделенная последовательность ДНК содержит последовательность ДНК тяжелой цепи, приведенную в SEQ ID NO: 53; SEQ ID NO: 54; SEQ ID NO: 67; SEQ ID NO: 68; SEQ ID NO: 81; SEQ ID NO: 82; SEQ ID NO: 95, SEQ ID NO: 96, и последовательность ДНК легкой цепи, приведенную в SEQ ID NO: 39 или SEQ ID NO: 40.
14. Выделенная последовательность ДНК по п.12, отличающийся тем, что выделенная последовательность ДНК содержит последовательность ДНК легкой цепи, приведенную в SEQ ID NO: 46 или SEQ ID NO: 47, и последовательность ДНК тяжелой цепи, приведенную в SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 102 или SEQ ID NO: 103.
15. Экспрессирующий вектор, содержащий одну или более последовательностей ДНК по п.13 или 14.
16. Клетка-хозяин для продуцирования антагонистического антитела или его связывающего фрагмента, содержащая один или более экспрессирующих векторов по п.15.
17. Способ получения антагонистического антитела по любому из пп.1-11, включающий культивирование клетки-хозяина по п.16 и выделение антитела.
18. Фармацевтическая композиция для ингибирования биологической сигнальной активности TGF-beta 1, TGF-beta 2 и TGF-beta 3, содержащая эффективное количество антагонистического антитела по любому из пп.1-11 в комбинации с одним или более из фармацевтически приемлемого вспомогательного вещества, разбавителя или носителя.
19. Фармацевтическая композиция по п.18, дополнительно содержащая другие активные ингредиенты.
20. Фармацевтическая композиция по п.18 или 19, отличающаяся тем, что указанная фармацевтическая композиция подходит для ингаляционного введения, например, с помощью распыления, аэрозоля и/или сухого порошка.
21. Применение антагонистического антитела по любому из пп.1-11 или композиции по пп.18-20 при лечении или для профилактики патологического расстройства, которое опосредовано TGF-beta 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3.
22. Применение антитела по любому из пп.1-11 при изготовлении лекарственного средства для лечения или профилактики патологического расстройства, которое опосредовано TGF-beta 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3.
23. Способ лечения пациента, страдающего или подверженного риску патологического расстройства, опосредованного TGF-beta 1, 2 или 3 или связанного с повышенным уровнем TGF-beta 1, 2 или 3, причем способ включает введение пациенту эффективного количества антитела по любому из пп.1-11.
24. Антагонистическое антитело Fab или Fab'-фрагмент по любому из пп.1-11, который связывается человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, для применения путем ингаляционного введения, например, с помощью распыления, аэрозоля и/или сухого порошка при лечении или для профилактики легочного расстройства, которое опосредовано TGF-beta 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3.
25. Применение антагонистического антитела Fab или Fab'-фрагмента по любому из пп. 1-11, которое связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3, в изготовлении лекарственного средства для лечения или профилактики легочного расстройства, которое опосредовано TGF-бета 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3, путем ингаляционного введения, например, с помощью распыления, аэрозоля и/или сухого порошка.
26. Способ лечения пациента, страдающего или подверженного риску легочного расстройства, которое опосредовано TGF-beta 1, 2 или 3 или которое связано с повышенным уровнем TGF-beta 1, 2 или 3, причем способ включает введение пациенту путем ингаляционного введения, например, с помощью распыления, аэрозоля и/или сухого порошка эффективного количества антагонистического антитела Fab или Fab'-фрагмента по любому из пп. 1-11, который связывается с человеческим TGF-beta 1, человеческим TGF-beta 2 и человеческим TGF-beta 3.
27. Антитело по п.24, применение по п. 25 или способ по п. 26, отличающиеся тем, что антитело такое, как определено по любому из пп.1-11.
28. Антитело по п.24, применение по п. 25 или способ по п. 26, отличающиеся тем, что легочное заболевание выбрано из группы, состоящей из фиброза легких, такого как идиопатический фиброз легких, кистозного фиброза или вторичного по отношению к системному склерозу, и легочной гипертензии, такой как легочная артериальная гипертензия.
| WO2006086469 A2, 17.08.2006 | |||
| LISA M | |||
| RICE et al., Fresolimumab treatment decreases biomarkers and improves clinical symptoms in systemic sclerosis patients, J Clin Invest., 2015, Vol.125, N.7, pp.2795-2807 | |||
| ROSEMARY J | |||
| AKHURST et al., Targeting the TGFβ signalling pathway in disease, Nat Rev Drug Discov, 2012, Vol.11, N.10, pp.790-811 | |||
| ГУМАНИЗИРОВАННЫЕ АНТИ-ТФР-БЕТА-АНТИТЕЛА | 2005 |
|
RU2386638C2 |
Авторы
Даты
2021-04-22—Публикация
2017-06-07—Подача