ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявки испрашивает приоритет в соответствии с предварительными заявками на патент США №№62/220691, поданной 18 сентября 2015 года; 62/263544, поданной 4 декабря 2015 года; 62/221852, поданной 22 сентября 2015 года; 62/220725, поданной 18 сентября 2015 года; 62/232681, поданной 25 сентября 2015 года; 62/252171, поданной 6 ноября 2015 года, и 62/354592, поданной 24 июня 2016 года; раскрытия которых настоящим включены посредством ссылки, как если бы они были написаны в данном документе во всей своей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ Настоящее изобретение в целом относится к моноклональным антителам к CD47 (mAb к CD47) с отличающимися функциональными профилями, описанными в данном документе, способам получения mAb к CD47 и способам применения этих mAb к CD47 в качестве терапевтических средств для предупреждения и лечения солидных и гематологических типов рака, ишемически-реперфузионного повреждения, сердечно-сосудистых заболеваний, аутоиммунных заболеваний или воспалительных заболеваний или в качестве диагностических средств для определения уровня CD47 в образцах ткани.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
CD47 представляет собой рецептор клеточной поверхности, состоящий из внеклеточного домена IgV-класса, трансмембранного домена, пронизывающего мембрану 5 раз, и цитоплазматического хвоста, который является результатом альтернативного сплайсинга. Два лиганда связывают CD47: сигнальный ингибиторный рецепторный белок α (SIRPα) и тромбоспондин-1 (TSP1). Было определено, что экспрессия и/или активность CD47 вовлечены в целый ряд заболеваний и нарушений. Соответственно, существует потребность в терапевтических композициях и способах лечения заболеваний и состояний, ассоциированных с CD47, у людей и животных, включая предупреждение и лечение солидных и гематологических типов рака, ишемически-реперфузионного повреждения (IRI), сердечно-сосудистых заболеваний или аутоиммунного или воспалительного заболевания. Также существует потребность в диагностических композициях и способах определения уровня экспрессии CD47 в образцах опухоли.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении описаны mAb к CD47 с отличающимися функциональными профилями. Эти антитела характеризуются отличающимися комбинациями свойств, выбранными из следующих: 1) проявляют перекрестную реактивность с гомологами CD47 одного или нескольких видов; 2) блокируют взаимодействие между CD47 и его лигандом SIRPα; 3) усиливают фагоцитоз опухолевых клеток человека, 4) индуцируют гибель чувствительных опухолевых клеток человека; 5) не индуцируют клеточную гибель опухолевых клеток человека; 6) характеризуются сниженным связыванием с эритроцитами человека (hRBC); 7) характеризуются отсутствием обнаруживаемого связывания с hRBC; 8) вызывают сниженную агглютинацию hRBC; 9) не вызывают обнаруживаемую агглютинацию hRBC; 10) обращают ингибирование пути с участием оксида азота (NO) под действием TSP1 и/или 11) не обращают ингибирование пути с участием NO под действием TSP1. Антитела по настоящему изобретению применимы в различных терапевтических способах лечения заболеваний и состояний, ассоциированных с CD47, у людей и животных, включая предупреждение и лечение солидных и гематологических типов рака, аутоиммунных заболеваний, воспалительных заболеваний, IRI и сердечнососудистых заболеваний. Антитела по настоящему изобретению также применимы в качестве диагностических средств для определения уровня экспрессия CD47 в образцах ткани. Варианты осуществления настоящего изобретения включают выделенные антитела и их иммунологически активные связывающие фрагменты; фармацевтические композиции, содержащие одно или несколько моноклональных антител к CD47, предпочтительно химерные или гуманизированные формы указанных антител; способы применения таких моноклональных антител к CD47 в терапевтических целях и клеточные линии, которые продуцируют данные моноклональные антитела к CD47.
Варианты осуществления настоящего изобретения включают mAb или их антигенсвязывающие фрагменты, которые определяются со ссылкой на специфические структурные характеристики, т.е. определенные аминокислотные последовательности либо CDR, либо полных вариабельных доменов тяжелой цепи или легкой цепи. Все данные антитела связываются с CD47.
Моноклональные антитела или их антигенсвязывающие фрагменты могут содержать по меньшей мере одну, обычно по меньшей мере три, последовательности CDR, представленные в данном документе, обычно в комбинации с каркасными последовательностями из вариабельной области человека или в виде выделенного пептида CDR. В некоторых вариантах осуществления антитело содержит по меньшей мере одну легкую цепь, содержащую три последовательности CDR легкой цепи, представленные в данном документе, расположенные в каркасном участке вариабельной области, который может представлять собой без ограничения каркасный участок вариабельной области мыши или человека, и по меньшей мере одну тяжелую цепь, содержащую три последовательности CDR тяжелой цепи, представленные в данном документе, расположенные в каркасном участке вариабельной области, который может представлять собой без ограничения каркасный участок вариабельной области мыши или человека.
Предпочтительными вариантами осуществления являются mAb к CD47 или их антигенсвязывающие фрагменты, содержащие вариабельный домен тяжелой цепи, содержащий CDR1 вариабельного домена тяжелой цепи, CDR2 вариабельного домена тяжелой цепи и CDR3 вариабельного домена тяжелой цепи, где указанный CDR1 вариабельного домена тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3; указанный CDR2 вариабельного домена тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6; и указанный CDR3 вариабельного домена тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, и SEQ ID NO: 10.
Вариабельный домен тяжелой цепи может содержать любую из перечисленных последовательностей CDR1 вариабельного домена тяжелой цепи (HCDR1) в комбинации с любой из последовательностей CDR2 вариабельного домена тяжелой цепи (HCDR2) и любой из последовательностей CDR3 вариабельного домена тяжелой цепи (HCDR3). Однако особенно предпочтительными являются определенные варианты осуществления HCDR1, и HCDR2, и HCDR3, которые получены из одного общего Vn-домена, примеры которых описаны в данном документе.
Антитело или его антигенсвязывающий фрагмент могут дополнительно содержать вариабельный домен легкой цепи (VL), который образует пару с VH-доменом с образованием антигенсвязывающего домена. Предпочтительными вариабельными доменами легкой цепи являются домены, содержащие CDR1 вариабельного домена легкой цепи, CDR2 вариабельного домена легкой цепи и CDR3 вариабельного домена легкой цепи, где указанный CDR1 вариабельного домена легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14; указанный CDR2 вариабельного домена легкой цепи необязательно содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17; и указанный CDR3 вариабельного домена легкой цепи необязательно содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20.
Вариабельный домен легкой цепи может содержать любую из перечисленных последовательностей CDR1 вариабельного домена легкой цепи (LCDR1) в комбинации с любой из последовательностей CDR2 вариабельного домена легкой цепи (LCDR2) и любой из последовательностей CDR3 вариабельного домена легкой цепи (LCDR3). Однако особенно предпочтительными являются определенные варианты осуществления LCDR1, и LCDR2, и LCDR3, которые получены из одного общего VL-домена, примеры которых описаны в данном документе.
Любое рассматриваемое антитело к CD47 или его антигенсвязывающий фрагмент, содержащие VH-домен, образующий пару с VL-доменом, будут содержать комбинацию из 6 CDR: CDR1 вариабельного домена тяжелой цепи (HCDR1), CDR2 вариабельного домена тяжелой цепи (HCDR2), CDR3 вариабельного домена тяжелой цепи (HCDR3), CDR1 вариабельного домена легкой цепи (LCDR1), CDR2 вариабельного домена легкой цепи (LCDR2) и CDR1 вариабельного домена легкой цепи (LCDR1). Хотя все комбинации из 6 CDR, выбранные из групп последовательностей CDR, перечисленных выше, являются допустимыми и находятся в пределах объема настоящего изобретения, определенные комбинации из 6 CDR являются особенно предпочтительными.
Предпочтительные комбинации из 6 CDR включают без ограничения комбинации из CDR1 вариабельного домена тяжелой цепи (HCDR1), CDR2 вариабельного домена тяжелой цепи (HCDR2), CDR3 вариабельного домена тяжелой цепи (HCDR3), CDR1 вариабельного домена легкой цепи (LCDR1), CDR2 вариабельного домена легкой цепи (LCDR2) и CDR3 вариабельного домена легкой цепи (LCDR3), выбранные из группы, состоящей из:
(i) HCDR1, содержащего SEQ ID NO: 1, HCDR2, содержащего SEQ ID NO: 4, HCDR3, содержащего SEQ ID NO: 7, LCDR1, содержащего SEQ ID NO: 11, LCDR2, содержащего SEQ ID NO: 15, LCDR3, содержащего SEQ ID NO: 18;
(ii) HCDR1, содержащего SEQ ID NO: 1, HCDR2, содержащего SEQ ID NO: 4, HCDR3, содержащего SEQ ID NO: 8, LCDR1, содержащего SEQ ID NO: 11, LCDR2, содержащего SEQ ID NO: 15, LCDR3, содержащего SEQ ID NO: 18;
(iii) HCDR1, содержащего SEQ ID NO: 2, HCDR2, содержащего SEQ ID NO: 5, HCDR3, содержащего SEQ ID NO: 9, LCDR1, содержащего SEQ ID NO: 12, LCDR2, содержащего SEQ ID NO: 16, LCDR3, содержащего SEQ ID NO: 19;
(iv) HCDR1, содержащего SEQ ID NO: 2, HCDR2, содержащего SEQ ID NO: 5, HCDR3, содержащего SEQ ID NO: 9, LCDR1, содержащего SEQ ID NO: 13, LCDR2, содержащего SEQ ID NO: 16, LCDR3, содержащего SEQ ID NO: 19; и
(v) HCDR1, содержащего SEQ ID NO: 3, HCDR2, содержащего SEQ ID NO: 6, HCDR3, содержащего SEQ ID NO: 10, LCDR1, содержащего SEQ ID NO: 14, LCDR2, содержащего SEQ ID NO: 17, LCDR3, содержащего SEQ ID NO: 20.
Дополнительные предпочтительные антитела к CD47 включают антитела или их антигенсвязывающие фрагменты, содержащие вариабельный домен тяжелой цепи, имеющий аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей под SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, и SEQ ID NO: 40 и аминокислотных последовательностей, проявляющих по меньшей мере 90%, 95%, 97%, 98% или 99% идентичность последовательности с одной из изложенных последовательностей. В качестве альтернативы или дополнения предпочтительные антитела к CD47, включая антитела или их антигенсвязывающие фрагменты, могут содержать вариабельный домен легкой цепи, имеющий аминокислотную последовательность, выбранную из группы, состоящей из аминокислотных последовательностей под SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, и SEQ ID NO: 52 и аминокислотных последовательностей, проявляющих по меньшей мере 90%, 95%, 97%, 98% или 99% идентичность последовательности с одной из изложенных последовательностей.
Хотя все возможные варианты образования пар VH-доменов и VL-доменов, выбранных из групп последовательностей VH- и VL-доменов, перечисленных выше, являются допустимыми и находятся в пределах объема настоящего изобретения, определенные комбинации из VH- и VL-доменов являются особенно предпочтительными. Соответственно, предпочтительными антителами к CD47 или их антигенсвязывающими фрагментами являются таковые, которые содержат комбинацию из вариабельного домена тяжелой цепи (VH) и вариабельного домена легкой цепи (VL), где комбинация выбрана из группы, состоящей из:
(i) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 21, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 41;
(ii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 23, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 43;
(iii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 34, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 49;
(iv) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 36, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 52;
(v) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 38, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 52;
(vi) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 39, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 52;
(vii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 24, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 43;
(viii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 37, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 52;
(ix) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 33, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(x) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 26, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 44;
(xi) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 27, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 44; и
(xii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 38, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 51;
(xiii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 39, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 51;
(xiv) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 40, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 52;
(xv) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 36, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 51;
(xvi) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 29, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 47;
(xvii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 30, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 47;
(xviii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 31, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 47;
(xix) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 32, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 47;
(xx) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 33, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 47;
(xxi) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 29, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(xxii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 30, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(xxiii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 31, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(xxiv) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 32, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(xxv) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 26, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 43;
(xxvi) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 27, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 43;
(xxvii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 28, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 46;
(xxviii)вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 35, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 50;
(xxix) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 29, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(xxx) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 30, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(xxxi) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 31, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(xxxii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 32, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 48;
(xxxiv)вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 37, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 51; и
(xxxiv) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 40, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность под SEQ ID NO: 51.
Предпочтительные антитела к CD47 или их антигенсвязывающие фрагменты могут также содержать комбинацию из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи, где вариабельный домен тяжелой цепи содержит последовательность VH, которая характеризуется по меньшей мере 85% идентичностью последовательности, или по меньшей мере 90% идентичностью последовательности, или по меньшей мере 95% идентичностью последовательности, или по меньшей мере 97%, 98% или 99% идентичностью последовательности с аминокислотными последовательностями тяжелой цепи, показанными выше в (i)-(xxxiv), и/или вариабельный домен легкой цепи содержит последовательность VL, которая характеризуется по меньшей мере 85% идентичностью последовательности, или по меньшей мере 90% идентичностью последовательности, или по меньшей мере 95% идентичностью последовательности, или по меньшей мере 97%, 98% или 99% идентичностью последовательности с аминокислотными последовательностями легкой цепи, показанными выше в (i)-(xxxiv). Специфическое образование пар или комбинаций VH и VL в частях от (i) по (xxxiv) может сохраняться в антителах к CD47, имеющих последовательности VH- и VL-домена с конкретным процентным значением идентичности последовательности с этими эталонными последовательностями.
Для всех вариантов осуществления, где вариабельные домены тяжелой цепи и/или легкой цепи антител или антигенсвязывающих фрагментов определены с помощью конкретных процентных значений идентичности последовательности с эталонной последовательностью, VH- и/или VL-домены могут сохранять идентичные последовательности CDR с присутствующими в эталонной последовательности, так что отличие присутствует только в пределах каркасных областей.
В другом варианте осуществления предпочтительные антитела к CD47 или их антигенсвязывающие фрагменты представляют собой таковые, которые содержат комбинацию из тяжелой цепи (НС) и легкой цепи (LC), где комбинация выбрана из группы, состоящей из:
(i) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 76, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 66;
(ii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 77, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 68;
(iii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 78, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 69;
(iv) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 79, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 70;
(v) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 80, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 70;
(vi) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 81, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 70;
(vii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 82, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 68;
(viii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 83, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 70;
(ix) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 84, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 71;
(x) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 85, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 72;
(xi) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 86, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 72;
(xii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 80, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 73;
(xiii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 81, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 73;
(xiv) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 87, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 70;
(xv) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 79, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 73;
(xvi) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 88, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 74;
(xvii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 89, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 74;
(xviii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 90, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 74;
(xix) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 91, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 74;
(xx) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 84, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 74;
(xxi) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 92, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 71;
(xxii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 89, и легкой цепи, содержащей аминокислотную последовательность под SEQIDNO: 71;
(xxiii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 90, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 31;
(xxiv) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 91, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 71;
(xxv) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 85, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 68;
(xxvi) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 86, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 68;
(xxvii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 93, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 100;
(xxviii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 94, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 75;
(xxix) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 95, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 71;
(xxx) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 96, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 71;
(xxxi) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 97, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 71;
(xxxii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 98, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 71;
(xxxiii)тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 83, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 73;
(xxxiv)тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 87, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 73;
(xxxv) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 102, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 101;
(ххху1)тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 104, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 103;
где аминокислотная последовательность VH на по меньшей мере 90%, 95%, 97%, 98% или 99% идентична им, и аминокислотная последовательность VL на по меньшей мере 90%, 95%, 97%, 98% или 99% идентична им.
Предпочтительные варианты осуществления антител к CD47, описанных в данном документе, также характеризуются комбинациями свойств, которые не проявляли антитела к CD47 из известного уровня техники, предложенные для применения в терапевтических целях у человека. Соответственно, предпочтительные антитела к CD47, описанные в данном документе, характеризуются тем, что они:
a. связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека и
d. индуцируют гибель чувствительных опухолевых клеток человека.
В другом предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. индуцируют гибель чувствительных опухолевых клеток человека и
e. не вызывают агглютинацию эритроцитов человека (hRBC).
В еще одном предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. индуцируют гибель чувствительных опухолевых клеток человека и
e. вызывают сниженную агглютинацию эритроцитов человека (hRBC).
В другом предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. специфически связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. индуцируют гибель чувствительных опухолевых клеток человека и
e. характеризуются сниженным связыванием с hRBC.
В другом предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. не вызывают агглютинацию эритроцитов человека (hRBC) и
e. не связываются с hRBC.
В другом предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. специфически связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. не вызывают агглютинацию эритроцитов человека (hRBC) и
e. характеризуются сниженным связыванием с hRBC.
В другом предпочтительном варианте осуществления, описанном в данном документе, моноклональное антитело или его антигенсвязывающий фрагмент также специфически связываются с CD47 примата, отличного от человека, где примат, отличный от человека, может включать без ограничения яванского макака, зеленую мартышку, макака-резуса и саймири.
В еще одном предпочтительном варианте осуществления, описанном в данном документе, моноклональное антитело или его антигенсвязывающий фрагмент связываются с CD47 человека, примата, отличного от человека, мыши, кролика и крысы.
Различные формы раскрытых mAb к CD47 предусмотрены в данном документе. Например, mAb к CD47 могут представлять собой полноразмерные гуманизированные антитела с каркасными участками и константными областями изотипов IgA, IgD, IgE, IgG и IgM человека, более конкретно IgG1, IgG2, IgG3, IgG4, и в некоторых случаях с различными мутациями для изменения Fc-рецепторной функции или предотвращения обмена Fab-плечами, или фрагмент антитела, например, F(ab')2-фрагмент, F(ab)-фрагмент, одноцепочечный Fv-фрагмент (scFv) и т.д., раскрытые в данном документе.
В предпочтительных вариантах осуществления настоящего изобретению предусмотрены фармацевтические или ветеринарные композиции, содержащие одно или несколько mAb к CD47 или фрагментов, раскрытых в данном документе, необязательно химерные или гуманизированные формы, и фармацевтически приемлемый носитель, разбавитель или наполнитель.
До настоящего изобретения существовала потребность в идентификации mAb к CD47, которые характеризуются функциональными профилями, описанными в данном документе. mAb к CD47 по настоящему изобретению проявляют отличающиеся комбинации свойств, в частности комбинации свойств, которые делают mAb особенно преимущественными или подходящими для применения в терапии человека, в частности в предупреждении и/или лечении солидных и гематологических типов рака, ишемически-реперфузионного повреждения, аутоиммунных и/или воспалительных заболеваний.
Дополнительный объем применимости настоящего изобретения станет очевидным из подробного описания, представленного ниже. Однако следует понимать, что подробное описание и конкретные примеры, хотя и указывают на предпочтительные варианты осуществления настоящего изобретения, приведены лишь с целью иллюстрации, поскольку из данного подробного описания специалистам в данной области станут очевидны различные изменения и модификации в пределах сущности и объема настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Вышеописанные и другие аспекты, признаки и преимущества настоящего изобретения будут лучше понятны из приведенного далее подробного описания, рассматриваемого в сочетании с прилагаемым графическим материалом(-ами), все из которых приведены лишь с целью иллюстрации и не ограничивают настоящее изобретение.
ФИГ. 1А. Связывание гуманизированных mAb VLX4 с клетками OV10 человека, экспрессирующими CD47 человека. Связывание гуманизированных mAb VLX4 (VLX4hum_01 IgG1, VLX4hum_02 IgG1, VLX4hum_01 IgG4 РЕ и VLX4hum_02 IgG4 РЕ) с CD47 человека определяли с помощью ELISA с применением клеток из клеточной линии OV10, экспрессирующей CD47 человека (OV10 hCD47). Клетки OV10 hCD47 высевали в 96-луночные планшеты, и они достигали конфлюэнтности к моменту проведения анализа. Различные концентрации mAb добавляли к клеткам на 1 ч. Клетки промывали и затем инкубировали с меченным HRP вторичным антителом в течение 1 ч., после чего добавляли субстрат для пероксидазы.
ФИГ. 1В. Связывание гуманизированных mAb VLX4 с клетками OV10 человека, экспрессирующими CD47 человека. Связывание гуманизированных mAb VLX4 (VLX4hum_06 IgG4 РЕ, VLX4hum_07 IgG4 РЕ, VLX4hum_12 IgG4 РЕ, и VLX4hum_13 IgG4 РЕ) с CD47 человека определяли с помощью ELISA с применением клеток OV10 CD47. Клетки OV10 hCD47 высевали в 96-луночные планшеты, и они достигали конфлюэнтности к моменту проведения анализа. Различные концентрации репрезентативных mAb VLX4 добавляли к клеткам на 1 ч. Клетки промывали и затем инкубировали с меченным HRP вторичным антителом в течение 1 ч., после чего добавляли субстрат для пероксидазы.
ФИГ. 2А. Связывание гуманизированных mAb VLX4 с RBC человека (hRBC). Связывание гуманизированных mAb VLX4 (VLX4hum_01 IgG1, VLX4hum_02 IgG1, VLX4hum_01 IgG4 РЕ и VLX4hum_02 IgG4PE) с CD47 человека определяли с применением свежевыделенных hRBC. hRBC инкубировали в течение 60 минут при 37°С с различными концентрациями mAb VLX4, промывали и инкубировали в течение 1 ч. с меченным FITC антителом осла к антителу человека. Клетки промывали и связывание антитела измеряли с применением проточной цитометрии.
ФИГ. 2В. Связывание гуманизированных mAb VLX4 с RBC человека. Связывание гуманизированных mAb VLX4 (VLX4hum_07 IgG4 РЕ, VLX4hum_12 IgG4 РЕ, и VLX4hum_13 IgG4 РЕ) с CD47 человека определяли с применением свежевыделенных hRBC. hRBC инкубировали в течение 60 минут при 37°С с различными концентрациями mAb VLX4, промывали и инкубировали в течение 1 ч. с меченным FITC антителом осла к антителу человека. Клетки промывали и связывание антитела измеряли с применением проточной цитометрии.
ФИГ. 3А. Связывание гуманизированных mAb VLX8 с клетками OV10 hCD47 человека. Связывание химерных (xi) или гуманизированных mAb VLX8 IgG4PE (VLX8hum_01 IgG4PE, VLX8hum_04 IgG4 PE, VLX8hum_07 IgG4 РЕ, и VLX8hum_09 IgG4 РЕ) с CD47 человека определяли с помощью ELISA с применением клеток OV10 hCD47. Клетки OV10 hCD47 высевали в 96-луночные планшеты, и они достигали конфлюэнтности к моменту проведения анализа. Различные концентрации репрезентативных mAb VLX8 добавляли к клеткам на 1 ч. Клетки промывали и затем инкубировали с меченным HRP вторичным антителом в течение 1 ч., после чего добавляли субстрат для пероксидазы.
ФИГ. 3В. Связывание гуманизированных mAb VLX8 с клетками OV10 hCD47 человека. Связывание химерных или гуманизированных mAb VLX8 (VLX8hum_06 IgG2, VLX8hum_07 IgG2, VLX8hum_08 IgG2, и VLX8hum_09 IgG2) с CD47 человека определяли с помощью ELISA с применением клеток OV10 hCD47. Клетки OV10 hCD47 высевали в 96-луночные планшеты, и они достигали конфлюэнтности к моменту проведения анализа. Различные концентрации репрезентативных mAb VLX8 добавляли к клеткам на 1 ч. Клетки промывали и затем инкубировали с меченным HRP вторичным антителом в течение 1 ч., после чего добавляли субстрат для пероксидазы.
ФИГ. 4А. Связывание гуманизированных mAb VLX8 с RBC человека. Связывание xi или гуманизированных mAb VLX8 IgG4PE (VLX8hum_01 IgG4PE, VLX8hum_03 IgG4PE, VLX8hum_07 IgG4PE, и VLX8hum_10 IgG4PE) с CD47 человека определяли с применением свежевыделенных RBC человека. RBC инкубировали в течение 1 ч. при 37°С с различными концентрациями mAb VLX8, промывали и инкубировали в течение 1 ч. с меченным FITC антителом осла к антителу человека. Клетки промывали и связывание антитела измеряли с применением проточной цитометрии.
ФИГ. 4В. Связывание гуманизированных mAb VLX8 с RBC человека. Связывание xi или гуманизированных mAb VLX8 IgG4PE (VLX8hum_06 IgG2, VLX8hum_07 IgG2, VLX8hum_08 IgG2 и VLX8hum_09 IgG2) с CD47 человека определяли с применением свежевыделенных RBC человека. RBC инкубировали в течение 1 ч. при 37°С с различными концентрациями mAb VLX8, промывали и инкубировали в течение 1 ч. с меченным FITC антителом осла к антителу человека. Клетки промывали и связывание антитела измеряли с применением проточной цитометрии.
ФИГ. 5А. Связывание гуманизированных mAb VLX9 с клетками OV10 hCD47 человека. Связывание xi или гуманизированных mAb VLX9 IgG2 (VLX9hum_01 IgG2, VLX9hum_02 IgG2, VLX9hum_03 IgG2, VLX9hum_04 IgG2 и VLX9hum_05 IgG2) с CD47 человека определяли с помощью ELISA с применением клеток OV10 CD47 человека. Клетки OV10 hCD47 высевали в 96-луночные планшеты, и они достигали конфлюэнтности к моменту проведения анализа. Различные концентрации mAb добавляли к клеткам на 1 ч. Клетки промывали и затем инкубировали с меченным HRP вторичным антителом в течение 1 ч., после чего добавляли субстрат для пероксидазы.
ФИГ. 5В. Связывание гуманизированных mAb VLX9 с клетками OV10 hCD47 человека. Связывание xi или гуманизированных mAb VLX9 IgG2 (VLX9hum_06 IgG2, VLX9hum_07 IgG2, VLX9hum_08 IgG2, VLX9hum_09 IgG2 и VLX9hum_10 IgG2) с CD47 человека определяли с помощью ELISA с применением клеток OV10 hCD47. Клетки OV10 hCD47 высевали в 96-луночные планшеты, и они достигали конфлюэнтности к моменту проведения анализа. Различные концентрации mAb добавляли к клеткам на 1 ч. Клетки промывали и затем инкубировали с меченным HRP вторичным антителом в течение 1 ч., после чего добавляли субстрат для пероксидазы.
ФИГ. 6. Связывание гуманизированных mAb VLX9 с RBC человека. Связывание xi или гуманизированных mAb VLX9 IgG2 с CD47 человека определяли с применением свежевыделенных hRBC человека. RBC инкубировали в течение 60 минут при 37°С с различными концентрациями mAb VLX9, промывали и инкубировали в течение 1 ч. с меченным FITC антителом осла к антителу человека. Клетки промывали и связывание антитела измеряли с применением проточной цитометрии.
ФИГ. 7. Гуманизированные mAb VLX4, VLX8 и VLX9 блокирую связывание SIRPα с CD47 на клетках Jurkat. 1,5×106 клеток Jurkat инкубировали с 5 мкг/мл гуманизированных mAb к CD47, VLX4, VLX8 и VLX9 (VLX4hum_01 IgG4 РЕ, VLX4hum_07 IgG4 РЕ, VLX8hum_10 IgG4 РЕ, VLX4hum_11 IgG4 РЕ, VLX9hum_03 IgG2, VLX9hum_06 IgG2, и VLX9hum_08 IgG2), или контрольным антителом в RPMI, содержащей 10% среды, в течение 30 мин. при 37°С. Добавляли равный объем флуоресцентно меченного слитого белка SIRPα-Fc и инкубировали в течение дополнительных 30 мин. при 37°С. Клетки промывали и связывание оценивали с применением проточной цитометрии.
ФИГ. 8. Химерные mAb к CD47, VLX4, усиливают фагоцитоз Т-клеток Jurkat под действием макрофагов человека. Макрофаги человека высевали при концентрации 1×104 клеток на лунку в 96-луночный планшет и оставляли для прикрепления на 24 часа. 5×104 меченных CFSE (1 мкМ) Т-клеток человека Jurkat и 1 мкг/мл химерных mAb VLX4 добавляли к культурам макрофагов и инкубировали при 37°С в течение 2 часов. Не подвергнутые фагоцитозу клетки Jurkat удаляли и культуры макрофагов интенсивно промывали. Макрофаги обрабатывали трипсином и окрашивали в отношении CD14. Проточную цитометрию применяли для определения процентного содержания CD14+/CFSE+ клеток в общей популяции CD14+клеток.
ФИГ. 9А. Гуманизированные mAb VLX4 усиливают фагоцитоз Т-клеток Jurkat под действием макрофагов человека. Макрофаги человека высевали при концентрации 1×104 клеток на лунку в 96-луночный планшет и оставляли для прикрепления на 24 часа. 5×104 меченных CFSE (1 мкМ) Т-клеток человека Jurkat и 1 мкг/мл антитела добавляли к культурам макрофагов и инкубировали при 37°С в течение 2 часов. Не подвергнутые фагоцитозу клетки Jurkat удаляли и культуры макрофагов интенсивно промывали. Макрофаги обрабатывали трипсином и окрашивали в отношении CD14. Проточную цитометрию применяли для определения процентного содержания CD14+/CFSE+ клеток в общей популяции CD14+ клеток.
ФИГ. 9В. Гуманизированные mAb VLX4 усиливают фагоцитоз Т-клеток Jurkat под действием макрофагов человека. Макрофаги человека высевали при концентрации 1×104 клеток на лунку в 96-луночный планшет и оставляли для прикрепления на 24 часа. 5×104 меченных CFSE (1 мкМ) Т-клеток человека Jurkat и 1 мкг/мл антитела добавляли к культурам макрофагов и инкубировали при 37°С в течение 2 часов. Не подвергнутые фагоцитозу клетки Jurkat удаляли и культуры макрофагов интенсивно промывали. Макрофаги обрабатывали трипсином и окрашивали в отношении CD14. Проточную цитометрию применяли для определения процентного содержания CD14+/CFSE+ клеток в общей популяции CD14+ клеток.
ФИГ. 10А. Химерные mAb к CD47, VLX8, усиливают фагоцитоз Т-клеток Jurkat под действием макрофагов человека. Макрофаги человека высевали при концентрации 1×104 клеток на лунку в 96-луночный планшет и оставляли для прикрепления на 24 часа. 5×104 меченных CFSE (1 мкМ) Т-клеток человека Jurkat и 1 мкг/мл химерных mAb VLX8 добавляли к культурам макрофагов и инкубировали при 37°С в течение 2 часов. Не подвергнутые фагоцитозу клетки Jurkat удаляли и культуры макрофагов интенсивно промывали. Макрофаги обрабатывали трипсином и окрашивали в отношении CD14. Проточную цитометрию применяли для определения процентного содержания CD14+/CFSE+ клеток в общей популяции CD14+ клеток.
ФИГ. 10В. Гуманизированные mAb VLX8 усиливают фагоцитоз клеток Jurkat под действием макрофагов человека. Макрофаги человека высевали при концентрации 1×104 клеток на лунку в 96-луночный планшет и оставляли для прикрепления на 24 часа. 5×104 меченных CFSE (1 мкМ) Т-клеток человека Jurkat и 1 мкг/мл антитела добавляли к культурам макрофагов и инкубировали при 37°С в течение 2 часов. Не подвергнутые фагоцитозу клетки Jurkat удаляли и культуры макрофагов интенсивно промывали. Макрофаги обрабатывали трипсином и окрашивали в отношении CD14. Проточную цитометрию применяли для определения процентного содержания CD14+/CFSE+ клеток в общей популяции CD14+ клеток.
ФИГ. 11А. Химерные mAb к CD47, VLX9, усиливают фагоцитоз Т-клеток Jurkat под действием макрофагов человека. Макрофаги человека высевали при концентрации 1×104 клеток на лунку в 96-луночный планшет и оставляли для прикрепления на 24 часа. 5×104 меченных CFSE (1 мкМ) Т-клеток Jurkat человека и 1 мкг/мл химерных mAb VLX9 добавляли к культурам макрофагов и инкубировали при 37°С в течение двух часов. Не подвергнутые фагоцитозу клети Jurkat удаляли и культуры макрофагов интенсивно промывали. Макрофаги обрабатывали трипсином и окрашивали в отношении CD14. Проточную цитометрию применяли для определения процентного содержания CD14+/CFSE+ клеток в общей популяции CD14+ клеток.
ФИГ. 11В. Гуманизированные mAb VLX9 усиливают фагоцитоз Т-клеток Jurkat под действием макрофагов человека. Макрофаги человека высевали при концентрации 1×104 клеток на лунку в 96-луночный планшет и оставляли для прикрепления на 24 часа. 5×104 меченных CFSE (1 мкМ) Т-клеток Jurkat человека и 1 мкг/мл антитела добавляли к культурам макрофагов и инкубировали при 37°С в течение двух часов. Не подвергнутые фагоцитозу клети Jurkat удаляли и культуры макрофагов интенсивно промывали. Макрофаги обрабатывали трипсином и окрашивали в отношении CD14. Проточную цитометрию применяли для определения процентного содержания CD14+/CFSE+ клеток в общей популяции CD14+ клеток.
ФИГ. 12А. Индукция клеточной гибели Т-клеток человека Jurkat под действием растворимых гуманизированных mAb VLX4. Т-клетки Jurkat (1×104) инкубировали с 1 мкг/мл гуманизированных mAb VLX4 в 1 мл среды RPMI в течение 24 часов при 37°С. Затем клетки окрашивали аннексином V и сигнал обнаруживали с помощью проточной цитометрии.
ФИГ. 12В. Индукция клеточной гибели Т-клеток человека Jurkat под действием растворимых гуманизированных mAb VLX4. Т-клетки Jurkat (1×104) инкубировали с 1 мкг/мл гуманизированных mAb VLX4 в 1 мл среды RPMI в течение 24 часов при 37°С. Затем клетки окрашивали аннексином V и сигнал обнаруживали с помощью проточной цитометрии.
ФИГ. 13А. Индукция клеточной гибели клеток человека Jurkat под действием растворимых химерных mAb к CD47, VLX8. Т-клетки ALL Jurkat (1×104) инкубировали с 1 мкг/мл гуманизированных mAb VLX8 в 1 мл среды RPMI в течение 24 часов при 37°С. Затем клетки окрашивали аннексином V и сигнал обнаруживали с помощью проточной цитометрии.
ФИГ. 13В. Индукция клеточной гибели клеток человека Jurkat под действием растворимых гуманизированных mAb VLX8. Т-клетки ALL Jurkat (1×1(Г) инкубировали с 1 мкг/мл гуманизированных mAb VLX8 в 1 мл среды RPMI в течение 24 часов при 37°С. Затем клетки окрашивали аннексином V и сигнал обнаруживали с помощью проточной цитометрии.
ФИГ. 14А. Индукция клеточной гибели клеток человека Jurkat под действием растворимых химерных mAb мыши/человека VLX9. 1×104 клеток Jurkat инкубировали с 1 мкг/мл химерных mAb к CD47, VLX9, в 0,1 мл среды RPMI в течение 24 часов при 37°С. Затем клетки окрашивали аннексином V и сигнал анализировали с помощью проточной цитометрии.
ФИГ. 14В. Индукция клеточной гибели клеток человека Jurkat под действием растворимых гуманизированных mAb VLX9. Т-клетки ALL Jurkat (1×104) инкубировали с 1 мкг/мл гуманизированных mAb VLX9 в 1 мл среды RPMI в течение 24 часов при 37°С. Затем клетки окрашивали аннексином V и сигнал обнаруживали с помощью проточной цитометрии. VLX9 IgG2 (xi) представляет собой химерное антитело мыши/человека.
ФИГ. 15А. Агглютинация hRBC под действием гуманизированных mAb VLX4. Гемагглютинацию оценивали после инкубации hRBC с различными концентрациями гуманизированных mAb VLX4 (25 мкг/мл - 0,4 нг/мл). Кровь разбавляли (1:50) и промывали 3 раза с помощью PBS/EDTA/BSA. hRBC добавляли в 96-луночные планшеты с U-образным дном с равными объемами антител (75 мкл) и инкубировали в течение 3 часов при 37°С и в течение ночи при 4°С.
ФИГ. 15В. Агглютинация hRBC под действием химерных и гуманизированных mAb VLX8. Гемагглютинацию оценивали после инкубации hRBC с различными концентрациями гуманизированных mAb VLX4 (25 мкг/мл - 0,4 нг/мл). Кровь разбавляли (1:50) и промывали 3 раза с помощью PBS/EDTA/BSA. hRBC добавляли в 96-луночные планшеты с U-образным дном с равными объемами антител (75 мкл) и инкубировали в течение 3 часов при 37°С и в течение ночи при 4°С.
ФИГ. 16. Агглютинация RBC человека под действием гуманизированных mAb VLX9. Гемагглютинацию оценивали после инкубации RBC человека с различными концентрациями химерных (xi) VLX9 IgG2 и гуманизированных mAb VLX9. Кровь разбавляли (1:50) и промывали 3 раза с помощью PBS/EDTA/BSA. RBC добавляли в 96-луночные планшеты с U-образным дном с равными объемами антител (75 мкл) и инкубировали в течение 3 часов при 37°С и в течение ночи при 4°С.
ФИГ. 17. Гуманизированное mAb VLX4 снижает опухолевый рост в модели с ксенотрансплантатом Raji. Самкам мышей NSG инокулировали подкожно в правый бок 0,1 мл смеси из 30% RPMI/70% Matrigel™ (BD Biosciences; Бедфорд, Массачусетс), содержащей суспензию из 5×106 опухолевых клеток Raji. Через пять дней после инокуляции измеряли объемы опухолей и мышей с пальпируемыми опухолями объемом 31-74 мм3 распределяли случайным образом по 8-10/группа. В это время начинали введение VLX4hum_07 или PBS (контроль). Мышей обрабатывали с помощью 5 мг/кг антитела 5Х/неделя в течение 4 недель путем осуществления внутрибрюшинных инъекций. Значения объема опухоли и веса тела регистрировали два раза в неделю.
ФИГ. 18. Гуманизированное mAb VLX8 снижает опухолевый рост в модели с ксенотрансплантатом Raji. Самкам мышей NSG инокулировали подкожно в правый бок 0,1 мл смеси из 30% RPMI/70% Matrigel™ (BD Biosciences; Бедфорд, Массачусетс), содержащей суспензию из 5×10б опухолевых клеток Raji. Через пять дней после инокуляции измеряли объемы опухолей и мышей с пальпируемыми опухолями объемом 31-74 мм3 распределяли случайным образом по 8-10/группа. В это время начинали введение VLX8hum_10 или PBS (контроль). Мышей обрабатывали с помощью 5 мг/кг антитела 5Х/неделя в течение 4 недель путем осуществления внутрибрюшинных инъекций. Значения объема опухоли и веса тела регистрировали два раза в неделю.
ФИГ. 19. Гуманизированное mAb VLX9 снижает опухолевый рост в модели с ксенотрансплантатом Raji. Самкам мышей NSG инокулировали подкожно в правый бок 0,1 мл смеси из 30% RPMI/70% Matrigel™ (BD Biosciences; Бедфорд, Массачусетс), содержащей суспензию из 5×106 опухолевых клеток Raji. Через пять дней после инокуляции измеряли объемы опухолей и мышей с пальпируемыми опухолями объемом 31-74 мм3 распределяли случайным образом по 8-1 О/группа. В это время начинали введение VLX9hum_08 IgG2 или PBS (контроль). Мышей обрабатывали с помощью 5 мг/кг антитела 5Х/неделя в течение 4 недель путем осуществления внутрибрюшинных инъекций. Значения объема опухоли и веса тела регистрировали два раза в неделю.
ФИГ. 20А. Уровни гемоглобина в крови после введения гуманизированного mAb VLX9 яванским макакам с помощью внутривенной инфузии. VLX9hum_08 IgG2 или среду-носитель вводили в виде одночасовой внутривенной инфузии с дозой 5 мг/кг в день 1 и дозой 15 мг/кг в день 18. Уровни гемоглобина отслеживали на протяжении всего исследования и нормализовали относительно значений, полученных для контроля.
ФИГ. 20В. Уровни RBC в крови после введения гуманизированных mAb VLX9 яванским макакам с помощью внутривенной инфузии. VLX9hum_08 IgG2 или среду-носитель вводили в виде одночасовой внутривенной инфузии с дозой 5 мг/кг в день 1 и дозой 15 мг/кг в день 18. Уровни RBC отслеживали на протяжении всего исследования и нормализовали относительно значений, полученных для контроля.
ФИГ. 21. Иммуногистохимическое окрашивание CD47 в опухолевой ткани человека с помощью химерного mAb мыши/кролика. Локализацию CD47 в ткани рака молочной железы человека определяли с применением химерного mAb мыши/кролика VLX4. Залитую в парафин ткань нарезали, окрашивали с помощью 4 мкг/мл очищенного антитела и локализацию определяли с помощью меченного HRP вторичного антитела к антителу кролика. Стрелки обозначают области с положительным результатом окрашивания CD47.
ФИГ. 22. Краткий обзор свойств антител к CD47.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Определения
Если не определено иное, научно-технические термины, используемые в связи с настоящим изобретением, будут иметь значения, которые обычно понимают средние специалисты в данной области техники. Кроме того, если контекст не требует иного, термины в единственном числе будут включать формы множественного числа, и термины во множественном числе будут включать форму единственного числа. В целом описанные в данном документе методики клеточной и тканевой культуры, молекулярной биологии и химического взаимодействия и гибридизации белков и олигонуклеотидов или полинуклеотидов, а также условные обозначения, используемые в связи ними, являются такими, которые хорошо известны и обычно используются в данной области техники.
Используемые в данном документе термины "CD47", "ассоциированный с интегринами белок (IAP)", "антиген рака яичников ОА3", "Rh-связанный антиген" и "MERG" являются синонимичными и могут использоваться взаимозаменяемо.
Термин "антитело к CD47" относится к антителу по настоящему изобретению, которое предназначено для применения в качестве терапевтического или диагностического средства и, следовательно, оно обычно будет характеризоваться аффинностью связывания, необходимой для применения в качестве терапевтического и/или диагностического средства.
Используемый в данном документе термин "антитело" относится к молекулам иммуноглобулина и иммунологически активным частям молекул иммуноглобулина (Ig), т.е. к молекулам, содержащим антигенсвязывающий участок, который специфически связывает антиген (вступает в иммунологическую реакцию с ним). Под "специфически связывает" или "вступает в иммунологическую реакцию" с или по отношению к подразумевается, что антитело реагирует с одной или несколькими антигенными детерминантами требуемого антигена и не реагирует с другими полипептидами или связывается с намного меньшей аффинностью (Kd>10-6). Антитела включают без ограничения поликлональные, моноклональные, химерные, Fab-фрагменты, Fab'-фрагменты, Р(ab')2-фрагменты, одноцепочечные Fv-фрагменты и одноплечевые антитела.
Используемый в данном документе термин "моноклональное антитело" (mAb) применительно к соединениям-антителам по настоящему изобретению относится к антителу, которое происходит от одной копии или клона, включая, например, любой эукариотический, прокариотический или фаговый клон, а не способу, с помощью которого его получают.mAb по настоящему изобретению предпочтительно существуют в гомогенной или практически гомогенной популяции. Полные mAb содержат 2 тяжелые цепи и 2 легкие цепи.
"Фрагмент антитела" относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающую антиген, с которым связывается интактное антитело. Примеры фрагментов антитела включают без ограничения Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv) и полиспецифические антитела, образованные из фрагментов антител.
Как раскрыто в данном документе, "соединения-антитела" относятся к mAb и их антигенсвязывающим фрагментам. Дополнительные соединения-антитела, проявляющие подобные функциональные свойства в соответствии с настоящим изобретением, можно получить с помощью традиционных способов. Например, мышей можно иммунизировать CD47 человека или его фрагментами, полученные в результате антитела можно выделить и очистить, и определение того, характеризуются ли они связывающими и функциональными свойствами, подобными или аналогичными таковым у раскрытых в данном документе соединений-антител, можно оценивать с помощью способов, раскрытых в примерах 3-11 ниже. Антигенсвязывающие фрагменты также можно получать с помощью традиционных способов. Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны из уровня техники, и их можно найти, например, в Harlow and Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, главы 5-8 и 15.
Моноклональные антитела охватывают антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах мыши, в частности CDR мыши, тогда как остальная часть цепи(-ей) идентична или гомологична соответствующим последовательностям в антителах человека. Другие варианты осуществления настоящего изобретения включают антигенсвязывающие фрагменты этих моноклональных антител, которые проявляют связывающие и биологические свойства, подобные или идентичные моноклональным антителам. Антитела по настоящему изобретению могут содержать константные области каппа- или лямбда-легкой цепи и константные области тяжелой цепи IgA, IgD, IgE, IgG или IgM, включая константные области из таких подклассов IgG, как IgG1, IgG2, IgG3 и IgG4, и в некоторых случаях с различными мутациями для изменения Fc-рецепторной функции.
Моноклональные антитела, содержащие раскрытые в настоящем изобретении CDR мыши, можно получать любым из различных способов, известных специалистам в данной области техники, включая способы рекомбинантной ДНК.
Обзоры современных способов конструирования и улучшения антител можно найти, например, в P. Chames, Ed., (2012) Antibody Engineering: Methods and Protocols, Second Edition (Methods in Molecular Biology, Book 907), Humana Press, ISBN-10: 1617799734; C. R. Wood, Ed., (2011) Antibody Drug Discovery (Molecular Medicine and Medicinal Chemistry, Book 4), Imperial College Press; R. Kontermann and S. Dubel, Eds., (2010) Antibody Engineering Volumes 1 and 2 (Springer Protocols), Second Edition; и W. Strohl and L. Strohl (2012) Therapeutic antibody engineering: Current and future advances driving the strongest growth area in the pharmaceutical industry, Woodhead Publishing.
Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны из уровня техники, и их можно найти, например, в Harlow and Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, главы 5-8 и 15.
Полноразмерное антитело, как оно существует в природе, представляет собой молекулу иммуноглобулина (Ig) "Y''-образной формы, содержащую четыре полипептидные цепи: две идентичные тяжелые (Н) цепи и две идентичные легкие (L) цепи, связанные между собой дисульфидными связями. Амино-концевая часть каждой цепи, называемая фрагментом с антигенсвязывающей областью (FAB), включает вариабельную область из приблизительно 100-110 или более аминокислот, которая в основном ответственна за распознавание антигена благодаря содержащимся в ней определяющих комплементарность областей (CDR). Карбокси-концевая часть каждой цепи определяет константную область ("Fc''-область), которая в основном ответственна за эффекторную функцию.
CDR чередуются с областями, которые являются более консервативными и называются каркасными участками ("FR"). Аминокислотные последовательности многих FR хорошо известны из уровня техники. Каждая вариабельная область легкой цепи (LCVR) и вариабельная область тяжелой цепи (HCVR) состоит из 3 CDR и 4 FR, расположенных от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. 3 CDR легкой цепи называют "LCDR1, LCDR2 и LCDR3", а 3 CDR тяжелой цепи называют "HCDR1, HCDR2 и HCDR3". CDR содержат большинство остатков, которые формируют специфические взаимосвязи с антигеном. Нумерация и положение аминокислотных остатков CDR в областях LCVR и HCVR соответствует общеизвестной системе нумерации Kabat, Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition. Публикация NIH №91-3242.
Как описано в данном документе, "антигенсвязывающий участок" может также быть определен как "гипервариабельные области", "HVR" или "HV" и относится к структурно гипервариабельным областям вариабельных доменов антитела, как определено Chothia и Lesk (Chothia and Lesk, Mol. Biol. 196:901-917, 1987). Существует шесть HVR, три в VH (H1, H2, Н3) и три в VL (L1, L2, L3). В данном документе авторы настоящего изобретения использовали CDR, как определено Kabat, за исключением Н-CDR1, который продлен с включением H1.
Существует пять типов тяжелых цепей иммуноглобулина (Ig) млекопитающих, обозначаемых греческими буквами α (альфа), δ (дельта), ε (эпсилон), γ (гамма) и μ (мю), которые определяют класс или изотип антитела как IgA, IgD, IgE, IgG или IgM соответственно. IgG-антитела можно дополнительно разделить на подклассы, например, IgG1, IgG2, IgG3 и IgG4.
Каждый тип тяжелой цепи характеризуется конкретной константной областью с последовательностью, известной из уровня техники. Константная область идентична во всех антителах одного и того же изотипа, но отличается в антителах разных изотипов. Тяжелые цепи γ, α и δ имеют константную область, состоящую из трех тандемных доменов иммуноглобулина (Ig), и шарнирную область для дополнительной гибкости. Тяжелые цепи μ и ε имеют константную область, состоящую из четырех доменов Ig.
Шарнирная область представляет собой гибкий отрезок из аминокислот, который связывает Fc- и Fab-части антитела. Эти области содержат цистеиновые остатки, которые могут образовывать дисульфидные связи, соединяющие две тяжелые цепи вместе.
Вариабельная область тяжелой цепи отличается в антителах, продуцируемых разными В-клетками, но является одинаковой для всех антител, продуцируемых единичной В-клеткой или клоном В-клетки. Вариабельная область каждой тяжелой цепи имеет длину примерно 110 аминокислот и состоит из одного домена Ig.
У млекопитающих легкие цепи классифицируют на каппа (κ) или лямбда (λ), и они характеризуются конкретной константной областью, известной из уровня техники. Легкая цепь имеет два последовательных домена: один вариабельный домен на амино-конце и один константный домен на карбокси-конце. Каждое антитело содержит две легкие цепи, которые всегда идентичны; при этом только один тип легкой цепи, κ или λ, присутствует в антителе у млекопитающих.
Fc-область, состоящая из двух тяжелых цепей, которые предоставляют три или четыре константных домена в зависимости от класса антитела, играет роль в модулировании активности иммунных клеток. Связываясь со специфическими белками, Fc-область гарантирует, что каждое антитело обеспечит соответствующий иммунный ответ на данный антиген. Fc-область также связывается с различными клеточными рецепторами, такими как Fc-рецепторы, и другими иммунными молекулами, такими как белки системы комплемента. Таким образом она опосредует различные физиологические эффекты, включая опсонизацию, клеточный лизис и дегрануляцию тучных клеток, базофилов и эозинофилов.
Используемый в данном документе термин "эпитоп" относится к конкретной группе аминокислот, расположенных на пептиде или белке, с которой связывается антитело или фрагмент антитела. Эпитопы зачастую состоят из группы поверхностно химически активных молекул, таких как аминокислоты или боковые цепи Сахаров, и имеют специфические характеристики трехмерной структуры, а также специфические характеристики заряда. Эпитопы могут быть линейными, т.е. участвующими в связывании с одной последовательностью аминокислот, или конформационными, т.е. участвующими в связывании с двумя или более последовательностями аминокислот в разных областях антигена, которые не обязательно могут являться смежными в линейной последовательности.
Используемые в данном документе термины "специфически связывается", "связывает специфически", "специфическое связывание" и т.п. применительно к соединениям-антителам по настоящему изобретению относятся к способности специфического связывающего средства (такого как антитело) связываться с целевыми молекулярными частицами вместо связывания с другими молекулярными частицами, с которыми смешаны специфическое связывающее средство и целевые молекулярные частицы. Считается, что специфическое связывающее средство специфически узнает целевые молекулярные частицы, если оно может специфически связываться с такой мишенью.
Используемый в данном документе термин "аффинность связывания" относится к силе связывания одной молекулы с другой в определенном участке молекулы. Если конкретная молекула будет связываться или специфически взаимодействовать с другой конкретной молекулой, то считается, что эти две молекулы проявляют аффинность связывания в отношении друг друга. Аффинность связывания относится к константе ассоциации и константе диссоциации для пары молекул, но для изложенных в данном документе способов измерение или определение данных констант не является крайне необходимым. Скорее, показатели аффинности, используемые в данном документе для описания взаимодействий между молекулами в описанных способах, как правило, представляют собой показатели кажущейся аффинности (если не указано иное), наблюдаемые в эмпирических исследованиях, которые можно применять для сравнения относительной силы, с которой одна молекула (например, антитело или другой партнер по специфическому связыванию) будет связывать две другие молекулы (например, две версии или варианта пептида). Понятия аффинности связывания, константы ассоциации и константы диссоциации хорошо известны.
Используемый в данном документе термин "идентичность последовательности" означает процентное содержание идентичных нуклеотидных или аминокислотных остатков в соответствующих положениях в двух или более последовательностях при выравнивании последовательностей с максимальным увеличением совпадения последовательностей, т.е. с учетом гэпов и вставок. Идентичность можно легко рассчитать с помощью известных способов, в том числе без ограничения описанных в Computational Molecular Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A. M, and Griffin, H. G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; и Carillo, H., and Lipman, D., SIAMJ. Applied Math., 48: 1073 (1988). Способы определения идентичности разработаны для получения наибольшего совпадения между тестируемыми последовательностями. Более того, способы определения идентичности кодифицированы в общедоступных компьютерных программах.
Оптимальное выравнивание последовательностей для сравнения можно осуществлять, например, с помощью алгоритма поиска локальной гомологии Smith и Waterman, с помощью алгоритмов выравнивания по гомологии, с помощью способа поиска сходства, или с помощью компьютерных реализаций данных алгоритмов (GAP, BESTFIT, PASTA и TFASTA в пакете программ GCG Wisconsin, доступном от Accelrys, Inc., Сан-Диего, Калифорния, Соединенные Штаты Америки), или с помощью визуального изучения. В целом, см. Altschul, S. F. et al., J. Mol. Biol. 215: 403-410 (1990) и Altschul et al. М/с/. Acids Res. 25: 3389-3402 (1997).
Одним примером алгоритма, который подходит для определения процентного значения идентичности последовательностей и сходства последовательностей, является алгоритм BLAST, который описан в (Altschul, S., et al., NCBI NLM NIH Bethesda, Md. 20894; и Altschul, S., et al., J. Mol. Biol. 215: 403-410 (1990). Программное обеспечение для выполнения анализов BLAST является общедоступным через Национальный центр биотехнологической информации. Данный алгоритм включает сначала идентификацию пар последовательностей с наибольшим баллом (HSP) путем идентификации коротких "слов" с длиной W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют некоторому положительному пороговому значению Т при выравнивании со "словом" той же длины в последовательности из базы данных. Т называют пороговым значением соседнего "слова".
Эти изначальные хиты соседних "слов" выступают в качестве начальных значений для инициации поисков с целью нахождения более длинных HSP, которые их содержат. Хиты "слов" затем удлиняют в обоих направлениях вдоль каждой последовательности до тех пор, пока может возрастать суммарный балл выравнивания.
В случае нуклеотидных последовательностей суммарные баллы рассчитывают с помощью параметров М (прибавляемого балла для пары совпадающих остатков; всегда; 0) и N (штрафного балла для несовпадающих остатков; всегда; 0). В случае аминокислотных последовательностей для расчета суммарного балла применяют матрицу замен. Удлинения хитов "слов" в каждом направлении прекращают, когда: суммарный балл выравнивания уменьшается на величину X от его максимального достигнутого значения, суммарный балл равняется нулю или меньше из-за накопления одного или нескольких выравниваний отрицательно оцениваемых остатков, или заканчивается любая последовательность. Параметры W, Т и X алгоритма BLAST определяют чувствительность и скорость выравнивания. В программе BLASTN (для нуклеотидных последовательностей) по умолчанию используется длина "слова" (W), равная 11, ожидаемое значение (Е), равное 10, отсечение, равное 100, М=5, N=-4, и сравнение обеих цепей. Для аминокислотных последовательностей в программе BLASTP по умолчанию используется длина "слова" (W), равная 3, ожидаемое значение (Е), равное 10, и матрица замен BLOSUM62.
Помимо расчета процентного значения идентичности последовательностей алгоритм BLAST также выполняет статистический анализ сходства между двумя последовательностями. Одной мерой сходства, обеспечиваемой алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), которая служит указанием вероятности, с которой может иметь место случайное совпадение между двумя нуклеотидными или аминокислотными последовательностями. Например, тестируемую последовательность нуклеиновой кислоты считают схожей с эталонной последовательностью, если наименьшая суммарная вероятность при сравнении тестируемой последовательности нуклеиновой кислоты с эталонной последовательностью нуклеиновой кислоты в одном варианте осуществления составляет менее приблизительно 0,1, в другом варианте осуществления менее приблизительно 0,01 и в еще одном варианте осуществления менее приблизительно 0,001.
Используемые в данном документе термины "гуманизированное", "гуманизация" и т.п. относятся к прививанию CDR моноклонального антитела мыши, раскрытых в данном документе, на FR и константные области человека. Также этими терминами охватываются возможные дополнительные модификации CDR мыши и FR человека с помощью способов, раскрытых, например, в Kashmiri et al. (2005) Methods 36(1):25-34 и Hou et al. (2008) J. Biochem. 144(1):115-120 соответственно, для улучшения различных свойств антитела, как обсуждается ниже.
Используемый в данном документе термин "гуманизированные антитела" относится к mAb и их антигенсвязывающим фрагментам, включая раскрытые в данном документе соединения-антитела, которые имеют связывающие и функциональные свойства в соответствии с настоящим изобретением, аналогичные раскрытым в данном документе, и которые имеют FR и константные области, которые являются практически человеческими или полностью человеческими, окружающие CDR, полученные из антитела, отличного от человеческого.
Используемый в данном документе термин "FR" или "каркасная последовательность" относится к любому из FR 1-4. Гуманизированные антитела и антигенсвязывающие фрагменты, охватываемые настоящим изобретением, включают молекулы, где любой один или несколько из FR 1-4 являются практически или полностью человеческими, т.е. где присутствует любая из возможных комбинаций отдельных практически или полностью человеческих FR 1-4. Например, это включает молекулы, в которых FR1 и FR2, FR1 и FR3, FR1, FR2 и FR3 и т.д., являются практически или полностью человеческими. Практически человеческие каркасные участки являются участками, последовательность которых по меньшей мере на 80% идентична известной каркасной последовательности зародышевой линии человека. Предпочтительно, практически человеческие каркасные участки характеризуются по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с каркасной последовательностью, раскрытой в данном документе, или с известной каркасной последовательностью зародышевой линии человека.
Полностью человеческие каркасные участки являются участками, которые идентичны известной каркасной последовательности зародышевой линии человека. Последовательности FR зародышевой линии человека можно получить из международной базы данных ImMunoGeneTics (IMGT) и из The Immunoglobulin FactsBook by Marie-Paule Lefranc and Gerard Lefranc, Academic Press, 2001, содержание которых включено в данный документ посредством ссылки во всей их полноте.
The Immunoglobulin Facts Book представляет собой каталог генов иммуноглобулина зародышевой линии человека, которые используются для создания спектра антител человека, и включает записи для 203 генов и 459 аллелей с отображением в общей сложности 837 последовательностей. Отдельные записи включают все гены константной области иммуноглобулина человека и гены зародышевой линии, отвечающие за вариабельность, разнообразие и соединение, которые имеют по меньшей мере один функциональный аллель или аллель с открытой рамкой считывания и которые локализованы в трех основных локусах. Например, FR легкой цепи зародышевой линии можно выбрать из группы, состоящей из: IGKV3D-20, IGKV2-30, IGKV2-29, IGKV2-28, IGKV1-27, IGKV3-20, IGKV1-17, IGKV1-16, 1-6, IGKV1-5, IGKV1-12, IGKV1D-16, IGKV2D-28, IGKV2D-29, IGKV3-11, IGKV1-9, IGKV1-39, IGKV1D-39 и IGKV1D-33 и IGKJ1-5, и FR тяжелой цепи зародышевой линии можно выбрать из группы, состоящей из: IGHV1-2, IGHV1-18, IGHV1-46, IGHV1-69, IGHV2-5, IGHV2-26, IGHV2-70, IGHV1-3, IGHV1-8, IGHV3-9, IGHV3-11, IGHV3- 15, IGHV3-20, IGHV3-66, IGHV3-72, IGHV3-74, IGHV4-31, IGHV3-21, IGHV3-23, IGHV3-30, IGHV3-48, IGHV4-39, IGHV4-59 и IGHV5-51 и IGHJ1-6.
Практически человеческие FR являются участками, последовательность которых по меньшей мере на 80% идентична известной последовательности FR зародышевой линии человека. Предпочтительно, практически человеческие каркасные участки характеризуются по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с каркасными последовательностями, раскрытыми в данном документе, или с известной каркасной последовательностью зародышевой линии человека.
CDR, охватываемые настоящим изобретением, включают не только CDR, которые конкретно раскрыты в данном документе, но также и последовательности CDR, имеющие такую идентичность последовательности, как по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с последовательностью CDR, раскрытой в данном документе. В качестве альтернативы CDR, охватываемые настоящим изобретением, включают не только CDR, которые конкретно раскрыты в данном документе, но также и последовательности CDR, имеющие 1, 2, 3, 4 или 5 аминокислотных замен в соответствующих положениях в сравнении с последовательностями CDR, раскрытыми в данном документе. Такая последовательность, идентичная или имеющая аминокислотную модификацию относительно CDR, предпочтительно связывается с антигеном, узнаваемым интактным антителом.
Гуманизированные антитела в дополнение к раскрытым в данном документе, проявляющие подобные функциональные свойства в соответствии с настоящим изобретением, можно получить с помощью нескольких разных способов Almagro et al. Frontiers in Biosciences. Humanization of antibodies. (2008) Jan 1; 13:1619-33.
В соответствии с одним подходом CDR исходного соединения-антитела прививают к каркасному участку человека, который характеризуется высокой идентичностью последовательности с каркасным участком исходного соединения-антитела. Идентичность последовательности нового каркасного участка, как правило, будет составлять по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с последовательностью соответствующего каркасного участка в исходном соединении-антителе. В случае каркасных участков, имеющих менее 100 аминокислотных остатков, можно изменить один, два, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислотных остатков. Осуществление такой прививки может привести к снижению аффинности связывания по сравнению с аффинностью связывания исходного антитела. В таком случае каркасный участок можно подвергать возвратному мутагенезу до исходного каркасного участка в определенных положениях с учетом конкретных критериев, раскрытых в Queen et al. (1991) Proc. Natl. Acad. Sci. USA 88:2869. Дополнительные ссылки, описывающие способы, применимые для получения гуманизированных вариантов на основе гомологии и возвратных мутаций, включают описанные в Olimpieri et al. Bioinformatics. 2015 Feb l;31(3):434-435 и патентах США №№4816397, 5225539 и 5693761; и способ Winter и соавторов (Jones et al. (1986) Nature 321:522-525; Riechmann et al. (1988) Nature 332:323-327; и Verhoeyen et al. (1988) Science 239:1534-1536).
Гуманизацию начинают с химеризации, способа, разработанного в первой половине 1980-х годов (Morrison, S.L., М.J. Johnson, L.A. Herzenberg & V.Т. Oi: Chimeric human antibody molecules: mouse antigen-binding domains with human constant region domains. Proc. Natl. Acad. Sci. USA., 81, 6851-5 (1984)), который заключается в объединении вариабельных (V) доменов антител мыши с константными (С) доменами человека с получением молекул, состав которых на ~70% соответствует молекулам человека.
Для получения гуманизированных антител можно применять несколько различных способов, которые описаны в данном документе. В соответствии с одним подходом CDR исходного соединения-антитела прививают к FR человека, который характеризуется высокой идентичностью последовательности с каркасным участком исходного соединения-антитела. Идентичность последовательности нового FR, как правило, будет составлять по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичность последовательности с последовательностью соответствующего FR в исходном соединении-антителе. В случае FR, имеющих менее 100 аминокислотных остатков, можно изменить один, два, три, четыре, пять или более аминокислотных остатков. Осуществление такой прививки может привести к снижению аффинности связывания по сравнению с аффинностью связывания исходного антитела. В таком случае FR можно подвергать возвратному мутагенезу до исходного каркасного участка в определенных положениях с учетом конкретных критериев, раскрытых в Queen et al. (1991) Proc. Natl. Acad. Sci. USA 88:2869. Дополнительные ссылки, описывающие способы, применимые для получения гуманизированных вариантов на основе гомологии и возвратных мутаций, включают описанные в Olimpieri et al. Bioinformatics. 2015 Feb 1; 31(3):434-435 и патентах США №№4816397, 5225539 и 5693761; и способ Winter и соавторов (Jones et al. (1986) Nature 321: 522-525; Riechmann et al. (1988) Nature 332: 323-327; и Verhoeyen et al. (1988) Science 239: 1534-1536).
Идентификацию остатков, которые следует учитывать для возвратной мутации, можно осуществлять, как описано ниже. Если аминокислота попадает в следующую категорию, то каркасную аминокислоту используемой последовательности зародышевой линии человека ("акцепторную FR") заменяют на каркасную аминокислоту из каркасного участка исходного соединения-антитела ("донорскую FR"):
(a) аминокислота в акцепторном каркасном участке FR человека является несвойственной для каркасных участков человека в этом положении, тогда как соответствующая аминокислота в донорном иммуноглобулине является типичной для каркасных участков человека в этом положении;
(b) положение аминокислоты непосредственно примыкает к одному из CDR;
или
(c) любой атом боковой цепи каркасной аминокислоты находится в пределах приблизительно 5-6 ангстрем (от центра к центру) от любого атома аминокислоты CDR в трехмерной модели иммуноглобулина.
Если каждая из аминокислот в акцепторном каркасном участке FR человека и соответствующая аминокислота в донорском каркасном участке являются, как правило, несвойственными для каркасных участков человека в таком положении, то такую аминокислоту можно заменить аминокислотой, типичной для каркасных участков человека в таком положении. Такой критерий возвратной мутации позволяет восстановить активность исходного соединения-антитела.
Другой подход к получению гуманизированных антител, проявляющих функциональные свойства, подобные соединениям-антителам, раскрытым в данном документе, предусматривает случайный мутагенез аминокислот в привитых CDR без изменения каркасного участка и скрининг полученных молекул в отношении аффинности связывания и других функциональных свойств, которые являются практически такими же или лучше таковых у исходных соединений-антител. Также в каждое положение аминокислоты в каждом CDR можно ввести единичные мутации с последующей оценкой эффектов таких мутаций в отношении аффинности связывания и других функциональных свойств. Единичные мутации, обеспечивающие улучшенные свойства, можно комбинировать для оценки их эффектов в комбинации друг с другом.
Кроме того, возможна комбинация обоих вышеуказанных подходов. После прививки CDR конкретные FR можно подвергать возвратному мутагенезу в дополнение к введению аминокислотных замен в CDR. Данная методика описана в Wu etal. (1999) J. Mol. Biol. 294: 151-162.
Применяя идеи настоящего изобретения, специалист в данной области техники может использовать общепринятые методики, например, сайт-направленный мутагенез, для замены аминокислот в последовательностях CDR и FR, раскрытых в данном документе, и, таким образом, получать дополнительные аминокислотные последовательности вариабельной области, полученные из последовательностей по настоящему изобретению. Практически все встречающиеся в природе аминокислоты можно вводить в конкретный участок замены. Способы, раскрытые в данном документе, можно затем применять для скрининга этих дополнительных аминокислотных последовательностей вариабельной области с целью идентификации последовательностей, имеющих указанные функции in vivo. Таким образом можно идентифицировать дополнительные последовательности, подходящие для получения гуманизированных антител и их антигенсвязывающих частей в соответствии с настоящим изобретением. Предпочтительно, аминокислотная замена в каркасных участках ограничивается одним, двумя, тремя, четырьмя или пятью положениями в любом одном или нескольких из четырех FR легкой цепи и/или тяжелой цепи, раскрытых в данном документе. Предпочтительно, аминокислотная замена в CDR ограничена одним, двумя, тремя, четырьмя или пятью положениями в любом одном или нескольких из трех CDR легкой цепи и/или тяжелой цепи. Также возможны комбинации различных изменений в этих FR и CDR, описанных выше.
То, что функциональные свойства соединений-антител, полученных в результате введения аминокислотных модификаций, рассмотренных выше, соответствуют свойствам, которые проявляют специфические молекулы, раскрытые в данном документе, можно подтвердить с помощью способов, раскрытых в данном документе в разделе "Примеры".
Как описано выше, для преодоления проблемы появления у пациентов ответа антител человека на антитело мыши (НАМА), с антителами мыши проводят генетические манипуляции для постепенной замены их мышиного состава аминокислотными остатками, присутствующими в их человеческих аналогах, путем прививки их определяющих комплементарность областей (CDR) на каркасные участки вариабельной области легкой цепи (VL) и вариабельной области тяжелой цепи (VH) молекул иммуноглобулина человека, сохраняя при этом те остатки в каркасных участках мыши, которые считаются необходимыми для целостности антигенсвязывающего участка. Однако ксеногенные CDR гуманизированных антител могут вызывать антиидиотипический (анти-Id) ответ у пациентов.
Для сведения к минимуму анти-Id ответа была разработана процедура гуманизации ксеногенных антител путем прививки на каркасные участки человека только наиболее важных для взаимодействия антитело-лиганд остатков CDR, называемой "прививкой SDR", где только важные определяющие специфичность остатки (SDR) CDR прививают на каркасные участки человека. Эта процедура, описанная в Kashmiri et al. (2005) Methods 36(l):25-34, включает идентификацию SDR с помощью базы данных трехмерных структур комплексов антиген-антитело с известной структурой или с помощью мутационного анализа паратопа. Альтернативный подход к гуманизации, предусматривающий сохранение большего количества остатков CDR, основан на прививке "сокращенных" CDR, отрезков из остатков CDR, которые включают все SDR. Kashmiri et al. также раскрывают процедуру оценки реакционной способности гуманизированных антител по отношению к образцам сыворотки крови от пациентов, которым вводили антитело мыши.
Другая стратегия для конструирования вариантов антител человека с улучшенными иммуногенными свойствами раскрыта в Hou et al. (2008) J. Biochem. 144(1): 115-120. Эти авторы разработали гуманизированное антитело из 4С8, моноклонального антитела мыши к CD34 человека, путем прививки CDR с применением молекулярной модели 4С8, построенной с помощью гомологичного моделирования, реализуемого с помощью компьютера. Путем применения этой молекулярной модели авторы идентифицировали остатки FR, являющиеся потенциально важными для связывания антигена. Гуманизированную версию 4С8 получили путем переноса этих ключевых остатков FR мыши на каркасный участок антитела человека, который выбрали на основе гомологии с FR антитела мыши, вместе с остатками CDR мыши. Было показано, что полученное гуманизированное антитело характеризуется аффинностью связывания антигена и специфичностью, подобными таковым у исходного антитела мыши, что свидетельствует о том, что оно может быть альтернативой антителам мыши к CD34, обычно применяемым в клинической практике.
Варианты осуществления настоящего изобретения охватывают антитела, созданные для предотвращения распознавания иммунной системой человека, содержащие CDR, раскрытые в данном документе, в любой комбинационной форме, так что предусматриваемые mAb могут содержать набор CDR из одного mAb мыши, раскрытого в данном документе, или легкие и тяжелые цепи, содержащие наборы CDR, включающие отдельные CDR, полученные из двух или трех раскрытых mAb мыши. Такие mAb можно создавать с помощью стандартных методик молекулярной биологии и подвергать скринингу в отношении требуемых активностей с помощью анализов, описанных в данном документе. Таким образом, в настоящем изобретении предусматривается подход "сочетания и комбинирования" для создания новых mAb, содержащих совокупность CDR из раскрытых mAb мыши, для достижения новых или улучшенных терапевтических активностей.
Моноклональные антитела или их антигенсвязывающие фрагменты, охватываемые настоящим изобретением, которые "конкурируют" с молекулами, раскрытыми в данном документе, представляют собой таковые, которые связывают CD47 человека в участке(-ах), который(-е) идентичен(-ны) или перекрывается(-ются) с участком(-ами), в котором(-ых) связываются молекулы по настоящему изобретению. Конкурентные моноклональные антитела или их антигенсвязывающие фрагменты можно идентифицировать, например, с помощью конкурентного анализа антител. Например, можно обеспечить связывание образца очищенного или частично очищенного внеклеточного домена CD47 человека с твердой подложкой. Затем добавляют соединение-антитело или его антигенсвязывающий фрагмент по настоящему изобретению и моноклональное антитело или его антигенсвязывающий фрагмент, которые предположительно могут конкурировать с таким соединением-антителом по настоящему изобретению. Одна из двух этих молекул несет метку. Если меченное соединение и соединение без метки связывается с отдельными и дискретными участками на CD47, то меченое соединение будет связываться на таком же уровне, независимо от того, присутствует ли предполагаемое конкурентное соединение или нет. Однако, если участки взаимодействия идентичны или перекрываются, то соединение без метки будет конкурировать, и количество меченого соединения, связавшегося с антигеном, будет уменьшаться. Если соединение без метки присутствует в избытке, то меченое соединение будет связываться в незначительном количестве или вообще не будет связываться. Для целей настоящего изобретения конкурентными моноклональными антителами или их антигенсвязывающими фрагментами являются таковые, которые уменьшают связывание соединений-антител по настоящему изобретению с CD47 на приблизительно 50%, на приблизительно 60%, на приблизительно 70%, на приблизительно 80%, на приблизительно 85%, на приблизительно 86%, на приблизительно 87%, на приблизительно 88%, на приблизительно 89%, на приблизительно 90%, на приблизительно 91%, на приблизительно 92%, на приблизительно 93%, на приблизительно 94%, на приблизительно 95%, на приблизительно 96%, на приблизительно 97%, на приблизительно 98% или на приблизительно 99%. Подробности процедур осуществления таких конкурентных анализов хорошо известны из уровня техники и могут быть найдены, например, в Harlow and Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. Такие анализы можно выполнять с возможностью количественного определения при применении очищенных антител. Калибровочную кривую строят путем титрования одного антитела против самого себя, т. е. одно и тоже антитело применяют и как метку, и как конкурент. С помощью титрования определяют способность конкурентного моноклонального антитела без метки или его антигенсвязывающего фрагмента ингибировать связывание меченой молекулы с планшетом. Результаты откладывают на графике и сравнивают концентрации, необходимые для достижения требуемой степени ингибирования связывания.
То, характеризуются ли mAb или их антигенсвязывающие фрагменты, которые конкурируют с соединениями-антителами по настоящему изобретению в таких конкурентных анализах, функциональными свойствами, аналогичными или подобными таковым у соединений-антител по настоящему изобретению, можно определить с помощью этих способов в сочетании со способами, описанными в примерах 3-5 ниже. В различных вариантах осуществления конкурентные антитела для применения в терапевтических способах, охватываемых в данном документе, обладают биологическими активностями, описанными в данном документе, в диапазоне от приблизительно 50% до приблизительно 100% или приблизительно 125% или более по сравнению с активностями соединений-антител, раскрытых в данном документе. В некоторых вариантах осуществления конкурентные антитела обладают приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или идентичной биологической активностью по сравнению с активностью соединений-антител, раскрытых в данном документе, что определяют с помощью способов, раскрытых в представленном ниже разделе "Примеры".
mAb или их антигенсвязывающие фрагменты или конкурентные антитела, применимые в композициях и способах, могут принадлежать к любому из описанных в данном документе изотипов. Кроме того, любой из этих изотипов может содержать дополнительные аминокислотные модификации, как указано ниже.
Моноклональное антитело или его антигенсвязывающий фрагмент или конкурентное антитело, описанные в данном документе, могут принадлежать к изотипу IgG1 человека.
Константную область IgG1 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для изменения периода полужизни антитела. Период полужизни антитела в значительной степени регулируется Fc-зависимыми взаимодействиями с неонатальным Fc-рецептором (Roopenian and Alikesh, 2007). Константную область IgG1 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе можно модифицировать для увеличения периода полужизни, включая без ограничения аминокислотные модификации: N434A, T307A/E380A/N434A (Petkova et al., 2006, Yeung et al., 2009); M252Y/S254T/T256E (Dall'Acqua et al., 2006); T250Q/M428L (Hinton et al., 2006); и M428L/N434S (Zalevsky et al., 2010).
В противоположность увеличению периода полужизни бывают некоторые обстоятельства, когда требуется уменьшение периода полужизни, например, для снижения вероятности возникновения побочных явлений, связанных с антителами с высокой антителозависимой клеточной цитотоксичностью (ADCC) и комплементзависимой цитотоксичностью (CDC) (Presta 2008). Константную область IgG1 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для уменьшения периода полужизни и/или уменьшения эндогенного IgG, включая без ограничения аминокислотные модификации: I253A (Petkova et al., 2006); P257I/N434H, D376V/N434H (Datta-Mannan et al., 2007); и M252Y/S254T/T256E/H433K/N434F (Vaccaro et al., 2005).
Константную область IgG1 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для увеличения или уменьшения эффекторных функций антитела. Эти эффекторные функции антитела включают без ограничения антителозависимую клеточную цитотоксичность (ADCC), комплементзависимую цитотоксичность (CDC), антителозависимый клеточный фагоцитоз (ADCP), связывание с C1q и измененное связывание с Fc-рецепторами.
Константную область IgG1 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для увеличения эффекторной функции антитела, включая без ограничения аминокислотные модификации: S298A/E333A/K334 (Shields et al., 2001); S239D/I332E и S239D/A330L/I332E (Lazar et al., 2006); F234L/R292P/Y300L, F234L/R292P/Y300L/P393L, и F243L/R292P/Y300L/V305I/P396L (Stevenhagen et al., 2007); G236A, G236A/S239D/I332E, и G236A/S239D/A330L/I332E (Richards et al., 2008); K326A/E333A, K326A/E333S и K326W/E333S (Idusogie et al., 2001); S267E и S267E/L328F (Smith et al., 2012); H268F/S324T, S267E/H268F, S267E/S234T, и S267E/H268F/S324T (Moore et al., 2010); S298G/T299A (Sazinsky et al., 2008); E382V/M428I (Jung et al., 2010).
Константную область IgG1 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для уменьшения эффекторной функции антитела, включая без ограничения аминокислотные модификации: N297A и N297Q (Bolt et al., 1993, Walker et al., 1989); L234A/L235A (Xu et al., 2000); K214T/Е233Р/E234V/L235A/делеция G236/A327G/P331A/D356E/L358M (Ghevaert et al., 2008); C226S/C229S/E233P/L234V/L235A (McEarchern et al., 2007); S267E/L328F (Chu et al., 2008).
Константную область IgG1 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для уменьшения эффекторной функции антитела, включая без ограничения аминокислотные модификации: V234A/G237A (Cole et al., 1999); E233D, G237D, P238D, H268Q, H268D, P271G, V309L, A330S, A330R, P331S, H268Q/A330S/V309L/P331S, H268D/A330S/V309L/P331S, H268Q/A330R/V309L/P331S, H268D/A330R/V309L/P331S, E233D/A330R, E233D/A330S, E233D/P271G/A330R, E233D/P271G/A330S, G237D/H268D/P271G, G237D/H268Q/P271G, G237D/ P271G/A330R, G237D/ P271G/A330S, E233D/H268D/P271G/A330R, E233D/H268Q/P271G/A330R, E233D/H268D/P271G/A330S, E233D/H268Q/P271G/A330S, G237D/H268D/P271G/A330R, G237D/H268Q/P271G/A330R, G237D/H268D/P271G/A330S, G237D/H268Q/P271G/A330S, E233D/G237D/H268D/P271G/A330R, E233D/G237D/H268Q/P271G/A330R, E233D/G237D/H268D/P271G/A330S, E233D/G237D/H268Q/P271G/A330S, P238D/E233D/A330R, P238D/E233D/A330S, P238D/E233D/P271G/A330R, P238D/E233D/P271G/A330S, P238D/G237D/H268D/P271G, P238D/G237D/H268Q/P271G, P238D/G237D/ P271G/A330R, P238D/G237D/ P271G/A330S, P238D/E233D/H268D/P271G/A330R, P238D/E233D/H268Q/P271G/A330R, P238D/E233D/H268D/P271G/A330S, P238D/E233D/H268Q/P271G/A330S, P238D/G237D/H268D/P271G/A330R, P238D/G237D/H268Q/P271G/A330R, P238D/G237D/H268D/P271G/A330S, P238D/G237D/H268Q/P271G/A330S, P238D/E233D/G237D/H268D/P271G/A330R, P238D/E233D/G237D/H268Q/P271G/A330R, P238D/E233D/G237D/H268D/P271G/A330S, P238D/E233D/G237D/H268Q/P271G/A330S (An et al., 2009, Mimoto, 2013).
Моноклональное антитело или его антигенсвязывающий фрагмент или конкурентное антитело, описанные в данном документе, могут принадлежать к изотипу IgG2 человека.
Константную область IgG2 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для увеличения или уменьшения эффекторных функций антитела. Эти эффекторные функции антитела включают без ограничения антителозависимую клеточную цитотоксичность (ADCC), комплементзависимую цитотоксичность (CDC), антителозависимый клеточный фагоцитоз (ADCP), и связывание с C1q, и измененное связывание с Fc-рецепторами.
Константную область IgG2 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для увеличения эффекторной функции антитела, включая без ограничения аминокислотную модификацию K326A/E333S (Idusogie et al., 2001).
Константную область IgG2 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для уменьшения эффекторной функции антитела, включая без ограничения аминокислотные модификации: V234A/G237A (Cole et al., 1999); E233D, G237D, P238D, H268Q, H268D, P271G, V309L, A330S, A330R, P331S, H268Q/A330S/V309L/P331S, H268D/A330S/V309L/P331S, H268Q/A330R/V309L/P331S, H268D/A330R/V309L/P331S, E233D/A330R, E233D/A330S, E233D/P271G/A330R, E233D/P271G/A330S, G237D/H268D/P271G, G237D/H268Q/P271G, G237D/ P271G/A330R, G237D/ P271G/A330S, E233D/H268D/P271G/A330R, E233D/H268Q/P271G/A330R, E233D/H268D/P271G/A330S, E233D/H268Q/P271G/A330S, G237D/H268D/P271G/A330R, G237D/H268Q/P271G/A330R, G23 7D/H268D/P271G/A330S, G237D/H268Q/P271G/A330S, E233D/G237D/H268D/P271G/A330R, E233D/G237D/H268Q/P271G/A330R, E233D/G237D/H268D/P271G/A330S, E233D/G237D/H268Q/P271G/A330S, P238D/E233D/A330R, P238D/E233D/A330S, P238D/E233D/P271G/A330R, P238D/E233D/P271G/A330S, P238D/G237D/H268D/P271G, P238D/G237D/H268Q/P271G, P238D/G237D/ P271G/A330R, P238D/G237D/ P271G/A330S, P238D/E233D/H268D/P271G/A330R, P238D/E233D/H268Q/P271G/A330R, P238D/E233D/H268D/P271G/A330S, P238D/E233D/H268Q/P271G/A330S, P238D/G237D/H268D/P271G/A330R, P238D/G237D/H268Q/P271G/A330R, P238D/G237D/H268D/P271G/A330S, P238D/G237D/H268Q/P271G/A330S, P238D/E233D/G237D/H268D/P271G/A330R, P238D/E233D/G237D/H268Q/P271G/A330R, P238D/E233D/G237D/H268D/P271G/A330S, P238D/E233D/G237D/H268Q/P271G/A330S (An et al., 2009, Mimoto, 2013).
Fc-участок IgG2 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для изменения изоформы и/или агонистической активности, включая без ограничения аминокислотные модификации: C127S (CH1-домен), C232S, C233S, C232S/C233S, C236S, и C239S (White et al., 2015, Lightle et al., 2010).
Моноклональное антитело или его антигенсвязывающий фрагмент или конкурентное антитело, описанные в данном документе, могут принадлежать к изотипу IgG3 человека.
Константная область IgG3 человека в моноклональном антителе или его антигенсвязывающем фрагменте, где указанную константную область IgG3 человека в моноклональном антителе или его антигенсвязывающем фрагменте можно модифицировать по одной или нескольким аминокислотам для увеличения периода полужизни, антителозависимой клеточной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC) или апоптотической активности.
Константная область IgG3 человека в моноклональном антителе или его антигенсвязывающем фрагменте, где указанную константную область IgG3 человека в моноклональном антителе или его антигенсвязывающем фрагменте можно модифицировать по аминокислоте R435H для увеличения периода полужизни антитела.
Моноклональное антитело или его антигенсвязывающий фрагмент или конкурентное антитело, описанные в данном документе, могут принадлежать к изотипу IgG4 человека.
Константную область IgG4 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для уменьшения эффекторных функций антитела. Эти эффекторные функции антитела включают без ограничения антителозависимую клеточную цитотоксичность (ADCC) и антителозависимый клеточный фагоцитоз (ADCP).
Константную область IgG4 человека в моноклональном антителе, его антигенсвязывающем фрагменте или конкурентном антителе, описанных в данном документе, можно модифицировать для предотвращения обмена Fab-плечами и/или уменьшения эффекторной функции антитела, включая без ограничения аминокислотные модификации: F234A/L235A (Alegre et al., 1994); S228P, L235E и S228P/L235E (Reddy et al., 2000).
Используемый в данном документе термин "опухоль" относится ко всем видам роста и пролиферации неопластических клеток, будь то они злокачественными или доброкачественными, и всем видам предраковых и раковых клеток и тканей.
Используемые в данном документе термины "рак", "раковый" и "опухоль" не являются взаимоисключающими.
Термины "рак" и "раковый" обозначают или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется аберрантными ростом/пролиферацией клеток. Примеры типов рака включают без ограничения карциному, лимфому (т.е. лимфому Ходжкина и неходжкинскую лимфому), бластому, саркому и лейкоз. Более конкретные примеры таких типов рака включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, рак брюшной полости, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, лейкоз и другие лимфопролиферативные нарушения, а также различные типы рака головы и шеи.
Используемый в данном документе термин "чувствительная форма рака" относится к раку, клетки которого экспрессируют CD47 и которые восприимчивы к лечению антителом или его антигенсвязывающим фрагментом или конкурентным антителом или его антигенсвязывающим фрагментом по настоящему изобретению.
Используемый в данном документе термин "аутоиммунное заболевание" относится к ситуации, когда иммунная система организма обращается против него самого и ошибочно атакует здоровые клетки.
Используемый в данном документе термин "воспалительное заболевание" относится к заболеванию, характеризующемуся воспалением, которое является фундаментальным патологическим процессом, состоящим из динамического комплекса гистологически видимых цитологических изменений, клеточной инфильтрации и высвобождения медиаторов, которое встречается в пораженных кровеносных сосудах и смежных тканях в ответ на повреждение или аномальную стимуляцию, вызванную физическим, химическим или биологическим средством, включая локальные реакции и возникающие в результате морфологические изменения; при этом разрушение или удаление вредоносного материала и ответов приводят к восстановлению и излечению.
Используемый в данном документе термин "аутовоспалительное заболевание" относится к заболеванию, которое возникает, когда врожденная иммунная система вызывает воспаление по неизвестным причинам.
Используемый в данном документе термин "ишемия" относится к сосудистому явлению, при котором снижение кровоснабжения органа, ткани или части организма вызвано, например, констрикцией или обструкцией одного или нескольких кровеносных сосудов. Ишемия иногда возникает в результате вазоконстрикции, или тромбоза, или эмболии. Ишемия может привести к непосредственному ишемическому повреждению, повреждению ткани вследствие гибели клеток, вызванной сниженным снабжением кислородом. Ишемия может иметь острую форму, которая возникает при хирургическом вмешательстве или в результате травмирования ткани, которое имеет место при несчастных случаях, телесных ранениях и в случае военных действий или после забора органов, предназначенных, например, для последующей трансплантации. Она также может иметь подострую форму, которая обнаруживается при атеросклеротическом заболевании периферических сосудов, при котором постепенное сужение кровеносных сосудов приводит к недостаточному кровотоку в ткани и органы. В случае, когда ткань подвергается ишемии, инициируется последовательность химических реакций, которые, в конечном счете, могут привести к нарушению клеточной функции и некрозу. Если конечным результатом в зоне ишемии является восстановление кровотока, то наступает вторая серия опасных событий, обеспечивающих дополнительное повреждение. Таким образом, во всех случаях, когда имеет место временное уменьшение или прерывание кровотока у субъекта, то возникающее в результате повреждение включает два компонента - непосредственное повреждение, появляющееся во время периода ишемии, и последующее опосредованное или реперфузионное повреждение.
"Ишемический инсульт" может быть вызван несколькими разными видами заболеваний. Наиболее распространенной проблемой является сужение артерий в области головы или шеи. Это чаще всего вызвано атеросклерозом или постепенным отложением холестерина. Если артерии становятся слишком узкими, то клетки крови могут скапливаться в них и формировать кровяные сгустки (тромбы). Эти кровяные сгустки могут блокировать артерию в месте, где они формируются (тромбоз), или могут перемещаться и задерживаться в артериях, которые расположены ближе к головному мозгу (эмболия). Мозговой инсульт может возникать в случае, когда атеросклеротическая бляшка частично отделяется от стенки сосуда и мешает току крови через кровеносный сосуд.
Используемый в данном документе термин "реперфузия" относится к восстановлению кровотока в ткани, которая является ишемизированной вследствие снижения кровотока. Реперфузия представляет собой процедуру лечения инфаркта или другой ишемии путем обеспечения возможности восстановления жизнеспособной ишемизированной ткани, таким образом ограничивая последующий некроз. Однако реперфузия сама по себе может стать причиной дополнительного повреждения ишемизированной ткани, вызывая возникновение реперфузионного повреждения. Помимо непосредственного повреждения, которое имеет место при нарушении кровотока, "ишемически/реперфузионное повреждение" включает повреждение ткани, которое имеет место после восстановления кровотока. В соответствии с современным пониманием большая часть данного повреждения вызывается химическими продуктами, свободными радикалами и активными биологическими веществами, высвобождаемыми ишемизированными тканями.
"Донор, предшественник оксида азота (NO) или местное средство, образующее оксид азота" относится к соединению или средству, которое либо доставляет NO, либо может превращаться в NO посредством ферментативных или неферментативных процессов. Примеры включают без ограничения газообразный NO, изосорбида динитрит, нитрит, нитропруссид, нитроглицерин, 3-морфолиносиднонимин (SIN-1), S-нитрозо-N-ацетилпеницилламин (SNAP), диэтилентриамин/NO (DETA/NO), S-нитрозотиолы, Bidil® и аргинин.
"Растворимая гуанилилциклаза (sGC)" является рецептором оксида азота в гладкой мускулатуре сосудов. В сердечно-сосудистой системе оксид азота образуется эндогенно с участием эндотелиальной синтазы оксида азота из L-аргинина и активирует растворимую гуанилилциклазу в соседних клетках гладкой мускулатуры сосудов для повышения уровней cGMP, индуцируя релаксацию сосудов. Оксид азота связывается с гемовым фрагментом, который в норме является восстановленным, у растворимой гуанилилциклазы и повышает образование cGMP из GTP, что приводит к снижению уровня внутриклеточного кальция, вазодилатации и развитию противовоспалительных эффектов. Окисление железа в геме на sGC снижает восприимчивость фермента к оксиду азота и стимулирует вазоконстрикцию. Таким образом, путь оксид азота-sGC-cGMP играет важную роль при сердечно-сосудистых заболеваниях. Было показано, что азотсодержащие соединения, такие как азид натрия, нитрит натрия, гидроксиламин, нитроглицерин и нитропруссид натрия, стимулируют sGC, что приводит к повышению уровня cGMP и релаксации сосудов. В отличие от стимуляторов sGC, которые связываются с восстановленной sGC, активаторы sGC активируют окисленный или дефицитный по гему фермент sGC, который не восприимчив к действию оксида азота, т.е. они стимулируют sGC независимо от состояния окисления-восстановления. В то время как стимуляторы sGC могут усиливать чувствительность восстановленной sGC к действию оксида азота, активаторы sGC могут повышать активность фермента sGC, даже если фермент находится в окисленном состоянии и, следовательно, меньше восприимчив или не восприимчив к действию оксида азота. Таким образом, активаторы sGC не являются соединениями на основе оксида азота. Следует отметить обзоры Nossaman et al. (2012) Critical Care Research and Practice, том 2012, статья 290805 и Derbyshire and Marietta (2012) Ann. Rev. Biochem. 81:533-559.
"Средство, которое активирует растворимую гуанилилциклазу" относится, например, к органическим нитратам (Artz et al. (2002) J. Biol. Chem. 277:18253-18256); протопорфирину IX (Ignarro et al. (1982) Proc. Natl. Acad. Sci. USA 79:2870-2873); YC-1 (Ko et al. (1994) Blood 84:4226-4233); BAY 41-2272 и BAY 41-8543 (Stasch et al. (2001 Nature 410 (6825): 212-5), CMF-1571 и A-350619 (обзор приведен в Evgenov et al. (2006) Nat. Rev. Drug. Discov. 5:755-768); BAY 58-2667 (Cinaciguat; Frey et al. (2008) Journal of Clinical Pharmacology 48 (12): 1400-10); BAY 63-2521 (Riociguat; Mittendorf et al. (2009) Chemmedchem 4 (5): 853-65). Дополнительные активаторы растворимой гуанилилциклазы раскрыты в Stasch et al. (2011) Circulation 123:2263-2273; Derbyshire and Marietta (2012) Ann. Rev. Biochem. 81:533-559 и Nossaman et al. (2012) Critical Care Research and Practice, том 2012, ID статьи 290805, С. 1-12.
Уровень cGMP также можно повысить путем подавления распада с применением ингибиторов фосфодиэстеразы. Примеры "средства, которое ингибирует фосфодиэстеразы циклических нуклеотидов" включают тадалафил, варденафил, уденафил и силденафил, аванафил.
Используемые в данном документе термины "осуществление лечения", или "лечить", или "лечение" означает замедление, прерывание, задержку, контроль, остановку, уменьшение или обращение прогрессирования или тяжести признака, симптома, нарушения, состояния или заболевания, но не обязательно включает полное устранение всех связанных с заболеванием признаков, симптомов, состояний или нарушений. Термин "осуществление лечения" и т.п. относится к терапевтическому вмешательству, которое уменьшает степень выраженности признака или симптома заболевания или патологического состояния после того, как оно начало развиваться.
Используемый в данном документе термин "эффективное количество" относится к количеству или дозе соединения-антитела по настоящему изобретению, которое при однократном или многократном введении пациенту или в орган обеспечивает требуемое лечение или предупреждение.
Точное эффективное количество для любого конкретного субъекта будет зависеть от его метрических характеристик и состояния здоровья, характера и степени выраженности его состояния, а также терапевтических средств или комбинации терапевтических средств, выбранных для введения. Эффективное количество для рассматриваемого пациента определяется с помощью обычных экспериментов и находится на усмотрении клинициста. Терапевтически эффективные количества соединений-антител по настоящему изобретению могут также включать количество в диапазоне от приблизительно 0,1 мг/кг до приблизительно 150 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 100 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 50 мг/кг или от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг на одну дозу, вводимую в забранный орган или пациенту. Известные фармацевтические препараты на основе антител служат руководством в этом отношении. Например, Herceptin™ вводят путем внутривенной инфузии раствора в дозе 21 мг/мл, при этом начальная нагрузочная доза составляет 4 мг/кг веса тела и недельная поддерживающая доза составляет 2 мг/кг веса тела; например, Rituxan™ вводят еженедельно в дозе 375 мг/м2.
Терапевтически эффективное количество для любого отдельного пациента может определить специалист в области здравоохранения путем отслеживания эффекта соединений-антител на регрессию опухоли, циркулирующие опухолевые клетки, опухолевые стволовые клетки или противоопухолевые ответы. Анализ данных, полученных этими способами, позволяет модифицировать схему лечения в ходе терапии, так чтобы вводить оптимальные количества соединений-антител по настоящему изобретению, независимо от того, используются ли они отдельно, или в комбинации друг с другом, или в комбинации с другим терапевтическим средством, или и с тем, и с другим, и таким образом можно также определить длительность лечения. Таким образом, схемы введения дозы/лечения можно модифицировать в течение курса терапии так, чтобы вводить наименьшие количества соединений-антител, применяемых отдельно или в комбинации, которые проявляют приемлемую эффективность, и так, чтобы введение таких антител продолжали лишь до тех пор, пока это необходимо для успешного лечения пациента. Известные фармацевтические препараты на основе антител служат руководством в отношении частоты введения, например, следует ли доставлять фармацевтические препараты ежедневно, еженедельно, ежемесячно и т.д. Частота и дозировка также могут зависеть от тяжести симптомов.
В некоторых вариантах осуществления соединения-антитела по настоящему изобретению можно применять в качестве лекарственных препаратов, предназначенных для применения в медицине человека и ветеринарии, которые вводят различными путями, включая без ограничения пероральный, внутривенный, внутримышечный, внутриартериальный, интрамедуллярный, внутрибрюшинный, интратекальный, интравентрикулярный, трансдермальный, чрескожный, местный, подкожный, внутриопухолевый, интраназальный, энтеральный, сублингвальный, внутривагинальный, интравезикулярный или ректальный пути. Композиции также можно вводить непосредственно в место поражения, такое как опухоль. Лечение дозами может проходить по схеме однократного приема дозы или по схеме многократного приема доз. Безыгольные шприцы также можно применять для введения фармацевтических композиций. Обычно терапевтические композиции можно получить либо в виде инъекционных препаратов, либо в виде жидких растворов или суспензий. Также можно получить твердые формы, пригодные для растворения или суспендирования в жидких средах-носителях перед инъекцией. Ветеринарные применения включают лечение домашних животных/домашних питомцев, таких как кошки и собаки; рабочих животных, таких как собаки-поводыри или собаки-помощники и лошади; животных, предназначенных для спортивных состязаний, таких как лошади и собаки; зоопарковых животных, таких как приматы, животные семейства кошачьих, такие как львы и тигры, медведи и т.д.; и других ценных животных, удерживаемых в неволе.
Такие фармацевтические композиции можно получать с помощью способов, хорошо известных из уровня техники, см., например, Remington: The Science and Practice of Pharmacy, 21st Edition (2005), Lippincott Williams & Wilkins, Philadelphia, PA, и содержат одно или несколько соединений-антител, раскрытых в данном документе, и фармацевтически или ветеринарно приемлемый, например физиологически приемлемый, носитель, разбавитель или наполнитель.
В настоящем изобретении описаны mAb к CD47 с отличающимися функциональными профилями. Эти антитела характеризуются отличающимися комбинациями свойств, выбранными из следующих: 1) проявляют перекрестную реактивность с гомологами CD47 одного или нескольких видов; 2) блокируют взаимодействие между CD47 и его лигандом SIRPα; 3) усиливают фагоцитоз опухолевых клеток человека, 4) индуцируют гибель чувствительных опухолевых клеток человека; 5) не индуцируют клеточную гибель опухолевых клеток человека; 6) характеризуются сниженным связыванием с эритроцитами человека (hRBC); 7) характеризуются отсутствием обнаруживаемого связывания с hRBC; 8) вызывают сниженную агглютинацию hRBC; 9) не вызывают обнаруживаемую агглютинацию hRBC; 10) обращают ингибирование пути с участием оксида азота (NO) под действием TSP1 и/или 11) не обращают ингибирование пути с участием NO под действием TSP1.
Антитела к CD47 и их антигенсвязывающие фрагменты по настоящему изобретению характеризуются комбинациями свойств, отличающимися от таковых у антител к CD47 из известного уровня техники. Эти свойства и характеристики далее будут описаны более подробно.
Связывание с CD47 разных видов
Антитела к CD47 и их антигенсвязывающие фрагменты по настоящему изобретению связывают CD47 человека. В определенных вариантах осуществления антитела к CD47 проявляют перекрестную реактивность с гомологами CD47 одного или нескольких видов, например, гомологами CD47, происходящими от приматов, отличных от человека. В определенных вариантах осуществления антитела к CD47 и их антигенсвязывающие фрагменты по настоящему изобретению связываются с CD47 человека и с CD47, происходящим от приматов, отличных от человека, мышей, крыс и/или кроликов. Перекрестная реактивность с гомологами других видов может быть особенно преимущественной при разработке и тестировании терапевтических антител. Например, доклиническое токсикологическое тестирование терапевтических антител часто проводят на видах приматов, отличных от человека, включая без ограничения яванского макака, зеленую мартышку, макака-резуса и саймири. Поэтому перекрестная реактивность с гомологами этих видов может быть особенно преимущественной для разработки антител в качестве клинических кандидатов.
Блокирование взаимодействия между CD47 и SIRPα и стимуляция фагоцитоза
CD47, также известный как ассоциированный с интегринами белок (LAP), представляет собой рецептор клеточной поверхности размером 50 кДа, состоящий из внеклеточного N-концевого домена IgV, трансмембранного домена, пронизывающего мембрану пять раз, и короткого С-концевого внутриклеточного хвоста, который является результатом альтернативного сплайсинга.
Два лиганда связываются с CD47: сигнальный регуляторный белок альфа (SIRPα) и тромбоспондин-1 (TSP1). TSP1 присутствует в плазме крови и синтезируется многими клетками, включая тромбоциты. SIRPα экспрессируется на гемопоэтических клетках, которые включают макрофаги и дендритные клетки.
Когда SIRPα на фагоците связывается с CD47 на клетке-мишени, это взаимодействие предотвращает фагоцитоз клетки-мишени. Взаимодействие CD47 и SIRPα эффективно посылает сигнал "не ешь меня" фагоциту (Oldenborg et al. Science 288: 2051-2054, 2000). Блокирование взаимодействия SIRPα и CD47 с помощью mAb к CD47 в терапевтическом контексте может обеспечить эффективное противораковое лечение за счет стимуляции поглощения и выведения раковых клеток иммунной системой хозяина. Таким образом, важной функциональной характеристикой некоторых mAb к CD47 является способность блокировать взаимодействие CD47 и SIRPα, что приводит к фагоцитозу CD47-экспрессирующих опухолевых клеток макрофагами. Было показано, что несколько mAb к CD47 блокируют взаимодействие CD47 и SIRPα, включая В6Н12 (Seiffert et al. Blood 94:3633-3643,1999; Latour et al. J. Immunol. 167: 2547-2554, 2001; Subramanian et al. Blood 107: 2548-2556, 2006; Liu et al. J Biol. Chem. 277: 10028-10036, 2002; Rebres et al. J. Cellular Physiol. 205: 182-193, 2005), BRIC126 (Vernon-Wilson et al. Eur J Immunol. 30: 2130-2137, 2000; Subramanian et al. Blood 107: 2548-2556, 2006), CC2C6 (Seiffert et al. Blood 94:3633-3643,1999) и 1F7 (Rebres et al. J. Cellular Physiol. 205: 182-193, 2005). Также было показано, что В6Н12 и BRIC126 вызывают фагоцитоз опухолевых клеток человека под действием макрофагов человека и мыши (Willingham et al. Proc Natl Acad Sci USA 109(17):6662-6667, 2012; Chao et al. Cell 142:699-713, 2012; EP 2242512 B1). Другие существующие mAb к CD47, такие как 2D3, не блокируют взаимодействие CD47 и SIRPα (Seiffert et al. Blood 94:3633-3643, 1999; Latour et al. J. Immunol. 167: 2547-2554, 2001; Rebres et al. J. Cellular Physiol. 205: 182-193, 2005) и не вызывают фагоцитоз опухолевых клеток (Willingham et al. Proc Natl Acad Sci USA 109(17):6662-6667, 2012; Chao et al. Cell 142:699-713, 2012; EP 2242512 B1).
Используемый в данном документе термин "блокирует связывание SIRPα с CD47 человека" относится к снижению связывания SIRPα-Fc с CD47 на клетках Jurkat на более чем 50% под действием mAb к CD47.
mAb к CD47 по настоящему изобретению, описанные в данном документе, блокируют взаимодействие CD47 и SIRPα и усиливают фагоцитоз опухолевых клеток человека.
"Фагоцитоз" раковых клеток относится к поглощению и расщеплению таких клеток макрофагами и окончательному расщеплению или разрушению этих раковых клеток с высвобождением расщепленных или разрушенных компонентов клеток внеклеточно или внутриклеточно для дополнительной обработки. Моноклональные антитела к CD47, которые блокируют связывание SIRPα с CD47, усиливают фагоцитоз раковых клеток макрофагами. В противном случае связывание SIRPα с CD47 на раковых клетках позволило бы этим клеткам избежать фагоцитоза макрофагами. Раковые клетки могут быть жизнеспособными или живыми раковыми клетками.
Индуцирование гибели опухолевых клеток
Некоторые растворимые mAb к CD47 инициируют программу гибели клеток при связывании с CD47 на опухолевых клетках, что приводит к падению митохондриального мембранного потенциала, потере способности вырабатывать АТР, повышенной экспрессии на поверхности клеток фосфатидилсерина (обнаруживают по увеличению степени окрашивания аннексином V) и гибели клеток без участия каспаз или фрагментации ДНК. Такие растворимые mAb к CD47 характеризуются потенциалом к лечению ряда солидных и гематологических типов рака. Некоторые растворимые mAb к CD47, которые, как было показано, индуцируют гибель опухолевых клеток, включают MABL-1, MABL-2 и их фрагменты (патент США №8101719; Uno et al. Oncol Rep. 17: 1189-94, 2007; Kikuchi et al. Biochem Biophys Res. Commun. 315: 912-8, 2004), Ad22 (Pettersen et al. J. Immuno. 166: 4931-4942, 2001; Lamy et al. J. Biol. Chem. 278: 23915-23921, 2003) и 1F7 (Manna et al. J. Immunol. 170: 3544-3553, 2003; Manna et al. Cancer Research, 64: 1026-1036, 2004). Некоторые из описанных в данном документе mAb к CD47 по настоящему изобретению индуцируют клеточную гибель опухолевых клеток человека.
Термины "индуцирование гибели клеток" или "уничтожает" и т.д. применяются в данном документе взаимозаменяемо для обозначения того, что добавление соединения-антитела по настоящему изобретению к культивируемым раковым клеткам вызывает проявление данными клетками поддающихся количественному определению характеристик, ассоциированных с гибелью клеток, включая любую одну или нескольких из следующих.
1. Повышенное связывание аннексина V (в присутствии ионов кальция) с опухолевыми клетками, что обнаруживают с помощью проточной цитометрии или конфокальной флуоресцентной микроскопии.
2. Повышенное поглощение опухолевыми клетками флуоресцентного соединения пропидиум йодида (что анализируют с помощью проточной цитометрии), или 7-аминоактиномицина D (7-AAD, что анализируют с помощью проточной цитометрии), или трипанового синего (что оценивают с помощью световой микроскопии).
3. Потеря функции митохондрий и мембранного потенциала у опухолевых клеток, что анализируют с помощью одного из нескольких доступных средств измерений (потенциометрических флуоресцентных красителей, таких как DiO-С6 или JC1, или анализов с использованием формазана, таких как МТТ или WST-1).
Индукция клеточной гибели относится к способности определенных растворимых антител к CD47, антител мыши, химерных антител, гуманизированных антител или их антигенсвязывающих фрагментов (и конкурентных антител и их антигенсвязывающих фрагментов), раскрытых в данном документе, к уничтожению раковых клеток посредством автономного клеточного механизма без участия комплемента или других клеток, включая без ограничения Т-клетки, нейтрофилы, естественные клетки-киллеры, макрофаги или дендритные клетки. В количественном отношении индукция клеточной гибели предусматривает без ограничения увеличение более чем в 2 раза степени окрашивания аннексином V опухолевых клеток человека, вызванное растворимым mAb к CD47, по сравнению с фоном, полученным с отрицательным контрольным антителом (гуманизированное антитело соответствующего изотипа).
Среди гуманизированных или химерных mAb по настоящему изобретению те, которые индуцируют клеточную гибель опухолевых клеток человека, вызывают повышенное связывание аннексина V, аналогичное результатам, полученным для mAb Ad22 к CD47 (Pettersen et al. J. lmmuno. 166: 4931-4942, 2001; Lamy et al. J. Biol. Chem. 278: 23915-23921, 2003); 1F7 (Manna and Frazier J. Immunol. 170:3544-3553, 2003; Manna and Frazier Cancer Res. 64:1026-1036, 2004); и MABL-1 и 2 (патент США №7531643 B2; патент США №7696325 В2; патент США №8101719 В2).
Анализы жизнеспособности клеток описаны в руководстве NCI/NIH, в котором описаны многочисленные типы клеточных анализов, которые можно применять для оценки индукции клеточной гибели, вызванной антителами к CD47: "Cell Viability Assays", Terry L Riss, PhD, Richard A Moravec, BS, Andrew L Niles, MS, Helene A Benink, PhD, Tracy J Worzella, MS и Lisa Minor, PhD. информация об авторах, опубликовано 1 мая 2013 года.
Связывание с hRBC
CD47 экспрессируется на красных кровяных тельцах человека (hRBC) (Brown. J Cell Biol. 111: 2785-2794, 1990; Avent. Biochem J., (1988) 251: 499-505; Knapp. Blood, (1989) Vol. 74, No. 4, 1448-1450; Oliveira et al. Biochimica et Biophysica Acta 1818: 481-490, 2012; Petrova P. et al. Cancer Res 2015; 75(15 Suppl): Abstract № 4271). Было показано, что mAb к CD47 связываются с RBC, включая В6Н12 (Brown et al. J. Cell Biol., 1990, Oliveira et al. Biochimica et Biophysica Acta 1818: 481-490, 2012, Petrova P. et al. Cancer Res 2015; 75(15 Suppl): Abstract №4271), BRIC125 (Avent. Biochem J., (1988) 251: 499-505), BRIC126 (Avent. Biochem J., (1988) 251: 499-505; Petrova P. et al. Cancer Res 2015; 75(15 Suppl): Abstract №4271), 5F9 (Uger R. et al. Cancer Res 2014; 74(19 Suppl): Abstract №5011, Liu et al. PLoS One. 2015 Sep 21; 10(9): e0137345; Sikic B. et al. J Clin Oncol 2016; 34 (suppl; abstract 3019)), антитела к CD47, раскрытые в публикации заявки на патент США №2014/0161799, публикации WO 2014/093678, публикации заявки на патент США №2014/0363442, и СС2С6 (Petrova P. et al. Cancer Res 2015; 75(15 Suppl): Abstract №4271, Uger R. et al. Cancer Res 2014; 74(19 Suppl): Abstract №5011). Было также показано, что слитый белок SIRPα-Fc, который связывается с CD47 человека, характеризуется сниженным связыванием с RBC человека по сравнению с другими клетками человека (Uger R. et al. Cancer Res 2014; 74(19 Suppl): Abstract №5011). Сниженного связывания с RBC можно достигать путем получения биспецифических антител только с одним CD47-связывающим плечом (Masternak et al. Cancer Res 2015; 75(15 Suppl): Abstract №2482).
Поскольку было показано, что некоторые mAb к CD47 приводят к снижению количества RBC при введении яванским макакам (Mounho-Zamora В. et al. The Toxicologist, Supplement to Toxicological Sciences, 2015; 144 (1): Abstract 596: 127, Liu et al. PLoS One. 2015 Sep 21; 10(9): e0137345; Pietsch et al. Cancer Res 2015; 75(15 Suppl): Abstract №2470), весьма желательно идентифицировать mAb к CD47, которые не связываются с CD47-экспрессирующими RBC.
Используемые в данном документе термины "эритроцит(-ы)" и "красное(-ые) кровяное(-ые) тельце(-а)" и являются синонимами и используются в данном документе взаимозаменяемо.
Используемый в данном документе термин "сниженное связывание с hRBC" относится к Kd связывания mAb к CD47 с hRBC, которая в 10 или более раз превышает Kd на опухолевой клетке человека, где опухолевая клетка представляет собой клетку OV10hCD47.
Используемый в данном документе термин "отсутствие связывания" или "NB" относится к отсутствию измеримого связывания с hRBC при концентрации mAb к CD47 не более 100 мкг/мл включительно.
До настоящего изобретения, описанного в данном документе, не было сообщений о mAb к CD47, которые не связываются с RBC человека, экспрессирующими CD47.
Некоторые из mAb к CD47, раскрытых в данном документе, характеризуются сниженным связыванием или отсутствием обнаруживаемого связывания с RBC человека.
Агглютинация RBC
Агглютинация или гемагглютинация эритроцитов (RBC) представляет собой гомотипическое взаимодействие, которое возникает, когда RBC агрегируют или скапливаются вместе после инкубации с различными средствами, включая антитела к антигенам RBC и белкам клеточной поверхности, таким как CD47. Сообщалось, что многие антитела к CD47 вызывают гемагглютинацию выделенных RBC человека in vitro зависимым от концентрации образом, включая В6Н12, BRIC126, MABL-1, MABL-2, СС2С6 и 5F9 (Uger R. et al. Cancer Res 2014; 74 (19 Suppl): Abstract №5011, патент США №9045541, Uno et al. Oncol Rep. 17: 1189-94, 2007; Kikuchi et al. Biochem Biophys Res. Commun. 315: 912-8, 2004; Sikic B. et al. J Clin Oncol 2016; 34 (suppl; abstract 3019)). Для этого функционального эффекта необходимо связывание RBC интактным бивалентным антителом, и оно может быть снижено или устранено путем получения либо F(ab')-, либо svFv-фрагментов антитела (Uno et al. Oncol Rep. 17: 1189-94, 2007; Kikuchi et al. Biochem Biophys Res. Commun. 315: 912-8, 2004) или биспецифических антител только с одним CD47-связывающим плечом (Masternak et al. Cancer Res 2015; 75 (15 Suppl): Abstract №2482). Было показано, что другие функциональные свойства этих фрагментов, включая уничтожение клеток, либо снижаются, либо сохраняются в этих фрагментах (Uno et al. Oncol Rep. 17: 1189-94, 2007; Klkuchi et al. Biochem Biophys Res. Commun. 315: 912-8, 2004). Антитело мыши 2D3 является примером антитела к CD47, которое связывается с CD47 на эритроцитах, но не вызывает гемагглютинацию (патент США № 9045541, Petrova et al. Cancer Res 2015; 75 (15 Suppl): Abstract №4271). Было показано, что гемагглютинация снижается/устраняется путем снижения селективного связывания с RBC человека, но не с другими клетками, с использованием слитого белка SIRPα-Fc (Uger R. et al. Blood 2013; 122(21): 3935). Кроме того, сообщалось, что мышиное mAb 2А1 к CD47 и гуманизированные версии 2А1 блокируют CD47/SIRPα, но не проявляют гемагглютинирующую активность (патент США №9045541). Сообщалось, что небольшое количество из панели антител мыши к CD47 человека (3 из 23) не вызывало гемагглютинацию RBC человека (Pietsch Е et al. Cancer Res 2015; 75 (15 Suppl): Abstract №2470). Поэтому до настоящего изобретения, описанного в данном документе, существовала необходимость в идентификации mAb к CD47, которые блокируют связывание SIRPα/CD47, характеризуются отсутствием обнаруживаемого связывания или сниженным связыванием с RBC и/или не вызывают гемагглютинацию. Термин "агглютинация" относится к скоплению клеток, тогда как термин "гемагглютинация" относится к скоплению определенной субпопуляции клеток, т.е. RBC. Таким образом, гемагглютинация является типом агглютинации.
Используемый в данном документе термин "сниженная гемагглютинация" относится к измеримой агглютинирующей активности hRBC при концентрациях mAb к CD47, превышающих 1,85 мкг/мл, и отсутствию измеримой активности при концентрациях, меньших или равных 1,85 мкг/мл.
Используемый в данном документе термин "отсутствие обнаруживаемой гемагглютинации" относится к отсутствию измеримой агглютинирующей активности hRBC при концентрациях mAb к CD47, превышающих или равных 0,3 пг/мл, до концентрации, меньшей или равной 50 мкг/мл.
Некоторые из антител к CD47, описанных в данном документе, вызывают сниженную гемагглютинацию или отсутствие обнаруживаемой гемагглютинации RBC человека.
Модулирование пути с участием NO
Как отмечено выше, TSP1 также является лигандом для CD47. Путь с участием TSP1/CD47 препятствует благоприятным эффектам пути с участием NO во многих типах клеток, включая без ограничения клетки сосудов. Путь с участием NO состоит из любого из трех ферментов (синтазы оксида азота, NOS I, NOS II и NOS III), которые образуют биологически активный газ NO с применением аргинина в качестве субстрата. NO может оказывать свое действие внутри клетки, в которой он вырабатывается, или в соседних клетках, активируя фермент, растворимую гуанилилциклазу, который вырабатывает молекулу-посредника, циклический GMP (cGMP). Правильное функционирование пути с участием NO/cGMP необходимо для защиты сердечно-сосудистой системы от стрессов, включая без ограничения стрессы, возникающие в результате ранения, воспаления, гипертензии, метаболического синдрома, ишемии и IRI. В случае этих клеточных стрессов ингибирование пути с участием NO/cGMP под действием системы TSP1/CD47 усиливает эффекты стресса. Это является особенной проблемой для сердечно-сосудистой системы, в которой оба cGMP и сАМР играют важные защитные роли. Существует множество причин, по которым ишемически-реперфузионное повреждение вызывает или вносит вклад в возникновение заболевания, травмы и неблагоприятного исхода хирургических процедур.
Как раскрыто в данном документе, одно или несколько химерных или гуманизированных антител к CD47 будут обращать ингибирование выработки cGMP под действием TSP1. Обращение буде полным (>80%) или промежуточным (20%-80%). Это обращение ингибирования выработки cGMP под действием TSP1 будет демонстрировать, что mAb к CD47 обладают способностью усиливать передачу сигнала с участием NO, и означать, что они применимы в защите сердечно-сосудистой системы от стрессов, включая без ограничения стрессы, возникающие в результате ранения, воспаления, гипертензии, метаболического синдрома, ишемии и ишемически-реперфузионного повреждения (IRI). Также ожидается, что дополнительные системы анализа, например, сокращение гладкомышечных клеток, будут показывать, что некоторые химерные или гуманизированные антитела обращают ингибиторные действия TSP1 в отношении последующих эффектов, происходящих в результате активации передачи сигнала с участием NO.
Как раскрыто в данном документе, "полное обращение ингибирования пути с участием NO" относится к более чем 80% обращению ингибирования передачи сигнала с участием N0 под действием TSP1 с помощью mAb к CD47 по сравнению с отрицательным контролем, гуманизированным антителом соответствующего изотипа.
Как раскрыто в данном документе, "промежуточное обращение ингибирования пути с участием NO" относится к 20-80% обращению ингибирования передачи сигнала с участием NO под действием TSP1 с помощью mAb к CD47 по сравнению с отрицательным контролем, гуманизированным антителом соответствующего изотипа.
Как раскрыто в данном документе, "отсутствие обращения ингибирования пути с участием NO" относится к менее чем 20% обращению ингибирования передачи сигнала с участием NO под действием TSP1 с помощью mAb к CD47 по сравнению с отрицательным контролем, гуманизированным антителом соответствующего изотипа.
Предпочтительные комбинации функциональных свойств
В известном уровне техники существуют mAb к CD47 с комбинациями некоторых, но не всех функциональных характеристик, описанных в данном документе. Ранее было показано, что гуманизированные mAb к CD47, такие как АВ6.12 IgG1, AB6.12-IgG4P и AB6.12-IgG4PE (патент США №9045541, публикация заявки на патент США №2014/0161799, публикация WO 2014/093678, публикация заявки на патент США №2014/0363442) и 5F9 (Mounho-Zamora В. et al. The Toxicologist, Supplement to Toxicological Sciences, 2015; 144 (1): Abstract 596: 127, Liu et al. PLoS One. 2015 Sep 21; 10(9): e0137345), связывают CD47 человека, блокируют взаимодействие CD47 и SIRPα и вызывают фагоцитоз опухолевых клеток человека. Гуманизированные mAb к CD47, АВ6.12 IgG1, AB6.12-IgG4P и AB6.12-IgG4PE, также не вызывают гемагглютинацию RBC человека (патент США №9045541). Гуманизированное mAb к CD47, 5F9, связывается с RBC человека и вызывает их гемагглютинацию (Uger R. et al. Cancer Res 2014; 74 (19 Suppl): Abstract №5011, Sikic B. et al. J Clin Oncol 2016; 34 (suppl; abstract 3019). mAb мыши к CD47, B6H12, BRIC126 и CC2C6, блокируют взаимодействие CD47 и SIRPα, вызывают фагоцитоз и связываются с RBC человека и вызывают их гемагглютинацию (Petrova P. et al. Cancer Res 2015; 75 (15 Suppl): Abstract №4271, Seiffert et al. Blood 94:3633-3643, 1999; Vernon-Wilson et al. Eur J Immunol. 30: 2130-2137, 2000; Latour et al. J. Immunol. 167: 2547-2554, 2001; Subramanian et al. Blood 107: 2548-2556, 2006; Liu et al. J Biol. Chem. 277: 10028-10036, 2002). mAb мыши к CD47, MABL-1 и MABL-2, связываются с CD47 человека, индуцируют гибель опухолевых клеток и вызывают гемагглютинацию RBC (патент США №8101719); mAb мыши Ad22 связывается с CD47 человека и индуцирует гибель опухолевых клеток (Pettersen et al. J. Immunol. 166: 4931-4942, 2001; Lamy et al. J Biol Chem. 278: 23915-23921, 2003) и mAb мыши, 1F7, связывается с CD47 человека, блокирует взаимодействие CD47 и SIRPα и индуцирует гибель опухолевых клеток (Rebres et al. J. Cellular Physiol. 205: 182-193, 2005; Manna et al. J. Immunol. 170: 3544-3553, 2003; Manna et al. Cancer Research, 64: 1026-1036, 2004).
Предпочтительные варианты осуществления антител к CD47, описанных в данном документе, также характеризуются комбинациями свойств, которые не проявляли антитела к CD47 из известного уровня техники, предложенные для применения в терапевтических целях у человека. Соответственно, предпочтительные антитела к CD47, описанные в данном документе, характеризуются тем, что они:
a. связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека и
d. индуцируют гибель чувствительных опухолевых клеток человека.
В другом предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. индуцируют гибель чувствительных опухолевых клеток человека и
e. не вызывают агглютинацию эритроцитов человека (hRBC).
В еще одном предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. индуцируют гибель чувствительных опухолевых клеток человека и
e. вызывают сниженную агглютинацию эритроцитов человека (hRBC).
В другом предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. специфически связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. индуцируют гибель чувствительных опухолевых клеток человека и
e. характеризуются сниженным связыванием с hRBC.
В другом предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. не вызывают агглютинацию эритроцитов человека (hRBC) и
e. не связываются с hRBC.
В другом предпочтительном варианте осуществления, описанном в данном документе, антитела к CD47 характеризуются тем, что они:
a. специфически связываются с CD47 человека,
b. блокируют связывание SIRPα с CD47 человека,
c. усиливают фагоцитоз опухолевых клеток человека,
d. не вызывают агглютинацию эритроцитов человека (hRBC) и
e. характеризуются сниженным связыванием с hRBC.
В другом предпочтительном варианте осуществления, описанном в данном документе, моноклональное антитело или его антигенсвязывающий фрагмент также специфически связываются с CD47 примата, отличного от человека, где примат, отличный от человека, может включать без ограничения яванского макака, зеленую мартышку, макака-резуса и саймири.
В еще одном предпочтительном варианте осуществления, описанном в данном документе, моноклональное антитело или его антигенсвязывающий фрагмент связывают CD47 человека, примата, отличного от человека, мыши, кролика и крысы.
В данном документе описаны mAb к CD47 с отличающимися функциональными профилями. Эти антитела характеризуются отличающимися комбинациями свойств, выбранными из следующих: 1) проявляют перекрестную реактивность с гомологами CD47 одного или нескольких видов; 2) блокируют взаимодействие между CD47 и его лигандом SIRPα; 3) усиливают фагоцитоз опухолевых клеток человека, 4) индуцируют гибель чувствительных опухолевых клеток человека; 5) не индуцируют клеточную гибель опухолевых клеток человека; 6) характеризуются сниженным связыванием с эритроцитами человека (hRBC); 7) характеризуются отсутствием обнаруживаемого связывания с hRBC; 8) вызывают сниженную агглютинацию hRBC; 9) не вызывают обнаруживаемую агглютинацию hRBC; 10) обращают ингибирование пути с участием оксида азота (NO) под действием TSP1 и/или 11) не обращают ингибирование пути с участием NO под действием TSP1.
Антитела к CD47
При многих типах рака у человека наблюдают положительную регуляцию экспрессии CD47 на клеточной поверхности, и при этом типы рака с наиболее высокими уровнями экспрессии CD47, по-видимому, являются наиболее агрессивными и наиболее летальными для пациентов. Полагают, что повышенная экспрессия CD47 защищает раковые клетки от выведения путем фагоцитоза путем посылки сигнала "не ешь меня" макрофагам с помощью SIRPα, ингибирующего рецептора, который предотвращает фагоцитоз CD47-несущих клеток (Oldenborg et al. Science 288: 2051-2054, 2000; Jaiswal et al. (2009) Cell 138(2):271-851; Chao et al. (2010) Science Translational Medicine 2(63):63ra94). Таким образом, повышение экспрессии CD47 при многих типах рака обеспечивает им маскировку по типу "свой", что замедляет их выведение путем фагоцитоза макрофагами и дендритными клетками.
Антитела, которые блокируют CD47 и предотвращают его связывание с SIRPα, показали эффективность в моделях опухолей (ксенотрансплантатов) человека у мышей. Такие блокирующие mAb к CD47, проявляющие это свойство, усиливают фагоцитоз раковых клеток макрофагами, что может снизить опухолевую нагрузку (Majeti et al. (2009) Cell 138 (2): 286-99; патент США №9045541; Willingham et al. (2012) Proc Natl Acad. Sci. USA 109(17):6662-6667; Xiao et al. (2015) Cancer Letters 360:302-309; Chao et al. (2012) Cell 142:699-713; Kim et al. (2012) Leukemia 26:2538-2545) и, в конечном счете, может привести к выработке адаптивного иммунного ответа в отношении опухоли (Tseng et al. (2013) PNAS 110 (27):11103-11108; Soto-Pantoja et al. (2014) Cancer Res. 74 (23): 6771-6783; Liu et al. (2015) Nat. Med. 21 (10): 1209-1215).
Однако существуют механизмы, с помощью которых mAb к CD47 могут атаковать трансформированные клетки и которые еще не были использованы при лечении рака. Несколько групп показали, что определенные mAb к CD47 человека индуцируют клеточную гибель опухолевых клеток человека. mAb к CD47, Ad22, индуцирует клеточную гибель нескольких линий опухолевых клеток человека (Pettersen et al. J. Immuno. 166: 4931-4942, 2001; Lamy et al. J. Biol. Chem. 278: 23915-23921, 2003). Было показано, что AD22 вызывает быстрое нарушение функции митохондрий и быструю клеточную гибель с ранним выведением на наружную поверхность фосфатидилсерина и падением митохондриального мембранного потенциала (Lamy et al. J. Biol. Chem. 278: 23915-23921, 2003). mAb к CD47, MABL-2, и его фрагменты индуцируют клеточную гибель линий лейкозных клеток человека, но не нормальных клеток in vitro, и оказывают противоопухолевый эффект в моделях с ксенотрансплантатом in vivo. (Uno et al. (2007) Oncol. Rep. 17 (5): 1189-94). mAb к CD47 человека, 1F7, индуцирует клеточную гибель при типах Т-клеточного лейкоза человека (Manna and Frazier (2003) J. Immunol. 170: 3544-53) и некоторых типах рака молочной железы (Manna and Frazier (2004) Cancer Research 64 (3): 1026-36). 1F7 уничтожает CD47-несущие опухолевые клетки без воздействия комплемент- или клеточно-опосредованного цитолиза NK-клетками, Т-клетками или макрофагами. Вместо этого, mAb к CD47, 1F7, оказывает свое действие посредством неапоптозного механизма, который включает непосредственную CD47-зависимую атаку на митохондрии, разряжая их мембранный потенциал и лишая клетку способности вырабатывать АТР, что приводит к быстрой клеточной гибели. Следует отметить, что mAb к CD47, 1F7, не уничтожает покоящиеся лейкоциты, которые также экспрессируют CD47, а лишь те клетки, которые "активированы" в результате трансформации. Таким образом, нормальные циркулирующие клетки, многие из которых экспрессируют CD47, сохраняются, в то время как раковые клетки селективно уничтожаются токсичным в отношении опухоли mAb к CD47 (Manna and Frazier (2003) J. Immunol. 170: 3544-53). Можно предположить, что данный механизм заключается в упреждающей, селективной и непосредственной атаке на опухолевые клетки в отличие от пассивного механизма вызывания фагоцитоза путем простого блокирования связывания CD47/SIRPα. Важно отметить, что mAb 1F7 также блокирует связывание SIRPα с CD47 (Rebres et al. J. Cellular Physiol. 205: 182-193, 2005) и, таким образом, оно может оказывать свое действие посредством двух механизмов: (1) прямая токсичность в отношении опухоли и (2) вызывание фагоцитоза раковых клеток. Одно mAb, которое может выполнять обе функции, может превосходить mAb, которое лишь блокирует связывание CD47/SIRPα.
После периодов ишемии ткани возникновение кровотока становится причиной повреждения, называемого "ишемически-реперфузионным повреждением" или IRI. IRI вносит вклад в неблагоприятные исходы при многих хирургических процедурах, при которых имеет место IRI вследствие необходимости остановки кровотока на некоторый период времени, при многих формах/причинах травмы, при которых кровоток прерывается, а позже восстанавливается в результате терапевтического вмешательства, и при процедурах, необходимых для трансплантации органа, сердечно/легочных процедурах шунтирования, реплантации отделенных частей тела, процедурах реконструктивной и косметической хирургии и в других ситуациях, предусматривающих остановку и повторный запуск кровотока. Сама по себе ишемия вызывает множество физиологических изменений, которые сами по себе в конечном счете могут привести к некрозу и гибели клеток и ткани. Реперфузия задает свой собственный набор повреждающих событий, включая образование активных форм кислорода, тромбоз, воспаление и опосредованное цитокинами повреждение. Пути, которые ограничены системой TSP1-CD47, представляют собой именно те, которые будут давать наибольший положительный эффект при борьбе с повреждением от IRI, включая путь с участием NO. Таким образом, блокирование пути с участием TSP1-CD47, как в случае с раскрытыми в данном документе антителами, будет обеспечивать наиболее надежное функционирование этих эндогенных защитных путей. Было показано, что mAb к CD47 снижают повреждение органа на моделях тепловой ишемии почки (Rogers et al. J Am Soc Nephrol. 23: 1538-1550, 2012), ишемически-реперфузионного повреждения печени (Isenberg et al. Surgery. 144: 752-761, 2008), трансплантации почки (Lin et al. Transplantation. 98: 394-401, 2014; Rogers et al. Kidney Interantional. 90: 334-347, 2016)) и трансплантации печени, в том числе форм стеатоза печени, у грызунов (Xiao et al. Liver Transpl. 21: 468-477, 2015; Xiao et al. Transplantation. 100: 1480-1489, 2016). Кроме того, mAb к CD47 вызывало значительное снижение систолического давления в правом желудочке и гипертрофии правого желудочка в монокроталиновой модели легочной артериальной гипертензии (Bauer et al. Cardiovasc Res. 93: 682-693, 2012). Исследования на модели кожного трансплантата показали, что модулирование CD47, в том числе с помощью mAb к CD47, ингибирует опосредованную TSP1 передачу сигнала CD47. Это приводит к повышенной активности пути с участием NO, что приводи в результате к снижению IRI (Maxhimer et al. Plast Reconstr Surg. 124: 1880-1889, 2009; Isenberg et al. Arterioscler Throm Vasc Biol. 27: 2582-2588, 2007; Isenberg et al. Curr Drug Targets. 9: 833-841, 2008; Isenberg et al. Ann Surg. 247: 180-190, 2008).
Также было показано, что mAb к CD47 эффективны в моделях других сердечнососудистых заболеваний. На мышиной модели сердечной недостаточности, обусловленной перегрузкой левого желудочка давлением в результате поперечного стеноза аорты, mAb к CD47 уменьшало гипертрофию кардиомиоцитов, снижало фиброз левого желудочка, предотвращало увеличение массы левого желудочка, снижало жесткость стенок желудочков и нормализовало изменения профиля петли объем-давление (Sharifi-Sanjani et al. J Am Heart Assoc., 2014). mAb к CD47 уменьшало степень выраженности атеросклероза в нескольких мышиных моделях (Kojima et al. Nature., 2016).
Показания рака
В настоящем изобретении раскрыты mAb к CD47 и их антигенсвязывающие фрагменты, эффективные в качестве противораковых терапевтических средств, которые можно вводить, предпочтительно парентерально, пациентам с чувствительными типами гематологического рака и солидными опухолями, включая без ограничения типы лейкоза, включая системный мастоцитоз, острый лимфоцитарный (лимфобластный) лейкоз (ALL), Т-клеточный ALL, острый миелоидный лейкоз (AML), миелогенный лейкоз, хронический лимфоцитарный лейкоз (CLL), хронический миелоидный лейкоз (CML), миелопролиферативное нарушение/неоплазма, моноцитарный лейкоз и плазмоцитарный лейкоз; множественную миелому (ММ); макроглобулинемию Вальденстрема; типы лимфомы, включая гистиоцитарную лимфому и Т-клеточную лимфому, типы В-клеточной лимфомы, включая лимфому Ходжкина и неходжкинскую лимфому, такую как фолликулярная неходжкинская лимфома низкой степени злокачественности (NHL), клеточная лимфома (FCC), лимфома из клеток мантийной зоны (MCL), диффузная крупноклеточная лимфома (DLCL), мелкоклеточная лимфоцитарная (SL) NHL, фолликулярная NHL средней степени злокачественности, диффузная NHL средней степени злокачественности, иммунобластная NHL высокой степени злокачественности, лимфобластная NHL высокой степени злокачественности, NHL из мелких клеток с нерасщепленными ядрами высокой степени злокачественности, NHL с массивным поражением; солидные опухоли, включая рак яичников, рак молочной железы, рак эндометрия, рак толстой кишки (колоректальный рак), рак прямой кишки, рак мочевого пузыря, рак уротелия, рак легкого (немелкоклеточный рак легкого, аденокарцинома легкого, плоскоклеточная карцинома легкого), рак бронхов, рак кости, рак предстательной железы, рак поджелудочной железы, рак желудка, гепатоцеллюлярную карциному (рак печени, гепатому), рак желчного пузыря, рак желчных протоков, рак пищевода, почечно-клеточную карциному, рак щитовидной железы, плоскоклеточную карциному головы и шеи (рак головы и шеи), рак яичек, рак эндокринной железы, рак надпочечника, рак гипофиза, рак кожи, рак мягких тканей, рак кровеносных сосудов, рак головного мозга, рак нервов, рак глаз, рак оболочек головного мозга, рак ротоглотки, рак гортаноглотки, рак шейки матки и рак матки, глиобластому, медуллобластому, астроцитому, глиому, менингиому, гастриному, нейробластому, миелодиспластический синдром, и типы саркомы, включая без ограничения остеосаркому, саркому Юинга, лейомиосаркому, синовиальную саркому, альвеолярную саркому мягких тканей, ангиосаркому, липосаркому, фибросаркому, рабдомиосаркому и хрондросаркому; и меланому.
Лечение рака
Как хорошо известно средним специалистам в данной области техники, комбинированные терапии зачастую используют при лечении рака, поскольку монотерапии или однокомпонентные процедуры могут быть недостаточными для лечения или излечения заболевания или состояния. Традиционные способы лечения рака включают хирургическое вмешательство, лучевую терапию, введение комбинации цитотоксических лекарственных средств для достижения аддитивных или синергических эффектов и комбинаций любых или всех таких подходов. В особенно применимых комбинациях химиотерапевтических и биологических способов терапии используются лекарственные средства, которые действуют за счет разных механизмов действия, повышая контроль или цитолиз раковых клеток, повышая способность иммунной системы контролировать рост раковых клеток, снижая вероятность развития резистентности к лекарственному средству в ходе терапии и сводя к минимуму возможное перекрытие профилей токсичности, позволяя применять уменьшенные дозы отдельных лекарственных средств.
Классы традиционных противоопухолевых/антибластомных средств, применимых в комбинированных терапиях, охватываемых способами по настоящему изобретению, раскрыты, например, в Goodman & Gilman's The Pharmacological Basis of Therapeutics, Twelfth Edition (2010), L.L. Brunton, B.A. Chabner, and В. C. Knollmann Eds., Section VIII, "Chemotherapy of Neoplastic Diseases", Chapters 60-63, pp. 1665-1770, McGraw-Hill, NY, и включают, например, алкилирующие средства, антиметаболиты, натуральные продукты, ряд прочих средств, гормоны и антагонисты, целенаправленно воздействующие лекарственные средства, моноклональные антитела и другие терапевтические средства на основе белка.
В дополнение к вышесказанному, способы по настоящему изобретению относятся к лечению показаний рака и дополнительно включают лечение пациента с помощью хирургического вмешательства, облучения и/или введения пациенту, нуждающемуся в этом, эффективного количества малой химической молекулы или биологического лекарственного средства, включая без ограничения терапевтическое средство на основе пептида, полипептида, белка, нуклеиновой кислоты, традиционно применяемое или находящееся на данный момент на стадии разработки, для лечения состояний, связанных с развитием опухоли. Оно включает антитела и антигенсвязывающие фрагменты, отличные от раскрытых в данном документе, цитокины, антисмысловые олигонуклеотиды, siRNA и miRNA.
Терапевтические способы, раскрытые и заявленные в данном документе, включают применение антител, раскрытых в данном документе, отдельно и/или в комбинациях друг с другом, и/или с их антигенсвязывающими фрагментами по настоящему изобретению, которые связываются с CD47, и/или с конкурентными антителами, также проявляющими соответствующую биологическую/терапевтическую активность, например, во всех возможных комбинациях этих соединений-антител, для достижения наибольшей эффективности лечения.
Кроме того, терапевтические способы по настоящему изобретению также охватывают применение данных антител, их антигенсвязывающих фрагментов, конкурентных антител и их комбинаций дополнительно в комбинации с: (1) любым одним или несколькими противоопухолевыми терапевтическими средствами лечения, выбранными из хирургического вмешательства, облучения, противоопухолевых, антибластомных средств и комбинаций любого из них, или (2) любым одним или несколькими противоопухолевыми биологическими средствами или (3) эквивалентами любого из вышеприведенных (1) или (2), как будет очевидно среднему специалисту в данной области техники, в соответствующей(-их) комбинации(-ях) для достижения требуемого терапевтического эффекта лечения для конкретного показания.
Лекарственные средства на основе антител и малых молекул, которые усиливают иммунный ответ на рак посредством модулирования костимулирующих или ингибирующих взаимодействий, влияющих на ответ Т-клеток на опухолевые антигены, включая ингибиторы иммунных контрольных точек и модуляторы костимулирующих молекул, также представляют особый интерес в контексте комбинированных терапевтических способов, охватываемых в данном документе, и включают, без ограничения, другие антитела к CD47. Введение терапевтических средств, которые связываются с белком CD47, например, антител или малых молекул, которые связываются с CD47 и предотвращают взаимодействие между CD47 и SIRPα, проводят пациенту, что приводит к выведению раковых клеток посредством фагоцитоза. Терапевтические средства, которые связываются с белком CD47, комбинируют с терапевтическим средством, таким как антитело, малая химическая молекула или биологическое лекарственное средство, раскрытое в данном документе, направленное против одной или нескольких дополнительных клеточных мишеней из CD70 (кластер дифференцировки 70), CD200 (мембранный гликопротеин ОХ-2, кластер дифференцировки 200), CD154 (кластер дифференцировки 154, CD40L, лиганд CD40, лиганд кластера дифференцировки 40), CD223 (ген активации лимфоцитов 3, LAG3, кластер дифференцировки 223), KIR (иммуноглобулин-подобные рецепторы клеток-киллеров), GITR (TNFRSF18, глюкокортикоид-индуцированный TNFR-родственный белок, индуцируемый активацией рецептор семейства TNFR, AITR, представитель 18 суперсемейства рецепторов фактора некроза опухоли), CD28 (кластер дифференцировки 28), CD40 (кластер дифференцировки 40, Вр50, CDW40, TNFRSF5, представитель 5 суперсемейства рецепторов фактора некроза опухоли, р50), CD86 (В7-2, кластер дифференцировки 86), CD160 (кластер дифференцировки 160, BY55, NK1, NK28), CD258 (LIGHT, кластер дифференцировки 258, представитель 14 суперсемейства лигандов фактора некроза опухоли, TNFSF14, HVEML, лиганд HVEM, лиганд медиатора проникновения герпесвируса, LTg), CD270 (HVEM, представитель 14 суперсемейства рецепторов фактора некроза опухоли, медиатор проникновения герпесвируса, кластер дифференцировки 270, LIGHTR, HVEA), CD275 (ICOSL, лиганд ICOS, лиганд индуцируемого костимулятора Т-клеток, кластер дифференцировки 275), CD276 (В7-Н3, В7-гомолог 3, кластер дифференцировки 276), OX40L (лиганд ОХ40), В7-Н4 (В7-гомолог 4, VTCN1, ингибитор 1 активации Т-клеток, содержащий домен V-класса), GITRL (лиганд глюкокортикоид-индуцированного рецептора фактора некроза опухоли, лиганд глюкокортикоид-индуцированного TNFR), 4-1BBL (лиганд 4-1ВВ), CD3 (кластер дифференцировки 3, T3D), CD25 (IL2Rα, кластер дифференцировки 25, α-цепь рецептора интерлейкина-2, α-цепь рецептора IL-2), CD48 (кластер дифференцировки 48, маркер активации В-лимфоцитов, BLAST-1, сигнальная молекула активации лимфоцитов 2, SLAMF2), CD66a (Ceacam-1, родственная онкоэмбриональному антигену молекула клеточной адгезии 1, желчный гликопротеин, BGP, BGP1, BGPI, кластер дифференцировки 66а), CD80 (В7-1, кластер дифференцировки 80), CD94 (кластер дифференцировки 94), NKG2A (группа естественных киллеров 2А, представитель 1 подсемейства D лектиноподобных рецепторов клеток-киллеров, KLRD1), CD96 (кластер дифференцировки 96, TActILE, белок активируемый в большом количестве Т-клетками при поздней экспрессии), CD112 (PVRL2, нектин, родственный рецептору полиовируса белок 2, медиатор проникновения герпесвируса В, HVEB, нектин-2, кластер дифференцировки 112), CD115 (CSF1R, рецептор колониестимулирующего фактора 1, рецептор колониестимулирующего фактора макрофагов, M-CSFR, кластер дифференцировки 115), CD205 (DEC-205, LY75, лимфоцитарный антиген 75, кластер дифференцировки 205), CD226 (DNAM1, кластер дифференцировки 226, вспомогательная молекула-1 DNAX, РТА1, антиген 1, способствующий активации тромбоцитов и Т-клеток), CD244 (кластер дифференцировки 244, рецептор 2В4 естественных клеток-киллеров), CD262 (DR5, TrailR2, TRAIL-R2, представитель 10b суперсемейства рецепторов фактора некроза опухоли, TNFRSF10B, кластер дифференцировки 262, KILLER, TRICK2, TRICKB, ZTNFR9, TRICK2A, TRICK2B), CD284 (Toll-подобный рецептор-4, TLR4, кластер дифференцировки 284), CD288 (Toll-подобный рецептор-8, TLR8, кластер дифференцировки 288), TNFSF15 (представитель 15 суперсемейства фактора некроза опухоли, ингибитор роста эндотелия сосудов, VEGI, TL1A), TDO2 (триптофан-2,3-диоксигеназа, ТРН2, TRPO), IGF-1R (инсулиноподобный фактор роста 1 типа), GD2 (дисиалоганглиозид 2), TMIGD2 (белок 2, содержащий трансмембранный и иммуноглобулиновый домен), RGMB (представитель В семейства RGM-домен-содержащих белков), VISTA (содержащий V-домен иммуноглобулина супрессор активации Т-клеток, В7-Н5, В7-гомолог 5), BTNL2 (бутирофилиноподобный белок 2), Btn (семейство бутирофилинов), TIGIT (Т-клеточный иммунорецептор с доменами Ig и ITIM, Vstm3, WUCAM), представители Siglec (связывающие сиаловую кислоту Ig-подобные лектины), нейрофилин, VEGFR (рецептор фактора роста эндотелия сосудов), семейства ILT (LIR, семейство иммуноглобулиноподобных транскриптов, иммуноглобулиноподобные рецепторы лейкоцитов), семейств NKG (семейства группы естественных киллеров, лектиновые трансмембранные рецепторы типа С), MICA (родственная полипептиду МНС класса I последовательность A), TGFP (трансформирующий фактор роста β), пути с участием STING (путь с участием стимулятора гена интерферона), аргиназы (аргининамидиназа, канаваназа, L-аргиназа, аргининтрансамидиназа), EGFRvIII (вариант III рецептора эпидермального фактора роста) и HHLA2 (В7-Н7, В7у, HERV-H LTR-ассоциированный белок 2, В7-гомолог 7), ингибиторов PD-1 (белок 1 программируемой гибели клеток, PD-1, CD279, кластер дифференцировки 279), PD-L1 (В7-Н1, В7-гомолог 1, лиганд 1 белка программируемой гибели, CD274, кластер дифференцировки 274), PD-L2 (B7-DC, лиганд 2 белка программируемой гибели клеток 1, PDCD1LG2, CD273, кластер дифференцировки 273), CTLA-4 (белок 4, ассоциированный с цитотоксическими Т-лимфоцитами, CD152, кластер дифференцировки 152), BTLA (В- и Т-лимфоцитарный аттенюатор, CD272, кластер дифференцировки 272), индоламин-2,3-диоксигеназы (IDO, IDO1), TIM3 (HAVCR2, клеточный рецептор 2 вируса гепатита А, Т-клеточный иммуноглобулин и домен муцина 3, KIM-3, молекула 3, обуславливающая повреждение почки, TIMD-3, Т-клеточный иммуноглобулин и домен муцина 3), аденозинового рецептора А2А (рецептор ADO), CD39 (эктонуклеозидтрифосфатдифосфогидролаза-1, кластер дифференцировки 39, ENTPD1) и CD73 (экто-5'-нуклеотидаза, 5'-нуклеотидаза, 5'-NT, кластер дифференцировки 73), CD27 (кластер дифференцировки 27), ICOS (CD278, кластер дифференцировки 278, индуцируемый костимулятор Т-клеток), CD137 (4-1ВВ, кластер дифференцировки 137, представитель 9 суперсемейства рецепторов фактора некроза опухоли, TNFRSF9), ОХ40 (CD134, кластер дифференцировки 134) и TNFSF25 (представитель 25 суперсемейства рецепторов фактора некроза опухоли), включая антитела, малые молекулы и агонисты, которые также конкретно предусматриваются в данном документе. Дополнительные средства включают IL-10 (интерлейкин-10, фактор ингибирования синтеза цитокинов человека, CSIF) и галектины.
YERVOY® (ипилимумаб; Bristol-Meyers Squibb) является примером одобренного антитела к CTLA-4.
KEYTRUDA® (пембролизумаб; Merck) и OPDIVO® (ниволумаб; Bristol-Meyers Squibb Company) являются примерами одобренных антител к PD-1.
TECENTRIQ™ (атезолизумаб; Roche) является примером одобренного антитела к PD-L1.
Связанные с ишемически-реперфузионным повреждением (IRI), аутоиммунные, аутовоспалительные, воспалительные, сердечно-сосудистые состояния и заболевания
Введение mAb к CD47 или его антигенсвязывающего фрагмента, раскрытых в данном документе, можно применять для лечения ряда заболеваний и состояний, при которых IRI является способствующим признаком, и для лечения различных аутоиммунных, аутовоспалительных, воспалительных и сердечно-сосудистых заболеваний. К ним относятся трансплантация органа, при которой mAb или его антигенсвязывающий фрагмент по настоящему изобретению вводят донору перед забором органа, в забранный донорский орган в растворе для консервации органа, пациенту-реципиенту или любой их комбинации; трансплантация кожи; хирургические резекции или реконструкция тканей, при которых такое mAb или его фрагмент вводят пациенту либо локально путем инъекции в пораженную ткань, либо парентерально; реплантация частей тела; лечение травматического повреждения; легочной гипертензии; легочной артериальной гипертензии; серповидноклеточной анемии (кризиса); инфаркта миокарда; нарушения мозгового кровообращения; инсульта; ишемии, вызванной хирургическим вмешательством; острого повреждения почек/почечной недостаточности; любого другого состояния, при котором IRI имеет место и вносит вклад в патогенез заболевания; аутоиммунных и воспалительных заболеваний, включая артрит, ревматоидный артрит, рассеянный склероз, псориаз, псориатический артрит, болезнь Крона, воспалительное заболевание кишечника, язвенный колит, волчанку, системную красную волчанку, ювенильный ревматоидный артрит, ювенильный идиопатический артрит, болезнь Грейвса, тиреоидит Хашимото, болезнь Аддисона, целиакию, дерматомиозит, рассеянный склероз, тяжелую миастению, пернициозную анемию, синдром Шегрена, диабет I типа, васкулит, увеит и анкилозирующий спондилит; аутовоспалительных заболеваний, включая семейную средиземноморскую лихорадку, младенческое мультисистемное воспалительное заболевание, периодический синдром, ассоциированный с мутацией гена рецептора фактора некроза опухоли (TNF), дефицит антагониста рецептора интерлейкина-1, болезнь Бехчета; сердечно-сосудистых заболеваний, включая коронарное заболевание сердца, заболевание коронарных артерий, атеросклероз, инфаркт миокарда, сердечную недостаточность и левожелудочковую сердечную недостаточность.
mAb к CD47 и их антигенсвязывающие фрагменты по настоящему изобретению также можно применять для повышения тканевой перфузии у субъекта, нуждающегося в таком лечении. Таких субъектов можно идентифицировать с помощью диагностических процедур, показывающих необходимость повышенной тканевой перфузии. Кроме того, необходимость повышенной тканевой перфузии может возникнуть вследствие того, что субъект перенес, переносит или будет переносить хирургическое вмешательство, выбранное из хирургического вмешательства на наружных покровах, хирургического вмешательства на мягких тканях, хирургического вмешательства на составных тканях, хирургического вмешательства с целью трансплантации кожи, резекции цельного органа, хирургического вмешательства с целью трансплантации органа или реплантации конечности или другой части тела.
Лечение связанных с ишемически-реперфузионным повреждением (IRI) показаний
Способы по настоящему изобретению, например, относящиеся к лечению связанных с IRI показаний, могут дополнительно включать введение пациенту, нуждающемуся в этом, эффективного количества терапевтического средства, которое связывается с белком CD47, и донора, предшественника оксида азота или и того, и другого; местного средства, образующего оксид азота; средства, которое активирует растворимую гуанилилциклазу; средства, которое ингибирует фосфодиэстеразы циклических нуклеотидов; или любой комбинации любого из вышеперечисленных.
В данных способах донор или предшественник оксида азота может быть выбран из газообразного N0, изосорбида динитрата, нитрита, нитропруссида, нитроглицерина, 3-морфолиносиднонимина (SIN-1), 8-нитрозо-N-ацетилпеницилламина (SNAP), диэтилентриамина/NO (DETA/NO), S-нитрозотиолов, Bidil® и аргинина.
Средство, которое активирует растворимую гуанилилциклазу, может представлять собой отличный от химического активатора на основе NO (оксида азота) химический активатор растворимой гуанилилциклазы, которая повышает уровни cGMP в клетках сосудов. Такие средства связывают растворимую гуанилилциклазу в участке, отличном от NO-связывающего мотива, и активируют фермент независимо от локального NO или стресса, оказываемого активными формами кислорода (ROS). Неограничивающие примеры химических активаторов растворимой гуанилилциклазы включают органические нитраты (Artz et al. (2002) J. Biol. Chem. 277:18253-18256); протопорфирин IX (Ignarro et al. (1982) Proc. Natl. Acad. Sci. USA 79:2870-2873); YC-1 (Ko et al. (1994) Blood 84:4226-4233); BAY 41-2272 и BAY 41-8543 (Stasch et al. (2001 Nature 410 (6825): 212-5), CMF-1571 и A-350619 (обзор приведен в Evgenov et al. (2006) Nat. Rev. Drug. Discov. 5:755-768); BAY 58-2667 (Cinaciguat; Frey et al. (2008) Journal of Clinical Pharmacology 48 (12): 1400-10); BAY 63-2521 (Riociguat; Mittendorf et al. (2009) Chemmedchem 4 (5): 853-65). Дополнительные активаторы растворимой гуанилилциклазы раскрыты в Stasch et al. (2011) Circulation 123:2263-2273; Derbyshire and Marietta (2012) Ann. Rev. Biochem. 81:533-559 и Nossaman et al. (2012) Critical Care Research and Practice, том 2012, ID статьи 290805, С. 1-12.
Средство, которое ингибирует фосфодиэстеразы циклических нуклеотидов, может быть выбрано из тадалафила, варденафила, уденафила, силденафила и аванафила.
Лечение аутоиммунных, аутовоспалительных, воспалительных заболеваний и сердечно-сосудистых заболеваний
Терапевтическое средство, которое связывается с белком CD47, для лечения аутоиммунного, аутовоспалительного, воспалительного заболевания и/или сердечнососудистого заболевания можно комбинировать с одним или несколькими терапевтическими средствами, такими как антитело, химическая малая молекула или биологическая, или медицинская, или хирургическая процедура, которые включают без ограничения приведенное ниже. Для лечения аутоиммунных, аутовоспалительных и воспалительных заболеваний комбинированные терапевтические средства представляют собой следующие: гидроксихлорохин, лефлуномид, метотрексат, миноциклин, сульфасалазин, абатацепт, ритуксимаб, тоцилизумаб, ингибиторы или блокаторы TNF (адалимумаб, этанерцепт, инфликсимаб, цертолизумаб пегол, голимумаб), нестероидные противовоспалительные лекарственные средства, глюкокортикоиды, кортикостероиды, иммуноглобулин для внутривенного применения, анакинра, канакинумаб, рилонацепт, циклофосфамид, микофенолята мофетил, азатиоприн, 6-меркаптопурин, белимумаб, бета-интерфероны, ацетат глатирамера, диметилфумарат, финголимод, терифлуномид, натализумаб, 5-аминосалициловая кислота, мезаламин, циклоспорин, такролимус, пимекролимус, ведолизумаб, устекинумаб, секукинумаб, иксекизумаб, апремиласт, будезонид и тофацитиниб. Для лечения атеросклероза комбинированные терапевтические средства или процедуры представляют собой следующие: медицинские процедуры и/или хирургическое вмешательство, включая чрескожное коронарное вмешательство (коронарная ангиопластика и стентирование), шунтирование коронарной артерии и каротидную эндартерэктомию; терапевтические средства, включая ингибиторы ангиотензинпревращающего фермента (АСЕ) (включая рамиприл, хинаприл, каптоприл и эналаприл), блокаторы кальциевых каналов (включая амлодипин, нифедипин, верапамил, фелодипин и дилтиазем), блокаторы рецепторов ангиотензина (включая эпосартан, олмесартен, азилсартан, валсартан, телмисартан, лозартан, кандесартан и ирбесартан), комбинацию эзетимиба и симвастатина, ингибиторы PCSK9 (включая алирокумаб и эволокумаб), анацетрапиб и ингибиторы HMG-CoA (включая аторвастатин, правастатин, симвастатин, розувастатин, питавастатин, ловастатин и флувастатин). Для лечения сердечной недостаточности комбинированные терапевтические средства представляют собой следующие: ингибиторы АСЕ, блокаторы рецепторов ангиотензина, ингибиторы рецепторов ангиотензина-неприлизина (включая комбинацию сакубитрила и валсартана), диуретики, дигоксин, инотропы, бета-блокаторы и антагонисты альдостерона. Для лечения легочной гипертензии комбинированные терапевтические средства представляют собой следующие: силденафил, тадалафил, амбрисентан, босентан, мацитентан, риоцигуат, трепростинил, эпопростенол, илопрост и селексипаг.
Как раскрыто в данном документе, mAb к CD47 вводят до, одновременно или после введения комбинированных терапевтических средств или осуществления медицинских или хирургических процедур.
Другой применимый класс соединений для комбинированных терапий, предусмотренных в данном документе, включает модуляторы связывания SIRPα/CD47, такие как антитела к SIRPα, а также растворимые белковые фрагменты этого лиганда или CD47 сам по себе, которые ингибируют связывание SIRPα с CD47 или препятствуют ему. Следует отметить, что охватываемые в данном документе терапевтические способы включают в себя применение антител, раскрытых в данном документе, отдельно, в комбинации друг с другом и/или также с их антигенсвязывающими фрагментами, например, во всех возможных комбинациях этих соединений-антител.
Примеры иллюстрируют различные варианты осуществления настоящего изобретения, но не должны рассматриваться как ограничивающие настоящее изобретение лишь такими конкретно раскрытыми вариантами осуществления.
Диагностика экспрессии CD47
Диагностика (в том числе дополнительная и сопутствующая) была предметом внимания в области онкологии. Был разработан ряд диагностических анализов для целенаправленно воздействующих терапевтических препаратов, таких как герцептин (Genentech), тарцева (OSI Pharmaceuticals/Genentech), пресса (Astra Zeneca) и эрбитукс (Imclone/Bristol Myers Squibb). Антитела mAb к CD47 по настоящему изобретению особенно хорошо подходят для использования в диагностических применениях. Соответственно, в настоящем изобретении предусмотрен способ измерения экспрессии CD47 на опухолевых и/или иммунных клетках с применением mAb к CD47 по настоящему изобретению.
mAb к CD47 по настоящему изобретению можно применять в диагностическом анализе и/или способе in vitro для измерения экспрессии CD47 на опухолевых и/или иммунных клетках, присутствующих в образце опухоли от пациента. В частности, mAb к CD47 по настоящему изобретению могут связывать CD47 на примерно 1% или более опухолевых и/или иммунных клеток, присутствующих в образце от пациента, по сравнению с эталонным уровнем. В другом варианте осуществления mAb к CD47 могут связывать CD47 на примерно 5% или более опухолевых и/или иммунных клеток в образце от пациента по сравнению с эталонным уровнем, например, или связывать по меньшей мере 10%, или по меньшей мере 20%, или по меньшей мере 30%, или по меньшей мере приблизительно 40%, или по меньшей мере приблизительно 50%, или по меньшей мере приблизительно 60%, или по меньшей мере приблизительно 70%, или по меньшей мере приблизительно 80%, или по меньшей мере приблизительно 90%, или 10-100% по сравнению с эталонным уровнем. В еще одном варианте осуществления mAb к CD47 могут связывать CD47 на опухолевых и/или иммунных клетках в образце от пациента на уровне, по меньшей мере в приблизительно 2 раза превышающем эталонный уровень, или по меньшей мере в приблизительно 3 раза, или по меньшей мере в приблизительно 4 раза, или по меньшей мере в приблизительно 5 раз, или по меньшей мере в приблизительно 10 раз, или в 2-10 раз или более превышающем эталонный уровень. Как описано в данном документе, измерение экспрессии CD47 в образце от пациента обеспечивает биологическую и/или клиническую информацию, которая позволяет принимать решение по разработке и применению потенциальной лекарственной терапии, а именно по применению антител к CD47 для лечения солидных и гематологических типов рака, аутоиммунного заболевания, воспалительного заболевания, атеросклероза, сердечной недостаточности, при которых рецептор CD47 играет определенную роль.
В одном варианте осуществления способ in vitro предусматривает получение образца от пациента, приведение образца от пациента в контакт с моноклональным антителом или его антигенсвязывающим фрагментом, которые специфически связываются с эпитопом в пределах последовательности под SEQ ID NO: 66, и осуществление анализа в отношении связывания антитела с образцом от пациента, где связывание антитела с образцом от пациента является диагностическим показателем экспрессии CD47 в образце от пациента.
В другом варианте осуществления предпочтительные антитела к CD47 или их антигенсвязывающие фрагменты, в случае способа in vitro, представляют собой таковые, которые содержат комбинацию из тяжелой цепи (НС) и легкой цепи (LC), перечисленных из комбинации:
(i) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 102, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 101;
(ii) тяжелой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 104, и легкой цепи, содержащей аминокислотную последовательность под SEQ ID NO: 103;
где аминокислотная последовательность VH на по меньшей мере 90%, 95%, 97%, 98%
или 99% идентична им, и аминокислотная последовательность VL на по меньшей мере 90%, 95%, 97%, 98% или 99% идентична им.
Соответственно, диагностический анализ в соответствии с настоящим изобретением может предусматривать приведение в контакт опухолевых и/или иммунных клеток в образце от пациента с mAb к CD47 или его антигенсвязывающим фрагментом, и осуществление анализа в отношении связывания mAb к CD47 с образцом опухоли от пациента, где связывание mAb к CD47 с образцом от пациента является диагностическим показателем экспрессии CD47. Предпочтительно, образец от пациента представляет собой образец, содержащий опухолевые клетки. В данном случае связывание mAb к CD47 по настоящему изобретению или его антигенсвязывающего фрагмента с опухолевыми клетками можно оценить в отношении экспрессии CD47. Уровни экспрессии CD47 опухолевыми клетками и/или иммунными клетками в образце опухоли от пациента могут быть прогностическими показателями клинического исхода у пациента.
Повышенное связывание mAb к CD47, связывающихся с клетками в образце от пациента, ассоциировано с повышенной экспрессией CD47. В одном варианте осуществления mAb к CD47 по настоящему изобретению могут связываться с примерно 5% или более опухолевых клеток в образце от пациента, и это может указывать на то, что пациент получит пользу от быстрого вмешательства в отношении солидного и гематологического рака. Диагностический анализ такого рода можно применять для определения подходящих схем лечения для солидных и гематологических типов рака, характеризующихся относительно высоким связыванием mAb к CD47 по настоящему изобретению, т.е. повышенной экспрессией CD47.
Следует принять во внимание, что раскрытый в данном документе диагностический анализ имеет ряд преимуществ. Наиболее важным из этих преимуществ является то, что диагностический анализ по настоящему изобретению может предоставить пользователю большую уверенность в экспрессии CD47 на опухолевых и/или иммунных клетках. Повышенная чувствительность диагностического анализа по настоящему изобретению позволяет обнаруживать CD47 в образце от пациента при более низких уровнях, чем это было ранее.
mAb к CD47 по настоящему изобретению можно применять в качестве средств для диагностического анализа в отношении многих форм рака. Конкретные формы рака, которые можно успешно исследовать в отношении экспрессии CD47, включают чувствительные гематологические типы рака и солидные опухоли, включая без ограничения типы лейкоза, типы лимфомы и солидные опухоли.
В диагностических анализах по настоящему изобретению можно использовать любые подходящие средства для обнаружения связывания mAb к CD47 для измерения экспрессии CD47. Подходящие способы можно выбирать с учетом характера любого репортерного фрагмента, применяемого в качестве метки mAb к CD47 по настоящему изобретению. Подходящие методики включают проточную цитометрию, и форматы твердофазного иммуноферментного анализа (ELISA), и анализы с использованием наночастиц, но никоим образом не ограничиваются ими. Особенно предпочтительно, чтобы диагностический анализ по настоящему изобретению включал иммуногистохимическое исследование, при котором образец опухоли подвергают воздействию mAb к CD47 по настоящему изобретению, и уровень мечения клеток оценивают с помощью иммуногистохимического исследования.
ПРИМЕРЫ
Пример 1
Аминокислотные последовательности
CDR легкой цепи

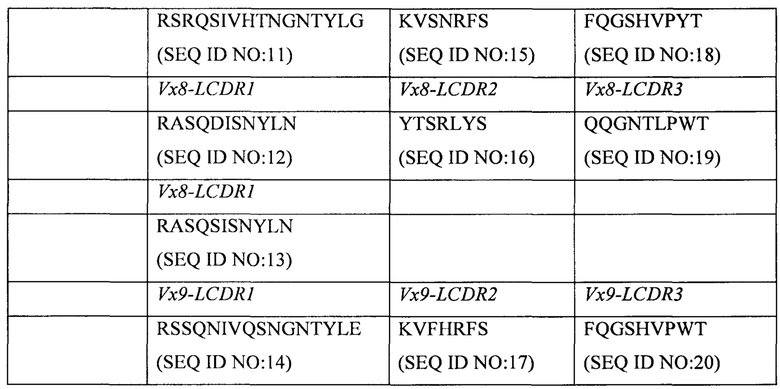

Вариабельные домены легкой цепи мыши
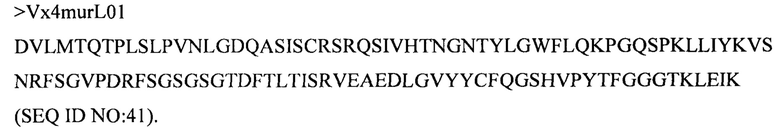
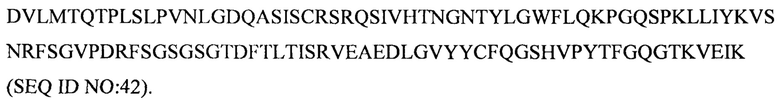
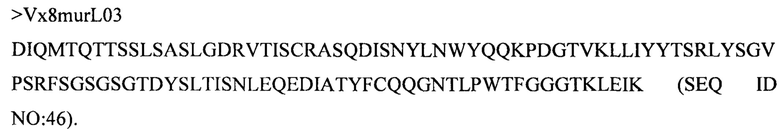
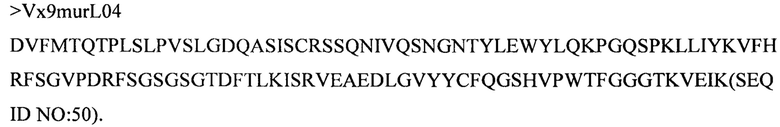
Вариабельные домены тяжелой цепи мыши
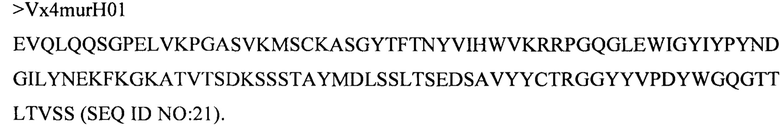
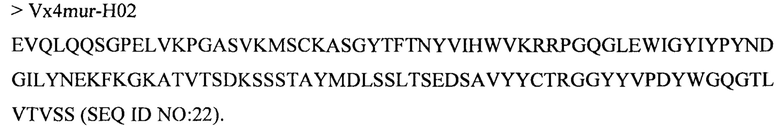
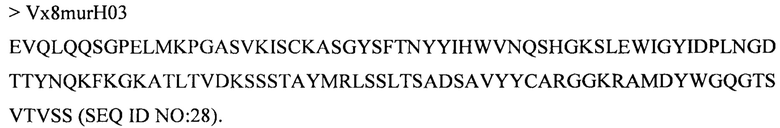
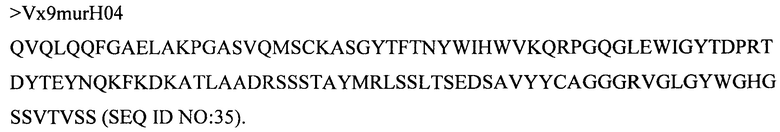
Вариабельные домены легкой цепи человека

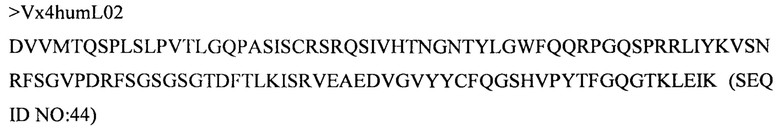
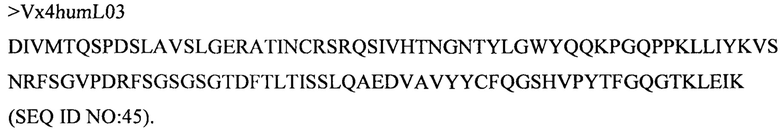
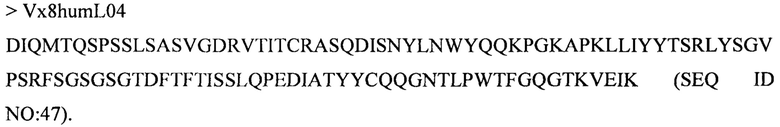
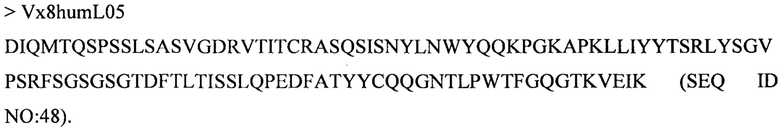
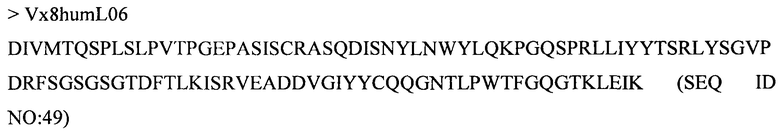
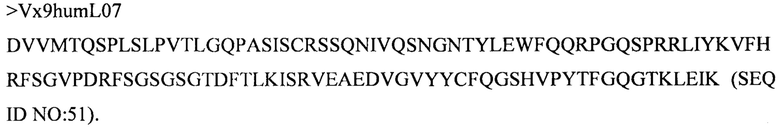
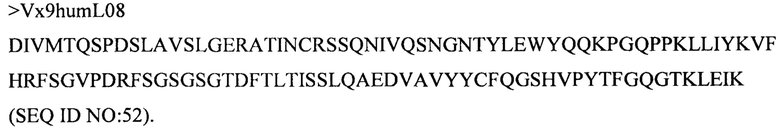
Вариабельные домены тяжелой цепи человека
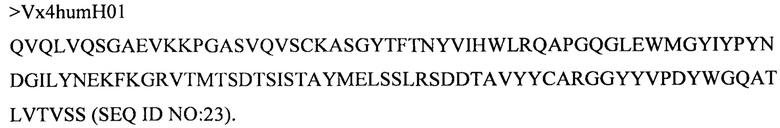
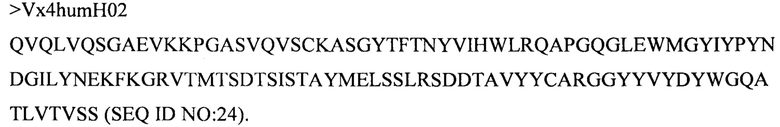
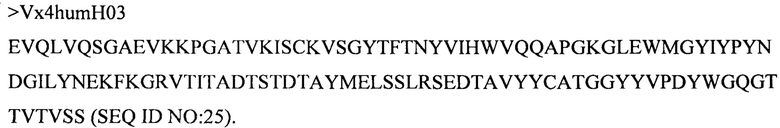
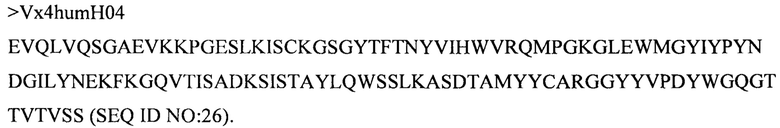
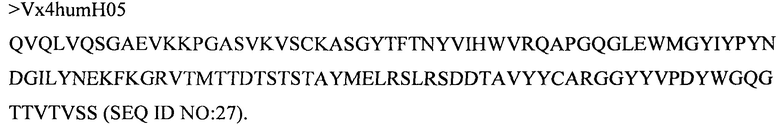

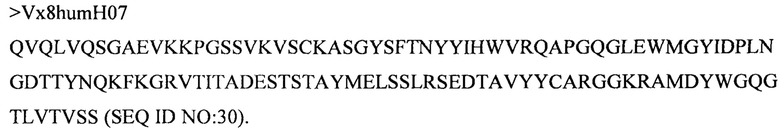
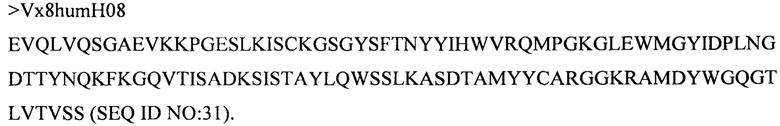
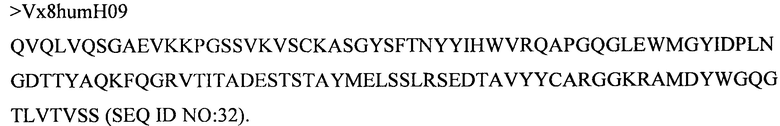
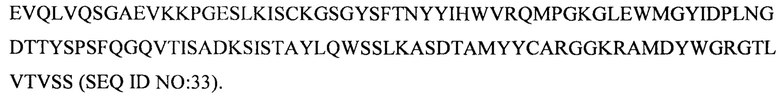
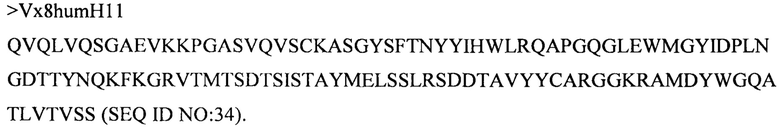
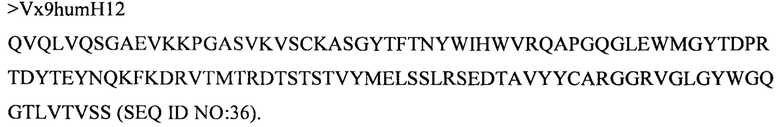
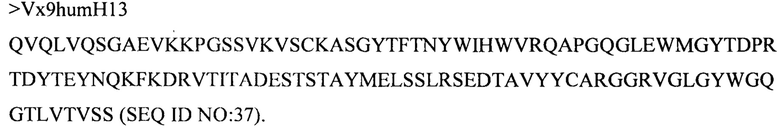
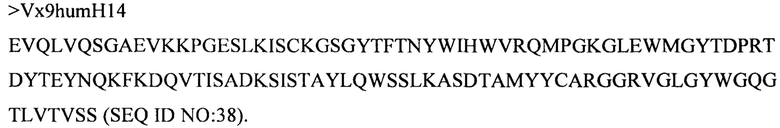
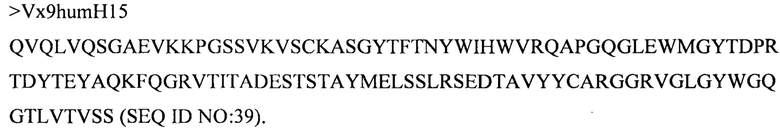
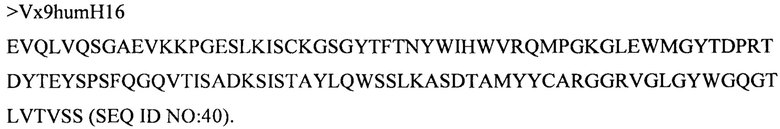
Fc IgG человека

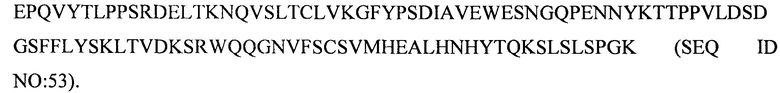








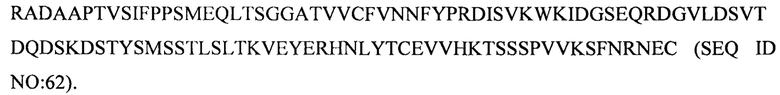
Fc IgG кролика



Химерные легкие цепи и легкие цепи человека


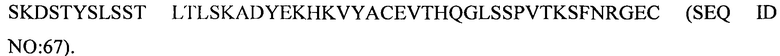





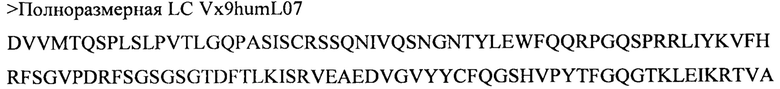




Химерные тяжелые цепи и тяжелые цепи человека

















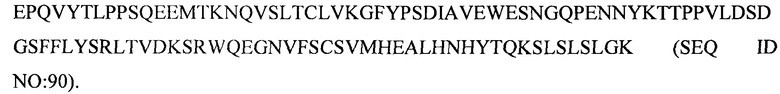












Пример 2
Получение антител к CD47
Химерные антитела, раскрытые в данном документе, содержат вариабельный домен тяжелой цепи мыши и вариабельный домен легкой цепи в комбинации с каппа-цепью человека или константными доменами Fc IgG1, IgG1-N297Q, IgG2, IgG4, IgG4 S228P и IgG4 РЕ человека соответственно. Они были разработаны таким образом, чтобы включать сигнал секреции, и их клонировали в систему экспрессии у млекопитающих и трансфицировали в клетки СНО для получения химерных антител (мыши-человека). Химерные варианты экспрессировались в виде полноразмерных молекул IgG, секретиро вались в среду, и их очищали с применением белка А.
В силу этого гуманизированные антитела, раскрытые в данном документе, содержали каркасные участки, полученные из генома человека. Набор охватывал разнообразие, обнаруживаемое в последовательностях эмбриональной линии человека, что обеспечивало получение функционально экспрессируемых антител in vivo. Определяющие комплементарность области (CDR) в вариабельных областях легкой и тяжелой цепи антител мыши и химерных антител (мыши-человека) описаны в данном документе, и их определяли с помощью следующих общепринятых правил, раскрытых в "Protein Sequence and Structure Analysis of Antibody Variable Domains", в Antibody Engineering Lab Manual, eds. S. Duebel and R. Kontermann, Springer-Verlag, Heidelberg (2001)). Затем разрабатывали вариабельные домены легкой цепи человека. Затем гуманизированные вариабельные домены объединяли с сигналом секреции и каппа-цепью человека и константными доменами Fc IgG1, IgG1-N297Q, IgG2, IgG3, IgG4 S228P и IgG4 РЕ человека, клонировали в систему экспрессии у млекопитающих и трансфицировали в клетки СНО для получения гуманизированных mAb. Гуманизированные варианты экспрессировались в виде полноразмерных молекул IgG, секретировались в среду, и их очищали с применением белка А.
Негликолизированную версию (IgG1-N297Q) создавали с помощью сайт-направленного мутагенеза положения 297 в тяжелой цепи для замены аспарагина на глутамин (Fc IgG1-N297Q человека, SEQ ID NO: 54). Вариант IgG4 создавали с помощью сайт-направленного мутагенеза положения 228 для замены серина на пролин, предотвращая, тем самым, обмен Fab-плечами in vivo. Двойной мутант IgG4 создавали с помощью сайт-направленного мутагенеза положений 228 (серин на пролин) и 235 (лейцин на глутамат) для предотвращения обмена Fab-плечами и для дополнительного снижения Fc-эффекторной функции. Изотипы IgG2, IgG3, IgG4 S228P и IgG4 РЕ конструировали путем клонирования вариабельного домена тяжелой цепи в рамку считывания с константными доменами IgG2, IgG3, IgG4 S228P и IgG4PE человека (Fc IgG2 человека, SEQ ID NO: 55; Fc IgG3 человека, SEQ ID NO: 56; Fc IgG4 S228P человека SEQ ID NO: 58 и Fc IgG4 РЕ человека, SEQ ID NO: 59).
Пример 3
Связывание моноклональных антител (mAb) с CD47
Связывание химерных антител (мыши-человека) и гуманизированных антител по настоящему изобретению определяли с помощью ELISA с применением клеток OV10, трансфицированных CD47 человека (OV10 hCD47), или с применением свежевыделенных эритроцитов человека (hRBC), на поверхности которых находится CD47 (Kamel et al. (2010) Blood. Transfus. 8(4):260-266).
Показатели активности связывания химерных (мыши-человека) и гуманизированных mAb VLX4, VLX8 и VLX9 определяли с помощью анализа ELISA с применением клеток OV10 hCD47 человека, экспрессирующих на клеточной поверхности CD47 человека. Клетки OV10 hCD47 выращивали в среде IMDM, содержащей 10% термоинактивированной фетальной бычьей сыворотки (BioWest; SO 1520). За один день до анализа 3×104 клеток высевали в 96-луночные планшеты CellBIND (Corning №3300, VWR №66025-626), и к моменту проведения анализа они достигали 95-100% конфлюэнтности. Клетки промывали и различные концентрации очищенных антител в IMDM 37°С добавляли на 1 ч. в атмосфере 95% O2/5% CO2. Затем клетки промывали средой и инкубировали в течение дополнительного часа при 37°C с меченным HRP вторичным антителом к антителу человека (Promega), разбавленным в среде из расчета 1/2500. Клетки трижды промывали с помощью PBS и добавляли субстрат для пероксидазы, 3,3',5,5'-тетраметилбензидин (Sigma; № по каталогу Т4444). Реакции останавливали добавлением HCl до 0,7 н. концентрации и определяли поглощение при 450 нм с применением планшет-ридера модели Infinite М200 от Tecan. Показатели кажущейся аффинности связывания этих клонов с клетками OV10 hCD47 человека определяли путем нелинейной аппроксимации (программное обеспечение GraphPad Prism).
Показатели активности связывания химерных (мыши-человека) и гуманизированных mAb VLX4, VLX8 и VLX9 с CD47 человека на hRBC также определяли с применением проточной цитометрии. hRBC инкубировали в течение 60 мин. при 37°C с различными концентрациями химерных или гуманизированных антител в растворе фосфатно-солевого буфера, pH 7,2, 2,5 мМ EDTA (PBS+E). Затем клетки промывали с помощью холодного PBS+E и инкубировали в течение дополнительного часа на льду с меченным FITC антителом осла к антителу человека (Jackson Immuno Research Labs, Вест-Гроув, Пенсильвания; № по каталогу 709-096-149) в PBS +E. Клетки промывали с помощью PBS+E, связывание антитела анализировали с применением проточного цитометра С6 Accuri (Becton Dickinson) и показатели кажущейся аффинности связывания определяли путем нелинейной аппроксимации (программное обеспечение GraphPad Prism) медианных значений интенсивности флуоресценции при различных концентрациях антитела.
Все химерные (мыши-человека) mAb VLX4 связывались с опухолевым клетками OV10 hCD47 человека при показателях кажущейся аффинности в диапазоне пикомолярных (пМ) значений (таблица 1).
Аналогично, гуманизированные mAb VLX4 связывались с опухолевыми клетками OV10 hCD47 человека зависимым от концентрации образом (ФИГ. 1А и ФИГ. 1В) при показателях кажущейся аффинности, варьирующих в диапазоне от пикомолярных до небольших наномолярных значений (таблица 2).
Все химерные mAb VLX4 связывались с RBC человека при значениях кажущейся Kd в диапазоне пикомолярных значений, и они были аналогичны значениям Kd, полученным для опухолевых клеток OV10 hCD47 с помощью ELISA (таблица 1).
Гуманизированные mAb VLX4, VLX4hum_01 IgG1 N297Q, VLX4hum_02 IgG1 N297Q, VLX4hum_01 IgG4 PE, VLX4hum_02 IgG4 PE, VLX4hum_12 IgG4 РЕ и VLX4hum_13 IgG4, связывались с RBC человека при значениях Kd, аналогичных значениям, полученным для опухолевых клеток OV10 hCD47, тогда как VLX4hum_06 IgG4 РЕ и VLX4hum_07 IgG4 РЕ проявляли сниженное связывание с hRBC (ФИГ. 2А, ФИГ. 2В и таблица 2). Такое различное связывание гуманизированных mAb с опухолевыми клетками и RBC было неожиданным, поскольку химерное mAb VLX4 IgG4PE связывалось при аналогичных значениях кажущейся Kd как с CD47 на опухолевых клетках, так и на RBC (таблица 1).
Как показано в таблице 1, все химерные mAb (мыши-человека) VLX8 связывались с опухолевыми клетками OV10 hCD47 человека зависимым от концентрации образом при показателях кажущейся аффинности в диапазоне пикомолярных (пМ) значений.
Аналогично, гуманизированные mAb VLX8 связывались с опухолевыми клетками OV10 hCD47 человека зависимым от концентрации образом (ФИГ. 3А и ФИГ. 3В) при показателях кажущейся аффинности в диапазоне пикомолярных значений (таблица 2).
Все химерные mAb VLX8 связывались с hRBC при значениях кажущейся Kd в диапазоне пикомолярных значений, и они были аналогичны значениям Kd, полученным для опухолевых клеток OV10 hCD47 с помощью ELISA (таблица 1).
Гуманизированные mAb VLX8, VLX8hum_01 IgG4 РЕ, VLX8hum_02 IgG4 РЕ, VLX8hum_03 IgG4 РЕ, VLX8hum_04 IgG4 РЕ, VLX8hum_05 IgG4 РЕ и VLX8hum_06 IgG4 РЕ, VLX8hum_07 IgG4 РЕ, VLX8hum_08 IgG4 РЕ, VLX8hum_09 IgG4 РЕ, VLX8hum_11 IgG4 РЕ, VLX8hum_06 IgG2, VLX8hum_07 IgG2, VLX8hum_08 IgG2 и VLX8hum_09 IgG2, связывались с RBC человека при значениях Kd, аналогичных значениям, полученными для опухолевых клеток OV10 hCD47, тогда как VLX8hum_10 IgG4 РЕ проявлял сниженное, но измеримое связывание с hRBC (ФИГ. 4А, ФИГ. 4В и таблица 2). Такое различное связывание гуманизированных mAb с опухолевыми клетками и RBC было неожиданным, поскольку химерное mAb VLX8 IgG4PE связывалось при аналогичных значениях кажущейся Kd как с CD47 на опухолевых клетках, так и на RBC (таблица 1).
В таблице 1 показаны показатели кажущейся аффинности связывания химерных mAb мыши-человека VLX9 с клетками OV10 hCD47 человека и с RBC человека. Все химерные mAb связывались с опухолевыми клетками OV10 hCD47 при значениях кажущейся Kd в диапазоне пикомолярных значений. Аналогично, гуманизированные mAb VLX9 связывались с опухолевыми клетками OV10 hCD47 человека зависимым от концентрации образом (ФИГ. 5А и ФИГ. 5В) при показателях кажущейся аффинности в диапазоне от пикомолярных до наномолярных значений (таблица 2).
Все химерные mAb VLX9 связывались с hRBC при значениях кажущейся Kd в диапазоне пикомолярных значений, и они были аналогичны значениям Kd, полученным для опухолевых клеток OV10 hCD47 с помощью ELISA (таблица 1). В отличие от химерных mAb гуманизированные mAb VLX9, VLX9hum_01 IgG2, VLX9hum_02 IgG2 и VLX9hum_07 IgG2, проявляли сниженное, но измеримое связывание с RBC человека (ФИГ. 6, таблица 2). Гуманизированные mAb VLX9hum_03, 04, 05, 06, 08, 09 и 10 IgG2 характеризовались не измеримым связыванием с RBC (таблица 2). Такое различное связывание гуманизированных mAb с опухолевыми клетками и RBC было неожиданным, поскольку все химерные mAb VLX9 IgG2 связывались при аналогичных значениях кажущейся Kd как с CD47 на опухолевых клетках, так и па RBC (таблица 1).
Таблица 1. Связывание химерных (xi) mAb VLX4, VLX8 и VLX9 с клетками OV10 hCD47 и эритроцитами человека (hRBC)
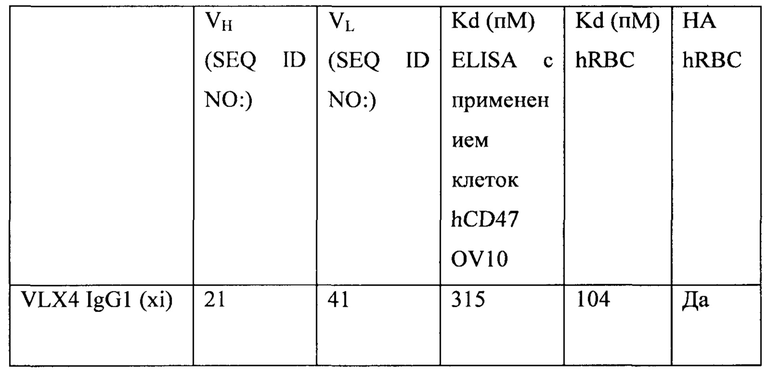
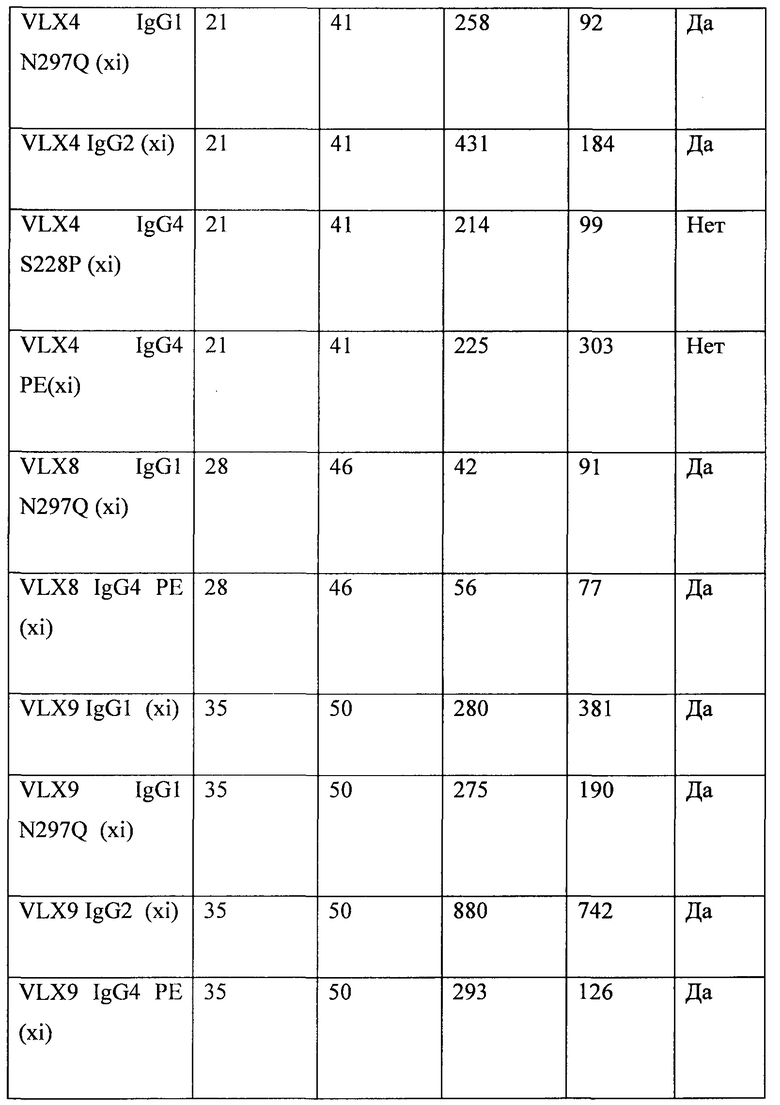

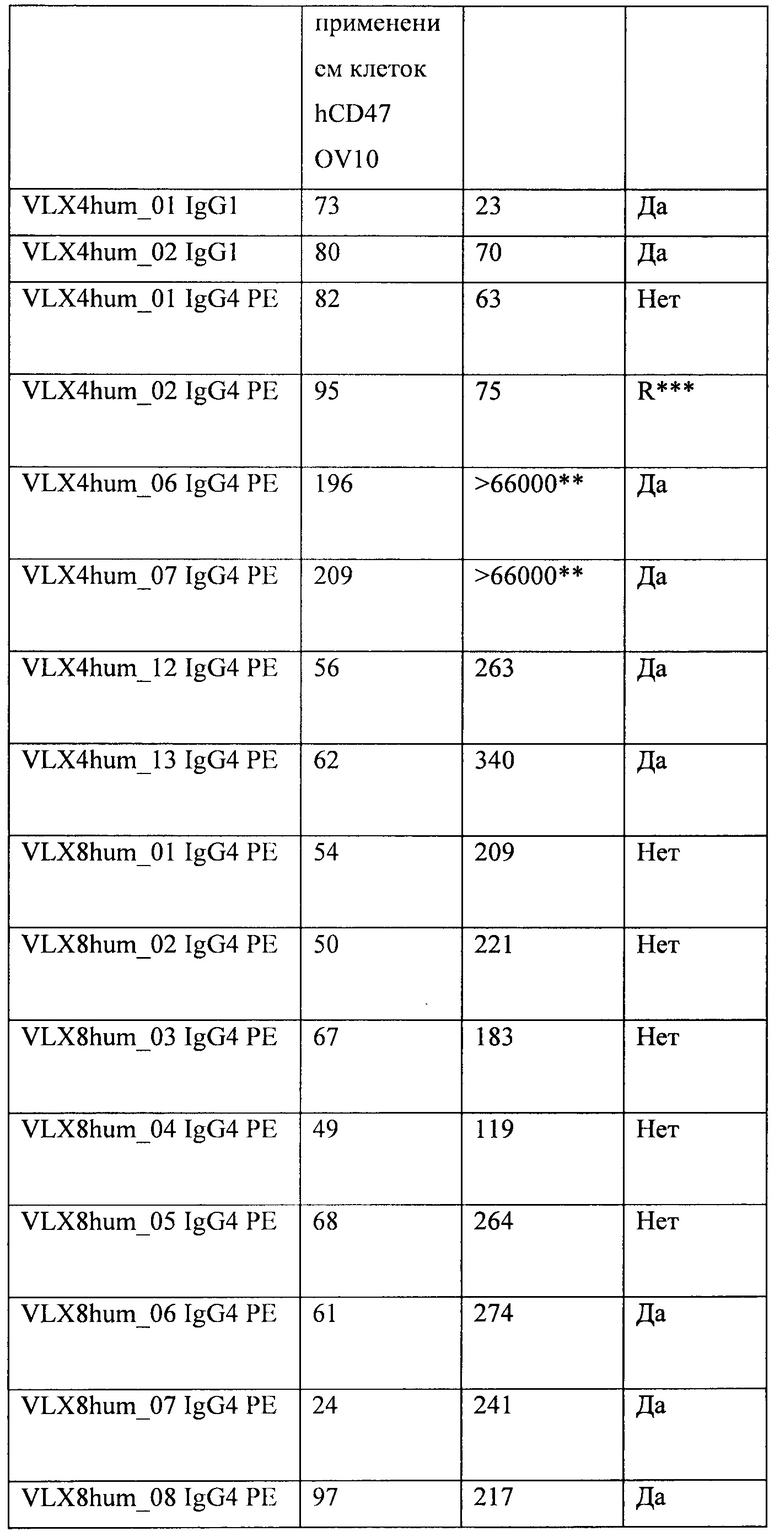
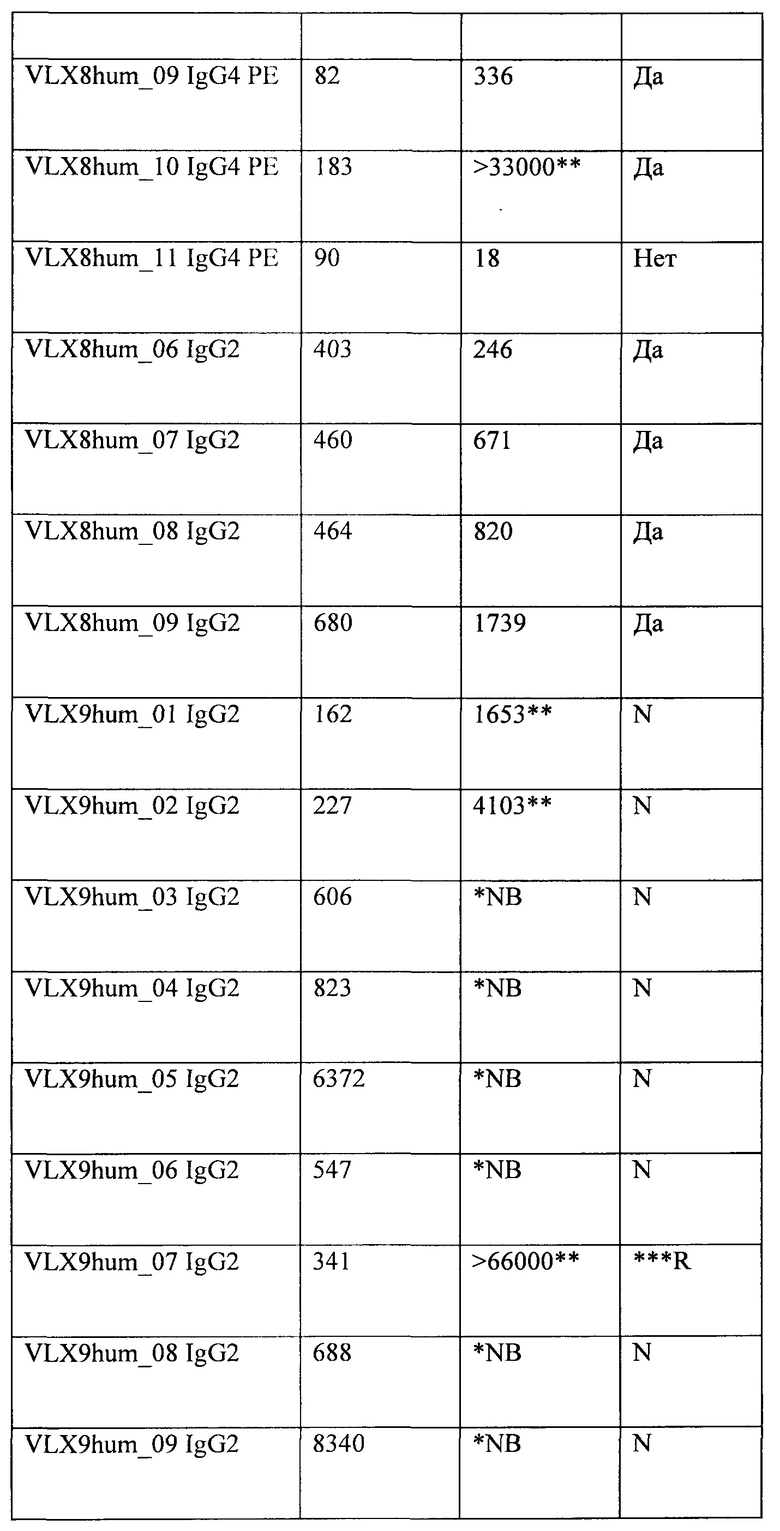

Перекрестное связывание гуманизированных mAb VLX4, VLX8 и VLX9 с молекулами других видов определяли с применением проточной цитометрии. RBC мыши, крысы, кролика или яванского макака инкубировали в течение 60 мин. при 37°C с различными концентрациями гуманизированных антител в растворе фосфатно-солевого буфера, pH 7,2, 2,5 мМ EDTA (PBS+E). Затем клетки промывали с помощью холодного PBS+E и инкубировали в течение дополнительного часа на льду с меченным FITC антителом осла к антителу человека (Jackson Immuno Research Labs, Вест-Гроув, Пенсильвания; № по каталогу 709-096-149) в PBS +E. Клетки промывали с помощью PBS+E и связывание антитела анализировали с применением проточного цитометра С6 Accuri (Becton Dickinson).
В таблице 3 показаны показатели кажущейся аффинности связывания гуманизированных mAb VLX4 и VLX8 с RBC от мыши, крысы и яванского макака, которые определены путем нелинейной аппроксимации (программное обеспечение GraphPad Prism) медианных значений интенсивности флуоресценции при различных концентрациях антитела. Эти данные показывают, что гуманизированные mAb VLX4 и VLX8 связываются с RBC мыши, крысы, кролика (данные не показаны) и яванского макака при значениях кажущейся Kd в диапазоне от пикомолярных до наномолярных значений (таблица 4).
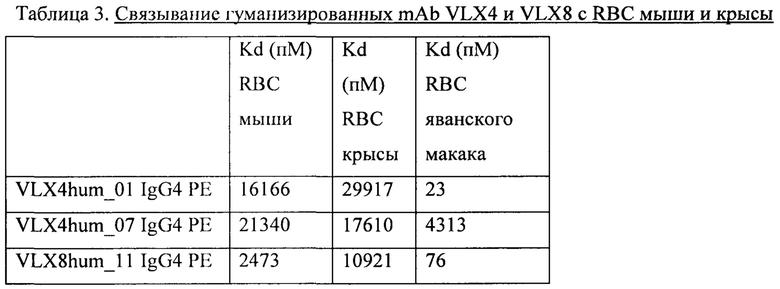
Пример 4
Антитела к CD47 блокируют связывание CD47/SIRPα
Для оценки эффекта гуманизированных mAb к CD47 в отношении связывания CD47 с SIRPα in vitro использовали следующий способ, основанный на связывании флуоресцентно меченного слитого белка SIRPα-Fc с Т-клетками Jurkat, экспрессирующими CD47.
Слитый белок SIRPα-Fc (R&D Systems, № по кат. 4546-SA) метили с применением набора для мечения антител Alexa Fluor® (Invitrogen, № по кат. А20186) в соответствии со спецификациями производителя. 1,5×106 Т-клеток Jurkat инкубировали с гуманизированными mAb (5 мкг/мл), контрольным антителом человека в RPMI, содержащей 10% среды, или со средой отдельно в течение 30 мин. при 37°С. Добавляли равный объем флуоресцентно меченного слитого белка SIRPα-Fc и инкубировали в течение дополнительных 30 мин. при 37°С. Клетки промывали один раз с помощью PBS и количество меченного SIRPα-Fc, связавшегося с Т-клетками Jurkat, анализировали с помощью проточной цитометрии.
Как показано на ФИГ. 7, гуманизированные mAb VLX4, VLX8 и VLX9 блокировали взаимодействие CD47, экспрессированного на Т-клетках Jurkat, с SIPRα, тогда как контрольное антитело человека (которое не связывается с CD47) или среда отдельно не блокировали взаимодействие CD47/SIRPα.
Пример 5
Антитела к CD47 усиливают фагоцитоз
Для оценки эффекта химерных (мыши-человека) и гуманизированных mAb к CD47, VLX4, VLX8 и VLX9, в отношении фагоцитоза опухолевых клеток под действием макрофагов in vitro использовали следующий способ с применением проточной цитометрии (Willingham et al. (2012) Proc Nati Acad Sci USA 109(17):6662-7 и Tseng et al. (2013) Proc Natl Acad Sci USA 110(27):11103-8).
Человеческие макрофаги получали путем лейкафереза периферической крови здорового человека и инкубировали в среде AIM-V (Life Technologies) в течение 7-10 дней. Для анализа фагоцитоза in vitro макрофаги пересевали при концентрации 1×104 клеток на лунку в 100 мкл среды AIM-V в 96-луночный планшет и оставляли для прикрепления на 24 часа. После того как эффекторные макрофаги прикрепились к культуральному сосуду целевые раковые клетки человека (Jurkat) метили с помощью 1 мкМ N-сукцинимидильного эфира 5(6)-карбоксифлуоресцеин диацетата (CFSE; Sigma Aldrich) и добавляли к культурам макрофагов при концентрации 5×104 клеток в 1 мл среды AIM-V (соотношение целевых и эффекторных клеток 5:1). mAb к CD47, VLX4, VLX8 и VLX9, (1 мкг/мл) добавляли непосредственно в смесь целевых и эффекторных клеток и оставляли инкубироваться при 37°С в течение 2-3 часов. Через 2-3 часа все не подвергнутые фагоцитозу клетки удаляли и оставшиеся клетки промывали трижды фосфатно-солевым буфером (PBS; Sigma Aldrich). Затем клетки обрабатывали трипсином, собирали в микроцентрифужные пробирки и инкубировали с 100 нг меченного аллофикоцианином (АРС) антитела к CD14 (BD Biosciences) в течение 30 минут, промывали один раз и анализировали с помощью проточной цитометрии (Accuri C6; BD Biosciences) в отношении процентного содержания CD14+ клеток, которые также были CFSE+, что указывало на завершенный фагоцитоз.
Как показано на ФИГ. 8, химерные mAb (мыши-человека) VLX4, VLX4 IgG1, VLX4 IgG1 N297Q, VLX4 IgG4 РЕ и VLX4 IgG4 S228P, усиливали фагоцитоз клеток Jurkat под действием макрофагов человека путем блокирования взаимодействия CD47/SIRPα, и этот улучшенный фагоцитоз не зависел от функции Fc.
Аналогично, как показано на ФИГ. 9А и ФИГ. 9В, VLX4hum_01 IgG1, VLX4hum_01 IgG4 РЕ, VLX4hum_06 IgG4 РЕ, VLX4hum_07 IgG4 РЕ, VLX4hum_12 IgG4 РЕ и VLX4hum_13 IgG4 РЕ усиливали фагоцитоз клеток Jurkat под действием макрофагов человека путем блокирования взаимодействия CD47/SIRPα.
Как показано на ФИГ. 10А, химерные mAb (мыши-человека) VLX8, VLX8 IgG1 N297Q и VLX8 IgG4 РЕ, усиливали фагоцитоз Т-клеток Jurkat под действием макрофагов человека посредством блокирования взаимодействия CD47/SIRPα, и этот улучшенный фагоцитоз не зависел от функции Fc.
Аналогично, как показано на ФИГ. 10В, VLX8hum_01 IgG4 РЕ, VLX8hum_03 IgG4 РЕ, VLX8hum_07 IgG4 РЕ, VLX8hum_08 IgG4 РЕ и VLX8hum_09 IgG4 РЕ усиливали фагоцитоз клеток Jurkat под действием макрофага человека путем блокирования взаимодействия CD47/SIRPα, и этот улучшенный фагоцитоз не зависел от функции Fc.
Как показано на ФИГ. 11А, все химерные mAb, VLX9 IgG1 N297Q, VLX9 IgG2 и VLX9 IgG4 РЕ, усиливали фагоцитоз Т-клеток Jurkat под действием макрофагов человека путем блокирования взаимодействия CD47/SIRPα, и этот улучшенный фагоцитоз не зависел от эффекторной функции Fc. Аналогично, как показано на ФИГ. 11В, все гумапизированные mAb VLX9 IgG2 усиливали фагоцитоз Т-клеток Jurkat.
Пример 6
Индукция клеточной гибели под действием растворимых антител к CD47
Было показано, что некоторые растворимые антитела к CD47 индуцируют селективную клеточную гибель опухолевых клеток. Полагают, что такое дополнительное свойство селективной токсичности в отношении раковых клеток дает преимущества по сравнению с mAb, которые только блокируют связывание SIRPα с CD47.
Индукцию клеточной гибели под действием растворимых mAb к CD47 измеряли in vitro (Manna et al. (2003) J. Immunol. 107 (7): 3544-53). Для анализа клеточной гибели in vitro 1×105 трансформированных Т-клеток человека (Т-клеток Jurkat) инкубировали с растворимыми гуманизированными mAb к CD47, VLX4, VLX8 и VLX9, (1 мкг/мл) в течение 24 часов при 37°С. По мере наступления клеточной гибели митохондриальный мембранный потенциал снижается, внутренний слой клеточной мембраны инвертируется с выведением на наружную поверхность фосфатидилсеринов (PS), и пропидиум йодид (PI) может встраиваться в ядерную ДНК. С целью обнаружения этих изменений в клетке клетки затем окрашивали с помощью флуоресцентно меченного аннексина V и PI или 7-аминоактиномицина D (7-AAD) (BD Biosciences) и сигнал обнаруживали с применением проточного цитометра Accuri C6 (BD Biosciences). Повышение выведение на наружную поверхность PS определяли путем измерения процента повышения сигнала аннексина V и процента погибших клеток путем измерения процента повышения сигнала PI или 7-AAD. Что важно для терапевтических целей, данные mAb индуцируют клеточную гибель опухолевых клеток напрямую, и для уничтожения не требуется участие комплемента или вмешательство других клеток (например, NK-клеток, Т-клеток или макрофагов). Таким образом, данный механизм не зависит как от других клеток, так и от эффекторной функции Fc. Следовательно, можно конструировать терапевтические антитела, разработанные на основании этих mAb, для снижения эффекторных функций Fc, таких как ADCC и CDC, и, тем самым, ограничивать вероятность побочных эффектов, свойственных для гуманизированных mAb с неизмененными эффекторными функциями Fc.
Как показано на ФИГ. 12А и ФИГ. 12В, растворимые гуманизированные mAb VLX4 индуцировали клеточную гибель Т-клеток ALL Jurkat, как измерено с помощью увеличения степени окрашивания аннексином V и окрашивания 7-AAD (не показано). Гуманизированные mAb, VLX4hum_01 IgG1, VLX4hum_01 IgG4 PE, VLX4hum_02 IgG1, VLX4hum_02 IgG4 PE, VLX4hum_06 IgG4 PE, VLX4hum_07 IgG4 PE, VLX4hum_12 IgG4 PE и VLX4hum_13 IgG4 PE, вызывали клеточную гибель. В отличие от этого, гуманизированные mAb, VLX4hum_08 IgG4 РЕ и VLX4hum_11 IgG4 РЕ, не вызывали клеточную гибель Т-клеток Jurkat. Индукция клеточной гибели и стимуляция фагоцитоза чувствительных раковых клеток обеспечивает дополнительное требуемое свойство антитела и терапевтическое преимущество при лечении рака.
Как показано на ФИГ. 13А и ФИГ. 13В, растворимые химерные и гуманизированные mAb VLX8 индуцировали клеточную гибель Т-клеток ALL Jurkat, как измерено как измерено с помощью увеличения степени окрашивания аннексином V и окрашивания 7-AAD (не показано). Химерные mAb, VLX8 IgG1 N297Q (xi) и VLX8 IgG4 РЕ, и гуманизированные mAb, VLX8hum_07 IgG4 РЕ и VLX8hum_08 IgG4 РЕ, индуцировали клеточную гибель Т-клеток ALL Jurkat. В отличие от этого, гуманизированные mAb, VLX8hum_02 IgG4 РЕ и VLX8hum_04 IgG4 РЕ, не вызывали клеточную гибель Т-клеток Jurkat. Индукция клеточной гибели и стимуляция фагоцитоза чувствительных раковых клеток обеспечивает дополнительное требуемое свойство антитела и терапевтическое преимущество при лечении рака.
Как показано на ФИГ. 14А, растворимые химерные антитела VLX9 индуцировали клеточную гибель клеток Jurkat, как измерено с помощью увеличения степени окрашивания аннексином V и окрашивания 7-AAD (не показано). Кроме того, как показано на ФИГ. 14В, химерное mAb VLX9 IgG2xi и гуманизированные mAb, VLX9hum_06 IgG2, VLX9hum_07 IgG2, VLX9hum_08 IgG2 и VLX9hum_09 IgG2, индуцировали клеточную гибель клеток Jurkat (более чем 2-кратное увеличения степени окрашивания аннексином V). В отличие от этого, гуманизированные mAb, VLX9hum_01 IgG2, VLX9hum_02 IgG2, VLX9hum_03 IgG2, VLX9hum_04 IgG2, VLX9hum_05 IgG2 и VLX9hum_010 IgG2, не вызывали клеточную гибель клеток Jurkat. Индукция клеточной гибели и стимуляция фагоцитоза чувствительных раковых клеток обеспечивает дополнительное требуемое свойство антитела и терапевтическое преимущество при лечении рака.
Пример 7
Гемагглютинация эритроцитов человека (hRBC)
Было показано, что многие антитела к CD47, включая В6Н12, BRIC126, MABL1, MABL2, СС2С6, 5F9, вызывают гемагглютинацию (НА) промытых RBC in vitro или in vivo (Petrova P. et al. Cancer Res 2015; 75(15 Suppl): Abstract №4271; патент США №9045541; Uno et al. Oncol Rep. 17: 1189-94, 2007; Kikuchi et al. Biochem Biophys Res. Commun. 315: 912-8, 2004; Sikic В. et al. J Clin Oncol 2016; 34 (suppl; abstract 3019)). Гемагглютинацию hRBC оценивали после инкубации hRBC с различными концентрациями химерных и гуманизированных mAb VLX4, VLX8 и VLX9 in vitro, по сути, как описано в Kikuchi et al. Biochem Biophys Res. Commun (2004) 315:912-918. Кровь получали от здоровых доноров, разбавляли (1:50) в PBS/1 мМ EDTA/BSA и промывали 3 раза с помощью PBS/EDTA/BSA. hRBC добавляли в 96-луночные планшеты с U-образным дном с равными объемами антител (75 мкл каждого) и инкубировали в течение 3 часов при 37°С и в течение ночи при 4°С.
Как показано на ФИГ. 15А и в таблицах 1 и 2, VLX4hum_01 IgG1 N297Q вызывал гемагглютинацию hRBC, тогда как гуманизированное mAb VLX4hum_01 IgG4 РЕ не вызывало (концентрация mAb составляла от 50 мкг/мл до 0,3 нг/мл). Отсутствие гемагглютинации под действием VLX4hum_01 IgG4 РЕ обеспечивает дополнительное требуемое свойство антитела и терапевтическое преимущество при лечении рака.
Как показано на ФИГ. 15В и в таблицах 1 и 2, химерное антитело VLX8 IgG4 РЕ (xi) и гуманизированные антитела, VLX8hum_08 IgG4 РЕ, VLX8hum_09 IgG4 РЕ и VLX8hum_010 IgG4 РЕ, вызывали гемагглютинацию hRBC, тогда как гуманизированные Ab VLX8, VLX8hum_01 IgG4 РЕ, VLX8hum_02 IgG4 РЕ, VLX8hum_03 IgG4 РЕ и VLX8hum_11 IgG4 РЕ, не вызывали (концентрации mAb составляли от 50 мкг/мл до 0,3 нг/мл).
Отсутствие гемагглютинации под действием гуманизированных антител, VLX4hum_01 IgG4 РЕ, VLX8hum_01 IgG4 РЕ, VLX8hum_02 IgG4 РЕ, VLX8hum_03 IgG4 РЕ и VLX8hum_11 IgG4 РЕ, обеспечивает дополнительное требуемое свойство антитела и терапевтическое преимущество при лечении рака.
Как показано на ФИГ. 16А и ФИГ. 16В, химерное антитело VLX9 IgG2 вызывало гемагглютинацию hRBC, тогда как все гуманизированные mAb VLX9, за исключением VLX9hum_07 IgG2, не вызывали (при концентрациях от 50 мкг/мл до 0,3 пг/мл). Однако степень гемагглютинации, вызываемой VLX9hum_07, была снижена по сравнению с химерным mAb VLX9 IgG2. И в этом случае, отсутствие гемагглютинации под действием гуманизированных mAb VLX9 обеспечивает дополнительное требуемое свойство антитела и терапевтическое преимущество при лечении рака.
Пример 8
Противоопухолевая активность in vivo
Целью данного эксперимента было продемонстрировать, что гуманизированные антитела VLX4, VLX8 и VLX9, проиллюстрированные с помощью VLX4_07 IgG4PE, VLX8_10 IgG4PE и VLX9hum_08 IgG2, снижают опухолевую нагрузку in vivo в мышиной модели с ксенотрансплантатом лимфомы.
Клетки лимфомы Беркитта человека Raji (АТСС № CCL-86, Манассас, Вирджиния) поддерживали на RPMI-1640 (Lonza; Уолкерсвилл, Мэриленд), дополненной 10% фетальной бычьей сыворотки (FBS; Omega Scientific; Тарзана, Калифорния), в атмосфере 5% CO2. Культуры размножали во флаконах для культуры тканей.
Самок NSG (NOD-Cg-PrkdcscidI12rgtmlWjl/SzJ) получали из Jackson Laboratory (Бар-Харбор, Мэн) в возрасте 5-6 недель. Мышей акклиматизировали перед проведением работ и помещали в микроизоляторные клетки (Lab Products, Сифорд, Дэлавер) в специальные непатогенные условия. Мышей кормили облученным 2920х рационом для лабораторных животных Teklad Global Diet® (Envigo, ранее Harlan; Индианаполис, Индиана) и обеспечивали автоклавированной водой ad libitum. Все процедуры проводили согласно рекомендациям Институционального комитета по уходу за животными и их использованию.
Самкам мышей NSG инокулировали подкожно в правый бок 0,1 мл смеси из 30% RPMI/70% Matrigel™ (BD Biosciences; Бедфорд, Массачусетс), содержащей суспензию из 5×106 опухолевых клеток Raji. Через пять дней после инокуляции цифровой штангенциркуль применяли для измерения диаметра опухоли в ширину и длину. Значения объема опухоли рассчитывали с использованием формулы: объем опухоли (мм3)=(а×b2/2), где 'b' представляет собой самый маленький диаметр, и 'а' представляет собой самый большой диаметр. Мышей с пальпируемыми опухолями объемом 31-74 мм3 распределяли случайным образом по 8-10/группа, и в это время начинали введение VLX9hum_08 или PBS (контроль). Мышей обрабатывали с помощью 5 мг/кг антитела 5Х/неделя в течение 4 недель путем осуществления внутрибрюшинных инъекций. Значения объема опухоли и веса тела регистрировали два раза в неделю.
Как показано на ФИГ. 17, обработка гуманизированным антителом VLX4hum_07 IgG4 РЕ значимо снижала опухолевый рост у опухолей Raji (p<0,05, двухфакторный ANOVA), что демонстрируем противоопухолевую эффективность in vivo.
Как показано на ФИГ. 18, обработка гуманизированным mAb к CD47, VLX8hum_10 IgG4 РЕ, значимо снижала (p<0,0001, двухфакторный ANOVA) опухолевый рост у опухолей Raji, что демонстрирует противоопухолевую эффективность in vivo.
Как показано на ФИГ. 19, обработка гуманизированным mAb к CD47, VLX9hum_08 IgG2, значимо снижала (p<0,05, ANOVA) опухолевый рост у опухолей Raji, что демонстрирует противоопухолевую эффективность in vivo.
Пример 9
Эффект в отношении параметров циркулирующих эритроцитов
Целью данного эксперимента было продемонстрировать, что гуманизированные антитела VLX9, которые не связываются с RBC человека in vitro (таблица 2), проиллюстрированные с помощью hum1017_08 IgG2, не вызывают снижение содержания гемоглобина (Hg) или циркулирующих RBC после введения яванским макакам.
Использовали самок яванского макака китайского происхождения (Charles River Laboratories, Хьюстон, Техас) весом 2,5-3 кг в соответствии с рекомендациями Институционального комитета по уходу за животными и их использованию. VLX9hum_08 IgG2 или среду-носитель (PBS) вводили в виде 1-часовой внутривенной инфузии в день 1 при дозе 5 мг/кг и в день 18 при дозе 15 мг/кг (3 животных/группа). Гематологические параметры измеряли на протяжении всего исследования в дни -7, -3, 3, 8, 12, 18 (перед введением дозы), 20, 25, 29, 35 и 41 и сравнивали/нормализовали относительно средних значений от контрольных животных. Значения содержания RBC и Hg до обработки в день 0 в группе VLX9hum_08 IgG2 были ниже, чем в контрольной группе. После обработки каждой дозой VLX9hum_08 IgG2 наблюдались минимальные изменения (<10%) содержания Hg (ФИГ. 20А) или количества RBC (ФИГ. 20В) по сравнению с контролем, что демонстрирует, что антитела, которые не связываются с RBC человека in vitro, не вызывают снижением гематологических параметров RBC при введении яванским макакам.
Пример 10
Иммуногистохимическое окрашивание CD47
Локализацию экспрессии CD47 определяли в фиксированных формалином, залитых в парафин (FFPE) блоках от пациентов с разными типами рака (полученными из коммерческих источников) с применением химерных mAb мыши/кролика к CD47. Из FFPE блоков нарезали срезы толщиной 3-4 микрона, депарафинировали и обрабатывали с помощью раствора для демаскирования антигена. Затем срезы инкубировали с 4 мкг/мл первичных химерных mAb мыши/кролика к CD47 в течение 1 ч. и с меченным HRP вторичным антителом к антителу кролика в течение 20 минут. Антитело к CD47, связавшееся с CD47 человека, визуализировали с применением субстрата для пероксидазы, 3,3',5,5'-тетраметилбензидена. Срезы перекрашивали гематоксилином и оценивали с помощью стандартной световой микроскопии. Как показано на ФИГ. 21, высокий уровень экспрессии CD47 обнаруживали в ткани рака молочной железы человека, как показано с помощью темных областей, обозначенных стрелками, с применением химерных mAb мыши/кролика к CD47, проиллюстрированных с помощью химерного mAb мыши/кролика VLX4. Это демонстрирует, что данные mAb можно применять для иммуногистохимического определения локализации CD47 человека в срезах опухолевой ткани, полученных их FFPE-блоков, в диагностических анализах.
Пример 11
Антитела к CD47 регулируют передачу сигнала с участием оксида азота
Связывание TSP1 с CD47 активирует гетеротримерный G-белок Gi, что приводит к снижению внутриклеточных уровней циклического AMP (cAMP). Кроме того, путь с участием TSP1/CD47 препятствует благоприятным эффектам пути с участием оксида азота (NO) во всех клетках сосудов. Путь с участием NO состоит из любого из трех ферментов синтаз оксида азота (NOS I, NOS II и NOS III), которые образуют биологически активный газ NO с применением аргинина в качестве субстрата. NO может оказывать свое действие внутри клетки, в которой он вырабатывается, или в соседних клетках, активируя фермент, растворимую гуанилилциклазу, который вырабатывает молекулу-посредника, циклический GMP (cGMP). Правильное функционирование пути с участием NO/cGMP необходимо для защиты сердечно-сосудистой системы от стрессов, включая без ограничения стрессы, возникающие в результате ранения, воспаления, гипертензии, метаболического синдрома, ишемии и ишемически-реперфузионного повреждения (IRI). В случае этих клеточных стрессов ингибирование пути с участием NO/cGMP под действием системы TSP1/CD47 усиливает эффекты стресса. Это является особенной проблемой для сердечно-сосудистой системы, в которой оба cGMP и сАМР играют важные защитные роли. Существует множество причин, по которым ишемически-реперфузионное повреждение вызывает или вносит вклад в возникновение заболевания, травмы и неблагоприятного исхода хирургических процедур.
Целью данного эксперимента было продемонстрировать, что гуманизированные mAb к CD47 по настоящему изобретению проявляют способность обращать опосредованное TSP1 ингибирование стимулируемого NO синтеза cGMP, например, как описано ранее с применением моноклональных антител мыши к CD47, как раскрыто в Isenberg et al. (2006) J. Biol. Chem. 281:26069-80, или в качестве альтернативы других последующих маркеров или эффектов, возникающих в результате передачи сигнала с участием NO, например, релаксация гладкомышечных клеток или агрегация тромбоцитов, как ранее описано в Miller et al. (2010) Br J. Pharmacol. 159: 1542-1547.
Способ, используемый для измерения cGMP, выполняли согласно описанию производителя (набор для флуоресцентного анализа циклического GMP CatchPoint, Molecular Devices, Саннивейл, Калифорния). Использовали клетки Jurkat JE6.1 (АТСС, Манассас, Вирджиния; № по каталогу TIB-152) или другие типы клеток, у которых сохраняется путь передачи сигнала с участием NO/cGMP при выращивании в культуре и у которых проявляется сильный и воспроизводимый ингибиторный ответ при связывании TSP1 с CD47. Клетки выращивали в среде Дульбекко в модификации Искова, содержащей 5% (об./об.) термоинактивированной фетальной бычьей сыворотки (BioWest; № по каталогу S01520), 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина (Sigma; № по каталогу Р4222) при значениях плотности менее 1×106 клеток/мл. В случае анализа cGMP клетки высевали в 96-луночные планшеты для культуры тканей при плотности 1×105 клеток/мл в среду Дульбекко в модификации Искова, содержащую 5% (об./об.) термоинактивированной фетальной бычьей сыворотки (BioWest; № по каталогу S01520), 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина (Sigma; № по каталогу Р4222), на 24 часа, а затем переносили в бессывороточную среду на ночь.
Раскрытые в данном документе гуманизированные антитела, очищенные из молекул, полученных с помощью временной трансфекции СНО клеток, как описано выше в примере 3, а также контрольное химерное антитело затем добавляли при конечной концентрации 20 нг/мл, после чего через 15 минут добавляли 0 или 1 мкг/мл TSP1 человека (Athens Research and Technology, Атенс, Джорджия, № по каталогу 16-20-201319). Через дополнительные 15 минут в половину лунок добавляли донор NO, диэтиламин-NONOaT (Cayman Chemical, Энн-Арбор, Мичиган, № по каталогу 82100), при конечной концентрации 1 мкМ. Через пять минут клетки лизировали буфером, поставляемым в наборе для выявления cGMP, и аликвоты из каждой лунки анализировали в отношении содержания cGMP.
Предполагалось, что некоторые химерные или гуманизированное антитела будут обращать ингибирование cGMP под действием TSP1. Обращение буде полным (>80%) или промежуточным (20%-80%). Это обращение ингибирования cGMP под действием TSP1 будет демонстрировать, что они обладают способностью усиливать передачу сигнала с участием NO, и означать, что они применимы в защите сердечнососудистой системы от стрессов, включая без ограничения стрессы, возникающие в результате ранения, воспаления, гипертензии, метаболического синдрома, ишемии и ишемически-реперфузионного повреждения (IRI). Также ожидается, что дополнительные аналитические системы, например, сокращение гладкомышечных клеток, будут показывать, что некоторые клоны химерных или гуманизированных антител обращают ингибиторные действия TSP в отношении последующих эффектов, происходящих в результате активации передачи сигнала с участием NO.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> TIOMA THERAPEUTICS, INC.
Puro, Robyn
Manning, Pamela T.
Almagro, Juan C.
Karr, Robert W.
<120> ТЕРАПЕВТИЧЕСКИ АНТИТЕЛА К CD47
<130> VLX0005-401-PC
<150> 62/220,691
<151> 2015-09-18
<150> 62/221,852
<151> 2015-09-22
<150> 62/220,725
<151> 2015-09-18
<150> 62/232,681
<151> 2015-09-25
<150> 62/252,171
<151> 2015-11-06
<150> 62/354,592
<151> 2016-06-24
<150> 62/263,544
<151> 2015-12-04
<160> 104
<170> PatentIn версия 3.5
<210> 1
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4-HCDR1
<400> 1
Gly Tyr Thr Phe Thr Asn Tyr Val Ile His
1 5 10
<210> 2
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8-HCDR1
<400> 2
Gly Tyr Ser Phe Thr Asn Tyr Tyr Ile His
1 5 10
<210> 3
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9-HCDR1
<400> 3
Gly Tyr Thr Phe Thr Asn Tyr Trp Ile His
1 5 10
<210> 4
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4-HCDR2
<400> 4
Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 5
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8-HCDR2
<400> 5
Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 6
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9-HCDR2
<400> 6
Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 7
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4-HCDR3
<400> 7
Gly Gly Tyr Tyr Val Pro Asp Tyr
1 5
<210> 8
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4-HCDR3
<400> 8
Gly Gly Tyr Tyr Val Tyr Asp Tyr
1 5
<210> 9
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8-HCDR3
<400> 9
Gly Gly Lys Arg Ala Met Asp Tyr
1 5
<210> 10
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9-HCDR3
<400> 10
Gly Gly Arg Val Gly Leu Gly Tyr
1 5
<210> 11
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4-LCDR1
<400> 11
Arg Ser Arg Gln Ser Ile Val His Thr Asn Gly Asn Thr Tyr Leu Gly
1 5 10 15
<210> 12
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8-LCDR1
<400> 12
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 13
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8-LCDR1
<400> 13
Arg Ala Ser Gln Ser Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 14
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9-LCDR1
<400> 14
Arg Ser Ser Gln Asn Ile Val Gln Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 15
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> KVSNRFS
<400> 15
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 16
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8-LCDR2
<400> 16
Tyr Thr Ser Arg Leu Tyr Ser
1 5
<210> 17
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9-LCDR2
<400> 17
Lys Val Phe His Arg Phe Ser
1 5
<210> 18
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4-LCDR3
<400> 18
Phe Gln Gly Ser His Val Pro Tyr Thr
1 5
<210> 19
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8-LCDR3
<400> 19
Gln Gln Gly Asn Thr Leu Pro Trp Thr
1 5
<210> 20
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9-LCDR3
<400> 20
Phe Gln Gly Ser His Val Pro Trp Thr
1 5
<210> 21
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4murH01
<400> 21
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 22
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4mur-H02
<400> 22
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 23
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4humH01
<400> 23
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Gln Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Ala Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 24
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4humH02
<400> 24
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Gln Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Val Tyr Asp Tyr Trp Gly Gln Ala Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 25
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4humH03
<400> 25
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Gln Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Asp Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 26
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4humH04
<400> 26
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 27
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4humH05
<400> 27
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 28
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8murH03
<400> 28
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Asn Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Arg Leu Ser Ser Leu Thr Ser Ala Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 29
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8humH06
<400> 29
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 30
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8humH07
<400> 30
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 31
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8humH08
<400> 31
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 32
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> >Vx8humH09
<400> 32
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 33
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8humH10
<400> 33
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 34
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8humH11
<400> 34
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Gln Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Ala Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 35
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9murH04
<400> 35
Gln Val Gln Leu Gln Gln Phe Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Gln Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Ala Ala Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Arg Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Gly Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly His Gly Ser Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 36
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9humH12
<400> 36
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 37
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9humH13
<400> 37
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 38
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9humH14
<400> 38
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 39
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9humH15
<400> 39
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 40
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9humH16
<400> 40
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 41
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4murL01
<400> 41
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 42
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4murL02
<400> 42
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 43
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4humL01
<400> 43
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Asp Asp Val Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 44
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4humL02
<400> 44
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 45
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx4humL03
<400> 45
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Tyr Gln Gln Lys Pro Gly Gln Pro
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 46
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8murL03
<400> 46
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 47
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8humL04
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 48
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8humL05
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 49
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx8humL06
<400> 49
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Tyr Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
65 70 75 80
Asp Asp Val Gly Ile Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 50
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9murL04
<400> 50
Asp Val Phe Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val Gln Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Phe His Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 51
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9humL07
<400> 51
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val Gln Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Phe His Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 52
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Vx9humL08
<400> 52
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Asn Ile Val Gln Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro Gly Gln Pro
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Phe His Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 53
<211> 330
<212> БЕЛОК
<213> Homo sapiens
<400> 53
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 54
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Fc IgG1-N297Q человека
<400> 54
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Gln Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 55
<211> 326
<212> БЕЛОК
<213> Homo sapiens
<400> 55
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 56
<211> 377
<212> БЕЛОК
<213> Homo sapiens
<400> 56
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr Cys Pro
100 105 110
Arg Cys Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg
115 120 125
Cys Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys
130 135 140
Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
145 150 155 160
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
165 170 175
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
180 185 190
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Lys Trp Tyr
195 200 205
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
210 215 220
Gln Tyr Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Leu His
225 230 235 240
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
245 250 255
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
260 265 270
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
275 280 285
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
290 295 300
Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn
305 310 315 320
Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
325 330 335
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile
340 345 350
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln
355 360 365
Lys Ser Leu Ser Leu Ser Pro Gly Lys
370 375
<210> 57
<211> 326
<212> БЕЛОК
<213> Homo sapiens
<400> 57
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 58
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Fc-IgG4 S228P человека
<400> 58
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 59
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Fc-IgG4 PE человека
<400> 59
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 60
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 60
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 61
<211> 329
<212> БЕЛОК
<213> Rattus rattus
<400> 61
Ala Arg Thr Thr Ala Pro Ser Val Tyr Pro Leu Val Pro Gly Cys Ser
1 5 10 15
Gly Thr Ser Gly Ser Leu Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Lys Trp Asn Ser Gly Ala Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Gly Leu Tyr Thr Leu
50 55 60
Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp Ser Ser Gln Thr Val
65 70 75 80
Thr Cys Ser Val Ala His Pro Ala Thr Lys Ser Asn Leu Ile Lys Arg
85 90 95
Ile Glu Pro Arg Arg Pro Lys Pro Arg Pro Pro Thr Asp Ile Cys Ser
100 105 110
Cys Asp Asp Asn Leu Gly Arg Pro Ser Val Phe Ile Phe Pro Pro Lys
115 120 125
Pro Lys Asp Ile Leu Met Ile Thr Leu Thr Pro Lys Val Thr Cys Val
130 135 140
Val Val Asp Val Ser Glu Glu Glu Pro Asp Val Gln Phe Ser Trp Phe
145 150 155 160
Val Asp Asn Val Arg Val Phe Thr Ala Gln Thr Gln Pro His Glu Glu
165 170 175
Gln Leu Asn Gly Thr Phe Arg Val Val Ser Thr Leu His Ile Gln His
180 185 190
Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys
195 200 205
Asp Leu Pro Ser Pro Ile Glu Lys Thr Ile Ser Lys Pro Arg Gly Lys
210 215 220
Ala Arg Thr Pro Gln Val Tyr Thr Ile Pro Pro Pro Arg Glu Gln Met
225 230 235 240
Ser Lys Asn Lys Val Ser Leu Thr Cys Met Val Thr Ser Phe Tyr Pro
245 250 255
Ala Ser Ile Ser Val Glu Trp Glu Arg Asn Gly Glu Leu Glu Gln Asp
260 265 270
Tyr Lys Asn Thr Leu Pro Val Leu Asp Ser Asp Glu Ser Tyr Phe Leu
275 280 285
Tyr Ser Lys Leu Ser Val Asp Thr Asp Ser Trp Met Arg Gly Asp Ile
290 295 300
Tyr Thr Cys Ser Val Val His Glu Ala Leu His Asn His His Thr Gln
305 310 315 320
Lys Asn Leu Ser Arg Ser Pro Gly Lys
325
<210> 62
<211> 107
<212> БЕЛОК
<213> Rattus rattus
<400> 62
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Met Glu
1 5 10 15
Gln Leu Thr Ser Gly Gly Ala Thr Val Val Cys Phe Val Asn Asn Phe
20 25 30
Tyr Pro Arg Asp Ile Ser Val Lys Trp Lys Ile Asp Gly Ser Glu Gln
35 40 45
Arg Asp Gly Val Leu Asp Ser Val Thr Asp Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Met Ser Ser Thr Leu Ser Leu Thr Lys Val Glu Tyr Glu
65 70 75 80
Arg His Asn Leu Tyr Thr Cys Glu Val Val His Lys Thr Ser Ser Ser
85 90 95
Pro Val Val Lys Ser Phe Asn Arg Asn Glu Cys
100 105
<210> 63
<211> 323
<212> БЕЛОК
<213> Oryctolagus cuniculus
<400> 63
Gly Gln Pro Lys Ala Pro Ser Val Phe Pro Leu Ala Pro Cys Cys Gly
1 5 10 15
Asp Thr Pro Ser Ser Thr Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Leu Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Thr Leu Thr Asn
35 40 45
Gly Val Arg Thr Phe Pro Ser Val Arg Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Ser Val Thr Ser Ser Ser Gln Pro Val Thr Cys
65 70 75 80
Asn Val Ala His Pro Ala Thr Asn Thr Lys Val Asp Lys Thr Val Ala
85 90 95
Pro Ser Thr Cys Ser Lys Pro Thr Cys Pro Pro Pro Glu Leu Leu Gly
100 105 110
Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
115 120 125
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln
130 135 140
Asp Asp Pro Glu Val Gln Phe Thr Trp Tyr Ile Asn Asn Glu Gln Val
145 150 155 160
Arg Thr Ala Arg Pro Pro Leu Arg Glu Gln Gln Phe Asn Ser Thr Ile
165 170 175
Arg Val Val Ser Thr Leu Pro Ile Ala His Gln Asp Trp Leu Arg Gly
180 185 190
Lys Glu Phe Lys Cys Lys Val His Asn Lys Ala Leu Pro Ala Pro Ile
195 200 205
Glu Lys Thr Ile Ser Lys Ala Arg Gly Gln Pro Leu Glu Pro Lys Val
210 215 220
Tyr Thr Met Gly Pro Pro Arg Glu Glu Leu Ser Ser Arg Ser Val Ser
225 230 235 240
Leu Thr Cys Met Ile Asn Gly Phe Tyr Pro Ser Asp Ile Ser Val Glu
245 250 255
Trp Glu Lys Asn Gly Lys Ala Glu Asp Asn Tyr Lys Thr Thr Pro Ala
260 265 270
Val Leu Asp Ser Asp Gly Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val
275 280 285
Pro Thr Ser Glu Trp Gln Arg Gly Asp Val Phe Thr Cys Ser Val Met
290 295 300
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Ile Ser Arg Ser
305 310 315 320
Pro Gly Lys
<210> 64
<211> 104
<212> БЕЛОК
<213> Oryctolagus cuniculus
<400> 64
Arg Asp Pro Val Ala Pro Thr Val Leu Ile Phe Pro Pro Ala Ala Asp
1 5 10 15
Gln Val Ala Thr Gly Thr Val Thr Ile Val Cys Val Ala Asn Lys Tyr
20 25 30
Phe Pro Asp Val Thr Val Thr Trp Glu Val Asp Gly Thr Thr Gln Thr
35 40 45
Thr Gly Ile Glu Asn Ser Lys Thr Pro Gln Asn Ser Ala Asp Cys Thr
50 55 60
Tyr Asn Leu Ser Ser Thr Leu Thr Leu Thr Ser Thr Gln Tyr Asn Ser
65 70 75 80
His Lys Glu Tyr Thr Cys Lys Val Thr Gln Gly Thr Thr Ser Val Val
85 90 95
Gln Ser Phe Asn Arg Gly Asp Cys
100
<210> 65
<211> 293
<212> БЕЛОК
<213> Homo sapiens
<400> 65
Met Trp Pro Leu Val Ala Ala Leu Leu Leu Gly Ser Ala Cys Cys Gly
1 5 10 15
Ser Ala Gln Leu Leu Phe Asn Lys Thr Lys Ser Val Glu Phe Thr Phe
20 25 30
Cys Asn Asp Thr Val Val Ile Pro Cys Phe Val Thr Asn Met Glu Ala
35 40 45
Gln Asn Thr Thr Glu Val Tyr Val Lys Trp Lys Phe Lys Gly Arg Asp
50 55 60
Ile Tyr Thr Phe Asp Gly Ala Leu Asn Lys Ser Thr Val Pro Thr Asp
65 70 75 80
Phe Ser Ser Ala Lys Ile Glu Val Ser Gln Leu Leu Lys Gly Asp Ala
85 90 95
Ser Leu Lys Met Asp Lys Ser Asp Ala Val Ser His Thr Gly Asn Tyr
100 105 110
Thr Cys Glu Val Thr Glu Leu Thr Arg Glu Gly Glu Thr Ile Ile Glu
115 120 125
Leu Lys Tyr Arg Val Val Ser Trp Phe Ser Pro Asn Glu Asn Ile Leu
130 135 140
Ile Val Ile Phe Pro Ile Phe Ala Ile Leu Leu Phe Trp Gly Gln Phe
145 150 155 160
Gly Ile Lys Thr Leu Lys Tyr Arg Ser Gly Gly Met Asp Glu Lys Thr
165 170 175
Ile Ala Leu Leu Val Ala Gly Leu Val Ile Thr Val Ile Val Ile Val
180 185 190
Gly Ala Ile Leu Phe Val Pro Gly Glu Tyr Ser Leu Lys Asn Ala Thr
195 200 205
Gly Leu Gly Leu Ile Val Thr Ser Thr Gly Ile Leu Ile Leu Leu His
210 215 220
Tyr Tyr Val Phe Ser Thr Ala Ile Gly Leu Thr Ser Phe Val Ile Ala
225 230 235 240
Ile Leu Val Ile Gln Val Ile Ala Tyr Ile Leu Ala Val Val Gly Leu
245 250 255
Ser Leu Cys Ile Ala Ala Cys Ile Pro Met His Gly Pro Leu Leu Ile
260 265 270
Ser Gly Leu Ser Ile Leu Ala Leu Ala Gln Leu Leu Gly Leu Val Tyr
275 280 285
Met Lys Phe Val Glu
290
<210> 66
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная Vx4murL01
<400> 66
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 67
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная Vx4murL01
<400> 67
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 68
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx4humL01
<400> 68
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Asp Asp Val Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 69
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx8humL03
<400> 69
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Tyr Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
65 70 75 80
Asp Asp Val Gly Ile Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 70
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx9humL02
<400> 70
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ser Ser Gln Asn Ile Val Gln Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro Gly Gln Pro
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Phe His Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 71
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx8humL02
<400> 71
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 72
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx4humL02
<400> 72
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 73
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx9humL07
<400> 73
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val Gln Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Lys Val Phe His Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 74
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx8humL01
<400> 74
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 75
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx9mur_L04
<400> 75
Asp Val Phe Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val Gln Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Phe His Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 76
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx4murH01
<400> 76
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 77
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx4humH01
<400> 77
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Gln Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Ala Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 78
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH11
<400> 78
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Gln Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Ala Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 79
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx9humH12
<400> 79
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 80
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx9humH14
<400> 80
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 81
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx9humH15
<400> 81
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 82
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx4humH02
<400> 82
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Gln Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Ser Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Val Tyr Asp Tyr Trp Gly Gln Ala Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 83
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx9humH13
<400> 83
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 84
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH10
<400> 84
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Arg Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 85
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx4humH04
<400> 85
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 86
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx4humH05
<400> 86
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 87
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx9humH16
<400> 87
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 88
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH06
<400> 88
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 89
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH07
<400> 89
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 90
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH08
<400> 90
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 91
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH09
<400> 91
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 92
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH06
<400> 92
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 93
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8mur-H03
<400> 93
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Asn Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Arg Leu Ser Ser Leu Thr Ser Ala Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 94
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx9mur-H04
<400> 94
Gln Val Gln Leu Gln Gln Phe Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Gln Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Thr Asp Pro Arg Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Ala Ala Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Arg Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Gly Gly Gly Arg Val Gly Leu Gly Tyr Trp Gly His Gly Ser Ser
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 95
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH06
<400> 95
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 96
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH07
<400> 96
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 97
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH08
<400> 97
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 98
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная HC Vx8humH09
<400> 98
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asp Pro Leu Asn Gly Asp Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Lys Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn
180 185 190
Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val
290 295 300
Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 99
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Fc-IgG4 PE' человека
<400> 99
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Glu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 100
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная LC Vx8murL03
<400> 100
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 101
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная Vx4mur-ratL01
<400> 101
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Met Glu
115 120 125
Gln Leu Thr Ser Gly Gly Ala Thr Val Val Cys Phe Val Asn Asn Phe
130 135 140
Tyr Pro Arg Asp Ile Ser Val Lys Trp Lys Ile Asp Gly Ser Glu Gln
145 150 155 160
Arg Asp Gly Val Leu Asp Ser Val Thr Asp Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Met Ser Ser Thr Leu Ser Leu Thr Lys Val Glu Tyr Glu
180 185 190
Arg His Asn Leu Tyr Thr Cys Glu Val Val His Lys Thr Ser Ser Ser
195 200 205
Pro Val Val Lys Ser Phe Asn Arg Asn Glu Cys
210 215
<210> 102
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная Vx4mur-ratH01
<400> 102
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Ala Arg Thr Thr Ala Pro Ser Val Tyr Pro Leu
115 120 125
Val Pro Gly Cys Ser Gly Thr Ser Gly Ser Leu Val Thr Leu Gly Cys
130 135 140
Leu Val Lys Gly Tyr Phe Pro Glu Pro Val Thr Val Lys Trp Asn Ser
145 150 155 160
Gly Ala Leu Ser Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Gly Leu Tyr Thr Leu Ser Ser Ser Val Thr Val Pro Ser Ser Thr Trp
180 185 190
Ser Ser Gln Thr Val Thr Cys Ser Val Ala His Pro Ala Thr Lys Ser
195 200 205
Asn Leu Ile Lys Arg Ile Glu Pro Arg Arg Pro Lys Pro Arg Pro Pro
210 215 220
Thr Asp Ile Cys Ser Cys Asp Asp Asn Leu Gly Arg Pro Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Lys Pro Lys Asp Ile Leu Met Ile Thr Leu Thr Pro
245 250 255
Lys Val Thr Cys Val Val Val Asp Val Ser Glu Glu Glu Pro Asp Val
260 265 270
Gln Phe Ser Trp Phe Val Asp Asn Val Arg Val Phe Thr Ala Gln Thr
275 280 285
Gln Pro His Glu Glu Gln Leu Asn Gly Thr Phe Arg Val Val Ser Thr
290 295 300
Leu His Ile Gln His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys
305 310 315 320
Lys Val Asn Asn Lys Asp Leu Pro Ser Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Pro Arg Gly Lys Ala Arg Thr Pro Gln Val Tyr Thr Ile Pro Pro
340 345 350
Pro Arg Glu Gln Met Ser Lys Asn Lys Val Ser Leu Thr Cys Met Val
355 360 365
Thr Ser Phe Tyr Pro Ala Ser Ile Ser Val Glu Trp Glu Arg Asn Gly
370 375 380
Glu Leu Glu Gln Asp Tyr Lys Asn Thr Leu Pro Val Leu Asp Ser Asp
385 390 395 400
Glu Ser Tyr Phe Leu Tyr Ser Lys Leu Ser Val Asp Thr Asp Ser Trp
405 410 415
Met Arg Gly Asp Ile Tyr Thr Cys Ser Val Val His Glu Ala Leu His
420 425 430
Asn His His Thr Gln Lys Asn Leu Ser Arg Ser Pro Gly Lys
435 440 445
<210> 103
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная Vx4mur-rabL01
<400> 103
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Ile Val His Thr
20 25 30
Asn Gly Asn Thr Tyr Leu Gly Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Asp Pro Val Ala Pro Thr Val Leu Ile Phe Pro Pro Ala Ala Asp
115 120 125
Gln Val Ala Thr Gly Thr Val Thr Ile Val Cys Val Ala Asn Lys Tyr
130 135 140
Phe Pro Asp Val Thr Val Thr Trp Glu Val Asp Gly Thr Thr Gln Thr
145 150 155 160
Thr Gly Ile Glu Asn Ser Lys Thr Pro Gln Asn Ser Ala Asp Cys Thr
165 170 175
Tyr Asn Leu Ser Ser Thr Leu Thr Leu Thr Ser Thr Gln Tyr Asn Ser
180 185 190
His Lys Glu Tyr Thr Cys Lys Val Thr Gln Gly Thr Thr Ser Val Val
195 200 205
Gln Ser Phe Asn Arg Gly Asp Cys
210 215
<210> 104
<211> 440
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Полноразмерная Vx4mur-rabH01
<400> 104
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Ile His Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Tyr Asn Asp Gly Ile Leu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Gly Tyr Tyr Val Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser Gly Gln Pro Lys Ala Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Cys Gly Asp Thr Pro Ser Ser Thr Val Thr Leu Gly Cys
130 135 140
Leu Val Lys Gly Tyr Leu Pro Glu Pro Val Thr Val Thr Trp Asn Ser
145 150 155 160
Gly Thr Leu Thr Asn Gly Val Arg Thr Phe Pro Ser Val Arg Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Ser Val Thr Ser Ser Ser
180 185 190
Gln Pro Val Thr Cys Asn Val Ala His Pro Ala Thr Asn Thr Lys Val
195 200 205
Asp Lys Thr Val Ala Pro Ser Thr Cys Ser Lys Pro Thr Cys Pro Pro
210 215 220
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Asp Asp Pro Glu Val Gln Phe Thr Trp Tyr Ile
260 265 270
Asn Asn Glu Gln Val Arg Thr Ala Arg Pro Pro Leu Arg Glu Gln Gln
275 280 285
Phe Asn Ser Thr Ile Arg Val Val Ser Thr Leu Pro Ile Ala His Gln
290 295 300
Asp Trp Leu Arg Gly Lys Glu Phe Lys Cys Lys Val His Asn Lys Ala
305 310 315 320
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Arg Gly Gln Pro
325 330 335
Leu Glu Pro Lys Val Tyr Thr Met Gly Pro Pro Arg Glu Glu Leu Ser
340 345 350
Ser Arg Ser Val Ser Leu Thr Cys Met Ile Asn Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ser Val Glu Trp Glu Lys Asn Gly Lys Ala Glu Asp Asn Tyr
370 375 380
Lys Thr Thr Pro Ala Val Leu Asp Ser Asp Gly Ser Tyr Phe Leu Tyr
385 390 395 400
Ser Lys Leu Ser Val Pro Thr Ser Glu Trp Gln Arg Gly Asp Val Phe
405 410 415
Thr Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Ile Ser Arg Ser Pro Gly Lys
435 440
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| CD47-АНТИГЕНСВЯЗЫВАЮЩАЯ ЕДИНИЦА И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2780859C2 |
| ПОЛУЧЕНИЕ МУЛЬТИСПЕЦИФИЧЕСКИХ СМЕСЕЙ АНТИТЕЛ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2815826C2 |
| АНТИГЕНСВЯЗЫВАЮЩИЙ ПОЛИПЕПТИД, СВЯЗЫВАЮЩИЙСЯ С CD47, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2833294C2 |
| АНТИ-SIRPα АНТИТЕЛА | 2018 |
|
RU2771174C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800923C2 |
| АНТИТЕЛА ПРОТИВ СИГНАЛ-РЕГУЛЯТОРНОГО БЕЛКА АЛЬФА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2771964C2 |
| АНТИТЕЛО ПРОТИВ SIRPα | 2019 |
|
RU2791002C2 |
| АНТИТЕЛА К МЕЗОТЕЛИНУ | 2019 |
|
RU2837574C2 |
| КОНСТРУКЦИИ, ИМЕЮЩИЕ SIRP-АЛЬФА ДОМЕН ИЛИ ЕГО ВАРИАНТ | 2016 |
|
RU2740672C2 |
| АНТИТЕЛА К ПАРВОВИРУСУ ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2020 |
|
RU2830441C2 |
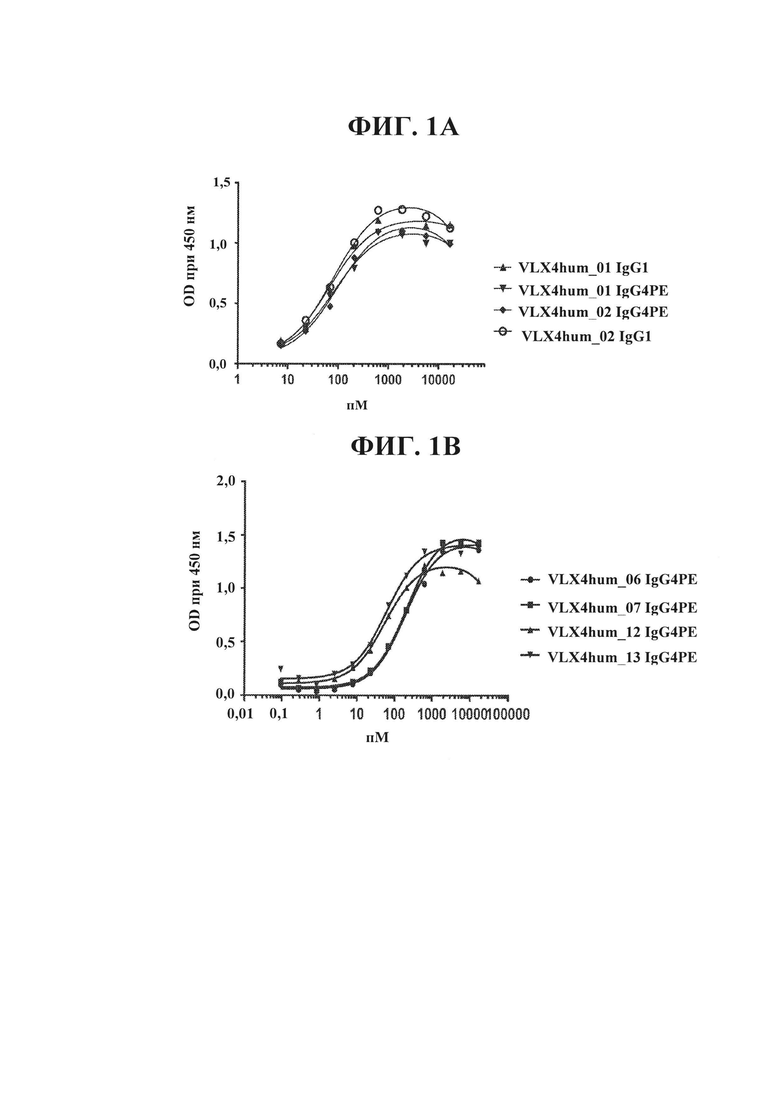
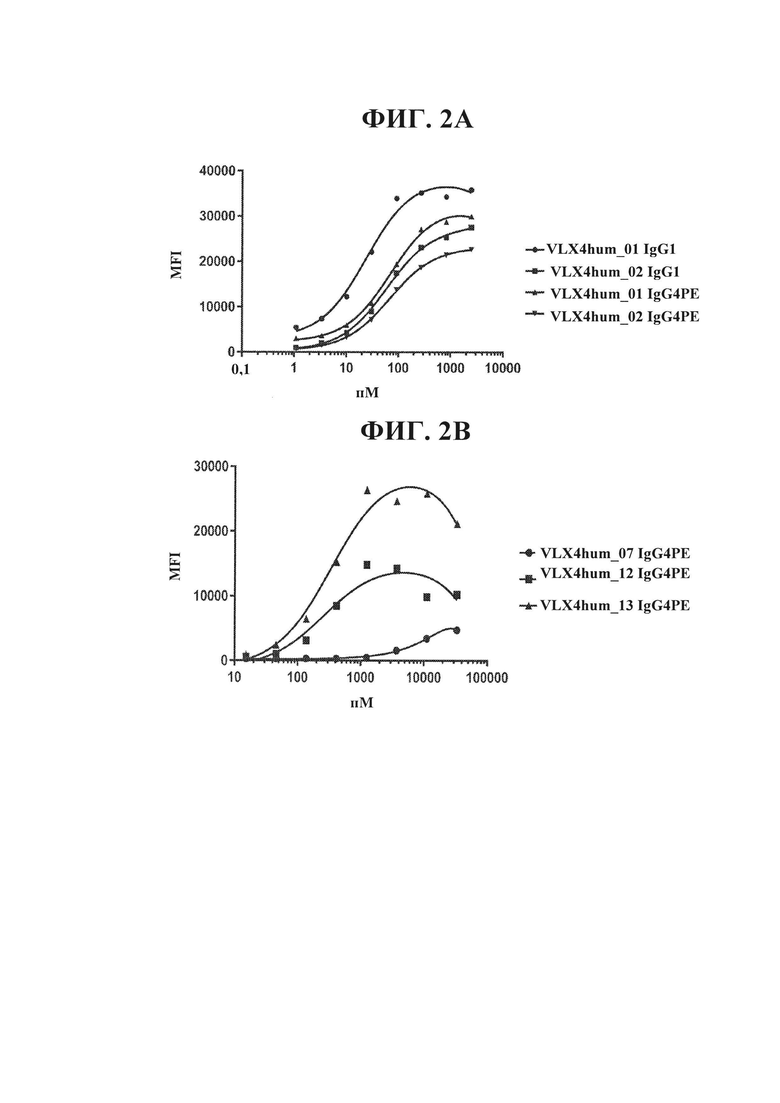
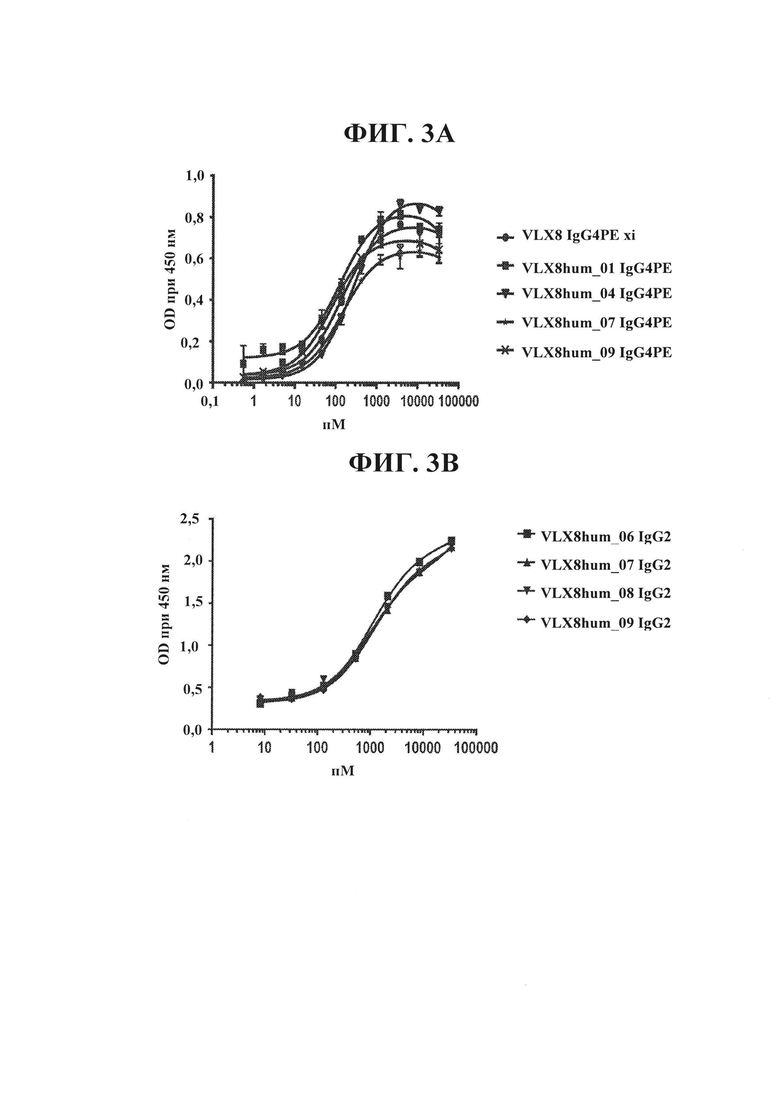
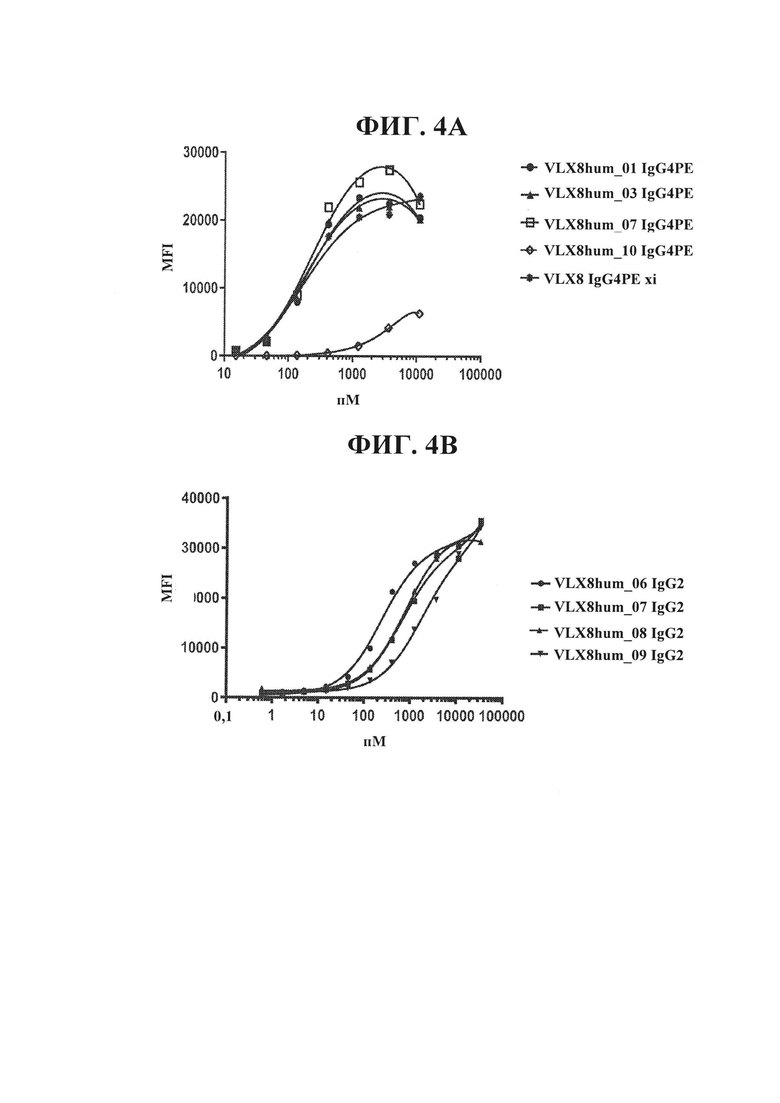
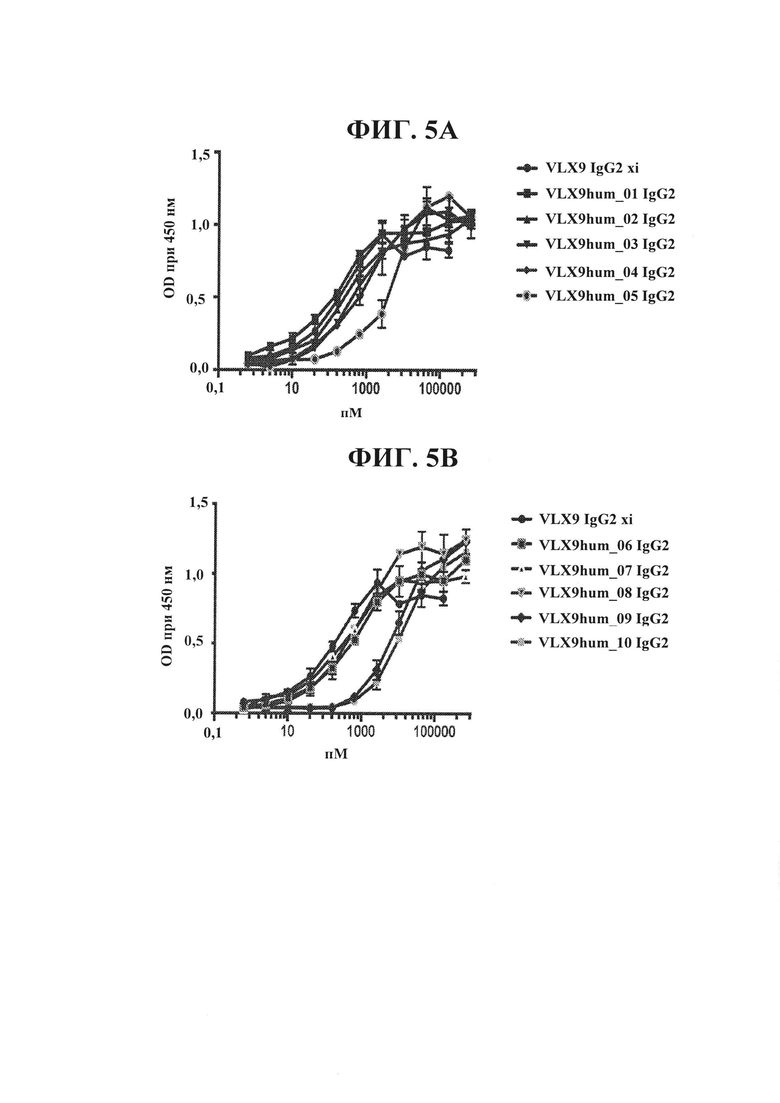
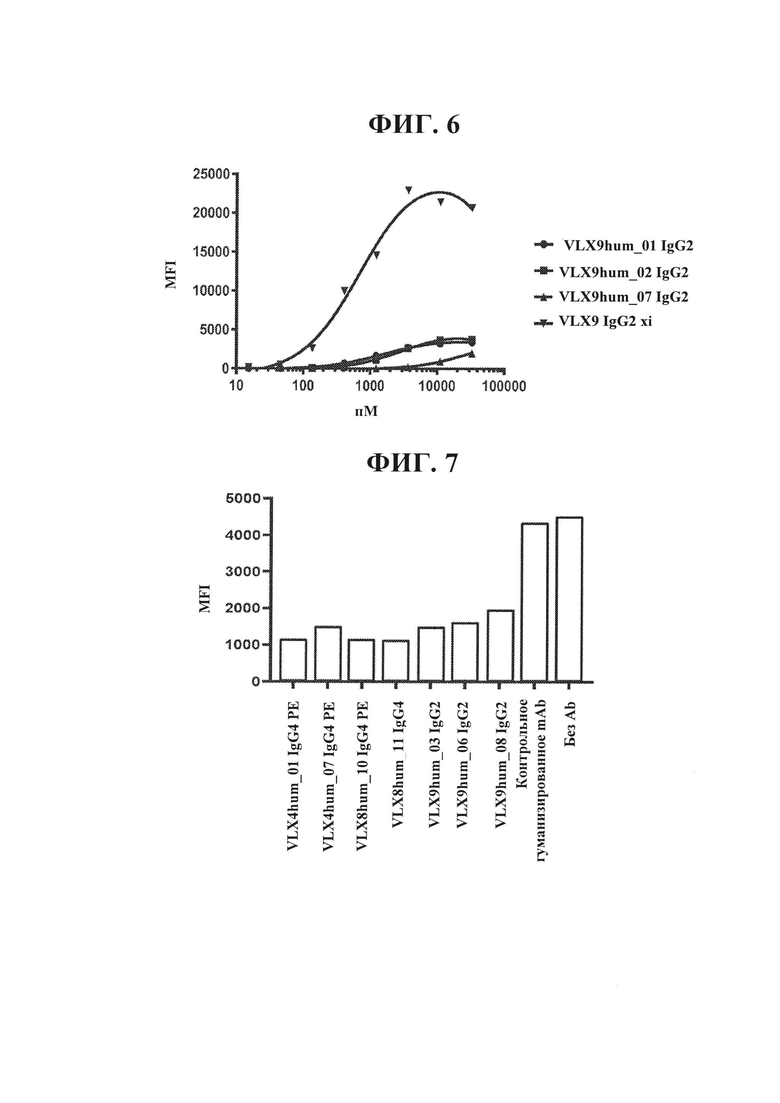
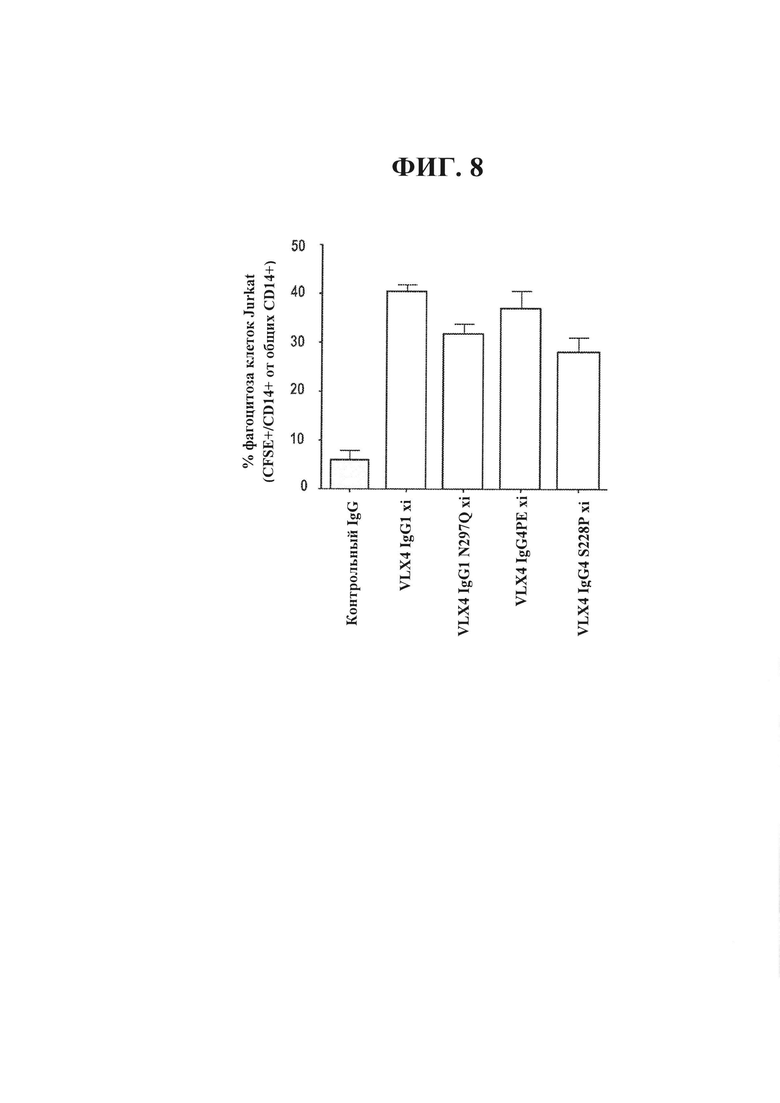
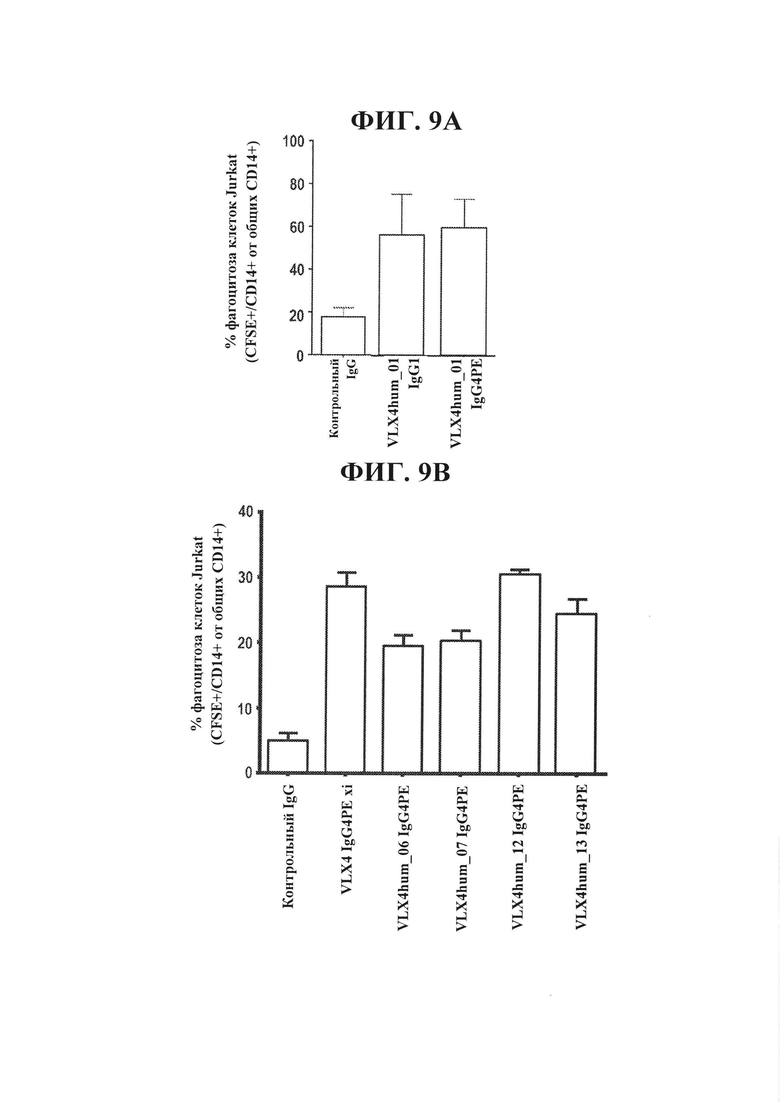
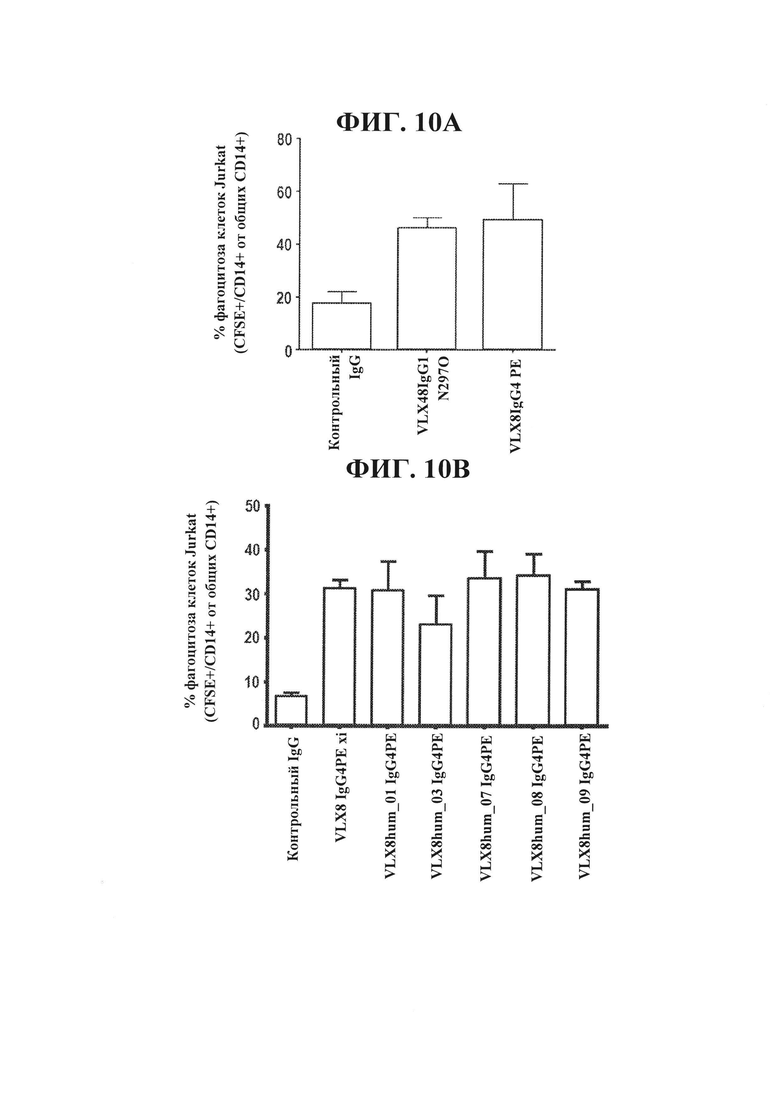
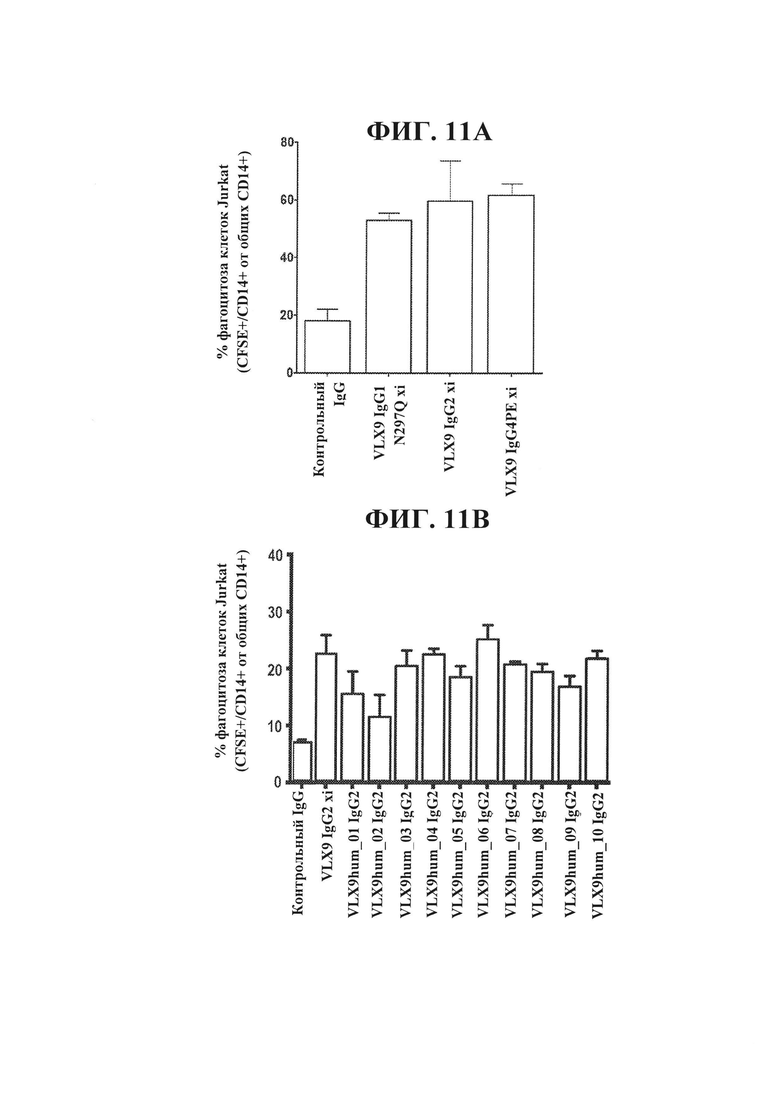
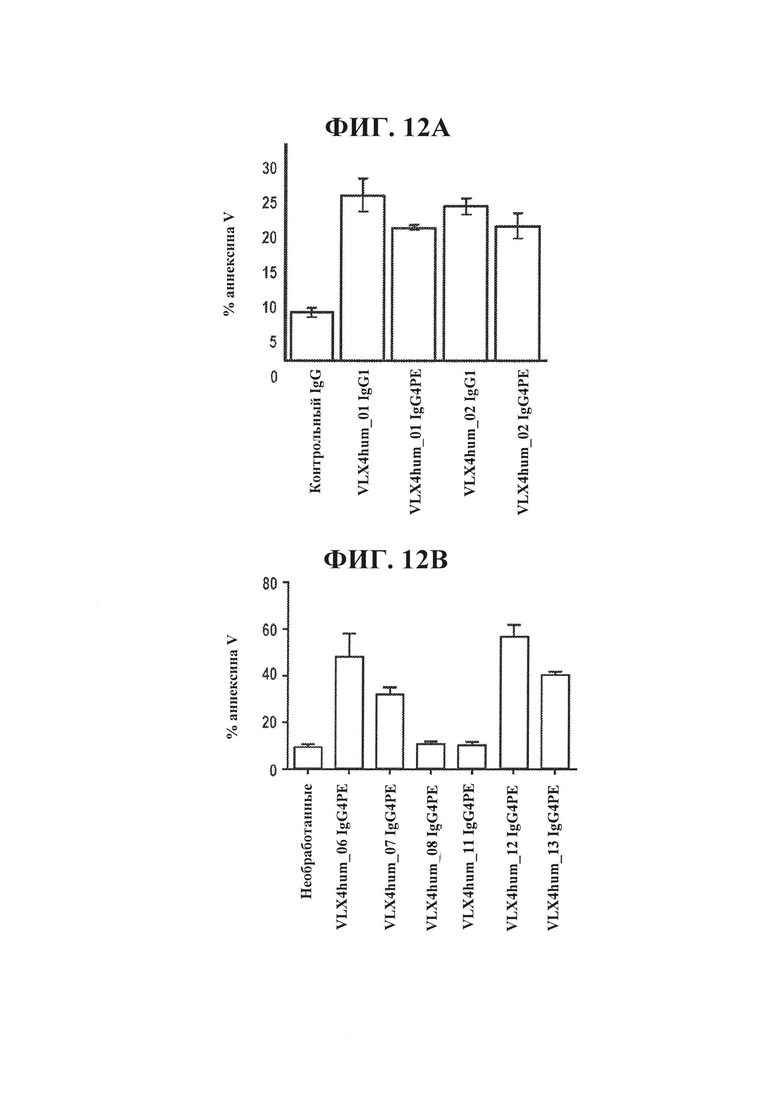
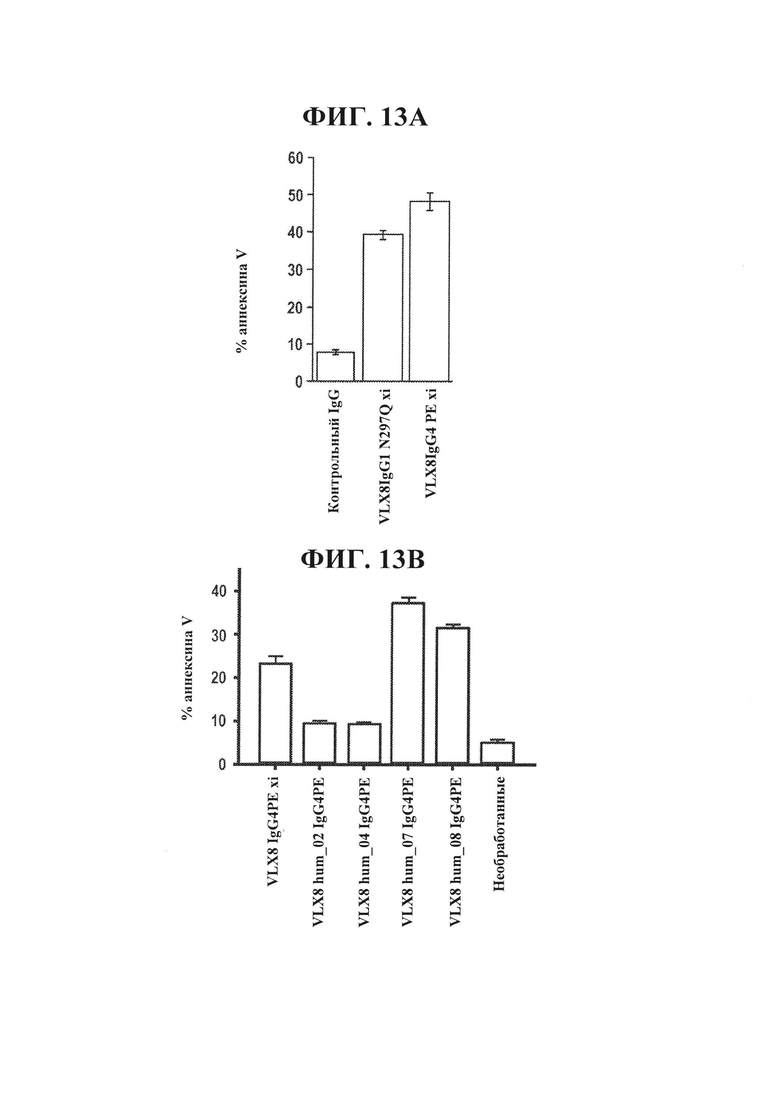

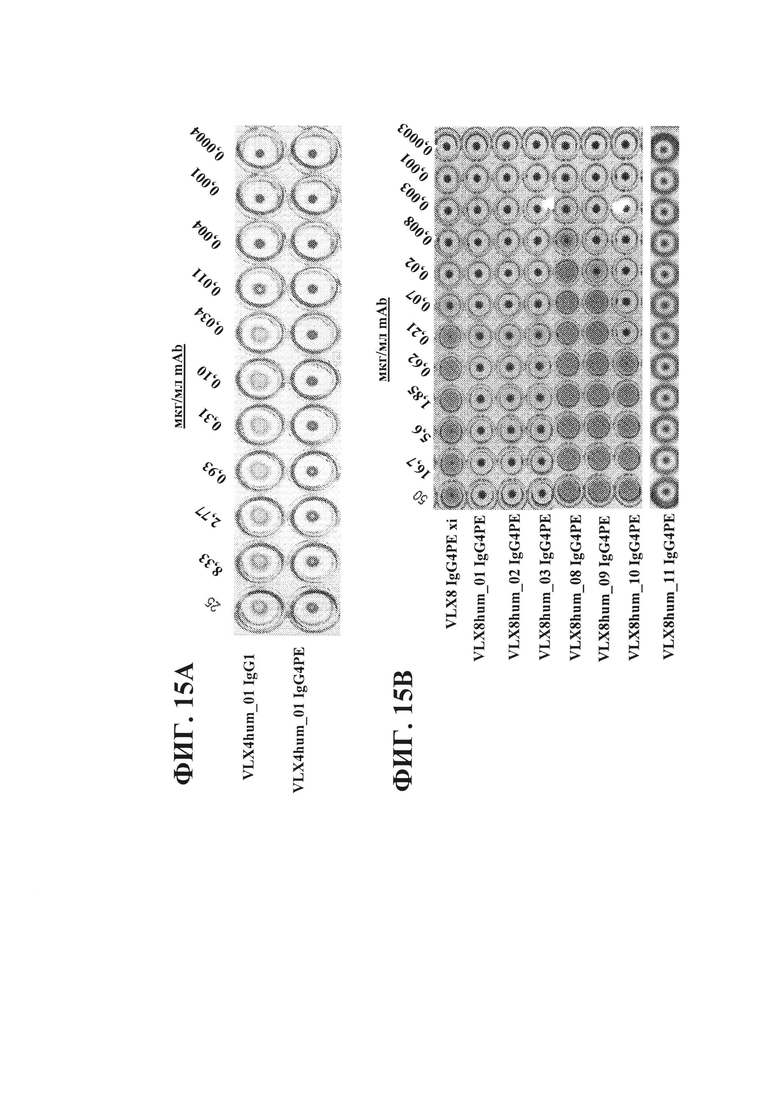

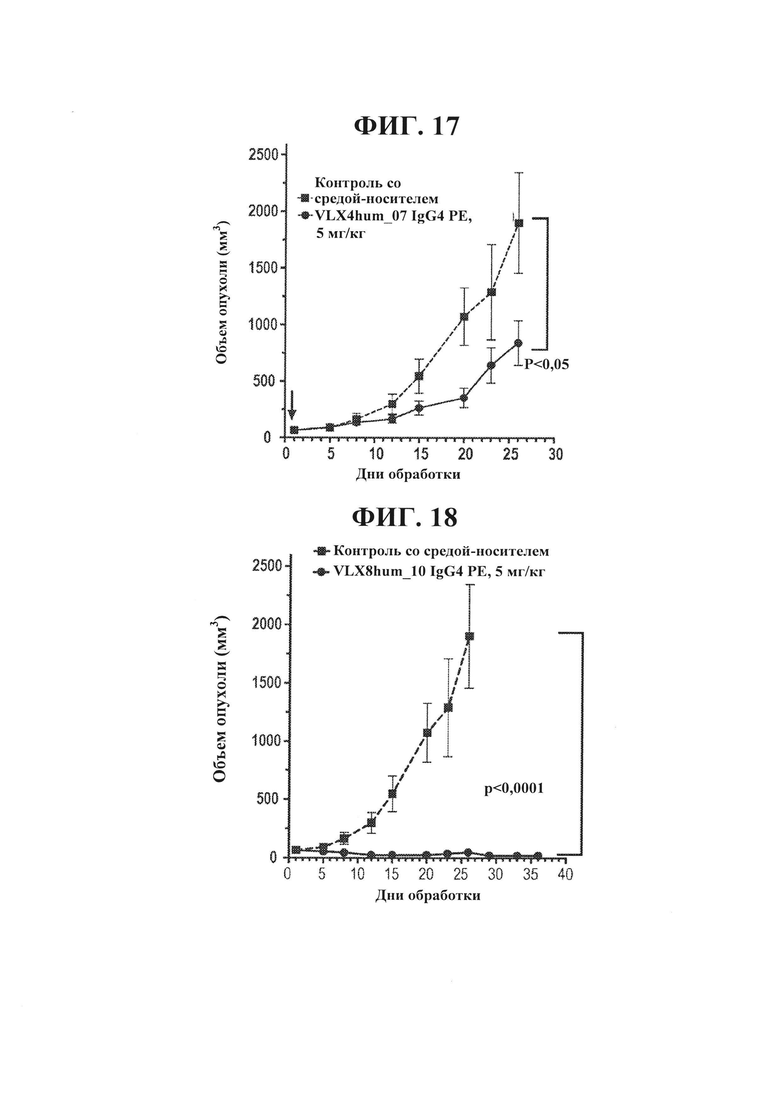
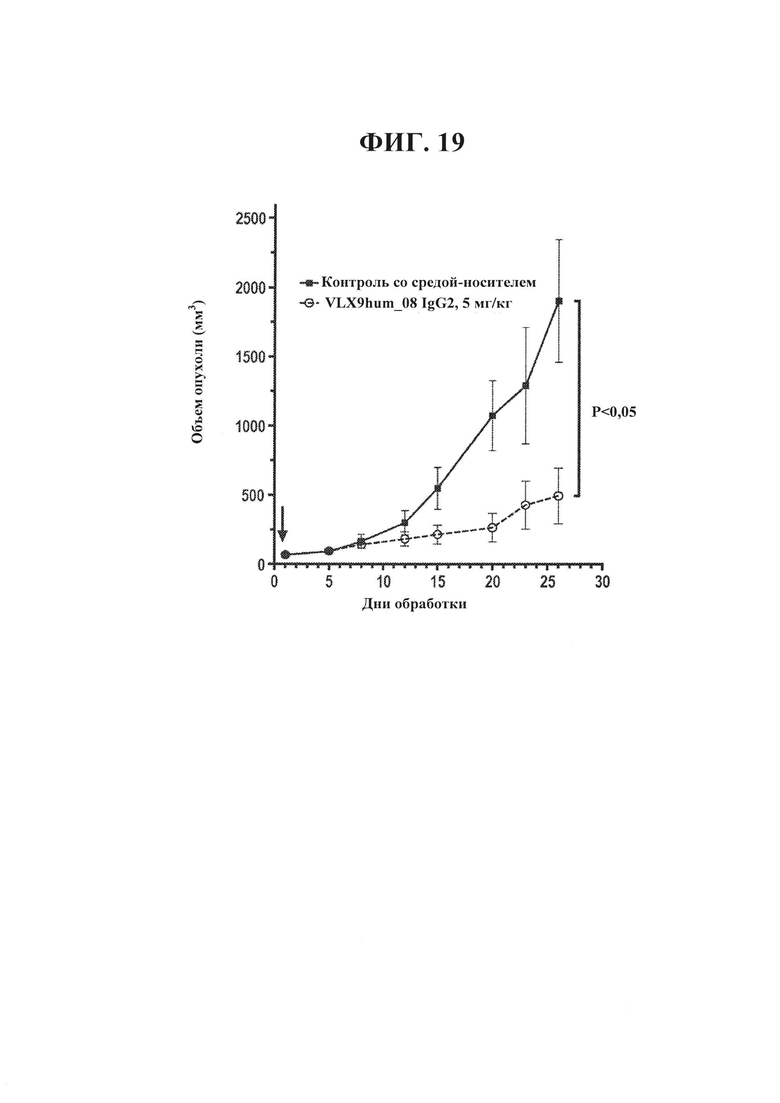


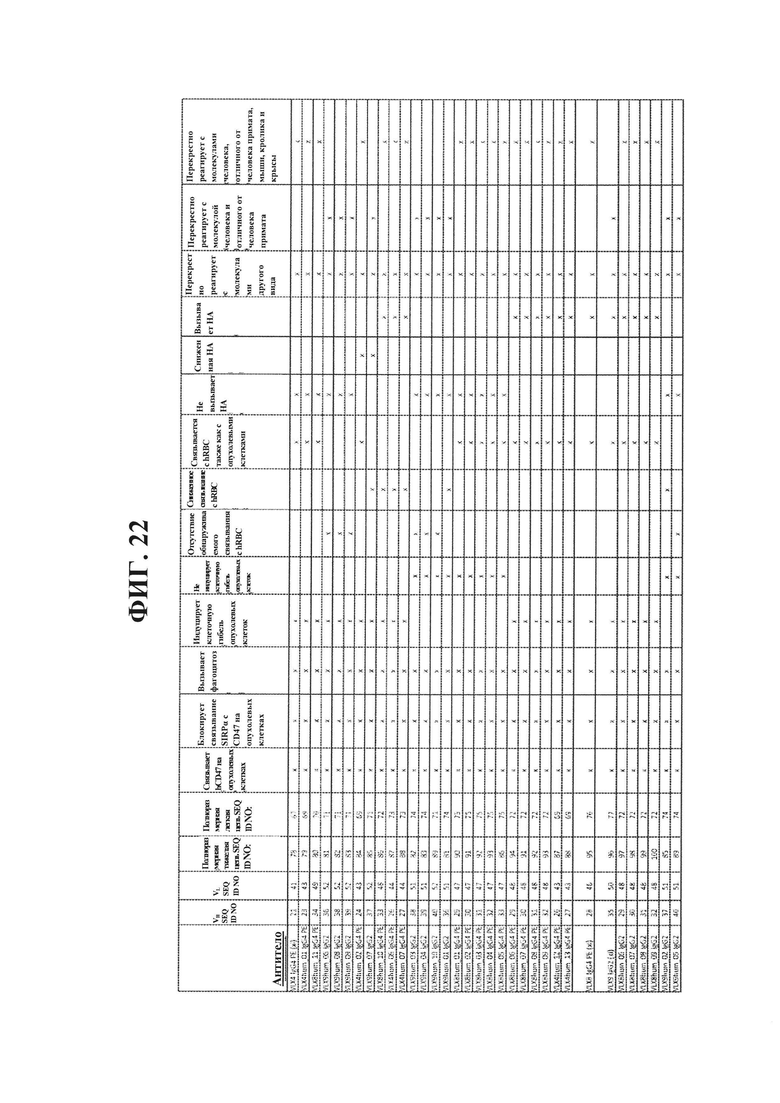
Изобретение относится к области биотехнологии. Предложено моноклональное антитело, специфически связывающее CD47. Также предложена фармацевтическая композиция, включающая указанное антитело, для предупреждения и лечения солидных и гематологических типов рака. Изобретение обеспечивает блокирование взаимодействия между CD47 и его лигандом SIRPальфа и может быть использовано в терапии рака у пациента-человека. 2 н. и 11 з.п. ф-лы, 36 ил., 3 табл., 11 пр.
1. Моноклональное антитело или его антигенсвязывающий фрагмент, которое(ый) специфически связывает CD47 и содержит:
аминокислотную последовательность CDR1 вариабельного домена тяжелой цепи (HCDR1), представленную SEQ ID NO: 3;
аминокислотную последовательность CDR2 вариабельного домена тяжелой цепи (HCDR2), представленную SEQ ID NO: 6;
аминокислотную последовательность CDR3 вариабельного домена тяжелой цепи (HCDR3), представленную SEQ ID NO: 10;
аминокислотную последовательность CDR1 вариабельного домена легкой цепи (LCDR1), представленную SEQ ID NO: 14;
аминокислотную последовательность CDR2 вариабельного домена легкой цепи (LCDR2), представленную SEQ ID NO: 17;
аминокислотную последовательность CDR3 вариабельного домена легкой цепи (LCDR1), представленную SEQ ID NO: 18.
2. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, которое(ый) специфически связывается с CD47 человека.
3. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, которое(ый) представляет собой химерное или гуманизированное антитело.
4. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, которое(ый) специфически связывает по меньшей мере один из CD47 примата, отличного от человека, крысы или мыши.
5. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, которое(ый) не связывается с эритроцитами человека.
6. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 1, содержащее(ий) комбинацию из вариабельного домена тяжелой цепи (VH) и вариабельного домена легкой цепи (VL), где комбинация выбрана из группы:
(i) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 36, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 51;
(ii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 36, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 52;
(iii) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 37, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 51;
(iv) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 37, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 52;
(v) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 38, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 51; и
(vi) вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 38, и вариабельного домена легкой цепи, содержащего аминокислотную последовательность, представленную SEQ ID NO: 52.
7. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 6, содержащее(ий) по меньшей мере одну тяжелую цепь и по меньшей мере одну легкую цепь, выбранные из группы:
(i) тяжелой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 81, и легкой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 73;
(ii) тяжелой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 80, и легкой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 70;
(iii) тяжелой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 81, и легкой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 70;
(iv) тяжелой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 79, и легкой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 70;
(v) тяжелой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 79, и легкой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 73; и
(vi) тяжелой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 80, и легкой цепи, содержащей аминокислотную последовательность, представленную SEQ ID NO: 73.
8. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 7, которое(ый) проявляет одну или несколько эффекторных функций, выбранных из антителозависимой клеточной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC), антителозависимого клеточного фагоцитоза (ADCP) и связывания C1q, в отношении CD47-экспрессирующих раковых клеток.
9. Фармацевтическая композиция для предупреждения и/или лечения солидных и гематологических типов рака, содержащая эффективное количество моноклонального антитела или его антигенсвязывающего фрагмента по п. 7 и фармацевтически или физиологически приемлемый носитель, разбавитель или наполнитель.
10. Фармацевтическая композиция по п. 9 для применения в терапии человека.
11. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 7 для применения в предупреждении или лечении рака у пациента-человека.
12. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 11, где рак выбран из лейкоза, лимфомы, множественной миеломы, рака яичников, рака молочной железы, рака эндометрия, рака толстой кишки (колоректального рака), рака прямой кишки, рака мочевого пузыря, рака уротелия, рака легкого (немелкоклеточного рака легкого, аденокарциномы легкого, плоскоклеточной карциномы легкого), рака бронхов, рака кости, рака предстательной железы, рака поджелудочной железы, рака желудка, гепатоцеллюлярной карциномы, рака желчного пузыря, рака желчных протоков, рака пищевода, почечно-клеточной карциномы, рака щитовидной железы, плоскоклеточной карциномы головы и шеи (рака головы и шеи), рака яичек, рака эндокринной железы, рака надпочечника, рака гипофиза, рака кожи, рака мягких тканей, рака кровеносных сосудов, рака головного мозга, рака нервов, рака глаз, рака оболочек головного мозга, рака ротоглотки, рака гортаноглотки, рака шейки матки и рака матки, глиобластомы, медуллобластомы, астроцитомы, глиомы, менингиомы, гастриномы, нейробластомы, меланомы, миелодиспластического синдрома и саркомы.
13. Моноклональное антитело или его антигенсвязывающий фрагмент по п. 12, где лейкоз выбран из системного мастоцитоза, острого лимфоцитарного (лимфобластного) лейкоза (ALL), T-клеточного ALL, острого миелоидного лейкоза (AML), миелогенного лейкоза, хронического лимфоцитарного лейкоза (CLL), множественной миеломы (MM), хронического миелоидного лейкоза (CML), миелопролиферативного нарушения/неоплазмы, миелодиспластического синдрома, моноцитарного лейкоза и плазмоцитарного лейкоза; где указанная лимфома выбрана из группы, состоящей из гистиоцитарной лимфомы и T-клеточной лимфомы, типов B-клеточной лимфомы, включая лимфому Ходжкина и неходжкинскую лимфому, такую как фолликулярная неходжкинская лимфома низкой степени злокачественности (NHL), клеточная лимфома (FCC), лимфома из клеток мантийной зоны (MCL), диффузная крупноклеточная лимфома (DLCL), мелкоклеточная лимфоцитарная (SL) NHL, фолликулярная NHL средней степени злокачественности, диффузная NHL средней степени злокачественности, иммунобластная NHL высокой степени злокачественности, лимфобластная NHL высокой степени злокачественности, NHL из мелких клеток с нерасщепленными ядрами высокой степени злокачественности, NHL с массивным поражением и макроглобулинемия Вальденстрема; и где указанная саркома выбрана из группы, состоящей из остеосаркомы, саркомы Юинга, лейомиосаркомы, синовиальной саркомы, альвеолярной саркомы мягких тканей, ангиосаркомы, липосаркомы, фибросаркомы, рабдомиосаркомы и хондросаркомы.
| WO 2014123580 A1, 14.08.2014 | |||
| WO 2014123580 A1, 14.08.2014 | |||
| US 2014161799 A1, 12.06.2014 | |||
| ISENBERG J.S | |||
| et al., CD47 Is Necessary for Inhibition of Nitric Oxide-stimulated Vascular Cell Responses by Thrombospondin-1, The Journal of Biological Chemistry, 2006, vol.281, pp.26069-26080 | |||
| SOTO-PANTOJA D | |||
| R | |||
| et al., Therapeutic opportunities for |
Авторы
Даты
2021-05-25—Публикация
2016-09-17—Подача