Настоящее изобретение относится к композиции, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, пептида D3, их гомологов с по меньшей мере 50%-ной идентичностью и производных пептида RD2 или пептида D3 или содержащей указанные пептиды, а также состоящей из полимеров или содержащей полимеры, которые содержат пептид RD2, пептид D3, их гомологи с по меньшей мере 50%-ной идентичностью и производные пептида RD2 и пептида D3 или состоят из указанных пептидов, для применения в качестве болеутоляющего средства (анальгетика), для применения при обезболивающем лечении, для применения при лечении хронических и/или невропатических болей и/или для ингибирования нейронных кальциевых каналов (НКК) N-типа. Изобретение относится далее к способу снижения выделения нейромедиаторов в сравнении с контролем, а также к способу ингибирования нейронного кальциевого канала N-типа с применением вышеуказанной композиции.
Данные Немецкого общества по изучению боли (Deutsche Schmerzgesellschaft) свидетельствуют о том, что более 12 миллионов человек в Германии страдают продолжительными, хроническими болями и/или невропатическими болями. Невропатические боли появляются после повреждения или заболевания афферентных систем в периферической или центральной нервной системе. При фармакотерапии возможно 50-80%-ное уменьшение болей, однако полного отсутствия болей часто достичь не удается. При использовании всех возможных вариантов фармакотерапии примерно 20-40% пациентов лишь в недостаточной степени реагируют на подобное лечение (уменьшение боли менее 30%, так называемые пациенты, не отвечающие на лечение) или страдают от недопустимых побочных эффектов. Наряду с антидепрессантами (три-/тетрациклическими антидепрессантами, избирательно действующими ингибиторами обратного захвата серотонина/норадреналина), опиоидами длительного действия, противосудорожными средствами с действием на нейронные натриевые каналы (например, карбамазепином) и терапевтическими средствами для местного применения (пластырями с лидокаином, пластырями с капсаицином в высокой дозировке) используется лечение лекарственными средствами, оказывающими действие на нейронные кальциевые каналы, такими как габапентин, прегабалин и зиконотид (Ziconotide, торговое наименование Prialt®). При этом габапентин и прегабалин представляют собой специфические ингибиторы кальциевых каналов P/Q-типа, а зиконотид представляет собой единственный разрешенный к применению специфический ингибитор кальциевых каналов N-типа. Зиконотид представляет собой циклический пептид из 25 аминокислот и первоначально был выделен из яда конуса Conus magus в виде ω-конотоксина MVIIA.
Зиконотид используют для лечения пациентов, которые страдают крайне сильными болями и все иные возможные варианты лечения которых оказываются безуспешными. Разрешение на применение препарата Prialt® основано на результатах трех клинических исследований фазы III на более чем 1200 пациентах. Во всех исследованиях зиконотид оказался способен по сравнению с плацебо эффективно уменьшать боли, в том числе и сильные, не поддающиеся лечению хронические боли вследствие онкологического заболевания или СПИДа. Помимо всего прочего дополнительное интратекальное введение зиконотида позволило снизить необходимую дозу опиоидов. По сравнению с морфином зиконотид вызывает меньше нежелательных эффектов.
Однако интратекальное применение зиконотида таит в себе риск занесения потенциально серьезных инфекций, таких как менингит, которые могут быть опасными для жизни. Менингит, заражение которым происходит вследствие проникновения организмов вдоль катетера или случайного загрязнения инфузионной системы, является известным осложнением при интратекальном введении лекарственных средств, прежде всего с использованием внешних систем. Помимо этого зиконотид вызывает у 88% пациентов сильные побочные действия на центральную нервную систему, такие как головокружение, тошнота, нистагм, спутанность сознания, неуверенная походка, нарушения памяти, неясность зрения ("пелена перед глазами"), головные боли, астения, рвота и сонливость. Несмотря на крайне сложный и связанный с высоким риском путь введения и сильные побочные действия зиконотид используется для обезболивающего лечения, поскольку он является единственным разрешенным к применению специфическим ингибитором кальциевых каналов N-типа, который позволяет достигнуть успеха и при очень сильных болях, которые вызваны, например, опухолями или СПИДом и при которых даже морфин уже не приносит никакого облегчения.
В основу настоящего изобретения была положена задача преодолеть недостатки, присущие уровню техники. Задача изобретения состояла прежде всего в том, чтобы предложить композиции, которые обладали бы меньшими побочными действиями и в соответствии с этим специфически и избирательно ингибировали бы НКК N-типа, не оказывая влияния на функцию НКК L-типа. Такие композиции должны допускать возможность их введения в организм простым путем, предпочтительно пероральным путем. Помимо этого ингибирование НКК-каналов N-типа должно носить обратимый характер во избежание долговременного отсутствия болевой чувствительности и во избежание поражения. Желательно было бы, кроме того, наличие значения IC50 выше пикомолярного диапазона с целью обеспечить возможность применения композиций, которое не зависит от особенностей метаболизма, присущих организму конкретного реципиента. При значениях IC50 в пикомолярном диапазоне или ниже даже уже небольшие изменения концентрации действующего вещества приводят к значительным последствиям. Такие изменения могут легко стать причиной недостаточной или избыточной дозировки, которая может зависеть от особенностей метаболизма конкретного индивида и может приводить к нежелательным побочным действиям или долговременным поражениям.
Еще одна задача изобретения состояла в том, чтобы предложить композицию, содержащую действующие вещества, которые обеспечивают преодоление гематоэнцефалического барьера.
Еще одна задача изобретения состояла в том, чтобы предложить стабильные, вводимые в организм энтеральным, внутривенным, подкожным, внутрибрюшинным, интраназальным и/или пероральным путем композиции, которые проявляют свое действие по месту назначения, т.е. на НКК N-типа.
Указанные задачи решаются согласно одному из объектов изобретения с помощью композиции, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, пептида D3, их гомологов с по меньшей мере 50%-ной идентичностью и производных пептида RD2 или пептида D3 или содержащей указанные пептиды, а также состоящей из полимеров или содержащей полимеры, которые содержат пептид RD2, пептид D3, их гомологи с по меньшей мере 50%-ной идентичностью и производные пептида RD2 и пептида D3 или состоят из указанных пептидов, для применения в качестве болеутоляющего средства.
Еще одним объектом настоящего изобретения является композиция, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, пептида D3, их гомологов с по меньшей мере 50%-ной идентичностью и производных пептида RD2 или пептида D3 или содержащей указанные пептиды, а также состоящей из полимеров или содержащей полимеры, которые содержат пептид RD2, пептид D3, их гомологи с по меньшей мере 50%-ной идентичностью и производные пептида RD2 и пептида D3 или состоят из указанных пептидов, для применения при обезболивающем лечении.
Объектом изобретения является далее композиция, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, пептида D3, их гомологов с по меньшей мере 50%-ной идентичностью и производных пептида RD2 или пептида D3 или содержащей указанные пептиды, а также состоящей из полимеров или содержащей полимеры, которые содержат пептид RD2, пептид D3, их гомологи с по меньшей мере 50%-ной идентичностью и производные пептида RD2 и пептида D3 или состоят из указанных пептидов, для применения при лечении хронических и/или невропатических болей.
Еще одним объектом изобретения является композиция, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, пептида D3, их гомологов с по меньшей мере 50%-ной идентичностью и производных пептида RD2 или пептида D3 или содержащей указанные пептиды, а также состоящей из полимеров или содержащей полимеры, которые содержат пептид RD2, пептид D3, их гомологи с по меньшей мере 50%-ной идентичностью и производные пептида RD2 и пептида D3 или состоят из указанных пептидов, для ингибирования нейронных кальциевых каналов (НКК) N-типа.
В одном из вариантов осуществления настоящего изобретения пептид состоит в основном из D-аминокислот. Согласно настоящему изобретению выражение "в основном из D-аминокислот" означает, что используемые согласно изобретению пептиды содержат D-аминокислоты в количестве по меньшей мере 50%, 60%, предпочтительно 75%, 80%, 81%, 82%, 83%, 84%, особенно предпочтительно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, прежде всего 96%, 97%, 98%, 99%, 100%, или состоят из них на по меньшей мере 50%, 60%, предпочтительно 75%, 80%, 81%, 82%, 83%, 84%, особенно предпочтительно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, прежде всего 96%, 97%, 98%, 99%, 100%.
В сравнении с L-энантиомерными пептидами, такими как зиконотид, D-пептиды (in vivo) намного устойчивее к действию протеаз и поэтому предоставляют возможность их перорального приема с длительными периодами полувыведения. Помимо этого D-пептиды по большей части неиммуногенны или лишь незначительно иммуногенны.
Еще один вариант осуществления изобретения относится к вышеописанной композиции для применения в дозе от 1 мкг до 1 г на кг массы тела, предпочтительно от 100 мкг до 10 мг на кг массы тела, особенно предпочтительно от 0,5 до 5 мг на кг массы тела.
Один из вариантов осуществления изобретения относится к вышеописанной композиции для энтерального, внутривенного, подкожного, внутрибрюшинного, интраназального или перорального применения, предпочтительно перорального применения.
В предпочтительном варианте вышеописанная композиция проявляет значение IC50 (концентрация полумаксимального ингибирования) в отношении НКК N-типа от 1 нМ до 1 мМ, предпочтительно от 10 нМ до 100 мкМ, особенно предпочтительно от 100 нМ до 10 мкМ, прежде всего от 100 нМ до 1 мкМ.
Применяемая согласно изобретению композиция в одном из вариантов содержит пептиды или состоит из пептидов, которые выбраны из группы, состоящей из
ANK1; (свободный N-конец, предпочтительно амидированный С-конец): rkrirlvyhinr (SEQ ID NO: 8);
ANK2; (свободный N-конец, предпочтительно амидированный С-конец): rkrirl06yhinr (SEQ ID NO: 9);
ANK3; (свободный N-конец, предпочтительно амидированный С-конец): rkrirl06yhwnr (SEQ ID NO: 10);
ANK4; (свободный N-конец, предпочтительно амидированный С-конец): rkrirlvyhwnr (SEQ ID NO: 11);
ANK5; (свободный N-конец, предпочтительно амидированный С-конец): rkrvrlvyhkkr (SEQ ID NO: 12);
ANK6; (свободный N-конец, предпочтительно амидированный С-конец): rkrirlvtkkkr (SEQ ID NO: 13);
ANK7; (свободный N-конец, предпочтительно амидированный С-конец): rkrvrl02thikr (SEQ ID NO: 14);
ANK15; (свободный N-конец, предпочтительно амидированный С-конец): rprvrl06yhwnr (SEQ ID NO: 15);
ANK16; (свободный N-конец, предпочтительно амидированный С-конец): rkr07rlvtkrnr (SEQ ID NO: 16);
ANK17; (свободный N-конец, предпочтительно амидированный С-конец): rkrirl06yhikr (SEQ ID NO: 17);
ANK18; (свободный N-конец, предпочтительно амидированный С-конец): rpr07rlhtkkkr (SEQ ID NO: 18);
где 02 обозначает 4-фторфенилаланин (D), 06 обозначает фенилглицин (D), а 07 обозначает D-гомоаргинин, или содержащей указанные пептиды.
В одном из альтернативных вариантов производные применяемых согласно изобретению и описанных выше пептидов представляют собой циклизованные или амидированные пептиды.
Применяемые согласно изобретению пептиды в еще одном варианте осуществления изобретения ковалентно связаны на своем свободном С-конце со своим же свободным N-концом и в этом случае, соответственно, представлены в циклизованном виде. Преимущество замыкания цикла состоит также в последующем отсутствии карбоксильной группы на свободном С-конце. Подобные пептиды преимущественно имеют аминокислотную последовательность, в которой произошла циклизация линейной молекулы, например, путем образования ковалентной связи первой аминокислоты с последней, например, с помощью реакции конденсации. Очевидно, что существуют и другие возможности циклизации, при которой, например, между собой соединяют иные аминокислоты. Исключительно в качестве примера можно назвать соединение второй аминокислоты с последней аминокислотой. Точно так же допустимо каждое возможное иное соединение. Преимущество, связанное с соединением между собой первой и последней аминокислот пептида, состоит в отсутствии открытых концов в пептидной цепи (аминокислотной последовательности). Подобная мера приводит далее к тому, что все пептиды с линейными аминокислотными последовательностями, которые после циклизации образуют одинаковые, уже не отличимые друг от друга аминокислотные последовательности, в этом смысле идентичны.
В качестве примера можно рассмотреть следующий. Линейная аминокислотная последовательность известного пептида D3 представляет собой rprtrlhthrnr (SEQ ID NO: 2). Соответствующий циклизованный пептид "cD3", замкнутый путем образования амидной связи между N-концевой аминогруппой и С-концевой карбоксильной группой, более не отличим от циклизованных пептидов с последовательностью prtrlhthrnrr, rtrlhthrnrrp, trlhthrnrrpr, rlhthrnrrprt, lhthrnrrprtr, hthrnrrprtrl, thrnrrprtrlh, hrnrrprtrlht, rnrrprtrlhth, nrrprtrlhthr или rrprtrlhthrn. Из каждой из этих последовательностей, кроме того, также возможно образование циклического пептида cD3.
Аналогичным образом обстоит дело с пептидом RD2, который имеет последовательность ptlhthnrrrrr (SEQ ID NO: 1), с циклизованными пептидами с последовательностью tlhthnrrrrrp, lhthnrrrrrpt, hthnrrrrrptl, thnrrrrrptlh, hnrrrrrptlht, nrrrrrptlhth, rrrrrptlhthn, rrrrptlhthnr, rrrptlhthnrr, rrptlhthnrrr, rptlhthnrrrr и с обозначением "cRD2".
Получение циклизованных пептидов известно из уровня техники и может, например, осуществляться способом, описанным в DE 102005049537 А1.
Преимущество циклизации по первой и последней аминокислотам пептида состоит в последующем отсутствии "открытых" концов в пептидной цепи, которые часто являются местами атаки со стороны различного рода расщепляющих пептиды химически активных факторов в клетках, в организме животных или в организме человека, например, со стороны аминопептидаз и карбоксипептидаз.
Применяемые согласно изобретению пептиды в еще одном варианте его осуществления амидированы на свободном С-конце, в соответствии с чем вместо карбоксильной группы присутствует группа амида кислоты (амидная группа). Таким образом, на С-конце вместо карбоксильной группы (группы -СООН) расположена амидная группа (группа -CONH2). Таким образом, в особенно предпочтительном варианте пептид амидирован на своем свободном С-конце. Благодаря этому достигается еще одно важное преимущество, состоящее в наличии пептида, который не имеет отрицательного избыточного заряда и благодаря большему сродству с молекулой-мишенью способен легче связываться с ней и получение которого возможно простым путем.
В одном из альтернативных вариантов осуществления изобретения вместо карбоксильной группы присутствует группа, выбранная из СОН, COCl, COBr, CONH-алкильного остатка, CONH-алкиламинового остатка (положительный результирующий заряд), при этом перечень групп, которые могут присутствовать вместо карбоксильной группы, не ограничен указанными группами.
Помимо этого в еще одном варианте каждый из применяемых согласно изобретению пептидов удлинен или укорочен на N-конце и/или С-конце на соответственно одну или две аминокислоты по сравнению с исходной последовательностью. В альтернативном варианте один конец имеет одну или две дополнительные аминокислоты, тогда как другой конец имеет на одну или две аминокислоты меньше. В предпочтительном варианте пептиды удлиняют по сравнению с их исходной последовательностью на С-конце на одну аминокислоту, выбранную из группы аминокислот r, l, h и t, предпочтительно на аминокислоту r.
К предпочтительным производным относятся циклизованные (цикло-)пептиды, амидированные пептиды и/или пептиды, последовательность которых удлинена на С-конце на одну аминокислоту, предпочтительно на аргинин r, прежде всего пептид D3r с последовательностью rprtrlhthrnrr (SEQ ID NO: 5) и циклизованный пептид D3r. К следующим предпочтительным производным относятся циклизованные пептиды RD2, а также линейные амидированные формы каждого из них и/или их формы с последовательностью, которая удлинена на С-конце на одну аминокислоту, предпочтительно на аргинин r, т.е. пептид RD2r с последовательностью ptlhthnrrrrrr (SEQ ID NO: 19).
Объектом настоящего изобретения, таким образом, является также пептид RD2r с последовательностью ptlhthnrrrrrr (SEQ ID NO: 19), представляющий собой 13-мер на основе пептида RD2, который на С-конце удлинен на одну аминокислоту, предпочтительно на аминокислоту r. Объектом изобретения является также амидированная форма и/или циклизованная форма cRD2r (аналогично пептиду cRD2). Еще одним объектом изобретения является пептид RD2r, а также его амидированная форма и/или циклизованная форма, предпочтительно cRD2r, для применения в медицине, соответственно в качестве медикамента, предпочтительно для применения при обезболивающем лечении, соответственно при лечении боли, прежде всего хронической и невропатической болей. К следующим применяемым согласно изобретению пептидам относятся пептид RD2RD2 с последовательностью ptlhthnrrrrrptlhthnrrrrr (SEQ ID NO: 3), пептид RD2D3 с последовательностью ptlhthnrrrrrrprtrlhthrnr (SEQ ID NO: 4), пептид цикло-RD2RD2 с последовательностью ptlhthnrrrrrptlhthnrrrrr, пептид цикло-D3r с последовательностью rprtrlhthrnrr, пептид D3p с последовательностью rprtrlhthrnrp (SEQ ID NO: 6) и пептид цикло-D3p, а также пептид D3a с последовательностью rprtrlhthrnra (SEQ ID NO: 7) и цикло-D3a.
Термин "гомологичные последовательности" или "гомологи" согласно настоящему изобретению означает, что аминокислотная последовательность имеет идентичность, соответственно степень идентичности с одной из вышеуказанных аминокислотных последовательностей мономеров по меньшей мере 50%, 55%, 60%, 65%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100%. Вместо термина "идентичность" в настоящем описании в синонимичном значении используется термин "гомологичный" или "гомология". Идентичность между двумя нуклеотидными последовательностями или аминокислотными последовательностями полипептидных цепей вычисляют путем сравнения с помощью программы BESTFIT, основанной на алгоритме, предложенном Smith T.F. и Waterman M.S. (Adv. Appl. Math. 2, 1981, cc. 482-489), при установке следующих параметров для аминокислот: штраф за создание гэпа ("gap creation penalty"): 8 и штраф за удлинение гэпа ("gap extension penalty"): 2, и следующих параметров для нуклеиновых кислот: штраф за создание гэпа: 50 и штраф за удлинение гэпа: 3. В предпочтительном варианте идентичность между двумя нуклеотидными последовательностями или аминокислотными последовательностями полипептидных цепей определяют по идентичности нуклеотидной последовательности/аминокислотной последовательности полипептидной цепи по всей соответствующей длине такой последовательности, вычисляя эту идентичность путем сравнения с помощью программы GAP, основанной на алгоритме, предложенном Needleman S.B. и Wunsch C.D. (J. Mol. Biol. 48, cc. 443-453), при установке следующих параметров для аминокислот: штраф за создание гэпа: 8 и штраф за удлинение гэпа: 2, и следующих параметров для нуклеиновых кислот: штраф за создание гэпа: 50 и штраф за удлинение гэпа: 3.
Две аминокислотные последовательности идентичны согласно настоящему изобретению, если они имеют одну и ту же последовательность.
В одном из альтернативных вариантов гомологию, соответственно идентичность определяют по общей длине каждого из соответствующих пептидов. В другом альтернативном варианте сравнение и тем самым определение идентичности, соответственно гомологии осуществляют только по отдельным участкам, соответственно по отдельным фрагментам.
В этом альтернативном варианте используемые согласно изобретению полипептиды также имеют гомологию по меньшей мере 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100%.
В еще одном варианте осуществления изобретения предлагаемая в нем композиция содержит полимеры или состоит из полимеров, которые содержат пептид RD2, пептид D3, их гомологи с по меньшей мере 50%-ной идентичностью и производные пептида RD2 и пептида D3 или другие вышеописанные пептиды либо состоят из указанных пептидов. Используемый согласно изобретению полимер содержит 2, 3, 4, 5, 6, 7, 8, 9, 10 или более описанных выше мономерных пептидов.
В предпочтительном варианте используют димеры, выбранные из группы, состоящей из пептида RD2D3, пептида D3RD2, пептида D3D3, пептида RD2RD2, их гомологов и производных или содержащей указанные пептиды.
Полимер может также образовывать любая комбинация из 2, 3, 4, 5, 6, 7, 8, 9, 10 или более вышеописанных последовательностей в линейной или циклизованной форме.
Полимеры можно получать, например, путем химического синтеза, соответственно синтеза пептидов.
В одном из вариантов осуществления настоящего изобретения пептиды могут быть соединены между собой в линейную цепь, прежде всего описанным выше образом. В другом варианте пептиды соединены между собой в разветвленную цепь с образованием используемого согласно изобретению полимера. Под разветвленным полимером может согласно изобретению подразумеваться дендример, у которого мономеры соединены между собой ковалентными или нековалентными связями. Альтернативно этому пептиды могут быть также связаны с базовой молекулой, так называемой молекулой-платформой (такой, например, как полиэтиленгликоль (ПЭГ) или углевод), и образовывать тем самым разветвленный полимер.
Мономерные пептиды линейно присоединены друг к другу в порядке "голова к голове", "хвост к хвосту" или "голова к хвосту" с дополнительными линкерами или без них, а в одном из альтернативных вариантов в целом циклизованы путем образования ковалентной связи между обоими оставшимися концами с дополнительными линкерами (например, одной или несколькими аминокислотами) или без них.
В одном из вариантов осуществления настоящего изобретения используемые согласно ему пептиды ковалентно связаны с другими аминокислотами, линкерами, спейсерами и/или функциональными группами.
В одном из альтернативных вариантов осуществления настоящего изобретения эти другие аминокислоты, линкеры, спейсеры и/или функциональные группы не изменяют свойства пептида. В еще одном альтернативном варианте подобные другие аминокислоты, линкеры, спейсеры и/или функциональные группы изменяют свойства пептида. В подобном варианте повышаются/повышается избирательность и/или сродство используемых согласно изобретению полимеров в отношении НКК N-типа.
Под линкером подразумевается одна или несколько молекул, которые присоединены к пептидам ковалентными связями, причем эти линкеры могут быть соединены между собой также ковалентными связями.
Под функциональными группами подразумеваются молекулы, которые ковалентно связаны с пептидами. В одном из вариантов функциональные группы содержат биотиновые группы. Благодаря этому возможно образование сильной ковалентной связи со стрептавидином.
В одном из вариантов осуществления настоящего изобретения пептиды содержат так называемые спейсеры. Под спейсером подразумевается молекула, которая ковалентными связями присоединена к пептиду и обладает определенными физическими и/или химическими свойствами, изменяющими свойства пептида. В одном из вариантов используют гидрофильные или гидрофобные спейсеры, предпочтительно гидрофильные спейсеры. Гидрофильные спейсеры выбирают из группы молекул, включающей полиэтиленгликоль, углевод, глицерин, поли-L-лизин и β-аланин.
Пептиды в одном из альтернативных вариантов связаны с еще одним веществом.
Под такими веществами в одном из вариантов подразумеваются лекарственные средства или действующие вещества согласно их определению, приведенному в параграфе 2, соответственно параграфе 4(19) действующего в Германии Закона об обращении лекарственных средств, по состоянию на сентябрь 2012 г.В одном из альтернативных вариантов действующие вещества представляют собой терапевтически активные вещества, применяемые в качестве лекарственных веществ.
В другом варианте под указанными веществами подразумеваются носители для контролируемого высвобождения действующего вещества (называемые также системами с носителями лекарственных средств ("drug carrier systems")). Цель при этом состоит, с одной стороны, в предотвращении быстрого выведения действующих веществ из организма. Большинство традиционных действующих веществ имеют молекулы малых размеров и поэтому лишь короткое время остаются в системе кровообращения, поскольку они из-за размера своих молекул находятся ниже почечного порога и по этой причине отделяются от крови и вновь выводятся из организма. С другой стороны, такими системами с носителями действующих веществ они направленно транспортируются в место вблизи определенных органов или клеток и контролируемо высвобождаются в этом месте.
Под указанными веществами в еще одном варианте подразумеваются вещества, которые усиливают действие пептидов. В одном из альтернативных вариантов подобными соединениями являются аминопиразол и/или его производные. К производным аминопиразола согласно изобретению относятся 3-аминопиразол-5-карбоновая кислота или 3-нитропиразол-5-карбоновая кислота, а также все производные, в которых гетероциклическая группа СН заменена на -CR-, -N-, -О- или -S-, и все полученные их них пептидные димеры, тримеры или тетрамеры, предпочтительно тример аминопиразола. В еще одном альтернативном варианте речь идет о соединениях, которые улучшают растворимость пептидов и/или преодоление гематоэнцефалического барьера.
Подобное вещество соединено с пептидом путем образования ковалентной связи или без ее образования. Соединение в данном случае осуществляется водородными мостиками, в результате гидрофильного, гидрофобного или электростатического взаимодействия, соответственно в результате образования гидрофильной, гидрофобной или электровалентной связи и/или путем стерической иммобилизации.
Следующим объектом настоящего изобретения является способ снижения выделения нейромедиаторов в сравнении с контролем, отличающийся тем, что композицию, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, пептида D3, их гомологов с по меньшей мере 50%-ной идентичностью и производных пептида RD2 или пептида D3 или содержащей указанные пептиды, а также состоящей из полимеров или содержащей полимеры, которые содержат пептид RD2, пептид D3, их гомологи с по меньшей мере 50%-ной идентичностью и производные пептида RD2 и пептида D3 или состоят из указанных пептидов, и которая предназначена для применения в качестве болеутоляющего средства, вводят в контакт с нейронным кальциевым каналом N-типа.
Предлагаемым в изобретении способом прежде всего снижают поступление кальция через нейронный кальциевый канал в сравнении с контролем.
Помимо этого объектом изобретения является также способ ингибирования нейронного кальциевого канала N-типа в сравнении с контролем, отличающийся тем, что нейронный кальциевый канал вводят в контакт с композицией, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, пептида D3, их гомологов с по меньшей мере 50%-ной идентичностью и производных пептида RD2 или пептида D3 или содержащей указанные пептиды, а также состоящей из полимеров или содержащей полимеры, которые содержат пептид RD2, пептид D3, их гомологи с по меньшей мере 50%-ной идентичностью и производные пептида RD2 и/или пептида D3.
Согласно изобретению выражение "вводят в контакт" означает наличие условий, обеспечивающих возможность взаимодействия между используемыми согласно изобретению пептидами и нейронным кальциевым каналом N-типа, прежде всего физических и/или химических взаимодействий, таких, например, как образование координационных связей или водородных мостиков.
Выбор контроля является стандартной частью экспериментального метода. В качестве контроля используют организм, который в одном из возможных вариантов идентичен исследуемому организму. Исследуемый организм подвергают действию предлагаемой в изобретении композиции, соответственно вводят в контакт с ней в наиболее широком смысле этого выражения, тогда как контроль (контрольный организм) не подвергают такой процедуре. Согласно изобретению термин "организм" охватывает также части организмов, ткани, пробы тканей, отдельные клетки или клеточные культуры, части клеток, такие как мембраны, содержащие НКК, предпочтительно N- или L-типа, или искусственные мембраны, такие, например, как двухслойная липидная мембрана, содержащие нейронные кальциевые каналы, предпочтительно N-типа и/или L-типа. Контроль, равно как и исследуемый организм выбирают из вышеуказанного перечня. В другом возможном варианте контроль определяется согласно заданным условиям клинических исследований, соответственно согласно заданным требованиям к ним.
Согласно изобретению термин "ингибирование" означает снижение активности нейронных кальциевых каналов, предпочтительно N-типа, под действием применяемой согласно изобретению композиции по отношению к контролю. Контроль согласно изобретению не вводят в контакт с этой композицией. Альтернативно этому контроль можно также вводить в контакт с известными ингибиторами.
Сравнив применение известных ингибиторов с применением используемой согласно изобретению композиции, можно также сделать вывод о ее эффективности.
В одном из вариантов осуществления настоящего изобретения ингибирование определяют при концентрации, которая соразмерна значению IC50, соответственно равна ему.
Используемые согласно изобретению композиции ингибируют НКК N-типа на по меньшей мере 10%, 15%, 20%, 25%, предпочтительно на 30%, особенно предпочтительно на 40%, 50%, 60%, 70%, 80%, прежде всего на 90% или 100%.
В одном из вариантов ингибирование определяют согласно изобретению так называемым методом пэтч-кламп (методом фиксации потенциала). При этом измеряют ионный ток через кальциевый канал при разных значениях напряжения. Ингибирование нейронного кальциевого канала, таким образом, определяют по уменьшению ионного тока. В одном из альтернативных вариантов ионный ток уменьшается на по меньшей мере 10%, 15%, 20%, 25%, предпочтительно на 30%, 35%, особенно предпочтительно на 40%, 42%, 44%, 46%, 48%, 50%, 52%, 54%, 56%, 58%, 60%, 70%, 80%, прежде всего на 90% или 100%. В предпочтительном варианте уменьшение ионного тока определяют при концентрации пептидов, равной значению IC50. В одном из вариантов измерение методом пэтч-кламп проводят при введении соответствующего канала в контакт с применяемой согласно изобретению композицией в концентрации 150нМ.
Предлагаемые в изобретении способы отличаются тем, что функция НКК L-типа не изменяется по отношению к контролю. Иными словами, поступление кальция через НКК L-типа не изменяется по отношению к контролю. Используемые согласно изобретению пептиды действуют специфично и/или избирательно на НКК N-типа.
Объектом настоящего изобретения является также применение используемых согласно изобретению пептидов в качестве замены конотоксину.
Так, в частности, введение в контакт с НКК, соответственно с содержащей их мембраной или с соответствующими содержащими их источниками можно осуществлять in vitro (ex vivo).
Изобретение относится также к лечению хронических и/или невропатических болей, т.е. к лечению, которое направлено на утоление болей и при котором в организм подвергаемого лечению индивида энтеральным, внутривенным, подкожным, внутрибрюшинным, интраназальным или пероральным путем, предпочтительно пероральным путем, вводят используемые согласно изобретению пептиды в количестве от 1 мкг до 1 г на кг массы тела.
Таким образом, изобретение относится также к способу, заключающемуся во включении используемых согласно изобретению пептидов в состав лекарственных (фармацевтических) препаратов распространенными, известными специалисту методами. В соответствии с этим объектом изобретения является также применение вышеописанных пептидов в лекарственных препаратах. Тем самым лекарственный препарат, содержащий используемые согласно изобретению и описанные выше пептиды, равным образом является объектом настоящего изобретения.
Объектом настоящего изобретения является далее применение композиции, заявленной в п.формулы изобретения, для приготовления болеутоляющего средства, лекарственного средства для применения при обезболивающем лечении и/или лекарственного средства для лечения хронических и невропатических болей.
Еще одним объектом изобретения является применение композиции, заявленной в п. 1 формулы изобретения, для ингибирования нейронных кальциевых каналов (НКК) N-типа.
При осуществлении предлагаемого в изобретении способа можно также использовать другие, описанные выше пептиды, их производные и гомологи.
Процедуры, описанные в последующих примерах, можно осуществлять с любым из вышеописанных пептидов.
Примеры
1. Пептид RD2 (амидированный на С-конце)
А. Белковые конструкции
Кодирующие области обоих разных пороформирующих субъединиц α1 (CaVα1) потенциалозависимого кальциевого канала лигировали с флуоресцентными белками с сохранением рамки считывания (лигирование по С-концам) следующим путем. Субъединицу из кролика CaV1.2 (UniProtKB:P15381) сшивали с желтым флуоресцентным белком YFP (CaV1.2-YFP), тогда как человеческую субъединицу CaV2.2 (UniProtKB:Q00975-l) сшивали с зеленым флуоресцентным белком GFP (CaV2.2-GFP). Одну β-субъединицу CaVβ2е (UniProtKB:Q8VGC3-2) присоединяли к мономерному красному флуоресцентному белку mRFP (CaVβ2e-mRFP), а другую β-субъединицу CaVβ4 (UniProtKB:O00305.2) присоединяли к мономерному красному флуоресцентному белку mCherry (CaVβ4-mCherry).
Б. Трансфекция клеток
Поскольку нормальная функция и поверхностная экспрессия субъединицы CaVα1 требует сборки (ассоциации) с субъединицей CaVβ, клетки линии tsA201 подвергали временной котрансфекции либо белковыми конструкциями CaV1 2-YFP и CaVβ2e-mRFP, либо белковыми конструкциями CaV2.2-GFP и CaVβ4-mCherry. Трансфекцию осуществляли посредством реагента Lipofectamine 2000™ (фирма Invitrogen) и успешно трансфицированные клетки идентифицировали на основании сигнала флуоресценции. Электрофизиологическую регистрацию отведений проводили через 24-48 ч после трансфекции.
В. Электрофизиологические исследования
Ионные токи измеряли методом пэтч-кламп в конфигурации "whole cell" ("целая клетка"), используя усилитель ЕРС-10 с установленным на нем программным обеспечением PatchMaster (фирма НЕКА Elektronik). В качестве носителя использовали барий. Микропипетки из боросиликатного стекла с сопротивлением от 0,9 до 2 МОм изготавливали на устройстве для их вытяжки (пуллере) Sutter Р-1000 (фирма Harvard Apparatus) и поверхность их кончиков подвергали термической полировке, используя микрокузницу MF-830 фирмы Narishige. В качестве внешнего раствора при измерениях использовали раствор следующего состава: ТЭА-MeSO3 в концентрации 140 мМ (ТЭА означает тетраэтиламмоний), BaCl2 в концентрации 10 мМ и HEPES (рН 7,3) в концентрации 10 мМ (HEPES означает N-2-гидроксиэтилпиперазин-N'-2-этансульфоновую кислоту), а в качестве внутреннего раствора использовали раствор следующего состава: Cs-MeSO3 в концентрации 135 мМ, EGTA в концентрации 10 мМ (EGTA означает этиленгликольтетрауксусную кислоту), CsCl2 в концентрации 5 мМ, MgCl2 в концентрации 1 мМ, MgATP в концентрации 4 мМ (АТР означает аденозинтрифосфат), Na2GTP в концентрации 0,4 мМ (GTP означает гуанозинтрифосфат) и HEPES (рН 7,3) в концентрации 10 мМ. Анализ данных проводили, используя комбинацию программного обеспечения FitMaster (фирма НЕКА), программного обеспечения Origin (фирма OriginLab) и программного обеспечения Excel (фирма Microsoft). Все данные представляли в виде среднего значения ± стандартная ошибка. Ионные токи корректировали, используя протокол Р/4 (вычитание утечки).
Для исследования фармакологического действия пептида RD2 клетки открепляли и переносили в перфузионный поток, который содержал испытуемое вещество или же не содержал его. Наблюдения осуществляли при постоянной перфузии с целью обеспечить постоянную концентрацию испытуемого вещества. Пептид RD2 растворяли в деметилсульфоксиде (ДМСО) с конечной концентрацией 1 мМ и незадолго до применения растворяли во внешнем растворе до концентрации 150 нМ. В экспериментах с контролем использовали известные блокаторы кальциевых каналов CaV1.2 и CaV2.2, а именно: нимодипин (в концентрации 10 мкМ) и ω-конотоксин (в концентрации 1нМ).
Г. Результаты
Влияние пептида RD2 на опосредуемые кальциевыми каналами CaV2.2 ионные потоки
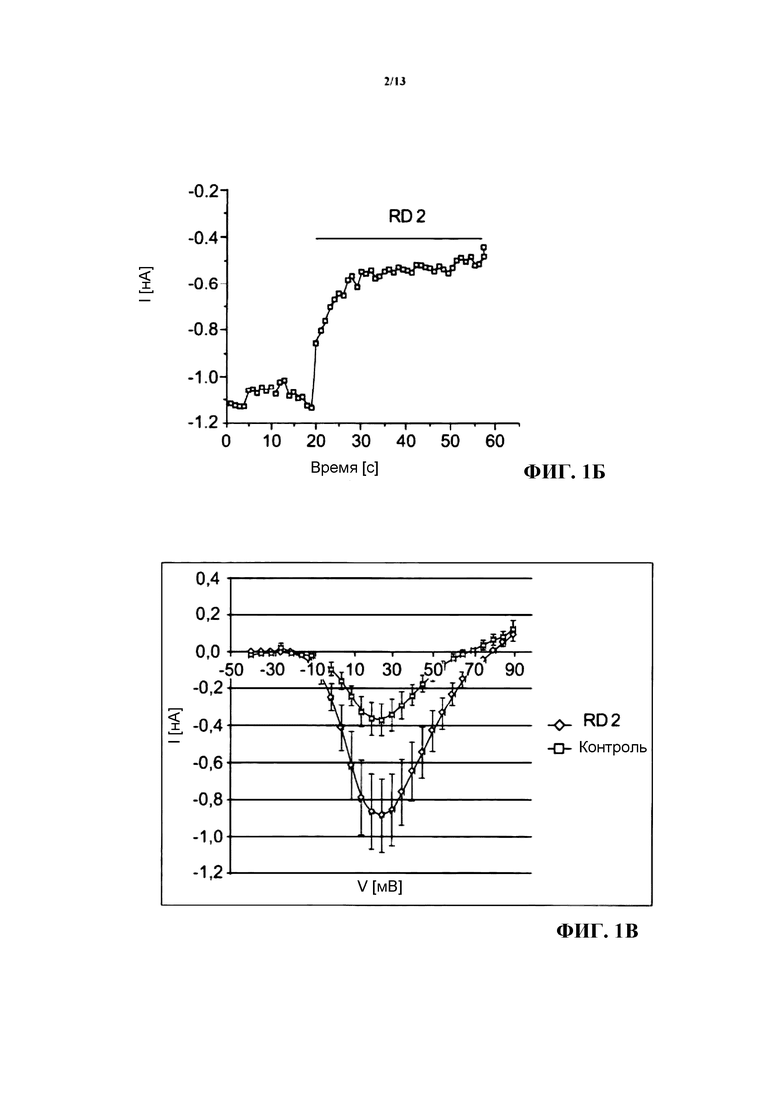
Кальциевые каналы CaV2.2 локализованы в пресинаптических нервных окончаниях и опосредуют передачу нервных импульсов на центральные синапсы. Опосредуемые кальциевыми каналами CaV2.2 ионные токи регистрировали на клетках линии tsA201, экспрессирующих CaV2.2/CaVβ4. Перфузия клеток внешним раствором, содержащим пептид RD2 (150 нМ), но не исключительно внешним раствором, приводила к значительному уменьшению ионного тока (см. фиг. 1А и 1Б, где на фиг.1А приведен репрезентативный график изменения силы тока, опосредуемого каналом CaV2.2, в ответ на подачу импульса длительностью 40 мс с изменением потенциала с начального потенциала покоя, равного -90 мВ, до потенциала, равного +20 мВ, до и после введения в контакт с композицией, содержащей пептид RD2 в концентрации 150 мМ, а на фиг.1Б приведена временная характеристика процесса ингибирования, зарегистрированного в репрезентативной клетке, при подаче последовательных импульсов каждые пять секунд с изменением потенциала от -90 мВ до +20 мВ). Вольтамперная характеристика (зависимость тока I от напряжения V) свидетельствовала об уменьшении ионного тока при всех исследовавшихся значениях напряжения на величину вплоть до 55% (см. фиг. 1В, где в графическом виде представлено усредненное отношение силы тока к напряжению у клеток, экспрессирующих кальциевые каналы CaV2.2, в присутствии и в отсутствие пептида RD2 (n=7)). Подавление ионного тока не сопровождалось изменением потенциалозависимой активации канала, что приводит к предположению о наличии у пептида RD2 пороблокирующего механизма (см. фиг.1Г, где в графическом виде представлена доля активированных каналов в функции напряжения (кривая активации) для тех же клеток, что и на фиг.1В, в сравнении с контролем: тем самым не происходит никакого изменения функции или механизма действия канала, поскольку кривые накладываются друг на друга и не смещены друг относительно друга). Ионные токи прерываются после воздействия блокатором кальциевых каналов CaV2.2, а именно ω-конотоксином в концентрации 1 нМ, чем подтверждается тот факт, что ионные токи опосредовались каналом CaV2.2 (см. вставку на фиг.1А).
Влияние пептида RD2 на опосредуемые кальциевыми каналами CaV1.2 ионные токи
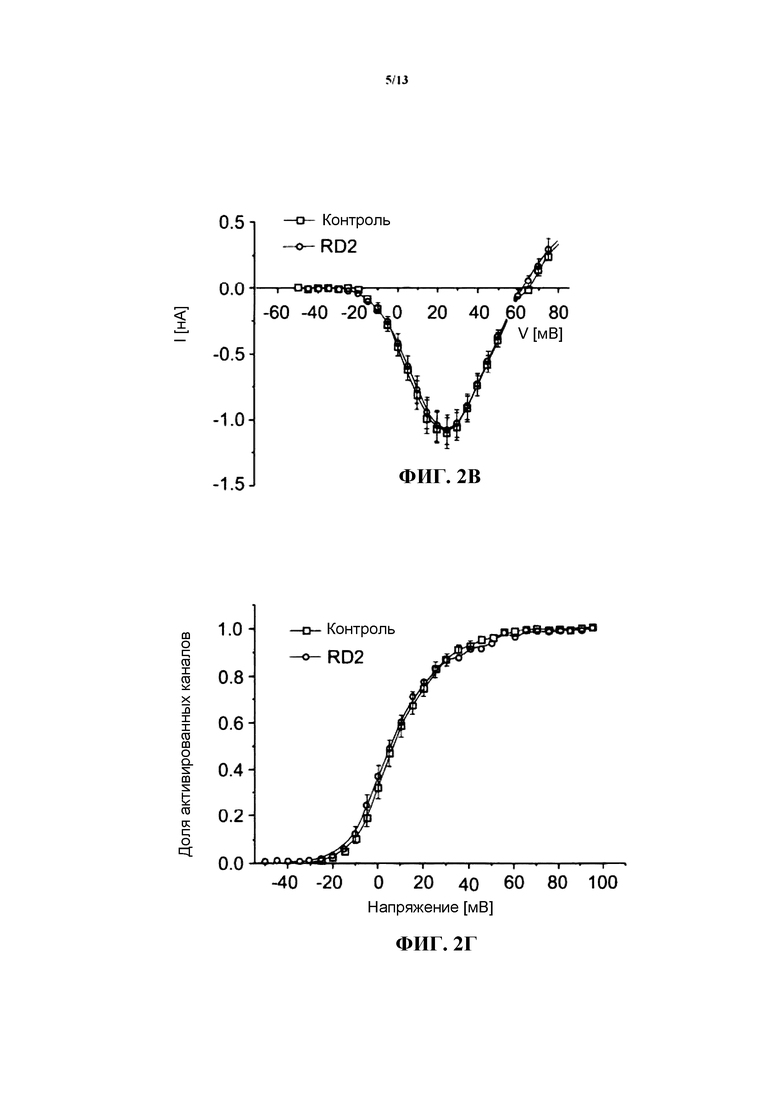
Белок CaVl.2 является кальциевым каналом L-типа, который экспрессируется преимущественно в сердце и ответственен за связь электрической активации кардиомиоцитов с сокращением миофиламентов. Ионные токи регистрировались на коэкспрессирующих CaV1.2 и CaVβ2е клетках и оставались почти неизменными после воздействия пептидом RD2 в концентрации 150 нМ (см. фиг.2А, где приведены репрезентативные графики изменения силы тока, опосредуемого каналом CaV1.2, в ответ на подачу импульса длительностью 40 мс с изменением потенциала с начального потенциала покоя, равного -90 мВ, до потенциала, равного +10 мВ, до и после введения в контакт с композицией, содержащей пептид RD2 в концентрации 150 мМ, и фиг.2Б, где приведена соответствующая временная характеристика, указывающая на отсутствие всякого изменения силы тока при перфузии раствором, содержащим пептид RD2 в концентрации 150 нМ). В отличие от этого перфузия раствором, содержащим нимодипин в концентрации 10 мкМ, который представляет собой известный блокатор канала CaV1.2, приводила к почти полному подавлению ионного тока. Таким образом, присутствие пептида RD2 не влияло на потенциалозависимость активации канала CaV1.2 (см. фиг.2В и 2Г).
Д. Выводы
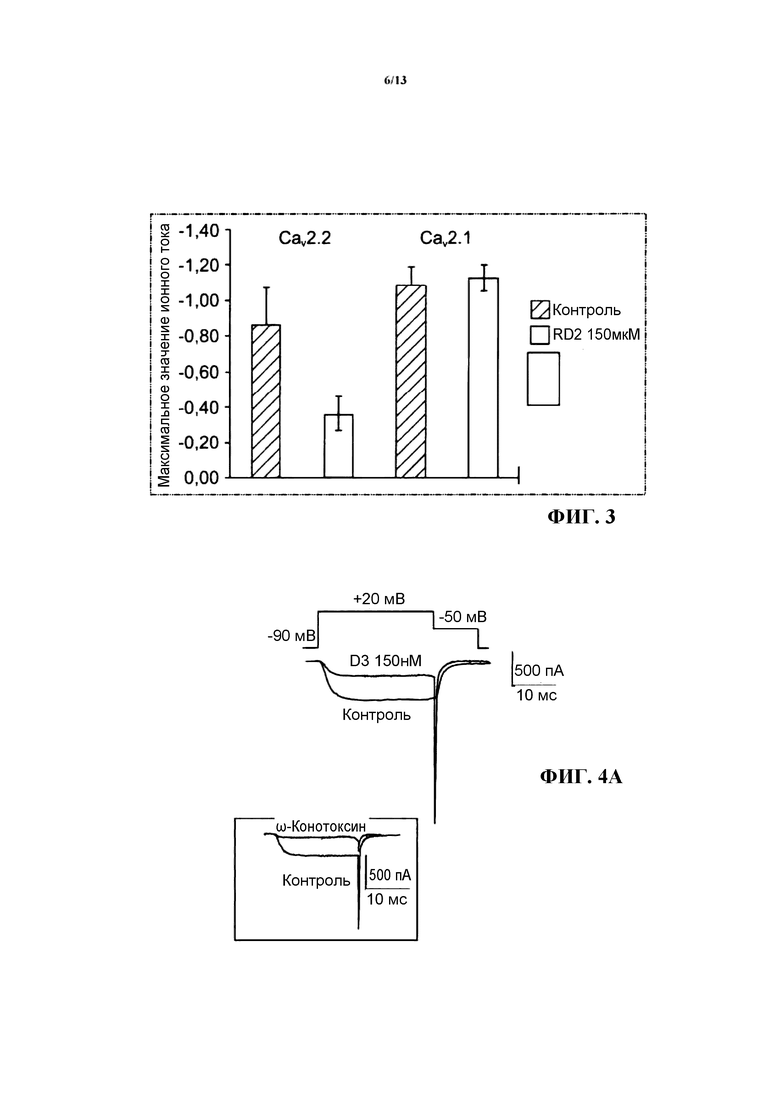
Пептид RD2 исследовали в концентрации 150нМ на его способность подавлять (блокировать) ионные токи, опосредуемые каналами CaV2.2 и CaV1.2. Исследования проводили на клетках линии tsA201, экспрессирующих каналы CaV2.2 и CaV1.2, используя метод пэтч-кламп в конфигурации "whole cell".
Пептид RD2 блокирует канал CaV2.2, тогда как канал CaV1.2 невосприимчив к пептиду RD2 в исследовавшейся концентрации (фиг.3).
2. Пептид D3 (амидированный на С-конце)
A. Белковые конструкции
Кодирующую область человеческих пороформирующих субъединиц α1 (CaVα1) потенциалозависимого кальциевого канала CaV2.2 (UniProtKB:Q00975-1) сшивали с зеленым флуоресцентным белком GFP с получением конструкции CaV2.2-GFP. β-Субъединицу CaVβ4 (UniProtKB:O00305.2) сшивали с мономерным красным флуоресцентным белком mCherry с получением конструкции CaVβ4-mCherry.
Б. Трансфекция клеток
Поскольку нормальная функция и поверхностная экспрессия субъединицы CaVα1 требует сборки (ассоциации) с субъединицей CaVβ, клетки линии tsA201 подвергали временной котрансфекции белковыми конструкциями CaV2.2-GFP и CaVβ4-mCherry. Трансфекцию осуществляли посредством реагента Lipofectamine 2000™ (фирма Invitrogen) и успешно трансфицированные клетки идентифицировали на основании сигнала флуоресценции. Электрофизиологическую регистрацию отведений проводили через 24-48 ч после трансфекции.
B. Электрофизиологические исследования
Ионные токи измеряли методом пэтч-кламп в конфигурации "whole cell" ("целая клетка"), используя усилитель ЕРС-10 с установленным на нем программным обеспечением PatchMaster (фирма НЕКА Elektronik). В качестве носителя использовали барий. Микропипетки из боросиликатного стекла с сопротивлением от 0,9 до 2 МОм изготавливали на устройстве для их вытяжки (пуллере) Sutter Р-1000 (фирма Harvard Apparatus) и поверхность их кончиков подвергали термической полировке, используя микрокузницу MF-830 фирмы Narishige. В качестве внешнего раствора при измерениях использовали раствор следующего состава: ТЭА-MeSO3 в концентрации 140 мМ, BaCl2 в концентрации 10 мМ и HEPES (рН 7,3) в концентрации 10 мМ, а в качестве внутреннего раствора использовали раствор следующего состава: Cs-MeSO3 в концентрации 135 мМ, EGTA в концентрации 10 мМ, CsCl2 в концентрации 5 мМ, MgCl2 в концентрации 1 мМ, MgATP в концентрации 4 мМ, Na2GTP в концентрации 0,4 мМ и HEPES (рН 7,3) в концентрации 10 мМ. Анализ данных проводили, используя комбинацию программного обеспечения FitMaster (фирма НЕКА), программного обеспечения Origin (фирма OriginLab) и программного обеспечения Excel (фирма Microsoft). Все данные представляли в виде среднего значения ± стандартная ошибка. Ионные токи корректировали, используя протокол Р/4 (вычитание утечки).
Для исследования фармакологического действия пептида D3 клетки открепляли и переносили в перфузионный поток, который содержал испытуемое вещество или же не содержал его. Наблюдения осуществляли при постоянной перфузии с целью обеспечить постоянную концентрацию испытуемого вещества. Пептид D3 растворяли в ДМСО с конечной концентрацией 1 мМ и незадолго до применения растворяли во внешнем растворе до концентрации 150 нМ. В экспериментах с контролем использовали известный блокатор кальциевых каналов CaV2.2, а именно ω-конотоксин (в концентрации 1нМ).
Г. Результаты
Влияние пептида D3 на опосредуемые кальциевыми каналами CaV2.2 ионные потоки
Опосредуемые кальциевыми каналами CaV2.2 ионные токи регистрировали на клетках линии tsA201, экспрессирующих CaV2.2/CaBβ4. Перфузия клеток внешним раствором, содержащим пептид D3 (150 нМ), но не исключительно внешним раствором, приводила к значительному уменьшению ионного тока (см. фиг.4А и 4Б, где на фиг.4А приведен репрезентативный график изменения силы тока, опосредуемого каналом CaV2.2, в ответ на подачу импульса длительностью 40 мс с изменением потенциала с начального потенциала покоя, равного -90 мВ, до потенциала, равного +20 мВ, до и после введения в контакт с композицией, содержащей пептид D3 в концентрации 150 мМ, а на фиг.4Б приведена характеристика процесса индуцированного пептидом D3 ингибирования, которое носит обратимый характер после реперфузии внешним раствором Рингера; силу тока регистрировали при подаче последовательных импульсов каждые 5 секунд с изменением потенциала от -90 мВ до +20 мВ). Вольтамперная характеристика (зависимость тока I от напряжения V) свидетельствовала об уменьшении ионного тока при всех исследовавшихся значениях напряжения на величину вплоть до 54% (см. фиг.4В). Подавление ионного тока не сопровождалось изменением потенциалозависимой активации канала, что приводит к предположению о наличии у пептида D3 пороблокирующего механизма (см. фиг.4Г). Ионные токи прерываются после воздействия блокатором кальциевых каналов CaV2.2, а именно ω-конотоксином в концентрации 1нМ, чем подтверждается тот факт, что ионные токи опосредовались каналом CaV2.2 (см. вставку на фиг.4А).
Д. Выводы
Пептид D3 блокирует канал CaV2.2 (фиг.5).
3. Пептид с D3 (циклизованный пептид D3) и пептид cRD2 (циклизованный пептид RD2)
Эксперименты проводили аналогично примерам 1 и 2.
Обобщенные данные о влиянии пептидов cD3r и cRD2r на каналы CaV2.2 и CaV1.2 (фиг.6)
На обеих столбиковых диаграммах обобщены данные о средних ионных токах, при этом такие диаграммы отражают зависимость силы тока от напряжения, которое составляло +20 мВ в экспериментах с каналом CaV2.2 и +10 мВ в экспериментах с каналом CaV1.2. **р≤0,01
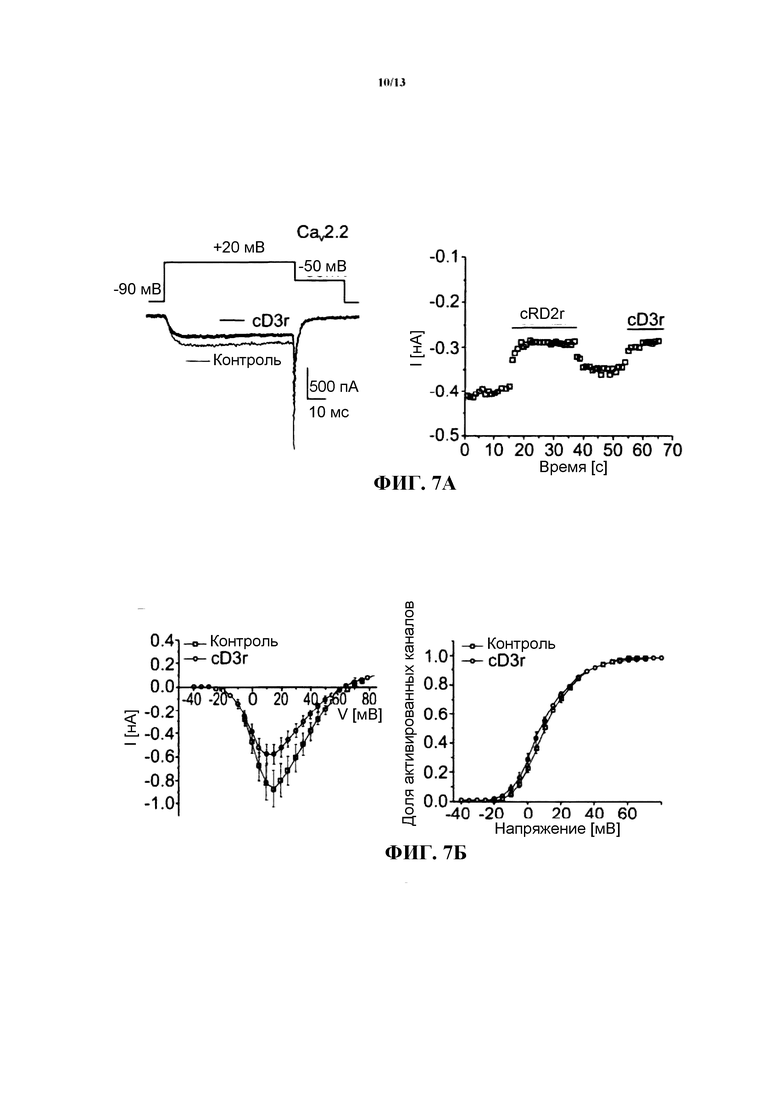
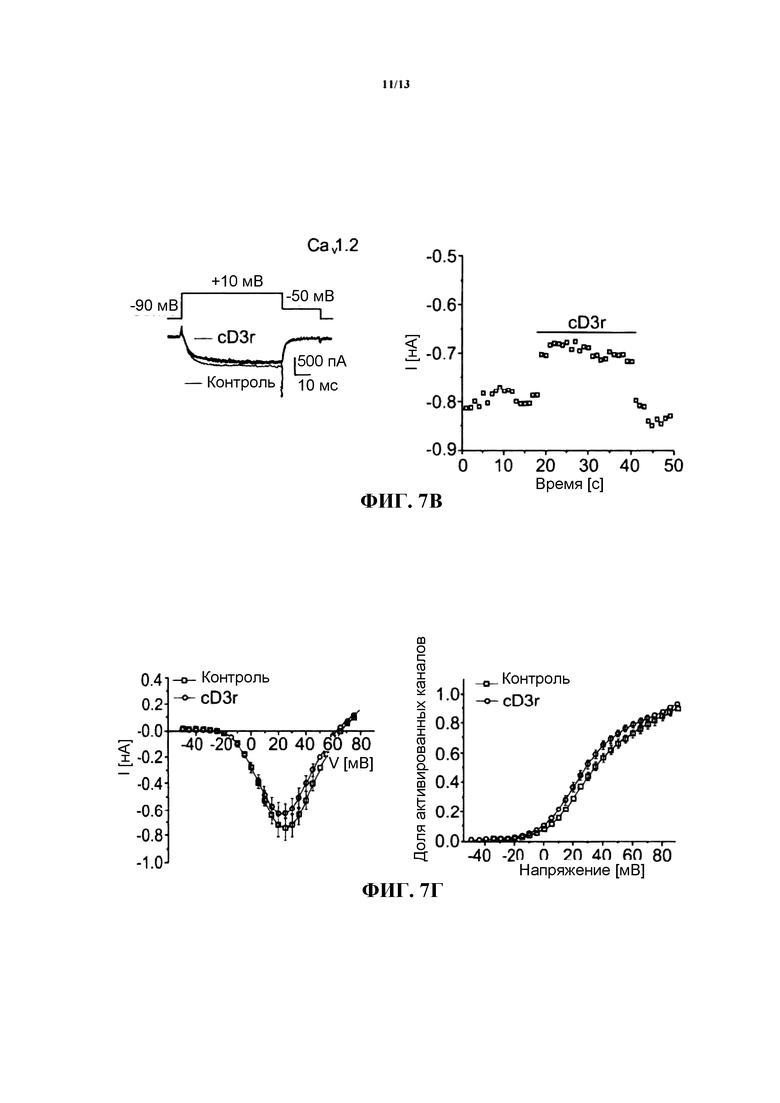
Влияние пептида cD3r на каналы CaV2.2 и CaV1.2 (фиг.7) Репрезентативные отведения ионного тока, опосредуемого каналом CaV2.2, регистрировали в течение импульса длительностью 40 мс с изменением потенциала с -90 мВ до +20 мВ до и после воздействия пептидом cD3r в концентрации 150нМ (левое изображение на фиг.7А). На правом изображении на фиг.7А приведена временная характеристика процесса подавления ионного тока в репрезентативной клетке при подаче последовательных импульсов каждые пять секунд с изменением потенциала от -90 мВ до +20 мВ. На фиг.7Б в графическом виде представлены усредненное отношение силы тока к напряжению у клеток, экспрессирующих кальциевые каналы CaV2.2, в присутствии и в отсутствие пептида cD3r (n=8) и доля активированных каналов в функции напряжения (кривая активации). На фиг.7В в графическом виде представлены репрезентативные отведения ионного тока, опосредуемого каналом CaV2.1, по результатам их регистрации в течение импульса длительностью 40 мс с изменением потенциала с -90 мВ до +10 мВ до и после воздействия пептидом cD3r в концентрации 150 нМ (левое изображение на фиг.7В). На правом изображении на фиг.7В приведена временная характеристика процесса подавления ионного тока в репрезентативной клетке при подаче последовательных импульсов каждые пять секунд с изменением потенциала от -90 мВ до +20 мВ. На фиг.7Г в графическом виде представлено усредненное отношение силы тока к напряжению в присутствии и в отсутствие пептида cD3r (n=8), а также приведена кривая активации для клеток, экспрессирующих кальциевые каналы CaV2.1 (n=7).
Влияние пептида cRD2r на каналы CaV2.2 и CaV1.2 (фиг.8)
На фиг.8А в графическом виде представлены репрезентативные отведения ионного тока, опосредуемого каналом CaV2.2, по результатам их регистрации в течение импульса длительностью 40 мс с изменением потенциала с -90 мВ до +20 мВ до и после воздействия пептидом cRD2r в концентрации 150 нМ (левое изображение на фиг.8А). На правом изображении на фиг.8А приведена временная характеристика процесса подавления ионного тока в репрезентативной клетке при подаче последовательных импульсов каждые пять секунд с изменением потенциала от -90 мВ до +20 мВ. На фиг.8Б в графическом виде представлены усредненное отношение силы тока к напряжению у клеток, экспрессирующих кальциевые каналы CaV2.2, в присутствии и в отсутствие пептида cRD2r (n=7) и доля активированных каналов в функции напряжения (кривая активации). На фиг.8В в графическом виде представлены репрезентативные отведения ионного тока, опосредуемого каналом CaV2.1, по результатам их регистрации в течение импульса длительностью 40 мс с изменением потенциала с -90 мВ до +20 мВ до и после воздействия пептидом cRD2r в концентрации 150 нМ (левое изображение). На правом изображении на фиг.8В приведена временная характеристика процесса подавления ионного тока в репрезентативной клетке при подаче последовательных импульсов каждые пять секунд с изменением потенциала от -90 мВ до +10 мВ. На фиг.8Г в графическом виде представлено усредненное отношение силы тока к напряжению в присутствии и в отсутствие пептида cRD2r (n=8), а также приведена кривая активации для клеток, экспрессирующих кальциевые каналы CaV2.1 (n=6).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДЫ И ИХ ПРОИЗВОДНЫЕ, ВЗАИМОДЕЙСТВУЮЩИЕ С НИКОТИНОВЫМ АЦЕТИЛХОЛИНОВЫМ РЕЦЕПТОРОМ И ПРИГОДНЫЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КОСМЕТОЛОГИИ ПРОТИВ МИМИЧЕСКИХ И ВОЗРАСТНЫХ МОРЩИН | 2013 |
|
RU2524428C1 |
| НОВЫЕ ПЕПТИДЫ С АНАЛЬГЕТИЧЕСКИМ ЭФФЕКТОМ, ИНГИБИРУЮЩИЕ ASIC-RFYFKS | 2011 |
|
RU2583299C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ ДЛЯ РЕГУЛЯЦИИ ВЕКТОРНЫХ ИОННЫХ КАНАЛОВ | 2011 |
|
RU2538597C2 |
| НОВЫЙ ПЕПТИД-ИНГИБИТОР PI3Kγ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ОРГАНОВ ДЫХАНИЯ | 2015 |
|
RU2704826C2 |
| МОДУЛЯЦИЯ ЛИПИДНЫХ РАФТОВ | 2007 |
|
RU2457853C2 |
| НЕЙРОДЕГЕНЕРАТИВНЫЕ РАССТРОЙСТВА | 2015 |
|
RU2707191C2 |
| НОВЫЕ КОМПОЗИЦИИ АГОНИСТОВ ЭКСЕНДИНА И СПОСОБЫ ИХ ВВЕДЕНИЯ | 2000 |
|
RU2242244C2 |
| ПЕПТИДНАЯ ЗАЩИТА ПРОТИВ ТОКСИЧЕСКОГО ВОЗДЕЙСТВИЯ УЛЬТРАФИОЛЕТОВОГО ИЗЛУЧЕНИЯ | 2010 |
|
RU2565535C2 |
| Аналог альфа-конотоксина RgIA для лечения боли | 2016 |
|
RU2731217C2 |
| СИНТЕТИЧЕСКИЕ АНАЛОГИ IL-10 | 1997 |
|
RU2194054C2 |








Изобретение относится к применению композиции, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, который имеет последовательность SEQ ID NO: 1, пептида 5 D3, который имеет последовательность SEQ ID NO: 2, пептида cD3r, который имеет последовательность SEQ ID NO: 5 в циклизованной форме, cRD2r, который имеет последовательность SEQ ID NO: 19 в циклизованной форме, или содержащей указанные в качестве болеутоляющего средства, при обезболивающем лечении, при лечении хронических и/или невропатических болей и/или для ингибирования нейронных кальциевых каналов N-типа. 7 н. и 7 з.п. ф-лы, 8 ил., 3 пр.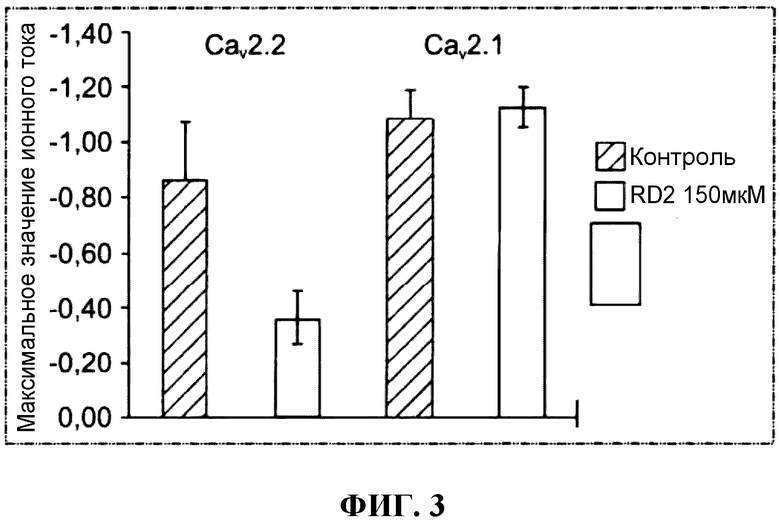
1. Применение композиции, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, который имеет последовательность SEQ ID NO: 1, пептида D3, который имеет последовательность SEQ ID NO: 2, пептида cD3r, который имеет последовательность SEQ ID NO: 5 в циклизованной форме, cRD2r, который имеет последовательность SEQ ID NO: 19 в циклизованной форме, или содержащей указанные пептиды в качестве болеутоляющего средства.
2. Применение композиции, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, который имеет последовательность SEQ ID NO: 1, пептида D3, который имеет последовательность SEQ ID NO: 2, пептида cD3r, который имеет последовательность SEQ ID NO: 5 в циклизованной форме, cRD2r, который имеет последовательность SEQ ID NO: 19 в циклизованной форме, или содержащей указанные пептиды для обезболивающего лечения.
3. Применение композиции, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, который имеет последовательность SEQ ID NO: 1, пептида D3, который имеет последовательность SEQ ID NO: 2, пептида cD3r, который имеет последовательность SEQ ID NO: 5 в циклизованной форме, cRD2r, который имеет последовательность SEQ ID NO: 19 в циклизованной форме, или содержащей указанные пептиды для лечения хронических болей.
4. Применение композиции, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, который имеет последовательность SEQ ID NO: 1, пептида D3, который имеет последовательность SEQ ID NO: 2, пептида cD3r, который имеет последовательность SEQ ID NO: 5 в циклизованной форме, cRD2r, который имеет последовательность SEQ ID NO: 19 в циклизованной форме, или содержащей указанные пептиды для лечения невропатических болей.
5. Применение композиции, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, который имеет последовательность SEQ ID NO: 1, пептида D3, который имеет последовательность SEQ ID NO: 2, пептида cD3r, который имеет последовательность SEQ ID NO: 5 в циклизованной форме, cRD2r, который имеет последовательность SEQ ID NO: 19 в циклизованной форме, или содержащей указанные пептиды для ингибирования нейронных кальциевых каналов (НКК) N-типа.
6. Применение по одному из пп. 1-5, отличающееся тем, что пептиды состоят в основном из D-энантиомеров.
7. Применение по одному из пп. 1-5 в дозе от 1 мкг до 1 г на кг массы тела.
8. Применение по одному из пп. 1-5 для энтерального, внутривенного, подкожного, внутрибрюшинного, интраназального или перорального применения, предпочтительно перорального применения.
9. Применение по одному из пп. 1-5, отличающееся значением IC50 в отношении НКК N-типа от 1нМ до 1мМ.
10. Применение по одному из пп. 1-5, отличающееся тем, что пептиды, выбранные из группы, состоящей из пептида RD2, пептида D3, пептида cD3r, пептида cRD2r или содержащей указанные пептиды, связаны с другими аминокислотами, линкерами, спейсерами, функциональными группами и/или веществами.
11. Способ снижения выделения нейромедиаторов в сравнении с контролем, отличающийся тем, что композицию, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, который имеет последовательность SEQ ID NO: 1, пептида D3, который имеет последовательность SEQ ID NO: 2, пептида cD3r, который имеет последовательность SEQ ID NO: 5 в циклизованной форме, cRD2r, который имеет последовательность SEQ ID NO: 19 в циклизованной форме, или содержащей указанные пептиды, вводят в контакт с нейронным кальциевым каналом N-типа.
12. Способ по п. 11, отличающийся тем, что снижают поступление кальция через нейронный кальциевый канал в сравнении с контролем.
13. Способ ингибирования нейронного кальциевого канала N-типа в сравнении с контролем, отличающийся тем, что нейронный кальциевый канал вводят в контакт с композицией, которая состоит из пептидов или содержит пептиды, которые выбраны из группы, состоящей из пептида RD2, который имеет последовательность SEQ ID NO: 1, пептида D3, который имеет последовательность SEQ ID NO: 2, пептида cD3r, который имеет последовательность SEQ ID NO: 5 в циклизованной форме, cRD2r, который имеет последовательность SEQ ID NO: 19 в циклизованной форме, или содержащей указанные пептиды.
14. Способ по одному из пп. 11-13, отличающийся тем, что функция НКК L-типа не изменяется по отношению к контролю.
| WO 2015043567 A1, 02.04.2015 | |||
| US 20150119336 A1, 30.04.2015 | |||
| DE 102015003676 A1, 22.09.2016 | |||
| СИНТЕТИЧЕСКИЕ ПЕПТИДЫ С НЕНАРКОТИЧЕСКИМ ТИПОМ АНАЛЬГЕТИЧЕСКОГО ДЕЙСТВИЯ | 2012 |
|
RU2508295C2 |
| JOSEPH G | |||
| MCGIVERN, "Targeting N-type and T-type calcium channels for the treatment of pain", DRUG DISCOVERY TODAY, 2006, vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2021-11-17—Публикация
2017-12-21—Подача