ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение, представленное в данном документе, относится к константным областям антитела IgG1 человека (Fc-областям), подвергнутым мутации таким образом, чтобы они сохраняли связывание c FcRn, но практически теряли способность специфично связываться с Fcγ-рецепторами и C1q.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Иммуноглобулины, которые являются гликопротеинами, присутствующими в сыворотке крови, ткани или биологической жидкости каждого млекопитающего, имеют функцию распознавания чужеродных антигенов. Иммуноглобулины участвуют посредством связывания антител с антигенами в биопрофилактике путем активации системы комплемента или путем активации эффекторных функций, как, например, усиления клеточного фагоцитоза, антителоопосредованной цитотоксичности и высвобождения медиаторов, инициируемого взаимодействиями с Fc-рецептором (FcR), присутствующим на поверхности эффекторных клеток.
Иммуноглобулины человека подразделяются на 5 различных классов, состоящих из IgG, IgA, IgM, IgD и IgE. IgG можно дополнительно классифицировать по 4 подклассам, состоящим из IgG1, IgG2, IgG3 и IgG4, тогда как IgA можно дополнительно классифицировать по двум подклассам, состоящим из IgA1 и IgA2. Основная структура иммуноглобулина содержит две гомологичные легкие цепи (L-цепи) и 2 гомологичные тяжелые цепи (H-цепи). Классы и подклассы иммуноглобулинов определяют в зависимости от H-цепей.
Известно, что различные типы иммуноглобулинов имеют различные функции. Например, комплементсвязывающая способность является высокой у IgM>IgG3>IgG1>IgG2 в данном порядке, а аффинность к Fcγ-рецептору I является высокой у IgG3>IgG1>IgG4>IgG2 в данном порядке. Более того, IgG1, IgG2 и IgG4 способны к связыванию с белком A.
Множество моноклональных антител были подвергнуты клиническим испытаниям за последние годы и были выведены на рынок для фармацевтических путей применения. Большинство этих моноклональных антител происходят из подкласса IgG1.
При использовании IgG1 в качестве исходной точки были предприняты попытки получения молекул, содержащих Fc, со сниженными связыванием с Fc-рецептором и эффекторными функциями, которые, тем не менее, сохраняют связывание с FcRn, длительную стабильность и низкую иммуногенность. Эти типы молекул могут представлять собой улучшенные терапевтические средства на основе антител, например, с лучшим профилем безопасности.
Антитела IgG являются бифункциональными молекулами в том смысле, что, помимо антигенспецифичного связывания посредством их Fab-фрагментов, они способны вступать в контакт с Fcγ-рецепторами (FcγR) посредством своего Fcγ-домена (Woof JM and DR Burton (2004). Nat Rev Immunol 4(2): 89-99). Существует три типа рецепторов для Fcγ, FcγRI - FcγRIII, с различными значениями аффинности к IgG (Bruhns P, et al. (2009). Blood 113(16): 3716-3725). FcγR экспрессируются на различных типах клеток, которые опосредуют Fcγ-опосредованные иммунные эффекторные функции, такие как антителозависимая клеточноопосредованная цитотоксичность (ADCC) или антителозависимый клеточный фагоцитоз (ADCP). Fcγ-домен антитела также связывается с фактором системы комплемента C1q и тем самым может запускать путь активации системы комплемента, что в конечном счете приводит к комплементзависимой цитотоксичности (CDC). Полагают, что эффекторные функции, опосредованные FcγR или C1q, играют важную роль в активности некоторых терапевтических антител (Redman JM, et al. (2015). Mol Immunol 67(2 Pt A): 28-45.
В дополнение к индуцированию эффектов посредством иммунных клеток, экспрессирующих FcγR, при вступлении в контакт с FcγR образуются кластеры антител высшего порядка, что вызывает кластеризацию высшего порядка или перекрестное связывание антигенов клеточной мембраны, связавшихся с Fab антитела, за счет чего инициируется передача сигнала в нисходящем направлении (Stewart RH, et al. (2014). Journal of ImmunoTherapy of Cancer 2(29)). В качестве примера, было показано, что антитела, специфичные к CD40, активируют передачу сигнала в нисходящем направлении от CD40 FcγR-зависимым образом (White AL, et al. (2011). J Immunol 187(4): 1754-1763).
Хотя для множества терапевтических путей применения антител желательно наличие сильных эффекторных функций, опосредованных Fcγ, определенные пути применения основываются на механизме действий, для которых не требуются эффекторные функции или даже необходимы инертные антитела, которые не индуцируют эффекты, опосредованные FcγR. По этой причине в таких антителах используются изотипы IgG со сниженными эффекторными функциями (например, IgG2 или IgG4) или сконструированные последовательности Fcγ с мутациями на поверхности контакта Fcγ-FcγR, которые снижают аффинность к FcγR. Например, противоопухолевые антитела, которые стимулируют T-клетки путем блокирования T-клеточных ингибирующих рецепторов, таких как PD-1 или PD-L1, являются преимущественно инертными, поскольку полностью компетентная Fc-область препятствует механизму действия антитела путем истощения популяции T-клеток посредством ADCC или CDC (Stewart RH, et al. (2014). Journal of ImmunoTherapy of Cancer 2(29)). Таким образом, антитела со сниженным или устраненным связыванием с FcγR имеют широкое применение.
В данной области было найдено несколько решений технической проблемы нахождения Fcγ со сниженной аффинностью к FcγR путем введения целевых мутаций в Fcγ-домен антитела. Nose и Wigzell описали, что антитела без N-связанного углевода в N297 не связываются с клетками, экспрессирующими FcγR, и не обладают активностью ADCC (Nose M and H Wigzell (1983). Proc Natl Acad Sci U S A 80(21): 6632-6636). Tao и Morrison, а также Bolt и соавт. проводили сайт-направленный мутагенез в положении N297, в результате чего получали агликозилированные антитела со сниженным связыванием с FcγR и C1q (Tao MH and SL Morrison (1989). J Immunol 143(8): 2595-2601; Bolt S, et al. (1993). Eur J Immunol 23(2): 403-411). Некоторые антитела или слитые белки на основе Fcγ, находящиеся на стадии клинических исследований, несут мутации в N297, например, mAb атезолизумаб к PDL1, mAb TRX518 к GITR, mAb отеликсизумаб к CD3 или слитый белок пептид-Fcγ ромиплостим (Strohl WR (2009). Curr Opin Biotechnol 20(6): 685-691; Stewart RH, et al. (2014). Journal of ImmunoTherapy of Cancer 2(29)).
CD3-специфичные антитела индуцируют FcR-зависимые активацию T-клеток и высвобождение цитокинов (Parren PW, et al. (1992). J Immunol 148(3): 695-701; Xu D, et al. (2000). Cell Immunol 200(1): 16-26). Наблюдалось, что CD3-специфичное антитело IgG1 с мутацией N297A в Fcγ по-прежнему приводит к активации T-клеток (WO2012143524), несмотря на то, что для N297A было описано отсутствие выявляемого связывания с клетками, экспрессирующими FcγR (Bolt S, et al. (1993). Eur J Immunol 23(2): 403-411). Эти наблюдения позволяют предположить, что анализы активации T-клеток in vitro с помощью CD3-специфичных антител являются весьма чувствительными к остаточному связыванию с FcγR. Таким образом, анализы T-клеток in vitro с антителами к CD3 представляют собой оптимальный функциональный анализ для идентификации сконструированных последовательностей Fcγ, аффинность связывания с FcγR у которых отсутствует или является минимальной.
Canfield и Morrison описали, что шарнирная область IgG способствует связыванию с высокоаффинным FcγRI (Canfield SM and SL Morrison (1991). J Exp Med 173(6): 1483-1491). Xu и соавт. продемонстрировали, что гуманизированное антитело hOKT3 к CD3, содержащее две мутации L234A и L235A в нижней шарнирной области (также называемые "Ala-Ala" или "LALA"), демонстрировало сниженное связывание с C1q и FcγR, приводящее к ослаблению FcγR-опосредованных активации T-клеток и высвобождения цитокинов in vitro (Xu D, et al. (2000). Cell Immunol 200(1): 16-26). Это антитело, называемое hOKT3γ1(Ala-Ala) или теплизумабом, впоследствии исследовали в клинических испытаниях, где было обнаружено, что введение мутаций LALA приводит к снижению частоты встречаемости неблагоприятного высвобождения цитокинов (Herold KC, et al. (2005). Diabetes 54(6): 1763-1769).
(Shields et al. (2001), J Biol Chem 276(9): 6591-6604) осуществляли подход с аланин-сканирующим мутагенезом в отношении всего Fcγ антитела для идентификации остатков, которые способствуют связыванию с FcγR. Они обнаружили, что мутация D265 уменьшает аффинность ко всем Fcγ-рецепторам. Кроме того, было показано, что мутация в положении P329 снижает связывание с Fcγ-рецепторами. Idusogie и соавт. картировали участок связывания с C1q в химерном антителе IgG1 ритуксимабе и обнаружили, что мутации в D270, K322, P329 или P331 снижают связывание с C1q (Idusogie EE, et al. (2000). J Immunol 164(8): 4178-4184). Wilson и соавт. описали комбинацию мутаций в D265 и N297 по типу замены на аланин, называемую "DANA". Было заявлено, что такие комбинированные мутации характеризуются сниженным связыванием с FcγR, но было выявлено остаточное связывание с FcγRIII мыши (Wilson NS, et al. (2011). Cancer Cell 19(1): 101-113). Gong и соавт. описали, что мутации "DANA" демонстрируют частичное снижение активации системы комплемента (Gong Q, et al. (2005). J Immunol 174(2): 817-826).
В других сообщениях описаны мутации определенных аминокислот в Fc-части антител (например, D265N и D265E: Shields RL, et al. (2001) J Biol Chem 276: 6591-6604; N297Q: Stavenhagen JB, et al. (2007) Cancer Res 67: 8882-8890; N297D: Sazinsky SL, et al. (2008) Proc Natl Acad Sci USA 105: 20167-20172, Kelton W, et al. (2014) Chem Biol 21: 1603-1609; P329G: Schlothauer T, et al. (2016) Protein Eng Des Sel 29: 457-466), хотя не все эти исследования связаны с ухудшением функциональных способностей Fc.
Было описано несколько мутаций в Fcγ, которые снижают связывание с FcγR, но ни одна из них, упомянутых выше, не устраняет полностью связывание с FcγR и связывание с C1q. Shields и соавт. описали возможность дополнительного снижения связывания с FcγR посредством комбинирования отдельных мутаций (Shields RL, et al. (2001). J Biol Chem 276(9): 6591-6604), и эта идея также лежит в основе комбинации мутаций "LALA" или "DANA", описанной выше.
Однако, остается проблема идентификации комбинации мутаций, которая приводит к оптимальному снижению связывания с FcγR и, что важно, которая не оказывает отрицательного влияния на другие ключевые свойства, которые важны для фармацевтического продукта, такие как технологичность, фармакокинетические характеристики или антигенность.
Например, в WO 2014/108483 описано несколько последовательностей Fcγ, содержащих комбинации мутаций, характеризующихся сниженным связыванием с FcγR. Большинство антител с мутантным Fcγ характеризовались более быстрым клиренсом у мышей, чем соответствующее немодифицированное антитело IgG1. Следовательно, известно, что введение мутаций в Fcγ-домены потенциально оказывает влияние на фармакокинетические свойства.
Fcγ-домен также взаимодействует с неонатальным Fc-рецептором FcRn (Kuo TT and VG Aveson (2011). MAbs 3(5): 422-430). Это взаимодействие отвечает за рециркуляцию антител, "спасение" от разрушения лизосомами и, таким образом, за длительный период полувыведения антител IgG1. Участок связывания с FcRn расположен на границе раздела CH2-CH3 в Fcγ1 (Martin WL, et al. (2001). Mol Cell 7(4): 867-877). Следовательно, новые сконструированные Fcγ-домены с мутациями в домене CH2 могут обладать ухудшенной аффинностью к FcRn и, следовательно, ухудшенными фармакокинетическими свойствами (Shields RL, et al. (2001). J Biol Chem 276(9): 6591-6604).
Таким образом, существует потребность в новых сконструированных последовательностях Fcγ, у которых отсутствует или является минимальной аффинность связывания с FcγR и C1q, но которые сохраняют другие свойства, важные для фармацевтического продукта, такие как фармакокинетический профиль или технологичность.
КРАТКОЕ ОПИСАНИЕ
В данном документе представлены композиции, содержащие модифицированные константные домены иммуноглобулинов, применимые для конструирования антител или антителоподобных терапевтических средств, как, например, содержащих Fc-область. Также описаны соответствующие полинуклеотиды, способные кодировать представленные модифицированные константные домены, клетки, экспрессирующие представленные модифицированные константные домены, а также связанные с ними векторы. Кроме того, описаны способы применения представленных модифицированных константных доменов.
Описанная композиция представляет собой мутантный вариант Fc IgG1, демонстрирующий сниженную способность к связыванию с FcγR, но характеризующийся сохраненным связыванием с FcRn. Такие мутантные варианты Fc IgG обеспечивают терапевтическое нацеливание на растворимые антигены или антигены клеточной поверхности со сведением при этом к минимуму Fc-ассоциированного привлечения иммунных эффекторных клеток и комплемент-опосредованной цитотоксичности. В одном аспекте молекула, содержащая Fc IgG1, содержит домен CH2, в котором аминокислоты в положениях 265, 297 и 329, указанных согласно индексу EU по Kabat и соавт., замещены другими аминокислотами.
В одном варианте осуществления аминокислота в положении 265 молекулы, содержащей Fc IgG1, замещена аланином (A), аспарагином (N) или глутаминовой кислотой (E), аминокислота в положении 297 замещена аланином, аспарагиновой кислотой (D) или глутамином (Q), а аминокислота в положении 329 замещена аланином, глицином (G) или серином (S).
В определенных вариантах осуществления композиции на основе мутантных вариантов Fc IgG1 применяют при показаниях, где полупериод удерживания терапевтического антитела (или продукта слияния на основе Fc) сохраняется благодаря взаимодействиям с FcRn, при этом нежелательные эффекты, обусловленные связыванием с C1q и FcγR и/или их активацией, которые ассоциированы с иммунными клетками и эффекторными функциями, такими как i) антителозависимая цитотоксичность (ADCC), ii) комплементзависимая цитотоксичность (CDC), iii) антителозависимый клеточный фагоцитоз (ADCP), iv) FcγR-опосредованная активация клеток, v) FcγR-опосредованные активация/истощение популяции тромбоцитов и/или vi) FcγR-опосредованное перекрестное связывание связавшейся мишени, сводятся к минимуму или устраняются.
В одном аспекте мутации в Fc IgG1 включены в терапевтические антитела или продукты слияния на основе Fc в связывающих веществах, таких как поливалентные связывающие вещества, нацеливающиеся на лиганды на клетках, вовлеченных в рак, неврологические нарушения, нарушения со стороны иммунной системы, как, например, связанные с активацией B-клеток или T-клеток, или на клетках, вовлеченных в восстановление или заживление тканей, таких как фибробласты или стволовые клетки.
В определенных вариантах осуществления мутантный вариант Fc IgG1 содержится в фармацевтической композиции. В определенных вариантах осуществления мутантный вариант Fc IgG1 является частью фармацевтически активной молекулы. Фармацевтические композиции, содержащие мутантный вариант Fc IgG1, или молекулы, содержащие активный мутантный вариант Fc IgG1, являются применимыми для лечения заболеваний или нарушений, например, рака.
Также в данном документе представлены рекомбинантные молекулы, содержащие Fc IgG1, характеризующиеся уменьшенной аффинностью к C1q и к по меньшей мере одному Fcγ-рецептору (FcγR) по сравнению с молекулой, содержащей Fc, с Fc-доменом дикого типа, при этом рекомбинантные молекулы, содержащие Fc IgG1, содержат мутации в аминокислотных положениях 265, 297 и 329, где нумерация остатков указана согласно индексу EU по Kabat и соавт.
В данном документе дополнительно представлены рекомбинантные полипептиды, содержащие (a) один или несколько связывающих доменов, способных к связыванию с по меньшей мере одной молекулой-мишенью; и (b) Fc-домен IgG1, содержащий мутации в аминокислотных положениях 265, 297 и 329, где полипептид способен связываться с молекулой-мишенью, не инициируя значительные Fcγ-опосредованные эффекты, такие как комплементзависимый лизис, клеточноопосредованное разрушение молекулы-мишени и/или FcγR-опосредованное перекрестное связывание связавшейся мишени.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Эксклюзионно-хроматографические профили mAb1 IgG1 и mAb1 IgG1 DANAPA.
Фиг. 2. Связывание мутантных вариантов антитела mAb1 к CD3 с мутантным Fc с CD3+ клетками Jurkat.
Фиг. 3A и 3B. A) Индуцирование активации лимфоцитов в PBMC человека с помощью мутантных вариантов mAb1 с мутантным Fcγ1, определяемое по окрашиванию на поверхностный антиген CD69. Пунктирной линией представлена процентная доля CD69-положительных клеток, полученная в лунках положительного контроля, содержащих активационные гранулы с антителами к CD2/CD3/CD28. B) Индуцирование высвобождения цитокинов в PBMC человека с помощью мутантных вариантов mAb1 с мутантным Fcγ1, определяемое посредством ELISA для IFNγ. Пунктирной линией представлен уровень IFNγ, полученный в лунках положительного контроля, содержащих активационные гранулы с антителами к CD2/CD3/CD28.
Фиг. 4A-4D. A) Схематическая иллюстрация анализа конкурентного связывания с Fc-рецепторами AlphaScreen™. B) Связывание мутантных вариантов mAb1 с мутантным Fc с FcγRI, FcγRIIA, FcγRIIB и FcγRIIIA человека, анализируемое с посредством анализа конкурентного связывания с Fc-рецепторами AlphaScreen™. C, D) Связывание мутантных вариантов mAb1 с мутантным Fc с FcγRI человека (C) и FcγRIIIA человека (D), анализируемое с помощью поверхностного плазмонного резонанса (BIAcore).
Фиг. 5. Связывание различных антител в формате IgG1 DANAPA с FcγRI, FcγRIIA, FcγRIIB и FcγRIIIA человека, анализируемое посредством анализа конкурентного связывания с Fc-рецепторами AlphaScreen™.
Фиг. 6. Связывание mAb1 с различными заменами в положениях D265, N297 и P329 с FcγRI человека, анализируемое посредством анализа конкурентного связывания с Fc-рецепторами AlphaScreen™.
Фиг. 7. Связывание mAb1 IgG1 DANAPA с C1q человека, анализируемое с помощью поверхностного плазмонного резонанса (BIAcore).
Фиг. 8. Связывание mAb1 IgG1 DANAPA с FcRn человека при pH 6,0, анализируемое с помощью поверхностного плазмонного резонанса (BIAcore).
Фиг. 9. Концентрации антитела в плазме крови у мышей C57BL/6 после i.v. введения 10 мг/кг mAb1 IgG1 DANAPA или mAb1 IgG1 соответственно. Данные представлены как среднее значение ± стандартное отклонение (n=5).
Фиг. 10. Связывание различных FynomAb, специфичных к CD3/CD33, с FcγRI, FcγRIIA, FcγRIIB и FcγRIIIA человека, анализируемое посредством анализа конкурентного связывания с Fc-рецепторами AlphaScreen™.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Чтобы настоящую заявку можно было понять более полно, ниже приведено несколько определений. Эти определения подразумевают охват грамматических эквивалентов.
По всему настоящему описанию и формуле изобретения нумерация остатков в Fc-области соответствует нумерации в тяжелой цепи иммуноглобулина в соответствии с индексом EU по Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), в явной форме включенном в данный документ посредством ссылки. "Индекс EU по Kabat" в данном документе относится к нумерации остатков антитела IgG1 EU человека. Данная нумерация хорошо известна специалисту в данной области и часто используется в данной области техники.
Под "полипептидом" или "белком", как используется в данном документе, подразумеваются по меньшей мере две ковалентно соединенные аминокислоты, которые включают белки, полипептиды, олигопептиды и пептиды.
Под "аминокислотой", как используется в данном документе, подразумевается одна из 20 встречающихся в природе аминокислот или любые ее неприродные аналоги, которые могут присутствовать в конкретном определенном положении.
"Молекула, содержащая Fc, имеющая замену (или "мутацию", или "замещение") в положениях 265, 297 и 329" означает молекулу, где аминокислота в положении 265 отличается от аспарагиновой кислоты (D), аминокислота в положении 297 отличается от аспарагина (N), и аминокислота в положении 329 отличается от пролина (P), где вся нумерация в Fc-области соответствует индексу EU по Kabat и соавт.
"Изменения аминокислот" в данном документе включают такие аминокислотные мутации, как замена, вставка и/или делеция в полипептидной последовательности. Под "аминокислотной заменой" или "заменой" в данном документе подразумевается замещение аминокислоты в определенном положении в исходной полипептидной последовательности другой аминокислотой. Например, замена P329A относится к мутантному полипептиду, в данном случае мутантному варианту Fc, в котором пролин в положении 329 замещен аланином.
В случае с комбинацией аминокислотных мутаций предпочтительным форматом является следующий: D265A/N297A/P329A. Это означает, что существует три аминокислотные мутации в Fc-области мутантного варианта по сравнению с его исходным полипептидом: одна в положении 265 (аспарагиновая кислота (D) замещена аланином (A)), одна в положении 297 (аспарагин (N) замещен аланином) и одна в положении 329 (пролин (P) замещен аланином).
Термин "антитело" используется в данном документе в наиболее широком смысле. "Антитело" относится к любому полипептиду, который по меньшей мере содержит (i) Fc-область и (ii) полипептидный связывающий домен, полученный из вариабельной области иммуноглобулина. Таким образом, антитела включают без ограничения полноразмерные иммуноглобулины, полиспецифические антитела, слитый белок на основе Fc, содержащий по меньшей мере одну вариабельную область, синтетические антитела (иногда называемые в данном документе "миметиками антител"), химерные антитела, гуманизированные антитела, полностью человеческие антитела, гетеродимерные антитела, слитые белки на основе антител, конъюгаты антител и фрагменты каждого из них соответственно. "FynomAb", как описано более подробно ниже, также содержит антитело.
Под "полноразмерным антителом" или под "иммуноглобулином", как используется в данном документе, подразумевается структура, которая составляет природную биологическую форму антитела, включая вариабельную и константную области. "Полноразмерное антитело" охватывает моноклональные полноразмерные антитела, полноразмерные антитела дикого типа, химерные полноразмерные антитела, гуманизированные полноразмерные антитела, полностью человеческие полноразмерные антитела, при этом данный перечень не является ограничительным.
У большинства млекопитающих, включая людей и мышей, структура полноразмерных антител обычно представляет собой тетрамер. Указанный тетрамер состоит из двух идентичных пар полипептидных цепей, при этом каждая пара имеет одну "легкую" цепь (как правило, с молекулярной массой приблизительно 25 кДа) и одну "тяжелую" цепь (как правило, с молекулярной массой приблизительно 50-70 кДа). У некоторых млекопитающих, например, у верблюдов и лам, полноразмерные антитела могут состоять только из двух тяжелых цепей, при этом каждая тяжелая цепь содержит вариабельный домен, присоединенный к Fc-области.
Аминоконцевая часть каждой цепи содержит вариабельную область из приблизительно 100-110 или больше аминокислот, которая в основном отвечает за распознавание антигена и содержит так называемые области, определяющие комплементарность (CDR).
Карбоксиконцевая часть каждой цепи определяет константную область, обычно в основном отвечающую за эффекторные функции.
В случае с иммуноглобулинами человека легкие цепи классифицируются как легкие каппа- и лямбда-цепи. Тяжелые цепи классифицируются как мю, дельта, гамма, альфа или эпсилон и определяют изотип антитела как IgM, IgD, IgG, IgA и IgE соответственно.
Как используется в данном документе, "антитела человека" включают антитела, имеющие аминокислотную последовательность иммуноглобулина человека, и включают антитела, выделенные из библиотек иммуноглобулинов человека или животных, трансгенных по одному или нескольким иммуноглобулинам человека, которые не экспрессируют эндогенные иммуноглобулины.
Под "IgG", как используется в данном документе, подразумевается полипептид, принадлежащий к классу антител, которые главным образом кодируются известным геном иммуноглобулина гамма. У людей IgG включает подклассы или изотипы IgG1, IgG2, IgG3 и IgG4. У мышей IgG включает IgG1, IgG2a, IgG2b, IgG3. Полноразмерные IgG состоят из двух идентичных пар двух цепей иммуноглобулинов, при этом каждая пара имеет одну легкую и одну тяжелую цепь, при этом каждая легкая цепь содержит домены иммуноглобулинов VL и CL, и при этом каждая тяжелая цепь содержит домены иммуноглобулинов VH, Cγ1 (также называемый CH1), Cγ2 (также называемый CH2) и Cγ3 (также называемый CH3). В контексте IgG1 человека "CH1" относится к положениям 118-215, домен CH2 относится к положениям 231-340, и домен CH3 относится к положениям 341-447 в соответствии с индексом EU по Kabat. IgG1 также содержит шарнирный домен, который относится к положениям 216-230 в случае с IgG1.
Под "Fc" или "Fc-областью", как используется в данном документе, подразумевается константная область полноразмерного иммуноглобулина за исключением первого домена константной области иммуноглобулина. Таким образом, Fc относится к двум последним доменам константной области иммуноглобулинов IgA, IgD и IgG, трем последним доменам константной области иммуноглобулинов IgE и IgM и гибкой шарнирной области, расположенной в N-концевом направлении от этих доменов. В случае с IgA и IgM Fc может содержать J-цепь. В случае с IgG Fc содержит домены иммуноглобулинов CH2, CH3 и нижнюю шарнирную область между CH1 и CH2. Fc-область IgG1 содержит домен от аминокислоты C226 до карбоксильного конца, где нумерация соответствует индексу EU по Kabat. Например, "Fc" или "Fc-область" может включать без ограничения Fc-область IgG1, содержащую любую из последовательностей под SEQ ID NO: 43 и 52-58 (каждая из которых является примером аминокислотных последовательностей Fc IgG1 человека дикого типа) или содержащую последовательность, на по меньшей мере 80%, по меньшей мере 85%, предпочтительно на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, более предпочтительно на по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичную по отношению к SEQ ID NO: 43 или любой из SEQ ID NO: 52-58. В предпочтительных вариантах осуществления Fc-область в соответствии с настоящим изобретением содержит, начиная с положения 226 (нумерация по Kabat) и далее, последовательность, на по меньшей мере 80%, по меньшей мере 85%, предпочтительно на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, более предпочтительно на по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97% или по меньшей мере 98% идентичную по отношению к SEQ ID NO: 43, и где аминокислота в положении 265 отличается от аспарагиновой кислоты (D), аминокислота в положении 297 отличается от аспарагина (N), и аминокислота в положении 329 отличается от пролина (P). Аналогичные домены для других подклассов IgG можно определить из выравнивания аминокислотных последовательностей тяжелых цепей или фрагментов тяжелых цепей указанных подклассов IgG с таковыми в IgG1 человека.
"Домен CH2", как используется в данном документе, предпочтительно относится к Fc-области IgG1 человека и содержит аминокислотную последовательность, на по меньшей мере 80%, 85%, 90%, предпочтительно на по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичную по отношению к SEQ ID NO: 60. "Домен CH3" Fc-области IgG1 человека, описанный в данном документе, содержит аминокислотную последовательность, на по меньшей мере 80%, 85%, 90%, предпочтительно на по меньшей мере 95%, по меньшей мере 98% или 100% идентичную по отношению к SEQ ID NO: 61.
Под "молекулой, содержащей Fc", как используется в данном документе, подразумевается полипептид, который содержит Fc-область. Молекулы, содержащие Fc, включают без ограничения антитела, продукты слияния на основе Fc, выделенные Fc, конъюгаты Fc, продукты слияния на основе антител, FynomAb и т. п.
Под "диким типом" или "WT" в данном документе подразумевается аминокислотная последовательность или нуклеотидная последовательность, которая обнаруживается в природе, т.е. которая является встречающейся в природе, включая аллельные вариации. Белок, полипептид, антитело, иммуноглобулин, IgG и т.д. WT имеют аминокислотную последовательность или нуклеотидную последовательность, которая не была преднамеренно модифицирована с помощью молекулярно-биологических методик, таких как мутагенез. Например, "Fc-области дикого типа" могут включать без ограничения Fc-область IgG1, содержащую последовательность под SEQ ID NO: 43, которая является примером аминокислотной последовательности Fc IgG1 человека дикого типа, или Fc-область IgG, содержащую любую из последовательностей под SEQ ID NO: 52-58, каждая из которых также является примером аминокислотных последовательностей Fc IgG1 человека дикого типа.
Термины "Fc-рецептор" или "FcR" используются для описания рецептора, который связывается с Fc-областью (например, Fc-областью антитела).
Термины "Fc-гамма-рецептор", "Fcγ-рецептор" или "FcγR" относится к рецепторам человека, которые связываются с Fc-областью антител IgG. Как используется в данном документе, FcγR включает подклассы FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16), в том числе их аллельные мутантные варианты и формы таких рецепторов, образующиеся в результате альтернативного сплайсинга.
Эти FcγR также определяются как активирующие рецепторы (FcγRI, FcγRIIa/c, FcγRIIIa/b) либо ингибирующий рецептор (FcγRIIb), поскольку они вызывают или ингибируют иммунные функции.
Семейство FcγRI состоит из трех генов (FCGRIA, FCGRIB и FCGRIC), но только продукт FCGRIA был идентифицирован как полноразмерный поверхностный рецептор. Указанный продукт, а именно FcγRI, экспрессируется дендритными клетками (DC), макрофагами, а также активированными нейтрофилами.
Семейство FcγRII состоит из трех генов (FCGR2A, FCGR2B и FCGR2C), которые кодируют белки FcγRIIa, FcγRIIb and FcγRIIc. FcγRIIa экспрессируется на моноцитах, определенных дендритных клетках и нейтрофилах. FcγRIIc экспрессируется на естественных клетках-киллерах (NK). FcγRIIb является широко экспрессируемым FcγR. FcγRIIb присутствует практически на всех лейкоцитах за исключением NK-клеток и T-клеток.
Семейство FcγRIII состоит из двух генов FCGR3A и FCGR3B, которые кодируют FcγRIIIa и FcγRIIIb. Белок FcγRIIIa экспрессируется в виде трансмембранного белка на моноцитах, тканеспецифических макрофагах, дендритных клетках, γδ-T-клетках и естественных клетках-киллерах. FcγRIIIb представляет собой GPI-заякоренный рецептор, экспрессирующийся на поверхности нейтрофилов и базофилов.
Два аллеля гена, кодирующего FcγRIIa, образуют 2 мутантных варианта, отличающихся по положению 131 (FcγRIIaR131 с низкой иммунореактивностью и FcγRIIaH131 с высокой иммунореактивностью). Аналогично, два аллеля гена, кодирующего FcγRIIIa, образуют 2 мутантных варианта, отличающихся по положению 158 (FcγRIIIaF158 с низкой иммунореактивностью и FcγRIIIaV158 с высокой иммунореактивностью).
Примечательно, что NK-клетки, которые, как полагают, являются ключевыми медиаторами антителозависимой клеточной цитотоксичности, экспрессируют только FcγRIIIa и FcγRIIc и ни один из других FcγR, в частности, ингибирующий FcγRIIb.
Каждый белок FcγR имеет дифференциальные предпочтения связывания с лигандом в отношении подклассов IgG и различные значения аффинности к подклассам IgG.
Активирующие FcγR инициируют различные иммунные ответы, такие как фагоцитоз, респираторный взрыв и продуцирование цитокинов (TNF-α, IL-6) в антигенпрезентирующих клетках (APC), антителозависимая клеточная цитотоксичность (ADCC) и дегрануляция нейтрофилов и NK-клеток. Активирующие FcγR также играют важную роль в клиренсе иммунных комплексов. В то же самое время ингибирующий рецептор FcγRIIb является критически важным регуляторным элементом в гомеостазе B-клеток. Он контролирует порог и степень активации клеток.
Fc-гамма-рецепторы и их функции рассматриваются в Nimmerjahn and Ravetch, Nature Reviews Immunology, 2008, 8, 34-47.
Как используется в данном документе, "C1q" представляет собой шестивалентную молекулу с молекулярной массой примерно 460000 и структурой, подобной букету тюльпанов, в котором шесть коллагеновых "стеблей" соединены с шестью областями "глобулярных головок". C1q образует с двумя сериновыми протеазами C1r и C1s комплекс C1, который является первым компонентом пути активации каскада комплемента.
C1q и его функция рассматриваются, например, в Kishore et al., Immunopharmacology, 2000, 49:159-170, и  Trends Immunol. 2009 30(2):83-90.
Trends Immunol. 2009 30(2):83-90.
Под "FcRn" или "неонатальным Fc-рецептором", как используется в данном документе, подразумевается белок, который связывается с Fc-областью антитела IgG и по меньшей мере частично кодируется геном FCRN. Как известно из уровня техники, функциональный белок FcRn содержит два полипептида, часто называемые тяжелой цепью и легкой цепью. Легкая цепь представляет собой бета-2-микроглобулин, а тяжелая цепь кодируется геном FCRN. FcRn или белок FcRn относится к комплексу α-цепи с бета-2-микроглобулином. У человека ген, кодирующий FcRn, называется FCGRT. FcRn участвует в передаче пассивного гуморального иммунитета от матери к ее плоду, а также в контроле клиренса IgG.
FcRn и его функция рассматриваются, например, в Roopenian, Nature Reviews Immunology, 2007, 7, 715-725.
Как используется в данном документе, молекула "сохраняет связывание с FcRn", если она связывается с FcRn с KD, которая менее чем в 5 раз, предпочтительно менее чем в 4 раза, более предпочтительно менее чем в 3 раза, еще более предпочтительно менее чем в 2 раза превышает KD исходной молекулы, содержащей Fc, без аминокислотной замены (например, IgG1 дикого типа) согласно измерению с применением поверхностного плазмонного резонанса (SPR), где KD измеряется при pH 6,0. В определенных вариантах осуществления KD в приблизительно 1-2 раза, например, в приблизительно 1,5 раза превышает KD исходной молекулы или является приблизительно такой же (т.е. 1-кратной), как KD исходной молекулы, а в определенных вариантах осуществления KD может также быть ниже, чем KD исходной молекулы.
"Сниженное связывание" относится к сниженному связыванию молекул, содержащих Fc, по настоящему изобретению, имеющих по меньшей мере одну аминокислотную замену в Fc-области, описанной в данном документе, например, с C1q и/или с рецептором FcγR по сравнению со связыванием исходной молекулы, содержащей Fc, без аминокислотной замены. "Сниженное связывание" может представлять собой связывание, сниженное в по меньшей мере приблизительно 2 раза, по меньшей мере приблизительно 5 раз, по меньшей мере приблизительно 10 раз, по меньшей мере приблизительно 20 раз, по меньшей мере приблизительно 50 раз, по меньшей мере приблизительно 75 раз или по меньшей мере приблизительно 100 раз. Связывание молекул, содержащих Fc, можно анализировать с помощью различных методик, известных из уровня техники, в том числе без ограничения поверхностного плазмонного резонанса (SPR). Измерения SPR можно проводить с помощью прибора BIAcore®. На практике молекулы, содержащие Fc, демонстрирующие "сниженное связывание" с конкретным FcγR, относятся к молекулам, содержащим Fc, которые характеризуются существенно сниженной или устраненной эффекторной функцией, опосредованной конкретным FcγR.
Как используется в данном документе, "рекомбинантный" включает антитела и другие белки, получаемые, экспрессируемые, создаваемые или выделяемые с помощью рекомбинантных способов.
"Вектор" означает полинуклеотид, который способен дуплицироваться в биологической системе или который может перемещаться между такими системами. Векторные полинуклеотиды, как правило, содержат такие элементы, как точки начала репликации, сигнал полиаденилирования или селектируемые маркеры, функция которых заключается в обеспечении дупликации или поддержания этих полинуклеотидов в биологической системе. Примеры таких биологических систем могут включать клетку, вирус, животное, растение и реконструированные биологические системы, в которых используются биологические компоненты, способные обеспечивать дупликацию вектора. Полинуклеотид, содержащий вектор, может представлять собой молекулы ДНК или РНК или их гибрид.
"Полинуклеотид" означает молекулу, содержащую цепь из нуклеотидов, ковалентно связанных с помощью сахарофосфатного остова или другой эквивалентной ковалентной химической структуры. Двухнитевые и однонитевые ДНК и РНК являются типичными примерами полинуклеотидов.
МУТАНТНЫЕ ВАРИАНТЫ FC С УМЕНЬШЕННЫМ СВЯЗЫВАНИЕМ С C1Q И FCγR
В настоящем изобретении впервые продемонстрирована комбинация замен в положениях 265, 297 и 329 константных областей (Fc) IgG1 в соответствии с индексом EU по Kabat. В результате направленного отбора по нескольким заменам остатков неожиданно был получен функциональный Fc-домен для применения в конструировании антител и для применения в качестве слитого полипептида, а также предоставлена возможность получения терапевтического объекта, не обладающего поддающейся измерению эффекторной функцией.
Таким образом, в настоящем изобретении представлена рекомбинантная молекула, содержащая Fc IgG1, которая содержит домен CH2, в котором аминокислота D в положении 265, аминокислота N в положении 297 и аминокислота P в положении 329, указанных согласно индексу EU по Kabat, замещены другими аминокислотами.
Предпочтительные молекулы, содержащие Fc IgG1, включают без ограничения молекулы, содержащие аминокислотную замену в положениях 265, 297 и 329. Как обсуждается ниже, такие полипептиды могут иметь одну или несколько дополнительных делеций, добавлений или замен в Fc-области. Таким образом, в объем настоящего изобретения входят молекулы, содержащие Fc IgG1, имеющие аминокислотные замены в положении 265 (т. е. имеющие аминокислоту, отличную от D, в данном положении), 297 (т. е. имеющие аминокислоту, отличную от N, в данном положении) и 329 (т. е. имеющие аминокислоту, отличную от P, в данном положении), и при этом в то же время Fc-области, начиная с положения 226 (нумерация по Kabat) и далее, являются на по меньшей мере 80%, по меньшей мере 85%, предпочтительно на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, более предпочтительно на по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97% или по меньшей мере 98% идентичными по отношению к SEQ ID NO: 43.
Термин "процентная (%) идентичность последовательностей" или "% идентичности" описывает число совпадений ("хитов") идентичных аминокислот в двух или более выровненных аминокислотных последовательностях по сравнению с числом аминокислотных остатков, составляющих общую длину аминокислотных последовательностей. Другими словами, при использовании выравнивания в двух или более последовательностях можно определить процентную долю аминокислотных остатков, которые являются одинаковыми (например, 90%, 95%, 97% или 98% идентичность), когда последовательности сравнивают и выравнивают для достижения максимального соответствия согласно измерению с применением алгоритма сравнения последовательностей, известного из уровня техники, или когда их выравнивают вручную и осматривают визуально. Таким образом, последовательности, сравниваемые для определения идентичности последовательностей, могут отличаться по замене(заменам), добавлению(добавлениям) или делеции(делециям) аминокислот. Подходящие программы для выравнивания последовательностей белков известны специалисту в данной области. Процентное значение идентичности последовательностей для последовательностей белков можно определять, например, с помощью таких программ, как CLUSTALW, Clustal Omega, FASTA или BLAST, например, с применением алгоритма BLAST NCBI (Altschul SF, et al (1997), Nucleic Acids Res. 25:3389-3402).
Например, для аминокислотных последовательностей идентичность и/или сходство последовательностей можно определять путем применения стандартных методик, известных из уровня техники, в том числе без ограничения алгоритма нахождения локальной идентичности последовательностей Смита-Уотермана, 1981, Adv. Appl. Math. 2:482, алгоритма выравнивания для нахождения идентичности последовательностей Нидлмана-Вунша, 1970, J. Mol. Biol. 48:443, способа поиска сходства Липмана-Пирсона, 1988, Proc. Nat. Acad. Sci. U.S.A. 85:2444, компьютеризованных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин), программы для анализа последовательностей BestFit, описанной Devereux et al, 1984, Nucl. Acid Res. 12:387-395, предпочтительно с использованием параметров по умолчанию или путем осмотра. В определенных вариантах осуществления процентную идентичность рассчитывают с помощью FastDB с использованием следующих параметров: штраф за несовпадение 1; штраф за гэп 1; штраф за длину гэпа 0,33 и штраф за объединение 30, "Current Methods in Sequence Comparison and Analysis", Macromolecule Sequencing and Synthesis, Selected Methods and Applications, pp 127-149 (1988), Alan R. Liss, Inc.
Другим примером применимого алгоритма является PILEUP. PILEUP создает множественное выравнивание последовательностей из группы родственных последовательностей с применением прогрессивных попарных выравниваний. Он также может построить дерево, показывающее кластерные взаимоотношения, используемые для создания выравнивания. Применимые параметры PILEUP включают штраф за открытие гэпа по умолчанию 3,00, штраф за продление гэпа по умолчанию 0,10 и оцениваемые концевые гэпы.
Другим примером применимого алгоритма является алгоритм BLAST, описанный в: Altschul et al, 1990, J. Mol. Biol. 215:403-410; Altschul et al, 1997, Nucleic Acids Res. 25:3389-3402; и Karin et al, 1993, Proc. Natl. Acad. Sci. U.S.A. 90:5873-5787. Особенно применимой программой BLAST является программа WU-BLAST-2, которая была получена из Altschul et al, 1996, Methods in Enzymology 266:460-480. В WU-BLAST-2 используется несколько параметров поиска, для большинства из которых установлены значения по умолчанию.
Дополнительным применимым алгоритмом является BLAST с гэпами, о котором сообщают Altschul et al, 1993, Nucl. Acids Res. 25:3389-3402.
Мутантные варианты IgG1 с несколькими заменами отбирали на основании значений их относительной аффинности к FcR (FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa и FcRn) человека, оцениваемой с помощью конкурентных анализов AlphaScreenTM и анализов SPR/Biacore. Эти мутантные варианты дополнительно тестировали в соответствующих клеточных системах и ранжировали по их способности индуцировать высвобождение цитокинов в PBMC. В наборе экспериментальных данных, представленном в данном документе, мутантные варианты Fc IgG1 сравнивали с молекулами, содержащими Fc IgG1 дикого типа. Дополнительные анализы этих мутантных вариантов в нескольких биологических анализах in vitro продемонстрировали, что они характеризуются уровнями активности от минимальных до невыявляемых и в значительной степени лишены аффинности связывания с FcγR. На основании этих скринингов мутантные варианты Fc IgG1, содержащие замены во всех трех аминокислотных положениях 265, 297 и 329 в комбинации, неожиданно были идентифицированы как те, у которых отсутствует или является минимальной выявляемая аффинность к FcγR и которые практически или полностью не обладают активностью в различных вышеупомянутых биологических анализах эффекторных/иммуностимулирующих функций. Мутантные варианты Fc IgG1 по настоящему изобретению могут считаться действительно "подавленными" Fc в том смысле, что у них отсутствует или является минимальной способность связываться с FcγR, опосредовать эффекторные функции или участвовать в Fc-опосредованном высвобождении цитокинов.
Исходя из настоящего изобретения, замены в аминокислотных положениях 265, 297 и 329 можно необязательно использовать в комбинации с другими аминокислотными мутациями, или замены можно использовать в другом изотипе IgG для достижения аналогичного или избирательного подавления эффекторных функций, как изложено в данном документе и в совокупности с тем, что известно из уровня техники. Данная комбинация мутаций в положениях 265, 297 и 329 неожиданно приводила к существенному улучшению подавления по сравнению с ранее описанной мутацией Fc N297A или двойной мутацией Fc L234A/L235A, каждая из которых использовалась в терапевтических антителах/белках, содержащих Fc, находящихся на стадии клинических исследований, для которых желательно минимальное остаточное взаимодействие с FcγR (Herold KC, et al. (2005). Diabetes 54(6): 1763-1769).
Вариант с тремя мутациями D265, N297 и P329 в соответствии с настоящим изобретением демонстрирует сниженное связывание с первым компонентом C1q системы комплемента по сравнению с его аналогом дикого типа. Другими словами, аффинность мутантного варианта к C1q является более низкой, чем аффинность у дикого типа.
Вариант с тремя мутациями D265, N297 и P329 в соответствии с настоящим изобретением также демонстрирует более низкую аффинность к по меньшей мере одному Fcγ-рецептору, чем аффинность его исходного полипептида. Как используется в данном документе, Fcγ-рецепторы включают рецепторы FcγRI, FcγRII и FcγRIII. Предпочтительно по меньшей мере один FcγR выбран из группы, состоящей из FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa.
Вариант с тремя мутациями D265, N297 и P329 демонстрирует сниженное связывание как с C1q, так и с Fcγ-рецепторами по сравнению с его аналогом дикого типа.
В определенных вариантах осуществления молекула, содержащая мутантный Fc IgG1, демонстрирует сниженное связывание с C1q, FcγRI, FcγRIIa, FcγRIIb и FcγRIIIa по сравнению с ее аналогом дикого типа.
Связывание с C1q или с любым из Fc-рецепторов можно оценивать с помощью хорошо известных способов из предшествующего уровня техники, таких как AlphaScreen™ и поверхностный плазмонный резонанс (SPR).
Например, прочность связывания мутантного варианта по настоящему изобретению с белком, представляющим интерес (таким как C1q или FcγR), можно сравнить с прочностью связывания его аналога дикого типа путем расчета соотношения их конкретных значений IC50, полученных с помощью конкурентного анализа AlphaScreen™, как описано в примере 4. AlphaScreen™, применяемый при высокопроизводительном скрининге, представляет собой технологию гомогенного анализа, которая обеспечивает возможность выявления таких молекулярных событий, как связывание. Покрытые "донорные" и "акцепторные" гранулы являются основой технологии анализа. В качестве анализа с использованием гранул AlphaScreen™ работает посредством взаимодействия гранул в непосредственной близости друг к другу, что приводит к каскаду химических реакций, действие которых заключается в формировании значительно усиленного сигнала. Для оценки значений относительной аффинности и авидности среди белков и между белками можно использовать прямые или косвенные измерения, например, при конкурентном связывании.
В качестве альтернативы, связывание молекулы, содержащей мутантный Fc IgG1, и ее аналога дикого типа с белком, представляющим интерес (например, C1q и/или FcγR), можно сравнивать посредством определения EC50 с помощью соответствующего анализа ELISA. EC50 относится к концентрации мутантного варианта, которая дает сигнал, представляющий 50% насыщение кривой зависимости процентной доли связавшегося белка, представляющего интерес, от логарифма концентрации мутантного варианта. Обычно считается, что молекула, содержащая мутантный Fc IgG1, демонстрирует сниженное связывание с белком, представляющим интерес (таким как C1q и/или FcγR), по сравнению с ее аналогом дикого типа, если ее EC50 в по меньшей мере 1,5 раза превышает EC50 ее аналога дикого типа.
Аффинность связывания молекулы, содержащей мутантный Fc IgG1, с белком, представляющим интерес (например, C1q и/или FcγR), также можно оценивать с помощью SPR посредством определения константы диссоциации (Kd). Обычно считается, что молекула, содержащая мутантный Fc IgG1, демонстрирует сниженное связывание с белком, представляющим интерес (например, C1q и/или FcγR) по сравнению с ее аналогом дикого типа, если ее Kd в по меньшей мере 1,5 раза превышает Kd ее исходного полипептида.
Аффинность мутантного варианта к C1q или к FcγR может быть такой слабой, что не могут быть точно определены специфический сигнал с помощью анализа AlphaScreen™ и даже Kd с помощью SPR или EC50 с помощью анализа ELISA, поскольку сигнал связывания находится в пределах фонового шума или ниже порога выявления. В таком случае считается, что молекула, содержащая мутантный Fc IgG1, не связывается с C1q и/или с соответствующим FcγR.
Например, молекула, содержащая Fc IgG1 с тремя мутациями, в соответствии с настоящим изобретением может не связываться с по меньшей мере одним FcγR и демонстрирует сниженное связывание с C1q или его отсутствие. Такая молекула, содержащая мутантный Fc IgG1, четко проиллюстрирована в примерах настоящей заявки.
В некоторых вариантах осуществления молекула, содержащая мутантный Fc IgG1, по настоящему изобретению не связывается с по меньшей мере одним белком, выбранным из C1q и Fcγ-рецепторов.
Заявитель показал, что введение мутаций в D265, N297 и P329 является достаточным для существенного ухудшения связывания с C1q и с Fcγ-рецепторами. Другими словами, для получения молекулы, содержащей мутантный Fc IgG1, с соответствующим сниженным связыванием с C1q и/или Fcγ-рецепторами в Fc-область IgG1 аналога IgG1 дикого типа не нужно вводить никакую другую мутацию помимо мутаций в D265, N297 и P329. Тем не менее, необязательно возможно было бы добавить дополнительные мутации в молекулу, содержащую Fc, по настоящему изобретению, если это желательно, например, для изменения других функциональных способностей молекулы.
Не ограничиваясь какой-либо теорией, заявитель полагает, что аминокислотные замены, представленные в настоящем изобретении, по существу не вызывают значительную структурную перестройку в Fc-области IgG1, поэтому в некоторых случаях другие функции, которые не опосредованы связыванием с C1q и FcγR, существенно не изменяются по сравнению с функциями исходного полипептида. Примечательно, что заявитель показал, что введение мутаций по типу замены в положениях D265, N297 и P329 в Fc-области IgG1 существенно не ухудшает их аффинность к неонатальному Fc-рецептору (FcRn). Например, константа диссоциации KD для mAb1, содержащего замены D265A, N297A и P329A в Fc IgG1 (DANAPA), составляет 500 нМ, а для его аналога дикого типа 470 нМ (см. пример 8). Другими словами, молекула, содержащая Fc IgG1 дикого типа, и молекула, содержащая мутантный Fc IgG1, в соответствии с настоящим изобретением демонстрируют свойство тесного связывания с FcRn.
Как упомянуто выше в данном документе, Fc-область дикого типа может быть выбрана из группы, состоящей из Fc-областей дикого типа IgG человека, их фрагментов и мутантных вариантов.
Как указано выше в данном документе, Fc-область по настоящему изобретению может содержать аминокислотные замены по меньшей мере трех аминокислот в Fc IgG1. Для напоминания, Fc-области дикого типа включают без ограничения Fc-область IgG1 человека под SEQ ID NO: 43. Известны аллельные варианты Fc-областей человека, и их также можно применять в качестве исходной молекулы для введения комбинации мутаций в соответствии с настоящим изобретением. Аллельные варианты Fc IgG1 человека отличаются друг от друга по положению 356 (глутаминовая кислота (E) или аспарагиновая кислота (D)), и/или по положению 358 (метионин (M) или лейцин (L)), и/или по положению 431 (аланин (A) или глицин (G)). Аллельные варианты включают встречающиеся в природе аллельные варианты, а также неприродные аллельные варианты. Неприродные аллельные варианты содержат остатки, которые встречаются во встречающихся в природе аллельных вариантах, но представлены в комбинациях, которые не обнаруживаются в природе. В работах Jefferis et al. приведен обзор аллельных вариантов IgG человека, который позволяет специалисту в данной области техники получить встречающиеся в природе и неприродные аллельные варианты последовательностей Fc (Jefferis R and M-P Lefranc (2009) mAbs 1: 1-7). Следовательно, в определенных вариантах осуществления исходная молекула для введения комбинации мутаций в соответствии с настоящим изобретением (т. е. мутаций в положениях 265, 297 и 329 в соответствии с нумерацией по Kabat) представляет собой молекулу, содержащую последовательность Fc IgG1 человека, выбранную из группы, состоящей из SEQ ID NO: 43, 52, 53, 54, 55, 56, 57 и 58. Таким образом, в настоящем изобретении в конкретных вариантах осуществления представлены рекомбинантные полипептиды, содержащие Fc IgG1, которые содержат аминокислотную последовательность в соответствии с любым из SEQ ID NO: 43, 52, 53, 54, 55, 56, 57 и 58, характеризующуюся тем, что: (i) аминокислота D в положении 265 была замещена другой аминокислотой, (ii) аминокислота N в положении 297 была замещена другой аминокислотой, и (iii) аминокислота P в положении 329 была замещена другой аминокислотой, где нумерация указана согласно индексу EU по Kabat.
Fc-область в соответствии с настоящим изобретением по сравнению с Fc-областью дикого типа или исходной Fc-областью имеет такую комбинацию мутаций, при которой аминокислотные остатки в положениях 265, 297 и 329 отличаются от D, N и P соответственно, где нумерация соответствует индексу EU по Kabat и соавт. В определенных вариантах осуществления аминокислотный остаток в положении 265 представляет собой A, N или E. В определенных вариантах осуществления аминокислотный остаток в положении 297 представляет собой A, D или Q. В определенных вариантах осуществления аминокислотный остаток в положении 329 представляет собой A, G или S. Специалисту в данной области будет понятно, что в этих положениях можно произвести замены другими аминокислотами (например, R, C, Q, G, H, I, L, K, M, F, P, S, T, W, Y или V в положении 265; R, C, E, G, H, I, L, K, M, F, P, S, T, W, Y или V в положении 297; R, C, Q, N, H, I, L, K, M, F, E, D, T, W, Y или V в положении 329), и полученные варианты Fc, имеющие указанные аминокислоты в положениях 265, 297 и 329, можно тестировать с помощью стандартных способов в отношении наличия практически тех же свойств связывания с Fc-рецепторами и C1q, что и у вариантов осуществления, проиллюстрированных в демонстрационных примерах в данном документе, и такие варианты включены в настоящее изобретение.
В некоторых вариантах осуществления аминокислотные замены в молекуле, содержащей Fc IgG1, включают аминокислотные замены D265A, N297A, P329A.
В некоторых других вариантах осуществления аминокислотные замены в молекуле, содержащей Fc IgG1, включают аминокислотные замены D265N, N297D, P329G.
В некоторых других вариантах осуществления аминокислотные замены в молекуле, содержащей Fc IgG1, включают аминокислотные замены D265E, N297Q, P329S.
В конкретном варианте осуществления мутантная молекула, содержащая Fc IgG1, при этом данный мутантный вариант демонстрирует сниженное связывание с белком C1q и с по меньшей мере одним рецептором FcγR по сравнению с молекулой, содержащей Fc IgG1 дикого типа, характеризуется тем, что:
1. аминокислота в положении 265 заменена аланином, аспарагином или глутаминовой кислотой,
2. аминокислота в положении 297 заменена аланином, аспартатом или глутамином, и
3. аминокислота в положении 329 заменена аланином, глицином или серином,
где нумерация аминокислот указана согласно индексу EU по Kabat.
В некоторых вариантах осуществления способ получения рекомбинантной молекулы, содержащей Fc IgG1, которая содержит домен CH2, в котором аминокислоты в положениях 265, 297 и 329, указанных согласно индексу EU по Kabat, замещены другими аминокислотами, отличными от D, N и P соответственно, включает стадии:
(a) получения нуклеиновой кислоты, кодирующей исходную молекулу, содержащую Fc IgG1,
(b) модификации нуклеиновой кислоты, полученной на стадии (a), в целях получения нуклеиновой кислоты, кодирующей рекомбинантную молекулу, содержащую Fc IgG1, в которой аминокислоты в по меньшей мере одном из положений 265, 297 и 329 замещены таким образом, что в полученной в результате кодируемой молекуле, содержащей Fc, аминокислоты в этих положениях отличаются от D (положение 265), N (положение 297) и P (положение 329), и
(c) обеспечения экспрессии нуклеиновой кислоты, полученной на стадии (b), в клетке-хозяине и извлечения указанного мутантного варианта.
Разумеется, если исходная молекула уже содержит аминокислоту, отличную от D в положении 265, N в положении 297 или P в положении 329, то только в других одном или двух из этих трех положений все еще необходимо произвести модификацию для создания молекулы, содержащей Fc, в соответствии с настоящим изобретением.
Эти стадии можно проводить с помощью традиционных практик молекулярной биологии. Для осуществления способа получения рекомбинантной молекулы, содержащей Fc IgG1, по настоящему изобретению специалист в данной области может обратиться к хорошо известным процедурам, описанным в предшествующем уровне техники, которые можно найти, например, в Molecular Cloning - A Laboratory Manual, 3rd Ed. (Maniatis, Cold Spring Harbor Laboratory Press, New York, 2001), The condensed protocols from Molecular cloning: a laboratory manual (Sambrook, Russell, CSHL Press, 2006) и Current Protocols in Molecular Biology (John Wiley & Sons, 2004).
Нуклеиновая кислота, кодирующая молекулу, содержащую Fc IgG1 дикого типа, может быть коммерческой или может быть получена с помощью классической процедуры молекулярной биологии или химического синтеза. Нуклеиновая кислота, кодирующая молекулу, содержащую мутантный Fc IgG1, упомянутая на стадии (b), может быть получена с помощью химического синтеза или с помощью модификации нуклеиновой кислоты, кодирующей исходный полипептид, с применением различных способов, известных из предшествующего уровня техники. Эти способы включают без ограничения сайт-направленный мутагенез, случайный мутагенез, мутагенез с помощью ПЦР и кассетный мутагенез.
Нуклеиновая кислота, кодирующая молекулу, содержащую мутантный Fc IgG1, может быть встроена в вектор экспрессии для ее экспрессии в клетке-хозяине.
Векторы экспрессии, как правило, содержат последовательность, кодирующую белок, функционально связанную, то есть расположенную в функциональной взаимосвязи, с контрольными или регуляторными последовательностями, такими как промотор, а также необязательно содержат селектируемые маркеры, каких-либо партнеров по слиянию и/или дополнительные элементы. Молекула, содержащая мутантный Fc IgG1, по настоящему изобретению может быть получена путем культивирования клетки-хозяина, трансформированной с помощью нуклеиновой кислоты, предпочтительно вектора экспрессии, содержащего нуклеиновую кислоту, кодирующую молекулу, содержащую мутантный Fc IgG1, в условиях, подходящих для того, чтобы индуцировать или вызывать экспрессию белка. Можно применять широкий спектр подходящих линий клеток-хозяев, в том числе без ограничения клетки млекопитающих, бактерии, клетки насекомых и дрожжи.
Например, различные линии клеток млекопитающих, которые можно применять, описаны в каталоге линий клеток ATCC, доступном из Американской коллекции типовых культур. Клетками-хозяевами могут являться без ограничения клетки YB2/0 (клетки YB2/3HL.P2.GII.IGAg.20, депонированные в Американской коллекции типовых культур, № в ATCC CRL-1662), SP2/0, YE2/0, 1R983F, Namalwa, PER.C6, линии клеток CHO, в частности CHO-K-1, CHO-Lec10, CHO-Lec1, CHO-Lec13, CHO Pro-5, CHO dhfr-, Wil-2, Jurkat, Vero, Molt-4, COS-7, HEK293, BHK, Vero, MDCK, иммортализованные линии клеток амниотической жидкости (CAP), EB66, KGH6, NSO, SP2/0-Ag 14, P3X63Ag8.653, C127, JC, LA7, ZR-45-30, hTPET, NM2C5, UACC-812 и т. п. Способы введения экзогенной нуклеиновой кислоты в клетки-хозяева широко известны из уровня техники и могут варьироваться в зависимости от применяемой клетки-хозяина.
Клетка-хозяин необязательно может принадлежать трансгенному животному, отличному от человека, или трансгенному растению. Таким образом, в данном случае молекула, содержащая мутантный Fc IgG1, получена из трансгенного организма.
Трансгенное животное, отличное от человека, может быть получено с помощью прямой инъекции желаемого гена в оплодотворенную яйцеклетку (Gordon et al., 1980 Proc Natl Acad Sci U S A.; 77:7380-4). Трансгенные животные, отличные от человека, включают мышь, кролика, крысу, козу, корову, крупный рогатый скот или домашнюю птицу и т. п. Трансгенное животное, отличное от человека, имеющее желаемый ген, может быть получено путем введения желаемого гена в эмбриональную стволовую клетку и получения животного с помощью способа агрегационной химеры или способа инъекционной химеры (Manipulating the Mouse Embryo, A Laboratory Manual, second edition, Cold Spring Harbor Laboratory Press (1994); Gene Targeting, A Practical Approach, IRL Press at Oxford University Press (1993)). Примеры эмбриональной стволовой клетки включают эмбриональные стволовые клетки мыши (Evans and Kaufman, 1981, Nature; 292:154-156), крысы, козы, кролика, обезьяны, домашней птицы, крупного рогатого скота и т. п. Кроме того, трансгенное животное, отличное от человека, также может быть получено с применением клональной методики, в рамках которой ядро, в которое вводится желаемый ген, трансплантируется в энуклеированную яйцеклетку (Ryan et al., 1997 Science; 278: 873-876; Cibelli et al., 1998 Science, 280: 1256-1258). Молекула, содержащая мутантный Fc IgG1, может быть получена путем введения ДНК, кодирующей молекулу, содержащую мутантный Fc IgG1, животному, полученному с помощью вышеуказанного способа, за счет чего обеспечивается образование и накопление мутантной молекулы в организме животного, а затем забора мутантного варианта из организма животного. Мутантная молекула, содержащая Fc IgG1, может быть получена для образования и накопления в молоке, яйцах и т.п. у животных.
Во всех приведенных выше вариантах осуществления молекула, содержащая Fc IgG1, может представлять собой встречающийся в природе полипептид (полипептид дикого типа), мутантный вариант или сконструированный вариант встречающегося в природе полипептида или синтетический полипептид.
В некоторых вариантах осуществления молекула, содержащая Fc IgG1, выбрана из группы, состоящей из слитого белка на основе Fc IgG1, конъюгата Fc IgG1 и антител.
Как используется в данном документе, слитый белок на основе Fc и конъюгат Fc состоят из Fc-области, связанной с партнером. Fc-область может быть связана со своим партнером с помощью спейсера, также называемого линкером, или без него.
Подходящие линкеры имеются в распоряжении специалиста в данной области. Линкер может быть выбран, например, из группы, состоящей из алкила с 1-30 атомами углерода, полиэтиленгликоля с 1-20 этиленовыми компонентами, полиаланина с 1-20 остатками, капроновой кислоты, замещенного или незамещенного поли-п-фенилена и триазола. Предпочтение отдается пептидным линкерам, более конкретно олигопептидам, имеющим длину от 1 до 30 аминокислот. Предпочтительные диапазоны длин составляют от 5 до 15 аминокислот.
Особенно предпочтительными являются линкеры, которые представляют собой пептиды, состоящие на по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или 100% из малых аминокислот, таких как глицин, серин и аланин. Особенно предпочтительными являются линкеры, состоящие только из глициновых и сериновых остатков. Неограничивающим примером подходящего линкера является линкер (G4S)3 (SEQ ID NO: 40).
В соответствии с настоящим изобретением слитый белок на основе Fc представляет собой белок, который содержит белок, полипептид или малый пептид, ковалентно связанный с Fc-областью. Слитый белок на основе Fc необязательно содержит пептидный линкер, как описано выше. Практически любой белок или малый пептид может быть связан с Fc-областями с образованием продукта слияния на основе Fc. Белковые партнеры по слиянию могут включать без ограничения область рецептора, связывающуюся с мишенью, адгезивную молекулу, лиганд, фермент, цитокин, хемокин или некоторый другой белок или белковый домен. Некоторые неограничивающие примеры слитых белков на основе Fc включают алефацепт, абатацепт, белатацепт, рилонацепт, этанерцепт, ромиплостим и афлиберцепт.
В частности, слитый белок на основе Fc может представлять собой иммуноадгезин, т.е. антителоподобный белок, в котором объединены связывающий домен гетерологичного "адгезивного" белка (т.е. рецептора, лиганда или фермента) и фрагмент константного домена иммуноглобулина (т.е. Fc-область) (в отношении обзора иммуноадгезинов см. Ashkenazi A, Chamow SM. 1997, Curr Opin Immunol. 9(2):195-200).
Малые пептиды могут включать без ограничения любое терапевтическое средство, которое направляет продукт слияния на основе Fc к терапевтической мишени.
В соответствии с настоящим изобретением конъюгат Fc может в определенных вариантах осуществления быть получен в результате химического связывания Fc-области с партнером по конъюгированию и необязательно содержит спейсер, связывающий Fc-областьс партнером по конъюгированию. Партнер по конъюгированию может быть белковым или небелковым. В реакции связывания обычно используются функциональные группы в Fc-области и в партнере по конъюгированию.
Подходящие партнеры по конъюгированию включают без ограничения терапевтические полипептиды, метки (в отношении примеров меток см. дополнительно ниже), лекарственные средства, цитотоксические средства, цитотоксические лекарственные средства (например, химиотерапевтические средства), токсины и активные фрагменты этих токсинов. Подходящие токсины и их соответствующие фрагменты включают без ограничения A-цепь дифтерийного токсина, A-цепь экзотоксина, A-цепь рицина, A-цепь абрина и т.п. Цитотоксическое средство может представлять собой любой радионуклид, который может быть непосредственно конъюгирован с мутантным вариантом Fc IgG1 или отделен хелатообразующим средством, которое ковалентно присоединено к мутантному варианту Fc IgG1. В дополнительных вариантах осуществления партнеры по конъюгированию могут быть выбраны из группы, состоящей из калихеамицина, ауристатинов, гелданамицина, майтанзина и дуокармицинов, а также их аналогов.
В одном варианте осуществления молекула, содержащая Fc IgG1, содержит "финомер". Финомеры представляют собой небольшие глобулярные белки размером 7 кДа, полученные из домена SH3 киназы Fyn человека (Fyn SH3, а.к. 83-145 киназы Fyn: GVTLFVALYDYEARTEDDLSFHKGEKFQILNSSEGDWWEARSLTTGETGYIPSNYVAPVDSIQ (SEQ ID NO: 59). В SEQ ID NO: 59, как показано выше, последовательности RT- и Src- петли выделены соответственно подчеркиванием и двойным подчеркиванием, и такие молекулы можно сконструировать для связывания с антителоподобной аффинностью и специфичностью практически с любой выбранной мишенью посредством случайной мутации в двух петлях (RT- и Src-петле) на поверхности домена SH3 Fyn, необязательно в комбинации с мутациями в других выбранных положениях в домене SH3 Fyn (см., например, WO 2008/022759). Полипептиды, полученные из SH3 Fyn, или финомеры, хорошо известны из уровня техники и были описаны, например, в Grabulovski et al. (2007) JBC, 282, p. 3196-3204; WO 2008/022759; Bertschinger et al (2007) Protein Eng Des Sel 20(2):57-68 и Gebauer and Skerra (2009) Curr Opinion in Chemical Biology 13:245-255. Термин "полипептид, полученный из SH3 Fyn", используемый в данном документе взаимозаменяемо с термином "финомер", относится к связывающему полипептиду, полученному не из иммуноглобулина (например, так называемой каркасной структуре, которая описана в Gebauer and Skerra (2009) Curr Opinion in Chemical Biology 13:245-255), который получен из домена SH3 Fyn человека. Финомеры могут быть генетически слиты с другими молекулами, такими как антитела, для создания так называемых FynomAb, которые могут быть сконструированы таким образом, что они обладают двойной специфичностью (например, Silacci et al, 2016, mAbs 8:1, 141-149; Brack et al, 2014, Mol Cancer Ther 13(8): p. 2030-9; WO 2014/044758 A1; WO 2014/170063 A1; WO 2015/141862 A1).
Как упоминается, термин "антитело" используется в данном документе в наиболее широком смысле. В соответствии с настоящим изобретением "антитело" относится к любому полипептиду, который содержит по меньшей мере (i) Fc-область и (ii) полипептидный связывающий домен, полученный из вариабельного домена иммуноглобулина. Указанный полипептидный связывающий домен способен специфично связываться с одним данным антигеном-мишенью или группой антигенов-мишеней. Полипептидный связывающий домен, полученный из вариабельной области иммуноглобулина, содержит по меньшей мере одну или несколько CDR. В данном документе антитела включают без ограничения полноразмерные антитела, полиспецифические антитела, слитый белок на основе Fc, содержащий по меньшей мере одну вариабельную область, или синтетические антитела (иногда называемые в данном документе "миметиками антител"), слитые белки на основе антител, конъюгаты антител и фрагменты каждого из них соответственно. FynomAb в соответствии с настоящим изобретением также содержат антитела с Fc-областью. Таким образом, в настоящем изобретении также представлены FynomAb, т.е. одна или несколько копий финомера, связанные с антителом, которые содержат Fc-область с мутациями в соответствии с настоящим изобретением, т.е. имеют аминокислоту, отличную от D, в положении 265, аминокислоту, отличную от N, в положении 297 и аминокислоту, отличную от P, в положении 329, где нумерация соответствует индексу EU по Kabat и соавт. Финомер может быть ковалентно связан посредством линкерного пептида с антителом или может быть непосредственно слит с антителом. Финомер в определенных вариантах осуществления может быть расположен ниже C-конца тяжелой цепи антитела, или выше N-конца тяжелой цепи антитела, или ниже C-конца легкой цепи антитела, или выше N-конца легкой цепи антитела. Предпочтительно две копии финомера связаны с антителом, по одной на каждый соответствующий конец в двух цепях антитела, например, одна копия на N-конце легкой цепи первой половины антитела и одна копия на N-конце легкой цепи второй половины антитела ("половина" антитела в данном документе означает тяжелую цепь и легкую цепь, которые вместе образуют область связывания), или одна копия на N-конце тяжелой цепи первой половины антитела и одна копия на N-конце тяжелой цепи второй половины антитела, или одна копия на C-конце легкой цепи первой половины антитела и одна копия на C-конце легкой цепи второй половины антитела, или одна копия на C-конце тяжелой цепи первой половины антитела и одна копия на C-конце тяжелой цепи второй половины антитела (см., например, Brack et al, 2014, Mol Cancer Ther 13: 2030-2039 и фиг. 8 в WO 2013/135588 в отношении примеров различных расположений финомеров на четырех концах антитела IgG). Такие продукты слияния могут быть получены с помощью генной инженерии путем внутрирамочного клонирования нуклеиновой кислоты, кодирующей часть, представляющую собой финомер, и соответствующую цепь антитела, с образованием единой слитой молекулы. Совместная экспрессия с другой цепью антитела (например, легкой цепью в случае слияния финомера с тяжелой цепью или тяжелой цепью в случае слияния финомера с легкой цепью) в клетке приводит к экспрессии функциональных FynomAb. Часть, представляющая собой финомер, может связываться с молекулой-мишенью, отличной от молекулы-мишени для части, представляющей собой антитело (в качестве неограничивающих примеров см., например, FynomAb, описанные в Silacci et al, 2016, mAbs 8:1, 141-149; WO 2014/044758 A1; WO 2014/170063 A1; WO 2015/141862 A1), или часть, представляющая собой финомер, может связываться с другим эпитопом на той же молекуле-мишени, что и для части, представляющей собой антитело (в качестве неограничивающих примеров см. FynomAb, описанные в Brack et al, 2014, Mol Cancer Ther 13(8): p. 2030-9; WO 2013/135588).
Под слитым белком на основе Fc, который содержит по меньшей мере одну вариабельную область, подразумевается сконструированный белок, содержащий (i) Fc-область и (ii) полипептидный связывающий домен, полученный из вариабельного домена иммуноглобулина. Особый интерес представляют антитела, которые содержат (a) мутантный вариант Fc IgG1 по настоящему изобретению и (b) один из следующих полипептидных связывающих доменов, полученных из вариабельной области иммуноглобулина (т. е. которые содержат по меньшей мере одну CDR): (i) Fab-фрагмент, состоящий из доменов VL, VH, CL и CH1, (ii) Fd-фрагмент, состоящий из доменов VH и CH1, (iii) Fv-фрагмент, состоящий из доменов VL и VH одного антитела; (iv) выделенные CDR-области, (v) F(ab')2-фрагмент - бивалентный фрагмент, содержащий два связанных Fab-фрагмента, (vi) одноцепочечные молекулы Fv (scFv), где домен VH и домен VL связаны пептидным линкером, который обеспечивает возможность ассоциации двух доменов с образованием антигенсвязывающего участка, (vii) биспецифический одноцепочечный Fv и (viii) "диатела" или "триатела" - поливалентные или полиспецифические фрагменты, сконструированные посредством слияния генов, при этом данный перечень не является ограничительным.
Под "полноразмерным антителом" в данном документе подразумевается антитело, имеющее встречающуюся в природе биологическую форму антитела, включая вариабельную и константную области. Полноразмерное антитело может представлять собой антитело дикого типа, мутантный вариант антитела дикого типа (например, содержащий уже существующие модификации), сконструированный вариант антитела дикого типа (например, в качестве примера, химерное, гуманизированное антитело или полностью человеческое антитело, см. дополнительно ниже), при этом данный перечень не является ограничительным. Как хорошо известно, структура полноразмерного антитела обычно представляет собой тетрамер, за исключением некоторых млекопитающих, таких как ламы и верблюды, у которых некоторые иммуноглобулины представляют собой димеры.
Компоненты каркаса полноразмерного антитела могут представлять собой смесь от различных видов. Такой мутантный вариант антитела может представлять собой химерное антитело и/или гуманизированное антитело. В целом, как "химерные антитела", так и "гуманизированные антитела" относятся к антителам, в которых объединены области более чем от одного вида. Например, "химерные антитела" традиционно содержат вариабельную(вариабельные) область(области) от животного, отличного от человека, обычно мыши (или, в некоторых случаях, крысы), и константную(константные) область(области) от человека. В большинстве случаев гуманизированные антитела представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина нечеловеческого происхождения. Обычно в гуманизированном антителе все антитело, за исключением CDR, кодируется полинуклеотидом человеческого происхождения или является идентичным антителу человека, за исключением его CDR. CDR, некоторые или все из которых кодируются нуклеиновыми кислотами, происходящими из организма, отличного от человека, прививаются на бета-складчатую структуру каркасной области в вариабельной области антитела человека для создания антитела, специфичность которого определяется привитыми CDR. Способ получения таких антител хорошо известен и описан в, например, WO 92/11018; Jones, 1986, Nature 321:522-525; Verhoeyen et al., 1988, Science 239:1534-1536, Tsurushita & Vasquez, 2004, Humanization of Monoclonal Antibodies, Molecular Biology of B Cells, 533-545, Elsevier Science (USA)).
Как используется в данном документе, "полностью человеческое антитело" или "полное антитело человека" относится к антителу, содержащему исключительно последовательности, происходящие из генов человека. В некоторых случаях это могут быть антитела человека, которые имеют последовательность гена антитела, полученную из хромосомы человека, с модификациями, указанными в данном документе. В качестве альтернативы, компоненты антитела могут быть человеческими, но не быть полученными из одного гена. Таким образом, например, CDR человека из одного антитела могут быть объединены с последовательностями, такими как каркасные последовательности, из одного или нескольких антител человека. Например, различные последовательности зародышевого типа могут быть объединены с образованием антитела человека или каркаса антитела человека.
Полноразмерные антитела, содержащие ковалентные модификации, также включены в объем настоящего изобретения. Такие модификации включают без ограничения гликозилирование, мечение и конъюгирование.
Мечение относится к связыванию детектируемой метки с полноразмерным антителом. Как используется в данном документе, метка включает без ограничения: a) изотопные метки, которые могут представлять собой радиоактивные или тяжелые изотопы; b) магнитные метки (например, магнитные частицы); c) редокс-активные компоненты; d) оптические красители, такие как хромофоры, люминофоры и флуорофоры; ферментативные группы (например, пероксидазу хрена, β-галактозидазу, люциферазу, щелочную фосфатазу); e) биотинилированные группы и f) предварительно определенные полипептидные эпитопы, распознаваемые вторичным репортером (например, парные последовательности лейциновой застежки-молнии, связывающие участки для вторичных антител, домены связывания с металлами, эпитопные метки и т. д.).
Конъюгирование относится к связыванию полноразмерного антитела с полипептидом или непептидной молекулой, такой как область рецептора, связывающаяся с мишенью, адгезивная молекула, лиганд, фермент, цитокин, хемокин, лекарственное средство, цитотоксическое средство (например, химиотерапевтические средства) или токсин.
В определенных вариантах осуществления молекула, содержащая Fc IgG1, выбрана из группы, состоящей из химерных иммуноглобулинов, гуманизированных иммуноглобулинов, полностью человеческих иммуноглобулинов, при этом иммуноглобулины предпочтительно выбраны из IgG и необязательно являются конъюгированными или мечеными.
Свойства молекулы, содержащей мутантный Fc IgG1, обычно можно установить, исходя из свойств молекулы, содержащей Fc IgG1 дикого типа, за исключением того, что касается связывания с C1q и Fcγ-рецепторами, поскольку связывание мутантного варианта с C1q и FcγR определяется аминокислотными модификациями в положениях 265, 297 и 329. Помимо этих весьма значимых различий, существуют некоторые незначительные различия в свойствах молекул, содержащих Fc, по настоящему изобретению и их соответствующих форм дикого типа, например, небольшое снижение термостабильности из-за отсутствия N-связанного гликозилирования.
Еще одним предметом настоящего изобретения является выделенная нуклеиновая кислота, кодирующая молекулу, содержащую мутантный Fc IgG1, определенную выше в данном документе. Настоящее изобретение также относится к вектору, содержащему нуклеиновую кислоту, кодирующую молекулу, содержащую мутантный Fc IgG1, и к клетке-хозяину, содержащей указанный вектор. В предпочтительном варианте осуществления нуклеиновая кислота, кодирующая указанный вектор, стабильно интегрирована в геном клетки-хозяина. Настоящее изобретение также относится к трансгенному животному, отличному от человека, содержащему указанную нуклеиновую кислоту или указанный вектор, стабильно интегрированные в его геном.
ПУТИ ПРИМЕНЕНИЯ СПОСОБА И МУТАНТНЫХ ВАРИАНТОВ В СООТВЕТСТВИИ С НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
Заявитель показал, что замена аминокислот 265, 297 и 329 в Fc-области IgG1 значительно ухудшает аффинность мутантного варианта Fc к C1q и FcγR, таким как FcγRI, FcγRIIa, FcγRIIb и FcγRIIa. Уменьшение аффинности к этим эффекторным молекулам является настолько выраженным, что в некоторых случаях связывание мутантного варианта Fc с C1q и/или с определенными FcγR не может наблюдаться in vitro с помощью традиционных анализов AlphaScreen™/SPR. Связывание Fc-области IgG1 с C1q является существенно важным для индуцирования CDC in vivo. Аналогичным образом, связывание Fc-области IgG1 с FcγRIIa и FcγRIIIa является ключевой стадией индуцирования ADCC и ADCP in vivo. Связывание с FcγR может индуцировать кластеризацию когнатных рецепторов, которая может обеспечивать передачу агонистического сигнала посредством этих рецепторов к клетке-мишени.
Следовательно, предполагается, что молекулы, содержащие мутантный Fc IgG1, по настоящему изобретению из-за их низкой аффинности к C1q не обладают активностью CDC или индуцируют значительно более слабый ответ по типу CDC in vivo по сравнению с их аналогами дикого типа (т.е. молекулами, содержащими Fc IgG1, которые содержат Fc-область IgG1 с аминокислотами D в положении 265, N в положении 297 и P в положении 329, где нумерация приведена согласно индексу EU по Kabat). Аналогичным образом, предполагается, что мутантные варианты по настоящему изобретению из-за их низкой аффинности к определенным FcγR (в частности FcγRIIa и FcγRIIIa) не обладают активностью ADCC или индуцируют значительно более слабый ответ по типу ADCC in vivo по сравнению с их аналогами дикого типа. Аналогичным образом, предполагается, что мутантные варианты по настоящему изобретению не индуцируют кластеризацию рецепторов или агонизм в их отношении посредством вступления в контакт с FcγR in vivo. Такой же результат также ожидается для анализов CDC, анализов ADCC и анализов кластеризации рецепторов in vitro.
Благодаря своим профилям эффекторной активности мутантные варианты по настоящему изобретению могут находить применение в широком спектре областей науки. В частности, мутантные варианты по настоящему изобретению можно применять в качестве реагентов для исследований, диагностических средств или терапевтических средств.
Например, мутантные варианты могут быть меченными флуорофором или таким изотопом, как индий-111 или технеций-99m, и могут применяться для визуализации in vivo, поскольку при таком применении активация ADCC или CDC не требуется.
При применении в качестве терапевтического средства мутантный вариант может применяться для доставки такого терапевтического средства, как радионуклиды, токсины, цитокины или ферменты, в клетку-мишень, например, в раковую клетку. В данном случае мутантный вариант может представлять собой конъюгат антитела и цитотоксического средства, и его терапевтическая активность зависит от цитотоксического средства (например, Gilliland et al., PNAS, 1980, 77, 4539-4543).
Молекула, содержащая Fc IgG1, по настоящему изобретению также может функционировать в качестве блокирующего или нейтрализующего средства для молекулы-мишени. Она также может оказывать агонистическое, антагонистическое или ингибирующее действие на молекулу-мишень.
Молекула, содержащая Fc IgG1, по настоящему изобретению может применяться для нацеливания на рецепторы без индуцирования кластеризации рецепторов или агонизма в их отношении посредством FcγR.
Молекула-мишень может быть любого типа и включает как экзогенные, так и эндогенные молекулы. Молекулы-мишени (также называемые антигенами, если мутантный вариант полипептида представляет собой или содержит антитело) включают без ограничения вирусные, бактериальные и грибные белки, прионы, токсины, ферменты, мембранные рецепторы, лекарственные средства и растворимые белки.
Мембранные рецепторы включают без ограничения антиген RhD, CD3, CD4, CD19, CD20, CD22, CD25, CD28, CD32B, CD33, CD38, CD40, CD44, CD52, CD71 (рецептор трансферрина), CD80, CD86, CTLA-4, CD147, CD160, CD224, рецепторы факторов роста, такие как рецепторы, которые принадлежат к семейству рецепторов ErbB - ErbB1, ErbB2, ErbB3, ErbB4 (EGFR, HER2/neu, HER3, HER4), PD1, VEGF-R1, VEGF-R2, IGF-R1, PIGF-R, молекулы MHC I класса и MHC II класса, например, HLA-DR, рецептор интерферона I типа, рецепторы интерлейкинов, такие как IL-1R, IL-2R-альфа, IL-2R-бета и IL-2R-гамма, IL-6R, рецепторы гормонов, такие как рецептор ингибирующего вещества Мюллера II типа, рецептор LDL, NKp44L, рецепторы хемокинов, такие как CXCR4, CCR5, TNFR, CD137, интегрины, адгезивные молекулы, такие как CD2, ICAM, EpCAM, рецептор, сопряженный с G-белком, и т.д.
Другие потенциальные белки-мишени включают маркеры опухолей, такие как GD2, GD3, CA125, MUC-1, MUC-16, раковый эмбриональный антиген (CEA), Tn, гликопротеин 72, PSMA, HMW-MAA, другие белки, такие как BDCA-2, специфичный для клеток DC, глюкагоноподобные пептиды (например, GLP-1 и т.д.), ферменты (например, глюкоцереброзидазу, идуронат-2-сульфатазу, альфа-галактозидазу A, агалсидазу альфа и бета, альфа-L-идуронидазу, бутирилхолинэстеразу, хитиназу, глутаматдекарбоксилазу, имиглюцеразу, липазу, уриказу, фактор активации тромбоцитов, ацетилгидролазу, нейтральную эндопептидазу, миелопероксидазу и т.д.), белки, связывающиеся с интерлейкинами и цитокинами (например, IL18BP, TNF-связывающий белок и т.д.), фактор активации макрофагов, макрофагальный пептид, B-клеточный фактор, T-клеточный фактор, белок A, ингибитор аллергии, гликопротеины некротических клеток, иммунотоксин, лимфотоксин, фактор некроза опухоли, онкосупрессоры и т.д.
Растворимые белки включают без ограничения цитокины, такие как, например, IL-1-бета, IL-2, IL-6, IL-12, IL-23, TGF-бета, TNF-альфа, IFN-гамма, хемокины, факторы роста, такие как VEGF, G-CSF, GM-CSF, EGF, PIGF, PDGF, IGF, гормоны и ингибирующие антитела, такие как ингибитор FVIII, фактор роста метастазов, альфа-1-антитрипсин, альбумин, альфа-лактальбумин, аполипопротеин E, эритропоэтин, высокогликозилированный эритропоэтин, ангиопоэтины, гемоглобин, тромбин, антитромбин III, пептид, активирующий рецепторы тромбина, тромбомодулин, фактор VII, фактор VIIa, фактор VIII, фактор IX, фактор XIII, фактор активации плазминогена, фибрин-связывающий пептид, урокиназу, стрептокиназу, гирудин, белок C, C-реактивный белок, рецептор фактора активации B-клеток, антагонисты рецепторов (например, IL1-Ra), белки системы комплемента C1, C2, C3, C4, C5, C6, C7, C8, C9, фактор H, фактор I, фактор P, другие белки, такие как CSAP, лиганд CD137, лектины, сиалилированные белки.
В некоторых иллюстративных и неограничивающих вариантах осуществления молекула, содержащая Fc IgG1, может быть выбрана из антител к CD3, антител к HER2 и антител к PD1 или молекулы, содержащей такие антитела.
В определенных вариантах осуществления молекула, содержащая Fc IgG1, содержит антитело к CD3. В определенных вариантах осуществления молекула по настоящему изобретению содержит антитело, которое связывается с CD3, а также другой связывающий компонент, такой как финомер, связывающийся с другой мишенью, т.е. она обладает биспецифической активностью связывания. Такие молекулы могут представлять собой агонистические mAb, применяемые для лечения рака, и они, например, описаны более подробно в примерах в данном документе.
В некоторых вариантах осуществления молекула, содержащая мутантный Fc IgG1, представляет собой или содержит нейтрализующее антитело, направленное на молекулу-мишень, выбранную из группы мембранных рецепторов, растворимых белков человека, токсинов, вирусных, бактериальных и грибных белков.
Вследствие своей низкой степени связывания с C1q и некоторыми FcγR мутантный вариант по настоящему изобретению особенно подходит для применения при лечении состояний, при которых привлечение иммунной системы посредством ADCC или CDC или при которых кластеризация когнатных рецепторов или агонизм в их отношении посредством FcγR не являются критически важными для терапевтической эффективности.
В некоторых случаях предполагается, что введение молекулы, содержащей мутантный Fc IgG1, по настоящему изобретению индуцирует меньшие побочные эффекты и меньшую IgG-опосредованную цитотоксичность, чем большинство антител и иммуноадгезинов, которые не содержат мутаций в аминокислотных положениях 265, 297 и 329 в их Fc-области IgG1.
Таким образом, еще одним предметом настоящего изобретения является применение мутантной молекулы, содержащей Fc IgG1, по настоящему изобретению для предупреждения или лечения патологического состояния, при котором FcR-опосредованные эффекты, в том числе индуцирование ответов по типу ADCC и/или CDC или кластеризация когнатных рецепторов посредством FcγR, не являются желательными.
Индуцирование ответов по типу ADCC и CDC не является желательным, если для терапевтической эффективности мутантного варианта не требуется активация эффекторных клеток или активация CDC. Такой мутантный вариант включает, например, блокирующие или нейтрализующие антитела.
Патологические состояния, для лечения или предупреждения которых не требуется индуцирование CDC и ADCC, включают без ограничения отторжение трансплантата, аутоиммунные заболевания, воспалительные заболевания.
Индуцирование кластеризации рецепторов посредством FcγR не является желательным, если для терапевтической эффективности мутантного варианта не требуется FcγR-опосредованная кластеризация рецепторов в целях терапевтической эффективности. Такие мутантные варианты включают, например, биспецифические молекулы, специфичные к CD3/опухолевому антигену, для которых требуется кластеризация рецепторов CD3 строго зависимым от опухолевого антигена образом, но не FcγR-зависимым образом.
В определенных вариантах осуществления в настоящем изобретении представлено FynomAb в соответствии с настоящим изобретением (т.е. содержащее Fc-область IgG1 с доменом CH2, где аминокислота в положении 265 не представляет собой D, аминокислота в положении 297 не представляет собой N, и аминокислота в положении 329 не представляет собой P, где нумерация соответствует индексу EU по Kabat), имеющее часть, представляющую собой антитело, связывающуюся с CD3, и часть, представляющую собой финомер, связывающуюся с CD33.
Другим предметом настоящего изобретения является применение мутантного варианта по настоящему изобретению для получения фармацевтической композиции.
Еще одним предметом настоящего изобретения является получение фармацевтических композиций, содержащих указанный мутантный вариант. Если мутантная молекула, содержащая Fc IgG1, представляет собой антитело, то мутантный вариант может присутствовать в форме моноклональных или поликлональных антител. Фармацевтические композиции получают путем смешивания мутантного варианта полипептида, имеющего желаемую степень чистоты, с необязательным физиологически приемлемым носителем, вспомогательными веществами или стабилизаторами в форме лиофилизированных составов или водных растворов.
Фармацевтическая композиция по настоящему изобретению может быть составлена в соответствии со стандартными способами, такими как способы, описанные в Remington: The Science and Practice of Pharmacy (Lippincott Williams & Wilkins; Twenty first Edition, 2005).
Фармацевтически приемлемые вспомогательные вещества, которые можно применять, описаны, в частности, в Handbook of Pharmaceuticals Excipients, American Pharmaceutical Association (Pharmaceutical Press; 6th revised edition, 2009).
В целях лечения пациента, нуждающегося в этом, можно вводить терапевтически эффективную дозу молекулы, содержащей мутантный Fc IgG1, по настоящему изобретению. Под "терапевтически эффективной дозой" в данном документе подразумевается доза, которая вызывает эффекты, ради которых ее вводят. Точная доза зависит от цели лечения и может быть установлена специалистом в данной области с применением известных методик. Дозы могут находиться в диапазоне от 0,0001 до 100 мг/кг массы тела или больше, например, составлять 0,001, 0,01, 0,1, 1,0, 10 или 50 мг/кг массы тела, при этом предпочтительными являются значения от 0,001 до 10 мг/кг. Как известно из уровня техники, может быть необходима поправка на разрушение белка, системную или локальную доставку и скорость синтеза новой протеазы, а также возраст, массу тела, общее состояние здоровья, пол, рацион, время введения, взаимодействие лекарственных средств и тяжесть состояния, и она может быть установлена путем проведения обычных экспериментов специалистами в данной области.
Введение фармацевтической композиции, содержащей молекулу, содержащую мутантный Fc IgG1, по настоящему изобретению, можно осуществлять различными путями, в том числе без ограничения пероральным, подкожным, внутривенным, парентеральным, интраназальным, внутриаортальным, внутриглазным, ректальным, вагинальным, трансдермальным, местным (например, в виде гелей), внутрибрюшинным, внутримышечным, внутрилегочным путями.
Молекулы, содержащие мутантный Fc IgG1, описанные в данном документе, можно необязательно вводить вместе с другими сопутствующими терапевтическими средствами, т.е. терапевтические средства, описанные в данном документе, необязательно можно вводить совместно с другими видами терапии или терапевтическими средствами, в том числе, например, малыми молекулами, другими биологическими препаратами, лучевой терапией, хирургическим вмешательством и т.д.
ИЛЛЮСТРАТИВНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ОПИСАННОГО ОБЪЕКТА ИЗОБРЕТЕНИЯ
Для лучшего и более полного описания объекта изобретения в данном документе в этом разделе представлены пронумерованные иллюстративные варианты осуществления представленного объекта изобретения.
Пронумерованные варианты осуществления являются следующими.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
1. Рекомбинантная молекула, содержащая Fc IgG1, которая содержит домен CH2, в котором аминокислота в положении 265 отличается от аспарагиновой кислоты (D), аминокислота в положении 297 отличается от аспарагина (N), и аминокислота в положении 329 отличается от пролина (P), где нумерация указана согласно индексу EU по Kabat.
2. Молекула согласно варианту осуществления 1, где молекула характеризуется сниженным связыванием с C1q и с по меньшей мере одним Fcγ-рецептором (FcγR) по сравнению с молекулой, содержащей Fc IgG1, имеющей домен CH2 дикого типа, который содержит D в положении 265, N в положении 297 и P в положении 329.
3. Молекула согласно варианту осуществления 1 или 2, где молекула сохраняет связывание с FcRn.
4. Молекула согласно любому из вариантов осуществления 2-3, где по меньшей мере один FcγR представляет собой FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa и FcγRIIIb.
5. Молекула согласно любому из вариантов осуществления 1-4, где:
i. аминокислота в положении 265 представляет собой аланин (A), аспарагин (N) или глутаминовую кислоту (E),
ii. аминокислота в положении 297 представляет собой аланин (A), аспарагиновую кислоту (D) или глутамин (Q), и
iii. аминокислота в положении 329 замещена аланином (A), глицином (G) или серином (S).
6. Молекула согласно любому из вариантов осуществления 1-5, где аминокислотная последовательность Fc-домена является на по меньшей мере 90% идентичной по отношению к аминокислотной последовательности Fc-домена IgG1 человека (SEQ ID NO: 43).
7. Молекула согласно любому из вариантов осуществления 1-6, где молекула представляет собой антитело, Fc-область, слитый белок на основе Fc или слитый белок на основе антитела, такой как FynomAb.
8. Молекула в соответствии с любым из вариантов осуществления 1-7, где молекула представляет собой антитело.
9. Молекула в соответствии с любым из вариантов осуществления 1-7, где молекула представляет собой слитый белок на основе антитела.
10. Молекула в соответствии с любым из вариантов осуществления 1-7, где молекула представляет собой FynomAb.
11. Молекула согласно любому из вариантов осуществления 1-10, где молекула содержит Fc-область, содержащую последовательность в соответствии с любым из SEQ ID NO: 43, 52, 53, 54, 55, 56, 57 или 58, где аминокислоты D в положении 265, N в положении 297 и P в положении 329 замещены другими аминокислотами.
12. Рекомбинантный полинуклеотид, кодирующий молекулу согласно любому из предыдущих вариантов осуществления.
13. Вектор, содержащий полинуклеотид согласно варианту осуществления 12.
14. Клетка-хозяин, содержащая рекомбинантный полинуклеотид согласно варианту осуществления 12 или вектор согласно варианту осуществления 13.
15. Способ получения рекомбинантной молекулы, содержащей Fc IgG1, которая содержит домен CH2, в котором аминокислоты в положениях 265, 297 и 329, указанных согласно индексу EU по Kabat, замещены другими аминокислотами, при этом способ включает стадии:
a. получения нуклеиновой кислоты, кодирующей молекулу, содержащую Fc IgG1 дикого типа,
b. модификации нуклеиновой кислоты, полученной на стадии (a), в целях получения нуклеиновой кислоты, кодирующей рекомбинантную молекулу, содержащую Fc IgG1, в которой аминокислоты в положениях 265, 297 и 329 замещены аминокислотами, отличными от D, N и P соответственно, и
c. обеспечения экспрессии нуклеиновой кислоты, полученной на стадии (b), в клетке-хозяине и извлечения указанного мутантного варианта.
16. Рекомбинантный полипептид, содержащий:
a. по меньшей мере один связывающий домен, способный связываться с молекулой-мишенью; и
b. Fc-домен IgG1, где аминокислоты в положениях 265, 297 и 329 в соответствии с индексом EU по Kabat отличаются от D, N и P соответственно,
где полипептид способен связываться с молекулой-мишенью, не инициируя значительную активацию лимфоцитов, комплемент зависимый лизис и/или клеточноопосредованное разрушение молекулы-мишени и/или клетки, на поверхности которой представлена молекула-мишень.
17. Рекомбинантный полипептид согласно варианту осуществления 16, где по меньшей мере один связывающий домен выбран из группы, состоящей из связывающего участка антитела, финомера, фермента, гормона, внеклеточного домена рецептора, цитокина, поверхностного антигена иммунных клеток, лиганда и адгезивной молекулы.
18. Рекомбинантный полипептид согласно варианту осуществления 16 или 17, где Fc-домен является на по меньшей мере 90% идентичным по отношению к аминокислотной последовательности Fc-домена IgG1 человека (SEQ ID NO: 43).
19. Рекомбинантный полипептид согласно любому из вариантов осуществления 16-18, где связывающий домен представляет собой связывающий участок антитела.
20. Фармацевтическая композиция, содержащая молекулу, содержащую Fc IgG1, согласно любому из вариантов осуществления 1-11, рекомбинантный полинуклеотид согласно варианту осуществления 12, вектор согласно варианту осуществления 13 или рекомбинантный полипептид согласно любому из вариантов осуществления 16-19 и фармацевтически приемлемое вспомогательное вещество.
21. Способ лечения заболевания или нарушения, включающий введение субъекту или пациенту молекулы, содержащей Fc IgG1, согласно любому из вариантов осуществления 1-11, рекомбинантного полинуклеотида согласно варианту осуществления 12, вектора согласно варианту осуществления 13, рекомбинантного полипептида согласно любому из вариантов осуществления 16-19 или фармацевтической композиции в соответствии с вариантом осуществления 20.
22. Способ согласно варианту осуществления 21, где заболевание или нарушение представляет собой рак.
23. Молекула, содержащая Fc IgG1, согласно любому из вариантов осуществления 1-11, рекомбинантный полинуклеотид согласно варианту осуществления 12, вектор согласно варианту осуществления 13, рекомбинантный полипептид согласно любому из вариантов осуществления 16-19 или фармацевтическая композиция в соответствии с вариантом осуществления 20 для применения в лечении заболевания или нарушения.
24. Молекула, содержащая Fc IgG1, рекомбинантный полинуклеотид, вектор или рекомбинантный полипептид согласно варианту осуществления 23, где заболевание или нарушение представляет собой рак.
25. Применение молекулы, содержащей Fc IgG1, согласно любому из вариантов осуществления 1-11, рекомбинантного полинуклеотида согласно варианту осуществления 12, вектора согласно варианту осуществления 13, рекомбинантного полипептида согласно любому из вариантов осуществления 16-19 или фармацевтической композиции в соответствии с вариантом осуществления 20 в изготовлении лекарственного препарата для лечения заболевания или нарушения.
26. Применение в соответствии с вариантом осуществления 25, где заболевание или нарушение представляет собой рак.
27. Способ получения рекомбинантной молекулы, содержащей Fc IgG1, при этом способ включает обеспечение экспрессии рекомбинантного полинуклеотида согласно варианту осуществления 12 в клетке-хозяине и сбор рекомбинантного полипептида.
ПРИМЕРЫ
Следующие примеры представлены для дополнения предшествующего раскрытия и для обеспечения лучшего понимания объекта изобретения, описанного в данном документе. Эти примеры не должны рассматриваться как ограничивающие описанный объект изобретения. Следует понимать, что примеры и варианты осуществления, описанные в данном документе, предназначены только для иллюстративных целей, и что в их свете различные модификации или изменения будут очевидны для специалистов в данной области и должны быть включены в данный документ, и они могут быть выполнены без отступления от истинного объема изобретения.
ПРИМЕР 1. ЭКСПРЕССИЯ И ОЧИСТКА АНТИТЕЛ С МУТАНТНЫМ FC
Несколько антител на основе mAb1, антитела IgG1 человека, специфичного к CD3 человека, получали с помощью различных мутаций в домене CH2. Мутации представляли собой:
- i) N297A,
- ii) D265 и P329A (DAPA),
- iii) D265, и N297A, и P329A (DANAPA), а также
- iv) L234A и L235A (LALA).
(Нумерация EU в соответствии с Kabat (Kabat, E. A. (1991). Sequences of proteins of immunological interest, Bethesda, MD: U.S. Dept. of Health and Human Services, Public Health Service, National Institutes of Health, 1991).
Для обеспечения экспрессии антител обычно присутствует лидерная последовательность, которая отщепляется и больше не присутствует в секретируемом продукте. Пример лидерной последовательности, применяемой для экспрессии в примерах, описанных в данном документе, представлен под SEQ ID NO: 42, и пример нуклеотидной последовательности, кодирующей ее, представлен под SEQ ID NO: 41.
Векторы экспрессии, кодирующие антитела с различными мутациями в Fc, вводили в клетки FreeStyle CHO-S путем транзиентной трансфекции, и обеспечивали их экспрессию в бессывороточной/не содержащей компонентов животного происхождения среде в течение 6 дней. Антитела к CD3 очищали из надосадочной жидкости с помощью аффинной хроматографии с белком А (GE-Healthcare, № по кат. 89928) с использованием прибора  (GE Healthcare) и подвергали диализу против PBS. Концентрации определяли путем измерения оптической плотности при 280 нм.
(GE Healthcare) и подвергали диализу против PBS. Концентрации определяли путем измерения оптической плотности при 280 нм.
SEC проводили с применением колонки SEC-5 (Agilent, размер частиц 5 мкм, 300 Å) на системе Agilent HPLC 1260. 10 мкл очищенного белка загружали в колонку, и элюирование регистрировали путем измерения OD280.
Мутантные варианты антител с мутантным Fc можно очищать с хорошими показателями выхода и высокой чистотой с помощью одностадийной аффинной хроматографии с белком А. Показатели выхода приведены в таблице 1.
Как было обнаружено с помощью SEC, все белки были примерно на 95% мономерными. Профили SEC для mAb1 IgG1 и mAb1 IgG1 DANAPA показаны на фиг. 1.
Эти результаты демонстрируют, что при вставке тройной мутации DANAPA в последовательность IgG1 человека сохраняется хорошая экспрессия и монодисперсность, каждая из которых является ключевым критерием для фармацевтического продукта.
Таблица 1. Показатели выхода белка для мутантных вариантов mAb1
ПРИМЕР 2. АНТИТЕЛА С МУТАНТНЫМ FC, СВЯЗЫВАЮЩИЕСЯ С КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ CD3, С ИДЕНТИЧНОЙ АФФИННОСТЬЮ ПО СРАВНЕНИЮ С НЕМОДИФИЦИРОВАННЫМ АНТИТЕЛОМ
Различные mAb1 с мутантным Fc титровали в CD3+ клетках Jurkat (ATCC® TIB-152™) для оценки аффинности связывания с CD3 человека. К клеткам Jurkat добавляли антитела с мутантным Fc в серийных разведениях при концентрации от 50 нМ до 0,13 пМ, и связавшиеся антитела выявляли с помощью антитела к IgG человека, конъюгированного с Alexa488. Среднюю интенсивность флуоресценции (MFI), определенную на цитометре, откладывали на графике в зависимости от концентрации антитела в логарифмическом масштабе.
Кривые связывания, полученные в CD3+ клетках Jurkat, показаны на фиг. 2.
Мутантные варианты антител с мутантным Fc связываются с CD3 с идентичной аффинностью, что указывает на то, что мутации в Fc не оказывают никакого влияния на связывание с клетками-мишенями.
ПРИМЕР 3. MAB1 IGG1 DANAPA НЕ ИНДУЦИРУЕТ АКТИВАЦИЮ ЛИМФОЦИТОВ
В целях исследования эффекта mAb1 с мутантным Fc в отношении активации иммунных клеток свежевыделенные PBMC человека инкубировали в присутствии mAb1 с мутантным Fc. Активацию иммунных клеток определяли i) по окрашиванию на поверхностный антиген CD69 спустя 14 ч. инкубирования или ii) с помощью количественного определения IFNγ в надосадочной жидкости спустя 3 дня инкубирования.
PBMC человека выделяли из препаратов лейкоцитарной пленки, собранных в Blutspende, Берн, Швейцария, за один день до выделения PBMC. PBMC выделяли путем центрифугирования в градиенте плотности с применением пробирок Pancoll (Pan-BioTech) согласно инструкциям производителя. После выделения PBMC остаточные эритроциты лизировали с помощью 1x буфера для лизиса RBC (Miltenyi).
100000 свежевыделенных PBMC смешивали с различными мутантными вариантами Fc mAb1 в серийных разведениях (концентрации от 300 нМ до 0,15 пМ) в общем объеме 200 мкл RPMI1640 с добавлением 10% термоинактивированной FBS в лунках 96-луночного планшета с U-образным дном. В качестве положительного контроля PBMC инкубировали в присутствии активационных гранул MACSiBead с антителами к CD2/CD3/CD28, содержащихся в наборе для активации/размножения T-клеток человека, приобретенном у Miltenyi.
Поверхностную экспрессию CD69 определяли спустя 14 ч. инкубирования. Содержимое лунок для анализа перемешивали, и 100 мкл из каждой лунки переносили в 96-луночный планшет с U-образным дном для последующего окрашивания на CD69. Клетки осаждали и ресуспендировали в 40 мкл антитела к CD69, конъюгированного с FITC (BD Biosciences), в буфере для FACS, содержащем 1% FBS и 0,2% азид натрия. Спустя 45 мин. инкубирования на льду несвязавшиеся антитела смывали, образцы фиксировали в 50 мкл 1,8% формалина в течение 15 мин. на льду и анализировали на проточном цитометре Guava easeCyte 8HT (Millipore). Процентную долю CD69-положительных лимфоцитов откладывали на графике в зависимости от концентрации антитела в логарифмическом масштабе.
Уровни IFNγ в надосадочной жидкости определяли с помощью сэндвич-ELISA спустя 3 дня инкубирования с применением набора BD OptEIA для ELISA IFNγ человека (BD biosciences) согласно инструкциям производителя. Концентрации IFNγ откладывали на графике в зависимости от концентрации антитела в логарифмическом масштабе.
Неожиданно оказалось, что mAb1 IgG1 DANAPA была единственной конструкцией, которая не индуцировала активацию лимфоцитов, что было продемонстрировано по отсутствию индуцирования экспрессии CD69 на PBMC (фиг. 3A) и IFNγ в надосадочной жидкости культуры (фиг. 3B). В отличие от этого, все другие мутантные варианты, которые содержат одиночные или комбинированные мутации в Fc, для которых ранее сообщалось о снижении связывания с FcR, по-прежнему индуцировали значительную активацию лимфоцитов. Важно отметить, что последовательность Fc DANAPA приводила к лучшему подавлению, чем последовательность Fc N297A или последовательность Fc LALA, обе последовательности "подавленного" Fc, применяющиеся в некоторых терапевтических белках, содержащих Fc, находящихся на стадии клинических исследований, для которых желательно минимальное взаимодействие с FcR. Эти результаты позволяют предположить, что последовательность Fc DANAPA придает сильно сниженный потенциал индуцирования активации T-клеток и высвобождения цитокинов в анализах с использованием PBMC человека.
ПРИМЕР 4. IGG1 DANAPA ДЕМОНСТРИРУЕТ МИНИМАЛЬНОЕ СВЯЗЫВАНИЕ С FCγ-РЕЦЕПТОРАМИ ЧЕЛОВЕКА
Характеристики связывания с FcγRI (CD64), FcγRIIA (CD32A), FcγRIIB (CD32B) и FcγRIIIA (CD16A) получали с помощью конкурентного анализа AlphaScreen™ (Vafa, O., G.L. Gilliland, R.J. Brezski, B. Strake, T. Wilkinson, E.R. Lacy, B. Scallon, A. Teplyakov, T. J. Malia and W.R. Strohl (2014). Methods 65(1): 114-126). Анализ схематично проиллюстрирован на фиг. 4A. Биотинилированное контрольное антитело захватывается донорными гранулами со стрептавидином; His-меченные Fcγ-рецепторы захватываются акцепторными гранулами с Ni2+; немеченые антитела с Fc, представляющим интерес, в серийных разведениях применяются в качестве конкурирующих средств. Данный формат приводит к снижению сигнала, когда происходит связывание конкурирующих средств с рецепторами.
B21M, контрольное антитело IgG1 человека, специфичное к респираторно-синцитиальному вирусу и, как полагают, не связывающееся специфично с какими-либо мишенями у здоровых млекопитающих (Vafa, O., G.L. Gilliland, R.J. Brezski, B. Strake, T. Wilkinson, E.R. Lacy, B. Scallon, A. Teplyakov, T.J. Malia and W.R. Strohl (2014). Methods 65(1): 114-126), метили биотином (набор для мечения хромофорным биотином SureLINK, KPL). 0,2 мкг/мл биотинилированного контрольного антитела IgG1 B21M, тестируемые антитела с мутантным Fc (400 мкг/мл и восемь их серийных 3-кратных разведений), His-меченные Fcγ-рецепторы человека (R&D, состав без носителя), акцепторные гранулы с Ni2+ (Perkin Elmer, в разведении 1:250) и донорные гранулы со стрептавидином (Perkin Elmer, в разведении 1:250) перемешивали в аналитическом буфере (PBS, 0,05% BSA, 0,01% Tween 20, pH 7,2) в порядке, указанном выше. Fcγ-рецепторы человека применяли в следующих концентрациях: FcγRI и FcγRIIIA при 200 нг/мл; FcγRIIA при 10 нг/мл; FcγRIIB при 14 нг/мл.
Для оценки связывания с FcγRI применяли биотинилированный IgG1 B21M LALA вместо IgG1 B21M (тяжелая цепь под SEQ ID NO: 18; легкая цепь под SEQ ID NO: 32) в целях увеличения чувствительности анализа. IgG1 B21M LALA (тяжелая цепь под SEQ ID NO: 30; легкая цепь под SEQ ID NO: 32) несет две замены на аланин в L234 и L235 (см. также пример 1), которые снижают аффинность связывания с FcγRI.
Спустя 30 мин. инкубирования планшеты анализировали на планшет-ридере EnVision.
%Max сигнала получали из необработанных данных EnVision посредством нормализации по минимальному и максимальному сигналу с использованием следующего уравнения:
%Max = (Exp - Min) / (Max - Min) * 100,
где
Exp=необработанный сигнал EnVision в лунке,
Min=минимальный сигнал, полученный при наиболее высокой концентрации конкурирующего средства среди всех тестируемых конкурирующих средств в планшете,
Max=максимальный сигнал, т.е., как правило, в отсутствие конкурирующего средства.
Значения %Max откладывали на графике в GraphPad Prism как среднее значение ± стандартное отклонение (n=3) по оси y и log (концентрации ингибитора) по оси x. Данные аппроксимировали с помощью нелинейной регрессии с использованием четырехпараметрической модели зависимости ответа от log (концентрации ингибитора) с переменным угловым коэффициентом Хилла.
Для подтверждения результатов конкурентного анализа AlphaScreen™ связывание мутантных вариантов mAb1 с мутантным Fc с высокоаффинным FcγRI (CD64) и с низкоаффинным FcγRIIIA (CD16A) анализировали с помощью поверхностного плазмонного резонанса (SPR). Чип CM5 BIAcore покрывали 1400 RU рекомбинантного FcγRIIIA человека (158F; R&D Systems) или 1500 RU рекомбинантного FcγRI человека (Sino Biological) с использованием набора для иммобилизации по аминогруппе BIAcore (GE Healthcare). Серийные двукратные разведения mAb1 с мутантным Fc в концентрациях от 2000 нМ до 31 нМ получали и вводили при 30 мкл/мин в PBS с pH 7,4 с добавлением 0,05% Tween-20 на поверхности чипов, покрытые FcR, и на непокрытую эталонную поверхность. Поверхность чипа регенерировали с помощью 10 нМ NaOH между введениями. Из полученных кривых связывания вычитали эталонные значения, затем вычитали значения буфера, и полученные кривые после двойного вычитания эталонных значений оценивали с помощью программного обеспечения для оценивания BIAcore с использованием кинетической модели Ленгмюра 1:1 с получением кинетических констант ассоциации и диссоциации kon и koff, из которых рассчитывали термодинамическую константу диссоциации KD как koff/kon, либо с использованием модели аффинности в равновесном состоянии с непосредственным получением термодинамической константы диссоциации KD.
Результаты конкурентного анализа AlphaScreen™ показаны на фиг. 4B и в таблице 2. mAb1 IgG1 DANAPA демонстрировало минимальную конкуренцию в отношении FcγRI (IC50 > 1000 нМ), сниженную более чем в 400 раз по сравнению с немодифицированным IgG1, что указывает на то, что данная последовательность Fc обладает минимальной остаточной активностью связывания с FcγRI. Fc DANAPA неожиданно продемонстрировал на удивление сниженное связывание с FcγRI по сравнению с последовательностями Fc LALA или Fc N297A, применяемыми в антителах, находящихся на стадии клинических исследований, для которых желательно минимальное взаимодействие с FcR. mAb1 IgG1 LALA, mAb1 IgG1 N297A и mAb1 IgG1 DAPA продемонстрировали сниженное, но по-прежнему более чем в 37 раз более сильное связывание с FcγRI человека, чем mAb1 IgG1 DANAPA (IC50=27 нМ, 24 нМ и 18 нМ).
Для mAb1 IgG1 DANAPA, mAb1 IgG1 DAPA и mAb1 IgG1 N297A не было обнаружено связывание ни с одним другим FcγR человека. Согласно наблюдениям mAb1 IgG1 LALA связывалось с FcγRIIIA и очень слабо связывалось с FcγRIIB.
Результаты анализов связывания на BIAcore показаны на фиг. 4C и в таблице 3 (связывание с FcγRI), а также на фиг. 4D и в таблице 4 (связывание с FcγRIIIA). mAb1 IgG1 DANAPA неожиданно демонстрировало полное устранение связывания с FcγRI. mAb1 IgG1 DAPA, mAb1 IgG1 N297A и mAb1 IgG1 LALA сохраняли остаточную активность связывания с FcγRI, хоть и со сниженной аффинностью по сравнению с mAb1 IgG1. mAb1 IgG1 DANAPA не демонстрировало связывание с FcγRIIIA человека. Аналогично, mAb1 IgG1 DAPA и mAb1 IgG1 N297A не демонстрировали связывание, тогда как mAb1 IgG1 LALA демонстрировало остаточное связывание с FcγRIIIA, хоть и со сниженной активностью по сравнению с mAb1 IgG1.
В конце концов эти результаты демонстрируют, что последовательность Fc DANAPA характеризуется на удивление сниженным связыванием с FcγRI, FcγRIIA, FcγRIIB и FcγRIIIA человека. Степень, в которой последовательность Fc DANAPA обладает сниженной активностью связывания с FcR, является намного более высокой по сравнению с другими одиночными или комбинированными мутациями в Fc, о которых ранее было известно, что они приводят к снижению активности связывания с FcγR. Эти результаты дополнительно позволяют предположить, что основное отличие между Fc DANAPA и другими Fc, тестируемыми в данном документе, заключается в на удивление сниженном связывании с FcγRI.
Таблица 2. Значения IC50 при конкурентном связывании с FcγRI
IgG1
IgG1 DAPA
IgG1 N297A
IgG1 LALA
IgG1 DANAPA
Таблица 3. Параметры связывания с FcγRI (BIAcore)
в равновесном состоянии
н.с.: связывание не наблюдалось (данные анализировались)
н.о.: не определено (связывание наблюдалось, но кинетические данные не анализировались)
Таблица 4. Параметры связывания с FcγRIIIA (BIAcore)
в равновесном состоянии
н.с.: связывание не наблюдалось (данные не анализировались)
ПРИМЕР 5. FC IGG1 DANAPA ДЕМОНСТРИРУЕТ СНИЖЕННОЕ СВЯЗЫВАНИЕ С FCγR В КАЧЕСТВЕ СОСТАВНОЙ ЧАСТИ РАЗЛИЧНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ АНТИТЕЛ
В дополнение к mAb1 IgG1 DANAPA, представленному в предыдущих примерах выше, получали три антитела с различными последовательностями Fab и различными когнатными мишенями в формате IgG1 DANAPA, как описано в примере 1 для mAb1: антитело mAb2 к CD3 (тяжелая цепь под SEQ ID NO: 14; легкая цепь под SEQ ID NO: 16), антитело к HER2 (тяжелая цепь под SEQ ID NO: 10; легкая цепь под SEQ ID NO: 12) и антитело к PD1 (тяжелая цепь под SEQ ID NO: 6; легкая цепь под SEQ ID NO: 8). Активность связывания с FcγR сравнивали с mAb1 IgG1 DANAPA в конкурентном анализе AlphaScreen™, как описано в примере 4.
Результаты показаны на фиг. 5. Все из CD3-специфичного антитела mAb2, HER2-специфичного антитела и PD-1-специфичного антитела в формате IgG1 DANAPA демонстрировали минимальное связывание с FcγRI (IC50=600 нМ или выше) и не демонстрировали связывание с другими тестируемыми FcR. Эти данные показывают, что последовательность IgG1 DANAPA сильно снижает связывание с FcR независимо от последовательности Fab или когнатной мишени и потенциально придает минимальное связывание с FcγR практически любому антителу.
ПРИМЕР 6. MAB1 С ЗАМЕНАМИ В D265, N297 И P329 ДЕМОНСТРИРУЕТ СНИЖЕННОЕ СВЯЗЫВАНИЕ С FCγR1 ЧЕЛОВЕКА
Для того, чтобы определить, можно ли воспроизвести сильно сниженную способность Fc DANAPA связываться с Fc-рецепторами путем замены такого же набора остатков (т.е. D265, N297 и P329) аминокислотами, отличными от аланина, получали mAb1 со следующими заменами, как описано в примере 1:
a) D265N, N297D, P329G (называемое DNNDPG)
(тяжелая цепь под SEQ ID NO: 18; легкая цепь под SEQ ID NO: 4)
b) D265E, N297Q, P329S (называемое DENQPS)
(тяжелая цепь под SEQ ID NO: 20; легкая цепь под SEQ ID NO: 4)
Активность связывания с FcγRI сравнивали с mAb1 IgG1 DANAPA в конкурентном анализе AlphaScreen™, как описано в примере 4.
Результаты показаны на фиг. 6. Все три антитела демонстрировали минимальное связывание с FcγRI, взаимодействие, которое, по-видимому, наиболее сложно устранить с помощью конструирования Fc (см. пример 4). Эти результаты показывают, что взаимодействие с FcγRI можно снизить путем замены трех остатков, D265, N297 и P329, различными аминокислотными остатками, а не только путем замены аланином.
ПРИМЕР 7. У IGG1 DANAPA УСТРАНЯЕТСЯ СВЯЗЫВАНИЕ С C1Q
Связывание C1q с Fc антитела является начальной стадией индуцирования антителоопосредованной активации системы комплемента и последующего комплемент-опосредованного лизиса клеток-мишеней. Связывание mAb1 IgG1 DANAPA с C1q человека измеряли в анализе связывания SPR на приборе BIAcore T100. Чип CM5 покрывали антителами посредством иммобилизации по аминогруппе при плотности покрытия 5000 RU. C1q человека (EMD Millipore) вводили в подвижный буфер (PBS, pH 7,4, 0,05% TWEEN-20) при 200 нМ и в его трехкратных серийных разведениях при скорости потока 30 мкл/мин. Связывание регистрировали, и определяли KD посредством подбора кривой с помощью программного обеспечения BIAcore с использованием модели аффинности в равновесном состоянии.
Результаты эксперимента показаны на фиг. 7. mAb1 IgG1 демонстрировало сильное связывание с C1q с кажущейся KD 30 нМ, что соответствует опубликованным значениям аффинности для этого взаимодействия и подтверждает правильность постановки анализа (Moore GL, et al. (2010), Mabs 2(2): 181-189).
mAb1 IgG1 DANAPA не демонстрирует какое-либо выявляемое связывание с C1q.
Примечательно, что сходная последовательность Fcγ1, Fcγ1 DANA, в которой объединены мутации D265A и N297A, но отсутствует мутация P329A, присутствующая в Fcγ1 DANAPA, была описана в литературе как демонстрирующая остаточное связывание с C1q (Gong, Q, et al. (2005), J Immunol 174(2): 817-826).
В отличие от Fcγ1 DANA, mAb1 IgG1 DANAPA на удивление демонстрировало полную потерю связывания с C1q.
ПРИМЕР 8. МУТАЦИИ DANAPA НЕ УХУДШАЮТ СВЯЗЫВАНИЕ С FCRN ЧЕЛОВЕКА
Взаимодействие Fc IgG с FcRn играет важную роль в метаболизме антител (Kuo TT and VG Aveson (2011), MAbs 3(5): 422-430). IgG, который поглощается клетками посредством пиноцитоза, вступает в контакт с рецептором FcRn в кислой среде эндосом. FcRn обеспечивает рециркуляцию IgG обратно на клеточную поверхность, где антитело диссоциирует от FcRn при нейтральном или основном pH и, таким образом, "спасается" от разрушения лизосомами. Этот механизм дает объяснение длительного периода полувыведения IgG из сыворотки крови. Следовательно, для обеспечения наличия длительного периода полувыведения из кровотока важно, чтобы антитела с заменами в Fc сохраняли полное связывание с FcRn при кислом pH и легко диссоциировали при нейтральном pH.
Тогда как FcγR человека связывается с остатками в нижней шарнирной области и с доменом CH2 антител IgG (Woof JM and DR Burton (2004), Nat Rev Immunol 4(2): 89-99), FcRn человека взаимодействует с некоторыми остатками на границе раздела CH2-CH3 (Martin WL, et al. (2001), Mol Cell 7(4): 867-877). Следовательно, мутации, введенные с целью снижения связывания с FcR, могут оказывать влияние на взаимодействие Fc и FcRn. Например, Shields и соавт. наблюдали, что некоторые мутации в нижней шарнирной области или домене CH2, которые приводили к снижению связывания с FcγR, также приводили к снижению связывания с FcRn (например, E233P, Q295A). Следовательно, особенно важно оценить влияние мутаций DANAPA на связывание с FcRn.
Связывание IgG1 DANAPA с FcRn анализировали с помощью поверхностного плазмонного резонанса (SPR). Чип CM5 BIAcore покрывали 600 RU рекомбинантного FcRn человека (Sino Biological) с использованием набора для иммобилизации по аминогруппе BIAcore (GE Healthcare). Серийные двукратные разведения mAb1 с мутантным Fc DANAPA и немутантного mAb1 IgG1 в концентрациях от 2000 нМ до 31 нМ получали и вводили при 30 мкл/мин в PBS с pH 6,0 с добавлением 0,05% Tween-20 на поверхность, покрытую FcR, и на непокрытую эталонную поверхность. Между инъекциями поверхность чипа регенерировали с помощью PBS с pH 7,4. Из полученных кривых связывания вычитали эталонные значения, затем вычитали значения буфера, и полученные кривые после двойного вычитания эталонных значений оценивали с помощью программного обеспечения для оценивания BIAcore с использованием модели аффинности в равновесном состоянии с получением термодинамической константы диссоциации KD.
Результаты анализа связывания с FcRn человека показаны на фиг. 8. Константа диссоциации KD составляла 500 нМ для mAb1 IgG1 DANAPA и 470 нМ для mAb1 IgG1, что указывает на отсутствие различий в связывании с FcRn человека. mAb1 IgG1 DANAPA демонстрирует быструю диссоциацию при нейтральном pH с по существу идентичной кинетикой диссоциации по сравнению с mAb1 IgG1. Эти результаты позволяют предположить, что mAb1 IgG1 DANAPA сохраняет IgG1-подобное связывание с FcRn, несмотря на устраненное связывание с FcγR.
ПРИМЕР 9. MAB1 IGG1 DANAPA ДЕМОНСТРИРУЕТ IGG1-ПОДОБНЫЙ ФАРМАКОКИНЕТИЧЕСКИЙ ПРОФИЛЬ
Хорошие фармакокинетические свойства, т. е. длительный период полувыведения из кровотока, являются одним из ключевых критериев, которым должен соответствовать фармацевтический продукт на основе антитела. Конструирование последовательностей Fc антител может оказывать неожиданные эффекты в отношении фармакокинетического профиля. Например, антитела с последовательностью Fc, содержащей пять мутаций для снижения связывания с Fc-рецептором ("LFLEDANQPS" [следует отметить: последняя мутация по типу замены P на S находится в положении 331 в соответствии с нумерацией по Kabat, т.е. в отличающемся положении по сравнению с мутантными вариантами в настоящем изобретении]), характеризуются в 3-5 раз увеличенным клиренсом по сравнению с IgG1 дикого типа, что приводит к более короткому конечному периоду полувыведения, чем у соответствующего IgG1 дикого типа (WO 2014108483).
Фармакокинетический профиль mAb1 IgG1 DANAPA у мышей C57BL/6 (Charles River) исследовали и сравнивали с mAb1 IgG1. Пятерым мышам C57BL/6 инъецировали i.v. 10 мг/кг mAb1 IgG1 DANAPA или mAb1 IgG1. Через 10 мин., 6, 24, 48, 96, 120, 144, 168, 192 и 216 часов кровь собирали в капиллярные пробирки Microvette, покрытые EDTA (Sarstedt), центрифугировали в течение 10 мин. при 9300 g, и уровни mAb1 IgG1 DANAPA и mAb1 IgG1 в сыворотке крови определяли с помощью специфичного сэндвич-ELISA для Fc. Прозрачные титрационные микропланшеты MaxiSorp (Nunc) покрывали захватывающим антителом, специфичным к Fc IgG1 человека (I2134, Sigma), в 440-кратном разведении. После блокирования с помощью 2% BSA (Sigma) в PBS наносили 40 мкл PBS и 10 мкл плазмы крови в соответствующем разведении. После инкубирования в течение 1 ч. лунки промывали с помощью PBS, и связавшиеся mAb1 IgG1 DANAPA или mAb1 IgG1 выявляли с помощью детекторного антитела, специфичного к Fc IgG1 человека, конъюгированного с HRP (A0170, Sigma), в 10000-кратном разведении. Реакцию в анализе проявляли с помощью флуорогенного субстрата QuantaRed (Pierce), и интенсивность флуоресценции измеряли через 2-4 мин. при 544 нм (возбуждение) и 590 нм (испускание). Уровни mAb1 IgG1 DANAPA и mAb1 IgG1 в плазме крови определяли с помощью калибровочной кривой для соответствующих антител. Воздействие антител в плазме крови представлено на графике в полулогарифмическом масштабе на протяжении периода 216 часов.
Фармакокинетические профили mAb1 IgG1 DANAPA и mAb1 IgG1 показаны на фиг. 9. Важным и непредсказуемым до создания настоящего изобретения является то, что mAb1 IgG1 DANAPA обладает фармакокинетическими свойствами, которые являются по существу идентичными таковым свойствам mAb1 IgG1.
ПРИМЕР 10. БИСПЕЦИФИЧЕСКИЕ FYNOMAB, СПЕЦИФИЧНЫЕ К CD33 X CD3, С FC IGG1 DANAPA ДЕМОНСТРИРУЮТ СНИЖЕННОЕ СВЯЗЫВАНИЕ С FCγR
При взаимодействии с клетками, экспрессирующими Fc-рецепторы, биспецифические молекулы, содержащие Fc, привлекающие T-клетки, которые имеют первый связывающий участок, специфичный в отношении опухолевого антигена, и второй связывающий участок, специфичный в отношении T-клеток, могут индуцировать опухоленезависимые активацию T-клеток и высвобождение цитокинов (неопухолевый эффект) (см. WO 2012143524). Для уменьшения этого риска такие молекулы могут быть снабжены сконструированными последовательностями Fc, которые характеризуются минимальной истинной аффинностью к FcγR.
Биспецифические FynomAb, специфичные к CD3/CD33, получали путем слияния CD33-специфичного финомера G1 (SEQ ID NO: 36) или CD33-специфичного финомера D5 (SEQ ID NO: 38) с C-концом легкой цепи гуманизированного CD3-специфичного антитела mAb2 (тяжелая цепь под SEQ ID NO: 14; легкая цепь под SEQ ID NO: 16) с помощью гибкого линкера (G4S)3 (SEQ ID NO: 40). Связывание этих FynomAb с FcγR определяли в конкурентном анализе AlphaScreen™, как описано в примере 4.
Связывание FynomAb, специфичных к CD3/CD33, с FcγR сравнивали со связыванием COVA467 (тяжелая цепь под SEQ ID NO: 26; легкая цепь под SEQ ID NO: 28), ранее описанным FynomAb, специфичным к CD3/CD33, с Fc IgG1 LALA (т. е. Fc IgG1, имеющим мутации L234A и L235A), которое получали путем слияния CD33-специфичного финомера B3 с C-концом легкой цепи CD3-специфичного антитела mAb3 (см. WO 2014170063). IgG1 B21M служил в качестве положительного контроля (см. пример 4).
Результаты показаны на фиг. 10. При том, что COVA467 демонстрировало остаточное связывание с FcγRIIIA и FcγRI человека (IC50=390 нМ и 29 нМ соответственно), два FynomAb с Fc IgG1 DANAPA не демонстрировали какое-либо связывание с FcγRIIIA и характеризовались сильно сниженным связыванием с FcγRI по сравнению с COVA467 (IC50=206 нМ или 800 нМ соответственно). Для данных конструкций не было обнаружено значительное связывание с FcγRII A и B.
Эти результаты демонстрируют, что биспецифические FynomAb, специфичные к CD3/CD33, с Fc IgG1 DANAPA демонстрируют сниженное связывание с FcγR по сравнению с COVA467. Следовательно, они обладают сниженным потенциалом индуцирования нежелательных неопухолевых активации T-клеток и высвобождения цитокинов и представляют собой улучшенные мутантные варианты биспецифических FynomAb, специфичных к CD3/CD33.
Таблица 5. Последовательности
(ДНК)
(белок)
(ДНК)
(ДНК)
(белок)
(ДНК)
(белок)
(ДНК)
(белок)
(ДНК)
(белок)
(ДНК)
(ДНК)
(белок)
(ДНК)
(ДНК)
(белок)
(ДНК)
(белок)
(ДНК)
(белок)
(белок)
(белок)
(белок)
(белок)
(белок)
(белок)
(белок)
(белок)
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BRACK, SIMON
ATTINGER-TOLLER, ISABELLA
BULLER, FABIAN
GRABULOVSKI, DRAGAN
BERTSCHINGER, JULIAN
ZUMSTEG, ADRIAN
<120> МУТАНТНЫЕ ВАРИАНТЫ FC IgG1, ЛИШЕННЫЕ ЭФФЕКТОРНЫХ ФУНКЦИЙ
<130> COV5009WOPCT1
<140>
<141>
<160> 61
<170> PatentIn версия 3.5
<210> 1
<211> 1356
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 1
caggtccagc tgcagcagag tggggccgaa ctggcaagac ccggagcaag cgtcaaaatg 60
tcatgtaaag caagcggtta tactttcact aggagcacca tgcactgggt gaaacagagg 120
cccggccagg gactggagtg gatcgggtac attaaccctt ccagcgctta caccaactat 180
aatcagaagt tcaaagacaa ggccaccctg acagctgata agtctagttc aacagcatat 240
atgcagctgt ccagcctgac ttctgaagac agtgcagtgt actattgcgc ctccccacag 300
gtccactacg attacaatgg ttttccttac tgggggcagg gcacactggt gactgtctcc 360
gccgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccccccaaa ccaaaggata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggatgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
aattcaacct acagagttgt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctgcctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcccggg aaatga 1356
<210> 2
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 2
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Ser
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Ala Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Gln Val His Tyr Asp Tyr Asn Gly Phe Pro Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 3
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 3
caggtggtgc tgacccagag ccctgctatt atgtccgcat tccccggtga aaaagtgact 60
atgacttgtt ccgcttcttc ctccgtctcc tacatgaact ggtatcagca gaagtcagga 120
acatctccca aaaggtggat ctacgactcc agcaagctgg catccggcgt gcctgcacga 180
ttctcaggct ccggaagcgg gacctcttat agtctgacaa tttctagtat ggagactgaa 240
gatgccgcta cctactattg ccagcagtgg tcaagaaacc ctccaacatt cggggggggg 300
actaaactgc agattactcg tacggtcgcg gcgccttctg tgttcatttt ccccccatct 360
gatgaacagc tgaaatctgg cactgcttct gtggtctgtc tgctgaacaa cttctaccct 420
agagaggcca aagtccagtg gaaagtggac aatgctctgc agagtgggaa ttcccaggaa 480
tctgtcactg agcaggactc taaggatagc acatactccc tgtcctctac tctgacactg 540
agcaaggctg attacgagaa acacaaagtg tacgcctgtg aagtcacaca tcaggggctg 600
tctagtcctg tgaccaaatc cttcaatagg ggagagtgct ga 642
<210> 4
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 4
Gln Val Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Phe Pro Gly
1. 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Ser Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Thr Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Arg Asn Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Gln Ile Thr Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 5
<211> 1353
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 5
caggtgcagc tccagcagag tggcgcagag ctggtgaagc ccggagcctc agtcaagatg 60
tcctgcaagg ccttcggcta cacttttacc acatatccta tcgagtggat gaagcagaac 120
cacgggaaaa gcctggaatg gattggtaac ttccatccat acaatgacga taccaagtat 180
aatgagaagt ttaaaggcaa ggcaaaactg acagtggaga aatccagcac taccgtctac 240
ctggaactgt ccaggctgac atctgacgat agtgccgtgt actattgtgc tcgggaaaac 300
tacggaagcc acggcggatt cgtctattgg gggcagggta cactggtgac tgtctctgcc 360
gctagcacaa agggccctag tgtgtttcct ctggctccct cttccaaatc cacttctggt 420
ggcactgctg ctctgggatg cctggtgaag gattactttc ctgaacctgt gactgtctca 480
tggaactctg gtgctctgac ttctggtgtc cacactttcc ctgctgtgct gcagtctagt 540
ggactgtact ctctgtcatc tgtggtcact gtgccctctt catctctggg aacccagacc 600
tacatttgta atgtgaacca caaaccatcc aacactaaag tggacaaaaa agtggaaccc 660
aaatcctgtg acaaaaccca cacctgccca ccttgtcctg cccctgaact gctgggagga 720
ccttctgtgt ttctgttccc ccccaaacca aaggataccc tgatgatctc tagaacccct 780
gaggtgacat gtgtggtggt ggctgtgtct catgaggacc ctgaggtcaa attcaactgg 840
tacgtggatg gagtggaagt ccacaatgcc aaaaccaagc ctagagagga acagtacgct 900
tcaacctaca gagttgtcag tgtgctgact gtgctgcatc aggattggct gaatggcaag 960
gaatacaagt gtaaagtctc aaacaaggcc ctggctgctc caattgagaa aacaatctca 1020
aaggccaagg gacagcctag ggaaccccag gtctacaccc tgccaccttc aagagaggaa 1080
atgaccaaaa accaggtgtc cctgacatgc ctggtcaaag gcttctaccc ttctgacatt 1140
gctgtggagt gggagtcaaa tggacagcct gagaacaact acaaaacaac cccccctgtg 1200
ctggattctg atggctcttt ctttctgtac tccaaactga ctgtggacaa gtctagatgg 1260
cagcagggga atgtcttttc ttgctctgtc atgcatgagg ctctgcataa ccactacact 1320
cagaaatccc tgtctctgtc tcccgggaaa tga 1353
<210> 6
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 6
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Phe Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Pro Ile Glu Trp Met Lys Gln Asn His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asn Phe His Pro Tyr Asn Asp Asp Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Lys Leu Thr Val Glu Lys Ser Ser Thr Thr Val Tyr
65 70 75 80
Leu Glu Leu Ser Arg Leu Thr Ser Asp Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asn Tyr Gly Ser His Gly Gly Phe Val Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Ala Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 7
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 7
gagaacgtgc tgacccagtc ccccgcaatc atgtctgcca gtcctggaga aaaggtcacc 60
atgacatgca gggcatccag ctctgtcatc agttcatacc tgcactggta tcagcagaag 120
agcggagctt ctccaaaact gtggatctac tcaacctcca acctggcaag cggggtgccc 180
gaccggttca gcggctctgg aagtgggact tcatatagtc tgaccatctc gtcggtcgag 240
gccgaagatg ccgctacata ctattgtcag cagtacaatg gctatcccct gacatttggt 300
gctggtacca aactcgagat taagcgtacg gtcgcggcgc cttctgtgtt cattttcccc 360
ccatctgatg aacagctgaa atctggcact gcttctgtgg tctgtctgct gaacaacttc 420
taccctagag aggccaaagt ccagtggaaa gtggacaatg ctctgcagag tgggaattcc 480
caggaatctg tcactgagca ggactctaag gatagcacat actccctgtc ctctactctg 540
acactgagca aggctgatta cgagaaacac aaagtgtacg cctgtgaagt cacacatcag 600
gggctgtcta gtcctgtgac caaatccttc aataggggag agtgctga 648
<210> 8
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 8
Glu Asn Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1. 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ile Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Ser Gly Ala Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Val Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Gly Tyr Pro
85 90 95
Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 9
<211> 1353
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 9
gaggttcagc tggtggagtc tggcggtggc ctggtgcagc cagggggctc actccgtttg 60
tcctgtgcag cttctggctt caacattaaa gacacctata tacactgggt gcgtcaggcc 120
ccgggtaagg gcctggaatg ggttgcaagg atttatccta cgaatggtta tactagatat 180
gccgatagcg tcaagggccg tttcactata agcgcagaca catccaaaaa cacagcctac 240
ctgcagatga acagcctgcg tgctgaggac actgccgtct attattgttc tagatgggga 300
ggggacggct tctatgctat ggactactgg ggtcaaggaa ccctggtcac cgtctcctcg 360
gctagcacaa agggccctag tgtgtttcct ctggctccct cttccaaatc cacttctggt 420
ggcactgctg ctctgggatg cctggtgaag gattactttc ctgaacctgt gactgtctca 480
tggaactctg gtgctctgac ttctggtgtc cacactttcc ctgctgtgct gcagtctagt 540
ggactgtact ctctgtcatc tgtggtcact gtgccctctt catctctggg aacccagacc 600
tacatttgta atgtgaacca caaaccatcc aacactaaag tggacaaaaa agtggaaccc 660
aaatcctgtg acaaaaccca cacctgccca ccttgtcctg cccctgaact gctgggagga 720
ccttctgtgt ttctgttccc ccccaaacca aaggataccc tgatgatctc tagaacccct 780
gaggtgacat gtgtggtggt ggctgtgtct catgaggacc ctgaggtcaa attcaactgg 840
tacgtggatg gagtggaagt ccacaatgcc aaaaccaagc ctagagagga acagtacgct 900
tcaacctaca gagttgtcag tgtgctgact gtgctgcatc aggattggct gaatggcaag 960
gaatacaagt gtaaagtctc aaacaaggcc ctggctgctc caattgagaa aacaatctca 1020
aaggccaagg gacagcctag ggaaccccag gtctacaccc tgccaccttc aagagaggaa 1080
atgaccaaaa accaggtgtc cctgacatgc ctggtcaaag gcttctaccc ttctgacatt 1140
gctgtggagt gggagtcaaa tggacagcct gagaacaact acaaaacaac cccccctgtg 1200
ctggattctg atggctcttt ctttctgtac tccaaactga ctgtggacaa gtctagatgg 1260
cagcagggga atgtcttttc ttgctctgtc atgcatgagg ctctgcataa ccactacact 1320
cagaaatccc tgtctctgtc tcccgggaaa tga 1353
<210> 10
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Ala Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 11
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 11
gatatccaga tgacccagtc cccgagctcc ctgtccgcct ctgtgggcga tagggtcacc 60
atcacctgcc gtgccagtca ggatgtgaat actgctgtag cctggtatca acagaaacca 120
ggaaaagctc cgaaactact gatttactcg gcatccttcc tctactctgg agtcccttct 180
cgcttctctg ggtccagatc tgggacggat ttcactctga ccatcagcag tctgcagccg 240
gaagacttcg caacttatta ctgtcagcaa cattatacta ctcctcccac gttcggacag 300
gggaccaagg tggagatcaa acgtacggtc gcggcgcctt ctgtgttcat tttcccccca 360
tctgatgaac agctgaaatc tggcactgct tctgtggtct gtctgctgaa caacttctac 420
cctagagagg ccaaagtcca gtggaaagtg gacaatgctc tgcagagtgg gaattcccag 480
gaatctgtca ctgagcagga ctctaaggat agcacatact ccctgtcctc tactctgaca 540
ctgagcaagg ctgattacga gaaacacaaa gtgtacgcct gtgaagtcac acatcagggg 600
ctgtctagtc ctgtgaccaa atccttcaat aggggagagt gctga 645
<210> 12
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 13
<211> 1368
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 13
gaggtgcagc tggtcgagtc tggaggagga ttggtgcagc ctggagggtc attgaaactc 60
tcatgtgcag cctctggatt caccttcaat acctacgcca tgaactgggt ccgccaggct 120
ccaggaaagg gtttggaatg ggttgctcgc ataagaagta aatataataa ttatgcaaca 180
tattatgccg attcagtgaa agacaggttc accatctcca gagatgattc aaaaaacact 240
gcctatctac aaatgaacag cttgaaaact gaggacactg ccgtgtacta ctgtgtgaga 300
catgggaact tcggtgatag ctacgtttcc tggtttgctt actggggcca agggactctg 360
gtcaccgtct cgagcgctag cacaaagggc cctagtgtgt ttcctctggc tccctcttcc 420
aaatccactt ctggtggcac tgctgctctg ggatgcctgg tgaaggatta ctttcctgaa 480
cctgtgactg tctcatggaa ctctggtgct ctgacttctg gtgtccacac tttccctgct 540
gtgctgcagt ctagtggact gtactctctg tcatctgtgg tcactgtgcc ctcttcatct 600
ctgggaaccc agacctacat ttgtaatgtg aaccacaaac catccaacac taaagtggac 660
aaaaaagtgg aacccaaatc ctgtgacaaa acccacacct gcccaccttg tcctgcccct 720
gaactgctgg gaggaccttc tgtgtttctg ttccccccca aaccaaagga taccctgatg 780
atctctagaa cccctgaggt gacatgtgtg gtggtggctg tgtctcatga ggaccctgag 840
gtcaaattca actggtacgt ggatggagtg gaagtccaca atgccaaaac caagcctaga 900
gaggaacagt acgcttcaac ctacagagtt gtcagtgtgc tgactgtgct gcatcaggat 960
tggctgaatg gcaaggaata caagtgtaaa gtctcaaaca aggccctggc tgctccaatt 1020
gagaaaacaa tctcaaaggc caagggacag cctagggaac cccaggtcta caccctgcca 1080
ccttcaagag aggaaatgac caaaaaccag gtgtccctga catgcctggt caaaggcttc 1140
tacccttctg acattgctgt ggagtgggag tcaaatggac agcctgagaa caactacaaa 1200
acaacccccc ctgtgctgga ttctgatggc tctttctttc tgtactccaa actgactgtg 1260
gacaagtcta gatggcagca ggggaatgtc ttttcttgct ctgtcatgca tgaggctctg 1320
cataaccact acactcagaa atccctgtct ctgtctcccg ggaaatga 1368
<210> 14
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asp Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Ala Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 15
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 15
cagaccgttg tgactcagga accttcactc accgtatcac ctggtggaac agtcacactc 60
acttgtcgct cgtcgactgg ggctgttaca actagcaact atgccaactg ggtccaacaa 120
aaaccgggtc aggcaccccg tggtctaata ggtggtacca acaagcgcgc accaggtact 180
cctgccagat tctcaggctc cctgcttgga ggcaaggctg ccctcaccct ctcgggggta 240
cagccagagg atgaggcaga atattactgt gctctatggt acagcaacct ctgggtgttc 300
ggtggaggaa ccaaactgac tgtcctaggc cagcctaaag cggcgccatc cgtcaccctg 360
ttccctccct catccgagga actgcaggcc aataaggcta cactggtctg tctgattagc 420
gacttctacc ctggggccgt gactgtggct tggaaagccg attcttctcc cgtgaaagct 480
ggagtggaaa caaccacccc ctctaaacag agcaacaaca aatacgctgc ctcttcatac 540
ctgtccctga cccctgaaca gtggaaatct caccggtctt actcatgcca ggtgacacac 600
gagggatcaa ctgtggagaa aaccgtggct cctaccgaat gttcatga 648
<210> 16
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 16
Gln Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1. 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Thr Glu Cys Ser
210 215
<210> 17
<211> 1356
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 17
caggtccagc tgcagcagag tggggccgaa ctggcaagac ccggagcaag cgtcaaaatg 60
tcatgtaaag caagcggtta tactttcact aggagcacca tgcactgggt gaaacagagg 120
cccggccagg gactggagtg gatcgggtac attaaccctt ccagcgctta caccaactat 180
aatcagaagt tcaaagacaa ggccaccctg acagctgata agtctagttc aacagcatat 240
atgcagctgt ccagcctgac ttctgaagac agtgcagtgt actattgcgc ctccccacag 300
gtccactacg attacaatgg ttttccttac tgggggcagg gcacactggt gactgtctcc 360
gccgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccccccaaa ccaaaggata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtgaatgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
gattcaacct acagagttgt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctgggtg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcccggg aaatga 1356
<210> 18
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 18
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Ser
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Ala Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Gln Val His Tyr Asp Tyr Asn Gly Phe Pro Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asn Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asp Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Gly Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 19
<211> 1356
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 19
caggtccagc tgcagcagag tggggccgaa ctggcaagac ccggagcaag cgtcaaaatg 60
tcatgtaaag caagcggtta tactttcact aggagcacca tgcactgggt gaaacagagg 120
cccggccagg gactggagtg gatcgggtac attaaccctt ccagcgctta caccaactat 180
aatcagaagt tcaaagacaa ggccaccctg acagctgata agtctagttc aacagcatat 240
atgcagctgt ccagcctgac ttctgaagac agtgcagtgt actattgcgc ctccccacag 300
gtccactacg attacaatgg ttttccttac tgggggcagg gcacactggt gactgtctcc 360
gccgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccccccaaa ccaaaggata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggaggtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
caatcaacct acagagttgt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctgtctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcccggg aaatga 1356
<210> 20
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 20
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Ser
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Ala Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Gln Val His Tyr Asp Tyr Asn Gly Phe Pro Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Glu Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Gln Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Ser Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 21
<211> 885
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 21
cagaccgttg tgactcagga accttcactc accgtatcac ctggtggaac agtcacactc 60
acttgtcgct cgtcgactgg ggctgttaca actagcaact atgccaactg ggtccaacaa 120
aaaccgggtc aggcaccccg tggtctaata ggtggtacca acaagcgcgc accaggtact 180
cctgccagat tctcaggctc cctgcttgga ggcaaggctg ccctcaccct ctcgggggta 240
cagccagagg atgaggcaga atattactgt gctctatggt acagcaacct ctgggtgttc 300
ggtggaggaa ccaaactgac tgtcctaggc cagcctaaag cggcgccatc cgtcaccctg 360
ttccctccct catccgagga actgcaggcc aataaggcta cactggtctg tctgattagc 420
gacttctacc ctggggccgt gactgtggct tggaaagccg attcttctcc cgtgaaagct 480
ggagtggaaa caaccacccc ctctaaacag agcaacaaca aatacgctgc ctcttcatac 540
ctgtccctga cccctgaaca gtggaaatct caccggtctt actcatgcca ggtgacacac 600
gagggatcaa ctgtggagaa aaccgtggct cctaccgaat gttcaggcgg tggaggatcc 660
gggggtgggg gaagcggcgg aggaggtagc ggcgtgactc tgttcgtcgc tctgtacgac 720
tatgaggccc tgggggctca cgaactgtcc ttccataagg gcgagaaatt tcagatcctg 780
tcccccagga gcgagggacc tttttgggaa gcacactctc tgaccacagg cgaaaccgga 840
tggattccct ctaactacgt ggcccccgtc gatagtattc agtga 885
<210> 22
<211> 294
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 22
Gln Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1. 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Thr Glu Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Gly Val Thr Leu Phe Val Ala Leu Tyr Asp
225 230 235 240
Tyr Glu Ala Leu Gly Ala His Glu Leu Ser Phe His Lys Gly Glu Lys
245 250 255
Phe Gln Ile Leu Ser Pro Arg Ser Glu Gly Pro Phe Trp Glu Ala His
260 265 270
Ser Leu Thr Thr Gly Glu Thr Gly Trp Ile Pro Ser Asn Tyr Val Ala
275 280 285
Pro Val Asp Ser Ile Gln
290
<210> 23
<211> 885
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 23
cagaccgttg tgactcagga accttcactc accgtatcac ctggtggaac agtcacactc 60
acttgtcgct cgtcgactgg ggctgttaca actagcaact atgccaactg ggtccaacaa 120
aaaccgggtc aggcaccccg tggtctaata ggtggtacca acaagcgcgc accaggtact 180
cctgccagat tctcaggctc cctgcttgga ggcaaggctg ccctcaccct ctcgggggta 240
cagccagagg atgaggcaga atattactgt gctctatggt acagcaacct ctgggtgttc 300
ggtggaggaa ccaaactgac tgtcctaggc cagcctaaag cggcgccatc cgtcaccctg 360
ttccctccct catccgagga actgcaggcc aataaggcta cactggtctg tctgattagc 420
gacttctacc ctggggccgt gactgtggct tggaaagccg attcttctcc cgtgaaagct 480
ggagtggaaa caaccacccc ctctaaacag agcaacaaca aatacgctgc ctcttcatac 540
ctgtccctga cccctgaaca gtggaaatct caccggtctt actcatgcca ggtgacacac 600
gagggatcaa ctgtggagaa aaccgtggct cctaccgaat gttcaggcgg tggaggatcc 660
gggggtgggg gaagcggcgg aggaggtagc ggcgtgactc tgttcgtcgc tctgtacgac 720
tatgaggccc tgggggctca cgaactgtcc ttccataagg gcgagaaatt tcagatcctg 780
tccagcctgg cagtgggacc attttgggag gcccactctc tgaccacagg cgaaaccgga 840
tggattccct ctaactacgt ggcacctgtc gatagtattc agtga 885
<210> 24
<211> 294
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 24
Gln Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1. 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Thr Glu Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Gly Val Thr Leu Phe Val Ala Leu Tyr Asp
225 230 235 240
Tyr Glu Ala Leu Gly Ala His Glu Leu Ser Phe His Lys Gly Glu Lys
245 250 255
Phe Gln Ile Leu Ser Ser Leu Ala Val Gly Pro Phe Trp Glu Ala His
260 265 270
Ser Leu Thr Thr Gly Glu Thr Gly Trp Ile Pro Ser Asn Tyr Val Ala
275 280 285
Pro Val Asp Ser Ile Gln
290
<210> 25
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 25
caggtgcagc tggtgcagtc tggcggcgga gtggtgcagc ctggaagatc cctgcggctg 60
tcctgcaagg cctccggcta caccttcacc cggtacacca tgcactgggt gcgacaggcc 120
cctggcaagg gcctggaatg gatcggctac atcaacccct cccggggcta caccaactac 180
aaccagaaag tgaaggaccg gttcaccatc tcccgggaca actccaagaa caccgccttt 240
ctgcagatgg acagcctgcg gcctgaggat accggcgtgt acttctgcgc ccggtactac 300
gacgaccact actgcctgga ctactggggc cagggcaccc ctgtgacagt gtcctctgct 360
agcacaaagg gccctagtgt gtttcctctg gctccctctt ccaaatccac ttctggtggc 420
actgctgctc tgggatgcct ggtgaaggat tactttcctg aacctgtgac tgtctcatgg 480
aactctggtg ctctgacttc tggtgtccac actttccctg ctgtgctgca gtctagtgga 540
ctgtactctc tgtcatctgt ggtcactgtg ccctcttcat ctctgggaac ccagacctac 600
atttgtaatg tgaaccacaa accatccaac actaaagtgg acaaaaaagt ggaacccaaa 660
tcctgtgaca aaacccacac ctgcccacct tgtcctgccc ctgaagccgc cggaggacct 720
tctgtgtttc tgttcccccc caaaccaaag gataccctga tgatctctag aacccctgag 780
gtgacatgtg tggtggtgga tgtgtctcat gaggaccctg aggtcaaatt caactggtac 840
gtggatggag tggaagtcca caatgccaaa accaagccta gagaggaaca gtacaattca 900
acctacagag tggtcagtgt gctgactgtg ctgcatcagg attggctgaa tggcaaggaa 960
tacaagtgta aagtctcaaa caaggccctg cctgctccaa ttgagaaaac aatctcaaag 1020
gccaagggac agcctaggga accccaggtc tacaccctgc caccttcaag agaggaaatg 1080
accaaaaacc aggtgtccct gacatgcctg gtcaaaggct tctacccttc tgacattgct 1140
gtggagtggg agtcaaatgg acagcctgag aacaactaca aaacaacccc ccctgtgctg 1200
gattctgatg gctctttctt tctgtactcc aaactgactg tggacaagtc tagatggcag 1260
caggggaatg tcttttcttg ctctgtcatg catgaggctc tgcataacca ctacactcag 1320
aaatccctgt ctctgtctcc cgggaaatga 1350
<210> 26
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 26
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1. 5 10 15
Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Val
50 55 60
Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Ala Phe
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly Val Tyr Phe Cys
85 90 95
Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Pro Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 27
<211> 876
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 27
gacatccaga tgacccagtc cccctccagc ctgtctgcct ctgtgggcga cagagtgaca 60
attacctgct ccgcctcctc ctccgtgtcc tacatgaact ggtatcagca gacccccggc 120
aaggccccca agcggtggat ctacgacacc tccaagctgg cctctggcgt gccctccaga 180
ttctccggct ctggctctgg caccgactat accttcacca tcagctccct gcagcccgag 240
gatatcgcca cctactactg ccagcagtgg tcctccaacc ccttcacctt tggccagggc 300
accaagctgc agatcacccg tacggtcgcg gcgccttctg tgttcatttt ccccccatct 360
gatgaacagc tgaaatctgg cactgcttct gtggtctgtc tgctgaacaa cttctaccct 420
agagaggcca aagtccagtg gaaagtggac aatgctctgc agagtgggaa ttcccaggaa 480
tctgtcactg agcaggactc taaggatagc acatactccc tgtcctctac tctgacactg 540
agcaaggctg attacgagaa acacaaagtg tacgcctgtg aagtcacaca tcaggggctg 600
tctagtcctg tgaccaaatc cttcaatagg ggagagtgcg gcggtggagg atccgggggt 660
gggggaagcg gcggaggagg tagcggcgtg accctgtttg tggccctgta cgactacgag 720
gccctgggcg ctcacgagct gtctttccac aagggcgaga agttccagat cctgaactcc 780
tccgagggcc ccttctggga ggctcactct ctgacaaccg gcgagacagg ctggattccc 840
tccaactatg tggcccccgt ggactccatc cagtga 876
<210> 28
<211> 291
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 28
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Asn Trp Tyr Gln Gln Thr Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Gln Ile Thr Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
210 215 220
Gly Gly Gly Ser Gly Val Thr Leu Phe Val Ala Leu Tyr Asp Tyr Glu
225 230 235 240
Ala Leu Gly Ala His Glu Leu Ser Phe His Lys Gly Glu Lys Phe Gln
245 250 255
Ile Leu Asn Ser Ser Glu Gly Pro Phe Trp Glu Ala His Ser Leu Thr
260 265 270
Thr Gly Glu Thr Gly Trp Ile Pro Ser Asn Tyr Val Ala Pro Val Asp
275 280 285
Ser Ile Gln
290
<210> 29
<211> 1353
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 29
cagatcaccc tgaaggagtc cgggcccaca ctggtgaaac ctactcagac cctgacactg 60
acttgcacct tctccggttt ttctctgagt acctcgggca tgggagtgag ctggatcagg 120
cagccccctg gcaaggcact ggaatggctg gcccacatct actgggacga tgacaagagg 180
tacaaccctt cactgaaatc ccggctgaca attactaagg ataccagcaa aaaccaggtg 240
gtcctgacca tgacaaatat ggaccccgtg gacactgcta cctactattg tgcaagactg 300
tacggcttca cctatggatt tgcttactgg gggcagggca ccctggtcac agtctcgagc 360
gctagcacaa agggccctag tgtgtttcct ctggctccct cttccaaatc cacttctggt 420
ggcactgctg ctctgggatg cctggtgaag gattactttc ctgaacctgt gactgtctca 480
tggaactctg gtgctctgac ttctggtgtc cacactttcc ctgctgtgct gcagtctagt 540
ggactgtact ctctgtcatc tgtggtcact gtgccctctt catctctggg aacccagacc 600
tacatttgta atgtgaacca caaaccatcc aacactaaag tggacaaaaa agtggaaccc 660
aaatcctgtg acaaaaccca cacctgccca ccttgtcctg cccctgaact gctgggagga 720
ccttctgtgt ttctgttccc ccccaaacca aaggataccc tgatgatctc tagaacccct 780
gaggtgacat gtgtggtggt ggatgtgtct catgaggacc ctgaggtcaa attcaactgg 840
tacgtggatg gagtggaagt ccacaatgcc aaaaccaagc ctagagagga acagtacaat 900
tcaacctaca gagttgtcag tgtgctgact gtgctgcatc aggattggct gaatggcaag 960
gaatacaagt gtaaagtctc aaacaaggcc ctgcctgctc caattgagaa aacaatctca 1020
aaggccaagg gacagcctag ggaaccccag gtctacaccc tgccaccttc aagagaggaa 1080
atgaccaaaa accaggtgtc cctgacatgc ctggtcaaag gcttctaccc ttctgacatt 1140
gctgtggagt gggagtcaaa tggacagcct gagaacaact acaaaacaac cccccctgtg 1200
ctggattctg atggctcttt ctttctgtac tccaaactga ctgtggacaa gtctagatgg 1260
cagcagggga atgtcttttc ttgctctgtc atgcatgagg ctctgcataa ccactacact 1320
cagaaatccc tgtctctgtc tcccgggaaa tga 1353
<210> 30
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 30
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1. 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 31
<211> 657
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 31
gacatcgtga tgacacagag cccagattct ctggccgtca gcctgggcga aagggccact 60
atcaactgcc gggcctccca gtctgtggac tacaatggaa tttcttacat gcactggtat 120
cagcagaagc ctggccagcc ccctaaactg ctgatctatg ccgcttcaaa ccctgagtcc 180
ggcgtgccag accgattcag tggctcaggc tccgggaccg attttaccct gacaatttcc 240
agcctgcaag ctgaggacgt ggcagtctac tattgccagc agatcattga agatccctgg 300
acattcggtc agggcactaa ggtggagatc aaacgtacgg tcgcggcgcc ttctgtgttc 360
attttccccc catctgatga acagctgaaa tctggcactg cttctgtggt ctgtctgctg 420
aacaacttct accctagaga ggccaaagtc cagtggaaag tggacaatgc tctgcagagt 480
gggaattccc aggaatctgt cactgagcag gactctaagg atagcacata ctccctgtcc 540
tctactctga cactgagcaa ggctgattac gagaaacaca aagtgtacgc ctgtgaagtc 600
acacatcagg ggctgtctag tcctgtgacc aaatccttca ataggggaga gtgctga 657
<210> 32
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 32
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Gln Ser Val Asp Tyr Asn
20 25 30
Gly Ile Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Pro Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ile Ile
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 33
<211> 1353
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 33
cagatcaccc tgaaggagtc cgggcccaca ctggtgaaac ctactcagac cctgacactg 60
acttgcacct tctccggttt ttctctgagt acctcgggca tgggagtgag ctggatcagg 120
cagccccctg gcaaggcact ggaatggctg gcccacatct actgggacga tgacaagagg 180
tacaaccctt cactgaaatc ccggctgaca attactaagg ataccagcaa aaaccaggtg 240
gtcctgacca tgacaaatat ggaccccgtg gacactgcta cctactattg tgcaagactg 300
tacggcttca cctatggatt tgcttactgg gggcagggca ccctggtcac agtctcgagc 360
gctagcacaa agggccctag tgtgtttcct ctggctccct cttccaaatc cacttctggt 420
ggcactgctg ctctgggatg cctggtgaag gattactttc ctgaacctgt gactgtctca 480
tggaactctg gtgctctgac ttctggtgtc cacactttcc ctgctgtgct gcagtctagt 540
ggactgtact ctctgtcatc tgtggtcact gtgccctctt catctctggg aacccagacc 600
tacatttgta atgtgaacca caaaccatcc aacactaaag tggacaaaaa agtggaaccc 660
aaatcctgtg acaaaaccca cacctgccca ccttgtcctg cccctgaagc cgccggagga 720
ccttctgtgt ttctgttccc ccccaaacca aaggataccc tgatgatctc tagaacccct 780
gaggtgacat gtgtggtggt ggatgtgtct catgaggacc ctgaggtcaa attcaactgg 840
tacgtggatg gagtggaagt ccacaatgcc aaaaccaagc ctagagagga acagtacaat 900
tcaacctaca gagtggtcag tgtgctgact gtgctgcatc aggattggct gaatggcaag 960
gaatacaagt gtaaagtctc aaacaaggcc ctgcctgctc caattgagaa aacaatctca 1020
aaggccaagg gacagcctag ggaaccccag gtctacaccc tgccaccttc aagagaggaa 1080
atgaccaaaa accaggtgtc cctgacatgc ctggtcaaag gcttctaccc ttctgacatt 1140
gctgtggagt gggagtcaaa tggacagcct gagaacaact acaaaacaac cccccctgtg 1200
ctggattctg atggctcttt ctttctgtac tccaaactga ctgtggacaa gtctagatgg 1260
cagcagggga atgtcttttc ttgctctgtc atgcatgagg ctctgcataa ccactacact 1320
cagaaatccc tgtctctgtc tcccgggaaa tga 1353
<210> 34
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 34
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1. 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 35
<211> 195
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 35
ggcgtgactc tgttcgtcgc tctgtacgac tatgaggccc tgggggctca cgaactgtcc 60
ttccataagg gcgagaaatt tcagatcctg tcccccagga gcgagggacc tttttgggaa 120
gcacactctc tgaccacagg cgaaaccgga tggattccct ctaactacgt ggcccccgtc 180
gatagtattc agtga 195
<210> 36
<211> 64
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 36
Gly Val Thr Leu Phe Val Ala Leu Tyr Asp Tyr Glu Ala Leu Gly Ala
1. 5 10 15
His Glu Leu Ser Phe His Lys Gly Glu Lys Phe Gln Ile Leu Ser Pro
20 25 30
Arg Ser Glu Gly Pro Phe Trp Glu Ala His Ser Leu Thr Thr Gly Glu
35 40 45
Thr Gly Trp Ile Pro Ser Asn Tyr Val Ala Pro Val Asp Ser Ile Gln
50 55 60
<210> 37
<211> 195
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 37
ggcgtgactc tgttcgtcgc tctgtacgac tatgaggccc tgggggctca cgaactgtcc 60
ttccataagg gcgagaaatt tcagatcctg tccagcctgg cagtgggacc attttgggag 120
gcccactctc tgaccacagg cgaaaccgga tggattccct ctaactacgt ggcacctgtc 180
gatagtattc agtga 195
<210> 38
<211> 64
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 38
Gly Val Thr Leu Phe Val Ala Leu Tyr Asp Tyr Glu Ala Leu Gly Ala
1. 5 10 15
His Glu Leu Ser Phe His Lys Gly Glu Lys Phe Gln Ile Leu Ser Ser
20 25 30
Leu Ala Val Gly Pro Phe Trp Glu Ala His Ser Leu Thr Thr Gly Glu
35 40 45
Thr Gly Trp Ile Pro Ser Asn Tyr Val Ala Pro Val Asp Ser Ile Gln
50 55 60
<210> 39
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 39
ggcggtggag gatccggggg tgggggaagc ggcggaggag gtagc 45
<210> 40
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 40
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1. 5 10 15
<210> 41
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 41
atgaattttg gactgaggct gattttcctg gtgctgaccc tgaaaggcgt ccagtgt 57
<210> 42
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 42
Met Asn Phe Gly Leu Arg Leu Ile Phe Leu Val Leu Thr Leu Lys Gly
1. 5 10 15
Val Gln Cys
<210> 43
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 43
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
1. 5 10 15
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
20 25 30
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
35 40 45
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
50 55 60
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
65 70 75 80
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
85 90 95
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
100 105 110
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
115 120 125
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
130 135 140
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
145 150 155 160
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
165 170 175
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
180 185 190
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
195 200 205
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 44
<211> 1356
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 44
caggtccagc tgcagcagag tggggccgaa ctggcaagac ccggagcaag cgtcaaaatg 60
tcatgtaaag caagcggtta tactttcact aggagcacca tgcactgggt gaaacagagg 120
cccggccagg gactggagtg gatcgggtac attaaccctt ccagcgctta caccaactat 180
aatcagaagt tcaaagacaa ggccaccctg acagctgata agtctagttc aacagcatat 240
atgcagctgt ccagcctgac ttctgaagac agtgcagtgt actattgcgc ctccccacag 300
gtccactacg attacaatgg ttttccttac tgggggcagg gcacactggt gactgtctcc 360
gccgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccccccaaa ccaaaggata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggctgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
gcttcaacct acagagttgt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctggctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcccggg aaatga 1356
<210> 45
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 45
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Ser
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Ala Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Gln Val His Tyr Asp Tyr Asn Gly Phe Pro Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Ala Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 46
<211> 1356
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 46
caggtccagc tgcagcagag tggggccgaa ctggcaagac ccggagcaag cgtcaaaatg 60
tcatgtaaag caagcggtta tactttcact aggagcacca tgcactgggt gaaacagagg 120
cccggccagg gactggagtg gatcgggtac attaaccctt ccagcgctta caccaactat 180
aatcagaagt tcaaagacaa ggccaccctg acagctgata agtctagttc aacagcatat 240
atgcagctgt ccagcctgac ttctgaagac agtgcagtgt actattgcgc ctccccacag 300
gtccactacg attacaatgg ttttccttac tgggggcagg gcacactggt gactgtctcc 360
gccgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccccccaaa ccaaaggata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggctgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
aattcaacct acagagttgt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctggctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcccggg aaatga 1356
<210> 47
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 47
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Ser
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Ala Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Gln Val His Tyr Asp Tyr Asn Gly Phe Pro Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Ala Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Ala Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 48
<211> 1356
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 48
caggtccagc tgcagcagag tggggccgaa ctggcaagac ccggagcaag cgtcaaaatg 60
tcatgtaaag caagcggtta tactttcact aggagcacca tgcactgggt gaaacagagg 120
cccggccagg gactggagtg gatcgggtac attaaccctt ccagcgctta caccaactat 180
aatcagaagt tcaaagacaa ggccaccctg acagctgata agtctagttc aacagcatat 240
atgcagctgt ccagcctgac ttctgaagac agtgcagtgt actattgcgc ctccccacag 300
gtccactacg attacaatgg ttttccttac tgggggcagg gcacactggt gactgtctcc 360
gccgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga actgctggga 720
ggaccttctg tgtttctgtt cccccccaaa ccaaaggata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggatgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
gcttcaacct acagagttgt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctgcctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcccggg aaatga 1356
<210> 49
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 49
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Ser
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Ala Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Gln Val His Tyr Asp Tyr Asn Gly Phe Pro Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 50
<211> 1356
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 50
caggtccagc tgcagcagag tggggccgaa ctggcaagac ccggagcaag cgtcaaaatg 60
tcatgtaaag caagcggtta tactttcact aggagcacca tgcactgggt gaaacagagg 120
cccggccagg gactggagtg gatcgggtac attaaccctt ccagcgctta caccaactat 180
aatcagaagt tcaaagacaa ggccaccctg acagctgata agtctagttc aacagcatat 240
atgcagctgt ccagcctgac ttctgaagac agtgcagtgt actattgcgc ctccccacag 300
gtccactacg attacaatgg ttttccttac tgggggcagg gcacactggt gactgtctcc 360
gccgctagca caaagggccc tagtgtgttt cctctggctc cctcttccaa atccacttct 420
ggtggcactg ctgctctggg atgcctggtg aaggattact ttcctgaacc tgtgactgtc 480
tcatggaact ctggtgctct gacttctggt gtccacactt tccctgctgt gctgcagtct 540
agtggactgt actctctgtc atctgtggtc actgtgccct cttcatctct gggaacccag 600
acctacattt gtaatgtgaa ccacaaacca tccaacacta aagtggacaa aaaagtggaa 660
cccaaatcct gtgacaaaac ccacacctgc ccaccttgtc ctgcccctga agccgccgga 720
ggaccttctg tgtttctgtt cccccccaaa ccaaaggata ccctgatgat ctctagaacc 780
cctgaggtga catgtgtggt ggtggatgtg tctcatgagg accctgaggt caaattcaac 840
tggtacgtgg atggagtgga agtccacaat gccaaaacca agcctagaga ggaacagtac 900
aattcaacct acagagtggt cagtgtgctg actgtgctgc atcaggattg gctgaatggc 960
aaggaataca agtgtaaagt ctcaaacaag gccctgcctg ctccaattga gaaaacaatc 1020
tcaaaggcca agggacagcc tagggaaccc caggtctaca ccctgccacc ttcaagagag 1080
gaaatgacca aaaaccaggt gtccctgaca tgcctggtca aaggcttcta cccttctgac 1140
attgctgtgg agtgggagtc aaatggacag cctgagaaca actacaaaac aaccccccct 1200
gtgctggatt ctgatggctc tttctttctg tactccaaac tgactgtgga caagtctaga 1260
tggcagcagg ggaatgtctt ttcttgctct gtcatgcatg aggctctgca taaccactac 1320
actcagaaat ccctgtctct gtctcccggg aaatga 1356
<210> 51
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 51
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1. 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Ser
20 25 30
Thr Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Ala Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Gln Val His Tyr Asp Tyr Asn Gly Phe Pro Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 52
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 52
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
1. 5 10 15
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
20 25 30
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
35 40 45
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
50 55 60
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
65 70 75 80
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
85 90 95
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
100 105 110
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
115 120 125
Ser Arg Asp Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
130 135 140
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
145 150 155 160
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
165 170 175
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
180 185 190
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
195 200 205
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 53
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 53
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
1. 5 10 15
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
20 25 30
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
35 40 45
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
50 55 60
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
65 70 75 80
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
85 90 95
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
100 105 110
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
115 120 125
Ser Arg Glu Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
130 135 140
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
145 150 155 160
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
165 170 175
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
180 185 190
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
195 200 205
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 54
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 54
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
1. 5 10 15
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
20 25 30
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
35 40 45
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
50 55 60
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
65 70 75 80
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
85 90 95
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
100 105 110
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
115 120 125
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
130 135 140
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
145 150 155 160
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
165 170 175
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
180 185 190
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Gly Leu His
195 200 205
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 55
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 55
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
1. 5 10 15
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
20 25 30
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
35 40 45
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
50 55 60
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
65 70 75 80
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
85 90 95
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
100 105 110
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
115 120 125
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
130 135 140
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
145 150 155 160
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
165 170 175
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
180 185 190
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
195 200 205
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 56
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 56
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
1. 5 10 15
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
20 25 30
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
35 40 45
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
50 55 60
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
65 70 75 80
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
85 90 95
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
100 105 110
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
115 120 125
Ser Arg Asp Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
130 135 140
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
145 150 155 160
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
165 170 175
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
180 185 190
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Gly Leu His
195 200 205
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 57
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 57
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
1. 5 10 15
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
20 25 30
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
35 40 45
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
50 55 60
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
65 70 75 80
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
85 90 95
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
100 105 110
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
115 120 125
Ser Arg Glu Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
130 135 140
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
145 150 155 160
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
165 170 175
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
180 185 190
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Gly Leu His
195 200 205
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 58
<211> 222
<212> БЕЛОК
<213> Homo sapiens
<400> 58
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
1. 5 10 15
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
20 25 30
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
35 40 45
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
50 55 60
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
65 70 75 80
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
85 90 95
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
100 105 110
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
115 120 125
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
130 135 140
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
145 150 155 160
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
165 170 175
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
180 185 190
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Gly Leu His
195 200 205
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215 220
<210> 59
<211> 63
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 59
Gly Val Thr Leu Phe Val Ala Leu Tyr Asp Tyr Glu Ala Arg Thr Glu
1. 5 10 15
Asp Asp Leu Ser Phe His Lys Gly Glu Lys Phe Gln Ile Leu Asn Ser
20 25 30
Ser Glu Gly Asp Trp Trp Glu Ala Arg Ser Leu Thr Thr Gly Glu Thr
35 40 45
Gly Tyr Ile Pro Ser Asn Tyr Val Ala Pro Val Asp Ser Ile Gln
50 55 60
<210> 60
<211> 110
<212> БЕЛОК
<213> Человек
<400> 60
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1. 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
100 105 110
<210> 61
<211> 107
<212> БЕЛОК
<213> Человек
<400> 61
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
1. 5 10 15
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
65 70 75 80
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| АНТИТЕЛА ПРОТИВ BTN3A И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА ИЛИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2800726C2 |
| АНТИТЕЛА К CD38 И КОМБИНАЦИИ С АНТИТЕЛАМИ К CD3 И CD28 | 2018 |
|
RU2812910C2 |
| АНТИТЕЛА ПРОТИВ TFR И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПРОЛИФЕРАТИВНЫХ И ВОСПАЛИТЕЛЬНЫХ РАССТРОЙСТВ | 2016 |
|
RU2737637C2 |
| СОДЕРЖАЩИЙ ЛЕКАРСТВЕННОЕ СРЕДСТВО ПЕРЕНОСЧИК В КЛЕТКУ ДЛЯ ФОРМИРОВАНИЯ ИММУННОГО КОМПЛЕКСА | 2012 |
|
RU2739792C1 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, ИНДУЦИРУЮЩАЯ ИММУННЫЙ ОТВЕТ НА АНТИГЕН-МИШЕНЬ | 2012 |
|
RU2722829C2 |
| КОНЪЮГАТЫ АНТИТЕЛ С ЛЕКАРСТВЕННЫМИ ВЕЩЕСТВАМИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2799547C2 |
| ВАРИАНТЫ FcγRIIB-СПЕЦИФИЧЕСКОЙ Fc-ОБЛАСТИ | 2013 |
|
RU2729831C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА ДЛЯ УСКОРЕНИЯ ИСЧЕЗНОВЕНИЯ АНТИГЕНА ЧЕРЕЗ FcγRIIB | 2013 |
|
RU2812226C1 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА ДЛЯ УСКОРЕНИЯ ИСЧЕЗНОВЕНИЯ АНТИГЕНА ЧЕРЕЗ FcγRIIB | 2013 |
|
RU2736349C2 |
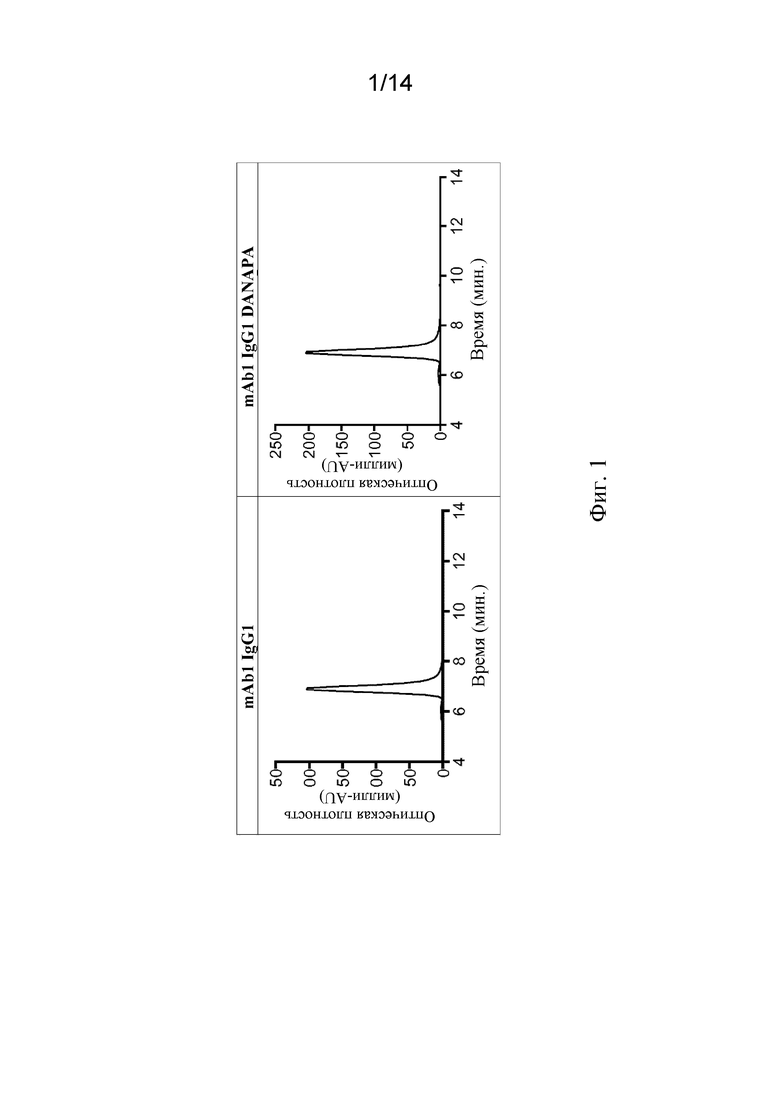
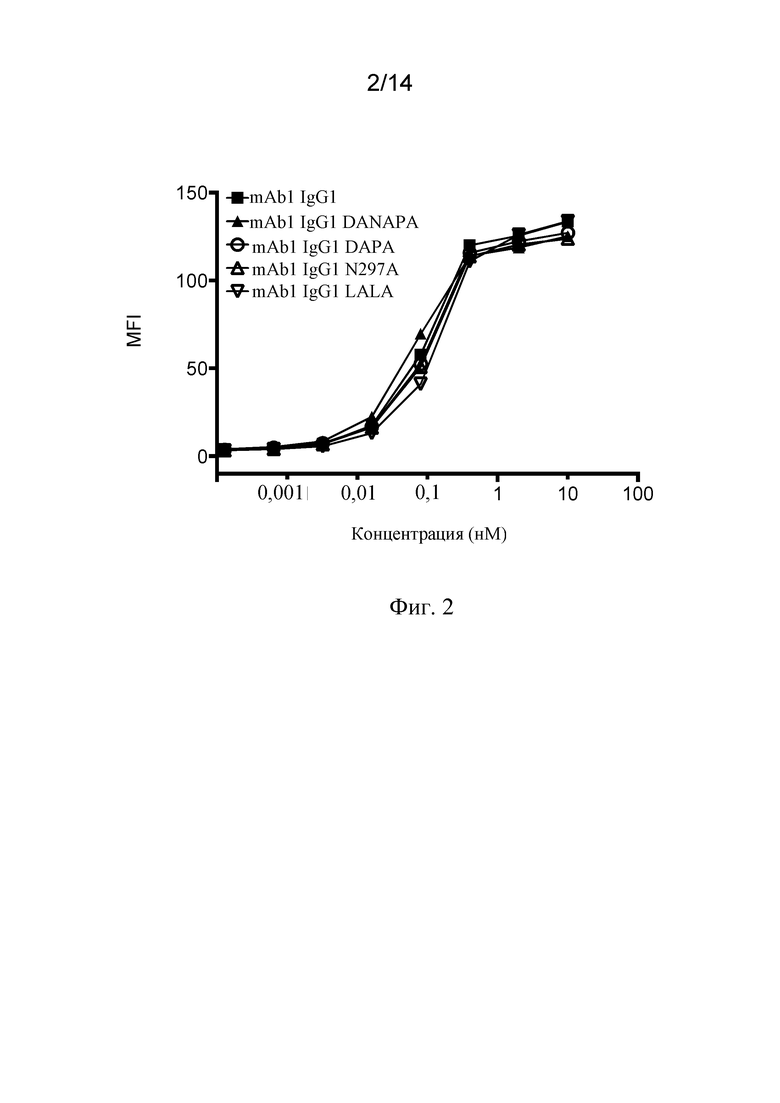
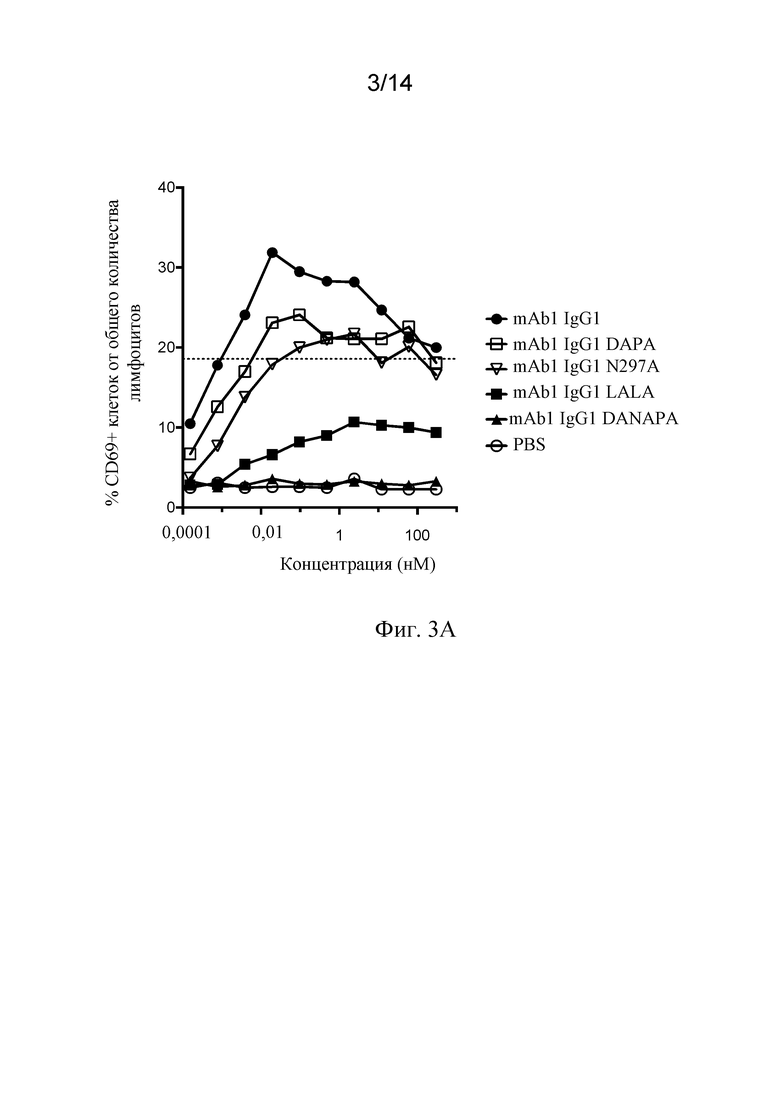
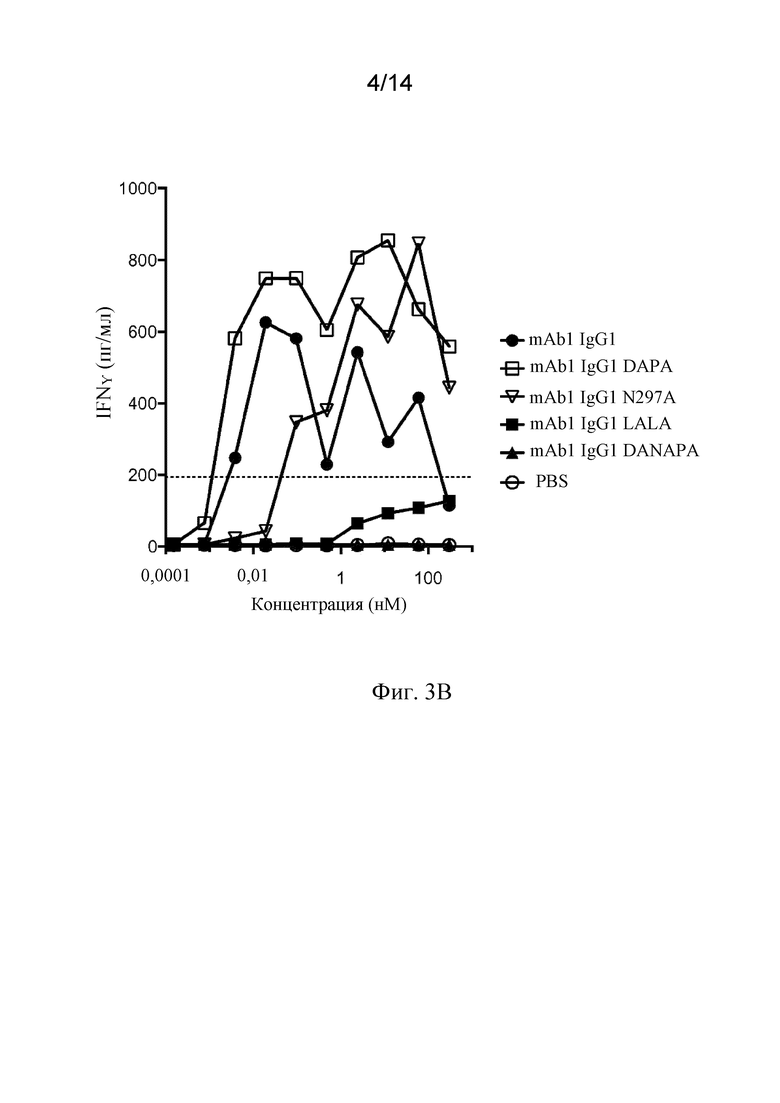
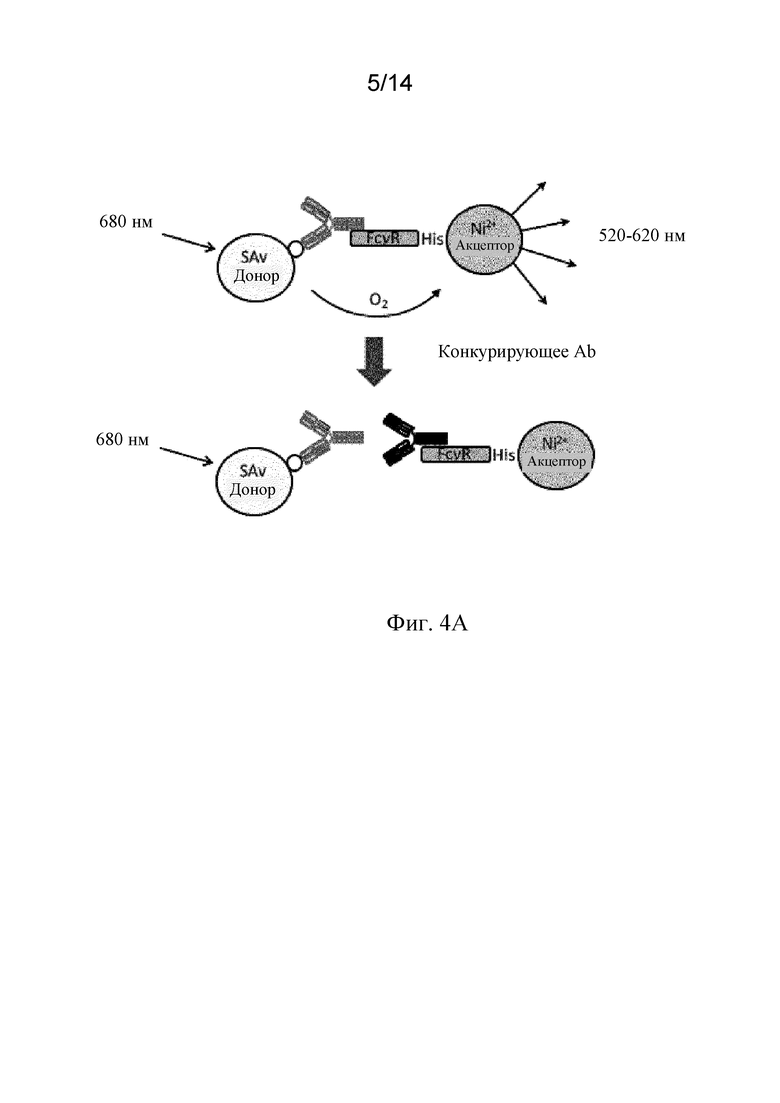
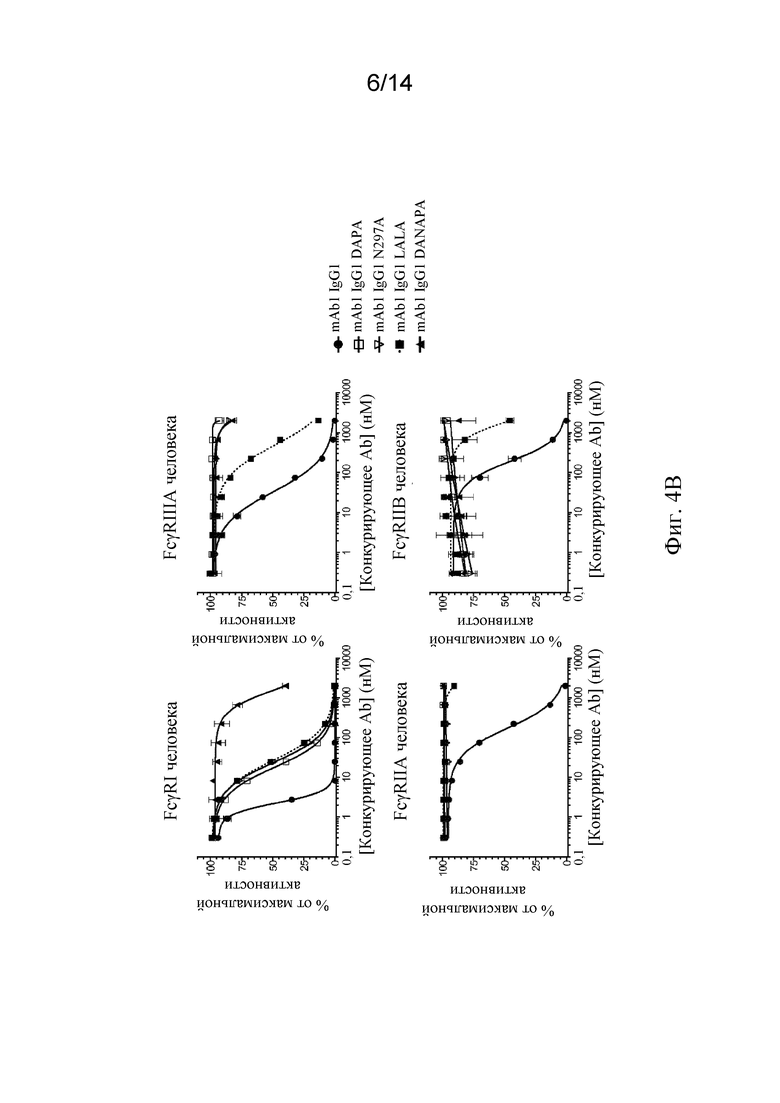

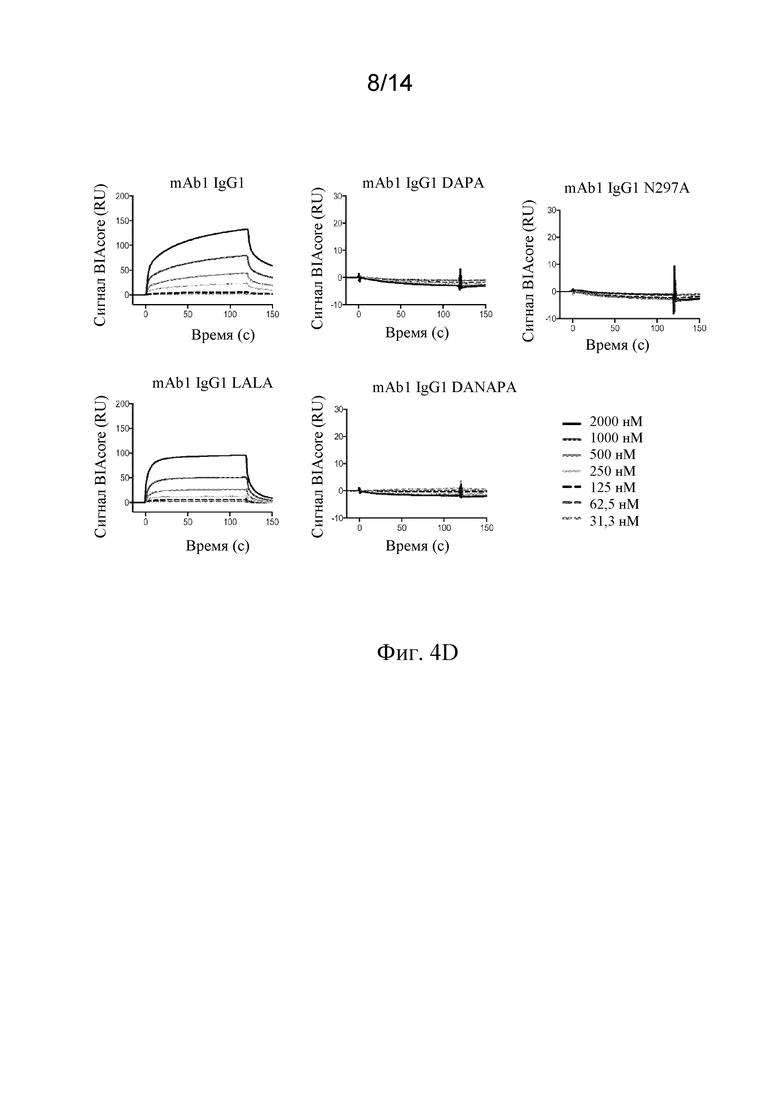
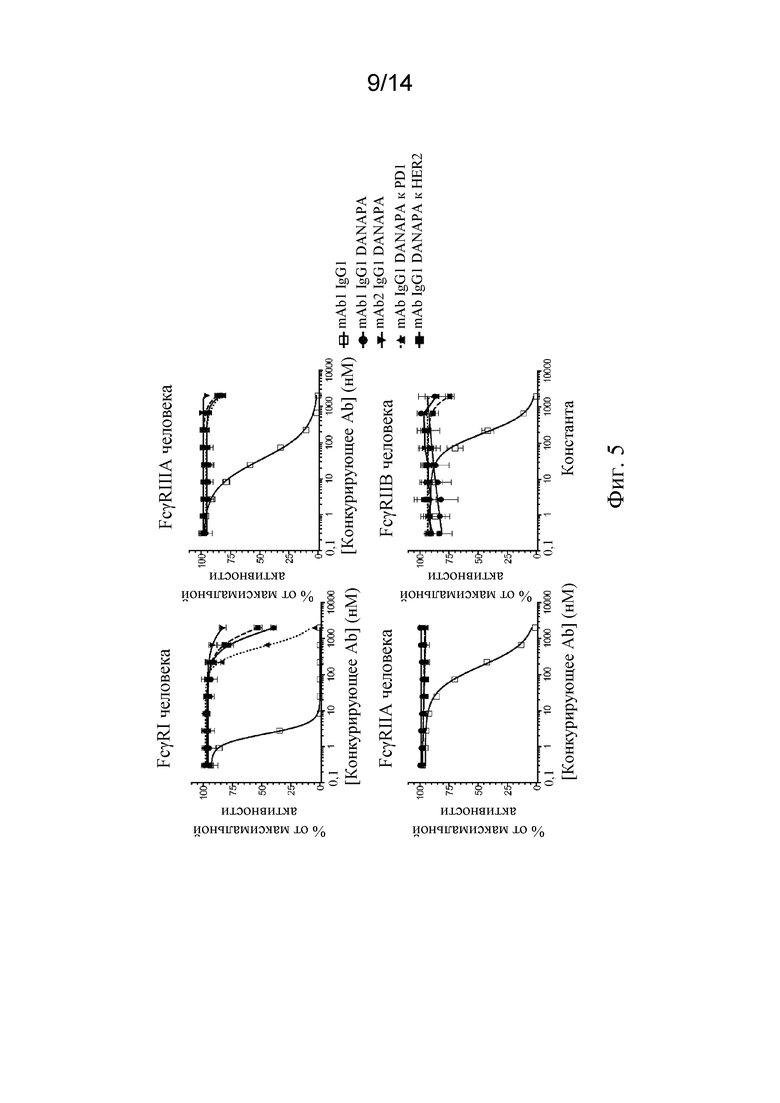
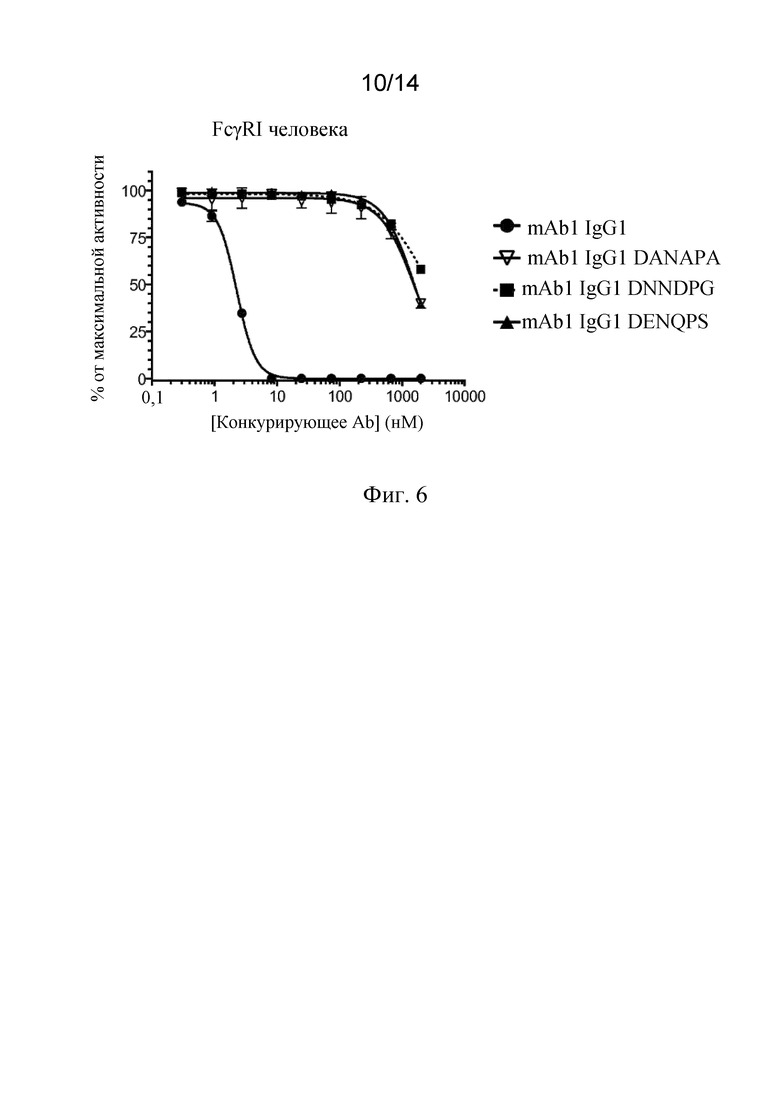
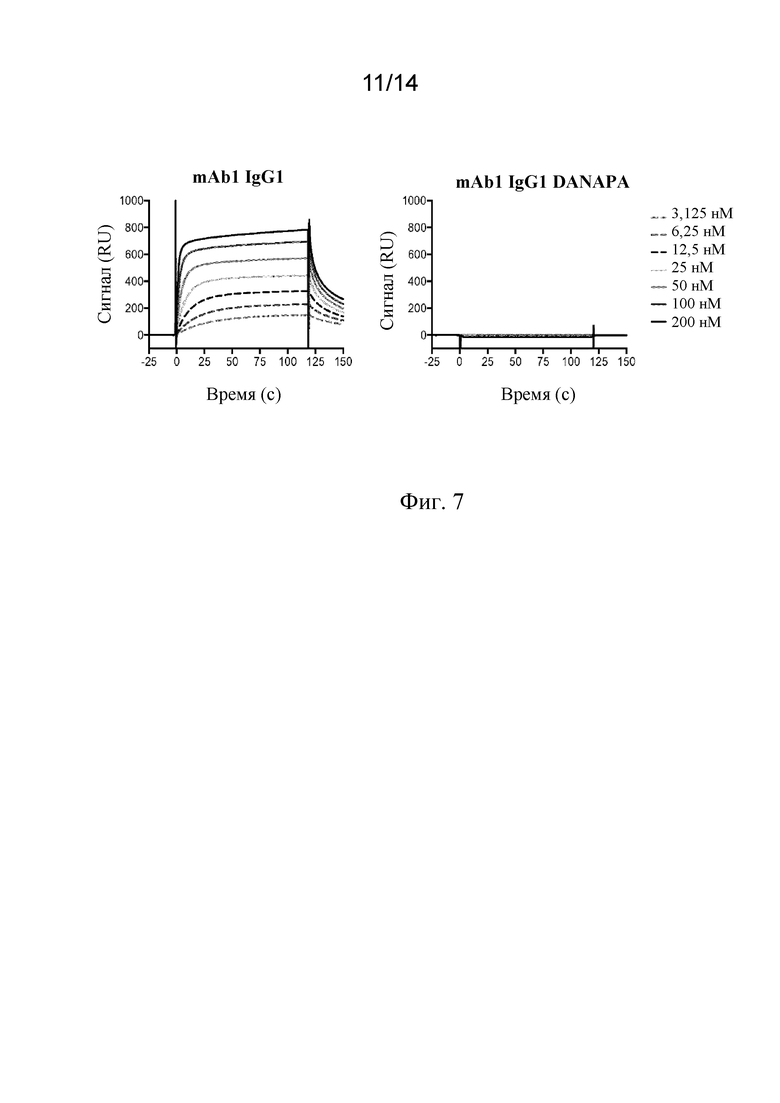
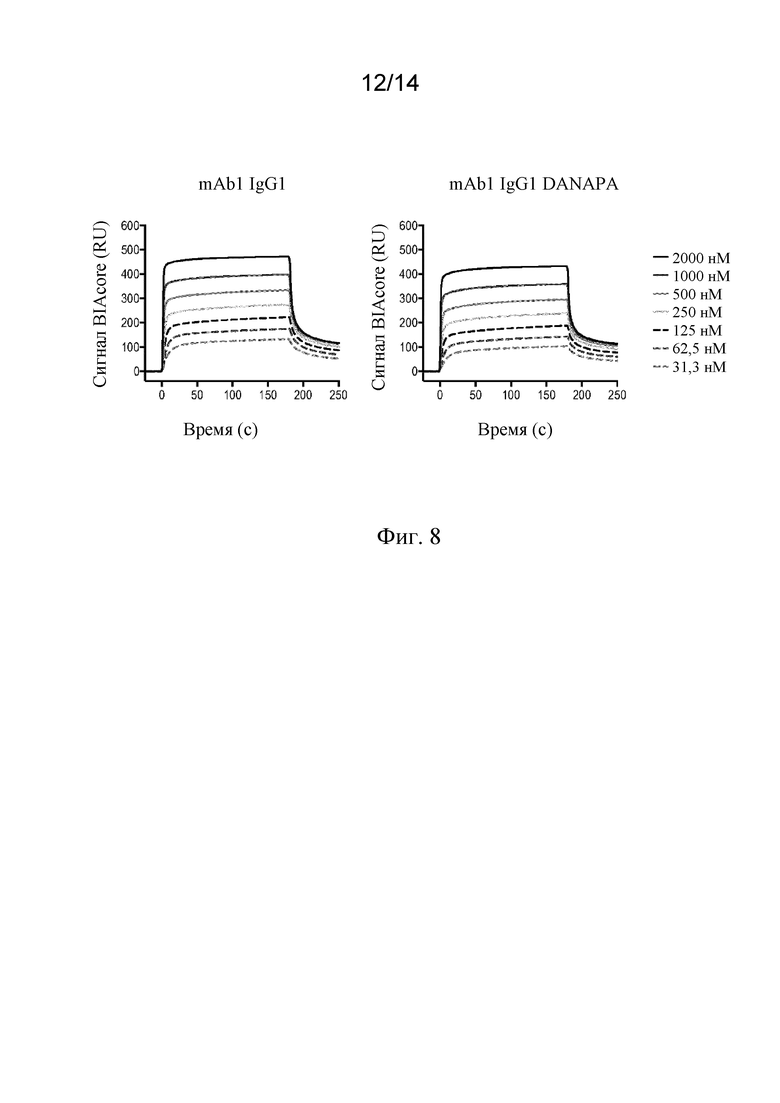
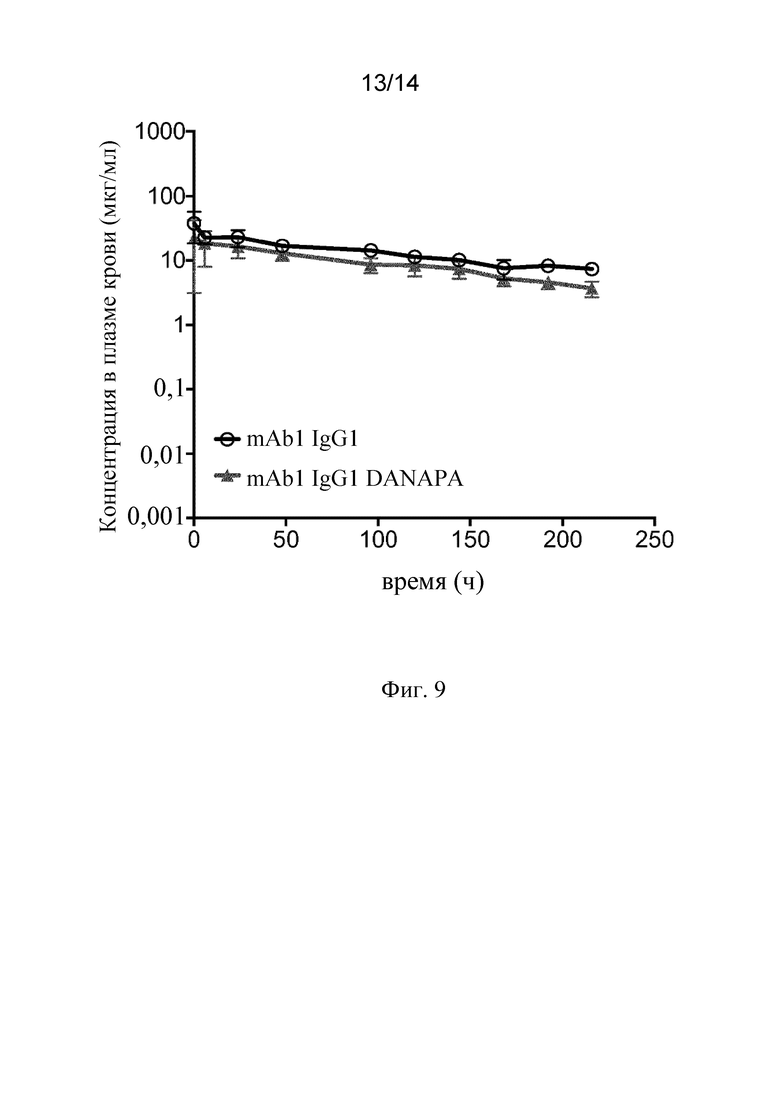
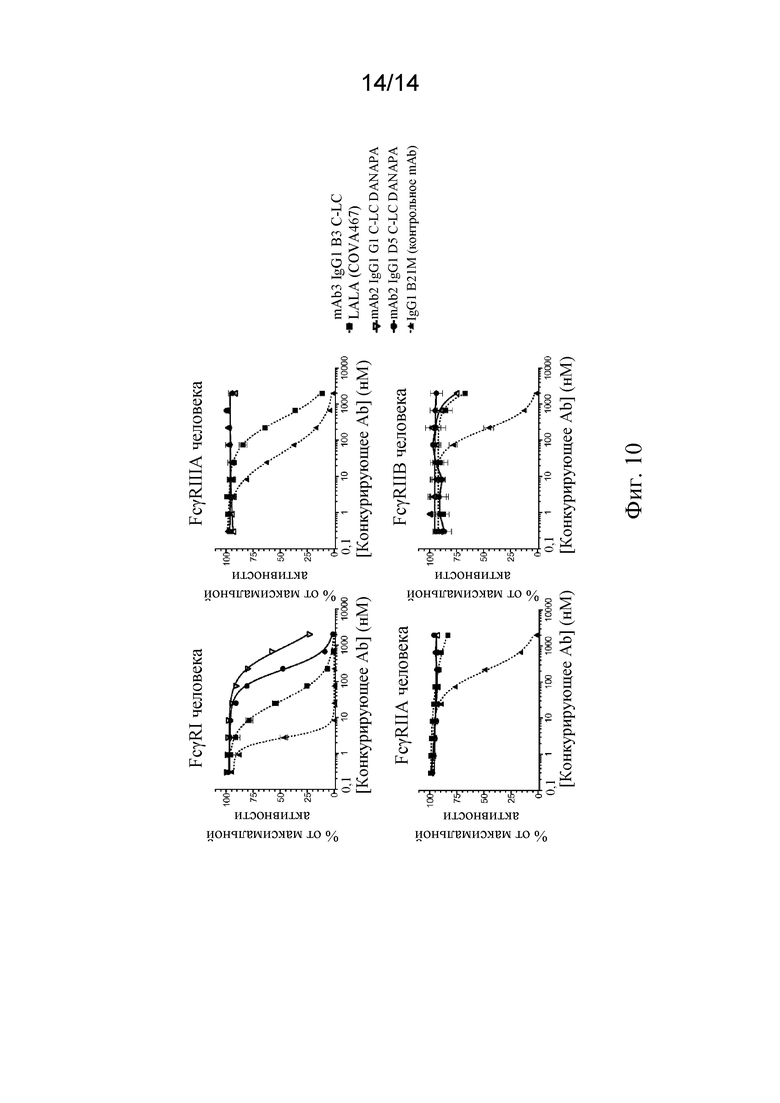
Группа изобретений относится к биотехнологии. Представлены: терапевтическая рекомбинантная молекула, содержащая Fc IgG1 человека, которая содержит домен CH2, а также ее применение для лечения различных заболеваний, рекомбинантный полинуклеотид, кодирующий молекулу, вектор экспрессии, клетка-хозяин, способы получения рекомбинантной молекулы, рекомбинантный полипептид, фармацевтическая композиция, способ лечения заболевания или нарушения. Новые молекулы, содержащие Fc, с видоизменениями в Fc-области со сниженным связыванием с C1q и Fc-гамма-рецепторами, позволяют применять их при лечении рака. 10 н. и 12 з.п. ф-лы, 10 ил., 5 табл., 10 пр.
1. Терапевтическая рекомбинантная молекула, содержащая Fc IgG1 человека, которая содержит домен CH2, содержащий аминокислотную последовательность, являющуюся на по меньшей мере 90% идентичной по отношению к аминокислотной последовательности под SEQ ID NO: 60, где
i. аминокислота в положении 265 представляет собой аланин (A), аспарагин (N) или глутаминовую кислоту (E),
ii. аминокислота в положении 297 представляет собой аланин (A), аспарагиновую кислоту (D) или глутамин (Q), и
iii. аминокислота в положении 329 замещена аланином (A), глицином (G) или серином (S), и,
где молекула сохраняет связывание с FcRn, и где молекула характеризуется в по меньшей мере 20 раз сниженным связыванием с C1q и с по меньшей мере одним Fcγ-рецептором (FcγR) по сравнению с молекулой, содержащей Fc IgG1 человека дикого типа, которая содержит D в положении 265, N в положении 297 и P в положении 329, и где нумерация указана согласно индексу EU по Kabat.
2. Молекула по п. 1, где молекула характеризуется в по меньшей мере 50 раз сниженным связыванием с C1q и с по меньшей мере одним FcγR по сравнению с молекулой, содержащей Fc IgG1 человека дикого типа, которая содержит D в положении 265, N в положении 297 и P в положении 329.
3. Молекула по п. 1 или 2, где по меньшей мере один FcγR выбран из FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa и FcγRIIIb.
4. Молекула по любому из пп. 1-3, где Fc-домен содержит аминокислотную последовательность, являющуюся на по меньшей мере 90% идентичной по отношению к аминокислотной последовательности Fc-домена IgG1 человека, содержащей SEQ ID NO: 43.
5. Молекула по любому из пп. 1-4, где молекула представляет собой антитело, Fc-область, слитый белок на основе Fc или слитый белок на основе антитела, такой как FynomAb.
6. Молекула по любому из пп. 1-5, где молекула содержит Fc-область, содержащую последовательность в соответствии с любым из SEQ ID NO: 43, 52, 53, 54, 55, 56, 57 или 58, где аминокислоты D в положении 265, N в положении 297 и P в положении 329 замещены другими аминокислотами.
7. Рекомбинантный полинуклеотид, кодирующий молекулу по любому из предыдущих пунктов.
8. Вектор экспрессии, содержащий полинуклеотид по п. 7.
9. Клетка-хозяин для продуцирования рекомбинантного полинуклеотида по п. 7 или вектора по п. 8.
10. Способ получения рекомбинантной молекулы, содержащей Fc IgG1 человека, которая содержит домен CH2, содержащий аминокислотную последовательность, являющуюся на по меньшей мере 90% идентичной по отношению к аминокислотной последовательности под SEQ ID NO: 60, и в котором аминокислоты в положениях 265, 297 и 329, указанных согласно индексу EU по Kabat, замещены другими аминокислотами, при этом способ включает стадии:
a. получения нуклеиновой кислоты, кодирующей молекулу, содержащую Fc IgG1 человека дикого типа,
b. модификации нуклеиновой кислоты, полученной на стадии (a), в целях получения нуклеиновой кислоты, кодирующей рекомбинантную молекулу, содержащую Fc IgG1 человека, в которой аминокислоты в положениях 265, 297 и 329 замещены аминокислотами, отличными от D, N и P соответственно, и
c. обеспечения экспрессии нуклеиновой кислоты, полученной на стадии (b), в клетке-хозяине и извлечения указанной рекомбинантной молекулы, содержащей Fc IgG1 человека,
где рекомбинантная молекула, содержащая Fc IgG1 человека, сохраняет связывание с FcRn, и где рекомбинантная молекула, содержащая Fc IgG1 человека, характеризуется в по меньшей мере 20 раз сниженным связыванием с C1q и с по меньшей мере одним Fcγ-рецептором (FcγR) по сравнению с молекулой, содержащей Fc IgG1 человека дикого типа, которая содержит D в положении 265, N в положении 297 и P в положении 329.
11. Рекомбинантный полипептид, способный к связыванию FcRn, содержащий:
a. по меньшей мере один связывающий домен, способный связываться с молекулой-мишенью; и
b. Fc-домен IgG1 человека, который содержит аминокислотную последовательность, являющуюся на по меньшей мере 90% идентичной по отношению к аминокислотной последовательности под SEQ ID NO: 60, и где аминокислоты в положениях 265, 297 и 329 в соответствии с индексом EU по Kabat отличаются от D, N и P соответственно,
где рекомбинантный полипептид сохраняет связывание с FcRn, и
где рекомбинантный полипептид способен связываться с молекулой-мишенью, не инициируя значительную активацию лимфоцитов, комплементзависимый лизис и/или клеточно-опосредованное разрушение молекулы-мишени и/или клетки, на поверхности которой экспрессируется молекула-мишень.
12. Рекомбинантный полипептид по п. 11, где по меньшей мере один связывающий домен выбран из группы, состоящей из связывающего участка антитела, финомера, фермента, гормона, внеклеточного домена рецептора, цитокина, поверхностного антигена иммунных клеток, лиганда и адгезивной молекулы.
13. Рекомбинантный полипептид по п. 11 или 12, где Fc-домен является на по меньшей мере 90% идентичным по отношению к аминокислотной последовательности Fc-домена IgG1 человека, содержащей SEQ ID NO: 43.
14. Рекомбинантный полипептид по любому из пп. 11, 12, где связывающий домен представляет собой связывающий участок антитела.
15. Фармацевтическая композиция для лечения рака, содержащая эффективное количество молекулы, содержащей Fc IgG1 человека, по любому из пп. 1-6 и фармацевтически приемлемое вспомогательное вещество.
16. Способ лечения заболевания или нарушения, включающий введение субъекту или пациенту молекулы, содержащей Fc IgG1 человека, по любому из пп. 1-6 или фармацевтической композиции по п. 15.
17. Способ по п. 16, где заболевание или нарушение представляет собой рак.
18. Способ получения рекомбинантной молекулы, содержащей Fc IgG1 человека, при этом способ включает обеспечение экспрессии рекомбинантного полинуклеотида по п. 7 в клетке-хозяине и сбор рекомбинантного полипептида.
19. Терапевтическая молекула, содержащая Fc IgG1 человека, по любому из пп. 1-6 или фармацевтическая композиция по п. 16 для применения при лечении заболевания или нарушения.
20. Молекула, содержащая Fc IgG1 человека или фармацевтическая композиция для применения по п. 19, где заболевание или нарушение представляет собой рак.
21. Применение молекулы, содержащей Fc IgG1 человека, по любому из пп. 1-6 или фармацевтической композиции по п. 15 в изготовлении лекарственного препарата для лечения заболевания или нарушения.
22. Применение по п. 21, где заболевание или нарушение представляет собой рак.
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| MEGAN LO et al | |||
| "Effector-attenuating Substitutions That Maintain Antibody Stability and Reduce Toxicity in Mice", Journal of Biological Chemistry, 2017, Vol | |||
Авторы
Даты
2022-01-18—Публикация
2018-10-01—Подача