Настоящее изобретение относится к биотехнологии и фармацевтической промышленности и может быть использовано при создании противовирусных лекарственных препаратов пролонгированного действия.
Интерфероны являются важными компонентами защиты позвоночных животных против инфекционных агентов. В настоящее время выделено и охарактеризовано более двадцати генетических разновидностей альфа-интерферонов человека (IFN-α1a, -α1b, -α2b, -α4а, -α4b, -α5, -α6 и т.д.), различающихся по первичной структуре, но обладающих сходными функциональными свойствами [Rubinstein М. The purification and characterization of alpha interferons and related cytokine receptors-a personal account // Cytokine Growth Factor Rev. 2007. V. 18. No. 5-6. P. 519-524; Emanuel S.L., Pestka, S.J. Human interferon-alpha A, -alpha 2, and -alpha 2(Arg) genes in genomic DNA // Biol. Chem. 1993. V. 268. No. 17. P. 12565-12569]. Разновидности альфа-интерферонов обеспечивают противовирусную защиту организма, оказывают антимикробное, противовоспалительное, иммуномодулирующее, противоопухолевое и радиопротективное действие [Baron S., Tyring S.K., Fleischmann W.R. Jr., Coppenhaver D.H., Niesel D.W., Klimpel G.R., Stanton G.J., Hughes Т.K. The interferons. Mechanisms of action and clinical applications // JAMA. 1991. V. 266. No. 10. P. 1375-1383; Pestka S., Langer J.A., Zoon K.C., Samuel C.E. Interferons and their actions // Annu. Rev. Biochem. 1987. V. 56. P. 727-777; Chelbi-Alix M.K., Wietzerbin J. Interferon, a growing cytokine family: 50 years of interferon research // Biochimie. 2007. V. 89. No. 6-7. P. 713-771.]. В геноме человека доминирующим является вариант локуса интерферона альфа 2b [Gewert D., Salom С., Barber K., Macbride S., Cooper H., Lewis A., Wood J., Crowe S. Analysis of interferon-alpha 2 sequences in human genomic DNA // J. Interferon Res. 1993. V. 13. No. 3. P. 227-231].
Зрелый лейкоцитарный интерферон альфа 2b человека (IFNα2b) - это белок с молекулярной массой 19300 Да, состоящий из 165 аминокислотных остатков. В белке имеются две дисульфидные связи, образованные четырьмя остатками цистеина в положениях Cys1-Cys98 (первая дисульфидная связь) и Cys29-Cys138 (вторая дисульфидная связь), причем последняя важна для проявления антивирусной активности IFNα2b.
Способность альфа-интерферонов оказывать противовирусное, иммуномодулирующее, противоопухолевое действие обусловили их широкое применение в медицине в качестве действующих ингредиентов лекарственных препаратов. Большинство таких препаратов содержат IFNα2b и используются для лечения гепатита С [Заявка на изобретение JP 2011173898 (A) Combination therapy comprising ribavirin and interferon alpha in antiviral treatment naive patient having chronic hepatitis С infection. 2011. A61K 38/21], онкологических заболеваний: базальных карцином [Заявка на изобретение US 5028422(A) Treatment of basal cell carcinoma intralesionally with recombinant human alpha interferon. 1991-07-02. A61K 38/21, A61K 37/66], саркомы Калоши [Патент на изобретение РФ №2140270 Способ лечения идиопатического типа саркомы Капоши. Опубл. 27.10.1999. МПК A61K 31/495, A61K 38/21], рака мочевого пузыря [Патент на изобретение РФ №2257912 (С1) Способ лечения рака мочевого пузыря. Опубл. 10.08.2005. МПК A61K 38/21, A61K 31/345, А61М 25/01, А61Р 35/00].
Последние годы во всем мире наблюдается рост потребления фармпрепаратов, содержащих в качестве действующего ингредиента рекомбинантный интерферон. Это, в свою очередь, диктует необходимость увеличения производства лейкоцитарного интерферона IFNα2b. Однако интерфероны, как и большинство других белков с небольшим молекулярным весом, нестабильны и легко деградируют в сыворотке крови протеазами и, в связи с этим, имеют короткий период полужизни в организме человека (1,5-2 часа).
Существует несколько способов увеличения периода полужизни инъецируемых рекомбинантных интерферонов:
1) инкапсулирование IFNα2b в полимерные или липидные наночастицы, обеспечивающие медленное и постепенное высвобождение цитокина [Патент на изобретение РФ №2552851 Липосомальное противовирусное средство на основе интерферона альфа-2b человека в капсулированной форме для вагинального применения. Опубл. 10.06.2015. МПК A61K 9/48, A61K 9/12, A61K 38/21, A61K 47/48, А61Р 31/12];
2) химическая модификация молекул IFNα2b молекулами полиэтиленгликоля (ПЭГ-илирование), в результате чего образуется ПЭГ-модифицированная молекула белка с принципиально новыми физико-химическими свойства, обладающая большей молекулярной массой, высокой гидрофильностью и устойчивость к протеолизу; препараты пегилированного интерферона α-2b имеют период полувыведения от 35 до 65 часов [Glue P., Fang J.W., Rouzier-Panis R., Raffanel С., Sabo R., Gupta S.K., Salfi M., Jacobs S. Pegylated interferon-alpha2b: pharmacokinetics, pharmacodynamics, safety, and preliminary efficacy data. Hepatitis С Intervention Therapy Group // Clin. Pharmacol. Ther. 2000. V. 68. No. 5. P. 556-567];
3) сайт-направленный мутагенез - замена протеаза-чувствительных аминокислот в молекуле IFNα2b, уменьшающая деградацию цитокина в сыворотке крови и увеличивающая время его полужизни [CN 107556376 (А) - 2018-01-09 Interferon alpha-2b mutant as well as preparation method and application thereof - A61K 38/21; A61P 31/12; C07K 14/56; C12N 15/70];
4) технология генно-инженерного создания гибридных молекул, содержащих химерный интерферон α2 (IFNα2), слитый с длительно циркулирующими белками крови [Заявка на изобретение CN 101768601 (A) Method for producing recombinant human serum albumin-interferon alpha 2b. 2010. МПК A61P 31/14, C07K 1/16, C07K 1/18, C07K 1/20, C07K 19/00, C12N 15/81, C12P21/02, C12R1/84; Патент на изобретение РФ №2262510 Слитый белок, обладающий биологической активностью интерферона-альфа, димерный слитый белок, фармацевтическая композиция, их содержащая, молекула ДНК (варианты) и способ адресования интерферона-альфа в ткани печени. 2005. МПК C07K 14/715, C07K 14/52, C12N15/21, C12N 15/63, C12N 15/62, C12N 15/86, C12N15/863, A61K 38/21].
Недостатки способов инкапсулирования рекомбинантных интерферонов: низкая скорость инкапсулирования, возможная денатурация белка в процессе инкапсулирования и, соответственно, потеря биологической активности интерферона [van de Weert М., Hennink W.E., Jiskoot W. Protein instability in poly(lactic-co-glycolic acid) microparticles // Pharm. Res. 2000. V. 17. No. 10. P. 1159-1167. Review].
Недостатками технологии пэгилирования являются ограниченная скорости диффузии и низкая биологическая активность пэгилированных интерферонов. Кроме того, препараты представляют собой смесь из множества отдельных модификаций, а также небольшого количества нмодифицированного интерферона, что приводит к трудностям в его производстве. Технология сайт-направленного мутагенеза связана с трудностями проектирования сайта мутации и предсказаний природы мутантного белка.
Получение генно-инженерными способами химерных белков, включая интерфероны, является сравнительно новым и перспективным подходом к увеличению времени полужизни указанных белков, однако биологическая активность и стабильность химерных интерферонов зависит от природы выбранного белка слияния с молекулой интерферона и выбора клетки-продуцента химерного цитокина.
При выборе белка слияния с IFNα2b известно использование сывороточного альбумина [Заявка на изобретение CN 101768601 (A) Method for producing recombinant human serum albumin-interferon alpha 2b. 2010. МПК A61P 31/14, C07K 1/16, C07K 1/18, C07K 1/20, C07K 19/00, C12N 15/81, C12P 21/02, C12R 1/84], иммуноглобулина [Патент на изобретение РФ №2262510 Слитый белок, обладающий биологической активностью интерферона-альфа, димерный слитый белок, фармацевтическая композиция, их содержащая, молекула ДНК (варианты) и способ адресования интерферона-альфа в ткани печени. Опубл. 20.10.2005. МПК C07K 14/715, C07K 14/52, C12N 15/21, C12N 15/63, C12N 15/62, C12N 15/86, C12N 15/863, A61K 38/21].
Наиболее распространенным решением получения химерного интерферона альфа пролонгированного действия является использование слитого с ним сывороточного альбумина человека (ЧСА), продуцируемого дрожжами Kluyveromyces lactis [Osborn B.L., Olsen H.S., Nardelli В., Murray J.H., Zhou J.X., Garcia A., Moody G., Zaritskaya L.S., Sung C. Pharmacokinetic and pharmacodynamic studies of a human serum albumin-interferon-alpha fusion protein in cynomolgus monkeys // J. Pharmacol. Exp.Ther. 2002. V. 303. No. 2. P. 540-548]. Известны также рекомбинантные интерфероны-альфа, слитые с альбумином, продуцируемые дрожжами Saccharomyces cerevisiae [Заявка на изобретение CN 101665798 (А) - 2010-03-10. Method for preparing recombinant human serum albumin and interferon alpha fusion protein. МПК C12N 15/62] или штаммом E. coli [Заявка на изобретение WO 2012048653 (A1) - 2012-04-19 Long-life interferon fusion protein and use thereof. 2012. МПК A61K 38/21; A61K 47/48; A61P 31/12; A61P 35/00; C07K 19/00; C12N 1/12; C12N 1/15; C12N 15/62; C12N 15/63; C12N 5/10 (24, 25)].
Как указано выше, биологическая активность и стабильность химерных интерферонов зависит не только от природы выбранного белка слияния с молекулой интерферона, но и выбора клетки-продуцента.
В основе современного биотехнологического производства терапевтических белков, как аналогичных природным, так и их химерных форм, лежит использование в качестве их продуцентов соответствующих культур клеток человека и других млекопитающих, рекомбинантных микроорганизмов.
Использование клеток млекопитающих в качестве продуцентов рекомбинантных цитокинов позволяет получать гликозилированные белки, наиболее приближенные по структуре к белкам человека, однако сам процесс культивирования клеток млекопитающих является продолжительным (8-10 суток), требующим особых условий аэрации и поддержания концентрации СО2, использования дорогостоящих сред, строгого соблюдения стерильных условий культивирования, а также привлечения к производству высококвалифицированного персонала.
Дрожжи & cerevisiae и K. lactis характеризуются избыточным гликозилированием белков, что приводит к существенному снижению их биологической активности [Loren D. Schultz, Jerry Tanner, Kathryn J. Hofmann, Emilio A. Emini, Jon H. Condra, Raymond E. Jones, Elliott Kieff, Ronald W. Ellis. Expression and secretion in yeast of a 400-kda envelope glycoprotein derived from epstein-barr virus // Gene. 1987. V.54. No. 1. P. 13-123; Yeh P., Fleer R., Maury I., Mayaux J.-F. Secretion of naturally N-glycosylated human proteins in Kluyveromyces lactis. Abstract D14, 6th International Symposium on Genetics of Industrial Organisms, Strasbourg. 1990].
Системы экспрессии E.coli и P. pastor is в настоящее время являются наиболее широко используемыми для крупномасштабного производства различных рекомбинантных фармацевтически значимых белков. Однако, бактерии Е. coli как продуценты терапевтических белков имеют ряд недостатков, таких как неспособность осуществлять посттрансляционные модификации белков, в частности, интерферона IFNα2b человека, свойственные эукариотическим организмам; накопление основной массы данного синтезируемого IFNα2b в телах включения в виде высокомолекулярных полимеров [Babu K.R., Swaminathan S., Marten S., Khanna N., Rinas U. Production of interferon-alpha in high cell density cultures of recombinant Escherichia coli and its single step purification from refolded inclusion body proteins // Appl. Microbiol. Biotechnol. 2000. V.53. No. 3. P. 655-660; Патент на изобретение РФ №2165455 Рекомбинантная плазмидная днк pss5, кодирующая синтез рекомбинантного человеческого альфа-2b интерферона, штамм escherichia coli ss5 - продуцент рекомбинантного человеческого альфа-2b интерферона и способ получения интерферона альфа-2b. 2001. МПК C12N 15/21, C12N 1/21, С12Р 21/02, C12R 1/19; Valente С.А., Monteiro G.A., Cabral J.M., Fevereiro M., Prazeres D.M. Optimization of the primary recovery of human interferon alpha2b from Escherichia coli inclusion bodies // Protein Expr. Purif. 2005. V. 45. No. 1. P. 226-234], что существенно усложняет процедуру получения рекомбинантного белка [Гавриков А.В., Рязанов И.А., Калужский В.Е., Машко С.В. Зависимость процедуры выделения и очистки рекомбинантного интерферона α-2b человека от условий его накопления в клетках штамма-продуцента в ходе регулируемого культивирования // Биотехнология. 2006. №5. С. 23-31]; наличие в синтезируемом белке эндотоксинов, полное освобождение от примеси которых значительно затрудняет и удорожает процедуру очистки рекомбинантного IFNα2b [Vu Т.Т., Jeong В., Krupa М., Kwon U., Song J.A., Do B.H., Nguyen M.T., Seo Т., Nguyen A.N., Joo C.H., Choe H. Soluble Prokaryotic Expression and Purification of Human Interferon Alpha-2b Using a Maltose-Binding Protein Tag // J. Mol. Microbiol. Biotechnol. 2016. V. 26. P. 359-368].
Одним из наиболее перспективных подходов в производстве биологически активных рекомбинантных интерферонов эукариот является использование для экспрессии кодирующих их генов клеток метилотрофных дрожжей Pichia pastoris. Дрожжи P. pastoris являются непатогенными для человека и животных микроорганизмами и не содержат токсических и пирогенных соединений, что позволяет использовать эти микроорганизмы в качестве продуцентов рекомбинантных интерферонов, используемых в клинической практике. Ранее были показаны следующие преимущества P. pastoris в качестве продуцентов других рекомбинантных белков, обусловленные:
а) применением для трансформации дрожжевых клеток интеграционных векторов, содержащих сильный регулируемый промотор гена метанол-индуцируемой алкоголь-оксидазы (АОХ1) [Cregg J.M., Madden K.R., Barringer K.J., Thill G.P., Stillman C.A. Functional characterization of the two alcohol oxidase genes from the yeast Pichia pastoris // Mol. Cell Biol. 1989. V. 9. No. 3. P. 1316-1323];
б) высокой генетической стабильностью рекомбинантных штаммов-продуцентов вследствие встройки клонируемых в них целевых генов в геном дрожжевых клеток [Cregg J.M., Barringer K.J., Hessler A.Y., Madden K.R. Pichia pastoris as a host system for transformations // Mol. Cell Biol. 1985. V. 5. No. 12. P. 3376-3385];
в) возможностью получения множественной встройки целевого гена в геном дрожжевой клетки и, как следствие этого, значительное увеличение синтеза кодируемого им белка [Shen W., Shu М., Ma L., Ni H., Yan H. High level expression of organophosphorus hydrolase in Pichia pastoris by multicopy ophcM assembly // Protein Expr. Purif. 2016. V. 119. P. 110-116; Shu M., Shen W., Yang S., Wang X., Wang F., Wang Y., Ma L. High-level expression and characterization of a novel serine protease in Pichia pastoris by multi-copy integration // Enzyme Microb. Technol. 2016. V. 92. P. 56-66];
г) культивированием дрожжевых клеток с применением недорогих сред и с малыми затратами энергии (клетки растут при низких температурах 25-28°С), с достижением высоких плотностей клеток (до 100 г/л или 500 ОЕ600/мл) [Sreekrishna K., Potenz R.H., Cruze J.A., McCombie W.R., Parker K.A., Nelles L., Mazzaferro P.K., Holden K.A., Harrison R.G., Wood P.J., et al. High level expression of heterologous proteins in methylotrophic yeast Pichia pastoris // J. Basic. Microbiol. 1988. V. 28. No. 4. P. 265-278; Stratton J., Chiruvolu V., Meagher M. High cell-density fermentation // Methods Mol. Biol. 1998. V. 103. P. 107-120].
д) способностью P. pastoris осуществлять такие посттрансляционные модификации белков, как: протеолитический процессинг, фолдинг, образование дисульфидных связей и гликозилирование, подобное таковому у человека [Pichia protocol. Higgins D.R., Cregg J.M. editors. // Methods in Molecular Biology. 1998. V.103. P. 1-270];
е) применением специальных типов экспрессирующих векторов, обеспечивающих получение целевого рекомбинантного белка в секретируемой в культуральную среду форме, что значительно упрощает процессы выделения и очистки целевого белка, на долю которого приходится до 80% от общего количества секретируемых дрожжами P. pastoris белков [Tschopp J.F., Sverlow G., Kosson R., Craig W. Grinna L. High-Level Secretion of Glycosylated Invertase in the Methylotrophic Yeast, Pichia Pastoris // Bio/Technology. 1987. V. 5. P. 1305-1308; Chen X., Li J., Sun H., Li S., Chen Т., Liu G., Dyson P. High-level heterologous production and Functional Secretion by recombinant Pichia pastoris of the shortest proline-rich antibacterial honeybee peptide Apidaecin // Sci. Rep. 2017. 7(1):14543. doi: 10.1038/s41598-017-15149-3];
ж) высоким уровнем синтеза и секреции целевых рекомбинантных белков [Clare J.J., Rayment F.B., Ballantine S.P., Sreekrishna K., Romanos M.A. High-level expression of tetanus toxin fragment С in Pichia pastoris strains containing multiple tandem integrations of the gene // Biotechnology (N Y). 1991. V. 9. No. 5. P. 455-460; Paifer E., Margolles E., Cremata J., Montesino R., Herrera L., Delgado J.M. Efficient expression and secretion of recombinant alpha amylase in Pichia pastoris using two different signal sequences // Yeast. 1994. 10. No. 11. P. 1415-1419].
В мировой патентной литературе известны следующие патенты по созданию рекомбинантных штаммов Pichia pastoris - продуцентов химерного IFNα2b человека, являющиеся аналогами заявляемого изобретения.
Известен способ получения штамма P. pastoris GS115 - продуцента химерного интерферона альфа, включая IFNα2b, с человеческим сывороточным альбумином (IFNα2b-ЧСА), обладающего пролонгированным действием. Белки в химере соединены (GlySer)n-линкером [Заявка на изобретение CN 101200503 (А) - 2008-06-18 Fusion protein for seralbumin and interferon. МПК C07K 14/76, C07K 19/00, C12N 1/19, C12N 15/62, C12N 15/63]. Недостатком данного изобретения является получение синтетических генов интерферона и альбумина с применением технологии кДНК, т.е. с помощью синтеза кодирующих областей этих генов на матрицах природных мРНК методом обратной транскрипции. Полученные таким образом гены содержат состав ко донов не оптимальный для экспрессии в клетках дрожжей P. pastoris. Технология кДНК снижает выход целевого белка, что, как следствие, ведет к росту процента деградированной протеазами части целевого белка, и соответственно, снижению его биологической активности.
Известен способ получения штамма P. pastoris KM71 - продуцента химерного интерферона альфа 2 с человеческим сывороточным альбумином (IFNα2-ЧСА), обладающего пролонгированным действием [Заявка на изобретение CN 1831124 (А) - 2006-09-13 Method for preparing fusion protein contg. human interferon-alpha 2 and human seralbumin and its products. 2006. МПК C07K 14/56, C07K 14/765, C07K 19/00, C12N 1/19, C12N 15/09, C12N 15/14, C12N 15/21, C12N 15/62]. В изобретении не приводятся данные о количественном выходе белка и его удельной биологической активности, однако непосредственное соединение двух синтетических генов IFNα2 и ЧСА без использования связующих линкеров может негативно сказаться на биологической активности химерного белка.
Известен способ получения штамма Р. pastoris GS115 продуцента химерного интерферона альфа 2b с человеческим сывороточным альбумином (IFNα2b-4CA). Гены, кодирующие химерный интерферон, связаны нуклеотидной последовательностью, кодирующей GlySer-линкер [Заявка на изобретение CN 1807646 (А) - 2006-07-26 Production method of recombinant fusion protein of human serum albumin-interferon alpha 2b. МПК C12N 1/19, C12N 15/14, C12N 15/21, C12N 15/62]. Недостатком аналога является низкая удельная биологическая активность химерного белка, составляющая 3,0×106 МЕ/мг.
Наиболее близким аналогом, принятым в качестве прототипа, является способ получения штамма Р. pastoris Х33, трансформированного рекомбинантной плазмидной ДНК, кодирующей химерный интерферон альфа 2b человека пролонгированного действия, включающей нуклеотидную последовательность гена интерферона альфа 2b человека (IFNα2b) и гена сывороточного альбумина человека (ЧСА). Гены IFNα2b и ЧСА связаны в плазмидной ДНК между собой нуклеотидной последовательностью, кодирующей (GlySer)n-линкер [Заявка на изобретение CN 101768601 (A) Method for producing recombinant human serum albumin-interferon alpha 2b. 2010. МПК A61P 31/14, C07K 1/16, C07K 1/18, C07K 1/20, C07K 19/00, C12N 15/81, C12P 21/02, C12R 1/84]. Недостатком прототипа является низкая противовирусная активность химерного белка, составляющая 1.5×106 МЕ/мг. Это, по-видимому, обусловлено тем, что альбумин, имеющий большую молекулярную массу, может оказывать влияние на конформацию слитого с ним IFNα2b и, как следствие этого, приводить к существенному снижению удельной биологической активности последнего.
Задачей настоящего изобретения является создание генно-инженерными методами штамма продуцента, содержащего плазмиду, кодирующую химерный интерферон a2b пролонгированного действия, обладающий более высокой противовирусной активностью, и способа получения указанного белка.
Техническим результатом является конструирование рекомбинантной плазмидной ДНК, обеспечивающей экспрессию гена химерного рекомбинантного интерферона alpha2b человека пролонгированного действия, обладающего более высокой противовирусной активностью, создание штамма дрожжей Pichia past oris Х33, трансформированного указанной плазмидной ДНК, - продуцента химерного интерферона alpha2b человека, включающего аминокислотные последовательности интерферона alpha2b человека и аполипопротеина A-I человека, и способа получения указанного белка.
Раскрытие сущности изобретения
Заявлена группа изобретений, включающая химерный интерферон alpha2b человека, обладающий противовирусной активностью; рекомбинантную плазмидную ДНК pPICZαA:IFNα2b-linker-ApoA-I, обеспечивающую синтез в клетках дрожжей Pichia pastoris Х33 химерного интерферона alpha2b человека; рекомбинантный штамм дрожжей Pichia pastoris Х33, трансформированный рекомбинантной плазмидной ДНК pPICZαA:IFNα2b-linker-ApoA-I, - продуцент химерного интерферона alpha2b человека; способ получения химерного интерферона alpha2b человека.
Химерный интерферон alpha2b человека (далее IFNα2b-linker-ApoA-I), 434 а.о., молекулярная масса 49,360 кДа (SEQ ID NO 1), обладающий противовирусной активностью, включает с N-конца аминокислотную последовательность зрелого интерферона alpha2b человека (далее - IFNα2b), 165 а.о., молекулярная масса 19,268 кДа (SEQ ID NO 2), слитую с С-конца с аминокислотной последовательностью линкера, 20 а.о., молекулярная масса 1,469 кДа (SEQ ID NO 3), который, в свою очередь, слит с С-конца с аминокислотной последовательностью зрелого аполипопротеина A-I человека (далее - ароА-1), 243 а.о., молекулярная масса 28,076 кДа (SEQ ID NO 4).
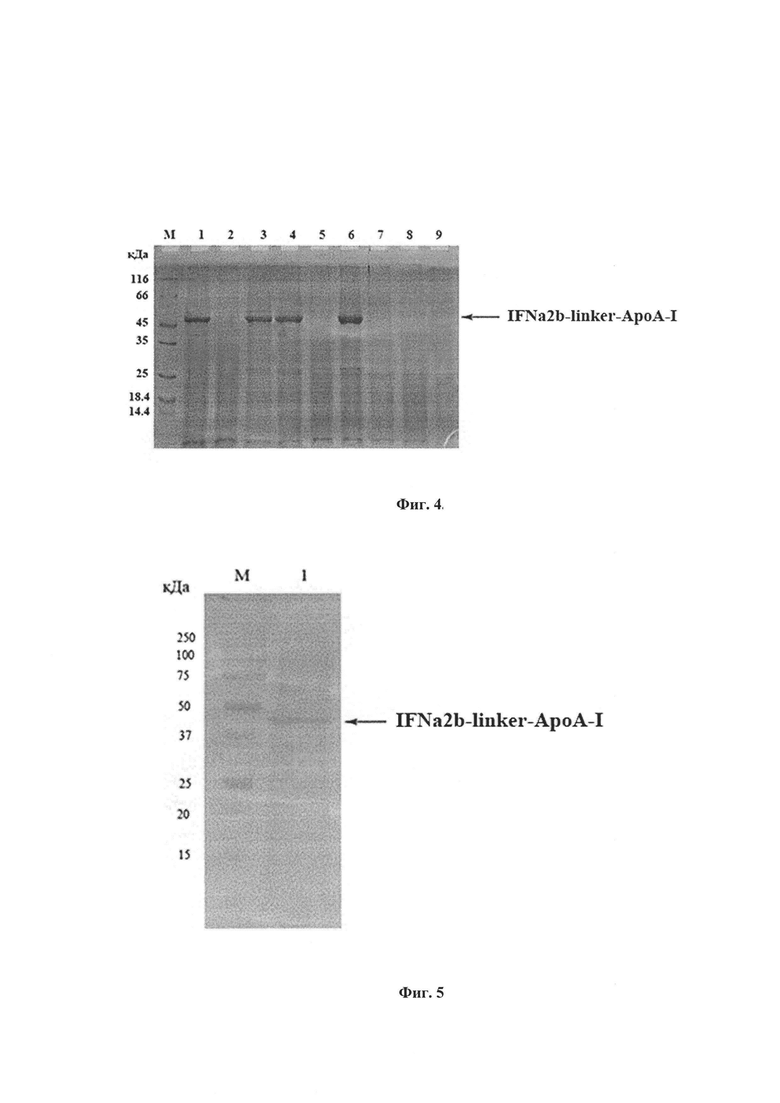
Рекомбинантная плазмидная ДНК pPICZαA:IFNα2b-linker-ApoA-I размером 4792 п.о., обеспечивающая синтез в клетках дрожжей Pichia pastoris Х33 химерного интерферона alpha2b человека (IFNα2b-linker-ApoA-I), содержит в направлении слева направо промотор АОХ-1 размером 940 п.о. (номера пар оснований в нуклеотидной последовательности плазмиды 1-940 п.о); фрагмент гена MFα дрожжей Saccharomyces cerevisiae, размером 249 п.о. (номера пар оснований 941-1189), кодирующий сигнал секреции a-фактора и обеспечивающий секрецию IFNα2b-linker-ApoA-I в культуральную среду; синтетический ген химерного интерферона alpha2b человека (SEQ ID NO 1) размером 1296 п.о., включающий ген зрелого интерферона alpha2b человека (SEQ ID NO 2) размером 495 п.о. (номера пар оснований 1208-1702), ген линкера (SEQ ID NO 3) размером 60 п.о. (номера пар оснований 1709-1768 п.о.) и ген зрелого ApoA-I (SEQ ID NO 4) размером 729 п.о. (номера пар оснований 1781-2509 п.о.); терминатор транскрипции гена АОХ-1 размером 342 п.о. (номера пар оснований 2540-2881); промотор гена TEF1 размером 412 п.о. (номера пар оснований 2882-3293); прокариотический промотор ЕМ7 размером 68 п.о. (номера пар оснований 3294-3361 п.о.); ген неомицинтрансферазы Zeo(R) размером 375 п.о., обеспечивающий устойчивость к зеоцину (номера пар оснований 3362-3736); терминатор транскрипции гена цитохрома C1 (CYC1) размером 318 п.о. (номера пар оснований 3737-4054); ориджин репликации плазмиды pUC размером 674 п.о. (номера пар оснвоаний 4065-4738)
Рекомбинантный штамм дрожжей Pichia pastoris X33/pPICZαA:IFNα2b-linker-ApoA-I - продуцент химерного интерферона IFNα2b-linker-ApoA-I (SEQ ID NO 1) получен путем трансформации дрожжей Pichia pastoris Х33 линеаризованной плазмидной ДНК pPICZαA:IFNα2b-linker-ApoA-I, встраиваемой в результате рекомбинации в геном трансформированных дрожжей.
Способ получения химерного интерферона IFNα2b-linker-ApoA-I (SEQ ID NO 1) включает микробиологический синтез этого белка в процессе культивирования штамма дрожжей Pichia pastoris X33/pPICZαA:IFNα2b-linker-ApoA-I; осаждение клеток указанного штамма с отделением супернатанта центрифугированием; осаждение из супернатанта химерного интерферона IFNα2b-linker-ApoA-I сульфатом аммония; суспендирование и растворение преципитата данного белка; очистку IFNα2b-linker-ApoA-I методом обращенно-фазовой хроматографии в градиенте ацетонитрила и последующий диализ данного очищенного белка.
Перечень фигур, чертежей и иных материалов
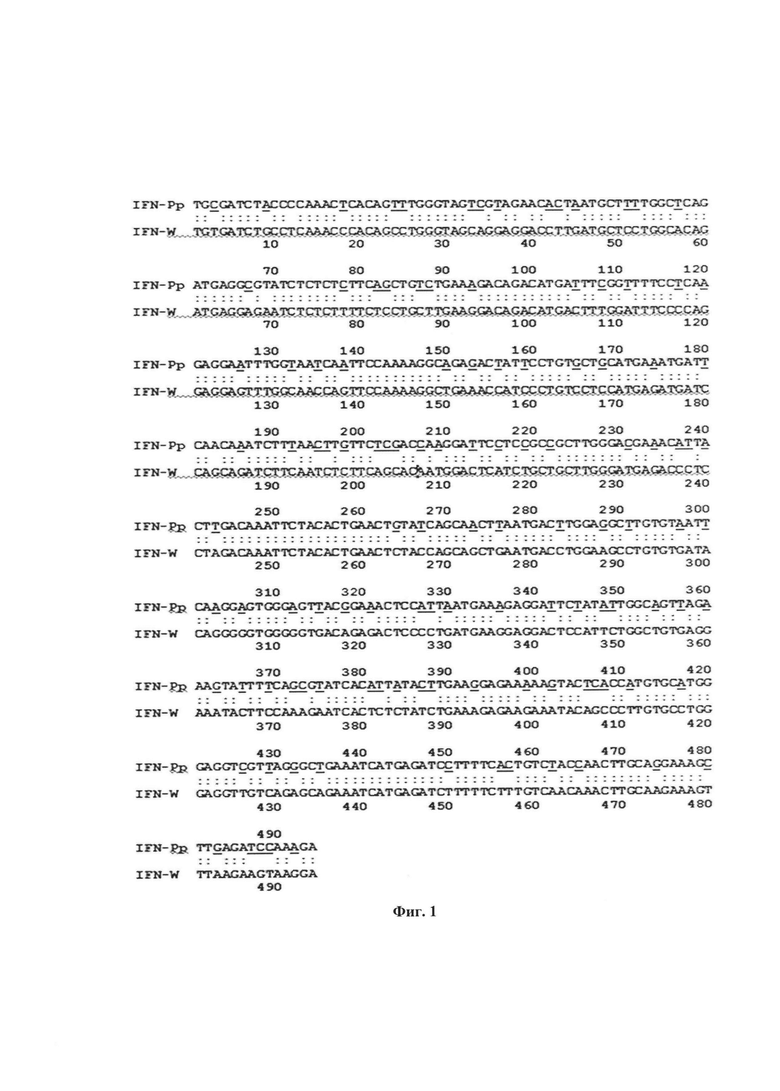
Фиг. 1. Сравнительный анализ нуклеотидных последовательностей нативного гена зрелого IFNα2b человека с 1 по 495 нуклеотид и соответствующего синтетического гена зрелого IFNα2b человека, оптимизированного для экспрессии в клетках дрожжей Р. pastoris.
Обозначения: IFN-W - нативный ген зрелого IFNα2b человека с 1 по 495 нуклеотид, IFN-Pp - синтетический ген зрелого IFNα2b человека с 1 по 495 нуклеотид.
Подчеркнуты синонимические нуклеотидные замены в синтетическом гене в сравнении с нативным геном IFNα2b человека (всего 120 замен).
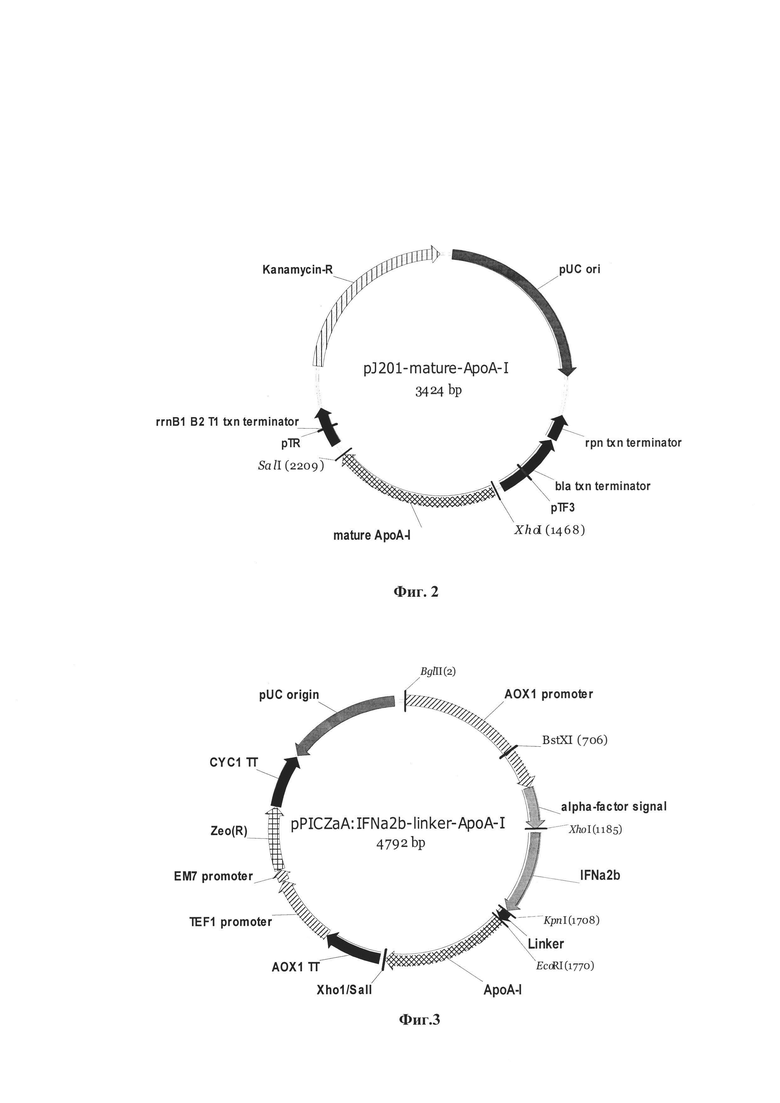
Фиг. 2. Физическая карта рекомбинантной плазмиды pJ201-mature-ApoA-I
pUC ori - ориджин репликации плазмиды pUC (41-844 п.о.); rpn txn terminator-терминатор транскрипции гена rpn txn (1016-1129 п.о.); bla txn terminator-терминатор гена bla (1136-1436 п.о.); pTF3 - промотор гена TF3 (1320-1345 п.о.); mature apoA-I - химически синтезированный ген зрелого apoA-I человека (1479-2207 п.о.); pTR - промотор (2346-2362 п.о.); rrnB1 В2 txn terminator - терминатор транскрипции генов пп В1 и В2 (2263-2437 п.о.); Kanamycin-R - ген неомицин фосфотрансферазы II (2622-3416 п.о.).
Фиг. 3. Физическая карта рекомбинантной плазмидной ДНК pPICZαA:IFNα2b-linker-ApoA-I
АОХ1 promoter - область промотора гена алкоголь оксидазы (1-940 п.о.); Alpha factor signal - фрагмент гена MFα дрожжей Saccharomyces cerevisiae, кодирующий сигнал секреции альфа-фактора (941-1189 п.о.); IFNα2b-linker-ApoA-I - синтетический ген химерного интерферона размером 1296 п.о., содержащий нуклеотидную последовательность гена зрелого интерферона alpha2-b человека (1208-1702 п.о.), состыкованную посредством олигонуклеотидного линкера (Linker) (1709-1768 п.о.) с геном зрелого apoA-I человека (1208-2509 п.о.); АОХ1 ТТ - терминатор транскрипции гена АОХ1 (2540-2881 п.о.); TEF1 - промотор гена фактора элонгации трансляции из Saccharomyces cerevisiae (2882-293); ЕМ7- прокариотический промотор (3294-3361 п.о.); ген Zeo(R), продукт которого обеспечивает устойчивость к антибиотику зеоцину (3362-3736 п.о.); CYC1 transcription terminator - область терминатора транскрипции гена цитохрома С1 (3737-4054 п.о.); pUC origin - ориджин репликации pUC (4065-4738 п.о.).
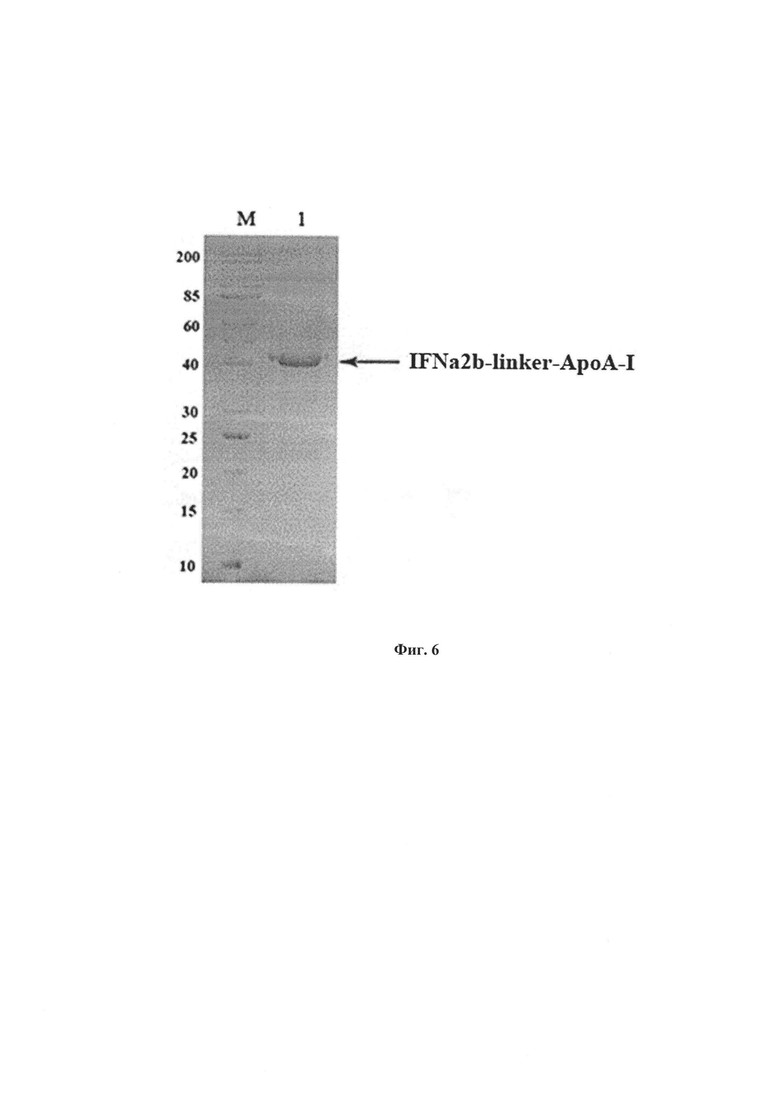
Фиг. 4. Электрофореграмма белков, присутствующих в культуральных жидкостях, клонов Pichia pastoris - анализируемых на продукцию химерного интерферона IFNα2b-linker-ApoA-I после 6-ти суток культивирования в среде BMGY на орбитальном шейкере в 96-глубоколуночном планшете.
Клоны индуцировали 1% метанолом (v/v) в течение 96 ч при 28°С. Электрофорез проводили в пластинах 12% ДСН-ПААГ. Дорожки: 1- маркер молекулярных масс белков Fermentas (12-116 кДа); 2-10 - белки в культуральных жидкостях анализируемых индуцированных метанолом клонов.
Фиг. 5. Вестерн-блот анализ химерного интерферона IFNα2b-linker-ApoA-I, продуцируемого одним из клонов Pichia pastoris.
Электрофорез проводили в пластинах 12% ДСН-ПААГ. Дорожки: 1 - маркер молекулярных масс белков (Bio-Rad) (10-250 кДа); 2 - химерный интерферон IFNα2b-linker-ApoA-I.
Фиг. 6. Электрофореграмма очищенного химерного интерферона IFNα2b-linker-АроА-I.
Электрофорез проводили в пластинах 12% ДСН-ПААГ. Дорожки: М - маркер молекулярных масс белков (Sib Enzyme) (10-200 кДа); 1 - химерный интерферон IFNα2b-linker-ApoA-I.
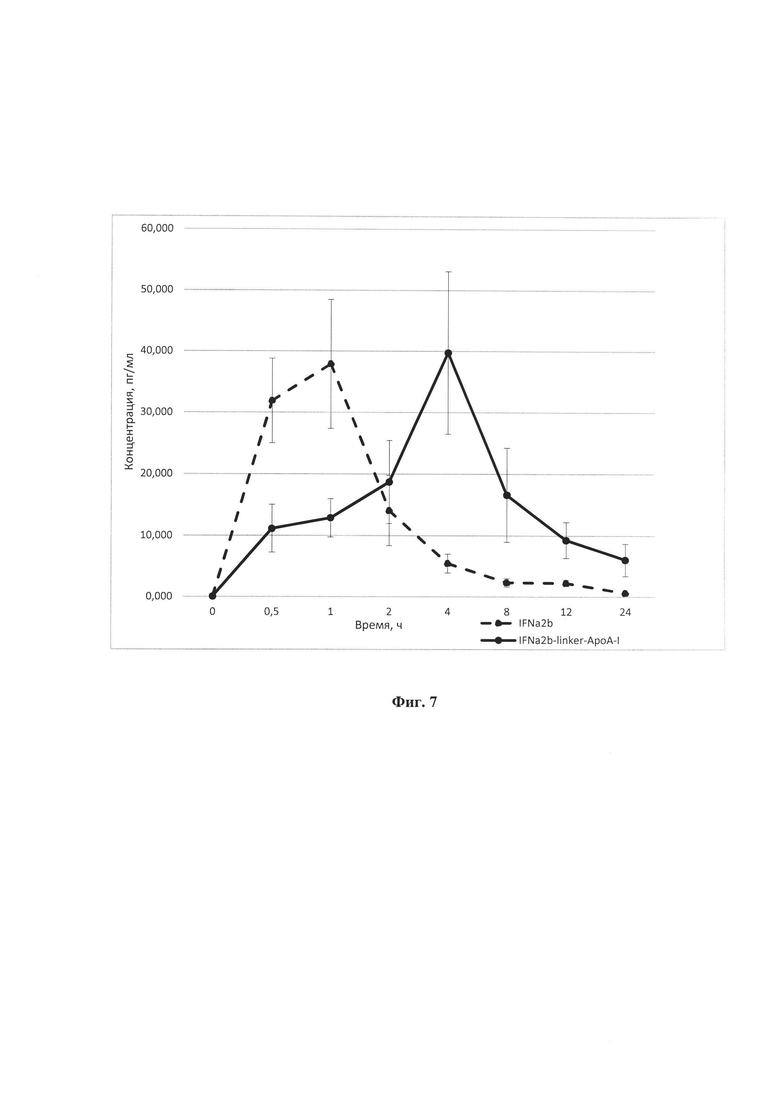
Фиг. 7. Фармакокинетические кривые концентрации IFNα2b и IFNα2b-linker-ApoA-I в сыворотках крови после их однократного подкожного введения самцам мышей линии CD-I в дозах 10 мкг/кг и 25 мкг/кг, соответственно.
Животным вводили эквимолярные количества IFNα2b и IFNα2b-linker-ApoA-I. Числовые данные представлены как среднее ± стандартное отклонение (n=5).
Осуществление изобретения
Ниже приведены примеры конкретного выполнения группы изобретений.
Пример 1. Проектирование и синтез генов белков IFNα2b-linker и АроА-I
Пример 1а. Проектирование и синтез гена химерного белка IFNα2b-linker
На первом этапе проводят теоретический расчет нуклеотидной последовательности проектируемого гена, кодирующего IFNα2b человека, слитый с нуклеотидной последовательностью, кодирующей олигопептидный линкер, с целью разработки оптимального для экспрессии в клетках P. pastoris состава вырожденных кодонов и исключения других факторов, влияющих на эффективность экспрессии гена на уровне транскрипции и трансляции. Работу проводят с применением трех компьютерных программ: с использованием компьютерной программы «Gene designer» («АТОМ», США), пакета программного обеспечения VisualGeneDeveloper (http://www.visualgenedeveloper.net/Download.html) и программы GeneOptimizer™ фирмы Invitrogen. В результате проведенных компьютерных расчетов разрабатывают первичную структуру искусственного гена зрелого IFNα2b человека, слитого с нуклеотидной последовательностью линкера (IFNα2b-linker), оптимизированную для экспрессии в клетках P. pastoris. Кроме того, в состав искусственного гена включают необходимые для клонирования сайты рестрикции. На фиг. 1 приведена нуклеотидная последовательность проектируемого гена зрелого IFNα2b человека, оптимизированного для экспрессии в дрожжах P. pastoris, в сравнении с нуклеотидной последовательностью природного гена этого белка. Как видно из фиг. 1, в искусственный ген IFNα2b относительно природного гена IFNα2b внесены 120 нуклеотидных замен в кодирующей области гена. Отмеченные замены являются синонимическими, т.е. не приводят к замене аминокислотных остатков, кодируемых соответствующими кодонами. Далее проводят химико-ферментативный синтез искусственного гена IFNα2b-linker, включающего ген зрелого IFNα2b, слитого на 3'-конце с нуклеотидной последовательностью линкера, за которой следует сайт рестрикции EcoRI, а в 5'-концевой области гена содержится последовательность, кодирующая сайты гидролиза протеазами Ste13 и Kex2 и сайт рестрикции XhoI.
Пример 16. Амплификация гена apoA-I методом ПЦР
Нуклеотидную последовательность гена apoA-I человека (SEQ ID NO 4) размером 729 п.о. синтезируют методом ПЦР с использованием прямого 373-F: 5'-GAGAATTCGATGAGCCACCACAGTCCC-3' и обратного 431-R: 5'-ACGGCTCGAGTCATTGCGTGTTTAACTTCTTAGTGTACTC-3' праймеров на ДНК плазмиды pJ201-mature-ApoA-I, используемой в качестве матрицы (фиг. 2). Плазмида pJ201-mature-ApoA-I содержит ген зрелого apoA-I человека, ранее оптимизированный для экспрессии в клетках Pichia pastoris [Мамаев А.Л., Беклемишев А.Б. Клонирование и анализ экспрессии синтетических генов аполипопротеина А1 человека в клетках Escherichia coli и метилотрофных дрожжей Pichia pastoris // Бюл. СО РАМН. 2014. Т. 34. №5. С. 37-49] (Пример 1). Праймеры, используемые для амплификации гена зрелого apoA-I, на 5'-концах содержат сайты рестрикции EcoRI и XhoI, необходимые для последующего клонирования ампликона в составе вектора pPICZαA по сайтам EcoRI и SaiI (Пример 1).
Пример 2. Конструирование заявленной рекомбинантной плазмидной ДНК pPICZαA:IFNα2b-linker-ApoA-I
Сначала осуществляют конструирование плазмиды pPICZαA:ApoA-I. Ампликон гена зрелого ароА-I человека гидролизуют рестриктазами XhoI и EcoRI и лигируют с плазмидным вектором pPICZαA, гидролизованным по сайтам EcoRI и SaiI. Лигазной смесью трансформируют электрокомпетентные клетки Е. coli шт. ТОР10 и затем выращивают и отбирают трансформанты на селективной низкосолевой среде ЛБ, содержащей 25 мкг/мл зеоцина. Выросшие клоны анализируют на наличие целевой рекомбинантной плазмиды pPICZαA:ApoA-I методом ПЦР колоний. ПЦР осуществляют в присутствии пары праймеров: прямого 423F (5'-TACTATTGCCAGCATTGCTGC-3') и обратного 424R (5'-GCAAATGGCATTCTGACATCC-3'), специфичных для фланкирующих ген зрелого apoA-I человека областей рекомбинантной плазмиды pPICZαA:ApoA-I. Размер ампликонов определяют электрофорезом в 0,8%-м агарозном геле. Один из ПЦР-позитивных клонов используют для препаративной наработки плазмиды pPICZαA:АроА-I.
На следующем этапе синтезированный химерный ген IFNα2b-linker гидролизуют по сайтам EcoRI и XhoI и лигируют с плазмидой pPICZαA:ApoA-I, предварительно гидролизованной рестриктазами по этим же сайтам. Полученной лигазной смесью трансформируют клетки E.coli шт. ТОР10. Затем выращивают и отбирают трансформанты на селективной низкосолевой среде ЛБ, содержащей 25 мкг/мл зеоцина. Выросшие клоны анализируют на наличие рекомбинантной плазмиды методом ПЦР колоний в присутствии прямого 423F и обратного 424R праймеров. Размер ампликонов определяют электрофорезом в 0,8%-м агарозном геле. Один из ПЦР-позитивных клонов используют для препаративной наработки рекомбинантной плазмидной ДНК pPICZαA:IFNα2b-linker-АроА-I (фиг. 3) методом щелочного лизиса.
Пример 3. Трансформация дрожжей P. pastoris Х33 рекомбинантной плазмидной ДНК pPICZαA:IFNα2b-linker-ApoA-I
Выделенную рекомбинантную плазмидную ДНК pPICZαA:IFNα2b-linker-ApoA-I обрабатывают рестриктазой BstXI и ее линеаризованную форму используют для трансформации электрокомпетентных клеток дрожжей P. pastoris Х33. Трансформированные клетки дрожжей высевают и отбирают на селективной агаризованной среде YPD, содержащей 500 и 2000 мкг/мл зеоцина. Отобранные колонии выращивают в колбах с дефлекторами в течение 2-х суток на орбитальном шейкере при 300 об/мин в среде BMGY, после чего в культуры ежедневно в течение 2-х - 3-х суток вносят метанол до 1%. По окончании индукции клетки осаждают центрифугированием (3500g, 20 мин, +4°С). Белки из супернатантов объемом 1-0,5 мл осаждают 10%-й трихлоруксусной кислотой. Осадки белков промывают ацетоном и анализируют электрофорезом в денатурирующих условиях в 12%-м полиакриламидном геле, (ДСН-ПААГ) (фиг. 4). Клон, продуцирующий наибольшее количество целевого рекомбинантного химерного интерферона IFNα2b-linker-ApoA-I, отбирают для осуществления способа получение указанного белка.
Пример 4. Способ получения химерного интерферона IFNα2b-linker-ApoA-I
Клон P. pastoris Х33, трансформированный линеаризованной плазмидной ДНК pPICZαA:IFNα2b-linker-ApoA-I, и продуцирующий наибольшие количества рекомбинантного химерного интерферона IFNα2b-linker-ApoA-I, используют для осуществления заявленного способа получения химерного интерферона IFNα2b-linker-АроА-I. Выращивание клона проводят в конических колбах объемом 250-300 мл с дефлекторами, содержащих по 50 мл среды BMGY на орбитальном шейкере при 28°С и 250 об/мин в течение 2-х суток. Перед индукцией в колбы вносят 0,2% (w/v) детергента Твин 20. Микробиологический синтез химерного интерферона IFNα2b-linker-ApoA-I ежедневно индуцируют внесением в колбы с культурами рекомбинантных дрожжей метанола до конечной концентрации 1%. На 4-е сутки после индукции клетки осаждают центрифугированием при +5°С, 3750xg в течение 25 мин, с отделением супернатанта.
Рекомбинантный химерный интерферон IFNα2b-linker-ApoA-I осаждают из супернатанта сульфатом аммония. Для этого в основную часть супернатанта вносят порошок сульфата аммония до 50% насыщения и выдерживают 12-16 часов при +4°С. Культуральную жидкость с образовавшимися преципитатами центрифугируют при 39000xg в течение 30 мин при +4°С. Преципитаты, содержащие химерный интерферон IFNα2b-linker-ApoA-I, после сульфат-аммонийного осаждения суспендируют и растворяют в 0,02% Твин 20, рН 4.5. Полученную суспензию центрифугируют 5 мин при 12000 об/мин для получения гомогенного осветленного супернатанта, который используют для дальнейшей хроматографической очистки химерного интерферона IFNα2b-linker-ApoA-I (Пример 5).
Наличие в составе химерного интерферона IFNα2b-linker-ApoA-I аминокислотной последовательности ароА-I подтверждено на основе иммуноблот-анализа. Для этого белки, секретируемые выбранным дрожжевым клоном, и стандартные биотинилированные маркерные белки разделяли электрофорезом в 12% ПААГ с последующим переносом на нитроцеллюлозную мембрану (Millipore, США). Мембрану инкубировали в течение 1 ч при комнатной температуре в буфере «А» (50 мМ фосфат натрия, рН 7.0, 150 мМ хлорид натрия, 5% (w/v) БСА) для блокирования неспецифического связывания мембраны с антителами и конъюгатом. Затем мембрану инкубировали в течение 1 ч при комнатной температуре в буфере «А», содержащем первичные кроличьи антитела против ароА-I человека, и после промывки буфером «А» инкубировали в течение 1 ч с антителами козы против иммуноглобулинов кролика, меченным пероксидазой хрена (разведение 1:500). Белки на мембране визуализировали смесью хромогенного красителя 4-хлор-1-нафтола и раствора Н2О2. На фиг. 5 приведены результаты иммуноблоттинга.
Пример 5. Хроматографическая очистка химерного интерферона IFNα2b-linker-ApoA-I
Белки из осветленного супернатанта (Пример 4) очищают методом обращенно-фазовой хроматографии в градиенте ацетонитрила. В супернатант вносят ТФУ до конечной концентрации 0,3% и наносят на хроматографическую колонку. Колонку промывают буфером, содержащим 20% ацетонитрил, 0,1% ТФУ. Целевой белок элюируют с колонки раствором, содержащим 0,1% ТФУ и возрастающие количества (градиент) ацетонитрила (20%-80%). Фракции, содержащие максимально очищенный химерный интерферон, объединяют, диализуют против буфера, содержащего 10 мМ натрий фосфат, 0,02% Твин 20, 1 мМ ЭДТА, рН 7.4, и анализируют электрофорезом в денатурирующих условиях в 12% ДСН-ПААГ. Чистота конечного препарата химерного интерферона IFNα2b-linker-ApoA-I при описанном способе очистки составляет ~90-93% по данным денситометрии полиакриламидного геля (фиг. 6). Концентрацию очищенного белка замеряют спектрофотометрически в УФ поглощении при длине волны 280 нм с учетом молярного коэффициента экстинкции, а также денситометрией полиакриламидного геля с помощью программ Gel Pro, и др.
Пример 6. Определение противовирусной активности химерного интерферона IFNα2b-linker-ApoA-I
Противовирусную активность химерного интерферона IFNα2b-linker-ApoA-I определяют на перевиваемой линии клеток почек быка (MDBK), инфицированной вирусом везикулярного стоматита лошадей, в соответствие с инструкцией, описанной в Общей фармакопейной статье (ОФС.1.7.2.0002Л 5) «Биологические методы испытания препаратов интерферона с использованием культур клеток». Величину противовирусной активности оценивают по способности химерного интерферона IFNα2b-linker-ApoA-I подавлять цитопатический эффект вируса везикулярного стоматита лошадей (VSV, ГКВ №600, штамм «Индиана», депонированный в Государственной коллекции вирусов НИИ вирусологии им. Д.И. Ивановского) на клетках MDBK. Вирус вносят в дозе, соответствующей 100 ТЦИД 50/0,1 мл (50% тканевых цитопатических инфекционных доз). В вышеописанном примере установлено, что химерный интерферон IFNα2b-linker-ApoA-I увеличивал противовирусную активность дозозависимым образом. По результатам проведенного анализа образец химерного интерферона IFNα2b-linker-ApoA-I обладает противовирусной активностью 1,6*10 МЕ/мг, которая соответствует таковой у европейского стандартного препарата интерферона.
Пример 7. Анализ фармакокинетики химерного интерферона IFNα2b-Iinker- АроА-1
Фармакокинетику химерного интерферона IFNα2b-linker-ApoA-I исследуют в сравнении с таковой аутентичного рекомбинантного IFNα2b человека. Исследование проводят на группах лабораторных мышей линии CD1. Животных взвешивают и случайным образом распределяют на 2 опытных группы. Мышам первой опытной группы вводят подкожно по 200 мкл фосфатно-солевого буфера (ФСБ), содержащего 1 мкг/мл IFNα2b (10 мкг/кг мыши), мышам второй опытной группы - по 200 мкл ФСБ, содержащего 2,5 мкг/мл IFNα2b-linker-ApoA-I (25 мкг/кг мыши), по 5 мышей на каждую группу. Мышам контрольной группы вводят по 200 мкл ФСБ. Кровь у наркотизированных эфиром животных забирают сразу после декапитации через 30 мин, 1 час, 2 часа, 4 часа, 8 часов, 12 ч и 24 ч после введения растворов в пробирки с гепарином. Для получения плазмы крови пробы центрифугируют 15 мин при 3000 об/мин. Образцы замораживают при -70°С до проведения анализа. Содержание исследуемых белков в плазме определяют методом твердофазного иммуноферментного анализа.
учетом молярного коэффициента экстинкции, а также денситометрией полиакриламидного геля с помощью программ Gel Pro, и др.
Пример 6. Определение противовирусной активности химерного интерферона IFNα2b-linker-ApoA-I
Противовирусную активность химерного интерферона IFNα2b-linker-ApoA-I определяют на перевиваемой линии клеток почек быка (MDBK), инфицированной вирусом везикулярного стоматита лошадей, в соответствие с инструкцией, описанной в Общей фармакопейной статье (ОФС.1.7.2.0002Л 5) «Биологические методы испытания препаратов интерферона с использованием культур клеток». Величину противовирусной активности оценивают по способности химерного интерферона IFNα2b-linker-ApoA-I подавлять цитопатический эффект вируса везикулярного стоматита лошадей (VSV, ГКВ №600, штамм «Индиана», депонированный в Государственной коллекции вирусов НИИ вирусологии им. Д.И. Ивановского) на клетках MDBK. Вирус вносят в дозе, соответствующей 100 ТЦИД 50/0,1 мл (50% тканевых цитопатических инфекционных доз). В вышеописанном примере установлено, что химерный интерферон IFNα2b-linker-ApoA-I увеличивал противовирусную активность дозозависимым образом. По результатам проведенного анализа образец химерного интерферона IFNα2b-linker-ApoA-I обладает противовирусной активностью 1,6*10 МЕ/мг, которая соответствует таковой у европейского стандартного препарата интерферона.
Пример 7. Анализ фармакокинетики химерного интерферона IFNα2b-Iinker- АроА-1
Фармакокинетику химерного интерферона IFNα2b-linker-ApoA-I исследуют в сравнении с таковой аутентичного рекомбинантного IFNα2b человека. Исследование проводят на группах лабораторных мышей линии CD1. Животных взвешивают и случайным образом распределяют на 2 опытных группы. Мышам первой опытной группы вводят подкожно по 200 мкл фосфатно-солевого буфера (ФСБ), содержащего 1 мкг/мл IFNα2b (10 мкг/кг мыши), мышам второй опытной группы - по 200 мкл ФСБ, содержащего 2,5 мкг/мл IFNα2b-linker-ApoA-I (25 мкг/кг мыши), по 5 мышей на каждую группу. Мышам контрольной группы вводят по 200 мкл ФСБ. Кровь у наркотизированных эфиром животных забирают сразу после декапитации через 30 мин, 1 час, 2 часа, 4 часа, 8 часов, 12 ч и 24 ч после введения растворов в пробирки с гепарином. Для получения плазмы крови пробы центрифугируют 15 мин при 3000 об/мин. Образцы замораживают при -70°С до проведения анализа. Содержание исследуемых белков в плазме определяют методом твердофазного иммуноферментного анализа.
Кроме того, apoA-I является основным белком ЛПВП и обладает множеством свойств в организме, таких как антиатерогенные [Rubin Е.М., Krauss R.M., Spangler Е.А., Verstuyft J.G., Clift S.M. Inhibition of early atherogenesis in transgenic mice by human apolipoprotein AI // Nature. 1991. V. 353. No. 6341. P. 265-267], противовоспалительные [Beck W.H., Adams C.P., Biglang-Awa I.M., Patel A.B., Vincent H., Haas-Stapleton E.J., Paul M.M. Weers. Apolipoprotein A-I binding to anionic vesicles and lipopolysaccharides: role for lysine residues in antimicrobial properties // Biochim. Biophys. Acta. 2013. V. 1828. No. 6. P. 1503-1510], антиоксидантные [Garner В., Waldeck A.R., Witting P.K., Rye K.A., Stacker R. Oxidation of highdensity lipoproteins. II. Evidence for direct reduction of lipid hydroperoxides by methionine residues of apolipoproteins AI and All // J. Biol. Chem. 1998. V. 273. No. 11. P. 6088-6095]. Показано, что снижение в организме уровня apoA-I прямо коррелирует с развитием ряда онкологических заболеваний [Мао, М., Wang, X., Sheng, Н., Liu, Y., Zhang, L., Dai, S., Chi, P.D. A novel score based on serum apolipoprotein A-l and C-reactive protein is a prognostic biomarker in hepatocellular carcinoma patients // BMC Cancer. 2018. V. 18. P. 1178; Lin X., Hong S., Huang J., Chen Y., Chen Y., Wu Z. Plasma apolipoprotein AI levels at diagnosis are independent prognostic factors in invasive ductal breast cancer // Discov. Med. 2017. V. 23. No. 127. P. 247-258; Shi H., Huang H., Pu J., Shi D., Ning Y., Dong Y., Han Y., Zarogoulidis P., Bai C. Decreased pretherapy serum apolipoprotein A-I is associated with extent of metastasis and poor prognosis of non-small-cell lung cancer // Onco Targets Ther. 2018. V. 11. P. 6995-7003]. Кроме того, apoA-I способен взаимодействовать с фосфолипидами и спонтанно формировать липопротеиновые частицы, которые могут дополнительно защищать транспортируемые терапевтические агенты. Предполагается, что использование apoA-I в качестве протектора при конструировании заявленного химерного интерферона позволит сочетать иммунологическую активность IFNα2b с фармакокинетическими преимуществами ароА-I.
--->
Перечень нуклеотидных и аминокислотных последовательностей
<110> Беклемишев Анатолий Борисович, Пыхтина Мария Борисовна
<120> Рекомбинантная плазмидная ДНК, кодирующая химерный интерферон alpha2b,
рекомбинантный штамм дрожжей Р. pastoris X33 - продуцент химерного
интерферона alpha2b и способ получения указанного белка
<160> 4
<210> 1
<211> 1302
<212> DNA
<213> Pichia Pastoris
<400> 1
tgc gat cta ccc caa act cac agt ttg ggt agt cgt aga aca cta atg 48
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
ctt ttg gct cag atg agg cgt atc tct ctc ttc agc tgt ctg aaa gac 96
Leu Leu Ala Gln Met Arg Arg Ile Ser Leu Phe Ser Cys Leu Lys Asp
20 25 30
aga cat gat ttc ggt ttt cct caa gag gaa ttt ggt aat caa ttc caa 144
Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
aag gca gag act att cct gtg ctg cat gaa atg att caa caa atc ttt 192
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
aac ttg ttc tcg acc aag gat tcc tcc gcc gct tgg gac gaa aca tta 240
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
ctt gac aaa ttc tac act gaa ctg tat cag caa ctt aat gac ttg gag 288
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
gct tgt gta att caa gga gtg gga gtt acg gaa act cca tta atg aaa 336
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
gag gat tct ata ttg gca gtt aga aag tat ttt cag cgt atc aca tta 384
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
tac ttg aag gag aaa aag tac tca cca tgt gca tgg gag gtc gtt agg 432
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
gct gaa atc atg aga tcc ttt tca ctg tct acc aac ttg cag gaa agc 480
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
ttg aga tcc aaa gag ggt acc gga tcc tcc ggc agc ggt gga tcc tca 528
Leu Arg Ser Lys Glu Gly Thr Gly Ser Ser Gly Ser Gly Gly Ser Ser
165 170 175
gga tcg ggt tcc ggt agt agt ggt gga tct ggt gaa ttc gct agc gat 576
Gly Ser Gly Ser Gly Ser Ser Gly Gly Ser Gly Glu Phe Ala Ser Asp
180 185 190
gag cca cca cag tcc cct tgg gac cgt gtt aag gac ctg gca act gta 624
Glu Pro Pro Gln Ser Pro Trp Asp Arg Val Lys Asp Leu Ala Thr Val
195 200 205
tat gtt gac gtg ttg aag gat tca ggc aga gac tac gtt tct caa ttc 672
Tyr Val Asp Val Leu Lys Asp Ser Gly Arg Asp Tyr Val Ser Gln Phe
210 215 220
gaa ggt tcc gca cta gga aaa cag ctg aac ttg aaa ctt ttg gac aat 720
Glu Gly Ser Ala Leu Gly Lys Gln Leu Asn Leu Lys Leu Leu Asp Asn
225 230 235 240
tgg gat tct gtc act tct aca ttt tct aaa cta aga gaa cag tta ggt 768
Trp Asp Ser Val Thr Ser Thr Phe Ser Lys Leu Arg Glu Gln Leu Gly
245 250 255
cca gtt acc caa gag ttc tgg gat aat ctt gaa aaa gaa acc gaa ggt 816
Pro Val Thr Gln Glu Phe Trp Asp Asn Leu Glu Lys Glu Thr Glu Gly
260 265 270
ttg aga caa gag atg tct aag gat ttg gag gag gtt aaa gct aag gtg 864
Leu Arg Gln Glu Met Ser Lys Asp Leu Glu Glu Val Lys Ala Lys Val
275 280 285
caa ccc tac tta gat gac ttt caa aag aaa tgg cag gaa gaa atg gag 912
Gln Pro Tyr Leu Asp Asp Phe Gln Lys Lys Trp Gln Glu Glu Met Glu
290 295 300
cta tat cga caa aag gta gaa cca ctt cgt gca gag ctg caa gaa ggg 960
Leu Tyr Arg Gln Lys Val Glu Pro Leu Arg Ala Glu Leu Gln Glu Gly
305 310 315 320
gcc aga caa aag cta cat gaa ttg caa gag aaa ctg tca cct ttg gga 1008
Ala Arg Gln Lys Leu His Glu Leu Gln Glu Lys Leu Ser Pro Leu Gly
325 330 335
gaa gaa atg agg gac cgt gct aga gcc cat gtc gat gca tta cga acg 1056
Glu Glu Met Arg Asp Arg Ala Arg Ala His Val Asp Ala Leu Arg Thr
340 345 350
cac ctg gcc ccc tac agt gat gag ctc aga caa agg tta gcc gct agg 1104
His Leu Ala Pro Tyr Ser Asp Glu Leu Arg Gln Arg Leu Ala Ala Arg
355 360 365
ttg gag gct ctt aag gag aat gga ggt gcc aga ctt gct gag tat cat 1152
Leu Glu Ala Leu Lys Glu Asn Gly Gly Ala Arg Leu Ala Glu Tyr His
370 375 380
gct aag gct aca gaa cac cta tct aca tta agt gaa aaa gct aag cca 1200
Ala Lys Ala Thr Glu His Leu Ser Thr Leu Ser Glu Lys Ala Lys Pro
385 390 395 400
gct ctg gag gat ttg aga cag ggc ctt tta cct gtc ttg gaa tcc ttt 1248
Ala Leu Glu Asp Leu Arg Gln Gly Leu Leu Pro Val Leu Glu Ser Phe
405 410 415
aag gtg tcc ttc ttg tca gct ttg gaa gag tac act aag aag tta aac 1296
Lys Val Ser Phe Leu Ser Ala Leu Glu Glu Tyr Thr Lys Lys Leu Asn
420 425 430
acg caa 1302
Thr Gln
<210> 2
<211> 495
<212> DNA
<213> Pichia Pastoris
<400> 2
tgc gat cta ccc caa act cac agt ttg ggt agt cgt aga aca cta atg 48
Cys Asp Leu Pro Gln Thr His Ser Leu Gly Ser Arg Arg Thr Leu Met
1 5 10 15
ctt ttg gct cag atg agg cgt atc tct ctc ttc agc tgt ctg aaa gac 96
Leu Leu Ala Gln Met Arg Arg Ile Ser Leu Phe Ser Cys Leu Lys Asp
20 25 30
aga cat gat ttc ggt ttt cct caa gag gaa ttt ggt aat caa ttc caa 144
Arg His Asp Phe Gly Phe Pro Gln Glu Glu Phe Gly Asn Gln Phe Gln
35 40 45
aag gca gag act att cct gtg ctg cat gaa atg att caa caa atc ttt 192
Lys Ala Glu Thr Ile Pro Val Leu His Glu Met Ile Gln Gln Ile Phe
50 55 60
aac ttg ttc tcg acc aag gat tcc tcc gcc gct tgg gac gaa aca tta 240
Asn Leu Phe Ser Thr Lys Asp Ser Ser Ala Ala Trp Asp Glu Thr Leu
65 70 75 80
ctt gac aaa ttc tac act gaa ctg tat cag caa ctt aat gac ttg gag 288
Leu Asp Lys Phe Tyr Thr Glu Leu Tyr Gln Gln Leu Asn Asp Leu Glu
85 90 95
gct tgt gta att caa gga gtg gga gtt acg gaa act cca tta atg aaa 336
Ala Cys Val Ile Gln Gly Val Gly Val Thr Glu Thr Pro Leu Met Lys
100 105 110
gag gat tct ata ttg gca gtt aga aag tat ttt cag cgt atc aca tta 384
Glu Asp Ser Ile Leu Ala Val Arg Lys Tyr Phe Gln Arg Ile Thr Leu
115 120 125
tac ttg aag gag aaa aag tac tca cca tgt gca tgg gag gtc gtt agg 432
Tyr Leu Lys Glu Lys Lys Tyr Ser Pro Cys Ala Trp Glu Val Val Arg
130 135 140
gct gaa atc atg aga tcc ttt tca ctg tct acc aac ttg cag gaa agc 480
Ala Glu Ile Met Arg Ser Phe Ser Leu Ser Thr Asn Leu Gln Glu Ser
145 150 155 160
ttg aga tcc aaa gag 495
Leu Arg Ser Lys Glu
165
<210> 3
<211> 60
<212> DNA
<213> Pichia Pastoris
<400> 3
gga tcc tcc ggc agc ggt gga tcc tca gga tcg ggt tcc ggt agt agt 48
Gly Ser Ser Gly Ser Gly Gly Ser Ser Gly Ser Gly Ser Gly Ser Ser
1 5 10 15
ggt gga tct ggt 60
Gly Gly Ser Gly
20
<210> 4
<211> 729
<212> DNA
<213> Pichia Pastoris
<400> 4
gat gag cca cca cag tcc cct tgg gac cgt gtt aag gac ctg gca act 48
Asp Glu Pro Pro Gln Ser Pro Trp Asp Arg Val Lys Asp Leu Ala Thr
1 5 10 15
gta tat gtt gac gtg ttg aag gat tca ggc aga gac tac gtt tct caa 96
Val Tyr Val Asp Val Leu Lys Asp Ser Gly Arg Asp Tyr Val Ser Gln
20 25 30
ttc gaa ggt tcc gca cta gga aaa cag ctg aac ttg aaa ctt ttg gac 144
Phe Glu Gly Ser Ala Leu Gly Lys Gln Leu Asn Leu Lys Leu Leu Asp
35 40 45
aat tgg gat tct gtc act tct aca ttt tct aaa cta aga gaa cag tta 192
Asn Trp Asp Ser Val Thr Ser Thr Phe Ser Lys Leu Arg Glu Gln Leu
50 55 60
ggt cca gtt acc caa gag ttc tgg gat aat ctt gaa aaa gaa acc gaa 240
Gly Pro Val Thr Gln Glu Phe Trp Asp Asn Leu Glu Lys Glu Thr Glu
65 70 75 80
ggt ttg aga caa gag atg tct aag gat ttg gag gag gtt aaa gct aag 288
Gly Leu Arg Gln Glu Met Ser Lys Asp Leu Glu Glu Val Lys Ala Lys
85 90 95
gtg caa ccc tac tta gat gac ttt caa aag aaa tgg cag gaa gaa atg 336
Val Gln Pro Tyr Leu Asp Asp Phe Gln Lys Lys Trp Gln Glu Glu Met
100 105 110
gag cta tat cga caa aag gta gaa cca ctt cgt gca gag ctg caa gaa 384
Glu Leu Tyr Arg Gln Lys Val Glu Pro Leu Arg Ala Glu Leu Gln Glu
115 120 125
ggg gcc aga caa aag cta cat gaa ttg caa gag aaa ctg tca cct ttg 432
Gly Ala Arg Gln Lys Leu His Glu Leu Gln Glu Lys Leu Ser Pro Leu
130 135 140
gga gaa gaa atg agg gac cgt gct aga gcc cat gtc gat gca tta cga 480
Gly Glu Glu Met Arg Asp Arg Ala Arg Ala His Val Asp Ala Leu Arg
145 150 155 160
acg cac ctg gcc ccc tac agt gat gag ctc aga caa agg tta gcc gct 528
Thr His Leu Ala Pro Tyr Ser Asp Glu Leu Arg Gln Arg Leu Ala Ala
165 170 175
agg ttg gag gct ctt aag gag aat gga ggt gcc aga ctt gct gag tat 576
Arg Leu Glu Ala Leu Lys Glu Asn Gly Gly Ala Arg Leu Ala Glu Tyr
180 185 190
cat gct aag gct aca gaa cac cta tct aca tta agt gaa aaa gct aag 624
His Ala Lys Ala Thr Glu His Leu Ser Thr Leu Ser Glu Lys Ala Lys
195 200 205
cca gct ctg gag gat ttg aga cag ggc ctt tta cct gtc ttg gaa tcc 672
Pro Ala Leu Glu Asp Leu Arg Gln Gly Leu Leu Pro Val Leu Glu Ser
210 215 220
ttt aag gtg tcc ttc ttg tca gct ttg gaa gag tac act aag aag tta 720
Phe Lys Val Ser Phe Leu Ser Ala Leu Glu Glu Tyr Thr Lys Lys Leu
225 230 235 240
aac acg caa 729
Asn Thr Gln
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ микробиологического синтеза прохимозина быка с использованием рекомбинантного штамма Pichia pastoris, содержащего синтетический ген варианта препрохимозина с модифицированной сигнальной последовательностью секреции | 2020 |
|
RU2779307C2 |
| ШТАММ КЛЕТОК CHO-SE-9/4 - ПРОДУЦЕНТ ХИМЕРНОГО АНТИТЕЛА ПРОТИВ ЭРИТРОПОЭТИНА ЧЕЛОВЕКА И ХИМЕРНОЕ АНТИТЕЛО, ПРОДУЦИРУЕМОЕ ДАННЫМ ШТАММОМ | 2019 |
|
RU2717038C1 |
| Рекомбинатные плазмиды- @ - @ ,кодирующие синтез лейкоцитарного интерферона типа @ - @ человека, и штаммы @ @ / @ - @ - @ -продуценты лейкоцитарного интерферона типа @ -F человека | 1983 |
|
SU1144376A1 |
| ХИМЕРНЫЕ ВАКЦИНЫ НА ОСНОВЕ ВИРУСОВ РОДОВ FLAVIVIRUS И LYSSAVIRUS | 2019 |
|
RU2816136C2 |
| Рекомбинантная плазмидная ДНК pET19b-Surv-OL, обеспечивающая синтез гибридного белка сурвивин-обелин (Surv-OL) и гибридный белок, связываемый анти-сурвивин антителами и обладающий биолюминесцентной активностью | 2021 |
|
RU2770490C1 |
| Антитела против белка р17 ВИЧ-1 субтипа А | 2019 |
|
RU2727673C1 |
| БИОСЕНСОРНАЯ СИСТЕМА ДЛЯ БЫСТРОГО ОБНАРУЖЕНИЯ ОПРЕДЕЛЯЕМЫХ КОМПОНЕНТОВ | 2016 |
|
RU2717658C2 |
| Способ получения секретируемой полностью функциональной фосфолипазы А2 в дрожжах Saccharomyces cerevisiae, белок-предшественник для осуществления этого способа (варианты) | 2019 |
|
RU2728240C1 |
| ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ СИНТЕЗ ГЛИКОПРОТЕИНА G ВИРУСА БЕШЕНСТВА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PVG18-1, КОДИРУЮЩАЯ ГЛИКОПРОТЕИН G ВИРУСА БЕШЕНСТВА, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГЛИКОПРОТЕИНА G ВИРУСА БЕШЕНСТВА | 1991 |
|
RU2008355C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2766586C2 |
Изобретение относится к биотехнологии и фармацевтической промышленности и может быть использовано при создании противовирусных лекарственных препаратов пролонгированного действия. Предложен химерный интерферон alpha2b человека, обладающий противовирусной активностью, имеющий 434 а.о., молекулярную массу 49,360 кДа и SEQ ID NO 1, включающий с N-конца аминокислотную последовательность зрелого интерферона alpha2b человека, имеющего 165 а.о., молекулярную массу 19,268 кДа и SEQ ID NO 2, слитую с С-конца с аминокислотной последовательностью линкера, имеющего 20 а.о., молекулярную массу 1,469 кДа и SEQ ID NO 3, который, в свою очередь, слит с С-конца с аминокислотной последовательностью зрелого аполипопротеина A-I человека, имеющего 243 а.о., молекулярную массу 28,076 кДа и SEQ ID NO 4. Предложены также рекомбинантная плазмидная ДНК pPICZαA:IFNα2b-linker-ApoA-I, обеспечивающая синтез указанного белка в клетках дрожжей Pichia pastoris Х33, рекомбинантный штамм дрожжей Pichia pastoris Х33, трансформированный указанной рекомбинантной плазмидной ДНК, а также предложен способ получения указанного белка. Изобретения обеспечивают получение химерного рекомбинантного интерферона alpha2b человека пролонгированного действия, обладающего высокой биологической активностью. 4 н.п. ф-лы, 7 ил., 7 пр.
1. Химерный интерферон alpha2b человека, 434 а.о., молекулярная масса 49,360 кДа (SEQ ID NO 1), обладающий противовирусной активностью, включающий с N-конца аминокислотную последовательность зрелого интерферона alpha2b человека, 165 а.о., молекулярная масса 19,268 кДа (SEQ ID NO 2), слитую с С-конца с аминокислотной последовательностью линкера, 20 а.о., молекулярная масса 1,469 кДа (SEQ ID NO 3), который, в свою очередь, слит с С-конца с аминокислотной последовательностью зрелого аполипопротеина A-I человека, 243 а.о., молекулярная масса 28,076 кДа (SEQ ID NO 4).
2. Рекомбинантная плазмидная ДНК pPICZαA:IFNα2b-linker-ApoA-I размером 4792 п.о., обеспечивающая синтез в клетках дрожжей Pichia pastoris Х33 химерного интерферона alpha2b человека по п. 1, содержащая промотор гена АОХ-1 размером 940 п.о.; фрагмент гена MFα дрожжей Saccharomyces cerevisiae размером 249 п.о., кодирующий сигнал секреции α-фактора; синтетический ген химерного интерферона alpha2b человека (SEQ ID NO 1) размером 1296 п.о., включающий ген зрелого интерферона alpha2b человека (SEQ ID NO 2), размером 495 п.о., ген линкера размером 60 п.о. (SEQ ID NO 3) и ген зрелого аполипопротеина A-I человека размером 729 п.о. (SEQ ID NO 4); терминатор транскрипции гена АОХ-1 размером 342 п.о.; промотор гена TEF1 размером 412 п.о.; промотор ЕМ7 размером 68 п.о.; ген неомицинтрансферазы размером 375 п.о., обеспечивающий устойчивость к зеоцину; терминатор транскрипции гена CYC1 размером 318 п.о.; ориджин репликации плазмиды pUC размером 674 п.о.
3. Рекомбинантный штамм дрожжей Pichia pastoris X33/pPICZαA:IFNα2b-linker-ApoA-I, полученный путем трансформации дрожжей P. pastoris X 33 линеаризованной плазмидной ДНК pPICZαA:IFNα2b-linker-ApoA-I по п. 2, - продуцент химерного интерферона alpha2b человека по п. 1.
4. Способ получения химерного интерферона alpha2b человека по п. 1, включающий микробиологический синтез этого белка в процессе культивирования штамма дрожжей Pichia pastoris X33/pPICZαA:IFNα2b-linker-ApoA-I по п. 2; осаждение клеток указанного штамма с отделением супернатанта центрифугированием; осаждение из супернатанта химерного интерферона alpha2b человека сульфатом аммония; суспендирование и растворение преципитата данного белка, его очистку методом обращенно-фазовой хроматографии в градиенте ацетонитрила и последующий диализ данного очищенного белка.
| РОМАНОВ В.П | |||
| И ДР | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Всероссийская мультиконференция с международным участием "Биотехнология - медицине будущего", 29 июня - 2 июля 2019 г., г | |||
| Новосибирск, Россия, с | |||
| Парный рычажный домкрат | 1919 |
|
SU209A1 |
| Найдено онлайн: | |||
Авторы
Даты
2022-01-21—Публикация
2020-12-08—Подача