Перекрестная ссылка на связанные заявки
Данная заявка заявляет приоритет по предварительной заявке на патент США № 62/731488, поданной 14 сентября 2018 г., и предварительной заявке на патент США № 62/888320, поданной 16 августа 2019 г., которая полностью включена в настоящий документ ссылкой.
Область техники, к которой относится изобретение
Это изобретение относится к гибридным белкам варианта sPD-1–Fc, полинуклеотидам, кодирующим гибридные белки варианта sPD-1–Fc, способам создания гибридных белков варианта sPD-1–Fc и способам применения гибридных белков варианта sPD-1–Fc, например, при лечении таких заболеваний, как рак, инфекции и т.п.
Предшествующий уровень техники
PD-1 (белок-1 запрограммированной гибели клеток) является важным рецептором иммунной контрольной точки, экспрессируемым активированными Т-клетками и В-клетками. Белок действует как посредник иммуносупрессии. PD-1 экспрессируется на активированных Т-клетках, В-клетках и естественных киллерах (NK). Лигандами для PD-1 являются лиганд 1 белка-1 запрограммированной гибели клеток (PD-L1, альтернативно B7-H1) и лиганд 2 белка-1 запрограммированной гибели клеток (PD-L2, альтернативно B7-DC), которые экспрессируются на многих опухолевых клетках и антиген-презентирующих клетках, таких как моноциты, дендритные клетки (DC) и макрофаги.
PD-1 является представителем суперсемейства иммуноглобулинов (Ig), который включает единственный V-подобный домен Ig во внеклеточной области. Цитоплазматический домен PD-1 включает два тирозина, причем наиболее проксимальный к мембране тирозин расположен внутри иммунорецепторного тирозинового ингибирующего мотива (ITIM). PD-1 ослабляет передачу сигналов рецептора антигена за счет рекрутирования цитоплазматических фосфатаз через свой цитоплазматический домен. Белки PD-1 человека и мыши имеют около 60% идентичности по аминокислотам с сохранением четырех потенциальных сайтов N-гликозилирования и остатков, которые определяют домен Ig-V.
PD-1 действует, чтобы доставить отрицательный сигнал иммунного ответа, когда он индуцируется в Т-клетках. Активация PD-1 посредством избирательного связывания с одним из его лигандов активирует ингибирующий иммунный ответ, который снижает пролиферацию Т-клеток и/или интенсивность и/или продолжительность Т-клеточного ответа. PD-1 также регулирует активность эффекторных Т-клеток в периферических тканях в ответ на инфекцию или прогрессирование опухоли (Pardoll, Nat Rev Cancer, 2012, 12 (4): 252-264).
Эндогенные иммунные контрольные точки, такие как сигнальный путь PD-1, которые обычно прерывают иммунные ответы, чтобы смягчить повреждение коллатеральных тканей, могут использоваться опухолями для того, чтобы избежать разрушения иммунной системой. Взаимодействие между PD-L1 и PD-1 при онкологических заболеваниях может уменьшить количество опухоль-инфильтрующих иммунных клеток и ингибировать иммунный ответ на злокачественные опухолевые клетки. Подавление активации Т-клеток и секреции цитокинов при связывании с PD-1 наблюдалось при нескольких раковых заболеваниях человека (Freeman et al., J Exp Med, 2000, 192(7): 1027-34; Latchman et al, Nat Immunol, 2001, 2(3):261-8). Кроме того, лиганд PD-1, PD-L1, сверхэкспрессируется при многих видах рака, включая рак молочной железы, рак ободочной кишки, рак пищевода, рак желудка, глиому, лейкоз, рак легких, меланому, множественную миелому, рак яичников, рак поджелудочной железы, почечно-клеточную карциному и уротелиальный рак. Также было показано, что пациенты с раком имеют ограниченный или сниженный адаптивный иммунный ответ из-за увеличения взаимодействий PD-1/PD-L1 у иммунных клеток. Это возрастание передачи сигналов активированного PD-1 также наблюдалось у пациентов с вирусными инфекциями. Например, вирусы гепатита B и C могут вызывать сверхэкспрессию лигандов PD-1 на гепатоцитах и активировать передачу сигналов PD-1 в эффекторных Т-клетках. Это, в свою очередь, приводит к истощению Т-клеток и иммунной толерантности к вирусной инфекции (Boni et al., J Virol, 2007, 81: 4215-4225; Golden-Mason et al, J Immunol, 2008, 180: 3637- 3641).
Современные антагонисты PD-1, такие как пидилизумаб, пембролизумаб (Keytruda®) и ниволумаб (Opdivo®), представляют собой антитела, которые нацелены на PD-1 на всех лимфатических клетках организма. Эти антитела обладают наномолярными аффинностями к PD-1, которые слабее, чем взаимодействие между PD-1 и его лигандами в иммунном синапсе, например, на границе раздела между антигенпрезентирующей клеткой и лимфоцитом.
В данной области существует потребность в эффективном терапевтическом лечении на основе белков, которое может облегчить или обратить вспять ингибирование адаптивного иммунитета у пациентов с раковым заболеванием или инфекцией. Настоящее изобретение удовлетворяет эту и другие потребности.
Целью настоящего изобретения является предоставление гибридных белков варианта sPD-1–Fc, имеющих улучшенные свойства (например, повышенную аффинность связывания с PD-L1 и/или PD-L2, и повышенную стабильность белка и т.д.), а также способы создания и применения таких гибридных белков варианта sPD-1–Fc при лечении пациентов с раковыми заболеваниями и/или инфекциями.
Краткое описание изобретения
В настоящем изобретении представлены, среди прочего, гибридные белки варианта sPD-1–Fc, полинуклеотиды, кодирующие гибридные белки варианта sPD-1–Fc, способы создания гибридных белков варианта sPD-1–Fc и способы применения гибридных белков варианта sPD-1–Fc, в частности, для лечения заболевания или расстройства, при котором адаптивная иммунная система подавлена или требуется увеличение величины или уровня иммунного ответа. В некоторых воплощениях гибридные белки варианта sPD-1–Fc можно использовать для лечения рака или хронической вирусной инфекции. В других воплощениях гибридный белок варианта sPD-1–Fc, описанный в настоящем документе, можно использовать в качестве адъювантной терапии для лечения рака.
В одном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, содержащий:
а) домен варианта растворимого PD-1 (sPD-1), включающий аминокислотную замену по сравнению с SEQ ID NO: 1, где указанная аминокислотная замена находится в положении, выбранном из группы, состоящей из 120, 112, 107, 104, 67, 69, 96 и 42;
b) необязательный линкер; и
с) домен Fc.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где гибридный белок Fc включает от N- к С-концу:
а) вариант домена sPD-1;
b) необязательный линкер; и
с) домен Fc.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где гибридный белок Fc включает от N- к С-концу:
а) домен Fc;
b) необязательный линкер; и
в) вариант домена sPD-1.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где вариант домена sPD-1 демонстрирует, по меньшей мере, 95% идентичности с SEQ ID NO: 1.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где вариант домена sPD-1 имеет аминокислотную замену(ы) в одном из указанных положений, двух из указанных положений, трех из указанных положений, четырех из указанных положений, пяти из указанных положений, шести из указанных положений, семи из указанных положений или восьми из указанных положений.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где вариант домена sPD-1 содержит аминокислотную замену, выбранную из группы, состоящей из: A120V, A112I, S107V, G104S, S67G, P69L, N96S и S42G.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где вариант домена sPD-1 включает набор аминокислотных замен, выбранных из группы, состоящей из S42G/S67G/P69L/G104S/S107V./A112I/A120V, S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V, P69L/G104S/S107V/A112I/A120V, S67G/G104S/S107V/A112I/A120V, S6710V/P69SL/G10/A120V, G104S/S107V/A112I/A120V и G104S/S107V/A112I.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где вариант домена sPD-1 включает набор аминокислотных замен S42G/S67G/P69L/G104S/S107V/A112I/A120V.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где вариант домена sPD-1 включает набор аминокислотных замен S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где указанный вариант домена sPD-1 включает набор аминокислотных замен P69L/G104S/S107V/A112I/A120V.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где указанный вариант домена sPD-1 включает набор аминокислотных замен S67G/G104S/S107V/A112I/A120V.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где указанный вариант домена sPD-1 включает набор аминокислотных замен S67G/P69L/G104S/S107V/A112I/A120V.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где указанный вариант домена sPD-1 включает набор аминокислотных замен G104S/S107V/A112I/A120V.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где указанный вариант домена sPD-1 включает набор аминокислотных замен G104S/S107V/A112I.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано в данном документе, где вариант домена sPD-1 имеет SEQ ID NO: 2.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано в данном документе, где вариант домена sPD-1 имеет SEQ ID NO: 3.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано в данном документе, где вариант домена sPD-1 имеет SEQ ID NO: 72.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано в данном документе, где вариант домена sPD-1 имеет SEQ ID NO: 110.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано в настоящем документе, где вариант домена sPD-1 имеет SEQ ID NO: 130.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано в данном документе, где вариант домена sPD-1 имеет SEQ ID NO: 131.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано в данном документе, где вариант домена sPD-1 имеет SEQ ID NO: 138.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где домен Fc представляет собой домен Fc человеческого IgG или вариантный домен Fc из IgG человека.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где домен Fc из IgG человека включает шарнир-CH2-CH3 из IgG4 человека.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где домен Fc представляет собой вариантный домен Fc из IgG человека.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где вариантный домен Fc из IgG человека включает шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P в соответствии с индексом нумерации EU.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где линкер выбран из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где линкер представляет собой GGGGS.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где гибридный белок Fc имеет SEQ ID NO: 5.
В дополнительном аспекте в изобретении предлагается гибридный белок варианта sPD-1–Fc, как описано выше, где гибридный белок Fc имеет SEQ ID NO: 6.
В дополнительном аспекте в изобретении предлагается нуклеиновую кислоту, кодирующую гибридный белок варианта sPD-1–Fc, как описано выше.
В дополнительном аспекте в изобретении предлагается экспрессирующий вектор, содержащий нуклеиновую кислоту, как описано выше.
В дополнительном аспекте изобретение относится к клетке-хозяину, содержащей нуклеиновую кислоту или экспрессирующий вектор, как описано выше.
В дополнительном аспекте в изобретении предлагается способ получения гибридного белка вариант sPD-1–Fc, включающий: a) культивирование клетки-хозяина, как описано выше, в условиях, в которых экспрессируется гибридный белок Fc; и b) выделение гибридного белка Fc.
В дополнительном аспекте в изобретении предлагается способ лечения, уменьшения или предотвращения метастазирования или инвазии опухоли у объекта с онкологическим заболеванием, причем способ включает введение объекту терапевтически эффективной дозы одного или нескольких указанных гибридных белков варианта sPD-1–Fc, как описано выше.
В дополнительном аспекте в изобретении предлагается способ лечения, уменьшения или предотвращения метастазирования или инвазии опухоли у объекта с раком, как описано выше, где раковое заболевание выбрано из группы, состоящей из меланомы, глиомы, лимфомы, миеломы, рак головы и шеи, рак пищевода, рак почки, рак легких, рак молочной железы, рак печени, колоректальный рак, рак желчного пузыря, рак желудка, рак поджелудочной железы, рак предстательной железы, рак шейки матки, рак матки, рак яичников, рак яичек и любая другая солидная злокачественная опухоль.
В дополнительном аспекте в изобретении предлагается способ лечения объекта с инфекцией, где способ включает введение объекту терапевтически эффективной дозы одного или нескольких указанных гибридных белков варианта sPD-1–Fc, как описано выше.
В дополнительном аспекте в изобретении предлагается способ лечения объекта с инфекцией, как описано выше, где инфекция представляет собой грибковую инфекцию, бактериальную инфекцию или вирусную инфекцию.
В дополнительном аспекте в изобретении предлагается способ лечения объекта с инфекцией, как описано выше, где вирусная инфекция выбрана из группы, состоящей из инфекции вируса гепатита B, инфекции вируса гепатита C, инфекции вируса папилломы человека, инфекции вируса иммунодефицита человека (HIV), инфекции Т-лимфотрофного вируса человека (HTLV), инфекции вируса Эпштейна-Барр, инфекции вируса герпеса, инфекции цитомегаловируса и любой другой хронической вирусной инфекции.
В дополнительном аспекте в изобретении предлагается способ лечения, уменьшения или предотвращения метастазирования или инвазии опухоли у объекта с раковым заболеванием, как описано выше, или способ лечения объекта с инфекцией, как описано выше, где эффективная доза один или несколько гибридных белков варианта sPD-1–Fc ингибируют, уменьшают или модулируют передачу сигнала, опосредованную PD-1 дикого типа у объекта.
В дополнительном аспекте в изобретении предлагается способ лечения, уменьшения или предотвращения метастазирования или инвазии опухоли у объекта с раковым заболеванием, как описано выше, или способ лечения объекта с инфекцией, как описано выше, где эффективная доза одного или нескольких гибридных белков Fc усиливают Т-клеточный ответ у объекта.
Краткое описание чертежей
На фиг. 1 схематически показаны домены полипептида PD-1 дикого типа (PD1 WT), версии 1 варианта sPD-1 (PD1 V1), версии 2 варианта sPD-1 (PD1 V2) и IgG4. Область сигнального пептида состоит из остатков с 1 по 20 и выделена курсивом, а внеклеточный домен (ECD) - из остатков с 21 до 170. Мутировавший сайт N-гликозилирования выделен жирным шрифтом и подчеркнут. Остальные мутировавшие остатки выделены жирным шрифтом. Линкеры подчеркнуты двойным подчеркиванием. Нумерация последовательностей начинается с первой аминокислоты области сигнального пептида.
На фиг. 2 представлен результат выравнивания последовательности PD-1 человека, цепи B из 4ZQK и цепи A из 5IUS. Идентичные остатки отмечены синим цветом, остатки, отсутствующие в обеих кристаллических структурах, отмечены красным, остатки, отсутствующие только в 4ZQK, отмечены голубым.
Фиг. 3 представляет собой наложение модели PD-1 человека и кристаллической структуры PD-1/PD-L1 человека (PDBID: 4ZQK). Кристаллические структуры PD-1 и PD-L1 в 4ZQK показаны синим и зеленым цветом, соответственно. 7 остатков (Ser62, Ser87, Pro89, Gly124, Ser127, Ala132 и Ala140 с нумерацией положений, начинающейся с сигнальной области) на PD-1 для мутации показаны оранжевыми палочками, сайт N-гликозилирования (Asn116) показан пурпурными палочками. Нумерация положений начинается с первой аминокислоты области сигнального пептида.
Фиг. 4 показана временная эволюция RMSD положения атомов основной цепи для WT PD-1/PD-L1 (отмечены синим), PD-1/PD-L1 с 3 интерфейсными мутациями (отмечены красным) и PD-1/PD-L1 со всеми 8 интерфейсными мутациями (отмечены зеленым).
Фиг. 5A показаны результаты выравнивания последовательностей PD-L2 человека и PD-L2 мыши (PDBID: 3RNQ, 3BP6 и 3BP5). Идентичность последовательностей PD-L2 человека и PD-L2 мыши составляет около 72%. Фиг. 5B показывает консенсусную модель PD-L2 человека. Идентичные остатки отмечены синим цветом. Остатки в недостающей петле отмечены красным.
Фиг. 6 представлено сравнение области взаимодействия при связывании PD-1 между моделью PD-L2 человека и кристаллической структурой PD-L2 мыши (PDBID: 3BP5). Остатки показаны линиями. Остатки области взаимодействия отмечены зеленым цветом в модели PD-L2 человека (показаны темно-синим). Кристаллическая структура мыши PD-L2 показана розовым цветом.
Фиг. 7 представляет собой наложение модели PD-1/PD-L2 человека и кристаллической структуры PD-1/PD-L2 мыши (PDBID: 3BP5). Модели PD-1 и PD-L2 человека показаны голубым и темно-синим цветом, структуры PD-1 и PD-L2 мыши показаны желтым и розовым цветом, соответственно.
Фиг. 8 показывает аффинность связывания гибридных белков варианта sPD-1–Fc с PD-L1 и PD-L2. Гибридный белок варианта sPD-1- Fc демонстрирует около 10000-кратное улучшение связывания PD-L1 по сравнению с гибридным белком WT PD-1 - Fc («исходный гибридный белок Fc») и около 200-кратное улучшение связывания PD-L2 по сравнению с исходным гибридным белком Fc.
На фиг. 9А показана связывающая активность гибридных белков варианта sPD-1–Fc (т.е. гибридного белка версии 1 варианта sPD-1–Fc и гибридного белка версии 2 варианта sPD-1–Fc) на нокаутированных клетках hPD-L1 MC38. Оба гибридных белка варианта sPD-1–Fc связываются намного лучше, чем группа дикого типа (т.е. группа гибридных белков PD-1 дикого типа—Fc) с нокаутированными клетками MC38-PD-L1. На фиг. 9В показана связывающая активность гибридных белков варианта sPD-1–Fc (т.е. гибридного белка версии 1 варианта sPD-1–Fc и гибридного белка версии 2 варианта sPD-1–Fc) на исходных клетках MC38. Гибридные белки варианта sPD-1- Fc также связываются с исходными клетками MC38, но в меньшей степени.
Фиг. 10 показана активация Т-клеток в присутствии клеток Hep3B-hPD-L1 при инкубации с различными концентрациями мутантов sPD-1, sPD-1 дикого типа и hIgG4. Активность Т-клеток измеряется IFN-β. Планки погрешностей представляют собой среднее значение и стандартное отклонение для трех технических повторов. Эксперимент проводили дважды независимо с РВМС, выделенными от разных доноров.
Фиг. 11A показан гибридный белок версии 2 варианта sPD-1–Fc, демонстрирующий лучшую противоопухолевую активность по сравнению с анти-PD-L1 антителом, о чем свидетельствует уменьшение объема опухоли в группе PD-1-ECD-Fc (т.е. в группе гибридного белка версии 2 варианта sPD-1–Fc) по сравнению с группой положительного контроля (т.е. группой анти-PD-L1 антитела). Фиг. 11B показывает гибридный белок версии 2 варианта sPD-1–Fc, демонстрирующий превосходную противоопухолевую активность по сравнению с анти-PD-L1 антителом, о чем свидетельствует усиленное ингибирование роста опухоли в группе PD-1-ECD-Fc (т.е. в группе гибридного белка версии 2 варианта sPD-1–Fc) по сравнению с группой положительного контроля (то есть группой анти-PD-L1 антитела). Фиг. 11C показывает гибридный белок версии 2 варианта sPD-1–Fc, демонстрирующий превосходную противоопухолевую активность по сравнению с анти-PD-L1 антителом, о чем свидетельствует повышенная выживаемость в группе PD-1-ECD-Fc (т.е. группе гибридного белка версии 2 варианта sPD-1–Fc) по сравнению с группой положительного контроля (т.е. группой анти-PD-L1 антитела). На фиг. 11D показаны относительные изменения массы тела в группах контроля носителя, PD-1-ECD-Fc (т.е. группы гибридного белка версии 2 варианта sPD-1–Fc) и положительного контроля (т.е. группы анти-PD-L1-антитела).
Фиг. 12 показаны шарнирные последовательности IgG1, IgG2, IgG3 и IgG4 человека.
Фиг. 13 показывает, что PD-L2 человека сверхэкспрессируется в клеточных линиях Hep3B и MC38. Положительные клоны отбирали с помощью сортировки клеток с активацией флуоресценции (FACS).
На фиг. 14 показано, что гибридный белок варианта 2 sPD-1–Fc прочно связывается с клетками Hep3b-hPDL2 в белке PD1 и тесте связывания tab1 PDL2 на клетках Hep3b-hPDL2.
Фиг. 15 показан тест активации Т-клеток в совместном культивировании PBMC и Hep3B-OS8-PDL2 4B9.
На фиг. 16 показаны объемы опухолей в разные дни после введения контрольного носителя, гибридного белка варианта 2 sPD-1–Fc или пембролизумаба в модели опухоли in vivo с использованием линии клеток колоректальной опухоли MC38-hPDL2.
На фиг. 17A-17O показаны аминокислотные последовательности зрелого внеклеточного домена (ECD) из PD1 WT (SEQ ID NO: 11) и различных вариантов sPD-1 (SEQ ID NO: 12-139) по сравнению с PD1 WT. Область сигнального пептида, например последовательность, представленная в SEQ ID NO: 7, может быть добавлена перед каждой из последовательностей, показанных на фиг. 17A-17O. Домен линкера, например GGGGS может быть добавлен после каждой из последовательностей, как показано на фиг. 17A-17O. Мутировавший сайт N-гликозилирования выделен жирным шрифтом и подчеркнут. Остальные мутировавшие остатки выделены жирным шрифтом. Мутации в каждой колонии суммированы в таблице 10 с нумерацией последовательностей, начиная с ее зрелой области. На фиг. 17A показаны аминокислотные последовательности PD1 WT (SEQ ID NO: 11) и различных вариантов sPD-1 (SEQ ID NO: 12-19). На фиг. 17В показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 20-28). На фиг. 17C показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 29-37). На фиг. 17D показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 38-46). На фиг. 17E показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 47-55). На фиг. 17F показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 56-64). На фиг. 17G показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 65-73). На фиг. 17H показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 74-82). На фиг. 17I показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 83-91). На фиг. 17J показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 92-100). На фиг. 17K показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 101-109). На фиг. 17L показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 110-118). На фиг. 17М показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 119-127). На фиг. 17N показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 128-136). На фиг. 17O показаны аминокислотные последовательности различных вариантов sPD-1 (SEQ ID NO: 137-139).
На фиг. 18A-18F показана экспрессия Т-клетками PD-L2, PD-L1 и CD8+ в микроматрице тканей человека из опухолей яичников, пищевода, желудка и головного мозга. Фиг. 18A показывает, что репрезентативные изображения микроматрицы тканей из рака яичников, содержащей как нормальные, так и злокачественные образцы (N = 156), были окрашены антителами против PD-L2 человека (серый), против PD-L1 человека (Latchman, Wood et al.) и цитокератина (красный) с помощью флуоресцентной иммуногистохимии. Интенсивность окрашивания каждого образца оценивали в баллах и количественно в соответствии со степенью злокачественности опухоли (вверху справа, PD-L2. Внизу справа, PD-L1). Фиг. 18B показывает репрезентативные изображения нормальных и злокачественных тканей пищевода (N = 72), окрашенные флуоресцентной иммуногистохимией против PD-L2 человека (серый), против PD-L1 человека (Latchman, Wood et al.) и цитокератина (красный). Каждый образец оценивали и количественно оценивали, чтобы показать экспрессию PD-L2 (вверху справа) и PD-L1 (внизу справа) в соответствии с классификацией опухоли. Фиг. 18C показывает репрезентативные изображения микроматрицы тканей рака желудка (N = 76), окрашенных и затем количественно определенных как для экспрессии PD-L2 (вверху справа), так и PD-L1 (внизу справа) на основе классификации опухолей. Фиг. 18D показывает репрезентативные изображения микроматрицы тканей глиобластомы (N = 152), окрашенных и затем количественно определенных для экспрессии PD-L2 (вверху справа) и PD-L1 (внизу справа) на основе классификации опухолей, окрашивание DAPI отмечает присутствие ядер. Фиг. 18E показывает микроматрицу тканей рака яичника, содержащей те же образцы, которые исследованы на фиг. 18A, окрашенных на антитела к CD8 человека (красный) и DAPI (синий) с репрезентативными изображениями, показанными в данном документе. Положительные по CD8 клетки отмечены стрелками, а масштабная метка равна 100 мкм. Фиг. 18F показывает микроматрицу тканей рака пищевода, содержащей те же образцы, которые исследованы на фиг. 18B, окрашенные антителами к CD8 человека (красный) и DAPI (синий) с показанными репрезентативными изображениями. Положительные по CD8 клетки были помечены стрелками, а масштабная метка равна 100 мкм. Каждый образец был определен количественно, показывая количество положительных ядер на поле и графически отображены в соответствии с классификацией опухоли (справа). Все количественные данные были нанесены на график с указанием баллов или количества положительных ядер на образец пациента с вычисленным средним значением и стандартным отклонением. Статистический анализ проводился с помощью однофакторного дисперсионного анализа для сравнения групп обработки. P-значение *=<0,05, **=<0,01 и ***=<0,001.
На фиг. 19A-19D показаны мутанты sPD-1 с превосходной аффинностью связывания с PD-L1 и PD-L2. Фиг. 19A показывает графическую иллюстрацию трех различных стратегий ингибирования передачи сигналов PD-1. Фиг. 19B демонстрирует репрезентативные точечные графики проточной цитометрии, демонстрирующие связывание с помощью дрожжевого дисплея библиотеки мутантов sPD-1 с PD-L1. Клоны с наиболее сильным связыванием с PD-L1 отбирали путем последовательного уменьшения концентрации PD-L1 (сорт 1 - сорт 4) с последующим увеличением времени инкубации (сорт 5 и сорт 6). Фиг. 19C показывает, что кинетику мутантной версии 1 sPD-1 (Topalian, Hodi et al. 2012, N Engl. J. Med. 366 (26): 2443-2454, настоящим полностью включено ссылкой), и связывание PD-1 дикого типа (внизу) с PD-L1 человека определяли с помощью системы поверхностного плазменного резонанса BIAcore. Каждая кривая представляет собой отдельную концентрацию аналита. Фиг. 19D показывает, что кинетику мутантной версии 1 sPD-1 (Topalian, Hodi et al. 2012, N Engl. J. Med. 366 (26): 2443-2454, полностью включено в данный документ ссылкой) и связывание PD-1 дикого типа (внизу) с PD-L2 человека определяли с помощью системы поверхностного плазменного резонанса BIAcore. Каждая кривая представляет собой отдельную концентрацию аналита.
На фиг. 20A-20C показан структурный анализ на основе компьютерного моделирования мутантов sPD-1 в ко-комплексе с PD-L1 и PD-L2 человека. Фиг. 20A демонстрирует на левой панели, что мутация G124S sPD-1 (оранжевый) образует водородную связь с PD-L1 Tyr123 (зеленые и красные палочки). Структура PD-1 дикого типа показана голубым цветом. На правой панели показана мутация A132I, образующая еще одну водородную связь с PD-L1 Gln166. Структура PD-1 дикого типа (голубой), структура мутанта PD-1 (оранжевый). Кристаллическая структура PD-L1 показана розовым цветом, а ко-комплекс PD-L1 с мутантом sPD-1 показан зеленым. На фиг. 20B показано сравнение поверхностной комплементарности мутации A132I. Сайт связывания PD-L1 помечен для выявления поверхности электростатического потенциала. Красный цвет указывает на отрицательный электростатический потенциал, синий - на положительный электростатический потенциал, а серый - на гидрофобные области. PD-1 дикого типа изображен в голубым рисунком и шарами (левая панель); мутантный PD-1 показан оранжевым рисунком и шарами (правая панель). На фиг. 20C показано сравнение поверхностной комплементарности мутации A132I с PD-L2 с такой же цветной аннотацией, что и на фиг. 20B.
На фиг. 21A-21C продемонстрировано, что мутанты sPD-1 показали превосходную способность блокировать опосредованные PD-L1 и PD-L2 активности лиганд-зависимым образом без влияния на жизнеспособность Т-клеток. На фиг. 21А показан клеточный анализ блокирования рецептора, демонстрирующий процентное ингибирование связывания Hep3B-hPD-L1 с биотин-конъюгированным PD-1 дикого типа в конкуренции с PD-1 дикого типа, hIgG4 и мутантами sPD-1. Один из двух показанных в данном документе независимых экспериментов с отдельными точками, представляющими среднее значение двух технических повторов. Фиг. 21B показывает анализ блокирования рецепторов на основе клеток, показывающий процентное ингибирование связывания клеток Hep3B-hPD-L2 с биотин-конъюгированным PD-1 дикого типа в конкуренции с sPD-1 дикого типа, hIgG4 и мутантами sPD-1 версий 1 и 2. Один из двух показанных в данном документе независимых экспериментов с отдельными точками, представляющими среднее значение двух технических повторов. Фиг. 21C показывает пролиферацию Т-клеток с течением времени в присутствии мутанта sPD-1 версии 2 и aPD-1 антитела с добавленным рекомбинантным PD-L1 или без него. Т-клетки, обработанные антигеном CD3/ CD28, использовали в качестве положительного контроля, а необработанные Т-клетки служили в качестве отрицательного контроля. Каждая точка данных показывает среднее значение и стандартное отклонение технического повтора. Эксперимент повторили с Т-клетками, выделенными от другого донора. Статистический анализ проводился с помощью одностороннего дисперсионного анализа для сравнения между группами обработки и повторного дисперсионного анализа для выявления изменений во времени. P-значение *=<0,05, **=<0,01.
На фиг. 22A-22H показано, что мутант sPD-1 ингибирует рост опухоли на мышиных моделях опухолей колоректального рака, меланомы и рака яичников. На фиг. 22A показано биораспределение мутанта sPD-1, меченного Alexa Fluor® 488, изображенное в зависимости от времени. На фиг. 22B показано биораспределение мутанта sPD-1 в сыворотке крови мышей после однократной дозы молекулы в 10 мг/кг, обнаруженной с помощью ELISA против IgG4 человека. Каждая точка данных представляет собой среднее значение двух животных, собранных в один и тот же момент времени. Фиг. 22C показывает рост опухоли с течением времени у мышей C57B/6, инокулированных колоректальным раком MC39-hPD-L2, затем соотнесённый с контролем носителя, мутантным sPD-1 10 мг/кг или пембролизумабом 10 мг/кг. Каждая точка данных представляет собой среднее значение и SEM для отдельной опухоли, измеренной с течением времени. Фиг. 22D показывает рост опухоли с течением времени у мышей C57B/6, инокулированных клетками меланомы B16/OVA, затем обработанных контрольным носителем или мутантом sPD-1 10 мг/кг. Структура PD-1 дикого типа показана голубым цветом. Фиг. 22E показан график выживаемости Каплана-Мейера у мышей C57B/6, ортотопически инокулированных клетками опухоли яичника мыши ID8, обработанными контрольным носителем, блокирующим антителом против αPD-1 мыши 10 мг/кг и мутантом sPD-1 10 мг/кг. Животных умерщвляли при развитии асцита. На фиг. 22F показаны репрезентативные точечные диаграммы проточной цитометрии CD4+ и CD8+ цитотоксических Т-клеток, выделенных из опухоли (верхняя панель) и селезенки (нижняя панель) опухолей меланомы B16/OVA, обработанных контрольным носителем, блокирующим антителом против мышиного αPD-1 10 мг/кг и мутантом sPD-1 10 мг/кг. На фиг. 22G показаны CD8+ Т-клетки, выделенные и проанализированные из опухолей MC38-hPD-L2, обработанных контрольным носителем, блокирующим антителом против PD-1 мыши 10 мг/кг и мутантом sPD-1 10 мг/кг. На фиг. 22H показаны CD4+ Т-клетки, выделенные и проанализированные из опухолей MC38-hPD-L2, обработанных контрольным носителем, блокирующим антителом против PD-1 мыши 10 мг/кг и мутантным sPD-1 10 мг/кг. Статистический анализ проводился с использованием однофакторного дисперсионного анализа для сравнения групп обработки и повторного дисперсионного анализа для выявления изменений, происходящих с течением времени. Для кривых выживаемости рассчитывалась оценка Каплана-Мейера. P-значение *=<0,05, **=<0,01. ***=<0,001.
На фиг. 23A-23E показывает, что мутант sPD-1 способен подавлять рост опухоли в модели рака яичников, которая зависит от PD-L2. На фиг. 23А показано, что опухоли ID8 PD-L1 CRSIPR KO инокулировали мышам PD-L1 KO и окрашивали на экспрессию PD-L1 и PD-L2. Масштабная метка 100 μм. Фиг. 23B показывает, что подкожный рост опухоли с течением времени у мышей C57B/6 PD-L1 KO, инокулированных опухолями ID8 PD-L1 CRSIPR KO, затем обработанными контрольным носителем, блокирующим антителом против мышиного αPD-L1 10 мг/кг и sPD-1 мутант 10 мг/кг. Фиг. 23C показывает общую массу опухолей ID8 PD-L1 CRISPR KO во время прерывания. На фиг. 23D показан анализ выживаемости по Каплану-Мейеру мышей C57B/6 PD-L1 KO, ортотопически инокулированных опухолевыми клетками яичников мыши ID8 PD-L1 CRISPR KO, обработанными контрольным носителем, антителом против мышиного PD-L1 10 мг/кг и мутантом sPD-1 10 мг/кг. Животных умерщвляли при развитии асцита. На фиг. 23E показано ИГХ-окрашивание PD-L1 и PD-L2 в опухолях ID8, обработанных контрольным носителем, блокирующим антителом против мышиного αPD-L1 10 мг/кг и мутантом sPD-1 10 мг/кг. Масштабная метка 100 μм. Статистический анализ проводился с использованием одностороннего дисперсионного анализа для сравнения между группами обработки и повторного дисперсионного анализа для выявления изменений, происходящих с течением времени. Для кривых выживаемости рассчитывалась оценка Каплана-Мейера. P-значение *=<0,05, **=<0,01. ***=<0,001.
На фиг. 24A-24E показано, что экспрессия PD-L1 и PD-L2 положительно коррелирует в образцах опухолей пациентов. На фиг. 24A показан график корреляции Пирсона экспрессии PD-L1 и PD-L2 при раке яичников. На фиг. 24B показан график корреляции Пирсона экспрессии PD-L1 и PD-L2 при раке пищевода. На фиг. 24C показан график корреляции Пирсона экспрессии PD-L1 и PD-L2 при раке желудка. На фиг. 24D показан график корреляции Пирсона экспрессии PD-L1 и PD-L2 в глиобластоме. На фиг. 24E показано ИГХ-окрашивание PD-L1 и PD-L2 человека на нормальной ткани миндалин, демонстрирующее специфический паттерн окрашивания.
На фиг. 25A-25B показана экспрессия CD8 в образцах пациентов с раком яичников и пищевода. На фиг. 25A показано, что образцы рака яичников были количественно определены с помощью количества CD8-положительных ядер на поле и нанесены на график в соответствии с классификацией опухоли. На фиг. 25B показано, что образцы рака пищевода были количественно определены с помощью количества CD8-положительных ядер на поле и нанесены на график в соответствии с классификацией опухоли.
Фиг. 26 показывает сортировку на основе направленной эволюции мутантных клонов, демонстрирующих превосходные характеристики связывания. Первые две сортировки были выполнены путем последовательного уменьшения количества PD-L1, инкубируемого с библиотекой. Сортировка три - сортировка шесть представляли собой скрининги на основе комбинации снижения концентрации лиганда, так и стратегии сортировки по кинетике диссоциации, при которой клоны выделяли на основе способности связывать PD-L1 в присутствии более низкой концентрации лиганда и более длительного времени инкубации в присутствии конкурентов. Проценты на каждой панели соответствуют собранной закрытой субпопуляции.
На фиг. 27A и 27B показан анализ кинетики связывания мутанта V2 sPD-1 с PD-L1 и PD-L2. На фиг. 27A показан анализ связывания мутанта sPD-1 версии 2 с кинетикой связывания с PD-L1 с помощью BIAcore T200 при 25°C. На фиг. 27B показан анализ связывания мутанта sPD-1 версии 2 с кинетикой связывания с PD-L2 с помощью BIAcore T200 при 25°C.
На фиг. 28A-28F показана выработка рекомбинантного белка мутантов sPD-1. Фиг. 28A показывает SDS-PAGE очищенного sPD-1 дикого типа-Fc, полоса 1 в восстанавливающих условиях и полоса 2 – в невосстанавливающих условиях. Фиг. 28B показывает анализ SEC-HPLC очищенного Fc sPD-1 дикого типа и уровни эндотоксина, показанные в таблице ниже. Фиг. 28C показывает SDS-PAGE очищенного мутанта sPD-1 версии 1, полоса 1 в восстанавливающих условиях и полоса 2 – в невосстанавливающих условиях. Фиг. 28D показывает анализ SEC-HPLC очищенного мутанта sPD-1 версии 1 и уровни эндотоксина, показанные в таблице ниже. Фиг. 28E показывает SDS-PAGE очищенного мутанта sPD-1 версии 2, полоса 1 в восстанавливающих условиях и полоса 2 – в невосстанавливающих условиях. Фиг. 28F показывает анализ SEC-HPLC очищенного мутанта sPD-1 версии 2 и уровни эндотоксина, показанные в таблице ниже.
На фиг. 29 показано белковое взаимодействие между мутантом sPD-1 и PD-L1 и анализ комплементарности поверхности и водородной связи для каждой из трех мутаций на границе связывания PD-1 и PD-L1.
Фиг. 30 сравнивает взаимодействие белков для модели PD-1/PD-L2 дикого типа и мутировавшего человека и показывает результаты анализа поверхностной комплементарности и водородной связи для 2 мутаций на границе связывания PD-1 и PD-L2.
На фиг. 31 показан анализ на основе FACs между sPD-1 дикого типа, мутантного PD-1 версии 2 и IgG4 и клетками Hep3B, сверхэкспрессирующими PD-L2.
На фиг. 32A-32E показано подтверждение сверхэкспрессии PD-L2 человека в клетках MC38. На фиг. 32A представлена таблица, показывающая процентное содержание и среднюю интенсивность флуоресценции клеток MC38, экспрессирующих 21 индивидуальный клон PD-L2 человека. Фиг. 32B демонстрирует клетки MC38-hPDL2, показывающие менее 30% популяции, положительной по hPD-L2. Фиг. 32C демонстрирует клетки MC38-hPD-L2, показывающие менее 30%–50% популяции, положительной по hPD-L2. Фиг. 32D демонстрирует клетки MC38-hPD-L2, показывающие 50%–60% популяции, положительной по hPD-L2. Фиг. 32E демонстрирует клетки MC38-hPD-L2, показывающие более 60% популяции, положительной по hPD-L2.
На фиг. 33A и 33B показано подтверждение экспрессии человеческого PD-L2 в клетках Hep3B-OS8 и клетках MC38. Фиг. 33A демонстрирует таблицу, показывающую среднюю интенсивность флуоресценции и процент клеток Hep3B-OS8, трансфицированных 16 клонами кДНК, положительными по сверхэкспрессии PD-L2 человека. Положительные клоны были отсортированы справа от самой низкой эффективности до самой высокой. Ab1 представляет собой антитело против PD-L2 человека, а Ab2 представляет собой контрольный IgG. Фиг. 33B показывает экспрессию PD-L2 на исходных клетках Hep3B, Hep3B-OS8 только с вектором, клетках Hep3B-OS8-hPD-L1 и Hep3B-OS8-hPD-L2 (верхняя панель); и экспрессия PD-L2 на исходных клетках MC38, MC38-hPD-L и MC38-hPD-L2 (нижняя панель). Оранжевая гистограмма показывает положительную экспрессию PD-L2.
На фиг. 34 показана общая масса тела мышей с опухолями MC38-hPD-L1, получавших контрольный носитель, мутант sPD-1 и атезолузумаб в ходе эксперимента. N = 10 для каждой группы лечения. Полоса ошибок представляет собой среднее и стандартное отклонение.
На фиг. 35A-35B показывает иммунный профиль опухолевых NK-клеток и макрофагов в моделях исходной опухоли MC38, обработанных антителом против мышиного PD-1 и мутантом sPD-1. Фиг. 35A показывает процент положительных NK-клеток в опухолях каждого животного, обработанного контрольным носителем (N = 8), антителом против PD-1 мыши (N = 8) и мутантным антителом sPD-1 (N = 10). Показаны отдельные точки данных, среднее значение и стандартное отклонение. Фиг. 35B показывает процент положительных макрофагов в опухолях каждого животного, обработанного контрольным носителем (N = 8), антителом против PD-1 мыши (N = 8) и мутантным антителом sPD-1 (N = 10). Показаны отдельные точки данных, среднее значение и стандартное отклонение.
На фиг. 36A и 36B показано выделение PD-L1-отрицательных клеток после CRISPR-трансфекции PD-L1. На фиг. 36A показаны PD-L1-отрицательные клетки ID8, отсортированные и собранные после трансфекции PD-L1 CRISPR клоном 4 (слева) и клоном 5 (справа). На фиг. 36B показаны PD-L1-отрицательные MC38 PD-L2 сверхэкспрессирующие клетки, отсортированные и собранные после трансфекции PD-L1 CRISPR клоном 4 (слева) и клоном 5 (справа).
На фиг. 37 показано секвенирование пула обогащенной библиотеки sPD-1 из каждого последовательного раунда сортировки. На фиг. 37 показано секвенирование пула обогащенной библиотеки sPD-1 из каждого последовательного раунда сортировки.
На фиг. 38A показана иллюстрированная карта аминокислотных мутаций, присутствующих в исходном клоне мутантного PD-1. Все мутации использовали для создания библиотеки из 128 мутантных клонов sPD-1, которая включает все возможные пермутации 7 мутаций. На фиг. 38B показан список 5 лучших мутантных клонов, выбранных из библиотеки мутантных клонов 128 sPD-1 для дальнейшего анализа связывания.
Фиг. 39A показывает дозозависимую кривую связывания и Kd исходного мутантного sPD-1 с PD-L1. Фиг. 39B показывает дозозависимую кривую связывания и Kd клона #1 с PD-L1. Фиг. 39C показывает дозозависимую кривую связывания и Kd клона # 2 с PD-L1. Фиг. 39D показывает дозозависимую кривую связывания и Kd клона #3 с PD-L1. Фиг. 39E показывает дозозависимую кривую связывания и Kd клона #4. Фиг. 39F показывает дозозависимую кривую связывания и Kd клона #5 с PD-L1.
На фиг. 40А показана иллюстрированная карта аминокислотных мутаций, присутствующих в исходном клоне мутантного PD-1. Все мутации использовали для создания библиотеки из 128 мутантных клонов sPD-1, которая включает все возможные пермутации 7 мутаций. На фиг. 40B показан список из 5 лучших мутантных клонов, выбранных из мутантного клона 128 sPD-1, с указанием Kd против PD-L1 человека.
Фиг. 41A показывает дозозависимую кривую связывания, Kd и Bmax исходного мутанта sPD-1 с PD-L2. Фиг. 41B показывает дозозависимую кривую связывания, Kd и Bmax клона #1 с PD-L2. Фиг. 41C показывает дозозависимую кривую связывания, Kd и Bmax клона #2 с PD-L2. Фиг. 41D показывает дозозависимую кривую связывания, Kd и Bmax клона #3 с PD-L2. Фиг. 41E показывает дозозависимую кривую связывания, Kd и Bmax клона #4 с PD-L2. ФИГ. 41F показывает дозозависимую кривую связывания, Kd и Bmax клона #5 с PD-L2.
Фиг. 42A показывает иллюстрированную карту аминокислотных мутаций, присутствующих в исходном клоне мутантного PD-1. Все мутации использовали для создания библиотеки из 128 мутантных клонов sPD-1, которая включает все возможные пермутации 7 мутаций. ФИГ. 42B показывает список 5 лучших мутантных клонов, выбранных из мутантного клона 128 sPD-1, с перечисленным Kd против PD-L2 человека.
Подробное описание изобретения
Введение
PD-1 представляет собой рецептор ингибиторной клеточной поверхности, участвующий в контроле функции Т-клеток во время иммунитета и толерантности. После связывания со своим лигандом, например, PD-L1 или PD-L2, PD-1 ингибирует эффекторные функции Т-клеток. Структура PD-1 представляет собой однопроходный мембранный белок типа 1. PD-1 кодируется геном рецептора запрограммированной гибели клеток 1 (Entrez Gene ID: 5133). Последовательность (кодирующая) мРНК PD-1 человека приведена, например, в учетном номере Genbank No. NM 005018. Последовательность полипептида PD-1 человека изложена, например, в Genbank Accession No. NP_005009 или UniProt No. Q15116. PD-1 также известен как запрограммированная гибель клеток 1, PDCD1, PD1, CD279, SLEB2, hPD-1 и hSLE-1. Полипептид PD-1 человека дикого типа состоит из 288 аминокислот. Последовательность сигнального пептида состоит из остатков с 1 по 20 (фиг. 1), ECD состоит из остатков с 21 по 170 (фиг. 1), трансмембранный домен - из остатков 171 по 191, а внутриклеточный домен - из остатков с 192 по 288 (в данном документе используется нумерация, которая начинается с области сигнального пептида; как будет понятно специалистам в данной области, нумерация также может быть основана на использовании первой аминокислоты зрелой последовательности в качестве первого положения аминокислоты, как показано в SEQ ID NO: 1 - SEQ ID NO: 6 из таблицы 1; то есть домен ECD также может быть с 1 по 150 и т.д.).
Как известно в данной области, существует ряд терапевтических антител, которые связываются с PD-1, чтобы блокировать связывание PD-1 с рецептором PD-L1 или PD-L2, что приводит к снижению иммунной супрессии для воздействия на иммунную активацию. Эти антитела включают KEYTRUDA® и OPDIVO®, а также ряд других, тестируемых в клинике. Аналогично существуют анти-PD-L1 антитела, которые одобрены как приводящие к аналогичному механизму и терапевтическому эффекту, такие как TECENTRIQ®.
Настоящее изобретение направлено на новый механизм применения ECD из PD-1 человека, включая варианты, для достижения аналогичной биологической функции и терапевтического эффекта. Таким образом, в настоящем изобретении предлагаются гибридные белки. Описанные в данном документе гибридные белки содержат два общих функциональных компонента. Первый компонент включает варианты растворимого ECD из PD-1 человека (далее «вариант sPD-1»). Варианты sPD-1 служат для увеличения аффинности связывания с PD-L1 и/или PD-L2 и/или стабильности белка. Второй компонент - это домен Fc из белка IgG человека, например, человеческий IgG4, чтобы обеспечить значительное увеличение периода полувыведения варианта sPD-1 в виде гибридного белка. Эти два компонента или домена обычно связаны с использованием доменного линкера, такого как линкер глицин-серин, как описано в данном документе, с образованием гибридного белка варианта sPD-1–Fc по настоящему изобретению.
Вариантный домен sPD-1 в данном документе связывается и блокирует/антагонизирует лиганды PD-1, то есть PD-L1 и/или PD-L2, и связан с доменом Fc (необязательно включая шарнирный домен и необязательно другие линкеры) белка IgG человека. Варианты sPD-1 могут действовать как конкурентные антагонисты PD-L1 и/или PD-L2, блокировать путь иммунной контрольной точки PD-1 и предотвращать передачу сигнала через рецептор PD-1. Таким образом, представленные в данном документе композиции и способы блокируют сигналы ингибирования Т-клеток и приводят к иммунно-опосредованной противоопухолевой активности. Кроме того, композиции и способы могут активировать, усиливать или усиливать иммунный ответ у объекта, страдающего инфекцией, например, хронической инфекцией. В настоящем изобретении предлагаются композиции и способы для стимуляции ответа Т-клеток, такие как стимуляция пролиферации Т-клеток, увеличение активации Т-клеток и/или уменьшение сигналов ингибирования Т-клеток у пациентов с раковым заболеванием или инфекцией.
Определения
При использовании в данном документе, следующие термины имеют приписываемые им значения, если не указано иное.
Используемые в данном документе формы единственного включают множественное число, если контекст явно не указывает иное. Таким образом, например, ссылка на «клетку» включает множество таких клеток, а ссылка на «агент» включает ссылку на один или несколько агентов, известных специалистам в данной области, и так далее.
Используемый в данном документе термин «белок» означает, по меньшей мере, две ковалентно связанные аминокислоты, который включает белки, полипептиды, олигопептиды и пептиды.
Термин «выделенный» относится к молекуле, которая по существу свободна от своего естественного окружения. Например, выделенный белок практически не содержит клеточного материала или других белков из клетки или источника ткани, из которого он получен. Термин «выделенный» также относится к препаратам, в которых выделенный белок является достаточно чистым для введения в виде фармацевтической композиции или, по меньшей мере, около на 70-80%, 80-90% или 90-95% (масс./масс.), или, по меньшей мере, около 95%, 96%, 97%, 98%, 99% или 100% (масс./масс.).
Термин «лиганд» относится к биомолекуле, которая способна связываться и образовывать комплекс со второй биомолекулой, такой как рецептор, присутствующий на поверхности клеток-мишеней, для выполнения биологической цели. Лиганд обычно представляет собой эффекторную молекулу, которая связывается с сайтом на целевом белке, например, с помощью межмолекулярных сил, таких как ионные связи, водородные связи, гидрофобные взаимодействия, диполь-дипольные связи или силы Ван-дер-Ваальса. Вариант sPD-1 по настоящему изобретению может связываться и образовывать комплекс с лигандом PD-1, таким как PD-L1 и/или PD-L2.
Термин «рецептор» относится к биомолекуле, присутствующей на поверхности клетки-мишени, которая способна связываться и образовывать комплекс со второй биомолекулой, такой как лиганд. Термин «рецептор» относится к биомолекуле, присутствующей на поверхности клетки-мишени, которая способна связываться и образовывать комплекс со второй биомолекулой, такой как лиганд. PD-L1 и PD-L2 являются примерами рецепторов клеточной поверхности.
Под «положением» в данном описании подразумевается местоположение в последовательности белка. Положения могут нумероваться последовательно или в соответствии с установленным форматом, например, индексом EU. В некоторых воплощениях настоящего изобретения положения нумеруются последовательно, начиная с первой аминокислоты зрелого белка.
Под «модификацией аминокислоты» в данном документе подразумевается аминокислотная замена, инсерция и/или делеция в полипептидной последовательности.
Под «аминокислотной заменой» или «заменой» в данном документе подразумевается замена аминокислоты в конкретном положении в последовательности исходного полипептида другой аминокислотой. В частности, в некоторых воплощениях замена осуществляется на аминокислоту, которая не встречается в природе в конкретном положении, либо не встречается в природе в организме или в каком-либо организме. Например, замена S228P относится к варианту полипептида, в данном случае к варианту Fc IgG4 человека, в котором серин в положении 228 заменен на пролин. Для ясности, белок, который был разработан для изменения кодирующей последовательности нуклеиновой кислоты, но без изменения исходной аминокислоты (например, замена CGG (кодирующего аргинин) на CGA (все еще кодирующей аргинин) для увеличения уровней экспрессии в организме-хозяине) не является «аминокислотной заменой»; то есть, несмотря на создание нового гена, кодирующего тот же белок, если белок имеет ту же аминокислоту в конкретном положении, с которого он начинался, то это не аминокислотная замена.
Под «инсерцией аминокислоты» или «инсерцией» в контексте настоящего описания подразумевается добавление аминокислотной последовательности в конкретное положение в последовательности исходного полипептида. Например, -233E или 233E обозначают инсерцию глутаминовой кислоты после положения 233 и перед положением 234. Кроме того, -233ADE или A233ADE обозначают инсерцию AlaAspGlu после положения 233 и перед позицией 234.
Под «аминокислотной делецией» или «делецией» в контексте настоящего описания подразумевается удаление аминокислотной последовательности в конкретном положении в исходной полипептидной последовательности. Например, E233- или E233 #, E233 () или E233del обозначают делецию глутаминовой кислоты в положении 233. Кроме того, EDA233- или EDA233 # обозначает делецию последовательности GluAspAla, которая начинается в положении 233.
Под «исходным полипептидом» в контексте настоящего описания подразумевается исходный полипептид, который впоследствии модифицируется для создания варианта. Исходный полипептид может представлять собой встречающийся в природе полипептид или вариант или модифицированную версию встречающегося в природе полипептида. Исходный полипептид может относиться к самому полипептиду, композициям, которые содержат исходный полипептид, или к аминокислотной последовательности, которая его кодирует. Соответственно, используемый в данном документе термин «исходный иммуноглобулин» означает немодифицированный полипептид иммуноглобулина, который модифицирован для создания варианта. В этом контексте «исходный домен Fc» будет относиться к приведенному варианту; таким образом, «вариантный домен Fc из IgG человека» сравнивают с исходным доменом Fc из IgG человека, например, «вариантный домен Fc из IgG4 человека» сравнивают с исходным доменом Fc из IgG4 человека и т.д.
Под «диким типом или WT» в данном документе подразумевается аминокислотная последовательность или нуклеотидная последовательность, которая встречается в природе, включая аллельные варианты. Белок WT имеет аминокислотную или нуклеотидную последовательность, которая не была намеренно модифицирована.
Под «вариантным белком», «вариантом белка» или «вариантом» в контексте настоящего описания подразумевается белок, который отличается от такового исходного белка на основании, по меньшей мере, одной модификации аминокислоты. В некоторых воплощениях исходные белки представляют собой последовательности дикого типа человека. В некоторых воплощениях исходные белки представляют собой человеческие последовательности с вариантами. Вариант белка может относиться к самому белку, композиции, содержащей белок, или аминокислотной последовательности, которая его кодирует. Предпочтительно вариант белка имеет, по меньшей мере, одну аминокислотную модификацию по сравнению с исходным белком, например, от около одной до около двадцати аминокислотных модификаций и предпочтительно от около одной до около восьми аминокислотных модификаций по сравнению с исходным. Последовательность варианта белка, представленная в данном документе, предпочтительно будет обладать, по меньшей мере, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью с исходной последовательностью белка, и наиболее предпочтительно идентичность, по меньшей мере, около 90%, более предпочтительно идентичность, по меньшей мере, около 95%/97%/98%/99%. Идентичность последовательностей между двумя подобными последовательностями (например, вариабельными доменами sPD-1) можно измерить с помощью таких алгоритмов, как алгоритм Smith, T.F. & Waterman, M.S. (1981) "Comparison Of Biosequences," Adv. Appl. Math. 2: 482 [алгоритм локальной гомологии]; Needleman, S.B. & Wunsch, CD. (1970) "A General Method Applicable To The Search For Similarities In The Amino Acid Sequence Of Two Proteins," J. Mol. Biol.48: 443 [алгоритм выравнивания гомологии], Pearson, W.R. & Lipman, D.J. (1988) "Improved Tools For Biological Sequence Comparison," Proc. Natl. Acad. Sci. (США) 85: 2444 [метод поиска сходства]; или Altschul, S.F. et al, (1990) "Basic Local Alignment Search Tool," J. Mol. Biol. 215: 403-10, алгоритм «BLAST», см. Https://blast.ncbi.nlm.nih.gov/Blast.cgi. При использовании любого из вышеупомянутых алгоритмов используются параметры по умолчанию (для длины окна, штрафа за открытие разрыва и т.д.). В одном воплощении идентичность последовательности осуществляется с использованием алгоритма BLAST с использованием параметров по умолчанию.
«IgG-вариант» или «вариант IgG» в контексте настоящего описания означает антитело, которое отличается от исходного IgG (опять же, во многих случаях, от последовательности IgG человека), по меньшей мере, одной аминокислотной модификацией.
«Fc-вариант» или «вариант Fc» в контексте настоящего описания означает белок, содержащий, по меньшей мере, одну аминокислотную модификацию по сравнению с исходным доменом Fc. В некоторых воплощениях исходный домен Fc представляет собой последовательность Fc дикого типа человека, такую как область Fc из IgG1, IgG2, IgG3 или IgG4. Таким образом, «вариантный домен Fc из IgG4 человека» представляет собой домен, который содержит модификации аминокислот (обычно аминокислотные замены) по сравнению с доменом Fc из IgG4 человека. Например, S241P или S228P представляет собой вариант шарнира с заменой на пролин в положении 228 относительно исходного полипептида шарнира IgG4, где нумерация S228P соответствует индексу EU, и S241P - нумерации по Kabat. Индекс EU или EU-индекс, как в схеме нумерации Kabat или EU, относится к нумерации EU (см. SEQUENCES OF IMMUNOLOGICAL INTEREST, 5th edition, NIH publication, No. 91-3242, E.A. Kabat et al., полностью включены в настоящее описание ссылкой; и см. также Edelman et al., 1969, Proc Natl Acad Sci USA 63: 78-85, полностью включены в настоящее описание ссылкой). В некоторых воплощениях исходные домены Fc представляют собой последовательности Fc человека с вариантами. Для всех положений, обсуждаемых в настоящем изобретении, которые относятся к домену Fc из IgG человека, если не указано иное, нумерация аминокислотных положений соответствует индексу EU. Модификация может быть добавлением, удалением, заменой или любой их комбинацией, как описано в данном документе. В качестве альтернативы варианты доменов Fc могут иметь от 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных модификаций по сравнению с исходным доменом Fc. Кроме того, как обсуждается в данном документе, варианты доменов Fc в данном документе все еще сохраняют способность образовывать димер с другим доменом Fc, а также связываться с рецептором FcRn, как измерено с использованием известных методов, описанных в данном документе, таких как неденатурирующий гель-электрофорез.
Термин «растворимый PD-1» или «sPD-1» в данном документе означает растворимую часть полипептида белка запрограммированной гибели клеток 1 (PD-1), содержащую внеклеточный домен (ECD) или его фрагмент или укороченную версию, но не трансмембранный домен или цитоплазматический (внутриклеточный) домен PD-1. ECD из PD-1 человека дикого типа показан от остатков 21 - 170 на фиг. 1 и также показана как SEQ ID NO: 1 в таблице 1. В некоторых воплощениях исходный домен sPD-1 дикого типа может иметь N-концевые и/или C-концевые укорочения до тех пор, пока укороченный sPD-1 дикого типа сохраняет биологическую активность, например, связывание с PD-L1 и/или PD-L2.
Термин «вариант sPD-1» относится к варианту sPD-1 дикого типа. Вариант sPD-1 сохраняет специфическое связывание с лигандом PD-1, таким как PD-L1 и/или PD-L2, но имеет аминокислотные замены и может иметь N- или C-концевые усечения по сравнению с sPD- дикого типа. 1. Специфическое связывание в этом случае определяется с помощью стандартного анализа связывания, такого как ELISA, Biacore, Sapidyne KinExA или анализ связывания с помощью проточной цитометрии, которые также можно использовать для определения аффинности связывания. Как обсуждается в данном документе, варианты sPD-1 могут в некоторых случаях иметь повышенную аффинность связывания по сравнению с sPD-1 дикого типа.
Термин «аффинность связывания» относится к способности лиганда или его варианта образовывать координированные связи с белком, например, рецептором или его вариантом. Аффинность связывания между лигандом и белком может быть представлена константой равновесной диссоциации (KD), соотношением koff/kon между лигандом и белком (например, рецептором или его вариантом). KD и аффинность связывания обратно пропорциональны. Например, значение KD относится к концентрации варианта sPD-1, необходимой для связывания с лигандом PD-1, а более низкое значение KD (более низкая концентрация варианта PD-1) соответствует более высокой аффинности связывания для лиганда PD-1. Высокая аффинность связывания соответствует большей межмолекулярной силе между лигандом и белком. Низкая аффинность связывания соответствует более низкой межмолекулярной силе между лигандом и белком. В некоторых случаях увеличение аффинности связывания лиганда может быть представлено как уменьшение скорости диссоциации, например, по меньшей мере, в 10 раз, по меньшей мере, в 20 раз, по меньшей мере, в 50 раз, по меньшей мере, в 100 раз, по меньшей мере, в 200 раз, по меньшей мере, в 500 раз или больше.
Способность варианта sPD-1 связываться с PD-L1 и/или PD-L2 может быть определена, например, по способности предполагаемого лиганда связываться с PD-L1 и/или PD-L2, нанесенных в виде покрытия на планшет для тестирования. В одном воплощении активность связывания вариантов sPD-1 с PD-L1 и/или PD-L2 может быть проанализирована либо путем иммобилизации лиганда, например, PD-L1 и/или PD-L2, либо варианта sPD-1. Например, анализ может включать иммобилизацию PD-L1 и/или PD-L2, слитых с His-меткой, на гранулах Ni-активированной смолы NTA. Агенты могут быть добавлены в соответствующий буфер, и шарики инкубируются в течение определенного периода времени при заданной температуре. После промывок для удаления несвязанного материала связанный белок может быть высвобожден, например, с помощью SDS, буферов с высоким pH и т.п. и проанализирован.
В ином случае аффинность связывания варианта sPD-1 с PD-L1 и/или PD-L2 может быть определена путем презентации варианта sPD-1 на поверхности микробных клеток, например, поверхности дрожжевых клеток, и обнаружения связанного комплекса с помощью, например, проточной цитометрии. Аффинность связывания sPD-1 с лигандами PD-1 может быть измерена с использованием любого известного способа, признанного в данной области, включая, помимо прочего, способ, описанный в примерах, анализы связывания радиоактивного лиганда, анализы связывания нерадиоактивного (флуоресцентного) лиганда, поверхностный плазмонный резонанс (SPR), такой как Biacore™, Octet™, плазмонно-волноводный резонанс (PWR), анализы термодинамического связывания, анализы связывания лигандов целой клеткой и анализы связывания лигандов на основе структуры.
«Специфическое связывание» или «специфически связывается с» или «специфично для» конкретного лиганда или его варианта означает связывание, которое заметно отличается от неспецифического взаимодействия. Специфическое связывание может быть измерено, например, путем определения связывания молекулы по сравнению со связыванием контрольной молекулы, которая в целом является молекулой с похожей структурой, которая не обладает активностью связывания. Например, специфическое связывание может быть определено путем конкуренции с контрольной молекулой, которая похожа на мишень. В некоторых воплощениях аффинность связывания измеряется с использованием анализов из данной области, как обсуждалось выше, таких как стандартный анализ Biacore.
Специфическое связывание с конкретным лигандом или его вариантом может проявляться, например, с белком, имеющим KD для другого белка лиганда, по меньшей мере, около 10-4 М, по меньшей мере, около 10-5 М, по меньшей мере, около 10-6 М, по меньшей мере, около 10-7 М, по меньшей мере, около 10-8 М, по меньшей мере, около 10-9 М, альтернативно, по меньшей мере, около 10-10 М, по меньшей мере, около 10-11 М, по меньшей мере, около 10-12 М, или выше, где KD относится к скорости диссоциации конкретного взаимодействия белок-лиганд. Как правило, белок, который специфически связывает лиганд, будет иметь KD в 20, 50, 100, 200, 500, 1000, 5000, 10000 или более раз больше для контрольной молекулы по сравнению с белком.
Под «остатком» в данном описании подразумевается положение в белке и связанные с ним идентичности аминокислот. Например, аспарагин 297 (также называемый Asn297 или N297) представляет собой остаток в положении 297 в человеческом антителе IgG1.
Под «шарниром» или «шарнирной областью», или «шарнирной областью антитела» или «шарнирным доменом» в данном документе подразумевается гибкий полипептид, содержащий аминокислоты между первым и вторым константными доменами антитела. Структурно домен IgG CH1 заканчивается в положении 215 по EU, а домен IgG CH2 начинается в положении остатка 231 по EU. Таким образом, для IgG шарнир антитела определяется в данном документе как включающий положения от 216 (E216 в IgG1) до 230 (p230 в IgG1), где нумерация соответствует индексу EU, как в Kabat. В некоторых случаях используется «шарнирный фрагмент», который содержит меньше аминокислот на одном или обоих N- и C-концах шарнирного домена. Как указано в данном документе, в некоторых случаях используются домены Fc, включающие шарнир, причем шарнир обычно используется в качестве гибкого линкера. (Кроме того, как дополнительно описано в данном документе, можно использовать дополнительные гибкие линкерные компоненты как с шарниром, так и без него).
Под «Fc», «Fc-областью» или «доменом Fc» в контексте настоящего описания подразумевается полипептид, содержащий домены CH2-CH3 молекулы IgG, а в некоторых случаях включая шарнир. В нумерации EU для человеческого IgG1 домен CH2-CH3 состоит из аминокислот с 231 по 447, а шарнир - с 216 по 230. Таким образом, определение «домен Fc» включает как аминокислоты 231-447 (CH2-CH3), так и 216-447 (шарнир-CH2-CH3), или их фрагменты. Таким образом, Fc относится к двум последним иммуноглобулиновым доменам константной области из IgA, IgD и IgG, последним трем иммуноглобулиновым доменам константной области из IgE и IgM и в некоторых случаях включает гибкий шарнир, расположенный на N-конце относительно этих доменов. Для IgA и IgM Fc может включать J-цепь. Для IgG домен Fc включает домены иммуноглобулина Cγ2 и Cγ3, а в некоторых случаях включает нижнюю шарнирную область между Cγ1 и Cγ2. «Фрагмент Fc» в этом контексте может содержать меньше аминокислот с одного или обоих N- и C-концов, но все же сохраняет способность образовывать димер с другим доменом Fc или фрагментом Fc, что может быть обнаружено стандартными способами, обычно в зависимости от размера (например, неденатурирующая хроматография, эксклюзионная хроматография и т.д.) домены Fc из IgG человека имеют особое применение в настоящем изобретении и могут быть доменом Fc из IgG1, IgG2, IgG3 или IgG4 человека. Как правило, IgG1, IgG2 и IgG4 используются чаще, чем IgG3. В некоторых воплощениях аминокислотные модификации производятся в области Fc, например, для изменения связывания с одним или несколькими рецепторами FcγR или с рецептором FcRn, и/или для увеличения периода полувыведения in vivo.
Под «модификацией подкласса IgG» или «модификацией изотипа» в контексте настоящего описания подразумевается модификация аминокислоты, которая преобразует одну аминокислоту одного изотипа IgG в соответствующую аминокислоту другого выровненного изотипа IgG. Например, поскольку IgG1 содержит тирозин, а IgG2 - фенилаланин в положения 296 по EU, замена F296Y в IgG2 считается модификацией подкласса IgG. Точно так же, поскольку IgG1 имеет пролин в положении 241, а IgG4 содержит там серин, молекула IgG4 с S241P считается модификацией подкласса IgG. Обратите внимание, что модификации подкласса считаются в данном документе аминокислотными заменами.
Под «неприродной модификацией» в данном описании подразумевается модификация аминокислоты, которая не является изотипической. Например, поскольку ни один из IgG не содержит аспарагин в положении 297, замена N297A в IgG1, IgG2, IgG3 или IgG4 (или их гибридах) считается не встречающейся в природе модификацией.
Под «аминокислотой» и «идентичностью аминокислот» в контексте настоящего описания подразумевается одна из 20 встречающихся в природе аминокислот, кодируемых ДНК и РНК.
Под «эффекторной функцией» в контексте настоящего описания подразумевается биохимическое событие, которое является результатом взаимодействия Fc-области антитела с Fc-рецептором или лигандом. Эффекторные функции включают, без ограничения указанным, ADCC, ADCP и CDC. Во многих случаях желательно устранить большую часть или все эффекторные функции, используя либо разные изотипы IgG (например, IgG4), либо аминокислотные замены в домене Fc; однако желательно сохранение связывания с рецептором FcRn, так как это способствует увеличению периода полувыведения гибридного белка в сыворотке крови человека.
Под «гамма-рецептором Fc», «FcγR» или «FcgammaR» в контексте настоящего описания подразумевается любой член семейства белков, которые связываются с Fc-областью антитела IgG и кодируются геном FcγR. У людей это семейство включает, без ограничения указанным, FcγRI (CD64), включая изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включая изоформы FcγRIIa (включая аллотипы H131 и R131), FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2) и FcγRIIc; и FcγRIII (CD16), включая изоформы FcγRIIIa (включая аллотипы V158 и F158) и FcγRIIIb (включая аллотипы FcγRIIb-NA1 и FcγRIIb-NA2) (Jefferis et al., 2002, Immunol Lett 82: 57-65, полностью включено в настоящее описание ссылкой), а также любых неоткрытых человеческих FcγR или изоформ или аллотипов FcγR. FcγR может происходить из любого организма, включая, помимо прочего, людей, мышей, крыс, кроликов и обезьян. FcγR мыши включают, без ограничения указанным, FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16) и FcγRIII-2 (CD16-2), а также любые неоткрытые мышиные FcγR, изоформы или аллотипы FcγR.
Под «FcRn» или «неонатальным Fc-рецептором» в контексте настоящего описания подразумевается белок, который связывает Fc-область антитела IgG и кодируется, по меньшей мере, частично геном FcRn.
Термины «линкер» или «линкерный пептид» в контексте настоящего описания имеют длину, достаточную для связывания двух молекул таким образом, что они принимают правильную конформацию относительно друг друга, так что они сохраняют искомую активность. Линкер или линкерный пептид может преимущественно включать следующие аминокислотные остатки: Gly, Ser, Ala или Thr. В одном воплощении линкер имеет длину от около 1 до 50 аминокислот, предпочтительно от около 1 до 30 аминокислот в длину. В одном воплощении могут использоваться линкеры длиной от 1 до 20 аминокислот, причем в некоторых воплощениях можно использовать от около 4 до около 10 аминокислот. Полезные линкеры включают полимеры глицин-серин, включая, например, (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n является целым числом, равным, по меньшей мере, одному (и обычно от 3 до 4), глицин-аланиновые полимеры, аланин-сериновые полимеры и другие гибкие линкеры. В ином случае множество небелковых полимеров, включая, помимо прочего, полиэтиленгликоль (PEG), полипропиленгликоль, полиоксиалкилены или сополимеры полиэтиленгликоля и полипропиленгликоля, могут найти применение в качестве линкеров.
В некоторых воплощениях линкер представляет собой «линкер домена», используемый для связывания любых двух доменов, как описано в данном документе, вместе, например, для связывания вариантного домена sPD-1 с (вариантным) доменом Fc. Хотя можно использовать любой подходящий линкер, во многих воплощениях используется глицин-сериновый полимер, включая, например, (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n является целым числом, по меньшей мере, 1 (и обычно от 3 до 4 до 5), а также любую пептидную последовательность, которая позволяет рекомбинантное присоединение двух доменов с достаточной длиной и гибкостью, чтобы позволить каждому домену сохранять свою биологическую функцию. Как обсуждается в данном документе, особенно полезным линкером домена является линкер GGGGS, присоединенный к шарнирному домену IgG4.
Под «клеткой-мишенью» в контексте настоящего описания подразумевается клетка, которая экспрессирует целевой полипептид или белок.
Под «клеткой-хозяином» в контексте продуцирования гибридных белков вариант sPD-1–Fc согласно настоящему изобретению подразумевается клетка, которая содержит экзогенные нуклеиновые кислоты, кодирующие компоненты гибридного белка варианта sPD-1–Fc, и способна экспрессии такого гибридного белка Fc в подходящих условиях. Подходящие клетки-хозяева описаны ниже.
Под «улучшенной активностью» или «улучшенной функцией» в данном документе подразумевается искомое изменение, по меньшей мере, одного биохимического свойства. Улучшенная функция в этом контексте может быть измерена как процентное увеличение или уменьшение конкретной активности или как «кратное» изменение с увеличением искомых свойств (например, повышение аффинности связывания и/или специфичности к PD-L1 и/или PD-L2, повышенная стабильность гибридного белка, увеличенный период полувыведения in vivo и т.д.). В общем, процентные изменения используются для описания изменений биохимической активности менее 100%, а кратные изменения используются для описания изменений биохимической активности более чем на 100% (по сравнению с исходным белком). В настоящем изобретении могут быть выполнены процентные изменения (обычно увеличение) биохимической активности, по меньшей мере, на около 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98% и 99%. В настоящем изобретении измеряется «кратное увеличение» (или уменьшение) по сравнению с исходным белком. Во многих воплощениях улучшение составляет, по меньшей мере, 1,1 раз (1,1), 1,5 (1,5 раза), 2 раза, 3 раза, 4 раза, 5 раза, 6 раза, 7 раза, 8 раза, 9 раза, 10 раз, 50 раз, 100 раз, 200 раз или выше. Например, как показано на фиг. 8, гибридный белок варианта sPD-1–Fc продемонстрировал около 10000-кратное улучшение связывания PD-L1 по сравнению с исходным гибридным белком WT PD-1–Fc («гибридный белок с исходным Fc») и около 200-кратное улучшение связывания с PD-L2 по сравнению с гибридным белком с исходным Fc.
Растворимые гибридные белки варианта PD-1–Fc
Как описано в данном документе, растворимые гибридные белки варианта PD-1–Fc («гибридный белок варианта sPD-1–Fc») по изобретению содержат вариант домена sPD-1, домен Fc и, необязательно, линкер, связывающий вариант домена sPD-1 с доменом Fc.
Как описано в данном документе, формат слитого белка может принимать несколько конфигураций с порядком переключения компонентных доменов в белке (от N- к C-концу). В одном воплощении гибридный белок содержит от N- к С-концу вариантный вариант домена sPD-1-линкерный домен-домен Fc. В некоторых воплощениях гибридный белок содержит от N- к С-концу домен Fc-линкерный домен-вариант домена sPD-1. В некоторых воплощениях линкер не используется, и в этом случае гибридный белок содержит от N- к С-концу либо вариант домена sPD-1–домен Fc, либо домен Fc–вариант домена sPD-1. Обратите внимание, что в некоторых случаях один и тот же гибридный белок может быть помечен несколько иначе. Например, в случае, когда домен Fc включает шарнирный домен, гибридный белок, содержащий вариант домена sPD-1-домен Fc, все еще включает линкер в форме шарнирного домена. В ином случае, этот же белок может не иметь шарнирного домена, включенного в домен Fc, и в этом случае гибридный белок содержит вариант домена sPD-1–CH2-CH3.
В ином случае этот же белок может не иметь шарнирного домена, включенного в домен Fc, и в этом случае гибридный белок содержит вариант домена sPD-1–CH2-CH3.
В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, как описано выше, где домен Fc содержит шарнирный домен, а вариант домена sPD-1 связан с доменом Fc с помощью дополнительного линкера, как описано в данном документе. Таким образом, гибридный белок может представлять собой, от N- к С-концу, вариант домена sPD-1 -линкерный домен-шарнирный домен -CH2-CH3; вариант домена sPD-1-линкерный домен -CH2-CH3; шарнирный домен-CH2-CH3-линкерный домен -вариант домена sPD-1 или CH2-CH3-линкерный домен -вариант sPD-1.
В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, как описано выше, где домен Fc не содержит шарнирного домена, а вариант домена sPD-1 связан с доменом Fc с помощью линкерного домена (например, без шарнира), как описано в данном документе.
Варианты доменов sPD-1
Варианты доменов sPD-1 по изобретению включают растворимый ECD из PD-1 человека с вариантами. Варианты sPD-1 служат для увеличения аффинности связывания и/или специфичности к PD-L1 и/или PD-L2 по сравнению с PD-1 дикого типа, как определено анализами аффинности связывания в данной области техники, такими как анализ Biacore.
В некоторых воплощениях варианты sPD-1 по настоящему изобретению являются антагонистами, которые связываются и блокируют лиганд PD-1 (например, PD-L1 и/или PD-L2) и тем самым препятствуют связыванию лиганда с его рецептором PD-1. Антагонисты могут усиливать иммунный ответ путем ингибирования пути передачи сигнала, опосредованного PD-1, посредством уменьшения количества лиганда, доступного для связывания рецептора PD-1. Таким образом, объект может вызвать более устойчивый иммунный ответ.
В некоторых случаях полезный вариант домена sPD-1 специфически связывается с PD-L1 и/или PD-L2 на клетке-мишени, например, на раковой клетке, и тем самым уменьшает (например, блокирует, предотвращает и т.д.) взаимодействие между PD-L1/PD-L2 и PD-1 (например, PD-1 дикого типа на иммунной клетке, например, на Т-клетке). Таким образом, предложенный в данном документе вариант sPD-1 может действовать как сконструированный рецептор-ловушка для PD-L1 и/или PD-L2. Уменьшая взаимодействие между PD-L1 и/или PD-L2 и PD-1 дикого типа, вариант домена sPD-1 может снижать иммунные ингибирующие сигналы, производимые взаимодействием PD-L/PD-1, и, следовательно, может увеличивать иммунный ответ (например, за счет увеличения активации Т-клеток). Подходящий вариант домена sPD-1 может включать часть PD-1, которая достаточна для связывания лиганда PD-1 с узнаваемой аффинностью, например, высокой аффинностью, которая обычно находится между сигнальной последовательностью и трансмембранным доменом или его фрагментом, который сохраняет связывающую активность.
Названия обозначенных белков/доменов белков и соответствующих аминокислотных последовательностей SEQ ID NO: 1 - SEQ ID NO: 10 перечислены в таблице 1, соответственно.
Таблица 1. SEQ ID номера, описания и соответствующие аминокислотные последовательности
(Описание)
(sPD-1 WT ECD)
(ECD версии 1 варианта sPD-1)
(ECD версии 2 варианта sPD-1)
(PD-1 WT ECD + доменный линкер + гибридный белок Fc)
(ECD версии 1 варианта sPD-1 + доменный линкер + гибридный белок Fc)
(ECD версии 2 варианта sPD-1 + доменный линкер + гибридный белок Fc)
(сигнальная область PD-1 WT)
(сигнальная область PD-1 WT + PD-1 WT ECD + доменный линкер + гибридный белок Fc)
(сигнальная область PD-1 WT + ECD версии 1 варианта sPD-1 + доменный линкер + гибридный белок Fc)
(сигнальная область PD-1 WT + ECD версии 2 варианта sPD-1 + доменный линкер + гибридный белок Fc)
В некоторых воплощениях варианты sPD-1 включают аминокислотные замены, делеции или инсерции или любую их комбинацию в домене PD-1 WT, как указано в SEQ ID NO: 1, что увеличивает или усиливает его активность связывания с PD-L1, PD-L2 или оба по сравнению с PD-1 дикого типа.
Настоящее изобретение предлагает домены вариантов sPD-1, содержащие, по меньшей мере, одну аминокислотную замену в одном или более (например, нескольких) положениях, соответствующих положениям 120, 112, 107, 104, 67, 69, 96 и 42, по сравнению с диким типом исходного домена PD-1 из SEQ ID NO: 1 с использованием нумерации, начинающейся со зрелой области. В некоторых воплощениях вариант sPD-1 имеет, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99%, но менее 100% идентичности с последовательностью с исходным доменом PD-1. В некоторых воплощениях исходный домен PD-1 представляет собой SEQ ID NO: 1. В предпочтительном воплощении вариант домена sPD-1 имеет, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99%, но менее 100% идентичности последовательности с SEQ ID NO: 1. В некоторых воплощениях, как отмечено в данном документе, вариант домена sPD-1 может иметь N-концевые и/или C-концевые укорочения по сравнению с sPD-1 дикого типа, пока укороченный вариант sPD-1 сохраняет биологическую активность (например, связывание с PD- L1 и/или PD-L2). Для ясности, варианты sPD-1 по изобретению содержат, по меньшей мере, одну аминокислотную замену и, следовательно, не имеют SEQ ID NO: 1.
Настоящее в изобретении предлагается домены вариантов sPD-1, содержащие, по меньшей мере, одну аминокислотную замену в одном или нескольких (например, нескольких) положениях, соответствующих положениям 42, 67, 69, 96, 104, 107, 112 и 120, по сравнению с диким типом исходного домена PD-1 ECD SEQ ID NO: 1.
В некоторых воплощениях вариант домена sPD-1 имеет аминокислотные замены в одном из указанных положений, двух из указанных положений, трех из указанных положений, четырех из указанных положений, пяти из указанных положений, шести из указанных положений, семи из указанных положений или восьми из указанных положений, как показано в таблице 10.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие одну или несколько аминокислотных замен, выбранных из группы, состоящей из: A120V, A112I, S107V, G104S, S67G, P69L, N96S и S42G по сравнению с SEQ ID NO: 1.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие набор аминокислотных замен, выбранных из группы, состоящей из S42G/S67G/P69L/G104S/S107V/A112I/A120V, S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V, S42G/S67G, S42G/P69L, S42G/G104S, S42G/S107V, S42G/A112I, S42G/A120V, S67G/P69L, S67G/G104S, S67G/S107V, S67G/A112I, S67G/A112I P69L/G104S, P69L/S107V, P69L/A112I, P69L/A120V, G104S/S107V, G104S/A112I, G104S/A120V, S107V/A112I, S107V/A120V, A112I/A120V, S42GL/S67G/P67GL/S67G/P67 G104S, S42G/S67G/S107V, S42G/S67G/A112I, S42G/S67G/A120V, S42G/P69L/G104S, S42G/P69L/S107V, S42G/P69L/A112I, S42G/P69L/A120V10, S42G/S42G/S42G/P69L/A120V10, S42G/S42G S42G/G104S/A112I, S42G/G104S/A120V, S42G/S107V/A112I, S42G/S107V/A120V, S42G/A112I/A120V, S67G/P69L/G104S, S67G/P69L/S107VL, S67G12/P69 P69L/A120V, S67G/G104S/S107V, S67G/G104S/A112I, S67G/G104S/A120V, S67G/S107V/A112I, S67G/S107V/A120V, S67G/A112I/A120V/P69L10 G104S/S69L/G104S/S69 A112I, P69L/G104S/120V, P69L/S107V/A11 2I, P69L/S107V/120V, P69L/A112I/A120V, G104S/S107V/A112I, G104S/S107V/A120V, G104S/A112I/A120V, S107V/A112I/A120V, S42G/S67G/P69L/G104G/G104G P69L/S107V, S42G/S67G/P69L/A112I, S42G/S67G/P69L/A120V, S42G/S67G/G104S/S107V, S42G/S67G/G104S/A112I, S42G/S67G/G104S/A120V67/S42G/S42G/G104S/A120V67/S42G A112I, S42G/S67G/S107V/A120V, S42G/S67G/A112I/A120V, S42G/P69L/G104S/S107V, S42G/P69L/G104S/A112I, S42G/P69L/G104S/A120V, S12 S42G10/PV69/PV69 S42G/P69L/S107V/A120V, S42G/P69L/A112I/A120V, S42G/G104S/S107V/A112I, S42G/G104S/S107V/A120V, S42G/G104S/A112I/A120V/S42G12/S107GV/A1 P69L/G104S/S107V, S67G/P69L/G104S/A112I, S67G/P69L/G104S/A120V, S67G/P69L/S107V/A112I, S67G/P69L/S107V/A120V, S67G/P69L/A112S/A120 S107V/A112I, S67G/G104S/S107V/A120V, S67G/G104S/A112I/A120V, S67G/S107V/A112I/A120V, P69L/G104S/S107V/A112I, P69L/G104S/S104S69/A120V A120V, P69L/S107V/A112I/A120V, G104S/S107V/A112I/A120V, S42G/S67G/P69L/G104S/S107V, S42G/S67G/P69L/G104S/A112I, S42G/S67G/P69 L/G104S/A120V, S42G/S67G/P69L/S107V/A112I, S42G/S67G/P69L/S107V/A120V, S42G/S67G/P69L/A112I/A120V, S42G/S67G/G104S/S107V/A112I67, S107V/A112I67 G104S/S107V/A120V, S42G/S67G/G104S/A112I/A120V, S42G/S67G/S107V/A112I/A120V, S42G/P69L/G104S/S107V/A112I, S42G/P69L/G104S/P107V/A1 G104S/A112I/A120V, S42G/P69L/S107V/A112I/A120V, S42G/G104S/S107V/A112I/A120V, S67G/P69L/G104S/S107V/A112I, S67G/P69L/G104S/S107V/A1 G104S/A112I/A120V, S67G/P69L/S107V/A112I/A120V, S67G/G104S/S107V/A112I/A120V, P69L/G104S/S107V/A112I/A120V, S42G/S67G/P69L/G104G/A112 S67G/P69L/G104S/S107V/A120V, S42G/S67G/P69L/G104S/A112I/A120V, S42G/S67G/P69L/S107V/A112I/A120V, S42G/S67G/G104S/S107V/A112IG/A120 G104S/S107V/A112I/A120V и S67G/P69L/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1. В некоторых воплощениях настоящее в изобретении предлагается гибридный(ые) белок(белки) вариант sPD-1 с Fc, содержащий домен(ы) варианта sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие набор аминокислотных замен, выбранных из группы, состоящей из S42G/S67G/P69L/G104S/S107V/A112I/A120V, S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V, P69L/G104S/S107V/A112I/A120V, S67G/G104S/S107V/A112I/A120V, S67G/P69L/G104S/S107V/A112I/A120V, G104S/S107V20V/S107V/S107V/S107V/A112/A112I по сравнению с SEQ ID NO: 1. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки вариант sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие аминокислотные замены S42G/S67G/P69L/G104S/S107V/A112I/A120V, по сравнению с SEQ ID NO: 1; и гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как раскрыто в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие аминокислотные замены S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V, по сравнению с SEQ ID NO: 1; и гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как раскрыто в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие аминокислотные замены P69L/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1; и гибридные белки варианта sPD-1 с Fc, содержащие вариант домена sPD-1, как раскрыто в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие аминокислотные замены S67G/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1; и гибридные белки варианта sPD-1 с Fc, содержащие вариант домена sPD-1, как раскрыто в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие аминокислотные замены S67G/P69L/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1; и гибридные белки варианта sPD-1 с Fc, содержащие вариант домена sPD-1, как раскрыто в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие аминокислотные замены G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1; и гибридные белки варианта sPD-1 с Fc, содержащие вариант домена sPD-1, как раскрыто в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагаются домены варианта sPD-1, содержащие аминокислотные замены G104S/S107V/A112I, по сравнению с SEQ ID NO: 1; и гибридные белки варианта sPD-1 с Fc, содержащие вариант домена sPD-1, как раскрыто в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагается вариант домена sPD-1, имеющий SEQ ID NO: 2, и гибридные белки варианта sPD-1 с Fc, содержащие SEQ ID NO: 2, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагается вариант домена sPD-1, имеющий SEQ ID NO: 3, и гибридные белки варианта sPD-1 с Fc, содержащие SEQ ID NO: 3, необязательный линкер и домен Fc.
В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, имеющие SEQ ID NO: 5.
В некоторых воплощениях настоящего изобретения предлагаются гибридные белки варианта sPD-1–Fc, имеющие SEQ ID NO: 6.
В некоторых воплощениях вариант домена sPD-1 содержит аминокислотную замену серина в положении 42 с нумерацией положений, начинающейся со зрелой области. В некоторых воплощениях замена производится на любую другую из 19 встречающихся в природе аминокислот, треонин, аспарагин, глутаминовую кислоту, глутамин, аспарагиновую кислоту, лизин, аргинин, гистидин, цистеин, глицин, аланин, изолейцин, лейцин, метионин, пролин, фенилаланин, триптофан, валин и тирозин, в некоторых воплощениях не используются цистеин (из-за возможного образования дисульфида) или пролин (из-за стерических эффектов). В некоторых воплощениях аминокислотная замена представляет собой S42G. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях вариант домена sPD-1 содержит аминокислотную замену серина в положении 67 с нумерацией положений, начиная с зрелой области. В некоторых воплощениях замена производится на любую другую из 19 встречающихся в природе аминокислот, треонин, аспарагин, глутаминовую кислоту, глутамин, аспарагиновую кислоту, лизин, аргинин, гистидин, цистеин, глицин, аланин, изолейцин, лейцин, метионин, пролин, фенилаланин, триптофан, валин и тирозин, в некоторых воплощениях не используются цистеин (из-за возможного образования дисульфида) или пролин (из-за стерических эффектов). В некоторых воплощениях аминокислотная замена представляет собой S67G. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях вариант домена sPD-1 содержит аминокислотную замену пролина в положении 69 с нумерацией положений, начинающейся со зрелой области. В некоторых воплощениях замена производится на любую другую из 19 встречающихся в природе аминокислот, серин, треонин, аспарагин, глутаминовую кислоту, глутамин, аспарагиновую кислоту, лизин, аргинин, гистидин, цистеин, глицин, аланин, изолейцин, лейцин, метионин, пролин, фенилаланин, триптофан, валин и тирозин, в некоторых воплощениях не используется цистеин (из-за возможного образования дисульфида). В некоторых воплощениях аминокислотная замена представляет собой P69L. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях вариант домена sPD-1 содержит аминокислотную замену аспарагина в положении 96 с нумерацией положений, начинающейся со зрелой области. В некоторых воплощениях замена производится на любую другую из 19 встречающихся в природе аминокислот, серин, треонин, глутаминовая кислота, глутамин, аспарагиновую кислоту, лизин, аргинин, гистидин, цистеин, глицин, аланин, изолейцин, лейцин, метионин, пролин, фенилаланин, триптофан, валин и тирозин, в некоторых воплощениях не используются цистеин (из-за возможного образования дисульфида) или пролин (из-за стерических эффектов). В некоторых воплощениях аминокислотная замена представляет собой N96S. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях вариант домена sPD-1 содержит аминокислотную замену глицина в положении 104 с нумерацией положений, начинающейся со зрелой области. В некоторых воплощениях замена осуществляется любой другой из 19 встречающихся в природе аминокислот, серин, треонин, аспарагин, глутаминовую кислоту, глутамин, аспарагиновую кислоту, лизин, аргинин, гистидин, цистеин, аланин, изолейцин, лейцин, метионин, пролин, фенилаланин, триптофан, валин и тирозин, в некоторых воплощениях не используются цистеин (из-за возможного образования дисульфида) или пролин (из-за стерических эффектов). В некоторых воплощениях аминокислотная замена представляет собой G104S. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях вариант домена sPD-1 содержит аминокислотную замену серина в положении 107 с нумерацией положений, начинающейся со зрелой области. В некоторых воплощениях замена производится на любую другую из 19 встречающихся в природе аминокислот, треонин, аспарагин, глутаминовую кислоту, глутамин, аспарагиновую кислоту, лизин, аргинин, гистидин, цистеин, глицин, аланин, изолейцин, лейцин, метионин, пролин, фенилаланин, триптофан, валин и тирозин, в некоторых воплощениях не используются цистеин (из-за возможного образования дисульфида) или пролин (из-за стерических эффектов). В некоторых воплощениях аминокислотная замена представляет собой S107V. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях вариант домена sPD-1 содержит аминокислотную замену аланина в положении 112 с нумерацией положений, начинающейся со зрелой области. В некоторых воплощениях замена производится любой другой из 19 встречающихся в природе аминокислот, серин, треонин, аспарагин, глутаминовую кислоту, глутамин, аспарагиновую кислоту, лизин, аргинин, гистидин, цистеин, глицин, изолейцин, лейцин, метионин, пролин, фенилаланин, триптофан, валин и тирозин, в некоторых воплощениях не используются цистеин (из-за возможного образования дисульфида) или пролин (из-за стерических эффектов). В некоторых воплощениях аминокислотная замена представляет собой A112I. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях вариант домена sPD-1 содержит аминокислотную замену аланина в положении 120 с нумерацией положений, начиная с зрелой области. В некоторых воплощениях замена производится любой другой из 19 встречающихся в природе аминокислот, серин, треонин, аспарагин, глутаминовую кислоту, глутамин, аспарагиновую кислоту, лизин, аргинин, гистидин, цистеин, глицин, изолейцин, лейцин, метионин, пролин, фенилаланин, триптофан, валин и тирозин, в некоторых воплощениях не используются цистеин (из-за возможного образования дисульфида) или пролин (из-за стерических эффектов). В некоторых воплощениях аминокислотная замена представляет собой A120V. В некоторых воплощениях настоящее в изобретении предлагается гибридные белки варианта sPD-1–Fc, содержащие вариант домена sPD-1, как описано в данном документе, необязательный линкер и домен Fc.
В некоторых воплощениях вариант белка sPD-1 короче, чем полноразмерный ECD. В некоторых воплощениях варианты sPD-1 могут содержать укороченную версию ECD до тех пор, пока укороченная форма сохраняет способность связывать человеческий PD-L1 и/или PD-L2, как измерено с помощью одного из анализов связывания, описанных в данном документе. Как известно в данной области, возможны укорочения как с N-, так и с С-конца, например, от около 1, 5, 10, 15, 20, 25, 30, 33, 35, 40, 45 или 50 остатков до около 130, 135, 140, 145, 149 или 150 остатков из SEQ ID NO: 1, например, 33-150 остатков. В некоторых случаях только несколько аминокислот (например, 1, 2, 3, 4, 5 или 6) удаляются с одного или обоих из N- и C-конца, пока сохраняется активность.
В некоторых воплощениях вариант sPD-1, описанный в настоящем документе, имеет аффинность связывания с лигандом PD-1 (т.е. PD-L1 и/или PD-L2), которая лучше, чем полипептид/домен PD-1 дикого типа. В некоторых воплощениях варианты sPD-1 обладают аффинностью связывания с PD-L1 и/или PD-L2, которая составляет, по меньшей мере, 1-кратную, 2-кратную, 3-кратную, 4-кратную, 5-кратную, 10-кратную, 50-кратную, 100-кратную, 200-кратную или более, чем у PD-1 дикого типа. В некоторых воплощениях варианты sPD-1 могут иметь аффинность связывания с PD-L1, которая составляет, по меньшей мере, 1-кратную, 2-кратную, 3-кратную, 4-кратную, 5-кратную, 10-кратную, 50-кратную, 100-кратную, 200-кратную или более, чем у PD-1 дикого типа. В некоторых воплощениях варианты sPD-1 могут иметь аффинность связывания с PD-L2, которое составляет, по меньшей мере, 1-кратную, 2-кратную, 3-кратную, 4-кратную, 5-кратную, 10-кратную, 50-кратную, 100-кратную, 200-кратную или более, чем у PD-1 дикого типа.
В некоторых воплощениях аффинность связывания варианта sPD-1 с PD-L1, PD-L2 или обоими увеличивается, по меньшей мере, на около 0,5%, 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% или более по сравнению с PD-1 дикого типа. В других воплощениях варианты sPD-1 по настоящему изобретению имеют аффинность связывания менее чем около 1 x 10-8 M, 1 x 10-9 M, 1 x 10-10 M или 1 x 10-12 M к PD-L1 и/или PD-L2. Варианты sPD-1 по настоящему изобретению могут иметь аффинность связывания менее чем около 1 × 10-8 М, 1 × 10-9 М, 1 × 10-10 М или 1 × 10-12 М к PD-L1. Варианты sPD-1 по настоящему изобретению могут иметь аффинность связывания менее чем около 1 × 10-8 М, 1 × 10-9 М, 1 × 10-10 М или 1 × 10-12 М к PD-L2. В других воплощениях варианты sPD-1 ингибируют или конкурируют за связывание PD-1 дикого типа с PD-L1 и/или PD-L2 in vivo или in vitro, либо в обоих случаях.
В некоторых воплощениях вариант sPD-1 имеет период полувыведения диссоциации для PD-L1 и/или PD-L2, который является 2-кратным или более (например, 5-кратным или более, 10-кратным или более, 100-кратным или более, 500-кратным или более, 1000-кратным или более, 5000-кратным или более, 10000-кратным или более и т.д.), больше, чем период полувыведения диссоциации с PD-L1 для PD-1 дикого типа.
Домены Fc
Как обсуждалось в данном документе, в дополнение к описанным выше доменам варианта sPD-1, гибридные белки по настоящему изобретению также включают домены Fc антител, которые обычно основаны на классе IgG, который имеет несколько подклассов, включая, без ограничения указанным, IgG1, IgG2, IgG3 и IgG4. Как описано в данном документе, домен Fc необязательно включает шарнирный домен антитела IgG.
Домены Fc из IgG человека особенно подходят для настоящего изобретения и могут быть доменом Fc из IgG1, IgG2, IgG3 или IgG4 человека. Как правило, IgG1, IgG2 и IgG4 используются чаще, чем IgG3.
Домен Fc белка IgG человека, включенный в гибридный белок по настоящему изобретению, обеспечивает значительное увеличение периода полувыведения гибридного белка и обеспечивает дополнительное связывание или взаимодействие с молекулами Ig. В некоторых воплощениях гибридный белок варианта sPD-1–Fc может способствовать очистке, мультимеризации, связыванию и нейтрализации других молекул по сравнению с мономерным полипептидом варианта sPD.
Домены Fc, которые находят применение в изобретении, также могут содержать варианты Fc для изменения функции по мере необходимости. Однако любые варианты Fc обычно должны сохранять как способность образовывать димеры, так и способность связывать FcRn. Таким образом, хотя многие из воплощений в данном документе основаны на использовании домена IgG4 человека, чтобы избежать эффекторной функции, могут быть созданы варианты Fc, которые усиливают или отменяют функцию в других доменах IgG. Таким образом, например, можно использовать варианты абляции, которые снижают или устраняют эффекторную функцию в IgG1 или IgG2, и/или варианты Fc, которые обеспечивают более прочное связывание с FcRn, могут быть использованы, что будет понятно специалистам в данной области.
Домены Fc из IgG4
Подкласс IgG4 отличается от других подклассов IgG, поскольку он демонстрирует незначительное связывание с белковым комплексом C1q и не может активировать классический путь комплемента (A. Nirula et al., 2011, Current Opinion in Rheumatology 23: 119-124, полностью включено в данный документ ссылкой). В результате IgG4 находит применение в настоящем изобретении, поскольку он не имеет значительной эффекторной функции и, таким образом, используется для блокирования связывания рецептор-лиганд без истощения клеток.
В другом воплощении домены Fc по настоящему изобретению представляют собой домены Fc из IgG4 человека.
В некоторых воплощениях домен Fc по настоящему изобретению включает шарнир-CH2-CH3 из IgG4 человека.
В некоторых воплощениях домен Fc по настоящему изобретению включает CH2-CH3 из IgG4 человека.
В другом воплощении домены Fc по настоящему изобретению представляют собой вариантные домены Fc из IgG4 человека. Однако варианты доменов Fc в данном документе по-прежнему сохраняют способность образовывать димер с другим доменом Fc, что измерено с использованием известных, а также способность связываться с FcRn, поскольку это вносит значительный вклад в увеличение периода полувыведения в сыворотке гибридных белков, описанных в данном документе.
Вариант домена Fc из IgG4 может включать добавление, делецию, замену или любую их комбинацию по сравнению с исходным человеческим доменом Fc из IgG4.
В некоторых воплощениях вариантные домены Fc из IgG4 человека по настоящему изобретению могут иметь, по меньшей мере, 80%, 85%, 90%, 95%, 95%, 97%, 98% или 99% идентичности с соответствующими исходным домен Fc из IgG4 человека (с использованием алгоритмов идентификации, описанных выше, с одним воплощением, использующим алгоритм BLAST, как известно в данной области техники, с использованием параметров по умолчанию).
В некоторых воплощениях варианты доменов Fc из IgG4 человека по настоящему изобретению могут иметь от 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных модификаций по сравнению с исходными доменами Fc IgG4 человека.
В некоторых воплощениях вариантный домен Fc из IgG4 человека содержит аминокислотную замену серина в положении 228 на пролин в соответствии с индексом нумерации EU.
Другие домены Fc из IgG
В некоторых воплощениях домены Fc по настоящему изобретению могут быть доменами Fc из других IgG, кроме IgG4, таких как IgG1, IgG2 или IgG3 человека. Как правило, IgG1 и IgG2 используются чаще, чем IgG3.
В некоторых воплощениях домен Fc по настоящему изобретению представляет собой домен Fc из IgG1 человека.
В некоторых воплощениях домен Fc по настоящему изобретению представляет собой домен Fc из IgG2 человека.
В некоторых воплощениях домен Fc по настоящему изобретению представляет собой вариантный домен Fc из IgG1 человека.
В некоторых воплощениях домен Fc по настоящему изобретению представляет собой вариантный домен Fc из IgG2 человека.
В некоторых воплощениях варианты доменов Fc человеческого IgG1 по изобретению могут иметь, по меньшей мере, 80%, 85%, 90%, 95%, 95%, 97%, 98% или 99% идентичности с соответствующим исходным доменом Fc IgG1 человека (с использованием алгоритмов идентификации, описанных выше, с одним воплощением, использующим алгоритм BLAST, как известно в данной области техники, с использованием параметров по умолчанию).
В некоторых воплощениях варианты доменов Fc из IgG2 человека по изобретению могут иметь, по меньшей мере, 80%, 85%, 90%, 95%, 95%, 97%, 98% или 99% идентичности с соответствующим исходным доменом Fc IgG2 человека (с использованием алгоритмов идентификации, описанных выше, с одним воплощением, использующим алгоритм BLAST, как известно в данной области техники, с использованием параметров по умолчанию).
В некоторых воплощениях варианты доменов Fc человеческого IgG3 по изобретению могут иметь, по меньшей мере, 80%, 85%, 90%, 95%, 95%, 97%, 98% или 99% идентичности с соответствующим исходным доменом Fc IgG3 человека (с использованием алгоритмов идентификации, описанных выше, в одном воплощении используется алгоритм BLAST, известный в данной области техники, с использованием параметров по умолчанию).
В некоторых воплощениях варианты доменов Fc из IgG1 человека по настоящему изобретению могут иметь от 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных модификаций по сравнению с исходными доменами Fc из IgG1 человека.
В некоторых воплощениях варианты доменов Fc человеческого IgG2 по настоящему изобретению могут иметь от 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных модификаций по сравнению с исходными доменами Fc из IgG2 человека.
В некоторых воплощениях варианты доменов Fc человеческого IgG3 по настоящему изобретению могут иметь от 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 аминокислотных модификаций по сравнению с исходными доменами Fc из IgG3 человека.
Линкеры
Два описанных выше домена (то есть вариант домена sPD-1 и домен Fc) обычно связаны с использованием линкерного домена, как описано в данном документе. В контексте изобретения важно то, что два домена присоединены с помощью гибкого линкера таким образом, что два домена могут действовать независимо. Это может быть выполнено различными способами с использованием традиционных линкеров и/или шарнирного линкера.
Хотя можно использовать любой подходящий линкер, во многих воплощениях используется глицин-сериновый полимер, включая, например, (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n является целым числом, по меньшей мере, 1 (и обычно от 3 до 4 до 5), а также любую пептидную последовательность, которая позволяет рекомбинантное присоединение двух доменов с достаточной длиной и гибкостью, чтобы позволить каждому домену сохранять свою биологическую функцию.
В некоторых воплощениях используется шарнирный домен человеческого антитела IgG. Шарнирные домены IgG1, IgG2, IgG3 и IgG4 человека показаны на фиг. 12. В некоторых случаях шарнирный домен также может содержать аминокислотные замены. Например, как показано на фиг. 1 и в таблице 1 используется шарнирный домен из IgG4, содержащий вариант S228P.
В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В одном воплощении линкер имеет длину от около 1 до 50 аминокислот, предпочтительно от около 1 до 30 аминокислот в длину.
В другом воплощении линкер имеет длину от 1 до 20 аминокислот, предпочтительно от около 5 до около 10 аминокислот.
Частные воплощения изобретения.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, проявляющий, по меньшей мере, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 1.
В некоторых воплощениях гибридные белки варианта sPD-1–Fc по настоящему изобретению содержат: a) домен варианта растворимого PD-1 (sPD-1), включающий аминокислотную замену по сравнению с SEQ ID NO: 1, где указанное аминокислотное замещение находится в положении, выбранном из группы, состоящей из 42, 67, 69, 96, 104, 107, 112 и 120, b) линкер и c) домен Fc. В некоторых воплощениях гибридный белок варианта sPD-1–Fc содержит от N- к С-концу: а) указанный вариант домена sPD-1; b) указанный линкер; и c) указанный домен Fc. В некоторых воплощениях гибридный белок варианта sPD-1–Fc содержит от N- к С-концу: а) указанный домен Fc; b) указанный линкер; и c) указанный вариант домена sPD-1. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридные белки варианта sPD-1–Fc по настоящему изобретению содержат домен растворимого варианта PD-1 (sPD-1), включающий аминокислотную замену по сравнению с SEQ ID NO: 1, где указанная аминокислотная замена представляет собой в положения с номером, выбранной из группы, состоящей из 42, 67, 69, 96, 104, 107, 112 и 120, и домена Fc. В некоторых воплощениях гибридный белок варианта sPD-1–Fc содержит от N- к С-концу: а) указанный вариант домена sPD-1; и b) указанный домен Fc. В некоторых воплощениях гибридный белок варианта sPD-1–Fc содержит от N- к С-концу: а) указанный домен Fc; и b) указанный вариант домена sPD-1. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению содержит: a) вариант домена sPD-1, включающий аминокислотную замену, выбранную из группы, состоящей из S42G, S67G, P69L, N96S, G104S, S107V, A112I и A120V по сравнению с SEQ ID NO: 1; b) линкер; и c) домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению содержит: вариант домена sPD-1, включающий аминокислотную замену, выбранную из группы, состоящей из S42G, S67G, P69L, N96S, G104S, S107V, A112I, и A120V по сравнению с SEQ ID NO: 1; и домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает: a) вариант домена sPD-1, содержащий набор аминокислотных замен S42G/S67G/P69L/G104S/S107V/A112I/A120V, S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V, S42G/S67G, S42G/P69L, S42G/G104S, S42G/S107V, S42G/A112I, S42G/A120V, S67G/P69L, S67GV/G104, S67G/A112I, S67G/A120V, P69L/G104S, P69L/S107V, P69L/A112I, P69L/A120V, G104S/S107V, G104S/A112I, G104S/A120V, S107V/A112I, S107V12/A120V, S107V12/A120V,/S67G/P69L, S42G/S67G/G104S, S42G/S67G/S107V, S42G/S67G/A112I, S42G/S67G/A120V, S42G/P69L/G104S, S42G/P69L/S107V, S42G/P69L42/A112I/A120V, S42G/G104S/S107V, S42G/G104S/A112I, S42G/G104S/A120V, S42G/S107V/A112I, S42G/S107V/A120V, S42G/A112I/A120V, S67G/P69L/S104V69, S67G/P69L/G104V69, S67G/P69L/A112I, S67G/P69L/A120V, S67G/G104S/S107V, S67G/G104S/A112I, S67G/G104S/A120V, S67G/S107V/A112I, S67G/S107V/A120V, S67G20/A1/G104S/S107V, P69L/G104S/A112I, P69L/G104S/120V, P 69L/S107V/A112I, P69L/S107V/120V, P69L/A112I/A120V, G104S/S107V/A112I, G104S/S107V/A120V, G104S/A112I/A120V, S107V/A112I/A120V, S42SL/S67 S42G/S67G/P69L/S107V, S42G/S67G/P69L/A112I, S42G/S67G/P69L/A120V, S42G/S67G/G104S/S107V, S42G/S67G/G104S/A112I, S42G/S67G/G104S/S42G/S67G/G104S S67G/S107V/A112I, S42G/S67G/S107V/A120V, S42G/S67G/A112I/A120V, S42G/P69L/G104S/S107V, S42G/P69L/G104S/A112I, S42G/P69L/G104SG/A120 S107V/A112I, S42G/P69L/S107V/A120V, S42G/P69L/A112I/A120V, S42G/G104S/S107V/A112I, S42G/G104S/S107V/A120V, S42G/G104S/A112I/A112I/S A120V, S67G/P69L/G104S/S107V, S67G/P69L/G104S/A112I, S67G/P69L/G104S/A120V, S67G/P69L/S107V/A112I, S67G/P69L/S107V/A120VL, S67V12/P69 A120VL, S67V12/P69 S67G/G104S/S107V/A112I, S67G/G104S/S107V/A120V, S67G/G104S/A112I/A120V, S67G/S107V/A112I/A120V, P69L/G104S/S107V/A112I, P69LV10, P69LV10/P10V4S/G10V4S G104S/A112I/A120V, P69L/S107V/A112I/A120V, G104S/S107V/A112I/A120V, S42G/S67G/P69L/G104S/S107V, S42G/S67G/P69L/G104S/A112I, S42G/S67G/P69L/G104S/A120V, S42G/S67G/P69L/S107V/A112I, S42G/S67G/P69L/S107V/A120V, S42G/S67G/P69L/A112I/A120V, S42G/S67G10/G10V4S/A1 S42G/S67G/G104S/S107V/A120V, S42G/S67G/G104S/A112I/A120V, S42G/S67G/S107V/A112I/A120V, S42G/P69L/G104S/S107V/A112I, S42G/P69L20V/G10 S42G/P69L/G104S/A112I/A120V, S42G/P69L/S107V/A112I/A120V, S42G/G104S/S107V/A112I/A120V, S67G/P69L/G104S/S107V/A112I, S67G/P69L20V/G10 S67G/P69L/G104S/A112I/A120V, S67G/P69L/S107V/A112I/A120V, S67G/G104S/S107V/A112I/A120V, P69L/G104S/S107V/A112I/A120V, S42G/S107GV/P69 A112I, S42G/S67G/P69L/G104S/S107V/A120V, S42G/S67G/P69L/G104S/A112I/A120V, S42G/S67G/P69L/S107V/A112I/A120V, S42G/S67G/G104V/A120/S107/S107 S42G/P69L/G104S/S107V/A112I/A120V и S67G/P69L/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1; b) необязательный линкер и с) домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, содержащий набор аминокислотных замен S42G/S67G/P69L/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1, необязательный линкер и домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, содержащий набор аминокислотных замен S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1, необязательный линкер и домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, содержащий набор аминокислотных замен P69L/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1, необязательный линкер и домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, содержащий набор аминокислотных замен S67G/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1, необязательный линкер и домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, содержащий набор аминокислотных замен S67G/P69L/G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1, необязательный линкер и домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, содержащий набор аминокислотных замен G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1, необязательным линкер и домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, содержащий набор аминокислотных замен G104S/S107V/A112I по сравнению с SEQ ID NO: 1, необязательный линкер, и домен Fc. В некоторых воплощениях домен Fc представляет собой домен Fc из IgG человека, выбранного из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях домен Fc представляет собой домен варианта Fc из IgG человека, где IgG человека выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. В некоторых воплощениях вариантный домен Fc из IgG человека, раскрытый в настоящем документе, содержит шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P. В некоторых воплощениях линкер представляет собой линкер домена, выбранный из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5. В некоторых воплощениях линкер представляет собой GGGGS. В некоторых воплощениях линкер домена представляет собой комбинацию шарнирного домена и гибкого линкера, такого как шарнир IgG4 с S228P, а также с линкером GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, необязательный линкер и домен Fc, где вариант домена sPD-1 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO. : 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36., SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO. : 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO : 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO : 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO : 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138 и SEQ ID NO: 139.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 2, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 3, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 72, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 110, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 130, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 131, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 138, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 12, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 13, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 14, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 15, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 16, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 17, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 18, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 19, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 20, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 21, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 22, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 23, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 24, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 25, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 26, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 27, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 28, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 29, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 30, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 31, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 32, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 33, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 34, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 35, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 36, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 37, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 38, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 39, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 40, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 41, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 42, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 43, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 44, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 45, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 46, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 47, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 48, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 49, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 50, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 51, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 52, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 53, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 54, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 55, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 56, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 57, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 58, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 59, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 60, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 61, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 62, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 63, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 64, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 65, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 66, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 67, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 68, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 69, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 70, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 71, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 73, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 74, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 75, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 76, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 77, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 78, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 79, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 80, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 81, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 82, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 83, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 84, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 85, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 86, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 87, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 88, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 89, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 90, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 91, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 92, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 93, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 94, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 95, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 96, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 97, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 98, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 99, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 100, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 101, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 102, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 103, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 104, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 105, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 106, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 107, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 108, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 109, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 111, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 112, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 113, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 114, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 115, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 116, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 117, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 118, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 119, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 120, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 121, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 122, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 123, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 124, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 125, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 126, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 127, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 128, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 129, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 132, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 133, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 134, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 135, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 136, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 137, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает вариант домена sPD-1, как указано в SEQ ID NO: 139, необязательный линкер и домен Fc.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает домен Fc из IgG человека или вариантный домен Fc из IgG человека.
В предпочтительном воплощении гибридный белок варианта sPD-1–Fc по настоящему изобретению содержит вариантный домен Fc из IgG человека.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает домен Fc из IgG человека, содержащий шарнир-CH2-CH3 из IgG4 человека.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению включает домен Fc из IgG человека, содержащий CH2-CH3 из IgG4 человека.
В предпочтительном воплощении гибридный белок варианта sPD-1–Fc по настоящему изобретению содержит вариантный домен Fc из IgG человека, содержащий шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P в соответствии с индексом нумерации EU.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению содержит линкер, который выбран из группы, состоящей из (GS)n, (GSGGS)n, (GGGGS)n и (GGGS)n, где n выбран из группы, состоящей из 1, 2, 3, 4 и 5.
В предпочтительном воплощении гибридный белок варианта sPD-1–Fc по настоящему изобретению содержит линкер GGGGS.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению имеет аминокислотную последовательность, указанную в SEQ ID NO: 5.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению имеет аминокислотную последовательность, указанную в SEQ ID NO: 6.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению имеет аффинность связывания с лигандом PD-1, которая составляет, по меньшей мере, около 1,1-кратную или более (например, 5-кратную или более, 10-кратную или более, 100-кратную или более, 500-кратную или более, 1000-кратную или более, 5000-кратную или более, 10000-кратную или более и т.д.), по сравнению с исходным гибридным белком Fc (например, гибридный белок WT PD-1 - Fc, как указано в SEQ ID NO: 4).
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению имеет аффинность связывания с лигандом PD-1, которая, по меньшей мере, в около 100 раз сильнее, чем аффинность исходного гибридного белка.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению имеет аффинность связывания с лигандом PD-1, которая, по меньшей мере, в около 200 раз сильнее, чем аффинность исходного гибридного белка.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению имеет аффинность связывания с лигандом PD-1, которая, по меньшей мере, в около 10000 раз сильнее, чем аффинность исходного гибридного белка.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению имеет аффинность связывания с лигандом PD-1 с KD 10-8 M или более высокую аффинность, где аффинность измеряется стандартным анализом Biacore.
В некоторых воплощениях гибридный белок варианта sPD-1–Fc по настоящему изобретению ингибирует или предотвращает связывание между полипептидом PD-1 дикого типа и лигандом PD-1 in vitro или in vivo.
Домен варианта sPD-1 из гибридного белка варианта sPD-1–Fc служит для увеличения аффинности связывания с PD-L1 и/или PD-L2. (Вариантный) домен Fc из белка IgG человека значительно увеличивает период полувыведения гибридного белка. Гибридные белки по настоящему изобретению особенно полезны для лечения заболевания или расстройства, при котором адаптивная иммунная система подавлена или требуется повышение уровня иммунного ответа. В некоторых воплощениях гибридные белки варианта sPD-1–Fc по настоящему изобретению можно использовать для лечения раковых заболеваний или инфекций.
Нуклеиновые кислоты
Настоящее изобретение также относится к композициям, содержащим нуклеиновую кислоту, кодирующую гибридный белок варианта sPD-1–Fc, по настоящему изобретению. Такие нуклеиновые кислоты могут кодировать любой из гибридных белков вариант sPD-1–Fc, перечисленных в настоящей заявке.
Нуклеиновые кислоты настоящего изобретения могут быть выделены и получены в значительной степени чистыми. Обычно нуклеиновые кислоты, как ДНК, так и РНК, будут получены, по существу, свободными от других встречающихся в природе последовательностей нуклеиновых кислот, обычно имеющих, по меньшей мере, около 50%, обычно, по меньшей мере, около 90% чистоты и обычно являются «рекомбинантными», например, фланкированы одним или несколькими нуклеотидами, с которыми они обычно не связаны в естественной хромосоме.
В некоторых воплощениях композиция содержит нуклеиновую кислоту, кодирующую гибридный белок варианта sPD-1–Fc из SEQ ID NO: 5. В некоторых воплощениях композиция содержит нуклеиновую кислоту, кодирующую гибридный белок варианта sPD-1–Fc из SEQ ID NO: 6.
В некоторых воплощениях нуклеиновая кислота кодирует гибридный белок варианта sPD-1–Fc, включая сигнальную последовательность. Как известно в данной области техники, сигнальные последовательности используются для направления продукта экспрессии наружу клетки. В этом случае подходящие сигнальные последовательности для экспрессии гибридных белков по изобретению представляют собой сигнальные последовательности PD-1 дикого типа, как показано на фиг. 1 курсивом и в SEQ ID NO: 7 из таблицы 1. Как будет понятно специалистам в данной области, подходящие сигнальные последовательности для экспрессии гибридных белков по изобретению могут быть «подобраны» к клетке-хозяину, используемой для экспрессии. То есть, когда гибридные белки по изобретению должны экспрессироваться в клетках-хозяевах млекопитающих, таких как клетки СНО, например, можно использовать сигнальные последовательности от клеток СНО.
В некоторых воплощениях композиция содержит нуклеиновую кислоту, кодирующую гибридный белок варианта sPD-1–Fc из SEQ ID NO: 9. В некоторых воплощениях композиция содержит нуклеиновую кислоту, кодирующую гибридный белок варианта sPD-1–Fc из SEQ ID NO: 10.
В некоторых воплощениях композиция содержит нуклеиновую кислоту, кодирующую гибридный белок варианта sPD-1–Fc, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO : 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO. : 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, и SEQ ID NO: 139.
В некоторых воплощениях нуклеиновая кислота, кодирующая гибридный белок варианта sPD-1–Fc, включает версию или вариант, оптимизированные по кодонам.
«Оптимизированный по кодонам» в этом контексте упоминается в отношении конкретного организма-хозяина и его обычно предпочтительных аминокислотных кодонов; то есть организм-хозяин, например, вид Aspergillus может давать более высокую трансляцию и/или секрецию с использованием предпочтительных для Aspergillus кодонов по сравнению с продуцирующим организмом дрожжами.
Оптимизация по кодонам может быть использована с любым из числа гибридных белков варианта sPD-1–Fc по настоящему изобретению, чтобы оптимизировать экспрессию в используемой клетке-хозяине.
Гибридный белок варианта sPD-1–Fc может быть получен обычно путем конструирования генов, кодирующих последовательность гибридного белка, с использованием хорошо известных методов, включая сайт-направленный мутагенез исходного гена и конструирование синтетического гена.
Экспрессия нуклеиновых кислот по настоящему изобретению может регулироваться их собственными или другими регуляторными последовательностями, известными в данной области.
Регуляторные последовательности
Настоящее изобретение также относится к конструкциям нуклеиновых кислот, включающим полинуклеотид, кодирующий гибридный белок варианта sPD-1–Fc по настоящему изобретению, функционально связанный с одной или несколькими управляющими последовательностями, которые направляют экспрессию кодирующей последовательности в подходящей клетке-хозяине в условиях, совместимых с управляющими последовательностями. Управляющая последовательность может включать промотор, полинуклеотид, который распознается клеткой-хозяином для экспрессии полинуклеотида. Промотор содержит последовательности контроля транскрипции, которые опосредуют экспрессию гибридного белка Fc. Промотор может быть любым полинуклеотидом, который проявляет транскрипционную активность в клетке-хозяине, включая мутантные, усеченные и гибридные промоторы, и может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды, гомологичные или гетерологичные клетке-хозяину.
В некоторых воплощениях контрольная последовательность также может быть областью, кодирующей сигнальный пептид, которая кодирует сигнальный пептид, связанный с N-концом варианта, и направляет экспрессируемую вариантную фитазу в секреторный путь клетки. 5'-конец кодирующей последовательности полинуклеотида может по своей природе содержать последовательность, кодирующую сигнальный пептид, естественно связанную в рамке считывания трансляции с сегментом кодирующей последовательности, которая кодирует вариантную фитазу. В ином случае 5'-конец кодирующей последовательности может содержать последовательность, кодирующую сигнальный пептид, которая является чужеродной для кодирующей последовательности. Кодирующая последовательность чужеродного сигнального пептида может потребоваться, если кодирующая последовательность в природе не содержит кодирующую последовательность сигнального пептида. В ином случае последовательность, кодирующая чужеродный сигнальный пептид, может просто заменять последовательность, кодирующую природный сигнальный пептид, для усиления секреции вариантной фитазы. Однако можно использовать любую последовательность, кодирующую сигнальный пептид, которая направляет экспрессируемый вариант в секреторный путь клетки-хозяина.
Экспрессирующие векторы
В настоящем документе также представлены векторы экспрессии для экспрессии in vitro или in vivo одного или нескольких гибридных белков варианта sPD-1–Fc по настоящему изобретению, либо конститутивно, либо под одним или несколькими регуляторными элементами. В некоторых воплощениях настоящее изобретение относится к экспрессирующим векторам, содержащим полинуклеотид, кодирующий гибридный белок варианта sPD-1–Fc, промотор и стоп-сигналы транскрипции и трансляции. Различные нуклеотидные и контрольные последовательности могут быть соединены вместе для получения рекомбинантного экспрессирующего вектора, который может включать один или несколько удобных сайтов рестрикции, чтобы сделать возможной вставку или замену полинуклеотида, кодирующего гибридный белок Fc, в таких сайтах. Альтернативно полинуклеотид можно экспрессировать путем вставки полинуклеотида или конструкции нуклеиновой кислоты, содержащей полинуклеотид, в подходящий вектор для экспрессии. При создании экспрессирующего вектора кодирующая последовательность располагается в векторе, так что кодирующая последовательность функционально связана с соответствующими контрольными последовательностями для экспрессии.
Рекомбинантный экспрессирующий вектор может быть любым вектором (например, плазмидой или вирусом), который может быть легко подвергнут процедурам рекомбинантной ДНК и может вызывать экспрессию полинуклеотида. Выбор вектора обычно будет зависеть от совместимости вектора с клеткой-хозяином, в которую вектор должен быть введен. Вектор может быть линейной или замкнутой круговой плазмидой.
Вектор может быть автономно реплицирующимся вектором, т.е. вектором, который существует как внехромосомный объект, репликация которого не зависит от хромосомной репликации, например, плазмида, внехромосомный элемент, минихромосома или искусственная хромосома. Вектор может содержать любые средства для обеспечения саморепликации. В ином случае вектор может быть таким, который при введении в клетку-хозяин интегрируется в геном и реплицируется вместе с хромосомой(ами), в которую он был интегрирован. Кроме того, можно использовать один вектор или плазмиду или два или более векторов или плазмид, которые вместе содержат всю ДНК, которая должна быть введена в геном клетки-хозяина, или транспозон. Векторы, предназначенные для применения в способах по настоящему изобретению, включают как интегрирующие, так и неинтегрирующие векторы.
Клетки-хозяева и производственные штаммы
Специалистам в данной области будет понятно, что существует большое разнообразие продуцирующих организмов-хозяев для рекомбинантного продуцирования гибридных белков гибридные белки варианта sPD-1–Fc по настоящему изобретению, включая, без ограничения указанным, бактериальные клетки, клетки млекопитающих и грибные клетки, включая дрожжи.
Нуклеиновые кислоты по изобретению могут быть введены в подходящие клетки-хозяева с использованием множества методов, доступных в данной области, таких как перенос ДНК, опосредованный поликатионным трансферрином, трансфекция «голыми» или инкапсулированными нуклеиновыми кислотами, опосредованный липосомами перенос ДНК, внутриклеточная транспортировка латексными шариками, покрытыми ДНК, слияние протопластов, вирусная инфекция, электропорация, генная пушка, трансфекция, опосредованная фосфатом кальция, и т.п.
Способы получения гибридных белков
Настоящее изобретение также относится к способам получения гибридного белка варианта sPD-1–Fc, включающим: (а) культивирование клетки-хозяина по настоящему изобретению в условиях, подходящих для экспрессии гибридного белка варианта sPD-1–Fc; и (b) необязательно извлечение гибридного белка варианта sPD-1–Fc.
Способы лечения
Объекты, поддающиеся лечению
Усиленный Т-клеточный ответ, достигаемый в результате использования гибридного белка варианта sPD-1–Fc по настоящему изобретению, достаточен для лечения заболевания или нарушения, включая, помимо прочего, раковые заболевания, вирусную инфекцию, бактериальную инфекцию, грибковую инфекцию и паразитарную инфекцию.
Способы по настоящему изобретению включают введение объекту, нуждающемуся в лечении, терапевтически эффективного количества одного или нескольких гибридных белков варианта sPD-1–Fc, описанных в данном документе. В некоторых воплощениях объект страдает от раковогозаболевания, и введение терапевтически эффективного количества одного или нескольких гибридных белков варианта sPD-1–Fc может лечить, уменьшать или предотвращать метастазирование или инвазию опухоли у объекта. В других воплощениях гибридный(ые) белок(ки) варианта sPD-1–Fc по настоящему изобретению может(ут) снижать или ингибировать рост солидной опухоли у объекта с раковым заболеванием.
В некоторых воплощениях объекту, страдающему инфекцией, например, местной или системной инфекцией, вводят терапевтически эффективное количество одного или нескольких гибридных белков варианта sPD-1 и Fc, описанных в настоящем документе, для лечения инфекции. В других воплощениях у объекта хроническое инфекционное заболевание, вызванное бактерией, вирусом, простейшими, паразитом или другим микробным патогеном.
Терапевтическое применение
В некоторых воплощениях терапевтически эффективная композиция или состав, включающий один или несколько гибридных белков варианта sPD-1–Fc по настоящему изобретению, можно вводить системно индивидууму, нуждающемуся в этом, или любым другим путем введения, известным в данной области.
Дозирование
В некоторых воплощениях эффективная доза терапевтического объекта по настоящему изобретению, например, для лечения метастатического рака или инфекции, варьируется в зависимости от многих различных факторов, включая способы введения, целевой участок, физиологическое состояние пациента, является ли пациент человеком или животным, другие применяемые лекарства и является ли лечение профилактическим или терапевтическим. Дозы лечения можно титровать для оптимизации безопасности и эффективности.
Примеры
Пример 1. Моделирование варианта sPD1 с комплексами PDL1 и PDL2 человека
Способы
Структура комплекса PD-1/PD-L1 человека доступна в базе данных белковых структур как PDBID - 4ZQK и 5IUS. Однако в обеих структурах PDB в области петли отсутствуют некоторые остатки PD-1, и некоторые из остатков мутированы по сравнению с PD-1 дикого типа. Чтобы лучше исследовать влияние мутаций на аффинность связывания и стабильность белка, сначала фиксировали недостающую петлю, а остаток снова мутировали на PD-1 дикого типа на основе кристаллической структуры 4ZQK. Мутированная структура PD-1 была смоделирована с использованием модуля сканирования остатков в Schrodinger Suite. Остатки в пределах 5,0 Å от мутантного остатка уточняли с помощью прогнозирования по боковой цепи и выборкой основной цепи. Анализ взаимодействия белков выполняли как для структуры комплекса WT PD-1/PD-L1, так и для структуры комплекса варианта sPD-1/PD-L1. Три модели комплекса PD-1/PD-L1, модель WT, модель с 3 мутациями в области взаимодействия, модель со всеми 8 мутациями, были подвергнуты моделированию молекулярной динамики (MD) в течение 10 нс с использованием силового поля OPLS3 для дальнейшей конкретизации и оптимизации. Каждый комплекс сольватировали в периодическом орторомбическом боксе с SPC водой в качестве растворителя. Минимальное расстояние от любого сложного атома до стенки ящика было установлено равным 10 Å. Все три MD симуляции были выполнены при постоянной температуре 300 К и постоянном давлении 1 атм. Для анализа использовались координаты траектории, сохраненные с интервалом в 1 пс.
Поскольку структура PD-L2 человека недоступна в банке данных по белкам, для исследования взаимодействия между PD-1 человека и PD-L2 была построена модель гомологии PD-L2. После поиска гомологии в наборе данных PDB без избыточности в качестве шаблонов были выбраны три структуры PDB PD-L2 мыши. Как описано ранее, анализ взаимодействия белков также был выполнен для WT и варианта sPD-1/модели PD-L2.
Моделирование комплекса PD-1/PD-L1 человека
Результат выравнивания последовательностей WT PD-1, 4ZQK и 5IUS показан на фиг. 2. Идентичные остатки отмечены синим цветом, остатки, отсутствующие в обеих кристаллических структурах, отмечены красным, остатки, отсутствующие только в 4ZQK, отмечены голубым.
Модель PD-1 с отсутствующей фиксированной петлей и остатком 93, обратно мутированным на Cys, показана голубым цветом на фиг. 3. Кристаллические структуры PD-1 и PD-L1 в 4ZQK показаны синим и зеленым цветом, соответственно. 7 остатков (Ser62, Ser87, Pro89, Gly124, Ser127, Ala132 и Ala140 с нумерацией, начинающейся с сигнальной области; которые эквивалентны Ser42, Ser67, Pro69, Gly104, Ser107, Ala112 и Ala120, соответственно, с нумерацией, начинающейся с зрелой области) в PD-1 для мутации показаны оранжевыми палочками, сайт N-гликозилирования (Asn116) показан пурпурными палочками.
Мутированная структура PD-1 была смоделирована с использованием модуля сканирования остатков в Schrodinger Suite. Остатки в пределах 5,0 Å от мутантного остатка уточняли с помощью прогнозирования по боковой цепи и выборкой основной цепи. Анализ взаимодействия белков выполняли как для структуры комплекса WT PD-1/PD-L1, так и для мутированной структуры комплекса PD-1/PD-L1 со всеми 8 мутированными остатками. Результат анализа представлен в таблицах 2 и 3, соответственно. Мутации G124S, S127V и A132I рассматриваются как мутации в области взаимодействия с нумерацией положений, начинающейся с сигнальной области. А мутации S62G, S86G, P89L и A140V считаются внешними мутациями с нумерацией положений, начинающейся с сигнальной области. Мутация G124S создает еще одну водородную связь с PD-L1, мутация A132I сохраняет водородную связь с PD-L1 и увеличивает комплементарность поверхности.
Для дальнейшего изучения того, как мутации влияют на связывание PD-1/PD-L1, были рассчитаны вариации аффинности связывания и стабильности белка до и после каждой мутации. Результат представлен в таблице 4. Расчет вариации аффинности связывания и стабильности белка также выполняли для множественных мутаций. Результат представлен в таблице 5. Более отрицательное значение аффинности связывания или стабильности указывает на большее их увеличение. В общем, мутации в области взаимодействия увеличивают как аффинность связывания, так и стабильность белка, а внешние мутации влияют в основном только на стабильность. При всех 8 мутациях аффинность связывания увеличивается на 19,03 ккал/моль, а стабильность белка увеличивается на 69,92 ккал/моль.
Три модели комплекса PD-1/PD-L1, модель WT, модель с 3 мутациями в области взаимодействия, модель со всеми 8 мутациями, были подвергнуты моделированию молекулярной динамики (MD) в течение 10 нс с использованием силового поля OPLS3 для дальнейшей конкретизации и оптимизации. Каждый комплекс сольватировали в периодическом орторомбическом боксе с SPC водой в качестве растворителя. Минимальное расстояние от любого сложного атома до стенки ящика было установлено равным 10 Å. Все три MD симуляции были выполнены при постоянной температуре 300 К и постоянном давлении 1 атм. Для анализа использовались координаты траектории, сохраненные с интервалом в 1 пс. Временная эволюция RMSD положения атомов основной цепи показана на фиг. 4. Результат MD также показывает, что мутации повышают стабильность модели.
Таблица 2. Анализ взаимодействия белков модели PD-1/PD-L1 человека дикого типа
3,0 A
3,3 A
2,9 A
3,6 A
1x hb с A:123:Tyr
1x hb, lx солевой мостик к A:125:Arg
Таблица 3. Анализ белкового взаимодействия модели мутированного PD-1(S62G, S87G, P89L, G124S, S127V, A132I, A140V и N116S с нумерацией положений, начиная с сигнальной области)/PD-L1 человека
Таблица 4. Изменение аффинности связывания и стабильности белка (в ккал/моль) PD-1/PD-L1 человека для каждой отдельной мутации
Таблица 5. Изменение аффинности связывания и стабильности белка (в ккал/моль) PD-1/PD-L1 человека для множественных мутаций. Более отрицательное значение аффинности связывания или стабильности указывает на большее их увеличение
(сольватированная)
Моделирование комплекса PD-1/PD-L2 человека
Результаты выравнивания последовательностей показаны на фиг. 5А. Идентичность последовательностей PD-L2 человека и PD-L2 мыши составляет около 72%. Консенсусная модель человеческого PD-L2 показана на фиг. 5B. Идентичные остатки отмечены синим цветом. Остатки в недостающей петле отмечены красным.
Сравнение области взаимодействия при связывании PD-1 между моделью PD-L2 человека и кристаллической структурой PD-L2 мыши (PDBID: 3BP5) показано на фиг. 6. Остатки показаны линиями. Остатки области взаимодействия отмечены зеленым цветом в модели PD-L2 человека (показаны темно-синим). Кристаллическая структура мыши PD-L2 показана розовым цветом. Идентичность последовательностей на интерфейсе составляет 66%. Модель комплекса PD-1/PD-L2 человека была построена на основе модели PD-1 человека (описанной в части I) и согласованной модели PD-L2 человека путем наложения на кристаллическую структуру PD-1/PD-L2 мыши (PDBID: 3BP5). Наложение модели PD-1/PD-L2 человека и кристаллической структуры PD-1/PD-L2 мыши (PDBID: 3BP5) показано на ФИГ. 7. Модели PD-1 и PD-L2 человека показаны голубым и темно-синим цветом, структуры PD-1 и PD-L2 мыши показаны желтым и розовым цветом, соответственно.
Как описано в разделе способов, анализ взаимодействия белков был также выполнен для модели WT и мутировавшего PD-1/PD-L2 человека. Результаты приведены в таблицах 6 и 7. Мутации G124S и A132I немного увеличивают комплементарность поверхности. Расчет вариации аффинности связывания и стабильности белка также выполняли для каждой отдельной мутации и множественных мутаций. Результаты приведены в таблицах 8 и 9. В общем, мутации в области взаимодействия увеличивают аффинность связывания, а внешние мутации повышают стабильность. При всех 8 мутациях аффинность связывания увеличивается на 10,62 ккал/моль, а стабильность белка увеличивается на 10,7 ккал/моль. Вариация аффинности связывания и стабильности PD-1/PD-L2 не так значительна, как у PD-1/PD-L1. Это может быть связано с различием структурной точности между моделью гомологии и кристаллической структурой.
Таблица 6. Анализ взаимодействия белков модели PD-1/PD-L2 человека дикого типа
Таблица 7. Анализ белкового взаимодействия модели мутированного (S62G, S87G, P89L, G124S, S127V, A132I, A140V и N116S с нумерацией положений, начиная с сигнальной области, которые эквивалентны S42G, S67G, P69L, G104S, S107V, A112I, A120V и N96S, соответственно, с нумерацией положений, начиная со зрелой области) PD-1/PD-L2 человека
Таблица 8. Изменение аффинности связывания и стабильности белка (в ккал/моль) PD-1/PD-L2 человека для каждой отдельной мутации
Таблица 9. Изменение аффинности связывания и стабильности белка (в ккал/моль) PD-1/PD-L2 человека для множественных мутаций
Таблица 10. Номера отслеживания колоний, номера SEQ ID и аминокислотные мутации в разных колониях по отношению к дикому типу (SEQ ID NO: 11). Область сигнального пептида состоит из остатков с 1 по 20, а зрелый внеклеточный домен (ECD) начинается с остатков от 21 до 170. Линкерный домен начинается с остатков от 171 до 175. Нумерация аминокислотных мутаций в каждой последовательности начинается с ее зрелой области
(SEQ ID NO:11)
A112I/A120V
(клон #5)
(клон #4)
(клон #2)
(клон #1)
(клон #3)
Пример 2. Аффинность связывания варианта sPD-1 с PD-L1 и PD-L2
Анализ аффинности связывания выполняли в соответствии с протоколом анализа производителя. Модель машины - Biacore T200, GE Healthcare Life Sciences. Эксперименты проводились при 25°С. Аналитами были PD-L1 человека и PD-L2 человека. Рабочим буфером был HBS-EP+. Вкратце, IgG против человеческого Fc иммобилизовали на сенсорном чипе CM5. Варианты sPD-1 были закреплены на иммобилизованный сенсорный чип. Многоканальную кинетику выполняли с введением серийно разведенного аналита.
Гибридный белок варианта sPD-1- Fc продемонстрировал около 10000-кратное улучшение связывания PD-L1 по сравнению с гибридным белком WT PD-1 - Fc («исходный гибридный белок Fc») и около 200-кратное улучшение связывания PD-L2 по сравнению с исходным гибридным белком Fc (фиг. 8).
Пример 3. Связывающая активность гибридный белок варианта sPD-1–Fc на клетках MC38
Анализ связывания FACS проводили для оценки активности связывания гибридного белка варианта sPD-1–Fc с линией клеток колоректального рака мыши MC38 и клеток MC38 с нокаутом PD-L1 человека.
Вкратце, клетки культивировали при 37°C с 5% CO2. Клетки собирали в соответствии со стандартными процедурами, а надосадочную жидкость отбрасывали. Клетки распределяли по планшетам для окрашивания по 0,3 миллиона клеток на лунку. Планшеты центрифугировали при 300 g при 4°C в течение 5 минут. Серийную концентрацию гибридного белка варианта sPD-1–Fc и отрицательного контроля в буфере FACS, содержащем 2% FBS, титровали 1: 5 от 500 мкг/мл. В каждую лунку добавляли 100 мкл и клетки инкубировали в течение 1 часа при 4°C. Клетки дважды промывали 200 мкл буфера FACS, центрифугировали при 300 g в течение 5 минут и надосадочную жидкость удаляли до и после каждой промывки. Затем клетки ресуспендировали с помощью антител против IgG человека-Alexa 488. Планшеты инкубировали в течение 1 часа при 4°C. Затем клетки дважды промывали для анализа FACS. Анализы FACS выполняли с помощью FACS Canto II, BD Biosciences в соответствии с инструкциями производителя.
Гибридные белки варианта sPD-1- Fc (например, гибридный белок версии 1 варианта sPD-1–Fc и гибридный белок версии 2 варианта sPD-1–Fc) продемонстрировали более высокую аффинность связывания с нокаутированными клетками MC38-PD-L1, чем группа PD-1 дикого типа (т.е. гибридный белок PD-1 дикого типа-Fc, как указано в SEQ ID NO: 4) (фиг. 9A), хотя гибридные белки варианта sPD-1–Fc также связываются с исходным MC38, но в более низкой степени (фиг. 9B).
Пример 4. Анализ активации Т-клеток
Выделение РВМС: образец крови от отдельного донора разбавляли таким же объемом стерильного PBS, например, 25 мл стерильного PBS добавляли в 25 мл свежей цельной крови и тщательно перемешивали осторожным встряхиванием. 15 мл среды Ficoll-Pague переносили в новую центрифужную пробирку на 50 мл, убедившись, что соотношение объема фиколла и крови составляет 3:4, затем разбавленный образец крови осторожно добавляли на поверхность среды Ficoll, избегая перемешивания, добавляя как можно более осторожно, чтобы отчетливо был виден слой двух жидкостей. Пробирку осторожно переместили в центрифугу при 400g, 30 мин, 20°С, с настройками максимального ускорения и минимального замедления во время центрифугирования. Слой мононуклеарных клеток осторожно абсорбировали и переносили в другую новую стерильную центрифужную пробирку. Стерильный буфер PBS добавляли к собранным PBMC для промывки в объемном соотношении 3:1 и центрифугировали при 300 × g, 10 мин, 20°C. Затем клетки ресуспендировали в 10% FBS + RPMI 1640 для анализа.
Получение нокаутированных клеток Hep3B, нокаутированных по PD-L1 человека, свободных от микоплазмы клеток Hep3b-hPDL1-OS8, получали в 15-сантиметровой чашке, и перед использованием поддерживали конфлуентность на уровне 60-80%. Клетки трипсинизировали с помощью фермента TrypLETM Express, затем трипсин нейтрализовали и клетки собирали в центрифужную пробирку на 50 мл и центрифугировали при 1000 об/мин в течение 5 минут. Надосадочную жидкость отбрасывали, и клетки ресуспендировали с митомицином, 10 мкг/мл (в 5-10 мл среды 10% FBS + RPMI1640). Клетки инкубировали при 37°C в течение 1 часа. Клетки промывали 15-20 мл PBS 4 раза перед подсчетом клеток с помощью цитометра, а затем центрифугировали при 1000 об/мин, 5 мин, при 20°C. Клетки ресуспендировали в 10% FBS + RPMI 1640 для анализа.
Стимуляция PBMC: добавляли PBMC из расчета 50000 клеток/лунку, 100 мкл/лунку, а затем добавляли серии белковых растворов 50 мкл/лунку 5X варианта sPD-1 версии 2 (PD1 V2), 5X PD1 WT или hIgG4 с последующим добавлением клеток Hep3b-hPDL1 по 5000 клеток/лунку в 50 мкл/лунку. Смешанный раствор инкубировали в инкубаторе при 37°C в течение 72 часов. Надосадочную жидкость собирали и замораживали при температуре ниже -20°C перед тестом ELISA. Концентрацию IFN-гамма проверяли с помощью набора для ELISA. Количественное определение IFN-γ определяли с помощью наборов Quantifkine ELISA, приобретенных в R&D. Процедуры выполняли в соответствии с процедурой анализа набора ELISA для человеческого IFN-γ, R&D, кат. № DY285.
На фиг. 10 показано, что гибридные белки варианта 2 sPD-1–Fc способны активировать Т-клетки, выделенные из PBMC человека.
Пример 5: Исследование опухоли in vivo с использованием клеточной линии колоректальной опухоли MC38-hPD-L1
Все животные были приобретены и размещены в аккредитованной AAALC среде с контролируемой температурой и без патогенов. Животных удаляли из исследования, как только размер опухоли достигал этического предела. Мышам C57/B6 инокулировали опухолевые клетки MC38-hPD-L1 и наблюдали в течение 5 дней для подтверждения роста опухоли, а затем распределяли в каждую из трех групп обработки по 10 животных в каждой группе: контроль носителя, анти-PD-L1 антитело, 10 мг/кг (группа положительного контроля) и гибридный белок варианта 2 sPD-1–Fc 10 мг/кг (группа PD1-ECD-Fc 10 мг/кг). Обработку начинали на 6-й день после инокуляции опухоли, и животных удаляли из исследования, когда размер опухоли превышал 2000 мм3. Рост опухоли с течением времени и выживаемость регистрировали в качестве конечной точки эксперимента.
Гибридный белок варианта 2 sPD-1–Fc продемонстрировал превосходную противоопухолевую активность по сравнению с группой положительного контроля (т.е. антитело против PD-L1), о чем свидетельствует уменьшение объема опухоли, усиление ингибирования роста опухоли, увеличение выживаемости и снижение массы тела в группе гибридного белка варианта 2 sPD-1–Fc (т.е. группа PD-1-ECD-Fc) по сравнению с группой анти-PD-L1 антитела.
Пример 6. Экспрессия PD-L2 в трансдуцированных лентивирусами клетках Hep3B-OS8 и клетках MC38
Клетки Hep3B-OS8 и клетки MC38 трансдуцировали лентивирусной плазмидой с экспрессией человеческого PD-L2.
Экспрессию PDL2 в отдельных клонах клеток Hep3B-OS8 и клеток MC38 анализировали с помощью FACS. Вкратце, клетки собирали в соответствии со стандартными процедурами, а надосадочную жидкость отбрасывали. Клетки помещали в планшет для окрашивания из расчета 0,3 миллиона клеток на лунку, и планшет центрифугировали при 300 g при 4°C в течение 5 минут. Добавляли 100 мкл/лунку кроличьего анти-hPD-L2 (1 мкг/тест) антитела в буфере FACS, титровали, и инкубировали в течение 1 часа при 4°C. Клетки дважды промывали 200 мкл буфера FACS, центрифугировали при 300 g в течение 5 мин и надосадочную жидкость удаляли до и после каждой промывки. Клетки ресуспендировали при 100 мкл/лунку с разбавлением 1: 1000 вторичного антитела. Планшеты инкубировали 30 мин при 4°C. Клетки промывали 2 раза 200 мкл буфера FACS, центрифугировали при 300 g в течение 5 мин, и надосадочную жидкость отбрасывали до и после каждой промывки. Клетки ресуспендировали в 100 мкл PBS. Клетки хранили в темноте и подвергали анализу FACS. Анализы FACS выполняли с помощью FACS Canto II, BD Biosciences в соответствии с инструкциями производителя.
Фиг. 13 показывает, что PD-L2 человека сверхэкспрессируется в клеточных линиях Hep3B и MC38.
Пример 7. Связывающая активность гибридный белок варианта sPD-1–Fc на клетках Hep3b, сверхэкспрессирующих PD-L2 человека (Hep3B-hPDL2)
Анализ связывания FACS выполняли для оценки активности связывания гибридного белка варианта sPD-1–Fc с клетками линии гепатоцеллюлярного рака человека клетками Hep3b, сверхэкспрессирующими PD-L2 человека (Hep3B-hPDL2).
Вкратце, клетки культивировали при 37°C с 5% CO2. Клетки собирали в соответствии со стандартными процедурами, а надосадочную жидкость отбрасывали. Клетки распределяли по планшетам для окрашивания по 0,3 миллиона клеток на лунку. Планшеты центрифугировали при 300 g при 4°C в течение 5 минут. Последовательные концентрации гибридного белка варианта sPD-1–Fc, PD-1 дикого типа, PDL2 tab1 и отрицательного контроля IgG4 человека в буфере FACS, содержащем 2% FBS, титровали 1:5 начиная с 500 мкг/мл. В каждую лунку добавляли 100 мкл и клетки инкубировали в течение 1 часа при 4°C. Клетки дважды промывали 200 мкл буфера FACS, центрифугировали при 300 g в течение 5 минут и надосадочную жидкость удаляли до и после каждой промывки. Затем клетки ресуспендировали с помощью антител против IgG человека-Alexa 488. Планшеты инкубировали в течение 1 часа при 4°C. Затем клетки дважды промывали для анализа FACS. Анализы FACS выполняли с помощью FACS Canto II, BD Biosciences в соответствии с инструкциями производителя.
Фиг. 14 показано, что гибридный белок варианта sPD-1–Fc (например, вариант гибридный белок варианта 2 sPD-1–Fc) продемонстрировал более высокую аффинность связывания с клетками Hep3B-hPDL2, чем группа PD-1 дикого типа.
Пример 8. Анализ активации Т-клеток в совместном культивировании PBMC и Hep3B-OS8-PDL2 4B9
Выделение РВМС: образец крови от отдельного донора разбавляли таким же объемом стерильного PBS, например, 25 мл стерильного PBS добавляли в 25 мл свежей цельной крови и тщательно перемешивали осторожным встряхиванием. 15 мл среды Ficoll-Pague переносили в новую центрифужную пробирку на 50 мл, убедившись, что соотношение объема фиколла и крови составляет 3: 4, затем разбавленный образец крови осторожно добавляли на поверхность среды Ficoll, избегая перемешивания, добавляя как можно более осторожно, чтобы были отчетливо видны слои двух жидкостей. Пробирку осторожно переместили в центрифугу при 400g, 30 мин, 20°C, с настройками максимального ускорения и минимального замедления во время центрифугирования. Слой мононуклеарных клеток осторожно абсорбировали и переносили в другую новую стерильную центрифужную пробирку. Стерильный буфер PBS добавляли к собранным PBMC для промывания в объемном соотношении 3: 1 и центрифугировали при 300 × g, 10 мин, 20°C. Затем клетки ресуспендировали в 10% FBS + RPMI 1640 для анализа.
Приготовление клеток Hep3B hPD-L2: свободные от микоплазмы клетки Hep3b-hPDL2-OS8 получали в 15-сантиметровой чашке, и перед использованием поддерживали конфлуентность на уровне 60-80%. Клетки трипсинизировали с помощью экспресс-фермента TrypLETM, затем трипсин нейтрализовали и клетки собирали в центрифужную пробирку на 50 мл центрифугированием при 1000 об/мин в течение 5 минут. Надосадочную жидкость отбрасывали, и клетки ресуспендировали с митомицином, 10 мкг/мл (в 5-10 мл среды 10% FBS + RPMI1640). Клетки инкубировали при 37°C в течение 1 часа. Клетки промывали 15-20 мл PBS 4 раза перед подсчетом клеток с помощью цитометра, а затем центрифугировали при 1000 об/мин, 5 мин, при 20°C. Клетки ресуспендировали в 10% FBS + RPMI 1640 для анализа.
Стимуляция PBMC: добавляли PBMC из расчета 50000 клеток/лунку, 100 мкл/лунку, а затем добавляли серии белковых растворов 50 мкл/лунку 5X варианта sPD-1 версии 2 (PD1 V2), 5X PD1 WT или hIgG4 по 50 мкл/лунку с последующим добавлением Hep3b-hPDL2. клеток по 5000 клеток/лунку по 50 мкл/лунку. Смешанный раствор инкубировали в инкубаторе при 37°C в течение 72 часов. Надосадочную жидкость собирали и замораживали при температуре ниже -20°C перед тестом ELISA. Концентрацию IFN-гамма проверяли с помощью набора для ELISA. Количественное определение IFN-γ определяли с помощью наборов Quantifkine ELISA, приобретенных в R&D. Процедуры выполняли в соответствии с процедурой анализа набора ELISA для человеческого IFN-γ, R&D, кат. № DY285.
На фиг. 15 показано, что гибридные белки варианта 2 sPD-1–Fc способны активировать Т-клетки в тесте активации Т-клеток с совместным культивированием PBMC и Hep3B-OS8-PDL2 4B9.
Пример 9. Исследование опухоли in vivo с использованием линии клеток колоректальной опухоли MC38-hPDL2
Все животные были приобретены и размещены в аккредитованной AAALC среде с контролируемой температурой и без патогенов. Животных удаляли из исследования, как только размер опухоли достигал этического предела. Мышей C57/B6 инокулировали опухолевыми клетками MC38-hPD-L2 и наблюдали в течение 5 дней для подтверждения роста опухоли, а затем распределяли в каждую из трех групп обработки по 10 животных в каждой группе: контроль носителя, анти-PD-L1 антитело, 10 мг/кг (группа положительного контроля) и гибридный белок варианта 2 sPD-1–Fc, 10 мг/кг (группа PD1-ECD-Fc 10 мг/кг). Обработку начинали на 6-й день после инокуляции опухоли, и животных удаляли из исследования, когда размер опухоли превышал 2000 мм3. Рост опухоли с течением времени и выживаемость регистрировали в качестве конечной точки эксперимента.
Фиг. 16 показывает, что гибридный белок версии 2 варианта sPD-1–Fc продемонстрировал эквивалентную противоопухолевую активность по сравнению с группой положительного контроля (т.е. анти- PD-1 антитело, пембролизумаб), о чем свидетельствует уменьшенный объем опухоли.
Пример 10: Нейтрализация PD-L1 и PD-L2 для повышения эффективности ингибиторов иммунных контрольных точек
Реферат
Ингибиторы иммунных контрольных точек, нацеленные на PD-1 и PD-L1, внесли значительный вклад в лечение раковых заболеваний, став одной из наиболее широко используемых иммунотерапевтических средств. К сожалению, низкая частота ответа пациентов представляет собой серьезную клиническую проблему, и для устранения этого недостатка большая часть исследовательских усилий была сосредоточена на повышении эффективности и скорости ответа для пациентов, получающих терапию с помощью иммунных контрольных точек. В этом исследовании мы представили как клинические, так и биологические доказательства того, что PD-L2 высоко экспрессируется при некоторых типах раковых заболеваний, таких как рак яичников, желудка и пищевода, каждый из которых плохо реагирует на ингибиторы PD-1 и PD-L1. Мы предполагаем, что такое отсутствие эффективности частично связано с подавляющим уровнем PD-L2, присутствующего в опухолях. В соответствии с предыдущим открытием, что PD-L2 имеет в 10 раз более высокую аффинность связывания с PD-1 по сравнению с PD-L1, высокие уровни PD-L2 приводят к недостаточной блокаде сигнального пути PD-1. Чтобы преодолеть этот клинический недостаток, мы сконструировали мутантную растворимую молекулу-приманку PD-1, которая связывает и нейтрализует как PD-L1, так и PD-L2 с улучшенной аффинностью связывания в 10000 и 200 раз, соответственно по сравнению с их взаимодействием дикого типа. Такое усиление аффинности связывания частично обусловлено консервативными аминокислотными мутациями как внутри, так и за пределами границы связывания. Кроме того, мы продемонстрировали, что мутантные молекулы sPD-1 способны стимулировать опосредованное Т-клетками уничтожение, не влияя на жизнеспособность Т-клеток, что впоследствии привело к превосходной эффективности in vivo на множественных сингенных моделях рака, управляемых как PD-L2, так и PD-L1.
Введение
Терапевтическое ингибирование сигнального пути PD-1 оказалось успешной стратегией в лечении злокачественных заболеваний (Berger and Pu 2018, Gene 638: 20-25, полностью включено в настоящий документ ссылкой), демонстрируя беспрецедентный устойчивый ответ в клинике (Abdel-Rahman 2016, Immunotherapy 8 (12): 1383-1391, полностью включено в данный документ ссылкой). Терапевтические антитела против PD-1 и PD-L1 одобрены для лечения различных типов раковых заболеваний в качестве монотерапии или в сочетании с действующими стандартами лечения (Abdel-Rahman 2016, Immunotherapy 8 (12): 1383-1391, полностью включено в данный документ ссылкой). К сожалению, клиническая реакция на ингибиторы PD-1/PD-L1 может быть столь же разнообразной, как и гетерогенная природа самих злокачественных заболеваний, что дополнительно раскрывает сложность иммунной регуляции и дисрегуляции, связанных с прогрессированием ракового заболевания (Ruiz de Galarreta, Bresnahan et al. 2019, Cancer Discov 9 (8): 1124-1141, полностью включено в данный документ ссылкой). Было ясно продемонстрировано, что активация сигнального пути PD-1 требует связывания и активации PD-L1 и PD-L2 (Latchman, Wood et al. 2001, Nat Immunol 2(3): 261-268; Ishida, Iwai et al. 2002, Immunol Lett 84 (1): 57-62, полностью включено в данный документ ссылкой). PD-L1 является преобладающим лигандом для PD-1 и представляет собой хорошо изученный и признанный биомаркер терапевтического ответа на PD-1 (Freeman, Long et al. 2000, J Exp Med 192 (7): 1027-1034, полностью включено в данный документ ссылкой). Однако роль PD-L2 в иммунобиологии опухолей остается неясной (Bardhan, Anagnostou et al. 2016, Front Immunol 7: 550, полностью включено в данный документ ссылкой).
В клинике предпринимались постоянные попытки повысить скорость ответа ингибиторов PD-1/PD-L1 путем тестирования этих ингибиторов в сочетании с коктейлем цитотоксических препаратов, таргетной терапии и лучевой терапии с целью повышения терапевтической эффективности при сохранении управляемого профиля токсичности (Sullivan, Hamid et al. 2019, Nat Med 25 (6): 929-935, полностью включено в данный документ ссылкой). Тем не менее, несмотря на все усилия, все еще вызывает недоумение тот факт, что некоторые типы раковых заболеваний, такие как рак яичников, рак пищевода и рак желудка, по-прежнему испытывают неоптимальный клинический ответ, демонстрируя минимальную инфильтрацию цитотоксических Т-клеток CD8+ и ограниченную активность Т-клеток (Meza-Perez and Randall 2017, Trends Immunol 38 (7): 526-536; Sato, Olson et al. 2005, Proc Natl Acad Sci U S. A 102 (51): 18538-18543, полностью включено в данный документ ссылкой). Интересно, что иммуногистохимический анализ опухолей пациентов выявил дополнительную информацию относительно экспрессии PD-L1 и PD-L2 в опухолях. Хотя экспрессия PD-L1 остается высокой при многих злокачественных новообразованиях. PD-L2, в значительной степени недостаточно изученный второй лиганд PD-1, также сообщается о высокой экспрессии при этих раковых заболеваниях, которые, как известно, плохо реагируют на ингибиторы PD-1/PD-L1 (Mak, Tong et al. 2016, Clin Cancer Res 22 (3): 609-620, настоящим полностью включено ссылкой). Хотя распространено мнение, что лечение антителами против αPD-1 достаточно для блокирования опосредованной PD-L1 и PD-L2 активации PD-1 (Garon, Rizvi et al. 2015, N Engl J Med 372 (21): 2018-2028, полностью включено в данный документ ссылкой). Однако исследования связывания, проведенные нами и другими, показали значительно более высокую аффинность связывания между PD-1 и PD-L2 по сравнению с PD-1 и PD-L1 (Lazar-Molnar, Yan et al. 2008, Proc Natl Acad Sci U S. A 105 (30): 10483-10488, полностью включено в настоящий документ ссылкой), что дает PD-L2 значительное преимущество при конкуренции с антителами PD-1 за связывание с рецептором.
В этом исследовании мы демонстрируем, что сверхэкспрессия PD-L2 является клинически значимым наблюдением при раке яичников, пищевода и желудка и коррелирует с высокой экспрессией PD-L1, также как и исключение CD8+ цитотоксических Т-клеток. Это наблюдение побудило нас разработать ловушку растворимого лиганда PD-1 с повышенной аффинностью связывания с PD-L1 и PD-L2. Растворимый мутант PD-1 показал в 10000 и 200 раз улучшение аффинности связывания с рецептором PD-1 по сравнению со связыванием дикого типа между PD-L1 и PD-L2, соответственно. Структурное моделирование комплекса рецептор-лиганд выявило уникальные мутации как в интерфейсах связывания, так и в сайтах без связывания, способствующих такому усилению аффинности. Это повышение аффинности связывания транслировалось в улучшенное ингибирование активности рецептора PD-1 как in vitro, так и in vivo, превосходя антитела, нацеленные на PD-L1 и PD-1, при нескольких типах раковых заболеваний. Что еще более важно, с помощью как генетических, так и фармакологических подходов мы укрепили биологическую потребность PD-L2 в качестве независимого участника передачи сигналов PD-1 и продемонстрировали, что применение высокоаффинного растворимого мутанта PD-1 является клинически жизнеспособной стратегией для нацеливания на раковые опухоли, экспрессирующие как PD-L1, так и PD-L2.
Результаты
PD-L2 чрезмерно экспрессируется в опухолях яичников, пищевода, желудка и головного мозга человека.
Хотя PD-L1-опосредованная передача сигналов PD-1 была предметом обширных исследований в области иммуноонкологии, о статусе PD-L2 известно меньше, особенно при раковых заболеваниях, которые плохо реагируют на анти-PD-1/PD-L1 терапии (Derks, Nason et al. 2015, Cancer Immunol Res 3(10): 1123-1129; Lingohr, Dohmen et al. 2019, Epigenomics 11(6): 639-653; настоящим полностью включен в качестве ссылки). В текущем исследовании мы хотели изучить клиническую значимость PD-L2 во время прогрессирования опухоли и, в частности, типы раковых заболеваний, которые показали неоптимальный противоопухолевый эффект в ответ на ингибиторы контрольных точек. Мы выбрали ТМА рака человека из рака яичников (n = 156), рака пищевода (n = 72), рака желудка (n = 76) и глиобластомы (n = 152). Каждый образец был совместно окрашен PD-L1 (Latchman, Wood et al.), PD-L2 (серый) и пан-цитокератином (красный) в качестве маркера эпителиальных клеток. Специфичность антител против PD-L1 и против PD-L2 была подтверждена в ткани миндалин человека, чтобы избежать возможной перекрестной реактивности между двумя антителами (фиг. 24E). Уровень экспрессии PD-L1 и PD-L2 оценивали в соответствии с интенсивностью окрашивания и дополнительно стратифицировали в соответствии со степенью злокачественности опухоли. При раке яичников, пищевода и желудка экспрессия PD-L1 повышена в злокачественной ткани, но значительно ниже в доброкачественных образцах (фиг. 18A-18C). Интересно, что уровни экспрессии PD-L2 также были значительно увеличены в раковых опухолях, и его паттерн экспрессии отслеживается с PD-L1 при раке яичников, желудка и пищевода (фиг. 18A-18C), за исключением глиобластомы (фиг. 18D). При глиобластоме в опухолях достоверно повышалась только экспрессия PD-L2, независимо от ее степени. Не было обнаружено никаких изменений в экспрессии PD-L1 между нормальными и разными классами образцов глиобластомы (фиг. 18D с количественной оценкой, показанной справа). Хотя в незлокачественной мозговой ткани было очень мало клеток в образце, эти клетки имели интенсивный сигнал для PD-L1, следовательно, высокий балл PD-L1 в нормальной ткани. Корреляции Пирсона между PD-L1 и PD-L2 также были рассчитаны и нанесены на график для каждого типа раковых заболеваний (фиг. 24A-24D). В соответствии с результатами иммуноокрашивания мы обнаружили положительную корреляцию между PD-L1 и PD-L2 для всех четырех типов раковых заболеваний, подтверждая нашу гипотезу о том, что PD-L2 присутствует в изобилии в опухолях, плохо реагирующих на терапию иммунными контрольными точками (фиг. 24A-24D). Функционально мы исследовали, приводит ли присутствие экспрессии PD-L1 и PD-L2 к изменениям в инфильтрирующих CD8+ Т-клетках. Мы окрашивали образцы рака яичников (фиг. 18E) и рака пищевода (фиг. 18F) из одних и тех же TMA и снова количественно определяли CD8+ клетки, стратифицированные в соответствии со степенью злокачественности опухоли. При раке яичников незлокачественная ткань яичника с кровеносными сосудами была включена в качестве положительного контроля, показывающего, что большинство CD8+ Т-клеток ограничено кровотоком (фиг. 18E верхняя панель). Репрезентативные изображения рака яичников, положительные и отрицательные в отношении инфильтрации CD8+ Т-клетками, показаны на фиг. 18E и снова количественно оценены в соответствии со степенью злокачественности опухоли (фиг. 25A). При ТМА рака пищевода большинство образцов рака пищевода имели низкое окрашивание CD8+ Т-клеток, за исключением нескольких, показывающих более высокие значения CD8 клеток (фиг. 18F и фиг. 25B). Ткани воспалительного эзофагита были включены в ТМА в качестве положительного контроля. Отсутствие CD8+ Т-клеток в опухоли предполагает, что присутствие как PD-L1, так и PD-L2 может вносить вклад в исключение Т-клеток. Таким образом, наши результаты продемонстрировали высокую экспрессию как PD-L1, так и PD-L2 при нескольких типах рака с известным неоптимальным клиническим ответом на терапию PD-1/PD-L1, и это также может играть роль в иммунном исключении цитотоксических CD8+ Т-лимфоцитов в пораженных раком тканях.
Конструирование мутантов sPD-1 с превосходной аффинностью связывания с PD-L1 и PD-L2
Изощренный способ противодействия как PD-L1, так и PD-L2 в биологической системе состоит в использовании растворимого компонента рецептора PD-1 (фиг. 19A). К сожалению, природная аффинность растворимого PD-1 дикого типа и обоих его лигандов низка в микромолярном диапазоне, что делает sPD-1 дикого типа неэффективным антагонистом для блокирования оси передачи сигналов PD-1/PD-L1/PD-L2 (Lazar-Molnar, Yan et al. 2008, Proc Natl Acad Sci U S A 105(30): 10483-10488, полностью включено в данный документ ссылкой). В попытке разработать антагонисты с высокой аффинностью связывания в отношении нейтрализации как PD-L1, так и PD-L2, мы создали библиотеку мутантов путем введения случайных мутаций во внеклеточный компонент молекулы PD-1 (растворимый PD-1). Применяя аналогичную стратегию, которую мы ранее опубликовали (Kariolis, et al. 2014, Nat Chem Biol 10 (11): 977-983, полностью включено в данный документ ссылкой) была представлена мутантная библиотека в виде гибридных белков на поверхности дрожжевых клеток, дополнительно обогащенная клонами с улучшенным связыванием с PD-L1 (фиг. 19B и фиг. 26). После шести раундов сортировки клоны с превосходной аффинностью связывания секвенировали для дальнейшей характеризации и анализа (фиг. 37). Восемь остатков были мутированы в домене sPD-1, соответствующем Ser62, Ser87, Pro89, Asn116, Gly124, Ser127, Ala132 и Ala140, с нумерацией положений, начинающейся с сигнальной области (таблица 4). Обновленная версия мутанта sPD-1 (версия 2) была создана путем удаления мутации в Asn116, чтобы избежать мутации сайта N-гликозилирования. Обе мутантные версии были слиты с доменом Fc из IgG4 человека для повышения стабильности и кажущихся аффинностей. Кажущиеся аффинности мутантных V1 и V2 из IgG4 к PD-L1 и PD-L2 человека количественно измеряли с использованием технологии поверхностного плазмонного резонанса BIAcore® и сравнивали с sPD-1 дикого типа - IgG4. Значительное улучшение аффинностей связывания с PD-L1 и PD-L2 человека было обнаружено в мутантных V1 и V2 по сравнению с sPD-1 дикого типа, демонстрируя приблизительно 10 000-кратное и 200-кратное улучшение аффинности связывания с PD-L1 и PD- L2, соответственно (фиг. 8). В обоих случаях это улучшение аффинности в первую очередь было вызвано более низкой скоростью диссоциации (фиг. 19C и 19D). Поскольку мы не увидели значительных различий в KD между мутантом sPD-1 V1 и мутантом sPD-1 V2. Все исследования на клетках и in vivo проводились с использованием мутанта sPD-1 V2. Совместно, используя технологию на основе дрожжевого дисплея, мы идентифицировали мутантные клоны sPD-1, проявляющие высокую аффинность связывания с PD-L1 и PD-L2. Эти клоны могут быть дополнительно охарактеризованы для оценки как структурного, так и биологического улучшения в результате сайт-специфических мутаций.
Вычислительное моделирование для определения структурной основы связывания с высокой аффинностью
Чтобы определить изменения в структурном подтверждении, которые приводят к такому увеличению аффинности между PD-1/PD-L1 и PD-L2, мы выполнили компьютерное моделирование, сравнивая PD-L1 и PD-L2 человека в совместном комплексе с мутантом sPD-1. Структура комплекса PD-1/PD-L1 человека дикого типа доступна в PDB (4ZQK и 5IUS). Однако, поскольку отсутствуют и мутированы остатки в области петли PD-1, мы сначала зафиксировали недостающую петлю и снова мутировали остаток на PD-1 дикого типа на основе 4ZQK. Выравнивание последовательностей 4ZQK и 5IUS показано на фиг. 2. Структуру мутанта sPD-1 моделировали с помощью модуля сканирования остатков в Schrodinger Suite. Кристаллическая структура PD-1 и PD-L1 показана синим и зеленым цветом, соответственно с 8 мутациями (Ser62, Ser87, Pro89, Asn116, Gly124, Ser127, Ala132 и Ala140 с нумерацией положений, начиная с сигнальной области), показанными оранжевыми палочками (фиг. 3). Объединив знания из ранее опубликованной литературы и наши данные структурного моделирования, мы идентифицировали остатки G124S, S127V и A132I как мутации в пределах области взаимодействия при связывании, S62G, S87G, P89L и A140V лежат вне области взаимодействия при связывании. G124S и A132I каждый образуют одну дополнительную водородную связь с Tyr 123 и Gln 66 PD-L1, соответственно (фиг. 20A, левая и правая панели). Мутация A132I также привела к увеличению поверхности, комплементарной PD-L1, с 0,72 до 0,85 (фиг. 20B, фиг. 29). Для дальнейшего изучения того, как эти мутации влияют на общее связывание между PD-1 и PD-L1, были рассчитаны вариации аффинности связывания и стабильности комплекса до и после отдельной мутации с результатами, приведенными в таблице 4. Расчет вариации аффинности связывания и стабильности комплекса также выполняли для сгруппированных мутаций внутри и вне границы связывания (таблица 5). Более высокое отрицательное значение указывает на повышенную аффинность связывания и стабильность. В целом, мутации в области взаимодействия способствовали как аффинности связывания, так и стабильности белка, как и ожидалось, а мутации вне области взаимодействия при связывании приводят к повышенной стабильности. Интересно, что мутация A140V за пределами границы связывания значительно улучшает стабильность комплекса на 25,89 ккал/моль. Это наблюдение дополнительно подкрепляло важность объективного подхода к скринингу для идентификации мутаций вне границы связывания для улучшения общей стабильности совместного комплекса.
Поскольку структура белка PD-L2 человека недоступна в PDB, модель PD-L2 человека была построена с использованием доступных структур PD-L2 мыши в качестве шаблонов (фиг. 5A). Идентичность последовательностей PD-L2 человека и PD-L2 мыши составляет около 72% (фиг. 6, фиг. 5A). Наложение предлагаемой модели PD-1/PD-L2 человека и кристаллической структуры PD-1/PD-L2 мыши (PDBID: 3BP5) показано на фиг. 6 и фиг. 5B. Кристаллическая структура совместного комплекса мутантного sPD-1 с предлагаемым PD-L2 человека показана на фиг. 7. По сравнению с предлагаемыми человеческими PD-1/PD-L2 дикого типа, аналогичным связыванию PD-1/PD-L1, мутация A132I снова сохранила ту же дополнительную водородную связь с PD-L2, что привело к увеличению поверхностной комплементарности (фиг. 20C и фиг. 30). Расчет вариации аффинности связывания и стабильности белка также выполняли для одиночной мутации и сгруппированных мутаций внутри и за пределами области взаимодействия при связывании (таблица 8 и таблица 9). На основе анализа структурного моделирования мы показали, что мутации как внутри, так и за пределами области взаимодействия при связывании способствуют улучшению общей аффинности связывания и стабильности.
Мутанты sPD-1 блокируют опосредованную PD-L1 и PD-L2 активацию PD-1 и вызывают активацию Т-клеток
Чтобы продемонстрировать, что мутанты sPD-1 могут эффективно нарушать взаимодействия между PD-L1/PD-L2 и PD-1, мы сначала оценили активность связывания мутантов sPD-1 с PD-L1 с использованием клеток MC38 с нокаутом PD-L1 человека (предоставлен ChemPartner, Шанхай). Обе версии мутантов sPD-1, sPD-1 дикого типа и контрольные hIgG4 тестировали с использованием анализа связывания на основе FACS. Значительное улучшение сигнала связывания наблюдалось с обеими версиями мутантов sPD-1 по сравнению с sPD-1 дикого типа и контролем hIgG4, где не может быть обнаружен флуоресцентный сигнал в диапазоне вплоть до мкМ для sPD-1 дикого типа (фиг. 9А). Чтобы подтвердить связывание sPD-1 с PD-L1 мыши для проведения последующего тестирования in vivo, мы также проанализировали связывание мутанта sPD-1 с исходным MC38 дикого типа, экспрессирующим PD-L1 и PD-L2 мыши. Увеличение сигнала связывания также было обнаружено как для версии 1, так и для версии 2 по сравнению с sPD-1 дикого типа с общей более низкой интенсивностью (фиг. 9B). Анализ связывания также повторяли в клеточной линии гепатоцеллюлярной карциномы Hep3B-OS8-hPD-L1 (ChemPartner, Шанхай) с аналогичными результатами (фиг. 31). Чтобы проверить, способны ли мутанты sPD-1 блокировать опосредованное рецептором взаимодействие между PD-L1 и PD-1. Мы провели анализ связывания с рецептором (RBA) с использованием мутантов sPD-1, sPD-1 дикого типа и контроля hIgG4. Оба мутанта sPD-1 показали более сильное ингибирование PD-L1-опосредованного связывания с рецептором с PD-1 по сравнению с sPD-1 дикого типа и hIgG4 (фиг. 21A). Чтобы продемонстрировать, что мутант sPD-1 способен связываться с PD-L2 и блокировать опосредованную PD-L2 активацию PD-1, мы сверхэкспрессировали PD-L2 человека как в клетках MC38, так и в клетках Hep3B (фиг. 32 и 33). Для анализа связывания мы тестировали мутант V2 sPD-1 вместе с sPD-1 дикого типа, антителом αPD-L2 в качестве положительного контроля и hIgG4 в качестве отрицательного контроля. Мутант sPD-1 показал лучшее связывание с MC38-PD-L2, sPD-1 дикого типа, а антитело αPD-L2 связывается с MC38-PD-L2 с меньшей эффективностью (фиг. 14). Точно так же мутант sPD-1 также проявлял повышенную способность блокировать опосредованную PD-L2 активацию PD-1 в анализе связывания с рецептором (фиг. 21B). Чтобы проверить, способен ли мутант sPD-1 активировать цитотоксические Т-клетки человека посредством блокирования передачи сигналов, опосредованной PD-L1 или PD-L2, PBMC человека собирали у здоровых доноров и инкубировали с клетками Hep3B-OS8-hPDL1 и Hep3B-OS8-hPDL2. Добавляли мутант sPD-1, PD-1 дикого типа и IgG4 и измеряли активность цитотоксических Т-клеток по уровню интерферона-γ. Мутант sPD-1 обладает высокой способностью активировать Т-клетки в присутствии PD-L1 и PD-L2, соответственно по сравнению с sPD-1 дикого типа и IgG4 в зависимости от дозы (фиг. 10 и 15), подтверждая аргумент, что мутант sPD-1 может функционально стимулировать активность Т-клеток путем блокирования взаимодействия между PD-L1/PD-L2 и PD-1. Поскольку длительная стимуляция активности Т-клеток посредством прямого связывания с использованием антител αPD-1 и рецепторов PD-1 на Т-клетках может потенциально влиять на функциональность и жизнеспособность Т-клеток с течением времени, наш мутант sPD-1 был разработан только для нацеливания на раковые клетки, экспрессирующие PD-L1 и PD-L2, стремясь сохранить долговечность и функциональность Т-клеток. Чтобы проверить эту гипотезу, мы сначала изготовили как мутанты sPD-1 (V1 и V2), так и sPD-1 дикого типа, все слитые с человеческим Fc из IgG4 с высокой чистотой и низким содержанием эндотоксина (фиг. 28). Затем обрабатывали активированные Т-клетки человека (посредством стимуляции коктейлем CD3/CD28) либо αPD-1 антителом, либо мутантом sPD-1 в присутствии или в отсутствие PD-L1 в течение 12 дней. Непрерывная обработка αPD-1 замедляла пролиферацию Т-клеток с течением времени, в то время как обработка мутантом sPD-1 не влияла на рост T-клеток, показывая скорость роста, аналогичную скорости роста T-клеток, стимулированных CD3/CD28. Как и ожидалось, нативные Т-клетки не пролиферировали в отсутствие стимуляции CD3/CD28 (фиг. 21C). Эти наблюдения подтверждают идею о том, что мутант sPD-1 способен связывать и блокировать сигнальный каскад PD-1/PD-L1 и PD-L2 и стимулировать активность Т-клеток, сохраняя при этом жизнеспособность и функциональность Т-клеток.
Мутант sPD-1 демонстрирует превосходную противоопухолевую эффективность на сингенных моделях злокачественных новообразований у мышей
Терапевтическая эффективность мутанта sPD-1 оценивалась на нескольких сингенных моделях опухолей мышей. Мутант sPD-1 без мутации в сайте N-гликозилирования (Asn116) использовали для всех исследований in vivo. Для определения схемы дозирования и фармакокинетики мутанта sPD-1 in vivo. Молекулу метили флуоресцентным красителем, и мышам вводили разовую дозу 10 мг/кг и получали изображения через 30 минут, 8 часов, 24 часа и 72 часа после обработки (фиг. 22A). Кроме того, ELISA, детектирующий часть IgG4 человека из мутантной молекулы sPD-1, также выполняли на сыворотке, взятой с течением времени у животного, получавшего такую же дозу (фиг. 22B). И флуоресцентный анализ, и анализ ELISA позволили сделать аналогичный вывод о том, что период полувыведения мутантной молекулы sPD-1 составляет приблизительно 24 часа после введения дозы, что является основанием для введения дозы in vivo в дозе 10 мг/кг каждые 48 часов. Мышей, которым подкожно привили колоректальный рак MC38-hPDL1, лечили контрольным носителем, мутантом sPD-1 или атезолизумабом. Значительное снижение роста опухоли наблюдалось как в опухолях, получавших мутант sPD-1, так и в опухолях, обработанных атезолизумабом (фиг. 11A). По сравнению с лечением атезолизумабом опухоли, обработанные мутантом sPD-1, показали превосходную эффективность в подавлении роста опухоли и увеличили выживаемость без серьезной токсичности, определяемой изменением массы тела (фиг. 11C, 35, 11B), что дополнительно дает обоснование для нацеливания как на PD-L1, так и на PD-L2 для достижения оптимальной противоопухолевой активности (фиг. 11B). Способность мутанта sPD-1 противодействовать опосредованному PD-L2 росту опухоли была продемонстрирована на моделях in vivo, инокулированных опухолями MC38, сверхэкспрессирующими PD-L2 человека (фиг. 22C). Существенная задержка роста опухоли наблюдалась у мышей с опухолью, получавших мутант sPD-1 или антитело против αPD-1, пембролизумаб. Хотя статистически не значимо, наблюдалась тенденция к лучшему подавлению роста опухоли в группе, получавшей мутант sPD-1, по сравнению с группой, получавшей пембролизумаб, что может потребовать дальнейшего исследования (фиг. 22C). Противоопухолевую эффективность мутанта sPD-1 также тестировали на мышиной модели меланомы B16/OVA и модели рака яичника ID8. Опухоли меланомы, обработанные мутантом sPD-1, не могут поддерживать рост опухоли по сравнению с группами, обработанными носителем (фиг. 22D). Клинически известно, что пациенты с раком яичников плохо реагируют на ингибирование PD-1. В этом исследовании мы хотели проверить эффективность мутанта sPD-1 на сингенной модели рака яичников. Животных с ортотопически инокулированными опухолевыми клетками яичника ID8 обрабатывали контрольным носителем; Мутант sPD-1 или мышиное αPD-1 антитело и животные были прекращены при развитии асцита. Анализ выживаемости по Каплан-Майеру показал улучшение общей выживаемости как для групп, обработанных мышиным антителом αPD-1, так и для групп, обработанных мутантом sPD-1. Однако наиболее значительные преимущества в выживаемости наблюдались у животных, получавших мутантную группу sPD-1, что позволяет предположить, что мутант sPD-1 более эффективен, когда направлен на рак яичников, а не на блокирование рецептора PD-1 (фиг. 22E). Т-клетки, инфильтрирующие опухоль (TIL), анализировали на мышах, несущих опухоли B16/OVA (фиг. 22F) и MC38 (фиг. 22G и 22H), обработанные антителом αPD-1 или мутантом sPD-1. Обработка обоими ингибиторами снова приводила к повышенной инфильтрации цитотоксических Т-клеток CD4+, CD8+, причем наиболее значительные изменения наблюдались в группах лечения мутанта sPD-1. Также были составлены профили других ассоциированных с опухолью иммунных клеток, но не было обнаружено значительных различий между группами лечения (фиг. 36). В совокупности мы продемонстрировали превосходную противоопухолевую эффективность мутанта sPD-1, протестированного на множественных сингенных моделях опухолей мышей, частично за счет лучшей инфильтрации TIL и имеющей потенциал для замены как антител αPD-L1, так и αPD-1 в качестве новой формы ингибитора контрольных точек.
Мутант sPD-1 эффективен в животных моделях PD-L2-управляемого рака человека (фиг. 23).
Для того, чтобы продемонстрировать, что PD-L2 является функционально важным лигандом PD-1, и PD-L2 способен способствовать опосредованному PD-1 росту опухоли, особенно при типах раковых заболеваний, которые плохо реагируют на ингибирование PD-L1. Мы генетически удалили PD-L1 в опухолевых клетках яичника ID8 с использованием технологии CRISPR-CAS9 и инокулировали опухолевые клетки мышам с нокаутом PD-L1, устранив экспрессию PD-L1 как в опухоли, так и в организме хозяина (фиг. 23А и 37А). Интересно, что полная потеря PD-L1 действительно приводила к более медленной скорости роста опухоли и формированию опухолей меньшего размера по сравнению с опухолью ID8 дикого типа, выращенной у нормальных мышей C57/B6. Тем не менее удовлетворительный рост опухоли действительно происходил, когда мышей инокулировали большим количеством клеток ID8, что возможно из-за повышенной экспрессии PD-L2 (фиг. 2). Опухоли, обработанные мутантом sPD-1, не могут расти и показали значительную регрессию опухоли у некоторых обработанных животных, поскольку ожидаемые опухоли, обработанные антителом αPD-L1, остаются в значительной степени нечувствительными (фиг. 23B и 23C). В отдельном исследовании, где клетки ID8 PD-L1 CRISPR были ортотопически инокулированы внутрибрюшинно, только у трех из восьми мышей в группе, получавшей мутант sPD-1, развился асцит, по сравнению с семью из восьми мышей в группе, получавшей αPD-L1. Значительное повышение выживаемости мышей с раком яичников, который управлялся исключительно PD-L2 (фиг. 23D). Наконец, опухоли c ID8 были окрашены на экспрессию PD-L2 и CD8. Как и ожидалось, все опухоли независимо от групп обработки показали положительную экспрессию PD-L2, однако только опухоли, обработанные мутантом sPD-1, увидели инфильтрацию CD8+ Т-клеток в опухоль из-за потери как PD-L1, так и PD-L2 (фиг. 23E).
В этом исследовании мы продемонстрировали клиническую значимость PD-L2 при раке, который считается слабым ответчиком на ингибитор иммунных контрольных точек, и представили терапевтическую стратегию, которая преимущественно нацелена как на PD-L1, так и на PD-L2 со сверхвысокой аффинностью. Структурный и биологический анализ мутанта sPD-1 убедительно подтвердил нашу гипотезу о том, что улучшение аффинности связывания приводит к более сильному ингибированию пути PD-1 за счет блокирования обоих его лигандов. Вместе с данными in vivo, демонстрирующими усиление противоопухолевого действия, мутант sPD-1 представляет собой жизнеспособный клинический подход для нацеливания на типы раковых заболеваний, у которых отсутствует удовлетворительный ответ на ингибиторы PD-1/PD-L1 в результате высокой экспрессии PD-L2.
Обсуждение
Иммунотерапия, такая как ингибиторы сигнального пути PD-1, произвела революцию в области лечения раковых заболеваний и значительно улучшила выживаемость раковых пациентов, у которых был устойчивый ответ на лечение (Topalian, Hodi et al. 2012, N Engl. J. Med. 366 (26): 2443-2454, полностью включено в данный документ ссылкой). Однако, хотя иммунотерапия действительно заслуживает того, чтобы называться «прорывом» в борьбе с раковыми заболеваниями, определенно не существует универсального подхода, который способствовал бы адекватному иммунному ответу у всех пациентов, получающих лечение. Ответ на ингибиторы PD-1/PD-L1 варьируется в зависимости от типа ракового заболевания, а также у отдельного пациента в одной и той же группе лечения в зависимости от иммуногенной природы злокачественных заболеваний (Pitt, Vetizou et al. 2016, Immunity 44 (6): 1255-1269, полностью включено в данный документ ссылкой). Гетерогенность, наблюдаемая с ингибиторами контрольных точек, может быть связана с несколькими факторами, включая 1), генетические мутации в определенных раковых клетках, вызывающие микронестабильность (MSI-H), более иммуногенны и, следовательно, демонстрируют лучший ответ на ингибиторы PD-1 (Diaz and Le 2015, N Engl J. Med. 373 (20): 1979, полностью включено в данный документ ссылкой). 2). Факторы, секретируемые как раковыми клетками, так и связанными с раком стромальными клетками в микроокружении опухоли, такие как PD-L1 и PD-L2, защищают раковые клетки от иммунного надзора, предотвращая рекрутирование и активацию цитотоксических Т-клеток (Tumeh, Harview et al. 2014, Nature 515 (7528): 568-571, полностью включено в данный документ ссылкой). В совокупности стратегии, которые могут стимулировать иммунный ответ хозяина на раковые клетки-мишени, имеют жизненно важное значение для успеха иммунной контрольной терапии.
В этом исследовании мы сосредоточены на осмыслении как уровня экспрессии, так и корреляции PD-L1 и PD-L2 в типах рака, которые клинически плохо реагируют на терапию контрольной точки PD-1 (Imai, Hasegawa et al. 2018, Oncol Lett 15 (5): 6457-6468, полностью включено в данный документ ссылкой). В отличие от PD-L1, который является более известным лигандом PD-1, роль PD-L2 в развитии раковых заболеваний остается неясной (Yearley, Gibson et al. 2017, Clin Cancer Res 23 (12): 3158-3167, полностью включено в данный документ ссылкой). Интересно, что это противоречит распространенному мнению о том, что PD-L1 является преобладающим лигандом PD-1, который активируется раковыми клетками. Мы наблюдали значительное повышение экспрессии PD-L2 во всех исследованных нами образцах пациентов, и уровень его экспрессии сильно коррелирует с экспрессией PD-L1. Интересно, что мы также наблюдали экспрессию PD-L1 как в раковых, так и в незлокачественных тканях, тогда как повышенная экспрессия PD-L2, по-видимому, ограничивается раковыми тканями, предполагая, что экспрессия PD-L2 может быть индуцирована в ходе онкологических заболеваний. Основываясь на этих наблюдениях, мы полагаем, что экспрессия PD-L2 сильно выражена при раке, который плохо реагирует на ингибиторы PD-1, и адекватное ингибирование как PD-L1, так и PD-L2 необходимо для оптимального противодействия сигнальному пути PD-1.
Можно достичь оптимального подавления сигнального пути PD-1, нарушив взаимодействие рецепторного лиганда между PD-1 и PD-L1/L2. Хотя блокирование рецепторов PD-1 на Т-клетках с помощью антител к PD-1 привело к устойчивому клиническому ответу у подгруппы пациентов, данные наших пациентов показали высокие уровни экспрессии PD-L2 при раковых заболеваниях с низкой скоростью ответа на ингибирование PD-1/PD-L1, предполагая, что присутствие PD-L2 может потенциально подорвать усилие ингибирования PD-1. Действительно, наши данные показали 10-кратное увеличение аффинности нативного связывания между PD-L2 и PD-1, чем аффинность связывания между PD-L1 и PD-1. Хотя большинство антител к αPD-1 претерпевает созревание аффинности, повышая их способность связывать PD-1 в присутствии его лигандов, высокий уровень PD-L2, экспрессируемый раковыми клетками, может значительно препятствовать способности антител αPD-1 конкурировать за связывание с PD-1. Вместо блокирования рецептора PD-1 на Т-клетках мы создали мутанты sPD-1 со значительным повышением аффинности связывания как с PD-L1, так и с PD-L2. С помощью платформы поверхностного дрожжевого дисплея с подходами направленной эволюции (Kariolis, et al. 2014, Nat Chem Biol 10 (11): 977-983, настоящим полностью включено ссылкой), были отобраны мутантные клоны, демонстрирующие значительное повышение аффинности связывания как с PD-L1, так и с PD-L2, и структурная основа, которая обеспечивает такую высокую аффинность связывания, была проанализирована с помощью компьютерного структурного моделирования. Сравнение белкового взаимодействия между sPD-1 дикого типа и мутантным sPD-1 с PD-L1 показало, что изменения в аффинности связывания были результатом как получения дополнительной водородной связи на Ala 132, так и повышения стабильности совместного комплекса в результате мутации в Ser127 и Ala140 с нумерацией положений, начинающейся с сигнальной области. Аналогичные результаты наблюдались при сравнении белкового взаимодействия между комплексом PD1/PD-L2 дикого типа и мутировавшим комплексом PD1/PD-L2, снова подтверждая идею о том, что, хотя мутации, происходящие в области взаимодействия при связывании, могут улучшать аффинность связывания рецептор-лиганд, мутации, находящиеся за пределами области взаимодействия при связывании, не менее важны для обеспечения устойчивости всей конструкции. Интересно, что были сообщения о двух дополнительных исследованиях, в которых были получены клоны sPD-1 с высокой аффинностью связывания (Maute, Gordon et al. 2015, Proc Natl Acad Sci U S A 112(47): E6506-6514; Li, Liang et al. 2018, Cancer Sci 109(8): 2435-2445, полностью включено в данный документ ссылкой). В обоих исследованиях сообщалось об уникальных сайтах мутаций, способствующих их повышенной аффинности связывания, которая не пересекается с нашим текущим исследованием, опять же в поддержку беспристрастного подхода, необходимого для создания терапевтических средств с повышенной аффинностью с желаемыми биологическими свойствами.
Концепция повышенной аффинности трансформируется в превосходную биологическую активность, когда анализ связывания in vitro FACS и анализ RBA четко продемонстрировали, что мутанты sPD-1 привели к повышению аффинности связывания и их способности блокировать взаимодействия между PD-1 и PD- L1/L2. Функционально мутант sPD-1 также приводил к повышенной активности Т-клеток, что является признаком подавления иммунных контрольных точек. Во всех сценариях было очевидно, что и PD-L1, и PD-L2 были достаточными для активации пути PD-1, а добавление мутанта sPD-1 эффективно нарушало передачу сигналов, опосредованную обоими лигандами. В нашем исследовании мы наблюдали снижение жизнеспособности Т-клеток после непрерывной обработки антителами αPD-1, тогда как Т-клетки, обработанные обработкой sPD-1, не влияли на рост клеток. При этом трудно подтвердить, было ли снижение жизнеспособности Т-клеток после обработки αPD-1 результатом истощения Т-клеток. С учетом того, что антитело αPD-1 напрямую связывает и стимулирует Т-клетки, тогда как мутант sPD-1 нацелен только на PD-L1/L2 на раковых клетках, избегание прямого взаимодействия с Т-клеткой может быть полезно для сохранения жизнеспособности и функциональности Т-клеток.
В текущем исследовании оценивали противоопухолевую активность мутанта sPD-1 в отношении как антител αPD-L1, так и αPD-1, чтобы ответить на два вопроса. 1) Может ли мутант sPD-1 превзойти оба антитела αPD-L1 и αPD-1 из-за его повышенной способности блокировать PD-L1 и PD-L2? 2) Может ли мутант sPD-1 влиять на рост опухоли в моделях опухолей, управляемый исключительно PD-L2? Действительно, мутант sPD-1 превосходил по эффективности как αPD-L1 антитела, так и αPD-1 антитела в моделях множественных сингенных опухолей мышей, подтверждая аргумент о том, что повышенная аффинность связывания рецептор-лиганд улучшает терапевтический результат ингибирования PD-1. Что еще более важно, поскольку вклад PD-L2 в рост опухоли остается неопределенным, мы оценили функциональную значимость PD-L2 с использованием мышей с нокаутом PD-L1, инокулированных опухолями PD-L1 CRISPR, доказав, что PD-L2 вместе с опухолью способен стимулировать опухолевый рост в отсутствие PD-L1 и может быть успешно нацелен с использованием мутантов sPD-1, но не антитела αPD-L1. Однако стоит отметить, что как более высокое количество опухолевых клеток, так и замедленный рост опухоли наблюдались в моделях опухолей, лишенных PD-L1, но в конечном итоге присутствие PD-L2 способно поддерживать рост опухоли, на который можно эффективно воздействовать с помощью мутанта sPD-1.
Подводя итог всему вышесказанному, отметим, что это исследование определило PD-L2 как потенциальный фактор риска, связанный с плохой клинической реакцией на ингибиторы PD-1 при нескольких типах раковых заболеваний. Это наблюдение подтолкнуло нас к разработке мутантов sPD-1 с превосходной аффинностью связывания как с PD-L1, так и с PD-L2 в качестве стратегии для устранения взаимодействия между PD-1 и PD-L1/L2. Мутации как внутри, так и за пределами области взаимодействия при связывании способствовали усилению аффинности связывания и приводили к более высокой противоопухолевой активности по сравнению с антителами как αPD-L1, так и αPD-1. Кроме того, наблюдение того, что опухоли, экспрессирующие PD-L2, способны расти независимым от PD-L1 образом in vivo и их рост ингибируется мутантом sPD-1, но не антителом к aPD-L1, еще больше укрепило противоопухолевую роль PD-L2 при раковых заболеваниях. Эти данные в совокупности предоставили обоснование для оценки мутанта sPD-1 в качестве альтернативы ингибиторам PD-1 при лечении рака, экспрессирующего PD-L1 и/или PD-L2.
Материалы и методы
Дизайн исследования
Это исследование было разработано для оценки участия PD-L2 как в моделях in vivo, так и в клинических образцах человека, а также для характеризации структурной, биохимической, функциональной и терапевтической эффективности растворимых мутантов PD-1 со сверхвысокой аффинностью связывания как с PD-L1, так и PD-L2. Все образцы опухолевых микрочипов были коммерчески приобретены в US Biomax (Дервуд, Мэриленд). Сертифицированный ветеринарный патолог провел иммуногистохимическую оценку окрашенных образцов микроматрицы опухоли. Исследования in vivo на мышах проводились с одобрения AAAPLAC в Стэнфордском университете и ChemPartner, Шанхай. Размер выборки для исследований на животных был основан на предыдущем опыте аналогичных исследований in vivo. Всех животных случайным образом разделяли на группы обработки. Образцы не исключались из исследований, за исключением животных, состояние которых требовало досрочного прекращения из-за болезни, не связанной с исследованием. Конечные точки экспериментов были определены заранее для каждого эксперимента. Кривые роста опухоли были представлены для исследований, в которых рост опухоли можно было измерить, а кривые Каплана-Мейера использовались для модели ортотропного рака яичников ID8. Соответствующий статистический анализ использовался для каждого экспериментального исследования.
Клеточные линии
MC38, ID8, ID8-PDL1 CRISPR, B16/OVA, MC38-hPD-L1, MC38-hPD-L2, MC38-hPD-L2-PD-L1 CRISPR, Hep3B-OS8-hPD-L1, Hep3B-OS8-hPD- L2 поддерживали в среде Игла, модифицированной Дульбекко (DMEM), с добавлением 10% фетальной бычьей сыворотки (FBS) и 1% антибиотиков в увлажненном инкубаторе с температурой 37°C и 5% CO2. Клетки обрабатывали трипсином и пассировали при 80% конфлуентности.
Синтез дрожжевой библиотеки sPD-1
ДНК, кодирующую внеклеточный домен PD-1 человека, аминокислоты Leu25 - Val170, клонировали в плазмиду дрожжевого дисплея pCT с использованием сайтов рестрикции NheI и BamHI. Нумерация последовательностей соответствовала использованной в Mihalis S. Kariolis et al. (Kariolis, et al. 2014, Nat Chem Biol 10 (11): 977-983, полностью включено в данный документ ссылкой), чтобы облегчить сравнение их работы с белками дикого типа. Библиотека, полученная с использованием ошибающейся полимеразы, была создана с использованием ДНК внеклеточного домена PD-1 в качестве матрицы, и мутации были введены с использованием неточной полимеразы Taq (Invitrogen) и нуклеотидных аналогов 8-oxo-dGTP и dPTP (TriLink Biotech). Было проведено шесть отдельных реакций ПЦР, в которых варьировали концентрацию аналогов и количество циклов для получения диапазона частот мутаций; пять циклов (200 мкМ), десять циклов (2, 20 или 200 мкМ) и 20 циклов (2 или 20 мкМ). Продукты этих реакций амплифицировали с использованием прямого и обратного праймеров, каждый из которых имел гомологию 50 п.н. с плазмидой pCT в отсутствие аналогов нуклеотидов. Амплифицированную ДНК очищали с помощью гель-электрофореза, и плазмиду pCT расщепляли NheI и BamHI. Очищенную мутантную кДНК и линеаризованную плазмиду электропорировали в соотношении 5: 1 по массе в дрожжи EBY100, где они собирались in vivo посредством гомологичной рекомбинации (Kariolis, et al. 2014, Nat Chem Biol 10 (11): 977-983, настоящим полностью включено ссылкой). Размер библиотеки был оценен как 7,4 × 107 при посеве методом разведения.
Скрининг библиотеки
Дрожжи, презентирующие мутанты PD-1 с высокой аффинностью, выделяли из библиотеки с использованием сортировки клеток с активацией флуоресценции (FACS). Для раундов 1 - 3 FACS проводили сортировки по равновесному связыванию, в которых дрожжи инкубировали при комнатной температуре в фосфатно-солевом буфере с 1 мг/мл BSA (PBSA) со следующими номинальными концентрациями Gas6 (R&D Systems): сортировка 1) 10 нМ PD-L1 в течение 3 ч; сортировка 2) 2 нМ PD-L1 в течение 3 ч; сортировка 3) 0,2 нМ PD-L1 в течение 24 часов. После инкубации с PD-L1 дрожжи осаждали, промывали и ресуспендировали в PBSA с 1: 250 куриным анти-c-Myc (Invitrogen) в течение 1 ч при 4°C. Затем дрожжи промывали, осаждали и проводили вторичное мечение на льду в течение 30 мин с использованием PBSA с разведением 1: 100 козьих антител против куриных антител, меченных Alexa Fluor 555 (Invitrogen) и мышиных анти-HIS антител Hilyte Fluor 488 (Anaspec).
Для раундов FACS 4-6 проводили сортировки по кинетике скорости диссоциации, в которых дрожжи инкубировали с 2 нМ PD-L1 в течение 3 часов при комнатной температуре, после чего клетки дважды промывали для удаления избытка несвязанного Gas6 и ресуспендировали в PBSA, содержащем ~ 50-кратный молярный избыток PD-1 (R&D Systems), чтобы сделать необратимыми события удаления связующего. Продолжительность стадии удаления связующего была следующей: сортировка 4) 4 ч; сортировка 5) 4 ч; сортировка 6) 24 часа, при этом все реакции удаления связующего проводят при комнатной температуре. В течение последнего часа реакции диссоциации куриные анти-c-Myc добавляли до конечного разведения 1: 250. Дрожжи осаждали, промывали и проводили вторичное мечение, как описано ранее. Меченые дрожжи сортировали с помощью FACS с использованием проточного цитометра Vantage SE (Stanford FACS Core Facility) и программного обеспечения CellQuest (Becton Dickinson). Сортировку проводили таким образом, что были отобраны 1–3% клонов с наивысшим соотношением связывания Gas6/экспрессии c-Myc, что обогатило библиотеку клонами с наивысшей аффинностью связывания с Gas6. При сортировке 1 подвергли скринингу 108 клеток, и в последующих раундах было проанализировано как минимум десятикратное количество клонов, собранных в предыдущем раунде сортировки, чтобы гарантировать адекватную выборку разнообразия библиотеки. Отобранные клоны размножали и подвергали дальнейшим циклам FACS. После сортировки 5 и 6 плазмидную ДНК выделяли с использованием набора Zymoprep (Zymo Research Corp.), трансформировали в суперкомпетентные клетки XL-1 blue и выделяли с использованием набора плазмид miniprep (Qiagen). Секвенирование проводили в Sequetech Corp.
Анализ продуктов сортировки дрожжевого дисплея проводили с использованием тех же реагентов и протоколов, которые описаны для сортировок библиотеки. Образцы анализировали на FACSCalibur (BD Biosciences), а данные анализировали с помощью программного обеспечения FlowJo (Treestar Inc.).
Получение рекомбинантного белка
Растворимый PD-1 дикого типа и мутанты, связанные с hIgG4Fc, клонировали в плазмиду pCPC с сигнальным пептидом (ChemPartner, Shanghai) и транзиторно трансфицировали в клетки эмбриональной почки человека HEK293 и культивировали в 4 л OPM-293 CD03. Затем продукты очищали с помощью смолы с протеином A MabSelect SuRe (GE Healthcare) и дополнительно выделяли с помощью эксклюзионной хроматографии superdex 200. За каждой стадией очистки следовали подтверждение SDS-PAGE и анализ SEC-HPLC. Конечные продукты тестировали на эндотоксин и верифицироли при уровне 0,09 МЕ/мг.
Анализ компьютерного моделирования
Структура комплекса PD1/PDL1 человека доступна в банке данных по белкам, PDBID - 4ZQK и 5IUS. Однако в обеих структурах PDB некоторые остатки PD1 отсутствуют в области петли, и некоторые из остатков были мутированы по сравнению с PD1 дикого типа. Отсутствующая петля и мутировавший остаток были реконструированы обратно в PD1 дикого типа на основе кристаллической структуры 4ZQK. Мутировавшая структура PD1 была смоделирована с использованием модуля сканирования остатков в Schrodinger Suite. Остатки в пределах 5,0 Å от мутантного остатка уточняли с помощью прогнозирования по боковой цепи и выборкой основной цепи. Расчет вариации аффинности связывания и стабильности комплекса также выполняли для множественных мутаций. Более отрицательное значение аффинности связывания или стабильности указывает на большее их увеличение. Модель гомологии PDL2 была построена для исследования взаимодействия между PD1 и PDL2 человека. После поиска гомологии в наборе данных PDB без избыточности, в качестве шаблонов были выбраны три структуры PDB мышиного PDL2. Сравнение области взаимодействия при связывании PD1 между моделью PDL2 человека и кристаллической структурой PDL2 мыши (PDBID: 3BP5).
Иммуноанализы
Предметные стекла депарафинировали и извлечение антигена проводили с использованием 10 мМ лимоннокислотного буфера, 0,05% Tween 20, pH 6. Предметные стекла удаляли из буфера и охлаждали при комнатной температуре в течение 15 минут. Гасили эндогенную пероксидазу разбавлением 1:10 34% перекиси водорода в воде в течение 15 минут. Добавляли блокатор авидина и биотина на 15 минут каждый. Добавляли белковый блок с использованием 2% фетальной телячьей сыворотки на 20 минут. Сыворотку и антитела разводили в PBT (1XPBS, 0,1% BSA, 0,2%, 0,01% Tween 20). Антитела αHuman PD-L1 1: 500 (# AF154, R&D systems, Миннеаполис, Миннесота), αΗuman PD-L2 1: 500 (# MABC1120, EMD Millipore, Массачусетс), αΗuman CD8 1: 500 (# Ab4005, Abcam, Кембридж, Массачусетс), αMouse PD-L1 1: 750 (# 17952-1-AP, Proteintech, Иллинойс), αMouse PD-L2 1: 750 (# Ab21107, Abcam, Кембридж, Массачусетс) и αΜouse CD8 1: 500 (# Ab203035, Abcam, Кембридж, Массачусетс), инкубировали в течение ночи при °C. Для иммуногистохимии на каждое предметное стекло добавляли антитела против антител кролика и крысы и инкубировали при 37°C в течение 30 минут, затем инкубировали с STREP-HRP в течение 30 минут при 37°C и проявляли сигналы с использованием набора субстрата DAB (# 34002, ThermoFisher Scientific., Уолтем, Массачусетс). Для определения иммунофлуоресценции все окрашивание проводили в темноте. Вторичные антитела 1: 400, разведенные в 2% BSA и 0,1% tween 20 в PBS, инкубировали при комнатной температуре в течение 1 часа. 0,2% раствор Sudan Black B в 70% этаноле через шприцевой фильтр, предварительно нагретый до комнатной температуры, добавляли к предметным стеклам на 10 минут при комнатной температуре. Для контрастного окрашивания использовали DAPI (# F6057, Sigma-Aldrich, Сент-Луис, Миссури), 0,1 мкг/мл, после чего закрывали покровным стеклом. Количественное определение IgG4 человека (# BMS2059, ThermoFisher Scientific, Уолтем, Массачусетс) проводили методом ELISA в соответствии с инструкциями производителя.
Поверхностный плазмонный резонанс
В качестве аналита использовали PD-L1 человека (# 10084-H08H, SinoBiological, Уэйн, Пенсильвания) и PD-L2 человека (# 10292-H08H, SinoBiological, Уэйн, Пенсильвания). Готовили рабочий буфер HBS-EP+ (10 мМ HEPES, 150 мМ NaCl, 3 мМ EDTA и 0,05% P20, pH 7,4). Скорость потока составляла 30 мкл/мин. Иммобилизовали антитела против Fc из IgG человека на сенсорном чипе CM5. PD1-Fc захватывался иммобилизованным сенсорным чипом. Использовали инъекцию серийно разведенного аналита. Для регенерации поверхности использовали глицин pH 1,5 в течение 30 с. Многоканальную кинетику измеряли на Biacore T200. Анализ Kd рассчитывали с использованием оценочного программного обеспечения Biacore T200 (GE Healthcare Life Sciences).
Анализ связывания на основе проточной цитометрии
Клетки MC38-hPD-L1, MC38-hPD-L2, Hep3B-OS8-hPD-L1, Hep3B-OS8-hPD-L2 и исходные клетки MC38 культивировали в стандартных условиях для тканевой культуры. Клетки собирали и надосадочную жидкость отбрасывали, затем наносили на окрашивающий планшет из расчета 3 × 105 клеток на лунку. Планшет центрифугировали при 300 g при 4°C в течение 5 минут. Различные концентрации мутантов sPD-1 и отрицательного контроля разводили в буфере FACS, содержащем 2% FBS, добавляли 100 мкл/лунку. Клетки инкубировали в течение 1 часа при 4°C, дважды промывали 200 мкл буфера FACS и центрифугировали при 300 g в течение 5 минут. Надосадочную жидкость удаляли до и после каждой промывки. Клетки повторно суспендировали в количестве 100 мкл/лунку в разбавителе 1: 1000 с антителом против IgG человека, конъюгированным с Alexa 488 (# A28175, ThermoFisher, Уолтем, Массачусетс). Планшеты инкубировали в течение 1 часа при 4°C. Клетки дважды промывали буфером FACS и центрифугировали при 300 g в течение 5 минут. Надосадочную жидкость удаляли, и клетки ресуспендировали в 100 мкл холодного PBS. Клетки хранили в темноте и FACS-анализ выполняли на FACS CantoII (BD Biosciences, Сан-Хосе, Калифорния).
Анализ блокировки рецепторов
Клетки Hep3B-OS8-hPD-L1, Hep3B-OS8-hPD-L2, MC38-hPD-L1 и MC38-hPD-L2 культивировали в среде PRMI 1640, 10% FBS, G418 и hygro, во флаконе T175 до конфлуентности 60-80%. Клетки собирали и повторно суспендировали в буфере для разведения. Клетки помещали в 96-луночный планшет с круглым дном Corning # 3799 при плотности 2 × 105 клеток/лунку. Мутант sPD-1 в нескольких концентрациях: 600, 120, 24, 4,8, 0,96, 0,192, 0,00384 нМ и 0 нМ ресуспендировали в буфере для разведения. sPD-1 дикого типа также получали в буфере для разведения. Планшет центрифугировали при 500 g в течение 3 минут и надосадочные жидкости отбрасывали. Клетки ресуспендировали с 50 мкл антитела с последующим добавлением 50 мкл лиганда. Планшеты инкубировали при 4°C в течение 2 часов, затем центрифугировали и промывали. Стрептавидин-Alexa Flour 488 (# S11223, Thermo Fisher, Уолтем, Массачусетс), разведенный 1: 1000 в буфере для разведения, готовили и инкубировали с клетками при 4°C в течение 1 часа. Планшет центрифугировали и промывали, затем ресуспендировали в 200 мкл буфера FACS. Клетки прогоняли на FACS Canto II (BD Biosciences, Сан-Хосе, Калифорния). Строили кривые со значениями MFI и рассчитывали IC50 и высшие точки.
Анализ стимуляции и пролиферации Т-клеток
Образцы крови здоровых доноров разбавляли равным объемом стерильного PBS и перемешивали легким встряхиванием. 15 мл среды Ficoll-Paque PLUS (-1440-02, GE Healthcare, Питсбург, Пенсильвания) переносили в свежую центрифужную пробирку объемом 50 мл с соотношением объемов фиколла и крови 3:4. Затем разбавленный образец крови осторожно наслаивали на поверхность среды фиколла, чтобы избежать перемешивания. Пробирку центрифугировали при 400 g в течение 30 минут при 20°C с настройками максимального ускорения и минимального замедления во время центрифугирования. После центрифугирования наблюдали 4 границы раздела со слоями плазмы, мононуклеарных клеток, среды фиколла и эритроцитов, видимых сверху вниз. Аккуратно удалив слой мононуклеарных клеток, осторожно перенесли в новую стерильную центрифужную пробирку. Для промывания к собранным PBMC добавляли стерильный буфер PBS. Пробирку центрифугировали при 300 × g в течение 10 минут при 20°C с настройками максимального ускорения и минимального замедления во время центрифугирования. Клетки повторно суспендировали в 10% FBS + RPMI 1640 для анализа. Клетки Hep3b-hPDL1-OS8, свободные от микоплазм, получали в 15-сантиметровой чашке с сохранением конфлуентности 60-80% перед использованием. Клетки трипсинизировали с помощью TrypLETM Express (# 12605-036, Thermo Fisher, Уолтем, Массачусетс), собирали в центрифужную пробирку на 50 мл и центрифугировали при 1000 об/мин в течение 5 минут. Надосадочную жидкость отбрасывали, и клетки повторно суспендировали с митомицином (# H33020786, Zhejiang, China) 10 мкг/мл в 5-10 мл среды 10% FBS + RPMI 1640. Клетки инкубировали при 37°C в течение часа. После инкубации клетки промывали в PBS, подсчитывая клетки с помощью цитометра. Клетки центрифугировали при 1000 об/мин в течение 5 минут при 20°C. Затем клетки ресуспендировали в 10% FBS + RPMI 1640 для анализа. Стимуляцию РВМС выполняли путем добавления РВМС в количестве 5E4 клеток/лунку со 100 мкл/лунку на 96-луночный микропланшет. Добавляли 50 мкл/лунку серии растворов белка 5X OD1 v2, 5X PD1 WT или hIgG4, а затем APC Hep3b-hPDL1-OS8 в количестве 5000 клеток/лунку по 50 мкл/лунку. Смешанный раствор инкубировали при 37°C в течение 72 часов. Надосадочную жидкость собирали и помещали при -20°C перед тестом ELISA. Концентрацию IFN-γ тестировали с помощью набора для ELISA. Количественное определение IFN-γ осуществляли с помощью наборов для количественного анализа ELISA, приобретенных в R&D. Следовали процедуре анализа, описанной в наборе ELISA для человеческого IFN-γ, R&D, кат. № DY285. Планшет считывали с помощью планшетного ридера для ELISA при длине волны 450 нм.
Экспрессия PD-L2 в трансдуцированных лентивирусами клетках Hep3B-OS8 и клетках MC38
Клеточную линию Hep3B-OS8 (4E8) трансдуцировали pLVX-IRES-hygro-hPDL2: CP приготовленного собственными силами, выращивая в среде 1640. Клетки MC38 трансдуцировали pLVX-IRES-hygro-hPDL2. Клетки собирали в соответствии со стандартными процедурами, и надосадочную жидкость отбрасывали. Клетки распределяли в 96-луночный планшет с круглым дном для окрашивания: Corning, REF # 3799, с 3e5 клеток на лунку. Планшет помещали в центрифугу при 300 g при 4°C на 5 минут. 100 мкл кроличьего анти-hPD-L2 в титрованном буфере 1xPBS + 2% FBS FACS добавляли в каждую лунку и инкубировали в течение одного часа при 4°C. Клетки дважды промывали 200 мкл буфера FACS и центрифугировали при 300 g в течение 5 минут. Надосадочную жидкость удаляли до и после каждой промывки. Клетки ресуспендировали в количестве 100 мкл/лунку с разведением 1: 1000 вторичного ослиного антитела против кроличьего IgG (H + L), конъюгированного с Alexa488 (life technology) и инкубировали в течение 1 часа при 4°C. Клетки снова дважды промывали 200 мкл буфера FACS и центрифугировали при 300 g в течение 5 минут. Надосадочную жидкость удаляли до и после каждой промывки. Клетки ресуспендировали в 100 мкл PBS. Клетки хранили в темноте и подвергали анализу FACS.
Исследования опухолей in vivo
Все эксперименты на животных были рассмотрены и одобрены институциональным комитетом по содержанию и использованию животных (IACUC) Стэнфордского университета и комитетом по этике отношений к животным, ChemPartner, Шанхай. Мышей C57B/6 с нокаутом hPD-L1 покупали у Biocytogen (Пекин, Китай), а мышей C57/B6 дикого типа приобретали у Biocytogen (Пекин, Китай) или The Jackson Laboratory (Бар-Харбор, Мэн). Мыши с нокаутом PD-L1 на фоне C57B/6 были любезно подарены (доктором Дином В. Фельшером из Стэнфордского университета). Самок мышей в возрасте 6-8 недель использовали для исследований опухоли яичников ID8, а самцов мышей в возрасте 6-8 недель использовали для колоректальных исследований MC38 и исследований меланомы B16/OVA. Мышей содержали в помещениях для животных, свободных от патогенов, при постоянной температуре и влажности и контролируемых 12-часовых циклах свет-темнота. Для колоректального исследования MC38, MC38-hPD-L1, MC38-hPD-L2 и исследования меланомы B16/OVA подкожно инъецировали 1 × 106 клеток, которые случайным образом назначали в контрольную группу или соответствующей группе обработки после подтверждения роста опухоли приблизительно через 7 дней после инокуляции опухоли. Рост опухоли измеряли на протяжении всего исследования и регистрировали массу тела. Животных умерщвляли в то же время, когда большинство опухолей достигло этической точки. Для исследования яичников ID8, внутрибрюшинно вводили 5 × 106 клеток, и каждое животное умерщвляли при развитии перитонеального асцита для анализа выживаемости. Для исследований опухолей, проведенных на мышах с нокаутом PD-L1, 10 × 106 клеток ID8 вводили подкожно или внутрибрюшинно для двух отдельных исследований.
Статистический анализ
Корреляция Пирсона использовалась для всех корреляционных анализов образцов опухолей. Значения показателя IHC H были определены сертифицированным ветеринарным патологом. Все из числа объема опухоли, выживаемости, количественной иммуногистохимической оценки in vivo проводили с использованием программного обеспечения Prism (GraphPad Software Inc). ANOVA с тестом Тьюки-Крамера использовался для сравнения нескольких групп обработки друг с другом. Р <0,05 считали значимым. ANOVA с повторным измерением использовался для сравнения нескольких групп обработки, измеренных с течением времени. Статистический анализ кривых выживаемости проводился в исследовании выживаемости ID8. Для сравнения средней выживаемости среди групп выполняли лог-ранговый тест (Мантел-Кокса); Статистически значимым считали P ≤ 0,05.
Пример 11. Нейтрализация PD-L1 и PD-L2 для повышения эффективности ингибиторов иммунных контрольных точек
Скрининг мутантных клонов против PD-L1 и PD-L2 человека
Библиотеки дрожжевого дисплея с 128 мутантами sPD-1, состоящие из всех возможных комбинаций пермутаций, произошли из мутанта sPD-1 с высокой аффинностью связывания с 7 мутациями (62-87-89-124-127-132-140 с нумерацией положений, начинающейся из сигнальной области) были выделены из библиотеки с помощью сортировки клеток, активируемой флуоресценцией (FACS). Осуществляли сортировки по равновесному связыванию, в которых дрожжи инкубировали при комнатной температуре в фосфатно-солевом буферном растворе с 1 мг/мл BSA (PBSA) со следующими номинальными концентрациями PDL1-Fc и PD-L2-Fc. Клоны с наибольшим связыванием были собраны и секвенированы для дальнейшего анализа.
Характеризация выбранных клонов
Фиг. 38A иллюстрирует аминокислотные мутации, присутствующие в исходном мутантном клоне PD-1, и все мутации были использованы для создания библиотеки из 128 мутантных клонов sPD-1, которая включает все возможные перестановки из 7 мутаций. На фиг. 38B показан список 5 лучших мутантных клонов, выбранных из библиотеки мутантных клонов 128 sPD-1 для дальнейшего анализа связывания. На ФИГ. 39 показаны дозозависимые кривые связывания исходного мутантного sPD-1 и клонов № 1-5 с PD-L1, а на фиг. 40 суммированы значения Kd исходного мутантного sPD-1 и клонов № 1-5, связывающихся с PD-L1. На фиг. 41 показаны кривые дозозависимого связывания исходного мутанта sPD-1 и клонов № 1-5 с PD-L2, а фиг. 42 суммирует значения Kd исходного мутантного sPD-1 и клонов № 1-5, связывающихся с PD-L2.
Приведенные выше примеры предоставлены для того, чтобы дать обычным специалистам в данной области техники полное раскрытие и описание того, как создавать и использовать воплощения композиций, систем и способов изобретения, и не предназначены для ограничения объема того, что изобретатели считают своим изобретением. Подразумевается, что модификации описанных выше способов осуществления изобретения, которые очевидны для специалистов в данной области техники, находятся в пределах объема следующей формулы изобретения. Все патенты и публикации, упомянутые в описании, указывают на уровень квалификации специалистов в области, к которой относится изобретение. Все источники, процитированные в этом раскрытии, включены ссылкой в той же степени, как если бы каждый источник был включена ссылкой полностью индивидуально.
Все заголовки и обозначения разделов используются только для ясности и справочных целей и никоим образом не должны рассматриваться как ограничивающие. Например, специалисты в данной области техники оценят полезность объединения различных аспектов из разных заголовков и разделов в соответствии с сущностью и объемом изобретения, описанного в данном документе.
Все источники, процитированные в данном документе, включены в данный документ ссылкой во всей своей полноте и для всех целей в той же степени, как если бы каждая отдельная публикация, патент или патентная заявка была специально и индивидуально указаны для включения ссылкой во всей ее полноте для всех целей.
Многие модификации и вариации этой заявки могут быть выполнены без отхода от ее сущности и объема, что будет очевидно специалистам в данной области техники. Описанные в данном документе конкретные воплощения и примеры предлагаются только в качестве примера.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR
UNIVERSITY
AKSO BIOPHARMACEUTICAL, INC.
<120> SPD-1 VARIANT - FC FUSION PROTEINS
<130> 1151248
<140> PCT/US2019/050742
<141> 2019-09-12
<150> 62/888,320
<151> 2019-08-16
<150> 62/731,488
<151> 2018-09-14
<160> 163
<170> PatentIn version 3.5
<210> 1
<211> 150
<212> PRT
<213> Homo sapiens
<400> 1
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 2
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 2
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Ser
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 3
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 3
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 4
<211> 384
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 4
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser Glu Ser Lys Tyr Gly
145 150 155 160
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
165 170 175
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
180 185 190
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
195 200 205
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
210 215 220
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
225 230 235 240
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
245 250 255
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
260 265 270
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
275 280 285
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
290 295 300
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
305 310 315 320
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
325 330 335
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
340 345 350
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
355 360 365
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
370 375 380
<210> 5
<211> 384
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 5
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Ser
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser Glu Ser Lys Tyr Gly
145 150 155 160
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
165 170 175
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
180 185 190
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
195 200 205
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
210 215 220
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
225 230 235 240
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
245 250 255
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
260 265 270
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
275 280 285
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
290 295 300
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
305 310 315 320
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
325 330 335
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
340 345 350
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
355 360 365
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
370 375 380
<210> 6
<211> 384
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 6
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser Glu Ser Lys Tyr Gly
145 150 155 160
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser
165 170 175
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
180 185 190
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
195 200 205
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
210 215 220
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
225 230 235 240
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
245 250 255
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
260 265 270
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
275 280 285
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
290 295 300
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
305 310 315 320
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
325 330 335
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
340 345 350
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
355 360 365
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
370 375 380
<210> 7
<211> 20
<212> PRT
<213> Homo sapiens
<400> 7
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg
20
<210> 8
<211> 404
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 8
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser Glu
165 170 175
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
180 185 190
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
195 200 205
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
210 215 220
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
225 230 235 240
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
245 250 255
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
260 265 270
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
275 280 285
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
290 295 300
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
305 310 315 320
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
325 330 335
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
340 345 350
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
355 360 365
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
370 375 380
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
385 390 395 400
Ser Leu Gly Lys
<210> 9
<211> 404
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 9
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Ser Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu
115 120 125
Ala Pro Lys Ile Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser Glu
165 170 175
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
180 185 190
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
195 200 205
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
210 215 220
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
225 230 235 240
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
245 250 255
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
260 265 270
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
275 280 285
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
290 295 300
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
305 310 315 320
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
325 330 335
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
340 345 350
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
355 360 365
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
370 375 380
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
385 390 395 400
Ser Leu Gly Lys
<210> 10
<211> 404
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 10
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu
115 120 125
Ala Pro Lys Ile Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser Glu
165 170 175
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
180 185 190
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
195 200 205
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
210 215 220
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
225 230 235 240
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
245 250 255
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
260 265 270
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
275 280 285
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
290 295 300
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
305 310 315 320
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
325 330 335
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
340 345 350
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
355 360 365
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
370 375 380
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
385 390 395 400
Ser Leu Gly Lys
<210> 11
<211> 150
<212> PRT
<213> Unknown
<220>
<221> source
<223> /note="Description of Unknown:
PD1 sequence"
<400> 11
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 12
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 12
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 13
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 13
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 14
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 14
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 15
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 15
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 16
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 16
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 17
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 17
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 18
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 18
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 19
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 19
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 20
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 20
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 21
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 21
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 22
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 22
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 23
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 23
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 24
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 24
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 25
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 25
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 26
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 26
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 27
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 27
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 28
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 28
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 29
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 29
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 30
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 30
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 31
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 31
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 32
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 32
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 33
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 33
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 34
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 34
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 35
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 35
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 36
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 36
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 37
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 37
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 38
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 38
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 39
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 39
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 40
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 40
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 41
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 41
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 42
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 42
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 43
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 43
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 44
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 44
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 45
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 45
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 46
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 46
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 47
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 47
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 48
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 48
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 49
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 49
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 50
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 50
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 51
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 51
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 52
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 52
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 53
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 53
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 54
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 54
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 55
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 55
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 56
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 56
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 57
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 57
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 58
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 58
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 59
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 59
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 60
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 60
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 61
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 61
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 62
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 62
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 63
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 63
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 64
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 64
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 65
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 65
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 66
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 66
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 67
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 67
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 68
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 68
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 69
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 69
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 70
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 70
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 71
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 71
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 72
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 72
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 73
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 73
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 74
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 74
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 75
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 75
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 76
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 76
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 77
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 77
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 78
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 78
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 79
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 79
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 80
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 80
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 81
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 81
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 82
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 82
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 83
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 83
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 84
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 84
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 85
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 85
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 86
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 86
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 87
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 87
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 88
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 88
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 89
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 89
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 90
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 90
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 91
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 91
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 92
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 92
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 93
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 93
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 94
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 94
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 95
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 95
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 96
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 96
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 97
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 97
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 98
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 98
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 99
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 99
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 100
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 100
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 101
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 101
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 102
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 102
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 103
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 103
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 104
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 104
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 105
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 105
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 106
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 106
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 107
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 107
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 108
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 108
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 109
<211> 149
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 109
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Phe Val Leu Asn Trp Tyr Arg
35 40 45
Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu Asp
50 55 60
Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu Pro
65 70 75 80
Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn Asp
85 90 95
Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile Gln
100 105 110
Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg Ala
115 120 125
Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly Gln
130 135 140
Phe Gln Thr Leu Val
145
<210> 110
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 110
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 111
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 111
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 112
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 112
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 113
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 113
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 114
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 114
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 115
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 115
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 116
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 116
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 117
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 117
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 118
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 118
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 119
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 119
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 120
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 120
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 121
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 121
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 122
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 122
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 123
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 123
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 124
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 124
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 125
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 125
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 126
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 126
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 127
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 127
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 128
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 128
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 129
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 129
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 130
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 130
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 131
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 131
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 132
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 132
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 133
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 133
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 134
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 134
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Ser Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 135
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 135
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 136
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 136
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 137
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 137
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 138
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 138
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 139
<211> 150
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 139
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Ser
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu Ala Pro Lys Ile
100 105 110
Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val
145 150
<210> 140
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> SITE
<222> (1)..(10)
<223> /note="This sequence may encompass 1-5 'Gly Ser'
repeating units"
<400> 140
Gly Ser Gly Ser Gly Ser Gly Ser Gly Ser
1 5 10
<210> 141
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> SITE
<222> (1)..(25)
<223> /note="This sequence may encompass 1-5 'Gly Ser Gly Gly Ser'
repeating units"
<400> 141
Gly Ser Gly Gly Ser Gly Ser Gly Gly Ser Gly Ser Gly Gly Ser Gly
1 5 10 15
Ser Gly Gly Ser Gly Ser Gly Gly Ser
20 25
<210> 142
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> SITE
<222> (1)..(25)
<223> /note="This sequence may encompass 1-5 'Gly Gly Gly Gly Ser'
repeating units"
<400> 142
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 143
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> SITE
<222> (1)..(20)
<223> /note="This sequence may encompass 1-5 'Gly Gly Gly Ser'
repeating units"
<400> 143
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser
20
<210> 144
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 144
Gly Gly Gly Gly Ser
1 5
<210> 145
<211> 20
<212> PRT
<213> Homo sapiens
<400> 145
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro
20
<210> 146
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="See specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 146
Gly Ser Gly Gly Ser
1 5
<210> 147
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="See specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 147
Gly Gly Gly Gly Ser
1 5
<210> 148
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="See specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 148
Gly Gly Gly Ser
1
<210> 149
<211> 175
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 149
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser
165 170 175
<210> 150
<211> 175
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 150
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Ser Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu
115 120 125
Ala Pro Lys Ile Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser
165 170 175
<210> 151
<211> 175
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 151
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Gly Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Gly Gln Leu Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Ser Ala Ile Val Leu
115 120 125
Ala Pro Lys Ile Gln Ile Lys Glu Ser Leu Arg Val Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Gly Gly Gly Gly Ser
165 170 175
<210> 152
<211> 229
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 152
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 153
<211> 119
<212> PRT
<213> Homo sapiens
<400> 153
Asp Arg Pro Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val
1 5 10 15
Thr Glu Gly Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser
20 25 30
Glu Ser Phe Val Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr
35 40 45
Asp Lys Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp
50 55 60
Cys Arg Phe Arg Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met
65 70 75 80
Ser Val Val Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly
85 90 95
Ala Ile Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala
100 105 110
Glu Leu Arg Val Thr Glu Arg
115
<210> 154
<211> 118
<212> PRT
<213> Homo sapiens
<400> 154
Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp
1 5 10 15
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
20 25 30
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
35 40 45
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Ser Arg Phe Arg
50 55 60
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
65 70 75 80
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
85 90 95
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
100 105 110
Thr Glu Arg Arg Ala Glu
115
<210> 155
<211> 129
<212> PRT
<213> Homo sapiens
<400> 155
Gly Pro Gly Ser Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr Phe
1 5 10 15
Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe Thr
20 25 30
Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe His Val Val Trp His Arg
35 40 45
Glu Ser Pro Ser Gly Gln Thr Asp Thr Leu Ala Ala Phe Pro Glu Asp
50 55 60
Arg Ser Gln Pro Gly Gln Asp Ala Arg Phe Arg Val Thr Gln Leu Pro
65 70 75 80
Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn Asp
85 90 95
Ser Gly Thr Tyr Val Cys Gly Val Ile Ser Leu Ala Pro Lys Ile Gln
100 105 110
Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Ala Ala
115 120 125
Ala
<210> 156
<211> 202
<212> PRT
<213> Homo sapiens
<400> 156
Ala Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His
1 5 10 15
Gly Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val
20 25 30
Asn Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr
35 40 45
Ser Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu
50 55 60
Gly Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly
65 70 75 80
Gln Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr
85 90 95
Leu Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile
100 105 110
Leu Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr
115 120 125
Gly Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala
130 135 140
Asn Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser
145 150 155 160
Val Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe
165 170 175
Trp Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln
180 185 190
Ser Gln Met Glu Pro Arg Thr His Pro Thr
195 200
<210> 157
<211> 201
<212> PRT
<213> Mus sp.
<400> 157
Leu Phe Thr Val Thr Ala Pro Lys Glu Val Tyr Thr Val Asp Val Gly
1 5 10 15
Ser Ser Val Ser Leu Glu Cys Asp Phe Asp Phe Phe Glu Cys Thr Glu
20 25 30
Leu Glu Gly Ile Arg Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Leu Gln Ser Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Leu Phe His Ile Pro Ser Val Gln Val Arg Asp Ser Gly Gln
65 70 75 80
Tyr Arg Cys Leu Val Ile Cys Gly Ala Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Val Lys Val Lys Ala Ser Tyr Met Arg Ile Asp Thr Arg Ile Leu
100 105 110
Glu Val Pro Gly Thr Gly Glu Val Gln Leu Thr Cys Gln Ala Arg Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Gln Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ile Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Gln Pro Ser Arg Asn Phe Ser Cys Met Phe Trp
165 170 175
Asn Ala His Met Lys Glu Leu Thr Ser Ala Ile Ile Asp Pro Leu Ser
180 185 190
Arg Met Glu Pro Lys Val Pro Arg Thr
195 200
<210> 158
<211> 202
<212> PRT
<213> Mus sp.
<400> 158
Met Leu Phe Thr Val Thr Ala Pro Lys Glu Val Tyr Thr Val Asp Val
1 5 10 15
Gly Ser Ser Val Ser Leu Glu Cys Asp Phe Asp Phe Phe Glu Cys Thr
20 25 30
Glu Leu Glu Gly Ile Arg Ala Ser Leu Gln Lys Val Glu Asn Asp Thr
35 40 45
Ser Leu Gln Ser Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu
50 55 60
Gly Lys Ala Leu Phe His Ile Pro Ser Val Gln Val Arg Asp Ser Gly
65 70 75 80
Gln Tyr Arg Cys Leu Val Ile Cys Gly Ala Ala Trp Asp Tyr Lys Tyr
85 90 95
Leu Thr Val Lys Val Lys Ala Ser Tyr Met Arg Ile Asp Thr Arg Ile
100 105 110
Leu Glu Val Pro Gly Thr Gly Glu Val Gln Leu Thr Cys Gln Ala Arg
115 120 125
Gly Tyr Pro Leu Ala Glu Val Ser Trp Gln Asn Val Ser Val Pro Ala
130 135 140
Asn Thr Ser His Ile Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser
145 150 155 160
Val Leu Arg Leu Lys Pro Gln Pro Ser Arg Asn Phe Ser Cys Met Phe
165 170 175
Trp Asn Ala His Met Lys Glu Leu Thr Ser Ala Ile Ile Asp Pro Leu
180 185 190
Ser Arg Met Glu Pro Lys Val Pro Arg Thr
195 200
<210> 159
<211> 29
<212> PRT
<213> Homo sapiens
<400> 159
Ala Leu Phe Thr Val Glu Leu Thr Ser Gln Thr Ser Pro His Gln Gln
1 5 10 15
Cys Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
20 25
<210> 160
<211> 29
<212> PRT
<213> Mus sp.
<400> 160
Met Leu Phe Thr Ala Glu Val Arg Ser Gln Thr Ser Leu Gln Gln Arg
1 5 10 15
Cys Leu Ile Cys Gly Ala Ala Trp Asp Tyr Lys Tyr Leu
20 25
<210> 161
<211> 23
<212> PRT
<213> Homo sapiens
<400> 161
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Leu Leu Gly Gly Pro
20
<210> 162
<211> 19
<212> PRT
<213> Homo sapiens
<400> 162
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val
1 5 10 15
Ala Gly Pro
<210> 163
<211> 70
<212> PRT
<213> Homo sapiens
<400> 163
Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr Cys Pro Arg Cys
1 5 10 15
Pro Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
20 25 30
Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro Glu
35 40 45
Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro Ala Pro
50 55 60
Glu Phe Leu Gly Gly Pro
65 70
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2831418C2 |
| ГЛИКАНЗАВИСИМЫЕ ИММУНОТЕРАПЕВТИЧЕСКИЕ МОЛЕКУЛЫ | 2016 |
|
RU2754661C2 |
| КОМПОЗИЦИИ И СПОСОБЫ РЕДАКТИРОВАНИЯ ГЕНОВ | 2019 |
|
RU2804665C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИЗБИРАТЕЛЬНОЙ ЭКСПРЕССИИ БЕЛКА | 2017 |
|
RU2795467C2 |
| ТРИСПЕЦИФИЧЕСКИЕ И/ИЛИ ТРИВАЛЕНТНЫЕ СВЯЗЫВАЮЩИЕ БЕЛКИ С ПРИМЕНЕНИЕМ КРОССОВЕРНОГО ФОРМАТА С ДВОЙНЫМ ВАРИАБЕЛЬНЫМ ДОМЕНОМ (CODV) ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ HIV | 2020 |
|
RU2820164C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| МОДИФИЦИРОВАННЫЕ НЕПРИРОДНЫЕ ЛИГАНДЫ NKG2D, КОТОРЫЕ ИЗБИРАТЕЛЬНО ДОСТАВЛЯЮТ ПРИСОЕДИНЕННЫЕ ГЕТЕРОЛОГИЧНЫЕ МОЛЕКУЛЫ К НЕПРИРОДНЫМ РЕЦЕПТОРАМ NKG2D НА CAR-КЛЕТКАХ | 2020 |
|
RU2823728C2 |
| КОМБИНАЦИИ АНТИТЕЛ ДЛЯ ЛЕЧЕНИЯ РАКА У КОНКРЕТНЫХ ПАЦИЕНТОВ | 2020 |
|
RU2816531C2 |
| КОНСТРУКЦИИ ДНК-АНТИТЕЛ ДЛЯ ПРИМЕНЕНИЯ ПРОТИВ БОЛЕЗНИ ЛАЙМА | 2017 |
|
RU2813829C2 |

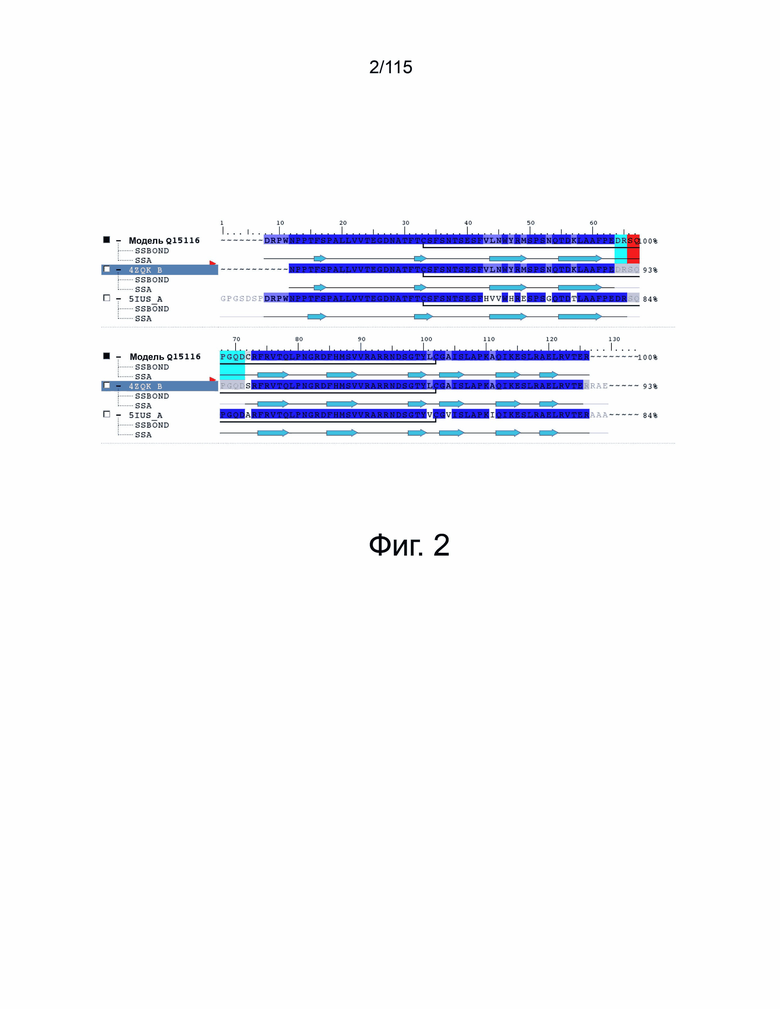
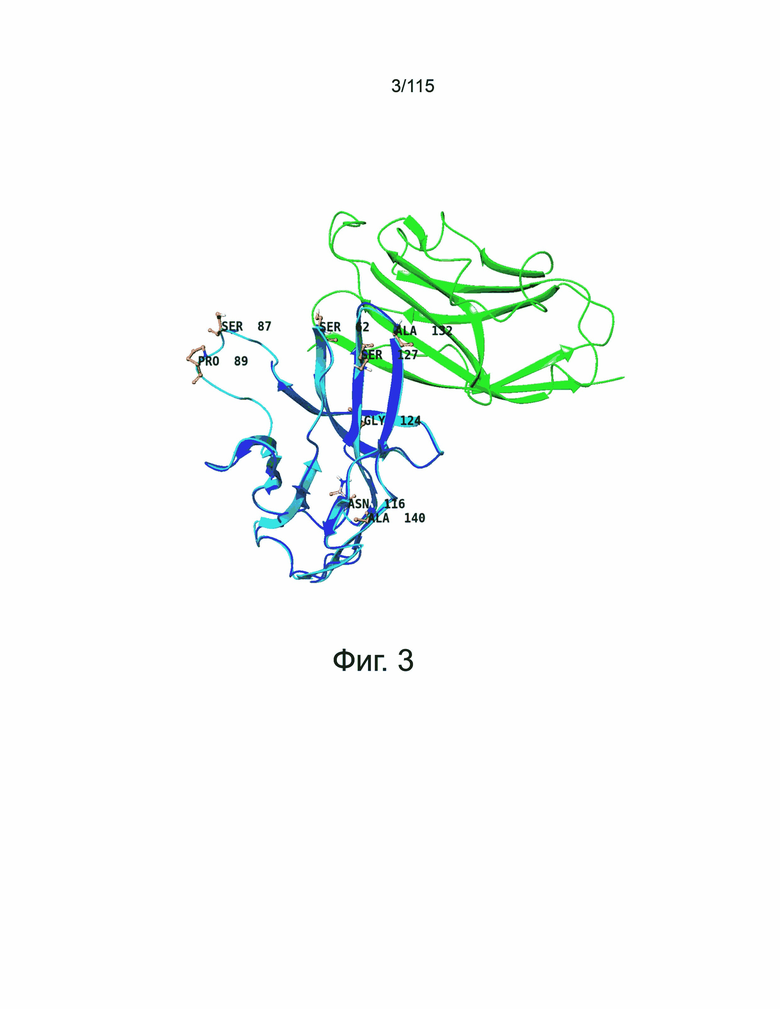
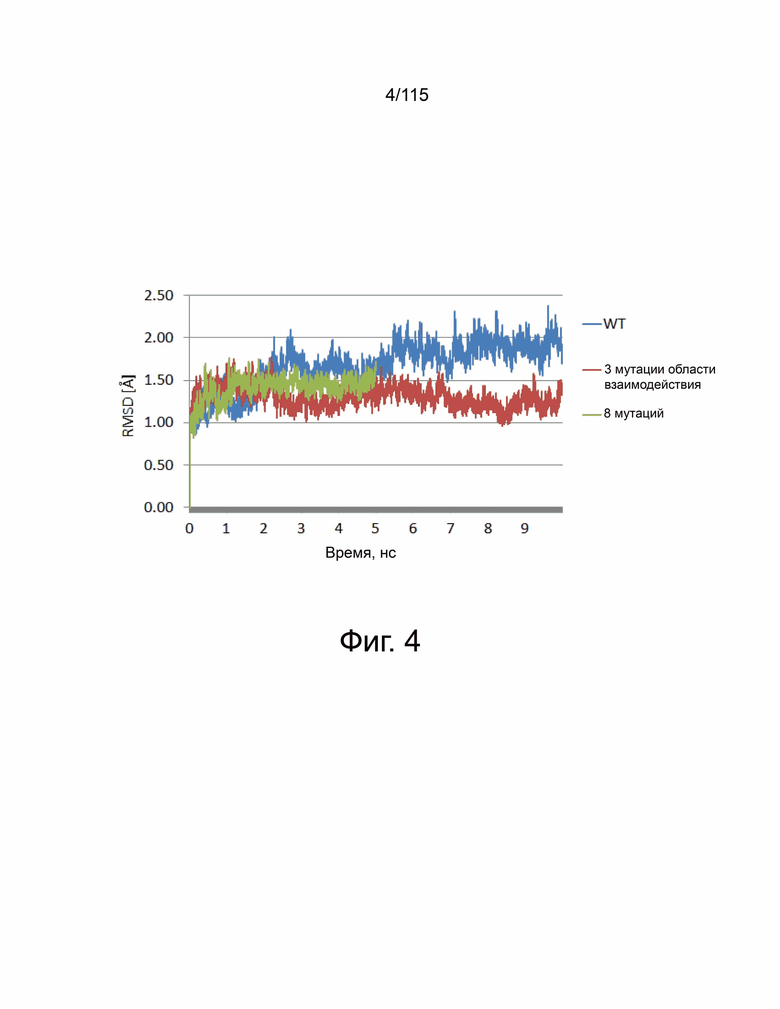

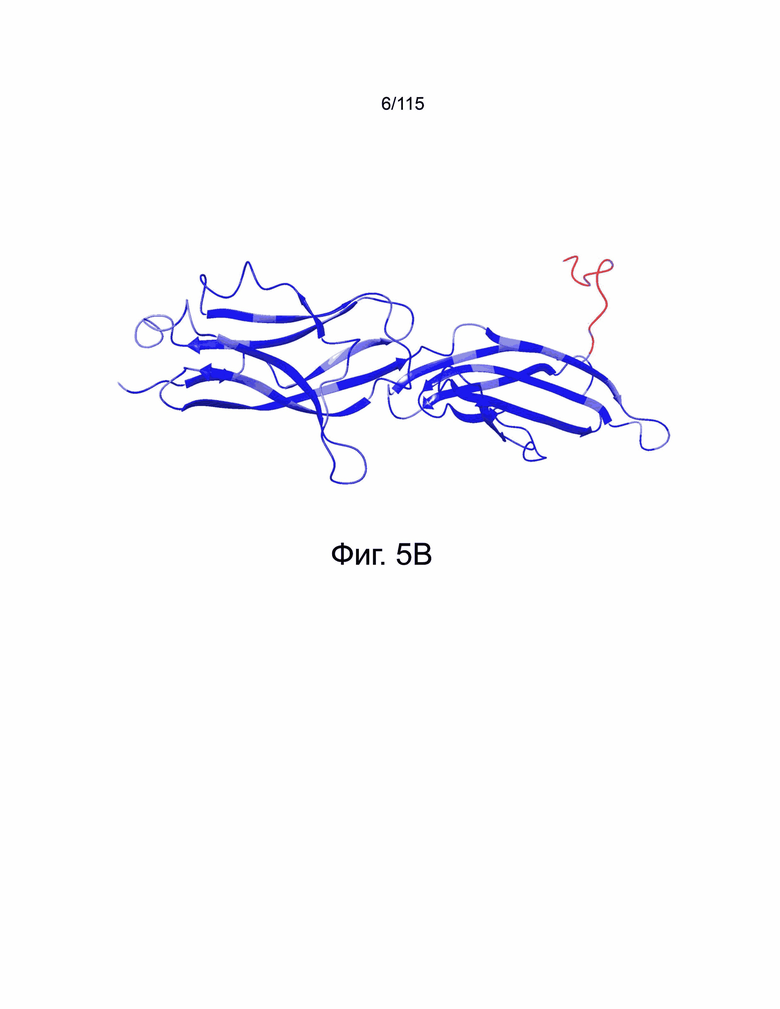
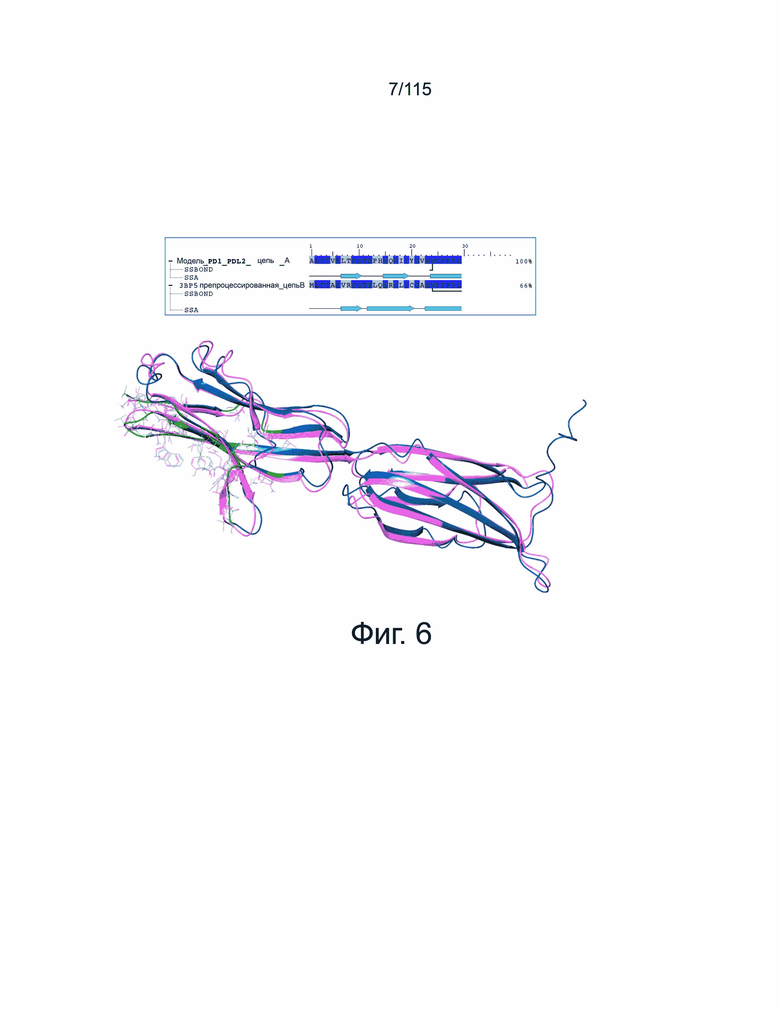
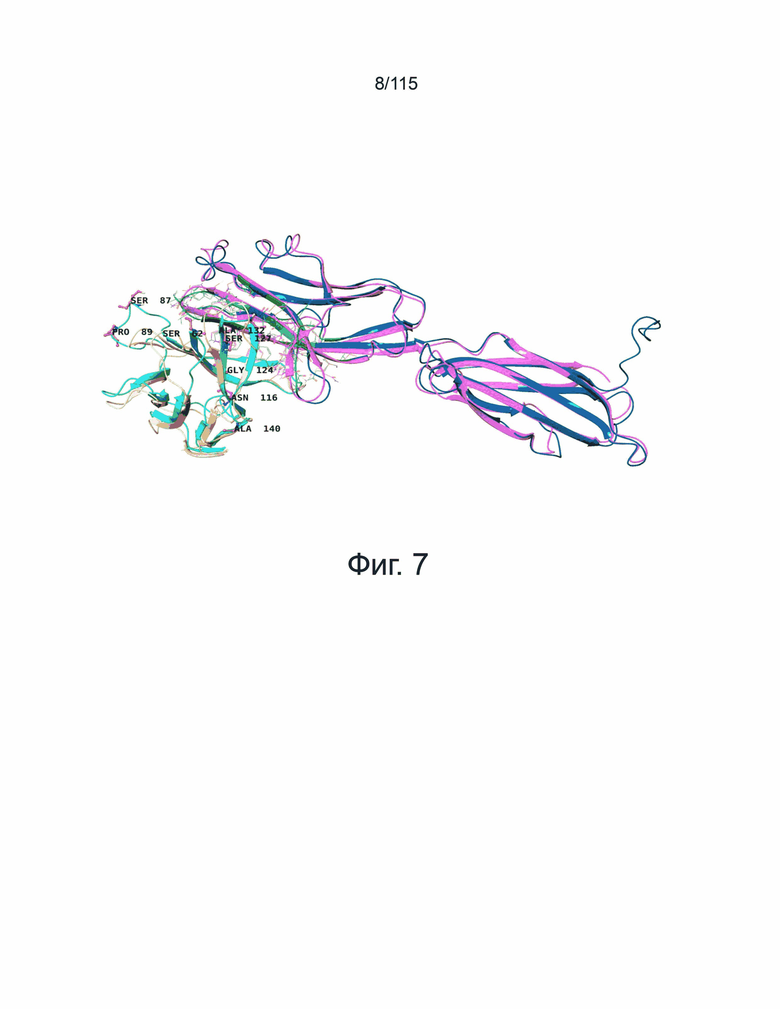

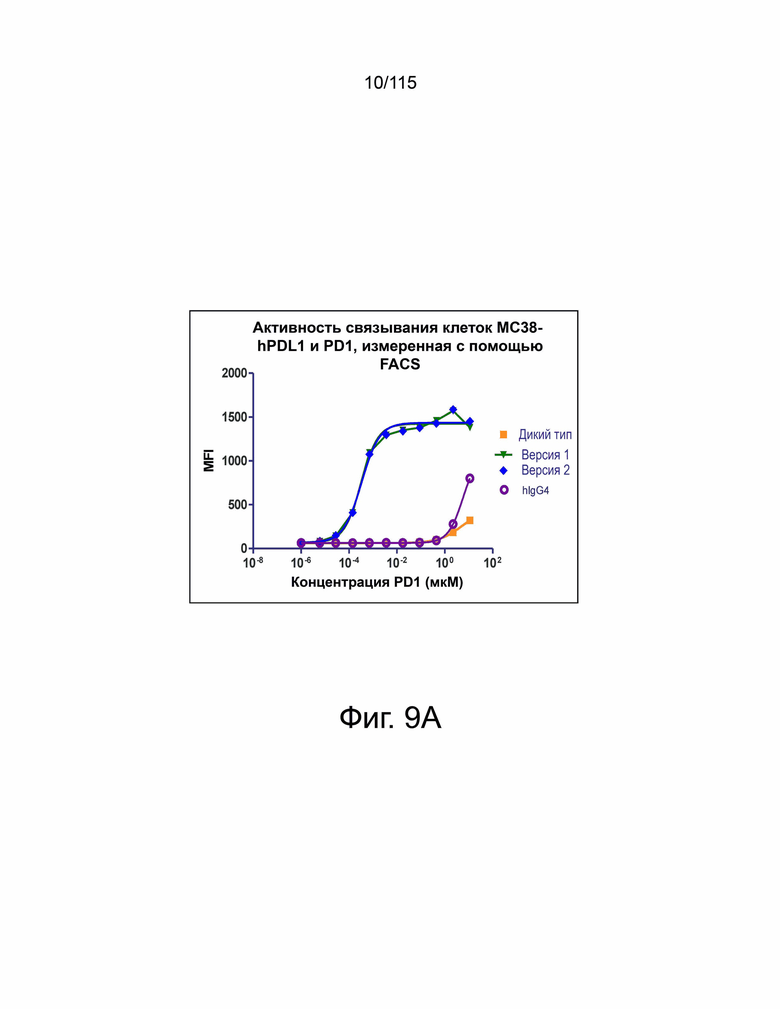
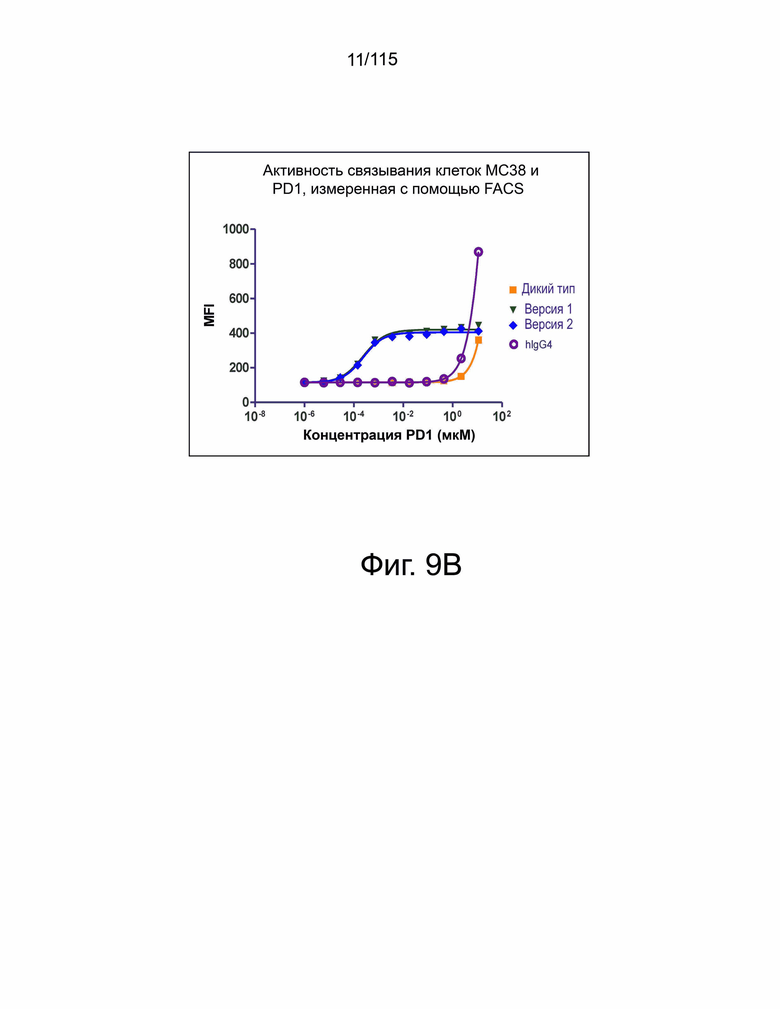
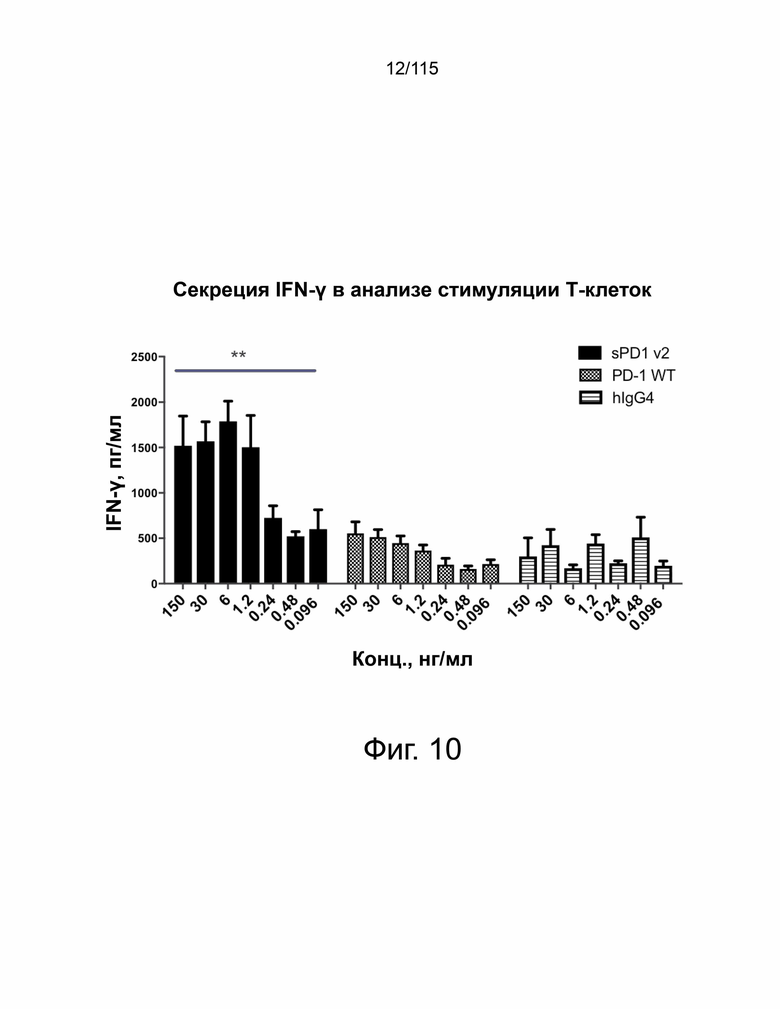
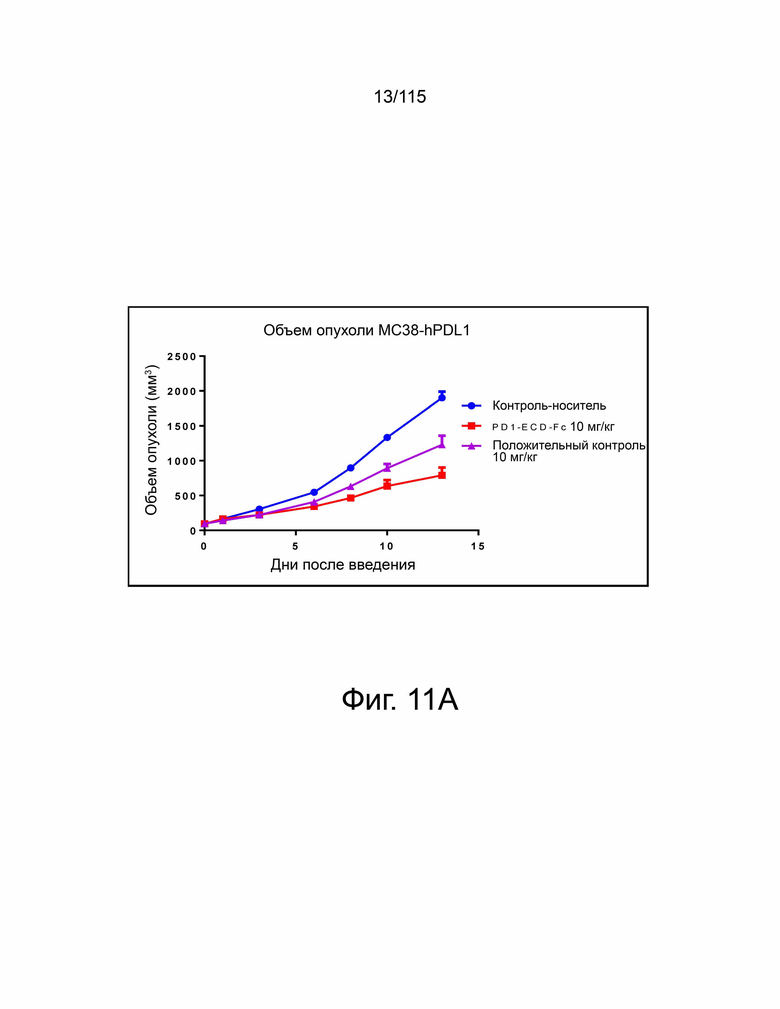
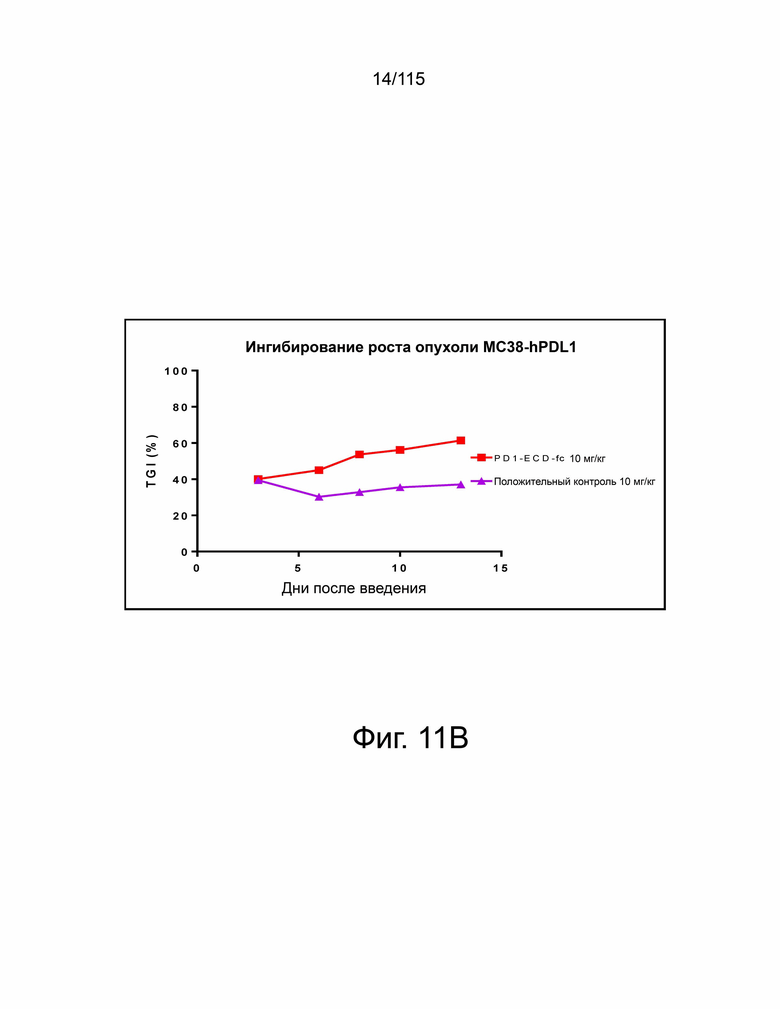
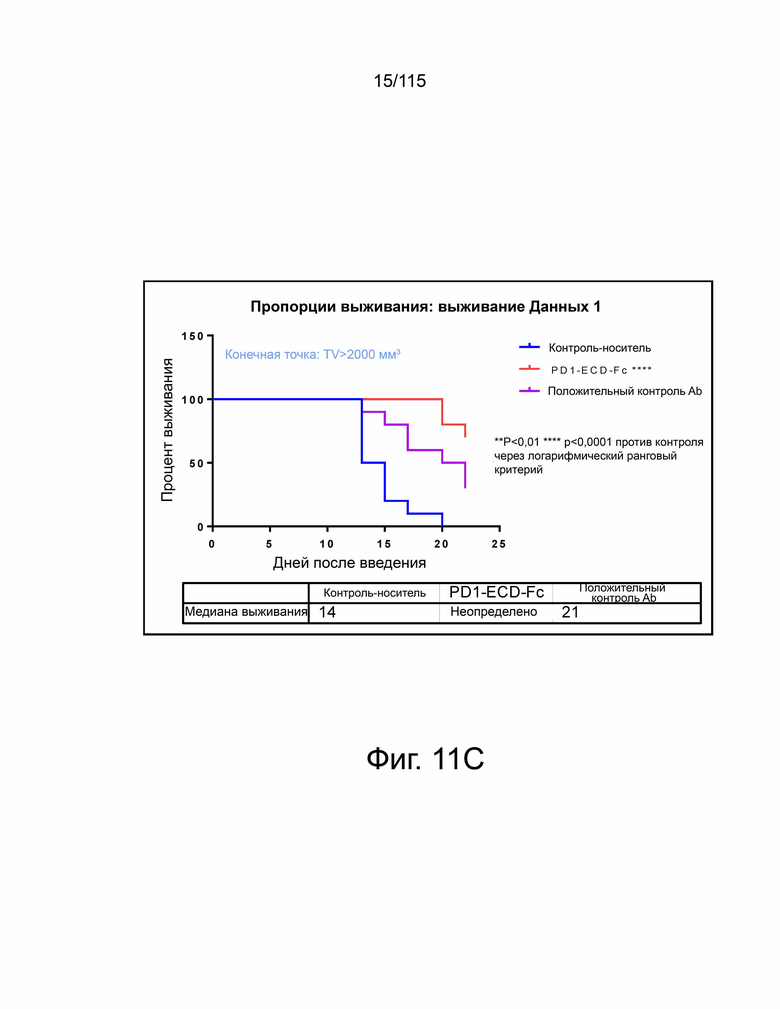
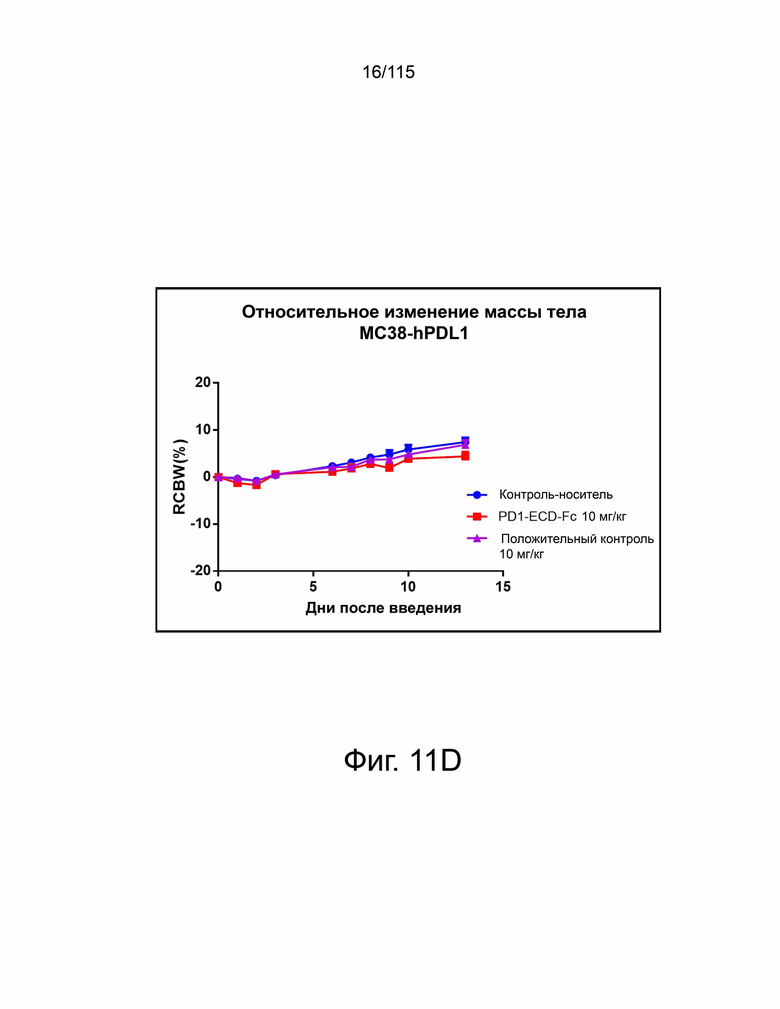

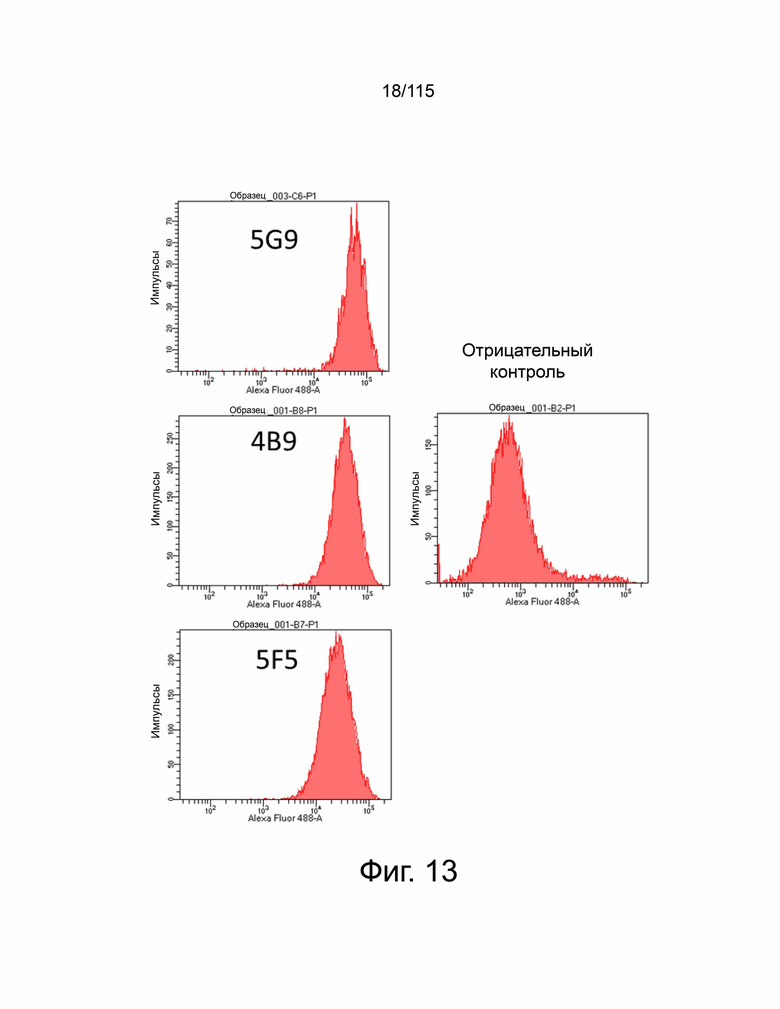

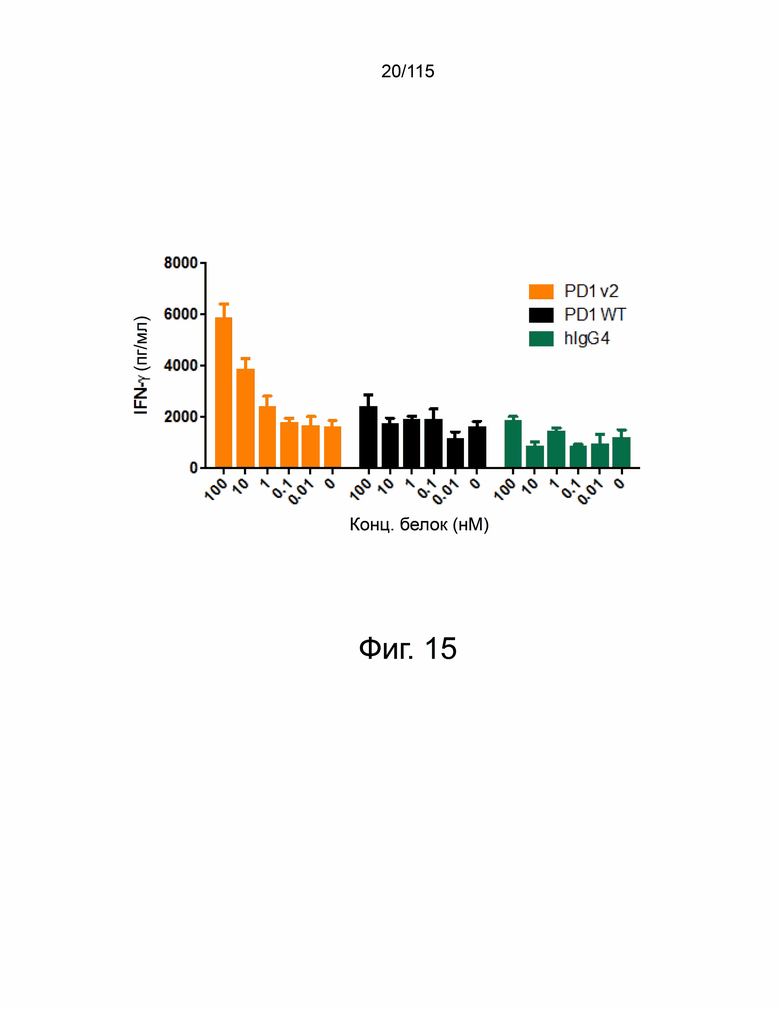
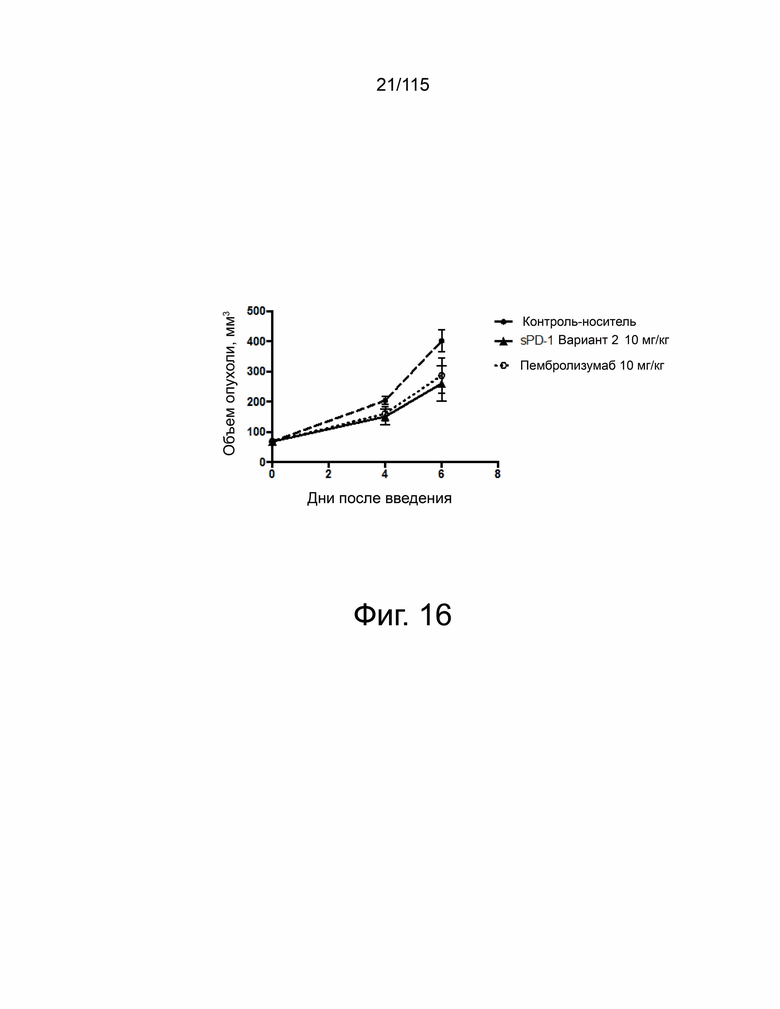















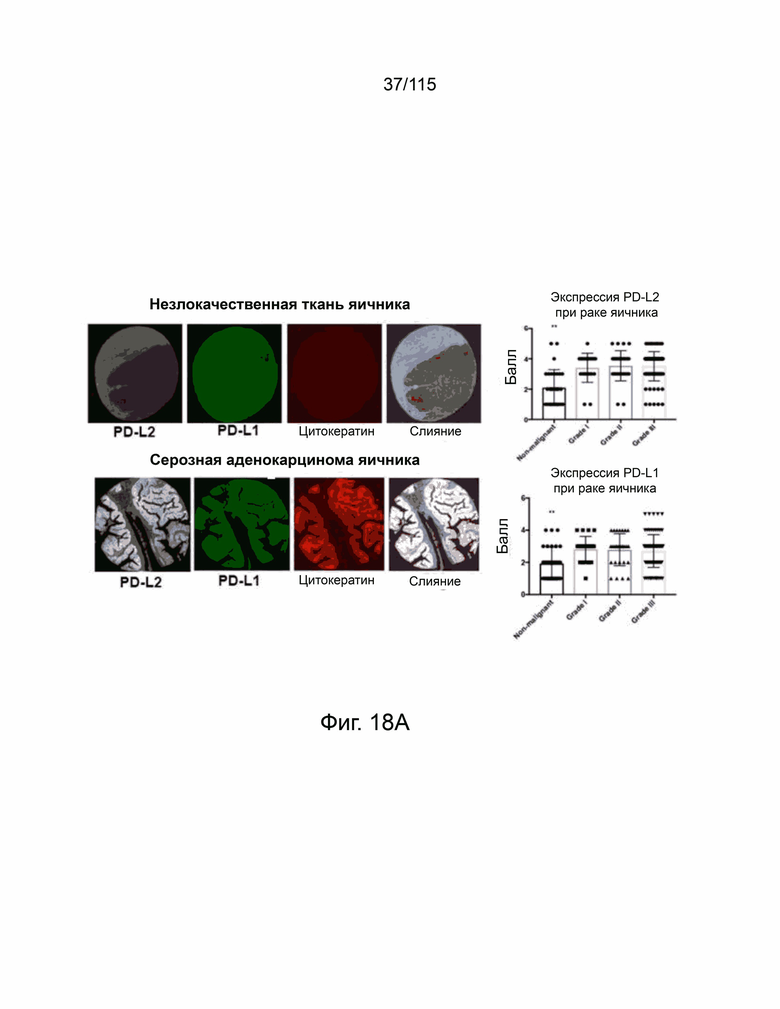
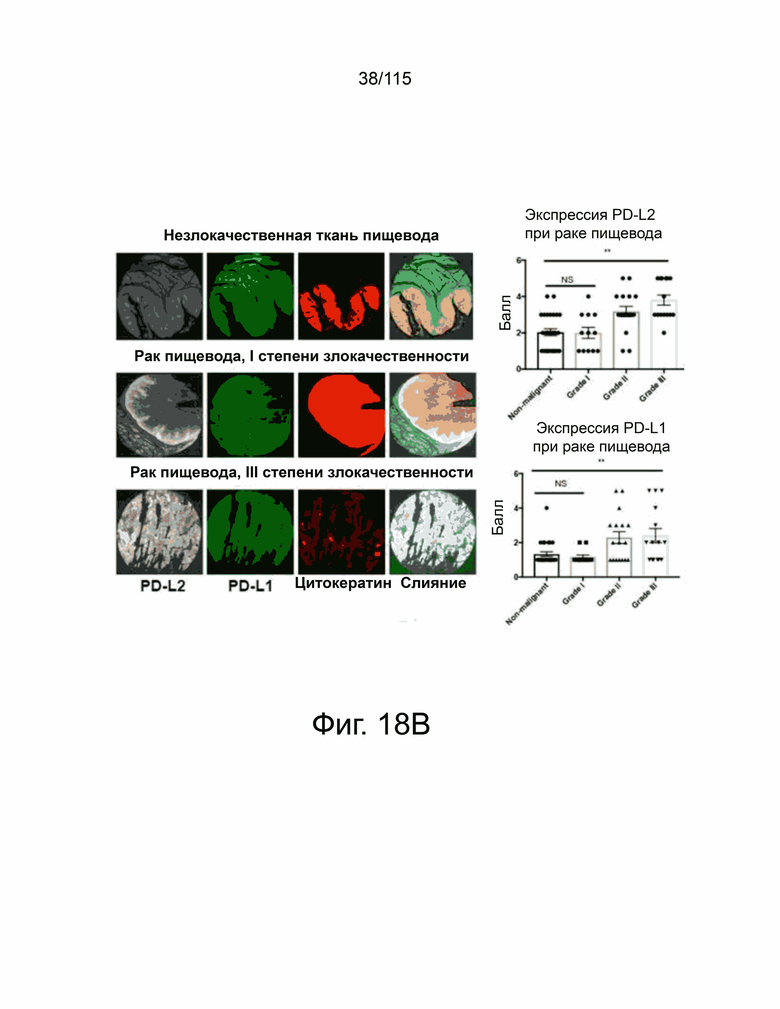
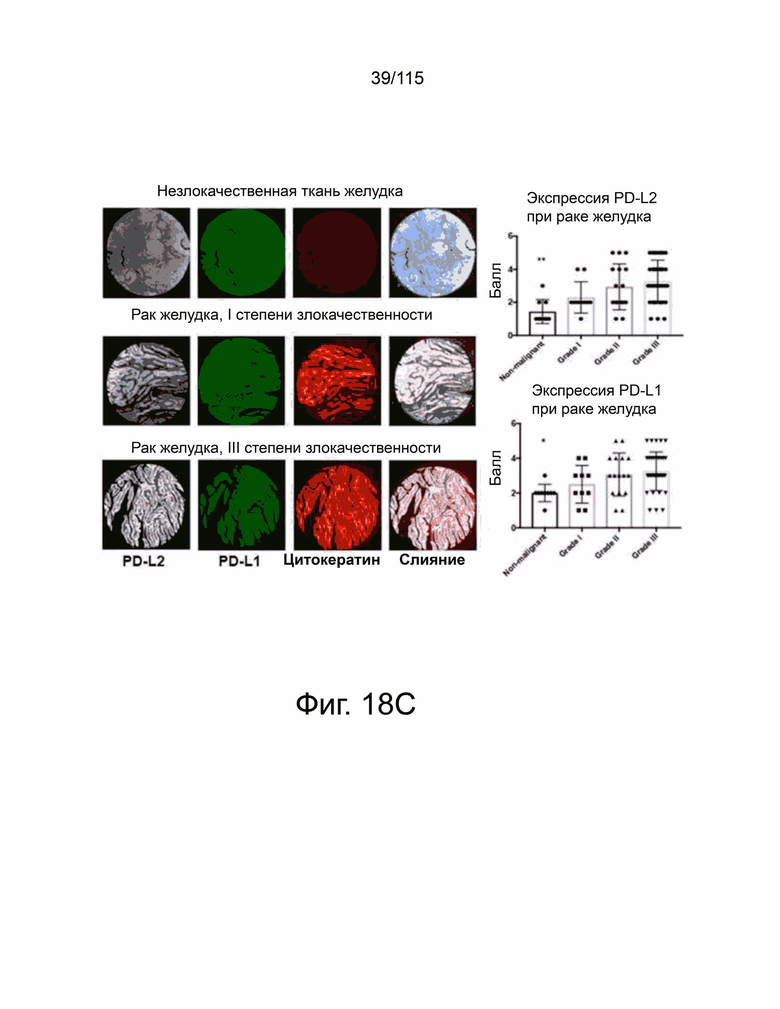

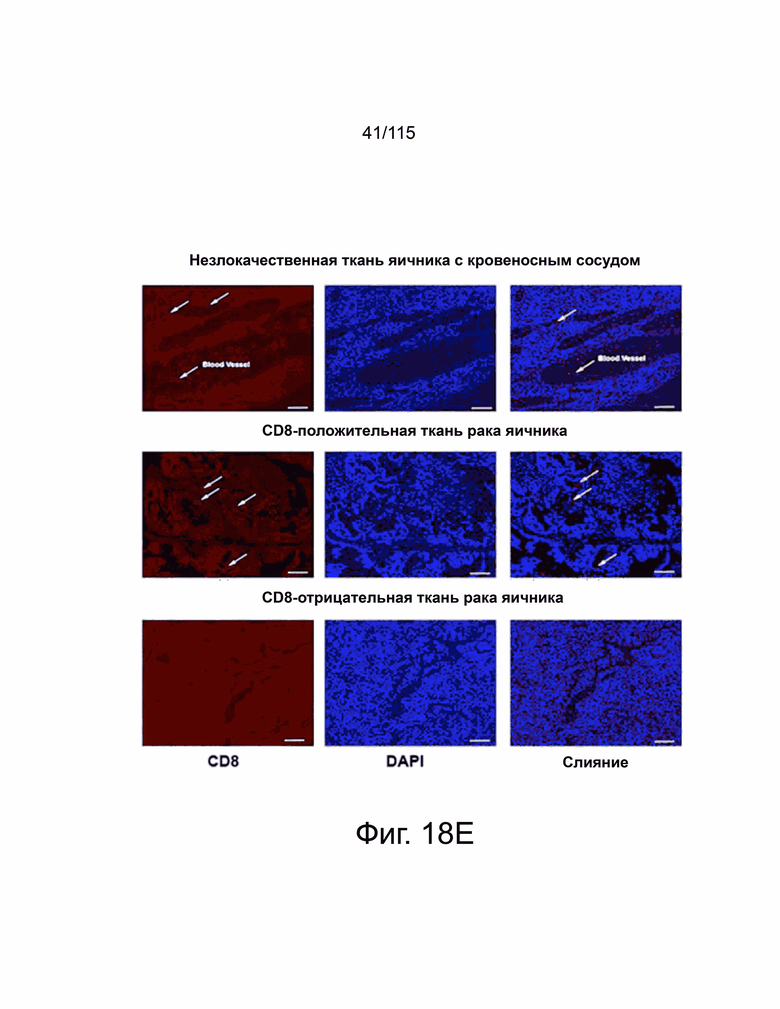
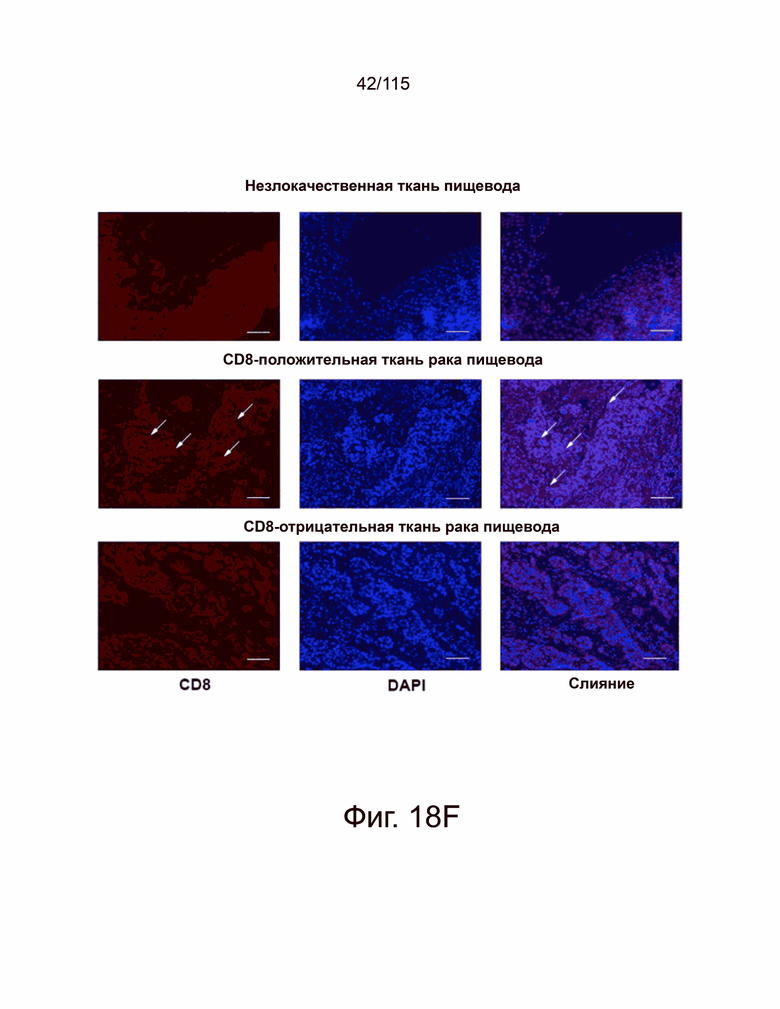
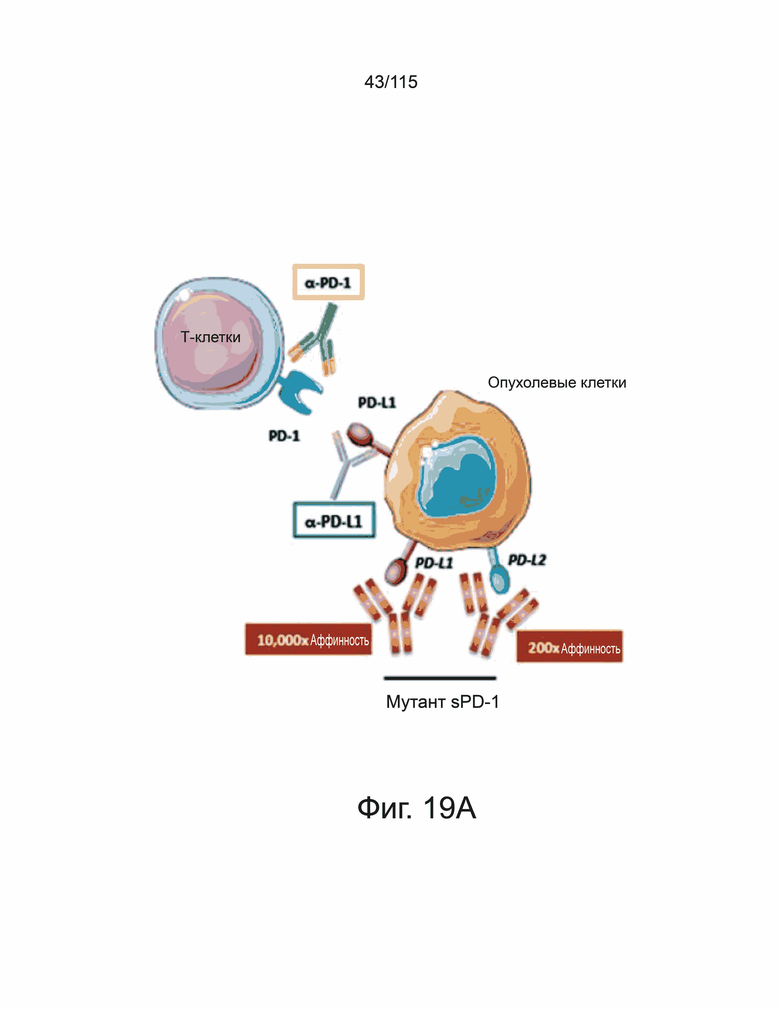
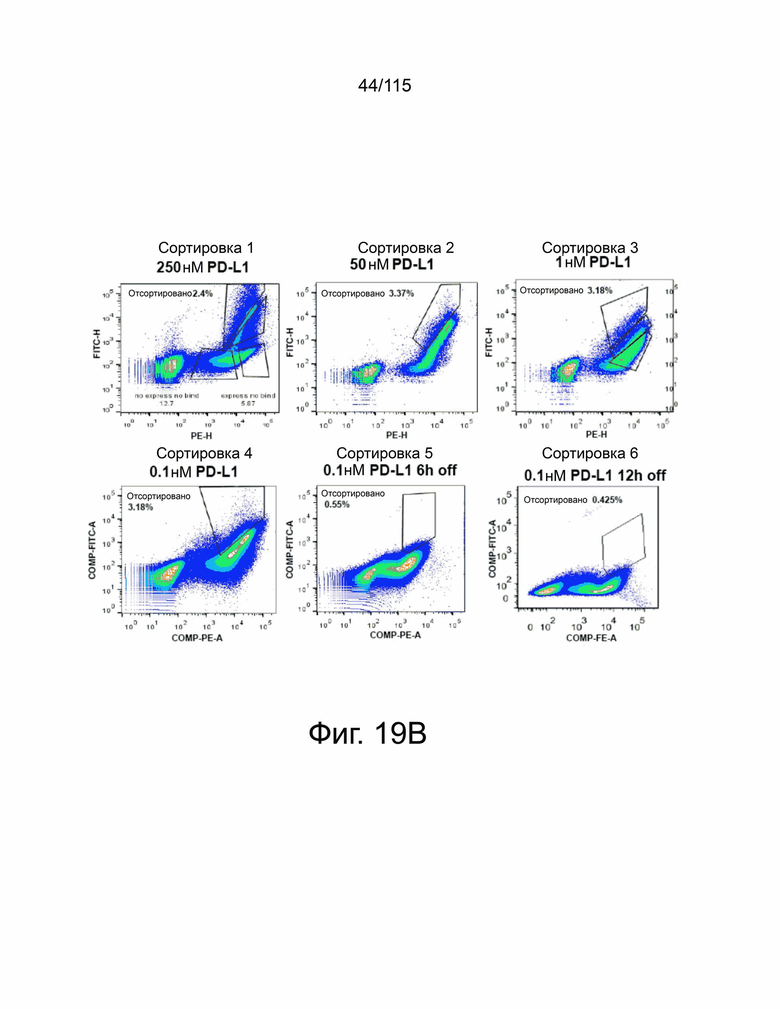
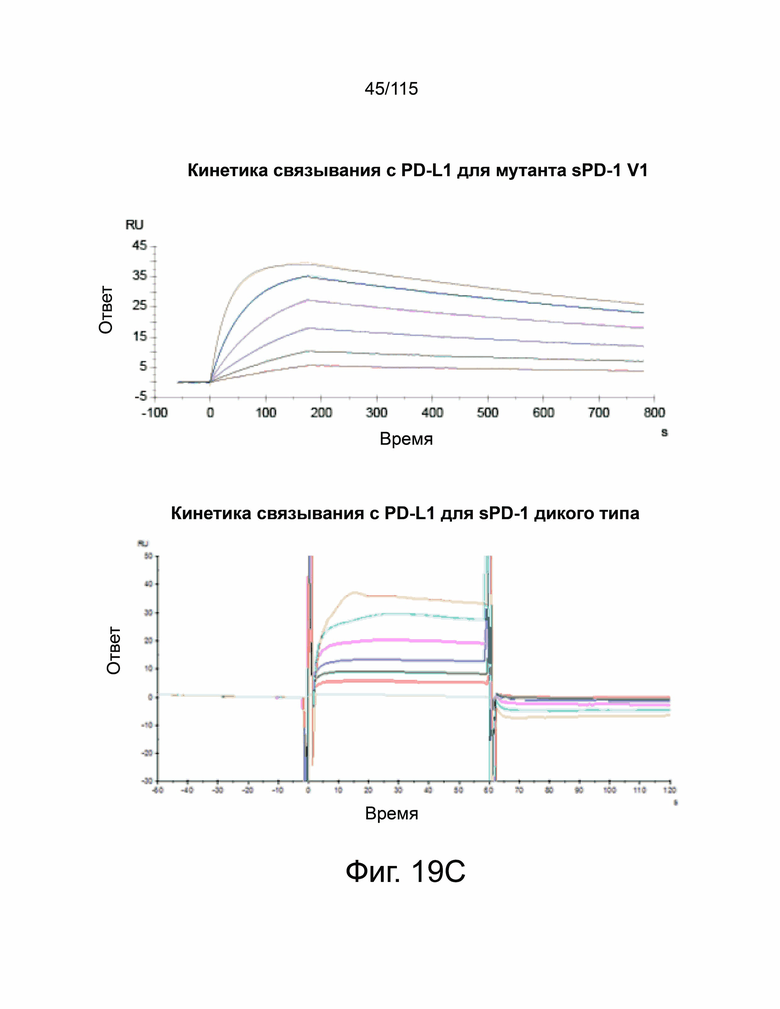
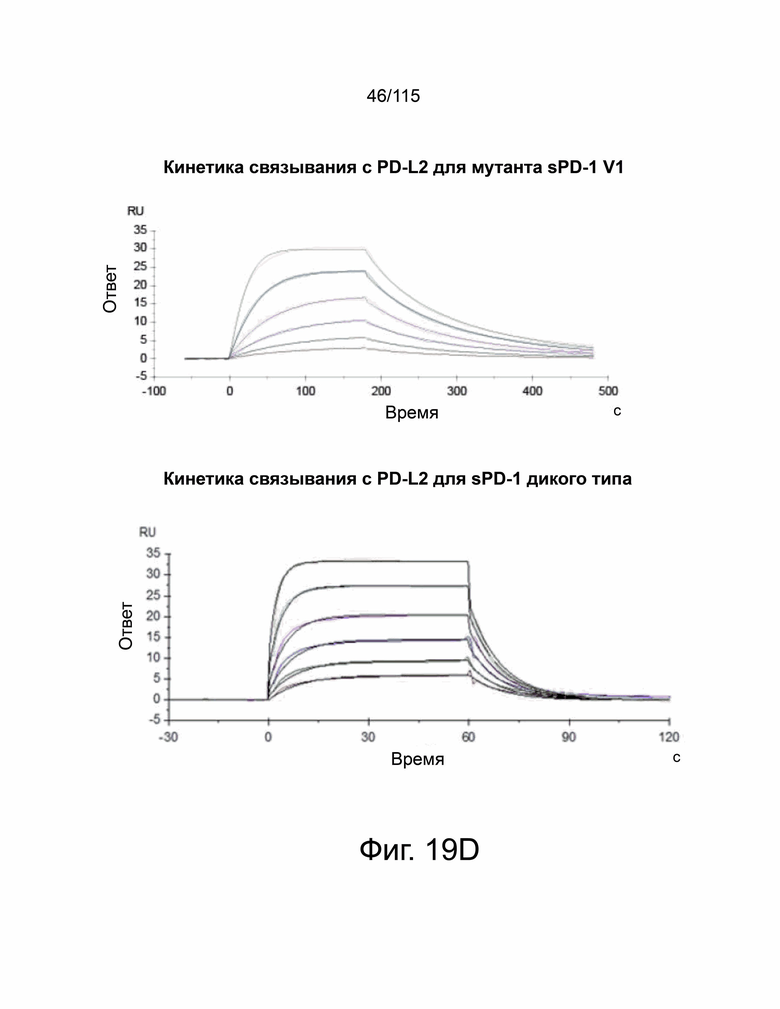
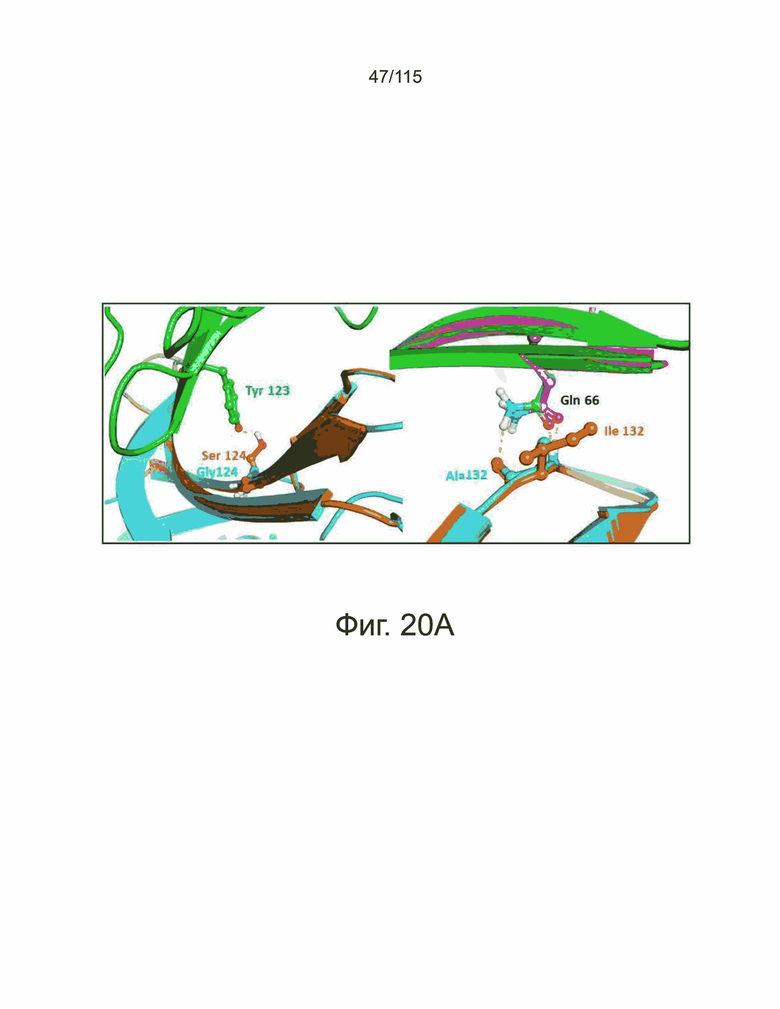
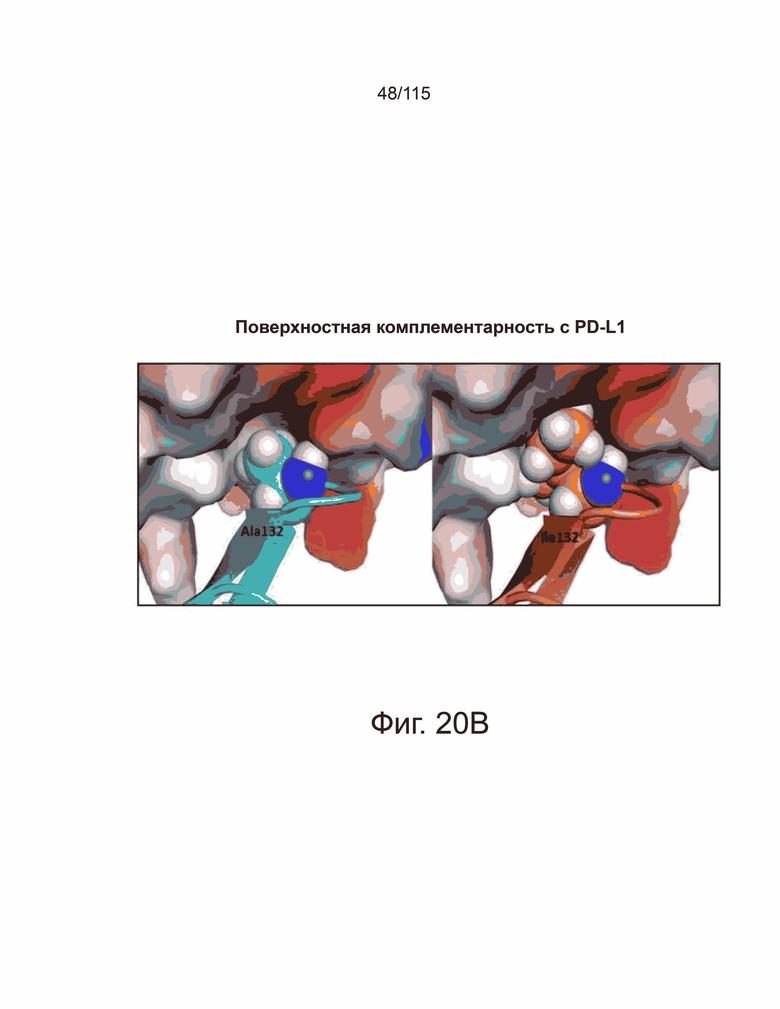


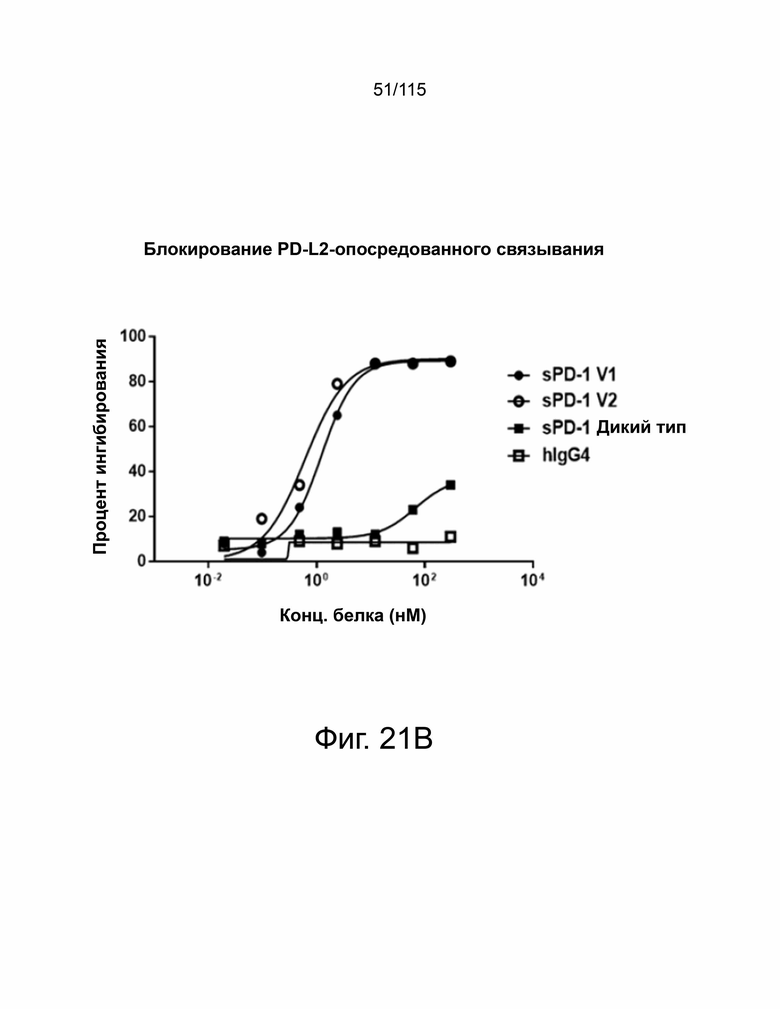
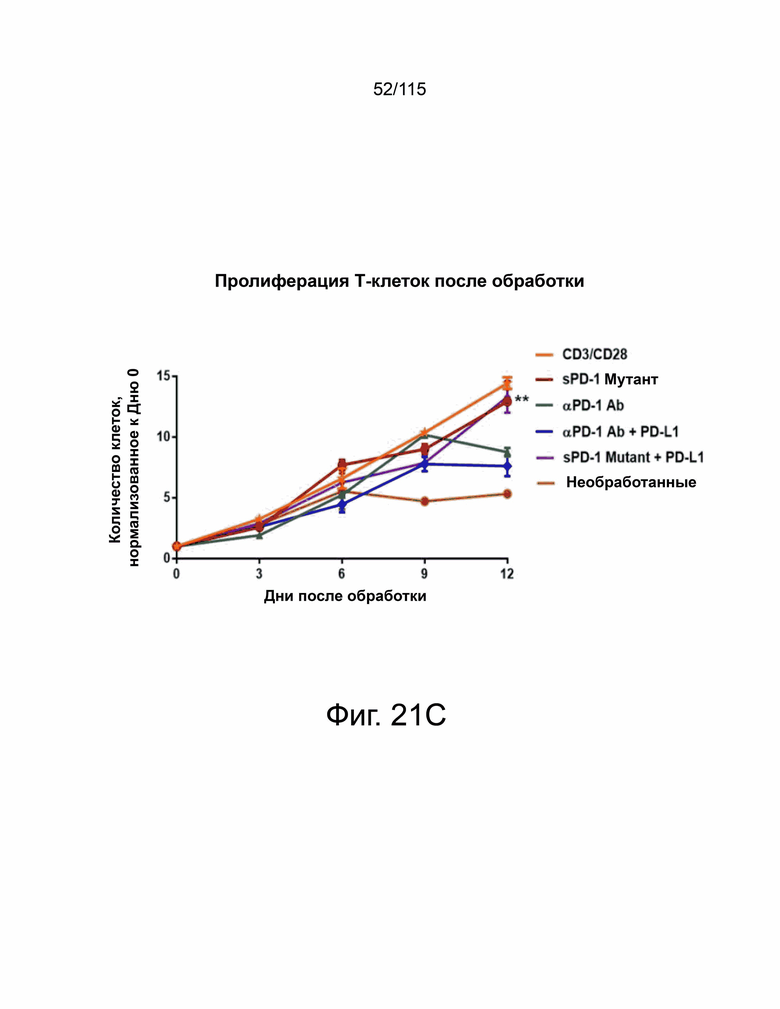

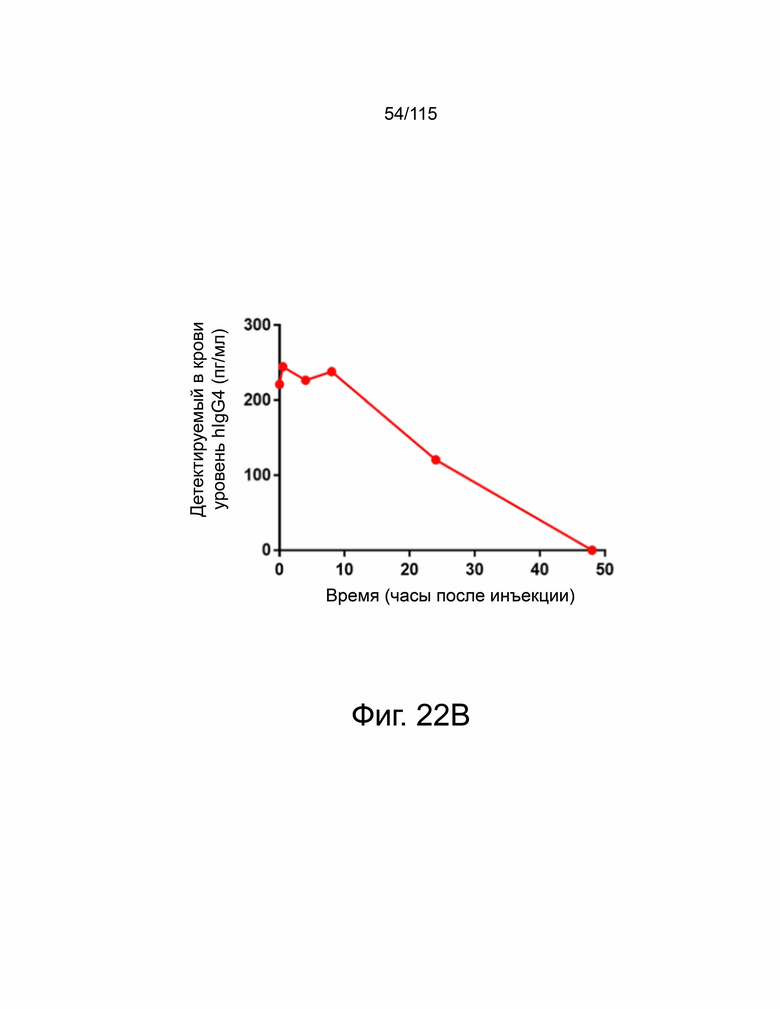
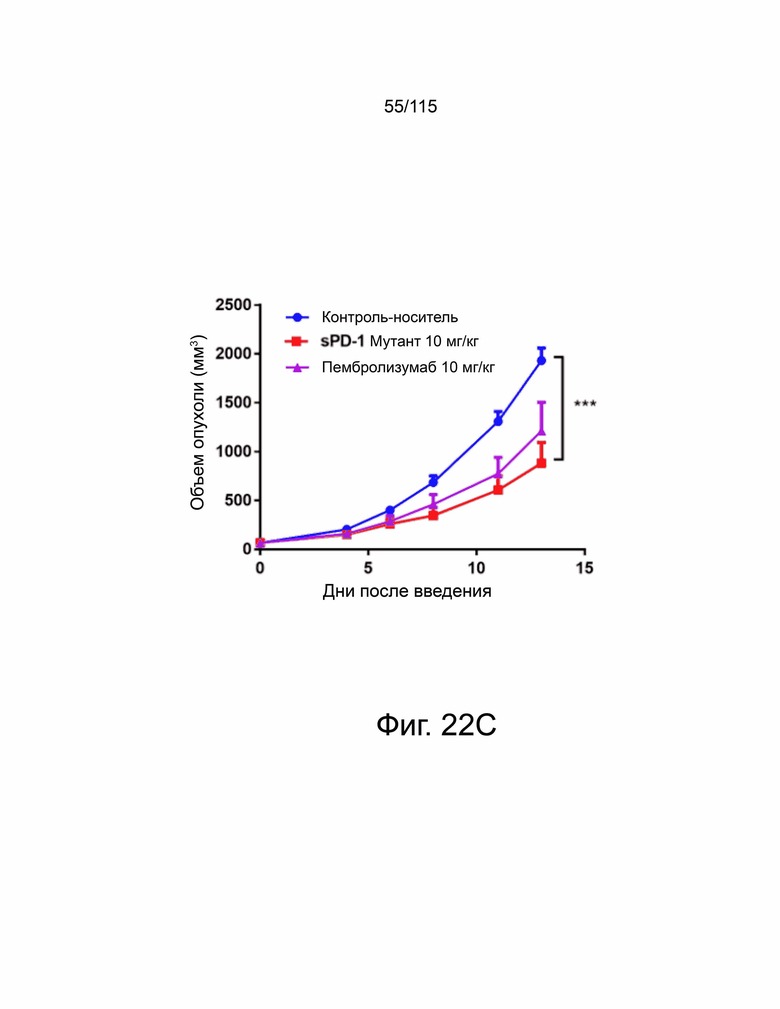
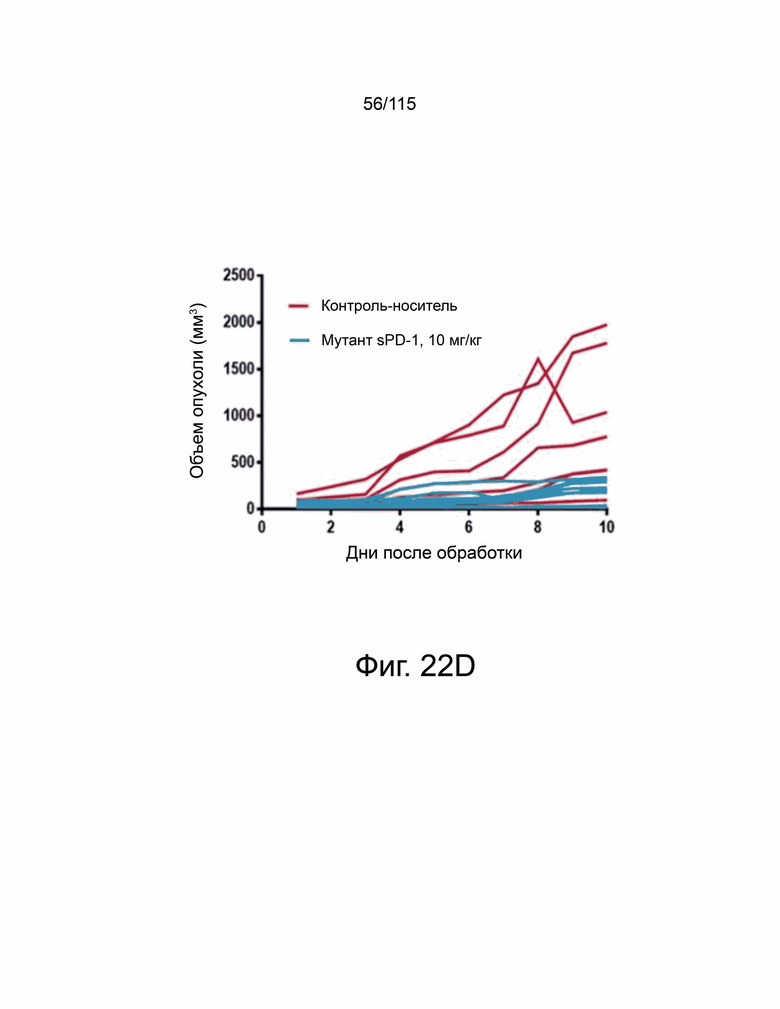
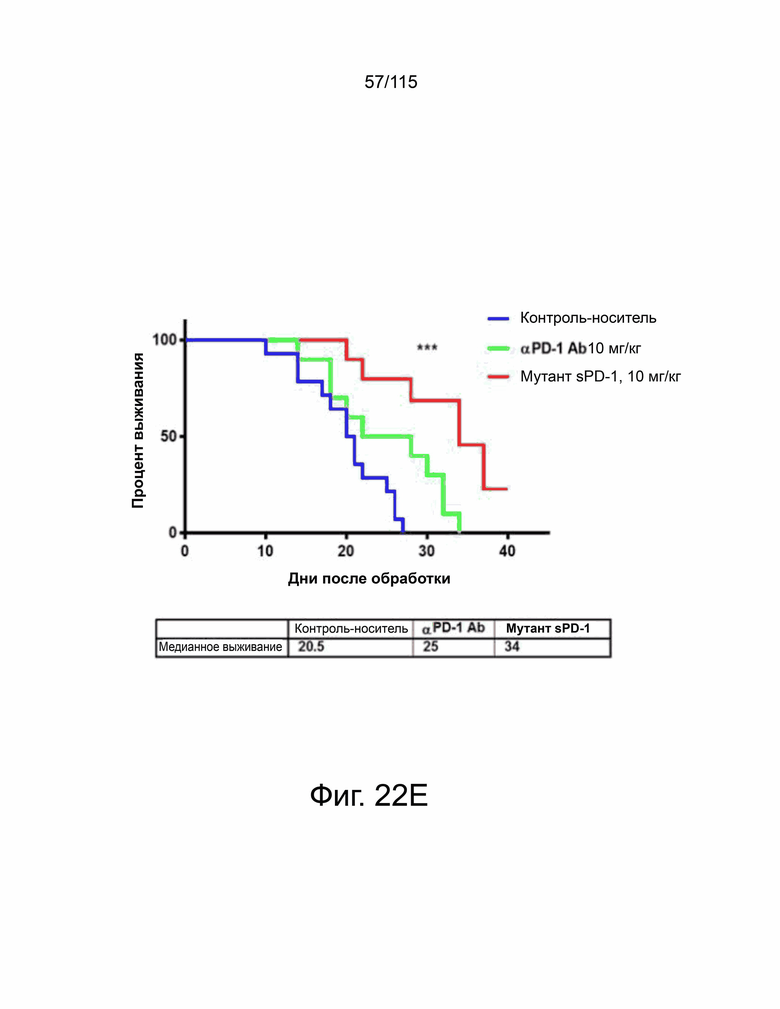
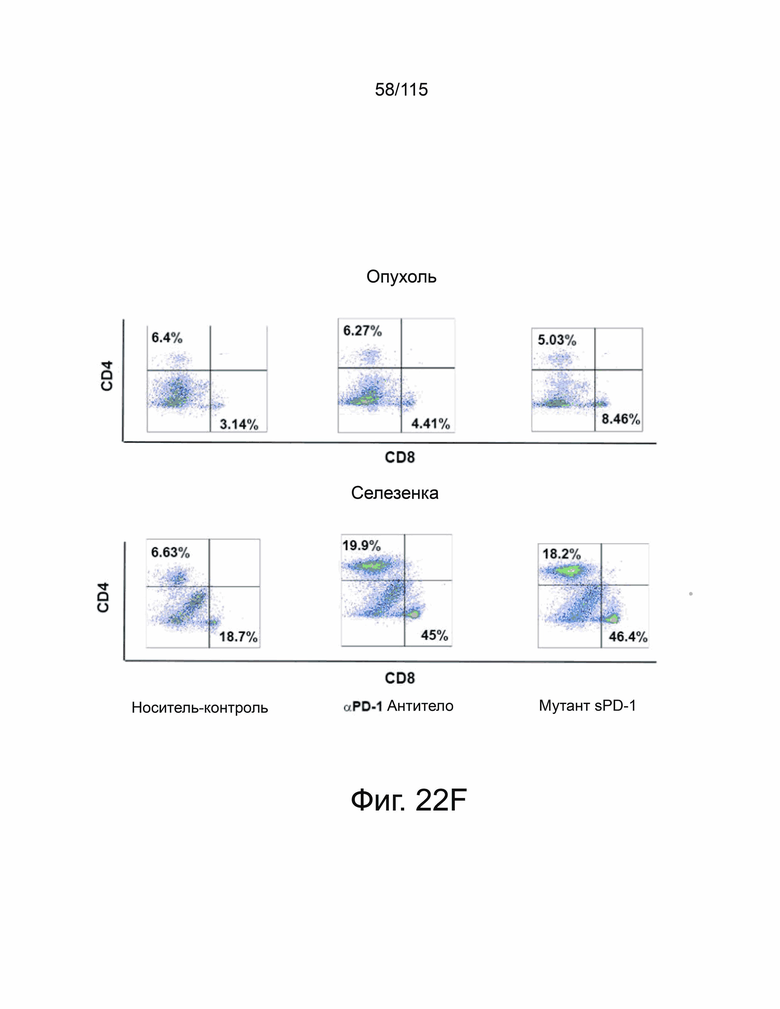
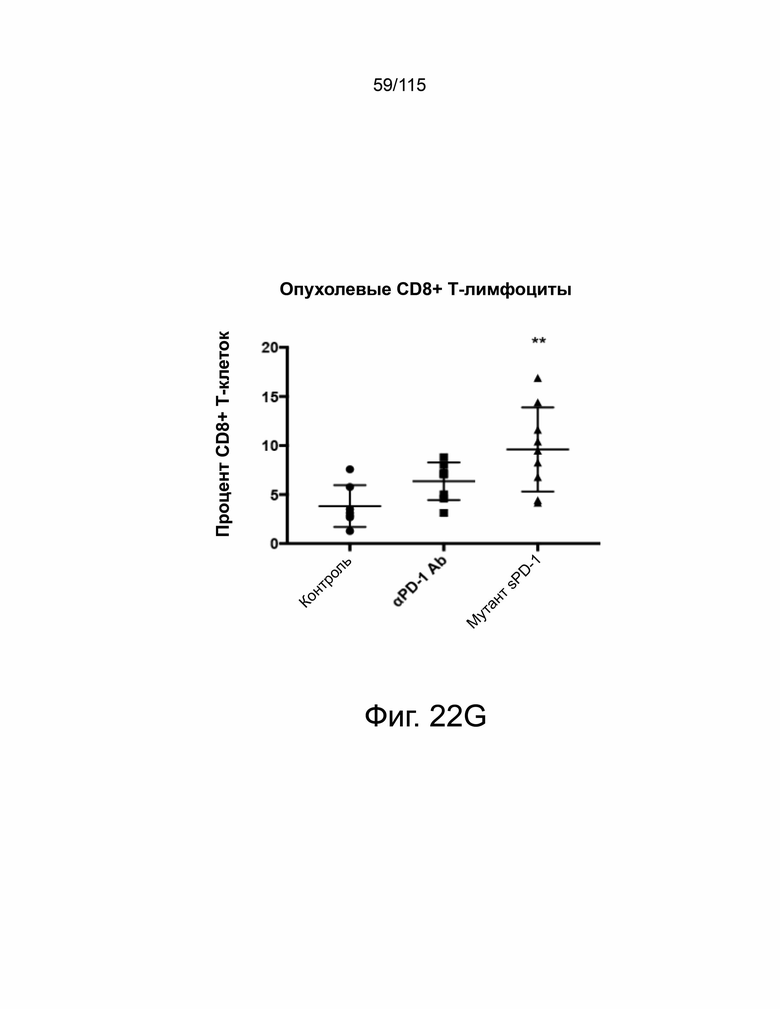
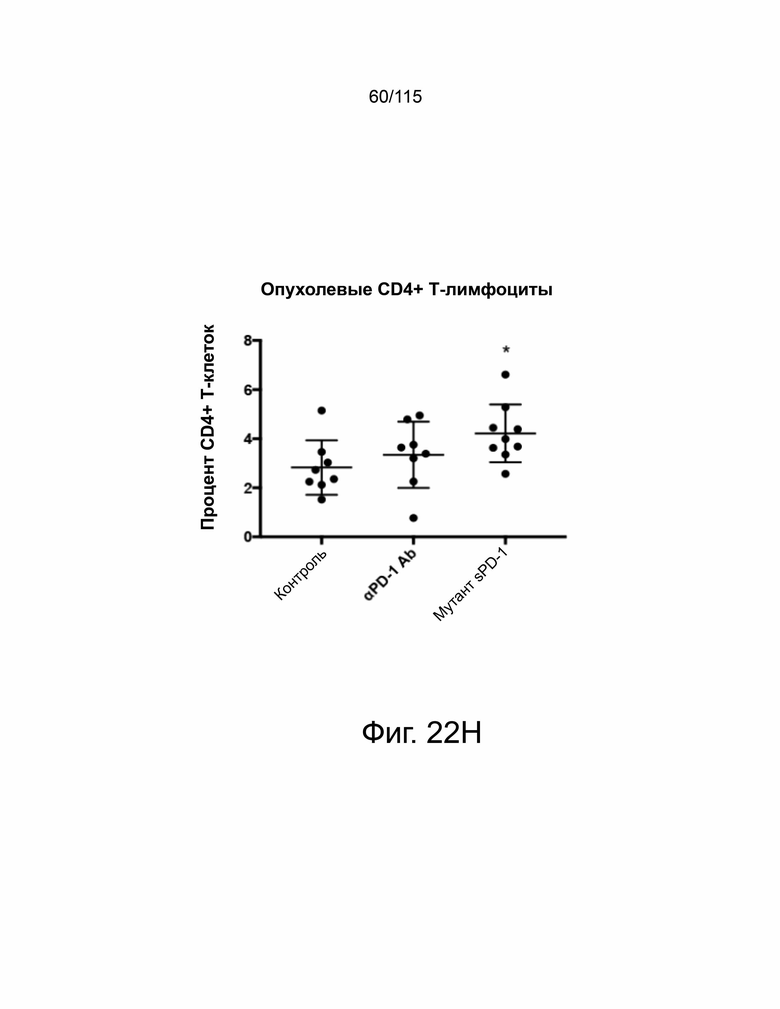

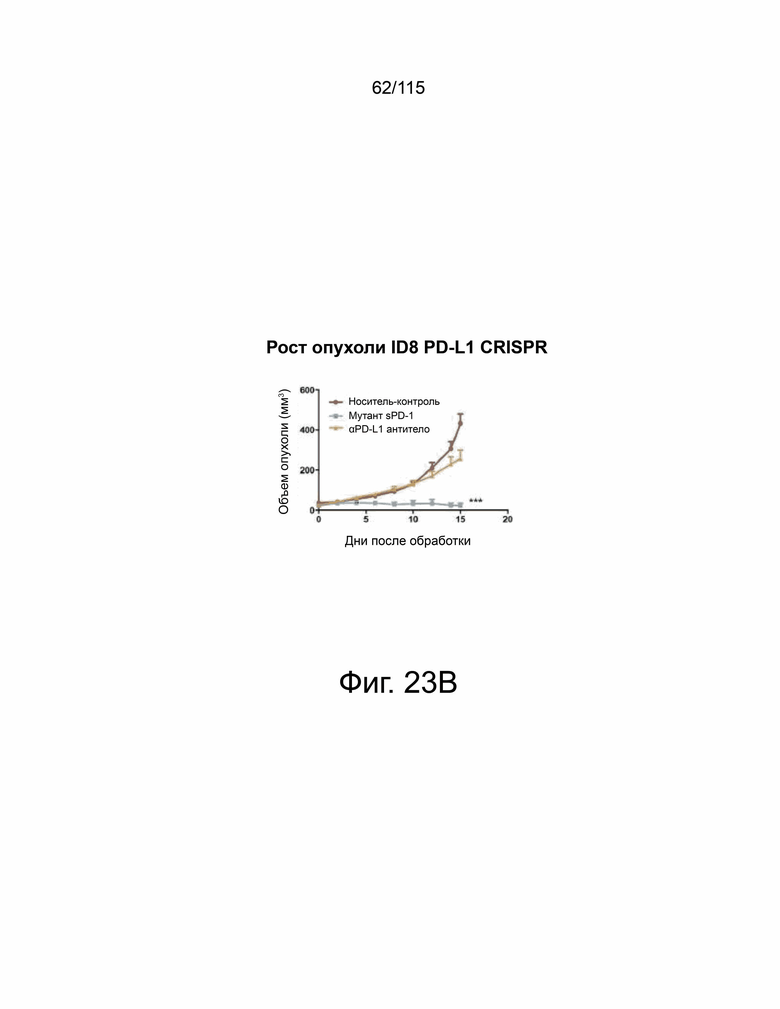
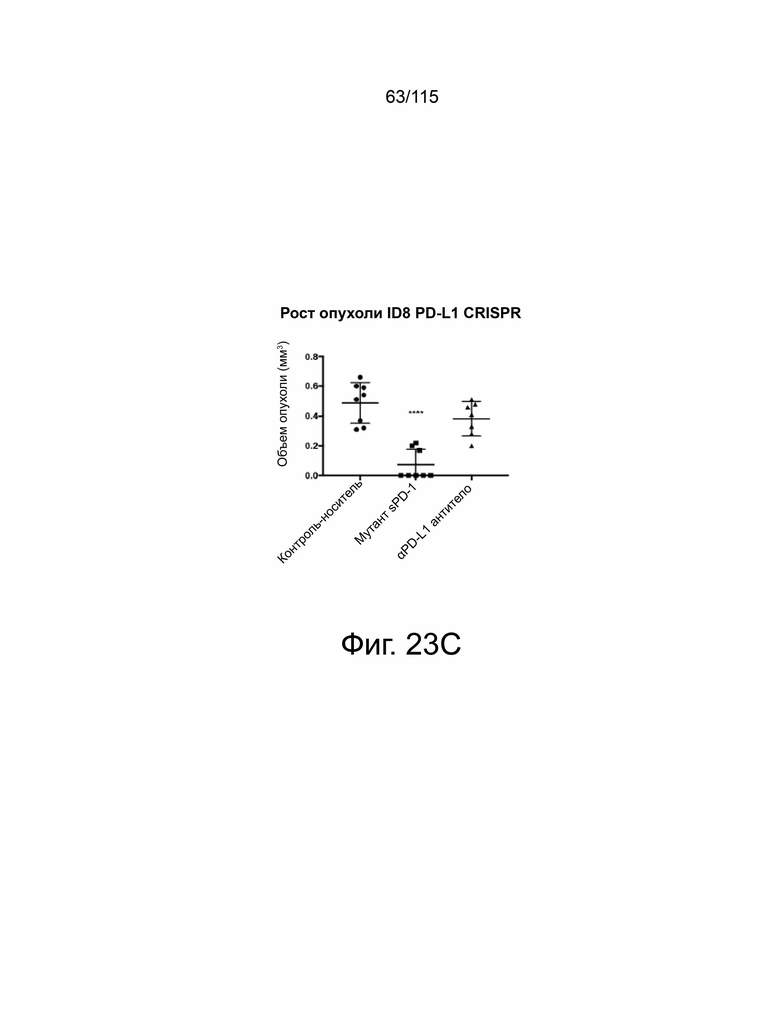
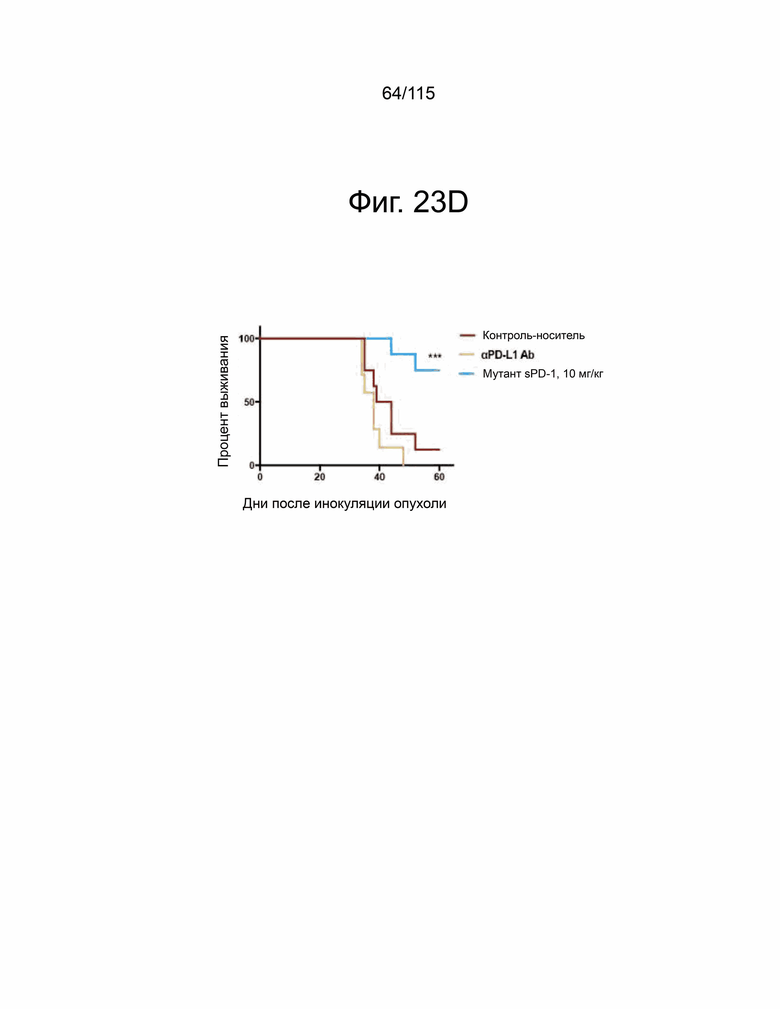
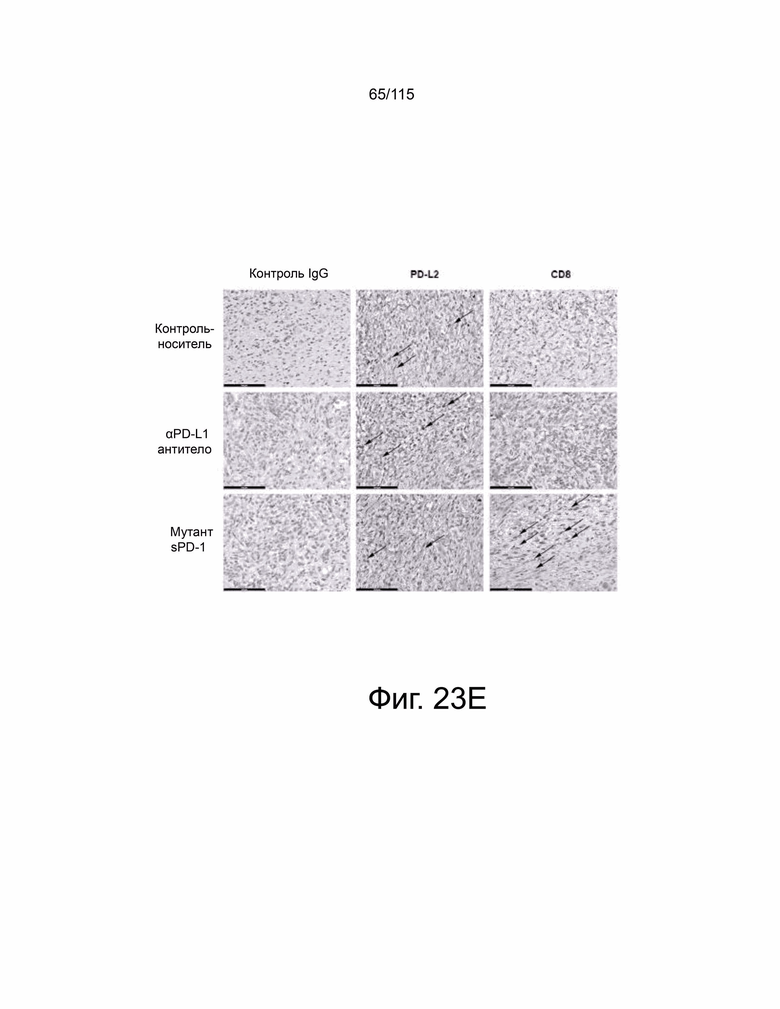
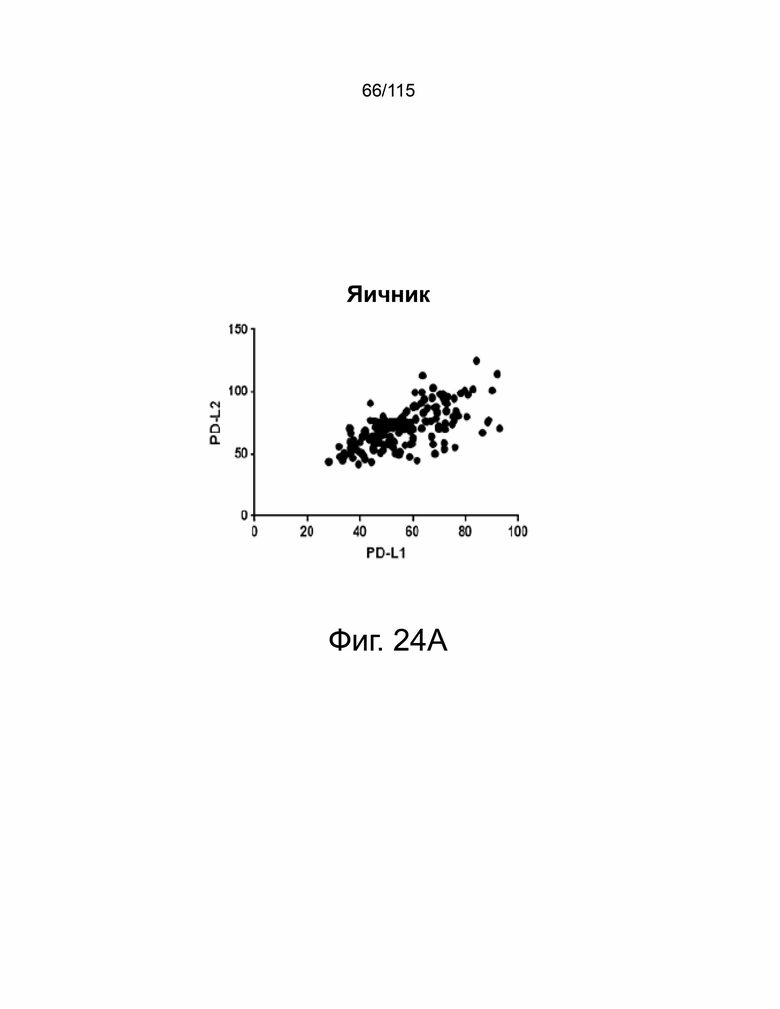
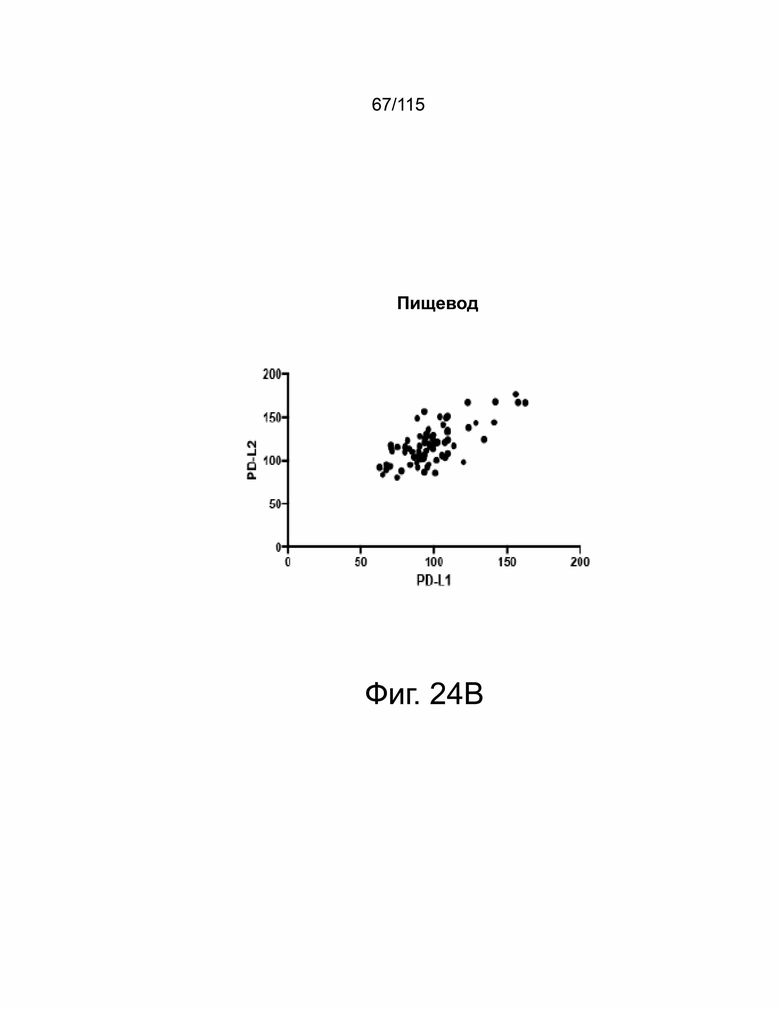
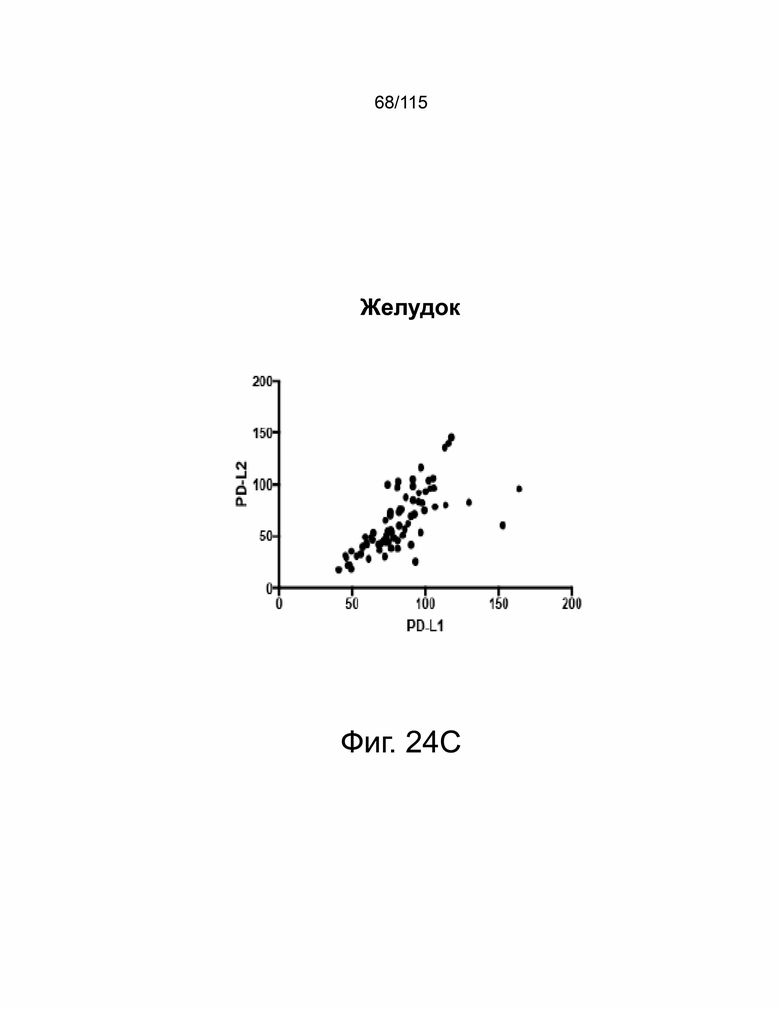

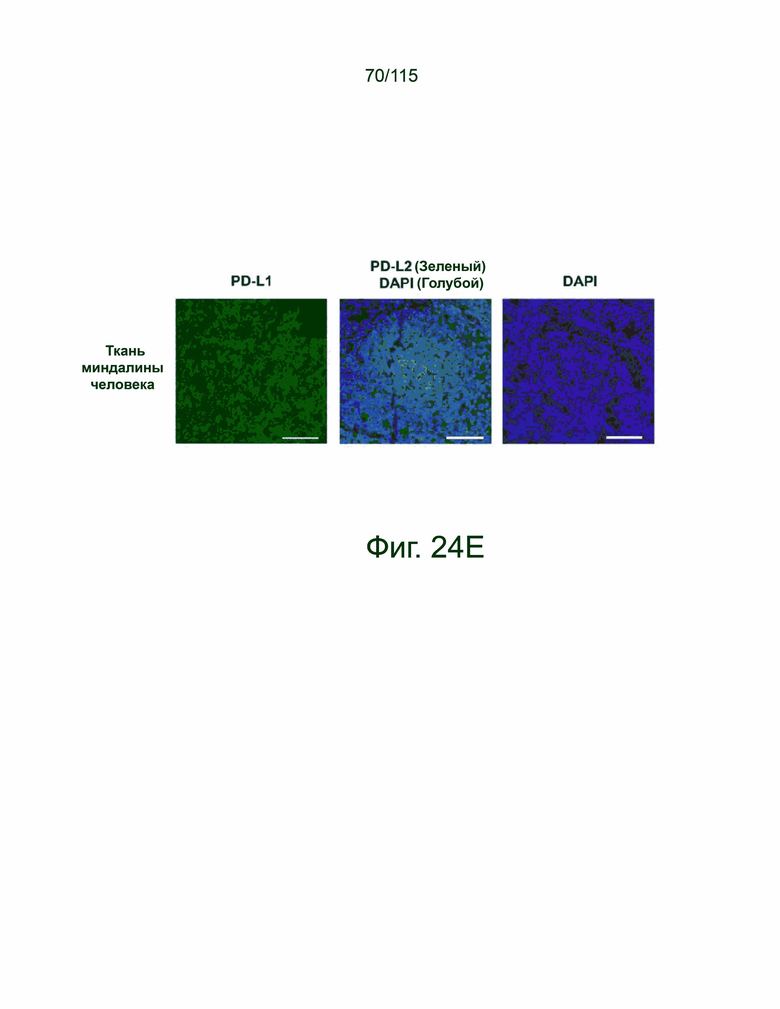
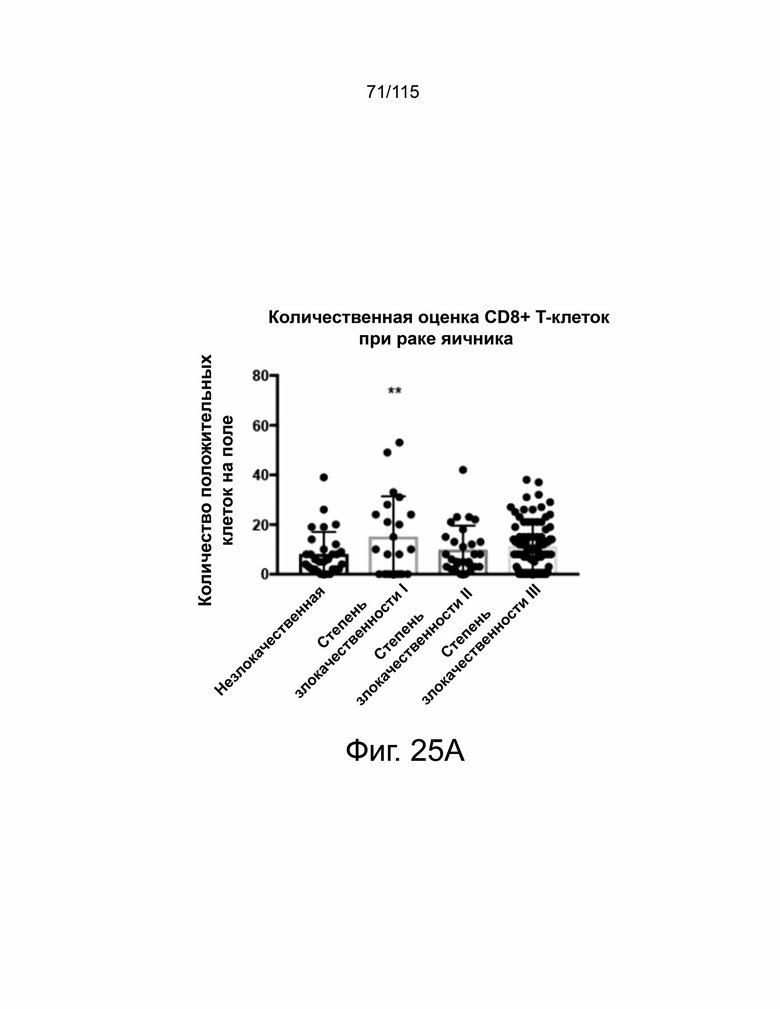
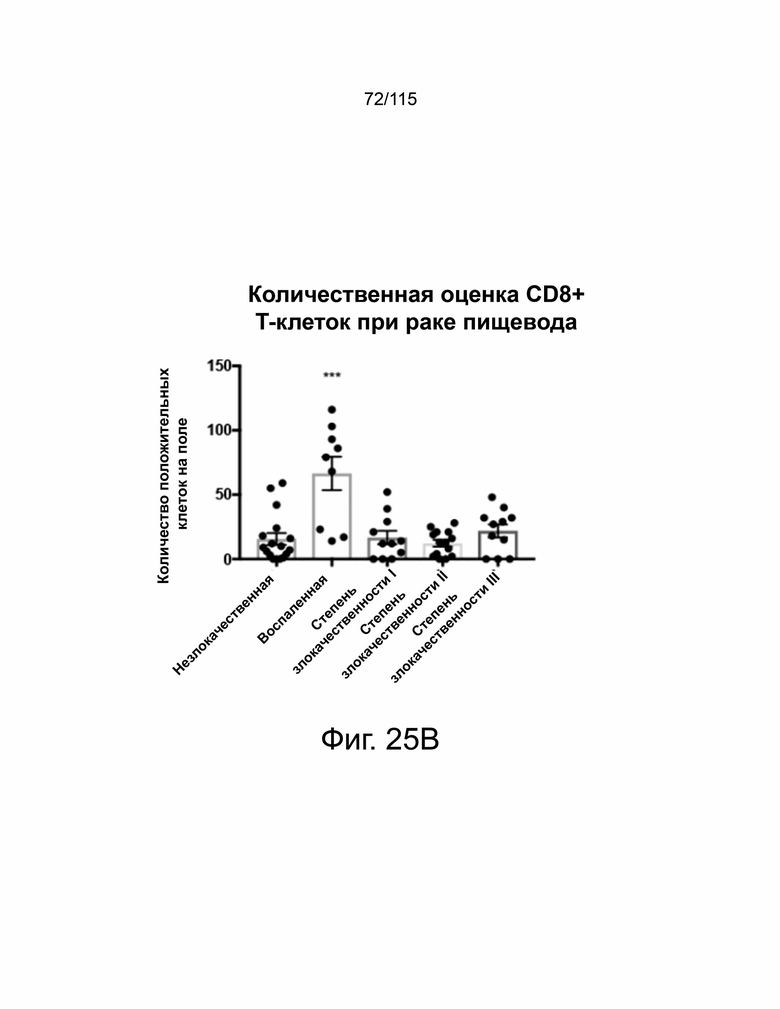
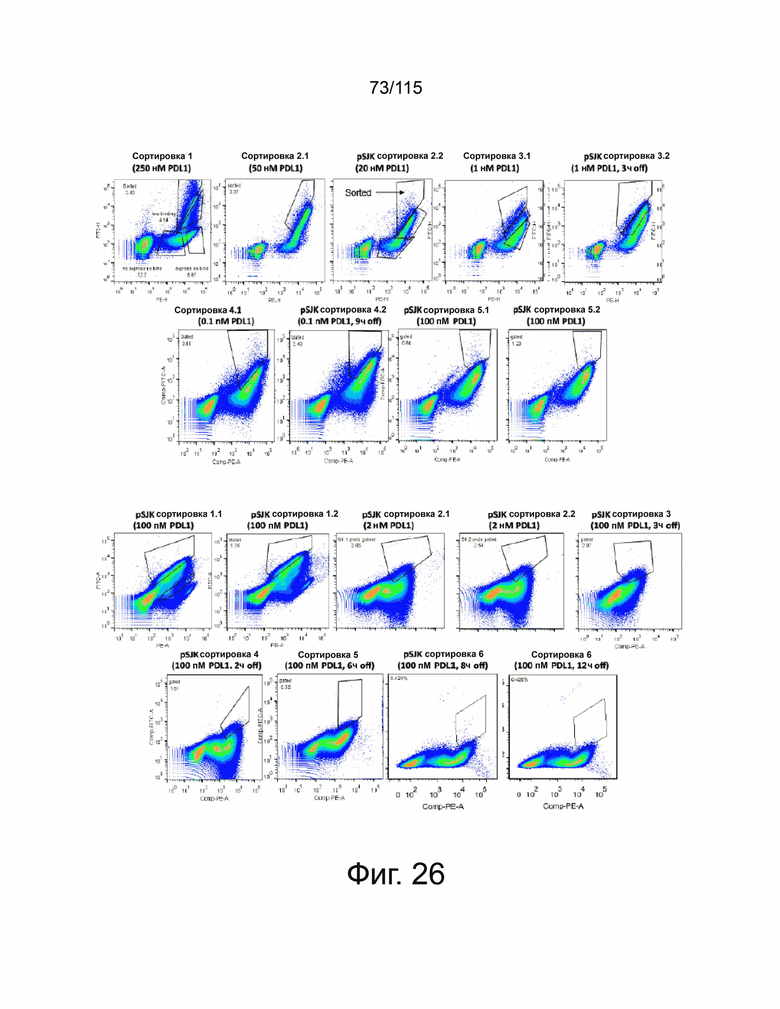
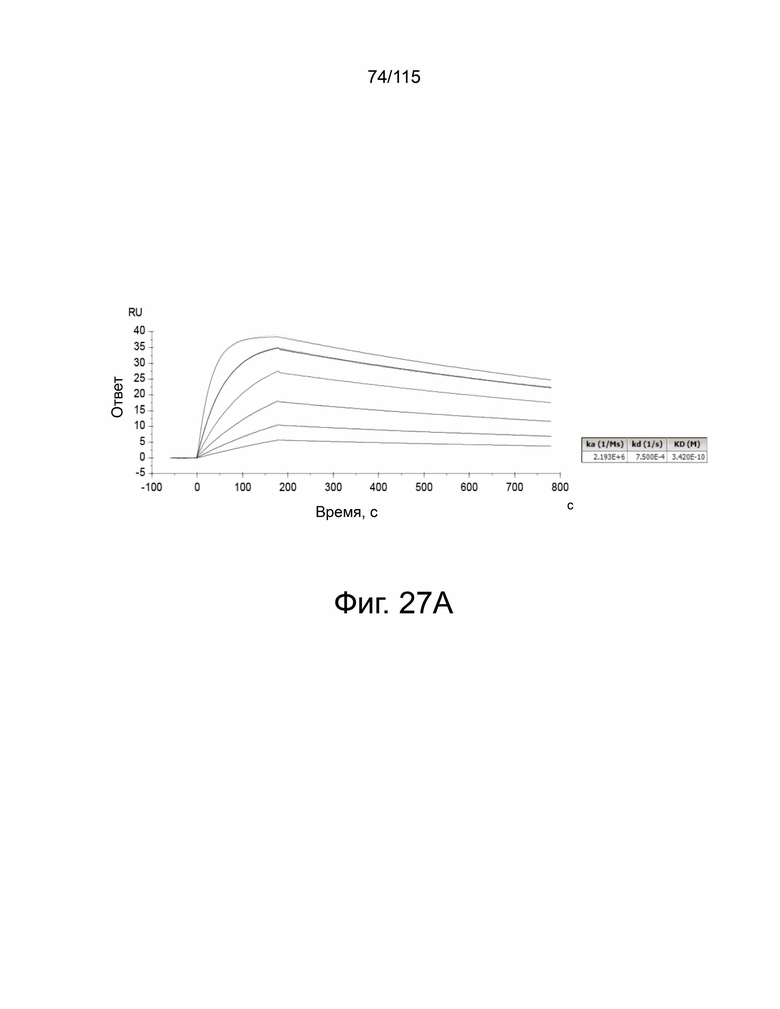
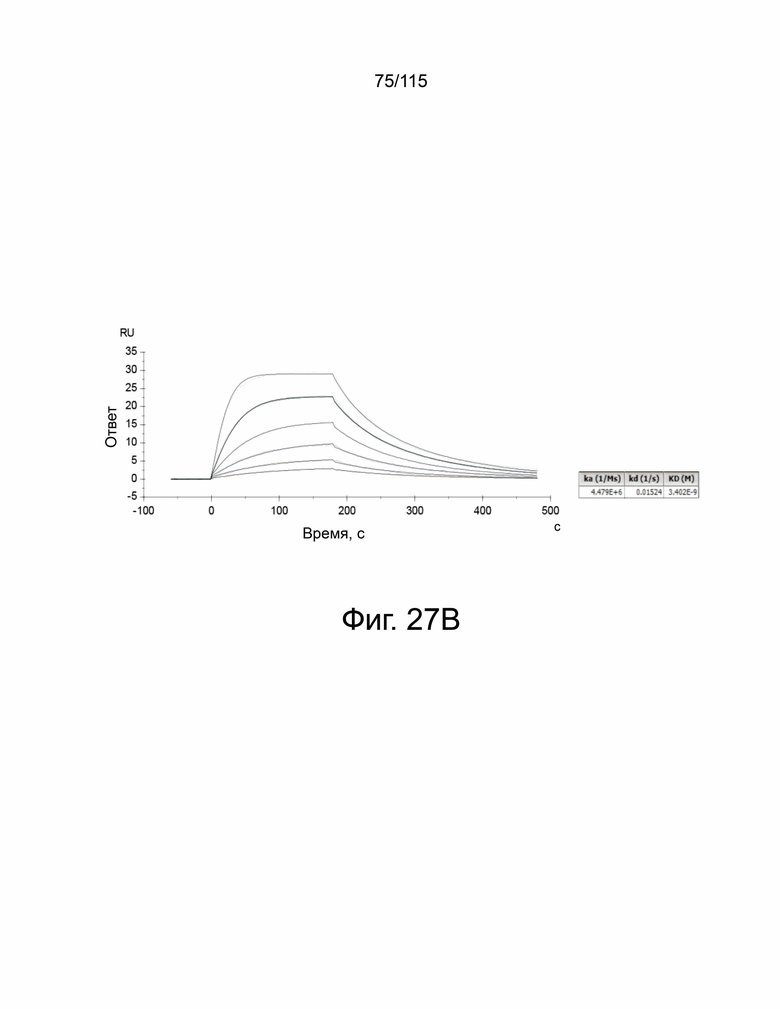
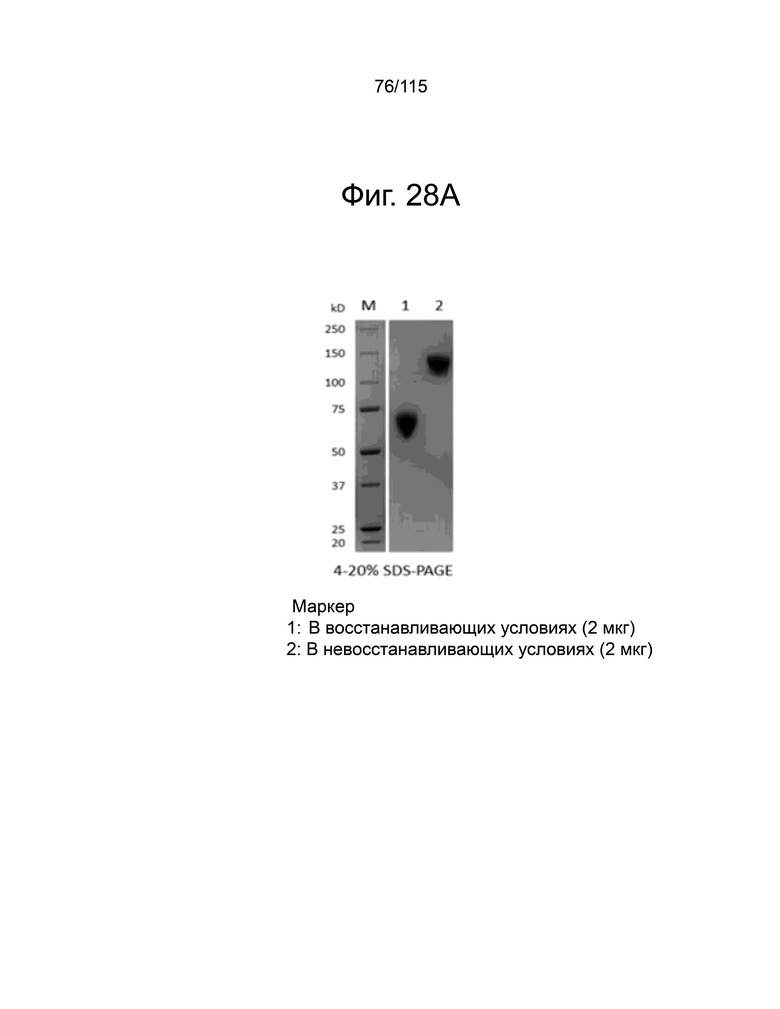
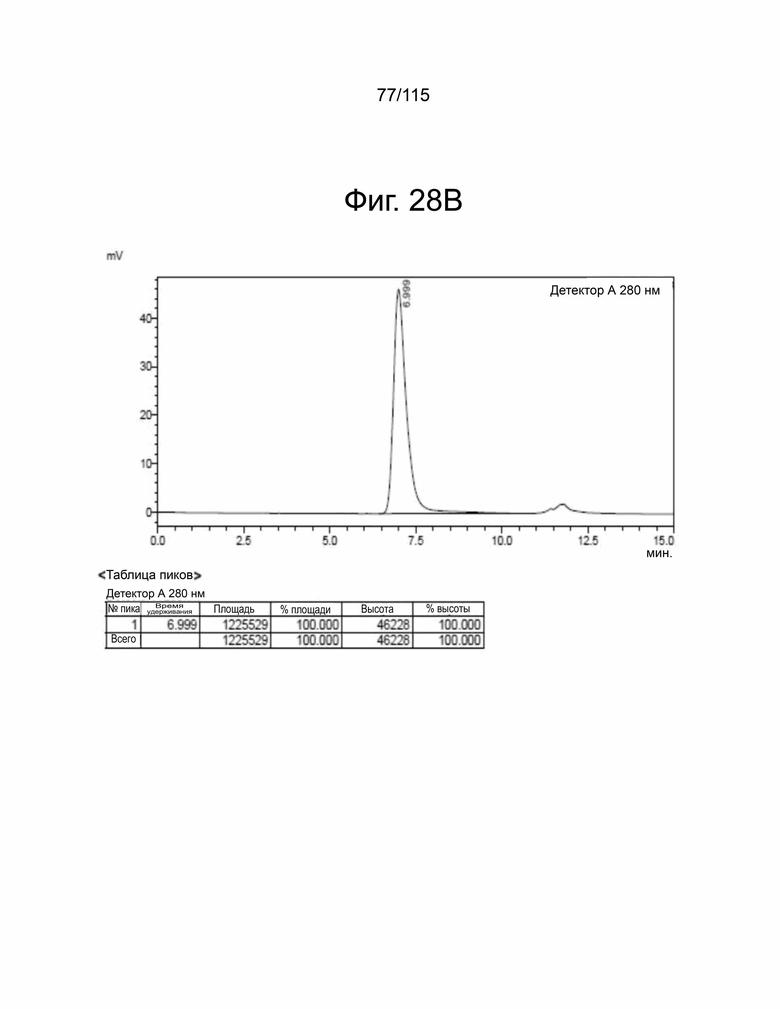
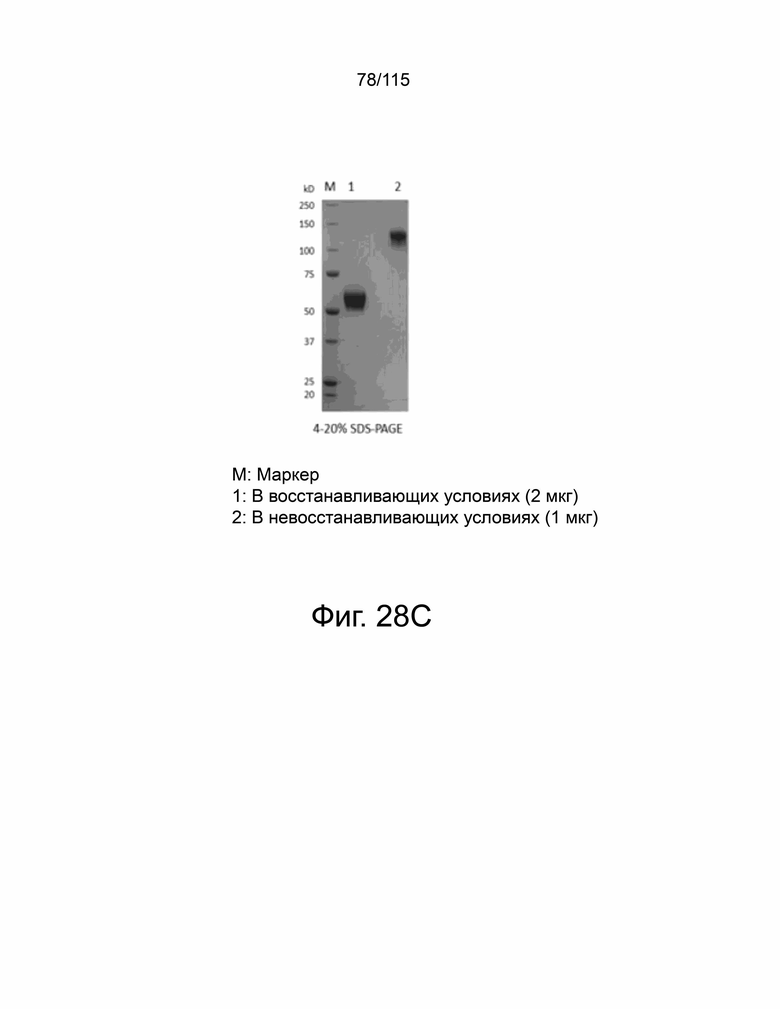
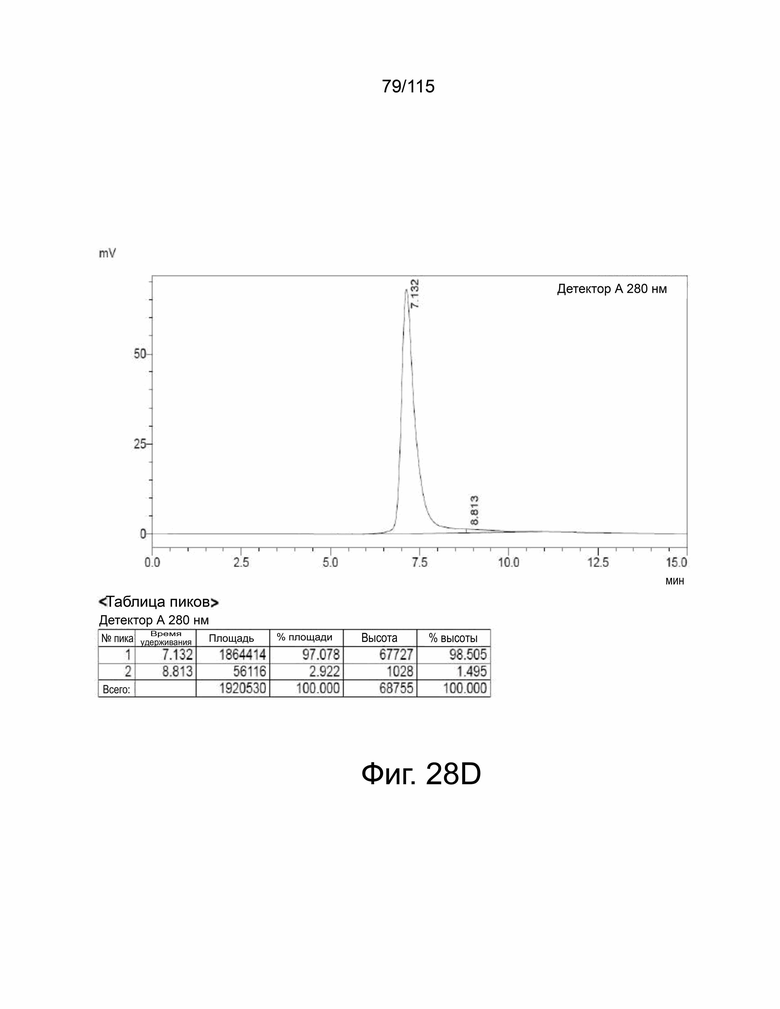

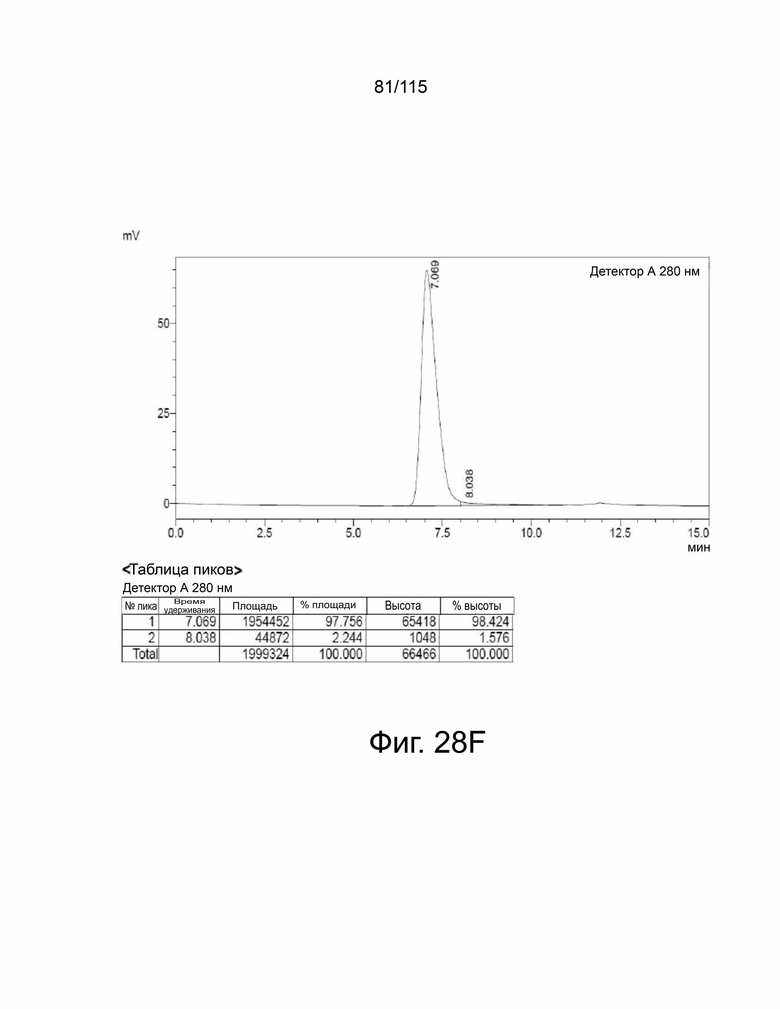

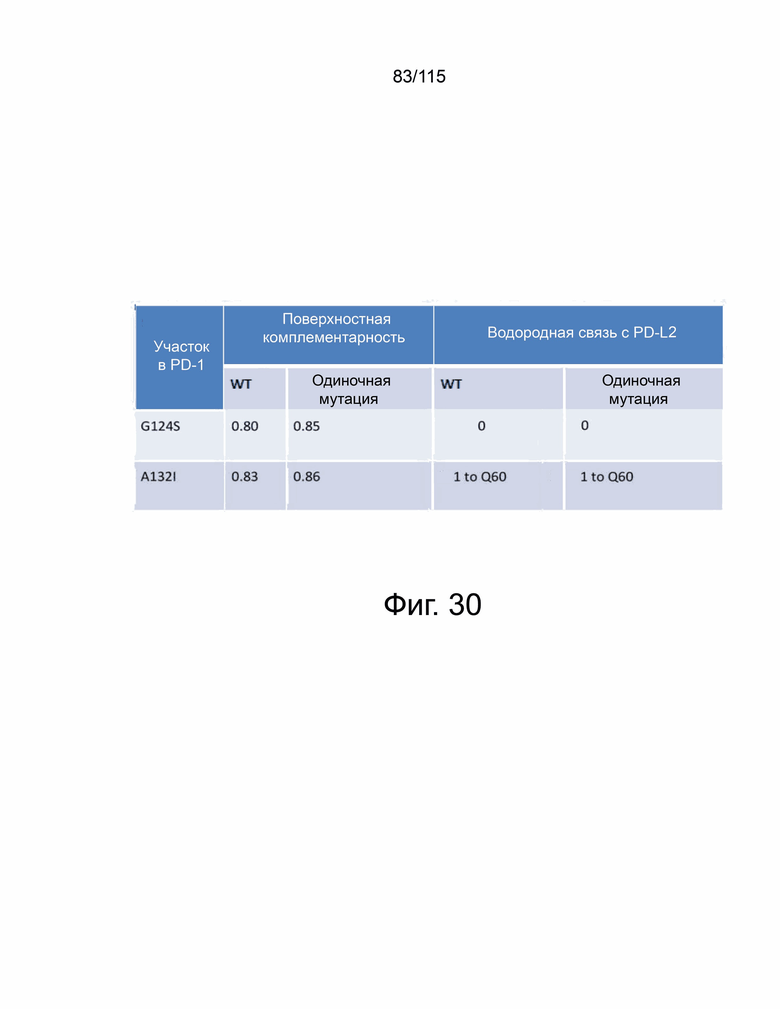
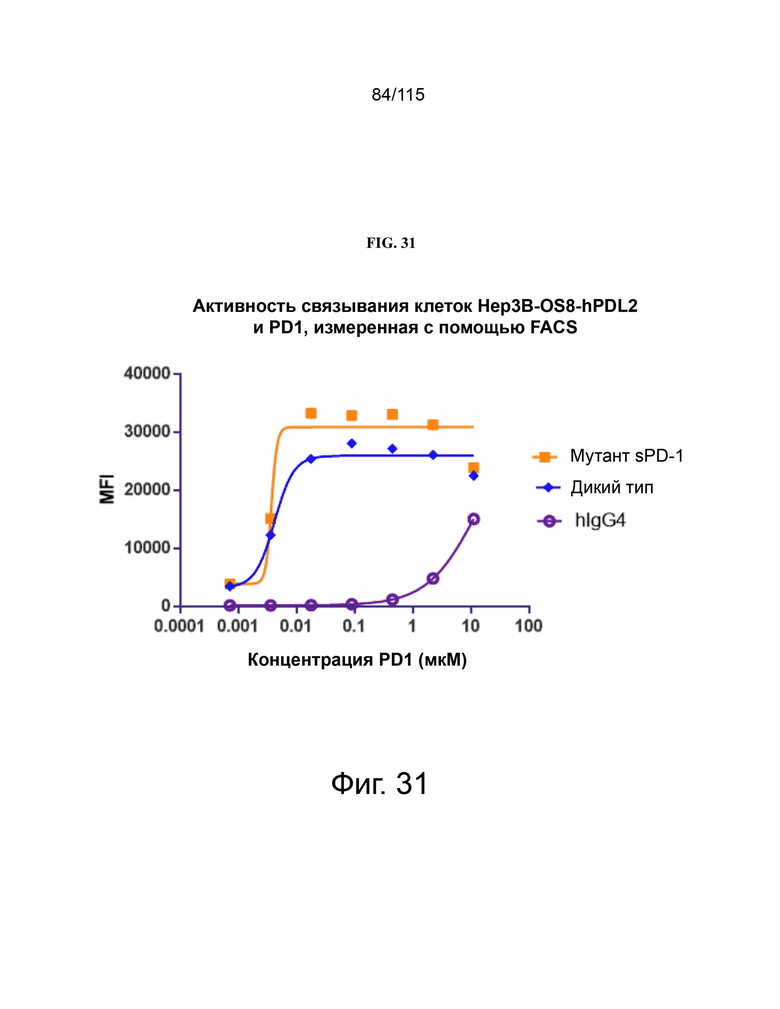


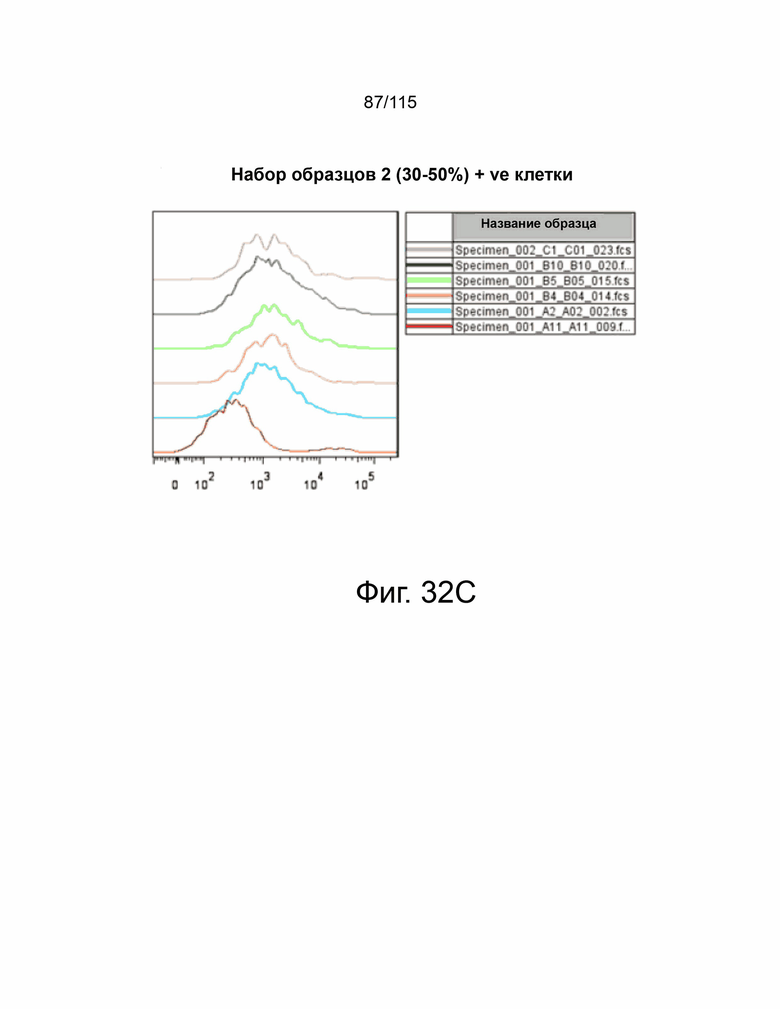
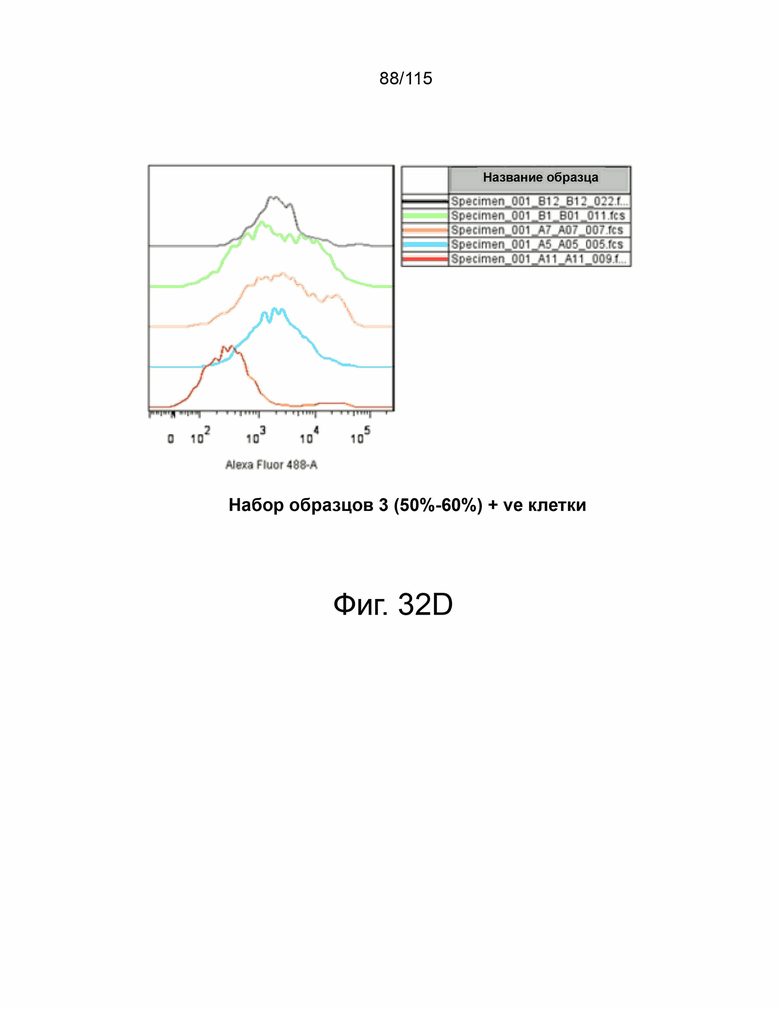
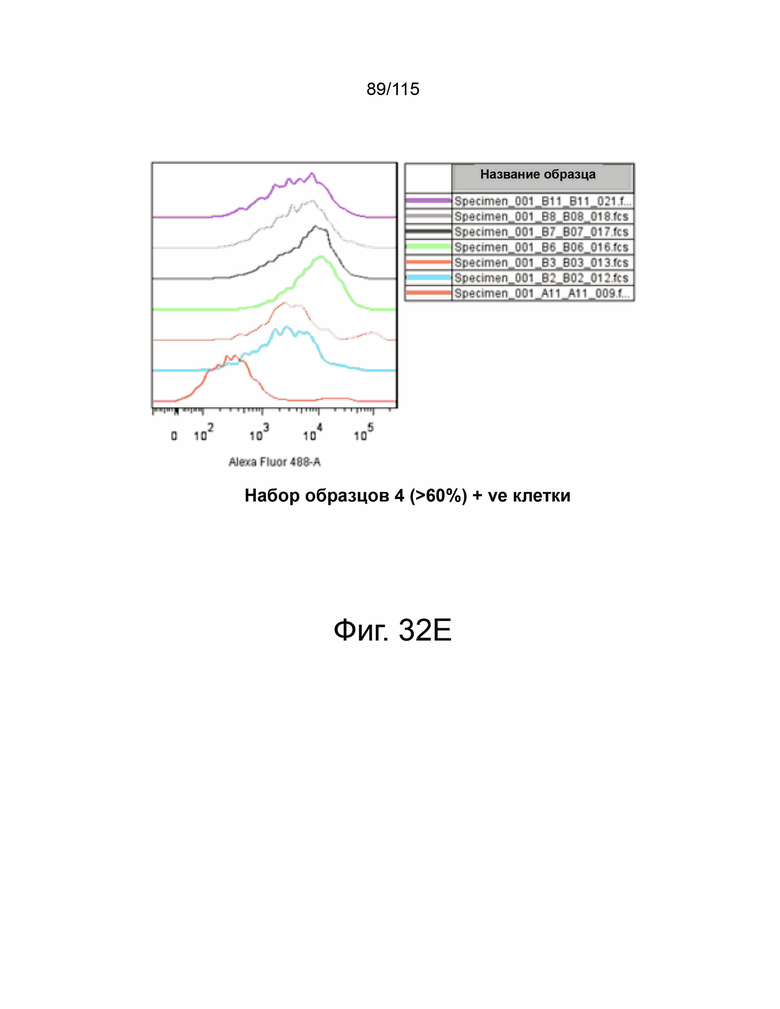
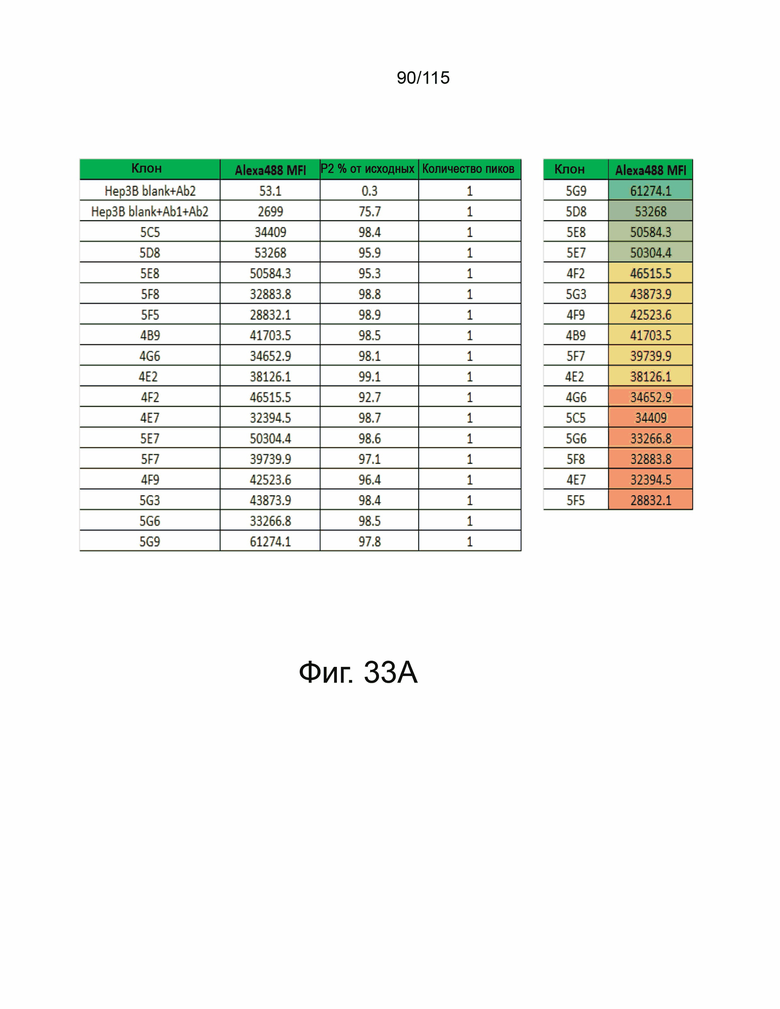
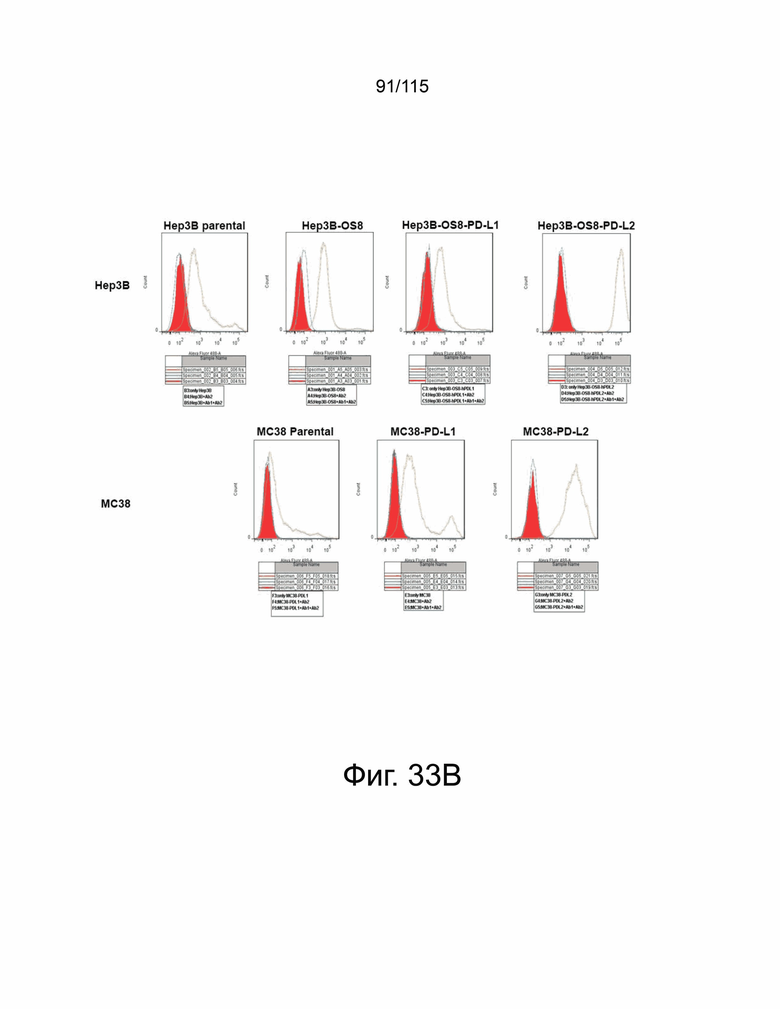
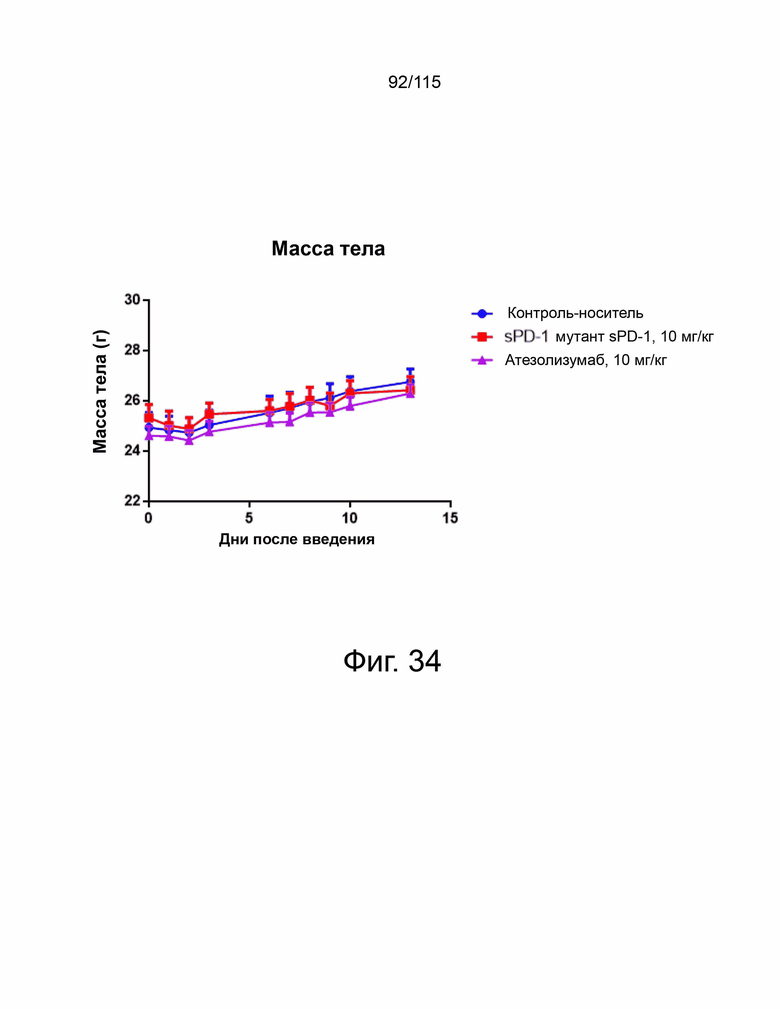
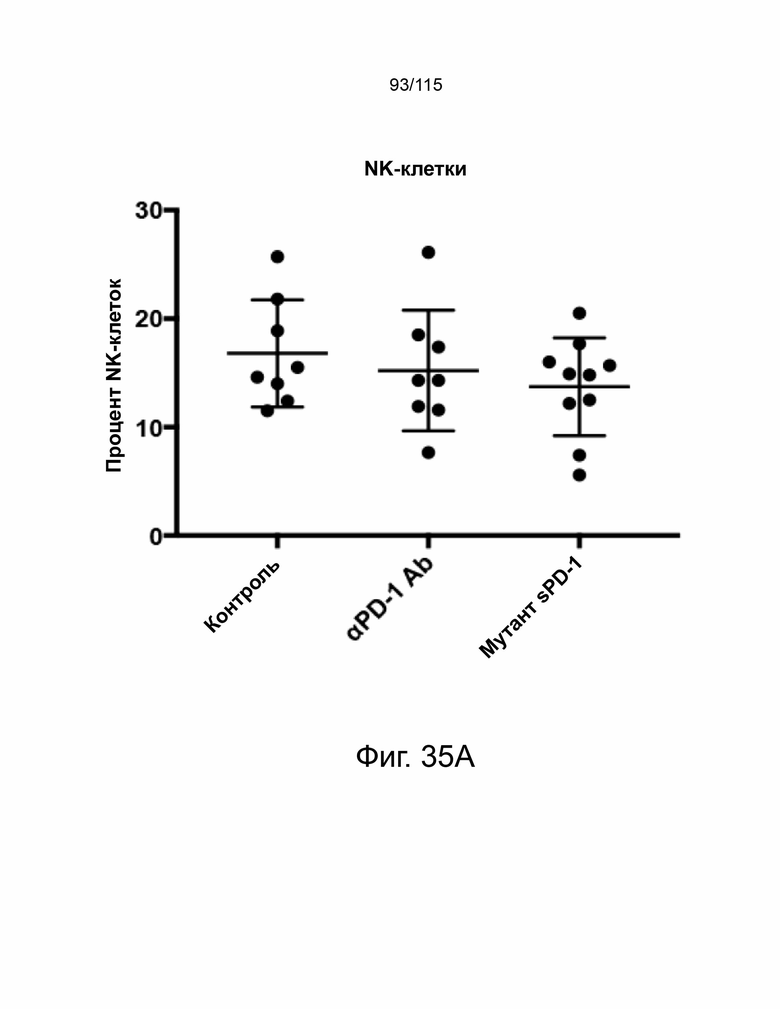
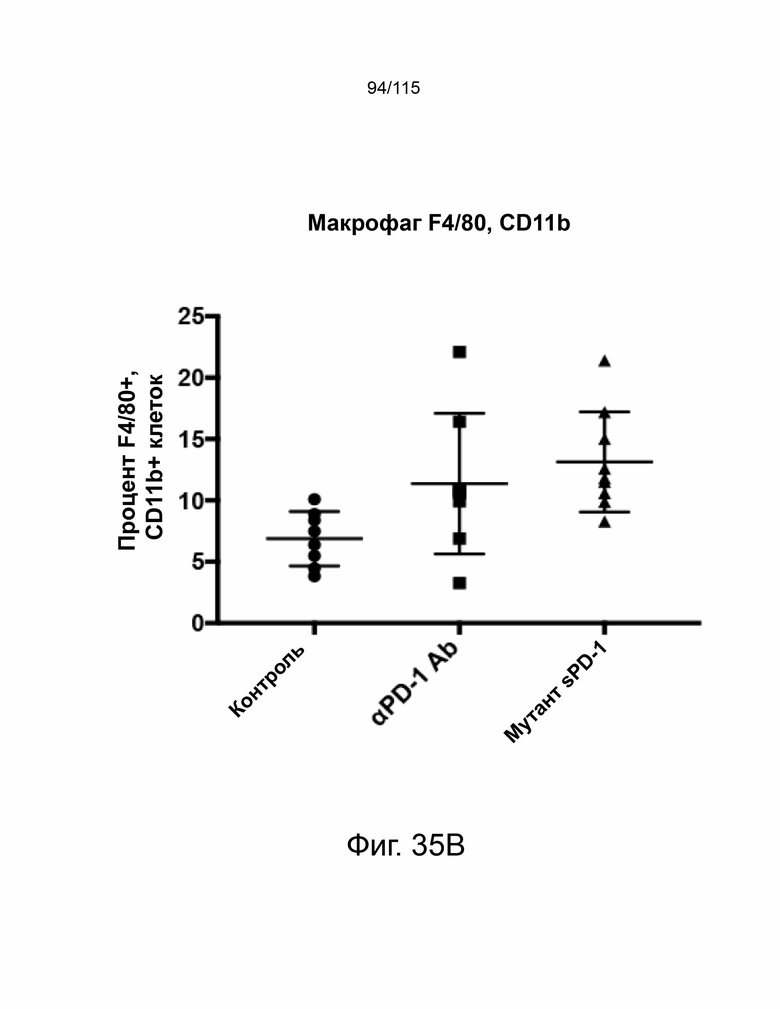
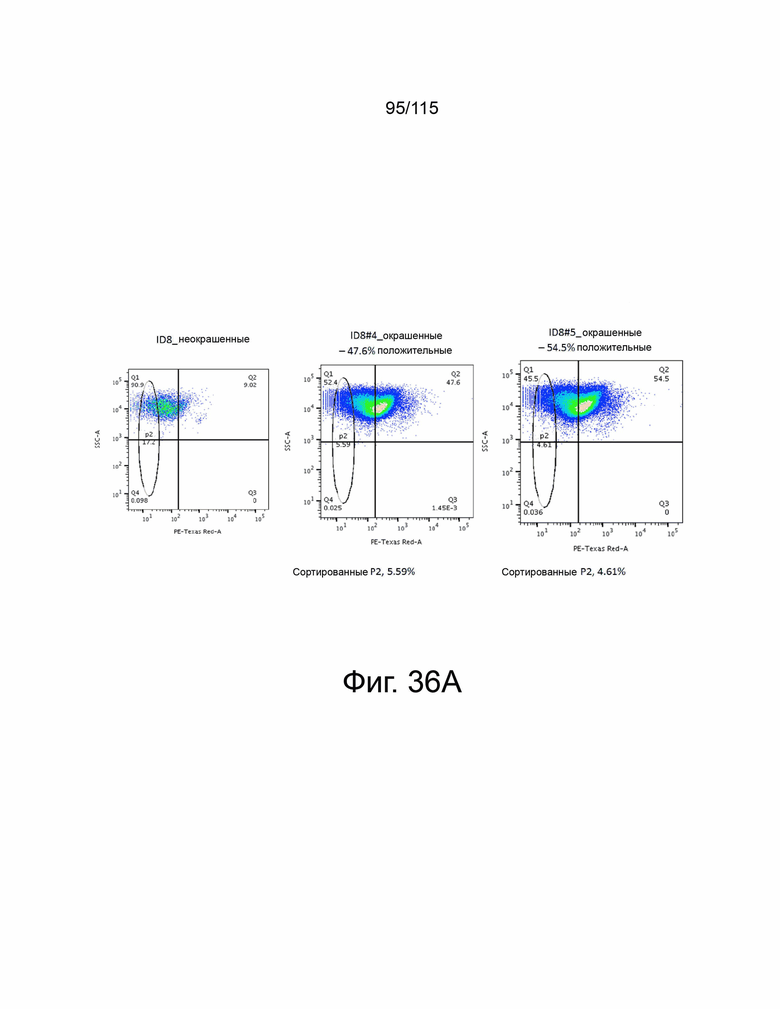
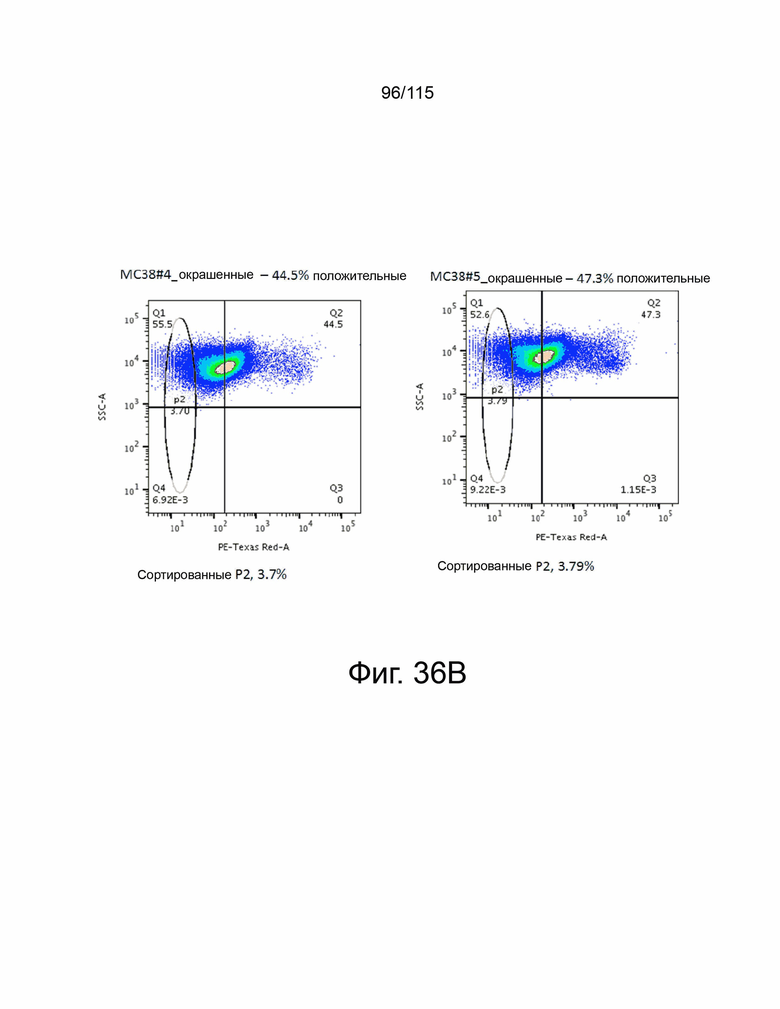



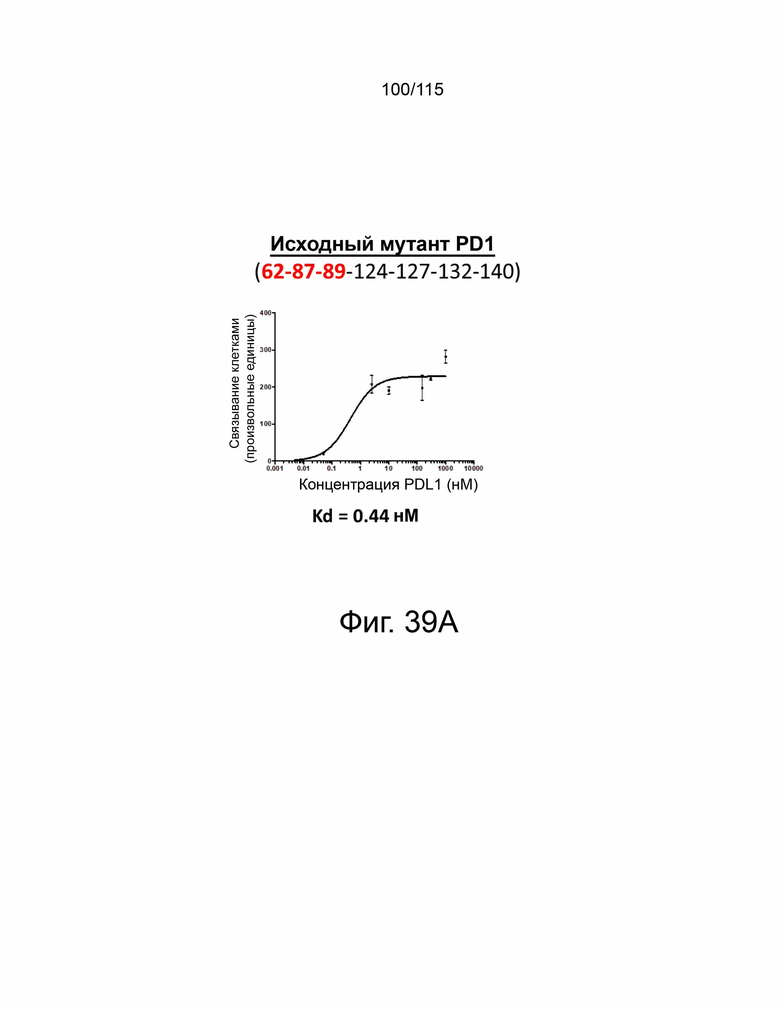

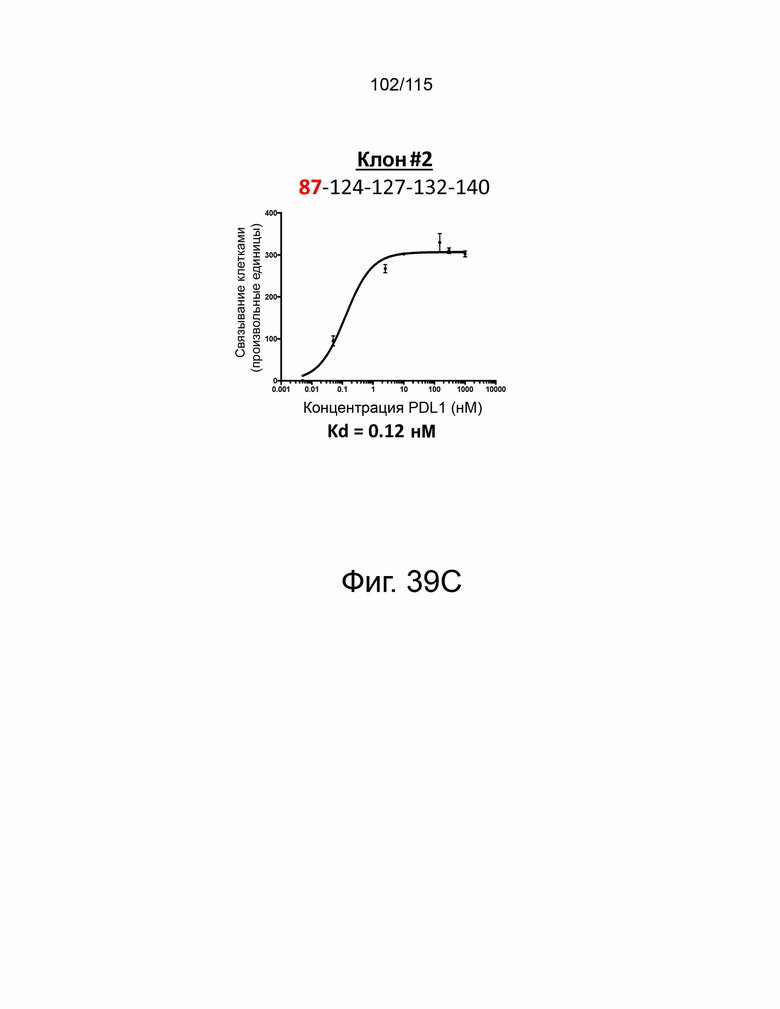
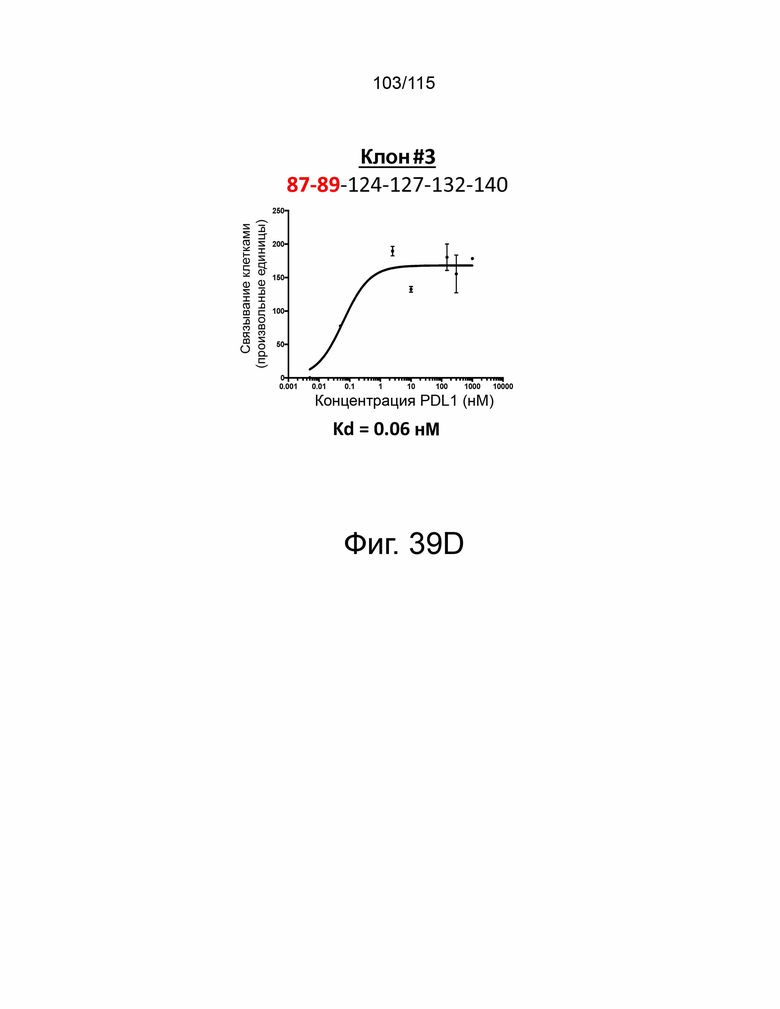
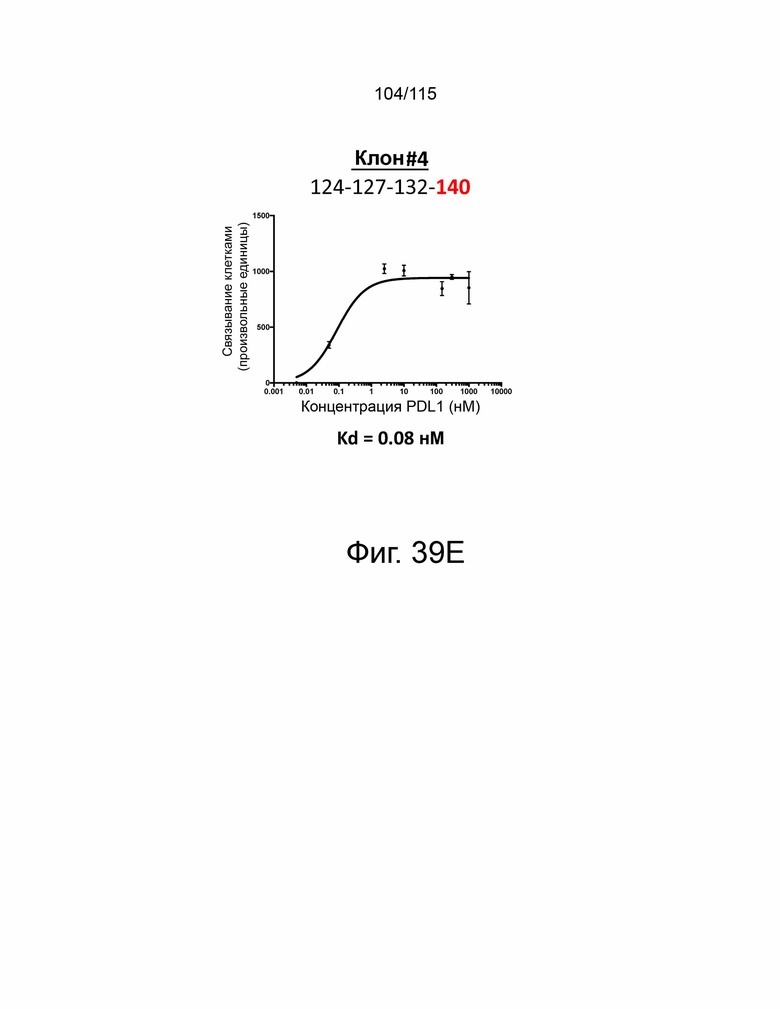
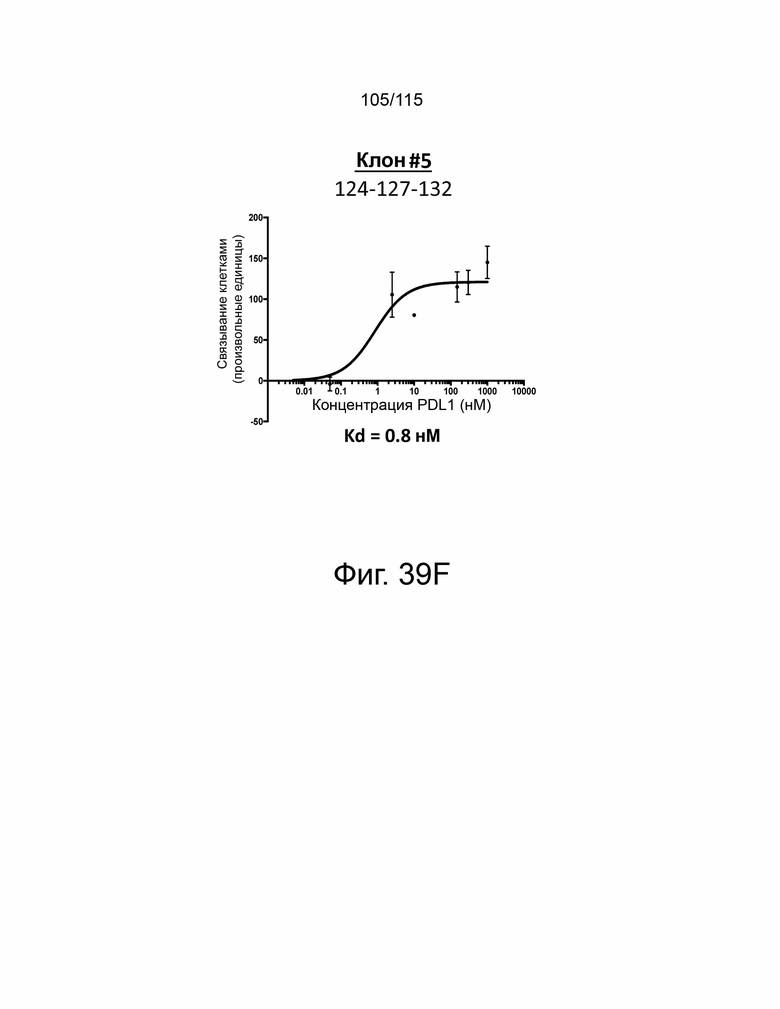


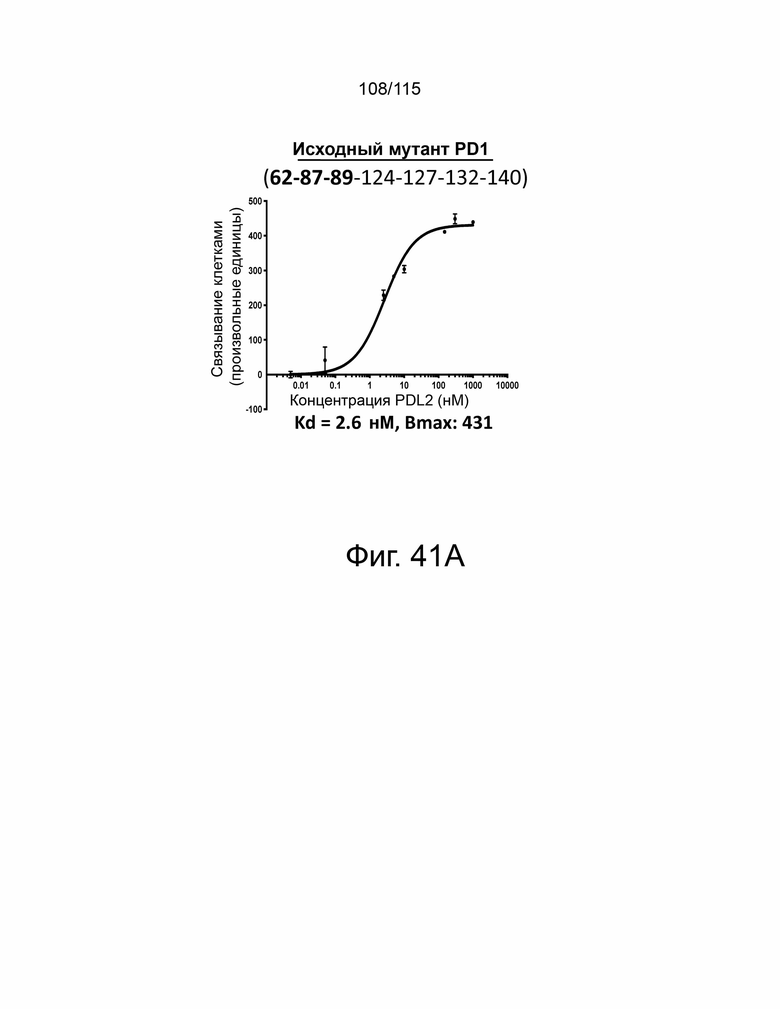
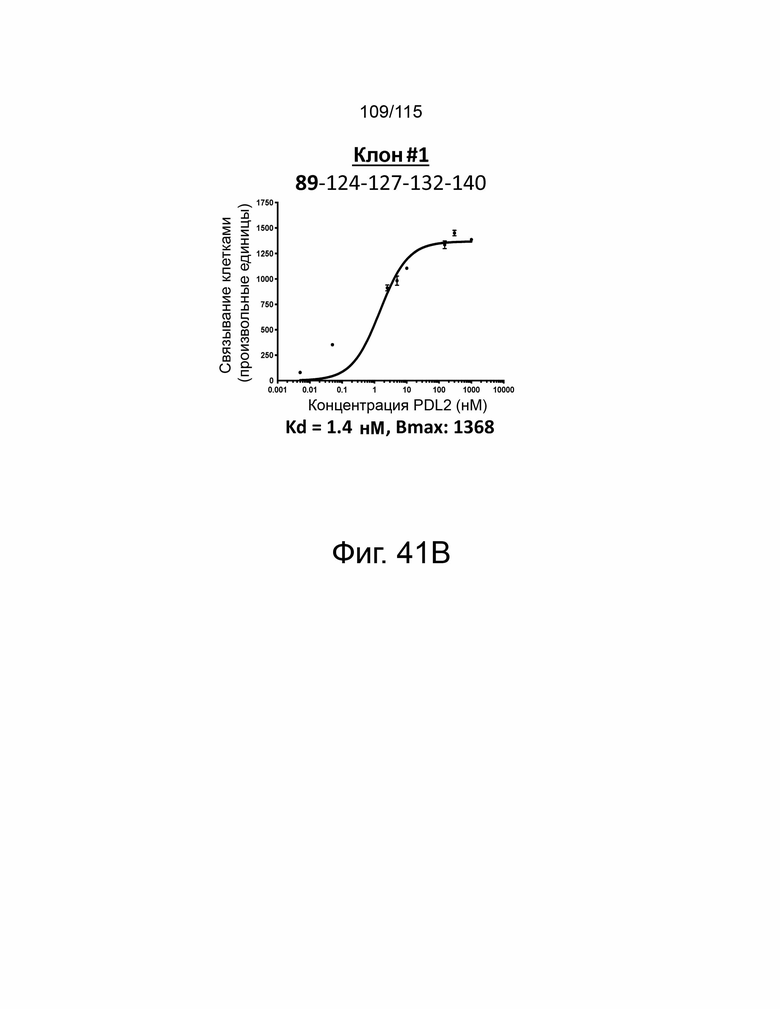

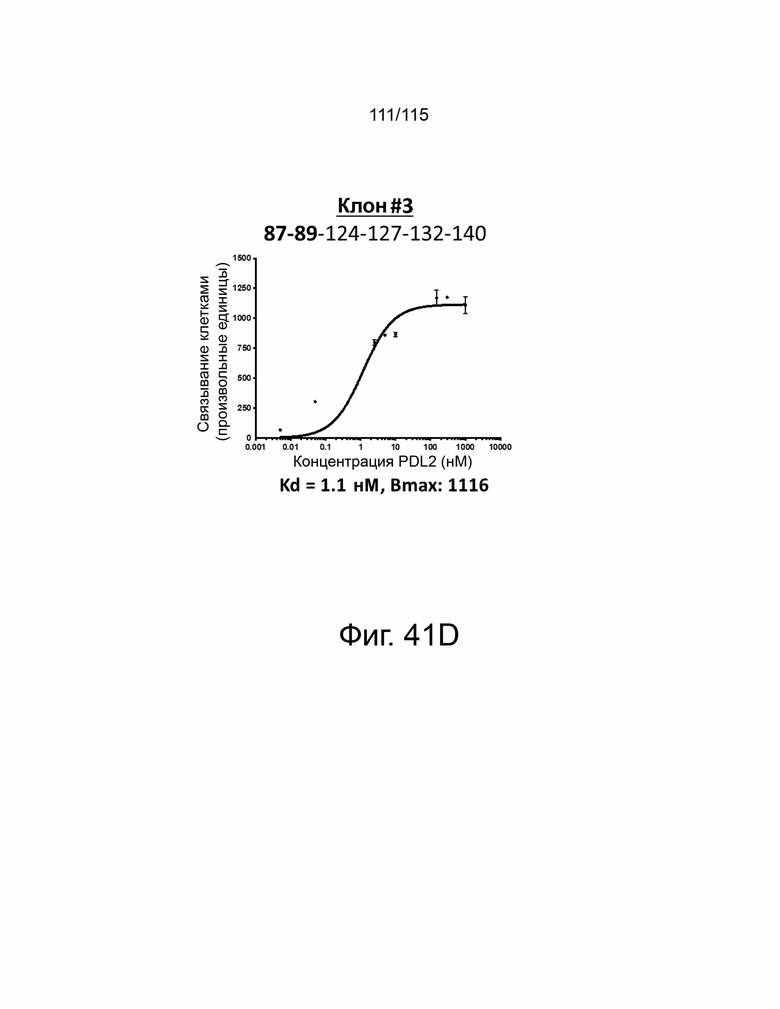
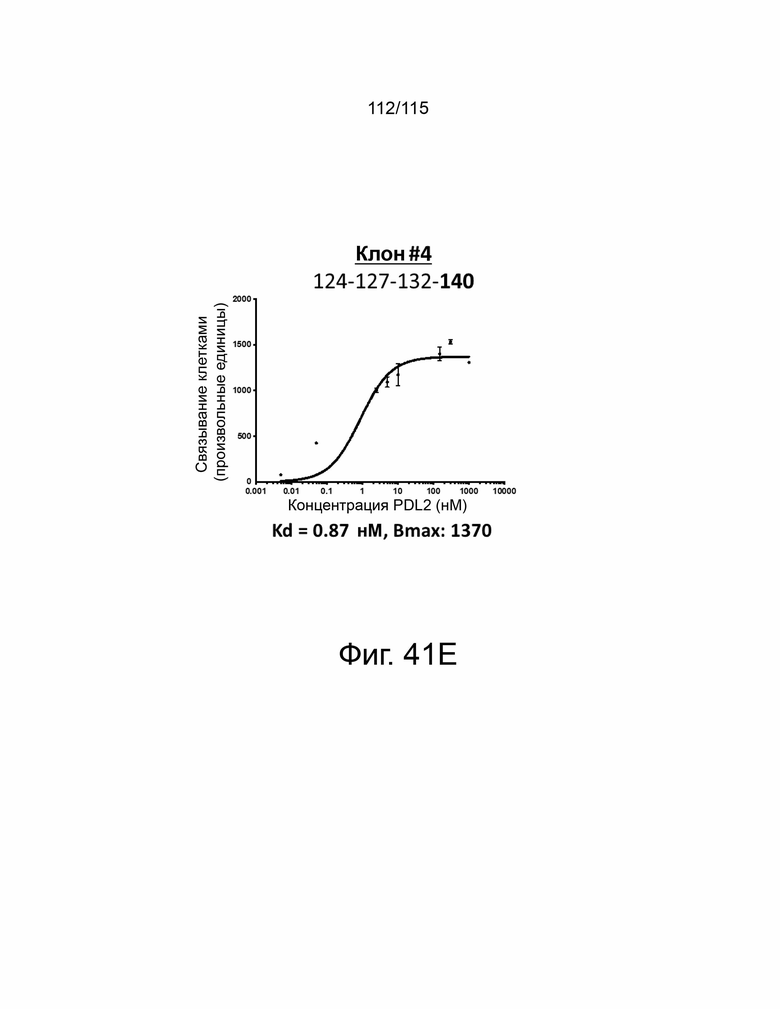
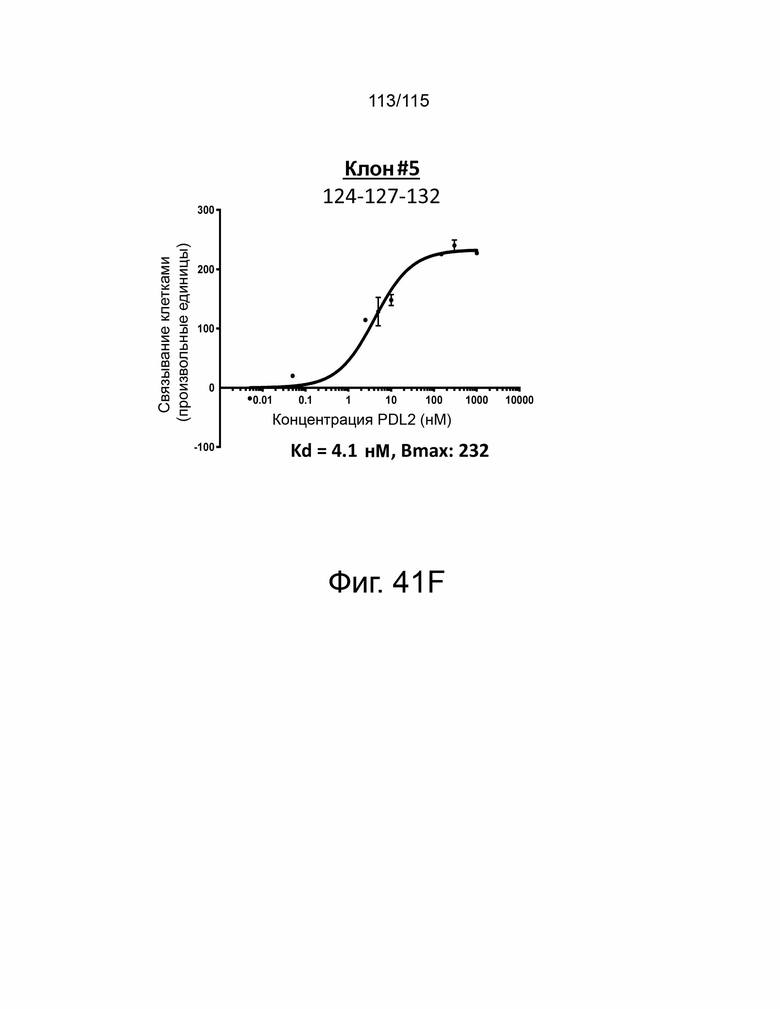


Изобретение относится к области биотехнологии, конкретно к гибридным белкам на основе белка-1 запрограммированной гибели клеток (PD-1), и может быть использовано в медицине для лечения, уменьшения или предотвращения метастазирования или инвазии опухоли у объекта с раком и для лечения объекта с инфекцией. Предложен гибридный белок варианта sPD-1–Fc, содержащий домен варианта растворимого PD-1 (sPD-1), включающий аминокислотную замену по сравнению с SEQ ID NO: 1, где указанная аминокислотная замена находится в положении, выбранном из группы, состоящей из 120, 112, 107, 104, 67, 69, 96 и 42; и где указанный домен варианта sPD-1 включает набор аминокислотных G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1; необязательный линкер и домен Fc. Изобретение обеспечивает получение гибридных белков варианта sPD-1–Fc, которые связываются с и антагонизируют лиганды PD-1. 7 н. и 31 з.п. ф-лы, 42 ил., 10 табл., 11 пр.
1. Гибридный белок варианта sPD-1–Fc, который связывается с и антагонизирует лиганды PD-1, содержащий:
a) домен варианта растворимого PD-1 (sPD-1), включающий аминокислотную замену по сравнению с SEQ ID NO: 1, где указанная аминокислотная замена находится в положении, выбранном из группы, состоящей из 120, 112, 107, 104, 67, 69, 96 и 42; и где указанный домен варианта sPD-1 включает набор аминокислотных G104S/S107V/A112I/A120V по сравнению с SEQ ID NO: 1;
b) необязательный линкер; и
c) домен Fc.
2. Гибридный белок Fc по п. 1, отличающийся тем, что указанный гибридный белок Fc включает, от N-конца к С-концу:
a) указанный домен варианта sPD-1;
b) указанный необязательный линкер; и
c) указанный домен Fc.
3. Гибридный белок Fc по п. 1, отличающийся тем, что указанный гибридный белок Fc включает, от N-конца к С-концу:
a) указанный домен Fc;
b) указанный необязательный линкер; и
c) указанный домен варианта sPD-1.
4. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 демонстрирует по меньшей мере 95% идентичности с SEQ ID NO: 1.
5. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 имеет аминокислотные замены в пяти из указанных положений, шести из указанных положений, семи из указанных положений или восьми из указанных положений.
6. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 дополнительно включает одну или несколько аминокислотных замен, выбранных из группы, состоящей из: S67G, P69L, N96S и S42G.
7. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 включает набор аминокислотных замен, выбранных из группы, состоящей из
S42G/S67G/P69L/G104S/S107V/A112I/A120V,
S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V,
P69L/G104S/S107V/A112I/A120V,
S67G/G104S/S107V/A112I/A120V,
S67G/P69L/G104S/S107V/A112I/A120V, и
G104S/S107V/A112I/A120V.
8. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 включает набор аминокислотных замен S42G/S67G/P69L/G104S/S107V/A112I/A120V.
9. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 включает набор аминокислотных замен S42G/S67G/P69L/N96S/G104S/S107V/A112I/A120V.
10. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 включает набор аминокислотных замен P69L/G104S/S107V/A112I/A120V.
11. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 включает набор аминокислотных замен S67G/G104S/S107V/A112I/A120V.
12. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 включает набор аминокислотных замен S67G/P69L/G104S/S107V/A112I/A120V.
13. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 включает набор аминокислотных замен G104S/S107V/A112I/A120V.
14. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 имеет SEQ ID NO: 2.
15. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 имеет SEQ ID NO: 3.
16. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 имеет SEQ ID NO: 110.
17. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 имеет SEQ ID NO: 130.
18. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 имеет SEQ ID NO: 131.
19. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен варианта sPD-1 имеет SEQ ID NO: 138.
20. Гибридный белок Fc по п. 1, отличающийся тем, что указанный домен Fc представляет собой домен Fc из IgG человека или домен варианта Fc из IgG человека.
21. Гибридный белок Fc по п. 20, отличающийся тем, что указанный домен Fc из IgG человека включает шарнир-CH2-CH3 из IgG4 человека.
22. Гибридный белок Fc по п. 20, отличающийся тем, что указанный домен Fc представляет собой домен варианта Fc из IgG человека.
23. Гибридный белок Fc по п. 22, отличающийся тем, что указанный домен варианта Fc из IgG человека включает шарнир-CH2-CH3 из IgG4 человека с аминокислотной заменой S228P.
24. Гибридный белок Fc по любому из предшествующих пунктов, отличающийся тем, что указанный линкер выбран из группы, состоящей из (GS)n, SEQ ID NO: 146, SEQ ID NO: 147 и SEQ ID NO: 148, где n выбран из группы, состоящей из 2, 3, 4 и 5.
25. Гибридный белок Fc по п. 24, отличающийся тем, что указанный линкер включает SEQ ID NO: 147.
26. Гибридный белок Fc по п. 1, отличающийся тем, что указанный гибридный белок Fc включает SEQ ID NO: 5.
27. Гибридный белок Fc по п. 1, отличающийся тем, что указанный гибридный белок Fc включает SEQ ID NO: 6.
28. Нуклеиновая кислота, кодирующая указанный гибридный белок Fc по п. 1, содержащая нуклеиновую кислоту, кодирующую гибридный белок варианта sPD-1–Fc по п. 1.
29. Экспрессирующий вектор, включающий указанную нуклеиновую кислоту по п. 28.
30. Клетка-хозяин для экспрессии гибридного белка варианта sPD-1–Fc по п. 1, содержащая указанную нуклеиновую кислоту по п. 28.
31. Способ получения гибридного белка варианта sPD-1–Fc, включающий: a) культивирование указанной клетки-хозяина по п. 30 в условиях, при которых указанный гибридный белок Fc экспрессируется; и b) выделение указанного гибридного белка Fc.
32. Способ лечения, уменьшения или предотвращения метастазирования или инвазии опухоли у объекта с раком, включающий введение объекту терапевтически эффективной дозы одного или нескольких указанных гибридных белков Fc по п. 1.
33. Способ по п. 32, отличающийся тем, что рак выбран из группы, состоящей из меланомы, глиомы, лимфомы, миеломы, рака головы и шеи, рака пищевода, рака почки, рака легких, рака молочной железы, рака печени, колоректального рака, рака желчного пузыря, рака желудка, рака поджелудочной железы, рака предстательной железы, рака шейки матки, рака матки, рака яичников, рака яичек и любой другой солидной злокачественной опухоли.
34. Способ лечения объекта с инфекцией, включающий введение объекту терапевтически эффективной дозы одного или нескольких указанных гибридных белков Fc по п. 1.
35. Способ по п. 34, отличающийся тем, что инфекция выбрана из группы, состоящей из грибковой инфекции, бактериальной инфекции и вирусной инфекции.
36. Способ по п. 35, отличающийся тем, что вирусная инфекция выбрана из группы, состоящей из инфекции вируса гепатита В, инфекции вируса гепатита С, инфекции вируса папилломы человека, инфекции вируса иммунодефицита человека (HIV), инфекции Т-лимфотрофного вируса человека (HTLV), вирусной инфекции Эпштейна-Барра, инфекции вируса герпеса, инфекции цитомегаловируса и любой другой хронической вирусной инфекции.
37. Способ по п. 32, отличающийся тем, что эффективная доза одного или нескольких гибридных белков Fc ингибирует, снижает или модулирует передачу сигнала, опосредованную PD-1 дикого типа у объекта.
38. Способ по п. 32, отличающийся тем, что эффективная доза одного или нескольких гибридных белков Fc увеличивает ответ Т-клеток у объекта.
| US 2012121634 A1, 17.05.2012 | |||
| WO 2016023001 A1, 11.02.2016 | |||
| WO 2014124217 A1, 14.08.2014 | |||
| WO 2017123548 A1, 20.07.2017 | |||
| WO 2016164428 A1, 13.10.2016 | |||
| DU J | |||
| ET AL., The design of high affinity human PD-1 mutants by using molecular dynamics simulations (MD), CELL COMMUNICATION AND SIGNALING, 2018, v | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ терапии метастатического рака с использованием вируса Сендай | 2017 |
|
RU2662916C1 |
Авторы
Даты
2022-12-15—Публикация
2019-09-12—Подача