ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композиции для профилактики, улучшения или лечения заболеваний или симптомов, связанных с хрящами, композиция включает гиалуронан и протеогликан связанный белок 1 (HAPLN1) в качестве активного ингредиента. Специфически, настоящее изобретение относится к композиции для регенерации хряща, или композиции для профилактики, улучшения или лечения остеоартрита, композиции включают HAPLN1 в качестве активного ингредиента. Настоящее изобретение также относится к композиции для пролиферации ростовой пластинки хряща или обеспечения роста кости в длину, или профилактики, улучшения или профилактики низкорослости.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Остеоартрит представляет собой дегенеративное заболевание суставов, которое вызывает боль в суставах, отек суставов, скованность, способствует уменьшению диапазона движений и вызывает деструкцию суставного хряща и основных костей. Известно, что остеоартрит развивается по меньшей мере у одного из десяти взрослых (Lawrence, Felson et al. 2008) и значительно ухудшает качество жизни пациента из-за боли, ассоциированной с движениями в суставах. Ранее остеоартрит расценивали, как общий результат старения. Однако, в настоящее время известно, что остеоартрит вызывает комплексное взаимодействие между множеством факторов, включая целостность суставов, генетическую предрасположенность, местное воспаление, механическую силу и клеточные и биохимические процессы. Его патогенетические характеристики включают гипертрофию нижнего хряща, формирование остеопороза (протрузия кости) и дегенерацию внеклеточного матрикса (ECM) суставного хряща, который полностью заполняет сустав.
Толщина хряща коленного сустава составляет около 2 мм. Когда при травме или заболевании повреждается площадь от около 1 мм2 до около 4 мм2, возможна регенерация посредством естественного заживления. Когда повреждена площадь около 20 мм2, саморегенерация затруднительна, и обычно возникает сильная боль. Кроме того, когда суставной хрящ полностью теряется из-за различных причин, таких как опухоли, некроз и др., лечение, такое как внедрение искусственного сустава в соответствующее место, проводят для восстановления функции сустава. Однако, искусственные суставы только лишь искусственно созданы сходно функциям суставов. Так как искусственные суставы являются инородными предметами в организме, трудно поддерживать биосовместимость. Кроме того, искусственные суставы трудно поддерживать в течение более чем 20 лет из-за сложного функционирования, требуемого в четкой среде организма. Ухудшение качества резины или металла, используемых в качестве материалов, образование продуктов износа, или подобного может вызывать нарушение функции или вызывать боль. Кроме того, искусственные суставы могут не быть достаточными по прочности. Следовательно, в качестве замены лечения искусственным суставом существует потребность в методике регенерации суставного хряща, как такового.
Кроме того, в недавних исследованиях сообщают о регенерации суставного хряща посредством перфорации поверхности сустава и помещения коллагена, содержащего костный морфогенетический белок (BMP), в желаемое место. Однако, регенерировавший суставной хрящ не непрерывно соединяется с соседним суставным хрящом и, следовательно, может не обеспечивать совершенную регенерацию. Более того, применения коллагена в организме вероятно нужно избегать из-за проблем, таких как губчатая энцефалопатия крупного рогатого скота (BSE), так называемое коровье бешенство и др. Соответственно существует необходимость в разработке новой композиции для регенерации хряща с использованием только материалов, для которых одобрено биомедицинское применение.
Между тем рост в высоту происходит, когда длина костей увеличивается, и эндохондральное окостенение в хряще участвует в росте костей в длину. Эндохондральное окостенение в хряще представляет собой процесс, когда образуется хрящ и в его центре появляется ядро окостенения с формированием костей, возникает в эпифизиальной пластинке и ассоциировано с ростом кости в длину. В настоящее время в качестве лекарственного средства, которое может обеспечивать увеличение роста, главным образом используется инъекция гормона роста.
Однако, эффект незначителен даже если гомон роста непосредственно обеспечивает пролиферацию хондроцитов ростовой площадки. Инсулиноподобный фактор роста 1 (ИФР-1(IGF-1)), секретируемый, когда гормон роста действует на печень, является основным фактором пролиферации хондроцитов. Соответственно, когда концентрация ИФР-1 в крови увеличивается при введении гормона роста, он определяет его нормальную работу, и когда гормон роста или ИФР-1 действует на хондроциты, секретируются факторы роста и ростовая пластинка пролиферирует. Более того, инъекция гормона роста не подходит для ребенка, чья секреция гормона нормальна, и при использовании вызывает побочные эффекты, такие как гипотиреоз или гиперпигментация. Кроме того, инъекции гормона роста являются дорогостоящими. Следовательно, существует необходимость в разработке вещества, которое способно индуцировать увеличение роста посредством обеспечения пролиферации хряща ростовой пластинки.
Суставной хрящ и ростовая пластинка хряща соответствуют гиалиновому хрящу среди различных форм хрящей. Внеклеточный матрикс (ECM) такой хрящевой ткани может иметь структуру агрегата, включая в качестве основных компонентов коллаген II типа, аггрекан, гиалуронан, гиалуронан и протеогликан связанный белок 1 (HAPLN1), и подобные. В нем множество аггреканов связаны с цепью гиалуронана, и известно, что HAPLN1 играет роль в физической и химической стабилизации агрегатов посредством более сильного связывания аггреканов с цепью гиалуронана. Однако, неизвестно, обладает ли HAPLN1 эффектом лечения, профилактики или улучшения заболеваний или симптомов, связанных с хрящами.
Между тем, в качестве исследования, связанного с заболеваниями или симптомами, связанными с хрящами, патентная публикация США No. 2016/0220699 описывает способ создания хондроцитов или клеток хрящевого типа, включающий стадию доставки вектора экспрессии, кодирующего один или более терапевтических полинуклеотидов, в сустав пациента. Более того, в публикации Международной патентной заявки No. 2017/123951 описан способ создания хондроцитов или сходных с ними клеток, включающий стадию получения ингредиента, полученного из пульпозного ядра, пациенту с дегенеративным заболеванием диска. Однако, вышеуказанные документы специфически не описывают профилактику, улучшение или лечение заболеваний или симптомов, связанных с хрящами, с использованием HAPLN1.
[Документы предшествующей области техники]
[Патентные документы]
(Патентный документ 0001) Патентная публикация США No. 2016/0220699 (опубликованная 4 августа 2016)
(Патентный документ 0002) Международная патентная публикация No. 2017/123951 (опубликованная 20 июля 2017)
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Настоящее изобретение обеспечивает композицию для профилактики, улучшения или лечения заболеваний или симптомов, связанных с хрящами, с использованием HAPLN1.
Специфически, настоящее описание обеспечивает композицию для регенерации хряща, или композицию для профилактики, улучшения или лечения остеоартрита. Настоящее изобретение также относится к композиции для пролиферации ростовой пластинки хряща или обеспечения роста кости в длину, или композиции для профилактики, улучшения или лечения низкорослости.
РЕШЕНИЕ ПРОБЛЕМЫ
Для достижения вышеуказанных целей настоящее изобретение обеспечивает фармацевтическую композицию для регенерации хряща, пищевую композицию для регенерации хряща, или композицию для кормления животных для регенерации хряща, каждая композиция включает гиалуронан и протеогликан связанный белок 1 (HAPLN1) в качестве активного ингредиента.
Настоящее изобретение обеспечивает фармацевтическую композицию и пищевую композицию или композицию для кормления животных для профилактики, улучшения или лечения остеоартрита, каждая включающая HAPLN1 в качестве активного ингредиента.
Настоящее изобретение обеспечивает фармацевтическую композицию для пролиферации ростовой площадки хряща или обеспечения роста кости в длину, фармацевтическая композиция включает HAPLN1 в качестве активного ингредиента. Настоящее изобретение также обеспечивает пищевую композицию для пролиферации ростовой площадки хряща и обеспечения роста кости в длину, пищевая композиция включает HAPLN1 в качестве активного ингредиента. Настоящее изобретение также обеспечивает композицию для кормления животных для пролиферации ростовой площадки хряща и обеспечения роста кости в длину, пищевая композиция включает HAPLN1 в качестве активного ингредиента.
Настоящее изобретение обеспечивает фармацевтическую композицию для лечения или профилактики нарушения роста кости в длину, фармацевтическая композиция включает HAPLN1 в качестве активного ингредиента. Нарушениями роста кости в длину по настоящему изобретению могут быть низкорослость, карликовость, нанизм или преждевременное половое созревание.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением, HAPLN1 белок может обладать способностью стимулировать образование хряща и способностью регенерации суставного хряща, и может увеличивать уровень экспрессии белка рецептора I TGF-β хондроцитов для увеличения популяции клеток, имеющих способность образования хряща и индукции образования тканей хряща. Соответственно, белок HAPLN1 по настоящему изобретению, который является новым материалом, регулирующим передачу сигнала TGF-β, может предпочтительно применяться в качестве фармацевтической композиции для регенерации хряща, пищевой композиции для регенерации хряща или композиции для кормления животных для регенерации хряща.
Кроме того, настоящее изобретение обеспечивает композицию для профилактики, улучшения или лечения остеоартрита посредством использования HAPLN1 белка.
Кроме того, так как HAPLN1 белок вызывает пролиферацию ростовой пластинки хряща и обеспечивает рост кости в длину, терапевтическое средство для увеличения роста и добавка могут быть добавлены с меньшим количеством побочных эффектов и лучшими эффектами, чем обычные гормоны.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
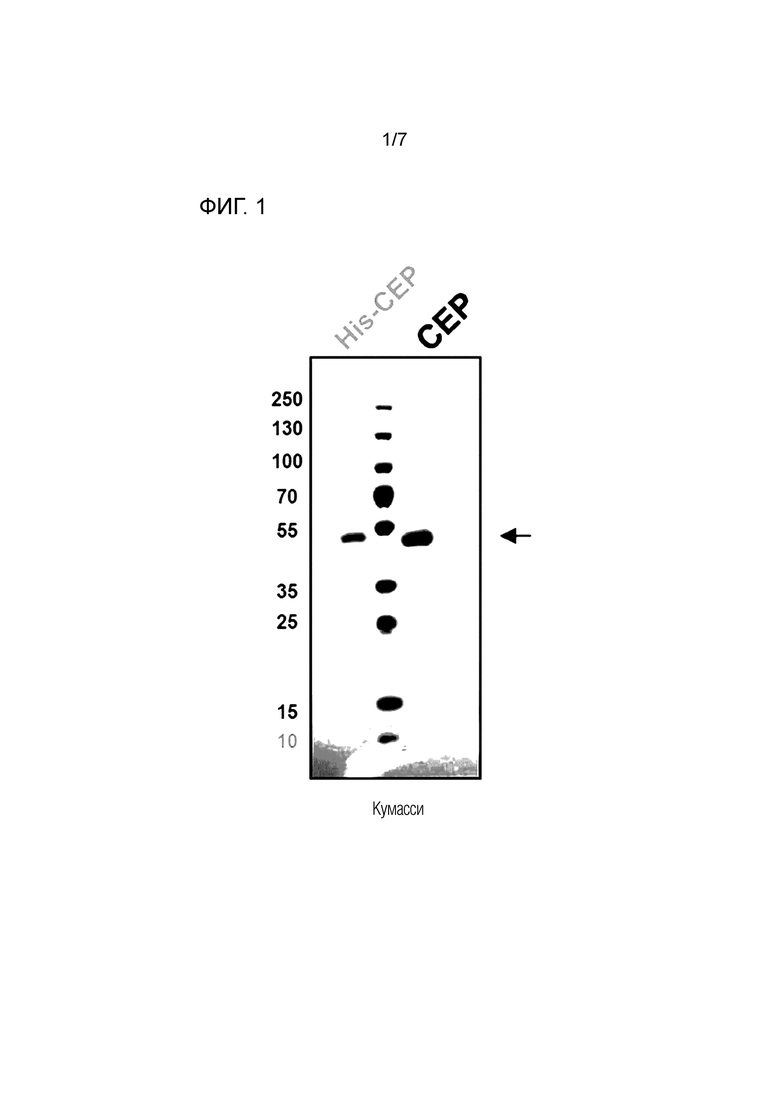
На фиг. 1 показаны результаты SDS-PAGE анализа рекомбинантного человеческого HAPLN1 белка, полученного с использованием клеток ExpiTM 293 в качестве системы экспрессии белка.
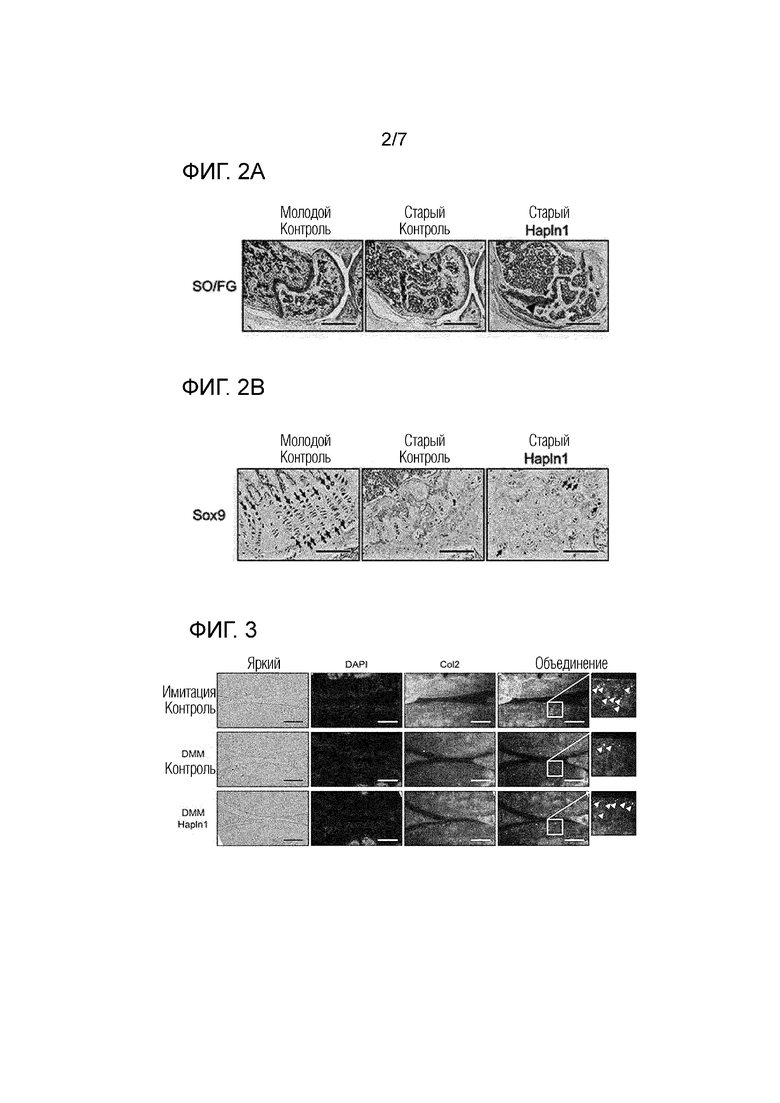
На фиг. 2 показана способность формирования хряща посредством повторного интраперитонеального введения HAPLN1 белка в дегенерировавшую ростовую площадку старой мыши, на которой на фиг. 2A показывает протеогликан в тканях, что визуализируется посредством окрашивания сафранин O/Fast Green FCF, и на фиг. 2B показано присутствие хондроцитов, имеющих способность формирования хряща, что визуализируется посредством иммуногистохимии.
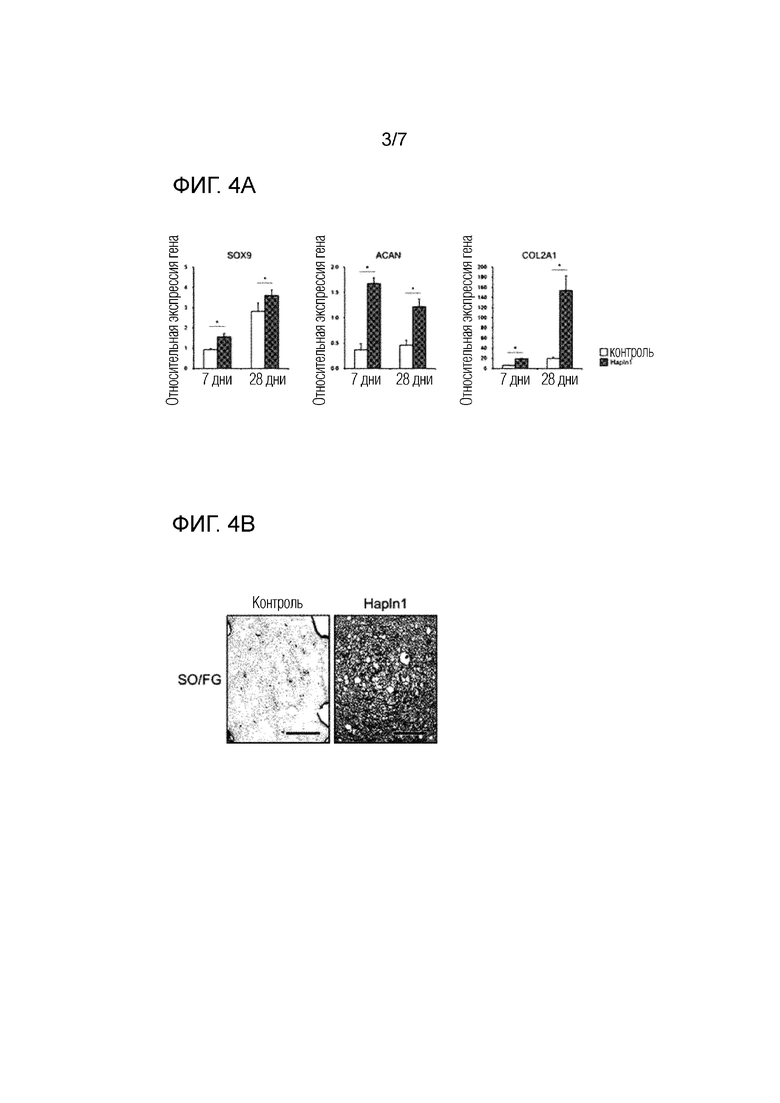
На фиг. 3 показана способность регенерации хряща вводимого внутрисуставно белка HAPLN1 в поврежденные ткани коленного сустава мышей, что визуализируется посредством иммунофлуоресценции.
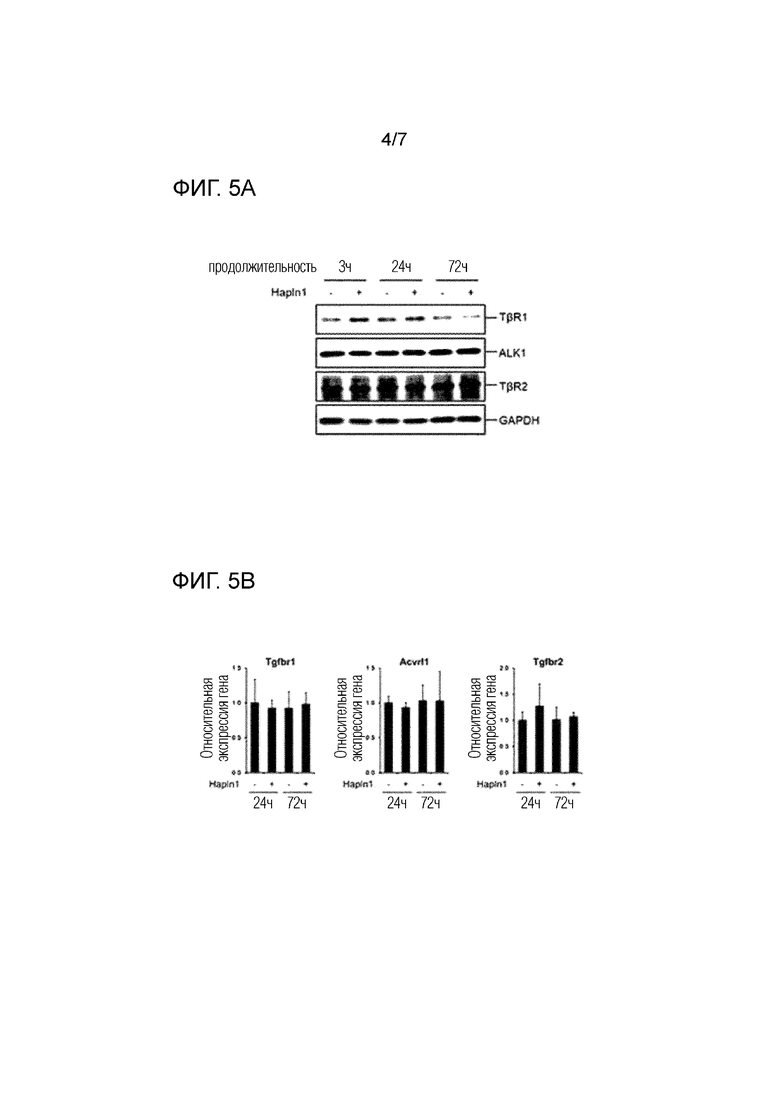
На фиг. 4 показана способность стимуляции образования хряща HAPLN1 белка для человеческих суставных хондроцитов, в которой на фиг. 4A показаны уровни экспрессии гена SOX9, который является геном, специфическим для хряща, аггрекана и коллагена II типа, которые являются компонентами матрикса хряща, что определено посредством полимеразной цепной реакции (ПЦР), и на фиг. 4B показаны протеогликаны, накопленные во внеклеточном матриксе, что визуализируется окрашиванием сафранин O/Fast Green FCF.
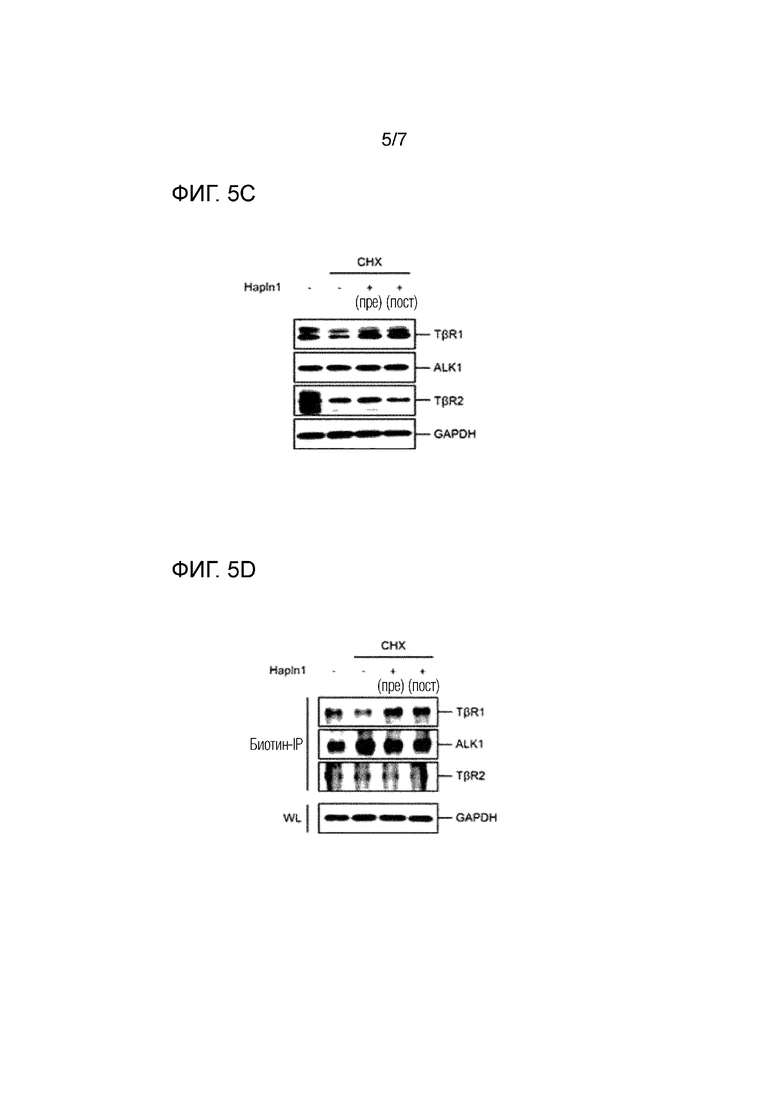
На фиг. 5 показана регуляция передачи сигнала TGF-β HAPLN1 белка для мышиных суставных хондроцитов, в котором на фиг. 5A показана способность регуляции передачи сигнала TGF-β HAPLN1 белком, что определяется вестерн блоттингом, на фиг. 5B и 5C показана стабилизация передачи сигнала рецептора I TGF-β HAPLN1 белка, что изучали ПЦР и вестерн блоттингом и на фиг. 5D показано представление улучшенной клеточной поверхности рецептора I TGF-β HAPLN1 белком, что определяется вестерн блоттингом.
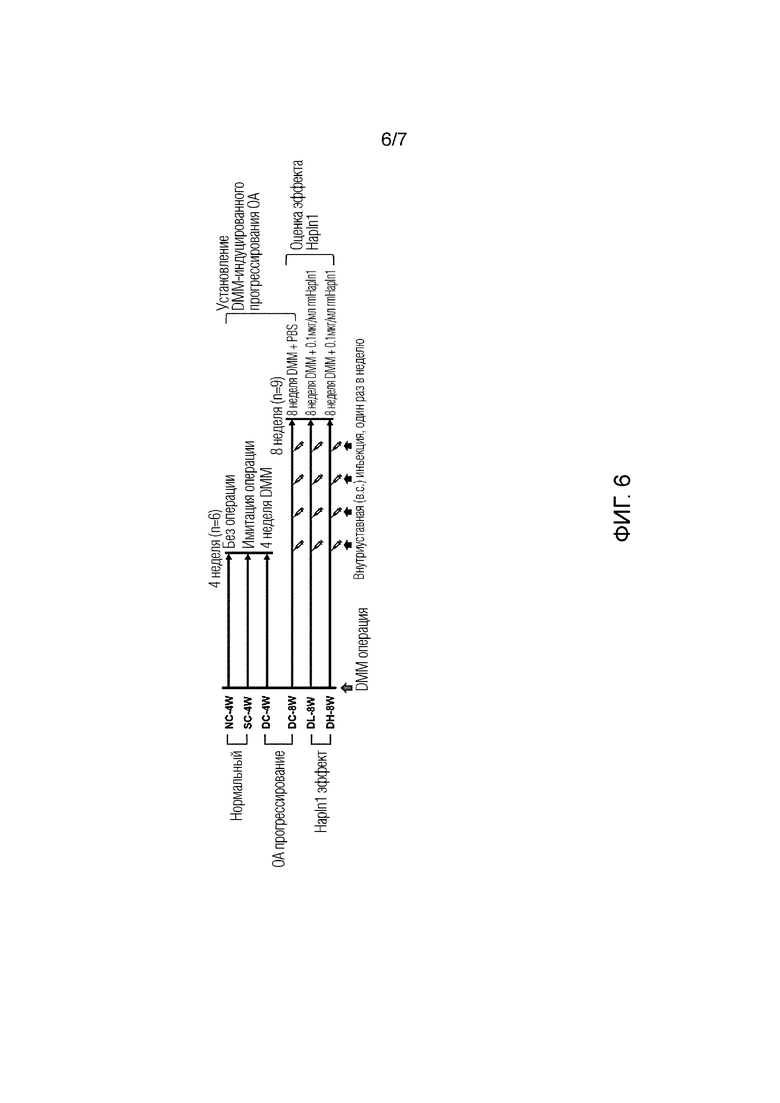
На фиг. 6 показана схематическая диаграмма, суммирующая шесть экспериментальных групп мышей, используемых для анализа улучшения остеоартрита белком HAPLN1.
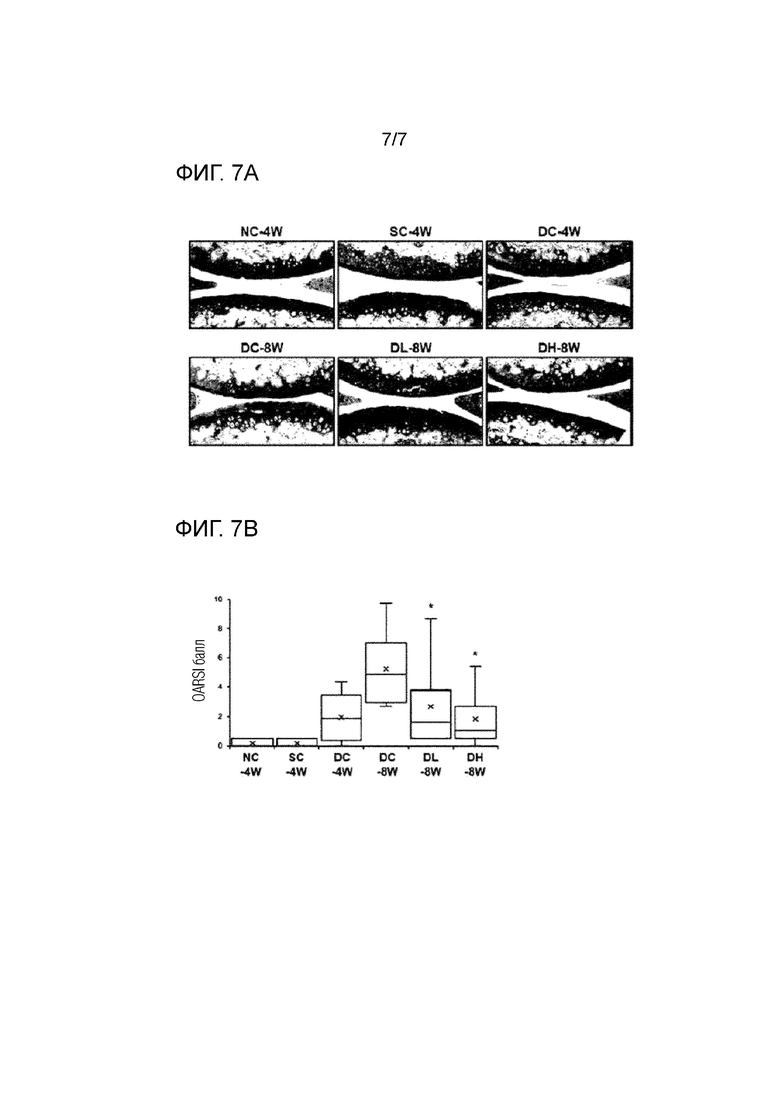
На фиг. 7 показано улучшение морфологии ткани суставного хряща белком HAPLN1 у мыши с индуцированным остеоартритом, в которой на фиг. 7A показана морфология ткани суставного хряща в каждой экспериментальной группе мышей, что подтверждено окрашиванием сафранин O/Fast Green FCF, и на фиг. 7B показана количественная оценка улучшения остеоартрита белком HAPLN1, полученным гистопатологической оценкой остеоартрита (OARSI балл).
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения подтвердили способность стимуляции образования хряща и способность регенерации хряща протеогликан связанным белком 1 (HAPLN1) у старых мышей и мышей с поврежденным суставным хрящом. Кроме того, способность обеспечения образования хряща и способность стимуляции регенерации хряща белком HAPLN1 в хондроцитах были подтверждены, как превосходные. Кроме того, было идентифицировано, что HAPLN1 белок селективно повышает уровень белка рецептора I TGF-β хондроцита, таким образом завершив настоящее изобретение.
Настоящее изобретение обеспечивает фармацевтическую композицию для регенерации хряща, включающую белок HAPLN1 в качестве активного ингредиента. Предпочтительно, HAPLN1 белок может обеспечивать образование хряща и может защищать суставной хрящ. Более предпочтительно HAPLN1 белок может селективно, стабильно увеличивать уровень белка рецептора I TGF-β для увеличения популяции клеток, имеющих способность стимуляции образования хряща и индукции образования хрящевых тканей.
В одном варианте осуществления изобретения настоящее изобретение обеспечивает способ регенерации хряща у пациента, нуждающегося в регенерации хряща, способ включает введение пациенту эффективного количества HAPLN1 белка. Термин "пациент", как используется в настоящем описании, включает людей и нечеловекообразных животных. Нечеловекообразные животные включают всех позвоночных, таких как млекопитающие, и немлекопитающие, такие как нечеловекообразные приматы, овцы, собаки, крупный рогатый скот, лошади и подобные.
В одном варианте осуществления настоящее изобретение обеспечивает применение HAPLN1 белка для регенерации хряща.
Настоящее изобретение обеспечивает пищевую композицию или композицию для кормления животных для регенерации хряща, включающую HAPLN1 белок в качестве активного ингредиента.
Настоящее изобретение обеспечивает фармацевтическую композицию для профилактики, улучшения или лечения остеоартрита, фармацевтическая композиция включает HAPLN1 белок в качестве активного ингредиента.
Термин "остеоартрит", используемый в настоящем описании, представляет собой заболевание, называемое дегенеративный артрит, при котором суставной хрящ, который окружает суставную поверхность кости, изнашивается и, следовательно, кость под хрящом открывается, и синовиальная мембрана вокруг сустава воспаляется, приводя к боли и деформации. Термин интерпретируют в смысле обычно используемого в области техники. При визуализации, кости, называемое как остеофиты, растут по краям костей, вызывая выпячивание узлов и деформацию суставов. В настоящее время не существует излечения остеоартрита, и в качестве фармакотерапии, обезболивающие используют для облегчения боли, или нестероидные противовоспалительные лекарственные средства (НПВС) используют для облегчения воспаления.
Когда используют HAPLN1 белок по настоящему изобретению, ткани суставного хряща, в котором развивается остеоартрит, улучшаются, принимая морфологию, сходную с нормальным хрящом. Более того, применение HAPLN1 белка уменьшает степень повреждения суставной поверхности и уменьшает количество фиброза и остеофитов, таким образом предотвращая, ингибируя или уменьшая прогрессирование остеоартрита.
В одном варианте осуществления настоящее изобретение обеспечивает способ профилактики, улучшения или лечения остеоартрита у пациента, нуждающегося в профилактике, улучшении или лечении остеоартрита, способ включает введение пациенту эффективного количества HAPLN1 белка.
В одном варианте осуществления настоящее изобретение обеспечивает применение HAPLN1 белка для профилактики, улучшения или лечения остеоартрита.
Настоящее изобретение обеспечивает пищевую композицию или композицию для кормления животных для профилактики или улучшения остеоартрита, включающую HAPLN1 белок в качестве активного ингредиента.
Настоящее изобретение обеспечивает фармацевтическую композицию для пролиферации ростовой пластинки хряща или обеспечения роста кости в длину, фармацевтическая композиция включает HAPLN1 белок в качестве активного ингредиента.
HAPLN1 белок по настоящему изобретению обеспечивает образование хряща в ростовой пластинке с увеличением активности ростовой пластинки и усилением ростовой пластинки. Следовательно, белок HAPLN1 также может быть использован для лечения или профилактики расстройств увеличения роста кости в длину. В таком случае нарушения роста кости в длину включают, без ограничения, низкорослость, карликовость, нанизм или преждевременное половое созревание.
В одном варианте осуществления настоящее изобретение обеспечивает способ пролиферации ростовой пластинки хряща или обеспечения роста кости в длину у пациента, нуждающегося в пролиферации ростовой пластинки хряща и обеспечении роста кости в длину, способ включает введение пациенту эффективного количества HAPLN1 белка. Настоящее изобретение также обеспечивает способ лечения или профилактики расстройств роста кости в длину у пациента, нуждающегося в лечении или профилактике расстройств роста кости в длину, включающий введение пациенту эффективного количества HAPLN1 белка.
В одном варианте осуществления настоящее изобретение обеспечивает применение HAPLN1 белка для стимуляции пролиферации ростовой пластинки хряща или обеспечения роста кости в длину. Настоящее изобретение также обеспечивает применение HAPLN1 белка для лечения или профилактики нарушений роста кости в длину.
Настоящее изобретение обеспечивает пищевую композицию или композицию для кормления животных для пролиферации ростовой пластинки хряща и обеспечения роста кости в длину, пищевая композиция или композиция для кормления животных включает HAPLN1 белок в качестве активного ингредиента.
Настоящее изобретение обеспечивает способ регенерации хрящевых тканей посредством обработки хондроцитов HAPLN1. Специфически обеспечивают способ регенерации хрящевых тканей in vitro с использованием HAPLN1, способ включает: выделение хондроцитов у пациента; и обработку хондроцитов HAPLN1.
Когда композиция по настоящему изобретению представляет собой фармацевтическую композицию, композиция может включать для введения фармацевтически приемлемый носитель, вспомогательное вещество, или разбавитель, в добавление к вышеуказанному активному ингредиенту.
Когда композиция по настоящему изобретению представляет собой пищевую композицию, композиция может включать множество питательных веществ, витаминов, минералов (электролитов), ароматизаторы, такие как синтетические и натуральные ароматизаторы, и др., краситель и наполнитель (сыр, шоколад и др.), пектиновую кислоту или ее соли, альгиновую кислоту или ее соли, органическую кислоту, защитный коллоидный загуститель, регулятор pH, стабилизатор, консервант, глицерин, спирты, углеродистое средство, используемое в газированных напитках и др.
Далее настоящее описание будет описано более подробно со ссылками на примерные варианты осуществления изобретения. Такие примерные варианты осуществления изобретения предназначены только для иллюстрации настоящего изобретения более подробно, и очевидно специалисту в области техники, что настоящее изобретение не ограничено такими примерными вариантами осуществления изобретения в соответствии с настоящим описанием.
Пример получения: Получение HAPLN1 белка
Для ускорения очистки белка, гены, кодирующие рекомбинантный человеческий HAPLN1, конъюгированный с 10 гистидинами, синтезировали, вставляли в плазмиду pcDNA3.4-TOPO, и трансфицировали в клетки ExpiTM 293 с использованием системы экспрессии белка. После 3 дней культивирования раствор культуры клеток собирали и для очистки белка пропускали через колонку HisTrap, которая представляет собой хелатирующую колонку, и затем, элюировали по градиенту концентраций от 20 мM до 500 мM соли имидазола с использованием имидазол PBS буфера, содержащего 0,5 M NaCl. После этого для удаления конъюгированного гистидина, проводили обработку TEV протеазой и затем, добавленную TEV протеазу удаляли с использованием DynaBeads. Полученный HAPLN1 загружали на SDS-PAGE для подтверждения очищенного белка (фиг. 1). Затем, подтверждали степень очистки для получения белка, имеющего чистоту 98% или более, и полученный белок использовали в in vitro клеточных экспериментах или in vivo тесте на эффективность.
Пример 1: Анализ способности стимуляции регенерации хряща HAPLN1 белком в дегенерировавшей ткани хряща in vivo
1-1. Стимуляция образования хряща в дегенерированной ростовой пластинке посредством повторного интраперитонеального введения HAPLN1 белка
6-недельных самцов мышей C57BL/6 классифицировали, как молодую группу, и 20-месячных мышей C57BL/6 классифицировали, как пожилую группу. Пожилой группе вводили интраперитонеально HAPLN1 белок, разведенный фосфатным буферным раствором (PBS), в дозе 0,1 мг/кг в сутки в течение 2 недель, тогда как контрольной группе интраперитонеально вводили PBS в эквивалентном количестве.
Мышиные тазобедренные и коленные суставы каждой группы получали и фиксировали нейтральным буферным 10% формалином (NBF) в течение 48 часов с последующей декальцификацией с помощью 10% раствора этилендиаминтетрауксусной кислоты (EDTA) в течение 7 дней. Впоследствии каждый образец погружали в парафин для получения парафинового блока, и получали сечения ткани 5 мкм толщиной в сагитальном направлении. Для гистологической оценки хрящевую ткань каждого слайда сечения ткани визуализировали посредством окрашивания сафранин O/fast green FCF (SO/FG). Окрашенные сечения тканей рассматривали и фотографировали с использованием микроскопа Ni-U (Nikon) и цифровой камеры DS-Ri1 (Nikon), и результаты показаны на фиг. FIG. 2A (масштабный отрезок=1 мм).
Как показано на фиг. 2A, ростовая пластинка пожилого контроля была дегенерировавшая и обнаруживали только следы ткани хряща, при сравнении с таковой молодого контроля, тогда как образование хряща наблюдали в дегенерировавшей ростовой пластинке пожилой группы (пожилые HAPLN1), которой повторно интраперитонеально вводили HAPLN1 белок (стрелка).
1-2. Образование и увеличение хондроцитов, имеющих способность образования хряща, посредством повторного интраперитонеального введения HAPLN1 белка
Для идентификации присутствия клеток, имеющих способность формирования хряща в месте образования хряща, которую индуцировало повторное интраперитонеальное введение HAPLN1 белка в примере 1-1, соответствующую область окрашивали иммуногистохимией (IHC) с использованием SOX9, который является фактором транскрипции, специфическим для хряща. Окрашенные сечения тканей визуализировали и фотографировали с использованием микроскопа Ni-U (Nikon) и цифровой камеры DS-Ri1 (Nikon), и результаты показаны на фиг. 2B (масштабный отрезок=1 мм).
Как показано на фиг. 2B, SOX9-экспрессирующие клетки сохранялись на всем протяжении хрящевой ткани у молодого контроля, тогда как SOX9-экспрессирующие клетки не обнаруживали у пожилого контроля. Однако, было подтверждено, что большое количество SOX9-экспрессирующих клеток обнаруживается в области стимуляции образования хряща пожилой группы (пожилые HAPLN1), которым повторно интраперитонеально вводили HAPLN1 белок (стрелка).
Следовательно, может быть видно, что HAPLN1 белок стимулирует ростовую пластинку и обеспечивает рост кости в длину посредством пролиферации или регенерации ростовой пластинки хряща.
Пример 2: Анализ способности регенерации хряща HAPLN1 белком в поврежденной ткани хряща in vivo
7-недельных самцов мышей C57BL/6 делили на три группы, как указано далее. Нормальную контрольную группу (контрольную группу имитации), которая являлась группой имитации операции методики дестабилизации медиального мениска (DMM), выращивали в существующих условиях в течение 4 недель после процедуры. Группу лечения носителем (DMM контрольная группа) выращивали в существующих условиях в течение 8 недель после DMM процедуры, и внутрисуставно вводили PBS один раз в неделю в течение последних 4 недель. Группу лечения HAPLN1 (DMM HAPLN1 группа) выращивали в существующих условиях в течение 8 недель после DMM процедуры, и внутрисуставно вводили HAPLN1 белок в PBS в концентрации 1 мкг/мл один раз в неделю в течение последних 4 недель.
В конце выращивания каждую коленную ткань, в отношении которой применяли методику и обработку, удаляли и фиксировали NBF в течение 48 часов, и впоследствии декальцинировали с помощью раствора 10% EDTA в течение 7 дней. Впоследствии каждый образец погружали в парафин для получения парафинового блока, и слайды сечений ткани толщиной 5 мкм получали в сагиттальном направлении. Коллаген II типа (Col2) окрашивали зеленой флуоресценцией посредством иммунофлуоресценции (IF), и ядра клеток были окрашены синим с помощью 4',6-диамидино-2-фенилиндола (DAPI). Окрашенные сечения тканей рассматривали и фотографировали с использованием микроскопа Ni-U (Nikon) и цифровой камеры DS-Ri1 (Nikon), и результаты показаны на фиг. 3 (масштабный отрезок=200 мкм).
Как показано на фиг. 3, было подтверждено, что количество коллаген II типа экспрессирующих клеток, обнаруженное в группе нормального контроля (контрольная группа имитации), было существенно снижено в группе введения носителя (DMM контрольная группа), тогда как количество коллаген II типа-экспрессирующих клеток было существенно увеличено в группе лечения HAPLN1 (DMM HAPLN1 группа) (стрелка).
Следовательно, может быть видно, что HAPLN1 белок обладает превосходным эффектом в отношении регенерации хряща.
Пример 3: Анализ способности стимуляции образования хряща HAPLN1 белком in vitro
3-1. Увеличение способности формирования хряща человеческих суставных хондроцитов HAPLN1 белком
Человеческие суставные хондроциты (HAC) культивировали в 1:1 смешанной среде Eagle, модифицированной Dulbecco /F12 (DMEM/F12; Gibco), содержащей 10% фетальной бычьей сыворотки (FBS; Gibco), 1% пенициллина/стрептомицина (Gibco), и 1% не-незаменимых аминокислот (NEAA; Gibco) в условиях 37°C и 5% CO2.
В качестве модели для исследования способности образования хряща HAC использовали трехмерную культуральную систему, в которой клетки погружали в альгинатные шарики. HAC однородно смешивали в 1,25% альгинатном растворе для включения 30000 клеток на шарик. Их культивировали посредством добавления 50 мкг/мл 2-фосфата L-аскорбиновой кислоты, 1% инсулин-трансферрин-селена (ITS; Gibco), и 10 нг/мл TGF-β1 к культуральной среде. К группе обработки HAPLN1 дополнительно добавляли 50 нг/мл HAPLN1. Культивирование продолжали в условиях 37°C и 5% CO2 в течение от 7 дней до 28 дней.
В конце инкубации для восстановления HAC, захваченных в альгинатные шарики, альгинат растворяли в 55 мM растворе EDTA, с последующим центрифугированием при 500 x g в течение 3 минут. Клетки, полученные после центрифугирования, подвергали экстракции РНК и полимеразной цепной реакции (ПЦР) для сравнения и анализа видов экспрессии генов. Подробные их методики являются следующими.
РНК экстрагировали с использованием раствора TRIZOL (Thermo Scientific) в соответствии с инструкциями производителя. Одноцепочечную кДНК синтезировали из 0,1 мкг полученной РНК с использованием олиго-dT20 праймеров и SUPERSCRIPT III First-Strand Synthesis Supermix (Invitrogen). Полученную кДНК подвергали ПЦР с 200 нM праймеров для каждого интересующего гена и IQ SYBR Green Supermix (Bio-Rad). Условия реакции включали поддержание температуры 95°C в течение первых 5 минут, с последующими 45 циклами, имеющими 10 секунд при 95°C, 15 секунд при 62°C, и 20 секунд при 72°C на цикл. Амплифицированный сигнал измеряли в реальном времени посредством CFX CONNECT (Bio-Rad), и уровень экспрессии интересующего гена рассчитывали, как относительное значение для каждого уровня экспрессии GAPDH. Результаты показаны на фиг. 4A, и последовательности праймеров, используемых в ПЦР для каждого человеческого гена, были следующими.
[Таблица 1]
Как показано на фиг. 4A, было подтверждено, что HAPLN1 белок вызывает увеличение экспрессии гена SOX9 в HAC, и в то же время увеличение экспрессии гена аггрекана (ACAN) и коллагена II типа (COL2A1).
3-2. Увеличенное накопление протеогликана во внеклеточном матриксе человеческих суставных хондроцитов HAPLN1
Из примера 3-1 для оценки внеклеточного накопления хрящевого матрикса посредством добавления HAPLN1, альгинатные шарики после 28 дней культивирования фиксировали NBF в течение 15 минут и замораживали в OCT соединении (Sakura) жидким азотом. После этого, получали замороженные сечения 5 мкм толщиной, и после фиксации ацетоном, визуализировали посредством окрашивания сафранин O/Fast Green FCF. Окрашенные сечения тканей рассматривали и фотографировали с использованием микроскопа Ni-U (Nikon) и цифровой камеры DS-Ri1 (Nikon), и результаты показаны на фиг. 4B (масштабный отрезок=250 мкм).
Как показано на фиг. 4B, было подтверждено, что накопление протеогликанов, окрашенных сафранин O, было существенно увеличено в альгинатных шариках HAC, культивируемых в среде, содержащей HAPLN1 белок, по сравнению с контрольной группой.
Пример 4: Анализ регуляции передачи сигнала TGF-β посредством HAPLN1 белка
4-1. Повышение уровня белка рецептора I TGF-β (TβR1) в мышиных суставных хондроцитах посредством HAPLN1 белка
Незрелые мышиные суставные хондроциты (iMAC) выделяли из билатерального суставного хряща 5-дневной мыши ICR. Полученные iMAC культивировали в среде DMEM/F12 (Gibco), содержащей 10% FBS (Gibco), 1% пенициллин/стрептомицина (Gibco), и 1% NEAA (Gibco) в условиях 37°C и 5% CO2.
iMAC, культивируемые с высокой плотностью на дне планшета, обрабатывали 100 нг/мл HAPLN1 в течение 3 часов до 72 часов, клетки собирали и белки экстрагировали в буфере для анализа радиоиммунопреципитации (RIPA). Затем проводили вестерн-блоттинг для оценки уровня экспрессии рецептора I TGF-β (TβR1), активин-рецептор подобной киназы 1 (ALK1), рецептора II TGF-β (TβR2), и Gapdh белков, и результаты показаны на фиг. 5A.
Как показано на фиг. 5A, было подтверждено, что уровень экспрессии белка TβR1 в iMAC увеличивался при помощи HAPLN1 белка. Наоборот, не было изменений в уровне экспрессии ALK1 и TβR2.
4-2. Повышенная стабильность TβR1 в мышиных суставных хондроцитах в результате воздействия HAPLN1 белка
Чтобы продемонстрировать, что повышение уровня белка TβR1 в результате воздействия HAPLN1 белка, как показано в примере 4-1, было обусловлено увеличенной стабильностью, уровни экспрессии генов трех белков, уровни которых сравнивали, сравнивали и анализировали в клетках, культивируемых в течение 24 часов и 72 часов в тех же экспериментальных условиях, и в то же время повышение уровня белка TβR1 посредством HAPLN1 было продемонстрировано в окружении, ограничивающем синтез белка de novo.
Экстракция РНК и методика ПЦР для анализа была, как указано далее.
РНК экстрагировали с использованием раствора TRIZOL (Thermo Scientific) в соответствии с инструкциями производителя. Одноцепочечную кДНК синтезировали из 0,1 мкг полученной РНК с использованием олиго-dT20 праймеров и SUPERSCRIPT III First-Strand Synthesis Supermix (Invitrogen). Полученную кДНК подвергали ПЦР с использованием 200 нМ праймеров для каждого интересующего гена и IQ SYBR Green Supermix (Bio-Rad). Условия реакции включали поддержание температуры 95°C в течение первых 5 минут с последующими 45 циклами, имеющими 10 секунд при 95°C, 15 секунд при 61°C, и 20 секунд при 72°C на цикл. Амплифицированный сигнал измеряли в реальном времени посредством CFX CONNECT (Bio-Rad), и уровень экспрессии интересующего гена рассчитывали, как относительное значение к каждому уровню экспрессии GAPDH. Результаты показаны на фиг. 5B, и последовательности праймеров, используемых в ПЦР для каждого мышиного гена, были следующими.
[Таблица 2]
Кроме того, 200 нг/мл HAPLN1 обрабатывали с 0,5 часов (пре) до обработки циклогексимидом (CHX) или с 0,5 часов (пост) после обработки циклогексимидом (CHX), тогда как iMAC, культивируемые при высокой плотности на дне планшета, подвергали воздействию 10 мкM циклогексимида (CHX). Через 24 часа после обработки CHX, планшет с прикрепленными клетками промывали PBS, клетки собирали и белки экстрагировали в RIPA буфере. Лизат экстрагированных клеток подвергали вестерн-блоттингу для оценки уровня экспрессии белка TβR1, ALK1, TβR2, и Gapdh, и результаты показаны на фиг. 5C.
Как показано на фиг. 5B и 5C, экспрессия ни одного из генов TβR1, ALK1, и TβR2 в iMAC не индуцировалась и не подавлялась HAPLN1 белком. Кроме того, было подтверждено, что TβR1 продемонстрировал повышенный уровень экспрессии белка под воздействием HAPLN1 белка, в отличие от ALK1 и TβR2, уровень экспрессии белка которых не изменялся. Это предполагает, что HAPLN1 белок не индуцирует транскрипцию гена TβR1, но увеличивает его период полужизни, демонстрируя, что стабильность TβR1 белка в iMAC увеличивалась.
4-3. Увеличенное представление TβR1 на поверхности клеток мышиных суставных хондроцитов в результате воздействия HAPLN1 белка
200 нг/мл HAPLN1 обрабатывали с 0,5 часов (пре) до обработки циклогексимидом (CHX) или с 0,5 часов (пост) после обработки циклогексимидом (CHX) тогда как iMAC, культивируемые при высокой плотности на дне планшета, подвергали воздействию 10 мкM циклогексимида (CHX). Через 24 часа после обработки CHX, планшет с прикрепленными клетками промывали PBS и подвергали реакции с EZ-Link Sulfo-NHS-LC-Biotin (Thermo Scientific) в течение 2 часов для метки белков поверхности клеток биотином. После того, как реакцию терминировали с помощью 0,1 M раствора глицина, клетки собирали и белки экстрагировали в NP-40 литическом буфере (Bioworld). Только меченные биотином белки поверхности клеток селективно экстрагировали из экстрагированного лизата посредством иммунопреципитации с использованием биотинового антитела и магнитных шариков. Фракцию, полученную таким образом, подвергали вестерн-блоттингу для оценки уровня экспрессии белка TβR1, ALK1, TβR2, и Gapdh, и результаты показаны на фиг. 5D.
Как показано на фиг. 5D, HAPLN1 белок увеличивал уровень экспрессии TβR1 белка на поверхности клеток iMAC, и в то же самое время не было изменений в экспрессии ALK1 и TβR2.
Соответственно может быть видно, что HAPLN1 белок селективно и стабильно повышает уровень TβR1 белка.
Пример 5: Анализ улучшения остеоаритрита посредством HAPLN1 белка, вводимого in vivo
5-1. Оценка улучшения морфологии ткани суставного хряща HAPLN1 белком у мышей с индуцированным остеоартритом
С целью анализа улучшения остеоартрита HAPLN1 белком, модель остеоартрита, полученного посредством дестабилизации медиального мениска (DMM), использовали в качестве модели заболевания для индукции остеоартрита посредством разреза связки медиального мениска коленного сустава мыши.
Семинедельных самцов мышей C57BL/6 делили на шесть экспериментальных групп и лечили, как указано далее.
- контроль без операции (NC-4W) - распределяли 6 животных (n=6) и выращивали в течение 4 недель без операции.
- контроль имитации операции (SC-4W) - распределяли 6 животных (n=6) и подвергали имитации операции и затем выращивали в течение 4 недель.
- группа легкого остеоартрита (DMM 4-недельный контроль, DC-4W) включала 6 животных (n=6), их подвергали DMM операции и затем выращивали в течение 4 недель.
- группа умеренного остеоартрита (DMM 8-недельный контроль, DC-8W) включала 9 животных (n=9), их подвергали DMM операции и затем выращивали в течение 4 недель, с последующей 4-недельной внутрисуставной инъекцией (5 мкL) фосфатного буферного раствора (PBS) один раз в неделю.
- тестируемая группа с низкой дозой HAPLN1 (DMM низкая доза HAPLN1, DL-8W) включала 9 животных (n=9), их подвергали операции DMM и затем выращивали в течение 4 недель с последующими 4-неделями внутрисуставной инъекции (5 мкL) 0,1 мкг/мл PBS-разведенного HAPLN1 белка в неделю.
- тестируемая группа высокой дозы HAPLN1 (DMM высокая доза HAPLN1, DH-8W) включала 9 животных (n=9), их подвергали операции DMM и затем выращивали в течение 4 недель, с последующей 4-недельной внутрисуставной инъекцией (5 мкл) 1,0 мкг/мл PBS-разведенного HAPLN1 белка один раз в неделю.
Такие тестируемые группы суммированы в таблице 3 и FIG. 6.
[Таблица 3]
В конце выращивания коленную ткань, к которой применяли операцию и лечение, экстрагировали и фиксировали нейтральным буферным формалином 10% (NBF) в течение 48 часов и затем подвергали декальцификации с помощью 10% раствора этилендиаминтетрауксусной кислоты (EDTA) в течение 7 дней. Впоследствии каждый образец погружали в парафин для получения парафинового блока, и получали слайды сагиттального сечения 5 мкм-толщиной.
Для морфологической оценки ткани суставного хряща хрящевую ткань каждого слайда сечения визуализировали посредством окрашивания сафранин O/fast green FCF (SO/FG). Окрашенные сечения тканей оценивали и фотографировали с использованием микроскопа Ni-U (Nikon) и цифровой камеры DS-Ri1 (Nikon), и результаты показаны на фиг. 7A.
Как показано на фиг. 7A, в случае нормальной группы без операции (NC-4W) и нормальной группы имитации операции (SC-4W) суставной хрящ был интактным, и в случае группы легкого остеоартрита (DC-4W) и группы умеренного остеоартрита (DC-8W), развивалась потеря суставной поверхности. Между тем, в случае тестируемой группы низкой дозы HAPLN1 (DL-8W) и тестируемой группы высокой дозы HAPLN1 (DH-8W) морфология суставного хряща была сходной с таковой нормального контроля, и в случае тестируемой группы высокой дозы HAPLN1 (DH-8W) морфология суставного хряща была почти такой же, как таковая нормального контроля.
5-2. Количественная оценка улучшения остеоартрита HAPLN1 белком
С целью количественной оценки улучшения остеоартрита HAPLN1 белком, окрашенные слайды тканей, полученные из примеров 5-1 оценивали гистопатологической оценкой остеоартрита (OARSIscore) представленной Osteoarthritis Research Society International (OARSI). Указанный способ использовали для количественной оценки степени повреждения и фиброза и остеофитов суставной поверхности. Чем выше балл, тем больше патология остеоартрита.
Как показано на фиг. 7B в случае нормальной группы без операции (NC-4W) и нормальной группы с имитацией операции (SC-4W), не было симптомов остеоартрита, и в случае группы легкого остеоартрита (DC-4W) и группы умеренного остеоартрита (DC-8W), остеоартрит прогрессировал в пропорции к периоду выращивания.
Однако, в случае тестируемой группы низкой дозы HAPLN1 (DL-8W) и тестируемой группы высокой дозы HAPLN1 (DH-8W), по сравнению с группой умеренного остеоартрита (DC-8W), который является контрольным по отношению к нему, прогрессирование остеоартрита подавляли или состояние остеоартрита улучшалось. Кроме того, было подтверждено, что ингибирование прогрессирования и улучшение в группе умеренного остеоартрита (DC-8W) возвращалось к уровню, эквивалентному таковому группы легкого остеоартрита (DC-4W).
Следовательно, может быть видно, что HAPLN1 белок является эффективным для профилактики, улучшения или лечения остеоартрита.
Группа изобретений относится к медицине, а именно к применению гиалуронан и протеогликан сшитого белка 1 (HAPLN1) для регенерации хряща. Применение гиалуронан и протеогликан сшитого белка 1 для регенерации хряща. Способ регенерации хрящевых тканей с использованием HAPLN1 включает выделение хондроцитов у пациента и обработку хондроцитов с помощью гиалуронан и протеогликан сшитого белка 1 в фармацевтически эффективном количестве. Вышеописанная группа позволяет повысить регенерацию ростовой пластинки хряща. 2 н. и 2 з.п. ф-лы, 7 ил., 3 табл., 5 пр.
1. Применение гиалуронан и протеогликан сшитого белка 1 (HAPLN1) для регенерации хряща.
2. Применение по п. 1, где HAPLN1 стимулирует образование хряща и защищает суставной хрящ.
3. Применение по п. 1, где HAPLN1 повышает белок рецептора I трансформирующего фактора роста (TGF-β рецептор I) для увеличения популяции клеток, имеющих способность образования хряща и индукции регенерации хрящевой ткани.
4. Способ регенерации хрящевых тканей с использованием HAPLN1, способ включает:
- выделение хондроцитов у пациента; и
- обработку хондроцитов с помощью гиалуронан и протеогликан сшитого белка 1 (HAPLN1) в фармацевтически эффективном количестве.
| Токарный резец | 1924 |
|
SU2016A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| WO 2017123951 A1, 20.07.2017 | |||
| NAOMI MOROZUMI ET AL, "ASB20123: A novel C-type natriuretic peptide derivative for treatment of growth failure and dwarfism", PLOS ONE, (20190222), vol | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WATANABE H ET AL, "MICE LACKING LINK PROTEIN | |||
Авторы
Даты
2023-01-17—Публикация
2019-02-28—Подача