Область техники
Изобретение относится к рекомбинантному плазмидному вектору, обеспечивающему экспрессию и секрецию моноклональных антител и химерному моноклональному антителу M12B9ch с использованием указанного вектора и может быть использовано в генетической инженерии и биотехнологии. Химерное моноклональное антитело M12B9ch связывается с белком L1 и обладает противовирусной активностью в отношении ортопоксвирусов.
Уровень техники
В XX веке вирус натуральной оспы унес жизни 300-500 миллионов человек. Победить эпидемию натуральной оспы удалось благодаря массовой вакцинации, об этом было объявлено в 1980 году на Ассамблее ВОЗ, и в последующие годы вакцинация была приостановлена (World Health Organization, http://www.who.int).
Однако беспокойство вызывают многочисленные массовые вспышки заболеваний человека, диких и домашних животных, вызванных близкородственными ортопоксвирусами. Наибольшую угрозу представляет вирус оспы обезьян, который вызывает у человека заболевание, по клиническим признакам схожее с натуральной оспой и летальностью до 10%. Причем большинство смертей приходится на более молодые возрастные группы. Существует опасность, что вирус оспы обезьян адаптируется к человеку и приобретет возможность передаваться от человека к человеку. Притом, в отличие от вируса натуральной оспы, вирус оспы обезьян имеет широкий природный резервуар, что создаст большие трудности для его уничтожения (Маренникова С.С., Щелкунов С.Н. Патогенные для человека ортопоксвирусы // М.: Товарищество научных изданий КМК, 1998. - 386 с.).
Вирус оспы коров - слабый патоген для человека, инфекция сопровождается умеренной лихорадкой и единичными поражениями на коже. Однако, у людей с иммунодефицитами вирус может вызывать генерализованную инфекцию с летальным исходом (Amer М., et al. Human cowpox infection in Sharkia Governorate, Egypt // Int. J. Dermatol. - 2001. - V. 40(1). - P. 14-17). Так же известны массовые и спорадические случаи клинического проявления инфекций, вызванных вирусом осповакцины, осповакцино-подобным вирусом и вирусами оспы буйволов и верблюдов у людей (Jahrling Р.В. Smallpox and related orthopoxviral infections. 3 ed. // Elsevier Inc. - 2011; Trindade G.S., et al. Brazilian vaccinia viruses and their origins // Emerg. Infect. Dis. - 2007. - V. 13(7). - P. 965-972).
Учитывая легкость передачи вирусов, широкий спектр хозяев и почти полное отсутствие специфического иммунитета среди населения, последствия подобных вспышек могут быть катастрофическими.
Одной из эффективных мер для исключения или снижения подобных рисков являются препараты моноклональных антител. На сегодняшний день доступным профилактическим и терапевтическим средством против патогенных для человека ортопоксвирусов являются иммуноглобулины, полученные из плазмы крови вакцинированных лиц. В США Центр по контролю заболеваний (CDC) в настоящее время является единственным источником противооспенных иммуноглобулинов для гражданских лиц. В России препарат антител представляет собой концентрированный раствор очищенной фракции иммуноглобулинов, выделенный методом фракционирования этиловым спиртом при температуре ниже 0°С из плазмы крови здоровых доноров, содержащей антитела к ортпоксвирусам в титре не менее 1:200 (Перекрест В.В. и др. Препараты для специфической профилактики натуральной оспы, зарегистрированные в Российской Федерации // БИОпрепараты. Профилактика, диагностика, лечение. - 2013. - С. 4-13).
Однако, препараты поликлональных антител часто обладают слабой эффективностью и приводят к нежелательным осложнениям. А их изготовление является длительным и трудоемким процессом. Технология получения препаратов на основе рекомбинантных гуманизированных и полностью человеческих моноклональных антител лишена указанных недостатков и пригодна для серийного производства. Поскольку процент идентичности иммунодоминантных белков среди ортопоксвирусов довольно высок, актуальна разработка препарата, содержащего моноклональные антитела, нейтрализующие широкий спектр патогенных для человека ортопоксвирусов.
Известно изобретение в котором авторы разработали несколько панелей моноклональных антител против ортопоксвирусов, продуцируемых гибридомами (международная заявка WO 2018/075621, МПК С07К 16/08, опубл. 26.04.2018 г.). Моноклональное антитело или фрагмент антитела характеризуется последовательностями CDR тяжелой и легкой цепей, спаренных клонами. Фрагмент антитела представляет собой рекомбинантное антитело ScFv (вариабельный одноцепочечный фрагмент), фрагмент Fab, фрагмент F(ab')2 или фрагмент Fv. Гибридома или сконструированная клетка кодирует антитело или фрагмент антитела, где антитело или фрагмент антитела характеризуется спаренными клонами последовательностями CDR тяжелой и легкой цепей.
Недостатком этого изобретения является использование гибридом для продукции антител, поскольку известно, что гибридомы часто синтезируют дополнительные варианты тяжелых и легких цепей, тем самым полученные антитела могут быть не моноспецифичными (Bradbury A.R.М., et al. When monoclonal antibodies are not monospecific: Hybridomas frequently express additional functional variable regions // MAbs. - 2018. - V. 10(4). - P. 539-546). Такие изменения могут критически отразиться на эффективности, а учитывая мышиное происхождение антител, и безопасности препарата.
Известны изобретения (патенты РФ: RU 2515905, опубл. 20.05.2014 г.; RU 2311927, опубл. 10.12.2007 г.), где представлены антитела, способные нейтрализовать патогенные для человека ортопоксвирусы. Антитела представляют собой одноцепочечные фрагменты антител, экспонированные на поверхности фаговых частиц, амплификация которых происходит в экспрессионной системе E.coli. Такой формат антител не обладает терапевтическим потенциалом, поскольку для эффективной нейтрализации ортопоксвирусов in vivo необходима активация сложного комплекса компонентов иммунной системы, в том числе это реализуется через Fc-области антител (Lane J.М. Immunity to smallpox and vaccinia: the future of smallpox vaccines // Expert Review of Clinical Immunology. - 2006. - V. 2(3). - P. 325-327).
Известны изобретения (патент РФ RU 2317330, опубл. 20.02.2008 г.) в котором авторы получали конструкции для продукции человеческого моноклонального антитела против вируса осповакцины в клетках млекопитающих линии НЕК293Т.
К недостаткам указанных генетических конструкций можно отнести эписомальную экспрессию. Поскольку, известно, что эписомальная/транзиентая экспрессия уступает по продуктивности стабильной экспрессии, а также походит только для получения продуцента одного цикла культивирования.
Наиболее близки аналогом (прототипом) является изобретение (патент США US 8623370, МПК C07K 16/08, А61К 39/395, опубл. 07.01.2014 г.), в котором авторами получены антитела к белкам В5 и Н3 вируса осповакцины. На основе клеток СНО с помощью вирусного вектора получены стабильные продуценты полноразмерных антител.
В частности, выделенное или очищенное антитело или его подпоследовательность, которая специфически связывается с белком оболочки поксвируса B5R, где указанное антитело или подпоследовательность содержит последовательность вариабельной области тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3, обозначенные как 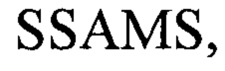
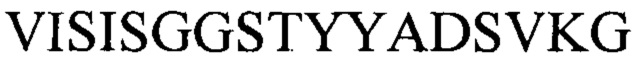 и
и  (SEQ ID NO: 17-19), соответственно, и последовательность вариабельной области легкой цепи, содержащая последовательности CDR1, CDR2 и CDR3, обозначенные как
(SEQ ID NO: 17-19), соответственно, и последовательность вариабельной области легкой цепи, содержащая последовательности CDR1, CDR2 и CDR3, обозначенные как 
 и
и 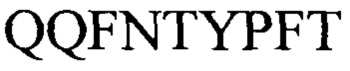 (SEQ ID NO: 29-31) соответственно. Указанное антитело ингибирует по меньшей мере 50% связывания антитела или его подпоследовательности с белком оболочки B5R вируса натуральной оспы или с белком оболочки вируса оспы В6, или к гомологу оспы обезьян В5, как определено в анализе ELISA. Изобретение содержит также вирусный вектор, содержащий нуклеиновую кислоту, кодирующую антитело или подпоследовательность и клетку-хозяина, которая экспрессирует антитело или подпоследовательность.
(SEQ ID NO: 29-31) соответственно. Указанное антитело ингибирует по меньшей мере 50% связывания антитела или его подпоследовательности с белком оболочки B5R вируса натуральной оспы или с белком оболочки вируса оспы В6, или к гомологу оспы обезьян В5, как определено в анализе ELISA. Изобретение содержит также вирусный вектор, содержащий нуклеиновую кислоту, кодирующую антитело или подпоследовательность и клетку-хозяина, которая экспрессирует антитело или подпоследовательность.
Недостатком является использование генетических конструкций на основе вирусного вектора, поскольку вирусные векторы встраиваются в транскрипционно-активные участки генома клеток-реципиентов, что может приводить к генетическим поломкам и, как следствие, нарушению метаболизма и гибели клеток продуцентов. Так же в патенте не указана продуктивность штамма-продуцента, поэтому невозможно оценить эффективность экспрессии генетических конструкций.
Таким образом, разработка моноклональных антител против патогенных для человека ортопоксвирусов и способов их производства остается актуальной задачей.
Раскрытие изобретения
Техническим результатом изобретения является получение химерного моноклонального scFv-Fc антитела, нейтрализующего вирус осповакцины с более высокой активностью за счет получения кодон-оптимизированной нуклеотидной последовательности, имеющей улучшенный индекс адаптации кодонов CAI (англ. Codon Adaptation Index) для экспрессии в клетках СНО и кодирующей полипептид со свойствами тяжелой и легкой цепей мышиного иммуноглобулина М12В9, связывающегося с белком L1 ортопоксвирусов, конструирования интегративного плазмидного вектора pVEAL-M12B9ch, содержащего указанную кодон-оптимизированную последовательность, и получения химерного моноклонального scFv-Fc антитела M12B9ch с помощью вектора pVEAL-M12B9ch при стабильной экспрессии в клетках млекопитающих.
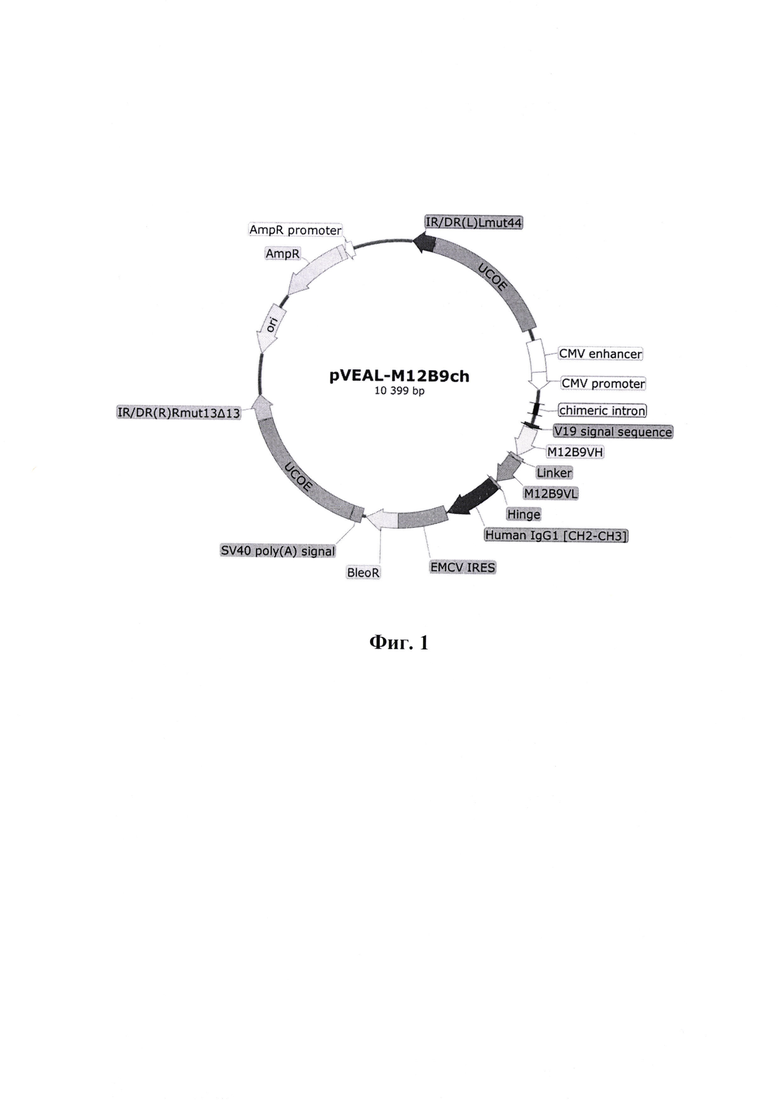
Указанный технический результат достигается созданием рекомбинантного плазмидного вектора pVEAL-M12B9ch, обеспечивающего стабильную экспрессию и секрецию химерного моноклонального антитела M12B9ch против ортопоксвирусов в клетках млекопитающих, имеющий нуклеотидную последовательность SEQ ID NO: 2 размером 10399 п.н., и содержащий следующие элементы:
- участок начала репликации ori (8101-8689);
- прямой и инвертированный повторы IR/DR - сайты, узнаваемые транспозазой SB100 (139-403, 7317-7612);
- UCOE-элементы, предотвращающие хромосомное «замалчивание» экспрессионной кассеты (416-1964, 5757-7305);
- CMV энхансер (2108-2487) и CMV промотор (2488-2699) - наиболее часто используемый промотор для экспрессии генов в клетках млекопитающих;
- Chimeric intron (2860-2992), химерный интрон для усиления экспрессии целевого гена;
- лидерный пептид V19 (3110-3153), обеспечивающий экспорт белка из клетки;
- кодон-оптимизированную нуклеотидную последовательность SEQ ID NO: 1, кодирующую полипептид, содержащий домены тяжелой и легкой цепей мышиного антитела М12В9 (3161-3907);
- Hinge - междоменный регион человеческого иммуноглобулина IgG1 (3920-3952);
- домены СН2-СН3 человеческого иммуноглобулина IgG1 (3953-4603) с мутациями M252Y, S254T, Т256Е, Е333А, H433K/N434F, увеличивающими период полураспада антитела in vivo;
- участок внутренней посадки рибосомы EMCV IRES (4618-5192);
- последовательность BleoR, кодирующая фактор устойчивости к антибиотику блеомицину (5197-5579);
- последовательность SV40 poly(A) signal для стабилизации мРНК-транскриптов за счет полиаденилирования (5626-5747);
- ген устойчивости к антибиотику ампициллину AmpR (8860-9720) и бактериальный промотор гена устойчивости к ампициллину (9721-9825).
Указанный технический результат достигается также тем, что получено рекомбинантное химерное моноклональное scFv-Fc антитело M12B9ch, полученное с использованием рекомбинантного плазмидного вектора pVEAL-M12B9ch, имеющее молекулярную массу ~52 кДа и аминокислотную последовательность SEQ ID NO: 3 полипептида со свойствами вариабельных доменов тяжелой и легкой цепей мышинного иммуноглобулина М12В9, образующего при димеризации химерное моноклональное scFv-Fc антитело M12B9ch.
Антитело M12B9ch имеет нейтрализующую активностью in vitro в отношении вируса осповакцины в концентрации не менее 0,002 мкг/мл.
Генетическая конструкция pVEAL-M12B9ch, обеспечивает как стабильную, так и транзиентную экспрессию гена и продукцию в клетках млекопитающих полипептида со свойствами тяжелой и легкой цепей мышиного иммуноглобулина M12B9.
Разработан способ получения рекомбинантного химерного моноклонального scFv-Fc антитела M12B9ch, включающего:
- создание продуцента химерного моноклонального scFv-Fc антитела M12B9ch на основе клеточных линий СНО и НЕК с помощью плазмиды pVEAL-M12B9ch;
- очистку химерного моноклонального scFv-Fc антитела M12B9ch из культуральной среды клеток-продуцента с помощью аффинной хроматографии на белке А;
- подтверждение получения химерного моноклонального scFv-Fc антитела M12B9ch, имеющего SEQ ID NO: 3.
Заявленные изобретения имеют существенные достоинства перед аналогами. Оптимизация ко донного состава повышает продукцию рекомбинантного белка путем усиления трансляции. Интегративный плазмидный вектор pVEAL (RU 2749459 C1), благодаря особенностям конструктивных элементов и системе транспозазы SB100X позволяет получать стабильные культуры продуцентов антител на основе клеток млекопитающих, которые обеспечивают высокий уровень продукции антител. Химерная форма антитела М12В9 сохраняет его нейтрализующие свойства, притом снижает иммуногенность для организма человека. Формат scFv-Fc в отличие от полноразмерных антител позволяет им быстрее достигать цели и выводиться из организма, такие антитела обладают более высокой стабильностью (Huston J.S. et al. Protein engineering of single-chain Fv analogs and fusion proteins // Methods in enzymology. - 1991. - V. 203. - P. 46-88). Для полноразмерного антитела требуется, как правило, создание конструкций для раздельного синтеза тяжелых и легких цепей, а продукция антител требует пропорциональной тетрамеризации продуктов двух векторов. Для продукции scFv-Fc антител достаточной создания одного вектора, что упрощает и ускоряет процесс создания генетических конструкций, а для продукции необходима димеризация гомологичных субъединиц.
В прототипе (US 8623370 B2) эффективной нейтрализующей активностью in vitro обладало антитело в концентрации 0,06 мкг/мл, заявляемое scFv-Fc антитело M12B9ch нейтрализовало вирус осповакцины в концентрации 0,002 мкг/мл. Антитело М12В9 связывается с вирусным белком L1, который имеет идентичность более 98% среди вирусов осповакцины, натуральной оспы, оспы коров и оспы обезьян. На конформационный эпитоп антитела приходятся только консервативный аминокислотные остатки (Kaever Т. et al. Potent neutralization of vaccinia virus by divergent murine antibodies targeting a common site of vulnerability in L1 protein // J Virol. - 2014. - V. 88(19). - P. 11339-11355). Таким образом полученное химерное моноклональное scFv-Fc антитело M12B9ch имеет терапевтический потенциал для профилактики и лечения ортопоксвирусных инфекций, а также лечения ряда поствакцинальных осложнений у вакцинируемых.
Осуществление изобретения
Изобретение иллюстрируется следующими фигурами:
Фиг. 1. Физическая карта интегративного плазмидного вектора pVEAL-M12B9ch, имеющего размер 10399 п.н.
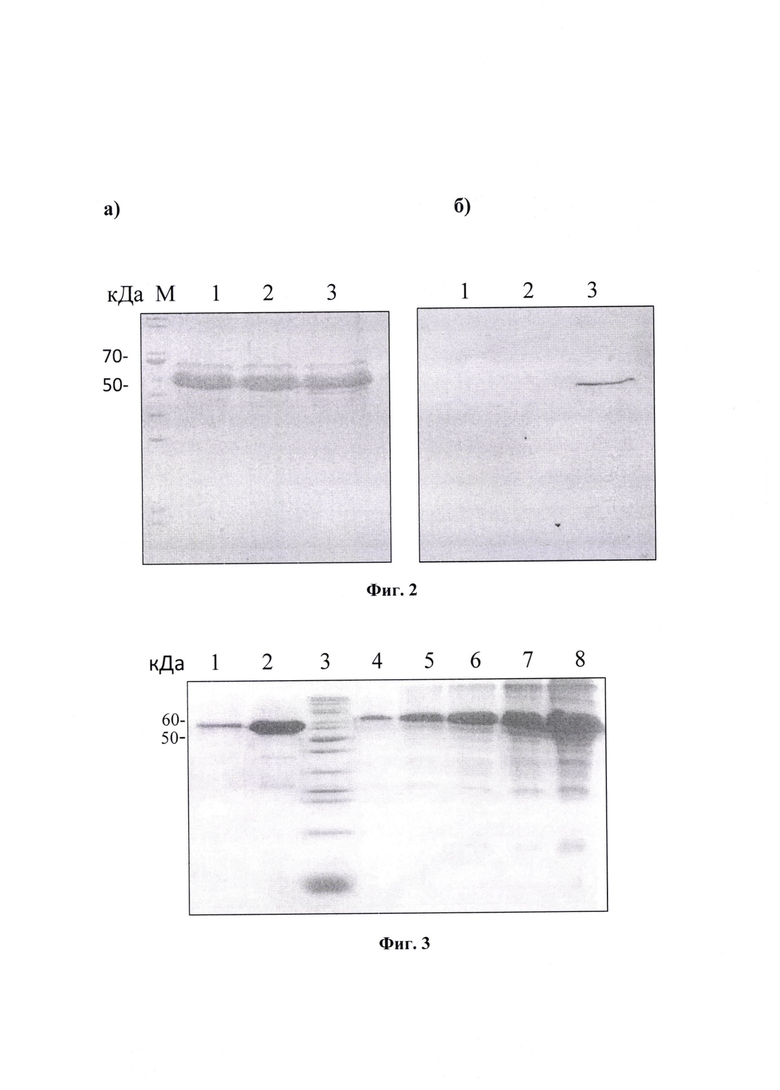
Фиг. 2. Разделение белков культуральной среды клеток НЕК293FT в ПААГ, при окрашивании кумасси G-250 (а) и антителами к Fc-фрагменту человеческих антител (б):
1 - нетрансфецированные клетки;
2 - клетки, трансфецированные исходной плазмидой pVEAL;
3 - клетки, трансфецированные pVEAL-M12B9ch.
Фиг. 3. Электрофореграмма разделения белков в 15% ДСН-ПААГ:
1 - препарат МкАТ M12B9ch после хроматографической очистки;
2 - препарат концентрированного МкАТ M12B9ch;
3 - маркер молекулярного веса, 10-200 кДа;
4-8 - БСА в концентрациях 0.1, 0.5, 1.25, 2.5 и 5 мг/мл.
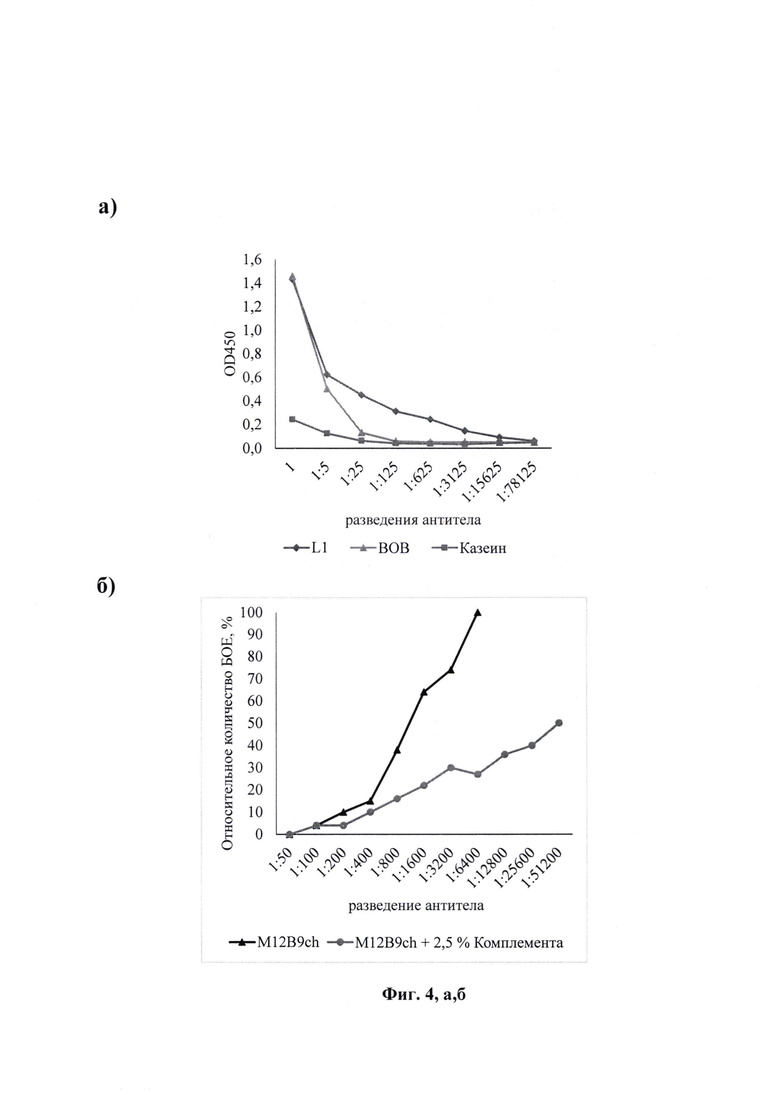
Фиг. 4. Анализ специфичности и нейтрализующей активности препарата химерного антитела M12B9ch (100 мкг/мл): а) взаимодействие с рекомбинантным белком L1 вируса натуральной оспы, лизатом MV и EV форм вируса осповакцины штамм ЛИВП в ИФА. Представлены средние значения ± стандартное отклонение; б) ингибирование бляшкообразования вируса осповакцины штамм ЛИВП на культуре клеток Vero in vitro. Указано среднее количество бляшек на лунку, относительно контроля вируса.
Ниже приведены примеры конкретного осуществления изобретения.
Пример 1. Проектирование кодон-оптимизированной нуклеотидной последовательности, кодирующей полипептид со свойствами тяжелой и легкой цепей мышиного иммуноглобулина М12В9
Аминокислотные последовательности, кодирующие вариабельные домены тяжелой (VH) и легкой (VL) цепей мышиного IgG2a М12В9, специфичного к белку L1 вируса осповакцины, извлекали из базы данных NCBI Protein Database (4U6H_A, 4U6H_B). Проектировали полипептид, последовательно соединяя VH-домен, GS-линкер 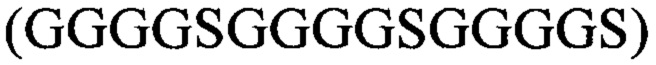 и VL-домен М12В9. Для итоговой аминокислотной последовательности проводили оптимизацию кодонного состава с помощью онлайн-инструмента Codon Optimization Tool (https://eu.idtdna.com/CodonOpt) для экспрессии в клетках СНО и фланкировали последовательностями, содержащими сайты рестрикции AfeI
и VL-домен М12В9. Для итоговой аминокислотной последовательности проводили оптимизацию кодонного состава с помощью онлайн-инструмента Codon Optimization Tool (https://eu.idtdna.com/CodonOpt) для экспрессии в клетках СНО и фланкировали последовательностями, содержащими сайты рестрикции AfeI 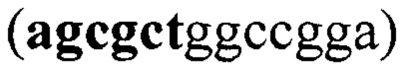 и BamHI
и BamHI 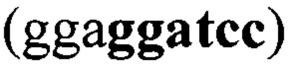 для последующего клонирования.
для последующего клонирования.
Итоговую нуклеотидную последовательность (SEQ ID NO: 1) синтезировали в ООО «ДНК-синтез» в составе вектора pGH-M12B9.
Пример 2. Конструирование интегративного плазмидного вектора pVEAL-M12B9ch для продукции химерного scFv-Fc антитела M12B9ch
На основе вектора pVEAL (RU 2749459 C1) был получен интегративный плазмидный вектор pVEAL-M12B9ch (фиг. 1), имеющий нуклеотидную последовательность SEQ ID NO: 2.
Плазмидные ДНК pVEAL и pGH-M12B9 (см. пример 1) гидролизовали эндонуклеазами рестрикции AfeI и BamHI, продукты реакции разделяли в 1% агарозном геле, визуализировали в УФ-свете, вырезали фрагменты, соответствующие размеру вектора и вставки, и экстрагировали из геля с помощью набора «DNA CleanUp Standart» («Евроген», Москва). Фрагменты лигировали в 5Х Quick Ligation буфер («Евроген», Москва) с помощью Т4 ДНК-лигазы и трансформировали лигазной смесью клетки E.coli NEB stable. Трансформанты высевали на LB-агар, содержащий селективный антибиотик ампициллин в концентрации 100 мкг/мл. Отдельные колонии культивировали в LB, выделяли плазмидную ДНК с помощью набора Plasmid Miniprep («Евроген», Москва) и секвенировали по методу Сенгера для подтверждения структуры вставки.
Пример 3. Продукция химерного scFv-Fc антитела M12B9ch в клетках млекопитающих
а) Транзиентная экспрессия в клетках НЕК293FT
Трансфекцию клеток НЕК293FT плазмидами pVEAL и pVEAL-M12B9ch проводили кальций фосфатным методом. Клетки растили в культуральных флаконах (25 см2) в полной питательной среде DMEM/F-12(1:1), содержащей 10% FBS и 50 мкг/мл гентамицина. По достижении 70-80% монослоя, заменяли питательную среду на поддерживающую, содержащую 2% FBS и через 2 часа проводили трансфекцию.
К 250 мкл стерильного буфера 2Х HBS (рН 7.02) по каплям приливали 250 мл раствора, содержащего 7 мкг соответствующей плазмидной ДНК и 25 мкл 2М CaCl2, инкубировали 15 минут при комнатной температуре и по каплям вносили в культуральные флаконы. Клетки помещали в CO2 инкубатор, через 20 часов меняли среду, и на 4 сутки после трансфекции собирали культуральную среду.
Культуральную среду очищали от клеток и клеточного дебриса центрифугированием при 12000 X g, +4°С в течение 10 минут, супернатант фильтровали через фильтры с диаметром пор 0,22 мкм. Наличие антител оценивали с помощью электрофореза в 15% ДСН-ПААГ по Лэммли и иммуноблотинга при окрашивании конъюгированными козьими антителами против человеческих IgG (ThermoFisher, США) (фиг. 2). При окрашивании геля и нитроцеллюлозной мембраны обнаружен белок ~52 кДа, что соответствует молекулярной массе полипептида, образующего при димеризации scFv-Fc антитело M12B9ch.
б) Стабильная экспрессия в клетках СНО-К1
Для получения стабильной культуры-продуцента проводили котрансфекцию клеток СНО-K1 плазмидами pVEAL-M12B9ch и pCMV(CAT)T7-SB100 (10:1) с помощью набора «Lipofectamine 3000 reagent» («Thermo Fisher Scientific», США) согласно рекомендациям производителя. Плазмида pCMV(CAT)T7-SB100 обеспечивает продукцию рекомбиназы SB100 (Sleeping Beauty), которая осуществляет встройку экспрессионной кассеты вектора pVEAL-M12B9ch в геном клеток СНО-K1. Клетки инкубировали в течение 3 суток, заменяли питательную среду на свежую, содержащую селективный антибиотик Zeocin в финальной концентрации 475 мкг/мл и культивировали в течение 2 недель до гибели клеток в отрицательном контроле. Затем культуральную среду меняли с периодичностью 3-5 дней, повышая концентрацию антибиотика для отбора наиболее продуктивных клонов.
После селекции поликлональную клеточную культуру рассевали в 96-луночные планшеты в концентрации 1.3 кл/лун для отбора индивидуальных клонов культуры-продуцента. Клоны, показавшие наибольший выход целевого белка, масштабировали и культивировали на роллерных установках в среде DMEM/F-12(1:1), содержащей 2% FBS и 50 мкг/мл гентамицина. Культуральную среду, содержащую антитела, фильтровали и очищали с помощью аффинной хроматографии на белке A («Mabselect», GE Healthcare). Колонку уравновешивали буфером, содержащим 50 мМ Tris-HCl, 150 мМ NaCl, рН 7.0. Затем наносили образец, несвязавшиеся белки удаляли 20 мМ Tris-HCl, рН 7.0. Элюцию целевого белка проводили буфером, содержащим 100 мМ Glycine-HCl, 150 мМ NaCl в градиенте рН 7.2-3.4. Фракции, содержащие целевой белок (52 кДа), объединяли, чистоту и концентрацию полученного препарата оценивали в 15% ДСН-ПААГ по Лэммли (фиг. 3). Выход белка составил 50-100 мг/л при адгезионном культивировании на роллерных установках.
Пример 4. Анализ специфичности и вируснейтрализующей активности химерного антитела M12B9ch
Специфичность препарата антитела M12B9ch определяли с помощью ИФА. В качестве антигенов использовали рекомбинантный белок L1 (а.о. 5А-185Q) вируса натуральной оспы штамм India-1967, полученный с помощью клеток млекопитающих СНО-К1 (Меркульева Ю.А., Щербаков Д.Н. Разработка панели рекомбинантных иммунодоминантных белков ортопоксвирусов для отбора высокоэффективных нейтрализующих моноклональных антител // Биотехнология: материалы VII Международная конференция молодых ученых: биофизиков, биотехнологов, мол. биологов и вирусологов - Новосибирск: ИПЦ НГУ, 2020. - С. 642.), и лизат вируса осповакцины штамм ЛИВП.
Антигены сорбировали в 96 луночном планшете в ночь при 4°С, затем блокировали в течение 1 ч 1% раствором казеина в PBS, трижды промывали PBST (0,1% Твин-20 в PBS). В лунки вносили последовательные 5-кратные разведения антитела M12B9ch в трех повторах (1 - 1:78125) и инкубировали в течение 1 ч при 37°С. Трижды промывали, добавляли моноклональные антитела к Fc-фрагменту человеческого антитела, меченые пероксидазой хрена, и инкубировали 1 ч при 37°С. Лунки промывали буфером PBST и вносили раствор субстрата ТМВ (Amresco, США). Через 15 минут реакцию терминировали раствором 1Н HCl и анализировали OD450 нм на планшетном ридере Varioskan Lux multimode microplate reader (Thermo Scientific, США).
Антитело M12B9ch взаимодействовало с белком L1 вируса натуральной оспы с пикомолярным сродством и лизатом зрелой формы вируса осповакцины (фиг. 4, а).
Анализ нейтрализующей активности в отношении вируса осповакцины определяли в отсутствие компонентов системы комплемента в реакции ингибирования бляшкообразования на культуре клеток in vitro.
Культуру клеток Vero растили в 24-луночных культуральных планшетах в ростовой среде ДМЕМ/F-12 (1:1) с 10% FBS до образования 90-100% монослоя. Готовили последовательные пятикратные разведения препарата M12B9ch (100 мкг/мл) в PBS начиная с 1:50. В качестве контроля использовали человеческую сыворотку донора, вакцинированного против ОПВ. К каждому разведению добавляли штамм ЛИВП вируса осповакцины (50 БОЕ/лун), инкубировали 1 час при +37°С и добавляли к монослою клеток Vero. Планшеты инкубировали в течение 3 сут при +37°C, 5% СО2. Клетки окрашивали добавлением 250 мкл 0,2% раствора генциан-виолета на лунку. Через 30 мин удаляли жидкость из лунок и промывали водой. Оценку результатов проводили визуально. Титром считали разведение, при котором наблюдается 50% уменьшение бляшек относительно контроля. Полученное антитело нейтрализовало вирус осповакцины в концентрации 0,125 мкг/мл в отсутствие компонентов системы комплемента, и в концентрации 0,002 мкг/мл в присутствии 2,5% комплемента (фиг. 4, б).
--->
ПРИЛОЖЕНИЕ
<110> Федеральное бюджетное учреждение науки «Государственный научный центр
вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере
защиты прав потребителей и благополучия человека (ФБУН ГНЦ ВБ
«Вектор» Роспотребнадзора)
<120> Рекомбинантный плазмидный вектор pVEAL-M12B9ch, обеспечивающий стабильную
экспрессию и секрецию химерного моноклонального антитела M12B9сh
против ортопоксвирусов в клетках млекопитающих и рекомбинантное
химерное моноклональное scFv-Fc антитело M12B9сh, полученное с
использованием указанного вектора pVEAL-M12B9ch.
<160> Номер SEQ ID NO: 3
<210> SEQ ID NO:1
<211> 766
<212> PRT
<213> Artificial Sequence
<220> Искусственная нуклеотидная последовательность
<223> Кодон-оптимизированная нуклеотидная последовательность,
кодирующая полипептид, содержащий вариабельные домены
тяжелой и легкой цепей мышиного иммуноглобулина
M12B9 соединенные GS-линкером
<400> 1
1 agcgctggcc ggacaagtcc agctgcagca gtctggcgct gagctggtta agacaggcgc
61 ctctctgcgg atgtcctgca agtcctctgg ctacaccttc accagattct ggatgcactg
121 gatcaagcag agcccaggcc agggacttga gtggatcggc tacatcaacc cctccaccgg
181 ctacaccgag tacaaccaga agttcaagga caaggctacc ctgaccgccg acagatcttc
241 taccaccgcc tacatgcagc tgatctccct gacctctggc gactccgccg tgtactactg
301 cgccagatct gaccagacca actatctgtt cccctactgg ggccagggca ccctggttac
361 agtttctgct ggtggcggag gatctggcgg aggtggaagc ggcggaggcg gatctgatgt
421 ggttatgaca cagatccctc tgagcctgcc tgtgtctctg ggcgatcagg cctccatctc
481 ctgcagatcc tctcagtctc tggtgcactc caacggcaac acctacctgc attggtccct
541 gcagaagccc ggccagtctc ctaacctgct gatctacaag gtgtccaacc ggttctctgg
601 cgtgcccgac agattctctg gatctggctc tggcaccgac ttcaccctga agatctccag
661 agtggaagcc gaggacctgg gcgtgtactt ctgtagccag tctacccacg atccttggac
721 ctttggcgga ggcaccaagc tggaaatcaa gagagctgga ggatcc
<210> SEQ ID NO:2
<211> 10399
<212> PRT
<213> Artificial Sequence
<220> Искусственная нуклеотидная последовательность
<223> Нуклеотидная последовательность вектора pVEAL-M12B9ch
<400> 2
1 caaggcgatt aagttgggta acgccagggt tttcccagtc acgacgttgt aaaacgacgg
61 ccagtgagcg cgcgtaatac gactcactat agggcgaatt ggagctcggt tccctataca
121 gttgaagtcg gaagtttaca tacacttaag ttggagtcat taaaactcgt ttttcaacta
181 ctccacaaat ttcttgttaa caaacaatag ttttggcaag tcagttagga catctacttt
241 gtgcatgaca caagtcattt ttccaacaat tgtttacaga cagattattt cacttataat
301 tcactgtatc acaattccag tgggtcagaa gtttacatac actaagttga ctgtgccttt
361 aaacagcttg gaaaattcca gaaaatgatg tcatggcttt agaagcttca ttggcgccct
421 ccgcgcctac agctcaagcc acatccgaag ggggagggag ccgggagctg cgcgcggggc
481 cgccgggggg aggggtggca ccgcccacgc cgggcggcca cgaagggcgg ggcagcgggc
541 gcgcgcgcgg cggggggagg ggccggcgcc gcgcccgctg ggaattgggg ccctaggggg
601 agggcggagg cgccgacgac cgcggcactt accgttcgcg gcgtggcgcc cggtggtccc
661 caaggggagg gaagggggag gcggggcgag gacagtgacc ggagtctcct cagcggtggc
721 ttttctgctt ggcagcctca gcggctggcg ccaaaaccgg actccgccca cttcctcgcc
781 cgccggtgcg agggtgtgga atcctccaga cgctggggga gggggagttg ggagcttaaa
841 aactagtacc cctttgggac cactttcagc agcgaactct cctgtacacc aggggtcagt
901 tccacagacg cgggccaggg gtgggtcatt gcggcgtgaa caataatttg actagaagtt
961 gattcgggtg tttccggaag gggccgagtc aatccgccga gttggggcac ggaaaacaaa
1021 aagggaaggc tactaagatt tttctggcgg gggttatcat tggcgtaact gcagggacca
1081 cctcccgggt tgagggggct ggatctccag gctgcggatt aagcccctcc cgtcggcgtt
1141 aatttcaaac tgcgcgacgt ttctcacctg ccttcgccaa ggcaggggcc gggaccctat
1201 tccaagaggt agtaactagc aggactctag ccttccgcaa ttcattgagc gcatttacgg
1261 aagtaacgtc gggtactgtc tctggccgca agggtgggag gagtacgcat ttggcgtaag
1321 gtggggcgta gagccttccc gccattggcg gcggataggg cgtttacgcg acggcctgac
1381 gtagcggaag acgccttagt gggggggaag gttctagaaa agcggcggca gcggctctag
1441 cggcagtagc agcagcgccg ggtcccgtgc ggaggtgctc ctcgcagagt tgtttctcca
1501 gcagcggcag ttctcactac agcgccagga cgagtccggt tcgtgttcgt ccgcggagat
1561 ctctctcatc tcgctcggct gcgggaaatc gggctgaagc gactgagtcc gcgatggagg
1621 taacgggttt gaaatcaatg agttattgaa aagggcatgg cgaggccgtt ggcgcctcag
1681 tggaagtcgg ccagccgcct ccgtgggaga gaggcaggaa atcggaccaa ttcagtagca
1741 gtggggctta aggtttatga acggggtctt gagcggaggc ctgagcgtac aaacagcttc
1801 cccaccctca gcctcccggc gccatttccc ttcactgggg gtgggggatg gggagctttc
1861 acatggcgga cgctgccccg ctggggtgaa agtggggcgc ggaggcggga cttcttattc
1921 cctttctaaa gcacgctgct tcgggggcca cggcgtctcc tcggggatct tcaatattgg
1981 ccattagcca tattattcat tggttatata gcataaatca atattggcta ttggccattg
2041 catacgttgt atctatatca taatatgtac atttatattg gctcatgtcc aatatgaccg
2101 ccatgttggc attgattatt gactagttat taatagtaat caattacggg gtcattagtt
2161 catagcccat atatggagtt ccgcgttaca taacttacgg taaatggccc gcctggctga
2221 ccgcccaacg acccccgccc attgacgtca ataatgacgt atgttcccat agtaacgcca
2281 atagggactt tccattgacg tcaatgggtg gagtatttac ggtaaactgc ccacttggca
2341 gtacatcaag tgtatcatat gccaagtccg ccccctattg acgtcaatga cggtaaatgg
2401 cccgcctggc attatgccca gtacatgacc ttacgggact ttcctacttg gcagtacatc
2461 tacgtattag tcatcgctat taccatggtg atgcggtttt ggcagtacac caatgggcgt
2521 ggatagcggt ttgactcacg gggatttcca agtctccacc ccattgacgt caatgggagt
2581 ttgttttggc accaaaatca acgggacttt ccaaaatgtc gtaacaactg cgatcgcccg
2641 ccccgttgac gcaaatgggc ggtaggcgtg tacggtggga ggtctatata agcagagctc
2701 gtttagtgaa ccgtcagatc actagaagct ttattgcggt agtttatcac agttaaattg
2761 ctaacgcagt cagtgcttct gacacaacag tctcgaactt aagctgcagt gactctctta
2821 aggtagcctt gcagaagttg gtcgtgaggc actgggcagg taagtatcaa ggttacaaga
2881 caggtttaag gagaccaata gaaactgggc ttgtcgagac agagaagact cttgcgtttc
2941 tgataggcac ctattggtct tactgacatc cactttgcct ttctctccac aggtgtccac
3001 tcccagttca attacagctc ttaaggctag agtacttaat acgactcact ataggctagc
3061 ctcgagaatt cgtcctgctg cgcacgaagc cctggccccg gccgccacca tgatgaggcc
3121 catcgtgctg gtgctgctgt tcgccacctc agcgctggcc ggacaagtcc agctgcagca
3181 gtctggcgct gagctggtta agacaggcgc ctctctgcgg atgtcctgca agtcctctgg
3241 ctacaccttc accagattct ggatgcactg gatcaagcag agcccaggcc agggacttga
3301 gtggatcggc tacatcaacc cctccaccgg ctacaccgag tacaaccaga agttcaagga
3361 caaggctacc ctgaccgccg acagatcttc taccaccgcc tacatgcagc tgatctccct
3421 gacctctggc gactccgccg tgtactactg cgccagatct gaccagacca actatctgtt
3481 cccctactgg ggccagggca ccctggttac agtttctgct ggtggcggag gatctggcgg
3541 aggtggaagc ggcggaggcg gatctgatgt ggttatgaca cagatccctc tgagcctgcc
3601 tgtgtctctg ggcgatcagg cctccatctc ctgcagatcc tctcagtctc tggtgcactc
3661 caacggcaac acctacctgc attggtccct gcagaagccc ggccagtctc ctaacctgct
3721 gatctacaag gtgtccaacc ggttctctgg cgtgcccgac agattctctg gatctggctc
3781 tggcaccgac ttcaccctga agatctccag agtggaagcc gaggacctgg gcgtgtactt
3841 ctgtagccag tctacccacg atccttggac ctttggcgga ggcaccaagc tggaaatcaa
3901 gagagctgga ggatccggag acaaaactca cacatgccca ccgtgcccag cacctgaact
3961 cctgggggga ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tctacatcac
4021 ccgggaacct gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa
4081 gttcaactgg tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga
4141 gcagtacaac agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct
4201 gaatggcaag gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgcgaa
4261 aaccatctcc aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc
4321 ccgggaggag atgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc
4381 cagcgacatc gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac
4441 gcctcccgtg ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa
4501 gagcaggtgg cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgaagtt
4561 ccactacacg cagaagagcc tctccctgtc tccgggtaaa tgagtcgagc ggttcccgcc
4621 cctctccctc ccccccccct aacgttactg gccgaagccg cttggaataa ggccggtgtg
4681 cgtttgtcta tatgttattt tccaccatat tgccgtcttt tggcaatgtg agggcccgga
4741 aacctggccc tgtcttcttg acgagcattc ctaggggtct ttcccctctc gccaaaggaa
4801 tgcaaggtct gttgaatgtc gtgaaggaag cagttcctct ggaagcttct tgaagacaaa
4861 caacgtctgt agcgaccctt tgcaggcagc ggaacccccc acctggcgac aggtgcctct
4921 gcggccaaaa gccacgtgta taagatacac ctgcaaaggc ggcacaaccc cagtgccacg
4981 ttgtgagttg gatagttgtg gaaagagtca aatggctcac ctcaagcgta ttcaacaagg
5041 ggctgaagga tgcccagaag gtaccccatt gtatgggatc tgatctgggg cctcggtgca
5101 catgctttac atgtgtttag tcgaggttaa aaaacgtcta ggccccccga accacgggga
5161 cgtggttttc ctttgaaaaa cacgatgata atatggccac aaccatggcc aagttgacca
5221 gtgccgttcc ggtgctcacc gcgcgcgacg tcgccggagc ggtcgagttc tggaccgacc
5281 ggctcgggtt ctcccgggac ttcgtggagg acgacttcgc cggtgtggtc cgggacgacg
5341 tgaccctgtt catcagcgcg gtccaggacc aggtggtgcc ggacaacacc ctggcctggg
5401 tgtgggtgcg cggcctggac gagctgtacg ccgagtggtc ggaggtcgtg tccacgaact
5461 tccgggacgc ctccgggccg gccatgaccg agatcggcga gcagccgtgg gggcgggagt
5521 tcgccctgcg cgacccggcc ggcaactgcg tgcacttcgt ggccgaggag caggactgag
5581 cggccgcttc cctttagtga gggttaatgc ttcgagcaga catgataaga tacattgatg
5641 agtttggaca aaccacaact agaatgcagt gaaaaaaatg ctttatttgt gaaatttgtg
5701 atgctattgc tttatttgta accattataa gctgcaataa acaagttcca cggccggccc
5761 tccgcgccta cagctcaagc cacatccgaa gggggaggga gccgggagct gcgcgcgggg
5821 ccgccggggg gaggggtggc accgcccacg ccgggcggcc acgaagggcg gggcagcggg
5881 cgcgcgcgcg gcggggggag gggccggcgc cgcgcccgct gggaattggg gccctagggg
5941 gagggcggag gcgccgacga ccgcggcact taccgttcgc ggcgtggcgc ccggtggtcc
6001 ccaaggggag ggaaggggga ggcggggcga ggacagtgac cggagtctcc tcagcggtgg
6061 cttttctgct tggcagcctc agcggctggc gccaaaaccg gactccgccc acttcctcgc
6121 ccgccggtgc gagggtgtgg aatcctccag acgctggggg agggggagtt gggagcttaa
6181 aaactagtac ccctttggga ccactttcag cagcgaactc tcctgtacac caggggtcag
6241 ttccacagac gcgggccagg ggtgggtcat tgcggcgtga acaataattt gactagaagt
6301 tgattcgggt gtttccggaa ggggccgagt caatccgccg agttggggca cggaaaacaa
6361 aaagggaagg ctactaagat ttttctggcg ggggttatca ttggcgtaac tgcagggacc
6421 acctcccggg ttgagggggc tggatctcca ggctgcggat taagcccctc ccgtcggcgt
6481 taatttcaaa ctgcgcgacg tttctcacct gccttcgcca aggcaggggc cgggacccta
6541 ttccaagagg tagtaactag caggactcta gccttccgca attcattgag cgcatttacg
6601 gaagtaacgt cgggtactgt ctctggccgc aagggtggga ggagtacgca tttggcgtaa
6661 ggtggggcgt agagccttcc cgccattggc ggcggatagg gcgtttacgc gacggcctga
6721 cgtagcggaa gacgccttag tgggggggaa ggttctagaa aagcggcggc agcggctcta
6781 gcggcagtag cagcagcgcc gggtcccgtg cggaggtgct cctcgcagag ttgtttctcc
6841 agcagcggca gttctcacta cagcgccagg acgagtccgg ttcgtgttcg tccgcggaga
6901 tctctctcat ctcgctcggc tgcgggaaat cgggctgaag cgactgagtc cgcgatggag
6961 gtaacgggtt tgaaatcaat gagttattga aaagggcatg gcgaggccgt tggcgcctca
7021 gtggaagtcg gccagccgcc tccgtgggag agaggcagga aatcggacca attcagtagc
7081 agtggggctt aaggtttatg aacggggtct tgagcggagg cctgagcgta caaacagctt
7141 ccccaccctc agcctcccgg cgccatttcc cttcactggg ggtgggggat ggggagcttt
7201 cacatggcgg acgctgcccc gctggggtga aagtggggcg cggaggcggg acttcttatt
7261 ccctttctaa agcacgctgc ttcgggggcc acggcgtctc ctcggggatc tagcttgtgg
7321 aaggctactc gaaatgtttg acccaagtta aacaatttaa aggcaatgct accaaatact
7381 aattgagtgt atgtaaactt ctgacccact gggaatgtga tgaaagaaat aaaagctgaa
7441 atgaatcatt ctctctacta ttattctgat atttcacatt cttaaaataa agtggtgatc
7501 ctaactgacc taagacaggg aatttttact aggattaaat gtcaggaatt gtgaaaaagt
7561 gagtttaaat gtatttggct aaggtgtatg taaacttccg acttcaactg tatagggttc
7621 ctctagctag agacgacctc gggtacccag cttttgttcc ctttagtgag ggttaattgc
7681 gcgcttggcg taatcatggt catagctgtt tcctgtgtga aattgttatc cgctcacaat
7741 tccacacaac atacgagccg gaagcataaa gtgtaaagcc tggggtgcct aatgagtgag
7801 ctaactcaca ttaattgcgt tgcgctcact gcccgctttc cagtcgggaa acctgtcgtg
7861 ccagctgcat taatgaatcg gccaacgcgc ggggagaggc ggtttgcgta ttgggcgctc
7921 ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt cggctgcggc gagcggtatc
7981 agctcactca aaggcggtaa tacggttatc cacagaatca ggggataacg caggaaagaa
8041 catgtgagca aaaggccagc aaaaggccag gaaccgtaaa aaggccgcgt tgctggcgtt
8101 tttccatagg ctccgccccc ctgacgagca tcacaaaaat cgacgctcaa gtcagaggtg
8161 gcgaaacccg acaggactat aaagatacca ggcgtttccc cctggaagct ccctcgtgcg
8221 ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc gcctttctcc cttcgggaag
8281 cgtggcgctt tctcatagct cacgctgtag gtatctcagt tcggtgtagg tcgttcgctc
8341 caagctgggc tgtgtgcacg aaccccccgt tcagcccgac cgctgcgcct tatccggtaa
8401 ctatcgtctt gagtccaacc cggtaagaca cgacttatcg ccactggcag cagccactgg
8461 taacaggatt agcagagcga ggtatgtagg cggtgctaca gagttcttga agtggtggcc
8521 taactacggc tacactagaa ggacagtatt tggtatctgc gctctgctga agccagttac
8581 cttcggaaaa agagttggta gctcttgatc cggcaaacaa accaccgctg gtagcggtgg
8641 tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa ggatctcaag aagatccttt
8701 gatcttttct acggggtctg acgctcagtg gaacgaaaac tcacgttaag ggattttggt
8761 catgagatta tcaaaaagga tcttcaccta gatcctttta aattaaaaat gaagttttaa
8821 atcaatctaa agtatatatg agtaaacttg gtctgacagt taccaatgct taatcagtga
8881 ggcacctatc tcagcgatct gtctatttcg ttcatccata gttgcctgac tccccgtcgt
8941 gtagataact acgatacggg agggcttacc atctggcccc agtgctgcaa tgataccgcg
9001 agacccacgc tcaccggctc cagatttatc agcaataaac cagccagccg gaagggccga
9061 gcgcagaagt ggtcctgcaa ctttatccgc ctccatccag tctattaatt gttgccggga
9121 agctagagta agtagttcgc cagttaatag tttgcgcaac gttgttgcca ttgctacagg
9181 catcgtggtg tcacgctcgt cgtttggtat ggcttcattc agctccggtt cccaacgatc
9241 aaggcgagtt acatgatccc ccatgttgtg caaaaaagcg gttagctcct tcggtcctcc
9301 gatcgttgtc agaagtaagt tggccgcagt gttatcactc atggttatgg cagcactgca
9361 taattctctt actgtcatgc catccgtaag atgcttttct gtgactggtg agtactcaac
9421 caagtcattc tgagaatagt gtatgcggcg accgagttgc tcttgcccgg cgtcaatacg
9481 ggataatacc gcgccacata gcagaacttt aaaagtgctc atcattggaa aacgttcttc
9541 ggggcgaaaa ctctcaagga tcttaccgct gttgagatcc agttcgatgt aacccactcg
9601 tgcacccaac tgatcttcag catcttttac tttcaccagc gtttctgggt gagcaaaaac
9661 aggaaggcaa aatgccgcaa aaaagggaat aagggcgaca cggaaatgtt gaatactcat
9721 actcttcctt tttcaatatt attgaagcat ttatcagggt tattgtctca tgagcggata
9781 catatttgaa tgtatttaga aaaataaaca aataggggtt ccgcgcacat ttccccgaaa
9841 agtgccacct gacgcgccct gtagcggcgc attaagcgcg gcgggtgtgg tggttacgcg
9901 cagcgtgacc gctacacttg ccagcgccct agcgcccgct cctttcgctt tcttcccttc
9961 ctttctcgcc acgttcgccg gctttccccg tcaagctcta aatcgggggc tccctttagg
10021 gttccgattt agtgctttac ggcacctcga ccccaaaaaa cttgattagg gtgatggttc
10081 acgtagtggg ccatcgccct gatagacggt ttttcgccct ttgacgttgg agtccacgtt
10141 ctttaatagt ggactcttgt tccaaactgg aacaacactc aaccctatct cggtctattc
10201 ttttgattta taagggattt tgccgatttc ggcctattgg ttaaaaaatg agctgattta
10261 acaaaaattt aacgcgaatt ttaacaaaat attaacgctt acaatttcca ttcgccattc
10321 aggctgcgca actgttggga agggcgatcg gtgcgggcct cttcgctatt acgccagctg
10381 gcgaaagggg gatgtgctg
<210> SEQ ID NO:3
<211> 480
<212> recombinant chimeric protein
<213> Artificial Sequence
<220> Искусственная аминокислотная последовательность
<223> Аминокислотная последовательность полипептида со свойствами
вариабельных доменов тяжелой и легкой цепи антитела M12B9
1 GQVQLQQSGA ELVKTGASLR MSCKSSGYTF TRFWMHWIKQ SPGQGLEWIG YINPSTGYTE
61 YNQKFKDKAT LTADRSSTTA YMQLISLTSG DSAVYYCARS DQTNYLFPYW GQGTLVTVSA
121 GGGGSGGGGS GGGGSDVVMT QIPLSLPVSL GDQASISCRS SQSLVHSNGN TYLHWSLQKP
181 GQSPNLLIYK VSNRFSGVPD RFSGSGSGTD FTLKISRVEA EDLGVYFCSQ STHDPWTFGG
241 GTKLEIKRAG GSGDKTHTCP PCPAPELLGG PSVFLFPPKP KDTLYITREP EVTCVVVDVS
301 HEDPEVKFNW YVDGVEVHNA KTKPREEQYN STYRVVSVLT VLHQDWLNGK EYKCKVSNKA
361 LPAPIAKTIS KAKGQPREPQ VYTLPPSREE MTKNQVSLTC LVKGFYPSDI AVEWESNGQP
421 ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW QQGNVFSCSV MHEALKFHYT QKSLSLSPGK
<---
Изобретение относится к биотехнологии, а именно к рекомбинантному плазмидному вектору, обеспечивающему экспрессию и секрецию моноклональных антител, и химерному моноклональному антителу M12B9ch. Описан рекомбинантный плазмидный вектор pVEAL-M12B9ch. Он обеспечивает стабильную экспрессию и секрецию химерного моноклонального антитела M12B9ch против ортопоксвирусов в клетках млекопитающих, имеет нуклеотидную последовательность SEQ ID NO: 2 размером 10399 п.н. Описано рекомбинантное химерное моноклональное scFv-Fc антитело M12B9ch против ортопоксвирусов в клетках млекопитающих, полученное с использованием рекомбинантного плазмидного вектора pVEAL-M12B9ch. Техническим результатом изобретения является получение химерного моноклонального scFv-Fc антитела, нейтрализующего вирус осповакцины с более высокой активностью. 2 н. и 1 з.п. ф-лы, 4 ил., 4 пр.
1. Рекомбинантный плазмидный вектор pVEAL-M12B9ch, обеспечивающий стабильную экспрессию и секрецию химерного моноклонального антитела M12B9ch против ортопоксвирусов в клетках млекопитающих, имеющий нуклеотидную последовательность SEQ ID NO: 2 размером 10399 п.н. и содержащий следующие элементы:
- участок начала репликации ori, имеющий координаты 8101-8689;
- прямой и инвертированный повторы IR/DR-сайты, узнаваемые транспозазой SB100 и имеющие координаты 139-403 и 7317-7612;
- UCOE-элементы, предотвращающие хромосомное «замалчивание» экспрессионной кассеты и имеющие координаты 416-1964 и 5757-7305;
- CMV энхансер с координатами 2108-2487 и CMV промотор с координатами 2488-2699 — наиболее часто используемый промотор для экспрессии генов в клетках млекопитающих;
- Chimeric intron химерный интрон для усиления экспрессии целевого гена, имеющий координаты 2860-2992;
- лидерный пептид V19, обеспечивающий экспорт белка из клетки и имеющий координаты 3110-3153;
- кодон-оптимизированную нуклеотидную последовательность SEQ ID NO: 1, кодирующую полипептид, содержащий домены тяжелой и легкой цепей мышиного антитела М12В9, и имеющую координаты 3161-3907;
- Hinge - междоменный регион человеческого иммуноглобулина IgG1, имеющий координаты 3920-3952;
- домены СН2-СН3 человеческого иммуноглобулина IgG1 () с мутациями M252Y, S254T, Т256Е, Е333А, H433K/N434F, увеличивающими период полураспада антитела in vivo, имеющего координаты 3953-4603;
- участок внутренней посадки рибосомы EMCV IRES с координатами от 4618 до 5192;
- последовательность BleoR, кодирующая фактор устойчивости к антибиотику блеомицину и имеющая координаты от 5197 до 5579;
- последовательность SV40 poly(A) signal для стабилизации мРНК-транскриптов за счет полиаденилирования, имеющая координаты от 5626 до 5747;
- ген устойчивости к антибиотику ампициллину AmpR с координатами от 8860 до 9720 и бактериальный промотор гена устойчивости к ампициллину с координатами от 9721 до 9825.
2. Рекомбинантное химерное моноклональное scFv-Fc антитело M12B9ch против ортопоксвирусов в клетках млекопитающих, полученное с использованием рекомбинантного плазмидного вектора pVEAL-M12B9ch по п. 1, имеющее молекулярную массу ~52 кДа и аминокислотную последовательность SEQ ID NO: 3 полипептида со свойствами вариабельных доменов тяжелой и легкой цепей мышинного иммуноглобулина М12В9, образующего при димеризации химерное моноклональное scFv-Fc антитело M12B9ch.
3. Антитело M12B9ch по п. 2, отличающееся тем, что оно имеет нейтрализующую активность in vitro в отношении вируса осповакцины в концентрации не менее 0,002 мкг/мл.
| Универсальный интеграционный вектор pVEAL и рекомбинантная плазмида pVEAL-15742, обеспечивающая синтез и секрецию scFv-Fc антител ADI-15742 против вируса Эбола в клетках млекопитающих и полученная с использованием вектора pVEAL | 2020 |
|
RU2749459C1 |
| US 20090155250 A1, 18.06.2009 | |||
| WO 2020132382 A1, 25.06.2020 | |||
| Matho MH, Schlossman A, Meng X, Benhnia MREI, KaeverT, et al | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
Авторы
Даты
2023-02-14—Публикация
2021-11-22—Подача