Настоящее изобретение относится к антигенсвязывающей молекуле (АВМ), которая содержит последовательности доменов человеческих антител, в частности, содержащие когнатный димер легкой цепи антитела, состоящей из доменов антитела VL и CL, связанной с тяжелой цепью антитела, содержащей по меньшей мере домены антитела VH и СН1, причем эта связь осуществляется за счет спаривания доменов VL и VH и доменов CL и СН1, при этом предпочтительное спаривание поддерживается определенными точечными мутациями в доменах CL и СН1.
УРОВЕНЬ ТЕХНИКИ
Моноклональные антитела широко применяются в качестве терапевтических антигенсвязывающих молекул. Основная структура антитела будет описана в настоящем документе с использованием интактного иммуноглобулина IgG1 в качестве примера.
Две идентичные тяжелые (Н) и две идентичные легкие (L) цепи объединяются с образованием Y-образной молекулы антитела. Каждая тяжелая цепь содержит четыре домена. Амино-концевые вариабельные домены (VH) находятся на концах Y. За ними располагаются три константных домена: CH1, СН2 и карбокси-концевой СН3, у основания стебля Y. Короткий участок, перемычка, соединяет вариабельную и константную области тяжелой цепи. Шарнирный участок соединяет СН2 и СН3 (фрагмент Fc) с остальной частью антитела (фрагменты Fab). Один фрагмент Fc и два идентичных фрагмента Fab могут быть получены с помощью протеолитического расщепления шарнирного участка в интактной молекуле антитела. Легкие цепи состоят из двух доменов: вариабельного (VL) и константного (CL), разделенных перемычкой.
Дисульфидные связи в шарнирной области соединяют две тяжелые цепи. Легкие цепи связаны с тяжелыми цепями дополнительными дисульфидными связями. Asn-связанные углеводные фрагменты прикреплены в разных положениях в константных доменах в зависимости от класса иммуноглобулина. В случае IgG1 две дисульфидные связи в шарнирной области, между парами Cys235 и Cys238, соединяют две тяжелые цепи. Легкие цепи связаны с тяжелыми цепями двумя дополнительными дисульфидными связями, между Cys220 (нумерация в соответствии с индексом ЕС) или Cys233 (нумерация в соответствии с Kabat) в доменах СН1 и Cys214 в доменах CL (индекс ЕС и нумерация в соответствии с Kabat). Углеводные фрагменты прикреплены к Asn306 каждого СН2 с образованием значительного выпячивания в стебле Y.
Эти признаки имеют принципиальные функциональные последствия. Вариабельные области как тяжелой (VH), так и легкой цепей (VL) лежат в N-концевой области, т.е. на «концах» Y, где они расположены так, чтобы реагировать с антигеном. Этот конец молекулы является стороной, на которой расположен N-концевой участок аминокислотной последовательности. Стебель Y выступает таким образом, чтобы эффективно опосредовать эффекторные функции, такие как активация комплемента и взаимодействие с рецепторами Fc, или АЗКЦ (ADCC, антителозависимая клеточная цитотоксичность) и АЗКФ (ADCP, антителозависимый клеточный фагоцитоз). Его домены СН2 и СН3 выпячиваются, чтобы облегчить взаимодействие с эффекторными белками. С-концевой участок аминокислотной последовательности расположен на противоположной стороне конца, который можно назвать «основанием» Y.
В антителах встречаются два типа легкой цепи, называемые лямбда (λ) и каппа (κ). Определенный иммуноглобулин имеет либо κ-цепи, либо λ-цепи, но никогда не имеет по одной каждого типа. Не было обнаружено функциональных различий между антителами, имеющими λ-легкую цепь или κ-легкую цепь.
Каждый домен в молекуле антитела имеет сходную структуру из двух бета-складчатых слоев, плотно прилегающих друг к другу в сжатой антипараллельной бета-складчатой конфигурации. Эта консервативная структура называется иммуноглобулиновой укладкой цепи. Иммуноглобулиновая укладка цепи константных доменов содержит трехцепочечный слой, прилегающий к четырехцепочечному слою. Укладка цепи стабилизируется водородными связями между бета-цепями каждого складчатого слоя, гидрофобными связями между остатками противоположных складчатых слоев внутри и дисульфидной связью между слоями. Трехцепочечный складчатый слой содержит цепи С, F и G, а четырехцепочечный складчатый слой содержит цепи А, В, Е и D. Буквы от А до G обозначают последовательные положения бета-цепей вдоль аминокислотной последовательности иммуноглобулиновой укладки цепи.
Укладка вариабельных доменов имеет 9 бета-цепей, расположенных в двух складчатых слоях из 4 и 5 цепей. Пятицепочечный слой структурно гомологичен трехцепочечному слою константных доменов, но содержит дополнительные цепи С и С''. Остальные цепи (А, В, С, D, Е, F, G) имеют аналогичную топологию и сходную структуру, как и их партнеры в иммуноглобулиновой укладке цепи константного домена. Дисульфидная связь соединяет цепи В и F в противоположных слоях, как и в константных доменах.
Вариабельные домены как легкой, так и тяжелой цепей иммуноглобулина содержат три гипервариабельные петли или области, определяющие комплементарность (CDR). Три CDR V-домена (CDR1, CDR2, CDR3) кластеризуются на одном конце бета-складчатой конфигурации. CDR представляют собой петли, которые соединяют бета-цепи В-С, С'-С'' и F-G иммуноглобулиновой укладки цепи. Остатки в CDR варьируются в разных молекулах иммуноглобулинов, придавая каждому антителу специфичность в отношении антигена.
Домены VL и VH на концах молекул антител плотно упакованы так, что 6 CDR (по 3 на каждом домене) взаимодействуют при построении поверхности (или полости) для антигенспецифичного связывания. Соответственно, природный антигенсвязывающий сайт антитела состоит из петель, которые соединяют цепи В-С, С'-С'' и F-G вариабельного домена легкой цепи и цепи В-С, С'-С'' и F-G вариабельного домена тяжелой цепи.
Петли, которые не являются CDR-петлями в нативном иммуноглобулине или не являются частью антигенсвязывающего кармана, определенного петлями CDR, и необязательно не являются смежными петлями в пределах области CDR-петли, не способны к специфичному связыванию антигена или эпитопа, но вносят вклад в правильное сворачивание всей молекулы иммуноглобулина и/или ее эффекторные или другие функции и поэтому называются структурными петлями.
В документах предшествующего уровня техники показано, что до настоящего времени иммуноглобулиноподобный каркас применяли для манипуляций над существующим антигенсвязывающим сайтом, придавая тем самым новые свойства связывания. В большинстве случаев области CDR были модифицированы для связывания антигена, другими словами, в случае иммуноглобулиновой укладки цепи только природный антигенсвязывающий сайт был модифицирован для того чтобы изменить его аффинность или специфичность связывания. Существует огромное количество литературы, в которой описаны различные форматы таких иммуноглобулинов, подвергшихся манипуляциям, часто экспрессируемых в форме одноцепочечных фрагментов Fv (scFv) или фрагментов Fab, либо экспонируемых на поверхности частиц фага, либо экспрессируемых в растворимой форме в различных прокариотических или эукариотических системах для экспрессии.
В настоящее время разрабатываются конструкции антител для улучшенных терапевтических средств, распознающих две различные мишени.
В Davis et al (Protein Engineering, Design & Selection 2010, 23(4) 195-202) описана платформа гетеродимерных Fc, которая позволяет конструировать биспецифические и асимметричные гибридные белки с использованием гетеродимеров СН3, полученных с помощью технологии конструирования доменов с обменом цепей (SEED). Эти производные доменов СН3 человеческих IgG и IgA создают комплементарные гетеродимеры человеческих СН3-SEED, которые состоят из чередующихся сегментов последовательностей IgA и IgG человека. Модификация с помощью SEED дополнительно описана в WO 2007/110205 A2 и ЕР 1999154 В1. В WO 2010/136172 A1 раскрыты три- или тетраспецифические антитела, которые содержат один или два одноцепочечных Fab, соединенных с С-концом Fc части антитела.
В Beck et al. (Nature Reviews Immunology, vol. 10, no. 5, 1 May 2010, pp 345-352) описаны терапевтические антитела следующего поколения и, в частности, сообщается о различных типах биспецифических антител.
В Ridgway et al. (Protein Engineering, vol. 9, no. 7, 1996, pp 617-621) описано конструирование типа «выступ-во-впадину» доменов СН3 антител для гетеродимеризации тяжелых цепей.
В Von Kreudenstein et al. (Landes Bioscience, vol. 5, no. 5, 2013, pp 646-654) описан каркас биспецифического антитела на основе гетеродимерной области Fc, модифицированной для стабильности.
В Liu et al. (Journal Of Biological Chemistry 2015, 290:7535-7562) описана стратегия получения моновалентных биспецифических гетеродимерных антител IgG с помощью электростатического механизма. Гетеродимерные молекулы IgG, происходящие из антител к HER2 и к EGFR, с правильными спариваниями легкой цепи (LC) и тяжелой цепи (НС) получали с помощью кратковременно и стабильно трансфецированных клеток млекопитающих. Специфическое спаривание LC и НС инициировали путем замены полярных или гидрофобных остатков на контактных поверхностях VH-VL и CH1-CL. Каждый из модифицированных вариантов характеризовался рядом точечных мутаций, в том числе в доменах VH и VL. Кроме того, точечные мутации конструировали в домене СН1, например, K147D, и в домене CL (С-каппа или Сκ), например, Т180K (нумерация в соответствии с индексом ЕС). Некоторые варианты содержали, среди прочего, точечные мутации в положениях 147 в домене СН1 и 180 или 131 в домене С-каппа.
В WO 2014/081955 также раскрыты такие гетеродимерные антитела, содержащие одну или более замен в каждом из следующих доменов: первый и второй домены СН3, домен СН1, домен CL, домен VH и домен VL.
В Lewis et al. (Nature Biotechnology 2014, 32: 191-198) описано получение биспецифических антител IgG с помощью основанного на структуре дизайна ортогональной контактной поверхности Fab. Были получены биспецифические IgG с улучшенным спариванием HC-LC. Было обнаружено, что вариабельные домены играют решающую роль в специфической сборке тяжелых цепей и легких цепей. Точечные мутации в каждом из доменов VH, VL, СН1 и CL применяли в двух различных конструкциях. Одна из конструкций содержала, среди прочего, точечные мутации в положениях 146 в домене СН1 и 129 в домене С-лямбда (нумерация в соответствии с Kabat).
В Dillon et al. (MAbs 2016; DOI: 10.1080/19420862.2016.1267089) описано получение биспецифического IgG разных изотипов и видового происхождения в отдельных клетках млекопитающих, а также конструкции, которые облегчают селективную сборку плеч Fab в сочетании с ранее описанными мутациями типа «выступы-во-впадины» для предпочтительной гетеродимеризации тяжелых цепей.
Биспецифические антитела описанных выше конструкций обязательно совмещают ряд точечных мутаций для стабилизации структуры IgG, включая преобладающие точечные мутации, расположенные в доменах VH и VL. Желательным будет конструирование биспецифических антител, в которых правильное спаривание уже поддерживается точечными мутациями только в доменах СН1 и CL.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение улучшенного спаривания тяжелой и легкой цепей антитела, которое поддерживает правильное спаривание НС и LC, оставляя при этом каркас доменов VH и VL без изменений. Такое улучшенное спаривание будет облегчать получение биспецифических антител.
Цель достигается с помощью предмета настоящего изобретения.
В соответствии с настоящим изобретением предложена антигенсвязывающая молекула (АВМ), содержащая когнатный димер LC/HC легкой цепи антитела (LC), состоящей из домена антитела VL и CL, связанной с тяжелой цепью антитела (НС), содержащей по меньшей мере домен антитела VH и СН1, причем эта связь осуществляется за счет спаривания доменов VL и VH и доменов CL и СН1, при этом аминокислоты в положении 18 в домене CL и в положении 26 в домене СН1 имеют противоположную полярность, при этом нумерация приведена в соответствии с IMGT.
В частности, когнатный димер LC/HC характеризуется когнатными доменами, которые спарены с образованием когнатной пары (доменов). Следует понимать, что димер LC/HC является когнатным, поскольку мономерные домены CL и СН1 являются когнатными или совпадающими частями, предпочтительно распознающими друг друга с образованием пары доменов CL и СН1, по сравнению с доменами дикого типа. В частности, домен CL, описанный в настоящем документе, предпочтительно спаривается с когнатным доменом СН1; и домен СН1, описанный в настоящем документе, предпочтительно спаривается с когнатным доменом CL.
В соответствии с конкретным аспектом АВМ характеризуется когнатными доменами антитела CL и СН1, которые предпочтительно спариваются друг с другом за счет сил притяжения и предпочтительно не спариваются с другими партнерскими доменами, которые не являются когнатными или имеют дикий тип, из-за сил отталкивания. Соответственно, ошибочное спаривание партнерских доменов антитела, которые представляют собой домены антитела дикого типа или которые были превращены в некогнатные (отталкивающиеся для уменьшения вероятности сборки) за счет соответствующих точечных мутаций, значительно снижается.
В частности, когнатные домены CL и СН1 характеризуются противоположной полярностью в указанных положениях аминокислот, в частности, так, что
a) остаток аминокислоты в положении 18 в домене CL имеет положительную полярность, в частности, любой из R, Н или K; и остаток аминокислоты в положении 26 в домене СН1 имеет отрицательную полярность, в частности, любой из D или Е; или
b) остаток аминокислоты в положении 18 в домене CL имеет отрицательную полярность, в частности, любой из D или Е; и остаток аминокислоты в положении 26 в домене СН1 имеет положительную полярность, в частности, любой из R, Н или K.
В частности, АВМ содержит одну или две точечные мутации, которые представляют собой любую одну или обе из точечных мутаций в положении 18 в домене CL и точечных мутаций в положении 26 в домене СН1.
Если не указано иное, положения в настоящем документе пронумерованы в соответствии с системой IMIGT (Lefranc et al., 1999, Nucleic Acids Res. 27: 209-212). Нумерация положений, указанных в формуле изобретения, соответствует нумерации в соответствии с Kabat и индексу ЕС из Kabat, как указано в следующей ниже таблице. Объяснение системы нумерации согласно Kabat можно найти в Kabat, ЕА, et al, Sequences of proteins of immunological interest (NIH publication no. 91-3242, 5th edition (1991)).

Указанные положения неожиданно оказались доминантными при конструировании плеча Fab, причем НС и LC собираются (спариваются) с улучшенной аффинностью. Конструкции предшествующего уровня техники включали различные пары точечных мутаций СН1 и CL, расположенных в разных положениях, которые были сконструированы помимо доминантных точечных мутаций VH и VL. Когнатную пару мутированных доменов CL и СН1 (под которыми в настоящем документе понимают когнатные домены или когнатную пару) предпочтительно получают путем установления противоположных полярностей в указанных положениях CL и СН1. В то же время ошибочное когнатное спаривание или спаривание с доменами CL и СН1 дикого типа заметно снижено.
В частности, АВМ характеризуется, как указано далее:
А
a) домен CL представляет собой С-каппа, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 1, которая содержит по меньшей мере точечную мутацию Т18Х, где X представляет собой любой из R, Н или K; и
b) домен СН1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 3, которая содержит по меньшей мере точечную мутацию K26Х, где X представляет собой любой из D или Е;
или В
a) домен CL представляет собой С-лямбда, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 2, которая содержит по меньшей мере точечную мутацию K18Х, где X представляет собой любой из D или Е; и
b) домен СН1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 3, где K в положении 26 не заменен какой-либо другой аминокислотой, или которая содержит по меньшей мере точечную мутацию K26Х, где X представляет собой любой из R или Н;
или С
a) домен CL представляет собой С-лямбда, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 2, где K в положении 18 не заменен какой-либо другой аминокислотой, или которая содержит по меньшей мере точечную мутацию K18Х, где X представляет собой любой из R или Н; и
b) домен СН1 содержит аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 3, которая содержит по меньшей мере точечную мутацию K26Х, где X представляет собой любой из D или Е;
при этом нумерация приведена в соответствии с IMIGT.
В частности, домены CL и СН1 происходят из человека, в частности, из молекулы человеческого IgG или IgG1, в частности, представляют функционально активные варианты, характеризующиеся по меньшей мере 90% идентичностью последовательности с природной человеческой последовательностью и одной или более точечными мутациями, такими как те, которые описаны в настоящем документе, и, в частности, дополнительно характеризуются структурой бета-складчатой конфигурации домена антитела, которая напоминает структуру соответствующих доменов в структуре человеческого IgG, IgM или IgE, в частности, в структуре человеческого IgG1.
Функционально активные варианты любого из доменов С-каппа, С-лямбда или СН1, описанных в настоящем документе, в частности, характеризуются структурой домена антитела, способной к спариванию с соответствующим совпадающим доменом антитела, в частности, где
А
a) вариант домена CL представляет собой вариант С-каппа, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 1 и которая содержит точечную мутацию Т18Х, где X представляет собой любой из R, Н или K; и способен к спариванию с
b) доменом СН1, состоящим из аминокислотной последовательности, определенной как SEQ ID 3, за исключением точечной мутации K26Х, где X представляет собой любой из D или Е;
или В
a) вариант домена CL представляет собой вариант С-лямбда, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 2 и которая содержит точечную мутацию K18Х, где X представляет собой любой из D или Е; и способен к спариванию с
b) доменом СН1, состоящим из аминокислотной последовательности, определенной как любая из SEQ ID 3 или SEQ ID 3 за исключением точечной мутации K26Х, где X представляет собой любой из R или Н;
или С
a) вариант домена CL представляет собой вариант С-лямбда, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности SEQ ID 2, где K в положении 18 не заменен какой-либо другой аминокислотой, или которая содержит точечную мутацию K18Х, где X представляет собой любой из R или Н; и способен к спариванию с
b) доменом СН1, состоящим из аминокислотной последовательности, определенной как SEQ ID 3, за исключением точечной мутации K26Х, где X представляет собой любой из D или Е.
В частности, аминокислотная последовательность С-каппа (также упоминаемая в настоящем документе как дикий тип или исходная) определена как SEQ ID 1.
В частности, аминокислотная последовательность С-лямбда (также упоминаемая в настоящем документе как дикий тип или исходная) определена как SEQ ID 2.
В частности, аминокислотная последовательность СН1 (также упоминаемая в настоящем документе как дикий тип или исходная) определена как SEQ ID 3.
В частности, домен CL характеризуется последовательностью CL человеческого IgG1 или ее модифицированным функционально активным вариантом, содержащим одну или более точечных мутаций, предпочтительно до 10 точечных мутаций, в частности, любую из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 точечных мутаций.
В частности, домен СН1 характеризуется последовательностью СН1 человеческого IgG1 или ее модифицированным функционально активным вариантом, содержащим одну или более точечных мутаций, предпочтительно до 10 точечных мутаций, в частности, любую из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 точечных мутаций.
В частности, любой или каждый из доменов CL и СН1 характеризуется соответствующей последовательностью человеческого IgG1 или ее модифицированным функционально активным вариантом, содержащим одну или более точечных мутаций, предпочтительно до 10 точечных мутаций, в частности, любую из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 точечных мутаций.
В частности, димер содержит по меньшей мере один междоменный дисульфидный мостик между доменами CL и СН1. В частности, междоменные дисульфидные мостики соединяют Cys220 (нумерация в соответствии с индексом ЕС) или Cys233 (нумерация в соответствии с Kabat) в доменах СН1 и Cys214 в доменах CL (индекс ЕС и нумерация в соответствии с Kabat).
В частности, домен CL дополнительно содержит точечную мутацию F7X, где X представляет собой любой из S, А или V, и домен СН1 дополнительно содержит точечную мутацию A20L, при этом нумерация приведена в соответствии с IMGT. Такие дополнительные точечные мутации дополнительно поддерживают предпочтительное спаривание когнатных доменов CL и СН1.
В частности, домены VL и VH в АВМ не содержат какую-либо точечную мутацию, изменяющую полярность аминокислоты в области контактной поверхности, которая обеспечивает междоменный контакт при спаривании доменов VL и VH с образованием антигенсвязывающего сайта.
В частности, АВМ содержит функциональный антигенсвязывающий сайт, состоящий из пары доменов VH/VL, способный связывать мишень с высокой аффинностью и KD, которая меньше любого из значений 10-6 М, 10-7 М, 10-8 М, 10-9 М или 10-10 М. В частности, АВМ представляет собой биспецифическое или гетеродимерное антитело, нацеленное на два разных антигена, причем каждый из антигенов распознается антителом с KD, которая меньше любого из значений 10-6 М, 10-7 М, 10-8 М, 10-9 М или 10-10 M.
В частности, НС дополнительно содержит по меньшей мере один домен СН2 и по меньшей мере один домен СН3. В частности, НС удлинена за счет домена СН2 и дополнительно удлинена за счет домена СН3, а именно последовательность доменов СН2-СН3 дополнительно спарена с другой цепью антитела, содержащей домен СН2-СН3, так, чтобы получить область Fc, состоящую из димера доменов СН2-СН3 и соответствующих цепей. В частности, НС удлинена за счет гибридизации домена СН2 с С-концом домена СН1 с применением линкера или шарнирной области или без них. В частности, НС дополнительно удлинена за счет гибридизации домена СН3 с С-концом домена СН2 с применением линкера или без него. В некоторых случаях НС дополнительно удлинена за счет гибридизации домена СН4 с С-концом домена СН3 с применением линкера или без него.
В частности, АВМ содержит шарнирную область, предпочтительно человеческую шарнирную область, например, шарнирную область человеческого IgG1, например, содержащую или состоящую из аминокислотной последовательности, определенной как SEQ ID 4.
Связь доменов, в частности, осуществляется с помощью рекомбинантной гибридизации или химической связи. Специфическая связь может быть получена за счет связывания С-конца одного домена с N-концом другого домена, например, когда один или более остатков аминокислот в концевых областях удалены, чтобы укоротить домен, или добавлены, чтобы увеличить гибкость доменов.
В частности, укороченная последовательность домена содержит делецию С-концевой и/или N-концевой области, например, для удаления по меньшей мере 1, 2, 3, 4 или 5, до 6, 7, 8, 9 или 10 аминокислот.
В частности, можно применять соединяющую последовательность, которая представляет собой линкер или шарнирную область или по меньшей мере часть шарнирной области иммуноглобулина, например, пептидный линкер, например, содержащий по меньшей мере 1, 2, 3, 4 или 5 аминокислот, до 10, 15 или 20 аминокислот. Соединяющая последовательность также называется в настоящем документе «соединение». Домен может быть удлинен с помощью линкера, например, за счет аминокислотной последовательности, которая происходит из N- или С-концевой области домена иммуноглобулина, которая в нативных условиях будет расположена рядом с доменом, так, чтобы включать нативное соединение между доменами. Согласно другому варианту линкер может содержать аминокислотную последовательность, происходящую из шарнирной области. Однако линкер также может представлять собой искусственную последовательность, например, состоящую из последовательных аминокислот Gly и/или Ser, предпочтительно длиной от 5 до 20 аминокислот, предпочтительно от 8 до 15 аминокислот.
В соответствии с конкретным аспектом АВМ представляет собой антитело или иммуноглобулин, содержащий структуру природного иммуноглобулина или иммуноглобулиноподобного каркаса, причем АВМ характеризуется по меньшей мере одним (предпочтительно двумя) антигенсвязывающим(ими) сайтом(ами) и структурой, состоящей из доменов антитела, соединенных с тяжелыми и легкими цепями подходящими соединяющими последовательностями или без них, при этом НС димеризуется с LC с образованием по меньшей мере одного антигенсвязывающего сайта и при этом необязательно две НС димеризуются с образованием области Fc.
В частности, АВМ представляет собой любой из фрагмента антитела Fab или (Fab)2 или полноразмерное антитело, содержащее часть Fc или область Fc, причем предпочтительно АВМ представляет собой полноразмерное антитело IgG, IgM или IgE, в частности, любое из IgG1, IgG2, IgG3 или IgG4. В частности, АВМ содержит один или два плеча Fab или фрагмента Fab (части Fab) в любом подходящем порядке. В соответствии с конкретными вариантами реализации АВМ даже может содержать более двух плеч Fab, например, три или четыре плеча Fab, причем по меньшей мере одно или только одно из плеч Fab содержит когнатную пару LC/HC и когнатные домены CL и СН1, описанные в настоящем документе. В соответствии с конкретным вариантом реализации другое плечо Fab содержит домены CL и СН1 дикого типа (природные).
В соответствии с конкретным вариантом реализации АВМ содержит только один когнатный димер LC/HC, причем НС дополнительно димеризуется с цепью Fc, содержащей СН2-СН3, необязательно дополнительно содержащей СН4, с получением области Fc. Такая АВМ представляет собой, в частности, моновалентное моноспецифическое антитело, характеризующееся только одним плечом Fab и областью Fc.
В соответствии с другим конкретным вариантом реализации АВМ содержит по меньшей мере два димера LC/HC, причем только один из димеров LC/HC характеризуется когнатным димером LC/HC и когнатными доменами CL и СН1 (т.е. когнатной парой CL/CH1), описанными в настоящем документе. Согласно другому варианту АВМ состоит из первого димера LC/HC, содержащего первый когнатный димер LC/HC, содержащий первую когнатную пару CL/CH1, характеризующуюся точечными мутациями, описанными в настоящем документе, и второй когнатный димер LC/HC, содержащий вторую когнатную пару CL/CH1, характеризующуюся точечными мутациями, описанными в настоящем документе, которые отличаются от мутаций в первой когнатной паре CL/CH1, так, что первые когнатные домены CL и СН1 предпочтительно спариваются друг с другом, и вторые когнатные домены CL и СН1 предпочтительно спариваются друг с другом, однако домен CL первой когнатной пары CL/CH1 предпочтительно не спаривается (или даже отталкивается от него) с доменом СН1 второй когнатной пары CL/CH1, и домен СН1 первой когнатной пары CL/CH1 предпочтительно не спаривается (или даже отталкивается от него) с доменом CL второй когнатной пары CL/CH1.
В соответствии с конкретным вариантом реализации АВМ содержит два разных плеча Fab, что обеспечивает две разные структуры Fv, каждая из которых имеет специфические характеристики связывания. В частности, АВМ представляет собой гетеродимерное или биспецифическое антитело, нацеленное на два разных антигена или два разных эпитопа антигена.
Согласно настоящему изобретению также предложено гетеродимерное или биспецифическое антитело, содержащее первое и второе плечи Fab, распознающие разные антигены или эпитопы, причем только одно из первого и второго плеч Fab содержит когнатный димер LC/HC АВМ, описанный в настоящем документе. В частности, гетеродимерное антитело представляет собой биспецифическое антитело или иммуноглобулин или его антигенсвязывающий фрагмент, например, биспецифический полноразмерный иммуноглобулин или (Fab)2.
В частности, АВМ представляет собой биспецифическое антитело, причем первая мишень представляет собой любой из CD3, CD16 или Her2neu, и вторая мишень представляет собой EGFR.
Под плечом Fab в настоящем документе понимают конкретно димер НС, состоящей из последовательности домена VH-CH1, и LC, состоящей из последовательности домена VL-CL (каппа или лямбда), с дисульфидными мостиками или без них, шарнирный домен и/или линкерные последовательности, соединяющие домены антитела. Под плечом Fab обычно понимают фрагмент Fab (или часть Fab), отщепленный от антитела. Плечо Fab, в частности, характеризуется только одним антигенсвязывающим сайтом, образованным за счет спаривания доменов VH и VL, который способен связывать мишень только моноспецифично и моновалентно.
В частности, только одно из первого и второго плеч Fab в биспецифическом антителе содержит:
а) точечную мутацию F7X в домене CL, где X представляет собой любой из S, А или
V; и
b) точечную мутацию A20L в домене СН1;
при этом нумерация приведена в соответствии с IMIGT.
В настоящем документе под такими точечными мутациями в положениях 7 и 20, указанными выше, понимают поддерживающие точечные мутации, которые фактически не изменяют полярность остатка аминокислоты, но стерические характеристики которых соответствуют размеру эквивалентного аминокислотного остатка.
В частности, домен CL, содержащий указанную выше поддерживающую точечную мутацию F7X, где X представляет собой любой из S, А или V, притягивает и предпочтительно спаривается с партнерским доменом СН1, содержащим поддерживающую точечную мутацию A20L, но непредпочтительно спаривается с доменом СН1 дикого типа или доменом СН1, который не содержит точечную мутацию A20L.
В частности, домен СН1, содержащий указанную выше поддерживающую точечную мутацию A20L, притягивает и предпочтительно спаривается с партнерским доменом CL, содержащим указанную выше поддерживающую точечную мутацию F7X, где X представляет собой любой из S, А или V, но непредпочтительно спаривается с доменом CL дикого типа или доменом CL, который не содержит точечную мутацию F7X, указанную выше, при этом X представляет собой любой из S, А или V.
В частности, гетеродимерное антитело характеризуется тем, что:
А
a) указанное первое плечо Fab содержит когнатный димер LC/HC, описанный в настоящем документе, который конкретно характеризуется точечными мутациями, определенными выше, в частности, одной или двумя точечными мутациями, обеспечивающими остаток аминокислоты в положении 18 в домене CL и остаток аминокислоты в положении 26 в домене СН1, которые имеют противоположную полярность, причем домены CL и СН1 дополнительно содержат поддерживающие точечные мутации, определенные выше, в частности, точечную мутацию F7X в домене CL, при этом X представляет собой любой из S, А или V; и точечную мутацию A20L в домене СН1; и
b) указанное второе плечо Fab не содержит какую-либо из точечных мутаций а), или В
а) указанное первое плечо Fab содержит когнатный димер LC/HC, описанный в настоящем документе, который конкретно характеризуется точечными мутациями, определенными выше, в частности, одной или двумя точечными мутациями, обеспечивающими остаток аминокислоты в положении 18 в домене CL и остаток аминокислоты в положении 26 в домене СН1, которые имеют противоположную полярность, причем домены CL и СН1 также не содержат поддерживающие точечные мутации, определенные выше, в частности, точечную мутацию F7X в домене CL, где X представляет собой любой из S, А или V; и точечную мутацию A20L в домене СН1; и
b) указанное второе плечо Fab содержит поддерживающие точечные мутации, определенные выше, в частности, точечную мутацию F7X в домене CL, где X представляет собой любое из S, А, или V; и точечную мутацию A20L в домене СН1.
Такая биспецифическая конструкция А, в частности, характеризуется точечными мутациями, описанными в настоящем документе, для предпочтительного спаривания когнатных доменов CL и СН1 когнатного димера LC/HC, которые модифицированы только в одном из двух плеч Fab (т.е. в первом плече Fab), что ведет к неблагоприятному спариванию или прикреплению к любой из НС или LC другого плеча Fab (т.е. второго плеча Fab).
Такая биспецифическая конструкция В, в частности, характеризуется первым плечом Fab, которое содержит когнатный димер LC/HC, описанный в настоящем документе, характеризующийся одной или двумя точечными мутациями в положении 18 в домене CL и в положении 26 в домене СН1, с получением остатков аминокислот в этих положениях, которые имеют противоположную полярность, и вторым плечом Fab, которое содержит поддерживающие точечные мутации, таким образом, что
a) НС первого плеча Fab благоприятно спаривается с LC первого плеча Fab или прикрепляется к ней, и неблагоприятно спаривается с LC второго плеча Fab или прикрепляется к ней; и
b) LC первого плеча Fab благоприятно спаривается с НС первого плеча Fab или прикрепляется к ней, и неблагоприятно спаривается с НС второго плеча Fab или прикрепляется к ней;
и, наоборот, это означает, что
c) НС второго плеча Fab благоприятно спаривается с LC второго плеча или прикрепляется к ней, и неблагоприятно спаривается с LC первого плеча Fab или прикрепляется ней; и
d) LC второго плеча Fab благоприятно спаривается с НС второго плеча Fab или прикрепляется к ней, и неблагоприятно спаривается с НС первого плеча Fab или прикрепляется к ней.
В соответствии с конкретным вариантом реализации оба, первое и второе, плеча Fab содержат одну или две точечные мутации в положении 18 в домене CL и в положении 26 в домене СН1 с получением в этих положениях остатков аминокислот, которые имеют противоположную полярность, при этом также точечные мутации в первом и втором плечах Fab являются различными, с получением
a) первого плеча Fab, которое содержит домен CL, в котором остаток аминокислоты в положении 18 имеет положительную полярность, специфически распознающий домен СН1, в котором остаток аминокислоты в положении 26 имеет отрицательную полярность; и
b) второго плеча Fab, которое содержит домен CL, в котором остаток аминокислоты в положении 18 имеет отрицательную полярность, специфический распознающий домен СН1, в котором остаток аминокислоты в положении 26 имеет положительную полярность;
при этом необязательно поддерживающие точечные мутации находятся как в первом плече Fab, так и во втором плече Fab.
Дополнительные варианты реализации относятся к биспецифическим конструкциям, в которых:
a) первое плечо Fab содержит домен CL, в котором остаток аминокислоты в положении 18 имеет положительную полярность, специфически распознающий домен СН1, в котором остаток аминокислоты в положении 26 имеет отрицательную полярность; и
b) второе плечо Fab, в котором остаток аминокислоты в положении 18 в домене CL и/или остаток аминокислоты в положении 26 в домене СН1 не имеет заряда, в частности, любой из N, С, Q, G, S, Т, W или Y; или является неполярным, в частности, любой из А, I, L, М, F, Р или V;
при этом необязательно поддерживающие точечные мутации находятся как в первом плече Fab, так и во втором плече Fab.
В соответствии с конкретным аспектом АВМ, описанная в настоящем документе, в частности, гетеродимерное антитело, описанное в настоящем документе, содержит две НС, каждая из которых содержит домен СН2 и СН3 и необязательно домен СН4, причем НС димеризуются с образованием области Fc.
Область Fc, в частности, характеризуется димером цепей Fc, каждая из которых характеризуется тем, что содержит цепь доменов антитела СН2-СН3, причем димер может представлять собой гомодимер или гетеродимер, например, первая цепь Fc отличается от второй цепи Fc по меньшей мере одной точечной мутацией в доменах СН2 и/или СН3.
В частности, область Fc содержит два домена СН3, которые модифицированы для введения и/или характеризуются одним или более из следующего:
a) гетеродимеры СН3 с доменом, сконструированным путем обмена цепей (SEED), которые состоят из чередующихся сегментов последовательностей СН3 человеческого IgA и IgG;
b) одна или более мутаций типа «выступ-во-впадину», предпочтительно любая из T366Y/Y407'T, F405A/T394'W, T366Y:F405A/T394'W:Y407'T, T366W/Y407'A и S354C:T366W/Y349'C:T366'S:L368A:Y407'V;
c) остаток цистеина в первом домене СН3, который ковалентно соединен с остатком цистеина во втором домене СН3 с введением междоменного дисульфидного мостика, предпочтительно соединяющего С-конец обоих доменов СН3;
d) одна или более мутаций, в случае которых отталкивающий заряд подавляет образование гетеродимера, предпочтительно любая из: K409D/D399'K, K409D/D399'R, K409E/D399'K, K409E/D399'R, K409D:K392D/D399'K:E356'K или K409D:K392D:K370D/ D399'K:E356'K:E357'K; и/или
e) одна или более мутаций, отобранных для образования гетеродимера и/или термостабильности, предпочтительно любая из:

при этом нумерация соответствует индексу ЕС из Kabat.
Такие мутации СН3 конструируют для получения двух разных цепей Fc и НС (отличающихся по меньшей мере разной последовательностью доменов СН3), соответственно, которые предпочтительно спариваются друг с другом с получением гетеродимера цепей Fc или НС, что существенно уменьшает тенденцию к получению гомодимера НС, т.е. димера двух НС с одинаковой последовательностью.
В описании точечных мутаций СН3, описанных в настоящем документе, «косая черта» разграничивает точечные мутации на одной цепи или одном домене от точечных мутаций из другой цепи или другого домена соответствующей пары; «отступ» в нумерации положений аминокислот обозначает вторую цепь или димер гетеродимера. «Двоеточие» определяет комбинацию точечных мутаций на одной из цепей или доменов, соответственно.
Также можно применять любую из мутаций, отобранных для образования гетеродимера и/или термостабильности, упомянутых выше, или дополнительных мутаций в соответствии с раскрытием Von Kreudenstein et al. (Landes Bioscience, vol. 5, no. 5, 2013, pp 646-654).
Предпочтительно на одной цепи или домене конструируют мутацию (i) «выступ»; или (ii) «впадина», или (iii) мутации «выступ» и «впадина», и на другой цепи гетеродимера конструируют партнерскую мутацию (i) «впадина» или (ii) «выступ», или (iii) мутации «впадина» и «выступ».
В частности, пара доменов СН3, содержащая один или два модифицированных домена СН3, может содержать более одного (дополнительного) междоменного дисульфидного мостика, например, 2 или 3, соединяющих пару из двух доменов СН3.
В частности, различные мутации (в соответствии с а) выше) конструируют в обоих доменах СН3 соответствующей пары доменов СН3 для получения когнатной (совпадающей) пары, причем один домен содержит стерическую модификацию контактной поверхности в области бета-складчатого слоя, которая предпочтительно прикреплена к соответствующей контактной поверхности другого домена за счет комплементарной стерической модификации. Такие стерические модификации в основном обусловлены различными остатками аминокислот и боковыми цепями, например, для получения структуры «выступ» или «впадина», которые комплементарны друг другу с образованием димера «выступ-во-впадину».
В соответствии с конкретным аспектом каждый из доменов СН3 в области Fc относится к типу IgG с аминокислотной последовательностью, определенной как SEQ ID 5 или функциональный вариант SEQ ID 5, который модифицирован для обмена цепей путем включения по меньшей мере одного бета-цепочечного сегмента IgA, содержащего по меньшей мере 2 аминокислоты в длину, и области Fc предпочтительно содержат когнатную пару доменов СН3 за счет спаривания сегмента IgA первого домена СН3 с сегментом IgA второго домена СН3. Такие домены СН3 после обмена цепями, в частности, могут содержать чередующиеся сегменты аминокислотных последовательностей IgA и IgG, например, могут содержать по меньшей мере 1, 2, 3, 4 или 5 разных сегментов IgA, каждый из которых расположен в разных положениях и отделен друг от друга сегментом, отличным от сегмента IgA, например, сегментами IgG.
В соответствии с конкретным аспектом АВМ представляет собой компетентное по эффекторной функции антитело, содержащее сайт связывания рецептора Fc-гамма и/или сайт связывания C1q, необязательно в области Fc.
В частности, антитело характеризуется любым из таких видов активности как АЗКЦ и/или КЗЦ (CDC, комплемент-зависимая цитотоксичность).
В соответствии с другим конкретным аспектом АВМ представляет собой отрицательное по эффекторной функции (EN) антитело, содержащее область Fc с ограниченным связыванием с рецептором Fc-гамма и/или C1q.
В частности, антитело является дефицитным по эффекторной функции (также упоминается в настоящем документе как отрицательное по эффекторной функции) с существенно сниженным или отсутствующим связыванием с рецептором Fc-гамма или CD16а за счет области Fc.
В частности, отрицательное по эффекторной функции антитело характеризуется последовательностью СН2 человеческого IgG2 или ее модифицированным вариантом, содержащим модифицированный домен СН2 человеческого IgG2 (F296A, N297Q), описанный в US8562986, гибридизованный с N-концом карбокси-концевого домена СН3 (нумерация в соответствии с индексом ЕС согласно Kabat).
В частности, антитело EN имеет существенно сниженную или отсутствующую АЗКЦ и/или КЗЦ.
В частности, АВМ содержит часть Fc антитела, которая содержит сайт связывания FcRn в месте соединения СН2 с доменом СН3 и/или сайт связывания рецептора Fc-гамма в пределах N-концевой области домена СН2, и/или сайт связывания C1q в пределах N-концевой области домена СН2.
В соответствии с конкретным аспектом АВМ содержит сайт рН-зависимого связывания FcRn, расположенный в доменах СН2 и/или СН3, если таковые имеются. В частности, сайт связывания FcRn способен к рН-зависимому аффинному связыванию с FcRn с KD менее 10-4 М или менее 10-5 М, 10-6 М, 10-7 М или 10-8 М.
В частности, аффинность рН-зависимого связывания FcRn повышается на величину по меньшей мере 1-log, предпочтительно по меньшей мере 2-log или 3-log при рН=5-6, по сравнению с указанной аффинностью связывания при физиологическом рН (рН=7,4).
В соответствии с дополнительным аспектом АВМ модифицирована для изменения рН-зависимого связывания FcRn. Например, по меньшей мере один домен СН3 модифицирован, чтобы содержать по меньшей мере одну мутацию в сайте связывания FcRn для снижения рН-зависимого связывания FcRn, в частности, по меньшей мере одну из мутаций Н433А или Н435А, или обе мутации Н433А и Н435А, причем нумерация приведена в соответствии с индексом ЕС согласно Kabat. Снижение рН-зависимого связывания FcRn может быть таким, что аффинность рН-зависимого связывания FcRn составляет менее 1-log, предпочтительно примерно сходна или меньше при рН=5-6 по сравнению с указанной аффинностью связывания при физиологическом рН (рН=7,4).
Конкретные варианты реализации относятся к любой АВМ, приведенной в настоящем документе в качестве примера, или содержащей любую из тяжелых и легких цепей или любую из пар тяжелых и легких цепей, описанных в разделе «Примеры». В частности, АВМ, описанная в настоящем документе, может содержать или состоять из тяжелых и легких цепей, описанных в разделе «Примеры».
В частности, АВМ, описанная в настоящем документе, предложена для медицинского, диагностического или аналитического применения.
Согласно настоящему изобретению также предложен фармацевтический препарат, содержащий АВМ, описанную в настоящем документе, предпочтительно в составе для парентерального введения или введения через слизистую оболочку, необязательно содержащий фармацевтически приемлемый носитель или вспомогательное вещество.
Согласно настоящему изобретению также предложена выделенная нуклеиновая кислота, кодирующая АВМ, описанную в настоящем документе.
Согласно настоящему изобретению также предложена кассета экспрессии или плазмида, содержащая или включающая нуклеиновую кислоту, описанную в настоящем документе, и необязательно дополнительные последовательности для экспрессии АВМ, кодируемой последовательностью нуклеиновой кислоты, такие как регуляторные последовательности.
В частности, кассета экспрессии или плазмида содержит кодирующую последовательность для экспрессии АВМ, описанной в настоящем документе, или НС и/или LC АВМ, описанной в настоящем документе.
В соответствии с конкретным примером АВМ состоит из одной или более НС и LC, причем каждая из НС характеризуется одинаковой аминокислотной последовательностью НС, и каждая из LC характеризуется одинаковой аминокислотной последовательностью LC, и кодирующие последовательности для НС и LC применяют для получения моновалентного или гомодимерного антитела.
В соответствии с другим конкретным примером АВМ состоит из двух разных НС и двух разных LC, и кодирующие последовательности для двух разных НС и двух разных LC применяют для получения гетеродимерного или биспецифического антитела.
Согласно настоящему изобретению также предложена продуцирующая клетка-хозяин, содержащая по меньшей мере одну кассету экспрессии или плазмиду, содержащую одну или более молекул нуклеиновой кислоты, кодирующей АВМ, описанную в настоящем документе.
В частности, клетка-хозяин кратковременно или стабильно экспрессирует АВМ. В соответствии с конкретными примерами клетка-хозяин представляет собой эукариотическую клетку-хозяина, предпочтительно любую из клеток дрожжей или млекопитающих.
Согласно настоящему изобретению также предложен способ получения АВМ, описанной в настоящем документе, в котором клетку-хозяина, описанную в настоящем документе, культивируют или поддерживают в условиях для получения указанной АВМ.
В частности, АВМ может быть выделена и/или очищена из супернатанта клеточной культуры. В соответствии с конкретным примером АВМ представляет собой биспецифическое полноразмерное антитело, которое является гетеродимерным и содержит две разные НС и две разные LC, и указанная АВМ имеет правильное спаривание когнатных пар HC/LC и когнатных доменов CL и СН1, соответственно, также указанная АВМ продуцируется клеткой-хозяином, причем менее 10% продуцируемых антител спарены неправильно, предпочтительно менее 5%, согласно результатам измерения методом масс-спектрометрии (LC-ESI-MS) при сравнении максимальной интенсивности пика.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1: Биспецифический IgG, ВхМ, был получен в результате кратковременной экспрессии в Expi293F и либо не нес мутации контактной поверхности (левая панель), либо нес мутации контактной поверхности МаВ40 (правая панель). Оба антитела дегликозилировали и исследовали с помощью LC-ESI-MS. Легкая и тяжелая цепи B10v5 показаны белым цветом, а легкая и тяжелая цепи hu225M показаны черным цветом. Относительное содержание каждого детектированного варианта спаривания цепей указано в процентах от всех детектированных полных IgG. В ВхМ дикого типа оба варианта с ошибочным спариванием в Fab детектируются в значительных количествах (каждый по 12% при сравнении максимальной интенсивности пика). Следовательно, пик правильно спаренного варианта также будет содержать вариант с ошибочным спариванием, в котором легкие цепи поменяли положения. При получении ВхМ МаВ40 продуцировался только вариант с правильным спариванием. Варианты с ошибочным спариванием устранялись благодаря модификации контактной поверхности.
Фигура 2: Аналитическая эксклюзионная хроматография (SEC) очищенного ВхМ дикого типа и ВхМ МаВ40. Оба IgG элюируются в ожидаемое время 16,3 мин. Отрицательное влияние модификации контактной поверхности на профиль SEC не детектировалось.
Фигура 3: Биспецифический IgG ВхО был получен с помощью кратковременной экспрессии в НЕK293-6Е и либо не нес мутации контактной поверхности (ВхО дикого типа, верхняя левая панель), либо нес мутации контактной поверхности МаВ40 (ВхО МаВ40, верхняя правая панель). В Fab B10v5 были введены поддерживающие мутации, которые привели к созданию биспецифических антител ВхО МаВ5/40, ВхО МаВ21/40 и ВхО МаВ45/40 (оставшиеся нижние панели). Все антитела дегликозилировали и исследовали с помощью LC-ESI-MS. Легкая и тяжелая цепи B10v5 показаны белым цветом, а легкая и тяжелая цепи ОKТ3 показаны черным цветом. Относительное содержание каждого детектированного варианта спаривания цепи указано в процентах от всех детектированных полноразмерных IgG. В ВхО дикого типа оба варианта с ошибочным спариванием в Fab детектируются в различных количествах, что приводит к накоплению более 40% антитела с ошибочным спариванием. В ВхО МаВ40 ошибочное спаривание было значительно снижено, но все же поддавалось детектированию. ВхО, содержащий не только мутации МаВ40, но и любую из поддерживающих мутаций, проявлял улучшенное спаривание. Более 90% всех детектированных полноразмерных IgG представляли собой правильно спаренные ВхО.
Фигура 4: Аналитическая эксклюзионная хроматография очищенного ВхО дикого типа, ВхО МаВ40, ВхО МаВ5/40 и ВхО МаВ45/40. Все IgG элюируются в ожидаемое время 15,4 мин. Отрицательное влияние модификации контактной поверхности на профиль SEC не детектировалось.
Фигура 5: Последовательности
SEQ ID 1: аминокислотная последовательность домена С-каппа человеческого IgG1
SEQID 2: аминокислотная последовательность домена С-лямбда человеческого IgG1
SEQID 3: аминокислотная последовательность домена СН1 человеческого IgG1
SEQ ID 4: аминокислотная последовательность шарнирной области человеческого IgG1
SEQ ID 5: аминокислотная последовательность домена СН3 человеческого IgG1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Конкретные термины, используемые в описании, имеют указанное далее значение. В настоящем документе термин «антигенсвязывающая молекула» или АВМ будет означать молекулу, содержащую связывающий домен, который представляет собой полипептид, который специфически распознает или связывается с антигеном или его эпитопом с определенной аффинностью и/или авидностью связывания. В соответствии с конкретными примерами АВМ связывающий домен представляет собой связывающую область иммуноглобулиноподобного типа, содержащую полипептид, выбранный из группы, состоящей из однодоменного антитела, одноцепочечных вариабельных доменов, фрагмента Fd, полипептида с Armadillo-повторами, фибронектинового домена типа III, домена тенасцина типа III, домена с повторяющимся мотивом анкирина, липокалина, домена Куница, Fyn-производного домена SH2, минипротеина, каркаса лектиноподобного домена С-типа, модифицированного миметика антитела и любых генетически модифицированных аналогов любого из вышеуказанных, которые сохраняют антигенсвязывающую функциональность.
Конкретные варианты реализации АВМ содержат или состоят из антитела или его антигенсвязывающего фрагмента.
В настоящем документе термин «антитело» определяется как антигенсвязывающие полипептиды, которые представляют собой либо иммуноглобулины, либо иммуноглобулиноподобные молекулы, либо другие белки, проявляющие модульные антительные форматы, например, состоящие из одного или более доменов антител и обладающие антигенсвязывающими свойствами, сходно с иммуноглобулинами или антителами, в частности, белки, которые могут проявлять свойства моно-, би- или полиспецифического, или моно-, би- или поливалентного связывания, например, по меньшей мере два специфических сайта связывания для эпитопов, например, антигенов, эффекторных молекул или структур, в частности, происходящих из патогенов, или структуры человека, такой как аутоантигены, включая связанные с клетками или сывороточные белки. Термины «антитело» и «иммуноглобулин» используются в настоящем документе взаимозаменяемо.
Антитело, как правило, состоит или содержит домены антитела, под которыми понимают константные и/или вариабельные домены тяжелых и/или легких цепей иммуноглобулинов, с одной или более линкерными последовательностями или без них. В частности, подразумевают, что антитела состоят или содержат комбинации вариабельных и/или константных доменов антитела с линкерной последовательностью или шарнирной областью или без них, включая пары вариабельных доменов антитела, такие как одна или две пары VH/VL. Под полипептидами понимают домены антитела, если они содержат структуру бета-складчатой конфигурации, состоящую из по меньшей мере двух бета-цепей доменной структуры антитела, соединенных петлевой последовательностью. Домены антитела могут иметь нативную структуру или могут быть модифицированы с помощью мутагенеза или дериватизации, например, для модификации антигенсвязывающих свойств или любого другого свойства, такого как стабильность или функциональные свойства, такие как связывание с рецепторами Fc, FcRn, и/или рецептором Fc-гамма.
В настоящем документе термин «антитело», в частности, включает полноразмерные антитела, включая антитела иммуноглобулиноподобных структур. В частности, антитело может представлять собой полноразмерное антитело, например, антитело типа IgG (например, подтипа IgG1, IgG2, IgG3 или IgG4), IgA1, IgA2, IgD, IgE или IgM.
Термин дополнительно включает любое из производных, комбинаций или гибридов антител, доменов антител или фрагментов антител.
Термин «полноразмерное антитело» используется для обозначения любой молекулы антитела, содержащей область Fc или по меньшей мере большую часть Fc антитела, которая, в частности, включает димер тяжелых цепей. Термин «полноразмерное антитело» используется в настоящем документе, чтобы подчеркнуть, что конкретная молекула антитела не является фрагментом антитела.
В соответствии с этим под антителом обычно понимают белок (или белковый комплекс), который содержит один или более полипептидов, по существу кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов. Общепризнанные гены иммуноглобулинов включают гены константной области каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также гены вариабельных областей иммуноглобулинов. Легкие цепи (LC) классифицируются как каппа (включая домен VL и С-лямбда) или лямбда (включая домен VL и С-каппа). Тяжелые цепи (НС) классифицируются как гамма, мю, альфа, дельта или эпсилон, которые, в свою очередь, определяют классы иммуноглобулинов, IgG, IgM, IgA, IgD и IgE, соответственно.
Каждая из НС или LC состоит из по меньшей мере двух доменов, соединенных друг с другом с получением цепи из доменов. В частности, подразумевается, что НС антитела содержит домен антитела VH и по меньшей мере один домен антитела, связанный с С-концом VH, т.е., по меньшей мере один домен антитела соединен с С-концом домена VH с помощью линкерной последовательности или без нее. LC антитела содержит домен VL антитела и по меньшей мере один домена антитела, связанный с С-концом VL, т.е., по меньшей мере один домен антитела связан с С-концом домена VL с помощью линкерной последовательности или без нее.
Определение дополнительно включает домены тяжелой и легкой цепей вариабельной области (такие как dAb, Fd, V1, Vk, Vh, VHH) и константную область или отдельные домены интактного антитела, такие как CH1, СН2, СН3, СН4, CL и Сk, а также минидомены, состоящие из по меньшей мере двух бета-цепей домена антитела, соединенных структурной петлей. Как правило, антитело, имеющее антигенсвязывающий сайт за счет специфической структуры CDR, способно связывать антиген-мишень за счет петель CDR пары доменов VH/VL.
Термин «антитело», в частности, будет включать антитела в выделенной форме, которые по существу не содержат другие антитела, направленные против разных антигенов-мишеней и/или содержащие другую структурную группировку доменов антитела. Тем не менее, выделенное антитело может содержаться в комбинированном препарате, содержащем комбинацию выделенного антитела, например, с по меньшей мере одним другим антителом, таким как моноклональные антитела или фрагменты антител, имеющие различные виды специфичности.
Термин «антитело» будет применим к антителам животного происхождения, включая человека, например, млекопитающих, включая человека, мышь, кролика, козу, верблюдового, ламу, корову и лошадь, или птиц, таких как курица, этот термин, в частности, будет включать рекомбинантные антитела, которые основаны на последовательности животного происхождения, например, человеческих последовательностях.
Термин «антитело», в частности, относится к человеческим антителам.
Под термином «человек», используемым в отношении антитела, понимают антитела, имеющие вариабельные и константные области, происходящие из последовательностей иммуноглобулинов человеческой зародышевой линии. Человеческое антитело может включать остатки аминокислот, не кодируемые последовательностями иммуноглобулинов человеческой зародышевой линии (например, мутации, введенные с помощью случайного или сайт-специфического мутагенеза в условиях in vitro или с помощью соматической мутации в условиях in vivo), например, в CDR. Человеческие антитела включают антитела, выделенные из библиотек человеческих иммуноглобулинов или животных, трансгенных по одному или более человеческим иммуноглобулинам.
Человеческое антитело предпочтительно выбрано или происходит из группы, состоящей из IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 и IgM.
Мышиное антитело предпочтительно выбрано или происходит из группы, состоящей из IgA, IgD, IgE, IgG1, IgG2A, IgG2B, IgG2C, IgG3 и IgM.
Термин «антитело» также применим к химерным антителам, например, химерным антителам, последовательности которых происходят из различных видов, такие как последовательности, происходящие из мыши и человека.
Термин «химерный», используемый в отношении антитела, относится к тем молекулам, в которых одна часть каждой из аминокислотных последовательностей тяжелых и легких цепей гомологична соответствующим последовательностям в иммуноглобулинах, происходящих из конкретного вида или принадлежащих к конкретному классу, тогда как оставшийся сегмент цепи гомологичен соответствующим последовательностям другого вида или класса. Как правило, вариабельная область как легкой цепи, так и тяжелой цепи имитирует вариабельные области иммуноглобулинов, происходящих из одного вида млекопитающих, тогда как константные части гомологичны последовательностям иммуноглобулинов, происходящих из другого вида. Например, вариабельная область может быть получена из известных в настоящее время источников с использованием легкодоступных В-клеток или гибридом из организмов-хозяев, не относящихся к человеку, в комбинации с константными областями, полученными, например, из препаратов клеток человека.
Термин «антитело» также может применяться к гуманизированным антителам.
Термин «гуманизированный», используемый в отношении антитела, относится к молекуле, имеющей антигенсвязывающий сайт, который по существу происходит из иммуноглобулина из вида, отличного от человека, причем оставшаяся иммуноглобулиновая структура молекулы основана на структуре и/или последовательности человеческого иммуноглобулина. Антигенсвязывающий сайт может содержать как полные вариабельные домены, гибридизованные на константные домены, так и только области, определяющие комплементарность (CDR), привитые на соответствующие каркасные участки в вариабельных доменах. Антигенсвязывающие сайты могут быть дикого типа или модифицированы, например, одной или более заменами аминокислот, предпочтительно модифицированы для более близкого сходства с иммуноглобулинами человека. Некоторые формы гуманизированных иммуноглобулинов сохраняют все последовательности CDR (например, гуманизированное мышиное антитело, которое содержит все шесть CDR из мышиного антитела). Другие формы имеют один или более CDR, которые изменены относительно исходного антитела.
В соответствии с конкретным вариантом реализации все домены антитела, содержащиеся в АВМ, описанной в настоящем документе, происходят из человека или являются их гуманизированными или функционально активными вариантами с по меньшей мере 60% идентичностью последовательности или по меньшей мере 70%, 80%, 90% или 95% идентичностью последовательности, предпочтительно, когда источником доменов антитела является любое из антител IgG1, IgG2, IgG3, IgG4, IgA, IgM или IgE. В частности, все домены антитела происходят из одной и той же основной иммуноглобулиновой укладки цепи, несмотря на то, что форматы бета-складчатого слоя могут различаться, и соединительные петли, безусловно, могут быть вариабельными, в частности, в V-доменах.
Термин «антитело» также применяется к моноклональным или поликлональным антителам, в частности, к рекомбинантному антителу, причем этот термин включает все антитела и структуры антитела, которые получают, экспрессируют, создают или выделяют рекомбинантными способами, такие как антитела, происходящие из животных, например, млекопитающих, включая человека, которые содержат гены или последовательности различного происхождения, например, химерные, гуманизированные антитела или антитела, полученные из гибридомы. Дополнительные примеры относятся к антителам, выделенным из клетки-хозяина, трансформированной для экспрессии антитела, или к антителам, выделенным из рекомбинантной комбинаторной библиотеки антител или доменов антител, или к антителам, полученным, экспрессированным, созданным или выделенным любыми другими способами, которые включают сплайсинг последовательностей генов антител с другими последовательностями ДНК.
Подразумевается, что термин «антитело» включает функционально активные варианты новых или существующих, например, природных антител. Также подразумевается, что термин вариант антитела, в частности, варианты антителоподобных молекул или варианты антител, также будет включать производные таких молекул.
Производное представляет собой любую комбинацию одного или более антител и/или гибридный белок, в котором любой домен или минидомен антитела может быть гибридизован в любом положении с одним или более другими белками, такими как другие антитела или фрагменты антител, но также с лигандами, ферментами, токсинами и т.п. АВМ или антитело, описанные в настоящем документе, в частности, можно применять в качестве выделенных полипептидов или в виде комбинации молекул, например, с помощью методик рекомбинации, гибридизации или конъюгации, с другими пептидами или полипептидами. Пептиды предпочтительно гомологичны последовательностям доменов антител и предпочтительно имеют по меньшей мере 5 аминокислот в длину, более предпочтительно по меньшей мере 10 или даже по меньшей мере 50 или 100 аминокислот в длину, и составляют по меньшей мере частично область петли домена антитела.
Производное антитела также может быть получено за счет объединения или связывания с другими веществами с помощью различных химических методик, таких как ковалентное связывание, электростатическое взаимодействие, образование дисульфидных связей и т.д. Другие вещества, связанные с антителами, могут представлять собой липиды, углеводы, нуклеиновые кислоты, органические и неорганические молекулы или любые их комбинации (например, ПЭГ, пролекарства или лекарственные препараты). Производное также будет содержать антитело с аналогичной аминокислотной последовательностью, но полученное полностью или частично из неприродных или химически модифицированных аминокислот.В конкретном варианте реализации антитело представляет собой производное, содержащее дополнительную метку, обеспечивающую специфическое взаимодействие с биологически приемлемым соединением. Отсутствует конкретное ограничение в отношении используемой метки, поскольку она не оказывает или имеет переносимое отрицательное влияние на связывание антитела с его мишенью. Примеры подходящих меток включают His-метку, Мус-метку, FLAG-метку, Strep-метку, кальмодулиновую метку, GST-метку, МВР-метку и S-метку. В другом конкретном варианте реализации антитело представляет собой производное, содержащее метку. В настоящем документе термин «метка» относится к детектируемому соединению или композиции, которая непосредственно или косвенно конъюгирована с антителом так, чтобы получить «меченое» антитело. Метка может быть детектируемой сама по себе, например, радиоизотопные метки или флуоресцентные метки, или, в случае ферментативной метки, может катализировать химическое изменение соединения или композиции, которые являются субстратами, которое поддается детектированию.
Производное антитела, например, происходит из исходного антитела или последовательности антитела, такой как исходная антигенсвязывающая (например, CDR) или каркасная (FR) последовательность, например, мутанты или варианты, полученные, например, in silico или с помощью рекомбинантного конструирования, или иными способами с помощью химической дериватизации или синтеза.
В настоящем документе термин «варианты», в частности, будет включать любой «мутант», «гомолог» или «производное», описанные в настоящем документе. Термин «вариант», в частности, будет включать функционально активные варианты, которые характеризуются определенной функциональностью.
Функциональность АВМ или антитела, описанных в настоящем документе, в частности, характеризуется определенным антигенсвязывающим свойством (в частности, специфичностью в отношении эпитопа) и предпочтительным спариванием доменов CL и СН1, при этом аминокислота в положении 18 в домене CL и/или аминокислота в положении 26 в домене СН1 характеризуются противоположной полярностью (нумерация приведена в соответствии с IMGT). В настоящем документе под функциональностью функциональных вариантов константных доменов антител понимают способность к спариванию с партнерским доменом антитела для получения пары доменов антитела. В частности, функциональные варианты доменов CL и СН1, описанных в настоящем документе, содержат доминантные точечные мутации для предпочтительного спаривания, причем аминокислота в положении 18 в домене CL и/или аминокислота в положении 26 в домене СН1 характеризуются противоположной полярностью («доминантные точечные мутации»; нумерация приведена в соответствии с IMGT), и необязательно дополнительные точечные мутации, которые поддерживают предпочтительное спаривание для получения димера CL/CH1, но не уменьшают вероятность спаривания.
Термин «вариант», в частности, будет относиться к антителам, таким как мутантные антитела или фрагменты антител, например, полученным с помощью методов мутагенеза, в частности, для удаления, обмена, введения вставок в конкретную аминокислотную последовательность антитела или область, или химической дериватизации аминокислотной последовательности, например, в константных доменах для конструирования стабильности, эффекторной функции или периода полужизни антитела, или в вариабельных доменах для улучшения антигенсвязывающих свойств, например, с помощью методик созревания аффинности, доступных в данной области техники. Можно применять любой из известных методов мутагенеза, включая точечные мутации в желаемых положениях, например, полученные с помощью методик рандомизации. В некоторых случаях положения выбраны случайным образом, например, как с любой из возможных аминокислот, так и с помощью отбора предпочтительных аминокислот для рандомизации последовательностей антител. Термин «мутагенез» относится к любой методике, общепризнанной в данной области техники, для изменения полинуклеотидной или полипептидной последовательности. Предпочтительные типы мутагенеза включают мутагенез с помощью подверженной ошибкам ПЦР, насыщающий мутагенез или другой сайт-направленный мутагенез.
В настоящем документе термин «функциональные варианты», также упоминаемые как «функционально активный вариант», например, может включать последовательность, полученную в результате модификации исходной последовательности (например, из исходного антитела) путем вставки, делеции или замены одной или более аминокислот или химической дериватизации одного или более остатков аминокислот в аминокислотной последовательности или нуклеотидов в нуклеотидной последовательности или на одном или обоих дистальных концах последовательности, например, в последовательности CDR или FR, причем такая модификация не влияет на активность этой последовательности, в частности, не нарушает ее. В случае если связывающий сайт обладает специфичностью в отношении выбранного антигена-мишени, функционально активный вариант антитела все еще будет иметь заранее определенную специфичность связывания, несмотря на то, что она может быть изменена, например, чтобы изменить тонкую специфичность в отношении конкретного эпитопа, аффинность, авидность, Коn или Koff скорости реакции и т.д. Например, под антителом с созревшей аффинностью, в частности, понимают функционально активный вариант антитела.
Следовательно, под модифицированной последовательностью CDR в антителе с созревшей аффинностью понимают функционально активный вариант.
Функциональную активность предпочтительно определяют на основании структуры и функции варианта по сравнению с исходной молекулой, например, в количественном исследовании для определения специфичности связывания антигена-мишени и/или требуемого периода полужизни молекулы в условиях in vivo и/или связывания FcRn рН-зависимым способом, например, определенных в стандартном количественном исследовании путем измерения функциональности антитела.
Функциональную активность антитела в отношении связывания антигена, как правило, определяют в иммуноферментном анализе (ИФА), количественном исследовании BIAcore, количественном исследовании Octet ВLI или количественном исследовании на основе флуоресцентно-активированной сортировки клеток (FACS), когда антиген экспрессируется на поверхности клетки.
Функционально активные варианты могут быть получены, например, путем изменения последовательности исходного антитела, например, моноклонального антитела, имеющего специфическую нативную структуру антитела, такую как структура IgG1, для получения варианта, обладающего аналогичной специфичностью при распознавании антигена-мишени, но имеющего структуру, которая отличается от исходной структуры, например, для модификации любого из доменов антитела, чтобы ввести специфические мутации, для получения биспецифических конструкций или для получения фрагмента исходной молекулы.
Как правило, исходное антитело или последовательность могут быть модифицированы для получения вариантов, которые включают мутации в пределах области последовательности, отличной от антигенсвязывающего сайта, или в пределах сайта связывания, что не нарушает связывание антигена, и предпочтительно будут иметь биологическую активность, сходную с таковой исходного антитела, включая способность связывать антиген, например, с по существу сходной биологической активностью, определенной с помощью количественного исследования специфического связывания или функционального теста для нацеливания на антиген.
В настоящем документе термин «по существу сходная биологическая активность» относится к активности, о которой свидетельствует по существу сходная активность, составляющая по меньшей мере 20%, по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90%, например, по меньшей мере 100% или по меньшей мере 125%, или по меньшей мере 150%, или по меньшей мере 175%, или, например, до 200% от активности, определенной для сопоставимого или исходного антитела.
Предпочтительные варианты, описанные в настоящем документе, являются функционально активными в отношении связывания антигена, предпочтительно способны специфически связывать отдельный антиген и не связываются значительно с другими антигенами, которые не являются антигенами-мишенями, например, с разницей значений Kd по меньшей мере 2-log, желательно по меньшей мере 3-log. Связывание антигена функционально активным вариантом, как правило, не нарушается, что соответствует по существу сходной аффинности связывания, как и у исходного антитела или последовательности, или антитела, содержащего вариант последовательности, например, с разницей значений Kd менее 2-log, предпочтительно менее 3-log, однако с возможностью даже улучшенной аффинности, например, с разницей значений Kd по меньшей мере 1-log, предпочтительно по меньшей мере 2-log.
В предпочтительном варианте реализации функционально активный вариант исходного антитела:
a) представляет собой биологически активный фрагмент антитела, причем фрагмент содержит по меньшей мере 50% последовательности молекулы, предпочтительно по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95% и наиболее предпочтительно по меньшей мере 97%, 98% или 99%;
b) происходит из антитела в результате по меньшей мере одной замены, добавления и/или делеции аминокислоты, причем последовательность функционально активного варианта идентична последовательности молекулы или ее части, такой как антитело, по меньшей мере на 50%, предпочтительно по меньшей мере на 60%, более предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 80%, еще более предпочтительно по меньшей мере на 90%, еще более предпочтительно по меньшей мере на 95% и наиболее предпочтительно по меньшей мере на 97%, 98% или 99%; и/или
c) состоит из антитела или его функционально активного варианта и дополнительно по меньшей мере одной аминокислоты или нуклеотида, гетерологичных по отношению к полипептиду или нуклеотидной последовательности.
Согласно одному варианту реализации настоящего изобретения функционально активный вариант АВМ или антитела, описанных в настоящем документе, по существу идентичен варианту, описанному выше, но отличается от его полипептида или кодирующей нуклеотидной последовательности, соответственно, тем, что он происходит из гомологичной последовательности другого вида. Такие варианты или аналоги называются природными.
Термин «функционально активный вариант» также включает природные аллельные варианты, а также мутанты или любые другие неприродные варианты. Как известно в данной области техники, аллельный вариант представляет собой альтернативную форму (поли)пептида, которая характеризуется тем, что содержит замену, делецию или добавление одной или более аминокислот, которые по существу не изменяют биологическую функцию полипептида.
Функционально активные варианты могут быть получены путем изменений последовательности в полипептиде или нуклеотидной последовательности, например, с помощью одной или более точечных мутаций, причем изменения последовательности сохраняют или улучшают функцию неизмененного полипептида или нуклеотидной последовательности при применении, описанном в настоящем документе. Такие изменения последовательности могут включать, но не ограничиваются этим, (консервативные) замены, добавления, делеции, мутации и вставки.
Конкретными функционально активными вариантами являются варианты CDR. Вариант CDR включает аминокислотную последовательность, модифицированную по меньшей мере одной аминокислотой в области CDR, при этом указанная модификация может представлять собой химическое или частичное изменение аминокислотной последовательности, причем эта модификация позволяет варианту сохранять биологические характеристики немодифицированной последовательности. Частичное изменение аминокислотной последовательности CDR может происходить за счет делеции или замены одной или более аминокислот, например, 1, 2, 3, 4 или 5 аминокислот, или за счет добавления или вставки одной или более аминокислот, например, 1, 2, 3, 4 или 5 аминокислот, или за счет химической дериватизации одной или более аминокислот, например, 1, 2, 3, 4 или 5 аминокислот, или их комбинации. Замены аминокислотных остатков могут представлять собой консервативные замены, например, замену одной гидрофобной аминокислоты альтернативной гидрофобной аминокислотой.
Консервативные замены представляют собой замены, которые происходят в пределах семейства аминокислот, которые имеют сходные боковые цепи и химические свойства. Примерами таких семейств являются аминокислоты с основными боковыми цепями, с кислыми боковыми цепями, с неполярными алифатическими боковыми цепями, с неполярными ароматическими боковыми цепями, с незаряженными полярными боковыми цепями, с небольшими боковыми цепями, с большими боковыми цепями и т.д.
Под точечной мутацией, в частности, понимают модификацию полинуклеотида, что приводит к экспрессии аминокислотной последовательности, которая отличается от немодифицированной аминокислотной последовательности заменой или обменом, делецией или вставкой одной или более отдельных (не последовательных) или дуплетных аминокислот для разных аминокислот.
В соответствии с определенным аспектом точечные мутации домена CL и СН1, описанные в настоящем документе для предпочтительного спаривания доменов антитела CL и СН1, изменяют полярность остатков аминокислот в положении 18 в домене CL и/или аминокислоты в положении 26 в домене СН1 на противоположную полярность, при этом нумерация приведена в соответствии с IMGT. Конкретные варианты реализации относятся к следующему:
a) если остаток аминокислоты в положении 18 в домене CL имеет положительную полярность, остаток аминокислоты в положении 26 в домене СН1 имеет отрицательную полярность; или
b) если остаток аминокислоты в положении 18 в домене CL имеет отрицательную полярность, остаток аминокислоты в положении 26 в домене СН1 имеет положительную полярность.
В настоящем документе точечные мутации, описанные выше, называются «доминантными» точечными мутациями, поскольку с помощью таких точечных мутаций противоположной полярности в указанных положениях могут быть получены АВМ или антитела, которые характеризуются предпочтительным спариванием доменов CL и СН1, несущих такие точечные мутации, даже если в доменах CL или СН1 или в любом из соседних доменов VL или VH отсутствуют дополнительные точечные мутации.
Помимо доминантных точечных мутаций могут присутствовать дополнительные точечные мутации, которые даже улучшают предпочтительное спаривание LC и НС, например, точечные мутации, которые называются в настоящем документе «поддерживающими» точечными мутациями. Такие поддерживающие точечные мутации могут быть сконструированы в любом из доменов CL и/или партнерском домене СН1 или в домене VL и/или партнерском домене VH. Примерные поддерживающие точечные мутации включают следующие: точечная мутация F7X в домене CL, где X представляет собой любой из S, А или V; и точечная мутация A20L в партнерском домене СН1, причем нумерация приведена в соответствии с FMGT. Как правило, поддерживающие точечные мутации представляют собой консервативные точечные мутации, характеризующиеся заменой остатков аминокислот, причем такая замена не изменяет полярность остатков аминокислот.
Варианты АВМ или антитела, описанных в настоящем документе, могут включать точечные мутации, которые относятся к обмену аминокислот с одинаковой полярностью и/или зарядом. В связи с этим аминокислоты относятся к 20 природным аминокислотам, кодируемым шестьюдесятью четырьмя триплетными кодонами. Эти 20 аминокислот можно разделить на те, которые имеют нейтральные заряды, положительные заряды и отрицательные заряды:
20 природных аминокислот представлены в таблице ниже вместе с соответствующим им трехбуквенным и однобуквенным кодом и полярностью:
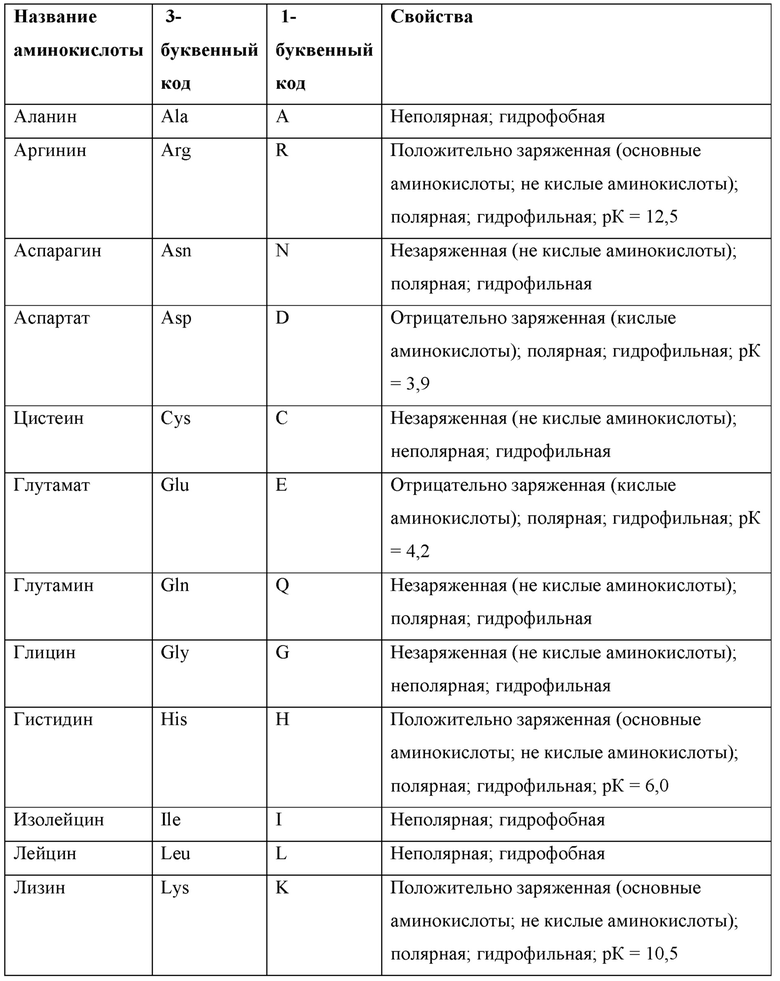
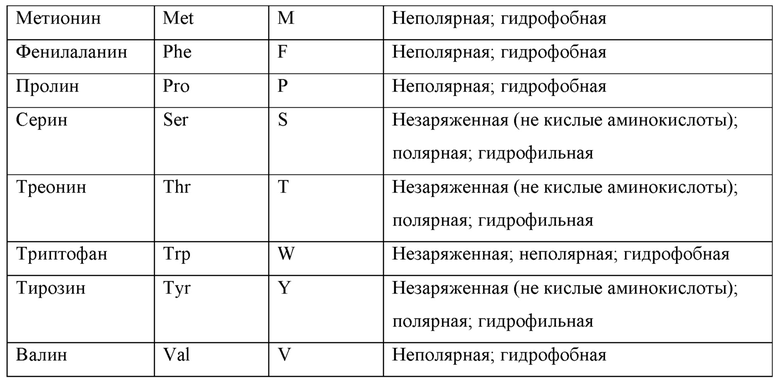
«Процент (%) идентичности аминокислотной последовательности» по отношению к полипептидным последовательностям определяется как процент остатков аминокислот в последовательности-кандидате, которые идентичны остаткам аминокислот в конкретной полипептидной последовательности после выравнивания последовательности и введения пробелов, при необходимости, для достижения максимального процента идентичности последовательности и без учета каких-либо консервативных замен как части идентичности последовательности. Специалисты в данной области техники смогут определить соответствующие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
В частности, подразумевается, что АВМ или вариант антитела включают гомологи, аналоги, фрагменты, модификации или варианты с конкретным профилем гликозилирования, например, полученным с помощью гликоконструирования, которые являются функциональными и могут служить в качестве функциональных эквивалентов, например, связывание с конкретными мишенями и наличие функциональных свойств. АВМ или антитело могут быть гликозилированными или негликозилированными. Например, рекомбинантная АВМ или антитело, описанные в настоящем документе, могут быть экспрессированы в подходящей клетке млекопитающего, чтобы обеспечить специфическое гликозилирование молекулы, определяемое клеткой-хозяином, экспрессирующей антитело.
В настоящем документе термин «бета-складчатый слой» или «бета-цепь» домена антитела, в частности, константного домена антитела, такого как домен CL или СН1, понимают следующим образом. Домен антитела, как правило, состоит из по меньшей мере двух бета-цепей, соединенных латерально по меньшей мере двумя или тремя водородными связями остова, образуя в основном скрученный складчатый лист. Бета-цепь представляет собой отдельный непрерывный участок аминокислот, как правило, длиной от 3 до 10 аминокислот, принимающий такую удлиненную конформацию и участвующий в образовании водородных связей остова с по меньшей мере одной другой цепью так, что они образуют бета-складчатый слой. В бета-слое большинство бета-цепей расположены рядом с другими цепями и образуют обширную сеть водородных связей со своими соседями, в которой группы N-H в остове одной цепи образуют водородные связи с группами С=O в остове соседних цепей.
Структура константных доменов антител, таких как домены CL или СН1, сходна со структурой вариабельных доменов, состоящих из бета-цепей, соединенных петлями, некоторые из которых содержат короткие альфа-спиральные участки. Каркас в основном является жестким, но петли сравнительно более гибкие, о чем свидетельствуют b-факторы различных кристаллических структур Fc. Домен антитела CL или СН1, как правило, имеет семь бета-цепей, образующих бета-складчатый слой (A-B-C-D-E-F-G), причем бета-цепи соединены за счет петель, при этом три петли расположены в N-концевой части домена (А-В, C-D, E-F), и другие три петли расположены в N-концевой части домена (В-С, D-E, F-G). «Область петли» домена относится к части белка, расположенной между областями бета-цепей (например, каждый из доменов CL или СН1 содержит семь бета-складчатых слоев, от А до G, ориентированных от N- к С-концу).
Предпочтительно пара доменов антитела, такая как пара доменов CL и СН1, образует (гетеро)димер за счет соединения связывающей поверхности, включая цепи А, В и/или Е, каждого из доменов (называемой в настоящем документе связывающей контактной поверхностью). Димер (обозначенный CL/CH1) образуется за счет такого контакта области бета-складчатого слоя домена CL с областью бета-складчатого слоя домена СН1.
В частности, домены CL и СН1, описанные в настоящем документе, содержат или состоят из аминокислотной последовательности человеческого антитела IgG1.
В частности, домен С-каппа характеризуется аминокислотной последовательностью, определенной как SEQ ID 1, или ее функциональным вариантом, например, с определенной идентичностью последовательности.
В частности, домен С-лямбда характеризуется аминокислотной последовательностью, определенной как SEQ ID 2, или ее функциональным вариантом, например, с определенной идентичностью последовательности.
В частности, домен СН1 характеризуется аминокислотной последовательностью, определенной как SEQ ID 3, или ее функциональным вариантом, например, с определенной идентичностью последовательности.
Согласно другому варианту домены антитела CL и СН1, описанные в настоящем документе, содержат или состоят из аминокислотной последовательности любого из человеческого IgG2, IgG3, IgG4, IgA, IgM, IgE, IgD или их функционального варианта, например, с определенной идентичностью последовательности.
Под частью Fv антитела, как правило, понимают пару доменов VL и VH, которая образует (гетеро)димер за счет соединения связывающей поверхности, включая цепи С, С и F, каждого из доменов (связывающая контактная поверхность). Димер (обозначенный VL/VH) образуется за счет такого контакта области бета-складчатых слоев домена VL с областью бета-слоев домена VH.
В настоящем документе под плечом Fab понимают пару первой и второй цепей антитела, причем первая цепь содержит или состоит из домена VL и домена CL, который соединен с С-концом домена VL (легкой цепи, LC), и вторая цепь содержит или состоит из домена VH и домена СН1, который соединен с С-концом домена VH (тяжелая цепь, НС), при этом VL соединяется с VH (спаривается) за счет связывающей поверхности, и CL соединяется с СН1 (спаривается) за счет связывающей поверхности с получением (гетеро)димера LC и НС (также обозначенного LC/HC).
В настоящем документе под частью Fc антитела понимают пару цепей антитела, каждая из которых содержит домен СН2 и домен СН3, который соединен с С-концом домена СН2 (цепи Fc), причем домены СН2 каждой из цепей антитела соединяются друг с другом за счет связывающей поверхности, включая цепи А, В и/или Е, каждого из доменов СН2 (связывающая контактная поверхность), и при этом домены СН3 каждой из цепей антитела соединяются (спариваются) друг с другом за счет связывающей поверхности, включая цепи А, В и/или Е, каждого из доменов СН3 (связывающая контактная поверхность) с получением (гомо)димера цепей Fc. Описанная в настоящем документе часть Fc может быть получена из IgG, IgA, IgD, IgE или IgM.
Согласно одному варианту реализации, описанному в настоящем документе, часть Fc содержит мутантные домены СН3, например, в которых по меньшей мере часть одной или более бета-цепей заменена гетерологичными последовательностями так, чтобы включить одну или более точечных мутаций, или мутаций типа «выступ» или «впадина». В этом случае область Fc содержит гетеродимер из цепей Fc, характеризующийся соединением двух разных доменов СН3.
Конкретные мутации типа «выступ» представляют собой одну или более аминокислотных замен для увеличения контактной поверхности между двумя доменами путем включения одной или более аминокислот, которые обеспечивают дополнительную выпуклость структуры бета-цепи, например, одну или более мутаций типа «выступ» СН3, выбранных из группы, состоящий из T366Y, T366W, T394W, F405A. Конкретная модификация типа «выступ» обозначает мутацию T366W в домене антитела СН3 (нумерация в соответствии с индексом ЕС согласно Kabat). Мутации типа «выступ», в частности, обеспечивают совпадающую (когнатную) поверхность для связывания другого домена антитела, например, который модифицирован для включения мутаций типа «впадина».
Конкретные мутации типа «впадина» представляют собой одну или более аминокислотных замен для увеличения контактной поверхности между двумя доменами путем включения одной или более аминокислот, которые обеспечивают дополнительную полость структуры бета-цепи, например, одну или более мутаций типа «впадина» СН3, выбранных из группы, состоящей из T366S, L368A и Y407V. Конкретная модификация типа «впадина» обозначает любую из мутаций T366S, L368A, Y407V, Y407T в домене СН3 антитела (нумерация в соответствии с индексом ЕС согласно Kabat). Мутации типа «впадина», в частности, обеспечивают совпадающую (когнатную) поверхность для связывания другого домена антитела, например, который модифицирован для включения мутаций типа «выступ».
Совпадающие мутации типа «выступ-во-впадину» представляют собой, например, T366Y на одном домене СН3 и совпадающую Y407'T на втором домене СН3 пары доменов СН3, называемые в настоящем документе T366Y/Y407'T. Другие совпадающие мутации представляют собой

Конкретные мутации СН3 включают межмолекулярную перестановку бета-цепей, например, когда один или более сегментов или последовательностей в пределах бета-цепи СН3 мутируют для включения сегментов или последовательностей из доменов антител, которые отличаются от исходного домена СН3, например, доменов антител другого типа или подтипа. Специфических мутантов получают с помощью обмена цепями, причем домен СН3 типа IgG включает один или более сегментов или последовательностей домена СН3 типа IgA. Если два домена СН3 после обмена цепями подвергают мутагенезу с образованием когнатной пары, сегменты или последовательности IgA каждого из доменов СН3 образуют междоменную контактную поверхность, которая является когнатной, так, что мутированные домены СН3 преимущественно спариваются друг с другом, в сравнении с доменом СН3 дикого типа. Конкретными примерами таких модификаций доменов антител для включения перестановки сегментов могут быть домены, сконструированные с помощью технологии обмена цепями (SEED). Такие модификации можно применять для получения асимметричных или биспецифических антител путем предпочтительного спаривания SEED-модифицированных доменов СН3 тяжелых цепей. Этот способ основан на обмене структурно родственных последовательностей в пределах консервативных доменов СН3. Чередующиеся последовательности из человеческих IgA и IgG в доменах SEED-CH3 образуют два асимметричных, но комплементарных домена, обозначенных AG и GA. Дизайн с помощью SEED позволяет эффективно получать гетеродимеры AG/GA, в то же время препятствует гомодимеризации доменов AG и GA SEED-CH3.
Соединение доменов антител или LC/HC, или цепей Fc может дополнительно поддерживаться с помощью внутридоменных или междоменных дисульфидных мостиков. Дисульфидные связи обычно образуются в результате окисления тиольных групп двух цистеинов, что соединяет S-атомы с образованием дисульфидного мостика между двумя остатками цистеина.
В соответствии с конкретным вариантом реализации домены антитела содержат мутации, включающие остатки цистеина, которые способны образовывать дисульфидные мостики для стабилизации домена антитела с помощью дополнительного внутридоменного дисульфидного мостика или пары доменов антитела с помощью дополнительного междоменного дисульфидного мостика. В частности, цистеин может быть вставлен (с помощью вставки дополнительной аминокислоты или замены аминокислоты) в С-концевой области или на С-конце домена СН3. Пара СН3, которая несет дополнительную цистеиновую модификацию, может быть стабилизирована за счет образования дисульфидной связи между парой СН3 с получением димера СН3/СН3. Согласно некоторым вариантам реализации настоящего изобретения дисульфидсоединенные домены антитела представляют собой гомодимеры или гетеродимеры, следовательно, пары одинаковых или разных доменов.
Чтобы обеспечить правильное спаривание цепей или доменов антител, в частности, можно применять любые из мутаций СН3, например, технологию ««выступ-во-впадину», технологию SEED, технологию отталкивания заряда, дисульфидную связь или технологию кросс-МАТ, чтобы уменьшить количество неправильно связанных молекул.
В настоящем документе под «парой» доменов антитела понимают набор из двух доменов антитела, когда один домен имеет область на своей поверхности или полость, которая специфически связывается с областью на другом домене и, следовательно, комплементарна ей. Домены антитела могут связываться или объединяться с образованием пары доменов антитела за счет контакта области бета-складчатого слоя. Такая пара доменов также упоминается как димер, который, например, связан за счет электростатического взаимодействия, рекомбинантной гибридизации или ковалентной связи, что приводит к непосредственной физической связи двух доменов, например, как в твердой, так и в жидкой форме. В настоящем документе, в частности, описан димер CL/CH1, который может представлять собой предпочтительную пару когнатных доменов антитела за счет определенных точечных мутаций в положениях, определенных в настоящем документе.
В настоящем документе под «предпочтительным спариванием» понимают образование димеров из доменов антитела или цепей антитела с получением пары доменов антитела или цепей антитела, причем пара образуется за счет повышенной аффинности или авидности связывающих поверхностей доменов антитела и повышенной (термо-) стабильность пары доменов или пары HC/LC. Когнатные домены антитела могут быть получены с помощью модификаций в области контактной поверхности, таких как описанные в настоящем документе, которые предпочтительно спариваются друг с другом, в сравнении с любым доменом дикого типа, относящимся к аналогичному типу.
В паре доменов антитела в настоящем документе домены антитела называются «партнерскими» доменами. В антителе, описанном в настоящем документе, следующие домены считаются партнерами, приемлемо образующими пару доменов антитела (партнеры, разделенные косой чертой (/)):
VL/VH;
CL (С-лямбда или С-каппа)/СН1;
СН2/СН2;
СН3/СН3.
Под термином «когнатный» в отношении пары доменов или димера доменов понимают домены, которые имеют совпадающую точку связывания или структуру для получения контактной поверхности на каждом из доменов, чтобы предпочтительно образовывать пару таких доменов. Подразумевается, что конкретные домены являются «когнатными» или когнатной парой доменов, если по меньшей мере один из доменов модифицирован для предпочтительного связывания своего когнатного (партнерского) партнера по связыванию для получения пары доменов. Предпочтительно оба когнатных домена модифицированы для включения совпадающих мутаций, например, мутаций для введения остатков аминокислот противоположных полярностей, мутаций типа «выступ-во-впадину», мутаций SEED, дополнительных остатков цистеина для образования дисульфидного мостика или модификаций, в которых применяется технология отталкивания зарядов.
Термин «поливалентный» по отношению к АВМ или антителу, описанным в настоящем документе, относится к молекуле, имеющей по меньшей мере два сайта связывания для связывания одного и того же антигена-мишени, специфически связывающих одни и те же или разные эпитопы такого антигена-мишени. Термин будет включать двухвалентные антитела или молекулы с 2 или более валентностями для связывания антигена-мишени, например, за счет по меньшей мере 2, 3, 4 или даже более сайтов связывания. Например, двухвалентное антитело может иметь два антигенсвязывающих сайта за счет двух пар доменов VH/VL, обе из которых связывают один и тот же антиген-мишень.
Термин «полиспецифичный» в отношении АВМ или антитела, описанных в настоящем документе, относится к молекуле, имеющей по меньшей мере два сайта связывания, специфически связывающих по меньшей мере два разных антигена-мишени. Термин будет включать биспецифические антитела или молекулы с 2 или более видами специфичности для связывания более чем одного антигена-мишени, например, за счет по меньшей мере 2, 3, 4 или даже более сайтов связывания.
Например, биспецифическое антитело может связывать один антиген-мишень за счет одной пары доменов VH/VL (область Fv) и другой антиген-мишень за счет второй пары доменов VH/VL (область Fv). Биспецифическое антитело, как правило, состоит из четырех различных цепей антитела, т.е. двух НС и двух LC, так, что два разных CDR-сайта связывания образуются путем гетеродимеризации (спаривания) первой НС с первой LC и второй НС со второй LC.
В настоящем документе термин «антиген» или «мишень», в частности, будет включать все антигены и молекулы-мишени, которые распознаются сайтом связывания антитела (также называемым паратопом). В частности, предпочтительные антигены, на которые нацелена связывающая молекула, описанная в настоящем документе, представляют собой те антигены, которые, как уже было доказано, являются или способны быть иммунологически или терапевтически целесообразными, в частности, те, для которых была испытана клиническая эффективность. В настоящем документе термин «мишень» или «антиген», в частности, будет включать молекулы, выбранные из группы, состоящей из рецепторов, ассоциированных с опухолью (человека или другого животного), и растворимых антигенов, ассоциированных с опухолью, которые являются аутоантигенами, таких как рецепторы, расположенные на поверхности опухолевых клеток, или цитокинов, или факторов роста, которые повсеместно присутствуют в кровотоке онкопациентов и связаны с такой опухолью. Другие антигены могут происходить из патогенов, например, микробных или вирусных патогенов.
Антиген-мишень распознается либо как целая молекула-мишень, либо как фрагмент такой молекулы, в частности, субструктуры, например, полипептидная или углеводная структуры мишеней, обычно называемые «эпитопы», например, В-клеточные эпитопы, Т-клеточный эпитоп), которые являются иммунологически целесообразными, т.е. также распознаются природными или моноклональными антителами. В настоящем документе термин «эпитоп», в частности, будет относиться к молекулярной структуре, которая может полностью представлять собой партнера по специфическому связыванию или быть частью партнера по специфическому связыванию с сайтом связывания АВМ или антитела, описанных в настоящем документе. Термин эпитоп также может относиться к гаптенам. Химически эпитоп может состоять из углевода, пептида, алифатической кислоты, органического, биохимического или неорганического вещества, или их производных и любых их комбинаций. Если эпитоп представляет собой полипептид, он обычно включает по меньшей мере 3 аминокислоты, предпочтительно от 8 до 50 аминокислот, и более предпочтительно от 10 до 20 аминокислот в пептиде. Не существует критического верхнего предела длины пептида, который может составлять почти всю длину полипептидной последовательности белка. Эпитопы могут быть как линейными, так и конформационными. Линейный эпитоп состоит из одного сегмента первичной последовательности полипептидной или углеводной цепи. Линейные эпитопы могут быть смежными или перекрывающимися. Конформационные эпитопы состоят из аминокислот или углеводов, сближенных за счет сворачивания полипептида с образованием третичной структуры, и аминокислоты необязательно являются смежными в линейной последовательности. В частности, эпитопы являются по меньшей мере частью диагностически целесообразных молекул, т.е. отсутствие или присутствие эпитопа в образце качественно или количественно коррелирует либо с заболеванием, либо с состоянием здоровья пациента, либо со статусом способа при изготовлении, либо со статусом окружающей среды и статусом питания. Эпитопы также могут представлять собой по меньшей мере часть терапевтически целесообразных молекул, т.е. молекул, на которые может быть нацелен специфический связывающий домен, который изменяет течение заболевания.
Конкретные варианты реализации относятся к природным антигенам или эпитопам или синтетическим (искусственным) антигенам или эпитопам. Преимуществом искусственных антигенов, которые являются производными природных антигенов, может быть повышенная антигенность или стабильность, что имеет значение для распознавания в качестве партнера по связыванию для конкретной АВМ или антитела.
В настоящем документе термин «специфичность» или «специфическое связывание» относится к реакции связывания, которая является определяющей для представляющего интерес когнатного лиганда в гетерогенной популяции молекул. Соответственно, в указанных условиях (например, в условиях иммуноанализа) АВМ или антитело, описанное в настоящем документе, связывается со своей конкретной мишенью и не связывается в значительном количестве с другими молекулами, присутствующими в образце. Специфическое связывание означает, что связывание является селективным касательно идентичности мишени, высокой, средней или низкой аффинности или авидности связывания, в соответствии с выбором. Селективное связывание обычно достигается, если константа связывания или динамика связывания различается по меньшей мере в 10 раз, предпочтительно различается по меньшей мере в 100 раз и более предпочтительно по меньшей мере в 1000 раз.
В настоящем документе термин «вариабельная связывающая область», также называемая «область CDR», относится к молекулам с изменяющимися структурами, способным к связывающим взаимодействиям с антигенами. Эти молекулы можно применять сами по себе или интегрировать в более крупный белок с образованием специфической области такого белка, имеющей функцию связывания. Изменяющиеся структуры могут происходить из природных репертуаров связывающих белков, таких как иммуноглобулины или антитела. Изменяющиеся структуры также могут быть получены с помощью методик рандомизации, в частности, описанных в настоящем документе. Они включают мутированные CDR или области, отличные от CDR (например, области структурных петель константных доменов антител), области петель вариабельных доменов или константных доменов антител, в частности, петли CDR антител. Как правило, связывающие структуры АВМ или антитела, описанных в настоящем документе, образованы такими вариабельными связывающими областями.
Термин «цитотоксический» или «цитотоксическая активность», используемый для целей АВМ или антитела, описанных в настоящем документе, будет относиться к любой специфической молекуле, направленной против клеточных антигенов, которая, в связанном с антигеном состоянии, активирует запрограммированную гибель клеток и запускает апоптоз. Специфические антитела эффективны благодаря своему действию на эффекторные клетки, что приводит к активации цитотоксических Т-клеток или клеток, которые опосредуют антителозависимую клеточную цитотоксичность (АЗКЦ), комплементзависимую цитотоксичность (КЗЦ) и/или клеточный фагоцитоз (АЗКФ). Специфические антитела уничтожают покрытые антителом клетки-мишени с помощью апоптоза, индуцирующего запрограммированную гибель клеток, и/или с помощью связывания с рецепторами Fc эффекторных клеток, опосредующих активность АЗКЦ и/или КЗЦ.
АВМ или антитело, описанные в настоящем документе, могут проявлять эффекторную функцию Fc или могут не проявлять ее. Fc может привлекать комплемент и способствовать устранению антигена-мишени или клетки-мишени за счет связывания поверхностного антигена путем образования иммунных комплексов.
Специфические антитела могут быть лишены активного фрагмента Fc или эффекторной функции Fc, соответственно, они либо состоят из доменов антитела, которые не содержат часть Fc антитела, либо не содержат сайт связывания рецептора Fc-гамма, либо содержат домены антитела, лишенные эффекторной функции Fc, например, за счет модификации для снижения эффекторных функций Fc, в частности, для отмены или снижения активности АЗКЦ и/или КЗЦ. Альтернативные антитела могут быть сконструированы с включением модификаций для увеличения эффекторных функций Fc, в частности, для усиления активности АЗКЦ и/или КЗЦ.
Такие модификации можно осуществлять с помощью мутагенеза, например, мутаций в сайте связывания рецептора Fc-гамма, или с помощью производных или агентов, которые препятствуют активности АЗКЦ и/или КЗЦ формата антитела так, чтобы достичь снижения или увеличения эффекторной функции Fc.
Термин «антигенсвязывающий сайт» или «связывающий сайт» относится к части АВМ или антитела, которая участвует в связывании антигена. Антигенсвязывающий сайт антитела, как правило, образуется аминокислотными остатками N-концевых вариабельных («V») областей тяжелой («Н») и/или легкой («L») цепей или их вариабельных доменов. Три сильно различающихся участка в пределах V-областей тяжелой и легкой цепей, называемые «гипервариабельные участки», расположены между более консервативными фланкирующими участками, известными как каркасные участки. Антигенсвязывающий сайт обеспечивает поверхность, которая комплементарна трехмерной поверхности связанного эпитопа или антигена, и гипервариабельные участки называются «области, определяющие комплементарность» или «CDR». Связывающий сайт, включенный в CDR в настоящем документе, также называют «CDR-сайт связывания».
Термин «экспрессия» понимают следующим образом. Молекулы нуклеиновых кислот, содержащие желательную кодирующую последовательность продукта экспрессии, такого как, например, АВМ или антитело, описанные в настоящем документе, и управляющие последовательности, такие как, например, функционально соединенный промотор, можно применять для целей экспрессии. Хозяева, трансформированные или трансфецированные этими последовательностями, способны вырабатывать кодируемые белки. Для осуществления трансформации система экспрессии может быть включена в вектор; однако соответствующая ДНК также может быть интегрирована в хромосому хозяина. В частности, термин относится к клетке-хозяину и совместимому вектору в условиях, например, подходящих для экспрессии белка, кодируемого чужеродной ДНК, переносимой вектором и вводимой в клетку-хозяина.
Кодирующая ДНК представляет собой последовательность ДНК, которая кодирует конкретную аминокислотную последовательность для конкретного полипептида или белка, такого как, например, антитело. Промоторная ДНК представляет собой последовательность ДНК, которая инициирует, регулирует или иным образом опосредует или контролирует экспрессию кодирующей ДНК. Промоторная ДНК и кодирующая ДНК могут быть из одного и того же гена или из разных генов и могут быть из одного и того же или из разных организмов. Рекомбинантные векторы для клонирования часто будут включать одну или более систем репликации для клонирования или экспрессии, один или более маркеров для отбора у хозяина, например, устойчивость к антибиотикам, и одну или более кассет экспрессии.
В настоящем документе «векторы» определяют как последовательности ДНК, которые необходимы для транскрипции клонированных рекомбинантных нуклеотидных последовательностей, т.е. рекомбинантных генов и трансляции их мРНК в подходящем организме-хозяине.
«Кассета экспрессии» относится к кодирующей последовательности ДНК или сегменту ДНК, который кодирует продукт экспрессии, которые могут быть вставлены в вектор в определенных сайтах рестрикции. Кассетные сайты рестрикции предназначены для обеспечения вставки кассеты в правильную рамку считывания. Обычно чужеродная ДНК вставлена в один или более сайтов рестрикции векторной ДНК и затем переносится вектором в клетку-хозяина вместе с переносимой векторной ДНК. Сегмент или последовательность ДНК, имеющие вставленную или добавленную ДНК, например, вектор экспрессии, также можно назвать «конструкция ДНК».
Векторы экспрессии содержат кассету экспрессии и помимо этого обычно содержат точку инициации для автономной репликации в клетках-хозяевах или сайт интеграции в геном, один или более селективных маркеров (например, ген синтеза аминокислот или ген, придающий устойчивость к антибиотикам, таким как зеоцин, канамицин, G418 или гигромицин), ряд сайтов расщепления рестриктазами, подходящую промоторную последовательность и терминатор транскрипции, компоненты которых функционально соединены друг с другом. В настоящем документе термин «вектор» включает автономно реплицирующиеся нуклеотидные последовательности, а также нуклеотидные последовательности, интегрирующиеся в геном. Распространенным типом вектора является «плазмида», которая обычно представляет собой автономную молекулу двухцепочечной ДНК, которая может легко принимать дополнительную (чужеродную) ДНК и которая может быть легко введена в подходящую клетку хозяина. Плазмидный вектор часто содержит кодирующую ДНК и промоторную ДНК и имеет один или более сайтов рестрикции, подходящих для вставки чужеродной ДНК. В частности, термин «вектор» или «плазмида» относится к носителю, с помощью которого последовательность ДНК или РНК (например, чужеродный ген) может быть введена в клетку хозяина так, чтобы трансформировать хозяина и стимулировать экспрессию (например, транскрипцию и трансляцию) введенной последовательности.
В настоящем документе термин «клетка-хозяин» относится к первичным рассматриваемым клеткам, трансформированным для получения конкретного рекомбинантного белка, такого как АВМ или антитело, описанные в настоящем документе, и любому их потомству. Следует понимать, что не все потомство абсолютно идентично родительской клетке (вследствие преднамеренных или случайных мутаций или различий в окружении), однако такое измененное потомство включено в эти термины, если потомство сохраняет ту же функциональность, что и первоначально трансформированная клетка. Термин «линия клеток-хозяев» относится к линии клеток из клеток-хозяев, используемой для экспрессии рекомбинантного гена для получения рекомбинантных полипептидов, таких как рекомбинантные антитела. В настоящем документе термин «клеточная линия» относится к установленному клону конкретного типа клеток, который приобрел способность к пролиферации в течение продолжительного периода времени. Такая клетка-хозяин или линия клеток-хозяев может поддерживаться в культуре клеток и/или культивироваться для получения рекомбинантного полипептида.
Термин «выделенный» или «выделение», используемый в настоящем документе в отношении нуклеиновой кислоты, антитела или другого соединения, будет относиться к такому соединению, которое было в достаточной степени отделено от окружения, с которым оно было бы связано в природных условиях, так, чтобы существовать в «по существу чистой» форме. «Выделенный» не обязательно означает исключение искусственных или синтетических смесей с другими соединениями или материалами или присутствие примесей, которые не нарушают основную активность и которые могут присутствовать, например, из-за неполной очистки. В частности, подразумевается, что выделенные молекулы нуклеиновых кислот, кодирующие АВМ или антитело, описанные в настоящем документе, также включают оптимизированные по кодонам варианты природных последовательностей нуклеиновых кислот для улучшения экспрессии в определенной клетке-хозяине или химически синтезированные варианты.
Термин «выделенная нуклеиновая кислота» иногда используется в отношении нуклеиновых кислот. Этот термин, применительно к ДНК, относится к молекуле ДНК, которая отделена от последовательностей, которые являются непосредственно смежными с ней в природном геноме организма, из которого она изначально происходит. Например, «выделенная нуклеиновая кислота» может содержать молекулу ДНК, вставленную в вектор, такой как плазмидный или вирусный вектор, или интегрированную в геномную ДНК прокариотической или эукариотической клетки или организма-хозяина. Применительно к РНК термин «выделенная нуклеиновая кислота» относится главным образом к молекуле РНК, кодируемой выделенной молекулой ДНК, определенной выше. Согласно другому варианту термин может относиться к молекуле РНК, которая была в достаточной степени отделена от других нуклеиновых кислот, с которыми она была бы связана в своем природном состоянии (т.е. в клетках или тканях). «Выделенная нуклеиновая кислота» (ДНК или РНК) может дополнительно представлять собой молекулу, полученную непосредственно с помощью биологических или синтетических способов и отделенную от других компонентов, присутствующих во время ее получения.
Применительно к полипептидам или белкам, таким как выделенные антитела, термин «выделенный», в частности, будет относиться к соединениям, которые не содержат или по существу не содержат материал, с которым они связаны в природе, такой как другие соединения, с которыми они обнаруживаются в их природном окружении, или окружении, в котором их получают (например, клеточная культура), когда такой препарат получают с помощью технологии рекомбинантной ДНК, осуществляемой в условиях in vitro или in vivo. Выделенные соединения могут быть изготовлены с разбавителями или адъювантами, но для практических целей, тем не менее, являются выделенными, например, полипептиды или полинуклеотиды могут быть смешаны с фармацевтически приемлемыми носителями или вспомогательными веществами при применении в диагностике или терапии.
В настоящем документе термин «рекомбинантный» будет означать «получаемый с помощью генной модификации или полученный в результате генной модификации». В другом варианте используется термин «модифицированный». Например, антитело или домен антитела могут быть модифицированы для получения варианта с помощью модификации соответствующей исходной последовательности для получения модифицированного антитела или домена. Рекомбинантный хозяин, в частности, содержит вектор экспрессии или вектор для клонирования, или он был генетически модифицирован так, чтобы содержать последовательность рекомбинантной нуклеиновой кислоты, в частности, с применением нуклеотидной последовательности, чужеродной для хозяина. Рекомбинантный белок получают путем экспрессии соответствующей рекомбинантной нуклеиновой кислоты у хозяина. В настоящем документе термин «рекомбинантное антитело» включает антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных способов, такие как (а) антитела, выделенные из животного (например, мыши), которое является трансгенным или трансхромосомным по генам человеческого иммуноглобулина, или гибридомы, полученной из него, (b) антитела, выделенные из клетки-хозяина, трансформированной для экспрессии антитела, например, из трансфектомы, (с) антитела, выделенные из рекомбинантной комбинаторной библиотеки человеческих антител, и (d) антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, который включает сплайсинг последовательностей генов человеческих иммуноглобулинов с другими последовательностями ДНК. Такие рекомбинантные антитела включают антитела, модифицированные для включения перегруппировок и мутаций, которые происходят, например, во время созревания антитела.
После выявления антител с желательной структурой такие антитела могут быть получены способами, хорошо известными в данной области техники, включая, например, методы гибридомы или технологию рекомбинантной ДНК.
В гибридомном способе мышь или другое подходящее животное-хозяина, такое как хомяк, иммунизируют, чтобы вызвать выработку лимфоцитов, которые вырабатывают или способны вырабатывать антитела, которые будут специфически связываться с белком, применявшимся для иммунизации. Согласно другому варианту лимфоциты могут быть иммунизированы в условиях in vitro. Затем лимфоциты сливают с клетками миеломы с использованием подходящего агента для слияния, такого как полиэтиленгликоль, с образованием клетки гибридомы.
Культуральную среду, в которой размножаются клетки гибридомы, количественно исследуют, чтобы определить выработку моноклональных антител, направленных против антигена. Предпочтительно специфичность связывания моноклональных антител, вырабатываемых клетками гибридомы, определяют с помощью иммунопреципитации или количественного исследования связывания в условиях in vitro, такого как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ИФА).
Рекомбинантные моноклональные антитела можно получить, например, путем выделения ДНК, кодирующей требуемые цепи антитела, и трансфекции рекомбинантной клетки-хозяина кодирующими последовательностями для экспрессии, используя хорошо известные рекомбинантные векторы экспрессии, например, плазмиды или кассету (кассеты) экспрессии, содержащие нуклеотидные последовательности, кодирующие АВМ или антитело, описанные в настоящем документе. Рекомбинантные клетки-хозяева могут представлять собой прокариотические и эукариотические клетки, такие как клетки, описанные выше.
В соответствии с конкретным аспектом нуклеотидную последовательность можно применять для генетической манипуляции, чтобы гуманизировать антитело или улучшить аффинность или другие характеристики антитела. Например, константная область может быть модифицирована так, чтобы придать ей сходство с человеческими константными областями, чтобы избежать иммунного ответа, если антитело применяют в клинических исследованиях и лечении человека. Желательной может быть генетическая манипуляция над последовательностью антитела для получения большей аффинности в отношении антигена-мишени. Для специалиста в данной области техники будет очевидно, что одно или более полинуклеотидных изменений могут быть внесены в антитело, при сохранении его способности к связыванию с антигеном-мишенью.
Получение молекул антител различными способами, в целом хорошо изучено. В патенте США №6331415 (Cabilly et al.), например, описан способ рекомбинантного получения антител, в котором тяжелые и легкие цепи одновременно экспрессируются из одного вектора или из двух отдельных векторов в одной клетке. В Wibbenmeyer et al., (1999, Biochim Biophys Acta 1430(2): 191-202) и Lee and Kwak (2003, J. Biotechnology 101:189-198) описано получение моноклональных антител из вырабатываемых по отдельности тяжелых и легких цепей с использованием плазмид, экспрессируемых в отдельных культурах Е. coli. Различные другие методики, относящиеся к получению антител, представлены, например, в Harlow, et al., ANTIBODIES: A LABORATORY MANUAL, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (1988).
Моноклональные антитела получают с применением любого способа, который позволяет получать молекулы антител с помощью непрерывных клеточных линий в культуре. Примеры подходящих способов получения моноклональных антител включают гибридомные способы, описанные Kohler et al. (1975, Nature 256:495-497), и способ гибридомы на основе В-клеток человека (Kozbor, 1984, J. Immunol. 133:3001; и Brodeur et al., 1987, Monoclonal Antibody Production Techniques and Applications, (Marcel Dekker, Inc., New York), pp. 51-63).
ABM или антитело, описанные в настоящем документе, можно применять для введения для лечения субъекта, нуждающегося в этом.
В настоящем документе термин «субъект» будет относиться к теплокровному млекопитающему, в частности, к человеку или животному, отличному от человека. Соответственно, термин «субъект» также может относиться, в частности, к животным, включая собак, кошек, кроликов, лошадей, крупный рогатый скот, свиней и домашнюю птицу. В частности, АВМ или антитело, описанные в настоящем документе, предложены для медицинского применения для лечения субъекта или пациента, нуждающегося в профилактике или лечении патологического состояния. Термин «пациент» включает человека и других млекопитающих-субъектов, которые получают либо профилактическое, либо терапевтическое лечение. Соответственно, термин «лечение» включает как профилактическое, так и терапевтическое лечение.
В частности, АВМ или антитело, описанные в настоящем документе, предложены в по существу чистой форме. В настоящем документе термин «по существу чистый» или «очищенный» будет относиться к препарату, содержащему по меньшей мере 50% (масс/масс), предпочтительно по меньшей мере 60%, 70%, 80%, 90% или 95% соединения, такого как молекула нуклеиновой кислоты или антитело. Степень чистоты измеряют способами, подходящими для соединения (например, хроматографические способы, электрофорез в полиакриламидном геле, ВЭЖХ и т.п.).
Термин «терапевтически эффективное количество», используемый в настоящем документе взаимозаменяемо с любым из терминов «эффективное количество» или «достаточное количество» соединения, например, АВМ или антитела, описанных в настоящем документе, представляет собой количество или активность, достаточные, при введении субъекту, для оказания благоприятных или желательных результатов, включая клинические результаты, и, как таковое, эффективное количество или равнозначное ему зависит от ситуации, в которой его применяют.
Под эффективным количеством подразумевают такое количество соединения, которое достаточно для лечения, предотвращения или ингибирования таких заболеваний или нарушений. Применительно к заболеванию терапевтически эффективные количества АВМ или антитела, описанных в настоящем документе, в частности, применяют для лечения, модуляции, ослабления, обращения или воздействия на заболевание или состояние, в отношении которого получают благоприятный эффект в результате взаимодействия антитела с его антигеном-мишенью.
Количество соединения, которое будет соответствовать такому эффективному количеству, будет варьироваться в зависимости от различных факторов, таких как конкретный лекарственный препарат или соединение, фармацевтический состав, путь введения, тип заболевания или нарушения, особенности субъекта или хозяина, которого лечат, и т.п., но тем не менее может быть определено обычным специалистом в данной области техники.
АВМ или антитело, описанные в настоящем документе, в частности, можно применять в фармацевтической композиции. Следовательно, предложена фармацевтическая композиция, которая содержит АВМ или антитело, описанные в настоящем документе, и фармацевтически приемлемый носитель или вспомогательное вещество, например, искусственный носитель или вспомогательное вещество, которое не встречается в природе вместе с иммуноглобулином в жидкости организма, или которое встречается в природе вместе с иммуноглобулином, однако обеспечено в препарате, содержащем носитель или вспомогательное вещество в другом количестве или соотношении.
Фармацевтические композиции, описанные в настоящем документе, могут быть введены в виде болюсной инъекции или инфузии или путем непрерывной инфузии. Фармацевтические носители, подходящие для облегчения таких способов введения, хорошо известны в данной области техники.
Фармацевтически приемлемые носители обычно включают любые и все подходящие твердые или жидкие вещества, растворители, дисперсионные среды, покрытия, изотонические агенты и агенты, замедляющие всасывание, и тому подобное, которые физиологически совместимы с АВМ или антителом, описанными в настоящем документе. Дополнительные примеры фармацевтически приемлемых носителей включают стерильную воду, физиологический солевой раствор, забуференный фосфатом физиологический раствор, декстрозу, глицерин, этанол и тому подобное, а также комбинации любых из них.
Согласно одному такому аспекту АВМ или антитело можно комбинировать с одним или более носителями, подходящими для желательного пути введения. Антитела можно смешивать, например, с любым из лактозы, сахарозы, крахмала, сложных эфиров целлюлозы и алкановых кислот, стеариновой кислоты, талька, стеарата магния, оксида магния, натриевых и кальциевых солей фосфорной и серной кислот, гуммиарабика, желатина, альгината натрия, поливинилпирролидина, поливинилового спирта и необязательно дополнительно таблетировать или инкапсулировать для обычного введения. Согласно другому варианту АВМ или антитело могут быть растворены в физиологическом солевом растворе, воде, полиэтиленгликоле, пропиленгликоле, коллоидных растворах карбоксиметилцеллюлозы, этаноле, кукурузном масле, арахисовом масле, хлопковом масле, кунжутном масле, трагакантовой камеди и/или различных буферах. Другие носители, адъюванты и способы введения хорошо известны в фармацевтической области. Носитель может включать материал с контролируемым высвобождением или материал, замедляющий высвобождение, такой как моностеарат глицерина или дистеарат глицерина, по отдельности или с воском, или другие материалы, хорошо известные в данной области техники.
Дополнительные фармацевтически приемлемые носители известны в данной области техники и описаны, например, в REMINGTON'S PHARMACEUTICAL SCIENCES. Жидкие составы могут представлять собой растворы, эмульсии или суспензии и могут включать вспомогательные вещества, такие как суспендирующие агенты, солюбилизаторы, поверхностно-активные вещества, консерванты и хелатирующие агенты.
Предусмотрены фармацевтические композиции, в состав которых входят АВМ или антитело, описанные в настоящем документе, и один или более терапевтически активных агентов. Стабильные составы получают для хранения путем смешивания указанной АВМ или антитела, имеющих желаемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, вспомогательными веществами или стабилизаторами в форме лиофилизированных составов или водных растворов. Составы для применения для введения в условиях in vivo, в частности, являются стерильными, предпочтительно в форме стерильного водного раствора. Это может быть легко достигнуто с помощью фильтрации через стерильные фильтрующие мембраны или других способов. АВМ или антитело и другие терапевтически активные агенты, описанные в настоящем документе, могут быть также изготовлены в виде иммунолипосом и/или заключены в микрокапсулы.
Введение фармацевтической композиции, содержащей АВМ или антитело, описанные в настоящем документе, может быть выполнено различными способами, включая пероральное, подкожное, внутривенное, интраназальное, интраоптическое, трансдермальное, через слизистую оболочку, местное, например, гели, мази, лосьоны, кремы и т.д, внутрибрюшинное, внутримышечное, внутрилегочное, вагинальное, парентеральное, ректальное или внутриглазное введение.
Примеры составов, применяемых для парентерального введения, включают составы, подходящие для подкожных, внутримышечных или внутривенных инъекций, такие как, например, стерильный раствор, эмульсия или суспензия.
Согласно настоящему изобретению, в частности, предложены примерные АВМ и антитела, подробно описанные в приведенных в настоящем документе примерах. Возможны и другие варианты антител, например, включающие функциональные варианты приведенных в качестве примеров антител, например, в которых Fc дополнительно модифицирована для улучшения структуры и функции молекулы или в которых, в частности, получают антитела, содержащие разные CDR-сайты связывания или имеющие различную специфичность, в частности, в которых получены две разные области Fv.
Вышеизложенное описание будет в более полной мере понято со ссылкой на следующие примеры. Однако такие примеры являются только типичными для способов осуществления одного или более вариантов реализации настоящего изобретения и не должны рассматриваться как ограничивающие объем настоящего изобретения.
ПРИМЕРЫ
Пример 1: B10v5 х hu225M SEED
Описано биспецифическое антитело со структурой IgG. B10v5-Fab связывается с человеческим с-МЕТ, тогда как hu225M-Fab связывается с человеческим EGFR (рецептор эпидермального фактора роста). Контактная поверхность между легкой цепью hu225M и тяжелой цепью hu225M содержит мутации, которые направляют обе легкие цепи биспецифического IgG к их когнатным тяжелым цепям. Домены СН3 антитела заменяли доменами SEED (также называемыми SEED-AG или SEED-GA, Davis et al. 2010 и US 20070287170 A1), чтобы обеспечить гетеродимеризацию тяжелых цепей. Исследование методом LC-ESI-MS применяли для подтверждения правильности сборки всех четырех цепей. В дальнейшем для описания этого биспецифического IgG будет использован термин ВхМ.
Все указанные далее цепи клонировали по отдельности в вектор рТТ5 (Национальный исследовательский совет Канады) для экспрессии в системе млекопитающих.
Тяжелая цепь hu225M с SEED-GA была названа hu225M_HC_GA (SEQ ID 6):


подчеркнуто: сигнальный пептид 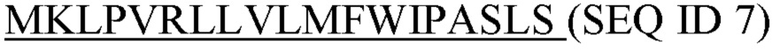
Легкая цепь hu225M была названа hu225M_LC (SEQ ID 8):

подчеркнуто: сигнальный пептид 
Тяжелая цепь B10v5 с SEED-AG была названа В 10v5_HC_AG (SEQ ID 9):

подчеркнуто: сигнальный пептид 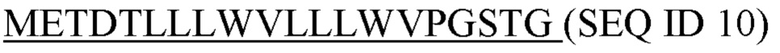
Легкая цепь B10v5 была названа В 10v5_LC (SEQ ID 11):

подчеркнуто: сигнальный пептид 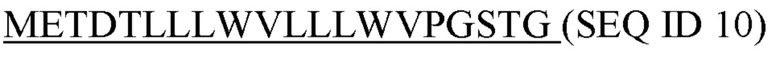
Введение мутаций контактной поверхности в hu225M
Мутации вводили с помощью сайт-направленного мутагенеза с использованием набора для направленного мутагенеза QuikChange Lightning (каталожный номер 210519, Agilent Technologies) в соответствии с протоколом производителя. Мутацию K26D вводили в CH1 hu225M_HC_AG, и мутацию T18R вводили в CL hu225M_LC. Успешное введение мутации подтверждали секвенированием гена, представляющего интерес.
Тяжелая цепь hu225M с мутацией K26D была названа hu225M_HC_resQ28_GA (SEQ ID 12):

подчеркнуто: сигнальный пептид 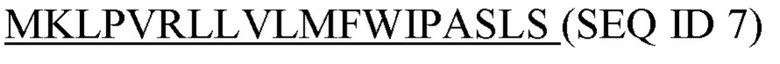
Легкая цепь hu225M с мутацией T18R была названа hu225M_LC_MB40 (SEQ ID 13)

подчеркнуто: сигнальный пептид 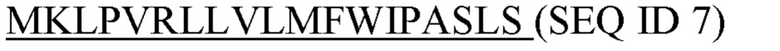
Экспрессия и очистка ВхМ дикого типа и мутантного ВхМ МаВ40 в клетках Expi293F™
ВхМ экспрессировали с использованием клеток Expi293F™ и набора для трансфекции ExpiFectamine™ 293 (ThermoFisher, А14525) в соответствии с протоколом производителя. Были запланированы две различные трансфекции:
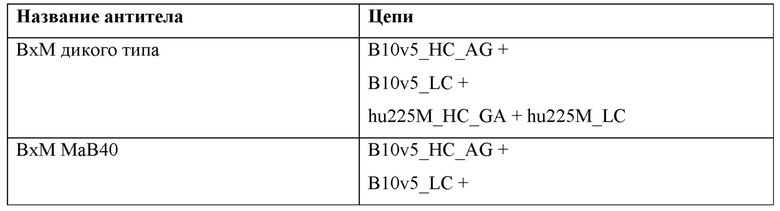

ДНК, кодирующая каждую цепь, была на четырех различных плазмидах. Молярное соотношение плазмид во время трансфекции составило 2:1:1:1 (тяжелая цепь В10v5:легкая цепь В10v5:тяжелая цепь hu225М:легкая цепь hu225M).
Мутант ВхМ МаВ40 содержал мутацию K26D на СН1 из hu225M (hu225M_HC_resQ28_GA, SEQ ID 12) и T18R на CL из hu225M (hu225M_LC_MB40, SEQ ID 13), тогда как ВхМ дикого типа не содержал мутацию. Культуры центрифугировали, и супернатанты, содержащие представляющий интерес белок, фильтровали через фильтр с размером пор 0,22 мкм и очищали с использованием набора для очистки антител Montage и колонок для центрифугирования со средами PROSEP-A (Merck-Millipore, LSK2ABA20) в соответствии с инструкциями производителя. Очищенный ВхМ дикого типа и ВхМ МаВ40 концентрировали с использованием Amicon ultra-15, НОММ 10 кДа, и затем подвергали диализу с использованием диализных кассет Slide-A-Lyser 0,5-3 мл с НОММ 7000 (ThermoFisher, каталожный номер 66370) против фосфатно-солевого буфера (ФСБ). В общей сложности ВхМ дикого типа и ВхМ МаВ40 дважды независимо экспрессировали, очищали и исследовали. Оба параллельных опыта привели к сходным результатам.
Исследование методом LC-ESI-MS для анализа спаривания цепей
N-гликаны обоих образцов высвобождали с использованием PNGaзы F перед измерением с помощью системы LC-ESI-MS. Рассчитывали массы всех десяти возможных вариантов спаривания цепей, и масс-спектры исследовали для определения их присутствия. Вариант с ошибочным спариванием, который содержал четыре разные цепи, но обе легкие цепи были связаны с некогнатными для них тяжелыми цепями (т.е. ВхМ с переставленными легкими цепями), имеет такую же массу, как и правильно собранный ВхМ, и, следовательно, не отличим от правильно спаренного ВхМ. Однако если ошибочное спаривание одной или обеих легких цепей с некогнатными для них тяжелыми цепями не поддается детектированию, то можно статистически исключить присутствие ВхМ с переставленными легкими цепями. Аналогичным образом, если ошибочное спаривание обеих легких цепей детектируется только в небольших количествах (относительное содержание <5%), тогда указанный вариант с ошибочным спариванием будет присутствовать только в незначительных количествах (<1%).
Гомодимеры тяжелых цепей не детектировали ни в одном из образцов (Фигура 1). В ВхМ дикого типа обе легкие цепи были способны связываться с некогнатной для них тяжелой цепью в одинаковых количествах (относительное содержание 12% в обоих случаях), что привело лишь к 76% правильно спаренного ВхМ (не учитывая ВхМ с переставленными легкими цепями). В ВхМ МаВ40 ошибочное спаривание не поддавалось детектированию, и детектировали только правильно спаренный биспецифический IgG.
В заключение следует отметить, что введение мутаций контактной поверхности привело к полному исчезновению ошибочного спаривания легкой цепи с тяжелой цепью.
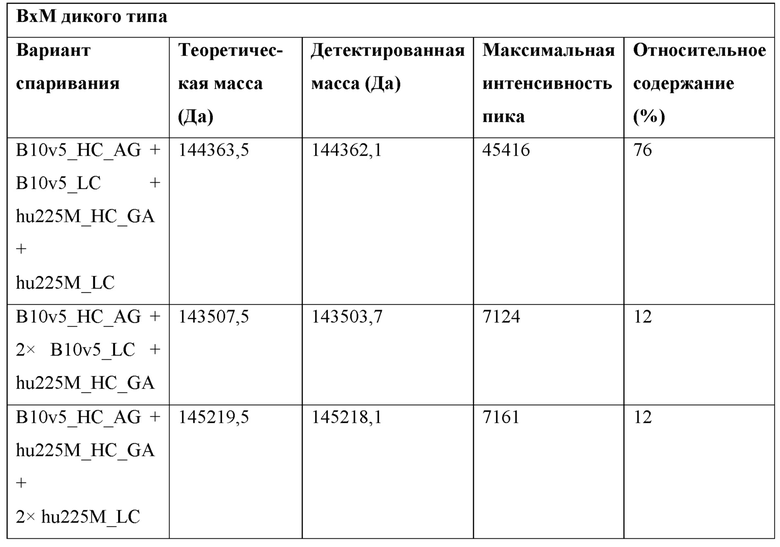
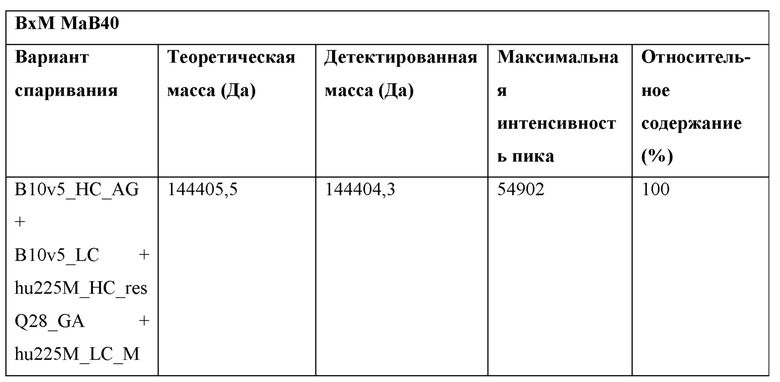
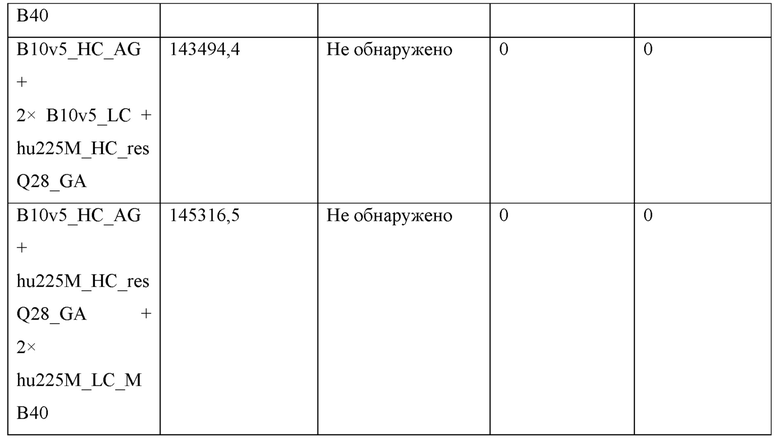
Эксклюзионная ВЭЖХ (HPLC-SEC)
ВхМ дикого типа и ВхМ МаВ40 исследовали с использованием эксклюзионной хроматографии (SEC). Обе хроматограммы показали основной пик через 15,6 мин, который ожидался для IgG. Признаки агрегации детектировали как у мутанта, так и у дикого типа (Фигура 2).
Количественное исследование термического сдвига для определения термостабильности
Количественное исследование термического сдвига проводили с использованием системы для ПЦР в режиме реального времени Step One Plus. Концентрация ВхМ дикого типа и ВхМ МаВ40 составила 1 мкМ в ФСБ, также использовали краситель Sypro Orange (Invitrogen) в конечной концентрации 20×. Оба образца измеряли с тремя повторами. Термограмма ВхМ дикого типа выявила два события разворачивания при 64,8°С и 74,5°С. Термограмма ВхМ МаВ40 выявила два события разворачивания при 64,6°С и 74,6°С. Соответственно, мутации контактной поверхности не нарушают термостабильность белка.
Аффинность ВхМ в отношении его антигенов
Аффинность ВхМ дикого типа и МаВ40 исследовали с использованием системы Octet с биосенсорами, покрытыми белком А. В качестве антигенов использовали внеклеточные домены сМЕТ и EGFR. Для определения аффинности испытывали три различные концентрации антител. KD ВхМ дикого типа в отношении сМЕТ составила 0,35 нМ, и 5,3 нМ в отношении EGFR. KD ВхМ МаВ40 в отношении сМЕТ составила 0,42 нМ и 2,9 нМ в отношении EGFR, это подтверждает то, что мутации контактной поверхности не нарушают аффинность антитела.
Одновременное связывание обоих антигенов
Способность ВхМ одновременно связываться с обоими своими антигенами подтверждали с использованием системы Octet с биосенсорами, покрытыми стрептавидином. Сначала биосенсоры погружали в раствор, содержащий биотинилированный сМЕТ. После гашения и замены буфера биосенсоры погружали в растворы, содержащие ВхМ дикого типа или ВхМ МаВ40. В обоих случаях детектировали связывание антитела с его первым антигеном. После этого биосенсоры погружали в раствор, содержащий EGFR, и детектировали связывание дикого типа и МаВ40 со вторым антигеном.
Влияние мутаций контактной поверхности на выход в НЕK293-6Е
ВхМ дикого типа и ВхМ МаВ40 экспрессировали в клетках НЕK293-6Е (Национальный исследовательский совет Канады) с использованием кратковременной трансфекции полиэтиленимином (ПЭИ) в соответствии со стандартными методиками. Экспрессированные IgG очищали с помощью аффинной хроматографии с белком А и подвергали диализу против ФСБ. Поглощение образцов обоих белков измеряли при 280 нм для определения концентрации. В общей сложности оба белка трижды независимо экспрессировали, очищали и измеряли, и рассчитывали средний выход. Выход ВхМ дикого типа составил 57,3 мг/л (±13,7 стандартного отклонения), и выход ВхМ МаВ40 составил 58,9 мг/л (±7,3 стандартного отклонения), это указывает на то, что модификация контактной поверхности не оказывает неблагоприятного влияния на выход белка.
Пример 2: B10v5xOKT3 SEED
Описано биспецифическое антитело IgG, структура которого аналогична той, которая описана в примере 1. B10v5-Fab связывается с человеческим с-МЕТ, тогда как ОKТ3-Fab связывается с человеческим CD3. Контактная поверхность между легкой цепью ОKТ3 и тяжелой цепью ОKТ3 содержит те же мутации, что описаны в примере 1. Помимо этого в B10v5-Fab вводили мутации, чтобы дополнительно обеспечить правильное спаривание легкой и тяжелой цепей. Как указано выше, технологию SEED применяли для гетеродимеризации тяжелых цепей. Исследование методом LC-ESI-MS применяли для подтверждения правильности сборки всех четырех цепей. В дальнейшем для описания этого биспецифического IgG будет использован термин ВхО.
Клонирование конструкций
Тяжелая цепь B10v5 (SEQ ID 9) и легкая цепь (SEQ ID 11) описаны в примере 1.
Все указанные далее цепи клонировали по отдельности в вектор рТТ5 (Национальный исследовательский совет Канады) для экспрессии в системе млекопитающих.
Тяжелая цепь ОKТ3 была названа OKT3_HC_GA (SEQ ID 14)

подчеркнуто: сигнальный пептид 
Легкая цепь ОKТ3 была названа OKT3_LC (SEQ ID 15)

подчеркнуто: сигнальный пептид 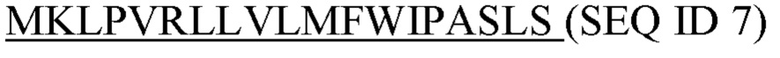
Введение мутаций контактной поверхности в ОKТ3 и B10v5
Мутации вводили с помощью сайт-направленного мутагенеза с использованием набора для направленного мутагенеза QuikChange Lightning (каталожный номер 210519, Agilent Technologies) в соответствии с протоколом производителя, как описано выше. В ОKТ3 вводили мутации K26D в СН1 и T18R в CL. В B10v5 вводили мутации A20L в СН1 и либо F7S, F7A либо F7V в CL. Успешное введение мутаций подтверждали секвенированием гена, представляющего интерес.
Тяжелая цепь ОKТ3 с мутацией K26D была названа OKT3_HC_resQ28_GA (SEQ ID 16)


подчеркнуто: сигнальный пептид 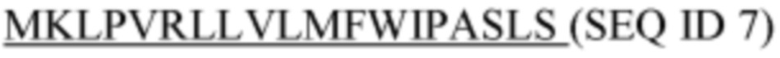
Легкая цепь ОKТ3 с мутацией T18R была названа OKT3_LC_MB40 (SEQ ID 17)

подчеркнуто: сигнальный пептид 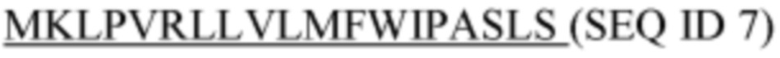
Тяжелая цепь B10v5 с мутацией A20L была названа В 10v5_HC_resQ203_AG (SEQ ID 18)

подчеркнуто: сигнальный пептид 
Легкая цепь B10v5 с мутацией F7S была названа В 10v5_LC_MB9 (SEQ ID 19)

подчеркнуто: сигнальный пептид 
Легкая цепь B10v5 с мутацией F7A была названа В 10v5_LC_MB21 (SEQ ID 20)

подчеркнуто: сигнальный пептид
Легкая цепь B10v5 с мутацией F7V была названа В 10v5_LC_MB45 (SEQ ID 21)

подчеркнуто: сигнальный пептид 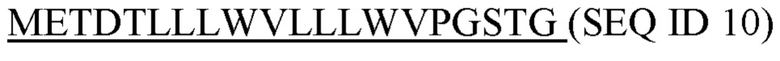
Экспрессия и очистка ВхО дикого типа и мутантов ВхО МаВ40, ВхО МаВ5/40, ВхО МаВ 21/40 и ВхО МаВ45/40 в клетках НЕK293-6Е
Биспецифические антитела экспрессировали в клетках FIEK293-6E с использованием кратковременной трансфекции полиэтиленимином (ПЭИ) в соответствии со стандартными методиками. Были запланированы четыре различные трансфекции:
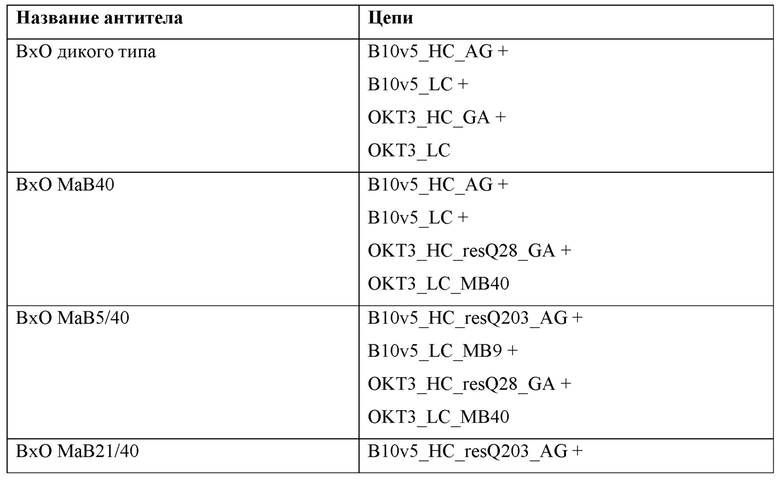
ДНК, кодирующая каждую цепь, была на четырех разных плазмидах. Молярное соотношение плазмид во время трансфекции составило 2:1:1:1 (тяжелая цепь В10v5:легкая цепь В10v5:тяжелая цепь ОKТ3:легкая цепь ОKТ3). Культуры собирали через 5 дней после трансфекции с помощью центрифугирования, и супернатанты очищали с помощью аффинной хроматографии с белком А. Все образцы подвергали диализу против ФСБ.
Исследование методом LC-ESI-MS для анализа спаривания цепей
N-гликаны обоих образцов высвобождали с использованием PNGaзы F перед измерением. Исследование проводили, как описано в примере 1. Введение мутаций контактной поверхности привело к заметному уменьшению детектируемого ошибочного спаривания легкой цепи с тяжелой цепью (Фигура 3).
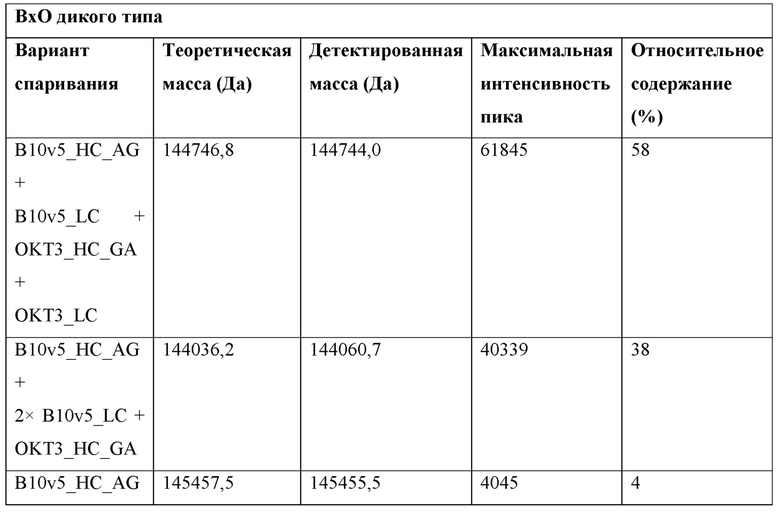


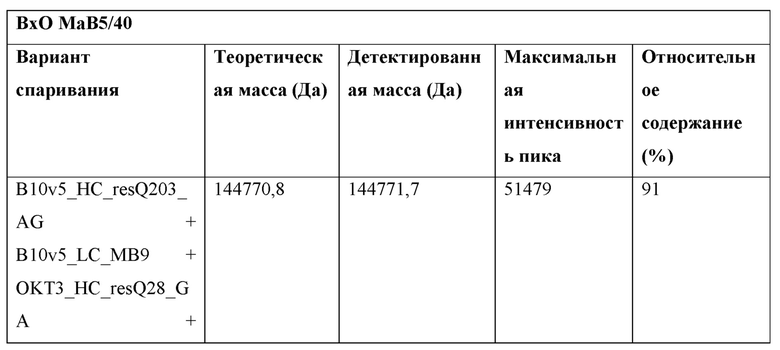
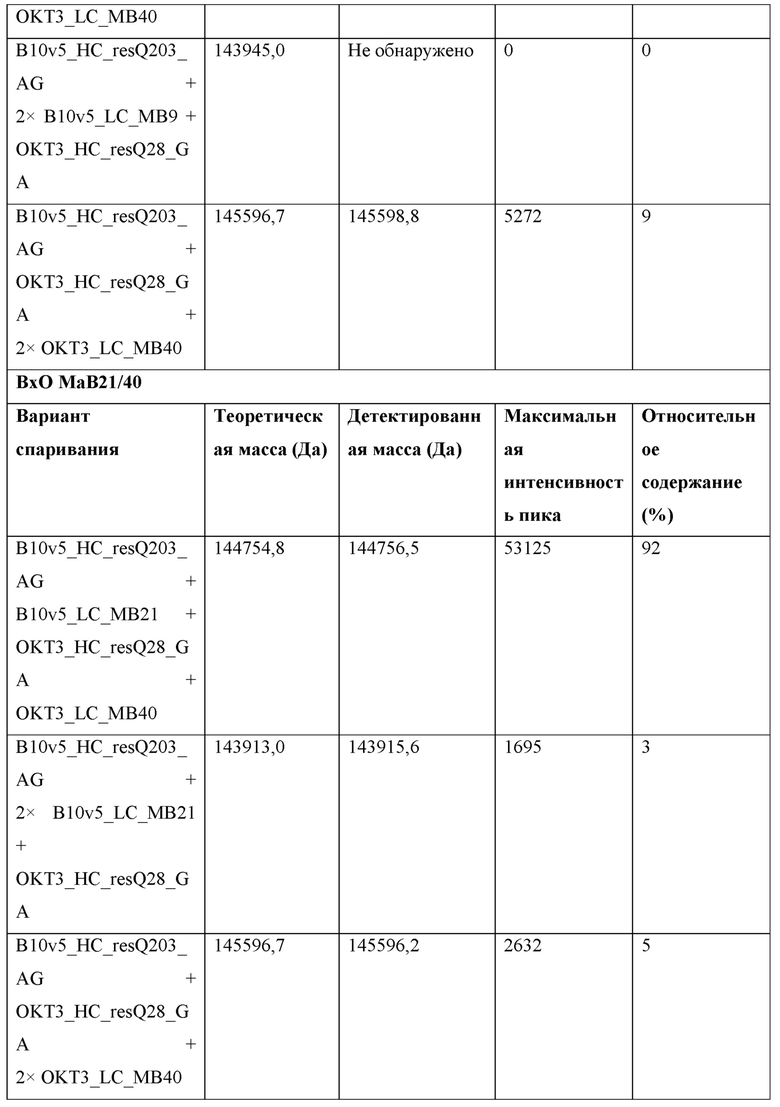
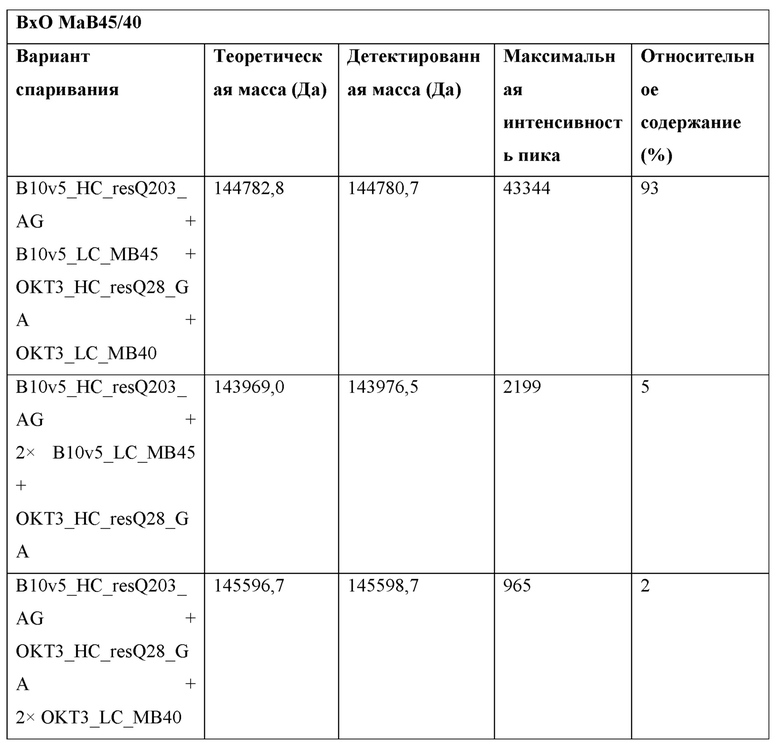
Эксклюзионная хроматография ВЭЖХ (HPLC-SEC)
ВхО дикого типа, ВхО МаВ5/40 и ВХО МаВ45/40 исследовали с использованием SEC. Все хроматограммы показали основной пик через 15,5 мин, который ожидался для IgG (Фигура 4). Признаки агрегации детектировали у мутантов, а также дикого типа в сходных количествах.
Обсуждение
В примере 1 описано получение биспецифического антитела со структурой IgG, названного ВхМ, с мутациями в Fab hu225M или без них. Исследование ВхМ дикого типа с помощью LC-ESI-MS демонстрирует проблему получения биспецифического IgG без какой-либо модификации, чтобы обеспечить правильное спаривание легких цепей с их когнатными тяжелыми цепями. Обе легкие цепи были способны связываться с некогнатной для них тяжелой цепью до суммарного количества 24%, что, в свою очередь, означает, что правильно спаренный биспецифический IgG составлял только 76% образца очищенного белка.
Для создания мутанта ВхМ МаВ40 вводили только две точечные мутации: K26D в СН1 и T18R в CL, обе в hu225M Fab. Этих мутаций было достаточно, чтобы полностью ингибировать неправильное спаривание легкой цепи с тяжелой цепью. В отличие от предыдущих сообщений (Lewis er al. 2014, Liu et al. 2015), модификация вариабельных доменов не требовалась. Следовательно, мутации согласно настоящему изобретению потенциально могут широко применяться в различных других биспецифических антителах. Кроме того, исключение любой мутации в вариабельных доменах ограничивает риск нежелательного влияния на аффинность антитела в отношении его антигена.
Дальнейшее изучение выявило, что мутации, введенные в ВхМ МаВ40, не оказывали неблагоприятного влияния на термическую стабильность, а также на выход белка. Кроме того, ВхМ МаВ40 обладал аффинностью в отношении обоих своих антигенов, сходной с таковой для ВхМ дикого типа, и был способен одновременно связываться с обоими антигенами, что было продемонстрировано с помощью интерферометрии биослоев. Эксклюзионная хроматография не выявила различий между ВхМ МаВ40 и ВхМ дикого типа, это доказывает, что мутации не приводят к повышенной агрегации или разрушению антитела.
Чтобы оценить, имеют ли идентифицированные мутации общее применение, конструировали другое биспецифическое антитело, ВхО, как показано в примере 2. Аналогично примеру 1, ВхО без мутаций (дикого типа) сравнивали с ВхО с мутациями K26D в СН1 и T18R в CL из Fab ОKТ3 (называемый ВхО МаВ40). Исследование ВхО дикого типа с помощью LC-ESI-MS выявило, что ошибочное спаривание легких цепей с некогнатными для них тяжелыми цепями было более распространенным, чем ошибочное спаривание, детектированное в ВхМ дикого типа. В целом более 40% детектированных IgG проявили ошибочное спаривание в Fab, что привело к менее чем 60% правильно спаренного ВхО. Исследование ВхО МаВ40 показало, что введение вышеупомянутых мутаций снова оказало значительное влияние на спаривание легких цепей. 74% детектированных IgG в ВхО МаВ40 были правильно спарены. Чтобы дополнительно обеспечить правильную сборку цепей, поддерживающие мутации вводили в другой Fab ВхО, т.е. B10v5 Fab, что привело к созданию ВхО МаВ5/40, ВхО МаВ21/40 и ВхО МаВ45/40. Во всех трех мутантах, содержащих поддерживающие мутации, количество правильно спаренных биспецифических IgG было значительно улучшено (относительное содержание >90% по данным LC-ESI-MS).
Исследование ВхО дикого типа, ВхО МаВ5/40 и ВХО МаВ45/40 методом эксклюзионной хроматографии продемонстрировало, что данные мутации не оказывают неблагоприятного влияния на антитело в отношении агрегации или разрушения.
Пример 3: Поверхностное экспонирование боковых цепей аминокислот в положениях на контактной поверхности между СН1 и CL
Для расчета доступной для растворителя площади поверхности или энергии сольватации белков применяли программу GETAREA (Fraczkiewicz et al. 1998, J. Соmр. Chem., 19, 319-333). Атомные координаты фрагмента Fab человеческого IgG1, 1DFB.pdb, который представляет собой фрагмент Fab человеческого моноклонального антитела против gp41 вируса иммунодефицита человека типа 1 с доменами СН1 и CL дикого типа (Не et al. 1992, Proc.Natl.Acad.Sci.USA 89: 7154-7158), вводили в программу в качестве входных данных. Применяли радиус зонда 1,4 Ангстрем. Выходные данные программы для остатков ALA20 и LYS26 в домене СН1, а также РНЕ7 и THR18 в домене CL показаны в таблице I ниже.
Вклады атомов остова и боковых цепей перечислены в 4 и 5 колонках, соответственно. В следующем столбце перечислено соотношение площади поверхности боковой цепи и значения «случайной спирали» на остаток. Значение «случайной спирали» остатка X представляет собой среднюю доступную для растворителя площадь поверхности X в трипептиде Gly-X-Gly в группе из 30 случайных конформаций. Остатки считаются подверженными воздействию растворителя, если значение соотношения превышает 50%, скрытыми, если соотношение меньше 20%, и не скрытыми, если соотношение составляет не менее 20%. Значения «случайной спирали» для 20 аминокислот приведены в таблице II ниже.

Из результатов, показанных в таблице I выше, следует, что три из четырех остатков скрыты (значение соотношения (%) менее 5%), тогда как остаток THR18 в домене CL имеет значение соотношения (%) 38,3 и поэтому не скрыт.
Неожиданно было обнаружено, что мутантное положение THR18 в домене CL, которое не скрыто внутри контактной поверхности СН/СН1, приводит к улучшенному спариванию доменов CL/CH1. В частности, улучшенное спаривание было обнаружено при спаривании домена CL с доменом СН1, где остаток аминокислоты в положении 18 в домене CL имеет полярность, противоположную остатку аминокислоты в положении 26 в домене СН1, как подробно описано в настоящем документе.
Этот факт был еще более неожиданным, поскольку в подходах к модификации в предшествующем уровне техники применяли определенные критерии для отбора пар остатков вдоль контактной поверхности тяжелой и легкой цепей, которые должны быть заменены заряженными остатками с противоположной полярностью. Согласно такими критериями в соответствии с предшествующим уровнем техники (например, Liu et al. Journal Of Biological Chemistry 2015, 290:7535-7562; и WO2014/081955A1) полагали принципиально важным, что все положения скрыты.
Соответственно, положение 18 в домене CL является исключением из этого правила предшествующего уровня техники и неожиданно способствует стабильности пары доменов CL/CH1, несмотря на то, что оно не скрыто внутри контактной поверхности СН1 и CL.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2780629C1 |
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2750721C2 |
| МОДИФИЦИРОВАННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2832921C1 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИЕ К PD1 И TIM3 | 2016 |
|
RU2729371C1 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С HLA-A2/WT1 | 2018 |
|
RU2815176C2 |
| ТРИ- ИЛИ ТЕТРАСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2010 |
|
RU2570633C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2019 |
|
RU2797268C2 |
| ДВУХВАЛЕНТНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2008 |
|
RU2547615C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2663123C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2020 |
|
RU2841523C2 |
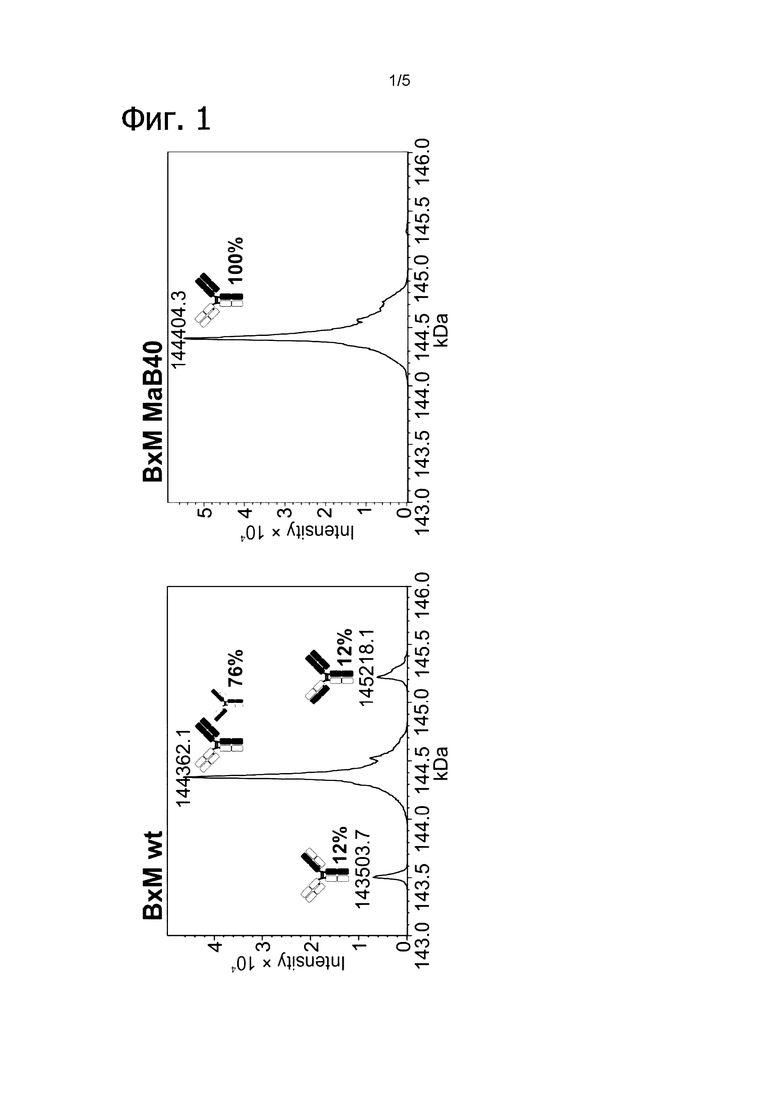
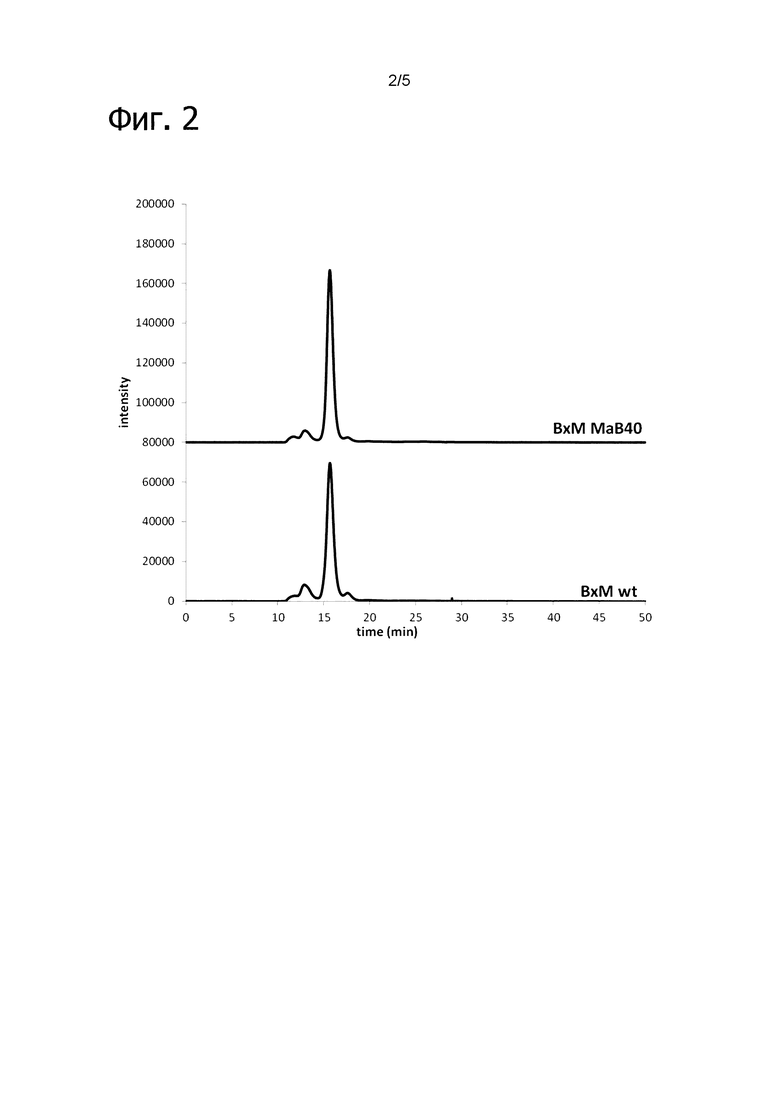
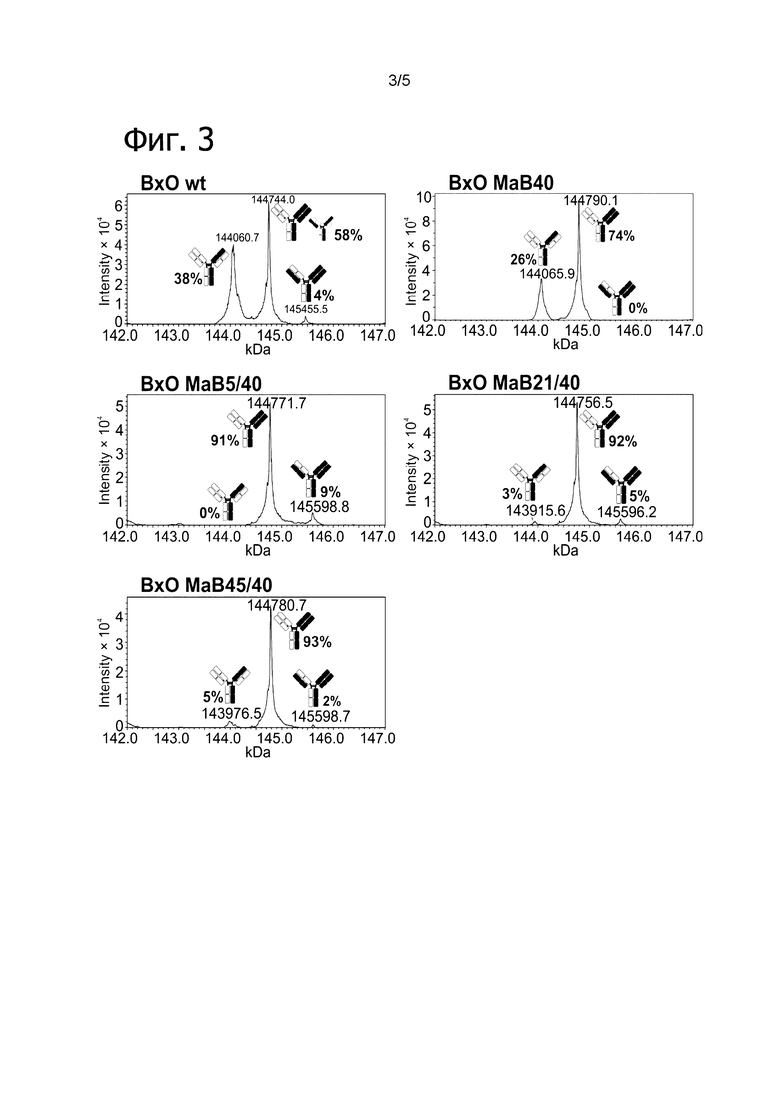
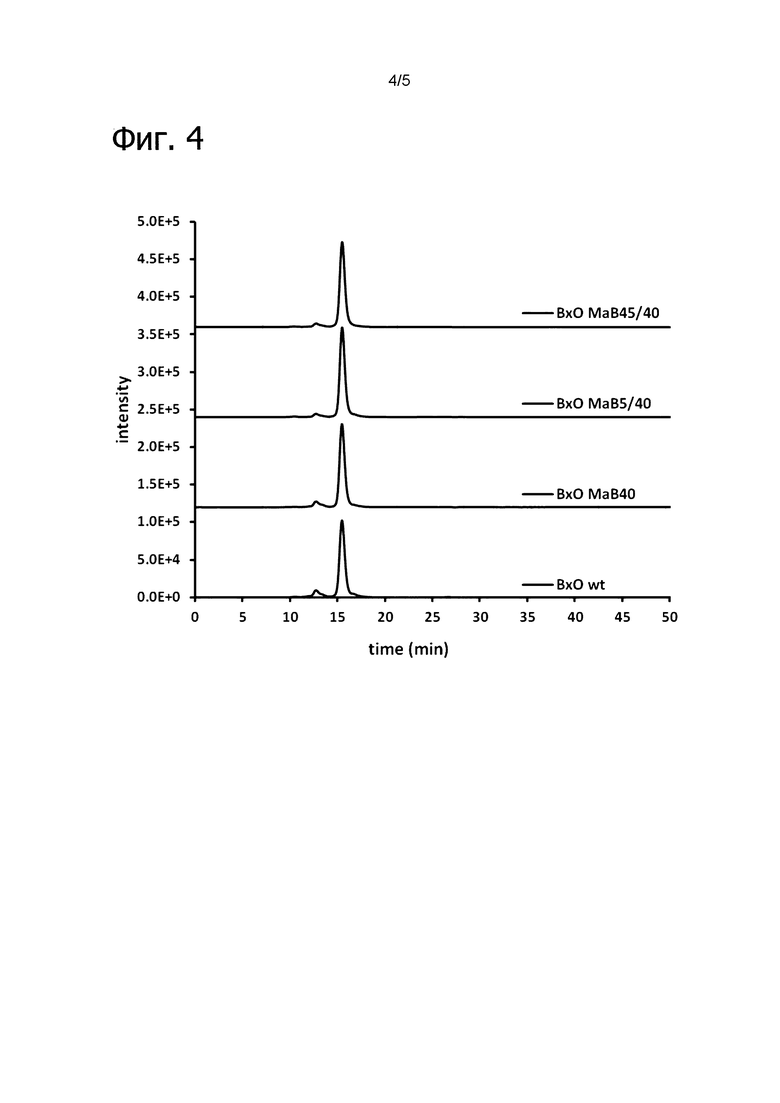

Изобретение относится к области биохимии, в частности к способу получения антигенсвязывающей молекулы (ABM), которая представляет собой гетеродимерное антитело IgG. Изобретение обеспечивает улучшенное спаривание тяжелой и легкой цепей антитела, которое поддерживает правильное спаривание HC и LC в биспецифическом антителе IgG. 9 з.п. ф-лы, 5 ил., 3 табл., 3 пр.
1. Способ получения антигенсвязывающей молекулы (ABM), которая представляет собой гетеродимерное антитело IgG, содержащее первое и второе плечи Fab, распознающие разные антигены или эпитопы, причем только одно из указанных первого и второго плеч Fab содержит когнатный димер легкой цепи/тяжелой цепи (LC/HC) из легкой цепи антитела (LC), состоящей из домена антитела VL и CL, связанной с тяжелой цепью антитела (HC), содержащей по меньшей мере домен антитела VH и CH1, причем указанная связь осуществляется за счет спаривания указанных доменов VL и VH и доменов CL и CH1, причем аминокислоты в положении 18 в домене CL и в положении 26 в домене CH1 имеют противоположную полярность, при этом нумерация приведена в соответствии с IMGT; включающий конструирование доменов CL и CH1 путем введения точечной(ых) мутации(ий) с получением указанных аминокислот в положении 18 в домене CL и в положении 26 в домене CH1, имеющих противоположную полярность.
2. Способ по п. 1, отличающийся тем, что
A
a) домен CL представляет собой C-каппа, содержащий аминокислотную последовательность SEQ ID 1, сконструированную таким образом, что она содержит точечную мутацию T18X, где X представляет собой любой из R, H или K; и
b) домен CH1 содержит аминокислотную последовательность SEQ ID 3, сконструированную таким образом, что она содержит точечную мутацию K26X, где Х представляет собой любой из D или Е;
или B
a) домен CL представляет собой С-лямбда, содержащий аминокислотную последовательность SEQ ID 2, сконструированную таким образом, что она содержит точечную мутацию K18X, где Х представляет собой любой из D или Е; и
b) домен CH1 содержит аминокислотную последовательность SEQ ID 3, где K в положении 26 не заменен любой другой аминокислотой, или которая сконструирована таким образом, что она содержит точечную мутацию K26X, где Х представляет собой любой из R или H;
или C
a) домен CL представляет собой С-лямбда, содержащий аминокислотную последовательность SEQ ID 2, где K в положении 18 не заменен любой другой аминокислотой, или которая сконструирована таким образом, что она содержит точечную мутацию K18X, где X представляет собой любой из R или H; и
b) домен CH1 содержит аминокислотную последовательность SEQ ID 3, которая сконструирована таким образом, что она содержит точечную мутацию K26X, где Х представляет собой любой из D или Е;
при этом нумерация приведена в соответствии с IMGT.
3. Способ по п. 1 или 2, отличающийся тем, что когнатный димер LC/HC содержит по меньшей мере один междоменный дисульфидный мостик между доменами CL и CH1.
4. Способ по любому из пп. 1-3, отличающийся тем, что домен CL дополнительно содержит точечную мутацию F7X, где X представляет собой любой из S, A или V, и домен CH1 дополнительно содержит точечную мутацию A20L, причем нумерация приведена в соответствии с IMGT.
5. Способ по любому из пп. 1-4, отличающийся тем, что указанные домены VL и VH не содержат какую-либо точечную мутацию, изменяющую полярность аминокислоты в области контактной поверхности.
6. Способ по любому из пп. 1-5, отличающийся тем, что указанная HC дополнительно содержит по меньшей мере один домен СН2 и по меньшей мере один домен СН3.
7. Способ по любому из пп. 1-6, отличающийся тем, что указанное первое плечо Fab содержит
a) точечную мутацию F7X в указанном домене CL, где X представляет собой любой из S, A или V; и
b) точечную мутацию A20L в указанном домене CH1;
при этом нумерация приведена в соответствии с IMGT.
8. Способ по любому из пп. 1-7, отличающийся тем, что
A
a) указанное первое плечо Fab, содержащее указанный когнатный димер LC/HC, характеризуется точечными мутациями, определенными в любом из пп. 1 или 2, причем указанные домены CL и CH1 дополнительно содержат точечные мутации, определенные в п. 4; и
b) указанное второе плечо Fab не содержит какую-либо из точечных мутаций a), или
B
a) указанное первое плечо Fab, содержащее указанный когнатный димер LC/HC, характеризуется точечными мутациями, определенными в любом из пп. 1 или 2, причем указанные домены CL и CH1 дополнительно не содержат точечные мутации, определенные в п. 4; и
b) указанное второе плечо Fab содержит точечные мутации, определенные в п. 4.
9. Способ по любому из пп. 1-8, дополнительно включающий две HC, каждая из которых содержит домен СН2 и домен СН3, причем HC димеризуются с образованием области Fc, при этом указанные домены СН3 модифицированы для введения одного или более из следующих:
а) гетеродимеров CH3 с доменом, сконструированным путем обмена цепей (SEED), которые состоят из чередующихся сегментов последовательностей CH3 человеческого IgA и IgG;
b) одной или более мутаций типа «выступ» или «впадина», предпочтительно любой из T366Y/Y407’T, F405A/T394’W, T366Y:F405A/T394‘W:Y407’T, T366W/Y407’A и S354C:T366W/Y349′C:T366′S:L368′A:Y407′V;
c) остатка цистеина в первом домене СН3, который ковалентно соединен с остатком цистеина во втором домене СН3 с введением междоменного дисульфидного мостика, предпочтительно соединяющего С-конец обоих доменов СН3;
d) одной или более мутаций, в которых отталкивающий заряд подавляет образование гетеродимера, предпочтительно любой из: K409D/D399′K, K409D/D399′R, K409E/D399′K, K409E/D399′R, K409D:K392D/D399’K:E356’K или K409D:K392D:K370D/ D399’K:E356’K:E357’K; и/или
е) одной или более мутаций, выбранных для образования гетеродимера и/или термостабильности, предпочтительно любой из:
T350V:L351Y:F405A:Y407V/T350V:T366L:K392L:T394W,
T350V:L351Y:F405A:Y407V/T350V:T366L:K392M:T394W,
L351Y:F405A:Y407V/T366L:K392M:T394W,
F405A:Y407V/T366L:K392M:T394W, или
F405A:Y407V/T366L:T394W,
при этом нумерация соответствует индексу ЕС согласно Kabat.
10. Способ по любому из пп. 1-9, дополнительно включающий культивирование клетки-хозяина, сконструированной для экспрессии указанной ABM в условиях, подходящих для экспрессии указанной ABM.
| ZHI L | |||
| et al., A Novel Antibody Engineering Strategy forMaking Monovalent Bispecific Heterodimeric IgG Antibodies by Electrostatic Steering Mechanism, 2015, Journal of Biological Chemistry, v | |||
| РЕЛЬСОВАЯ ПЕДАЛЬ | 1920 |
|
SU290A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| WO 2014081955 A1, 30.05.2014 | |||
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ АЛЬФА-ИНТЕРФЕРОНА ЧЕЛОВЕКА | 2009 |
|
RU2532832C2 |
Авторы
Даты
2023-03-22—Публикация
2018-02-02—Подача