1. Область техники, к которой относится настоящее изобретение
Настоящее изобретение основано на обнаружении того, что введение полипептидов, содержащих по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF), пациентам-людям с эпизодом тромботической тромбоцитопенической пурпуры (TTP), например, с первоначальным эпизодом и/или рецидивирующим эпизодом TTP, приводит к улучшению исходов, в том числе к более короткому времени до ответа в виде изменения числа тромбоцитов, более низкой доле пациентов со смертельным исходом, рецидивом или большим тромбоэмболическим событием (TE) на протяжении периода лечения, более низкой частоте рецидивов и предупреждению рефрактерности. В настоящем изобретении предусмотрен полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, для применения в лечении заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом. Кроме того, настоящее изобретение относится к стандартным лекарственным формам, наборам и медицинским путям применения для лечения TTP.
2. Предпосылки изобретения
2.1 Роль vWF в агрегации тромбоцитов
Мультимерный белок плазмы крови vWF существенно важен для привлечения циркулирующих тромбоцитов к поврежденной стенке сосуда при повреждении сосудов. Это привлечение опосредуется связыванием домена A1 vWF с рецепторным гликопротеином тромбоцитов GPIb-IX-V.
После экспрессии эндотелиальными клетками vWF секретируется в кровоток в виде сверхкрупных мультимеров или сверхкрупных vWF (ULvWF). Эти мультимеры подвергаются процессингу до меньших мультимеров обычного размера посредством ферментативного расщепления дезинтегриноподобной металлопротеазой с тромбоспондиновыми повторами 13 (ADAMTS13). В этих мультимерах vWF обычного размера участок связывания рецептора тромбоцитов GPIb-IX-V в домене A1 является скрытым и не будет самопроизвольно реагировать с тромбоцитами. Конформационная активация участка связывания рецептора тромбоцитов GPIb-IX-V в домене A1 запускается иммобилизацией или в условиях напряжения сдвига, что приводит к адгезии тромбоцитов и последующему образованию тромба.
2.2 Роль vWF и процессинга vWF в патофизиологических особенностях TTP
ТТР является редким и опасным для жизни заболеванием системы свертывания крови, в которое вовлечено накопление мультимеров ULvWF, что приводит к повышенному риску образования тромбов в мелких кровеносных сосудах из-за чрезмерной агрегации тромбоцитов. Данное состояние характеризуется системной агрегацией тромбоцитов в микрокровотоке, что вызывает флуктуирующую ишемию во многих органах. При длительном течении оно может вызывать инфаркт тканей, ассоциированный с глубокой тромбоцитопенией и фрагментацией эритроцитов.
Мультимеры ULvWF обладают природной способностью самопроизвольно взаимодействовать с рецептором тромбоцитов GPIb-IX-V. Было обнаружено, что при наследственной TTP, а также приобретенной идиопатической TTP (aTTP) наблюдается тяжелый дефицит активности ADAMTS13. Большинство пациентов с TTP имеют аутоантитела к ADAMTS13, что приводит к нарушенному процессингу мультимеров ULvWF. Вследствие этого домен A1 в ULvWF является конститутивно активным и легко взаимодействует с рецептором тромбоцитов GPIb-IX-V. В конечном итоге это приводит к образованию характерных сгустков крови, обнаруживаемых у популяции пациентов с ТТР.
Существующая терапия TTP с помощью плазмообмена (сокращенно обозначенного в данном документе как "PE" или "PEX") и трансфузии обеспечивает замещение ADAMTS13 и удаление антител к ферменту, что таким образом постепенно приводит к нормализации процессинга ULvWF. Однако такое лечение требует многократных обменов и трансфузий в течение многих дней, во время которых отсутствует непосредственное фармакологическое целенаправленное воздействие на активный процесс агрегации тромбоцитов, опосредованной ULvWF.
Хотя проведение РЕ и трансфузии обеспечили значительное снижение уровней смертности от ТТР за последние три десятилетия, данное состояние по-прежнему несет в себе значительный риск смертности и заболеваемости. Уровень смертности от острых эпизодов при острой идиопатической ТТР у пациентов, контроль у которых осуществляется с помощью существующих терапевтических средств, остается равным величине порядка от 10% до 30% (Vesely et al. Blood 2003; 102: 60-68; Allford et al. Br.J.Haematol. 2003; 120: 556-573; Sadler et al. Hematology. Am.Soc.Hematol.Educ.Program. 2004; 407-423). В случае вторичной ТТР РЕ и трансфузия признаны менее эффективными, и уровень смертности является значительно более высоким. В случаях, когда заболевание развивается на фоне беременности, при которой PE считается достаточно эффективным, уровень смертности от острого эпизода TTP составляет примерно 25%, увеличиваясь до более чем 40% в случаях с сопутствующей преэклампсией (Martin et al. Am.J.Obstet.Gynecol. 2008; 199: 98-104). Однако в случаях, развивающихся на фоне, например, первопричинных злокачественных новообразований или трансплантации костного мозга, уровень смертности остается соответствующим величине от 40% до 60%, несмотря на применение таких режимов лечения (Sadler et al. 2004, выше; Elliott et al. Mayo Clin.Proc. 2003; 78: 421-430; Kremer Hovinga and Meyer Curr.Opin.Hematol. 2008; 15: 445-450.)
С учетом сохраняющегося значительного уровня смертности от ТТР и наблюдаемых осложнений РЕ и трансфузии существует очевидная необходимость в разработке дополнительных терапевтических подходов для дополнения современных способов лечения или потенциального снижения необходимости в таковых.
Исследования, проведенные в отношении TTP за последние три десятилетия, обеспечили улучшение понимания патофизиологических особенностей заболевания, что обеспечивает возможность потенциальной разработки новых средств, целенаправленно воздействующих на первопричинные болезненные процессы.
Одиночные вариабельные домены иммуноглобулинов (ISVD), направленные против vWF/связывающие vWF, были описаны, например, в WO 2004/015425, WO 2004/062551, WO 2006/074947, WO 2006/122825, WO 2009/115614 и WO 2011/067160.
В WO 2015/193326 от имени Ablynx описывается, помимо прочего, неожиданное обнаружение того, что введение полипептидов, содержащих по меньшей мере один ISVD, связывающий vWF, пациентам-людям с ТТР обеспечивает уменьшение времени до ответа, что проявляется в виде восстановления числа тромбоцитов до ≥150000/мкл. Это отражается в соотношении рисков (или нормализации числа тромбоцитов), равном 2,2, что означает, что у субъектов, получавших лечение каплацизумабом, вероятность достижения ответа в виде изменения числа тромбоцитов в любой заданный момент времени является в 2,2 раза большей. За счет этого ослабляется процесс тромбообразования, инициируемый комплексами тромбоцит-vWF, характерными для данного заболевания. Следовательно, подтверждение обоснованности концепции применения полипептида по настоящему изобретению было продемонстрировано со статистически значимым и клинически значимым сокращением времени до подтвержденного ответа со стороны тромбоцитов. Кроме того, количество обострений снизилось с 11 в группе, получающей плацебо, до 3 в группе, получающей лечение. В группе, получающей лечение, не было случаев смерти по сравнению с 2 случаями смерти в группе, получающей плацебо. Действительно, в исследованиях фазы II (TITAN) и фазы III (HERCULES) было показано, что ISVD, направленные против vWF (например, ALX 0081), являются эффективными и безопасными при лечении пациентов с TTP.
Однако в WO 2015/193326 и сообщениях о результатах TITAN и HERCULES ничего не говорится о пациентах с первоначальным эпизодом aTTP.
При отсутствии лечения смертность от TTP составляет 90%, и ее можно снизить при незамедлительном обеспечении плазмообмена. Тем не менее, преждевременная смерть все еще имеет место: примерно половина случаев смерти в региональном реестре Великобритании произошла в течение 24 часов после проявления, главным образом среди женщин (Scully et al., 2008 BJH 142: 819-826). Следовательно, крайне важно, чтобы эпизод аТТР был правильно диагностирован (см. Bindi et al. 2010 Transf Aph Sci 43:167-170). Однако диагностика может быть затруднена, поскольку имеется клиническое перекрывание с гемолитико-уремическим синдромом (HUS), аутоиммунным заболеванием и спектром проблем, связанных с беременностью (см. Scully et al., 2012 BJH 158:323-335; George and Al-Nouri 2012 Hematology 604-609, Scully et al. 2017 J Thromb Haem 15:312-322). Действительно, руководства по диагностике ТТР и связанных с ней микроангиопатий в последние годы несколько раз менялись от определения наличия пентады тромбоцитопении, MAHA (микроангиопатической гемолитической анемии), флуктуирующих неврологических признаков, почечной недостаточности и лихорадки, часто с неявным началом проявления, где диагноз устанавливался на основании клинического анамнеза, обследования пациента и анализа пленки крови (Scully et al., 2012 BJH 158:323-335), до диагностики, включающей в себя определение наличия (i) изолированной MAHAT (микроангиопатической гемолитической анемии и тромбоцитопении), (ii) новых очаговых неврологических симптомов, судорог или инфаркта миокарда (MI) с MAHAT неустановленной этиологии и (iii) ТТР в предшествующем анамнезе (Scully et al. 2017 J Thromb Haem 15:312-322). Анализы ADAMTS13 позволяют подтвердить диагноз, контролировать течение заболевания и даже определять дальнейшие варианты лечения.
Правильный диагноз осложняется низкой частотой TTP в популяции, из-за чего большинство врачей не знакомы с симптомами, особенно в случаях, когда у субъекта проявляется первоначальный эпизод TTP. Действительно, первоначальные эпизоды ТТР зачастую диагностируются позже, чем рецидивирующие эпизоды. В последних случаях пациент и медицинский персонал осведомлены об истории болезни и легче распознают симптомы. Вследствие этого у пациентов с первоначальным эпизодом ТТР при поступлении в клинику наблюдается позднее проявление и более тяжелое заболевание, чем у пациентов с рецидивирующим заболеванием.
Следовательно, еще предстоит выяснить, являются ли полипептиды, содержащие по меньшей мере один ISVD, направленный против vWF, такие как ALX 0081 или ALX 0081-A, благоприятными для пациентов с первоначальным эпизодом TTP, независимо от того, оказывают ли полипептиды, содержащие по меньшей мере один ISVD, направленный против vWF, такие как ALX 0081 или ALX 0081-A, положительный эффект, и каким будет эффективный режим лечения и дозирования.
Существует необходимость в улучшенных терапевтических средствах для пациентов с TTP, особенно в случаях, когда у субъекта проявляется первоначальный эпизод TTP.
3. Краткое описание изобретения
Настоящее изобретение основано на неожиданном обнаружении того, что введение полипептидов, содержащих по меньшей мере один ISVD, направленный против vWF, пациентам-людям с ТТР приводит к улучшению исходов у пациентов с первоначальным эпизодом TTP, которые характеризуются поздним проявлением и более тяжелым заболеванием на исходном уровне, чем пациенты с рецидивирующим заболеванием, т. e. рецидивирующим эпизодом TTP (см. пример 7.11).
Более того, в настоящем изобретении также продемонстрировано, что полипептиды по настоящему изобретению (например, ALX 0081 или ALX 0081-A) приводили к более быстрой нормализации числа тромбоцитов, обеспечивали предупреждение обострений и обеспечивали предупреждение появления у пациентов рефрактерности к лечению. Это отражалось, помимо прочего, в снижении параметров плазмообмена и сокращении количества дней, проводимых в больнице и в отделении интенсивной терапии (ICU) (см. пример 7.12).
Кроме того, в настоящем изобретении показано, что терапия полипептидами по настоящему изобретению (например, ALX 0081 или ALX 0081-A) в открытом режиме (OL) была эффективной у пациентов, которые испытали обострение aTTP (см. пример 7.13).
Таким образом, имеющиеся в настоящее время данные демонстрируют, что снижение частоты PE и трансфузии и ассоциированных с ними осложнений достигается без значительных побочных эффектов от применения самих полипептидов по настоящему изобретению. Это представляет очевидное преимущество в отношении безопасности при применении полипептидов по настоящему изобретению в лечении пациентов с TTP.
Следовательно, введение полипептидов, содержащих по меньшей мере один ISVD, направленный против vWF, пациентам-людям с ТТР обеспечивает неожиданное уменьшение времени до ответа, длительный и пролонгированный эффект, снижение частоты обострений, снижение частоты госпитализаций, в том числе занятости ICU, снижение заболеваемости, снижение количества случаев смерти и/или снижение количества PE у пациентов с эпизодом TTP, например, первоначальным эпизодом и/или рецидивирующим эпизодом TTP.
На основании обширного механистического фармакокинетическо-фармакодинамического (PK/PD) моделирования были разработаны различные сценарии для поддержки режима введения доз. Модель адекватно описывала взаимодействие в комплексе лекарственное средство-vWF в динамике по времени, в том числе прогрессирование заболевания у пациентов с aTTP и эффекты, определяемые лечебными процедурами РЕ. Модель успешно применялась для облегчения понимания PK/PD-взаимовлияния между каплацизумабом и vWF в целевой популяции и благодаря использованию имитационного моделирования подтверждала рациональное обоснование введения доз как у взрослых, так и у педиатрических пациентов, а также обеспечивала возможность переноса данных исследования на японских пациентов с aTTP (см. пример 7.18). Популяционный фармакокинетический анализ у пациентов с aTTP показал, что возраст, пол, раса и группа крови не влияют на фармакокинетические параметры каплацизумаба. Масса тела и почечная функция, выражающаяся клиренсом креатинина (CrCL), оказывали статистически значимый эффект на фармакокинетические параметры с предполагаемым более сильным воздействием у пациентов с меньшей массой тела и CrCL. Однако предполагаемый диапазон воздействия в популяциях пациентов с крайними значениями этих ковариат в значительной степени перекрывался, и не считалась необходимой никакая особенная корректировка дозы. Исходные уровни vWF оказывали статистически значимый эффект на воздействие лекарственного средства, но увеличенное воздействие лекарственного средства у пациентов с повышенным уровнем vWF не приводило к другому фармакодинамическому эффекту, и индивидуальная корректировка дозы не считалась необходимой (см. пример 7.16.5).
Поскольку педиатрических пациентов не включали в клинические испытания каплацизумаба, эту PK/PD-модель также использовали для рекомендаций по введению доз подросткам и детям. В отличие от вышеизложенного, рекомендуемая доза для подростков в возрасте 12-18 лет при массе тела ≥40 кг составляет 10 мг, а при массе тела <40 кг - 5 мг. Поскольку на основании различий в возрасте не предполагались никакие различия в подавлении vWF:Ag, такая же рекомендация по введению доз применима для детей в возрасте 2-12 лет: 10 мг, если масса тела составляет ≥40 кг, и 5 мг, если она составляет <40 кг (см. пример 7.19).
Существующая терапия TTP с помощью PE и трансфузии обеспечивает замещение ADAMTS13 и удаление антител к ферменту, что таким образом постепенно приводит к нормализации процессинга ULvWF. Однако такое лечение требует многократных обменов и трансфузий в течение многих дней, во время которых отсутствует непосредственное фармакологическое целенаправленное воздействие на активный процесс агрегации тромбоцитов, опосредованной ULvWF.
В ходе клинических испытаний у пациентов с aTTP каплацизумаб вводили в виде внутривенно вводимой (i.v.) болюсной дозы 10 мг перед РЕ, а затем ежедневных подкожно вводимых (s.c.) доз 10 мг на протяжении периода ежедневного PE и в течение по меньшей мере 30 дней после него. Также исследовали потенциальный эффект различных временных интервалов между первым i.v. болюсным введением и последующим PE, а также эффект различных схем PE. Что удивительно, эффективные уровни лекарственного средства предполагаются до момента начала PE в рамках периода до 5 часов после введения первой i.v. дозы каплацизумаба. При более длительных задержках может быть предусмотрена дополнительная s.c. доза 10 мг или 11 мг перед PE. В случае применения РЕ BID (два раза в день) на протяжении 7 дней схему s.c. введения каплацизумаба можно корректировать с введением каплацизумаба BID после каждой лечебной процедуры РЕ (см. пример 7.17).
В ходе программы управляемого предоставления недоступных препаратов (MAP) пациенты получали каплацизумаб в качестве средства терапии первой линии или для лечения aTTP с рефрактерным течением. Самостоятельные отчеты о безопасности соответствовали профилю безопасности, наблюдаемому в клинических исследованиях, без новых сигналов о безопасности. Первые доказательства, полученные в условиях реальной клинической практики применения каплацизумаба у пациентов с aTTP, подтверждают важные преимущества каплацизумаба, наблюдаемые в клинических испытаниях, особенно в случае, когда его начинают принимать в качестве средства терапии первой линии.
Полипептиды по настоящему изобретению не препятствуют действию фермента, замещаемого в ходе плазмотрансфузии. Полипептиды по настоящему изобретению (например, ALX 0081 или ALX 0081-A) можно использовать в комбинации с PE и трансфузией для прямого ингибирования непрерывного образования небольших тромбов и потребления тромбоцитов в микроциркуляторном русле. Это позволяет быстрее контролировать первопричинный процесс тромбообразования и сопровождающее его потребление тромбоцитов с преимуществами, заключающимися в снижении степени ишемических и геморрагических осложнений. Это также приводит к более быстрому клиническому восстановлению и меньшей заболеваемости с более коротким периодом и сниженным количеством РЕ и трансфузий. Действительно, анализ специфических и клинически значимых биомаркеров повреждения органов LDH, тропонина Т или I и креатинина позволил предположить, что более быстрое купирование ишемии тканей микрососудов характеризуется клиническим преимуществом. Кроме того, продемонстрированное ингибирование полипептидами по настоящему изобретению (например, ALX 0081 или ALX 0081-A) взаимодействия тромбоцитов, опосредованного ULvWF, и наблюдаемые антитромботические эффекты демонстрируют положительные эффекты при их более длительном применении после восстановления пациентов после острого эпизода TTP, например, первоначального эпизода и/или рецидивирующего эпизода TTP, для предупреждения рецидивов и/или обострений заболевания. Снижение частоты острых эпизодов ТТР, например, первоначального эпизода TTP и/или рецидивирующих эпизодов TTP, представляет собой значительное преимущество с потенциалом снижения смертности и заболеваемости, ассоциированных с TTP, а также дальнейшего снижения необходимости в PE и трансфузиях на протяжении жизни пациента.
Хотя более быстрое восстановление после ТТР и снижение частоты обострений и рецидивов является очевидным клиническим преимуществом с точки зрения эффективности лечения, снижение продолжительности и частоты РЕ и трансфузий также обеспечивает дополнительные преимущества с точки зрения безопасности пациента. Хотя PE и трансфузию в настоящее время рассматривают в качестве стандартного лечения при контроле TTP (Scully et al. Br.J.Haem. 2012; 158:323-335), данные процедуры несут риск значительных осложнений. Процедура PE требует больших объемов жидкости и скоростей потока, что приводит к необходимости использования центральных венозных двухпросветных катетеров для гемодиализа. Осложнения процедуры включают в себя кровотечение из-за введения катетера, сепсис, катетер-ассоциированный тромбоз, пневмоторакс, перегрузку жидкостью, гипоксию и гипотензию (Fontana et al. Semin.Hematol. 2004; 41: 48-59; George J.Intensive Care Med. 2007; 22: 82-91; Howard et al. Transfusion 2006; 46: 154-156; Rizvi et al. Transfusion 2000; 40: 896-901; Nguyen et al. Transfusion 2009; 49: 392-394). Анафилактоидные реакции осложняют от 0,25% до 0,5% процедур (Allford et al. 2003, выше; George 2007, выше). Кроме того, инфузия плазмы крови, содержащей препараты крови, может вызывать неинфекционное острое посттрансфузионное повреждение легких (TRALI). Это состояние признано одной из наиболее частых причин смертельных исходов, связанных с трансфузией, с оцениваемой частотой возникновения от 0,02% до 0,05% на плазмосодержащую единицу. При среднедневном количестве 17 единиц плазмы крови расчетный ежедневный риск может находиться в диапазоне от 0,34% до 0,85%. Для большинства пациентов с TTP требуются многократные PE и трансфузии. Пациентам с острой идиопатической ТТР требуются ежедневные лечебные процедуры, а для достижения ремиссии требуется в среднем примерно 16 лечебных процедур (Allford et al. 2003, выше). В случаях рефрактерности частота проведения лечебных процедур может быть увеличена до двух раз в день (Allford et al. 2003, выше). В случае с пациентами с семейной ТТР рекомендуются регулярные профилактические инфузии плазмы крови с интервалами в две-три недели (Lammle et al. J.Thromb.Haemost. 2005; 3: 1663-1675). Анафилаксия и TRALI, таким образом, представляют очевидные риски для пациентов с TTP, лечение которых требует такой частоты и регулярности PE и трансфузий. Хотя считается, что этот риск может быть ниже, если вместо свежезамороженной плазмы крови используется плазма крови, обработанная растворителем/детергентом (S/D), использование больших объемов плазмы крови, обработанной S/D, может быть ассоциировано с повышенным риском венозной тромбоэмболии (Allford et al. 2003, выше; Fontana et al. 2004, выше). В целом, по оценкам от примерно 30% до 40% пациентов будут испытывать нежелательные эффекты от PE и трансфузии, а уровень смертности от этой процедуры составляет порядка от 2% до 3% (George et al. Semin.Hematol. 2004; 41: 60-67; George 2007, выше; George and Al-Nouri 2012, выше). Следовательно, снижение продолжительности и частоты PE и трансфузии также обеспечивает дополнительные преимущества с точки зрения безопасности пациента.
После восстановления после эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, многие пациенты описывают когнитивные нарушения в течение многих лет и сообщают о причиняющих беспокойство проблемах с памятью, концентрацией, упадке сил и усталости. Такие симптомы оказывают отрицательное влияние на качество повседневной жизни пациентов. Кроме того, такое ухудшение качества жизни может происходить у всех пациентов, имеющих ТТР, независимо от этиологии и степени тяжести (Lewis et al. Transfusion 2009; 49: 118-124). Считается, что эти симптомы могут отражать остаточные эффекты ишемии тканей. Исходя из этого, можно разумно предположить, что более быстрое восстановление после ТТР и ограничение образования тромбов в микроциркуляторном русле, которые обеспечиваются полипептидами по настоящему изобретению, такими как ALX 0081 или ALX 0081-A, приводят к улучшенному более долгосрочному исходу для пациентов с точки зрения качества их жизни.
Что удивительно, в различных экспериментах in vitro, сравнительных исследованиях методом ядерного магнитного резонанса (NMR) и поверхностного плазмонного резонанса (SPR), было показано, что каплацизумаб и каплацизумаб с C-концевым удлинением имеют сходные характеристики и сходные профили связывания с vWF-мишенью, хотя каплацизумаб с C-концевым удлинением характеризовался меньшим связыванием предсуществующих антител. Ввиду сходства характеристик и профилей между каплацизумабом и каплацизумабом с C-концевым удлинением предполагают, что эти соединения каплацизумаба с C-концевым удлинением также можно применять для лечения и/или предупреждения aTTP подобно каплацизумабу (см. пример 7.21).
Соответственно, в настоящем изобретении предусмотрены способы лечения или облегчения заболеваний, связанных с vWF, таких как TTP, у субъекта путем введения субъекту полипептида, содержащего по меньшей мере один ISVD, направленный против vWF, где количество вводимого полипептида является эффективным для сокращения времени до ответа, для снижения частоты обострений, для снижения частоты рецидивов, для снижения частоты госпитализаций, в том числе занятости ICU, для снижения степени тяжести ишемии, для снижения числа умерших и/или для снижения количества требуемых PE. В настоящем изобретении предусмотрены конкретные диапазоны доз и схемы введения доз полипептидов по настоящему изобретению, которые приводят к одному или нескольким из этих благоприятных эффектов в отношении заболевания, связанного с vWF, такого как TTP. В частности, в настоящем изобретении предусмотрены фармакологически активные средства, композиции, способы и/или схемы введения доз, которые обладают определенными преимуществами по сравнению со средствами, композициями, способами и/или схемами введения доз, которые применяются в настоящее время и/или известны из уровня техники, в том числе удовлетворяют требованию менее частого применения PE. Эти преимущества станут очевидными из дальнейшего приведенного ниже описания.
В предпочтительном аспекте настоящее изобретение относится к полипептиду, содержащему два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого vWF, для применения в лечении (симптомов) заболевания, связанного с vWF, предпочтительно TTP, у человека путем введения человеку дозы 10 мг или 11 мг указанного полипептида в случае, если указанный человек имеет массу тела ≥40 кг, и 5 мг в случае, если указанная масса тела составляет <40 кг.
В одном аспекте настоящее изобретение относится к полипептиду, содержащему два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого фактора фон Виллебранда (vWF), для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека путем введения человеку дозы 1-80 мг, предпочтительно 5-40 мг, еще более предпочтительно 10 мг или 11 мг, указанного полипептида.
В одном аспекте настоящее изобретение относится к полипептиду, содержащему два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого фактора фон Виллебранда (vWF), для применения в лечении первой линии заболевания, связанного с vWF, предпочтительно TTP, у человека путем введения человеку дозы 1-80 мг, предпочтительно 5-40 мг, еще более предпочтительно 10 мг или 11 мг, указанного полипептида.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, где указанная стадия введения полипептида по настоящему изобретению повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней, как, например, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев или даже больше (периода лечения).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, где указанное лечение приводит к более короткому времени до ответа в виде изменения числа тромбоцитов, более низкой доле пациентов со смертельным исходом, рецидивом или большим TE-событием на протяжении периода лечения, более низкой частоте рецидивов и/или предупреждению рефрактерности.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, где указанный полипептид содержит по меньшей мере один ISVD, связывающий человеческий vWF (SEQ ID NO: 20).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) заболевания, связанного с vWF, предпочтительно TTP, у человека, где указанный полипептид на по меньшей мере 90% идентичен по отношению к SEQ ID NO: 1 и содержит С-концевое удлинение (X)n, при этом n равняется 1-10, предпочтительно 1-5, как, например, 1, 2, 3, 4 или 5 (и предпочтительно 1 или 2, как, например, 1); и каждый X представляет собой (предпочтительно встречающийся в природе) аминокислотный остаток, который независимо выбран и предпочтительно независимо выбран из группы, состоящей из аланина (A), глицина (G), валина (V), лейцина (L) или изолейцина (I); еще более предпочтительно представляет собой аланин.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, у человека, где по меньшей мере один ISVD представлен под SEQ ID NO: 19 (12A02H1).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, где указанный полипептид на по меньшей мере 90% идентичен по отношению к SEQ ID NO: 1.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, где указанный полипептид представляет собой ALX 0081 (SEQ ID NO: 1) или ALX 0081-A (SEQ ID NO: 24).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, где указанная доза вводится 1 раз в день или два раза в день.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, включающем повторение введения указанного полипептида до тех пор, пока число тромбоцитов у указанного человека не будет составлять по меньшей мере 150000/мкл.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, у человека, включающем повторение введения указанного полипептида до тех пор, пока число тромбоцитов у указанного человека не будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, где указанная стадия введения полипептида по настоящему изобретению повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней или даже больше, после того, как указанное число тромбоцитов будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, у человека, где указанные 2 последовательных измерения осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, включающем повторение введения указанного полипептида до тех пор, пока активность ADAMTS13 у указанного человека не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, включающем повторение введения указанного полипептида до тех пор, пока уровень маркера повреждения органов, как, например, уровень LDH, уровень тропонина T, уровень тропонина I и/или уровень креатинина, у указанного человека не вернется к величине, составляющей по меньшей мере 40% или даже по меньшей мере 50%, как, например, 60%, 70%, 80%, 90% или даже до 100%, от нормальных уровней.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, включающем осуществление плазмообмена.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении (симптомов) первоначального эпизода заболевания, связанного с vWF, у человека, где указанное заболевание, связанное с vWF, выбрано из острого коронарного синдрома (ACS), транзиторной церебральной ишемической атаки, нестабильной или стабильной стенокардии, инсульта, инфаркта миокарда или тромботической тромбоцитопенической пурпуры (TTP), предпочтительно TTP.
В одном аспекте настоящее изобретение относится к полипептиду, содержащему два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого фактора фон Виллебранда (vWF), для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем введение человеку дозы 1-80 мг, предпочтительно 5-40 мг, еще более предпочтительно 10 мг или 11 мг, указанного полипептида.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанная стадия введения полипептида по настоящему изобретению повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней, как, например, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев или даже больше (периода лечения).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанное лечение приводит к более короткому времени до ответа в виде изменения числа тромбоцитов, более низкой доле пациентов со смертельным исходом, рецидивом или большим TE-событием на протяжении периода лечения, более низкой частоте рецидивов и/или предупреждению рефрактерности.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанный полипептид содержит по меньшей мере один ISVD, связывающий SEQ ID NO: 20.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где по меньшей мере один ISVD представлен под SEQ ID NO: 19 (12A02H1).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанный полипептид на по меньшей мере 90% идентичен по отношению к SEQ ID NO: 1.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанный полипептид представляет собой ALX 0081 (SEQ ID NO: 1) или ALX 0081-A (SEQ ID NO: 24).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанная доза вводится 1 раз в день или два раза в день.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем повторение введения указанного полипептида до тех пор, пока число тромбоцитов у указанного человека не будет составлять по меньшей мере 150000/мкл.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем повторение введения указанного полипептида до тех пор, пока число тромбоцитов у указанного человека не будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанная стадия введения полипептида по настоящему изобретению повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней или даже больше, после того, как указанное число тромбоцитов будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанные 2 последовательных измерения осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем повторение введения указанного полипептида до тех пор, пока активность ADAMTS13 у указанного человека не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем повторение введения указанного полипептида до тех пор, пока уровень маркера повреждения органов, как, например, уровень LDH, уровень тропонина T, уровень тропонина I и/или уровень креатинина, у указанного человека не вернется к величине, составляющей по меньшей мере 40% или даже по меньшей мере 50%, как, например, 60%, 70%, 80%, 90% или даже до 100%, от нормальных уровней.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем осуществление плазмообмена.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в сокращении количества дней пребывания в больнице и/или в отделении интенсивной терапии (ICU) в ходе лечения острого эпизода заболевания, связанного с vWF, у человека, нуждающегося в этом, где указанное заболевание, связанное с vWF, выбрано из острого коронарного синдрома (ACS), транзиторной церебральной ишемической атаки, нестабильной или стабильной стенокардии, инсульта, инфаркта миокарда или тромботической тромбоцитопенической пурпуры (TTP), предпочтительно TTP.
В одном аспекте настоящее изобретение относится к полипептиду, содержащему два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого фактора фон Виллебранда (vWF), для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем введение человеку дозы 1-80 мг, предпочтительно 5-40 мг, еще более предпочтительно 10 мг или 11 мг, указанного полипептида.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанная стадия введения полипептида по настоящему изобретению повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней, как, например, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев или даже больше (периода лечения).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанное лечение приводит к более короткому времени до ответа в виде изменения числа тромбоцитов, более низкой доле пациентов со смертельным исходом, рецидивом или большим TE-событием на протяжении периода лечения, более низкой частоте рецидивов и/или предупреждению рефрактерности.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанный полипептид содержит по меньшей мере один ISVD, связывающий SEQ ID NO: 20.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где по меньшей мере один ISVD представлен под SEQ ID NO: 19 (12A02H1).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанный полипептид на по меньшей мере 90% идентичен по отношению к SEQ ID NO: 1.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанный полипептид представляет собой ALX 0081 (SEQ ID NO: 1) или ALX 0081-A (SEQ ID NO: 24).
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанная доза вводится 1 раз в день или два раза в день.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем повторение введения указанного полипептида до тех пор, пока число тромбоцитов у указанного человека не будет составлять по меньшей мере 150000/мкл.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем повторение введения указанного полипептида до тех пор, пока число тромбоцитов у указанного человека не будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанная стадия введения полипептида по настоящему изобретению повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней или даже больше, после того, как указанное число тромбоцитов будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, где указанные 2 последовательных измерения осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем повторение введения указанного полипептида до тех пор, пока активность ADAMTS13 у указанного человека не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем повторение введения указанного полипептида до тех пор, пока уровень маркера повреждения органов, как, например, уровень LDH, уровень тропонина T, уровень тропонина I и/или уровень креатинина, у указанного человека не вернется к величине, составляющей по меньшей мере 40% или даже по меньшей мере 50%, как, например, 60%, 70%, 80%, 90% или даже до 100%, от нормальных уровней.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, включающем осуществление плазмообмена.
В дополнительном аспекте настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в предупреждении появления у пациентов рефрактерности к лечению острого эпизода, например, первоначального эпизода и/или рецидивирующего эпизода, заболевания, связанного с vWF, у человека, нуждающегося в этом, где указанное заболевание, связанное с vWF, выбрано из острого коронарного синдрома (ACS), транзиторной церебральной ишемической атаки, нестабильной или стабильной стенокардии, инсульта, инфаркта миокарда или тромботической тромбоцитопенической пурпуры (TTP), предпочтительно TTP.
Соответственно, в настоящем изобретении предусмотрен полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, предпочтительно 2 ISVD, еще более предпочтительно ALX 0081 или ALX 0081-A, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, включающем введение указанному человеку первой дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где в рамках периода от 5 минут до 8 часов после указанного введения указанного полипептида следует осуществление первого РЕ.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где указанному введению указанной первой дозы предшествует осуществление предшествующего РЕ, предпочтительно в рамках периода 36 часов, как, например, в рамках периода 32 часов, 30 часов, 28 часов, 26 часов, 24 часов, 22 часов, 20 часов, 18 часов, 16 часов, 14 часов, 12 часов, 10 часов, 8 часов, например, в рамках периода 7 часов, 6 часов, 5 часов, 4 часов, 3 часов, 3 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут до указанного первого РЕ.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где после указанного первого PE следует введение второй дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида, предпочтительно путем подкожной инъекции, предпочтительно в рамках периода 1-60 минут, более предпочтительно в рамках периода 30 минут после указанного первого PE.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где указанный предшествующий PE осуществляют в рамках периода 36 часов, предпочтительно 32, 30, 28, 26, 24, 22, 20, 18 или 16 часов, предпочтительно приблизительно 24 часов до указанного первого PE.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где указанный полипептид вводят парентерально, предпочтительно путем подкожной, внутрибрюшинной, внутривенной или внутримышечной инъекции, предпочтительно путем внутривенной (i.v.) болюсной струйной инъекции.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где в рамках периода от 5 минут до 8 часов, как, например, в рамках периода от 10 минут до 6 часов или от 15 минут до 4 часов, например, в рамках периода 8 часов, 7 часов, 6 часов, 5 часов, 4 часов, 3 часов, 3 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут, предпочтительно в рамках периода менее 5 часов после введения указанного полипептида следует осуществление PE.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где указанное лечение заболевания, связанного с vWF, такого как TTP, предпочтительно TTP, у человека, нуждающегося в этом, дополнительно включает:
(i) осуществление PE; и (последующее)
(ii) введение дозы 1-80 мг, как, например, 5-40 мг, указанного полипептида через от 5 минут до 4 часов после указанного PE на стадии (i); и
(iii) необязательно измерение числа тромбоцитов и/или активности ADAMTS13 у указанного пациента,
где стадию (i) и стадию (ii) повторяют один раз в день, предпочтительно до тех пор, пока число тромбоцитов у указанного пациента не будет составлять > 150000/мкл и/или указанная активность ADAMTS13 не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, дополнительно включающем введение один раз в день дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида на протяжении по меньшей мере 5, 10, 15, 20, 25, 30, 40, 50, 60, 90 или даже 120 дней после того, как число тромбоцитов у указанного пациента в первый раз будет составлять > 150000/мкл.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, дополнительно включающем введение один раз в день дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида до вхождения указанного человека в ремиссию.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, включающем введение указанного полипептида до тех пор, пока активность ADAMTS13 не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанная доза составляет приблизительно 1-80 мг или 5-40 мг, как, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50, 60, 70 или 80 мг, предпочтительно приблизительно 10 мг или 11 мг, указанного полипептида.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где указанный человек страдает от эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, обострения TTP и/или рецидива TTP.
В предпочтительном аспекте в настоящем изобретении предусмотрен полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, для применения в лечении заболевания, связанного с vWF, такого как TTP, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, включающем
(1) необязательно осуществление предшествующего PE;
(2) введение указанному человеку первой дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида, и в случае осуществления стадии (1) предпочтительно в рамках периода 36 часов, как, например, в рамках периода 32 часов, 30 часов, 28 часов, 26 часов, 24 часов, 22 часов, 20 часов, 18 часов, 16 часов, 14 часов, 12 часов, 10 часов, 8 часов, например, в рамках периода 7 часов, 6 часов, 5 часов, 4 часов, 3 часов, 3 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут после (окончания) стадии (1);
(3) осуществление PE, необязательно в рамках периода от 5 минут до 8 часов, как, например, в рамках периода от 10 минут до 6 часов или от 15 минут до 4 часов, например, в рамках периода 8 часов, 7 часов, 6 часов, 5 часов, 4 часов, 3 часов, 3 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут, после стадии (2);
(4) введение дополнительной дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида, предпочтительно в рамках периода от 5 минут до 8 часов, как, например, в рамках периода от 10 минут до 6 часов или от 15 минут до 4 часов, например, в рамках периода 8 часов, 7 часов, 6 часов, 5 часов, 4 часов, 3 часов, 3 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут, после (окончания) стадии (3);
(5) повторение стадии (3) и стадии (4) один раз в день; необязательно до тех пор, пока число тромбоцитов у указанного пациента не будет составлять > 150000/мкл и/или указанная активность ADAMTS13 не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13;
(6) необязательно введение один раз в день дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида на протяжении по меньшей мере 5, 10, 15, 20, 25, 30, 40, 50, 60, 90 или даже 120 дней после того, как число тромбоцитов у указанного пациента в первый раз будет составлять > 150000/мкл, или до тех пор, пока активность ADAMTS13 не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
Если стадию (3) осуществляют через 5 часов после стадии (2), то вводят дополнительную дозу 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида.
В другом предпочтительном аспекте в настоящем изобретении предусмотрен полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, для применения в лечении заболевания, связанного с vWF, такого как TTP, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, включающем
(1) осуществление PE два раза в день;
(2) введение указанному человеку дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида после каждого РЕ на стадии (1).
Кроме того, в настоящем изобретении предусмотрен полипептид, содержащий два ISVD, направленных против человеческого vWF, для применения в предупреждении (симптомов) рецидива заболевания, связанного с vWF, у человека путем введения человеку доз 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный ISVD, направленный против vWF, содержит по меньшей мере один одиночный вариабельный домен иммуноглобулина, связывающийся с SEQ ID NO: 20.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный ISVD, направленный против vWF, содержит вариабельный домен тяжелой цепи, который получен из традиционного четырехцепочечного антитела, или вариабельный домен тяжелой цепи, который получен из антитела, состоящего только из тяжелых цепей, или нанотела.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанное нанотело представляет собой VHH.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный ISVD, направленный против vWF, по существу состоит из 4 каркасных областей (от FR1 до FR4 соответственно) и 3 областей, определяющих комплементарность (от CDR1 до CDR3 соответственно), при этом:
a) CDR1 содержит:
- аминокислотную последовательность YNPMG или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью YNPMG; или по существу состоит из них,
и
b) CDR2 содержит:
- аминокислотную последовательность AISRTGGSTYYPDSVEG; или
- аминокислотную последовательность, которая характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичностью последовательности по отношению к аминокислотной последовательности AISRTGGSTYYPDSVEG; или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью AISRTGGSTYYPDSVEG; или по существу состоит из них,
и
c) CDR3 содержит:
- аминокислотную последовательность AGVRAEDGRVRTLPSEYTF; или
- аминокислотную последовательность, которая характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичностью последовательности по отношению к аминокислотной последовательности AGVRAEDGRVRTLPSEYTF; или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF; или по существу состоит из них.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, в котором:
a) CDR1 представляет собой YNPMG (SEQ ID NO: 21);
b) CDR2 представляет собой AISRTGGSTYYPDSVEG (SEQ ID NO: 22); и
c) CDR3 представляет собой AGVRAEDGRVRTLPSEYTF (SEQ ID NO: 23).
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где ISVD, направленный против vWF, представлен под SEQ ID NO: 19 (12A02H1).
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, содержащий по меньшей мере два ISVD, направленных против vWF, или состоящий из них.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где каждый ISVD из указанных по меньшей мере двух ISVD, направленных против vWF, по существу состоит из 4 каркасных областей (от FR1 до FR4 соответственно) и 3 областей, определяющих комплементарность (от CDR1 до CDR3 соответственно), при этом:
a) CDR1 содержит:
- аминокислотную последовательность YNPMG или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью YNPMG; или по существу состоит из них,
и
b) CDR2 содержит:
- аминокислотную последовательность AISRTGGSTYYPDSVEG; или
- аминокислотную последовательность, которая характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичностью последовательности по отношению к аминокислотной последовательности AISRTGGSTYYPDSVEG; или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью AISRTGGSTYYPDSVEG; или по существу состоит из них,
и
c) CDR3 содержит:
- аминокислотную последовательность AGVRAEDGRVRTLPSEYTF; или
- аминокислотную последовательность, которая характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичностью последовательности по отношению к аминокислотной последовательности AGVRAEDGRVRTLPSEYTF; или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF; или по существу состоит из них.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, в котором каждый ISVD, направленный против vWF, по существу состоит из 4 каркасных областей (от FR1 до FR4 соответственно) и 3 областей, определяющих комплементарность (от CDR1 до CDR3 соответственно), при этом:
a) CDR1 представляет собой YNPMG (SEQ ID NO: 21);
b) CDR2 представляет собой AISRTGGSTYYPDSVEG (SEQ ID NO: 22); и
c) CDR3 представляет собой AGVRAEDGRVRTLPSEYTF (SEQ ID NO: 23).
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный полипептид содержит SEQ ID NO: 1-18 или 24, предпочтительно SEQ ID NO: 1 или 24, или состоит из них.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный ISVD, направленный против vWF, представляет собой одноцепочечный полипептид, содержащий один или несколько одиночных вариабельных доменов иммуноглобулинов.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный ISVD, направленный против vWF, является одновалентным или поливалентным.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный ISVD, направленный против vWF, является моноспецифическим или полиспецифическим.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где один или несколько одиночных вариабельных доменов иммуноглобулинов содержат привитые CDR, являются гуманизированными, камелизированными, деиммунизированными или отобранными с помощью фагового дисплея.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный ISVD, направленный против vWF, содержит аминокислотную последовательность, которая на по меньшей мере 90% идентична по отношению к SEQ ID NO: 1.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, содержащий два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого vWF, и ISVD, направленный против человеческого сывороточного альбумина (HSA).
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный полипептид составлен в фармацевтически приемлемом составе.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный состав содержит цитратный или фосфатный буфер с pH в диапазоне от 5,0 до 7,5.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный состав подходит для парентерального введения, как, например, для одного или нескольких, выбранных из внутривенной инъекции, подкожной инъекции, внутримышечной инъекции или внутрибрюшинной инъекции.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанный состав представлен в жидкой, лиофилизированной, высушенной распылением, восстановленной из лиофилизированного состояния или замороженной форме.
В настоящем изобретении предусмотрены набор или изделие, содержащие контейнер, содержащий полипептид, описываемый в данном документе, или состав, описываемый в данном документе, и инструкции по применению.
В настоящем изобретении предусмотрены набор или изделие, описываемые в данном документе, где состав представлен во флаконе или шприце для инъекции.
В настоящем изобретении предусмотрены набор или изделие, описываемые в данном документе, где состав представлен в предварительно заполненном шприце для инъекции.
В настоящем изобретении предусмотрены набор или изделие, описываемые в данном документе, где шприц или флакон состоит из стекла, пластика или полимерного материала, выбранного из циклического олефинового полимера или сополимера.
В настоящем изобретении предусмотрен состав, содержащий:
(a) полипептид, описываемый в данном документе, в концентрации от приблизительно 0,1 мг/мл до приблизительно 80 мг/мл;
(b) наполнитель, выбранный из сахарозы, глицина, маннита, трегалозы или NaCl, в концентрации от приблизительно 1% до приблизительно 15% (вес/об.);
(c) Tween-80 в концентрации от приблизительно 0,001% до 0,5% (об./об.) и
(d) буфер, выбранный из цитратного буфера в концентрации от приблизительно 5 мM до приблизительно 200 мM, так что рН состава составляет от приблизительно 6,0 до 7,0, и фосфатного буфера в концентрации от приблизительно 10 мM до приблизительно 50 мM, так что рН состава составляет от приблизительно 6,5 до 7,5,
для применения в лечении заболевания, связанного с vWF, предпочтительно TTP, у человека, нуждающегося в этом, путем введения человеку дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида, где в рамках периода от 5 минут до 8 часов, как, например, от 15 минут до 4 часов, после введения указанной дозы необязательно следует первый плазмообмен (PE).
В настоящем изобретении предусмотрена фармацевтическая стандартная лекарственная форма, подходящая для парентерального введения пациенту, предпочтительно пациенту-человеку, содержащая полипептид, описываемый в данном документе, или состав, описываемый в данном документе.
В настоящем изобретении предусмотрен полипептид, описываемый в данном документе, где указанное заболевание, связанное с vWF, выбрано из острого коронарного синдрома (ACS), транзиторной церебральной ишемической атаки, нестабильной или стабильной стенокардии, инсульта, инфаркта миокарда или (приобретенной и/или врожденной) тромботической тромбоцитопенической пурпуры (TTP), предпочтительно TTP.
В настоящем изобретении предусмотрен способ лечения пациента-человека, который подвержен заболеванию, связанному с vWF, такому как TTP, или у которого диагностировано такое заболевание, включающий введение эффективного количества полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF), пациенту-человеку.
В настоящем изобретении предусмотрен способ лечения или предупреждения заболевания, связанного с vWF, такого как TTP, включающий введение человеку дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF), за счет чего обеспечивается ослабление одного или нескольких симптомов, ассоциированных с заболеванием, связанным с vWF.
В настоящем изобретении предусмотрен вид лечения, описываемый в данном документе, где в рамках периода от 5 минут до 8 часов, как, например, от 15 минут до 4 часов, после указанного введения полипептида, описываемого в данном документе, следует осуществление первого плазмообмена (PE).
В настоящем изобретении предусмотрен вид лечения, описываемый в данном документе, где указанному введению полипептида, описываемого в данном документе, предшествует осуществление предшествующего плазмообмена (PE) в рамках периода 36 часов, предпочтительно 32, 30, 28, 26, 24, 22, 20, 18 или 16 часов, предпочтительно приблизительно 24 часов до указанного первого PE.
В настоящем изобретении предусмотрен вид лечения, описываемый в данном документе, где в рамках периода от 5 минут до 8 часов, как, например, в рамках периода от 10 минут до 6 часов или от 15 минут до 4 часов, например, в рамках периода 8 часов, 7 часов, 6 часов, 5 часов, 4 часов, 3 часов, 3 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут, после указанного первого PE следует введение второй дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида, описываемого в данном документе, например, где указанную вторую дозу указанного полипептида вводят в рамках периода 1-60 минут, как, например, 30 минут, после указанного первого PE, предпочтительно путем подкожной инъекции.
В настоящем изобретении предусмотрен вид лечения, описываемый в данном документе, дополнительно включающий:
(i) осуществление PE; (после которого следует)
(ii) введение дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида, описываемого в данном документе, через от 15 минут до 4 часов после указанного PE на стадии (i); и
(iii) необязательно измерение числа тромбоцитов и/или активности ADAMTS13 у указанного пациента,
где стадию (i) и стадию (ii) повторяют один раз в день, необязательно до тех пор, пока число тромбоцитов у указанного пациента не будет составлять > 150000/мкл и/или активность ADAMTS13 не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
В настоящем изобретении также предусмотрен вид лечения, описываемый в данном документе, дополнительно включающий введение один раз в день дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида, описываемого в данном документе, на протяжении по меньшей мере 5, 10, 15, 20, 25 или даже 30 дней после того, как число тромбоцитов у указанного пациента будет составлять > 150000/мкл.
В настоящем изобретении предусмотрен вид лечения, описываемый в данном документе, дополнительно включающий введение один раз в день дозы 1-80 мг, как, например, 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида, описываемого в данном документе, до вхождения указанного человека в ремиссию.
В настоящем изобретении предусмотрен вид лечения, описываемый в данном документе, включающий введение указанного полипептида до тех пор, пока активность ADAMTS13 не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
В одном варианте осуществления настоящее изобретение относится к способу снижения риска и/или предупреждения острого эпизода заболевания, связанного с vWF, такого как эпизод TTP, например, первоначальный эпизод и/или рецидивирующий эпизод TTP, у человека, нуждающегося в этом, включающему: (i) введение указанному человеку дозы 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF); или заключающемуся в этом, где введение указанного полипептида приводит к снижению риска и/или предупреждению острого эпизода заболевания, связанного с vWF, такого как эпизод TTP, например, первоначальный эпизод и/или рецидивирующий эпизод TTP. Указанный риск предпочтительно снижается в 1,2, 1,3, 1,4, 1,5, 1,6, 1,75, 1,8, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз. Указанный риск предпочтительно снижается на 10% или даже больше, как, например, на 20%, 30%, 40%, 50%, 60% или больше, как, например, на 80% или даже 100%.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную стадию (i) введения полипептида по настоящему изобретению повторяют по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз или даже более чем 10 раз, как, например, 20 раз, предпочтительно более чем 30 раз или даже больше.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную стадию (i) введения полипептида по настоящему изобретению повторяют на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней, как, например, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев или даже больше.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную дозу вводят 1 раз в день или два раза в день (BID).
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, дополнительно включающему
(ii) необязательно измерение активности ADAMTS13 у указанного пациента;
(iii) необязательно сравнение активности ADAMTS13 у указанного пациента с эталонной активностью ADAMTS13; и
(iv) в случае, если указанная активность ADAMTS13 составляет менее 30%, как, например, 20%, 15% или 10%, от указанной эталонной активности ADAMTS13, повторение указанной стадии (i) введения полипептида по настоящему изобретению.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную активность ADAMTS13 у указанного пациента измеряют ежедневно или один раз в 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, предпочтительно по меньшей мере один раз в неделю.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную стадию введения полипептида по настоящему изобретению повторяют до тех пор, пока указанная активность ADAMTS13 не будет составлять по меньшей мере 10%, 15%, как, например, 20% или даже 30% или больше, от указанной эталонной активности ADAMTS13.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где стадию (i) повторяют до тех пор, пока указанная активность ADAMTS13 не будет составлять по меньшей мере 10%, 15%, как, например, 20% или 30%, от указанной эталонной активности ADAMTS13 при по меньшей мере 2 последовательных измерениях. Указанные 2 последовательных измерения предпочтительно осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную стадию (i) введения полипептида по настоящему изобретению повторяют на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней или даже больше, после того, как указанная активность ADAMTS13 будет составлять по меньшей мере 10% или 15%, как, например, 20% или 30%, от указанной эталонной активности при по меньшей мере 2 последовательных измерениях.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, дополнительно включающему
- необязательно измерение активности ADAMTS13 у указанного пациента;
- необязательно сравнение активности ADAMTS13 у указанного пациента с эталонной активностью ADAMTS13; и
- в случае, если указанная активность ADAMTS13 составляет > 10%, как, например, более чем 15% или более чем 20% или 30%, от указанной эталонной активности ADAMTS13, повторение указанной стадии (i) введения полипептида по настоящему изобретению на протяжении не более 30 дней, как, например, не более 20 дней, или даже 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дней, или даже 1 дня.
В одном варианте осуществления настоящее изобретение относится к способу снижения риска и/или предупреждения острого эпизода заболевания, связанного с vWF, такого как эпизод TTP, например, первоначальный эпизод и/или рецидивирующий эпизод TTP, у человека, нуждающегося в этом, включающему по меньшей мере следующие стадии:
(i) измерение активности ADAMTS13 у указанного пациента;
(ii) сравнение указанной активности ADAMTS13 с эталонной активностью ADAMTS13; и
(iii) в случае, если указанная активность ADAMTS13 составляет менее 30%, 20%, 15% или 10% от указанной эталонной активности, введение указанному человеку дозы 5-40 мг, как, например, 10 мг или 11 мг, полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF).
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где
- риск повреждения органов, ишемического повреждения и/или образования микротромбов снижается на 10%, 20%, 30%, предпочтительно на по меньшей мере 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%;
- риск повреждения органов, ишемического повреждения и/или образования микротромбов снижается в 1,2, 1,3, 1,4, 1,5, 1,75, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- степень повреждения органов, ишемического повреждения и/или образования микротромбов предпочтительно снижается на по меньшей мере 10%, 20%, 30%, 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%;
- степень повреждения органов, ишемического повреждения и/или образования микротромбов снижается в 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- уровни маркеров повреждения органов, такие как уровни LDH, уровни тропонина T, уровни тропонина I и/или уровни креатинина, возвращаются к величине, составляющей по меньшей мере 40% или даже по меньшей мере 50%, как, например, 60%, 70%, 80%, 90% или даже до 100%, от нормальных уровней;
- уровни маркеров повреждения органов, такие как уровни LDH, уровни тропонина T, уровни тропонина I и/или уровни креатинина, улучшаются на по меньшей мере 20%, как, например, на 30% или даже больше, как, например, на 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%, от нормальных уровней. Указанные маркеры повреждения органов, такие как уровни LDH, уровни тропонина T, уровни тропонина I и/или уровни креатинина, предпочтительно улучшаются за менее чем 30 дней лечения, предпочтительно за менее чем 20 дней лечения, как, например, за менее чем 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дня или даже в рамках периода 1 дня;
- число тромбоцитов сохраняется на уровне > 150000/мкл;
- риск обострений снижается на по меньшей мере 10%, 20%, 30%, 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%;
- риск обострений снижается в 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- смертность вследствие указанного заболевания, связанного с vWF, снижается на 10%, 20%, 30%, предпочтительно на по меньшей мере 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%;
- смертность вследствие указанного заболевания, связанного с vWF, снижается в 1,2, 1,3, 1,4, 1,5, 1,6, 1,75, 1,8, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- рефрактерность предпочтительно снижается на по меньшей мере 10%, 20%, 30%, 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%; и/или
- рефрактерность снижается в 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, дополнительно включающему измерение числа тромбоцитов; и в случае, если указанное число тромбоцитов составляет менее 150000/мкл, повторение указанной стадии введения полипептида по настоящему изобретению.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанное число тромбоцитов у указанного пациента измеряют ежедневно или один раз в 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, предпочтительно по меньшей мере один раз в неделю.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную стадию введения полипептида по настоящему изобретению повторяют до тех пор, пока указанное число тромбоцитов не будет составлять по меньшей мере 150000/мкл.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную стадию введения полипептида по настоящему изобретению повторяют до тех пор, пока указанное число тромбоцитов не будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях. Указанные 2 последовательных измерения предпочтительно осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, где указанную стадию введения полипептида по настоящему изобретению повторяют на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней или даже больше, после того, как указанное число тромбоцитов будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях. Указанные 2 последовательных измерения предпочтительно осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
В одном варианте осуществления настоящее изобретение относится к способу, описываемому в данном документе, дополнительно включающему измерение числа тромбоцитов у указанного пациента и в случае, если указанное число тромбоцитов составляет > 150000/мкл, повторение указанной стадии (i) введения полипептида по настоящему изобретению на протяжении не более 30 дней, как, например, не более 20 дней, или даже 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дней, или даже 1 дня.
В одном варианте осуществления настоящее изобретение относится к способу снижения риска и/или предупреждения острого эпизода заболевания, связанного с vWF, такого как эпизод TTP, например, первоначальный эпизод и/или рецидивирующий эпизод TTP, предпочтительно TTP, у человека, нуждающегося в этом, включающему по меньшей мере следующие стадии:
(i) измерение числа тромбоцитов у указанного пациента; и
(ii) в случае, если указанное число тромбоцитов составляет менее 150000/мкл, введение указанному человеку дозы 5-40 мг, как, например, 10 мг или 11 мг, полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF);
где введение указанного полипептида приводит к снижению риска и/или предупреждению острого эпизода заболевания, связанного с vWF, такого как эпизод TTP, например, первоначальный эпизод и/или рецидивирующий эпизод TTP, предпочтительно TTP.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, предпочтительно TTP, у человека, нуждающегося в этом, включающему по меньшей мере следующие стадии:
(i) введение указанному человеку первой дозы 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF);
(ii) осуществление первого плазмообмена (PE), предпочтительно в рамках периода от 5 минут до 8 часов после стадии (i), предпочтительно в рамках периода 5 часов.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, предпочтительно TTP, описываемой в данном документе, у человека, нуждающегося в этом, где стадии (i), т. е. введению указанному человеку полипептида по настоящему изобретению, предшествует осуществление предшествующего PE, предпочтительно в рамках периода 24 часов до стадии (ii), т. е. осуществления первого PE.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, предпочтительно TTP, у человека, нуждающегося в этом, включающему по меньшей мере следующие стадии: (i) осуществление плазмообмена (PE); (ii) введение указанному человеку дозы 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF). Указанную стадию (i), т. е. осуществление PE, и указанную стадию (ii), т. е. введение указанному человеку указанного полипептида по настоящему изобретению, предпочтительно повторяют один раз или два раза в день на протяжении не более 1, 2, 3, 4, 5, 6 или 7 дней.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, описываемого в данном документе, у человека, нуждающегося в этом, где стадию (ii), т.е. введение указанному человеку указанного полипептида по настоящему изобретению, осуществляют в рамках периода от 15 минут до 4 часов после стадии (i), т.е. осуществления PE.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, описываемого в данном документе, у человека, нуждающегося в этом, дополнительно включающему измерение числа тромбоцитов у указанного человека, предпочтительно после стадии (ii), т.е. введения указанному человеку указанного полипептида по настоящему изобретению; и в случае, если указанное число тромбоцитов составляет <150000/мкл, повторение указанной стадии (i), т. е. осуществления PE, и указанной стадии (ii), т. е. введения указанному человеку указанного полипептида.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, описываемого в данном документе, у человека, нуждающегося в этом, дополнительно включающему измерение числа тромбоцитов у указанного пациента [предпочтительно после стадии (ii), т. е. введения указанному человеку указанного полипептида по настоящему изобретению]; и повторение стадии (i), т.е. осуществления PE, и стадии (ii), т.е. введения указанному человеку указанного полипептида, [один раз/два раза в день] до тех пор, пока указанное число тромбоцитов не будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях. Указанные 2 последовательных измерения предпочтительно осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, описываемого в данном документе, у человека, нуждающегося в этом, дополнительно включающему введение один раз в день дозы 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида на протяжении по меньшей мере 1-30 дней после того, как число тромбоцитов у указанного человека в первый раз будет составлять >150000/мкл.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, описываемого в данном документе, у человека, нуждающегося в этом, дополнительно включающему измерение активности ADAMTS13 у указанного человека, предпочтительно после стадии (ii), т.е. введения указанному человеку указанного полипептида.
В одном варианте осуществления настоящее изобретение относится к способу лечения эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего эпизода TTP, описываемого в данном документе, у человека, нуждающегося в этом, где стадию (i), т.е. осуществление PE, и стадию (ii), т.е. введение указанному человеку указанного полипептида по настоящему изобретению, повторяют до тех пор, пока активность ADAMTS13 не будет [в первый раз] составлять более 15%, или 20%, или даже 30% от эталонной активности ADAMTS13.
В одном варианте осуществления настоящее изобретение относится к способу снижения риска и/или предупреждения ишемического повреждения, повреждения органов, рефрактерности и/или образования микротромбов [вызываемых заболеванием, связанным с vWF, таким как TTP, эпизод TTP, например, первоначальный эпизод и/или рецидивирующий эпизод TTP] у человека, нуждающегося в этом, включающему по меньшей мере следующую стадию: (i) введение указанному человеку дозы 5-40 мг/день, предпочтительно 10 мг/день или 11 мг/день, полипептида, содержащего по меньшей мере один ISVD, направленный против vWF; где введение указанного полипептида приводит к снижению риска и/или предупреждению ишемического повреждения, повреждения органов, рефрактерности и/или образования микротромбов на 10%, 20%, 30%, предпочтительно на по меньшей мере 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%. Введение указанного полипептида предпочтительно приводит к снижению риска и/или предупреждению ишемического повреждения, повреждения органов, рефрактерности и/или образования микротромбов в 1,2, 1,3, 1,4, 1,5, 1,6, 1,75, 1,8, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз.
В одном варианте осуществления настоящее изобретение относится к способу, где указанную стадию введения указанного полипептида повторяют на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7 дней или даже дольше, как, например, 1 недели, 2 недель, 3 недель или даже дольше, как, например, 1 месяца или даже 2 месяцев.
В одном варианте осуществления настоящее изобретение относится к способу, дополнительно включающему измерение активности ADAMTS13 у указанного пациента, предпочтительно один раз в неделю.
В одном варианте осуществления настоящее изобретение относится к способу, где указанную стадию введения указанного полипептида повторяют на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7 дней или даже дольше, как, например, 1 недели, 2 недель, 3 недель или даже дольше, как, например, 1 месяца или даже 2 месяцев, в случае, если активность ADAMTS13 [в первый раз] составляет >10%, как, например, более чем 15% или даже более чем 20%, от эталонной активности ADAMTS13.
В одном варианте осуществления настоящее изобретение относится к способу лечения симптома заболевания, связанного с vWF, такого как TTP, у человека, страдающего указанным заболеванием, включающему введение субъекту полипептида по настоящему изобретению в количестве, эффективном для лечения симптома заболевания, связанного с vWF, у человека, страдающего указанным заболеванием.
В одном варианте осуществления настоящее изобретение относится к способу ингибирования у человека начала проявления или прогрессирования заболевания, связанного с vWF, такого как TTP, ингибирование которого осуществляется путем связывания полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF), с vWF, включающему введение человеку с предварительно определенным интервалом эффективных ингибирующих доз указанного полипептида, где при каждом введении полипептида человеку доставляется от 0,1 мг на кг до 25 мг на кг массы тела человека, предпочтительно 10 мг или 11 мг указанного полипептида в случае, если указанный человек имеет массу тела ≥40 кг, и 5 мг в случае, если указанная масса тела составляет <40 кг, за счет чего таким образом обеспечивается ингибирование начала проявления или прогрессирования заболевания у человека.
В одном варианте осуществления настоящее изобретение относится к способу снижения вероятности появления у человека ишемического контрактурного повреждения органов вследствие заболевания, связанного с vWF, который включает введение человеку в предварительно определенной дозе полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF), где при каждом введении антитела человеку доставляется от 0,1 мг на кг до 25 мг на кг массы тела человека, предпочтительно 10 мг или 11 мг указанного полипептида в случае, если указанный человек имеет массу тела ≥40 кг, и 5 мг в случае, если указанная масса тела составляет <40 кг, за счет чего таким образом обеспечивается снижение вероятности появления у человека ишемического контрактурного повреждения органов.
4. Подробное описание
Если не указано иное, все способы, стадии, методики и манипуляции, которые не описаны специально в подробностях, могут осуществляться и осуществлялись широко известным способом, как будет ясно специалисту в данной области. Например, в этом случае также делается ссылка на нормативные справочники и общий уровень техники, упомянутые в данном документе, и на дополнительные ссылочные материалы, цитируемые в них; а также, например, на следующие обзоры Scully et al. 2017, выше, и Presta, Adv. Drug Deliv. Rev. 2006, 58 (5-6): 640-56; Levin and Weiss, Mol. Biosyst. 2006, 2(1): 49-57; Irving et al., J. Immunol. Methods, 2001, 248(1-2), 31-45; Schmitz et al., Placenta, 2000, 21 Suppl. A, S106-12, Gonzales et al., Tumour Biol., 2005, 26(1), 31-43, в которых описаны методики конструирования белков, такие как созревание аффинности и другие методики улучшения специфичности и других желаемых свойств белков, таких как иммуноглобулины. Если не указано иное, все термины, которые не определены специально в подробностях в данном документе, известны в соответствующей области техники и будут ясны специалисту в данной области; а также, например, в Scully et al. 2017, выше, где описывается обобщенная стандартизация терминологии, касающейся ТТР и родственных тромботических микроангиопатий.
Следует отметить, что используемые в данном документе формы единственного числа включают ссылку на формы множественного числа, если контекст четко не указывает на иное. Таким образом, например, ссылка на "реагент" включает один или несколько различных таких реагентов, а ссылка на "способ" включает ссылку на эквивалентные стадии и способы, известные среднему специалисту в данной области, которые могут быть модифицированы или применяться вместо способов, описываемых в данном документе.
Если не указано иное, термин "по меньшей мере", предшествующий ряду элементов, следует понимать как относящийся к каждому элементу в этом ряду. Специалисту в данной области будут понятны, или он сможет установить с применением всего лишь стандартных экспериментов, многие эквиваленты конкретных вариантов осуществления настоящего изобретения, описанных в данном документе. Предполагается, что такие эквиваленты охватываются настоящим изобретением.
Термин "и/или" во всех случаях, в которых он используется в данном документе, включает значение "и", "или" и "все комбинации или любая другая комбинация элементов, связанных с указанным термином".
Термин "приблизительно" или "примерно", используемый в данном документе, означает в пределах 20%, предпочтительно в пределах 15%, более предпочтительно в пределах 10% и наиболее предпочтительно в пределах 5% от данной величины или диапазона.
По всему настоящему описанию и формуле изобретения, которые следуют далее, если по контексту не требуется иное, термин "содержать" и его варианты, такие как "содержит" и "содержащий", следует понимать как подразумевающие включение указанных целого числа или стадии или группы целых чисел или стадий, но не исключение никаких других целого числа или стадии или группы целых чисел или стадий. При использовании в данном документе термин "содержащий" может быть заменен термином "включающий в себя" или "включающий" или иногда используемым в данном документе термином "имеющий".
Терапевтический потенциал полипептидов по настоящему изобретению, в частности ALX 0081, в ситуации с TTP был дополнительно оценен и продемонстрирован в исследовании фазы III (Hercules).
Было продемонстрировано, что у пациентов с первоначальным эпизодом aTTP наблюдается позднее проявление и более тяжелое заболевание на исходном уровне, чем у пациентов с рецидивирующими эпизодами заболевания. Даже в этой более серьезной болезненной ситуации было показано, что лечение каплацизумабом улучшало исход (пример 7.11). В частности, было продемонстрировано, что полипептиды по настоящему изобретению, такие как ALX 0081 и ALX 0081-A, приводили к улучшению исходов, включающему более короткое время до ответа в виде изменения числа тромбоцитов, более низкую долю пациентов со смертельным исходом, рецидивом или большим TE-событием на протяжении периода лечения, более низкую частоту рецидивов на протяжении всего периода лечения и предупреждение рефрактерности, по сравнению с плацебо.
TTP представляет собой острое заболевание с рецидивирующими приступами или вспышками, т. е. отдельное рецидивирующее болезненное событие, требующее немедленного лечения при каждом эпизоде. Как используется в данном документе, "первоначальный эпизод TTP" (также указываемый как "первоначальный эпизод при TTP") является первым случаем проявления у субъекта приступа или вспышки TTP. Как используется в данном документе, "рецидивирующий эпизод TTP" (также указываемый как "рецидивирующий эпизод при TTP") представляет собой любой приступ TTP после первоначального эпизода TTP.
Настоящее изобретение также по меньшей мере частично основано на обнаружении того, что посредством быстрого блокирования полипептидами по настоящему изобретению, такими как ALX 0081 или ALX 0081-A, адгезии тромбоцитов, опосредованной vWF, обеспечивается новый вариант лечения aTTP. В частности, лечение каплацизумабом приводило к улучшению исходов лечения, что отражается в значительном сокращении использования ресурсов здравоохранения, в том числе количества дней проведения РЕ, продолжительности госпитализации и количества дней, проводимых в ICU (пример 7.12).
Кроме того, было продемонстрировано, что введение полипептидов согласно настоящему изобретению, содержащих по меньшей мере один ISVD, связывающий vWF, таких как ALX 0081 или ALX 0081-A, было эффективным у пациентов, которые испытывали обострение aTTP (пример 7.13).
Кроме того, было продемонстрировано, что введение полипептидов согласно настоящему изобретению, содержащих по меньшей мере один ISVD, связывающий vWF, таких как ALX 0081 или ALX 0081-A, было эффективным у пациентов при снижении рефрактерности.
Хотя существующая терапия TTP с использованием PE и трансфузии обеспечила значительное снижение уровней смертности от TTP, было показано, что терапия первой линии с введением полипептидов согласно настоящему изобретению, содержащих по меньшей мере один ISVD, связывающий vWF, таких как ALX 0081 или ALX 0081-A, была исключительно преимущественной. Например, может быть выиграно драгоценное время при использовании каплацизумаба в качестве средства терапии первой линии.
Следовательно, настоящее изобретение обеспечивает неожиданно длительный и пролонгированный эффект, снижение частоты обострений, снижение частоты госпитализаций, снижение заболеваемости, снижение количества требуемых PE, снижение степени тяжести ишемии, снижение рефрактерности, снижение степени повреждения органов и/или снижение числа умерших даже в более тяжелой болезненной ситуации с первоначальными эпизодами TTP.
Таким образом, настоящее изобретение относится к применению полипептидов по настоящему изобретению для лечения или уменьшения интенсивности проявлений заболевания, связанного с vWF, такого как TTP, у пациента посредством неожиданно значительного уменьшения времени до ответа, демонстрируемого по ускоренному восстановлению числа тромбоцитов. Настоящее изобретение также обеспечивает возможность менее частого проведения PE с сохранением в то же время восстановления числа тромбоцитов у пациента-человека на протяжении неожиданно продолжительных периодов времени. Соответственно, предусмотрены способы уменьшения времени до ответа у пациента-человека путем введения пациенту полипептида по настоящему изобретению, где количество вводимого полипептида является эффективным для изменения одного или нескольких маркеров заболевания TTP, таких как число тромбоцитов, тромбоцитопения, нейрокогнитивная функция, уровни ADAMTS13 и титры антител к ADAMTS13, уровни активности ADAMTS13, уровни сердечного маркера (тропонина T (TnT или cTnT) или тропонина I (TnI или cTnI)), BNP (мозгового натрийуретического пептида) или N-концевого про-мозгового натрийуретического пептида (NT proBNP) и маркеров повреждения головного мозга (таких как NSE (нейронспецифическая енолаза) и Sβ100 (S100-бета)), предпочтительно увеличение числа тромбоцитов.
Кроме того, полипептид по настоящему изобретению при введении пациенту-человеку с TTP был безопасным, что исследовали с помощью лабораторных маркеров безопасности, таких как RiCo, vWF и FVIII с использованием хромогенного субстрата. Хотя существовала возможность повышенного риска кровотечения, она была полностью контролируемой.
Маркеры можно измерить с помощью стандартных способов, известных специалистам в данной области и используемых ими, таких как различные иммунологические анализы, в том числе твердофазные иммуноферментные анализы (ELISA; также известный как иммуноферментный анализ (EIA)), радиоиммунологические анализы или количественные иммуноферментные анализы. Также можно использовать химические, колориметрические и ферментативные анализы в случаях, когда это целесообразно.
Соответственно, в настоящем изобретении предусмотрен полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, предпочтительно ALX 0081 или ALX 0081-A, для применения в лечении заболевания, связанного с vWF, такого как TTP, у человека, нуждающегося в этом, путем многократного введения человеку дозы 5-40 мг указанного полипептида, где в рамках периода от 15 минут до 4 часов после введения указанной дозы следует первый PE.
Полипептиды по настоящему изобретению вводили в качестве вспомогательного лечения в определенные моменты времени относительно процедур PE для лечения или предупреждения заболевания, связанного с vWF, например, TTP (например, ослабления или уменьшения интенсивности проявлений одного или нескольких симптомов, ассоциированных с ним).
Термин "осуществление лечения" (осуществление лечения, лечение) относится к введению средства терапии в количестве, путем и/или способом, которые являются эффективными для улучшения состояния, симптома или параметра, ассоциированного с заболеванием, или для предупреждения прогрессирования заболевания в статистически значимой степени либо в степени, поддающейся выявлению специалистом в данной области. В случае терапевтического применения лечение может приводить к улучшению течения, излечению, поддержанию или уменьшению продолжительности заболевания или состояния у субъекта. В терапевтических путях применения у субъекта может наблюдаться частичное или полное проявление симптомов. В типичном случае лечение приводит к улучшению течения заболевания или состояния субъекта в степени, поддающейся выявлению врачом, или предупреждению ухудшения течения заболевания или состояния. Например, улучшаются клинические особенности и проявления острого эпизода ТТР, как показано в таблице 1 или как приведено в руководствах по лечению ТТР (Scully et al. 2012, выше). Например, благодаря лечению нормализуется число тромбоцитов, уменьшается титр аутоантител к ADAMTS13 и/или увеличивается активность ADAMTS13, что в каждом случае известно из уровня техники и/или более подробно описано далее (см. ниже). Эффективное количество, путь или способ могут варьироваться в зависимости от субъекта и могут быть адаптированы для субъекта.
Термин "период лечения" относится к интервалу времени, в течение которого пациент получает лечение, которое может включать в себя РЕ и/или введение полипептида по настоящему изобретению и необязательно других лекарственных препаратов, таких как, например, стероиды или ритуксимаб. В предпочтительном варианте осуществления период лечения относится к введению полипептида по настоящему изобретению пациенту, нуждающемуся в этом, где указанное введение повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней, как, например, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев или даже больше.
Используемый в данном документе термин "предупреждение" означает смягчение симптома упомянутого нарушения. В частности, указанный термин охватывает полный спектр терапевтически положительных эффектов введения полипептида по настоящему изобретению субъекту, в том числе ослабление, облегчение и устранение нарушения, связанного с vWF, например, ТТР, и его симптомов. Термин "предупреждение" включает предупреждение или отсрочку развития заболевания, предупреждение или отсрочку развития симптомов и/или снижение степени тяжести таких симптомов, которые будут развиваться или согласно предположениям будут развиваться. Он также включает уменьшение интенсивности проявлений имеющихся симптомов, предупреждение дополнительных симптомов и уменьшение интенсивности проявлений или предупреждение первопричин симптомов.
Используемые в данном документе термины "субъект" и "пациент" используются взаимозаменяемо. Используемые в данном документе термины "субъект" и "субъекты" относятся к животному, например, млекопитающему, в том числе к млекопитающему, отличному от примата (например, корове, свинье, лошади, ослу, козе, верблюду, кошке, собаке, морской свинке, крысе, мыши, овце), и примату (например, нечеловекообразной обезьяне, такой как яванский макак, горилле, шимпанзе и человеку). "Пациент" предпочтительно относится к человеку. Указанные пациенты могут включать пожилых людей, взрослых, подростков и детей любого возраста, например, детей в возрасте в диапазоне от 2 до менее 12 лет, подростков в возрасте в диапазоне от 12 до менее 18 лет, взрослых в возрасте в диапазоне от 18 до менее 65 лет и пожилых людей в возрасте от 65 лет и старше.
Неограничивающие примеры заболеваний, связанных с vWF, которые можно лечить, включают без ограничения, например, острый коронарный синдром (ACS), транзиторную церебральную ишемическую атаку, нестабильную или стабильную стенокардию, инсульт, инфаркт миокарда, тромботическую тромбоцитопеническую пурпуру (TTP) и синдром Апшо-Шульмана, предпочтительно TTP.
Процедуры PE для лечения или предупреждения заболевания, связанного с vWF, такого как, например, TTP, были описаны в обобщенных руководствах по диагностике и контролю TTP и других тромботических микроангиопатий (Scully et al. 2017, выше), которые в явной форме включены в данный документ посредством ссылки. Полная ремиссия определяется как нормальное число тромбоцитов, т. е. >150000/мкл, и необязательно отсутствие обострений (см. Scully et al. 2012, 2017, выше).
Как используется в данном документе, "время до ответа" представляет собой время между первой лечебной процедурой для пациента с острым эпизодом TTP, например, первоначальным эпизодом и/или рецидивирующим эпизодом TTP, и моментом, в который число тромбоцитов будет составлять >150000/мкл, при этом первая лечебная процедура представляет собой PE или введение полипептида по настоящему изобретению или и то, и другое, в зависимости от того, что осуществляют раньше.
Используемый в данном документе термин "рефрактерность" или "рефрактерный" относится к персистентной тромбоцитопении, отсутствию устойчивого увеличения числа тромбоцитов или числу тромбоцитов <50×109 л-1 и перманентно повышенному уровню LDH (>1,5 ULN), несмотря на 5 РЕ и лечение стероидами, в том числе у субъектов, которым не удается достичь ремиссии или у которых улучшенные число тромбоцитов и уровень LDH ухудшаются, несмотря на продолжающееся лечение.
Термин "плазмообмен" ("PE" или "PEX") относится к терапевтической процедуре, применяемой для лечения ряда заболеваний, в том числе TTP, посредством объемного удаления плазмы крови, т.е. к процедуре, при которой удаляется большой объем плазмы крови, обычно 1-1,5 объема плазмы крови, которую замещают замещающей жидкостью (Winters 2012 Hematology ASH Education Book 1:7-12). Посредством объемного удаления и замещения плазмы крови в ходе PE удаляются патологические вещества, такие как аутоантитела к ADAMTS13 и ULvWF, а также и некоторые тромбоциты. Плазму крови используют в качестве замещающей жидкости для замещения ADAMTS13 при лечении TTP (McLeod Best Pract Res Clin Haematol. 2006; 19:157-167). Объемное удаление и замещение плазмы крови также влияет на лабораторное тестирование, что осложняет тестирование пациентов.
Поскольку РЕ предусматривает объемное удаление плазмы крови, то все, что циркулирует в плазме крови, будет удалено. Следовательно, эта процедура является неизбирательной, при которой удаляются как нормальные, так и патологические компоненты плазмы крови, а также и любые лекарственные препараты для лечения TTP, вводимые перед PE.
Несмотря на преимущества PE при лечении TTP, в настоящем изобретении было показано, что каплацизумаб является благоприятным в случае, когда его начинают принимать в качестве средства терапии первой линии. Термин "терапия первой линии" (или лечение первой линии) относится к первому виду лечения (также называемому лечением "первого ряда"), получаемому при заболевании, например, TTP. Наряду с терапией первой линии может быть добавлено или применяться вместо нее дополнительное лечение, такое как РЕ и дополнительное иммунодепрессивное лечение (например, применение кортикостероидов, таких как (метил)-преднизолон или (метил)-преднизон, или ритуксимаба), применение антитромбоцитарных средств (например, аспирина), поддерживающая терапия с трансфузией эритроцитов или добавлением фолата, лечение винкристином или циклоспорином, применение антител к аутоантителам к ADAMTS13 или ADAMTS13.
Специалист в данной области хорошо знаком с определением числа тромбоцитов. Подсчет тромбоцитов может быть выполнен любым способом, известным из уровня техники, как, например, вручную с использованием гемоцитометра или с помощью автоматического анализатора, например, путем электронного подсчета. Подсчет можно также осуществлять в ходе исследования мазка крови. При микроскопическом способе используют фазово-контрастный микроскоп для просмотра крови на предметном стекле гемоцитометра. Электронный подсчет тромбоцитов является наиболее распространенным способом. Существуют два типа электронных счетчиков - системы подсчета, работающие на импульсах напряжения, и оптико-электронные системы подсчета. Например, гематологический анализатор ADVIA® можно использовать для получения числа тромбоцитов и проверки полученного числа путем оценочного подсчета в мазке крови, окрашенном красителем Райта. ADVIA позволяет измерять число тромбоцитов с помощью проточной цитометрии, основанной на принципах рассеяния света. Например, тромбоциты идентифицируют по их размеру (<30 фл, малоугловое рассеяние света) и показателю преломления (от n=1,35 до n=1,40 при высокоугловом рассеянии света).
У различных пациентов после острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего(рецидивирующих) эпизода(эпизодов) TTP, полипептид по настоящему изобретению, содержащий по меньшей мере один ISVD, направленный против vWF, например, ALX 0081 или ALX 0081-A, вводили после того, как указанный пациент получил PE ("предшествующий PE"; PE, предшествующий введению первой дозы полипептида по настоящему изобретению).
Соответственно, настоящее изобретение относится к осуществлению PE (предшествующего PE) у пациента, нуждающегося в этом, например, у пациента с острым эпизодом TTP, например, первоначальным эпизодом TTP и/или рецидивирующими эпизодами TTP, а затем следующего PE в рамках периода 24 часов после указанного предшествующего PE и введения полипептида по настоящему изобретению ("первой дозы") за приблизительно 8 часов, 7 часов, 6 часов, 5 часов, 4 часа, 3 часа, 3 часа, 1 час, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут до начала указанного следующего PE, как, например, в рамках периода от 6 часов до 15 минут до начала указанного следующего PE ("первого PE"). В настоящем изобретении термин "первая доза" означает первое введение полипептида по настоящему изобретению пациенту, нуждающемуся в этом, например, после острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP.
В одном варианте осуществления в рамках периода от 5 минут до 8 часов, как, например, в рамках периода от 10 минут до 6 часов или от 15 минут до 4 часов, например, в рамках периода 8 часов, 7 часов, 6 часов, 5 часов, 4 часов, 3 часов, 3 часов, 1 часа, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут, после введения полипептида по настоящему изобретению пациенту, предпочтительно первой дозы, следует РЕ.
В настоящем изобретении термин "первый PE" означает первый PE, осуществляемый после введения пациенту первой дозы полипептида по настоящему изобретению (или в некоторых случаях одновременно с ним).
Полипептид по настоящему изобретению можно вводить или применять для введения в форме жидкого раствора (например, инъекционных и инфузионных растворов). Такие композиции можно вводить парентеральным способом (например, путем подкожной, внутрибрюшинной или внутримышечной инъекции) или путем ингаляции. Выражения "парентеральное введение" и "вводимый парентерально", используемые в данном документе, означают способы введения, отличные от энтерального и местного введения, обычно путем инъекции, и включают в себя подкожное (s.c.) или внутримышечное введение, а также внутривенную (i.v.), интракапсулярную, интраорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, субкутикулярную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и внутригрудинную инъекцию и инфузию. Вторую или дополнительные дозы полипептидов по настоящему изобретению, описываемых в данном документе, предпочтительно вводят подкожно.
Введение первой дозы полипептида по настоящему изобретению после острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP, предпочтительно представляет собой внутривенную болюсную инъекцию, например, при которой полипептид доставляется посредством капельницы и вводится за один раз на протяжении периода одной или двух минут. Введение первой дозы полипептида по настоящему изобретению после острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP, еще более предпочтительно представляет собой внутривенную струйную инъекцию, например, при которой полипептид доставляется посредством капельницы и вводится за один раз на протяжении периода приблизительно 30 секунд или меньше.
Авторы настоящего изобретения считают, что полипептид по настоящему изобретению безопасен для применения, как было продемонстрировано в предыдущих исследованиях с участием здоровых добровольцев и в настоящем исследовании с участием пациентов с TTP (см. примеры), что TTP может быть трудно диагностировать, особенно первоначальный эпизод TTP, и что любое потерянное время до начала лечения приводит к неблагоприятным последствиям, и приходят к выводу, что эти полученные данные имеют преимущество, заключающееся в том, что лечение полипептидом по настоящему изобретению уже может быть начато своевременно, даже до того, как пациент поступит в больницу, как, например, в машине скорой помощи. Полипептид по настоящему изобретению, такой как ALX 0081 или ALX 0081-A, предпочтительно вводят путем внутривенной струйной инъекции, так как это можно легко осуществлять вне больниц, что тем самым экономит драгоценное время.
Соответственно, настоящее изобретение относится к введению пациенту, нуждающемуся в этом, такому как, например, пациенты с острыми эпизодами (острыми приступами) TTP, например, первоначальным эпизодом TTP и/или рецидивирующим (рецидивирующими) эпизодом (эпизодами) TTP, полипептида по настоящему изобретению за приблизительно 8 часов, 7 часов, 6 часов, 5 часов, 4 часа, 3 часа, 3 часа, 1 час, 45 минут, 30 минут, 20 минут, 15 минут, 10 минут или даже 5 минут до начала PE, как, например, в рамках периода от 6 часов до 15 минут до начала PE ("первая доза").
В одном варианте осуществления после введения первой дозы полипептида по настоящему изобретению после острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP, следует PE ("первый PE"). После этого первого РЕ, независимо от того, предшествует ему предшествующий РЕ или нет, следует введение второй или дополнительной дозы полипептида по настоящему изобретению ("вторая доза" или "дополнительная доза"). Вторую дозу или дополнительную дозу предпочтительно вводят в рамках периода 120, 90 или 60 минут, как, например, в рамках периода 1-60 минут, например, в рамках периода 50, 45, 40, 35, 30, 25, 20, 15, 10, 5, 4, 3, 2 или даже 1 минуты, после первого PE. В некоторых случаях может быть преимущественным введение второй или дополнительной дозы вместе или одновременно с замещающей жидкостью, например, плазмой крови для РЕ.
В дополнительных вариантах осуществления первая доза, вторая доза или дополнительная доза полипептида по настоящему изобретению составляет приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35 или 40, 50, 60, 70 или 80 мг, предпочтительно 5-40 мг, еще более предпочтительно 10 мг или 11 мг, которые можно вводить пациенту, нуждающемуся в этом, предпочтительно в день. Для введения ювенильным пациентам, таким как, например, дети и подростки, дозу можно скорректировать с учетом массы пациента. В конкретных вариантах осуществления доза составляет приблизительно 0,01, 0,025, 0,05, 0,075, 0,1, 0,12, 0,14, 0,15, 0,16, 1,08, 0,2, 0,22, 0,24 или 0,25 мг/кг, предпочтительно 0,143 мг/кг, что соответствует дозе 10 мг для взрослого массой 70 кг. В других вариантах осуществления доза составляет приблизительно 5 мг в случае, если масса тела указанного ребенка или подростка составляет <40 кг.
В одном варианте осуществления настоящее изобретение относится к введению приблизительно 5-40 мг, предпочтительно 10 мг или 11 мг, полипептида по настоящему изобретению, например, ALX 0081 или ALX 0081-A, в рамках периода 1-60 минут после процедуры PE, например, первого PE, второго PE или дополнительного PE.
В одном варианте осуществления полипептид по настоящему изобретению, например, ALX 0081 или ALX 0081-A, вводят один раз в день или два раза в день пациенту с TTP, нуждающемуся в этом, предпочтительно пациенту с числом тромбоцитов ниже 100000/мкл плазмы крови и/или пациенту с активностью ADAMTS13<10%, как, например, <5%.
В дополнительном варианте осуществления пациент с TTP, нуждающийся в этом, получает лечение с помощью (i) PE и (ii) дозы 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида через от 60 минут до 1 минуты после указанного PE на стадии (i), где стадию (i) и стадию (ii) повторяют один раз или два раза в день до тех пор, пока число тромбоцитов у указанного пациента не будет составлять по меньшей мере 50000/мкл плазмы крови, например, 75000, 100000, 125000 или даже 150000 на мкл плазмы крови.
В некоторых случаях может быть преимущественным повторение стадии (i) и стадии (ii) на протяжении не менее двух дней после наступления полной ремиссии (при которой число тромбоцитов составляет >150000/мкл плазмы крови).
В одном варианте осуществления 5-40 мг полипептида по настоящему изобретению вводят один раз в день или два раза в день на протяжении по меньшей мере 5, 10, 15, 20, 25, 30, 60, 90 или даже 120 дней после того, как число тромбоцитов у указанного пациента будет составлять >150000/мкл плазмы крови, в частности, в случае, когда активность ADAMTS13 у указанного пациента составляет <10%, как, например, <5%, или после последнего PE.
Следовательно, введение полипептидов, содержащих по меньшей мере один ISVD, направленный против vWF, таких как ALX 0081 или ALX 0081-A, пациентам-людям с ТТР после острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP, обеспечивает неожиданное уменьшение времени до ответа независимо от порядка введения указанного полипептида и указанного PE, например, осуществления PE до или после введения первой дозы полипептида по настоящему изобретению.
Кроме того, было неожиданно обнаружено, что количество обострений уменьшалось на протяжении периода лечения в двойном слепом режиме (DB) в случае, когда пациентов переводили на каплацизумаб в открытом режиме ("OL") вместе с возобновлением ежедневного плазмообмена (PEX) и подавлением иммунного ответа с сохранением при этом ослепления при первоначальном назначении лечения (см. пример 7.13).
Используемый в данном документе термин "обострение" относится к рецидивирующей тромбоцитопении после подтвержденного ответа со стороны тромбоцитов, требующей возобновления ежедневных лечебных процедур PE через ≥1 день, но ≤30 дней после последнего ежедневного PE.
Это указывает на то, что полипептид по настоящему изобретению, такой как ALX 0081 или ALX 0081-A, может единолично отвечать за лечение и/или облегчение (симптомов) TTP.
Соответственно, настоящее изобретение относится к полипептиду, содержащему по меньшей мере один ISVD, направленный против vWF, такому как ALX 0081 или ALX 0081-A, для применения в лечении заболевания, связанного с vWF, такого как TTP, у человека, нуждающегося в этом, путем введения человеку дозы 1-80 мг или 5-40 мг, как, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50, 60, 70 или 80 мг, предпочтительно 10 мг или 11 мг, указанного полипептида в случае, если указанный человек имеет массу тела ≥40 кг, и 5 мг в случае, если указанная масса тела составляет <40 кг.
Исходя из этих неожиданных наблюдений, представленных в данном документе, авторы настоящего изобретения разработали дополнительно оптимизированный протокол лечения, который по существу основывается на предположении, что распределение времени подтвержденного ответа со стороны тромбоцитов является более коротким и не является скошенным или смещенным вправо (к более длительному времени до ответа) в группе, получавшей CAP (каплацизумаб), по сравнению с группой, получавшей плацебо. В дополнительно оптимизированном протоколе лечения все субъекты получают лечение с фиксированным периодом лечебных процедур РЕ, который установлен равным 3-5 дней, как, например, 3 дня, или 4 дня, или 5 дней, предпочтительно 3 дня. В этом случае период лечебных процедур РЕ может быть независимым от восстановления числа тромбоцитов (>150000/мкл). В дополнительно оптимизированном протоколе лечения снижаются нагрузка на пациента и затраты.
Соответственно, настоящее изобретение относится к полипептиду, содержащему по меньшей мере один ISVD, направленный против vWF, такому как ALX 0081 или ALX 0081-A, для применения в лечении заболевания, связанного с vWF, у человека, нуждающегося в этом, включающем: (i) осуществление PE и (ii) введение дозы 5-40 мг, как, например, 10 мг или 11 мг, полипептида по настоящему изобретению через от 15 минут до 4 часов после указанного PE на стадии (i), где стадию (i) и стадию (ii) повторяют один раз в день на протяжении 3-5 дней, как, например, 3 дней, 4 дней или 5 дней, предпочтительно 3 дней; за которыми следует предусматриваемое дополнительное введение один раз в день дозы 5-40 мг, как, например, 10 мг или 11 мг, указанного полипептида на протяжении по меньшей мере 10 дней, как, например, по меньшей мере 20 дней или по меньшей мере 30 дней, и/или на протяжении по меньшей мере 10 дней, как, например, по меньшей мере 20 дней или по меньшей мере 30 дней, после того, как число тромбоцитов у указанного пациента в первый раз будет составлять >150000/мкл.
В настоящем исследовании пациенты с ТТР проходили последующее наблюдение в течение периода до одного года для контроля ремиссии. Используемый в данном документе термин "ремиссия" относится к подтвержденному ответу со стороны тромбоцитов и отсутствию обострений. Используемый в данном документе термин "подтвержденный ответ со стороны тромбоцитов" относится к времени до ответа на лечение, определяемому по восстановлению числа тромбоцитов до ≥150000/мкл, где ответ должен быть подтвержден спустя 48 часов после первоначального сообщения о восстановлении числа тромбоцитов до уровня выше 150000/мкл путем измерения числа тромбоцитов de novo с результатом ≥150000/мкл и предпочтительно при LDH ≤ 2 X ULN.
Как отмечено выше, число тромбоцитов является основной мерой для оценки ремиссии. Измерение активности ADAMTS13 у пациентов с классической ТТР в анамнезе является важным, поскольку было показано, что низкие уровни позволяют прогнозировать рецидив. Однако в настоящее время неясно (и данные являются противоречивыми), является ли титр ингибирующего антитела к ADAMTS13 значимым, т.е. развивается ли у индивидуумов с высоким титром антител к ADAMTS13 рецидив с большей вероятностью, чем у индивидуумов с низким титром. Специалисту в данной области понятно, что существующие тесты ADAMTS13 осуществляются в статических условиях и не всегда точно отражают физиологические изменения, происходящие in vivo (http://practical-haemostasis.com/Miscellaneous/Miscellaneous%20Tests/adamts13_assays.html).
Ремиссия, по-видимому, является более выраженной в подгруппе субъектов с низкой активностью ADAMTS13 на исходном уровне (т.е. менее чем 10%, как, например, менее чем 5%) в момент начала лечения, например, введения первой дозы полипептида по настоящему изобретению, такого как ALX 0081 или ALX 0081-A.
Соответственно, настоящее изобретение относится к полипептиду, содержащему по меньшей мере один ISVD, направленный против vWF, для применения в лечении заболевания, связанного с vWF, у человека, нуждающегося в этом, путем введения указанному человеку первой дозы 1-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида, до тех пор, пока число тромбоцитов у указанного человека не будет составлять >150000/мкл. В предпочтительном аспекте указанный человек характеризуется активностью ADAMTS13, составляющей менее чем 10%, например, менее чем 5%, при введении указанного полипептида.
Используемый в данном документе термин "рецидив" относится к событию TTP de novo, которое происходит позже чем через 30 дней после последнего ежедневного PE.
Активность ADAMTS13 является прогностическим маркером рецидивов ТТР и ее потенциала для принятия решений относительно лечения. Активность ADAMTS13 может позволять прогнозировать рецидивы, происходящие вскоре после прекращения лечения каплацизумабом. Эти рецидивы рассматриваются как рецидивы проявляющегося эпизода ТТР (неустраненной активности заболевания, определяемой на основании неизменно низкой активности ADAMTS13). 30-дневный период лечения (после РЕ) каплацизумабом продемонстрировал значительное влияние на количество обострений. Следовательно, продление периода лечения каплацизумабом для пациентов с риском рецидива (т.е. с активностью первопричинного заболевания, определяемой на основании активности ADAMTS13) будет поддерживать защитные эффекты каплацизумаба до тех пор, пока первопричинное заболевание не будет подвергнуто надлежащему лечению и устранено. И наоборот, профилактическое лечение каплацизумабом приведет к снижению риска нового острого эпизода ТТР.
Следовательно, лечение полипептидом по настоящему изобретению, таким как ALX 0081 или ALX 0081-A, следует продолжать в течение более длительных периодов по сравнению с пациентами с более высокой активностью ADAMTS13. Полипептид по настоящему изобретению следует вводить пациенту с TTP для снижения риска и/или предупреждения вероятности рецидива (рецидивов) до тех пор, пока активность ADAMTS13 не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 40%, 45% или даже 50%, по сравнению с нормальной или эталонной активностью.
Соответственно, настоящее изобретение относится к полипептиду, содержащему по меньшей мере один ISVD, направленный против vWF, для применения в снижении риска и/или предупреждении острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP, у человека, нуждающегося в этом, включающем стадию (i) введения указанному человеку дозы 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида. Указанный риск предпочтительно снижается в по меньшей мере 1,2, 1,3, 1,4, 1,5, 1,6, 1,75, 1,8, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз. Указанный риск предпочтительно снижается на 10% или даже больше, как, например, на 20%, 30%, 40%, 50%, 60% или больше, как, например, на 80% или даже 100%.
Соответственно, настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, описываемого в данном документе, у человека, нуждающегося в этом, где указанную стадию введения указанному человеку указанного полипептида повторяют по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз или даже более чем 10 раз, как, например, 20 раз, предпочтительно более чем 30 раз или даже больше.
Соответственно, настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, описываемого в данном документе, у человека, нуждающегося в этом, где указанная стадия введения указанному человеку указанного полипептида повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней, как, например, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев или даже больше.
Соответственно, настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, описываемого в данном документе, у человека, нуждающегося в этом, где указанная доза вводится 1 раз в день или два раза в день.
Соответственно, настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, описываемого в данном документе, у человека, нуждающегося в этом, дополнительно включающем
(ii) сравнение активности ADAMTS13 с эталонной активностью ADAMTS13; и
(iii) в случае, если указанная активность ADAMTS13 составляет менее 30%, как, например, 20%, 15%, 10% или 5%, от указанной эталонной активности ADAMTS13, повторение указанной стадии (i) введения указанному человеку указанного полипептида.
Соответственно, настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, описываемого в данном документе, у человека, нуждающегося в этом, где указанную активность ADAMTS13 у указанного пациента измеряют и/или сравнивают ежедневно или один раз в 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней, предпочтительно по меньшей мере один раз в неделю.
Соответственно, настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, описываемого в данном документе, у человека, нуждающегося в этом, где стадию введения полипептида по настоящему изобретению указанному человеку повторяют до тех пор, пока указанная активность ADAMTS13 не будет составлять по меньшей мере 5%, 10%, 15%, как, например, 20% или даже 30% или больше, от указанной эталонной активности ADAMTS13.
Соответственно, настоящее изобретение относится к полипептиду, содержащему два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого фактора фон Виллебранда (vWF), для применения в лечении (симптомов) обострения заболевания, связанного с vWF, у человека, включающем введение указанному человеку дозы 1-80 мг, предпочтительно 5-40 мг, еще более предпочтительно 10 мг или 11 мг, указанного полипептида 1 раз в день или 2 раза в день до тех пор, пока активность ADAMTS13 не будет составлять более чем 10% от эталонной активности ADAMTS13; необязательно повторение указанной стадии введения до тех пор, пока указанная активность ADAMTS13 не будет составлять более чем 10% от эталонной активности ADAMTS13, на протяжении по меньшей мере 2 дней, как, например, по меньшей мере 5 дней, 7 дней или даже дольше, как, например, 14 дней, 21 дня или даже по меньшей мере 1 месяца.
Соответственно, настоящее изобретение относится к полипептиду, содержащему два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого фактора фон Виллебранда (vWF), для применения в лечении (симптомов) рецидива заболевания, связанного с vWF, у человека, включающем введение указанному человеку дозы 1-80 мг, предпочтительно 5-40 мг, еще более предпочтительно 10 мг или 11 мг, указанного полипептида 1 раз в день или 2 раза в день до тех пор, пока активность ADAMTS13 не будет составлять более чем 10% от эталонной активности ADAMTS13; необязательно повторение указанной стадии введения до тех пор, пока указанная активность ADAMTS13 не будет составлять более чем 10% от эталонной активности ADAMTS13, на протяжении по меньшей мере 2 дней, как, например, по меньшей мере 5 дней, 7 дней или даже дольше, как, например, 14 дней, 21 дня или даже по меньшей мере 1 месяца.
Соответственно, настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, описываемого в данном документе, у человека, нуждающегося в этом, где стадию введения указанному человеку указанного полипептида повторяют до тех пор, пока указанная активность ADAMTS13 не будет составлять по меньшей мере 5%, 10%, 15%, как, например, 20% или 30%, от указанной эталонной активности ADAMTS13 при по меньшей мере 2 последовательных измерениях. Указанные 2 последовательных измерения предпочтительно осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
Соответственно, настоящее изобретение относится к полипептиду, описываемому в данном документе, для применения в лечении и/или предупреждении заболевания, связанного с vWF, описываемого в данном документе, у человека, нуждающегося в этом, где указанная стадия введения указанному человеку указанного полипептида повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней или даже больше, после того, как указанная активность ADAMTS13 будет составлять по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, как, например, 20% или по меньшей мере 30%, от указанной эталонной активности при по меньшей мере 2 последовательных измерениях.
Соответственно, настоящее изобретение относится к полипептиду, содержащему по меньшей мере один ISVD, направленный против vWF, для применения в снижении риска и/или предупреждении острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего(рецидивирующих) эпизода(эпизодов) TTP, у человека, нуждающегося в этом, включающем стадию (i) введения указанному человеку дозы 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида, дополнительно включающем
- измерение активности ADAMTS13 у указанного пациента;
- сравнение указанной активности ADAMTS13 с эталонной активностью ADAMTS13; и
- в случае, если указанная активность ADAMTS13 составляет >5%, как, например, >10%, или даже >15%, или более чем 20% или 30%, от указанной эталонной активности ADAMTS13, повторение указанной стадии (i) на протяжении не более 30 дней, как, например, не более 20 дней, или даже 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дней, или даже 1 дня.
Соответственно, настоящее изобретение относится к полипептиду, содержащему по меньшей мере один ISVD, направленный против vWF, для применения в снижении риска и/или предупреждении острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP, у человека, нуждающегося в этом, включающем по меньшей мере следующие стадии:
(i) необязательно измерение активности ADAMTS13 у указанного пациента;
(ii) необязательно сравнение указанной активности ADAMTS13 с эталонной активностью ADAMTS13; и
(iii) в случае, если указанная активность ADAMTS13 составляет менее 30%, 20%, 15%, 10% или 5% от указанной эталонной активности, введение указанному человеку дозы 5-40 мг, предпочтительно 10 мг или 11 мг, указанного полипептида, содержащего по меньшей мере один ISVD, направленный против vWF.
Как используется в данном документе, снижение риска или частоты возникновения включает в себя уменьшение вероятности или частоты возникновения показания, симптома или результата заболевания, связанного с vWF, такого как ТТР, у субъекта, по сравнению с соответствующей, например, не получающей лечения, контрольной популяцией, или с тем же субъектом до лечения согласно настоящему изобретению.
Показание, симптом или результат заболевания, связанного с vWF, такого как ТТР, как используется в данном документе, включают в себя любое из повреждения органов, ишемического повреждения, образования микротромбов, обострений, смертности, рецидивов, рефрактерности, одного или нескольких маркеров заболевания для заболевания, связанного с vWF, такого как TTP, в том числе числа тромбоцитов, тромбоцитопении, нейрокогнитивной функции, уровней ADAMTS13 и титров антител к ADAMTS13, уровней активности ADAMTS13, уровней сердечного маркера (тропонина T или тропонина I), BNP (мозгового натрийуретического пептида) или N-концевого про-мозгового натрийуретического пептида (NT proBNP), креатинина и маркеров повреждения головного мозга (таких как NSE (нейронспецифическая енолаза) и Sβ100 (S100-бета)), предпочтительно маркеров повреждения органов, как, например, уровней LDH, уровней тропонина Т и/или тропонина I и/или уровней креатинина.
Снижение риска или частоты возникновения может включать в себя задержку или предупреждение начала проявления показания, симптома или результата заболевания, связанного с vWF, такого как TTP. Риск или частота возникновения могут также снижаться, если степень тяжести показания, симптома или результата заболевания, связанного с vWF, такого как ТТР, снижается до такого уровня, при котором она не является клинически значимой. Таким образом, показание, симптом или результат заболевания, связанного с vWF, такого как ТТР, может проявляться, но на уровне, который не угрожает жизни, формам активности и/или самочувствию субъекта. В некоторых случаях частота встречаемости заболевания, связанного с vWF, такого как ТТР, снижается до такой степени, при которой у субъекта не проявляются какие-либо признаки заболевания, связанного с vWF, такого как ТТР, на протяжении и/или после периода лечения.
Следует понимать, что ни одного фактического доказательства снижения риска для индивидуума не может быть получено, поскольку, если проведено лечение, то нельзя сказать, могли ли появиться показание, симптом или результат заболевания, связанного с vWF, такого как ТТР, или могли ли они появиться раньше при отсутствии такого лечения. Таким образом, понятие риска и повышенного или сниженного риска относится исключительно к статистическим величинам. Кроме того, снижение риска развития показания, симптома или результата заболевания, связанного с vWF, такого как ТТР, может отражаться в снижении степени тяжести показания, симптома или результата заболевания, связанного с vWF, такого как ТТР, а также в отсутствии наблюдения или задержке наблюдения показания, симптома или результата заболевания, связанного с vWF, такого как ТТР.
Следует понимать, что полипептид по настоящему изобретению обеспечивает снижение риска и/или предупреждение острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP. Следовательно, также ослабляются показание, симптом или результат острого эпизода TTP, например, первоначального эпизода TTP и/или рецидивирующего (рецидивирующих) эпизода (эпизодов) TTP. С учетом патофизиологических особенностей приобретенной ТТР, где нити ULvWF захватывают тромбоциты при образовании микротромбов, было сделано разумное предположение, что восстановление числа тромбоцитов является косвенной мерой предупреждения дальнейшего образования микротромбов. Заболеваемость и острая смертность, ассоциированная с приобретенной ТТР, является результатом образования этих микротромбов.
Действительно, это разумное предположение подтверждается нормализацией уровней маркеров повреждения органов. В частности, результаты указывают на то, что уровни маркеров повреждения органов, таких как тропонин I и Т, LDH и креатинин, быстрее возвращаются к нормальным у субъектов, получающих полипептид по настоящему изобретению, например, ALX 0081 или ALX 0081-A, чем у субъектов, получающих плацебо (см. примеры).
Следовательно, результаты позволяют предположить, что более высокая скорость нормализации уровней этих маркеров повреждения органов связана с лучшим клиническим исходом, т.е. со снижением риска и меньшей степенью повреждения органов вследствие ишемии органов, вызванной образованием микротромбов, и со снижением рефрактерности.
Соответственно, настоящее изобретение относится к способу, описываемому в данном документе, где
- риск повреждения органов, ишемического повреждения и/или образования микротромбов снижается на 10%, 20%, 30%, предпочтительно на по меньшей мере 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100% (например, имеет место отсутствие повреждения органов, ишемического повреждения и/или образования микротромбов вследствие заболевания, связанного с vWF);
- риск повреждения органов, ишемического повреждения и/или образования микротромбов снижается в 1,2, 1,3, 1,4, 1,5, 1,6, 1,75, 1,8, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- степень повреждения органов, ишемического повреждения и/или образования микротромбов предпочтительно снижается на по меньшей мере 10%, 20%, 30%, 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%;
- степень повреждения органов, ишемического повреждения и/или образования микротромбов снижается в 1,2, 1,3, 1,4, 1,5, 1,6, 1,75, 1,8, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- уровни маркеров повреждения органов, такие как уровни LDH, уровни тропонина T, уровни тропонина I и/или уровни креатинина, возвращаются к величине, составляющей по меньшей мере 40% или даже по меньшей мере 50%, как, например, 60%, 70%, 80%, 90% или даже до 100%, от нормальных уровней;
- уровни маркеров повреждения органов, такие как уровни LDH, уровни тропонина T, уровни тропонина I и/или уровни креатинина, улучшаются на по меньшей мере 20%, как, например, на 30% или даже больше, как, например, на 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%, от нормальных уровней. Указанные маркеры повреждения органов, такие как уровни LDH, уровни тропонина T, уровни тропонина I и/или уровни креатинина, предпочтительно улучшаются за менее чем 30 дней лечения, предпочтительно за менее чем 20 дней лечения, как, например, за менее чем 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 дня или даже в рамках периода 1 дня ;
- число тромбоцитов сохраняется на уровне >150000/мкл;
- время до нормализации числа тромбоцитов (>150000/мкл) сокращается на по меньшей мере 10%, 20%, 30%, 35%, 39%, предпочтительно на по меньшей мере 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%;
- риск обострений снижается на по меньшей мере 10%, 20%, 30%, 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%;
- риск обострений снижается в 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- смертность вследствие указанного заболевания, связанного с vWF, снижается на 10%, 20%, 30%, предпочтительно на по меньшей мере 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%;
- смертность вследствие указанного заболевания, связанного с vWF, снижается в 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- степень ремиссии повышается в 1,2, 1,3, 1,4, 1,5, 1,6, 1,75, 1,8, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз;
- рефрактерность снижается предпочтительно на по меньшей мере 10%, 20%, 30%, 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%; и/или
- рефрактерность снижается в 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз.
Используемый в данном документе термин "эталонная активность" относится к средней активности ADAMTS13 у 5 здоровых субъектов в осуществляемом анализе, которую принимают равной 100%. Например, в анализе методом резонансного переноса энергии флуоресценции (FRET) с использованием vWF73 строят калибровочную кривую с использованием пула нормальной плазмы крови человека, в котором рассчитывают наклон кривой регрессии для каждого калибровочного образца и который используют для построения калибровочной кривой (линия тренда: у=ах+b; где х=ADAMTS13 (%), а у=дельта RFU/дельта времени). Активность ADAMTS13 (%) в образце затем рассчитывают следующим образом: (y - b) x 1/a, например, как описано в Kokame et al. (Br J Haematol. 2005, 129:93-100). Действительно, в целом пациенты с рецидивами характеризуются более низкой активностью ADAMTS13, чем пациенты без рецидивов.
Соответственно, настоящее изобретение относится к полипептиду для снижения риска и/или предупреждения ишемического повреждения, повреждения органов и/или образования микротромбов, например, вызываемых заболеванием, связанным с vWF, таким как TTP, эпизод TTP, например, первоначальный эпизод TTP и/или рецидивирующий (рецидивирующие) эпизод(эпизоды) TTP, у человека, нуждающегося в этом, включающего по меньшей мере следующую стадию (i) введения указанному человеку дозы 5-40 мг/день, предпочтительно 10 мг/день или 11 мг/день, полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF); где введение указанного полипептида приводит к снижению риска и/или предупреждению ишемического повреждения, повреждения органов и/или образования микротромбов на по меньшей мере 10%, 20%, 30%, предпочтительно на по меньшей мере 40% или даже на по меньшей мере 50%, как, например, на 60%, 70%, 80%, 90% или даже до 100%. Введение указанного полипептида предпочтительно приводит к снижению риска и/или предупреждению ишемического повреждения, повреждения органов, рефрактерности и/или образования микротромбов в 1,2, 1,3, 1,4, 1,5, 1,6, 1,75, 1,8, 2 или больше раз, как, например, в 3, 4, 5, 6, 7, 8, 9 или даже 10 или даже больше раз, как, например, в 20, 50 или даже 100 раз.
Соответственно, настоящее изобретение относится к полипептиду для снижения риска и/или предупреждения ишемического повреждения, повреждения органов, рефрактерности и/или образования микротромбов, описываемых в данном документе, где указанная стадия введения указанного полипептида повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7 дней или даже дольше, как, например, 1 недели, 2 недель, 3 недель или даже дольше, как, например, 1 месяца или даже 2 месяцев.
Соответственно, настоящее изобретение относится к полипептиду для снижения риска и/или предупреждения ишемического повреждения, повреждения органов, рефрактерности и/или образования микротромбов, описываемых в данном документе, дополнительно включающего измерение активности ADAMTS13 у указанного пациента, предпочтительно один раз в неделю.
Соответственно, настоящее изобретение относится к полипептиду для снижения риска и/или предупреждения ишемического повреждения, повреждения органов, рефрактерности и/или образования микротромбов, описываемых в данном документе, где указанная стадия (i) введения указанного полипептида повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7 дней или даже дольше, как, например, 1 недели, 2 недель, 3 недель или даже дольше, как, например, 1 месяца или даже 2 месяцев, в случае, если активность ADAMTS13 [в первый раз] составляет >5%, как, например, >10% или даже >15%, от эталонной активности ADAMTS13.
Соответственно, настоящее изобретение относится к полипептиду по настоящему изобретению для лечения симптома заболевания, связанного с vWF, такого как TTP, описываемая в данном документе, у человека, страдающего указанным заболеванием, включающего введение субъекту полипептида по настоящему изобретению в количестве, эффективном для лечения симптома заболевания, связанного с vWF, у человека, страдающего указанным заболеванием.
Соответственно, настоящее изобретение относится к полипептиду по настоящему изобретению для ингибирования у человека начала проявления или прогрессирования заболевания, связанного с vWF, такого как TTP, описываемая в данном документе, ингибирование которого осуществляется путем связывания полипептида, содержащего по меньшей мере один ISVD, направленный против vWF, с vWF, включающего введение человеку с предварительно определенным интервалом эффективных ингибирующих доз указанного полипептида, где при каждом введении антитела человеку доставляется от 0,1 мг на кг до 25 мг на кг массы тела человека, предпочтительно 10 мг или 11 мг указанного полипептида в случае, если указанный человек имеет массу тела ≥40 кг, и 5 мг в случае, если указанная масса тела составляет <40 кг, за счет чего таким образом обеспечивается ингибирование начала проявления или прогрессирования заболевания у человека.
Соответственно, настоящее изобретение относится к полипептиду для снижения вероятности появления у человека ишемического контрактурного повреждения органов вследствие заболевания, связанного с vWF, описываемого в данном документе, которое включает введение человеку в предварительно определенной дозе полипептида, содержащего по меньшей мере один одиночный вариабельный домен иммуноглобулина (ISVD), направленный против фактора фон Виллебранда (vWF), где при каждом введении антитела человеку доставляется от 0,1 мг на кг до 25 мг на кг массы тела человека, предпочтительно 10 мг или 11 мг указанного полипептида в случае, если указанный человек имеет массу тела ≥40 кг, и 5 мг в случае, если указанная масса тела составляет <40 кг, за счет чего таким образом обеспечивается снижение вероятности появления у человека ишемического контрактурного повреждения органов.
Моделирование на основании этих результатов указывает на то, что продолжение введения полипептидов по настоящему изобретению в течение продолжительных периодов времени будет эффективным для предупреждения острых эпизодов. Этот преимущественный профиль приводит к уменьшению опасности для здоровья. Следовательно, можно сделать вывод, что полипептид по настоящему изобретению обеспечивает предупреждение рецидивов.
Соответственно, настоящее изобретение относится к введению полипептида по настоящему изобретению один раз в 1, 2, 3, 4, 5, 6, 7 дней или даже 2, 4, 6 или 8 недель в дозах в диапазоне от 1 до 80 мг, как, например, от 5 до 40 мг, предпочтительно при предупреждении острых эпизодов TTP. Особенно эффективные дозы составляют 10-20 мг. В конкретных вариантах осуществления доза содержит приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50, 60, 70 или 80 мг, предпочтительно 10 мг или 11 мг, полипептида, содержащего по меньшей мере один ISVD, направленный против vWF, такого как ALX 0081 или ALX 0081-A. Особенно эффективные дозы для людей с массой тела <40 кг, как, например, для детей и подростков, составляют 2-10 мг. В конкретных вариантах осуществления доза содержит приблизительно 2, 3, 4, 5, 6, 7, 8, 9 или 10 мг, предпочтительно 5 мг полипептида, содержащего по меньшей мере один ISVD, направленный против vWF, такого как ALX 0081 или ALX 0081-A.
В одном варианте осуществления настоящее изобретение относится к способу предупреждения рецидива у пациента с TTP, включающему
(1) необязательно измерение активности ADAMTS13 у пациента с TTP с помощью анализа, такого как прямой или косвенный анализ;
(2) необязательно сравнение активности ADAMTS13 у пациента с TTP с эталонным значением (нормальным значением); и
(3) в случае, если активность ADAMTS13 у пациента с TTP составляет менее чем 15%, как, например, менее чем 10% и менее чем 5%, от эталонного значения, введение полипептида по настоящему изобретению, например, ALX 0081 или ALX 0081-A;
за счет чего обеспечивается предупреждение рецидива.
Предварительные результаты позволяют предположить, что введение первой дозы полипептида по настоящему изобретению перед первым РЕ уже приводит к повышению числа тромбоцитов.
Соответственно, настоящее изобретение относится к введению полипептида по настоящему изобретению пациенту, нуждающемуся в этом, такому как, например, пациент, испытывающий острый эпизод TTP, такой как первоначальный и/или рецидивирующий (рецидивирующие) эпизод (эпизоды) TTP, в дозе, составляющей приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50, 60, 70 или 80 мг, предпочтительно 10 мг или 11 мг, полипептида, содержащего по меньшей мере один ISVD, направленный против vWF, такого как ALX 0081 или ALX 0081-A.
Полипептиды по настоящему изобретению, содержащие по меньшей мере один ISVD, направленный против vWF, например, ALX 0081 или ALX 0081-A, можно вводить субъекту (например, субъекту-человеку) по отдельности или в комбинации со вторым средством, например, вторым терапевтически или фармакологически активным средством, для лечения или предупреждения заболевания, связанного с vWF, например, TTP (например, ослабления или уменьшения интенсивности проявлений одного или нескольких симптомов, ассоциированных с ним).
Неограничивающие примеры средств, которые можно применять в качестве второго терапевтически или фармакологически активного средства или составлять совместно с полипептидами по настоящему изобретению, содержащими по меньшей мере один ISVD, направленный против vWF, например, ALX 0081 или ALX 0081-A, включают в себя, например, средства дополнительного иммунодепрессивного лечения (например, кортикостероиды, такие как (метил)преднизолон или (метил)преднизон; или ритуксимаб), антитромбоцитарные средства (например, аспирин), средства поддерживающей терапии с трансфузией эритроцитов или добавлением фолата, средства лечения, представляющие собой винкристин или циклоспорин, антитела к аутоантителам к ADAMTS13 или ADAMTS13. В таких видах комбинированной терапии можно преимущественно использовать более низкие дозировки вводимых терапевтических средств, избегая таким образом возможных эффектов токсичности или осложнений, ассоциированных с различными видами монотерапии.
В одном варианте осуществления настоящее изобретение относится к комбинированной терапии с применением полипептида по настоящему изобретению вместе с иммунодепрессивным средством лечения, в частности, ритуксимабом, которая обеспечивает эффективное предупреждение рецидивов у пациентов с TTP. Комбинированную терапию предпочтительно проводят до тех пор, пока активность ADAMTS13 не будет составлять по меньшей мере >5%, как, например, >10%, >15%, >20%, 25%, 30%, 35%, 40%, 45%, или даже нормализуется до такого уровня, как >50%, от нормальной активности.
ТТР остается диагнозом, устанавливаемым на основании клинического анамнеза, обследования пациента и анализа пленки крови. Анализ ADAMTS13 позволяет подтвердить диагноз и контролировать течение заболевания и возможную потребность в дополнительных видах лечения. Острые эпизоды ТТР можно диагностировать в соответствии с таблицей 1 и руководствами, например, из Scully et al. (2012, 2017, выше).
Таблица 1. Клинические признаки и симптомы острого эпизода TTP (первоначального или рецидивирующего)
Эффективность любого конкретного полипептида по настоящему изобретению или режима введения доз можно определить посредством способов, доступных для специалистов в данной области. Вкратце, в ходе клинического испытания пациентов может наблюдать медицинский персонал, и состояние заболевания оценивается посредством любой комбинации критериев. Улучшение состояния заболевания пациента определяют на основании этих критериев во множестве моментов времени, и комбинацию этих определений в популяции пациентов наносят на график для оценки эффективности лечения.
В иллюстративных вариантах осуществления оценку эффективности можно определить согласно любому или всем из критериев, приведенных ниже.
• Время до ответа на лечение, определяемое по восстановлению числа тромбоцитов до ≥150000/мкл. Этот ответ должен быть подтвержден спустя 48 часов после первоначального сообщения о восстановлении числа тромбоцитов до уровня выше 150000/мкл путем измерения числа тромбоцитов de novo с результатом ≥150000/мкл и предпочтительно при LDH ≤ 2 X ULN.
• Количество субъектов с полной ремиссией.
• Количество обострений (субъектов с обострениями) ТТР и время до первого обострения ТТР. Обострение определяется как рецидивирующая тромбоцитопения после ответа, требующая возобновления ежедневных лечебных процедур РЕ через ≥1 день, но ≤30 дней после последнего ежедневного РЕ.
• Количество субъектов с рецидивом ТТР (определенным как событие ТТР de novo, которое происходит позже чем через 30 дней после последнего ежедневного РЕ) в течение максимум 1 года и время до первого рецидива ТТР.
• Данные ежедневного РЕ, в том числе серьезные нежелательные явления (SAE), связанные с ежедневными лечебными процедурами РЕ.
• Нейрокогнитивная функция, измеряемая с помощью набора нейрокогнитивных тестов, при полной ремиссии и в течение 1 года последующего наблюдения. Этому тесту предшествует анализ по шкале комы Глазго для определения состояния сознания субъекта.
• Облегчение дисфункции органов и облегчение признаков и симптомов, связанных с ТТР
• Общая смертность в рамках периода ежедневных лечебных процедур РЕ и в рамках последующего периода лечения исследуемым лекарственным средством (включая постепенное снижение дозы).
• Определение уровней биомаркеров ТТР, в том числе без ограничения уровней дезинтегриноподобной металлопротеазы с тромбоспондиновыми повторами 13 (ADAMTS13) и титров антител к ADAMTS13.
Специалист в данной области знаком с определением показателей эффективности.
Например, активность ADAMTS13 можно оценивать с помощью электрофореза мультимеров vWF для выявления сверхкрупных мультимеров, не расщепляемых протеазой (Moake et al. (1982) The New England journal of medicine 307, 1432-1435; Furlan, et al. (1997) Blood 89, 3097-3103 7, 8). Активность ADAMTS13 можно тестировать с использованием FRETS-vWF73, фрагмента vWF, химически модифицированного для испускания флуоресценции при расщеплении под действием ADAMTS13. В этом анализе FRETS-vWF73 добавляют к образцу плазмы крови пациента, и измеряют изменение флуоресценции с течением времени для определения активности ADAMTS13. Если присутствует ингибитор, он часто представляет собой нейтрализующее антитело IgG, направленное против ADAMTS13, которое можно измерить посредством ELISA (Kokame et al. (2005) British journal of haematology 129, 93-100). В качестве альтернативы или дополнения, активность ADAMTS13 можно определить, как описано, например, в Vesely et al. (2003, выше), Fontana et al. (2004, выше) или Remuzzi et al. (Blood 2002; 100: 778-7852002). Например, косвенные анализы активности ADAMTS13 предусматривают выявление продуктов расщепления полноразмерной молекулы vWF либо фрагмента vWF, который охватывает участок расщепления для ADAMTS13 в домене А2 vWF. (1) Анализы связывания коллагена. Нормальную плазму крови или очищенный vWF инкубируют с тестируемым образцом плазмы крови в присутствии BaCl2 и 1,5 М мочевины, которая денатурирует vWF. VWF расщепляют с помощью ADAMTS13, и остаточный vWF измеряют по его связыванию с коллагеном III типа. Связанный vWF определяют количественно с помощью анализа методом ELISA с конъюгированным антителом к vWF. (2) Агрегация, индуцированная ристоцетином. Этот тест аналогичен анализу связывания коллагена, описанному выше, но остаточный vWF измеряют по агрегации тромбоцитов, индуцированной ристоцетином, с помощью тромбоцитарного агрегометра. (3) Функциональные анализы методом ELISA. В этом анализе рекомбинантный фрагмент vWF иммобилизуют на планшете для ELISA с помощью антитела к метке в vWF. Фрагмент vWF кодирует домен А2 и участок расщепления для ADAMTS13 в Tyr1605-Met1606 и является меченным глутатион-S-трансферазой [GST] и гистидином [GST-VWF73-His]. К иммобилизованному фрагменту GST-VWF73-His добавляют плазму крови, и в участке расщепления для ADAMTS13 происходит расщепление иммобилизованного фрагмента. Остаточный расщепленный фрагмент vWF измеряют с применением второго моноклонального антитела, которое распознает только расщепленный фрагмент vWF, но не интактный фрагмент. Таким образом, активность ADAMTS13 обратно пропорциональна остаточной концентрации субстрата. Этот способ лежит в основе анализа активности ADAMTS13 методом ELISA TECHNOZYM®.
Специалист в данной области знаком с определением аутоантител к ADAMTS13, например, аутоантитела к ADAMTS13 можно определять посредством ELISA, такого как ELISA TECHNOZYM® ADAMTS13 INH (Technoclone).
Специалист в данной области знаком с определением активности ристоцетинового кофактора в образцах от человека, например, ристоцетиновый кофактор можно определить посредством vW Select® от Bio/Data Corp. на анализаторе-агрегометре PAP-8E (Bio/Data Corp.).
Специалист в данной области знаком с определением фактора VIII в образцах от человека, например, с помощью Coamatic Factor VIII (Chromogenix) на анализаторе STA-R Evolution (Diagnostica Stago).
Специалист в данной области знаком с определением антигена фактора фон Виллебранда в образцах от человека, например, с помощью иммунотурбидиметрического анализа (например, с помощью STA-Liatest vWF:Ag) на анализаторе STA-R Evolution (Diagnostica Stago).
Специалист в данной области знаком с определением уровней LDH. В основе большинства способов лежит ферментативный анализ с использованием лактатдегидрогеназы на спектрофотометре. Подходящий обзор приведен в Medbø et al. (2000) "Examination of four different instruments for measuring blood lactate concentration". Scand J Clin Lab Invest 60:367-380. Различные компании предоставляют наборы для анализов, такие как Abnova (номер по каталогу KA1653), с помощью которого измеряется взаимное превращение лактата и пирувата, катализируемое LDH, т.е. проводится нерадиоактивный колориметрический анализ LDH на основе восстановления соли тетразолия МТТ в NADH-сопряженной ферментативной реакции до восстановленной формы МТТ, которая демонстрирует максимум поглощения при 565 нм. Интенсивность образующегося пурпурного окрашивания прямо пропорциональна ферментативной активности. Аналогичным образом, в наборе Sigma Aldrich (MAK066-1KT) LDH восстанавливает NAD до NADH, который специфично выявляется посредством колориметрического (450 нм) анализа. Нормальные уровни приведены в таблице 1.1 ниже.
Специалист в данной области знаком с определением тропонина I и Т. Как правило, уровни тропонина Т и I измеряют с помощью способов иммунологического анализа, которые доступны в виде множества различных платформ для иммунологического анализа, например, DPC Immulite, Abbott AxSYM, Bayer ACS:Centaur, Ortho Vitros, Roche Elecsys третьего поколения. Подходящий обзор приведен в Wu et al. (1999) National Academy of Clinical Biochemistry Standards of Laboratory Practice: recommendations for the use of cardiac markers in coronary artery diseases. Clin Chem. Jul 1999;45(7):1104-21. Нормальные уровни приведены в таблице 1.1 ниже.
Специалист в данной области знаком с определением креатинина. Подходящий обзор приведен в Peake and Whiting "Measurement of Serum Creatinine - Current Status and Future Goals" Clin Biochem Rev. 2006 Nov; 27(4): 173-184. Например, уровни креатинина можно определить с помощью набора для анализа креатинина Abcam (ab65340) или набора для анализа креатинина BioVision. В этом анализе креатинин превращается в креатин под действием креатининазы, креатин превращается в саркозин, который специфично окисляется с получением продукта, реагирующего с зондом с образованием красного окрашивания (λmax=570 нм) и флуоресценции (Ex/Em=538/587 нм). Нормальные уровни приведены в таблице 1.1 ниже. Поскольку количество креатинина в крови увеличивается с мышечной массой, мужчины обычно характеризуются более высокими уровнями креатинина, чем женщины.
Таблица 1.1. Нормальные значения
Следует понимать, что нормальные уровни, приведенные в таблице 1.1, могут варьироваться в разных лабораториях, у мужчин и женщин и в зависимости от возраста. Тем не менее, специалист в данной области примет во внимание, что в зависимости от применяемого анализа нормальные уровни, приводимые производителем, можно в обычном случае использовать в качестве эталона, или, в качестве альтернативы, нормальных уровней, оцениваемых врачом в конкретной ситуации.
Полипептиды по настоящему изобретению, как правило, содержат по меньшей мере один ISVD, направленный против vWF. ISVD по настоящему изобретению связываются с vWF и/или обладают аффинностью к нему ("направлены против vWF"). В контексте настоящего изобретения "vWF" включает в себя без ограничения vWF яванского макака, павиана, свиньи, морской свинки, мыши и/или человека и наиболее предпочтительно vWF человека, т. е. SEQ ID NO: 20 или запись в GenBank NP_000543.
ISVD, направленный против vWF, предпочтительно по существу состоит из 4 каркасных областей (от FR1 до FR4 соответственно) и 3 областей, определяющих комплементарность (от CDR1 до CDR3 соответственно), при этом:
a) CDR1 содержит:
- аминокислотную последовательность YNPMG или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью YNPMG; или по существу состоит из них,
и
b) CDR2 содержит:
- аминокислотную последовательность AISRTGGSTYYPDSVEG; или
- аминокислотную последовательность, которая характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичностью последовательности по отношению к аминокислотной последовательности AISRTGGSTYYPDSVEG; или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью AISRTGGSTYYPDSVEG; или по существу состоит из них,
и
c) CDR3 содержит:
- аминокислотную последовательность AGVRAEDGRVRTLPSEYTF; или
- аминокислотную последовательность, которая характеризуется по меньшей мере 80%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 99% идентичностью последовательности по отношению к аминокислотной последовательности AGVRAEDGRVRTLPSEYTF; или
- аминокислотную последовательность, которая имеет 2 аминокислотных отличия или только 1 аминокислотное отличие по сравнению с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF; или по существу состоит из них.
ISVD, направленный против vWF, еще более предпочтительно по существу состоит из 4 каркасных областей (от FR1 до FR4 соответственно) и 3 областей, определяющих комплементарность (от CDR1 до CDR3 соответственно), при этом:
a) CDR1 представляет собой YNPMG (SEQ ID NO: 21);
b) CDR2 представляет собой AISRTGGSTYYPDSVEG (SEQ ID NO: 22); и
c) CDR3 представляет собой AGVRAEDGRVRTLPSEYTF (SEQ ID NO: 23).
ISVD, направленный против vWF, еще более предпочтительно представлен под SEQ ID NO: 19 (12A02H1).
Полипептиды по настоящему изобретению предпочтительно содержат по меньшей мере два ISVD, направленных против vWF, или состоят из них.
Полипептиды по настоящему изобретению еще более предпочтительно содержат два ISVD, направленных против vWF, определяемых SEQ ID NO: 1-18 или 24, и наиболее предпочтительно SEQ ID NO: 1 (ALX 0081; INN "каплацизумаб") или SEQ ID NO: 24, или состоят из них. ALX 0081 является двухвалентным нанотелом, состоящим из двух идентичных одновалентных структурных элементов, нацеливающихся на vWF. ALX 0081-A представляет собой ALX 0081 с добавленным C-концевым аланином.
Полипептиды, содержащие по меньшей мере один ISVD, направленный против vWF, например, SEQ ID NO: 1-19 или 24, могут применяться в лечении заболевания, связанного с vWF, в частности, тромботической тромбоцитопенической пурпуры (TTP).
Термины "полипептид" и "аминокислотная последовательность" применяются в данном документе взаимозаменяемо.
Так, например, подходящие полипептиды для применения в настоящем изобретении могут включать в себя соединения из таблицы А-1, например, SEQ ID NO: 1-19 или 24, или соединение, характеризующееся 80% или большей, более предпочтительно 85% или большей, наиболее предпочтительно 90%, 95%, 96%, 97%, 98%, 99% или большей идентичностью аминокислотных последовательностей по отношению к соединению, определяемому любым из SEQ ID NO: 1-19 или 24 в таблице A-1 (см. в разделе "Определения" в отношении "идентичности последовательностей").
ISVD, направленные против vWF, для применения в полипептидах по настоящему изобретению предпочтительно представляют собой 12A02H1-подобные соединения. Для целей настоящего описания 12А02Н1-подобное соединение представляет собой соединение, содержащее 12А02Н1 (т. е. SEQ ID NO: 19), или соединение, характеризующееся 80% или большей, более предпочтительно 85% или большей, наиболее предпочтительно 90%, 95%, 96%, 97%, 98%, 99% или большей идентичностью аминокислотных последовательностей по отношению к 12A02H1 (SEQ ID NO: 19). Особо предпочтительным полипептидом, содержащим два ISVD, направленных против vWF, является ALX 0081 (SEQ ID NO: 1) или ALX 0081-A (SEQ ID NO: 24).
Одиночные вариабельные домены иммуноглобулинов, такие как домены VHH верблюдовых, камелизированные домены VH или гуманизированные домены VHH, представляют собой быстро развивающийся класс терапевтических средств. Например, одиночные вариабельные домены иммуноглобулинов, направленные против vWF, были описаны в WO 2004/015425, WO 2004/062551, WO 2006/074947, WO 2006/122825, WO 2009/115614 и WO 2011/067160. Дополнительные предпочтительные одиночные вариабельные домены иммуноглобулинов для применения в полипептидах по настоящему изобретению включают в себя улучшенные нанотела, описанные в WO 06/122825.
Если не указано иное, термин "последовательность иммуноглобулина", независимо от того, используется ли он в данном документе в отношении антитела, состоящего только из тяжелых цепей, или традиционного 4-цепочечного антитела, используется в качестве общего термина для включения как полноразмерного антитела, его отдельных цепей, так и всех его частей, доменов или фрагментов (в том числе без ограничения антигенсвязывающих доменов или фрагментов, таких как домены VHH или домены VH/VL соответственно). Кроме того, используемый в данном документе термин "последовательность" (например, в таких терминах, как "последовательность иммуноглобулина", "последовательность антитела", "последовательность вариабельного домена", "последовательность VHH" или "последовательность белка") следует в целом понимать как включающий как соответствующую аминокислотную последовательность, так и нуклеиновые кислоты или нуклеотидные последовательности, кодирующие ее, если по контексту не требуется более ограниченная интерпретация.
Термин "одиночный вариабельный домен иммуноглобулина" ("ISVD"), используемый взаимозаменяемо с термином "одиночный вариабельный домен", означает молекулы, в которых антигенсвязывающий участок присутствует в одиночном домене иммуноглобулина и образован им. Это отличает одиночные вариабельные домены иммуноглобулинов от "традиционных" иммуноглобулинов или их фрагментов, где два домена иммуноглобулина, в частности, два вариабельных домена, взаимодействуют с образованием антигенсвязывающего участка. Как правило, в традиционных иммуноглобулинах вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) взаимодействуют с образованием антигенсвязывающего участка. В этом случае области, определяющие комплементарность (CDR), как VH, так и VL вносят вклад в образование антигенсвязывающего участка, т.е. в общей сложности 6 CDR участвуют в образовании антигенсвязывающего участка.
В отличие от этого, связывающий участок в одиночном вариабельном домене иммуноглобулина образуется одиночным доменом VH или VL. Следовательно, антигенсвязывающий участок одиночного вариабельного домена иммуноглобулина образован не более чем тремя CDR.
Следовательно, термин "одиночный вариабельный домен иммуноглобулина" не включает традиционные иммуноглобулины или их фрагменты, в которых требуется взаимодействие по меньшей мере двух вариабельных доменов для образования антигенсвязывающего участка. Это также справедливо для вариантов осуществления настоящего изобретения, которые "включают в себя" или "содержат" одиночный вариабельный домен иммуноглобулина. В контексте настоящего изобретения такие варианты осуществления исключают традиционные иммуноглобулины или их фрагменты. Таким образом, полипептид или композиция, "включающие в себя" или "содержащие" одиночный вариабельный домен иммуноглобулина, могут относиться, например, к конструкциям, содержащим более одного одиночного вариабельного домена иммуноглобулина. В качестве альтернативы, могут присутствовать дополнительные компоненты, отличные от одиночных вариабельных доменов иммуноглобулинов, например, вспомогательные средства различных видов, белковые метки, пигменты, красители и т.д. Однако эти термины включают фрагменты традиционных иммуноглобулинов, в которых антигенсвязывающий участок образован одиночным вариабельным доменом.
Как правило, одиночные вариабельные домены представляют собой аминокислотные последовательности, которые по существу состоят из 4 каркасных областей (от FR1 до FR4 соответственно) и 3 областей, определяющих комплементарность (от CDR1 до CDR3 соответственно). Такие одиночные вариабельные домены и фрагменты являются наиболее предпочтительными, поскольку они имеют укладку, характерную для иммуноглобулинов, или способны к образованию укладки, характерной для иммуноглобулинов, при подходящих условиях. Таким образом, одиночный вариабельный домен может, например, содержать последовательность вариабельного домена легкой цепи (например, последовательность VL) или ее подходящий фрагмент или последовательность вариабельного домена тяжелой цепи (например, последовательность VH или последовательность VHH) или ее подходящий фрагмент; при условии, что она способна к образованию одиночной антигенсвязывающей единицы (т.е. функциональной антигенсвязывающей единицы, которая по существу состоит из одиночного вариабельного домена, так что одиночный антигенсвязывающий домен не обязательно должен взаимодействовать с другим вариабельным доменом для образования функциональной антигенсвязывающей единицы, как, например, в случае с вариабельными доменами, присутствующими, например, в традиционных антителах и scFv-фрагментах (одноцепочечных вариабельных фрагментах), которые должны взаимодействовать с другим вариабельным доменом, например, посредством взаимодействия VH/VL, для образования функционального антигенсвязывающего домена).
В одном варианте осуществления настоящего изобретения одиночные вариабельные домены иммуноглобулинов представляют собой последовательности вариабельных доменов легкой цепи (например, последовательность VL) или последовательности вариабельных доменов тяжелой цепи (например, последовательность VH); более конкретно, одиночные вариабельные домены иммуноглобулинов могут представлять собой последовательности вариабельных доменов тяжелой цепи, полученные из традиционного четырехцепочечного антитела, или последовательности вариабельных доменов тяжелой цепи, полученные из антитела, состоящего только из тяжелых цепей (например, VHH).
Для общего описания антител, состоящих только из тяжелых цепей, и их вариабельных доменов делается ссылка на, среди прочего, предшествующий уровень техники, цитируемый в данном документе, а также на предшествующий уровень техники, упомянутый на странице 59 WO 08/020079, и на перечень ссылочных материалов, упомянутый на страницах 41-43 международной заявки WO 06/040153, при этом предшествующий уровень техники и ссылочные материалы включены в данный документ посредством ссылки. Как описано в этих ссылочных материалах, нанотела (в частности, последовательности VHH и частично гуманизированные нанотела) могут быть, в частности, охарактеризованы по наличию одного или нескольких "характерных остатков" в одной или нескольких последовательностях каркасной области. Дополнительное описание нанотел, включающее гуманизацию и/или камелизацию нанотел, а также другие модификации, части или фрагменты, производные или "продукты слияния нанотел", поливалентные конструкции (содержащие некоторые неограничивающие примеры линкерных последовательностей) и различные модификации для увеличения периода полувыведения нанотел и препаратов на их основе можно найти, например, в WO 08/101985 и WO 08/142164.
Например, одиночный вариабельный домен или одиночный вариабельный домен иммуноглобулина (или аминокислотная последовательность, подходящая для применения в качестве одиночного вариабельного домена иммуноглобулина) может представлять собой (одно)доменное антитело (или аминокислотную последовательность, подходящую для применения в качестве (одно)доменного антитела), "dAb", или dAb (или аминокислотную последовательность, подходящую для применения в качестве dAb), или нанотело (определенное в данном документе и включающее в себя без ограничения последовательность VHH), другие одиночные вариабельные домены или любой подходящий фрагмент любого из них. Для общего описания (одно)доменных антител также делается ссылка на предшествующий уровень техники, цитируемый в данном документе, а также на ЕР 0368684. Для термина "dAb" делается ссылка, например, на Ward et al. 1989 (Nature 341 (6242): 544-6), на Holt et al. 2003 (Trends Biotechnol. 21(11): 484-490); а также, например, на WO 04/068820, WO 06/030220, WO 06/003388 и другие опубликованные заявки на патент от имени Domantis Ltd. Также следует отметить, что одиночные вариабельные домены могут быть получены из некоторых видов акул (например, так называемые "домены IgNAR", см., например, WO 05/18629), хотя это менее предпочтительно в контексте настоящего изобретения вследствие того, что они происходят не из млекопитающих.
В частности, одиночный вариабельный домен иммуноглобулина может представлять собой Nanobody® (определенное в данном документе) или его подходящий фрагмент. [Примечание: Nanobody®, Nanobodies® и Nanoclone® являются зарегистрированными товарными знаками Ablynx N.V.] Для общего описания нанотел делается ссылка на дальнейшее описание ниже, а также на предшествующий уровень техники, цитируемый в данном документе, как, например, описанный в WO 08/020079 (стр. 16).
Аминокислотную последовательность и структуру последовательности иммуноглобулина, в частности, одиночного вариабельного домена иммуноглобулина, можно рассматривать, однако, не ограничиваясь этим, как состоящую из четырех каркасных областей или "FR", которые называются в уровне техники и в данном документе "каркасной областью 1" или "FR1"; "каркасной областью 2" или "FR2"; "каркасной областью 3" или "FR3" и "каркасной областью 4" или "FR4" соответственно; при этом каркасные области перемежаются областями, определяющими комплементарность, или "CDR", которые называются в уровне техники "областью 1, определяющей комплементарность" или "CDR1"; "областью 2, определяющей комплементарность" или "CDR2" и "областью 3, определяющей комплементарность" или "CDR3" соответственно.
Общее число аминокислотных остатков в одиночном вариабельном домене иммуноглобулина может находиться в диапазоне 110-120, предпочтительно 112-115 и наиболее предпочтительно составляет 113. Однако следует отметить, что части, фрагменты, аналоги или производные одиночного вариабельного домена иммуноглобулина конкретно не ограничены их длиной и/или размером, при условии, что такие части, фрагменты, аналоги или производные отвечают дополнительным требованиям, изложенным в данном документе, и также предпочтительно являются подходящими для целей, описанных в данном документе.
Таким образом, в понимании настоящего изобретения термин "одиночный вариабельный домен иммуноглобулина" или "одиночный вариабельный домен" включает пептиды, которые получены из источника, отличного от человека, предпочтительно из животного семейства верблюдовых, предпочтительно из антитела верблюда, состоящего только из тяжелых цепей. Они могут быть гуманизированы, как описано ранее, например, в WO 08/101985 и WO 08/142164. Кроме того, термин включает полипептиды, полученные из источников, отличных от верблюдовых, например, из мыши или человека, которые были "камелизированы", как описано ранее, например, в WO 08/101985 и WO 08/142164.
Термин "одиночный вариабельный домен иммуноглобулина" охватывает последовательности иммуноглобулинов различного происхождения, в том числе последовательности иммуноглобулинов мыши, крысы, кролика, осла, человека и верблюдовых. Он также включает полностью человеческие, гуманизированные или химерные последовательности иммуноглобулинов. Например, он включает в себя последовательности иммуноглобулинов верблюдовых и гуманизированные последовательности иммуноглобулинов верблюдовых или камелизированные одиночные вариабельные домены иммуноглобулинов, например, камелизированное dAb, которые описаны у Ward et al. (см., например, WO 94/04678 и Davies and Riechmann 1994, Febs Lett. 339: 285 и 1996, Protein Engineering 9: 531).
Все ISVD, направленные против vWF (или средства, связывающие vWF), упомянутые выше, хорошо известны из литературы. Она включает информацию об их изготовлении (см., в частности, например, WO 2006/122825, а также WO 2004/062551). Например, ALX 0081 или ALX 0081-A получают, как описано, например, в WO 2006/122825 или WO 2009/115614.
Одиночные вариабельные домены иммуноглобулинов, предусмотренные в настоящем изобретении, предпочтительно представлены в выделенной форме или в по существу выделенной форме или образуют часть белка или полипептида по настоящему изобретению, который может содержать один или несколько одиночных вариабельных доменов иммуноглобулинов или по существу состоять из них и который может необязательно дополнительно содержать одну или несколько дополнительных аминокислотных последовательностей (все из которых необязательно связаны посредством одного или нескольких подходящих линкеров). Например, без ограничения, один или несколько одиночных вариабельных доменов иммуноглобулинов могут применяться в качестве связывающей единицы в таком белке или полипептиде, который может необязательно содержать одну или несколько дополнительных аминокислотных последовательностей, которые могут служить в качестве связывающей единицы (т. е. направленной против одной или нескольких мишеней, отличных от клеточноассоциированных антигенов), так чтобы получить соответственно одновалентный, поливалентный или полиспецифический полипептид по настоящему изобретению, во всех случаях согласно описанному в данном документе. Такой белок или полипептид может также быть представлен в выделенной или по существу выделенной форме. Таким образом, согласно настоящему изобретению одиночные вариабельные домены иммуноглобулинов включают в себя конструкции, содержащие две или более антигенсвязывающие единицы в форме одиночных доменов, как изложено выше. Например, два (или более) одиночных вариабельных домена иммуноглобулина с одной или той же или разной антигенной специфичностью могут быть связаны с образованием, например, двухвалентной, трехвалентной или поливалентной конструкции. Путем объединения одиночных вариабельных доменов иммуноглобулинов с двумя или более видами специфичности можно образовывать биспецифические, триспецифические и т.д. конструкции. Например, полипептид согласно настоящему изобретению может содержать два одиночных вариабельных домена иммуноглобулина, направленных против мишени А, и один одиночный вариабельный домен иммуноглобулина, направленный против мишени В, что делает его двухвалентным в отношении А и одновалентным в отношении В. Все такие конструкции и их модификации, которые специалист в данной области может без труда предусмотреть, охватываются настоящим изобретением. В конкретных вариантах осуществления настоящее изобретение относится к бипаратопным конструкциям, содержащим по меньшей мере два одиночных вариабельных домена иммуноглобулина, направленных на разные эпитопы в одном и том же антигене-мишени.
Все эти молекулы также называются "полипептидом по настоящему изобретению", что является синонимом "последовательностей иммуноглобулинов" или "одиночных вариабельных доменов иммуноглобулинов" по настоящему изобретению.
Кроме того, используемый в данном документе термин "последовательность" (например, в таких терминах, как "последовательность иммуноглобулина", "последовательность антитела", "последовательность вариабельного домена", "последовательность VHH" или "последовательность белка") следует в целом понимать как включающий как соответствующую аминокислотную последовательность, так и последовательности нуклеиновых кислот или нуклеотидные последовательности, кодирующие ее, если по контексту не требуется более ограниченная интерпретация.
В соответствии с одним неограничивающим вариантом осуществления настоящего изобретения последовательности иммуноглобулинов, Nanobody® или полипептид по настоящему изобретению являются гликозилированными. В соответствии с другим неограничивающим вариантом осуществления настоящего изобретения последовательности иммуноглобулинов, Nanobody® или полипептид по настоящему изобретению являются негликозилированными.
Как упомянуто выше, настоящее изобретение относится к полипептидам, как правило, содержащим по меньшей мере один, как, например, 2 или больше, из ISVD, направленных против vWF, т.е. ISVD, связывающих антиген, определенный в данном документе, например, фактор фон Виллебранда (vWF) и предпочтительно человеческий vWF (SEQ ID NO: 20), и/или обладающих аффинностью к нему.
В контексте настоящего изобретения выражение "связывающийся с и/или обладающий аффинностью к" в отношении определенного антигена имеет значение, обычное в данной области техники, например, понятное применительно к антителам и их соответствующим антигенам.
В конкретных вариантах осуществления настоящего изобретения термин "связывающийся с и/или обладающий аффинностью к" означает, что последовательность иммуноглобулина специфично взаимодействует с антигеном, и используется взаимозаменяемо с последовательностями иммуноглобулинов, "направленными против" указанного антигена.
Термин "специфичность" относится к ряду различных типов антигенов или антигенных детерминант, с которыми может связываться конкретная последовательность иммуноглобулина, антигенсвязывающая молекула или антигенсвязывающий белок (такой как Nanobody® или полипептид по настоящему изобретению). Специфичность антигенсвязывающего белка можно определить на основе аффинности и/или авидности. Аффинность, представленная константой равновесия для диссоциации антигена и антигенсвязывающего белка (KD), является мерой силы связывания между антигенной детерминантой и антигенсвязывающим участком в антигенсвязывающем белке: чем меньше значение KD, тем больше сила связывания между антигенной детерминантой и антигенсвязывающей молекулой (в качестве альтернативы, аффинность может также быть выражена в виде константы аффинности (KA), которая равна 1/KD). Как будет ясно специалисту в данной области (например, исходя из дальнейшего раскрытия в данном документе), аффинность можно определить широко известным способом в зависимости от конкретного антигена, представляющего интерес. Авидность является мерой силы связывания между антигенсвязывающей молекулой (такой как Nanobody® или полипептид по настоящему изобретению) и соответствующим антигеном. Авидность относится как к аффинности между антигенной детерминантой и антигенсвязывающим участком для нее в антигенсвязывающей молекуле, так и к числу соответствующих связывающих участков, присутствующих в антигенсвязывающей молекуле.
Как правило, последовательности иммуноглобулинов по настоящему изобретению (такие как аминокислотные последовательности, Nanobodies® и/или полипептиды по настоящему изобретению) будут связываться со своим антигеном с константой диссоциации (KD), составляющей от 10-5 до 10-12 молей/литр или меньше, предпочтительно от 10-7 до 10-12 молей/литр или меньше и более предпочтительно от 10-8 до 10-12 молей/литр (т.е. с константной ассоциации (KA), составляющей от 105 до 1012 литров/моль или больше и предпочтительно от 107 до 1012 литров/моль или больше и более предпочтительно от 108 до 1012 литров/моль), и/или будут связываться с клеточноассоциированными антигенами, определенными в данном документе, с константой скорости kon, составляющей от 102 M-1с-1 до приблизительно 107 M-1с-1, предпочтительно от 103 M-1с-1 до 107 M-1с-1, более предпочтительно от 104 M-1с-1 до 107 M-1с-1, как, например, от 105 M-1с-1 до 107 M-1с-1; и/или будут связываться с клеточноассоциированными антигенами, определенными в данном документе, с константой скорости koff, составляющей от 1 с-1 (t1/2=0,69 с) до 10-6 с-1 (с получением практически необратимого комплекса, t1/2 которого составляет несколько дней), предпочтительно от 10-2 с-1 до 10-6 с-1, более предпочтительно от 10-3 с-1 до 10-6 с-1, как, например, от 10-4 с-1 до 10-6 с-1.
Любое значение KD больше 10-4 М (или любое значение KA ниже 104 М-1), как правило, считается указывающим на неспецифичное связывание.
Одновалентная последовательность иммуноглобулина по настоящему изобретению предпочтительно будет связываться с желаемым антигеном с аффинностью, составляющей менее 500 нМ, предпочтительно менее 200 нМ, более предпочтительно менее 10 нМ, как, например, менее 500 пМ.
Специфичное связывание антигенсвязывающего белка с антигеном или антигенной детерминантой можно определить любым подходящим широко известным способом, в том числе, например, с помощью анализа Скэтчарда и/или анализов конкурентного связывания, таких как радиоиммунологические анализы (RIA), иммуноферментные анализы (ЕIA) и конкурентные сэндвич-анализы, и их различных вариантов, широко известных из уровня техники; а также других методик, упомянутых в данном документе.
Константа диссоциации (KD) может быть действительной или кажущейся константой диссоциации, как будет ясно специалисту в данной области. Способы определения константы диссоциации будут ясны специалисту в данной области и включают в себя, например, методики, упомянутые в данном документе. В связи с этим также будет ясно, что измерение констант диссоциации, составляющих более 10-4 молей/литр или 10-3 молей/литр (например, 10-2 молей/литр), может не быть возможным. Как также будет ясно специалисту в данной области, (действительную или кажущуюся) константу диссоциации необязательно можно рассчитать, исходя из (действительной или кажущейся) константы ассоциации (KA) с помощью отношения [KD=1/KA].
Аффинность означает силу или стабильность молекулярного взаимодействия. Аффинность обычно представляют в виде KD, или константы диссоциации, измеряемой в единицах моль/литр (или М). Аффинность можно также выразить в виде константы ассоциации KA, которая равна 1/KD и измеряется в единицах (моль/литр)-1 (или М-1). В настоящем описании стабильность взаимодействия между двумя молекулами (такими как аминокислотная последовательность, последовательность иммуноглобулина, Nanobody® или полипептид по настоящему изобретению и их предполагаемая мишень) можно выразить главным образом в виде значения KD для их взаимодействия; специалисту в данной области ясно, что с учетом соотношения KA=1/KD определение силы молекулярного взаимодействия по его значению KD можно также применять для расчета соответствующего значения KA. Значение KD характеризует силу молекулярного взаимодействия также в термодинамическом смысле, поскольку оно связано со свободной энергией (DG) связывания посредством хорошо известного соотношения DG=RT.ln(KD) (что эквивалентно DG = -RT.ln(KA)), где R равняется газовой постоянной, Т равняется абсолютной температуре, a ln означает натуральный логарифм.
KD для биологических взаимодействий, таких как связывание последовательностей иммуноглобулинов по настоящему изобретению с клеточноассоциированным антигеном, определенным в данном документе, которые считаются значимыми (например, специфичными), как правило, находится в диапазоне от 10-10 M (0,1 нM) до 10-5 M (10000 нM). Чем сильнее взаимодействие, тем ниже его KD.
KD можно также выразить в виде отношения константы скорости диссоциации комплекса, обозначенной как koff, к скорости его ассоциации, обозначенной как kon (так что KD=koff/kon, а KA=kon/koff). Скорость диссоциации koff измеряется в единицах с-1 (где с является обозначением единицы для секунды согласно СИ). Скорость ассоциации kon измеряется в единицах M-1с-1.
Что касается последовательностей иммуноглобулинов по настоящему изобретению, то скорость ассоциации может варьироваться от 102 M-1с-1 до приблизительно 107 M-1с-1, достигая диффузионно-ограниченной константы скорости ассоциации для бимолекулярных взаимодействий. Скорость диссоциации связана с полупериодом данного молекулярного взаимодействия посредством соотношения t1/2=ln(2)/koff. Скорость диссоциации последовательностей иммуноглобулинов по настоящему изобретению может варьироваться от 10-6с-1 (практически необратимый комплекс, t1/2 которого составляет несколько дней) до 1 с-1 (t1/2=0,69 с).
Аффинность молекулярного взаимодействия между двумя молекулами можно измерить с помощью различных широко известных методик, таких как хорошо известная биосенсорная методика поверхностного плазмонного резонанса (SPR) (см., например, Ober et al., Intern. Immunology, 13, 1551-1559, 2001), где одну молекулу иммобилизуют на биосенсорном чипе, а другую молекулу пропускают над иммобилизованной молекулой в условиях потока с получением измеренных показателей kon, koff и, следовательно, значений KD (или KA). Это, например, можно осуществлять с помощью хорошо известных приборов Biacore.
Специалисту в данной области также будет ясно, что измеренная KD может соответствовать кажущейся KD, если на процесс измерения каким-либо образом влияет собственная аффинность связывания предполагаемых молекул, например, артефактов, связанных с покрытием биосенсора одной молекулой. Кроме того, кажущуюся KD можно измерить, если одна молекула содержит более одного участка распознавания для другой молекулы. В такой ситуации на измеренную аффинность может влиять авидность взаимодействия двух молекул.
Другим подходом, который можно применять для оценки аффинности, является 2-стадийная процедура ELISA (твердофазного иммуноферментного анализа) согласно Friguet et al. (J. Immunol. Methods, 77, 305-19, 1985). Этот способ обеспечивает определение равновесного связывания в фазе раствора и позволяет избежать возможных артефактов, связанных с адсорбцией одной из молекул на подложке, такой как пластик.
Однако точное измерение KD может быть достаточно трудоемким, и вследствие этого часто определяют кажущиеся значения KD для оценки силы связывания двух молекул. Следует отметить, что, поскольку все измерения проводят согласованным образом (например, при сохранении неизменных условий анализа), измерения кажущейся KD можно использовать в качестве аппроксимации истинной KD, и, следовательно, в данном документе KD и кажущуюся KD следует трактовать с одинаковой значимостью или важностью.
Наконец, следует отметить, что во многих ситуациях опытный ученый может счесть удобным определение аффинности связывания по отношению к некоторой эталонной молекуле. Например, для оценки силы связывания между молекулами А и В можно, например, применять эталонную молекулу С, для которой известно ее связывание с В и которая подходящим образом мечена флуорофорной или хромофорной группой или другим химическим компонентом, таким как биотин, для облегчения выявления в рамках ELISA или FACS (сортировки клеток с активированной флуоресценцией) или другого формата (флуорофор для выявления флуоресценции, хромофор для выявления поглощения света, биотин для выявления с помощью ELISA, опосредованного стрептавидином). Как правило, эталонную молекулу С поддерживают при фиксированной концентрации, а концентрация А варьируется при заданных концентрации или количестве В. В результате получают значение IC50, соответствующее концентрации А, при которой сигнал, измеренный для С в отсутствие А, уменьшен наполовину. При условии, что известна KDref, представляющая собой KD эталонной молекулы, а также общая концентрация cref эталонной молекулы, можно получить кажущуюся KD для взаимодействия А-В из следующей формулы: KD=IC50/(1+cref/KDref). Следует отметить, что если cref << KDref, то KD ≈ IC50. При условии, что измерение IC50 осуществляют согласованным образом (например, при сохранении фиксированной cref) для сравниваемых связывающих средств, то силу или стабильность молекулярного взаимодействия можно оценивать по IC50, и этот измеренный показатель считается эквивалентом KD или кажущейся KD во всем данном тексте.
Настоящее изобретение относится к одиночным вариабельным доменам иммуноглобулинов, описанным в WO 2004/015425, WO 2004/062551, WO 2006/074947, WO 2006/122825, WO 2009/115614 или WO 2011/067160, все из которых опубликованы от имени подателя настоящей заявки, или получаемым способами, раскрытыми в них.
Настоящее изобретение также охватывает оптимизированные варианты этих аминокислотных последовательностей. Как правило, "оптимизированный вариант" аминокислотной последовательности согласно настоящему изобретению является вариантом, содержащим одну или несколько благоприятных замен, таких как замены, при которых увеличивается i) степень "гуманизации", ii) химическая стабильность и/или iii) уровень экспрессии; тогда как активность (измеренная, например, путем анализа активности, описанного в экспериментальной части WO 2006/122825, остается сопоставимой (т.е. в пределах 10% отклонения) с активностью 12А02 дикого типа (определенной в WO 2006/122825) или сопоставимой с активностью варианта 12А02Н1 (SEQ ID NO: 19), также определенной в WO 2006/122825. По сравнению с последовательностью 12А02 дикого типа аминокислотная последовательность по настоящему изобретению предпочтительно содержит по меньшей мере одну такую замену, и предпочтительно по меньшей мере две такие замены, и предпочтительно по меньшей мере три гуманизирующие замены, и предпочтительно по меньшей мере 10 таких гуманизирующих замен.
В конкретном аспекте аминокислотные последовательности по настоящему изобретению содержат в общей сложности от 1 до 15, предпочтительно от 2 до 14, как, например, от 9 до 13, например, 10, 11 или 12, аминокислотных замен по сравнению с последовательностью 12А02 дикого типа. Как уже упоминалось, эти различия предпочтительно составляют по меньшей мере одну и предпочтительно по меньшей мере две гуманизирующие замены, как, например, три, четыре, или пять, или десять таковых, и могут необязательно включать в себя одну или несколько дополнительных замен (таких как любая из дополнительных замен (а) - (с), упомянутых в данном документе, или любая подходящая комбинация из любых двух или более из них). Специалист в данной области, исходя из раскрытия, приведенного в данном документе, и необязательно после ограниченного количества проб и ошибок в этом случае также сможет выбрать одну или несколько таких подходящих гуманизирующих и/или дополнительных замен (или их подходящую комбинацию).
Настоящее изобретение охватывает полипептидные последовательности, характеризующиеся высокой степенью сходства с любым из конкретных примеров, приведенных в данном документе, или с любым из конкретных примеров, определенных по ссылке выше. Высокая степень сходства означает идентичность аминокислот, составляющую по меньшей мере 90%, например, 95%, 97%, 98% или 99%. Полипептидные последовательности с высокой степенью сходства выполняют ту же функцию, что и последовательность, из которой они получены, т. е. они связываются с vWF, более конкретно, специфично связываются с vWF и ингибируют взаимодействие между ним и тромбоцитами, как, например, ALX 0081-A, который получен из ALX 0081.
В конкретном варианте осуществления настоящее изобретение относится к последовательностям, характеризующимся высокой степенью сходства с любой из SEQ ID NO: 1-19 или 24, в частности, SEQ ID NO: 1. Однако у каждого варианта последовательности в составе, определенном в данном документе, необходимо оценивать стабильность, так что настоящее изобретение, в частности, относится к вариантам или последовательностям с высокой степенью сходства, которые являются стабильными в составах, определенных в данном документе.
Способы получения полипептидных последовательностей по настоящему изобретению широко известны и включают в себя, например, рекомбинантную экспрессию или синтез. Специалисту в данной области хорошо известна подходящая технология экспрессии, например, подходящие рекомбинантные векторы и клетки-хозяева, например, бактериальные или дрожжевые клетки-хозяева. Специалисту в данной области также хорошо известны подходящие методики и протоколы очистки.
В настоящем изобретении также предусмотрены составы на основе полипептидов, содержащих по меньшей мере один одиночный вариабельный домен иммуноглобулина, направленный против vWF, например, ALX 0081 или ALX 0081-A, которые являются стабильными и предпочтительно пригодными для фармацевтических путей применения, в том числе для получения лекарственных препаратов (также называемые "фармацевтическим составом по настоящему изобретению" или "составом (составами) по настоящему изобретению").
В конкретных вариантах осуществления состав содержит один или несколько полипептидов, выбранных из SEQ ID NO: 1-19 или 24, предпочтительно SEQ ID NO: 1.
Термин "фармацевтический состав" относится к препарату, который представлен в такой форме, которая обеспечивает эффективную биологическую активность активного ингредиента (полипептида по настоящему изобретению), и который не содержит дополнительных компонентов, неприемлемо токсичных для субъекта, которому будут вводить состав. Такие составы являются стерильными. "Фармацевтически приемлемые" вспомогательные средства (среды-носители, добавки) представляют собой вспомогательные средства, которые можно целесообразно вводить субъекту-млекопитающему с обеспечением эффективной дозы используемого активного ингредиента.
Используемый в данном документе термин "вспомогательное средство" означает инертное вещество, которое широко применяют в качестве разбавителя, среды-носителя, консерванта, лиопротектора, поверхностно-активного вещества, связующего средства, носителя или стабилизирующего средства для соединений, придающее составу благоприятное физиологическое свойство. Специалисту в данной области техники знакомы вспомогательные средства, подходящие для фармацевтических целей, которые могут выполнять определенные функции в составе, такие как лиопротекция, стабилизация, консервация и т.д.
"Стерильный" состав является асептическим или не содержит или по существу не содержит никаких живых микроорганизмов и их спор. Этого легко достичь посредством фильтрации через стерильные фильтрующие мембраны.
"Стабильный" состав представляет собой состав, в котором белок, находящийся в нем, по существу сохраняет свою физическую стабильность, и/или химическую стабильность, и/или биологическую активность при хранении. Состав предпочтительно по существу сохраняет свою физическую и химическую стабильность, а также свою биологическую активность при хранении. Период хранения, как правило, выбирают, исходя из предполагаемого срока годности состава. Из уровня техники доступны различные аналитические методики измерения стабильности белков, и их обзор приведен, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991), и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность можно измерять при выбранной температуре в течение выбранного периода времени. В определенных вариантах осуществления состав является стабильным при приблизительно 40°С в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8 или больше недель. Кроме того, состав предпочтительно является стабильным после замораживания (например, до -20°С или до -70°С) и размораживания состава, например, после 1, 2, 3, 4 или 5 циклов замораживания и размораживания. Стабильность можно оценить качественно и/или количественно рядом различных способов, известных специалисту в данной области. Исследования стабильности показали, что ALX 0081 или ALX 0081-A является стабильным при -20°С в течение по меньшей мере 3 лет.
Состав содержит водный носитель. Водный носитель представляет собой, в частности, буфер.
Как используется в данном документе, "буфер" относится к буферному раствору, устойчивому к изменениям pH за счет действия его сопряженных кислотных и основных компонентов. Состав по настоящему изобретению содержит буфер, выбранный по меньшей мере из одного из цитратного или фосфатного буфера, предпочтительно цитратный буфер. Как определено ранее, эти буферы повышают стабильность средств, связывающих vWF.
Состав согласно настоящему изобретению содержит цитратный буфер в концентрации в диапазоне 5-200 мМ, предпочтительно 7,5-80 мМ, еще более предпочтительно 10-50, например, 10, 15, 20, 25 или 30 мМ, и наиболее предпочтительно 20 мМ, при этом следует понимать, что каждое значение необязательно охватывает диапазон ±5 мМ. В качестве альтернативы, состав согласно настоящему изобретению может содержать фосфатный буфер в концентрации в диапазоне 5-200 мM, предпочтительно 5-80 мM, более предпочтительно 7,5-60 мM, еще более предпочтительно 10-40, например, 10, 15, 20, 25 или 30 мM, и наиболее предпочтительно 10 мM, при этом следует понимать, что каждое значение необязательно охватывает диапазон ±5 мМ. Следует понимать, что более низкая концентрация буфера оказывает эффект на конечную осмоляльность, и, соответственно, может быть необходимо добавлять дополнительные растворимые вещества.
pH состава по настоящему изобретению находится в диапазоне от 5,0 до 7,5, при этом следует понимать, что каждое значение охватывает диапазон ±0,2. Наиболее преимущественное значение рН зависит от буфера, содержащегося в составе. Следовательно, настоящее изобретение относится, в частности, к составу, содержащему фосфатный буфер, который предпочтительно имеет рН в диапазоне от 6,5 до 7,5, предпочтительно 6,9; 7,0; 7,1; например, 7,1. Было показано, что состав, содержащий цитратный буфер, был чрезвычайно подходящим для хранения и применения. Следовательно, настоящее изобретение относится к составу, содержащему цитратный буфер, который предпочтительно имеет рН от 6,0 до 7,0, более предпочтительно 6,1; 6,2; 6,3; 6,4; 6,5; 6,6; 6,7; 6,8 или 6,9; например, 6,5, при этом следует понимать, что каждое значение необязательно охватывает диапазон ±0,2.
Составы по настоящему изобретению будут содержать полипептиды по настоящему изобретению, в частности, одиночные вариабельные домены иммуноглобулинов или полипептиды, содержащие по меньшей мере один одиночный вариабельный домен иммуноглобулина, направленный против vWF, такие как ALX 0081 или ALX 0081-A, в концентрации, которая подходит для клинических целей, которая включает в себя концентрации, используемые в исходных растворах для разбавления перед применением для пациента. Помимо улучшенной стабилизации, составы по настоящему изобретению обеспечивают высокие концентрации полипептидов, содержащих по меньшей мере один ISVD, направленный против vWF, таких как ALX 0081 или ALX 0081-A.
Типичные концентрации активного средства, например, полипептидов, содержащих по меньшей мере один ISVD, направленный против vWF, таких как ALX 0081 или ALX 0081-A, в составах по настоящему изобретению включают в себя неограничивающие примеры концентраций в диапазоне от 0,1 до 150 мг/мл, таких как 1-100 мг/мл, 5-80 мг/мл или 10-40 мг/мл, предпочтительно 10 мг/мл или 11 мг/мл, при этом следует понимать, что каждое значение необязательно охватывает диапазон ±20% (например, значение 10 необязательно охватывает диапазон от 8 до 12 мг/мл).
В дополнительном варианте осуществления настоящего изобретения состав в соответствии с любым аспектом настоящего изобретения может дополнительно содержать детергент или поверхностно-активное вещество.
В данном документе "поверхностно-активное вещество" относится к поверхностно-активному средству, предпочтительно неионогенному поверхностно-активному веществу. Примеры поверхностно-активных веществ в данном документе включают полисорбат; полоксамер (например, полоксамер 188); Triton, додецилсульфат натрия (SDS); лаурилсульфат натрия; октилгликозид натрия; лаурил-, миристил-, линолеил- или стеарилсульфобетаин; лаурил-, миристил-, линолеил- или стеарилсаркозин; линолеил-, миристил- или цетилбетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостеарамидопропилбетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропилдиметиламин; метилкокоилтаурат натрия или метилолеилтаурат динатрия и серии MONAQUAT® (Mona Industries, Inc., Патерсон, Нью-Джерси); полиэтиленгликоль, полипропиленгликоль и сополимеры этилен- и пропиленгликоля (например, Pluronic, PF68 и т.д.) и т.д. В одном варианте осуществления в данном документе поверхностно-активное вещество представляет собой полисорбат 80. Предпочтительные подходящие детергенты или поверхностно-активные вещества для применения в настоящем изобретении включают в себя без ограничения полиоксиэтиленовые сложные эфиры сорбитана и жирных кислот, например, полисорбат 20, 40, 60, 65, 80 или 85. Общепринятые торговые наименования для полисорбатов включают Alkest, Canarcel и Tween. Специалисту в данной области известны дополнительные неограничивающие примеры детергентов, такие как те, которые перечислены, например, в WO 2010/077422. В предпочтительном варианте осуществления детергент представляет собой неионогенный детергент. Более конкретно, детергент представляет собой полисорбат-80, также обозначаемый далее как Tween-80. Специалист в данной области может легко определить подходящую концентрацию детергента для состава по настоящему изобретению. Как правило, концентрация будет как можно более низкой при сохранении в то же время благоприятных эффектов детергентов, например, стабилизирующего эффекта в условиях напряжения сдвига, например, перемешивания, при котором снижается агрегация составленных полипептидов по настоящему изобретению. В иллюстративных неограничивающих вариантах осуществления концентрация детергента может находиться в диапазоне от 0,001 до 0,5%, например, составлять 0,001%; 0,002%; 0,003%; 0,004%; 0,005%; 0,01%; 0,015%; 0,02%; 0,025%; 0,03%; 0,035%; 0,04%; 0,045%; 0,05%, 0,1%, 0,2%, 0,3%, 0,4% или 0,5%, предпочтительно является концентрацией от 0,01% до 0,05%, более предпочтительно от 0,01% до 0,02%, например, 0,01% (об./об.).
Состав по настоящему изобретению может дополнительно содержать такие вспомогательные средства, как консерванты.
"Консервант" является соединением, которое может быть необязательно включено в состав для существенного снижения в нем бактериальной активности, за счет чего обеспечивается получение, например, состава для многоразового применения. Примеры потенциальных консервантов включают хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония (смесь хлоридов алкилбензилдиметиламмония, в которой алкильные группы являются длинноцепочечными соединениями) и хлорид бензетония. Другие типы консервантов включают в себя ароматические спирты, такие как фенол, бутиловый и бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин, резорцин, циклогексанол, 3-пентанол и м-крезол. В одном варианте осуществления в данном документе консервант представляет собой бензиловый спирт.
Состав по настоящему изобретению может дополнительно содержать стабилизирующие средства, такие как многоатомные спирты.
"Многоатомный спирт" представляет собой вещество с несколькими гидроксильными группами и включает в себя сахара (восстанавливающие и невосстанавливающие сахара), сахароспирты и сахарные кислоты. Многоатомный спирт необязательно может быть включен в состав, например, для улучшения стабильности. В определенных вариантах осуществления в данном документе многоатомные спирты имеют молекулярную массу, составляющую менее чем приблизительно 600 кДа (например, в диапазоне от приблизительно 120 до приблизительно 400 кДа). "Восстанавливающий сахар" представляет собой сахар, содержащий полуацетальную группу, которая может восстанавливать ионы металлов или реагировать с лизином и другими аминогруппами в белках с образованием ковалентной связи, а "невосстанавливающий сахар" представляет собой сахар, не обладающий этими свойствами восстанавливающего сахара. Примерами восстанавливающих сахаров являются фруктоза, манноза, мальтоза, лактоза, арабиноза, ксилоза, рибоза, рамноза, галактоза и глюкоза. Heвосстанавливающие сахара включают в себя сахарозу, трегалозу, сорбозу, мелицитозу и раффинозу. Маннит, ксилит, эритрит, треит, сорбит и глицерин являются примерами сахароспиртов. Что касается сахарных кислот, то они включают в себя L-глюконат и его соли металлов. Если желательно, чтобы состав был стабильным к замораживанию-размораживанию, то многоатомный спирт предпочтительно представляет собой спирт, который не кристаллизуется при температурах замерзания (например, -20°С), так что он не дестабилизирует антитело в составе. В определенных вариантах осуществления невосстанавливающие сахара, такие как сахароза и трегалоза, являются примерами многоатомных спиртов, при этом предпочтительной является сахароза, несмотря на стабильность трегалозы в растворе.
Терапевтические соединения по настоящему изобретению, применяемые в соответствии с настоящим изобретением, готовят для хранения путем смешивания полипептида (полипептидов) желаемой степени чистоты с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. [1980]) в форме лиофилизированных составов или водных растворов. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для получающих их пациентов при используемых дозировках и концентрациях. Соответственно, составы согласно настоящему изобретению могут также необязательно содержать одно или несколько наполнителей.
Широко применяемые стабилизаторы и консерванты хорошо известны специалисту в данной области (см., например, WO 2010/077422). Фармацевтически приемлемые носители, которые можно применять в этих композициях, включают в себя без ограничения ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный оксид кремния, трисиликат магния, гидрофильные полимеры, такие как поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий-карбоксиметилцеллюлозу, полиакрилаты, воски, желатин, блок-сополимеры полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин, антиоксиданты, включающие в себя аскорбиновую кислоту и метионин; консерванты; низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки и аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин. В преимущественных вариантах осуществления наполнитель может быть одним или несколькими, выбранными из перечня, состоящего из NaCl, трегалозы, сахарозы, маннита или глицина.
Активные ингредиенты также могут быть заключены в микрокапсулы, полученные, например, посредством методик коацервации или путем полимеризации на границе раздела фаз, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Полипептиды по настоящему изобретению могут быть составлены в любом фармацевтически приемлемом составе. Состав может быть жидким или сухим. Состав может быть получен посредством смешивания, сушки, лиофилизации, вакуумной сушки или любого известного способа составления фармацевтических композиций.
Предпочтительный состав по настоящему изобретению содержит полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, такой как ALX 0081 или ALX 0081-A, в фосфатном буферном растворе (pH 7,1). Состав по настоящему изобретению еще более предпочтительно содержит полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, такой как ALX 0081 или ALX 0081-A, в фосфатном буферном растворе (pH 7,1), глицин (0,2 M) и полисорбат 80 (0,02% об./об.).
Полипептиды по настоящему изобретению, кроме того, могут быть составлены, как описано в WO 2014/184352.
Особенно предпочтительный состав содержит:
(a) полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, такой как ALX 0081 или ALX 0081-A, в концентрации от приблизительно 0,1 мг/мл до приблизительно 80 мг/мл, предпочтительно 5 мг, или 10 мг, или 11 мг;
(b) наполнитель, выбранный из сахарозы, глицина, маннита, трегалозы или NaCl, в концентрации от приблизительно 1% до приблизительно 15% (вес/об.);
(c) Tween-80 в концентрации от приблизительно 0,001% до 0,5% (об./об.) и
(d) цитратный буфер в концентрации от приблизительно 5 мM до приблизительно 200 мM, так что рН состава составляет от приблизительно 6,0 до 7,0.
Дополнительный предпочтительный состав по настоящему изобретению содержит полипептид, содержащий по меньшей мере один ISVD, направленный против vWF, такой как ALX 0081 или ALX 0081-A, предпочтительно в концентрации 5 мг/мл, 10 мг/мл или 11 мг/мл, цитратный буфер в концентрации 20 мM (pH 6,5), и дополнительно содержит 7% сахарозу (вес/об.) и Tween-80 в концентрации 0,01% (об./об.).
В некоторых вариантах осуществления состав хранят в виде жидкости. В других вариантах осуществления состав получают в виде жидкости, а затем высушивают, например, путем лиофилизации или распылительной сушки, перед хранением. Высушенный состав можно применять в виде сухого соединения, например, в виде аэрозоля или порошка, или восстанавливать до его исходной или другой концентрации, например, с помощью воды, буфера или другой подходящей жидкости.
Настоящее изобретение также относится к заполненным флаконам, содержащим лиофилизат, содержащий 12,5 мг каплацизумаба и вспомогательные средства для раствора для инъекций. Вспомогательные средства (на мл восстановленного раствора): 0,21 мг лимонной кислоты, 5,58 мг дигидрата цитрата тринатрия, 70 мг сахарозы, 0,11 мг полисорбата-80 на флакон (pH 6,5±0,5). После восстановления с помощью 1 мл воды для инъекций (WFI) концентрация составляет 12,5 мг/мл каплацизумаба (для вводимой номинальной дозы 10 мг или 11 мг).
Настоящее изобретение также охватывает продукты, получаемые путем дополнительной обработки жидкого состава, такого как замороженный, лиофилизированный или высушенный распылением продукт. При восстановлении эти твердые продукты могут становиться жидкими составами, описываемыми в данном документе (без ограничения). Таким образом, в своем наиболее широком смысле термин "состав" охватывает как жидкие, так и твердые составы. Однако твердые составы понимаются как получаемые из жидких составов (например, путем замораживания, сублимационной сушки или распылительной сушки) и, следовательно, имеют различные характеристики, определяемые признаками, указанными в данном документе для жидких составов. Настоящее изобретение не исключает восстановления, которое приводит к получению композиции, отклоняющейся от исходной композиции, например, перед сублимационной или распылительной сушкой. Соответственно, лиофилизированный состав может быть восстановлен с получением состава, имеющего концентрацию, отличающуюся от исходной концентрации (т.е. до лиофилизации), в зависимости от количества воды или разбавителя, добавленного к лиофилизату, по отношению к объему жидкости, которую первоначально подвергали сублимационной сушке. Подходящие составы можно идентифицировать путем оценки одного или нескольких параметров целостности антител.
В предпочтительном варианте осуществления составы согласно настоящему изобретению являются изотоничными по отношению к крови человека. Изотонические растворы обладают таким же осмотическим давлением, как плазма крови, и поэтому их можно вливать субъекту внутривенно, не изменяя осмотическое давление плазмы крови субъекта. Тоничность можно выразить в показателях осмоляльности, которая может быть теоретической осмоляльностью или предпочтительно экспериментально определенной осмоляльностью. Как правило, осмоляльность находится в диапазоне 290±60 мОсм/кг, предпочтительно 290±20 мОсм/кг.
Составы по настоящему изобретению также могут содержать соединения, особенно применимые для защиты полипептида по настоящему изобретению во время сублимационной сушки. Такие соединения также известны как лиопротекторы и хорошо известны специалисту в данной области. Конкретные примеры включают в себя без ограничения сахара, такие как сахароза, сорбит или трегалоза; аминокислоты, такие как глутамат, в частности, глутамат мононатрия, или гистидин; бетаин, сульфат магния, сахароспирты, пропиленгликоль, полиэтиленгликоли и их комбинации. Получая достаточное представление о настоящем изобретении, специалист в данной области может легко определить необходимое для добавления количество такого соединения с учетом стабильности состава в жидкой форме и при воздействии лиофилизации. Составы, особенно пригодные для сублимационной сушки, могут дополнительно содержать объемообразующие средства. Подходящие средства широко известны специалисту в данной области. Было показано, что состав, содержащий сахарозу, особенно подходит не только для сохранения физической стабильности, например, при хранении и замораживании-размораживании средств, связывающих vWF, но также в качестве лиопротектора.
Как изложено выше, любой из вышеуказанных составов можно дополнительно обрабатывать, например, путем лиофилизации, распылительной сушки или замораживания, например, замораживания насыпью. Полученный в результате обработанный продукт имеет характеристики, происходящие от жидкого исходного состава, как определено выше. Если необходимо, могут быть включены дополнительные средства для дополнительной обработки, такие как, например, лиопротекторы и т.д.
Составы по настоящему изобретению после лиофилизации обладают эффектом сохранения химической и физической целостности полипептидов по настоящему изобретению, в частности, ALX 0081 или ALX 0081-A, т.е. даже после продолжительного хранения, например, в течение периодов, определенных выше, при температурах от -70°С до +40°С профиль чистоты/примесей продукта по существу не изменяется. Например, продолжительное хранение после лиофилизации не оказывает значительный эффект на профили обращенно-фазовой высокоэффективной жидкостной хроматографии (RP-HPLC), эксклюзионной высокоэффективной жидкостной хроматографии (SE-HPLC) или капиллярного изоэлектрического фокусирования (cIEF).
Полипептиды по настоящему изобретению можно получить с помощью любого широко применяемого способа. Типичные примеры включают рекомбинантную экспрессию в подходящих системах хозяев, например, бактериальных или дрожжевых. Полипептиды по настоящему изобретению подвергают подходящему режиму очистки перед составлением в соответствии с настоящим изобретением.
Как правило, полипептиды по настоящему изобретению продуцируются живыми клетками-хозяевами, которые были сконструированы методами генной инженерии для продуцирования полипептида. Способы конструирования клеток методами генной инженерии для продуцирования белков хорошо известны из уровня техники. См., например, Ausubel et al., eds. (1990), Current Protocols in Molecular Biology (Wiley, New York). Такие способы включают в себя введение нуклеиновых кислот, которые кодируют полипептид и обеспечивают его экспрессию в живых клетках-хозяевах. Эти клетки-хозяева могут являться бактериальными клетками, грибными клетками или животными клетками, выращиваемыми в культуре. Бактериальные клетки-хозяева включают в себя без ограничения клетки Escherichia coli. Примеры подходящих штаммов E. coli включают: HB101, DH5a, GM2929, JM109, KW251, NM538, NM539 и любой штамм E. coli, в котором не может происходить расщепление чужеродной ДНК. Грибные клетки-хозяева, которые можно применять, включают в себя без ограничения клетки Saccharomyces cerevisiae, Pichia pastoris и Aspergillus. Некоторыми примерами линий животных клеток, которые можно применять, являются CHO, VERO, BHK, HeLa, Cos, MDCK, 293, 3T3 и WI38. Новые линии животных клеток можно создавать с помощью способов, хорошо известных специалистам в данной области (например, путем трансформации, вирусной инфекции и/или отбора). Полипептид необязательно может секретироваться клетками-хозяевами в среду.
В некоторых вариантах осуществления полипептиды могут продуцироваться бактериальными клетками, например, клетками Е. coli. Например, если полипептид кодируется последовательностями в векторе для фагового дисплея, который содержит супрессируемый стоп-кодон между объектом, подвергаемым дисплею, и белком бактериофага (или его фрагментом), то векторная нуклеиновая кислота может быть перенесена в бактериальную клетку, в которой не может происходить супрессия стоп-кодона. В этом случае полипептид не сливается с белком, кодируемым геном III, и секретируется в периплазму и/или в среду.
Полипептиды могут также продуцироваться в эукариотических клетках. В одном варианте осуществления полипептиды экспрессируются в дрожжевых клетках, таких как Pichia (см., например, Powers et al. 2001 J Immunol Methods 251:123-35), Hansenula или Saccharomyces.
В одном варианте осуществления полипептиды продуцируются в клетках млекопитающих. Типичные клетки-хозяева, являющиеся клетками млекопитающих, для экспрессии клонов антител или их антигенсвязывающих фрагментов включают в себя клетки яичника китайского хомячка (клетки CHO) (в том числе dhfr- клетки CHO, описанные в Urlaub and Chasin, 1980 Proc. Natl. Acad. Sci. USA 77:4216-4220, применяемые с селектируемым маркером DHFR, например, как описано в Kaufman and Sharp, 1982 Mol. Biol. 159:601-621), линии клеток-лимфоцитов, например, клетки миеломы NS0 и клетки SP2, клетки COS и клетки от трансгенного животного, например, трансгенного млекопитающего. Например, клетка является эпителиальной клеткой млекопитающего.
В дополнение к последовательностям нуклеиновых кислот, кодирующим полипептид, рекомбинантные векторы экспрессии могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например, точки начала репликации), и селектируемые маркерные гены. Селектируемый маркерный ген облегчает отбор клеток-хозяев, в которые был введен вектор (см., например, патенты США №№ 4399216, 4634665 и 5179017). Например, как правило, селектируемый маркерный ген придает устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую был введен вектор.
Для получения рекомбинантного вектора экспрессии, трансфекции клеток-хозяев, отбора трансформантов, культивирования клеток-хозяев и извлечения молекулы антитела из культуральной среды можно применять стандартные методики молекулярной биологии. Например, полипептиды по настоящему изобретению можно выделять посредством аффинной хроматографии.
В одном варианте осуществления полипептид по настоящему изобретению очищают, как описано в WO 10/056550. В иллюстративном варианте осуществления полипептид очищают от одного или нескольких загрязняющих компонентов путем приведения смеси полипептида и загрязняющего(загрязняющих) компонента(компонентов) в контакт с подложкой на основе белка А и/или с ионообменной подложкой в условиях, обеспечивающих связывание полипептида с подложкой или его адсорбцию на ней; удаления одного или нескольких загрязняющих компонентов путем промывания связывающей подложки в условиях, при которых полипептид остается связанным с подложкой, и избирательного элюирования полипептида с подложки путем элюирования адсорбированной молекулы полипептида элюирующим буфером.
Полипептиды по настоящему изобретению могут также продуцироваться трансгенным животным. Например, в патенте США № 5849992 описан способ экспрессии антитела в молочной железе трансгенного животного. Конструируют трансген, содержащий промотор, специфичный для молока, и нуклеиновые кислоты, кодирующие молекулу антитела, а также сигнальную последовательность для секреции. Молоко, вырабатываемое самками таких трансгенных животных, содержит секретируемый в нем одиночный домен, представляющий интерес. Молекулу антитела можно очистить из молока или в некоторых путях применениях использовать непосредственно.
Настоящее изобретение охватывает способы получения составов, определенных в данном документе.
Стадии очистки и составления могут совпадать, например, в случаях, когда полипептиды по настоящему изобретению элюируют из колонки с помощью буфера согласно настоящему изобретению. В качестве альтернативы, составы по настоящему изобретению можно получить путем замены буфера любыми подходящими способами, например, с помощью способов, широко применяемых в данной области техники, таких как диализ, ультрафильтрация и т.д.
В некоторых вариантах осуществления способ получения состава по настоящему изобретению может также относиться к восстановлению лиофилизированного или высушенного распылением состава, например, путем добавления воды или подходящего буфера (который может при необходимости содержать дополнительные вспомогательные средства).
Способы получения состава согласно настоящему изобретению могут охватывать дополнительные стадии, такие как их разливание во флаконы, подходящие для клинического применения, такие как герметичные контейнеры, и/или их приготовление в виде стандартной лекарственной формы. Способы могут также включать дополнительные стадии, такие как распылительная сушка, лиофилизация или замораживание, например, замораживание насыпью. Настоящее изобретение также охватывает контейнеры, стандартные лекарственные формы или другие продукты, получаемые любым из способов, перечисленных в данном документе.
Составы по настоящему изобретению можно применять для хранения полипептидов по настоящему изобретению, например, полипептидов, содержащих по меньшей мере один ISVD, направленный против vWF, таких как ALX 0081 или ALX 0081-A, определенных в данном документе. Таким образом, настоящее изобретение охватывает способ хранения полипептидов по настоящему изобретению, как используется в данном документе, характеризующийся применением состава, определенного в данном документе. Более конкретно, настоящее изобретение охватывает способы стабилизации полипептидов по настоящему изобретению для хранения, включающие, например, получение состава, описываемого в данном документе. Хранение можно осуществлять в течение 1-36 месяцев, как, например, 1, 1,5, 3, 6, 9, 12, 18, 24, 30 или 36 месяцев, например, по меньшей мере 12 месяцев, необязательно при температуре от -70°С до +40°С, как, например, -70°С, -20°С, +5°С, +25°С или +40°С, предпочтительно при температуре от -70°С до +25°С, более предпочтительно при температуре от -20°С до +5°С. Таким образом, хранение может охватывать замораживание, сублимационную сушку (лиофилизацию) и/или распылительную сушку. Способы хранения могут дополнительно включать оценку физической и химической целостности средств, связывающих vWF, определенных в данном документе.
Настоящее изобретение также относится к способам анализа составов, содержащих по меньшей мере одно из средств, связывающих vWF, определенных в данном документе. Составы можно анализировать в отношении любых признаков химической или физической нестабильности средств, связывающих vWF, определенных в данном документе. Например, композиции можно оценивать в отношении наличия продуктов разложения, например, низкомолекулярных производных, таких как протеолитические фрагменты; и/или в отношении химических производных, например, пироглутаматсодержащих вариантов; и/или в отношении высокомолекулярных производных, таких как агрегаты, агломераты и т. д. Состав можно также оценивать в отношении общего содержания белка и/или активности. Каждый из различных способов анализа, упомянутых в данном документе, можно применять в способе анализа по настоящему изобретению.
Таким образом, настоящее изобретение также относится к способу мониторинга и/или оценки качества и/или стабильности состава, например, во время одного или нескольких из изготовления, хранения и применения. Настоящее изобретение также относится к способу контроля качества состава, например, оценки того, соответствует ли состав спецификациям продукта, как далее описывается в данном документе. Настоящее изобретение в любом из этих аспектов включает одно или несколько, выбранных из сравнения с одним или несколькими эталонными образцами, анализа варьирования между партиями и постоянного мониторинга процесса получения.
Настоящее изобретение относится к любому продукту, связанному с составами по настоящему изобретению, например, благодаря тому, что он их содержит, или благодаря тому, что он необходим для их получения или приготовления, без каких-либо ограничений.
Например, настоящее изобретение относится к изделию, например, герметичному контейнеру, содержащему один или несколько составов согласно настоящему изобретению.
Настоящее изобретение также относится к фармацевтической стандартной лекарственной форме, например, лекарственной форме, подходящей для парентерального введения (например, внутрикожно, внутримышечно, внутрибрюшинно, внутривенно и подкожно) пациенту, предпочтительно пациенту-человеку, содержащей один или несколько составов согласно любому варианту осуществления, описываемому в данном документе.
Стандартная лекарственная форма может быть, например, представлена в формате предварительно заполненного шприца, ампулы, картриджа или флакона.
Также представлены наборы или изделия, содержащие состав по настоящему изобретению и инструкции по применению, например, медицинским работником. Наборы или изделия могут содержать флакон или шприц, содержащий состав по настоящему изобретению, описываемый в данном документе.
Флакон или шприц предпочтительно состоит из стекла, пластика или полимерного материала, выбранного из циклического олефинового полимера или сополимера. Шприц, ампула, картридж или флакон могут быть изготовлены из любого подходящего материала, такого как стекло или пластик, и могут содержать резиновые материалы, такие как резиновые пробки для флаконов, а также резиновые поршни и резиновые прокладки для шприцев и картриджей. Настоящее изобретение также относится к набору, содержащему один или несколько составов согласно настоящему изобретению. Набор может дополнительно содержать инструкции по применению и/или вкладыш в клинической упаковке. В любом варианте осуществления продуктов, определяемых в данном документе, настоящее изобретение также охватывает наличие упаковочного материала, инструкций по применению и/или вкладышей в клинической упаковке, например, как требуется регуляторными аспектами.
Для целей сравнения двух или более аминокислотных последовательностей можно рассчитать процент "идентичности последовательностей" между первой аминокислотной последовательностью и второй аминокислотной последовательностью (также называемый в данном документе "идентичностью аминокислот") путем деления [числа аминокислотных остатков в первой аминокислотной последовательности, идентичных аминокислотным остаткам в соответствующих положениях во второй аминокислотной последовательности] на [общее число аминокислотных остатков в первой аминокислотной последовательности] и умножения на [100%], где каждая делеция, вставка, замена или добавление аминокислотного остатка во второй аминокислотной последовательности по сравнению с первой аминокислотной последовательностью считается отличием по одному аминокислотному остатку (положению), т.е. "аминокислотным отличием", определенным в данном документе.
В качестве альтернативы, степень идентичности последовательностей между двумя аминокислотными последовательностями можно рассчитать с помощью известного компьютерного алгоритма, такого как алгоритмы, упоминаемые выше, для определения степени идентичности последовательностей для нуклеотидных последовательностей, в этом случае также с использованием стандартных устанавливаемых параметров.
Как правило, для целей определения процента "идентичности последовательностей" между двумя аминокислотными последовательностями в соответствии со способом расчета, изложенным выше, аминокислотную последовательность с наибольшим числом аминокислотных остатков берут в качестве "первой" аминокислотной последовательности, а другую аминокислотную последовательность берут в качестве "второй" аминокислотной последовательности.
Кроме того, при определении степени идентичности последовательностей между двумя аминокислотными последовательностями специалист в данной области может учитывать так называемые "консервативные" аминокислотные замены, которые могут в целом быть описаны как аминокислотные замены, в которых аминокислотный остаток замещен другим аминокислотным остатком сходной химической структуры и которые оказывают незначительное влияние или по существу не оказывают влияния на функцию, активность или другие биологические свойства полипептида. Такие консервативные аминокислотные замены хорошо известны из уровня техники, например, из WO 04/037999, GB-A-3357768, WO 98/49185, WO 00/46383 и WO 01/09300; и (предпочтительные) типы и/или комбинации таких замен могут быть выбраны, исходя из соответствующих идей из WO 04/037999, а также WO 98/49185 и из дополнительных ссылочных материалов, цитируемых в данном документе. Такие консервативные замены предпочтительно представляют собой замены, в которых одна аминокислота из следующих групп (a) - (е) заменена другим аминокислотным остатком из той же самой группы: (а) небольшие алифатические, неполярные или слабополярные остатки: Ala, Ser, Thr, Pro и Gly; (b) полярные, отрицательно заряженные остатки и их (незаряженные) амиды: Asp, Asn, Glu и Gln; (с) полярные, положительно заряженные остатки: His, Arg и Lys; (d) крупные алифатические, неполярные остатки: Met, Leu, Ile, Val и Cys; и (е) ароматические остатки: Phe, Tyr и Trp. Особенно предпочтительными консервативными заменами являются следующие: Ala на Gly или на Ser; Arg на Lys; Asn на Gln или на His; Asp на Glu; Cys на Ser; Gln на Asn; Glu на Asp; Gly на Ala или на Pro; His на Asn или на Gln; Ile на Leu или на Val; Leu на Ile или на Val; Lys на Arg, на Gln или на Glu; Met на Leu, на Tyr или на Ile; Phe на Met, на Leu или на Tyr; Ser на Thr; Thr на Ser; Trp на Tyr; Tyr на Trp и/или Phe на Val, на Ile или на Leu. Любые аминокислотные замены, применяемые к полипептидам, описываемым в данном документе, могут также производиться на основании анализа частот аминокислотных вариаций между гомологичными белками из различных видов, разработанного в Schulz et al., Principles of Protein Structure, Springer-Verlag, 1978, анализов структурообразующих потенциалов, разработанных в Chou и Fasman, Biochemistry 13: 211, 1974, и Adv. Enzymol., 47: 45-149, 1978, и анализа паттернов гидрофобности белков, разработанного в Eisenberg et al., Proc. Natl. Acad. Sci. USA 81: 140-144, 1984; Kyte & Doolittle; J Molec. Biol. 157: 105-132, 1981, и Goldman et al., Ann. Rev. Biophys. Chem. 15: 321-353, 1986, все из которых включены в данный документ посредством ссылки во всей своей полноте. Информация о первичной, вторичной и третичной структуре Nanobodies® приведена в описании в данном документе и общем уровне техники, цитируемом выше. Кроме того, для этой цели кристаллическая структура домена VHH ламы, например, приведена в Desmyter et al., Nature Structural Biology, Vol. 3, 9, 803 (1996); Spinelli et al., Natural Structural Biology (1996); 3, 752-757; и Decanniere et al., Structure, Vol. 7, 4, 361 (1999). Дополнительную информацию о некоторых из аминокислотных остатков, которые в традиционных доменах VH образуют поверхность контакта VH/VL, и потенциальных камелизирующих заменах в этих положениях можно найти в предшествующем уровне техники, цитируемом выше.
Настоящее изобретение также относится к способу лечения или предупреждения заболевания, связанного с vWF, такого как например, острый коронарный синдром (ACS), транзиторная церебральная ишемическая атака, нестабильная или стабильная стенокардия, инсульт, инфаркт миокарда или тромботическая тромбоцитопеническая пурпура (TTP); при этом указанный способ включает введение субъекту фармацевтической композиции, содержащей состав по настоящему изобретению, за счет чего обеспечивается ослабление одного или нескольких симптомов, ассоциированных с указанным заболеванием, связанным с vWF. В частности, указанное заболевание, связанное с vWF, представляет собой TTP.
В другом варианте осуществления настоящего изобретения предусмотрено изделие, содержащее материалы, применимые для лечения заболевания, описываемого выше. Изделие содержит контейнер, этикетку и листок-вкладыш в упаковке. Подходящие контейнеры включают в себя, например, бутылки, флаконы, шприцы и т.д. Контейнеры могут быть изготовлены из ряда материалов, таких как стекло или пластик. Контейнер содержит композицию, которая является эффективной для лечения состояния и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет с раствором для внутривенной инъекции или флакон с пробкой, прокалываемой иглой для подкожных инъекций). По меньшей мере одно активное средство в композиции представляет собой полипептид по настоящему изобретению, такой как ALX 0081 или ALX 0081-A. На этикетке, находящейся на контейнере или предоставляемой вместе с ним, указывается, что композицию применяют для лечения выбранного состояния. Изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как фосфатно-солевой буферный раствор или цитратно-солевой буферный раствор, описываемый в данном документе. Он может дополнительно содержать другие материалы, желательные с точки зрения потребителя или с коммерческой точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
В настоящем изобретении предусмотрены набор или изделие, содержащие контейнер, содержащий полипептид, описываемый в данном документе, или состав, описываемый в данном документе, и инструкции по применению.
В настоящем изобретении предусмотрены набор или изделие, описываемые в данном документе, где состав представлен во флаконе или шприце для инъекции.
В настоящем изобретении предусмотрены набор или изделие, описываемые в данном документе, где состав представлен в предварительно заполненном шприце для инъекции.
В настоящем изобретении предусмотрены набор или изделие, описываемые в данном документе, где шприц или флакон состоит из стекла, пластика или полимерного материала, выбранного из циклического олефинового полимера или сополимера.
Варианты осуществления, иллюстрируемые и обсуждаемые в настоящем описании, предназначены исключительно для того, чтобы показать специалистам в данной области наилучший путь, известный авторам настоящего изобретения, для осуществления и применения настоящего изобретения. Модификации и видоизменения вышеописанных вариантов осуществления настоящего изобретения возможны без отступления от объема настоящего изобретения, как понятно специалистам в данной области в свете вышеприведенных идей. Таким образом, понятно, что в пределах объема формулы изобретения и ее эквивалентов настоящее изобретение может осуществляться на практике иначе, чем это конкретно описано.
Настоящее изобретение далее будет описано посредством следующих неограничивающих предпочтительных аспектов, примеров и фигур.
Полное содержание всех ссылочных материалов (в том числе литературных источников, выданных патентов, опубликованных заявок на патент и одновременно находящихся на рассмотрении заявок на патент), цитируемых во всей настоящей заявке, настоящим в явной форме включено посредством ссылки, в частности, в отношении идей, упомянутых в данном документе выше.
5. Сокращения
Перечень пояснений широко используемых сокращений в настоящем описании приведен в таблице 5.
6. Условные обозначения к фигурам
Фигура 1. Время до подтвержденной нормализации числа тромбоцитов в популяции, сформированной в соответствии с назначенным лечением. Данные периода ежедневного плазмообмена в двойном слепом режиме до момента завершения сбора данных использовали для анализа первичной конечной точки. Момент завершения сбора данных определяли по: истечению 45 дней ежедневного плазмообмена после начала приема исследуемого лекарственного средства, прекращению ежедневного плазмообмена или прекращению лечения исследуемым лекарственным средством в зависимости от того, что происходит раньше.
Фигура 2. Активность ADAMTS13 в соответствии с рецидивами. На панелях A и B показаны категории активности ADAMTS13 для отдельных пациентов через неделю после окончания периода ежедневного плазмообмена и в конце лечения исследуемым лекарственным средством соответственно. На каждой панели представлены категории активности ADAMTS13 (подавленная, ≤10% или нормализованная, >10%) для пациентов в различных группах лечения. В левой части каждой панели указаны данные о пациентах, у которых не было рецидива, в правой части каждой панели указаны данные о пациентах, у которых был рецидив, и о том, когда он происходил относительно окончания периода ежедневного РЕ или окончания лечения.
Фигура 3. Профили зависимости средних уровней vWF:Ag от времени в течение 7 дней повторного ежедневного подкожного введения дозы 10 мг каплацизумаба здоровым добровольцам (верхняя панель) и во время повторного ежедневного подкожного введения 10 мг каплацизумаба пациентам с аТТР (нижняя панель). aTTP: приобретенная тромботическая тромбоцитопеническая пурпура; РЕ: плазмообмен; FU: последующее наблюдение; vWF: фактор фон Виллебранда.
Фигура 4. Средняя (± SD) активность RICO в исследовании ALX-0681-2.1/10 фазы II ("TITAN", верхняя панель) и в исследовании ALX0681-C301 фазы III ("HERCULES", нижняя панель). Значения RICO <20% представляют пороговый уровень фармакологической активности каплацизумаба; для целей построения графика значения ниже нижнего предела количественного определения, составляющего 15%, принимали равными 15%, значения выше верхнего предела количественного определения, составляющего 120%, принимали равными 120%. На графиках показано среднее значение ± стандартная ошибка среднего. PE: плазмообмен; FU: последующее наблюдение; RICO: ристоцетиновый кофактор; SD: стандартное отклонение; vWF: фактор фон Виллебранда.
Фигура 5. Профиль зависимости концентрации каплацизумаба в плазме крови от времени после введения однократных нарастающих подкожно вводимых доз (А) и после однократного и повторного введения ежедневных подкожно вводимых доз 10 мг в течение семи дней (В) здоровым добровольцам.
7. ПРИМЕРЫ
7.1 Действующие нормативные требования
Все образцы от человека, используемые в разделе "Примеры", получали из коммерческих источников либо от здоровых добровольцев (после получения всех требуемых согласий и разрешений) и использовали в соответствии с действующими законодательными и нормативными требованиями (включая те, которые относятся к врачебной тайне и анонимности пациентов).
Клинические испытания осуществляли в соответствии с действующими законами и нормативными требованиями (включая Хельсинкскую декларацию и принципы врачебной тайны и защиты анонимности пациентов) и после получения всех требуемых разрешений (включая разрешения соответствующих комитетов по этике) и согласий (включая информированное согласие субъектов, принимающих участие).
Задачи и содержание этого клинического исследования, а также его результаты рассматривались как конфиденциальные и не были сделаны доступными для третьих лиц. Сотрудники, участвующие в исследовании, были связаны обязательством по соблюдению конфиденциальности. Все неиспользованные лекарственные средства были возвращены заявителю либо уничтожены.
7.2 Критерии пригодности к участию
Пациенты должны были удовлетворять всем следующим критериям пригодности к регистрации в исследовании фазы III.
Критерии включения
1. Взрослые мужчины или женщины в возрасте ≥ 18 лет на момент подписания формы информированного согласия (ICF).
2. Клинически диагностированная приобретенная TTP, которая предусматривала тромбоцитопению и микроскопические свидетельства фрагментации эритроцитов (например, наличие шизоцитов).
3. Необходимость начала ежедневных лечебных процедур PE и получение 1 лечебной процедуры РЕ перед рандомизацией.
Критерии исключения
Число тромбоцитов ≥100×109/л.
Уровень сывороточного креатинина >200 мкмоль/л в случае, если число тромбоцитов >30×109/л (для исключения возможных случаев атипичного гемолитико-уремического синдрома [атипичного HUS]).
Известные другие причины тромбоцитопении, в том числе без ограничения:
- клинические свидетельства кишечной инфекции, вызванной E. coli 0157 или родственным организмом;
- атипичный HUS;
- тромботическая микроангиопатия, ассоциированная с трансплантацией гемопоэтических стволовых клеток, костного мозга или органов;
- известный или подозреваемый сепсис;
- диагностированное диссеминированное внутрисосудистое свертывание.
Врожденная TTP (известная на момент включения в исследование).
Беременность или кормление грудью.
Клинически значимое активное кровотечение или высокий риск кровотечения (за исключением тромбоцитопении).
Известное длительное лечение антикоагулянтными средствами лечения, которое нельзя безопасно прекратить (прервать), в том числе без ограничения:
- антагонистами витамина K;
- гепарином или низкомолекулярным гепарином (LMWH);
- нестероидными противовоспалительными молекулами, отличными от ацетилсалициловой кислоты.
Злокачественная артериальная гипертензия.
Клиническое состояние, отличное от ассоциированного с TTP, с ожидаемой продолжительностью жизни <6 месяцев, такое как злокачественное новообразование в конечной стадии.
Субъекты, которые ранее были включены в клиническое исследование каплацизумаба и получали каплацизумаб или для которых не известна группа лечения, в которую они были распределены.
7.3 План исследования
Настоящее исследование разрабатывали как двойное слепое плацебо-контролируемое рандомизированное исследование фазы III для оценки эффективности и безопасности лечения каплацизумабом при введении в дополнение к стандартному лечению субъектов с острым эпизодом приобретенной ТТР (Hercules). В исследовании оценивали эффективность каплацизумаба в более быстром восстановлении нормального числа тромбоцитов и эффект лечения каплацизумабом в отношении комбинированной конечной точки смертности, связанной с ТТР, предупреждения рецидива проявляющегося эпизода ТТР и предупреждения больших тромбоэмболических событий (TE) в ходе лечения исследуемым лекарственным средством. После подтверждения соответствия критериям участия в исследовании (см. пример 7.2) и после начала лечебных процедур РЕ субъектов рандомизировали в соотношении 1:1 для получения каплацизумаба либо плацебо в дополнение к стандартной терапии. Рандомизацию проводили со стратификацией по степени тяжести неврологических симптомов (шкала комы Глазго [GCS]).
Продолжительность исследования для каждого субъекта составляла от примерно 2 месяцев до примерно 6 месяцев в случае продления лечения и обострения в течение 30 дней после периода ежедневного PE или рецидива в течение периода продления лечения.
Пациентов наблюдали в течение различных фаз на протяжении данного исследования.
- Период скрининга: от подписания формы информированного согласия (ICF) до рандомизации.
- Период лечения исследуемым лекарственным средством: охватывающий период ежедневного PE (вариабельная продолжительность) и 30 дней после периода ежедневного PE.
- Период продления лечения: 7-дневные продления максимум до 28 дней, т.е. 4×7 дней.
- Открытый режим: в случае, если происходили обострение в течение 30-дневного периода лечения или рецидив в течение периода продления лечения (первые обострение или рецидив), субъект получал каплацизумаб в открытом режиме (OL) вместе с возобновлением ежедневного PE и оптимизированным иммунодепрессивным лечением. Схема лечения каплацизумабом и график визитов были такими же, как для первоначального периода лечения исследуемым лекарственным средством (охватывающего ежедневный PE (вариабельная продолжительность) и 30 дней после периода ежедневного PE) и возможного периода продления лечения.
- Период последующего наблюдения (FU) на протяжении 4 недель: первый визит FU через 7 дней и заключительный визит FU через 28 дней после последнего дня введения исследуемого лекарственного средства.
Пациенты получали наилучший медицинский уход и лечение, которое исследователь в каждом исследовательском центре считал подходящим, в соответствии с руководствами по лечению ТТР.
Исследуемое лекарственное средство вводили в качестве вспомогательного лечения в определенные моменты времени относительно процедур РЕ. Исследуемое лекарственное средство состояло из 10 мг каплацизумаба ("группа лечения" или "CAPLA") или плацебо ("группа плацебо"), даваемых один раз или два раза в день.
7.4 Лечение исследуемым лекарственным средством в рамках исследования Hercules
Нагрузочная i.v. доза: субъекты получали однократную нагрузочную дозу 10 мг исследуемого лекарственного средства путем i.v. болюсной инъекции в рамках периода от 6 часов до 15 минут до первого PE, выполняемого после рандомизации; также давали i.v. болюсную дозу 10 мг до 1го PE, выполняемого для лечения первого обострения или рецидива.
Ежедневная подкожно вводимая (s.c.) доза: по завершении каждого ежедневного PE ежедневно вводили s.c. инъекцию 10 мг исследуемого лекарственного средства на протяжении всего периода лечебных процедур PE.
Ежедневное s.c. введение 10 мг исследуемого лекарственного средства продолжали на протяжении периода 30 дней после прекращения ежедневного PE. Никакой корректировки этого периода не было произведено для сокращения частоты PE.
Продление лечения исследуемым лекарственным средством по истечении этих 30 дней осуществляли, руководствуясь рядом факторов риска развития рецидива проявляющегося эпизода TTP, включающих профиль активности ADAMTS13, а также другие признаки и симптомы продолжающейся активности первопричинного заболевания.
В случае первого обострения проявляющегося эпизода TTP субъекты получали каплацизумаб в открытом режиме вместе с ежедневным РЕ.
В случае, если у субъекта наблюдается первый рецидив ТТР, когда он все еще получает исследуемое лекарственное средство в период продления лечения, тогда начинали ежедневный РЕ как часть стандартного лечения вместе с соответствующим иммунодепрессивным лечением.
В случае, если у субъекта наблюдались первый или последующий рецидив ТТР после завершения лечения исследуемым лекарственным средством (т. е. в период FU), то начинали стандартное лечение с ежедневным РЕ и соответствующим иммунодепрессивным лечением в соответствии с практикой исследовательского центра.
7.5 Конечные точки
Первичной конечной точкой этого исследования фазы III было время до ответа в виде изменения числа тромбоцитов, определяемого как первоначальное число тромбоцитов ≥150×109/л, с последующим прекращением ежедневного PE в рамках периода 5 дней. Ниже перечислены ключевые вторичные конечные точки.
1. Доля субъектов со смертельным исходом, связанным с TTP, рецидивом TTP или по меньшей мере одним большим тромбоэмболическим событием, возникающим после начала лечения (например, инфарктом миокарда, нарушением мозгового кровообращения, эмболией легочной артерии или тромбозом глубоких вен [DVT]) на протяжении периода лечения исследуемым лекарственным средством (включая продления).
2. Доля субъектов с рецидивом TTP на протяжении всего периода исследования (включая 4-недельный период FU).
3. Доля субъектов с рефрактерной TTP, определенной в исследовании как отсутствие удвоения числа тромбоцитов после 4 дней стандартного лечения и LDH > ULN.
4. Время до нормализации уровней всех 3 из следующих маркеров повреждения органов: время до LDH ≤ 1 x верхний предел нормы (ULN), и cTnI ≤ 1 x ULN, и сывороточный креатинин ≤ 1 x ULN.
5. Другие конечные точки включали в себя продолжительность и объем плазмообмена, продолжительность пребывания в больнице и отделении интенсивной терапии, смертность, фармакодинамические и фармакокинетические параметры, а также иммуногенность.
6. Оценки безопасности осуществляли на протяжении периодов лечения исследуемым лекарственным средством и последующего наблюдения и включали в себя определение показателей жизненно важных функций, физикальное обследование, клинико-лабораторные тесты и электрокардиографию в 12 отведениях. Нежелательные явления, о которых сообщалось, кодировали с использованием предпочтительных терминов из Medical Dictionary for Regulatory Activities версии 20.0.
7.6 Статистический анализ
В исследовании Hercules была определена плановая выборка из 132 пациентов, чтобы обеспечить 80% мощность для выявления 40% сокращения медианного времени нормализации числа тромбоцитов с помощью каплацизумаба с использованием двустороннего логарифмического рангового критерия при 5% уровне значимости, предполагая частоту выбывания равной 10%. Размер выборки, составляющий 132 субъекта, также был установлен таким образом, чтобы обеспечить 83% мощность для выявления 20% снижения первой ключевой вторичной конечной точки с использованием двустороннего критерия хи-квадрат с аппроксимацией по большой выборке и 5% уровнем значимости. Все анализы эффективности осуществляли в популяции, сформированной в соответствии с назначенным лечением (состоящей из всех рандомизированных пациентов), а анализы безопасности и иммуногенности осуществляли в популяции для оценки безопасности (состоящей из всех пациентов, которые получили по меньшей мере одну дозу исследуемого лекарственного средства). Время до ответа в виде изменения числа тромбоцитов в группе каплацизумаба и группе плацебо сравнивали путем использования двустороннего стратифицированного логарифмического рангового критерия на основании анализа Каплана-Мейера со степенью тяжести неврологического вовлечения в качестве фактора стратификации.
Для анализа ключевых вторичных конечных точек применяли подход с фиксированной последовательностью. Смертельный исход, связанный с ТТР, большое тромбоэмболическое событие и рецидив (обострение) ТТР анализировали с использованием критерия Кохрана-Мантеля-Хензеля с поправкой на степень тяжести неврологического вовлечения, тогда как четвертую конечную точку, время до нормализации уровней маркеров повреждения органов, анализировали с использованием стратифицированного логарифмического рангового критерия на основании анализа Каплана-Мейера с поправкой на исходную степень тяжести неврологического вовлечения и уровень LDH.
7.7 Определение активности ADAMTS13
Активность ADAMTS13 и активность функционального ингибитора измеряли с помощью флуорогенного анализа с использованием субстрата FRETS-VWF73 (Kokame et al. 2005. Br J Haematol 129(1):93-100; Kremer Hovinga et al. 2006 J Thromb Haemost 4(5):1146-8).
Вкратце, анализ FRETS-VWF73 осуществляли по существу согласно описанному (Kokame et al. 2005, выше) со следующими модификациями. В аналитический буфер (5 ммоль⋅л-1 Bis-Tris, 25 ммоль⋅л-1 CaCl2, 0,005% Tween-20, pH 6,0) добавляли Pefabloc SC (Boehringer, Мангейм, Германия) в конечной концентрации 1 ммоль⋅л-1. Калибровку анализа проводили с использованием пула нормальной плазмы крови человека (NHP; Swiss Red Cross Blood Services, Берн, Швейцария), разведенного 1:25 (100%) в аналитическом буфере. Дополнительные калибровочные образцы получали путем серийных предварительных разведений NHP 3:4 (75%), 1:2 (50%), 1:4 (25%), 1:10 (10%), 1:20 (5%), 1:50 (2%) и 1:100 (1%) в термоинактивированной NHP, инкубируемой в течение 30 минут при 56°C с последующим 15-минутным центрифугированием при 15000×g, для коррекции матричного эффекта в плазме крови в диапазоне более низкой активности на стандартной кривой. Все эти стандартные образцы, а также термоинактивированную NHP (0% активности ADAMTS13) и все тестируемые образцы впоследствии разбавляли 1:25 в аналитическом буфере. Затем 25 мкл каждого разбавленного стандарта или образца от пациента инкубировали при 37°С в 384-луночном белом планшете (NUNC, Роскилле, Дания). Через 10 минут в каждую лунку добавляли 25 мкл 4 мкмоль⋅л-1 пептидного субстрата FRETS-VWF73, растворенного в аналитическом буфере, и регистрировали выделение флуоресценции при 37°C во флуоресцентном микропланшетном ридере (GENios, Tecan, Цюрих, Швейцария), оснащенном фильтром возбуждения на 340 нм (ширина полосы 35 нм) и фильтром испускания на 450 нм (ширина полосы 25 нм). Выделение флуоресценции измеряли с течением времени (каждые 5 минут в течение 42 циклов). Скорость реакции рассчитывали с помощью линейного регрессионного анализа (Пассинга-Бэблока) выделения флуоресценции с течением времени от 5 (цикл 2) до 60 минут (цикл 13). Наклон кривой регрессии рассчитывали для каждого калибровочного образца и использовали для построения калибровочной кривой (линия тренда: y=ax+b; где x=ADAMTS13 (%), а y=дельта RFU/дельта времени). Активность ADAMTS13 (%) в образце затем рассчитывали следующим образом: (y - b) x 1/a.
Активность функционального ингибитора ADAMTS13 измеряли с помощью того же флуорогенного способа FRETS-VWF73 путем определения остаточной активности ADAMTS13 в нормальной плазме крови человека после инкубирования 1:1 (об.:об.) в течение 2 часов при 37°C с термоинактивированной плазмой крови пациента (30 минут при 56°С).
Для каждой аналитической партии калибровочную кривую строили с использованием пула нормальной плазмы крови человека (NHP; Swiss Red Cross Blood Services, Берн, Швейцария), разведенного 1:25 (100%) в аналитическом буфере. Дополнительные калибровочные образцы получали путем серийных предварительных разведений NHP 1:2 (50%), 1:4 (25%), 1:10 (10%), 1:20 (5%), 1:50 (2%) и 1:100 (1%) в термоинактивированной NHP. Все точки калибровки применяли в одной повторности. Критерии приемлемости. (1) Наклон линии конечной регрессии для стандартной кривой должен составлять >6,0; и (2) R² регрессии для конечного графика должен составлять >0,98 (или R >0,9899). В противном случае анализ отклоняли.
7.8 Исследуемая популяция
В настоящем исследовании Hercules 145 пациентов произвольным образом распределяли для получения каплацизумаба (n=72) или плацебо (n=73). Все пациенты получали исследуемое лекарственное средство, за исключением одного пациента в группе каплацизумаба, который отозвал свое согласие до первого введения дозы. В общей сложности 108 пациентов завершили исследование (т.е. завершили все запланированные визиты во время лечения и совершили заключительный визит последующего наблюдения), при этом 37 пациентов досрочно прекратили участие в исследовании (14 в группе каплацизумаба, 23 в группе плацебо). Наиболее частыми причинами досрочного прекращения участия в исследовании были нежелательные явления, отзыв согласия и решение врача.
Демографические показатели и характеристики заболевания на исходном уровне в целом были сходными в 2 исследуемых группах (таблица 7.8), за исключением предыдущих эпизодов ТТР и активности ADAMTS13. В общей сложности 97% (140/145) пациентов получали глюкокортикоиды, и 24% из них (35/145) начинали лечение ритуксимабом во время периода ежедневного плазмообмена (17% или 12/72 в группе каплацизумаба и 32% или 23/73 в группе плацебо).
Таблица 7.8. Демографические показатели и характеристики заболевания на исходом уровне* в популяции, сформированной в соответствии с назначенным лечением
(N=72)
(N=73)
(N=145)
Европеоиды
Негроиды
Монголоиды
Лица испанского или латиноамериканского происхождения
15 (22)
4 (6)
4 (6)
13 (20)
0
2 (3)
28 (21)
1 (1)
6 (4)
Первоначальный
Рецидивирующий
24 (33)
39 (53)
63 (43)
<10%
≥10%
Данные пропущены
13 (18)
1
7 (10)
1
20 (14)
2
≤12
13-15
Данные пропущены
65 (91)
1
67 (93)
1
132 (92)
1
* Исходный уровень определяли как уровень до первого введения исследуемого лекарственного средства; все пациенты должны были пройти предварительный PEX до визита исходного уровня.
§ Раса и этническая группа определялись исследователем.
В результате предварительного PEX в некоторых случаях активность ADAMTS13 на исходном уровне была выше, чем измеренная локально при регистрации. Там, где это возможно, собирали локально измеренные уровни активности ADAMTS13 при регистрации и представляли меньшее из значения на исходном уровне и значения при регистрации.
7.9 Первичная и ключевые вторичные конечные точки
Наблюдалось значительное сокращение времени до ответа в виде изменения числа тромбоцитов в группе каплацизумаба, что определяли на основании анализа Каплана-Мейера и стратифицированного логарифмического рангового критерия (фигура 1). В любой заданный момент времени у пациентов, получавших каплацизумаб, вероятность достижения ответа в виде изменения числа тромбоцитов была в 1,55 раза большей по сравнению с пациентами, получавшими лечение с помощью плацебо (показатель нормализации числа тромбоцитов 1,55; 95% CI, 1,09-2,19; P=0,01). На протяжении периода лечения исследуемым лекарственным средством лечение каплацизумабом приводило к 74% снижению количества пациентов со смертельным исходом, связанным с TTP, рецидивом TTP или большим тромбоэмболическим событием (P<0,0001, таблица 7.9). На протяжении всего периода исследования, включая 28-дневный период последующего наблюдения без лечения, 28 пациентов в группе плацебо испытали рецидив по сравнению с 9 пациентами в группе каплацизумаба, что представляло 67% снижение (P<0,001, таблица 7.9). У всех 6 пациентов в группе каплацизумаба, которые испытали рецидив ТТР на протяжении периода последующего наблюдения (т. е. рецидив через более чем 30 дней после окончания периода ежедневного плазмообмена), уровень активности ADAMTS13 составлял <10% в конце лечения исследуемым лекарственным средством, что позволяет предположить, что первопричинное заболевание было все еще активным на момент прекращения приема исследуемого лекарственного средства. Ни один из пациентов, получавших лечение каплацизумабом, не был рефрактерным к терапии, тогда как 3 пациента, получавших плацебо, были рефрактерными (P=0,057). Лечение каплацизумабом также было связано с тенденцией к более быстрой нормализации уровней 3 маркеров повреждения органов: LDH, cTnI и сывороточного креатинина.
Таблица 7.9. Первичная и ключевые вторичные конечные точки эффективности в популяции, сформированной в соответствии с назначенным лечением
(N=72)
(N=73)
Время до ответа: каплацизумаб в сравнении с плацебо
Показатель нормализации числа тромбоцитов (95% CI)
P-значение
0,01
По меньшей мере одно из указанных ниже событий при лечении исследуемым лекарственным средством в слепом режиме - количество (%)
Смертельный исход, связанный с TTP
Большое тромбоэмболическое событие
Рецидив (обострение) TTP
0
6 (8,5)
3 (4,2)
3 (4,1)
6 (8,2)
28 (38,4)
При приеме исследуемого лекарственного средства в слепом режиме (обострение)
На протяжении периода последующего наблюдения (рецидив)
3 (4,2)
6 (9,1)
28 (38,4)
0
Медианное время - дни (95% CI)
* Рецидив определяли как новое снижение числа тромбоцитов после первоначальной нормализации числа тромбоцитов, что приводит к необходимости возобновления PEX. Согласно общепринятой терминологии рецидивы в рамках периода 30 дней после окончания периода ежедневного PEX являются обострениями, тогда как рецидивы, происходящие более чем через 30 дней после окончания периода ежедневного PEX, называются рецидивами (Scully et al., 2017, J Thromb Haemost 5:312-22).
§ Для этой конечной точки рефрактерность определяли как отсутствие удвоения числа тромбоцитов после 4 дней лечения и уровень LDH, превышающий нормальные уровни (Benhamou et al. 2015 J Thromb Haemost 13:293-302).
7.10 Активность ADAMTS13 во взаимосвязи с рецидивом
Обострение. Из 145 пациентов, рандомизированных в настоящем исследовании Hercules, 129 достигли ответа в виде изменения числа тромбоцитов и завершили период ежедневного плазмообмена (65 в группе каплацизумаба и 64 в группе плацебо). Через неделю после окончания периода ежедневного плазмообмена активность ADAMTS13 вернулась к уровню, превышающему 10%, у 42% (54/129) пациентов, но осталась подавленной на уровне ниже 10% у остальных 58% (75/129). В общей сложности обострение испытал 31 пациент, у 2 из которых активность ADAMTS13 нормализовалась, а у 29 было неустраненное первопричинное заболевание, о чем свидетельствуют уровни активности ADAMTS13<10% (фигура 2, панель A).
Рецидив . Данные об уровнях активности ADAMTS13 в конце лечения исследуемым лекарственным средством были доступны для 120 пациентов (60 в конце лечения каплацизумабом в двойном слепом режиме, 34 в конце лечения с помощью плацебо в двойном слепом режиме и 26 в конце лечения каплацизумабом в открытом режиме). Из этих пациентов 74% (89/120) характеризовались нормализованными уровнями активности ADAMTS13 к моменту прекращения лечения. Ни один из этих пациентов не страдал от рецидива в течение 28-дневного последующего наблюдения после окончания лечения исследуемым лекарственным средством. Другие 26% (31/120) пациентов все еще характеризовались подавленной активностью ADAMTS13 на момент прекращения лечения исследуемым лекарственным средством. В общей сложности 9 из этого 31 пациента страдали от рецидива в последующие 28 дней, при этом 6 из 9 после окончания лечения каплацизумабом в двойном слепом режиме и 3 из 9 после окончания лечения каплацизумабом в открытом режиме (фигура 2, панель B) (см. пример 7.13).
7.11 Получение характеристик и исходы у пациентов с aTTP с первоначальным или рецидивирующим заболеванием
Предпосылки. Приобретенная тромботическая тромбоцитопеническая пурпура (аТТР) является опасным для жизни аутоиммунным нарушением свертывания крови. Пациенты подвергаются риску значительной заболеваемости и смерти во время каждого эпизода. Данные об эффективности и безопасности у пациентов с aTTP получали в исследовании каплацизумаба Hercules фазы III (Scully et al., Blood 2017 130:LBA-1).
Цели. Получение характеристик проявления заболевания и оценка исходов лечения у пациентов, включенных в исследование HERCULES, с первоначальным или рецидивирующим эпизодом aTTP.
Способы. Демографические показатели, характеристики заболевания на исходном уровне и исходы лечения (время до ответа в виде изменения числа тромбоцитов, смертность, рецидив, большие тромбоэмболические события (TE) и рефрактерность) оценивали для обеих подгрупп с использованием обобщенных описаний. Число тромбоцитов, уровни LDH и уровни сердечного тропонина I определяли в соответствии со стандартными способами (см. подробное описание).
Результаты. Были рандомизированы 145 пациентов - 82 с первоначальным эпизодом aTTP и 63 с рецидивирующим заболеванием. Демографические показатели в целом были сбалансированными между группами, тогда как характеристики заболевания на исходном уровне были более тяжелыми при первоначальных эпизодах по сравнению с рецидивирующими: среднее число тромбоцитов (28,8×109/л в сравнении с 44,4×109/л), средний уровень LDH (598 ед/л в сравнении с 523 ед/л) и медианный уровень сердечного тропонина I (0,119 мкг/л в сравнении с 0,036 мкг/л). Время с момента проявления первых симптомов до диагностирования также было более длительным у тех, кто испытывал первоначальный эпизод (6,5 дня) по сравнению с рецидивирующим (3,9 дня). В группе каплацизумаба у большего количества пациентов наблюдался первый эпизод аТТР (66,7%) по сравнению с группой плацебо (46,6%). Лечение каплацизумабом приводило к улучшению исходов [т. е. более короткому времени до ответа в виде изменения числа тромбоцитов, более низкой доле пациентов со смертельным исходом, рецидивом или большим TE-событием на протяжении периода лечения, более низкой частоте рецидивов на протяжении всего периода исследования и предупреждению рефрактерности] в обеих подгруппах по сравнению с плацебо (см. таблицу 7.11 в отношении подробных результатов).
Выводы. У пациентов с первоначальным эпизодом aTTP наблюдается позднее проявление и более тяжелое заболевание на исходном уровне, чем у пациентов с рецидивирующим заболеванием. Лечение каплацизумабом приводит к улучшению исходов в обеих подгруппах.
Таблица 7.11. Исходы, свидетельствующие об эффективности, в соответствии с предыдущим эпизодом TTP (популяция с назначенным лечением)
N=48*
N=34
N=24
N=39
Показатель скорости
нормализации числа тромбоцитов (95% CI)
* Процентные значения приведены на основании результатов для 47 пациентов (1 субъект отозвал свое согласие до начала лечения исследуемым лекарственным средством).
7.12 Лечение приобретенной TTP нанотелом, направленным против vWF, приводит к значительному сокращению использования ресурсов здравоохранения
Предпосылки. Оценивали эффективность и безопасность каплацизумаба, представляющего собой нанотело, направленное против фактора фон Виллебранда (vWF), при лечении приобретенной тромботической тромбоцитопенической пурпуры (aTTP) (Scully et al., Blood 2017 130:LBA-1).
Цели. Исследование эффекта лечения каплацизумабом в отношении использования ресурсов здравоохранения: параметров плазмообмена (PE), количества дней, проводимых в больнице и в отделении интенсивной терапии (ICU).
Способы. Объем и количество дней проведения PE, количество дней пребывания в больнице и ICU обобщали и сравнивали между группами каплацизумаба и плацебо на протяжении всего периода лечения исследуемым лекарственным средством, используя нормальную аппроксимацию критерия суммы рангов Уилкоксона.
Результаты. В исследовании Hercules рандомизировали 145 пациентов - 73 для получения плацебо и 72 для получения каплацизумаба. Лечение каплацизумабом приводило к более быстрой нормализации числа тромбоцитов, предупреждению обострений и предупреждению появления у пациентов рефрактерности к лечению. Это отражалось в 38% сокращении среднего (± SE) количества дней проведения PE в группе каплацизумаба (n=71) по сравнению с группой плацебо (n=73): 5,8 (± 0,51) дня в сравнении с 9,4 (± 0,81) дня (p<0,001). Средний (± SE) общий объем плазмообмена аналогичным образом снижался на 41%: 21,3 (± 1,6) л в сравнении с 35,9 (± 4,2) л (p<0,001). Средняя продолжительность госпитализации (± SE) уменьшалась на 31% в группе каплацизумаба (n=71) по сравнению с группой плацебо (n=73): 9,9 (± 0,7) дня в сравнении с 14,4 (± 0,7) дня (p=0,0025).
Треть пациентов была госпитализирована в ICU (28 пациентов в группе каплацизумаба и 27 пациентов в группе плацебо). В группе каплацизумаба среднее (± SE) количество дней, проводимых в ICU, сократилось на 65%: 3,4 (± 0,4) дня в сравнении с 9,7 (± 2,1) дня (p=0,0098).
Выводы. Каплацизумаб благодаря быстрому блокированию адгезии тромбоцитов, опосредованной vWF, представляет собой новое средство лечения aTTP. Лечение каплацизумабом приводит к улучшению исходов, что отражается в значительном сокращении использования ресурсов здравоохранения.
7.13 Эффективность и безопасность каплацизумаба в открытом режиме у пациентов с обострениями aTTP
Предпосылки. Эффективность и безопасность каплацизумаба у пациентов с приобретенной тромботической тромбоцитопенической пурпурой (aTTP) была продемонстрирована в одностороннем слепом исследовании фазы 2 (Peyvandi et al., 2016 N Engl J Med 374:511-522) и подтверждена в двойном слепом исследовании фазы 3 (Scully et al., Blood 2017 130:LBA-1).
Цели. В данном документе авторы настоящего изобретения представляют результаты исследования эффективности и безопасности у пациентов, получавших каплацизумаб в открытом режиме (OL).
Способы. В случае рецидива на протяжении периода лечения в двойном слепом режиме (DB) пациентов переводили на каплацизумаб OL вместе с возобновлением ежедневного плазмообмена (PEX) и подавлением иммунного ответа с сохранением при этом ослепления при первоначальном назначении лечения. Число тромбоцитов определяли согласно стандартным способам (см. подробное описание). Активность ADAMTS13 определяли, как описано в примере 7.7.
Результаты. 31 пациент испытывал обострение на протяжении периода DB - 28 в группе плацебо и 3 в группе каплацизумаба. 28 из них переводили на лечение каплацизумабом OL (26 из 28 пациентов, получающих лечение с помощью плацебо, и 2 из 3 пациентов, получающих лечение каплацизумабом). Ко дню 6 81% пациентов, получающих каплацизумаб OL, достигали подтвержденного ответа в виде изменения числа тромбоцитов (т.е. числа тромбоцитов ≥150×109/л, подтвержденного при прекращении ежедневного PE в рамках периода 5 дней). Смертельные исходы отсутствовали. Один пациент (3,6%) испытывал обострение TTP, и 1 пациент (3,6%) испытывал большое тромбоэмболическое событие (тромбоз полой вены) на протяжении периода лечения OL. После окончания лечения OL у 3 пациентов наблюдался рецидив TTP, и все 3 характеризовались активностью ADAMTS13<10%, когда лечение было прекращено. Профиль безопасности в группе каплацизумаба OL соответствовал профилю безопасности, наблюдаемому в группе каплацизумаба DB. В общей сложности у 25 пациентов (89,3%) сообщалось о по меньшей мере одном нежелательном явлении, возникающем после начала лечения.
Выводы. Терапия каплацизумабом в открытом режиме была эффективной у пациентов, испытывавших обострение aTTP. Профиль безопасности соответствовал наблюдаемому на протяжении периода лечения в двойном слепом режиме (см. пример 7.14).
7.14 Весь период исследования: безопасность и иммуногенность
Ввиду используемого плана исследования Hercules (который включал перевод на лечение каплацизумабом в открытом режиме в случае рецидива ТТР при приеме исследуемого лекарственного средства в двойном слепом режиме) и того, что почти все рецидивы наблюдались в группе плацебо (см. пример 7.13), медианная продолжительность воздействия была большей в группе каплацизумаба, чем в группе плацебо: 35 (диапазон от 1 до 65) в сравнении с 23 (диапазон от 2 до 66) днями.
На протяжении всего периода исследования у 69 пациентов (97,2%) в группе каплацизумаба и 71 пациента (97,3%) в группе плацебо сообщалось о по меньшей мере одном нежелательном явлении. Нежелательные явления рассматривались исследователем как по меньшей мере возможно связанные с исследуемым лекарственным средством у 41 пациента (57,7%) в группе каплацизумаба и 32 пациентов (43,8%) в группе плацебо.
У четырех пациентов нежелательное явление приводило к смерти в ходе исследования: у 1 (1,4%) в группе каплацизумаба (в течение периода последующего наблюдения без лечения, и оно рассматривалось исследователем как не связанное с исследуемым лекарственным средством) и у 3 (4,1%) в группе плацебо (во всех случаях в течение периода лечения исследуемым лекарственным средством).
На протяжении всего периода исследования о серьезных нежелательных явлениях сообщалось у 28 пациентов (39,4%) в группе каплацизумаба и 39 пациентов (53,4%) в группе плацебо. Согласно протоколу о рецидивах должно было сообщаться как о серьезных нежелательных явлениях, и в количественном отношении они были основным фактором в группе плацебо. Серьезные нежелательные явления рассматривались исследователем как по меньшей мере возможно связанные с исследуемым лекарственным средством у 10 пациентов (14,1%) в группе каплацизумаба и 4 пациентов (5,5%) в группе плацебо.
У пяти пациентов в группе каплацизумаба и 9 субъектов в группе плацебо сообщалось о нежелательном явлении, приводящем к досрочному прекращению приема исследуемого лекарственного средства.
О нежелательных явлениях, связанных с кровотечением, сообщалось у 46 пациентов (64,8%) в группе каплацизумаба и у 35 пациентов (47,9%) в группе плацебо. Наиболее частыми были носовое кровотечение и кровоточивость десен; все они устранялись, большинство из них без вмешательства. Эти явления были легкими или умеренными у большинства пациентов и тяжелыми у 3 пациентов, получавших каплацизумаб, и 1 пациента, получавшего плацебо. О серьезных нежелательных явлениях кровотечения сообщалось у 8 пациентов (11,3%), получавших каплацизумаб, и у одного пациента (1,4%), получавшего плацебо. Серьезным нежелательным явлением кровотечения, о котором сообщалось наиболее часто, было носовое кровотечение - у 4 пациентов в группе каплацизумаба.
Антитела к лекарственному средству, индуцированные лекарственным средством, вырабатывались у 3,1% пациентов, получавших лечение каплацизумабом. У этих пациентов не наблюдалось влияние на клиническую эффективность и не сообщалось о серьезных нежелательных явлениях (см. пример 7.21).
7.15. Фармакодинамические параметры каплацизумаба
Взаимодействие каплацизумаба с vWF является высокоспецифичным, и связывание каплацизумаба с доменом A1 vWF не влияет на способность vWF взаимодействовать с фактором свертывания крови VIII (FVIII), для которого vWF выполняет функцию носителя. Аналогичным образом, избирательное связывание каплацизумаба не влияет на способность vWF взаимодействовать с фибриллярными коллагенами, коллагеном VI типа или ADAMTS13. Более того, каплацизумаб не вступает в перекрестную реакцию с эритроцитами или тромбоцитами. Ввиду этой высокой специфичности в доклинических исследованиях и клинических испытаниях нецелевые эффекты не предполагались и не наблюдались.
Уровни общего (свободного+в комплексе с лекарственным средством) vWF, активность ристоцетинового кофактора (RICO) и уровни FVIII измеряли у здоровых добровольцев после внутривенного или подкожного введения однократных нарастающих доз и ежедневного подкожного введения многократных доз 10 мг и у пациентов с аТТР после многократного введения один раз в день подкожно вводимых доз 10 мг или плацебо, которое следовало за первоначальным введением 10 мг внутривенной болюсной дозы или плацебо.
7.15.1 Антиген vWF (vWF:Ag)
На исходном уровне уровни vWF:Ag были более высокими у пациентов с аTTP, чем у здоровых субъектов. В клинических исследованиях, проводимых с каплацизумабом, средние (± стандартное отклонение [SD]) уровни vWF:Ag в плазме крови составляли 38,5 ± 10,9 нМ у здоровых субъектов и 70,5 ± 30,0 нМ у пациентов с аТТР. Лечение каплацизумабом оказывало влияние на распределение vWF, что приводило к временному снижению общих уровней циркулирующего vWF:Ag. Этот эффект обращался вспять в среднем в рамках периода 2-7 дней после введения заключительной дозы у здоровых добровольцев и пациентов с аTTP (фигура 3).
Временное уменьшение общих уровней vWF:Ag объяснялось более быстрым выведением комплекса лекарственное средство-мишень по сравнению со свободной мишенью.
7.15.2 RIPA/RICO
Анализы агрегации тромбоцитов, индуцированной ристоцетином (RIPA), и RICO представляют собой анализы in vitro для оценки способности vWF, присутствующего в крови, связываться с тромбоцитами. Методика анализов RIPA и RICO основана на добавлении ристоцетина к плазме крови в присутствии тромбоцитов, что вызывает агглютинацию тромбоцитов. Антибиотик ристоцетин активирует vWF в той же степени, что и условия кровотока с высокой скоростью сдвига, и, следовательно, модулирует связывание vWF с рецептором тромбоцитов GP1b. Поскольку агрегация тромбоцитов in vitro может блокироваться взаимодействием каплацизумаба с vWF, эти способы выбирали для оценки активности каплацизумаба в ходе лечения. На полное ингибирование каплацизумабом адгезии тромбоцитов, опосредованной vWF, указывало уменьшение RIPA или активности RICO до уровня ниже 10% или 20% соответственно. Полное стабильное ингибирование мишени в течение по меньшей мере 24 часов наблюдалось после введения однократной подкожно вводимой дозы ≥10 мг у здоровых добровольцев. Эта подкожно вводимая доза 10 мг, даваемая ежедневно, также вызывала полное ингибирование адгезии тромбоцитов, опосредованной vWF, у пациентов с аТТР на протяжении всего периода лечения (фигура 4). Во всех клинических исследованиях активность RICO восстанавливалась до исходных значений в рамках периода 7 дней после досрочного прекращения приема исследуемого лекарственного средства.
7.15.3 FVIII
vWF выступает в качестве носителя для FVIII. Модулирование уровней общего vWF каплацизумабом также приводило к временному снижению уровней FVIII, и, как и в случае с vWF, восстановление уровней FVIII до нормальных диапазонов наблюдалось в рамках периода 2-7 дней после введения заключительной дозы у здоровых добровольцев и пациентов с аТТР.
7.15.4 Исследования QT/QTc
В неклинических исследованиях эффект в отношении сердечно-сосудистой системы не наблюдался. В завершенных исследованиях с участием людей не было свидетельств клинически значимых результатов электрокардиографии (ECG) (см. пример 7.13).
С учетом молекулярной структуры и размера каплацизумаба, его специфичности в отношении мишени и отсутствия склонности к отрицательному влиянию на сердечно-сосудистую систему in vivo не предполагалось, что каплацизумаб будет обеспечивать удлинение интервала QT.
Это не наблюдалось.
7.16 Фармакокинетические параметры каплацизумаба
Уровни концентраций общего (свободного+связанного с мишенью) каплацизумаба измеряли в плазме крови здоровых добровольцев и пациентов с аТТР. Полные фармакокинетические профили получали у здоровых субъектов после внутривенных инфузий однократных нарастающих доз и однократного и повторного введения подкожно вводимых доз (фигура 5). У пациентов с аТТР в испытаниях фазы II и фазы III получали выборочные образцы плазмы крови. Фармакокинетический профиль каплацизумаба исследовали с помощью стандартного некомпартментного анализа (NCA) у здоровых добровольцев и в популяционных фармакокинетических анализах у здоровых добровольцев и пациентов с аТТР.
После повторного ежедневного подкожного введения 10 мг равновесное состояние быстро достигалось, начиная со второго введения лекарственного средства, с ограниченным накоплением каплацизумаба в зависимости от экспрессии мишени vWF:Ag.
7.16.1 Всасывание
Основные параметры воздействия, оцениваемые с помощью стандартных некомпартментных способов после введения однократной дозы у здоровых добровольцев или прогнозируемые в модели в равновесном состоянии у пациентов с аТТР, приведены в таблицах 7.16.1A и 7.16.1B. После однократного введения дозы степень (площадь под кривой; AUC) и скорость воздействия (максимальные концентрации; Cmax) увеличивались с введенной дозой, но не пропорционально. После подкожного введения 10 мг Cmax каплацизумаба достигалась через 4 часа после введения дозы. Абсолютная биодоступность, определяемая в популяционном фармакокинетическом анализе, по оценкам составляла 90% у пациентов с аТТР и была близкой к 100% у здоровых добровольцев.
Таблица 7.16.1A. Фармакокинетические параметры после однократного внутривенного или подкожного введения 10 мг каплацизумаба у здоровых добровольцев
(n=8)
(n=8)
AUCinf: площадь под кривой зависимости концентрации от времени, экстраполированная до бесконечности; Cmax: максимальная концентрация; SD: стандартное отклонение; Tmax: время до Cmax.
Таблица 7.16.1B. Смоделированные средние фармакокинетические параметры воздействия в равновесном состоянии (AUC, Cmax, Cmin и Cavg) и соответствующий фармакодинамический эффект (изменение уровня vWF:Ag относительно исходного уровня) после 40 дней ежедневного подкожного введения 10 мг каплацизумаба у пациентов с аТТР
aTTP: приобретенная тромботическая тромбоцитопеническая пурпура; AUCτ: площадь под кривой зависимости концентрации от времени в интервале между введениями доз; Cavg: средняя концентрация; Cmax: максимальная концентрация; Cmin: минимальная концентрация; vWF:Ag: антиген фактора фон Виллебранда.
7.16.2 Распределение и метаболизм
Фармакокинетические параметры каплацизумаба представлены двухфазным профилем в плазме крови. Центральный объем распределения у здоровых добровольцев и пациентов с аТТР по оценкам с помощью популяционной фармакокинетической модели составлял соответственно 5,35 и 6,33 л, тогда как периферический объем распределения по оценкам составлял 27 л.
Доклинические исследования на яванских макаках показали, что в системном кровотоке каплацизумаб связывает vWF и нейтрализует его активность в течение пяти минут. Комплекс каплацизумаб-vWF, основная циркулирующая форма каплацизумаба, распределяется в печень и, аналогично несвязанному vWF, быстро катаболизируется ретикулоэндотелиальной системой. Доклинические исследования позволили предположить, что избыток несвязанного каплацизумаба распределяется в другие хорошо перфузируемые органы/ткани, где он разлагается в результате высокоэффективного неспецифического катаболизма. Свободный каплацизумаб с MW 28 кДа может фильтроваться через клубочек, хотя и не свободно. Вклад почек в общее выведение небольших белков зависел от протеолитической активности в других участках организма. Для каплацизумаба доля введенной дозы, выделяющаяся с мочой, была пренебрежимо малой (<0,5%).
7.16.3 Выведение
Кажущийся клиренс каплацизумаба варьировался в зависимости от введенной дозы. После введения однократной внутривенно вводимой дозы 10 мг у здоровых добровольцев согласно оценкам с использованием внемодельного способа средний клиренс составлял 769 ± 343 мл/час, а средний конечный период полувыведения составлял 19,2 ± 7,5 часа. Фармакокинетические параметры каплацизумаба после подкожного введения дозы, по-видимому, контролируются всасыванием. После введения однократной подкожно вводимой дозы 10 мг у здоровых добровольцев средний кажущийся клиренс составлял 386 ± 160 мл/час, а средний конечный период полувыведения составлял 38,5 ± 22,2 часа.
7.16.4 Пропорциональность дозе
При увеличении подкожно вводимых доз каплацизумаба от 2 до 16 мг у здоровых субъектов увеличение Cmax и AUC было менее чем пропорциональным дозе. При показателе увеличения дозы 1,0:2,0:4,0:5,0:8,0 средний показатель увеличения Cmax составлял 1,0:1,8:2,0:2,4:2,8, а среднее значение AUC увеличивалось с показателем 1,0: 3,9: 4,1: 5,3: 6,1.
Общий клиренс каплацизумаба зависел от уровней лекарственного средства и мишени и представлял собой сумму линейного (катаболического) и нелинейного (опосредованного мишенью) клиренса. Конечный период полувыведения каплацизумаба также зависел от уровня лекарственного средства и мишени. У здоровых добровольцев средний кажущийся конечный период полувыведения увеличивался с 13 до 40 часов после введения однократной внутривенно вводимой дозы (от 0,5 до 12 мг) и с 11 до 53 часов после однократного подкожного введения (от 2 до 16 мг).
7.16.5 Эффект демографических факторов и размера тела
Популяционный фармакокинетический анализ у пациентов с aTTP показал, что возраст, пол, раса и группа крови не влияют на фармакокинетические параметры каплацизумаба. Масса тела и почечная функция, выражающаяся клиренсом креатинина (CrCL), оказывали статистически значимый эффект на фармакокинетические параметры с предполагаемым более сильным воздействием у пациентов с меньшей массой тела и CrCL.
Однако предполагаемый диапазон воздействия в популяциях пациентов с крайними значениями этих ковариат в значительной степени перекрывался, как показано в таблице 7.16.5, и не считалась необходимой никакая особенная корректировка дозы. Исходные уровни vWF оказывали статистически значимый эффект на воздействие лекарственного средства, но увеличенное воздействие лекарственного средства у пациентов с повышенным уровнем vWF не приводило к другому фармакодинамическому эффекту (изменению относительно исходного уровня vWF), и индивидуальная корректировка дозы не считалась необходимой (см. также примеры 7.16.6 и 7.18).
Таблица 7.16.5. Смоделированные медианные фармакокинетические параметры воздействия в равновесном состоянии (AUC, Cmax, Cmin) и соответствующий фармакодинамический эффект (изменение уровня vWF:Ag относительно исходного уровня) после 40 дней ежедневного подкожного введения 10 мг каплацизумаба у пациентов с аТТР с низкой массой тела, высокими исходными уровнями vWF и низким CrCL.
aTTP: приобретенная тромботическая тромбоцитопеническая пурпура; AUCτ: площадь под кривой зависимости концентрации от времени в интервале между введениями доз; BW: масса тела; Cavg: средняя концентрация; Cmax: максимальная концентрация; Cmin: минимальная концентрация; CrCL: клиренс креатинина; vWF: фактор фон Виллебранда; vWF:Ag: антиген фактора фон Виллебранда.
7.16.6 Фармакокинетические параметры в особых популяциях
Формальное исследование каплацизумаба у пациентов с тяжелой острой или хронической печеночной недостаточностью не проводилось, и не было доступных данных относительно применения каплацизумаба в этих популяциях. Риск, связанный с применением каплацизумаба у пациентов с легкой и умеренной печеночной недостаточностью, считался сходным с риском в общей популяции пациентов, поскольку предполагается, что комплекс каплацизумаб-vWF выводится через активированные клетки Купфера, а не через поврежденную печеночноклеточную паренхиму. Однако каплацизумаб следует применять с осторожностью у пациентов с тяжелой печеночной недостаточностью, представляющей повышенный риск кровотечения.
Формальное исследование эффекта почечной недостаточности в отношении фармакокинетических параметров каплацизумаба не проводилось. В популяционной фармакокинетическо-фармакодинамической модели почечная функция (исходный CrCL, диапазон: от 11,9 до >120 мл/минута) обладала статистически значимым эффектом, который приводил к ограниченному увеличению прогнозируемого воздействия (AUCss) при тяжелой почечной недостаточности. В клинических исследованиях с участием пациентов с аТТР у пациентов со сниженной почечной функцией не был продемонстрирован дополнительный риск нежелательных явлений.
7.16.7 Взаимодействия между лекарственными средствами
Исследование взаимодействия между лекарственными средствами in vitro для каплацизумаба не проводилось, поскольку предполагалось, что нанотела в виде фрагментов антител, представляющих собой одиночные вариабельные домены, катаболизируются под действием убиквитарных протеолитических ферментов и не взаимодействуют непосредственно с изоформами цитохрома P450 или другими метаболизирующими ферментами или переносчиками. Хотя модулирование цитокинов может являться непрямым механизмом, посредством которого нанотела могут изменять экспрессию CYP, взаимодействия между лекарственными средствами, опосредованные цитокинами и связанные с CYP, являются маловероятными для каплацизумаба: не предполагается, что Nanobody® обладает иммуномодулирующими свойствами, поскольку оно избирательно нацеливается на vWF.
Лечение aTTP зачастую предусматривает применение кортикостероидов и ритуксимаба с аспирином и гепарином с низкой MW, иногда применяемым в качестве профилактики тромбоза. Реже применяли винкристин, циклофосфамид или циклоспорин при рефрактерном заболевании. Как известно, все эти соединения, за исключением ритуксимаба, интенсивно выводятся печенью через CYP-опосредованные пути, тогда как путь почечного клиренса является лишь второстепенным путем, и взаимодействие между лекарственным средством и нанотелом не ожидается, если эти виды лечения начинают в комбинации с каплацизумабом. Что касается других моноклональных антител, то разложение ритуксимаба происходит посредством неспецифического высокоэффективного протеолиза без предполагаемого потенциала взаимодействия между лекарственными средствами.
Каплацизумаб избирательно и специфично ингибирует домен А1 vWF. In vitro каплацизумаб лишь частично конкурировал с гепарином за связывание с vWF. In vivo фармакодинамические взаимодействия между совместно вводимыми гепарином и каплацизумабом не предполагались как клинически значимые, поскольку основной целевой эффект гепарина опосредуется связыванием с ингибитором ферментов антитромбином III.
7.16.8 Зависимость доза-эффект
Исследования с участием здоровых добровольцев после введения однократных нарастающих внутривенно вводимых доз и однократного и повторного введения подкожно вводимых доз подтвердили предполагаемый фармакологический эффект и безопасность каплацизумаба.
7.17 Эффект PE в отношении фармакокинетических параметров и фармакодинамических параметров каплацизумаба
Предпосылки. В ходе клинических испытаний у пациентов с приобретенной тромботической тромбоцитопенической пурпурой каплацизумаб вводили в виде внутривенно вводимой (i.v.) болюсной дозы 10 мг перед плазмообменом (PE), а затем ежедневных подкожно вводимых (s.c.) доз 10 мг на протяжении периода ежедневного PE и в течение по меньшей мере 30 дней после него.
Цели . Исследовали потенциальный эффект различных временных интервалов между первым i.v. болюсным введением и последующим PE, а также эффект различных схем PE.
Способы. Разрабатывали интегрированную фармакокинетическо-фармакодинамическую (PK)/(PD) модель для описания взаимодействия между каплацизумабом и vWF с помощью нелинейного моделирования со смешанными эффектами, которую использовали для имитационного моделирования полученных в результате PK- и PD-параметров для различных предварительно определенных сценариев:
(1) начало PE через 3, 5, 11, 23 часа после введения i.v. болюсной дозы 10 мг каплацизумаба;
(2) схема PE: один раз в день и два раза в день (BID) в первый день или на протяжении 7 дней.
Результаты. Данные клинических испытаний указывали на полную нейтрализацию активности vWF при концентрациях каплацизумаба в плазме крови ≥ 500 нг/мл. Имитационное моделирование позволяло предположить, что медианные уровни каплацизумаба в плазме крови останутся превышающими это пороговое значение, если РЕ будет начинаться в рамках периода до 5 часов после введения i.v. болюсной дозы каплацизумаба. При более длительных задержках медианные уровни каплацизумаба в плазме крови могут упасть ниже 500 нг/мл, и дополнительная s.c. доза 10 мг перед PE может обеспечивать сохранение эффективного воздействия лекарственного средства.
Имитационное моделирование эффекта PE BID на протяжении 7 дней позволяло предположить, что схема введения s.c. доз каплацизумаба на протяжении периода PE может быть скорректирована с введением s.c. доз 10 мг каплацизумаба BID после каждой лечебной процедуры PE на протяжении периода лечебных процедур PE BID.
Выводы . Эффективные уровни лекарственного средства предполагаются в случае, если PE начинают в рамках периода до 5 часов после введения первой i.v. дозы каплацизумаба. При более длительных задержках может быть предусмотрена дополнительная s.c. доза 10 мг перед PE.
В случае применения РЕ BID на протяжении 7 дней схему s.c. введения каплацизумаба можно корректировать с введением каплацизумаба BID после каждой лечебной процедуры РЕ.
7.18 Рациональное обоснование введения доз каплацизумаба у пациентов с аТТР, подтвержденное с помощью механистического PK/PD-моделирования
Цели. Для описания взаимовлияния между концентрациями каплацизумаба и его мишени, антигена фактора фон Виллебранда (vWF:Ag), после лечения в различных популяциях взрослых субъектов. Разработанную модель следует использовать для имитационного моделирования гипотетических сценариев для подтверждения режима введения доз.
Способы . Анализ основывался на данных десяти исследований фазы I-III1-10 каплацизумаба с участием здоровых добровольцев (n=100), пациентов, перенесших чрескожное коронарное вмешательство (PCI) (n=225), и пациентов с приобретенной тромботической тромбоцитопенической пурпурой (n=216) с общим количеством 3629 PK- и 6295 PD-наблюдений. Большинство пациентов с аТТР получали плазмообмен (РЕ) и лечение иммунодепрессантами в качестве стандарта оказания медицинской помощи. В данных представлен широкий диапазон уровней доз, схем лечения и РЕ. Включены данные после как i.v., так и s.c. введения.
Популяционный PK/PD-анализ проводили путем нелинейного моделирования со смешанными эффектами с использованием NONMEM версии 7.3.0. Модель разрабатывали поэтапно. Изначально для разработки модели использовали подмножество из набора данных, включающего данные от здоровых добровольцев и пациентов с PCI. Впоследствии модель обновляли для описания специфических характеристик, связанных с состоянием заболевания аТТР и стандартом оказания медицинской помощи РЕ, в подмножестве из набора данных от пациентов с аТТР. Эффекты возраста, пола, расы, группы крови, массы тела, клиренса креатинина и сопутствующего лечения оценивали на основе графической оценки с помощью стратифицированных визуальных оценок предсказательной способности модели после корректировки прогноза и одномерной оценки в NONMEM.
Имитационное моделирование осуществляли с использованием окончательной модели для пациентов с аТТР, чтобы оценить эффект изменения доз, массы тела пациента, необходимости корректировки дозы у педиатрических пациентов.
Результаты. Взаимодействие между каплацизумабом и vWF:Ag адекватно описывалось с помощью полной модели распределения лекарственного средства, опосредованного мишенью. Модель включала в себя двухкомпонентную модель распределения лекарственного средства с параллельными медленными и быстрыми процессами всасывания первого порядка и линейным выведением свободного лекарственного средства первого порядка. Модель описывала образование комплексов лекарственное средство-vWF со способностью образовывать как димеры, так и тримеры. Продуцирование и созревание vWF описывалось переходными компартментами и накоплением vWF в пуловом компартменте, что имитирует накопление в тельцах Вайбеля-Паладе в эндотелии с последующим быстрым высвобождением и выведением свободного vWF. Период полувыведения свободного vWF привязывали к известному из литературы значению 16 часов (Lenting et al. 2015 Blood 26: 2019-2028; Favaloro et al. 2007 Thromb Haemost 97: 922-930; Dobrkovska et al. 1998 Haemophilia 4: 33-39; Goudemand et al. 2005 J Thromb Haemost 3: 2219-2227). Был включен механизм двойной обратной связи, стимулирующий скорость продуцирования и высвобождения vWF из пула в случаях, когда уровень vWF уменьшался ниже исходного уровня у субъекта.
Для пациентов с аТТР прогрессирование заболевания регистрировали как временное повышение уровня vWF:Ag с течением времени, а эффект PE описывали как параллельное удаление свободного vWF, свободного лекарственного средства и комплекса лекарственное средство-vWF. Типичная для популяции общая скорость выведения в условиях РЕ по оценкам была в 3,7 раза более высокой для свободного лекарственного средства, в 3,5 раза более высокой для свободного vWF и в 1,7 раза более высокой для комплекса лекарственное средство-vWF.
Массу тела включали в модель аллометрически (с фиксированными экспонентами), и у пациентов с аТТР клиренс креатинина идентифицировали как статистически значимую ковариату с незначительным снижением клиренса для пациентов с CRCL ниже медианного CRCL (100 мл/минута).
Эту модель успешно применяли для имитационного моделирования гипотетических сценариев для подтверждения режима введения доз, введения доз в особых популяциях и того, как поступать с пропущенными дозами. Имитационное моделирование также осуществляли для получения информации о режиме введения доз у педиатрических пациентов и для прогнозирования PK/PD-поведения у японских пациентов с aTTP на основании различий в размере тела. Также проводили имитационное моделирование, чтобы узнать больше о влиянии исходных концентраций vWF:Ag, а также об эффекте схем PE с точки зрения временных рамок, интенсивности и продолжительности.
Выводы . Разрабатывали полумеханистическую популяционную PK/PD-модель для описания взаимодействия между каплацизумабом и vWF (на основании наблюдений vWF:Ag). Модель адекватно описывала взаимодействие в комплексе лекарственное средство-vWF в динамике по времени, в том числе прогрессирование заболевания у пациентов с aTTP и эффекты, определяемые лечебными процедурами РЕ. Модель успешно применялась для улучшения понимания PK/PD-взаимовлияния между каплацизумабом и vWF в целевой популяции и благодаря использованию имитационного моделирования подтверждала рациональное обоснование введения доз как у взрослых, так и у педиатрических пациентов, а также обеспечивала возможность переноса данных исследования на японских пациентов с aTTP.
7.19 Рекомендации по введению доз на основании модели каплацизумаба у педиатрических пациентов с приобретенной тромботической тромбоцитопенической пурпурой
Предпосылки. Приобретенная тромботическая тромбоцитопеническая пурпура (аТТР) является редким и опасным для жизни аутоиммунным нарушением свертывания крови с гораздо более низкой частотой встречаемости у детей по сравнению со взрослыми. Каплацизумаб оценивали в рандомизированных клинических испытаниях фазы 2 и фазы 3 у взрослых пациентов с аТТР.
Цели . Поскольку педиатрические пациенты не были включены в клинические испытания каплацизумаба, то рекомендации по введению доз для этой популяции разрабатывали с помощью имитационного моделирования на основе построения модели.
Способы . Была разработана полумеханистическая фармакокинетическо-фармакодинамическая (PK/PD) популяционная модель, описывающая взаимодействие между каплацизумабом и антигеном фактора фон Виллебранда (vWF:Ag) после внутривенного и подкожного введения каплацизумаба в различных популяциях взрослых субъектов при различных уровнях доз, с помощью нелинейного моделирования со смешанными эффектами. Осуществляли имитационное моделирование на основе построения аллометрически масштабированной PK/PD-модели для установления подходящего режима введения доз у подростков и детей в возрасте >2 лет. Определяли восемь возрастных категорий, включающих 1000 человек в каждой категории, и соответствующие индивидуальные показатели массы тела отбирали из базы данных Национальной программы проверки здоровья и питания. Смоделированные уровни воздействия каплацизумаба в различных возрастных категориях сравнивали с прогнозируемыми у взрослых.
Результаты. Имитационное моделирование воздействия указывает на то, что ежедневное введение постоянной дозы 10 мг будет приводить к более сильному воздействию у детей с низкой массой тела, в первую очередь у детей в возрасте до 10 лет. Корректировка дозы до 5 мг ежедневно для детей с массой тела <40 кг будет приводить к в среднем сходному воздействию во всех возрастных и весовых группах. Также согласно прогнозу введение доз, скорректированных по массе тела, приводит к подавлению vWF:Ag с высокой степенью сходства среди различных возрастных групп.
Выводы . Рекомендуемая доза для подростков в возрасте 12-18 лет при массе тела ≥40 кг составляет 10 мг, а при массе тела <40 кг - 5 мг. Поскольку на основании различий в возрасте не предполагаются никакие различия в подавлении vWF:Ag, такая же рекомендация по введению доз применима для детей в возрасте 2-12 лет: 10 мг, если масса тела составляет ≥40 кг, и 5 мг, если она составляет <40 кг.
7.20 Доказательства, полученные в условиях реальной клинической практики, у пациентов с аТТР, получавших лечение каплацизумабом в рамках программы управляемого предоставления недоступных препаратов
Предпосылки. Приобретенная тромботическая тромбоцитопеническая пурпура (aTTP) представляет собой опасную для жизни иммуноопосредованную тромботическую микроангиопатию (TMA). Эффективность и безопасность каплацизумаба у пациентов с aTTP были показаны в рандомизированных клинических испытаниях.
Цели. Авторы настоящего изобретения описательно сообщают о первом доказательстве, полученном в условиях реальной клинической практики применения каплацизумаба у пациентов с аТТР в ходе программы управляемого предоставления недоступных препаратов (MAP).
Способы. Критерии пригодности к участию в MAP были следующими: (i) у пациента был эпизод aTTP, который (ii) нельзя было удовлетворительным образом лечить одобренными терапевтическими средствами; (iii) у пациента не было известной гиперчувствительности к активному веществу или любому из вспомогательных средств и (iv) отсутствовала беременность. Доступ к каплацизумабу предоставлялся в соответствии с законами и нормативными требованиями, действующими в стране, в которой был запрошен продукт. Запрашивающий врач должен был сообщать о событиях, связанных с безопасностью, в соответствии со всеми применимыми национальными законодательными актами о фармакологическом надзоре.
Результаты. С 14го мая 2018 года по 22е января 2019 года было получено 118 запросов на участие в MAP, из которых 75 были одобрены, 7 были отклонены, 35 не были исполнены или были отозваны запрашивающей стороной, а 1 находился на стадии оценки. Что касается одобренных запросов, 67 пациентов получали лечение каплацизумабом, при этом 8 в конечном итоге не начали терапию. Пациенты получали каплацизумаб в качестве средства терапии первой линии или для лечения aTTP с рефрактерным течением. Терапия была успешно завершена у 37 пациентов, продолжалась у 13 пациентов и была досрочно прекращена у 17 пациентов (из которых 5 умерли). Все смертельные исходы произошли у пациентов, у которых прием каплацизумаба был начат поздно, при тяжелом рефрактерном течении, и ни один из них не рассматривался как связанный с каплацизумабом. Самостоятельные отчеты о безопасности соответствовали профилю безопасности, наблюдаемому в клинических исследованиях, без новых сигналов о безопасности.
Выводы. Первые доказательства, полученные в условиях реальной клинической практики применения каплацизумаба у пациентов с aTTP, подтверждают важные преимущества каплацизумаба, наблюдаемые в клинических испытаниях, особенно в случае, когда его начинают принимать в качестве средства терапии первой линии.
7.21 Новые форматы
Применяли модифицированный анализ антител к лекарственному средству (mADA) для выявления ADA, индуцированных лекарственным средством, вырабатываемых после начала лечения. В mADA используют модифицированную молекулу каплацизумаба в качестве детекторного реагента в мостиковом формате, т.е. вариант каплацизумаб-ALA (SEQ ID NO: 24). Каплацизумаб с С-концевым аланиновым удлинением не связывал какие-либо предсуществующие антитела.
В различных экспериментах in vitro каплацизумаб и каплацизумаб с С-концевым аланиновым удлинением вели себя эквивалентно.
С помощью сравнительных анализов методом ядерного магнитного резонанса (ЯМР) 12А2Н1 (структурного элемента каплацизумаба; SEQ ID NO: 19) было продемонстрировано, что С-концевое удлинение (аланин) не влияет на конформацию нанотела в целом.
Кроме того, в анализе методом поверхностного плазмонного резонанса (SPR) был продемонстрирован сходный профиль связывания каплацизумаба и каплацизумаба с С-концевым аланиновым удлинением с мишенью (vWF).
Ввиду сходства характеристик и профилей между каплацизумабом и каплацизумабом с C-концевым удлинением предполагают, что эти соединения каплацизумаба с C-концевым удлинением также можно применять для лечения и/или предупреждения aTTP подобно каплацизумабу.
7.22 Заключение
За последние два десятилетия, несмотря на улучшение понимания патофизиологических особенностей аТТР и применение новых иммунодепрессантов, исходы лечения не изменились, при этом имеют место значительная заболеваемость и уровни смертности, которые согласно сообщениям составляют вплоть до 20% (Joly et al. 2017 Blood 129:2836-2846). Каплацизумаб, представляющий собой нанотело, направленное против домена A1 vWF, блокирует адгезию и агрегацию тромбоцитов, опосредованную vWF, и предупреждает дальнейшее потребление тромбоцитов в микротромбах, которое вызывает тяжелую тромбоцитопению и повреждение тканей и органов при аТТР.
АТТР остается клиническим диагнозом, устанавливаемым на основании анамнеза пациента, физикального обследования и анализа мазка периферической крови. Действительно, у пациентов с первоначальным эпизодом aTTP наблюдается позднее проявление и более тяжелое заболевание на исходном уровне, чем у пациентов с рецидивирующими эпизодами заболевания.
В этом исследовании пациенты с клинически диагностированной аТТР были пригодными к включению в исследование, и при рандомизации проводили подтверждающее тестирование активности ADAMTS13. Клинический диагноз подтверждали по активности ADAMTS13, составляющей менее 10% у 86% из рандомизированных пациентов. Более того, у 13 из 20 пациентов с активностью ADAMTS13, превышающей 10% на исходном уровне, было основание для диагностирования TTP, такое как TTP в анамнезе или подавленная активность ADAMTS13 в другие моменты времени на протяжении исследования.
В исследовании TITAN фазы 2 лечение каплацизумабом приводило к более быстрой нормализации числа тромбоцитов и предупреждению обострений. Тем не менее, в подгруппе пациентов с неустраненной активностью первопричинного заболевания происходили ранние рецидивы. Поэтому в текущем исследовании исследователям было рекомендовано продлить лечение исследуемым лекарственным средством в слепом режиме вместе с оптимизацией подавления иммунитета у пациентов со свидетельствами персистентной аутоиммунной активности.
Результаты исследования HERCULES фазы 3 подтвердили гипотезу о том, что лечение каплацизумабом приводит к сокращению времени до ответа в виде изменения числа тромбоцитов путем прекращения потребления тромбоцитов в микротромбах. Они также продемонстрировали клинически высокозначимое влияние каплацизумаба на смертельный исход, связанный с ТТР, рецидив ТТР или большое тромбоэмболическое событие во время лечения исследуемым лекарственным средством, а также на рецидивы в целом. Подход, заключающийся в продлении лечения исследуемым лекарственным средством и оптимизации подавления иммунного ответа у пациентов со свидетельствами неустраненного первопричинного заболевания, подтверждался результатами данного исследования, что демонстрируется по меньшему числу рецидивов после лечения исследуемым лекарственным средством по сравнению с наблюдаемым в исследовании фазы 2. Действительно, все рецидивы, наблюдаемые после прекращения приема исследуемого лекарственного средства, происходили у пациентов с активностью ADAMTS13, составляющей менее 10%. В реальной клинической ситуации для защиты таких пациентов от рецидива аТТР лечение каплацизумабом следует продлить до тех пор, пока первопричинное заболевание не будет устранено.
Было продемонстрировано, что даже в более тяжелой болезненной ситуации у пациентов, испытывающих первоначальный эпизод aTTP, лечение каплацизумабом приводило к улучшению исхода, включающему более короткое время до ответа в виде изменения числа тромбоцитов, более низкую долю пациентов со смертельным исходом, рецидивом или большим TE-событием на протяжении периода лечения, более низкую частоту рецидивов на протяжении всего периода лечения и предупреждение рефрактерности, по сравнению с плацебо.
В исследованиях как фазы 2, так и фазы 3 не сообщалось о смертельных исходах в ходе лечения каплацизумабом, что является благоприятным исходом в отношении предупреждения смертности. Кроме того, ни один из пациентов, получавших лечение каплацизумабом, не был рефрактерным к плазмообмену. Это позволяет предположить, что каплацизумаб обладает потенциалом предупреждения рефрактерности заболевания и худших исходов, о которых сообщается в этой субпопуляции. У пациентов, получавших лечение каплацизумабом, также наблюдалась тенденция к более быстрой нормализации уровней маркеров, ассоциированных с повреждением органов.
Влияние лечения каплацизумабом на время до ответа в виде изменения числа тромбоцитов и предупреждение рецидивов было связано со значительной экономией ресурсов здравоохранения.
Каплацизумаб служит препятствием для vWF, ключевого белка гемостаза, и на основании этого фармакологического эффекта он ассоциирован с повышенным риском кожно-слизистого кровотечения, подобным тому, который наблюдается при болезни фон Виллебранда (Leebeek & Eikenboom 2016 N Engl J Med 375:2067-2080). Результаты исследования безопасности соответствовали тому, о чем сообщалось ранее.
Активность ADAMTS13 становится все более значимой при контроле аТТР, поскольку она является прогностическим маркером риска рецидива (Westwood et al. 2013 J Thromb Haemost 11:481-490; Peyvandi et al. 2008 Haematologica 93:232-239; Lammle et al. 2008 Haematologica 93:172-177; Knovich et al. 2012 Eur J Haematol 88:518-525; Kremer Hovinga et al. 2010 Blood 115:1500-1511; Quiz 662; Bresin et al. 2009 Thromb Haemost 101:233-238; Cataland et al. 2009 Eur J Haematol 83:559-564; Goyal et al. 2013 J Clin Apher 28:390-394). Ее значение было подтверждено в настоящем исследовании, поскольку почти все пациенты с рецидивами характеризовались подавленной активностью ADAMTS13. Более 50% пациентов еще не достигли нормализации активности ADAMTS13 в конце периода плазмообмена, и обострения происходили в течение периода до 25 дней после окончания плазмообмена в этой группе, что подтверждает необходимость продолжения лечения каплацизумабом на протяжении по меньшей мере 30 дней после достижения ответа в виде изменения числа тромбоцитов.
Каплацизумаб благодаря быстрому блокированию адгезии тромбоцитов, опосредованной vWF, представляет собой важное дополнение к инструментарию лечения для пациентов с аТТР.
Таблица A-1. Примеры полипептидов, содержащих ISVD и CDR, направленные против vWF
(ALX 0081)
Таблица A-2
Таблица 5
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ablynx NV
<120> Способы лечения первоначального эпизода TTP с помощью одиночных
вариабельных доменов иммуноглобулинов
<130> P18-002-PCT-1
<150> US62/627,082
<151> 2018-02-06
<150> US62/662,381
<151> 2018-04-25
<160> 24
<170> PatentIn версия 3.5
<210> 1
<211> 259
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 2
<211> 259
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 2
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg
165 170 175
Asp Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 3
<211> 265
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 3
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Glu Arg Asp Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Asn Leu Lys
210 215 220
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 4
<211> 286
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 4
Gln Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Asn Leu Lys Pro Glu Gly Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 5
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 5
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Ala Ala Ala Glu Val Gln
115 120 125
Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg
130 135 140
Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly Ala Met Gly
145 150 155 160
Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala Thr Ile
165 170 175
Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu Gln Met Asn
195 200 205
Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr Ala Asn Leu
210 215 220
Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp Gly Gln Gly
225 230 235 240
Thr Gln Val Thr Val Ser Ser
245
<210> 6
<211> 253
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 6
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe
145 150 155 160
Ser Ile Gly Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg
165 170 175
Glu Leu Val Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp
180 185 190
Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr
195 200 205
Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr
210 215 220
Tyr Cys Tyr Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
245 250
<210> 7
<211> 274
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 7
Ala Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Leu Ala Ser Gly Arg Ile Phe Ser Ile Gly
20 25 30
Ala Met Gly Met Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Thr Ile Thr Ser Gly Gly Ser Thr Asn Tyr Ala Asp Pro Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Gly Pro Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Tyr
85 90 95
Ala Asn Leu Lys Gln Gly Ser Tyr Gly Tyr Arg Phe Asn Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
145 150 155 160
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Leu Ala
165 170 175
Ser Gly Arg Ile Phe Ser Ile Gly Ala Met Gly Met Tyr Arg Gln Ala
180 185 190
Pro Gly Lys Gln Arg Glu Leu Val Ala Thr Ile Thr Ser Gly Gly Ser
195 200 205
Thr Asn Tyr Ala Asp Pro Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
210 215 220
Gly Pro Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu
225 230 235 240
Asp Thr Ala Val Tyr Tyr Cys Tyr Ala Asn Leu Lys Gln Gly Ser Tyr
245 250 255
Gly Tyr Arg Phe Asn Asp Tyr Trp Gly Gln Gly Thr Gln Val Thr Val
260 265 270
Ser Ser
<210> 8
<211> 259
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 8
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg
165 170 175
Asp Val Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala
180 185 190
Arg Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 9
<211> 265
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 9
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Glu Arg Asp Val Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ala Leu Lys
210 215 220
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 10
<211> 286
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 10
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ala Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ala Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Asp Val Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ala Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 11
<211> 259
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 12
<211> 259
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 12
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Val Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala
180 185 190
Arg Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser
<210> 13
<211> 265
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 13
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 14
<211> 265
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Ser Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 15
<211> 265
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
130 135 140
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala
145 150 155 160
Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln
165 170 175
Ala Pro Gly Lys Gly Arg Glu Val Val Ala Ala Ile Ser Arg Thr Gly
180 185 190
Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly Arg Phe Thr Ile Ser
195 200 205
Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln Met Asn Ser Leu Arg
210 215 220
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala
225 230 235 240
Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu Tyr Asn Phe Trp Gly
245 250 255
Gln Gly Thr Gln Val Thr Val Ser Ser
260 265
<210> 16
<211> 286
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 16
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 17
<211> 286
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Ser Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 18
<211> 286
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val
145 150 155 160
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
165 170 175
Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn Pro Met
180 185 190
Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Val Val Ala Ala
195 200 205
Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Ala Arg Ser Val Glu Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala
245 250 255
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
260 265 270
Tyr Asn Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
275 280 285
<210> 19
<211> 128
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
<210> 20
<211> 2804
<212> БЕЛОК
<213> Homo sapiens
<400> 20
Met Ile Pro Ala Arg Phe Ala Gly Val Leu Leu Ala Leu Ala Leu Ile
1 5 10 15
Leu Pro Gly Thr Leu Cys Ala Glu Gly Thr Arg Gly Arg Ser Ser Thr
20 25 30
Ala Arg Cys Ser Leu Phe Gly Ser Asp Phe Val Asn Thr Phe Asp Gly
35 40 45
Ser Met Tyr Ser Phe Ala Gly Tyr Cys Ser Tyr Leu Leu Ala Gly Gly
50 55 60
Cys Gln Lys Arg Ser Phe Ser Ile Ile Gly Asp Phe Gln Asn Gly Lys
65 70 75 80
Arg Val Ser Leu Ser Val Tyr Leu Gly Glu Phe Phe Asp Ile His Leu
85 90 95
Phe Val Asn Gly Thr Val Thr Gln Gly Asp Gln Arg Val Ser Met Pro
100 105 110
Tyr Ala Ser Lys Gly Leu Tyr Leu Glu Thr Glu Ala Gly Tyr Tyr Lys
115 120 125
Leu Ser Gly Glu Ala Tyr Gly Phe Val Ala Arg Ile Asp Gly Ser Gly
130 135 140
Asn Phe Gln Val Leu Leu Ser Asp Arg Tyr Phe Asn Lys Thr Cys Gly
145 150 155 160
Leu Cys Gly Asn Phe Asn Ile Phe Ala Glu Asp Asp Phe Met Thr Gln
165 170 175
Glu Gly Thr Leu Thr Ser Asp Pro Tyr Asp Phe Ala Asn Ser Trp Ala
180 185 190
Leu Ser Ser Gly Glu Gln Trp Cys Glu Arg Ala Ser Pro Pro Ser Ser
195 200 205
Ser Cys Asn Ile Ser Ser Gly Glu Met Gln Lys Gly Leu Trp Glu Gln
210 215 220
Cys Gln Leu Leu Lys Ser Thr Ser Val Phe Ala Arg Cys His Pro Leu
225 230 235 240
Val Asp Pro Glu Pro Phe Val Ala Leu Cys Glu Lys Thr Leu Cys Glu
245 250 255
Cys Ala Gly Gly Leu Glu Cys Ala Cys Pro Ala Leu Leu Glu Tyr Ala
260 265 270
Arg Thr Cys Ala Gln Glu Gly Met Val Leu Tyr Gly Trp Thr Asp His
275 280 285
Ser Ala Cys Ser Pro Val Cys Pro Ala Gly Met Glu Tyr Arg Gln Cys
290 295 300
Val Ser Pro Cys Ala Arg Thr Cys Gln Ser Leu His Ile Asn Glu Met
305 310 315 320
Cys Gln Glu Arg Cys Val Asp Gly Cys Ser Cys Pro Glu Gly Gln Leu
325 330 335
Leu Asp Glu Gly Leu Cys Val Glu Ser Thr Glu Cys Pro Cys Val His
340 345 350
Ser Gly Lys Arg Tyr Pro Pro Gly Thr Ser Leu Ser Arg Asp Cys Asn
355 360 365
Thr Cys Ile Cys Arg Asn Ser Gln Trp Ile Cys Ser Asn Glu Glu Cys
370 375 380
Pro Gly Glu Cys Leu Val Thr Gly Gln Ser His Phe Lys Ser Phe Asp
385 390 395 400
Asn Arg Tyr Phe Thr Phe Ser Gly Ile Cys Gln Tyr Leu Leu Ala Arg
405 410 415
Asp Cys Gln Asp His Ser Phe Ser Ile Val Ile Glu Thr Val Gln Cys
420 425 430
Ala Asp Asp Arg Asp Ala Val Cys Thr Arg Ser Val Thr Val Arg Leu
435 440 445
Pro Gly Leu His Asn Ser Leu Val Lys Leu Lys His Gly Ala Gly Val
450 455 460
Ala Met Asp Gly Gln Asp Ile Gln Leu Pro Leu Leu Lys Gly Asp Leu
465 470 475 480
Arg Ile Gln His Thr Val Thr Ala Ser Val Arg Leu Ser Tyr Gly Glu
485 490 495
Asp Leu Gln Met Asp Trp Asp Gly Arg Gly Arg Leu Leu Val Lys Leu
500 505 510
Ser Pro Val Tyr Ala Gly Lys Thr Cys Gly Leu Cys Gly Asn Tyr Asn
515 520 525
Gly Asn Gln Gly Asp Asp Phe Leu Thr Pro Ser Gly Leu Ala Glu Pro
530 535 540
Arg Val Glu Asp Phe Gly Asn Ala Trp Lys Leu His Gly Asp Cys Gln
545 550 555 560
Asp Leu Gln Lys Gln His Ser Asp Pro Cys Ala Leu Asn Pro Arg Met
565 570 575
Thr Arg Phe Ser Glu Glu Ala Cys Ala Val Leu Thr Ser Pro Thr Phe
580 585 590
Glu Ala Cys His Arg Ala Val Ser Pro Leu Pro Tyr Leu Arg Asn Cys
595 600 605
Arg Tyr Asp Val Cys Ser Cys Ser Asp Gly Arg Glu Cys Leu Cys Gly
610 615 620
Ala Leu Ala Ser Tyr Ala Ala Ala Cys Ala Gly Arg Gly Val Arg Val
625 630 635 640
Ala Trp Arg Glu Pro Gly Arg Cys Glu Leu Asn Cys Pro Lys Gly Gln
645 650 655
Val Tyr Leu Gln Cys Gly Thr Pro Cys Asn Leu Thr Cys Arg Ser Leu
660 665 670
Ser Tyr Pro Asp Glu Glu Cys Asn Glu Ala Cys Leu Glu Gly Cys Phe
675 680 685
Cys Pro Pro Gly Leu Tyr Met Asp Glu Arg Gly Asp Cys Val Pro Lys
690 695 700
Ala Gln Cys Pro Cys Tyr Tyr Asp Gly Glu Ile Phe Gln Pro Glu Asp
705 710 715 720
Ile Phe Ser Asp His His Thr Met Cys Tyr Cys Glu Asp Gly Phe Met
725 730 735
His Cys Thr Met Ser Gly Val Pro Gly Ser Leu Leu Pro Asp Ala Val
740 745 750
Leu Ser Ser Pro Leu Ser His Arg Ser Lys Arg Ser Leu Ser Cys Arg
755 760 765
Pro Pro Met Val Lys Leu Val Cys Pro Ala Asp Asn Leu Arg Ala Glu
770 775 780
Gly Leu Glu Cys Thr Lys Thr Cys Gln Asn Tyr Asp Leu Glu Cys Met
785 790 795 800
Ser Met Gly Cys Val Ser Gly Cys Leu Cys Pro Pro Gly Met Val Arg
805 810 815
His Glu Asn Arg Cys Val Ala Leu Glu Arg Cys Pro Cys Phe His Gln
820 825 830
Gly Lys Glu Tyr Ala Pro Gly Glu Thr Val Lys Ile Gly Cys Asn Thr
835 840 845
Cys Val Cys Arg Asp Arg Lys Trp Asn Cys Thr Asp His Val Cys Asp
850 855 860
Ala Thr Cys Ser Thr Ile Gly Met Ala His Tyr Leu Thr Phe Asp Gly
865 870 875 880
Leu Lys Tyr Leu Phe Pro Gly Glu Cys Gln Tyr Val Leu Val Gln Asp
885 890 895
Tyr Cys Gly Ser Asn Pro Gly Thr Phe Arg Ile Leu Val Gly Asn Lys
900 905 910
Gly Cys Ser His Pro Ser Val Lys Cys Lys Lys Arg Val Thr Ile Leu
915 920 925
Val Glu Gly Gly Glu Ile Glu Leu Phe Asp Gly Glu Val Asn Val Lys
930 935 940
Arg Pro Met Lys Asp Glu Thr His Phe Glu Val Val Glu Ser Gly Arg
945 950 955 960
Tyr Ile Ile Leu Leu Leu Gly Lys Ala Leu Ser Val Val Trp Asp Arg
965 970 975
His Leu Ser Ile Ser Val Val Leu Lys Gln Thr Tyr Gln Glu Lys Val
980 985 990
Cys Gly Leu Cys Gly Asn Phe Asp Gly Ile Gln Asn Asn Asp Leu Thr
995 1000 1005
Ser Ser Asn Leu Gln Val Glu Glu Asp Pro Val Asp Phe Gly Asn
1010 1015 1020
Ser Trp Lys Val Ser Ser Gln Cys Ala Asp Thr Arg Lys Val Pro
1025 1030 1035
Leu Asp Ser Ser Pro Ala Thr Cys His Asn Asn Ile Met Lys Gln
1040 1045 1050
Thr Met Val Asp Ser Ser Cys Arg Ile Leu Thr Ser Asp Val Phe
1055 1060 1065
Gln Asp Cys Asn Lys Leu Val Asp Pro Glu Pro Tyr Leu Asp Val
1070 1075 1080
Cys Ile Tyr Asp Thr Cys Ser Cys Glu Ser Ile Gly Asp Cys Ala
1085 1090 1095
Cys Phe Cys Asp Thr Ile Ala Ala Tyr Ala His Val Cys Ala Gln
1100 1105 1110
His Gly Lys Val Val Thr Trp Arg Thr Ala Thr Leu Cys Pro Gln
1115 1120 1125
Ser Cys Glu Glu Arg Asn Leu Arg Glu Asn Gly Tyr Glu Cys Glu
1130 1135 1140
Trp Arg Tyr Asn Ser Cys Ala Pro Ala Cys Gln Val Thr Cys Gln
1145 1150 1155
His Pro Glu Pro Leu Ala Cys Pro Val Gln Cys Val Glu Gly Cys
1160 1165 1170
His Ala His Cys Pro Pro Gly Lys Ile Leu Asp Glu Leu Leu Gln
1175 1180 1185
Thr Cys Val Asp Pro Glu Asp Cys Pro Val Cys Glu Val Ala Gly
1190 1195 1200
Arg Arg Phe Ala Ser Gly Lys Lys Val Thr Leu Asn Pro Ser Asp
1205 1210 1215
Pro Glu His Cys Gln Ile Cys His Cys Asp Val Val Asn Leu Thr
1220 1225 1230
Cys Glu Ala Cys Gln Glu Pro Gly Gly Leu Val Val Pro Pro Thr
1235 1240 1245
Asp Ala Pro Val Ser Pro Thr Thr Leu Tyr Val Glu Asp Ile Ser
1250 1255 1260
Glu Pro Pro Leu His Asp Phe Tyr Cys Ser Arg Leu Leu Asp Leu
1265 1270 1275
Val Phe Leu Leu Asp Gly Ser Ser Arg Leu Ser Glu Ala Glu Phe
1280 1285 1290
Glu Val Leu Lys Ala Phe Val Val Asp Met Met Glu Arg Leu Arg
1295 1300 1305
Ile Ser Gln Lys Trp Val Arg Val Ala Val Val Glu Tyr His Asp
1310 1315 1320
Gly Ser His Ala Tyr Ile Gly Leu Lys Asp Arg Lys Arg Pro Ser
1325 1330 1335
Glu Leu Arg Arg Ile Ala Ser Gln Val Lys Tyr Ala Gly Ser Gln
1340 1345 1350
Val Ala Ser Thr Ser Glu Val Leu Lys Tyr Thr Leu Phe Gln Ile
1355 1360 1365
Phe Ser Lys Ile Asp Arg Pro Glu Ala Ser Arg Ile Ala Leu Leu
1370 1375 1380
Leu Met Ala Ser Gln Glu Pro Gln Arg Met Ser Arg Asn Phe Val
1385 1390 1395
Arg Tyr Val Gln Gly Leu Lys Lys Lys Lys Val Ile Val Ile Pro
1400 1405 1410
Val Gly Ile Gly Pro His Ala Asn Leu Lys Gln Ile Arg Leu Ile
1415 1420 1425
Glu Lys Gln Ala Pro Glu Asn Lys Ala Phe Val Leu Ser Ser Val
1430 1435 1440
Asp Glu Leu Glu Gln Gln Arg Asp Glu Ile Val Ser Tyr Leu Cys
1445 1450 1455
Asp Leu Ala Pro Glu Ala Pro Pro Pro Thr Leu Pro Pro His Met
1460 1465 1470
Ala Gln Val Thr Val Gly Pro Gly Leu Arg Asn Ser Met Val Leu
1475 1480 1485
Asp Val Ala Phe Val Leu Glu Gly Ser Asp Lys Ile Gly Glu Ala
1490 1495 1500
Asp Phe Asn Arg Ser Lys Glu Phe Met Glu Glu Val Ile Gln Arg
1505 1510 1515
Met Asp Val Gly Gln Asp Ser Ile His Val Thr Val Leu Gln Tyr
1520 1525 1530
Ser Tyr Met Val Thr Val Glu Tyr Pro Phe Ser Glu Ala Gln Ser
1535 1540 1545
Lys Gly Asp Ile Leu Gln Arg Val Arg Glu Ile Arg Tyr Gln Gly
1550 1555 1560
Gly Asn Arg Thr Asn Thr Gly Leu Ala Leu Arg Tyr Leu Ser Asp
1565 1570 1575
His Ser Phe Leu Val Ser Gln Gly Asp Arg Glu Gln Ala Pro Asn
1580 1585 1590
Leu Val Tyr Met Val Thr Gly Asn Pro Ala Ser Asp Glu Ile Lys
1595 1600 1605
Arg Leu Pro Gly Asp Ile Gln Val Val Pro Ile Gly Val Gly Pro
1610 1615 1620
Asn Ala Asn Val Gln Glu Leu Glu Arg Ile Gly Trp Pro Asn Ala
1625 1630 1635
Pro Ile Leu Ile Gln Asp Phe Glu Thr Leu Pro Arg Glu Ala Pro
1640 1645 1650
Asp Leu Val Leu Gln Arg Cys Cys Ser Gly Glu Gly Leu Gln Ile
1655 1660 1665
Pro Thr Leu Ser Pro Ala Pro Asp Cys Ser Gln Pro Leu Asp Val
1670 1675 1680
Ile Leu Leu Leu Asp Gly Ser Ser Ser Phe Pro Ala Ser Tyr Phe
1685 1690 1695
Asp Glu Met Lys Ser Phe Ala Lys Ala Phe Ile Ser Lys Ala Asn
1700 1705 1710
Ile Gly Pro Arg Leu Thr Gln Val Ser Val Leu Gln Tyr Gly Ser
1715 1720 1725
Ile Thr Thr Ile Asp Val Pro Trp Asn Val Val Pro Glu Lys Ala
1730 1735 1740
His Leu Leu Ser Leu Val Asp Val Met Gln Arg Glu Gly Gly Pro
1745 1750 1755
Ser Gln Ile Gly Asp Ala Leu Gly Phe Ala Val Arg Tyr Leu Thr
1760 1765 1770
Ser Glu Met His Gly Ala Arg Pro Gly Ala Ser Lys Ala Val Val
1775 1780 1785
Ile Leu Val Thr Asp Val Ser Val Asp Ser Val Asp Ala Ala Ala
1790 1795 1800
Asp Ala Ala Arg Ser Asn Arg Val Thr Val Phe Pro Ile Gly Ile
1805 1810 1815
Gly Asp Arg Tyr Asp Ala Ala Gln Leu Arg Ile Leu Ala Gly Pro
1820 1825 1830
Ala Gly Asp Ser Asn Val Val Lys Leu Gln Arg Ile Glu Asp Leu
1835 1840 1845
Pro Thr Met Val Thr Leu Gly Asn Ser Phe Leu His Lys Leu Cys
1850 1855 1860
Ser Gly Phe Val Arg Ile Cys Met Asp Glu Asp Gly Asn Glu Lys
1865 1870 1875
Arg Pro Gly Asp Val Trp Thr Leu Pro Asp Gln Cys His Thr Val
1880 1885 1890
Thr Cys Gln Pro Asp Gly Gln Thr Leu Leu Lys Ser His Arg Val
1895 1900 1905
Asn Cys Asp Arg Gly Leu Arg Pro Ser Cys Pro Asn Ser Gln Ser
1910 1915 1920
Pro Val Lys Val Glu Glu Thr Cys Gly Cys Arg Trp Thr Cys Pro
1925 1930 1935
Cys Val Cys Thr Gly Ser Ser Thr Arg His Ile Val Thr Phe Asp
1940 1945 1950
Gly Gln Asn Phe Lys Leu Thr Gly Ser Cys Ser Tyr Val Leu Phe
1955 1960 1965
Gln Asn Lys Glu Gln Asp Leu Glu Val Ile Leu His Asn Gly Ala
1970 1975 1980
Cys Ser Pro Gly Ala Arg Gln Gly Cys Met Lys Ser Ile Glu Val
1985 1990 1995
Lys His Ser Ala Leu Ser Val Glu Leu His Ser Asp Met Glu Val
2000 2005 2010
Thr Val Asn Gly Arg Leu Val Ser Val Pro Tyr Val Gly Gly Asn
2015 2020 2025
Met Glu Val Asn Val Tyr Gly Ala Ile Met His Glu Val Arg Phe
2030 2035 2040
Asn His Leu Gly His Ile Phe Thr Phe Thr Pro Gln Asn Asn Glu
2045 2050 2055
Phe Gln Leu Gln Leu Ser Pro Lys Thr Phe Ala Ser Lys Thr Tyr
2060 2065 2070
Gly Leu Cys Gly Ile Cys Asp Glu Asn Gly Ala Asn Asp Phe Met
2075 2080 2085
Leu Arg Asp Gly Thr Val Thr Thr Asp Trp Lys Thr Leu Val Gln
2090 2095 2100
Glu Trp Thr Val Gln Arg Pro Gly Gln Thr Cys Gln Pro Ile Leu
2105 2110 2115
Glu Glu Gln Cys Leu Val Pro Asp Ser Ser His Cys Gln Val Leu
2120 2125 2130
Leu Leu Pro Leu Phe Ala Glu Cys His Lys Val Leu Ala Pro Ala
2135 2140 2145
Thr Phe Tyr Ala Ile Cys Gln Gln Asp Ser Cys His Gln Glu Gln
2150 2155 2160
Val Cys Glu Val Ile Ala Ser Tyr Ala His Leu Cys Arg Thr Asn
2165 2170 2175
Gly Val Cys Val Asp Trp Arg Thr Pro Asp Phe Cys Ala Met Ser
2180 2185 2190
Cys Pro Pro Ser Leu Val Tyr Asn His Cys Glu His Gly Cys Pro
2195 2200 2205
Arg His Cys Asp Gly Asn Val Ser Ser Cys Gly Asp His Pro Ser
2210 2215 2220
Glu Gly Cys Phe Cys Pro Pro Asp Lys Val Met Leu Glu Gly Ser
2225 2230 2235
Cys Val Pro Glu Glu Ala Cys Thr Gln Cys Ile Gly Glu Asp Gly
2240 2245 2250
Val Gln His Gln Phe Leu Glu Ala Trp Val Pro Asp His Gln Pro
2255 2260 2265
Cys Gln Ile Cys Thr Cys Leu Ser Gly Arg Lys Val Asn Cys Thr
2270 2275 2280
Thr Gln Pro Cys Pro Thr Ala Lys Ala Pro Thr Cys Gly Leu Cys
2285 2290 2295
Glu Val Ala Arg Leu Arg Gln Asn Ala Asp Gln Cys Cys Pro Glu
2300 2305 2310
Tyr Glu Cys Val Cys Asp Pro Val Ser Cys Asp Leu Pro Pro Val
2315 2320 2325
Pro His Cys Glu Arg Gly Leu Gln Pro Thr Leu Thr Asn Pro Gly
2330 2335 2340
Glu Cys Arg Pro Asn Phe Thr Cys Ala Cys Arg Lys Glu Glu Cys
2345 2350 2355
Lys Arg Val Ser Pro Pro Ser Cys Pro Pro His Arg Leu Pro Thr
2360 2365 2370
Leu Arg Lys Thr Gln Cys Cys Asp Glu Tyr Glu Cys Ala Cys Asn
2375 2380 2385
Cys Val Asn Ser Thr Val Ser Cys Pro Leu Gly Tyr Leu Ala Ser
2390 2395 2400
Thr Ala Thr Asn Asp Cys Gly Cys Thr Thr Thr Thr Cys Leu Pro
2405 2410 2415
Asp Lys Val Cys Val His Arg Ser Thr Ile Tyr Pro Val Gly Gln
2420 2425 2430
Phe Trp Glu Glu Gly Cys Asp Val Cys Thr Cys Thr Asp Met Glu
2435 2440 2445
Asp Ala Val Met Gly Leu Arg Val Ala Gln Cys Ser Gln Lys Pro
2450 2455 2460
Cys Glu Asp Ser Cys Arg Ser Gly Phe Thr Tyr Val Leu His Glu
2465 2470 2475
Gly Glu Cys Cys Gly Arg Cys Leu Pro Ser Ala Cys Glu Val Val
2480 2485 2490
Thr Gly Ser Pro Arg Gly Asp Ser Gln Ser Ser Trp Lys Ser Val
2495 2500 2505
Gly Ser Gln Trp Ala Ser Pro Glu Asn Pro Cys Leu Ile Asn Glu
2510 2515 2520
Cys Val Arg Val Lys Glu Glu Val Phe Ile Gln Gln Arg Asn Val
2525 2530 2535
Ser Cys Pro Gln Leu Glu Val Pro Val Cys Pro Ser Gly Phe Gln
2540 2545 2550
Leu Ser Cys Lys Thr Ser Ala Cys Cys Pro Ser Cys Arg Cys Glu
2555 2560 2565
Arg Met Glu Ala Cys Met Leu Asn Gly Thr Val Ile Gly Pro Gly
2570 2575 2580
Lys Thr Val Met Ile Asp Val Cys Thr Thr Cys Arg Cys Met Val
2585 2590 2595
Gln Val Gly Val Ile Ser Gly Phe Lys Leu Glu Cys Arg Lys Thr
2600 2605 2610
Thr Cys Asn Pro Cys Pro Leu Gly Tyr Lys Glu Glu Asn Asn Thr
2615 2620 2625
Gly Glu Cys Cys Gly Arg Cys Leu Pro Thr Ala Cys Thr Ile Gln
2630 2635 2640
Leu Arg Gly Gly Gln Ile Met Thr Leu Lys Arg Asp Glu Thr Leu
2645 2650 2655
Gln Asp Gly Cys Asp Thr His Phe Cys Lys Val Asn Glu Arg Gly
2660 2665 2670
Glu Tyr Phe Trp Glu Lys Arg Val Thr Gly Cys Pro Pro Phe Asp
2675 2680 2685
Glu His Lys Cys Leu Ala Glu Gly Gly Lys Ile Met Lys Ile Pro
2690 2695 2700
Gly Thr Cys Cys Asp Thr Cys Glu Glu Pro Glu Cys Asn Asp Ile
2705 2710 2715
Thr Ala Arg Leu Gln Tyr Val Lys Val Gly Ser Cys Lys Ser Glu
2720 2725 2730
Val Glu Val Asp Ile His Tyr Cys Gln Gly Lys Cys Ala Ser Lys
2735 2740 2745
Ala Met Tyr Ser Ile Asp Ile Asn Asp Val Gln Asp Gln Cys Ser
2750 2755 2760
Cys Cys Ser Pro Thr Arg Thr Glu Pro Met Gln Val Ala Leu His
2765 2770 2775
Cys Thr Asn Gly Ser Val Val Tyr His Glu Val Leu Asn Ala Met
2780 2785 2790
Glu Cys Lys Cys Ser Pro Arg Lys Cys Ser Lys
2795 2800
<210> 21
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR1
<400> 21
Tyr Asn Pro Met Gly
1 5
<210> 22
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR2
<400> 22
Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Glu
1 5 10 15
Gly
<210> 23
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CDR3
<400> 23
Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro Ser Glu
1 5 10 15
Tyr Thr Phe
<210> 24
<211> 260
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность нанотела
<400> 24
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Tyr Asn
20 25 30
Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg Glu Leu Val
35 40 45
Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg Met Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg Thr Leu Pro
100 105 110
Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
115 120 125
Ala Ala Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe
145 150 155 160
Ser Tyr Asn Pro Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Gly Arg
165 170 175
Glu Leu Val Ala Ala Ile Ser Arg Thr Gly Gly Ser Thr Tyr Tyr Pro
180 185 190
Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Arg
195 200 205
Met Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Ala Ala Gly Val Arg Ala Glu Asp Gly Arg Val Arg
225 230 235 240
Thr Leu Pro Ser Glu Tyr Thr Phe Trp Gly Gln Gly Thr Gln Val Thr
245 250 255
Val Ser Ser Ala
260
<---
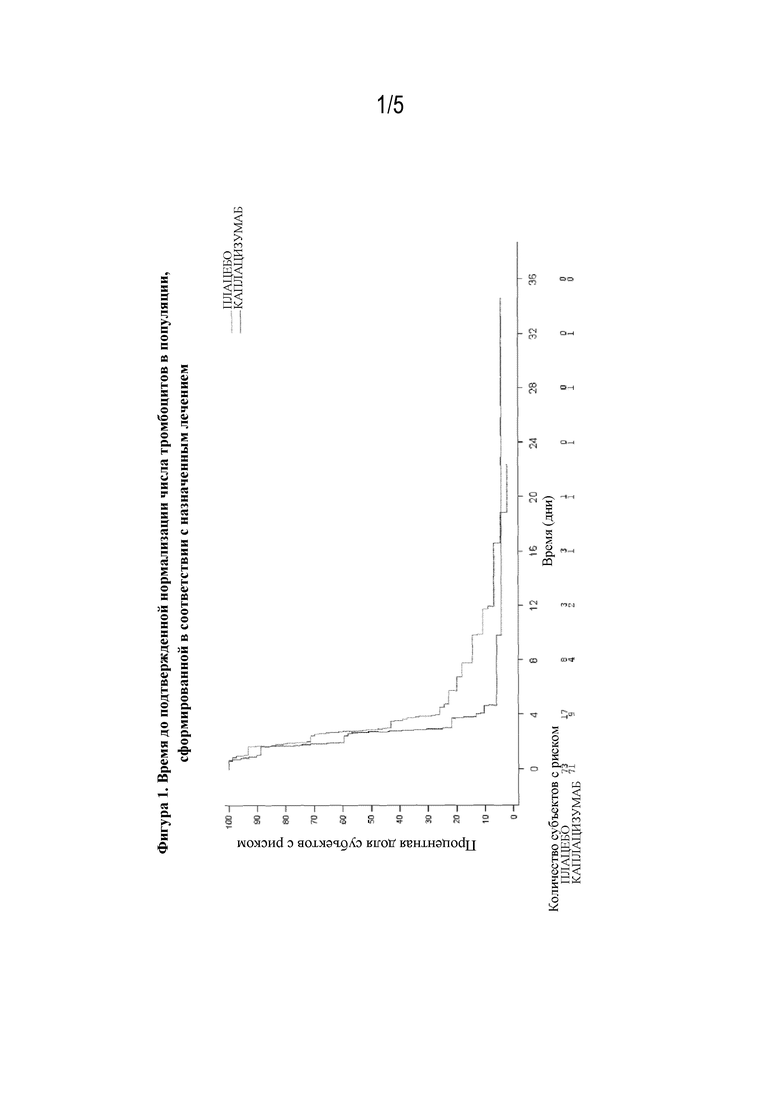
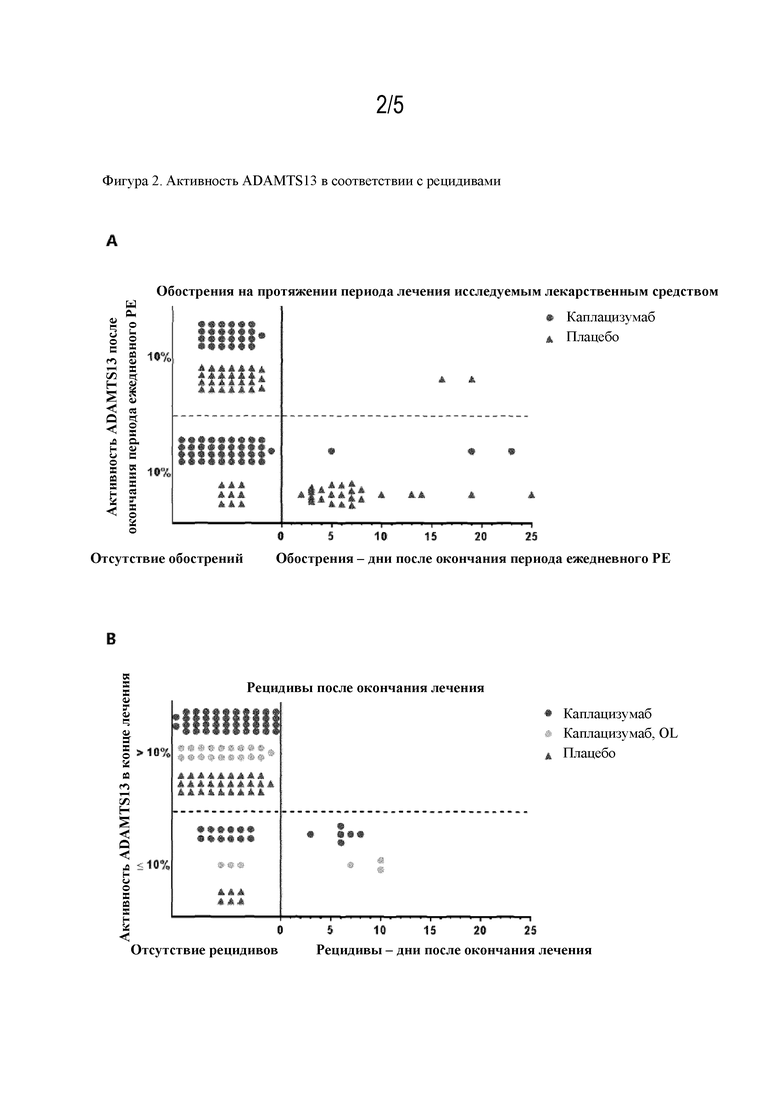
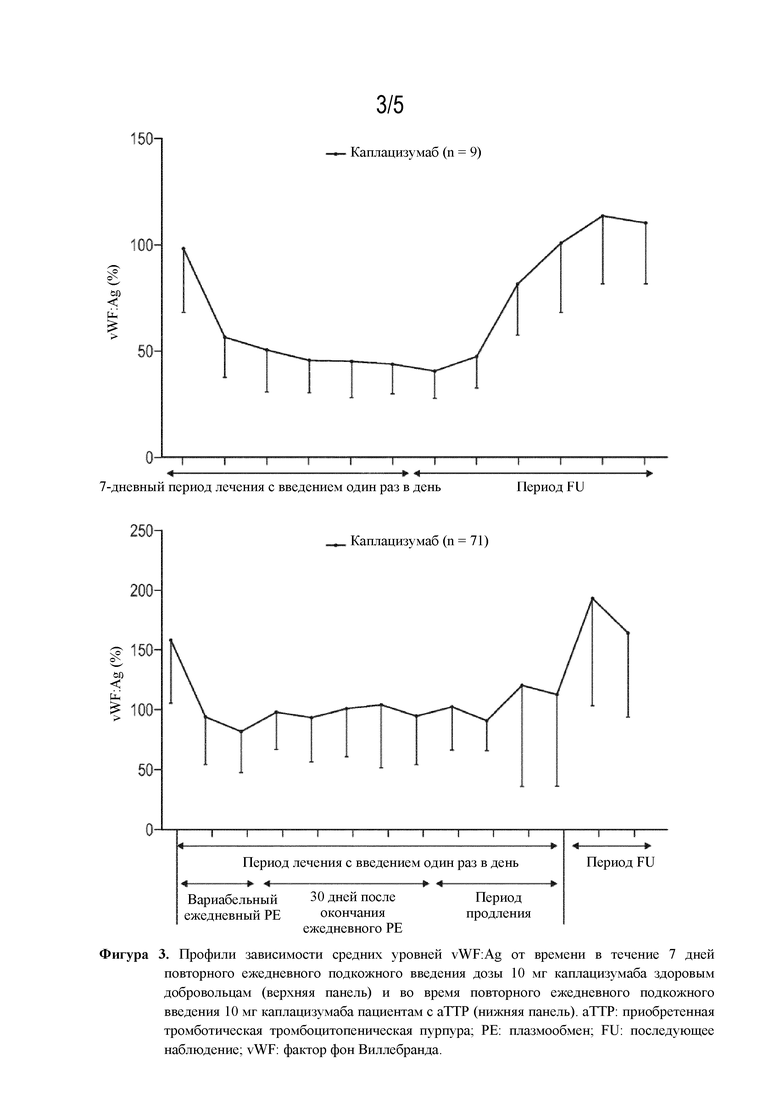
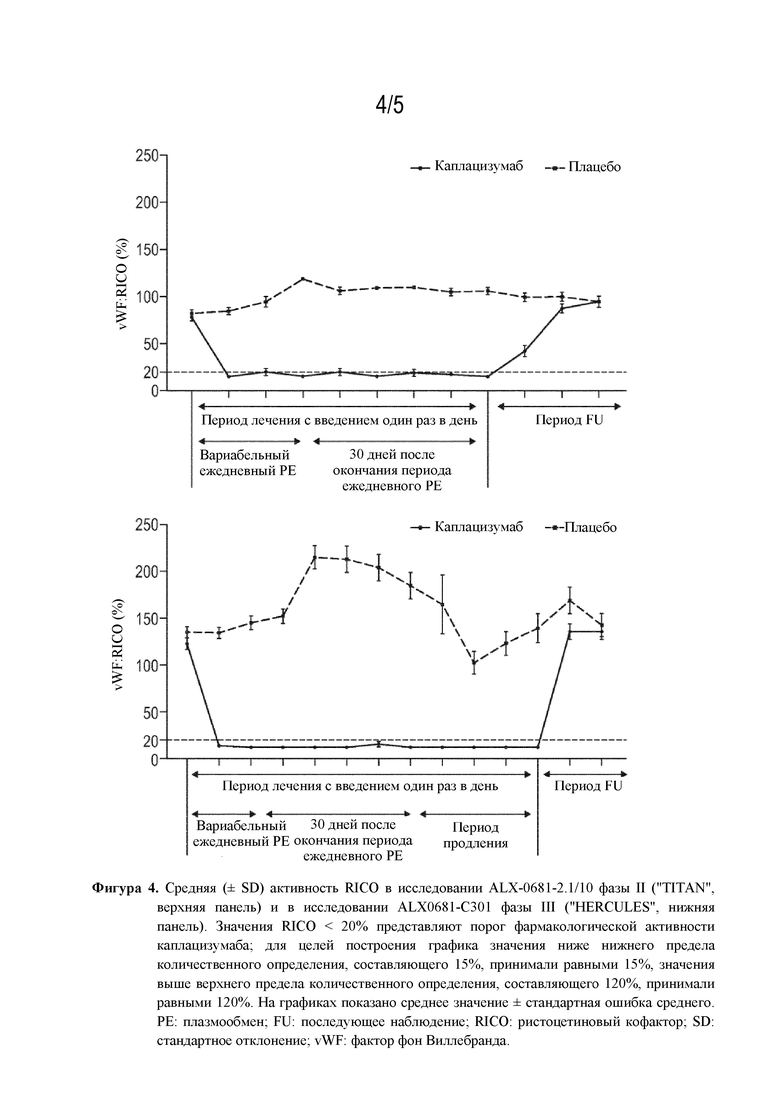
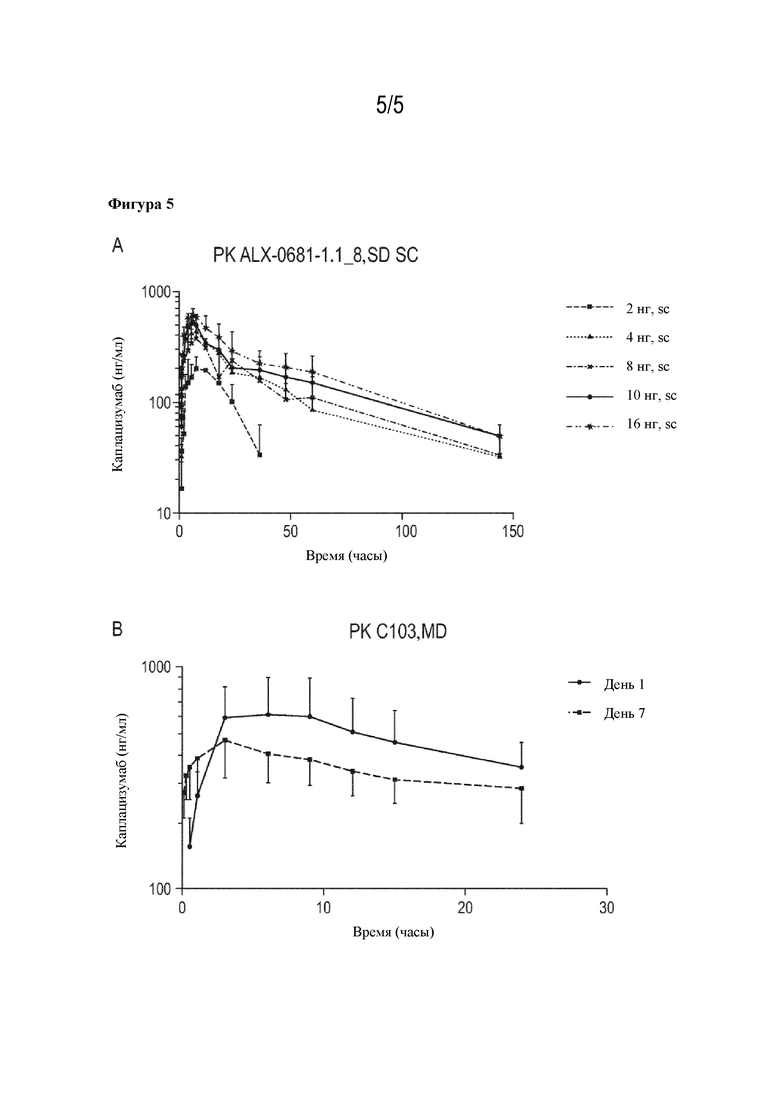
Настоящее изобретение относится к иммунологии и медицине, в частности к способу лечения симптомов первоначального эпизода заболевания, связанного с vWF, в частности тромбоцитопенической пурпуры (ТТР), а также применению набора, содержащего контейнер, содержащий полипептид, содержащий два одиночных вариабельных домена иммуноглобулина (ISVD), и инструкции по применению, где каждый ISVD, направленный против человеческого vWF, представлен под SEQ ID NO: 19, для лечения симптомов первоначального эпизода ТТР. Настоящее изобретение обеспечивает эффективное лечение первоначального эпизода ТТР, который является более тяжёлым и трудноизлечимым в отличие от рецидивирующего эпизода. 2 н. и 14 з.п. ф-лы, 5 ил., 10 табл., 22 пр.
1. Способ лечения симптомов первоначального эпизода заболевания, связанного с vWF, у человека, который включает введение человеку дозы 5 или 10 мг полипептида, содержащего два одиночных вариабельных домена иммуноглобулина (ISVD), направленных против человеческого фактора фон Виллебранда (vWF), где указанное лечение приводит к более короткому времени до ответа в виде изменения числа тромбоцитов, более низкой доле пациентов со смертельным исходом, рецидивом или большим TE-событием на протяжении периода лечения, более низкой частоте рецидивов и/или предупреждению рефрактерности,
где указанное заболевание, связанное с vWF, представляет собой тромботическую тромбоцитопеническую пурпуру (TTP), и
где каждый ISVD, направленный против человеческого vWF, представлен под SEQ ID NO: 19.
2. Способ по п. 1, где указанная стадия введения полипептида, определенного в п. 1, повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней, как, например, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев или даже больше.
3. Способ по любому из пп. 1-2, где указанный полипептид на по меньшей мере 90% идентичен по отношению к SEQ ID NO: 1.
4. Способ по любому из пп. 1-3, где указанный полипептид представляет собой SEQ ID NO: 1 или SEQ ID NO: 24.
5. Способ по любому из пп. 1-4, где указанная доза вводится 1 раз в день или два раза в день.
6. Способ по любому из пп. 1-5, включающий повторение введения указанного полипептида до тех пор, пока число тромбоцитов у указанного человека не будет составлять по меньшей мере 150000/мкл.
7. Способ по п. 6, включающий повторение введения указанного полипептида до тех пор, пока число тромбоцитов у указанного человека не будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях.
8. Способ по п. 7, где указанная стадия введения полипептида по настоящему изобретению повторяется на протяжении по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дней или даже более чем 10 дней, как, например, 20 дней, предпочтительно более чем 30 дней или даже больше, после того, как указанное число тромбоцитов будет составлять по меньшей мере 150000/мкл при по меньшей мере 2 последовательных измерениях.
9. Способ по п. 7 или 8, где указанные 2 последовательных измерения осуществляются с интервалом в по меньшей мере 24 часа, более предпочтительно 48 часов, как, например, с интервалом в по меньшей мере 3 дня или даже больше, как, например, с интервалом в 4, 5, 6 или даже 7 дней, предпочтительно с интервалом в одну неделю.
10. Способ по любому из пп. 1-9, включающий повторение введения указанного полипептида до тех пор, пока активность ADAMTS13 у указанного человека не будет составлять по меньшей мере 10%, как, например, по меньшей мере 15%, 20%, 25%, 30%, 35%, 45% или даже 50%, от эталонной активности ADAMTS13.
11. Способ по любому из пп. 1-10, включающий повторение введения указанного полипептида до тех пор, пока уровень маркера повреждения органов, как, например, уровень LDH, уровень тропонина T, уровень тропонина I и/или уровень креатинина у указанного человека не вернется к величине, составляющей по меньшей мере 40% или даже по меньшей мере 50%, как, например, 60%, 70%, 80%, 90% или даже до 100%, от нормальных уровней.
12. Способ по любому из пп. 1-11, включающий осуществление плазмообмена.
13. Способ по любому из пп. 1-12, где способ включает введение человеку дозы 5 мг указанного полипептида, если указанный человек представляет собой ребенка или подростка с массой тела <40 кг.
14. Применение набора, содержащего контейнер, содержащий полипептид, содержащий два одиночных вариабельных домена иммуноглобулина (ISVD), и инструкции по применению, где каждый ISVD, направленный против человеческого vWF, представлен под SEQ ID NO: 19, для лечения симптомов первоначального эпизода заболевания, связанного с vWF, у человека.
15. Применение по п. 14, где указанный полипептид на по меньшей мере 90% идентичен по отношению к SEQ ID NO: 1.
16. Применение по п. 15, где указанный полипептид представляет собой SEQ ID NO: 1 или SEQ ID NO: 24.
| WO 2015193326 A1, 23.12.2015 | |||
| SCULLY M | |||
| et al., Results of the randomized, double-blind, placebo-controlled, phase 3 Hercules study of caplacizumab in patients with acquired Thrombotic Thrombocytopenic Purpura, Blood, Vol | |||
| Реверсивный дисковый культиватор для тросовой тяги | 1923 |
|
SU130A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ТЕРАПЕВТИЧЕСКИЕ ПОЛИПЕПТИДЫ, ИХ ГОМОЛОГИ, ИХ ФРАГМЕНТЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ МОДУЛЯЦИИ АГРЕГАЦИИ, ОПОСРЕДОВАННОЙ ТРОМБОЦИТАМИ | 2004 |
|
RU2524129C2 |
| NANOBODIES TM ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ АГРЕГАЦИЕЙ | 2006 |
|
RU2433139C2 |
Авторы
Даты
2023-04-11—Публикация
2019-02-06—Подача